ポリクローナル抗体およびその利用
【課題】フコイダンと特異的に反応する抗体を作製すると共に、これを利用してオキナワモズクフコイダンを正確に測定することのできる測定系や免疫染色系を提供する。
【解決手段】オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体およびこの抗体を利用したオキナワモズクフコイダンの測定方法、測定キット、免疫染色方法。
【解決手段】オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体およびこの抗体を利用したオキナワモズクフコイダンの測定方法、測定キット、免疫染色方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、オキナワモズクフコイダンに特異的に反応するポリクローナル抗体およびこの抗体を利用したオキナワモズクフコイダンの測定方法、免疫染色方法、測定キット等に関する。
【背景技術】
【0002】
フコイダンは褐藻類に特有の多糖で、硫酸化されたフコースを構成糖に有するものであるが、褐藻類の種類によってその構造は異なることが知られている。例えば、フコイダンの中でもオキナワモズクフコイダンは下記式で示すようにα1,3結合したフコースを主鎖として、フコース6分子にグルクロン酸が1分子結合したものであり、また、フコースの半分は硫酸化されているものである。
【化1】

【0003】
そしてこのオキナワモズクフコイダンには抗潰瘍作用、抗炎症作用、整腸作用、抗腫瘍作用、コレステロール低下作用等が報告されている(非特許文献1〜4)。
【0004】
しかしながら、このオキナワモズクフコイダンに限らず、その他のフコイダンについても血中、組織中の濃度測定系が殆ど確立しておらず、摂取されたフコイダンがどのようにして上記作用を奏しているのかは全く不明であった。
【0005】
一応、これまでに、ガゴメコンブ由来のフコイダンを抗原として得られたモノクローナル抗体を利用したもの、マコンブ由来のフコイダンを抗原として得られたモノクローナル抗体を利用したもの、ワカメ由来のフコダイダンを抗原として得られたモノクローナル抗体を利用したもの等も報告されているが(特許文献1、非特許文献5〜6)、これらの抗体はオキナワモズクフコイダンに特異的に反応するものではないため、これらの抗体を利用してオキナワモズクフコイダンを正確に測定することはできなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO00/077049国際公開パンフレット
【非特許文献】
【0007】
【非特許文献1】Matsumoto S, et al. Fucoidan derived from Cladosiphon okamuranus Tokita ameriorates murine chronic colitis through the down-regulation of interleukin-6 production on colonic epithelial cells. Clin Exp Immunol 2004,136; 432-439.
【非特許文献2】Shibata H, et al. Properties of fucoidan from Cladosiphon okamuranus tokita in gastric mucosal protection. BioFactors 2000, 11; 235-245.
【非特許文献3】曽根俊郎 他、オキナワモズクの抗炎症作用 FRAGRANCE Journal12月号、2001年、871−892
【非特許文献4】Nagamine T, et al.Inhibitory effect of fucoidan on Huh7 hepatoma cells through downregulation of CXCL12. Nutr Cancer 2009, 61; 340-347.
【非特許文献5】Mizuno M et al. Quantification and localization of fucoidan in Laminaria Japonica Using a novel antibody. Biosci Biotechnol Biochem 2009, 73; 335-338.
【非特許文献6】Irhimeh MR, et al. A quantitative method to detect fucoidan in human血漿 using a novel antibody. Methods Find Exp Clin Pharmacol 2005, 27;705-710.
【発明の概要】
【発明が解決しようとする課題】
【0008】
従って、本発明の課題はフコイダンと特異的に反応する抗体を作製すると共に、これを利用してオキナワモズクフコイダンを正確に測定することのできる測定系や免疫染色系を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究した結果、オキナワモズクフコイダンに特定の生体高分子を結合させた結合物を抗原として動物に免疫して得られる抗血清を特定の方法で精製することによりオキナワモズクフコイダンに特異的に反応する抗体を作製できることを見出した。また、この抗体を利用することでオキナワモズクフコイダンの濃度の測定や免疫染色を行えることを見出し、本発明を完成させた。
【0010】
すなわち本発明は、オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体である。
【0011】
また、本発明はオキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることを特徴とする上記ポリクローナル抗体の製造方法である。
【0012】
更に、本発明は検体に、上記ポリクローナル抗体を作用させ、検体中のオキナワモズクフコイダンを測定することを特徴とするオキナワモズクフコイダンの測定方法である。
【0013】
また更に、本発明は上記ポリクローナル抗体を含有することを特徴とするオキナワモズクフコイダンの測定キットである。
【0014】
更にまた、本発明は検体に、上記ポリクローナル抗体を作用させた後、染色試薬により、検体中のオキナワモズクフコイダンを染色することを特徴とするオキナワモズクフコイダンの免疫染色方法である。
【発明の効果】
【0015】
本発明のポリクローナル抗体は、オキナワモズクフコイダンと特異的に反応するものである。そのため、この抗体を利用してオキナワモズクフコイダンの測定系を構築すると、血清、尿、細胞、組織等の検体中のオキナワモズクフコイダンをngのオーダーで測定することができる。また、この抗体は細胞や肝臓、腸管等の組織中のオキナワモズクフコイダンの染色にも利用することができる。
【0016】
従って、本発明のポリクローナル抗体を利用すれば、血中や組織中のオキナワモズクフコイダン代謝を解明することができる。
【図面の簡単な説明】
【0017】
【図1】免疫スケジュールを示す図である。
【図2】本発明のポリクローナル抗体による免疫染色の結果を示す図である。
【図3】本発明のポリクローナル抗体を利用したサンドイッチ法によるオキナワモズクフコイダンおよび多糖類の測定結果を示す図である。
【発明を実施するための形態】
【0018】
本発明のポリクローナル抗体(以下、「本発明抗体」という)は、オキナワモズクフコイダンと特異的に反応するものである。ここで特異的とは、ポリクローナル抗体がオキナワモズクフコイダンと抗原・抗体反応で反応し、オキナワモズクフコイダン以外の多糖類とは実質的に交差反応しないことをいい、また、オキナワモズクフコイダン以外の多糖類とは実質的に交差反応しないとは、後記する本発明抗体を用いたサンドイッチ法(本発明抗体を一次抗体および二次抗体の両方に使用)にて、ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、ラミナリン、アルギン酸等の多糖類を測定した場合に、100ng/ml以下、好ましくは1〜100ng/mlの範囲で測定されないことをいう。
【0019】
上記本発明抗体は、例えば、オキナワモズクフコイダンに生体高分子を結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることにより得られる。
【0020】
上記においてオキナワモズクフコイダンと結合される生体高分子としては、特に限定されないが、例えば、オブアルブミン(OVA)、スカシ貝ヘモシアニン(KLH)およびウシ血清アルブミン(BSA)から選ばれるものが挙げられる。これらの生体高分子の中でも得られる抗体の感度が高いためKLHが好ましい。また、これら生体高分子とオキナワモズクフコイダンとの結合は、特に制限されず種々の方法で行うことができ、例えば、KLHとオキナワモズクフコイダンとの結合であれば、1−メチル3−(3ジメチルラミノプロピル)カルボジイミド(EDC)を用いてグルクロン酸のカルボキシル基を活性化した後、KLH中のリジン残基とをカップリングさせる方法等で行うことができる。具体的に、KLHとオキナワモズクフコイダンとの結合物は、1〜40mg/ml、好ましくは2〜30mg/mlのオキナワモズクフコイダン水溶液0.25〜5ml、好ましくは1.25〜2.25ml/mlに、0.5〜10mg/ml、好ましくは2.5〜7.5mg/mlのKLHを0.1〜2ml、好ましくは0.5〜1.5mlを混和したのちに、これを撹拌しながら0.5〜10mg/ml、好ましくは2.5〜7.5mg/mlのEDCを0.1〜2ml、好ましくは0.5〜1.5mlをゆっくり滴下して混ぜ、4℃で5〜96時間、好ましくは24〜36時間撹拌することにより得られる。
【0021】
上記結合物を用いた動物の免疫は、例えば、マウス、ラット、ウサギ等のほ乳動物に、結合物と、フロイント完全アジュバンド、フロイント非完全アジュバント等のアジュバンドとを併用し、これを皮内、腹腔等に注射等で投与することにより行われる。免疫のスケジュールは、例えば、結合物を1〜4週間毎、好ましくは1〜3週間毎に、計1〜10回、好ましくは3〜7回動物に摂種する。摂種量は初回が0.01〜0.30mg、好ましくは0.75〜2.25mg、その後は0.03〜0.60mg、好ましくは0.15〜0.45mgである。最終の免疫をしてから1〜10週間後、好ましくは2〜6週間後に全採血することにより抗血清が得られる。
【0022】
上記抗血清のオキナワモズクフコイダンを用いたアフィニティー精製は、特に制限されず種々の方法で行うことができ、例えば、オキナワモズクフコイダンを固相化したアフィニティーカラムで行うことができる。具体的には、オキナワモズクフコイダンを、セファロース等を臭化シアン等で活性化した活性化樹脂等にカルボジイミド法やグルタルアルデヒド法、過ヨウ素酸法、マレイミド法、ピリジルジスルフィド法等の方法で固相化したものをカラムに詰めて作製したアフィニティーカラムに、上記のようにして得られる抗血清を通液し、オキナワモズクフコイダンと抗血清中のポリクローナル抗体を結合させた後、アフィニティーカラムに塩化マグネシウムやグリシン緩衝液等の溶出液を通液し、オキナワモズクフコイダンと結合していたポリクローナル抗体(本発明抗体)を溶出させることにより抗血清を精製することができる。具体的に、抗血清の精製は、まず、カラム内の活性化樹脂等に適量の抗血清を乗せて3〜40分、好ましくは15〜30分間静置し、樹脂担体と抗体を反応させる。その後、濾液を回収し、残りの抗血清を同様にして反応させる。この操作を抗血清がなくなるまで繰り返す。さらに、回収した濾液を2〜10回、好ましくは4〜7回カラム内を循環させる。濾液をすべて回収したのち、ゲル内に残ったポリクローナル抗体(本発明抗体)を溶出バッファー(アジ化ナトリウムとリン酸緩衝生理食塩水(PBS)の混液)で押し出す。このとき、分光光度計にて吸光度が計測されなくなるまでPBSで洗浄する。その後、前述の溶出バッファーをゲルにのせ、フラクションコレクターで回収する。このとき、グリシン緩衝液を用いて溶出する場合はトリス緩衝液などで中和する。分光光度計により抗体が溶出するフラクションの範囲を決め、回収したものをPBSで透析して本発明抗体を得ることができる。
【0023】
上記のようにして得られる本発明抗体はオキナワモズクフコイダンと特異的に反応するものである。そのため本発明抗体を利用すれば、検体中のオキナワモズクフコイダンの測定、免疫染色等ができる。
【0024】
本発明抗体を用いて検体中のオキナワモズクフコイダンを測定する方法は、特に限定されないが、例えば、検体に本発明抗体を作用させることにより、検体中のオキナワモズクフコイダンを測定することができる。本発明抗体をオキナワモズクフコイダンに作用させる方法としては、例えば、ホースラディッシュペルオキシダーゼ(HRP)標識抗体法(Gerlich WH and Luer W, J. Med. Virol. 1979, 4, 227-38)、アビジン・ビオチン標識法(Hsu SM, Rain L and Fanger H, Am. J. Clin. Pathol. 1981, 75, 734-738)等が挙げられる。
【0025】
また、本発明抗体を用いたオキナワモズクフコイダンの測定には、例えば、本発明抗体を固相化したプレート、標識化した本発明抗体、前記標識を発色させるための発色試薬、洗浄液等から構成されるサンドイッチELISAキットを利用することができる。この様なキットであれば検体中のオキナワモズクフコイダンを100ng/ml以下、好ましくは1〜100ng/mlの範囲で測定することができる。
【0026】
上記測定に用いることのできる検体としては、尿、血清、血漿、細胞または肝臓、腎臓、小腸等の組織等が挙げられ、これらの中でも特に尿、血清または血漿が好ましい。
【0027】
一方、本発明抗体を用いて検体中のオキナワモズクフコイダンを免疫染色する方法は、特に限定されないが、例えば、検体に本発明抗体を作用させた後、更に染色試薬を作用させることにより、検体中のオキナワモズクフコイダンを染色することができる。本発明抗体や染色試薬を作用させる方法に特に制限はないが、例えば、酵素抗体法(間接法:Yolken RH and Leister FJ, J. Immunol. Methods, 43, 209-218 (1981))等を利用することができる。
【0028】
上記免疫染色に用いることのできる検体としては、手術材料、生検材料、各種細胞または肝臓、腎臓、小腸等の組織等が挙げられ、これらの中でも特に各種細胞または肝臓、腎臓、小腸等の組織が好ましい。
【0029】
また、本発明抗体を用いたオキナワモズクフコイダンの免疫染色には、例えば、本発明抗体、標識化した2次抗体、前記標識を発色させるための発色試薬等から構成される免疫染色キットを利用することができる。この様なキットであれば検体中のオキナワモズクフコイダンを特異的に感度良く免疫染色することができる。
【実施例】
【0030】
以下、本発明を実施例を挙げて詳細に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0031】
実 施 例 1
抗血清の作製:
20mg/mlのオキナワモズクフコイダン(品名:フコイダン、サウスプロダクト社製)溶液を2.5mlおよび5mg/mlのスカシ貝ヘモシアニン(KLH:PIERCE製)溶液を1ml混合し、攪拌しながら5mg/mlの1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC:PIERCE製)の1mlをゆっくり滴下した。これを4℃で2日間攪拌し、オキナワモズクフコイダンのグルクロン酸が持つカルボキシル基と、KLHのアミノ基とをカルボジイミド反応を用いて結合させた結合物(以下、「KLH結合物」という)を作製した。
【0032】
この結合物とアジュバンドを混合したものを抗原として3匹の家兔に図1のスケジュールで皮内注射して免疫し、免疫終了後に全採血をして抗血清を得た。なお、アジュバンドとしてはフロイント完全アジュバンド(FCA)を使用した。
【0033】
また、抗原として、牛血清アルブミン(BSA)、オキナワモズクフコイダンを用いて、上記と同様にして抗血清を得た。
【0034】
これら3種の抗原を用いて得られた抗血清に含まれる抗体の感度を比較した。具体的には、フコイダン標準液(200ml中にオキナワモズクフコイダンを1g含有)の希釈系列を作製して、希釈液中のオキナワモズクフコイダン濃度をELISA法で測定した。その結果、KLH結合物を抗原として得られた抗体(5万倍希釈)>BSA結合物を抗原として得られた抗体(1万倍希釈)>オキナワモズクフコイダンを抗原として得られた抗体(8千倍希釈)の順で感度が高いことがわかった。
【0035】
実 施 例2
フコイダン抗体の調製:
(1)オキナワモズクフコイダンアフィニティーカラムの作製
EAHセファロース4B(GE Healthcare製)をカラムに充填した後、0.5Mの塩化ナトリウム水溶液400mlで洗浄した。次に、洗浄後のEAHセファロース4Bと20mg/mlのオキナワモズクフコイダン10mlを50ml容量の遠沈管に入れ、それを振りながら5mg/mlのEDC10mlを滴下し、それを室温で2時間攪拌し、更に、4℃で3日間攪拌した。その後、これをカラムに充填し、0.5Mの塩化ナトリウム溶液400mlで洗浄し、1Mの酢酸ナトリウム(pH4.5)に室温で2時間浸漬し、ブロッキングをした。最後にこれをリン酸緩衝生理食塩水(PBS)で洗浄し、オキナワモズクフコイダンアフィニティーカラムを作製した。
【0036】
(2)抗血清の精製:
上記で作製したオキナワモズクフコイダンアフィニティーカラムのコックを閉じ、ゲルの上に、上記実施例1で得られた抗血清を適量のせて15〜20分ほど放置してカラム内のオキナワモズクフコイダンと結合させた。その後、カラムのコックを開け、ろ液を回収し、これを再度ゲルにのせた。この操作を数回繰り返した後、ゲル内に残った抗血清を0.03%のアジ化ナトリウムと10mMのPBSの混液で押し出した。その後、分光光度計にて吸光度が計測されなくなるまでPBSで洗浄した。
【0037】
上記作製した抗血清とオキナワモズクフコイダンが結合したカラムに、3Mの塩化マグネシウム溶液を加え、溶出液をフラクションコレクターで回収した。回収した溶出液をPBSに透析し、モノスペシフィックに精製されたポリクローナル抗体(以下、「フコイダン抗体」という)を得た。
【0038】
実 施 例3
フコイダン抗体による免疫染色試験:
培養ヒト肝癌細胞(HepG2細胞)に、オキナワモズクフコイダンを0、200、500μg/ml投与し、投与12時間後に実施例2で得られたフコイダン抗体を使用して酵素抗体法(間接法)で免疫染色した。なお、免疫染色は以下の手順で行った。また、予め実施例2で得られたフコイダン抗体に、オキナワモズクフコイダンを十分に吸収させた後、上記と同様にして培養ヒト肝細胞を免疫染色した。それらの結果を図2に示した(上段はオキナワモズクフコイダン吸収前(吸収前)、下段はオキナワモズクフコイダン吸収後(吸収後))。
<免疫染色手順>
1)細胞標本の固定
標本(HepG2細胞)を95%エタノールに浸漬(室温、30分)後、流水で水洗(
2〜3分)した
2)内因性ペルオキシダーゼの除去
標本を3%過酸化水素加100%メタノール*1に浸漬(30分)した
3)洗浄
標本を流水で水洗(5分)した
4)マイクロウェーブ処理による抗原賦活化
0.01Mクエン酸緩衝液(pH6.0)を予備加温(500W電子レンジ・5分)した
後、加温した緩衝液に標本を浸してさらに加温(500W電子レンジ・5分)し、その
後室温で冷却(常温まで・20〜30分)した
5)洗浄
標本をPBS*2で洗浄(3分×3回)した
6)一次抗体(フコイダン抗体)の添加・反応
フコイダン抗体を抗体希釈液*3で1:50に希釈して、1標本当たり50〜100μ
l添加し、反応(室温、120分・本実験の希釈抗体濃度 約6μg/ml)させた
7)洗浄
標本を0.05%Tween20加PBS*4で洗浄(3分×3回)した
8)二次抗体の添加・反応
二次抗体(Histofine Simple Stain MAX-PO(MULTI):ニチレイ製)を1標本当たり1
〜2滴添加し、反応(室温、60分)させた
9)洗浄
標本を0.05%Tween20加PBS*4で洗浄(3分×3回)した
10)発色反応
標本を発色試薬*5に浸漬し、発色反応(室温、20〜30分・時間は発色の程度を確
認しながら決めた)させた
11)洗浄
標本を流水で水洗(5分)した
12)染色
標本をマイヤーのヘマトキシリンで核染色(室温、1〜2分)した
13)洗浄
標本を流水で水洗(5〜10分)した
14)脱水・透徹
標本を以下の順序で脱水・透徹した
a)70%エタノール(数秒)
b)90%エタノール(数秒)
c)100%エタノール(数秒)
d)無水エタノールI(数秒)
e)無水エタノールII(数秒)
f)キシレンI(数十秒)
g)キシレンII(数十秒)
15)封入
標本をマリノール(武藤化学製)で封入した
*1:100%メタノールに30%過酸化水素水を3%になるように加えた溶液
*2:0.01Mリン酸緩衝液(pH7.4)に塩化ナトリウムを0.8%加えた溶液
*3:2%ブロックエース(大日本製薬製)、0.8%塩化ナトリウムおよび0.1%アジ
化ナトリウムを含有する水溶液
*4:PBS*2にTween20を0.05%になるように加えた溶液
*5:0.05Mトリス塩酸緩衝液(pH7.6)にジアミノベンチジン(DAB)を0.
02%加えた溶液
【0039】
図2より、フコイダン抗体は、濃度依存的に細胞内フコイダンを染色した(吸収前)。また、フコイダンを予め吸収させたフコイダン抗体で免疫染色した結果、細胞内フコイダンは染色されなかった(吸収後)。これらの結果からフコイダン抗体はオキナワモズクフコイダンを特異的に免疫染色することがわかった。
【0040】
実 施 例4
サンドイッチ法による測定:
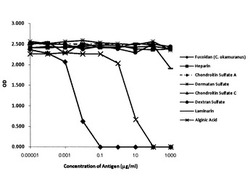
実施例2で得られたフコイダン抗体を、マイクロタイタープレート(Nalge Nunc International製)の各ウエルに添加し、4℃で一夜インキュベートすることによって固相化した。次に、この各ウエルにブロッキングバッファー(10%(w/v)BSAおよび0.05%プロリンを含むPBS)を加えてブロッキングし、更にその後、洗浄バッファー(0.2%Tween20を含むPBS)で各ウエルを洗浄して、フコイダン抗体を固相化したプレートを作製した。このプレートの各ウエルに種々の濃度のオキナワモズクフコイダンを含む溶液を添加し、室温(20〜25℃)で振動させながら1時間インキュベートし、固相化したフコイダン抗体とオキナワモズクフコイダンとを結合させた。その後、ホースラディッシュペルオキシダーゼ(POD)と結合させたフコイダン抗体を含み、0.05%のTween20を含むPBSの100μlを各ウエルに添加し、室温(20〜25℃)で穏やかに振動させながら1時間インキュベートした。その後、プレートを洗浄し、100μlの発色試薬溶液(0.4mg/ml(w/v)o−フェニレンジアミン)を添加し、室温で振動させながら20分間インキュベートし、十分に発色したところで、100μlの1N硫酸溶液を加え、反応を停止させた。最後にプレートをマイクロプレートリーダー(MPR−A4:トーソー製)を用いて波長492nmの吸光度を測定した。また、オキナワモズクフコイダンに代えて、多糖類(ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、アルギン酸、ラミナリン)についても同様の測定を行った。これらの結果を図3に示した。
【0041】
図3より上記測定系では100ng/ml以下、特に1〜100ng/mlのオキナワモズクフコイダン濃度を特異的に測定できることがわかった。また、この濃度範囲においては、ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、ラミナリン、アルギン酸との交差反応は認められなかった。
【0042】
実 施 例5
ヒト検体中のオキナワモズクフコイダンの測定:
10名のボランティアにオキナワモズクフコイダン(品名:フコイダン、サウスプロダクト社製)1gを経口摂取させ、0時間(摂取前)、3時間、6時間、9時間後に血清、血漿および尿を採取し、以下の前処理を行った後、実施例4の測定系で各サンプル中のオキナワモズクフコイダン濃度を測定した。その結果を表1に示した。
【0043】
血清、血漿および尿の前処理は、まず、血清、血漿および尿をPBSで4倍に希釈し、ドライサーモユニット(タイテック製)を用いて100℃で10分間沸騰させた。その後氷で冷却し、更に、これを12,000rpmで10分間遠心し、その上清をサンプルとした。
【0044】
【表1】

【0045】
その結果、全例で尿中オキナワモズクフコイダンを検出した。また、7例では血清および血漿中にオキナワモズクフコイダンを検出した。
【産業上の利用可能性】
【0046】
本発明のポリクローナル抗体は、オキナワモズクフコイダンと特異的に反応するため、オキナワモズクフコイダン摂取後の血中、尿中等の濃度測定や組織の染色に利用できる。
以 上
【技術分野】
【0001】
本発明は、オキナワモズクフコイダンに特異的に反応するポリクローナル抗体およびこの抗体を利用したオキナワモズクフコイダンの測定方法、免疫染色方法、測定キット等に関する。
【背景技術】
【0002】
フコイダンは褐藻類に特有の多糖で、硫酸化されたフコースを構成糖に有するものであるが、褐藻類の種類によってその構造は異なることが知られている。例えば、フコイダンの中でもオキナワモズクフコイダンは下記式で示すようにα1,3結合したフコースを主鎖として、フコース6分子にグルクロン酸が1分子結合したものであり、また、フコースの半分は硫酸化されているものである。
【化1】

【0003】
そしてこのオキナワモズクフコイダンには抗潰瘍作用、抗炎症作用、整腸作用、抗腫瘍作用、コレステロール低下作用等が報告されている(非特許文献1〜4)。
【0004】
しかしながら、このオキナワモズクフコイダンに限らず、その他のフコイダンについても血中、組織中の濃度測定系が殆ど確立しておらず、摂取されたフコイダンがどのようにして上記作用を奏しているのかは全く不明であった。
【0005】
一応、これまでに、ガゴメコンブ由来のフコイダンを抗原として得られたモノクローナル抗体を利用したもの、マコンブ由来のフコイダンを抗原として得られたモノクローナル抗体を利用したもの、ワカメ由来のフコダイダンを抗原として得られたモノクローナル抗体を利用したもの等も報告されているが(特許文献1、非特許文献5〜6)、これらの抗体はオキナワモズクフコイダンに特異的に反応するものではないため、これらの抗体を利用してオキナワモズクフコイダンを正確に測定することはできなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】WO00/077049国際公開パンフレット
【非特許文献】
【0007】
【非特許文献1】Matsumoto S, et al. Fucoidan derived from Cladosiphon okamuranus Tokita ameriorates murine chronic colitis through the down-regulation of interleukin-6 production on colonic epithelial cells. Clin Exp Immunol 2004,136; 432-439.
【非特許文献2】Shibata H, et al. Properties of fucoidan from Cladosiphon okamuranus tokita in gastric mucosal protection. BioFactors 2000, 11; 235-245.
【非特許文献3】曽根俊郎 他、オキナワモズクの抗炎症作用 FRAGRANCE Journal12月号、2001年、871−892
【非特許文献4】Nagamine T, et al.Inhibitory effect of fucoidan on Huh7 hepatoma cells through downregulation of CXCL12. Nutr Cancer 2009, 61; 340-347.
【非特許文献5】Mizuno M et al. Quantification and localization of fucoidan in Laminaria Japonica Using a novel antibody. Biosci Biotechnol Biochem 2009, 73; 335-338.
【非特許文献6】Irhimeh MR, et al. A quantitative method to detect fucoidan in human血漿 using a novel antibody. Methods Find Exp Clin Pharmacol 2005, 27;705-710.
【発明の概要】
【発明が解決しようとする課題】
【0008】
従って、本発明の課題はフコイダンと特異的に反応する抗体を作製すると共に、これを利用してオキナワモズクフコイダンを正確に測定することのできる測定系や免疫染色系を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究した結果、オキナワモズクフコイダンに特定の生体高分子を結合させた結合物を抗原として動物に免疫して得られる抗血清を特定の方法で精製することによりオキナワモズクフコイダンに特異的に反応する抗体を作製できることを見出した。また、この抗体を利用することでオキナワモズクフコイダンの濃度の測定や免疫染色を行えることを見出し、本発明を完成させた。
【0010】
すなわち本発明は、オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体である。
【0011】
また、本発明はオキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることを特徴とする上記ポリクローナル抗体の製造方法である。
【0012】
更に、本発明は検体に、上記ポリクローナル抗体を作用させ、検体中のオキナワモズクフコイダンを測定することを特徴とするオキナワモズクフコイダンの測定方法である。
【0013】
また更に、本発明は上記ポリクローナル抗体を含有することを特徴とするオキナワモズクフコイダンの測定キットである。
【0014】
更にまた、本発明は検体に、上記ポリクローナル抗体を作用させた後、染色試薬により、検体中のオキナワモズクフコイダンを染色することを特徴とするオキナワモズクフコイダンの免疫染色方法である。
【発明の効果】
【0015】
本発明のポリクローナル抗体は、オキナワモズクフコイダンと特異的に反応するものである。そのため、この抗体を利用してオキナワモズクフコイダンの測定系を構築すると、血清、尿、細胞、組織等の検体中のオキナワモズクフコイダンをngのオーダーで測定することができる。また、この抗体は細胞や肝臓、腸管等の組織中のオキナワモズクフコイダンの染色にも利用することができる。
【0016】
従って、本発明のポリクローナル抗体を利用すれば、血中や組織中のオキナワモズクフコイダン代謝を解明することができる。
【図面の簡単な説明】
【0017】
【図1】免疫スケジュールを示す図である。
【図2】本発明のポリクローナル抗体による免疫染色の結果を示す図である。
【図3】本発明のポリクローナル抗体を利用したサンドイッチ法によるオキナワモズクフコイダンおよび多糖類の測定結果を示す図である。
【発明を実施するための形態】
【0018】
本発明のポリクローナル抗体(以下、「本発明抗体」という)は、オキナワモズクフコイダンと特異的に反応するものである。ここで特異的とは、ポリクローナル抗体がオキナワモズクフコイダンと抗原・抗体反応で反応し、オキナワモズクフコイダン以外の多糖類とは実質的に交差反応しないことをいい、また、オキナワモズクフコイダン以外の多糖類とは実質的に交差反応しないとは、後記する本発明抗体を用いたサンドイッチ法(本発明抗体を一次抗体および二次抗体の両方に使用)にて、ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、ラミナリン、アルギン酸等の多糖類を測定した場合に、100ng/ml以下、好ましくは1〜100ng/mlの範囲で測定されないことをいう。
【0019】
上記本発明抗体は、例えば、オキナワモズクフコイダンに生体高分子を結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることにより得られる。
【0020】
上記においてオキナワモズクフコイダンと結合される生体高分子としては、特に限定されないが、例えば、オブアルブミン(OVA)、スカシ貝ヘモシアニン(KLH)およびウシ血清アルブミン(BSA)から選ばれるものが挙げられる。これらの生体高分子の中でも得られる抗体の感度が高いためKLHが好ましい。また、これら生体高分子とオキナワモズクフコイダンとの結合は、特に制限されず種々の方法で行うことができ、例えば、KLHとオキナワモズクフコイダンとの結合であれば、1−メチル3−(3ジメチルラミノプロピル)カルボジイミド(EDC)を用いてグルクロン酸のカルボキシル基を活性化した後、KLH中のリジン残基とをカップリングさせる方法等で行うことができる。具体的に、KLHとオキナワモズクフコイダンとの結合物は、1〜40mg/ml、好ましくは2〜30mg/mlのオキナワモズクフコイダン水溶液0.25〜5ml、好ましくは1.25〜2.25ml/mlに、0.5〜10mg/ml、好ましくは2.5〜7.5mg/mlのKLHを0.1〜2ml、好ましくは0.5〜1.5mlを混和したのちに、これを撹拌しながら0.5〜10mg/ml、好ましくは2.5〜7.5mg/mlのEDCを0.1〜2ml、好ましくは0.5〜1.5mlをゆっくり滴下して混ぜ、4℃で5〜96時間、好ましくは24〜36時間撹拌することにより得られる。
【0021】
上記結合物を用いた動物の免疫は、例えば、マウス、ラット、ウサギ等のほ乳動物に、結合物と、フロイント完全アジュバンド、フロイント非完全アジュバント等のアジュバンドとを併用し、これを皮内、腹腔等に注射等で投与することにより行われる。免疫のスケジュールは、例えば、結合物を1〜4週間毎、好ましくは1〜3週間毎に、計1〜10回、好ましくは3〜7回動物に摂種する。摂種量は初回が0.01〜0.30mg、好ましくは0.75〜2.25mg、その後は0.03〜0.60mg、好ましくは0.15〜0.45mgである。最終の免疫をしてから1〜10週間後、好ましくは2〜6週間後に全採血することにより抗血清が得られる。
【0022】
上記抗血清のオキナワモズクフコイダンを用いたアフィニティー精製は、特に制限されず種々の方法で行うことができ、例えば、オキナワモズクフコイダンを固相化したアフィニティーカラムで行うことができる。具体的には、オキナワモズクフコイダンを、セファロース等を臭化シアン等で活性化した活性化樹脂等にカルボジイミド法やグルタルアルデヒド法、過ヨウ素酸法、マレイミド法、ピリジルジスルフィド法等の方法で固相化したものをカラムに詰めて作製したアフィニティーカラムに、上記のようにして得られる抗血清を通液し、オキナワモズクフコイダンと抗血清中のポリクローナル抗体を結合させた後、アフィニティーカラムに塩化マグネシウムやグリシン緩衝液等の溶出液を通液し、オキナワモズクフコイダンと結合していたポリクローナル抗体(本発明抗体)を溶出させることにより抗血清を精製することができる。具体的に、抗血清の精製は、まず、カラム内の活性化樹脂等に適量の抗血清を乗せて3〜40分、好ましくは15〜30分間静置し、樹脂担体と抗体を反応させる。その後、濾液を回収し、残りの抗血清を同様にして反応させる。この操作を抗血清がなくなるまで繰り返す。さらに、回収した濾液を2〜10回、好ましくは4〜7回カラム内を循環させる。濾液をすべて回収したのち、ゲル内に残ったポリクローナル抗体(本発明抗体)を溶出バッファー(アジ化ナトリウムとリン酸緩衝生理食塩水(PBS)の混液)で押し出す。このとき、分光光度計にて吸光度が計測されなくなるまでPBSで洗浄する。その後、前述の溶出バッファーをゲルにのせ、フラクションコレクターで回収する。このとき、グリシン緩衝液を用いて溶出する場合はトリス緩衝液などで中和する。分光光度計により抗体が溶出するフラクションの範囲を決め、回収したものをPBSで透析して本発明抗体を得ることができる。
【0023】
上記のようにして得られる本発明抗体はオキナワモズクフコイダンと特異的に反応するものである。そのため本発明抗体を利用すれば、検体中のオキナワモズクフコイダンの測定、免疫染色等ができる。
【0024】
本発明抗体を用いて検体中のオキナワモズクフコイダンを測定する方法は、特に限定されないが、例えば、検体に本発明抗体を作用させることにより、検体中のオキナワモズクフコイダンを測定することができる。本発明抗体をオキナワモズクフコイダンに作用させる方法としては、例えば、ホースラディッシュペルオキシダーゼ(HRP)標識抗体法(Gerlich WH and Luer W, J. Med. Virol. 1979, 4, 227-38)、アビジン・ビオチン標識法(Hsu SM, Rain L and Fanger H, Am. J. Clin. Pathol. 1981, 75, 734-738)等が挙げられる。
【0025】
また、本発明抗体を用いたオキナワモズクフコイダンの測定には、例えば、本発明抗体を固相化したプレート、標識化した本発明抗体、前記標識を発色させるための発色試薬、洗浄液等から構成されるサンドイッチELISAキットを利用することができる。この様なキットであれば検体中のオキナワモズクフコイダンを100ng/ml以下、好ましくは1〜100ng/mlの範囲で測定することができる。
【0026】
上記測定に用いることのできる検体としては、尿、血清、血漿、細胞または肝臓、腎臓、小腸等の組織等が挙げられ、これらの中でも特に尿、血清または血漿が好ましい。
【0027】
一方、本発明抗体を用いて検体中のオキナワモズクフコイダンを免疫染色する方法は、特に限定されないが、例えば、検体に本発明抗体を作用させた後、更に染色試薬を作用させることにより、検体中のオキナワモズクフコイダンを染色することができる。本発明抗体や染色試薬を作用させる方法に特に制限はないが、例えば、酵素抗体法(間接法:Yolken RH and Leister FJ, J. Immunol. Methods, 43, 209-218 (1981))等を利用することができる。
【0028】
上記免疫染色に用いることのできる検体としては、手術材料、生検材料、各種細胞または肝臓、腎臓、小腸等の組織等が挙げられ、これらの中でも特に各種細胞または肝臓、腎臓、小腸等の組織が好ましい。
【0029】
また、本発明抗体を用いたオキナワモズクフコイダンの免疫染色には、例えば、本発明抗体、標識化した2次抗体、前記標識を発色させるための発色試薬等から構成される免疫染色キットを利用することができる。この様なキットであれば検体中のオキナワモズクフコイダンを特異的に感度良く免疫染色することができる。
【実施例】
【0030】
以下、本発明を実施例を挙げて詳細に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0031】
実 施 例 1
抗血清の作製:
20mg/mlのオキナワモズクフコイダン(品名:フコイダン、サウスプロダクト社製)溶液を2.5mlおよび5mg/mlのスカシ貝ヘモシアニン(KLH:PIERCE製)溶液を1ml混合し、攪拌しながら5mg/mlの1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC:PIERCE製)の1mlをゆっくり滴下した。これを4℃で2日間攪拌し、オキナワモズクフコイダンのグルクロン酸が持つカルボキシル基と、KLHのアミノ基とをカルボジイミド反応を用いて結合させた結合物(以下、「KLH結合物」という)を作製した。
【0032】
この結合物とアジュバンドを混合したものを抗原として3匹の家兔に図1のスケジュールで皮内注射して免疫し、免疫終了後に全採血をして抗血清を得た。なお、アジュバンドとしてはフロイント完全アジュバンド(FCA)を使用した。
【0033】
また、抗原として、牛血清アルブミン(BSA)、オキナワモズクフコイダンを用いて、上記と同様にして抗血清を得た。
【0034】
これら3種の抗原を用いて得られた抗血清に含まれる抗体の感度を比較した。具体的には、フコイダン標準液(200ml中にオキナワモズクフコイダンを1g含有)の希釈系列を作製して、希釈液中のオキナワモズクフコイダン濃度をELISA法で測定した。その結果、KLH結合物を抗原として得られた抗体(5万倍希釈)>BSA結合物を抗原として得られた抗体(1万倍希釈)>オキナワモズクフコイダンを抗原として得られた抗体(8千倍希釈)の順で感度が高いことがわかった。
【0035】
実 施 例2
フコイダン抗体の調製:
(1)オキナワモズクフコイダンアフィニティーカラムの作製
EAHセファロース4B(GE Healthcare製)をカラムに充填した後、0.5Mの塩化ナトリウム水溶液400mlで洗浄した。次に、洗浄後のEAHセファロース4Bと20mg/mlのオキナワモズクフコイダン10mlを50ml容量の遠沈管に入れ、それを振りながら5mg/mlのEDC10mlを滴下し、それを室温で2時間攪拌し、更に、4℃で3日間攪拌した。その後、これをカラムに充填し、0.5Mの塩化ナトリウム溶液400mlで洗浄し、1Mの酢酸ナトリウム(pH4.5)に室温で2時間浸漬し、ブロッキングをした。最後にこれをリン酸緩衝生理食塩水(PBS)で洗浄し、オキナワモズクフコイダンアフィニティーカラムを作製した。
【0036】
(2)抗血清の精製:
上記で作製したオキナワモズクフコイダンアフィニティーカラムのコックを閉じ、ゲルの上に、上記実施例1で得られた抗血清を適量のせて15〜20分ほど放置してカラム内のオキナワモズクフコイダンと結合させた。その後、カラムのコックを開け、ろ液を回収し、これを再度ゲルにのせた。この操作を数回繰り返した後、ゲル内に残った抗血清を0.03%のアジ化ナトリウムと10mMのPBSの混液で押し出した。その後、分光光度計にて吸光度が計測されなくなるまでPBSで洗浄した。
【0037】
上記作製した抗血清とオキナワモズクフコイダンが結合したカラムに、3Mの塩化マグネシウム溶液を加え、溶出液をフラクションコレクターで回収した。回収した溶出液をPBSに透析し、モノスペシフィックに精製されたポリクローナル抗体(以下、「フコイダン抗体」という)を得た。
【0038】
実 施 例3
フコイダン抗体による免疫染色試験:
培養ヒト肝癌細胞(HepG2細胞)に、オキナワモズクフコイダンを0、200、500μg/ml投与し、投与12時間後に実施例2で得られたフコイダン抗体を使用して酵素抗体法(間接法)で免疫染色した。なお、免疫染色は以下の手順で行った。また、予め実施例2で得られたフコイダン抗体に、オキナワモズクフコイダンを十分に吸収させた後、上記と同様にして培養ヒト肝細胞を免疫染色した。それらの結果を図2に示した(上段はオキナワモズクフコイダン吸収前(吸収前)、下段はオキナワモズクフコイダン吸収後(吸収後))。
<免疫染色手順>
1)細胞標本の固定
標本(HepG2細胞)を95%エタノールに浸漬(室温、30分)後、流水で水洗(
2〜3分)した
2)内因性ペルオキシダーゼの除去
標本を3%過酸化水素加100%メタノール*1に浸漬(30分)した
3)洗浄
標本を流水で水洗(5分)した
4)マイクロウェーブ処理による抗原賦活化
0.01Mクエン酸緩衝液(pH6.0)を予備加温(500W電子レンジ・5分)した
後、加温した緩衝液に標本を浸してさらに加温(500W電子レンジ・5分)し、その
後室温で冷却(常温まで・20〜30分)した
5)洗浄
標本をPBS*2で洗浄(3分×3回)した
6)一次抗体(フコイダン抗体)の添加・反応
フコイダン抗体を抗体希釈液*3で1:50に希釈して、1標本当たり50〜100μ
l添加し、反応(室温、120分・本実験の希釈抗体濃度 約6μg/ml)させた
7)洗浄
標本を0.05%Tween20加PBS*4で洗浄(3分×3回)した
8)二次抗体の添加・反応
二次抗体(Histofine Simple Stain MAX-PO(MULTI):ニチレイ製)を1標本当たり1
〜2滴添加し、反応(室温、60分)させた
9)洗浄
標本を0.05%Tween20加PBS*4で洗浄(3分×3回)した
10)発色反応
標本を発色試薬*5に浸漬し、発色反応(室温、20〜30分・時間は発色の程度を確
認しながら決めた)させた
11)洗浄
標本を流水で水洗(5分)した
12)染色
標本をマイヤーのヘマトキシリンで核染色(室温、1〜2分)した
13)洗浄
標本を流水で水洗(5〜10分)した
14)脱水・透徹
標本を以下の順序で脱水・透徹した
a)70%エタノール(数秒)
b)90%エタノール(数秒)
c)100%エタノール(数秒)
d)無水エタノールI(数秒)
e)無水エタノールII(数秒)
f)キシレンI(数十秒)
g)キシレンII(数十秒)
15)封入
標本をマリノール(武藤化学製)で封入した
*1:100%メタノールに30%過酸化水素水を3%になるように加えた溶液
*2:0.01Mリン酸緩衝液(pH7.4)に塩化ナトリウムを0.8%加えた溶液
*3:2%ブロックエース(大日本製薬製)、0.8%塩化ナトリウムおよび0.1%アジ
化ナトリウムを含有する水溶液
*4:PBS*2にTween20を0.05%になるように加えた溶液
*5:0.05Mトリス塩酸緩衝液(pH7.6)にジアミノベンチジン(DAB)を0.
02%加えた溶液
【0039】
図2より、フコイダン抗体は、濃度依存的に細胞内フコイダンを染色した(吸収前)。また、フコイダンを予め吸収させたフコイダン抗体で免疫染色した結果、細胞内フコイダンは染色されなかった(吸収後)。これらの結果からフコイダン抗体はオキナワモズクフコイダンを特異的に免疫染色することがわかった。
【0040】
実 施 例4
サンドイッチ法による測定:
実施例2で得られたフコイダン抗体を、マイクロタイタープレート(Nalge Nunc International製)の各ウエルに添加し、4℃で一夜インキュベートすることによって固相化した。次に、この各ウエルにブロッキングバッファー(10%(w/v)BSAおよび0.05%プロリンを含むPBS)を加えてブロッキングし、更にその後、洗浄バッファー(0.2%Tween20を含むPBS)で各ウエルを洗浄して、フコイダン抗体を固相化したプレートを作製した。このプレートの各ウエルに種々の濃度のオキナワモズクフコイダンを含む溶液を添加し、室温(20〜25℃)で振動させながら1時間インキュベートし、固相化したフコイダン抗体とオキナワモズクフコイダンとを結合させた。その後、ホースラディッシュペルオキシダーゼ(POD)と結合させたフコイダン抗体を含み、0.05%のTween20を含むPBSの100μlを各ウエルに添加し、室温(20〜25℃)で穏やかに振動させながら1時間インキュベートした。その後、プレートを洗浄し、100μlの発色試薬溶液(0.4mg/ml(w/v)o−フェニレンジアミン)を添加し、室温で振動させながら20分間インキュベートし、十分に発色したところで、100μlの1N硫酸溶液を加え、反応を停止させた。最後にプレートをマイクロプレートリーダー(MPR−A4:トーソー製)を用いて波長492nmの吸光度を測定した。また、オキナワモズクフコイダンに代えて、多糖類(ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、アルギン酸、ラミナリン)についても同様の測定を行った。これらの結果を図3に示した。
【0041】
図3より上記測定系では100ng/ml以下、特に1〜100ng/mlのオキナワモズクフコイダン濃度を特異的に測定できることがわかった。また、この濃度範囲においては、ヘパリン、コンドロイチン硫酸A、デルマタン硫酸、コンドロイチン硫酸C、デキストラン硫酸、ラミナリン、アルギン酸との交差反応は認められなかった。
【0042】
実 施 例5
ヒト検体中のオキナワモズクフコイダンの測定:
10名のボランティアにオキナワモズクフコイダン(品名:フコイダン、サウスプロダクト社製)1gを経口摂取させ、0時間(摂取前)、3時間、6時間、9時間後に血清、血漿および尿を採取し、以下の前処理を行った後、実施例4の測定系で各サンプル中のオキナワモズクフコイダン濃度を測定した。その結果を表1に示した。
【0043】
血清、血漿および尿の前処理は、まず、血清、血漿および尿をPBSで4倍に希釈し、ドライサーモユニット(タイテック製)を用いて100℃で10分間沸騰させた。その後氷で冷却し、更に、これを12,000rpmで10分間遠心し、その上清をサンプルとした。
【0044】
【表1】

【0045】
その結果、全例で尿中オキナワモズクフコイダンを検出した。また、7例では血清および血漿中にオキナワモズクフコイダンを検出した。
【産業上の利用可能性】
【0046】
本発明のポリクローナル抗体は、オキナワモズクフコイダンと特異的に反応するため、オキナワモズクフコイダン摂取後の血中、尿中等の濃度測定や組織の染色に利用できる。
以 上
【特許請求の範囲】
【請求項1】
オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体。
【請求項2】
オキナワモズクフコイダン以外の多糖類と実質的に交差反応をしないものである請求項1記載のポリクローナル抗体。
【請求項3】
オキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることにより得られたものである請求項1記載のポリクローナル抗体。
【請求項4】
オキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることを特徴とする請求項1記載のポリクローナル抗体の製造方法。
【請求項5】
検体に、請求項1ないし3の何れかに記載のポリクローナル抗体を作用させ、検体中のオキナワモズクフコイダンを測定することを特徴とするオキナワモズクフコイダンの測定方法。
【請求項6】
検体が、尿、血清または血漿である請求項5記載のオキナワモズクフコイダンの測定方法。
【請求項7】
請求項1ないし3の何れかに記載のポリクローナル抗体を含有することを特徴とするオキナワモズクフコイダンの測定キット。
【請求項8】
検体に、請求項1ないし3の何れかに記載のポリクローナル抗体を作用させた後、更に染色試薬を作用させることにより、検体中のオキナワモズクフコイダンを染色することを特徴とするオキナワモズクフコイダンの免疫染色方法。
【請求項9】
検体が、細胞または組織である請求項8記載のオキナワモズクフコイダンの免疫染色方法。
【請求項1】
オキナワモズクフコイダンと特異的に反応することを特徴とするポリクローナル抗体。
【請求項2】
オキナワモズクフコイダン以外の多糖類と実質的に交差反応をしないものである請求項1記載のポリクローナル抗体。
【請求項3】
オキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることにより得られたものである請求項1記載のポリクローナル抗体。
【請求項4】
オキナワモズクフコイダンに、オブアルブミン、スカシ貝ヘモシアニンおよびウシ血清アルブミンから選ばれる生体高分子の一つを結合させ、当該結合物で動物を免疫し、当該動物から得られる抗血清を、更にオキナワモズクフコイダンを用いたアフィニティー精製をすることを特徴とする請求項1記載のポリクローナル抗体の製造方法。
【請求項5】
検体に、請求項1ないし3の何れかに記載のポリクローナル抗体を作用させ、検体中のオキナワモズクフコイダンを測定することを特徴とするオキナワモズクフコイダンの測定方法。
【請求項6】
検体が、尿、血清または血漿である請求項5記載のオキナワモズクフコイダンの測定方法。
【請求項7】
請求項1ないし3の何れかに記載のポリクローナル抗体を含有することを特徴とするオキナワモズクフコイダンの測定キット。
【請求項8】
検体に、請求項1ないし3の何れかに記載のポリクローナル抗体を作用させた後、更に染色試薬を作用させることにより、検体中のオキナワモズクフコイダンを染色することを特徴とするオキナワモズクフコイダンの免疫染色方法。
【請求項9】
検体が、細胞または組織である請求項8記載のオキナワモズクフコイダンの免疫染色方法。
【図1】


【図3】


【図2】




【図3】


【図2】


【公開番号】特開2011−98899(P2011−98899A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2009−253601(P2009−253601)
【出願日】平成21年11月5日(2009.11.5)
【出願人】(504426218)株式会社サウスプロダクト (15)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年11月5日(2009.11.5)
【出願人】(504426218)株式会社サウスプロダクト (15)
【Fターム(参考)】
[ Back to top ]

