ポリスルホン系分離膜およびポリスルホン系分離膜モジュールの製造方法
【課題】有機物やタンパク質、血小板付着などの付着が少ない高性能なポリスルホン系分離膜モジュールを提供することにある。
【解決手段】ポリスルホン系分離膜表面にビニルピロリドンユニットと疎水性ユニットを有し、膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも大きくしたポリスルホン系分離膜モジュール。
【解決手段】ポリスルホン系分離膜表面にビニルピロリドンユニットと疎水性ユニットを有し、膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも大きくしたポリスルホン系分離膜モジュール。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ポリスルホン系分離膜およびポリスルホン系分離膜モジュールの製造方法に関する。本発明は血液適合性やタンパク質や有機物の非付着が要求される用途に好適に用いられる。例えば、血液浄化用の分離膜では血液適合性やタンパク質の非付着が要求され、浄水器用膜、上水浄化膜、下水浄化膜、逆浸透膜や、生体成分分離用膜などではタンパク質や有機物の非付着が要求される。したがって、かかる分野において本発明の分離膜モジュールおよびその製造方法が好適に用いられる。
【背景技術】
【0002】
体液や血液と接触する医療用の分離膜は、タンパク質や血小板が付着すると分離膜の性能低下や、生体反応を引き起こす原因となり、深刻な問題となる。また、浄水器などの水処理膜においても、タンパク質や有機物の付着が、分離膜の性能低下を引き起こす。かかる問題を分離膜を親水化することによる解決が試みられており、様々な検討がなされている。例えば、ポリスルホンに親水性高分子であるポリビニルピロリドンを、製膜原液の段階で混合させて成形することで、膜に親水性を与え、汚れを抑制する方法が開示されている(特許文献1)。しかしながら、これらの方法では、表面に親水性を付与するには、製膜原液中の親水性高分子量を多くする必要があることや、基材となる高分子と相溶性のある親水性高分子に限定されることや、材料の使用用途に合わせて、最適な原液組成を検討しなければならないなどの制約を受ける。
【0003】
そこで、製膜の工程中で、形成された膜に対し、放射線または熱により、ポリビニルピロリドンなどの親水性成分を水不溶化させて導入する方法(特許文献2)や、ポリスルホン系の分離膜をポリビニルピロリドンなどの親水性高分子溶液と接触させた後、放射線架橋により不溶化した被膜層を形成する方法(特許文献3)が開示されている。しかしながら、ポリビニルピロリドンなどの水性高分子とポリスルホン系高分子は、分子間の相互作用が弱いために、被膜層を形成させることが困難という問題があった。
【0004】
そのため、ある範囲のケン化度のポリビニルアルコール水溶液をポリスルホン系分離膜と接触させて、ポリスルホンと酢酸ビニルの疎水性相互作用により、効率的に膜表面の被膜層を形成させる方法が開示されている(特許文献4)。しかしながら、本発明者らが検討した結果、ポリビニルアルコールを分離膜に被覆すると、分離膜の性能低下が著しいことがわかった。さらにポリビニルアルコールなどの水酸基は、血液と接触した際に、補体を活性化しやすいことも知られている。
【0005】
また、ある濃度のビニルピロリドン−スチレン共重合体をポリスルホンの製膜原液に添加することで、スチレンユニットを膜内部に、ビニルピロリドンユニットを表面側に存在させる方法が開示されている(特許文献5)。しかしながら、このような膜構造は、スチレンユニットとポリスルホンの相互作用によって誘起されるものであるため、ビニルピロリドン−スチレン量を多くすると、製膜原液から相分離により紡糸する際に、スチレンユニットとポリスルホンの相互作用により、相分離しにくくなり、高い膜性能を得ることは容易ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平2−18695号公報
【特許文献2】特公平8−9668号公報
【特許文献3】特開平6−238139号公報
【特許文献4】特開2006−198611号公報
【特許文献5】特再平9−13575号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、かかる従来技術の欠点を改良し、タンパク質や有機物の付着が少ない高性能なポリスルホン系分離膜モジュールを提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を達成するため鋭意検討を進めた結果、血液適合性に優れ、タンパク質や有機物の付着が少ないポリスルホン系分離膜およびポリスルホン系分離膜モジュールは、下記の1〜10の構成によって達成されることを見出した。
1.ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する前記疎水性ユニット量比が、膜内部に存在する前記疎水性ユニット量比よりも30%以上大きいことを特徴とするポリスルホン系分離膜。
2.前記のビニルピロリドンユニットと前記疎水性ユニットとが共重合体を構成していることを特徴とする前記1に記載のポリスルホン系分離膜。
3.前記の共重合体が、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有することを特徴とする前記2に記載のポリスルホン系分離膜。
4.前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットを有することを特徴とする前記1〜3のいずれかに記載のポリスルホン系分離膜。
5.前記共重合体中における前記疎水性ユニットの比率が10−80モル%であることを特徴とする前記2〜4のいずれかに記載のポリスルホン系分離膜。
6.血液浄化用分離膜であることを特徴とする前記1〜5のいずれかに記載のポリスルホン系分離膜。
7.前記1〜6のいずれかに記載のポリスルホン系分離膜が内蔵されたことを特徴とするポリスルホン系分離膜モジュール。
8.ビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットとから構成される共重合体溶液をポリスルホン系分離膜と接触させた状態で放射線照射および/または熱処理することを特徴とするポリスルホン系分離膜モジュールの製造方法。
9.前記のビニルピロリドンユニットと前記疎水性ユニットの共重合体溶液をポリスルホン系分離膜と接触させる際に、分離膜の内外で圧力差を設けることを特徴とする前記8に記載のポリスルホン系分離膜モジュールの製造方法。
10.前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットであることを特徴とする前記8または9に記載のポリスルホン系分離膜モジュールの製造方法。
【発明の効果】
【0009】
本発明に係るポリスルホン系分離膜およびポリスルホン系分離膜モジュールにおいては、表面に存在することを特徴とする分離膜モジュールであり、血液適合性やタンパク質・有機物の付着しにくい性質が要求される用途に幅広く用いることができる。
【図面の簡単な説明】
【0010】
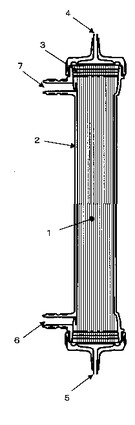
【図1】本発明に用いられる人工腎臓の一態様を示す。
【図2】実施例1〜10、比較例1〜7で実施したβ2−ミクログロブリン クリアランス測定における回路を示す。
【発明を実施するための形態】
【0011】
本発明は、ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する疎水性ユニット量比が、膜内部に存在する疎水性ユニット量比よりも大きいことを特徴とする分離膜モジュールである。ここで、ユニット量比とは、膜中の任意の箇所におけるポリスルホンユニットの存在量に対するビニルピロリドンユニットまたはポリスルホン系以外の疎水性ユニットの存在量の比を示すものであり、測定方法については後述の通りである。なお、以降、単に疎水性ユニットと記載している場合は、ポリスルホン系ユニット以外の疎水性ユニットを指す。
【0012】
タンパク質は疎水性表面に付着しやすいため、分離膜表面全体が親水性であることが重要と考えられている。しかしながら、一方で、ポリビニルピロリドンやポリエチレングリコールのような親水性高分子で材料表面を被覆しても、タンパク質などの付着は一時的にしか抑制できないとも言われている。本発明においては、ビニルピロリドンユニットと疎水性ユニットの両方が分離膜表面に存在することで、タンパク質や血小板の付着を効果的に抑制できる。この理由は定かではないが、表面の親水性と疎水性とがバランスよく存在することが、タンパク質や血小板の付着抑制のために重要なのではないかと考えられる。特に、水酸基を有する化合物を用いると、親水性が強すぎて、上記バランスを保つことができない。しかしながら、ビニルピロリドン基は、水酸基ほど親水性が強すぎず、疎水性のバランスが取れやすいのではないかと考えられる。
【0013】
したがって、疎水性ユニットの種類や表面のビニルピロリドン基と疎水性ユニットの比率が重要となる。表面の疎水性が強くなりすぎると、タンパク質や、血小板の付着を惹起する。表面の疎水性ユニット量は、0.1重量%〜40重量%程度、好ましくは1重量%〜20重量%である。また、表面のビニルピロリドンユニットの量としては、10重量%以上が好ましく、より好ましくは15重量%以上である。また、多すぎても親水性の効果が強くなりすぎるため、50重量%以下が好ましく、より好ましくは40重量%以下である。なお、表面のビニルピロリドンユニットの量としては、分離膜にポリビニルピロリドンが含まれる場合は、ビニルピロリドンユニットと疎水性ユニットの共重合ポリマー由来と、ポリビニルピロリドン由来との合計の値になる。表面のビニルピロリドンユニットの量は、ESCAなどにより求めることができる。
【0014】
表面におけるビニルピロリドンユニットおよび疎水性ユニットは、共重合体を形成していることが好ましい。各々のホモポリマーを添加するよりも、これらユニットが共重合体であることにより、付着抑制効果が高くなる。この理由は、不明な点も多いが、ビニルピロリドンと疎水性ユニットの表面の分布や1分子内で親水性と疎水性が適度にバランスが良くなっていることなどに起因するのではないかと考えられる。
【0015】
また、ここでいう表面は、分離機能層を有する表面をいう。例えば、人工腎臓用中空糸膜の場合は、中空糸膜の内表面を指す。また、本発明で表面と言った場合、表面からの深さが100nmまでの領域をベースとして、50nm、10nmの領域でも良い。膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも大きいかどうかは、例えば、X線光電子分光法(ESCA)と全反射赤外分光法(ATR)を組み合わせることによって知ることができる。これは、ESCAは、表面の数nm〜数10nmの深さの組成を測定するものであり、全反射赤外分光法(ATR)は、数μmまでの深さの組成を測定するものであることによる。したがって、ESCAで得られた疎水性ユニット量比の値が、ATRで得られた値よりも30%以上大きければ、本発明でいう膜表面に存在する前記疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも30%以上大きいとすることができる。なお、各測定の値は3点の平均値とする。なお、ESCAやATRで検出できない疎水性の官能基の場合は、分析電子顕微鏡やイオンエッチングと飛行時間型2次イオン質量分析法などを組み合わせたデプスプロファイルを取得することによって知ることもできる。
【0016】
また、本発明者らが検討した結果、分離膜内部の疎水性ユニット量比が多くなると、分離膜性能が低くなることもわかった。これは、膜の表面では、ある程度の疎水性があれば、タンパク質などの付着を抑制するが、膜全体としての疎水性が増加すれば、水や、水溶性物質の透過が起こりにくいためではないかと考えられる。すなわち、分離膜性能を考えた場合、分離膜全体としては、親水性のほうが好ましいものと考えられる。
【0017】
以上のことから、膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも30%以上大きいことが必要であるが、100%以上が好ましく、さらには300%以上が好ましい。ここで、膜表面に存在する疎水性ユニット量比(S)が、膜内部の疎水性ユニット量比(I)の何%大きいかは、下記式によって算出する。
((S−I)/I)×100 (%)
本発明でいうところの疎水性ユニットとしては、その疎水性ユニットからなるホモポリマーが、水に不溶もしくは難溶であるものを言う。ここで水に不溶もしくは難溶とは、20℃における純水100mlへの溶解度が1g以下、好ましくは0.1g以下のものを言う。具体的には、メチルメタクリレート、エチルメタクリレート、n−プロピルメタクリレート、n−ブチルメタクリレート、ベンジルメタクリレート等のメタクリル酸エステル及びアクリル酸エステルやスチレン、メチルスチレン、エチルスチレン等のスチレン系モノマー、酢酸ビニル等のカルボン酸ビニルエステル、脂肪族炭化水素、アクリロニトリル等のモノマーの重合体または共重合体からなるセグメントを挙げることができるが、特に酢酸ビニルや、ビニルカプロラクタム、脂肪族炭化水素、特に炭素数が2〜18の直鎖飽和炭化水素基がタンパク質や血小板の付着抑制機能が高いため、好適に用いられる。ここで、疎水性ユニットがスチレンやナフタレンのような芳香族系の官能基を有する場合には、疎水性の度合いが大きくなり過ぎるためか、タンパク質などの付着抑制効果は低い場合がある。
【0018】
また、共重合体中における疎水性ユニットの好ましい比率としては、疎水性ユニットによって異なるが、一般的には10モル%〜80モル%である。特に疎水性ユニットが酢酸ビニルからなる場合は、25〜75モル%が好適に用いられ、より好ましくは35〜65モル%である。ただし、酢酸ビニルが60モル%以上になると水に溶けにくくなるため、取り扱い性を考慮すると、35〜50モル%が好ましい。ビニルカプロラクタムからなる場合は、25〜75モル%が好適に用いられ、より好ましくは45〜55モル%である。炭素数が4の直鎖飽和炭化水素の場合は、1〜50モル%が好適に用いられ、より好ましくは5〜20モル%である。
【0019】
共重合体としては、グラフト共重合体よりもブロック共重合体や交互共重合体、ランダム共重合体が、タンパク質や血小板の付着抑制機能が高いため、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有する共重合体が好適に用いられる。これは、グラフト重合体では、主鎖にグラフトしたユニット部分がタンパク質などと接触する機会が多いため、共重合体としての特性よりも、グラフト鎖部分の特性が大きく影響するためと考えられる。また、ブロック共重合体よりも交互共重合体、ランダム共重合体がより好ましい。ブロック共重合体では、それぞれのユニットの特性(親水性部分と疎水性部分)がはっきりと分かれるためではないかと考えられる。1分子のなかでの親水性と疎水性の適度なバランスという点では、ランダム共重合体および交互共重合体から選ばれる少なくとも一つを有する共重合体が最も好適に用いられる。
【0020】
また、膜表面に存在する疎水性ユニット量比を、膜内部の疎水性ユニット量比よりも大きくするには、分離膜の製膜原液に疎水性ユニットを含んだポリマーを混和しておいて成形する方法や、分離膜成形後に疎水性ユニットを含んだポリマーを接触させる方法、例えばコーティングする方法が挙げられる。また、分離膜が中空糸膜の場合には、二重環状口金から吐出する際に内側に注入液を流すが、この注入液に疎水性ユニットを含んだポリマーを添加しても良い。中空糸膜が相分離し、膜構造が決定する前に、注入液中の疎水性ユニットを含んだポリマーが、製膜原液側に拡散するため、膜内表面に局在化させることができる。このとき、に疎水性ユニットを含んだポリマーが膜内に拡散しやいようにポリスルホン系ポリマーの重量平均分子量は小さいほうが好ましく、10万以下、さらには5万以下のものが好適に用いられる。さらに上記接触操作の後、放射線照射、熱処理またはこれら両方の処理などにより不溶化する方法、分離膜にビニルピロリドンモノマーと疎水性モノマーの混合溶液に浸漬し、重合反応を分離膜表面上で起こさせる方法などが挙げられる。これらの場合においても、タンパク質等の付着抑制効果およびハンドリング性等から、疎水性ユニットを含んだポリマーとしては、ビニルピロリドンユニットと疎水性ユニットとから構成される共重合体が好適に用いられる。
【0021】
製膜原液から湿式製膜する場合、表面にはエントロピーロスを防ぐために高分子量のポリマーが集まり、エンタルピーロスを防ぐために、親水性ポリマーが集まる傾向にある。従って、例えば、ポリスルホン膜の場合、ポリスルホンとポリビニルピロリドンおよび、疎水性ユニットを含んだポリマーの3成分ポリマーからなる原液を作成し、疎水性ユニットを含んだポリマーの分子量を、ポリビニルピロリドンの分子量よりも大きくすることで、表面に濃縮させることができる。しかしながら、疎水性ユニットを含んだポリマーのポリスルホンとの親和性が高ければ、エントロピー効果よりもエンタルピーの効果が優勢になり、疎水性ユニットは表面ではなく、分離膜内部に濃縮されることになる。一般的には、疎水性ユニットのホモポリマーよりも、ビニルピロリドンユニットとの共重合体のほうが、ポリスルホンとの親和性が弱いために好適に用いられる。特に芳香族系の疎水性ユニットは、ポリスルホンとの親和が高いことが多いので、それ以外の疎水性ユニットが好適に用いられる。
【0022】
分離膜内部の疎水性ユニット量比が多くなると、分離膜性能を高くすることは難しいため、できるだけ少量であることが好ましい。具体的には、疎水性ユニットを含んだポリマーは、分離膜の構成成分100重量部に対して、1重量部未満、好ましくは0.5重量部未満、さらには0.02重量部未満である。
【0023】
分離膜成形後に疎水性ユニットを含んだポリマーをコーティングする方法は、簡便に分離膜表面に疎水性ユニットを存在させることができるために、好適に用いられる。コーティング後、放射線照射、熱処理などにより不溶化しても良い。また、分離膜をビニルピロリドンモノマーと疎水性モノマーの混合溶液に浸漬させ、重合反応を分離膜表面上で起こさせても良い。
【0024】
これらのなかでも、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を、分離膜と接触させることで分離膜表面をコーティングする方法は、簡便でかつ少量で実施できるため好適な方法である。例えば、ビニルピロリドンユニットと疎水性ユニットの共重合体を水に溶解させてから接触させ、共重合体を分離膜に吸着させても良いし、接着剤のようなもので、分離膜素材にビニルピロリドンユニットと疎水性ユニットの共重合体を固定化させても良い。また、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を分離膜表面に接触させる際に、中空糸膜内部に入り込んだ共重合体を内表面により集積させるために、分離膜の内外で圧力差を設け、その圧力差を利用して膜表面に濃縮する方法は効率的であり、好適に用いられる。圧力差としては、加圧であっても減圧であっても良い。なお、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液そのもので圧力差をかけて膜表面に導入しなくとも、溶液を接触後、気体や、水など他の溶液で加圧しても良い。分離膜の内外における圧力差としては、好ましくは5kPa以上、より好ましくは10kPa以上、さらに好ましくは20kPa以上である。また、圧力差が高い場合には、分離膜がリークしてしまう場合があるので、100kPa以下が好ましく、より好ましくは70kPa以下、さらに好ましくは50kPa以下である。なお、ここで言うところの分離膜の内側とは、処理液と接する分離膜機能層の表面側、外側とはその反対側を言う。人工腎臓用中空糸膜を例に挙げると、被処理液である血液が流れる機能層の表面は内側に、透析液が流れるその反対表面は外側に相当する。
【0025】
また、分離膜は、ビニルピロリドンユニットと疎水性ユニットの共重合体以外に、20℃の水100gに対する溶解度が1g以上、好ましくは10g以上である水溶性ポリマーを含有していることが、タンパク質や血小板の付着抑制の観点から好ましい。具体的には、ポリビニルピロリドンや、ポリエチレングリコールなどが好適に用いられる。これは、表面の適度な親水性と疎水性のバランスが、タンパク質や血小板の付着抑制のために重要なためではないかと考えられている。分離膜に含有される水溶性ポリマー量としては、0.1重量%以上が好ましく、より好ましくは1重量%以上である。また、含有量が多すぎると膜性能が低くなる傾向にあるため30重量%以下が好ましく、より好ましくは10重量%以下である。また、機能層表面の水溶性ポリマー量としては、10重量%以上が好ましく、より好ましくは15重量%以上である。また、多すぎても親水性の効果が強くなりすぎるため、50重量%以下が好ましく、より好ましくは40重量%以下である。機能層表面の水溶性ポリマー量は、ESCAなどによって求めることができる。
【0026】
さらに、コーティング後、放射線照射、熱処理などにより不溶化する方法は、共重合体の溶出を低減できるため好適な方法である。例えば、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体溶液に浸漬した状態で放射線照射や熱処理を行えば良い。あるいは、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体溶液に浸漬させた後、溶液を抜き出した後、放射線照射や熱処理をしても良い。放射線照射する場合には、若干量の溶媒が存在すると、ビニルピロリドンユニットと疎水性ユニットの共重合体が分離膜に固定、不溶化されやすい。これは、溶媒が放射線照射によりラジカルとなり、これが起点となって、該共重合体や分離膜の素材もラジカル化し、共重合体が膜へ架橋、不溶化することによる。したがって、分離膜の乾燥重量に対して、0.2重量倍以上、さらには1.0重量倍の溶媒が残存していることが好ましい。なお、溶媒としては、取り扱い性の観点から水が好適に用いられる。一方で、分離膜モジュール内に水が充填されていない状態であると、放射線照射までの時間にコーティングした共重合体が溶出する懸念が少ないという観点から、分離膜のみ湿潤状態であることは好ましい。具体的には、分離膜の乾燥重量に対して、6.0重量倍以下、さらには4.0重量倍以下が好ましい。また、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合溶液に浸漬し、分離膜をコーティングした後、水などに置換してから放射線照射や熱処理を行っても良い。さらには、置換した水などを抜き出した後、放射線照射や熱処理をしても良い。
【0027】
なお、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を用いる場合において、共重合体溶液濃度が低いと、分離膜を充分にコーティングできない。また、濃度が高すぎると、溶出物が増える場合が多い。具体的な濃度は、共重合体の種類によってことなるが、一般的には、0.0001重量%以上、1重量%以下が好ましく、さらには、0.001重量%以上、0.1重量%以下が好ましい。
【0028】
分離膜を形成するポリマーをその良溶媒で溶解した際に、溶液には不溶性成分が含まれるが、かかる不溶性成分の含水率が95%以上、好ましくは97%以上である場合には、分離膜からのポリマーの溶出を抑えつつ、タンパク質の付着をより効果的に抑制することができる。タンパク質の付着を抑制するためには、ある程度の親水性が必要である。しかしながら、分離膜中にポリビニルピロリドンのような水溶性ポリマーを有しつつ、不溶性成分が含まれない場合には、タンパク質の種類によっては、付着の抑制効果が高くない場合がある。これは、膜表面に存在するポリビニルピロリドンの散漫層にタンパク質が潜りこんでトラップされるためと考えられる。上記散漫層がある程度の架橋状態であれば、タンパク質の潜りこみを抑制できるとためと推測できる。
【0029】
不溶性成分の含水率については、次のように求められる。乾燥した分離膜を、良溶媒で2重量%の濃度に溶解する。該溶液を濾紙を用いて濾過し、不溶性成分を得る。良溶媒で可溶性成分を十分に洗浄後、良溶媒を水で置換する。余分な水を取り除き、含水状態の不溶性成分重量(w)を測定後、十分に乾燥させた後の不溶性成分重量(d)を測定する。含水率は下式により算出できる。
含水率(%)=(w−d)×100/w
なお、例えば、ポリスルホン系ポリマーとポリビニルピロリドン、ビニルピロリドン/酢酸ビニル(6/4)からなる分離膜の場合は、ジメチルアセトアミドが良溶媒になる。
【0030】
不溶性成分を形成させるには、分離膜に放射線や熱処理を行うことによって、分子間や分子内で架橋反応を起こさせることが好適である。また、放射線照射線量や加熱温度、時間をコントロールすることで含水率を95%以上とすることができる。ポリマーによって異なるが、一般的に、放射線量としては5〜50kGyが、加熱条件としては120〜300℃が好適である。また、放射線を照射する際に抗酸化剤を用いることで、架橋反応を制御することも可能である。抗酸化剤の詳細については、後述する。
【0031】
中空糸膜内のポリマーの分散状態も、架橋反応に影響を及ぼす。すなわち、架橋性のポリマーが中空糸膜内で微分散していることが好ましい。中空糸膜内のポリマーの分散状態に影響を与える因子としては、製膜原液の組成比、撹拌速度、撹拌時間、溶解後の製膜までの時間、ビニルピロリドンユニットと疎水性ユニットの共重合体を注入液に添加する場合には、注入液組成、注入液温度、ビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングする際には、コーティング方法などが挙げられる。
【0032】
例えば、ポリスルホンとポリビニルピロリドンからなる中空糸膜に、ビニルピロリドン/酢酸ビニル(6/4)共重合体をコーティングする場合、製膜原液におけるポリビニルピロリドンの比は全ポリマー重量に対して、15〜35重量%が好ましい。ポリビニルピロリドンが少ないと、親水性の割合が少なくなるために、架橋反応後も含水率が低くなる。また、多すぎてもポリビニルピロリドンが微分散できなくなるために架橋反応が進行し、含水率が低下する。また、撹拌速度としては30rpm以上、好ましくは50rpm以上であった場合には、ポリビニルピロリドンの分散状態を高めることができるので好適である。さらに、溶解後、時間が経つと製膜原液内でミクロ相分離が生じ始めるために、ポリビニルピロリドンが微分散されなくなるため、溶解後1週間以内に紡糸することが好ましい。また、該共重合体をコーティングする際には、分離膜の内外で圧力差を生じさせることが効果的である。
【0033】
また、浸漬させたビニルピロリドンユニットと疎水性ユニットの共重合体溶液や水などを除去する方法としては、減圧乾燥、高温乾燥、低温送風乾燥、ブロー乾燥など、種々の方法を用いることができる。なお、放射線を照射する際に、酸素が存在すると、酸素ラジカルなどが発生し、分離膜素材の高分子材料が分解してしまうことが知られている。従って、放射線照射する際の分離膜周囲の酸素濃度は10%以下であることが望ましい。分離膜モジュールに放射線照射する場合は、例えば、モジュール内を窒素ガスでパージした後、密閉することで、酸素濃度を低下させ、放射線照射すれば良い。
【0034】
また、分離膜をモジュールに内蔵する手順としては、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体でコーティング等した後にモジュールに組み込んでも良く、分離膜を内蔵した分離膜モジュール内を該共重合体溶液で充填することで、コーティング等しても良い。コーティング等の後、上述したように放射線照射や熱処理を行っても良い。
【0035】
なお、ビニルピロリドンユニットと疎水性ユニットの共重合体を用いてコーティングした分離膜は、高い分離性能を発揮することができる。例えば、ビニルピロリドンユニットをビニルアルコールに置き換えて、疎水性ユニットとして酢酸ビニルを用いた共重合体の場合、コーティングによる分離性能の低下が著しい。これは、ビニルアルコールの水酸基と水分子や溶質分子が、水素結合などによって束縛され、膜を通過しにくいことなどが考えられるが、詳細な理由は不明である。
【0036】
本発明でいうところの放射線はα線、β線、γ線、X線、紫外線、電子線などが用いられる。また、人工腎臓などの血液浄化用モジュールは滅菌することが必要であり、近年は残留毒性の少なさや簡便さの点から、γ線や電子線を用いた放射線滅菌法が多用されている。すなわち、分離膜にビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングさせた場合、滅菌と同時に該共重合体の不溶化も同時に達成できる。
【0037】
基材の滅菌と改質を同時に行う場合は、15kGy以上の照射線量が好ましい。血液浄化用モジュール等をγ線で滅菌するには15kGy以上が効果的なためである。しかしながら、照射線量が100kGy以上であると、ビニルピロリドンユニットと疎水性ユニットの共重合体の3次元架橋や崩壊などが起きるため、血液適合性が低下する。
【0038】
また、分離膜にビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングさせ、放射線により該共重合体の不溶化する工程において、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液中に該共重合体以外の成分、例えば、抗酸化剤が入っていても良い。さらには、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液で、分離膜をコーティングした後、抗酸化剤溶液と接触させても良い。
【0039】
抗酸化剤を入れることで、発生するラジカル量を調整することができる。例えば、血液浄化用モジュールで、不溶化と滅菌を兼ねるための放射線照射を行う際に、両者のいずれかに適した線量を設定する場合であって、分離膜などが劣化する場合、それを防止するために抗酸化剤を併用すれば良い。抗酸化剤とは、他の分子に電子を与えやすい性質を持つ分子のことを言う。例えば、ビタミンCなどの水溶性ビタミン類、ポリフェノール類、メタノール、エタノール、プロパノール、エチレングリコール、プロピレングリコール、グリセリンなどのアルコール類、グルコース、ガラクトース、マンノース、トレハロースなどの糖類、ソジウムハイドロサルファイト、ピロ亜硫酸ナトリウム、二チオン酸ナトリウムなどの無機塩類、尿酸、システイン、グルタチオンなどが挙げられるが、これらに限定されるものではない。これらの抗酸化剤は単独で用いてもよいし、2種類以上混合して用いてもよい。本発明の方法を医療用具に用いる際は、その安全性を考慮する必要があるため、抗酸化剤としては毒性の低いものが好適に用いられる。
【0040】
抗酸化剤を含有する溶液の濃度については、含有する抗酸化剤の種類、放射線の照射線量などにより異なる。抗酸化剤の濃度が低すぎると、溶媒から発生するラジカルの消去が十分にできないため、分離膜などの劣化を防ぐことができない。また、抗酸化剤を多量に入れると、ラジカルが十分に消去されてしまうために、共重合体の分離膜への固定化量が落ちるために、溶出物の増加やタンパク質や血小板などの付着抑制効果も十分に得られない。以上のことから、抗酸化剤として好適に用いられる物質は、エタノール、n−プロパノール、2−プロパノール、エチレングリコール、プロピレングリコール、グリセリンであり、その濃度範囲は、0.01重量%以上、90重量%以下が好適に用いられる。特にエタノール、n−プロパノール、2−プロパノールの場合は、0.01重量%以上、10重量%以下が好適に用いられ、さらに好ましくは0.05重量%以上、1重量%以下である。プロピレングリコール、グリセリンの場合は、0.1重量%以上、90重量%以下、さらに好ましくは、0.5重量%以上、70重量%以下である。
【0041】
本発明でいうところの分離膜とは血液や水溶液などの処理する液体に含まれる特定の物質を、吸着もしくは濾過、拡散により、選択的に除去する膜のことである。
【0042】
本発明の分離膜は、高い付着抑制機能を有するので、水処理用分離膜や生体成分分離膜として好適に用いることができる。特に、人工腎臓などの血液浄化用モジュールに適する。ここで、血液浄化用モジュールとは、血液を体外に循環させて、血中の老廃物や有害物質を取り除く機能を有したモジュールのことをいい、人工腎臓や外毒素吸着カラムなどがある。また、人工腎臓用モジュールとしては、コイル型、平板型、中空糸膜型があるが、処理効率などの点から、中空糸膜型が好ましい。
【0043】
本発明の分離膜となる素材は、特に限定しないが、医療用に用いられている素材が好ましく、例えば、ポリ塩化ビニル、セルロース系ポリマー、ポリプロピレン、ポリアクリルニトリル、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート、ポリスルホンやポリエーテルスルホンなどのポリスルホン系ポリマー、ポリウレタンなどが挙げられる。この中でも特にポリスルホン系ポリマーは成形が容易で、膜にしたときの物質透過性能に優れているため、好適に用いられる。
【0044】
本発明で用いられるポリスルホン系ポリマーは、主鎖に芳香環、スルフォニル基およびエーテル基をもつもので、例えば、次式(1)、(2)の化学式で示されるポリスルホンが好適に使用されるが、本発明ではこれらに限定されない。式中のnは、例えば50〜80の如き整数である。
【0045】
【化1】

【0046】
ポリスルホンの具体例としては、ユーデルポリスルホンP−1700、P−3500(ソルベイ社製)、ウルトラソンS3010、S6010(BASF社製)、ビクトレックス(住友化学)、レーデルA(ソルベイ社製)、ウルトラソンE(BASF社製)等のポリスルホンが挙げられる。又、本発明で用いられるポリスルホンは上記式(1)及び/又は(2)で表される繰り返し単位のみからなるポリマーが好適ではあるが、本発明の効果を妨げない範囲で他のモノマーと共重合していても良い。特に限定するものではないが、他の共重合モノマーは10重量%以下であることが好ましい。
【0047】
分離膜モジュールの製造としては、その用途により、種々の方法があるが、大まかな工程としては、分離膜の製造工程と、その分離膜をモジュールに組み込むという工程にわけることができる。
【0048】
血液浄化用モジュールとして、人工腎臓の製造方法についての一例を示す。まず、分離膜である中空糸膜の製造方法としては、ポリスルホンとポリビニルピロリドン(重量比率20:1〜1:5が好ましく、5:1〜1:1がより好ましい)をポリスルホンの良溶媒(N,N−ジメチルアセトアミド、ジメチルスルホキシド、ジメチルホルムアミド、N−メチルピロリドン、ジオキサンなどが好ましい)および貧溶媒の混合溶液に溶解させた原液(濃度は、10〜30重量%が好ましく、15〜25重量%がより好ましい)を二重環状口金から吐出する際に内側に注入液を流し、乾式部を走行させた後凝固浴へ導く。この際、乾式部の湿度が影響を与えるために、乾式部走行中に膜外表面からの水分補給によって、外表面近傍での相分離挙動を速め、孔径拡大し、結果として透析の際の透過・拡散抵抗を減らすことも可能である。ただし、相対湿度が高すぎると外表面での原液凝固が支配的になり、かえって孔径が小さくなり、結果として透析の際の透過・拡散抵抗を増大する傾向がある。そのため、相対湿度としては60〜90%が好適である。また、注入液組成としてはプロセス適性から原液に用いた溶媒を基本とする組成からなるものを用いることが好ましい。注入液濃度としては、例えばジメチルアセトアミドを用いたときは、45〜80重量%、さらには60〜75重量%の水溶液が好適に用いられる。
【0049】
中空糸膜をモジュールに内蔵する方法としては、特に限定されないが、一例を示すと次の通りである。まず、中空糸膜を必要な長さに切断し、必要本数を束ねた後、筒状ケースに入れる。その後両端に仮のキャップをし、中空糸膜両端部にポッティング剤を入れる。このとき遠心機でモジュールを回転させながらポッティング剤を入れる方法は、ポッティング剤が均一に充填されるために好ましい方法である。ポッティング剤が固化した後、中空糸膜の両端が開口するように両端部を切断し、中空糸膜モジュールを得る。
【0050】
以下実施例を挙げて本発明を説明するが、本発明はこれらの例によって限定されるものではない。
【実施例】
【0051】
以下実施例と比較例を挙げて本発明を説明するが、本発明はこれらの例によって限定されるものではない。
1.中空糸膜モジュールの作製
(1)ポリスルホン/ポリビニルピロリドン(PSf/PVP)混合中空糸膜
ポリスルホン(アモコ社 Udel−P3500)16重量部、ポリビニルピロリドン(インターナショナルスペシャルプロダクツ社;以下ISP社と略す)K30 3重量部、ポリビニルピロリドン(ISP社K90)3重量部をジメチルアセトアミド77重量部、水1重量部と加熱溶解し、製膜原液とした。
【0052】
この原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から芯液としてジメチルアセトアミド63重量部、水37重量部からなる溶液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、350mmのドライゾーン雰囲気を経て、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60〜75℃90秒の水洗工程、130℃の乾燥工程を2分通過させ、160℃のクリンプ工程を経て得られた中空糸膜を巻き取り束とした。この中空糸膜の総膜面積を1.6m2になるようにケースに充填し、かつ中空糸膜の両端をポッティング材によりケース端部に固定し、ポッティング材の端部の一部をカッティングすることで両端の中空糸膜を開口させて、人工腎臓モジュールとした。
【0053】
(2)ポリスルホン(PSf)中空糸膜
ポリスルホン(アモコ社 Udel−P3500)18重量部をジメチルアセトアミド81部、水1部と加熱溶解し、製膜原液とした。
【0054】
この原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から注入液としてジメチルアセトアミド63部、水37部からなる溶液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、乾式長350mmのドライゾーン雰囲気を通過した後、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60℃/90秒の水洗工程を通過させ、中空糸膜(中空糸膜2)を巻き取り束とした。
【0055】
(3)注入液へのポリマー添加検討
ポリスルホン(アモコ社 Udel−P3500(重量平均分子量4.7万))18重量部、ポリビニルピロリドン(インターナショナルスペシャルプロダクツ社;以下ISP社と略す)K30 9重量部をジメチルアセトアミド72重量部、水1重量部と加熱溶解し、製膜原液とした。
【0056】
ジメチルアセトアミド63重量部、水37重量部の溶液にビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)10重量部を溶解させて注入液とした。
【0057】
製膜原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から注入液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、350mmのドライゾーン雰囲気を経て、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60〜75℃・90秒の水洗工程、130℃の乾燥工程を2分通過させ、160℃のクリンプ工程を経て得られた中空糸膜(中空糸膜3)を巻き取り束とした。
【0058】
また、注入液にコリドンVA64を添加しない組成の溶液を用いて、上記と同様にして中空糸膜(中空糸膜4)を作成した。
2.測定方法
(1)中空糸膜のヒト血小板付着試験方法
18mmφのポリスチレン製の円形板に両面テープを貼り付け、そこに中空糸膜を固定した。貼り付けた中空糸膜を片刃で半円筒状にそぎ切り、中空糸膜の内表面を露出させた。中空糸内表面に汚れや傷、折り目などがあると、その部分に血小板が付着し、正しい評価ができないことがあるので注意を要する。筒状に切ったFalcon(登録商標)チューブ(18mmφ、No.2051)に該円形板を、中空糸膜を貼り付けた面が、円筒内部にくるように取り付け、パラフィルムで隙間を埋めた。この円筒管内を生理食塩水で洗浄後、生理食塩水で満たした。人間の静脈血を採血後、直ちにヘパリンを50U/mlになるように添加した。前記円筒管内の生理食塩水を廃棄後、前記血液を、採血後10分以内に、円筒管内に1.0ml入れて37℃にて1時間振盪させた。その後、中空糸膜を10mlの生理食塩水で洗浄し、2.5%グルタルアルデヒド生理食塩水で血液成分の固定を行い、20mlの蒸留水にて洗浄した。洗浄した中空糸膜を常温0.5Torrにて10時間減圧乾燥した。この中空糸膜を走査型電子顕微鏡の試料台に両面テープで貼り付けた。その後、スパッタリングにより、Pt−Pdの薄膜を中空糸膜表面に形成させて、試料とした。この中空糸膜の内表面をフィールドエミッション型走査型電子顕微鏡(日立社製S800)にて、倍率1500倍で試料の内表面を観察し、1視野中(4.3×103μm2)の付着血小板数を数えた。中空糸長手方向における中央付近で、異なる10視野での付着血小板数の平均値を血小板付着数(個/4.3×103μm2)とした。中空糸の長手方向における端の部分は、血液溜まりができやすいため付着数の計測対象からはずした。
【0059】
(2)フィブリノーゲンの相対付着率測定
中空糸膜へのタンパク質の付着として、凝固系タンパク質の1つである、フィブリノーゲンの相対吸着率を測定した。
【0060】
プラスチック管に中空糸膜を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。
【0061】
次に、人間の静脈血を採血後、直ちにクエン酸を10容量%になるように添加した。該血液を4℃にて3000rpm、15分間遠心し、血漿を得た。
【0062】
血漿1mLを流速0.5mL/minで2時間循環させた。ミニモジュールから中空糸を24cm相当切り出し、約1mm長に細切しエッペンチューブに入れた。リン酸緩衝液(以下、PBSと略記)にて洗浄した(1mL×3回、血液が残っている場合には繰り返した)。トゥイーン−20(片山化学)をPBSで0.05重量%になるように調整した(以下、PBS−Tと略記)。スキムミルクを0.1重量%になるように、PBS−Tに溶解させ、該溶液で3回洗浄した。抗ヒトフィブリノーゲン(HPR)抗体を0.1重量%のスキムミルク/PBS−T溶液で10000倍に希釈し、1mL添加した後、室温にて2時間ローテーターで回転、撹拌させた。0.1重量%のスキムミルク/PBS−T溶液で2回洗浄した後、0.1重量%のスキムミルク/PBS溶液で2回洗浄した。TMB one solutionを1mL添加し、ミクロミキサーで撹拌した。発色具合をみて6Nの塩酸を200μL添加し、反応停止した(後述のコントロールの吸光度が1〜1.5の範囲に入るように反応をコントロールする)。450nmの吸光度を測定した。コントロールとして東レ社製人工腎臓“トレスルホン”TS−1.6ULを用いた。コントロールの吸光度(Ac)と対象サンプルの吸光度(As)から、フィブリノーゲンの相対付着量を下記式により求めた。
フィブリノーゲンの相対付着率(%)=As/Ac×100。
(3)β2−ミクログロブリン(β2−MG) クリアランス測定
エチレンジアミン四酢酸二ナトリウムを添加した牛血液について、ヘマトクリットが30±3%、総タンパク量が6.5±0.5g/dLとなるように調整した。
【0063】
次に、β2−ミクログロブリン濃度が1mg/lになるように加え、撹拌した。かかる牛血液について、その2Lを循環用に、1.5Lをクリアランス測定用として分けた。
【0064】
回路を図2のようにセットした。透析装置としては、東レメディカル株式会社製 TR2000Sを用いた。TR2000Sは、図2のうち、Biポンプ、Fポンプ、および透析装置にあたる。
【0065】
透析装置に、透析液(キンダリー液AF2号 扶桑薬品工業株式会社製)A液およびB液をセットした。透析液側から血液側に向けてRO水を流した。透析液濃度13〜15mS/cm、温度34℃以上、透析液側流量を500ml/minに設定した。
【0066】
透水装置の除水速度を10ml/(min・m2)に設定した。Bi回路入口部を上記で調整した牛血液2L(37℃)の入った循環用ビーカーに入れ、Biポンプをスタートし、Bo回路出口部から排出される液体90秒間分を廃棄後、ただちにBo回路出口部および、Do回路出口部を循環用ビーカーに入れて循環状態とした。
【0067】
続いて透析装置のFポンプを動かし、循環を1時間行った後、BiポンプおよびFポンプを停止した。
【0068】
次に、Bi回路入口部を上記で調整したクリアランス測定用の牛血液に入れ、Bo回路出口部を廃棄用ビーカーに入れた。Do回路出口部から流出する液体は廃棄した。
【0069】
Diポンプをスタートした。また、血液ポンプをスタートするとともに、トラップとBiチャンバーの間を開放した。
【0070】
スタートから2分経過後、クリアランス測定用の牛血液(37℃)からサンプルを10ml採取し、Bi液とした。スタートから4分30秒経過後に、Bo回路出口部からサンプルを10ml採取し、Bo液とした。これらのサンプルは、−20℃以下の冷凍庫で保存した。
【0071】
各液のβ2−ミクログロブリンの濃度からクリアランスを下記式によって算出した。牛血液のロットによって測定値が異なる場合があるので、実施例に用いたデータは全て同一ロットの牛血液を使用した。
【0072】
Co(ml/min)=(CBi−CBo)×QB/CBi
上記の式において、CO=β2−ミクログロブリンクリアランス(ml/min)、CBi=Bi液におけるβ2−ミクログロブリン濃度、CBo=Bo液におけるβ2−ミクログロブリン濃度、QB=Biポンプ流量(ml/min)である。
(4)分離膜表面および内部の酢酸ビニルユニット量比の測定
分離膜表面および内部の酢酸ビニルユニット量比は、ポリスルホンに対する存在比で、比較した。表面の酢酸ビニルユニット量比の測定には、X線電子分光法を用いた。測定装置としてESCA LAB220iXLを用い、サンプルを装置にセットして、X線の入射角に対する検出器の角度は90度にて測定を行った。この角度においては、測定深さは約10nmである。
【0073】
中空糸膜を超純水で充分に洗浄した後、室温、0.5Torrにて10時間乾燥させた。その後、中空糸膜を片刃で半円筒状にそぎ切り、中空糸膜内表面の酢酸ビニルユニット量比を測定した。さらに、中空糸膜の内表面の一部分を片刃でそぎ取り、膜厚部分を露出させ、酢酸ビニルユニット量比を測定した。測定装置、条件は、以下の通り。
【0074】
測定装置: ESCALAB220iXL
励起X線: monochromatic Al Kα1,2 線(1486.6eV)
X線径: 0.15mm
光電子脱出角度: 90 °(試料表面に対する検出器の傾き)
表面の酢酸ビニルユニット量比は、C1sピークにエステル基(COO)のピークが現れることから、ピーク分割することで得られる。より具体的には、C1sには、主にCHx,C−C,C=C,C−S由来の成分、主にC−O,C−N由来の成分、π-π*サテライト由来の成分、C=O由来の成分、エステル基(COO)由来の成分の5つの成分から構成される。従って、5つ成分でピーク分割を行う。COO由来の成分は、C1sのCHやC−Cのメインピーク(285eV付近)から+4.0〜4.2eVに現れるピークである。この各成分のピーク面積比は、小数点第1桁目を四捨五入し、算出する。全元素(水素原子は検出できないので、水素原子以外の全元素)に対する該ピーク面積の割合を算出し、エステル基量(COOの炭素量)(原子数%)を求めた。ここで、ピーク分割の結果、0.4%以下であれば、検出限界以下とした。また、ポリスルホン量は、ポリスルホンの繰り返しユニット当たりに1個の硫黄原子が存在するので、硫黄量を求めることで得られる。したがって、表面酢酸ビニルユニット量比=エステル基量(原子数%)/硫黄量(原子数%)とした。
【0075】
なお、表面のビニルピロリドンユニット量は、窒素量(a(原子数%))と硫黄量(b(原子数%))を求め、下式よりを算出した。
表面ビニルピロリドン量(重量%)=(a×111/(a×111+b×442))×100
内部の酢酸ビニルユニット量比は、ATR測定を行うことによって求めた。測定条件は分解能4、積算回数64回とした。1730cm−1付近のエステル基由来のC=Oのピークの強度(ACO)と、1580cm−1付近のポリスルホンのベンゼン環由来のC=C吸収ピークの強度(ACC)を求めた。ATRは表面から約2〜3μmまでの測定深さである。
【0076】
各種濃度のポリスルホンとポリ酢酸ビニルをN,N−ジメチルアセトアミドに溶解させた。各種濃度の溶液を、ホットプレートで110℃に加熱したガラス板の上に滴下し、厚さ203μmとなるようキャストした。キャスト後、5分間ホットプレート上で放置し、溶媒を蒸発させた後、ガラス板ごと水浴へ浸漬し透明フィルムを得た(水浴に浸漬させるのは、フィルムをガラス板からはがしやすくさせるためである)。
このフィルムについてATR測定を行い、(ACO)と(ACC)の強度比と酢酸ビニルユニット量比の検量線を求めた。
【0077】
中空糸膜内表面についてATR測定を行い、(ACO)と(ACC)の強度比から、上記の検量線を用いて、内部の酢酸ビニルユニット量比とした。
【0078】
(5)不溶性成分の含水率測定
乾燥した中空糸膜を2g/vol%になるようにジメチルアセトアミドで5時間以上撹拌、溶解させた。濾紙(「アドバンテック」(登録商標)No.7 東洋濾紙社製)で不溶性成分を濾過させた後、ジメチルアセトアミドで可溶性成分を十分に洗浄した。遠沈管に不溶性成分(ゲル状物)を回収し、さらにジメチルアセトアミドで十分に撹拌後、遠心により該ゲルを沈降させ、上澄みを取り除くことを3回以上繰り返した。その後、上澄みを取り除いた後、純水を添加し、十分に撹拌後、遠心により該ゲルを沈降させ、上澄みを取り除くことを5回繰り返し、ジメチルアセトアミドを純水に置換した。余剰の水分を抜き取り、含水した重量(w)を測定した。得られた含水ゲルについて、凍結乾燥を24時間以上行い、完全に乾燥後、重量(d)を測定した。下記式により含水率を算出した。
含水率(%)=(w−d)×100/w。
【0079】
下記の実施例1〜9および比較例1〜5については、ポリスルホン/ポリビニルピロリドン(PSf/PVP)混合中空糸膜(中空糸膜1)を使用した。
(実施例1)
ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.1重量%水溶液を中空糸膜モジュールの血液側入口から血液側出口に500mL通液した。次に血液側入口から透析液側入口に500mL通液することで、中空糸膜の内表面に、VA64を集積させた。中空糸膜内部に入り込んだVA64を内表面に、より集積させるために、100kPaの圧縮空気で透析液側から血液側へ充填液を押しだした。この後、血液側の充填液をブローし、中空糸膜のみに水溶液が保持された状態にした。さらに窒素で透析液側、血液側それぞれをブローした後、該モジュールにγ線を照射した。該モジュールについて、血小板付着試験、β2−ミクログロブリン クリアランス測定、膜表面および内部の酢酸ビニルユニット量比の測定を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(実施例2)
“コリドンVA64“0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。比較例1と比べてβ2−ミクログロブリン除去性能が高い理由としては、VA64が機能層表面を覆い、細孔径が狭小化する効果よりも、タンパク質などの付着抑制効果が高いため、タンパク質による膜の目詰まりによる性能低下が少なかったためと考えられる。また、不溶性成分の含水率は95.2%であり、フィブリノーゲンの相対吸着率は65%であった。
(実施例3)
“コリドンVA64“0.001重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。実施例1、2と比べて血小板付着抑制性がやや低下した理由としては、実施例1、2と比べて機能層表面のVA64量が少ないためと考えられる。
(実施例4)
“コリドンVA64“0.001重量%とエタノール0.1重量%の混合水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。VA64と同一の処理濃度にも関わらず、実施例3と比べて血小板付着抑制性が高い理由としては、エタノールによるVA64へのγ線保護効果があったためと考えられる。また、不溶性成分の含水率は97.3%であり、フィブリノーゲンの相対吸着率は28%であった。実施例1と比較して、血小板付着数は同じでもフィブリノーゲンの付着は半分以下に抑えられた。
(実施例5)
“コリドンVA64“0.01重量%水溶液を実施例1と同様の操作に充填したのみで、圧縮空気によるブローは行わなかった。結果は表1の通りであった。すなわち、膜をVA64溶液に浸漬させた状態でγ線照射しても、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(実施例6)
ビニルピロリドン/酢酸ビニル(7/3)共重合体(BASF社製、“ルビスコールVA73“)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであり、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。すなわち、機能層表面にVA73を多く局在化させることができた。血小板付着は比較例1に比べて、抑制されているが、実施例1と比べて、やや多い値となった。これは、VA73には分子内の疎水性ユニットであるエステル基が少なく、親水性と疎水性のバランスがVA64よりも悪いため、付着抑制性に劣っていたと考えられる。
(実施例7)
ビニルピロリドン/酢酸ビニル(3/7)共重合体(BASF社製、“ルビスコールVA37“)0.1重量%のメタノール溶液を中空糸膜モジュールの血液側入口から血液側出口に通液し、次に血液側入口から透析液側出口に通液する順で充填した。さらに水を同様に通液した後、実施例1と同様に、ブロー、窒素置換し、γ線照射した。結果は表1の通りであり、水に難溶のビニルピロリドン/酢酸ビニル(3/7)共重合体をアルコール水溶液にて分離膜に導入し、水に置換後、γ線を照射しても、高い分離膜性能と血小板付着抑制性を両立できた。すなわち、機能層表面にVA37を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(参考例1)
ビニルピロリドン/ビニルカプロラクタム(5/5)共重合体(BASF社製、“ルビテック”VPC55K65W)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行い、内表面にVPC55K65Wを集積させた。結果は表1の通りであった。結果は表1の通りであった。すなわち、機能層表面にVPC55K65Wを多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(参考例2)
ビニルピロリドン/1−ブテン(90/10)共重合体(ISP社製、“ガネックス”P−904LC)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行い、内表面にP−904LCを集積させた。結果は表1の通りであった。結果は表1の通りであった。すなわち、機能層表面にガネックスP−904LCを多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(比較例1)
ビニルピロリドン/酢酸ビニル(6/4)共重合体の代わりに水を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。β2−ミクログロブリン除去性能は高かったが、血小板が多く付着する表面であった。また、不溶性成分の含水率は94.7%であり、フィブリノーゲンの相対吸着率は110%であった。
(比較例2)
ポリビニルピロリドン(BASF社製、K90)0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、親水性であるビニルピロリドンのホモポリマーを用いた場合であっても、血小板がよく付着する表面であった。
(比較例3)
ポリエチレングリコール(分子量5万)0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。ポリエチレングリコールは水に良く溶ける親水性ポリマーであるが、血小板が多く付着する表面であった。
(比較例4)
“コリドンVA64“を、中空糸膜表面から内部まで充填することを目的とし、“コリドンVA64“0.1重量%水溶液を中空糸膜モジュールの血液側入口から血液側出口に通液し、次に透析液側入り口から透析液側出口に通液する順で充填した。水溶液を充填したまま、該モジュールにγ線を照射した。結果は表1の通りであった。すなわち、機能層表面および内部もVA64量が多すぎるために、血小板付着抑制性はあるが、β2−ミクログロブリン除去性能が顕著に低かった。
【0080】
(比較例5)
ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.0001重量%とエタノール0.1重量%の混合水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を局在化させることができないために、血小板付着抑制性がほとんど認められなかった。また、不溶性成分の含水率は97.1%であり、フィブリノーゲンの相対吸着率は105%であった。実施例4と比較して、不溶性成分の含水率は同じ程度であるが、中空糸膜内表面のエステル基量が少ないために、フィブリノーゲンの付着を抑制できなかったと考えられる。
(比較例6)
ポリビニルアルコール(PVA)(分子量1万、ケン化度80%)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にPVAを多く局在化することができているが、β2−ミクログロブリン除去性能は低い値であった。
【0081】
下記の実施例10および比較例7については、ポリスルホン(PSf)中空糸膜(中空糸膜2)を使用した。
【0082】
(実施例8)
プラスチック管にポリスルホン(PSf)中空糸膜(中空糸膜2)を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。次に、ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.01重量%水溶液を中空糸膜の内側に3mL通液した後、中空糸膜の内側から外側に向けて3mL通液させた。その後、内側および外側の溶液をブローで抜き出した後、25kGyのγ線を照射した。γ線照射後、純水にて十分に洗浄した後、各種試験を行った。
【0083】
なお、中空糸膜の性能としては、以下の方法で、β2−ミクログロブリンのクリアランスを測定した。すなわち、濃度が5mg/Lになるように、β2−ミクログロブリンを37℃の牛血清に加えた。これを前記ミニモジュールの血液側に1mL/minで流し、透析液側に37℃の生理食塩液を20mL/minで流した。2時間循環させた後、血液側の牛血清と、透析液側の生理食塩液を全量回収してエスアールエル(株)に分析を依頼し、β2−ミクログロブリンの濃度を測定した。測定結果から有効膜面積1.8m2として換算したクリアランスを算出した。
【0084】
また、ミニモジュールでのβ2−ミクログロブリンのクリアランス測定は、実験毎の数値のばらつきがあるため、実験毎にコントロールを加えて、実験間の比較を行った。コントロールには、東レ社製人工腎臓“トレスルホン”TS−1.6ULの中空糸膜を用いた。コントロールに用いるTS−1.6ULは、製造ロットが同一のものを使用した。TS−1.6ULの測定結果と百分率で比較して、相対除去率(%)を求め、この数値をもって実験間の比較を行った。
【0085】
結果は表2の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。また、実施例2に比べて、血小板付着の抑制効果がやや劣ったのは、ポリスルホンの単独組成の中空糸膜であり、水溶性ポリマーであるPVPが存在していないためと考えられる。
【0086】
(比較例7)
VA64の代わりに水を用いた以外は、実施例8と同様の操作を行った。結果は表2の通りであった。すなわち、血小板がよく付着する表面であった。
【0087】
下記の実施例9および比較例8については、注入液にビニルピロリドンユニットと疎水性ユニットの共重合体のそれぞれを添加した膜(中空糸膜3,4)を用いて比較を行った。
【0088】
(実施例9)
プラスチック管に中空糸膜3を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。中空糸膜の内部および外側の水を圧空ブローにて抜き出した後、25kGyのγ線を照射した。γ線照射後、純水にて十分に洗浄した後、各種試験を行った。中空糸膜の性能としては、実施例8と同様にしてβ2−ミクログロブリンのクリアランスを測定した。結果は表3の通りであった。すなわち、血小板の付着が抑制され、β2−ミクログロブリン除去性能が高かった。比較例8と比べて、β2−ミクログロブリン除去性能が高い理由としては、VA64が機能層表面を覆い、タンパク質などの付着抑制効果が高いため、タンパク質による膜の目詰まりによる性能低下が少なかったためと考えられる。
【0089】
(比較例8)
プラスチック管に中空糸膜4を36本通し、実施例9と同様の操作を行い、得られた中空糸膜についても、同様の評価を行った。結果は表3の通りであった。すなわち、血小板が多く付着する表面であり、β2−ミクログロブリン除去性能も実施例9よりも低かった。
【0090】
【表1】

【0091】
【表2】

【0092】
【表3】

【符号の説明】
【0093】
1 中空糸膜
2 ケース
3 ポッティング剤
4 血液側入口(Bi)
5 血液側出口1(Do)
6 透析液側入口(Di)
7 透析液側出口(Do)
8 基準線
9 透析装置
10 中空糸膜モジュール
11 Biポンプ
12 Fポンプ
13 廃棄用容器
14 循環用血液
15 クリアランス測定用血液
16 Bi回路
17 Bo回路
18 Di回路
19 Do回路
20 温水槽
【技術分野】
【0001】
本発明は、ポリスルホン系分離膜およびポリスルホン系分離膜モジュールの製造方法に関する。本発明は血液適合性やタンパク質や有機物の非付着が要求される用途に好適に用いられる。例えば、血液浄化用の分離膜では血液適合性やタンパク質の非付着が要求され、浄水器用膜、上水浄化膜、下水浄化膜、逆浸透膜や、生体成分分離用膜などではタンパク質や有機物の非付着が要求される。したがって、かかる分野において本発明の分離膜モジュールおよびその製造方法が好適に用いられる。
【背景技術】
【0002】
体液や血液と接触する医療用の分離膜は、タンパク質や血小板が付着すると分離膜の性能低下や、生体反応を引き起こす原因となり、深刻な問題となる。また、浄水器などの水処理膜においても、タンパク質や有機物の付着が、分離膜の性能低下を引き起こす。かかる問題を分離膜を親水化することによる解決が試みられており、様々な検討がなされている。例えば、ポリスルホンに親水性高分子であるポリビニルピロリドンを、製膜原液の段階で混合させて成形することで、膜に親水性を与え、汚れを抑制する方法が開示されている(特許文献1)。しかしながら、これらの方法では、表面に親水性を付与するには、製膜原液中の親水性高分子量を多くする必要があることや、基材となる高分子と相溶性のある親水性高分子に限定されることや、材料の使用用途に合わせて、最適な原液組成を検討しなければならないなどの制約を受ける。
【0003】
そこで、製膜の工程中で、形成された膜に対し、放射線または熱により、ポリビニルピロリドンなどの親水性成分を水不溶化させて導入する方法(特許文献2)や、ポリスルホン系の分離膜をポリビニルピロリドンなどの親水性高分子溶液と接触させた後、放射線架橋により不溶化した被膜層を形成する方法(特許文献3)が開示されている。しかしながら、ポリビニルピロリドンなどの水性高分子とポリスルホン系高分子は、分子間の相互作用が弱いために、被膜層を形成させることが困難という問題があった。
【0004】
そのため、ある範囲のケン化度のポリビニルアルコール水溶液をポリスルホン系分離膜と接触させて、ポリスルホンと酢酸ビニルの疎水性相互作用により、効率的に膜表面の被膜層を形成させる方法が開示されている(特許文献4)。しかしながら、本発明者らが検討した結果、ポリビニルアルコールを分離膜に被覆すると、分離膜の性能低下が著しいことがわかった。さらにポリビニルアルコールなどの水酸基は、血液と接触した際に、補体を活性化しやすいことも知られている。
【0005】
また、ある濃度のビニルピロリドン−スチレン共重合体をポリスルホンの製膜原液に添加することで、スチレンユニットを膜内部に、ビニルピロリドンユニットを表面側に存在させる方法が開示されている(特許文献5)。しかしながら、このような膜構造は、スチレンユニットとポリスルホンの相互作用によって誘起されるものであるため、ビニルピロリドン−スチレン量を多くすると、製膜原液から相分離により紡糸する際に、スチレンユニットとポリスルホンの相互作用により、相分離しにくくなり、高い膜性能を得ることは容易ではない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平2−18695号公報
【特許文献2】特公平8−9668号公報
【特許文献3】特開平6−238139号公報
【特許文献4】特開2006−198611号公報
【特許文献5】特再平9−13575号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、かかる従来技術の欠点を改良し、タンパク質や有機物の付着が少ない高性能なポリスルホン系分離膜モジュールを提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を達成するため鋭意検討を進めた結果、血液適合性に優れ、タンパク質や有機物の付着が少ないポリスルホン系分離膜およびポリスルホン系分離膜モジュールは、下記の1〜10の構成によって達成されることを見出した。
1.ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する前記疎水性ユニット量比が、膜内部に存在する前記疎水性ユニット量比よりも30%以上大きいことを特徴とするポリスルホン系分離膜。
2.前記のビニルピロリドンユニットと前記疎水性ユニットとが共重合体を構成していることを特徴とする前記1に記載のポリスルホン系分離膜。
3.前記の共重合体が、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有することを特徴とする前記2に記載のポリスルホン系分離膜。
4.前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットを有することを特徴とする前記1〜3のいずれかに記載のポリスルホン系分離膜。
5.前記共重合体中における前記疎水性ユニットの比率が10−80モル%であることを特徴とする前記2〜4のいずれかに記載のポリスルホン系分離膜。
6.血液浄化用分離膜であることを特徴とする前記1〜5のいずれかに記載のポリスルホン系分離膜。
7.前記1〜6のいずれかに記載のポリスルホン系分離膜が内蔵されたことを特徴とするポリスルホン系分離膜モジュール。
8.ビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットとから構成される共重合体溶液をポリスルホン系分離膜と接触させた状態で放射線照射および/または熱処理することを特徴とするポリスルホン系分離膜モジュールの製造方法。
9.前記のビニルピロリドンユニットと前記疎水性ユニットの共重合体溶液をポリスルホン系分離膜と接触させる際に、分離膜の内外で圧力差を設けることを特徴とする前記8に記載のポリスルホン系分離膜モジュールの製造方法。
10.前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットであることを特徴とする前記8または9に記載のポリスルホン系分離膜モジュールの製造方法。
【発明の効果】
【0009】
本発明に係るポリスルホン系分離膜およびポリスルホン系分離膜モジュールにおいては、表面に存在することを特徴とする分離膜モジュールであり、血液適合性やタンパク質・有機物の付着しにくい性質が要求される用途に幅広く用いることができる。
【図面の簡単な説明】
【0010】
【図1】本発明に用いられる人工腎臓の一態様を示す。
【図2】実施例1〜10、比較例1〜7で実施したβ2−ミクログロブリン クリアランス測定における回路を示す。
【発明を実施するための形態】
【0011】
本発明は、ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する疎水性ユニット量比が、膜内部に存在する疎水性ユニット量比よりも大きいことを特徴とする分離膜モジュールである。ここで、ユニット量比とは、膜中の任意の箇所におけるポリスルホンユニットの存在量に対するビニルピロリドンユニットまたはポリスルホン系以外の疎水性ユニットの存在量の比を示すものであり、測定方法については後述の通りである。なお、以降、単に疎水性ユニットと記載している場合は、ポリスルホン系ユニット以外の疎水性ユニットを指す。
【0012】
タンパク質は疎水性表面に付着しやすいため、分離膜表面全体が親水性であることが重要と考えられている。しかしながら、一方で、ポリビニルピロリドンやポリエチレングリコールのような親水性高分子で材料表面を被覆しても、タンパク質などの付着は一時的にしか抑制できないとも言われている。本発明においては、ビニルピロリドンユニットと疎水性ユニットの両方が分離膜表面に存在することで、タンパク質や血小板の付着を効果的に抑制できる。この理由は定かではないが、表面の親水性と疎水性とがバランスよく存在することが、タンパク質や血小板の付着抑制のために重要なのではないかと考えられる。特に、水酸基を有する化合物を用いると、親水性が強すぎて、上記バランスを保つことができない。しかしながら、ビニルピロリドン基は、水酸基ほど親水性が強すぎず、疎水性のバランスが取れやすいのではないかと考えられる。
【0013】
したがって、疎水性ユニットの種類や表面のビニルピロリドン基と疎水性ユニットの比率が重要となる。表面の疎水性が強くなりすぎると、タンパク質や、血小板の付着を惹起する。表面の疎水性ユニット量は、0.1重量%〜40重量%程度、好ましくは1重量%〜20重量%である。また、表面のビニルピロリドンユニットの量としては、10重量%以上が好ましく、より好ましくは15重量%以上である。また、多すぎても親水性の効果が強くなりすぎるため、50重量%以下が好ましく、より好ましくは40重量%以下である。なお、表面のビニルピロリドンユニットの量としては、分離膜にポリビニルピロリドンが含まれる場合は、ビニルピロリドンユニットと疎水性ユニットの共重合ポリマー由来と、ポリビニルピロリドン由来との合計の値になる。表面のビニルピロリドンユニットの量は、ESCAなどにより求めることができる。
【0014】
表面におけるビニルピロリドンユニットおよび疎水性ユニットは、共重合体を形成していることが好ましい。各々のホモポリマーを添加するよりも、これらユニットが共重合体であることにより、付着抑制効果が高くなる。この理由は、不明な点も多いが、ビニルピロリドンと疎水性ユニットの表面の分布や1分子内で親水性と疎水性が適度にバランスが良くなっていることなどに起因するのではないかと考えられる。
【0015】
また、ここでいう表面は、分離機能層を有する表面をいう。例えば、人工腎臓用中空糸膜の場合は、中空糸膜の内表面を指す。また、本発明で表面と言った場合、表面からの深さが100nmまでの領域をベースとして、50nm、10nmの領域でも良い。膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも大きいかどうかは、例えば、X線光電子分光法(ESCA)と全反射赤外分光法(ATR)を組み合わせることによって知ることができる。これは、ESCAは、表面の数nm〜数10nmの深さの組成を測定するものであり、全反射赤外分光法(ATR)は、数μmまでの深さの組成を測定するものであることによる。したがって、ESCAで得られた疎水性ユニット量比の値が、ATRで得られた値よりも30%以上大きければ、本発明でいう膜表面に存在する前記疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも30%以上大きいとすることができる。なお、各測定の値は3点の平均値とする。なお、ESCAやATRで検出できない疎水性の官能基の場合は、分析電子顕微鏡やイオンエッチングと飛行時間型2次イオン質量分析法などを組み合わせたデプスプロファイルを取得することによって知ることもできる。
【0016】
また、本発明者らが検討した結果、分離膜内部の疎水性ユニット量比が多くなると、分離膜性能が低くなることもわかった。これは、膜の表面では、ある程度の疎水性があれば、タンパク質などの付着を抑制するが、膜全体としての疎水性が増加すれば、水や、水溶性物質の透過が起こりにくいためではないかと考えられる。すなわち、分離膜性能を考えた場合、分離膜全体としては、親水性のほうが好ましいものと考えられる。
【0017】
以上のことから、膜表面に存在する疎水性ユニット量比が、膜内部の疎水性ユニット量比よりも30%以上大きいことが必要であるが、100%以上が好ましく、さらには300%以上が好ましい。ここで、膜表面に存在する疎水性ユニット量比(S)が、膜内部の疎水性ユニット量比(I)の何%大きいかは、下記式によって算出する。
((S−I)/I)×100 (%)
本発明でいうところの疎水性ユニットとしては、その疎水性ユニットからなるホモポリマーが、水に不溶もしくは難溶であるものを言う。ここで水に不溶もしくは難溶とは、20℃における純水100mlへの溶解度が1g以下、好ましくは0.1g以下のものを言う。具体的には、メチルメタクリレート、エチルメタクリレート、n−プロピルメタクリレート、n−ブチルメタクリレート、ベンジルメタクリレート等のメタクリル酸エステル及びアクリル酸エステルやスチレン、メチルスチレン、エチルスチレン等のスチレン系モノマー、酢酸ビニル等のカルボン酸ビニルエステル、脂肪族炭化水素、アクリロニトリル等のモノマーの重合体または共重合体からなるセグメントを挙げることができるが、特に酢酸ビニルや、ビニルカプロラクタム、脂肪族炭化水素、特に炭素数が2〜18の直鎖飽和炭化水素基がタンパク質や血小板の付着抑制機能が高いため、好適に用いられる。ここで、疎水性ユニットがスチレンやナフタレンのような芳香族系の官能基を有する場合には、疎水性の度合いが大きくなり過ぎるためか、タンパク質などの付着抑制効果は低い場合がある。
【0018】
また、共重合体中における疎水性ユニットの好ましい比率としては、疎水性ユニットによって異なるが、一般的には10モル%〜80モル%である。特に疎水性ユニットが酢酸ビニルからなる場合は、25〜75モル%が好適に用いられ、より好ましくは35〜65モル%である。ただし、酢酸ビニルが60モル%以上になると水に溶けにくくなるため、取り扱い性を考慮すると、35〜50モル%が好ましい。ビニルカプロラクタムからなる場合は、25〜75モル%が好適に用いられ、より好ましくは45〜55モル%である。炭素数が4の直鎖飽和炭化水素の場合は、1〜50モル%が好適に用いられ、より好ましくは5〜20モル%である。
【0019】
共重合体としては、グラフト共重合体よりもブロック共重合体や交互共重合体、ランダム共重合体が、タンパク質や血小板の付着抑制機能が高いため、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有する共重合体が好適に用いられる。これは、グラフト重合体では、主鎖にグラフトしたユニット部分がタンパク質などと接触する機会が多いため、共重合体としての特性よりも、グラフト鎖部分の特性が大きく影響するためと考えられる。また、ブロック共重合体よりも交互共重合体、ランダム共重合体がより好ましい。ブロック共重合体では、それぞれのユニットの特性(親水性部分と疎水性部分)がはっきりと分かれるためではないかと考えられる。1分子のなかでの親水性と疎水性の適度なバランスという点では、ランダム共重合体および交互共重合体から選ばれる少なくとも一つを有する共重合体が最も好適に用いられる。
【0020】
また、膜表面に存在する疎水性ユニット量比を、膜内部の疎水性ユニット量比よりも大きくするには、分離膜の製膜原液に疎水性ユニットを含んだポリマーを混和しておいて成形する方法や、分離膜成形後に疎水性ユニットを含んだポリマーを接触させる方法、例えばコーティングする方法が挙げられる。また、分離膜が中空糸膜の場合には、二重環状口金から吐出する際に内側に注入液を流すが、この注入液に疎水性ユニットを含んだポリマーを添加しても良い。中空糸膜が相分離し、膜構造が決定する前に、注入液中の疎水性ユニットを含んだポリマーが、製膜原液側に拡散するため、膜内表面に局在化させることができる。このとき、に疎水性ユニットを含んだポリマーが膜内に拡散しやいようにポリスルホン系ポリマーの重量平均分子量は小さいほうが好ましく、10万以下、さらには5万以下のものが好適に用いられる。さらに上記接触操作の後、放射線照射、熱処理またはこれら両方の処理などにより不溶化する方法、分離膜にビニルピロリドンモノマーと疎水性モノマーの混合溶液に浸漬し、重合反応を分離膜表面上で起こさせる方法などが挙げられる。これらの場合においても、タンパク質等の付着抑制効果およびハンドリング性等から、疎水性ユニットを含んだポリマーとしては、ビニルピロリドンユニットと疎水性ユニットとから構成される共重合体が好適に用いられる。
【0021】
製膜原液から湿式製膜する場合、表面にはエントロピーロスを防ぐために高分子量のポリマーが集まり、エンタルピーロスを防ぐために、親水性ポリマーが集まる傾向にある。従って、例えば、ポリスルホン膜の場合、ポリスルホンとポリビニルピロリドンおよび、疎水性ユニットを含んだポリマーの3成分ポリマーからなる原液を作成し、疎水性ユニットを含んだポリマーの分子量を、ポリビニルピロリドンの分子量よりも大きくすることで、表面に濃縮させることができる。しかしながら、疎水性ユニットを含んだポリマーのポリスルホンとの親和性が高ければ、エントロピー効果よりもエンタルピーの効果が優勢になり、疎水性ユニットは表面ではなく、分離膜内部に濃縮されることになる。一般的には、疎水性ユニットのホモポリマーよりも、ビニルピロリドンユニットとの共重合体のほうが、ポリスルホンとの親和性が弱いために好適に用いられる。特に芳香族系の疎水性ユニットは、ポリスルホンとの親和が高いことが多いので、それ以外の疎水性ユニットが好適に用いられる。
【0022】
分離膜内部の疎水性ユニット量比が多くなると、分離膜性能を高くすることは難しいため、できるだけ少量であることが好ましい。具体的には、疎水性ユニットを含んだポリマーは、分離膜の構成成分100重量部に対して、1重量部未満、好ましくは0.5重量部未満、さらには0.02重量部未満である。
【0023】
分離膜成形後に疎水性ユニットを含んだポリマーをコーティングする方法は、簡便に分離膜表面に疎水性ユニットを存在させることができるために、好適に用いられる。コーティング後、放射線照射、熱処理などにより不溶化しても良い。また、分離膜をビニルピロリドンモノマーと疎水性モノマーの混合溶液に浸漬させ、重合反応を分離膜表面上で起こさせても良い。
【0024】
これらのなかでも、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を、分離膜と接触させることで分離膜表面をコーティングする方法は、簡便でかつ少量で実施できるため好適な方法である。例えば、ビニルピロリドンユニットと疎水性ユニットの共重合体を水に溶解させてから接触させ、共重合体を分離膜に吸着させても良いし、接着剤のようなもので、分離膜素材にビニルピロリドンユニットと疎水性ユニットの共重合体を固定化させても良い。また、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を分離膜表面に接触させる際に、中空糸膜内部に入り込んだ共重合体を内表面により集積させるために、分離膜の内外で圧力差を設け、その圧力差を利用して膜表面に濃縮する方法は効率的であり、好適に用いられる。圧力差としては、加圧であっても減圧であっても良い。なお、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液そのもので圧力差をかけて膜表面に導入しなくとも、溶液を接触後、気体や、水など他の溶液で加圧しても良い。分離膜の内外における圧力差としては、好ましくは5kPa以上、より好ましくは10kPa以上、さらに好ましくは20kPa以上である。また、圧力差が高い場合には、分離膜がリークしてしまう場合があるので、100kPa以下が好ましく、より好ましくは70kPa以下、さらに好ましくは50kPa以下である。なお、ここで言うところの分離膜の内側とは、処理液と接する分離膜機能層の表面側、外側とはその反対側を言う。人工腎臓用中空糸膜を例に挙げると、被処理液である血液が流れる機能層の表面は内側に、透析液が流れるその反対表面は外側に相当する。
【0025】
また、分離膜は、ビニルピロリドンユニットと疎水性ユニットの共重合体以外に、20℃の水100gに対する溶解度が1g以上、好ましくは10g以上である水溶性ポリマーを含有していることが、タンパク質や血小板の付着抑制の観点から好ましい。具体的には、ポリビニルピロリドンや、ポリエチレングリコールなどが好適に用いられる。これは、表面の適度な親水性と疎水性のバランスが、タンパク質や血小板の付着抑制のために重要なためではないかと考えられている。分離膜に含有される水溶性ポリマー量としては、0.1重量%以上が好ましく、より好ましくは1重量%以上である。また、含有量が多すぎると膜性能が低くなる傾向にあるため30重量%以下が好ましく、より好ましくは10重量%以下である。また、機能層表面の水溶性ポリマー量としては、10重量%以上が好ましく、より好ましくは15重量%以上である。また、多すぎても親水性の効果が強くなりすぎるため、50重量%以下が好ましく、より好ましくは40重量%以下である。機能層表面の水溶性ポリマー量は、ESCAなどによって求めることができる。
【0026】
さらに、コーティング後、放射線照射、熱処理などにより不溶化する方法は、共重合体の溶出を低減できるため好適な方法である。例えば、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体溶液に浸漬した状態で放射線照射や熱処理を行えば良い。あるいは、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体溶液に浸漬させた後、溶液を抜き出した後、放射線照射や熱処理をしても良い。放射線照射する場合には、若干量の溶媒が存在すると、ビニルピロリドンユニットと疎水性ユニットの共重合体が分離膜に固定、不溶化されやすい。これは、溶媒が放射線照射によりラジカルとなり、これが起点となって、該共重合体や分離膜の素材もラジカル化し、共重合体が膜へ架橋、不溶化することによる。したがって、分離膜の乾燥重量に対して、0.2重量倍以上、さらには1.0重量倍の溶媒が残存していることが好ましい。なお、溶媒としては、取り扱い性の観点から水が好適に用いられる。一方で、分離膜モジュール内に水が充填されていない状態であると、放射線照射までの時間にコーティングした共重合体が溶出する懸念が少ないという観点から、分離膜のみ湿潤状態であることは好ましい。具体的には、分離膜の乾燥重量に対して、6.0重量倍以下、さらには4.0重量倍以下が好ましい。また、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合溶液に浸漬し、分離膜をコーティングした後、水などに置換してから放射線照射や熱処理を行っても良い。さらには、置換した水などを抜き出した後、放射線照射や熱処理をしても良い。
【0027】
なお、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液を用いる場合において、共重合体溶液濃度が低いと、分離膜を充分にコーティングできない。また、濃度が高すぎると、溶出物が増える場合が多い。具体的な濃度は、共重合体の種類によってことなるが、一般的には、0.0001重量%以上、1重量%以下が好ましく、さらには、0.001重量%以上、0.1重量%以下が好ましい。
【0028】
分離膜を形成するポリマーをその良溶媒で溶解した際に、溶液には不溶性成分が含まれるが、かかる不溶性成分の含水率が95%以上、好ましくは97%以上である場合には、分離膜からのポリマーの溶出を抑えつつ、タンパク質の付着をより効果的に抑制することができる。タンパク質の付着を抑制するためには、ある程度の親水性が必要である。しかしながら、分離膜中にポリビニルピロリドンのような水溶性ポリマーを有しつつ、不溶性成分が含まれない場合には、タンパク質の種類によっては、付着の抑制効果が高くない場合がある。これは、膜表面に存在するポリビニルピロリドンの散漫層にタンパク質が潜りこんでトラップされるためと考えられる。上記散漫層がある程度の架橋状態であれば、タンパク質の潜りこみを抑制できるとためと推測できる。
【0029】
不溶性成分の含水率については、次のように求められる。乾燥した分離膜を、良溶媒で2重量%の濃度に溶解する。該溶液を濾紙を用いて濾過し、不溶性成分を得る。良溶媒で可溶性成分を十分に洗浄後、良溶媒を水で置換する。余分な水を取り除き、含水状態の不溶性成分重量(w)を測定後、十分に乾燥させた後の不溶性成分重量(d)を測定する。含水率は下式により算出できる。
含水率(%)=(w−d)×100/w
なお、例えば、ポリスルホン系ポリマーとポリビニルピロリドン、ビニルピロリドン/酢酸ビニル(6/4)からなる分離膜の場合は、ジメチルアセトアミドが良溶媒になる。
【0030】
不溶性成分を形成させるには、分離膜に放射線や熱処理を行うことによって、分子間や分子内で架橋反応を起こさせることが好適である。また、放射線照射線量や加熱温度、時間をコントロールすることで含水率を95%以上とすることができる。ポリマーによって異なるが、一般的に、放射線量としては5〜50kGyが、加熱条件としては120〜300℃が好適である。また、放射線を照射する際に抗酸化剤を用いることで、架橋反応を制御することも可能である。抗酸化剤の詳細については、後述する。
【0031】
中空糸膜内のポリマーの分散状態も、架橋反応に影響を及ぼす。すなわち、架橋性のポリマーが中空糸膜内で微分散していることが好ましい。中空糸膜内のポリマーの分散状態に影響を与える因子としては、製膜原液の組成比、撹拌速度、撹拌時間、溶解後の製膜までの時間、ビニルピロリドンユニットと疎水性ユニットの共重合体を注入液に添加する場合には、注入液組成、注入液温度、ビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングする際には、コーティング方法などが挙げられる。
【0032】
例えば、ポリスルホンとポリビニルピロリドンからなる中空糸膜に、ビニルピロリドン/酢酸ビニル(6/4)共重合体をコーティングする場合、製膜原液におけるポリビニルピロリドンの比は全ポリマー重量に対して、15〜35重量%が好ましい。ポリビニルピロリドンが少ないと、親水性の割合が少なくなるために、架橋反応後も含水率が低くなる。また、多すぎてもポリビニルピロリドンが微分散できなくなるために架橋反応が進行し、含水率が低下する。また、撹拌速度としては30rpm以上、好ましくは50rpm以上であった場合には、ポリビニルピロリドンの分散状態を高めることができるので好適である。さらに、溶解後、時間が経つと製膜原液内でミクロ相分離が生じ始めるために、ポリビニルピロリドンが微分散されなくなるため、溶解後1週間以内に紡糸することが好ましい。また、該共重合体をコーティングする際には、分離膜の内外で圧力差を生じさせることが効果的である。
【0033】
また、浸漬させたビニルピロリドンユニットと疎水性ユニットの共重合体溶液や水などを除去する方法としては、減圧乾燥、高温乾燥、低温送風乾燥、ブロー乾燥など、種々の方法を用いることができる。なお、放射線を照射する際に、酸素が存在すると、酸素ラジカルなどが発生し、分離膜素材の高分子材料が分解してしまうことが知られている。従って、放射線照射する際の分離膜周囲の酸素濃度は10%以下であることが望ましい。分離膜モジュールに放射線照射する場合は、例えば、モジュール内を窒素ガスでパージした後、密閉することで、酸素濃度を低下させ、放射線照射すれば良い。
【0034】
また、分離膜をモジュールに内蔵する手順としては、分離膜をビニルピロリドンユニットと疎水性ユニットの共重合体でコーティング等した後にモジュールに組み込んでも良く、分離膜を内蔵した分離膜モジュール内を該共重合体溶液で充填することで、コーティング等しても良い。コーティング等の後、上述したように放射線照射や熱処理を行っても良い。
【0035】
なお、ビニルピロリドンユニットと疎水性ユニットの共重合体を用いてコーティングした分離膜は、高い分離性能を発揮することができる。例えば、ビニルピロリドンユニットをビニルアルコールに置き換えて、疎水性ユニットとして酢酸ビニルを用いた共重合体の場合、コーティングによる分離性能の低下が著しい。これは、ビニルアルコールの水酸基と水分子や溶質分子が、水素結合などによって束縛され、膜を通過しにくいことなどが考えられるが、詳細な理由は不明である。
【0036】
本発明でいうところの放射線はα線、β線、γ線、X線、紫外線、電子線などが用いられる。また、人工腎臓などの血液浄化用モジュールは滅菌することが必要であり、近年は残留毒性の少なさや簡便さの点から、γ線や電子線を用いた放射線滅菌法が多用されている。すなわち、分離膜にビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングさせた場合、滅菌と同時に該共重合体の不溶化も同時に達成できる。
【0037】
基材の滅菌と改質を同時に行う場合は、15kGy以上の照射線量が好ましい。血液浄化用モジュール等をγ線で滅菌するには15kGy以上が効果的なためである。しかしながら、照射線量が100kGy以上であると、ビニルピロリドンユニットと疎水性ユニットの共重合体の3次元架橋や崩壊などが起きるため、血液適合性が低下する。
【0038】
また、分離膜にビニルピロリドンユニットと疎水性ユニットの共重合体をコーティングさせ、放射線により該共重合体の不溶化する工程において、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液中に該共重合体以外の成分、例えば、抗酸化剤が入っていても良い。さらには、ビニルピロリドンユニットと疎水性ユニットの共重合体溶液で、分離膜をコーティングした後、抗酸化剤溶液と接触させても良い。
【0039】
抗酸化剤を入れることで、発生するラジカル量を調整することができる。例えば、血液浄化用モジュールで、不溶化と滅菌を兼ねるための放射線照射を行う際に、両者のいずれかに適した線量を設定する場合であって、分離膜などが劣化する場合、それを防止するために抗酸化剤を併用すれば良い。抗酸化剤とは、他の分子に電子を与えやすい性質を持つ分子のことを言う。例えば、ビタミンCなどの水溶性ビタミン類、ポリフェノール類、メタノール、エタノール、プロパノール、エチレングリコール、プロピレングリコール、グリセリンなどのアルコール類、グルコース、ガラクトース、マンノース、トレハロースなどの糖類、ソジウムハイドロサルファイト、ピロ亜硫酸ナトリウム、二チオン酸ナトリウムなどの無機塩類、尿酸、システイン、グルタチオンなどが挙げられるが、これらに限定されるものではない。これらの抗酸化剤は単独で用いてもよいし、2種類以上混合して用いてもよい。本発明の方法を医療用具に用いる際は、その安全性を考慮する必要があるため、抗酸化剤としては毒性の低いものが好適に用いられる。
【0040】
抗酸化剤を含有する溶液の濃度については、含有する抗酸化剤の種類、放射線の照射線量などにより異なる。抗酸化剤の濃度が低すぎると、溶媒から発生するラジカルの消去が十分にできないため、分離膜などの劣化を防ぐことができない。また、抗酸化剤を多量に入れると、ラジカルが十分に消去されてしまうために、共重合体の分離膜への固定化量が落ちるために、溶出物の増加やタンパク質や血小板などの付着抑制効果も十分に得られない。以上のことから、抗酸化剤として好適に用いられる物質は、エタノール、n−プロパノール、2−プロパノール、エチレングリコール、プロピレングリコール、グリセリンであり、その濃度範囲は、0.01重量%以上、90重量%以下が好適に用いられる。特にエタノール、n−プロパノール、2−プロパノールの場合は、0.01重量%以上、10重量%以下が好適に用いられ、さらに好ましくは0.05重量%以上、1重量%以下である。プロピレングリコール、グリセリンの場合は、0.1重量%以上、90重量%以下、さらに好ましくは、0.5重量%以上、70重量%以下である。
【0041】
本発明でいうところの分離膜とは血液や水溶液などの処理する液体に含まれる特定の物質を、吸着もしくは濾過、拡散により、選択的に除去する膜のことである。
【0042】
本発明の分離膜は、高い付着抑制機能を有するので、水処理用分離膜や生体成分分離膜として好適に用いることができる。特に、人工腎臓などの血液浄化用モジュールに適する。ここで、血液浄化用モジュールとは、血液を体外に循環させて、血中の老廃物や有害物質を取り除く機能を有したモジュールのことをいい、人工腎臓や外毒素吸着カラムなどがある。また、人工腎臓用モジュールとしては、コイル型、平板型、中空糸膜型があるが、処理効率などの点から、中空糸膜型が好ましい。
【0043】
本発明の分離膜となる素材は、特に限定しないが、医療用に用いられている素材が好ましく、例えば、ポリ塩化ビニル、セルロース系ポリマー、ポリプロピレン、ポリアクリルニトリル、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート、ポリスルホンやポリエーテルスルホンなどのポリスルホン系ポリマー、ポリウレタンなどが挙げられる。この中でも特にポリスルホン系ポリマーは成形が容易で、膜にしたときの物質透過性能に優れているため、好適に用いられる。
【0044】
本発明で用いられるポリスルホン系ポリマーは、主鎖に芳香環、スルフォニル基およびエーテル基をもつもので、例えば、次式(1)、(2)の化学式で示されるポリスルホンが好適に使用されるが、本発明ではこれらに限定されない。式中のnは、例えば50〜80の如き整数である。
【0045】
【化1】

【0046】
ポリスルホンの具体例としては、ユーデルポリスルホンP−1700、P−3500(ソルベイ社製)、ウルトラソンS3010、S6010(BASF社製)、ビクトレックス(住友化学)、レーデルA(ソルベイ社製)、ウルトラソンE(BASF社製)等のポリスルホンが挙げられる。又、本発明で用いられるポリスルホンは上記式(1)及び/又は(2)で表される繰り返し単位のみからなるポリマーが好適ではあるが、本発明の効果を妨げない範囲で他のモノマーと共重合していても良い。特に限定するものではないが、他の共重合モノマーは10重量%以下であることが好ましい。
【0047】
分離膜モジュールの製造としては、その用途により、種々の方法があるが、大まかな工程としては、分離膜の製造工程と、その分離膜をモジュールに組み込むという工程にわけることができる。
【0048】
血液浄化用モジュールとして、人工腎臓の製造方法についての一例を示す。まず、分離膜である中空糸膜の製造方法としては、ポリスルホンとポリビニルピロリドン(重量比率20:1〜1:5が好ましく、5:1〜1:1がより好ましい)をポリスルホンの良溶媒(N,N−ジメチルアセトアミド、ジメチルスルホキシド、ジメチルホルムアミド、N−メチルピロリドン、ジオキサンなどが好ましい)および貧溶媒の混合溶液に溶解させた原液(濃度は、10〜30重量%が好ましく、15〜25重量%がより好ましい)を二重環状口金から吐出する際に内側に注入液を流し、乾式部を走行させた後凝固浴へ導く。この際、乾式部の湿度が影響を与えるために、乾式部走行中に膜外表面からの水分補給によって、外表面近傍での相分離挙動を速め、孔径拡大し、結果として透析の際の透過・拡散抵抗を減らすことも可能である。ただし、相対湿度が高すぎると外表面での原液凝固が支配的になり、かえって孔径が小さくなり、結果として透析の際の透過・拡散抵抗を増大する傾向がある。そのため、相対湿度としては60〜90%が好適である。また、注入液組成としてはプロセス適性から原液に用いた溶媒を基本とする組成からなるものを用いることが好ましい。注入液濃度としては、例えばジメチルアセトアミドを用いたときは、45〜80重量%、さらには60〜75重量%の水溶液が好適に用いられる。
【0049】
中空糸膜をモジュールに内蔵する方法としては、特に限定されないが、一例を示すと次の通りである。まず、中空糸膜を必要な長さに切断し、必要本数を束ねた後、筒状ケースに入れる。その後両端に仮のキャップをし、中空糸膜両端部にポッティング剤を入れる。このとき遠心機でモジュールを回転させながらポッティング剤を入れる方法は、ポッティング剤が均一に充填されるために好ましい方法である。ポッティング剤が固化した後、中空糸膜の両端が開口するように両端部を切断し、中空糸膜モジュールを得る。
【0050】
以下実施例を挙げて本発明を説明するが、本発明はこれらの例によって限定されるものではない。
【実施例】
【0051】
以下実施例と比較例を挙げて本発明を説明するが、本発明はこれらの例によって限定されるものではない。
1.中空糸膜モジュールの作製
(1)ポリスルホン/ポリビニルピロリドン(PSf/PVP)混合中空糸膜
ポリスルホン(アモコ社 Udel−P3500)16重量部、ポリビニルピロリドン(インターナショナルスペシャルプロダクツ社;以下ISP社と略す)K30 3重量部、ポリビニルピロリドン(ISP社K90)3重量部をジメチルアセトアミド77重量部、水1重量部と加熱溶解し、製膜原液とした。
【0052】
この原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から芯液としてジメチルアセトアミド63重量部、水37重量部からなる溶液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、350mmのドライゾーン雰囲気を経て、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60〜75℃90秒の水洗工程、130℃の乾燥工程を2分通過させ、160℃のクリンプ工程を経て得られた中空糸膜を巻き取り束とした。この中空糸膜の総膜面積を1.6m2になるようにケースに充填し、かつ中空糸膜の両端をポッティング材によりケース端部に固定し、ポッティング材の端部の一部をカッティングすることで両端の中空糸膜を開口させて、人工腎臓モジュールとした。
【0053】
(2)ポリスルホン(PSf)中空糸膜
ポリスルホン(アモコ社 Udel−P3500)18重量部をジメチルアセトアミド81部、水1部と加熱溶解し、製膜原液とした。
【0054】
この原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から注入液としてジメチルアセトアミド63部、水37部からなる溶液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、乾式長350mmのドライゾーン雰囲気を通過した後、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60℃/90秒の水洗工程を通過させ、中空糸膜(中空糸膜2)を巻き取り束とした。
【0055】
(3)注入液へのポリマー添加検討
ポリスルホン(アモコ社 Udel−P3500(重量平均分子量4.7万))18重量部、ポリビニルピロリドン(インターナショナルスペシャルプロダクツ社;以下ISP社と略す)K30 9重量部をジメチルアセトアミド72重量部、水1重量部と加熱溶解し、製膜原液とした。
【0056】
ジメチルアセトアミド63重量部、水37重量部の溶液にビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)10重量部を溶解させて注入液とした。
【0057】
製膜原液を温度50℃の紡糸口金部へ送り、環状スリット部の外径0.35mm、内径0.25mmの2重スリット管から注入液を吐出させ、中空糸膜を形成させた後、温度30℃、露点28℃の、350mmのドライゾーン雰囲気を経て、ジメチルアセトアミド20重量%、水80重量%からなる温度40℃の凝固浴を通過させ、60〜75℃・90秒の水洗工程、130℃の乾燥工程を2分通過させ、160℃のクリンプ工程を経て得られた中空糸膜(中空糸膜3)を巻き取り束とした。
【0058】
また、注入液にコリドンVA64を添加しない組成の溶液を用いて、上記と同様にして中空糸膜(中空糸膜4)を作成した。
2.測定方法
(1)中空糸膜のヒト血小板付着試験方法
18mmφのポリスチレン製の円形板に両面テープを貼り付け、そこに中空糸膜を固定した。貼り付けた中空糸膜を片刃で半円筒状にそぎ切り、中空糸膜の内表面を露出させた。中空糸内表面に汚れや傷、折り目などがあると、その部分に血小板が付着し、正しい評価ができないことがあるので注意を要する。筒状に切ったFalcon(登録商標)チューブ(18mmφ、No.2051)に該円形板を、中空糸膜を貼り付けた面が、円筒内部にくるように取り付け、パラフィルムで隙間を埋めた。この円筒管内を生理食塩水で洗浄後、生理食塩水で満たした。人間の静脈血を採血後、直ちにヘパリンを50U/mlになるように添加した。前記円筒管内の生理食塩水を廃棄後、前記血液を、採血後10分以内に、円筒管内に1.0ml入れて37℃にて1時間振盪させた。その後、中空糸膜を10mlの生理食塩水で洗浄し、2.5%グルタルアルデヒド生理食塩水で血液成分の固定を行い、20mlの蒸留水にて洗浄した。洗浄した中空糸膜を常温0.5Torrにて10時間減圧乾燥した。この中空糸膜を走査型電子顕微鏡の試料台に両面テープで貼り付けた。その後、スパッタリングにより、Pt−Pdの薄膜を中空糸膜表面に形成させて、試料とした。この中空糸膜の内表面をフィールドエミッション型走査型電子顕微鏡(日立社製S800)にて、倍率1500倍で試料の内表面を観察し、1視野中(4.3×103μm2)の付着血小板数を数えた。中空糸長手方向における中央付近で、異なる10視野での付着血小板数の平均値を血小板付着数(個/4.3×103μm2)とした。中空糸の長手方向における端の部分は、血液溜まりができやすいため付着数の計測対象からはずした。
【0059】
(2)フィブリノーゲンの相対付着率測定
中空糸膜へのタンパク質の付着として、凝固系タンパク質の1つである、フィブリノーゲンの相対吸着率を測定した。
【0060】
プラスチック管に中空糸膜を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。
【0061】
次に、人間の静脈血を採血後、直ちにクエン酸を10容量%になるように添加した。該血液を4℃にて3000rpm、15分間遠心し、血漿を得た。
【0062】
血漿1mLを流速0.5mL/minで2時間循環させた。ミニモジュールから中空糸を24cm相当切り出し、約1mm長に細切しエッペンチューブに入れた。リン酸緩衝液(以下、PBSと略記)にて洗浄した(1mL×3回、血液が残っている場合には繰り返した)。トゥイーン−20(片山化学)をPBSで0.05重量%になるように調整した(以下、PBS−Tと略記)。スキムミルクを0.1重量%になるように、PBS−Tに溶解させ、該溶液で3回洗浄した。抗ヒトフィブリノーゲン(HPR)抗体を0.1重量%のスキムミルク/PBS−T溶液で10000倍に希釈し、1mL添加した後、室温にて2時間ローテーターで回転、撹拌させた。0.1重量%のスキムミルク/PBS−T溶液で2回洗浄した後、0.1重量%のスキムミルク/PBS溶液で2回洗浄した。TMB one solutionを1mL添加し、ミクロミキサーで撹拌した。発色具合をみて6Nの塩酸を200μL添加し、反応停止した(後述のコントロールの吸光度が1〜1.5の範囲に入るように反応をコントロールする)。450nmの吸光度を測定した。コントロールとして東レ社製人工腎臓“トレスルホン”TS−1.6ULを用いた。コントロールの吸光度(Ac)と対象サンプルの吸光度(As)から、フィブリノーゲンの相対付着量を下記式により求めた。
フィブリノーゲンの相対付着率(%)=As/Ac×100。
(3)β2−ミクログロブリン(β2−MG) クリアランス測定
エチレンジアミン四酢酸二ナトリウムを添加した牛血液について、ヘマトクリットが30±3%、総タンパク量が6.5±0.5g/dLとなるように調整した。
【0063】
次に、β2−ミクログロブリン濃度が1mg/lになるように加え、撹拌した。かかる牛血液について、その2Lを循環用に、1.5Lをクリアランス測定用として分けた。
【0064】
回路を図2のようにセットした。透析装置としては、東レメディカル株式会社製 TR2000Sを用いた。TR2000Sは、図2のうち、Biポンプ、Fポンプ、および透析装置にあたる。
【0065】
透析装置に、透析液(キンダリー液AF2号 扶桑薬品工業株式会社製)A液およびB液をセットした。透析液側から血液側に向けてRO水を流した。透析液濃度13〜15mS/cm、温度34℃以上、透析液側流量を500ml/minに設定した。
【0066】
透水装置の除水速度を10ml/(min・m2)に設定した。Bi回路入口部を上記で調整した牛血液2L(37℃)の入った循環用ビーカーに入れ、Biポンプをスタートし、Bo回路出口部から排出される液体90秒間分を廃棄後、ただちにBo回路出口部および、Do回路出口部を循環用ビーカーに入れて循環状態とした。
【0067】
続いて透析装置のFポンプを動かし、循環を1時間行った後、BiポンプおよびFポンプを停止した。
【0068】
次に、Bi回路入口部を上記で調整したクリアランス測定用の牛血液に入れ、Bo回路出口部を廃棄用ビーカーに入れた。Do回路出口部から流出する液体は廃棄した。
【0069】
Diポンプをスタートした。また、血液ポンプをスタートするとともに、トラップとBiチャンバーの間を開放した。
【0070】
スタートから2分経過後、クリアランス測定用の牛血液(37℃)からサンプルを10ml採取し、Bi液とした。スタートから4分30秒経過後に、Bo回路出口部からサンプルを10ml採取し、Bo液とした。これらのサンプルは、−20℃以下の冷凍庫で保存した。
【0071】
各液のβ2−ミクログロブリンの濃度からクリアランスを下記式によって算出した。牛血液のロットによって測定値が異なる場合があるので、実施例に用いたデータは全て同一ロットの牛血液を使用した。
【0072】
Co(ml/min)=(CBi−CBo)×QB/CBi
上記の式において、CO=β2−ミクログロブリンクリアランス(ml/min)、CBi=Bi液におけるβ2−ミクログロブリン濃度、CBo=Bo液におけるβ2−ミクログロブリン濃度、QB=Biポンプ流量(ml/min)である。
(4)分離膜表面および内部の酢酸ビニルユニット量比の測定
分離膜表面および内部の酢酸ビニルユニット量比は、ポリスルホンに対する存在比で、比較した。表面の酢酸ビニルユニット量比の測定には、X線電子分光法を用いた。測定装置としてESCA LAB220iXLを用い、サンプルを装置にセットして、X線の入射角に対する検出器の角度は90度にて測定を行った。この角度においては、測定深さは約10nmである。
【0073】
中空糸膜を超純水で充分に洗浄した後、室温、0.5Torrにて10時間乾燥させた。その後、中空糸膜を片刃で半円筒状にそぎ切り、中空糸膜内表面の酢酸ビニルユニット量比を測定した。さらに、中空糸膜の内表面の一部分を片刃でそぎ取り、膜厚部分を露出させ、酢酸ビニルユニット量比を測定した。測定装置、条件は、以下の通り。
【0074】
測定装置: ESCALAB220iXL
励起X線: monochromatic Al Kα1,2 線(1486.6eV)
X線径: 0.15mm
光電子脱出角度: 90 °(試料表面に対する検出器の傾き)
表面の酢酸ビニルユニット量比は、C1sピークにエステル基(COO)のピークが現れることから、ピーク分割することで得られる。より具体的には、C1sには、主にCHx,C−C,C=C,C−S由来の成分、主にC−O,C−N由来の成分、π-π*サテライト由来の成分、C=O由来の成分、エステル基(COO)由来の成分の5つの成分から構成される。従って、5つ成分でピーク分割を行う。COO由来の成分は、C1sのCHやC−Cのメインピーク(285eV付近)から+4.0〜4.2eVに現れるピークである。この各成分のピーク面積比は、小数点第1桁目を四捨五入し、算出する。全元素(水素原子は検出できないので、水素原子以外の全元素)に対する該ピーク面積の割合を算出し、エステル基量(COOの炭素量)(原子数%)を求めた。ここで、ピーク分割の結果、0.4%以下であれば、検出限界以下とした。また、ポリスルホン量は、ポリスルホンの繰り返しユニット当たりに1個の硫黄原子が存在するので、硫黄量を求めることで得られる。したがって、表面酢酸ビニルユニット量比=エステル基量(原子数%)/硫黄量(原子数%)とした。
【0075】
なお、表面のビニルピロリドンユニット量は、窒素量(a(原子数%))と硫黄量(b(原子数%))を求め、下式よりを算出した。
表面ビニルピロリドン量(重量%)=(a×111/(a×111+b×442))×100
内部の酢酸ビニルユニット量比は、ATR測定を行うことによって求めた。測定条件は分解能4、積算回数64回とした。1730cm−1付近のエステル基由来のC=Oのピークの強度(ACO)と、1580cm−1付近のポリスルホンのベンゼン環由来のC=C吸収ピークの強度(ACC)を求めた。ATRは表面から約2〜3μmまでの測定深さである。
【0076】
各種濃度のポリスルホンとポリ酢酸ビニルをN,N−ジメチルアセトアミドに溶解させた。各種濃度の溶液を、ホットプレートで110℃に加熱したガラス板の上に滴下し、厚さ203μmとなるようキャストした。キャスト後、5分間ホットプレート上で放置し、溶媒を蒸発させた後、ガラス板ごと水浴へ浸漬し透明フィルムを得た(水浴に浸漬させるのは、フィルムをガラス板からはがしやすくさせるためである)。
このフィルムについてATR測定を行い、(ACO)と(ACC)の強度比と酢酸ビニルユニット量比の検量線を求めた。
【0077】
中空糸膜内表面についてATR測定を行い、(ACO)と(ACC)の強度比から、上記の検量線を用いて、内部の酢酸ビニルユニット量比とした。
【0078】
(5)不溶性成分の含水率測定
乾燥した中空糸膜を2g/vol%になるようにジメチルアセトアミドで5時間以上撹拌、溶解させた。濾紙(「アドバンテック」(登録商標)No.7 東洋濾紙社製)で不溶性成分を濾過させた後、ジメチルアセトアミドで可溶性成分を十分に洗浄した。遠沈管に不溶性成分(ゲル状物)を回収し、さらにジメチルアセトアミドで十分に撹拌後、遠心により該ゲルを沈降させ、上澄みを取り除くことを3回以上繰り返した。その後、上澄みを取り除いた後、純水を添加し、十分に撹拌後、遠心により該ゲルを沈降させ、上澄みを取り除くことを5回繰り返し、ジメチルアセトアミドを純水に置換した。余剰の水分を抜き取り、含水した重量(w)を測定した。得られた含水ゲルについて、凍結乾燥を24時間以上行い、完全に乾燥後、重量(d)を測定した。下記式により含水率を算出した。
含水率(%)=(w−d)×100/w。
【0079】
下記の実施例1〜9および比較例1〜5については、ポリスルホン/ポリビニルピロリドン(PSf/PVP)混合中空糸膜(中空糸膜1)を使用した。
(実施例1)
ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.1重量%水溶液を中空糸膜モジュールの血液側入口から血液側出口に500mL通液した。次に血液側入口から透析液側入口に500mL通液することで、中空糸膜の内表面に、VA64を集積させた。中空糸膜内部に入り込んだVA64を内表面に、より集積させるために、100kPaの圧縮空気で透析液側から血液側へ充填液を押しだした。この後、血液側の充填液をブローし、中空糸膜のみに水溶液が保持された状態にした。さらに窒素で透析液側、血液側それぞれをブローした後、該モジュールにγ線を照射した。該モジュールについて、血小板付着試験、β2−ミクログロブリン クリアランス測定、膜表面および内部の酢酸ビニルユニット量比の測定を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(実施例2)
“コリドンVA64“0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。比較例1と比べてβ2−ミクログロブリン除去性能が高い理由としては、VA64が機能層表面を覆い、細孔径が狭小化する効果よりも、タンパク質などの付着抑制効果が高いため、タンパク質による膜の目詰まりによる性能低下が少なかったためと考えられる。また、不溶性成分の含水率は95.2%であり、フィブリノーゲンの相対吸着率は65%であった。
(実施例3)
“コリドンVA64“0.001重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。実施例1、2と比べて血小板付着抑制性がやや低下した理由としては、実施例1、2と比べて機能層表面のVA64量が少ないためと考えられる。
(実施例4)
“コリドンVA64“0.001重量%とエタノール0.1重量%の混合水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。VA64と同一の処理濃度にも関わらず、実施例3と比べて血小板付着抑制性が高い理由としては、エタノールによるVA64へのγ線保護効果があったためと考えられる。また、不溶性成分の含水率は97.3%であり、フィブリノーゲンの相対吸着率は28%であった。実施例1と比較して、血小板付着数は同じでもフィブリノーゲンの付着は半分以下に抑えられた。
(実施例5)
“コリドンVA64“0.01重量%水溶液を実施例1と同様の操作に充填したのみで、圧縮空気によるブローは行わなかった。結果は表1の通りであった。すなわち、膜をVA64溶液に浸漬させた状態でγ線照射しても、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(実施例6)
ビニルピロリドン/酢酸ビニル(7/3)共重合体(BASF社製、“ルビスコールVA73“)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであり、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。すなわち、機能層表面にVA73を多く局在化させることができた。血小板付着は比較例1に比べて、抑制されているが、実施例1と比べて、やや多い値となった。これは、VA73には分子内の疎水性ユニットであるエステル基が少なく、親水性と疎水性のバランスがVA64よりも悪いため、付着抑制性に劣っていたと考えられる。
(実施例7)
ビニルピロリドン/酢酸ビニル(3/7)共重合体(BASF社製、“ルビスコールVA37“)0.1重量%のメタノール溶液を中空糸膜モジュールの血液側入口から血液側出口に通液し、次に血液側入口から透析液側出口に通液する順で充填した。さらに水を同様に通液した後、実施例1と同様に、ブロー、窒素置換し、γ線照射した。結果は表1の通りであり、水に難溶のビニルピロリドン/酢酸ビニル(3/7)共重合体をアルコール水溶液にて分離膜に導入し、水に置換後、γ線を照射しても、高い分離膜性能と血小板付着抑制性を両立できた。すなわち、機能層表面にVA37を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(参考例1)
ビニルピロリドン/ビニルカプロラクタム(5/5)共重合体(BASF社製、“ルビテック”VPC55K65W)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行い、内表面にVPC55K65Wを集積させた。結果は表1の通りであった。結果は表1の通りであった。すなわち、機能層表面にVPC55K65Wを多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(参考例2)
ビニルピロリドン/1−ブテン(90/10)共重合体(ISP社製、“ガネックス”P−904LC)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行い、内表面にP−904LCを集積させた。結果は表1の通りであった。結果は表1の通りであった。すなわち、機能層表面にガネックスP−904LCを多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。
(比較例1)
ビニルピロリドン/酢酸ビニル(6/4)共重合体の代わりに水を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。β2−ミクログロブリン除去性能は高かったが、血小板が多く付着する表面であった。また、不溶性成分の含水率は94.7%であり、フィブリノーゲンの相対吸着率は110%であった。
(比較例2)
ポリビニルピロリドン(BASF社製、K90)0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、親水性であるビニルピロリドンのホモポリマーを用いた場合であっても、血小板がよく付着する表面であった。
(比較例3)
ポリエチレングリコール(分子量5万)0.01重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。ポリエチレングリコールは水に良く溶ける親水性ポリマーであるが、血小板が多く付着する表面であった。
(比較例4)
“コリドンVA64“を、中空糸膜表面から内部まで充填することを目的とし、“コリドンVA64“0.1重量%水溶液を中空糸膜モジュールの血液側入口から血液側出口に通液し、次に透析液側入り口から透析液側出口に通液する順で充填した。水溶液を充填したまま、該モジュールにγ線を照射した。結果は表1の通りであった。すなわち、機能層表面および内部もVA64量が多すぎるために、血小板付着抑制性はあるが、β2−ミクログロブリン除去性能が顕著に低かった。
【0080】
(比較例5)
ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.0001重量%とエタノール0.1重量%の混合水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にVA64を局在化させることができないために、血小板付着抑制性がほとんど認められなかった。また、不溶性成分の含水率は97.1%であり、フィブリノーゲンの相対吸着率は105%であった。実施例4と比較して、不溶性成分の含水率は同じ程度であるが、中空糸膜内表面のエステル基量が少ないために、フィブリノーゲンの付着を抑制できなかったと考えられる。
(比較例6)
ポリビニルアルコール(PVA)(分子量1万、ケン化度80%)0.1重量%水溶液を用いた以外は、実施例1と同様の操作を行った。結果は表1の通りであった。すなわち、機能層表面にPVAを多く局在化することができているが、β2−ミクログロブリン除去性能は低い値であった。
【0081】
下記の実施例10および比較例7については、ポリスルホン(PSf)中空糸膜(中空糸膜2)を使用した。
【0082】
(実施例8)
プラスチック管にポリスルホン(PSf)中空糸膜(中空糸膜2)を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。次に、ビニルピロリドン/酢酸ビニル(6/4)共重合体(BASF社製、“コリドンVA64“)0.01重量%水溶液を中空糸膜の内側に3mL通液した後、中空糸膜の内側から外側に向けて3mL通液させた。その後、内側および外側の溶液をブローで抜き出した後、25kGyのγ線を照射した。γ線照射後、純水にて十分に洗浄した後、各種試験を行った。
【0083】
なお、中空糸膜の性能としては、以下の方法で、β2−ミクログロブリンのクリアランスを測定した。すなわち、濃度が5mg/Lになるように、β2−ミクログロブリンを37℃の牛血清に加えた。これを前記ミニモジュールの血液側に1mL/minで流し、透析液側に37℃の生理食塩液を20mL/minで流した。2時間循環させた後、血液側の牛血清と、透析液側の生理食塩液を全量回収してエスアールエル(株)に分析を依頼し、β2−ミクログロブリンの濃度を測定した。測定結果から有効膜面積1.8m2として換算したクリアランスを算出した。
【0084】
また、ミニモジュールでのβ2−ミクログロブリンのクリアランス測定は、実験毎の数値のばらつきがあるため、実験毎にコントロールを加えて、実験間の比較を行った。コントロールには、東レ社製人工腎臓“トレスルホン”TS−1.6ULの中空糸膜を用いた。コントロールに用いるTS−1.6ULは、製造ロットが同一のものを使用した。TS−1.6ULの測定結果と百分率で比較して、相対除去率(%)を求め、この数値をもって実験間の比較を行った。
【0085】
結果は表2の通りであった。すなわち、機能層表面にVA64を均一に多く局在化させることができ、血小板付着抑制性およびβ2−ミクログロブリン除去性能が高かった。また、実施例2に比べて、血小板付着の抑制効果がやや劣ったのは、ポリスルホンの単独組成の中空糸膜であり、水溶性ポリマーであるPVPが存在していないためと考えられる。
【0086】
(比較例7)
VA64の代わりに水を用いた以外は、実施例8と同様の操作を行った。結果は表2の通りであった。すなわち、血小板がよく付着する表面であった。
【0087】
下記の実施例9および比較例8については、注入液にビニルピロリドンユニットと疎水性ユニットの共重合体のそれぞれを添加した膜(中空糸膜3,4)を用いて比較を行った。
【0088】
(実施例9)
プラスチック管に中空糸膜3を36本通し、両端を接着剤で固定した有効長100mmのプラスチック管ミニモジュールを作製し、純水で十分に洗浄した。中空糸膜の内部および外側の水を圧空ブローにて抜き出した後、25kGyのγ線を照射した。γ線照射後、純水にて十分に洗浄した後、各種試験を行った。中空糸膜の性能としては、実施例8と同様にしてβ2−ミクログロブリンのクリアランスを測定した。結果は表3の通りであった。すなわち、血小板の付着が抑制され、β2−ミクログロブリン除去性能が高かった。比較例8と比べて、β2−ミクログロブリン除去性能が高い理由としては、VA64が機能層表面を覆い、タンパク質などの付着抑制効果が高いため、タンパク質による膜の目詰まりによる性能低下が少なかったためと考えられる。
【0089】
(比較例8)
プラスチック管に中空糸膜4を36本通し、実施例9と同様の操作を行い、得られた中空糸膜についても、同様の評価を行った。結果は表3の通りであった。すなわち、血小板が多く付着する表面であり、β2−ミクログロブリン除去性能も実施例9よりも低かった。
【0090】
【表1】

【0091】
【表2】

【0092】
【表3】

【符号の説明】
【0093】
1 中空糸膜
2 ケース
3 ポッティング剤
4 血液側入口(Bi)
5 血液側出口1(Do)
6 透析液側入口(Di)
7 透析液側出口(Do)
8 基準線
9 透析装置
10 中空糸膜モジュール
11 Biポンプ
12 Fポンプ
13 廃棄用容器
14 循環用血液
15 クリアランス測定用血液
16 Bi回路
17 Bo回路
18 Di回路
19 Do回路
20 温水槽
【特許請求の範囲】
【請求項1】
ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する前記疎水性ユニット量比が、膜内部に存在する前記疎水性ユニット量比よりも30%以上大きいことを特徴とするポリスルホン系分離膜。
【請求項2】
前記のビニルピロリドンユニットと前記疎水性ユニットとが共重合体を構成していることを特徴とする請求項1に記載のポリスルホン系分離膜。
【請求項3】
前記の共重合体が、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有することを特徴とする請求項2に記載のポリスルホン系分離膜。
【請求項4】
前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットを有することを特徴とする請求項1〜3のいずれかに記載のポリスルホン系分離膜。
【請求項5】
前記共重合体中における前記疎水性ユニットの比率が10−80モル%であることを特徴とする請求項2〜4のいずれかに記載のポリスルホン系分離膜。
【請求項6】
血液浄化用分離膜であることを特徴とする請求項1〜5のいずれかに記載のポリスルホン系分離膜。
【請求項7】
請求項1〜6のいずれかに記載のポリスルホン系分離膜が内蔵されたことを特徴とするポリスルホン系分離膜モジュール。
【請求項8】
ビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットとから構成される共重合体溶液をポリスルホン系分離膜と接触させた状態で放射線照射および/または熱処理することを特徴とするポリスルホン系分離膜モジュールの製造方法。
【請求項9】
前記のビニルピロリドンユニットと前記疎水性ユニットの共重合体溶液をポリスルホン系分離膜と接触させる際に、分離膜の内外で圧力差を設けることを特徴とする請求項8に記載のポリスルホン系分離膜モジュールの製造方法。
【請求項10】
前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットであることを特徴とする請求項8または9に記載のポリスルホン系分離膜モジュールの製造方法。
【請求項1】
ポリスルホン系分離膜表面にビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットを有し、膜表面に存在する前記疎水性ユニット量比が、膜内部に存在する前記疎水性ユニット量比よりも30%以上大きいことを特徴とするポリスルホン系分離膜。
【請求項2】
前記のビニルピロリドンユニットと前記疎水性ユニットとが共重合体を構成していることを特徴とする請求項1に記載のポリスルホン系分離膜。
【請求項3】
前記の共重合体が、ランダム共重合体、交互共重合体およびブロック共重合体から選ばれる少なくとも一つを有することを特徴とする請求項2に記載のポリスルホン系分離膜。
【請求項4】
前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットを有することを特徴とする請求項1〜3のいずれかに記載のポリスルホン系分離膜。
【請求項5】
前記共重合体中における前記疎水性ユニットの比率が10−80モル%であることを特徴とする請求項2〜4のいずれかに記載のポリスルホン系分離膜。
【請求項6】
血液浄化用分離膜であることを特徴とする請求項1〜5のいずれかに記載のポリスルホン系分離膜。
【請求項7】
請求項1〜6のいずれかに記載のポリスルホン系分離膜が内蔵されたことを特徴とするポリスルホン系分離膜モジュール。
【請求項8】
ビニルピロリドンユニットとポリスルホン系ユニット以外の疎水性ユニットとから構成される共重合体溶液をポリスルホン系分離膜と接触させた状態で放射線照射および/または熱処理することを特徴とするポリスルホン系分離膜モジュールの製造方法。
【請求項9】
前記のビニルピロリドンユニットと前記疎水性ユニットの共重合体溶液をポリスルホン系分離膜と接触させる際に、分離膜の内外で圧力差を設けることを特徴とする請求項8に記載のポリスルホン系分離膜モジュールの製造方法。
【請求項10】
前記疎水性ユニットが、酢酸ビニル、ビニルカプロラクタム、脂肪族炭化水素から選ばれる少なくとも一つのユニットであることを特徴とする請求項8または9に記載のポリスルホン系分離膜モジュールの製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2009−262147(P2009−262147A)
【公開日】平成21年11月12日(2009.11.12)
【国際特許分類】
【出願番号】特願2009−85788(P2009−85788)
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成21年11月12日(2009.11.12)
【国際特許分類】
【出願日】平成21年3月31日(2009.3.31)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

