ポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体
【課題】熱的安定性及び伝導度に優れるポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体を提供する。
【解決手段】本発明に係るポリベンズイミダゾール−塩基複合体は、ポリベンズイミダゾール系物質と、塩基と、を含み、ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない。かかるポリベンズイミダゾール−塩基複合体は、熱的安定性及び伝導度に優れる。
【解決手段】本発明に係るポリベンズイミダゾール−塩基複合体は、ポリベンズイミダゾール系物質と、塩基と、を含み、ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない。かかるポリベンズイミダゾール−塩基複合体は、熱的安定性及び伝導度に優れる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体に関する。
【背景技術】
【0002】
従来、電圧を印加することによってイオンが移動するイオン伝導体が知られている。このイオン伝導体は、電池や電気化学センサーなどの電気化学装置として広く利用されている。
【0003】
例えば、燃料電池においては、発電効率、システム効率、構成部材の長期耐久性の観点で、100ないし300℃の作動温度で無加湿、あるいは相対湿度50%以下の低加湿作動条件で、良好なプロトン伝導性を長期安定的に表すプロトン伝導体が要求されている。
【0004】
従来の固体高分子型燃料電池の開発に当たっては、前記要求に鑑みて検討されてきたが、パーフルオロカルボンスルホン酸膜を電解質膜として利用した固体高分子型燃料電池では、100〜300℃の作動温度で相対湿度50%以下では、十分な発電性能を得られないという短所がある。
【0005】
また、従来プロトン伝導性付与剤を含有させた電解質膜を使用した燃料電池、シリカ分散膜を使用した燃料電池、無機−有機複合膜を使用した燃料電池、リン酸ドーピンググラフト膜を使用した燃料電池またはイオン性液体複合膜を使用した燃料電池がある。
【0006】
また、リン酸などの強酸をドーピングさせたポリベンズイミダゾール(以下、PBI)からなる固体高分子電解質膜が開示されている(例えば、以下の特許文献1を参照。)。
【0007】
前述のPBI電解質膜は、他の高分子電解質膜に比べて熱的安定性に優れて独歩的な優位を占めている。
【0008】
しかし、既知のPBI高分子の製造方法(例えば、非特許文献1および非特許文献2を参照。)は、強酸性雰囲気下で高い粘性度を持つ溶液状態で合成する工程であるため、各合成工程のバッチ(batch)ごとに一定の物性を持つPBIを得難いということも周知の事実である。
【0009】
特に、PBIの合成条件は、強酸性雰囲気下で熱を加えて合成する反応条件下で行われるだけではなく、反応物及び生成物が主に塩基性性質を有しているアミンまたはイミン作用基を有しており、周辺環境から容易に量子化されて正電荷を持つため、一般的なGPCやHPLCを利用して純粋な形態に分離し難いということは公知の事実である。
【0010】
また、特許文献1のように、PBIを燃料電池用高分子電解質膜として使用するためには、主に強リン酸のような強酸性溶液を含浸させて使用するため、未反応モノマーやオリゴマーレベルの不純物を、完成された高分子生成物から分離することも困難であるため、これら不純物による影響は無視して使用しているという実情である。
【0011】
しかし、既知の前記製造方法により作られたPBI高分子を利用してリン酸などの強酸をドーピングさせた後、固体高分子電解質膜に製作して燃料電池に適用すれば、燃料電池の特性が一定に現れないか、その機械的強度が容易に劣化するか、燃料電池の初期活性化時間が長くなる場合が頻繁に発生して、これに対する改善が必要である。
【0012】
【特許文献1】米国特許第5,525,436号明細書
【非特許文献1】Macromol.Rapid Commun.2004,25,1410.
【非特許文献2】J.Poly.Sci.Part A:Polym.Chem,1989,27,2815.
【発明の開示】
【発明が解決しようとする課題】
【0013】
そこで、本発明は、このような問題に鑑みてなされたもので、その目的は、熱的安定性及び伝導度に優れる、新規かつ改良されたポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体を提供することにある。
【課題を解決するための手段】
【0014】
上記課題を解決するために、本発明のある観点によれば、ポリベンズイミダゾール系物質と、塩基と、を含み、ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない、ポリベンズイミダゾール−塩基複合体が提供される。
【0015】
前記ポリベンズイミダゾール−塩基複合体は、300MHzで作動する1H−NMRにより、ケミカルシフト9.14±0.5、8.32±0.5、7.92±0.5、7.75±0.5、7.62±0.5でピークが検出されることが好ましい。
【0016】
前記ポリベンズイミダゾール−塩基複合体における前記塩基の含有量は、前記ポリベンズイミダゾール系物質100質量部を基準として、0.01〜20質量部であってもよい。
【0017】
前記ポリベンズイミダゾール−塩基複合体における前記塩基は、炭酸ナトリウム(Na2CO3)、炭酸水素ナトリウム(NaHCO3)、炭酸カルシウム(K2CO3)、炭酸水素カルシウム(KHCO3)、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)、炭酸アンモニウム((NH4)2CO3)及び炭酸水素アンモニウム((NH4)HCO3)からなる群より選択された一つ以上であってもよい。
【0018】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(ICP)分析によって測定される金属イオンの含有量は、300〜1200ppmであることが好ましい。
【0019】
前記ポリベンズイミダゾール−塩基複合体の熱分解開始温度は、180〜220℃であることが好ましい。
【0020】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量Mwと数平均分子量Mnとの比(Mw/Mn)は、2.1〜2.5であってもよい。
【0021】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000であり、前記ポリベンズイミダゾール−塩基複合体の数平均分子量は、25000〜30000であってもよい。
【0022】
前記ポリベンズイミダゾール系物質は、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)であることが好ましい。
【0023】
上記課題を解決するために、本発明の別の観点によれば、ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得て、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理して形成された、ポリベンズイミダゾール−塩基複合体が提供される。
【0024】
上記課題を解決するために、本発明の更に別の観点によれば、ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得る工程と、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理する工程と、を含むポリベンズイミダゾール−塩基複合体の製造方法が提供される。
【0025】
前記塩基は、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)からなる群で選択された一つ以上であることが好ましい。
【0026】
前記有機溶媒は、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリドンからなる群で選択された一つ以上であることが好ましい。
【0027】
前記熱処理は、60〜150℃で行われることが好ましい。
【0028】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンズイミダゾール−塩基複合体を含む、燃料電池用電解質膜が提供される。
【0029】
前記燃料電池用電解質膜は、リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含むことが好ましい。
【0030】
上記課題を解決するために、本発明の更に別の観点によれば、カソードと、アノードと、前記カソードと前記アノードとの間に設けられた電解質膜と、を備えた燃料電池において、前記電解質膜は、上記ポリベンズイミダゾール−塩基複合体を含むことを特徴とする燃料電池が提供される。
【0031】
上記課題を解決するために、本発明の更に別の観点によれば、(i)上記ポリベンズイミダゾール−塩基複合体と、(ii)下記化学式3で表示される第1ベンゾオキサジン系モノマー及び下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、の重合生成物であることを特徴とする、ポリベンゾオキサジン系化合物の架橋体が提供される。
【0032】
【化1】

・・・(化学式3)
【0033】
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【0034】
【化2】

・・・(化学式4)
【0035】
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群から選択される。
【0036】
前記ポリベンズイミダゾール−塩基複合体の含有量は、前記第1ベンゾオキサジン系モノマーと前記第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、5〜95質量部であることが好ましい。
【0037】
前記化学式3で表示される第1ベンゾオキサジン系モノマーは、下記化学式5〜化学式14で表示される化合物の中から選択された一つであることが好ましい。
【0038】
【化3】

・・・(化学式5)
【0039】
【化4】

・・・(化学式6)
【0040】
【化5】

・・・(化学式7)
【0041】
【化6】

・・・(化学式8)
【0042】
【化7】

・・・(化学式9)
【0043】
【化8】

・・・(化学式10)
【0044】
【化9】

・・・(化学式11)
【0045】
【化10】

・・・(化学式12)
【0046】
【化11】

・・・(化学式13)
【0047】
【化12】

・・・(化学式14)
【0048】
前記化学式4で表示される第2ベンゾオキサジン系モノマーは、下記化学式15〜化学式19で表示される化合物の中から選択された一つであることが好ましい。
【0049】
【化13】

・・・(化学式15)
【0050】
【化14】

・・・(化学式16)
【0051】
【化15】

・・・(化学式17)
【0052】
【化16】

・・・(化学式18)
【0053】
【化17】

・・・(化学式19)
【0054】
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【0055】
【化18】

【0056】
前記ポリベンゾオキサジン系化合物の架橋体は、下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体との3成分による重合生成物であることが好ましい。
【0057】
【化19】

・・・(化学式6)
【0058】
【化20】

・・・(化学式16)
【0059】
なお、前記化学式16において、R2は、フェニル基である。
【0060】
ポリベンズイミダゾール−塩基複合体と、化学式3で表示される第1ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、の重合生成物であることが好ましい。
【0061】
前記第2ベンゾオキサジン系モノマーのうち少なくとも一つの含有量は、前記第1ベンゾオキサジン系モノマー100質量部を基準として、0.5〜50質量部であってもよい。
【0062】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンゾオキサジン系化合物の架橋体を含む電解質膜が提供される。
【0063】
前記電解質膜は、リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含むことが好ましい。
【0064】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンゾオキサジン系化合物の架橋体を含む電解質膜を備えた燃料電池が提供される。
【発明の効果】
【0065】
本発明によれば、熱的安定性及び伝導度に優れるポリベンズイミダゾール−塩基複合体と、このポリベンズイミダゾール−塩基複合体を用いた燃料電池用電解質膜、燃料電池を提供することが可能である。
【発明を実施するための最良の形態】
【0066】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0067】
本実施形態は、ポリベンズイミダゾール系物質を有機溶媒に溶解して得たポリベンズイミダゾール溶液を塩基と反応させ、これを熱処理して得た生成物のポリベンズイミダゾール−塩基複合体を提供する。
【0068】
前記塩基は、弱塩基であることが望ましい。望ましくは、炭酸ナトリウム(Na2CO3)、炭酸水素ナトリウム(NaHCO3)、炭酸カルシウム(K2CO3)、炭酸水素カルシウム(KHCO3)、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)、炭酸アンモニウム((NH4)2CO3)及び炭酸水素アンモニウム((NH4)HCO3)からなる群から選択された一つ以上を使用する。前記塩基の含有量は、ポリベンズイミダゾール系物質100質量部を基準として、例えば、0.01〜20質量部であることが望ましい。
【0069】
もし、塩基の含有量が0.01質量部未満ならば、複合体の形成が不完全であり、20質量部を超過すれば、ポリベンズイミダゾール−塩基複合体形成用組成物の粘度増加によって組成物内の各成分の均一な分散が不可能となり、望ましくない。
【0070】
前記ポリベンズイミダゾール系物質の具体的な例には、例えば、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)がある。
【0071】
本実施形態に係るポリベンズイミダゾール−塩基複合体の製造過程を説明すれば、次の通りである。
【0072】
まず、ポリベンズイミダゾール系物質を有機溶媒に完全に溶解させて、ポリベンズイミダゾール溶液を得る。
【0073】
前記有機溶媒としては、ポリベンズイミダゾール系物質を溶解させるものならばいずれも使用でき、具体的な例として、例えば、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、1−メチル−2−ピロリジン(NMP)からなる群から選択された一つ以上を挙げることができる。
【0074】
前記有機溶媒の含有量は、ポリベンズイミダゾール系物質を溶解して、10〜20質量%のポリベンズイミダゾール溶液を得られるように調節する。もし、有機溶媒の含有量が前記範囲未満ならば、ポリベンズイミダゾール系物質が均等に溶解され難く、前記範囲を超過すれば、分散が容易でないだけではなく、完全な複合体の形成が難しくて望ましくない。
【0075】
次いで、前記ポリベンズイミダゾール溶液に塩基を付加し、これを熱処理する過程を経る。このような熱処理過程を経た結果物をろ過すれば、目的とするポリベンズイミダゾール−塩基複合体を収得できるようになる。
【0076】
前記熱処理温度は、例えば60〜150℃であることが望ましい。もし、熱処理温度が前記範囲未満ならば、混合及び分散が容易でなく、前記範囲を超過すれば、複合体の形成側面で望ましくない。
【0077】
ポリベンズイミダゾール−塩基複合体の形成は、核磁気共鳴スペクトル(NMR)を通じて確認できる。NMR分析に用いられる分析機器は、300MHzによる測定が可能な機器であれば、特に限定されるものではない。本実施形態においてNMR分析に使われた分析機器は、Bruker biospin社で販売するBruker NMR 300MHz(model名:DPX300)であり、分析サンプル10mg/0.7mL DMSO d6、0.8mlを利用して分析したものである。そして、熱重量分析(TGA)は、TA Instrument TGA 2050を使用し、温度条件は、常温〜1000℃(10℃/min)範囲で実施し、窒素(N2)ガス雰囲気下でPtパンを使用して分析する。
【0078】
前述した製造過程によって得られたポリベンズイミダゾール−塩基複合体の熱分解開始温度は、例えば、180〜220℃、特に200℃であり、加熱温度20〜1000℃でのポリベンズイミダゾール−塩基複合体の熱分解速度が8〜15℃/分、特に10℃/分であり、熱重量分析曲線で10%減量温度は、200〜280℃、特に約250℃の特性を表す。
【0079】
本実施形態において、熱分解開始温度、熱分解速度及び熱重量分析曲線での10%減量温度は、TA Instrument社の熱重量分析装置であるTGA 2050を利用し、窒素ガス雰囲気下で8〜15℃/分、特に10℃/分の昇温速度の条件下で測定したものである。なお、熱分解開始温度、熱分解速度及び熱重量分析曲線の測定に利用する機器は、上記のものに限定されるわけではない。
【0080】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量と数平均分子量との比(Mw/Mn、“分子量分布”という。)は、例えば、2.1〜2.5、特に2.4であることが望ましい。そして、前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000程度、特に約69000であり、数平均分子量は25000〜30000程度、特に約29000であり、粘度平均分子量は、80000〜83000程度、特に約82000である。
【0081】
前記分子量は、ゲル透過クロマトグラフィー(GPC)法によって測定したものであり、測定時に使われた分析機器は、Viscotek GPCma社製のTDA302である。分析時に溶離液としてはジメチルホルムアミド(DMF)と0.1質量%のLiBrとを利用し、カラムとしては、PLGel Mixed−C*2(temp:40℃)を使用し、流速は約1ml/minであり、注入体積(Inj.Volume)は約100μlを使用する。なお、ゲル透過クロマトグラフィーの測定や使用するカラム等は、上述のものに限定されるわけではない。
【0082】
また、前記ポリベンズイミダゾール−塩基複合体は、1H−核磁気共鳴(1H−NMR)分光分析により、ケミカルシフト12〜15ppmで一般的なポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない。そして、300MHzで作動する1H−NMRによりケミカルシフト9.15±0.5(s,1H)、8.30±0.5(d,2H)、7.92±0.5(s,1H)、7.75±0.5(m,3H)、7.62±0.5(m,3H)でピークが検出される。
【0083】
このように、300MHzで作動する1H−NMRにより複合体の形成前に見られたケミカルシフト12〜15ppm、特に約14ppm付近のNHピークが消えると同時に、8.2〜7.4ppm範囲でポリベンズイミダゾールピークが明確に積分値に合わせてスプリッティングされることが分かる。
【0084】
前記ケミカルシフト12〜15ppm、特に約14ppm付近のNHピークが消えるのは、ポリベンズイミダゾール系物質が塩基と反応してこれを熱処理する過程で、ポリベンズイミダゾールの−NHが反応に関与して、Hの磁気的環境が変化するためである。前記NMR分析時に、ポリベンズイミダゾール−塩基複合体を溶解する溶媒としては、例えば、DMSO−d6、DMF−d6などを使用することが可能であり、本実施形態によれば、DMSO−d6を使用する。
【0085】
前記分析に使われた機器は、Bruker biospin社製のDPX300であり、分析のために前記ポリベンズイミダゾール−塩基複合体を溶解するのに使われた溶媒は、ジメチルスルホキシド(DMSO)−d6である。
【0086】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(ICP)分析によって測定される金属イオン(代表的な例としては、例えば、Na+、K+、Ca2+など)の含有量は、例えば、300〜1200ppm、特に323〜1170ppmである。本実施形態でICP分析に使われた機器は、島津社製のICPS−8100シーケンシャル・スペクトロメーターである。なお、誘導結合プラズマ分析に用いられる機器は、上述のものに限定されるわけではない。
【0087】
本実施形態で使用するポリベンズイミダゾール系物質は、その例として、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)を挙げることができる。
【0088】
本実施形態で使用するポリベンズイミダゾール系物質は、その製造方法が広く知られているが、その製造方法を、下記化学式1の化合物及び化学式2の化合物を一例として挙げて説明する。しかしながら、これら製造方法のみに限定されるものではない。
【0089】
最初の製造方法として、化学式1の化合物の製造方法を説明する(Macromol.Rapid Commun.2004,25,1410)。
【0090】
下記反応式1に示したように、出発物質として3,3’−ジアミノベンジジンとイソフタル酸を利用し、これに五酸化リン、メタンスルホン酸及びトリフルオロメタンスルホン酸を付加し、これらを窒素雰囲気下、150℃で熱処理すれば、化学式1の化合物を得ることができる。
【0091】
【化21】

【0092】
前記化学式1で表示される化合物の重量平均分子量は、40000〜44000であるため、このような分子量を持つようにnを調節する。
【0093】
第2の製造方法として、下記化学式2の化合物の製造方法を説明する(J.Poly.Sci.Part A:Polym.Chem,27,2815(1989))。
【0094】
下記反応式2に示したように、出発物質として3,3’−ジアミノベンジジンとメトキシイソフタル酸を利用し、これに五酸化リンとメタンスルホン酸を付加し、これらを窒素雰囲気下、140℃で熱処理すれば、化学式2の化合物を得ることができる。
【0095】
【化22】

【0096】
前記化学式2で表示される化合物の重量平均分子量は、40000〜45000であるため、このような分子量を持つようにnを調節する。
【0097】
本発明のポリベンズイミダゾール−塩基複合体は、熱的安定性及び伝導度に優れ、燃料電池用電解質膜の形成材料として有用である。これを酸のようなプロトン伝導体に含浸して電解質膜を形成する。前述した電解質膜を採用した高温無加湿条件下でも、発電性能の改善された燃料電池を製作できる。
【0098】
前記プロトン伝導体の非制限的な例としては、例えば、リン酸、ホスホン酸、C1−C20の有機ホスホン酸などを使用する。前記C1−C20の有機ホスホン酸の例として、例えば、エチルホスホン酸、メチルホスホン酸、ビニルホスホン酸などがある。
【0099】
前記プロトン伝導体の含有量は、電解質膜の総質量100質量部に対して、例えば、300〜1000質量部が使われる。本発明で使用する酸の濃度は特別に制限されないが、リン酸を使用する場合、85質量%のリン酸水溶液を使用し、リン酸含浸時間は80℃で2.5時間〜14時間の範囲等とすることが可能である。
【0100】
一方、本実施形態は、前述したポリベンズイミダゾール−塩基複合体と、下記化学式3で表示される第1ベンゾオキサジン系モノマーおよび下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、の重合の結果得られたポリベンゾオキサジン系化合物の架橋体を提供する。
【0101】
【化23】

・・・(化学式3)
【0102】
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【0103】
【化24】

・・・(化学式4)
【0104】
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または、置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群より選択される。
【0105】
前記ポリベンゾオキサジン系化合物の架橋体は、例えば、下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体と、の3成分重合生成物であることが望ましい。
【0106】
【数25】

・・・(化学式6)
【0107】
【化26】

・・・(化学式16)
【0108】
前記化学式16において、R2は、フェニル基である。
【0109】
本実施形態において、第1ベンゾオキサジン系モノマーと第2ベンゾオキサジン系モノマーとが共に使われる場合、前記第2ベンゾオキサジン系モノマーの含有量は、第1ベンゾオキサジン系モノマー100質量部を基準として、例えば、0.5〜50質量部であることが望ましく、特に1〜10質量部であることがさらに望ましい。
【0110】
このように、第1ベンゾオキサジン系モノマーは、架橋性化合物と重合されて電解質膜を形成するための高分子マトリックス形成用モノマーとして使われ、前記第2ベンゾオキサジン系モノマーは、電解質膜形成時に添加剤として使われる。前記化学式3及び化学式4でR2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示されるグループ(置換基)であることが望ましい。
【0111】
【化27】

【0112】
前記化学式4で、R3は、−C(CH3)2−、−C(CF3)2−、−C(=O)−、−SO2−、−CH2−、−C(CCl3)−、−CH(CH3)−、−CH(CF3)−である場合には、ベンゾオキサジン環を2つ含有する二官能性ベンゾオキサジン化合物であり、R3が下記化学式で表示されるグループである場合には、ベンゾオキサジン環を3つ含有する三官能性ベンゾオキサジン系化合物である。
【0113】
【化28】

【0114】
前記化学式3で表示される第1ベンゾオキサジン系モノマーの例として、例えば、下記化学式5〜化学式14で表示される化合物を挙げることができる。
【0115】
【化29】

・・・(化学式5)
【0116】
【化30】

・・・(化学式6)
【0117】
【化31】

・・・(化学式7)
【0118】
【化32】

・・・(化学式8)
【0119】
【化33】

・・・(化学式9)
【0120】
【化34】

・・・(化学式10)
【0121】
【化35】

・・・(化学式11)
【0122】
【化36】

・・・(化学式12)
【0123】
【化37】

・・・(化学式13)
【0124】
【化38】

・・・(化学式14)
【0125】
前記化学式4で表示される第2ベンゾオキサジン系モノマーの具体的な例として、例えば、下記化学式15〜化学式19で表示される化合物がある。
【0126】
【化39】

・・・(化学式15)
【0127】
【化40】

・・・(化学式16)
【0128】
【化41】

・・・(化学式17)
【0129】
【化42】

・・・(化学式18)
【0130】
【化43】

・・・(化学式19)
【0131】
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【0132】
【化44】

【0133】
前述した化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーと、前述したポリベンズイミダゾール−塩基複合体と、の重合生成物であるポリベンゾオキサジン系化合物の架橋体を合成する過程を説明すれば、次の通りである。
【0134】
前記化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、ポリベンズイミダゾール−塩基複合体とを、所定の混合比で混合する。
【0135】
前記ポリベンズイミダゾール−塩基複合体の含有量は、第1ベンゾオキサジン系モノマーと第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、例えば、5〜95質量部であることが望ましい。
【0136】
もし、ポリベンズイミダゾール−塩基複合体の含有量が5質量部未満ならば、リン酸が含浸されずにプロトン伝導性が落ち、ポリベンズイミダゾール−塩基複合体の含有量が95質量部を超過すれば、過剰リン酸の存在下で架橋体がポリリン酸に溶け、ガス透過が発生して望ましくない。
【0137】
前記化学式4で表示される第2ベンゾオキサジン系モノマーの含有量は、化学式3で表示される第1ベンゾオキサジン系モノマー100質量部を基準として、例えば、0.5〜50質量部であることが望ましく、特に1〜10質量部であることがさらに望ましい。
【0138】
もし、第2ベンゾオキサジン系モノマーの含有量が0.5質量部未満ならば、リン酸のようなプロトン伝導体を限界含浸量以上含有した場合、電解質膜の物理的及び化学的性質が欠け、50質量部を超過すれば、複合体の架橋密度の高集積化によってプロトン伝導体のドーピングが容易でなくて望ましくない。
【0139】
次いで、前記混合物の硬化反応を実施すれば、これらの相互架橋反応を通じてポリベンゾオキサジン系化合物の架橋体を得ることができる。すなわち、第1ベンゾオキサジン系モノマー及び第2ベンゾオキサジン系モノマーは、熱的開環重合を通じたポリベンズイミダゾール−塩基複合体と重合(硬化)して高分子マトリックスを形成し、前記重合反応は、順次の温度調節反応によって進み、硬化反応のための温度で最小限7時間以上の反応時間が確保されて始めて網状構造を形成できる。
【0140】
前記硬化反応の温度は、第1ベンゾオキサジン系モノマー、第2ベンゾオキサジン系モノマー、ポリベンズイミダゾール−塩基複合体の特性によって可変的であるが、例えば、50〜250℃の範囲内で実施する。もし、硬化反応の温度が50℃未満ならば、硬化反応自体が進まず、250℃範囲を超過すれば、副反応物質が得られて望ましくない。
【0141】
前記硬化反応時間は、硬化反応温度に依存的であるが、前述した温度範囲で7時間以上、特に、8〜20時間程度実施することが望ましい。
【0142】
前述した化学式1の第1ベンゾオキサジン系モノマーと、化学式2の第2ベンゾオキサジン系モノマーと架橋性化合物間の重合生成物であるポリベンゾオキサジン系化合物の架橋体の化学的及び物理的特性を説明すれば、次の通りである。
【0143】
本実施形態によって得たポリベンゾオキサジン系化合物の架橋体は、有機溶媒、酸、塩基にも溶けない熱硬化性特性がある。したがって、既存の高分子の分子量についての情報を得る最も一般的な方法であるGPC(Gel Permeation Chromatography)では、分子量測定が不可能である。
【0144】
本発明のポリベンゾオキサジン系化合物の架橋体は、ベンゾオキサジン系化合物の強い酸トラッピング能力を持ち、架橋により機械的特性向上及びポリリン酸に溶ける性質が除去されて、化学的に非常に安定している。これを利用して製造された電解質膜は、高温でリン酸保液能力に優れただけではなく機械的、化学的安定性が非常に改善される。また、本発明のポリベンゾオキサジン系化合物の架橋体は、他の重合開始剤や架橋剤を使用せずに単純な熱を通じた重合過程を経て得ることができ、別途の架橋剤をさらに必要としないため、工程上、量産面で望ましい。また、前記架橋体合成時に使われる出発物質が非常に安くてコストダウンできるという利点がある。
【0145】
特に、本発明のベンゾオキサジン系化合物の架橋体からなる電解質膜は、プロトン伝導度を高めるために、リン酸のようなプロトン伝導体の含浸量を増加させる場合にも機械的及び化学的安定性が優秀に保持されて、高温無加湿用燃料電池に有用に使われうる。
【0146】
本実施形態に係るベンゾオキサジン系化合物の架橋体を利用した電解質膜の製造過程を説明すれば、次の通りである。
【0147】
最初の方法によれば、前述した化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4の第2ベンゾオキサジン系モノマーのうち選択された一つ以上と、本実施形態に係るポリベンズイミダゾール−塩基複合体とをブレンドした後、これを50〜250℃程度、特に80〜220℃の範囲で硬化反応を実施する。次いで、これに酸のようなプロトン伝導体を含浸して、電解質膜を形成する。
【0148】
第2の方法によれば、化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーのうち選択された一つ以上と、本実施形態に係るポリベンズイミダゾール−塩基複合体との混合物を利用して膜を形成する。
【0149】
前記膜を形成する方法としては、テープキャスティング法を利用することもでき、通例的なコーティング法を利用することもできる。前記コーティング法の例には、支持体上にドクターブレードを利用して前記混合物をキャスティングする方法を挙げることができる。ここで、ドクターブレードとしては、例えば250〜500μmギャップを持つものを使用する。
【0150】
もし、前記膜を形成する過程でドクターブレードを利用したキャスティング法を利用する場合には、硬化後、酸を含浸する工程以前に、支持体から電解質膜を分離して支持体を除去する工程がさらに実施される。このように支持体を除去しようとする場合には、60〜80℃の蒸溜水に浸漬する過程を経る。
【0151】
前記支持体としては、電解質膜を支持する役割を行えるものならばいずれも使用でき、支持体の例として、例えば、ガラス基板、ポリイミド、ポリエチレンテレフタレートフィルムなどを使用する。テープキャスティング法を利用する場合には、テープキャスティングされた膜を硬化する前に、ポリエチレンテレフタレートのような支持体から分離した後、硬化のためのオーブンに入れる。
【0152】
また、ベンゾオキサジン系モノマーとポリベンズイミダゾールとからなる混合物を利用して、膜をテープキャスティング法によって形成する場合、混合物をろ過する工程をさらに経ることができる。このように形成された膜を熱処理して硬化反応を実施した後、これを酸のようなプロトン伝導体に含浸して電解質膜を形成する。
【0153】
前記プロトン伝導体の含有量及び非制限的な例は、ポリベンズイミダゾール−塩基複合体を利用して電解質膜を形成する場合と同一である。
【0154】
前述したポリベンズイミダゾール−塩基複合体及びポリベンゾオキサジン系化合物の架橋体を利用して形成された電解質膜は、燃料電池の水素イオン伝導膜として使われうる。これを利用して燃料電池用電極−膜アセンブリを製造する過程を説明すれば、次の通りである。本発明で使用する用語である“電極−膜アセンブリ(MEA:Membrane and Electrode Assembly)”は、電解質膜を中心として、この両面に触媒層と拡散層とで構成された電極が順次に積層されている構造を称する。
【0155】
本実施形態に係るMEAは、触媒層を備えている電極を前記過程によって得た電解質膜の両面に位置させた後、高温及び高圧で接合して形成するか、または触媒金属を含有した電極触媒層形成用組成物を高分子膜上にコーティングした後、これに燃料拡散層を接合して形成できる。
【0156】
この時、前記接合のための加熱温度及び圧力は、水素イオン伝導膜が軟化する温度(ナフィオンの場合、約125℃)まで加熱した状態で、0.1〜3ton/cm2、特に、約1ton/cm2の圧力で加圧して実行する。
【0157】
次いで、前記電極−膜アセンブリにそれぞれバイポーラプレートを装着して、燃料電池を完成する。ここで、バイポーラとプレートは燃料供給用溝を持っており、集電体機能を持っている。
【0158】
前記電極膜アセンブリの製造時、触媒としては、例えば、白金(Pt)単独または金、パラジウム、ロジウム、イリジウム、ルテニウム、スズ、モリブデン、コバルト、クロムからなる群で選択された一種以上の金属と白金との合金あるいは混合物を使用する。
【0159】
本実施形態に係る燃料電池は、特別にその用途が限定されるものではないが、望ましい一面によれば、高分子電解質膜(Polymer Electrolyte Membrane:PEM)燃料電池として使われる。
【0160】
本実施形態に係る化学式1及び化学式2で使われる置換基の定義について説明すれば、次の通りである。
【0161】
本実施形態に係る化学式で前記非置換のC1−C20のアルキル基の具体的な例には、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、ヘキシルなどを挙げることができ、前記アルキル基のうち一つ以上の水素原子は、ハロゲン原子、ハロゲン原子で置換されたC1−C20のアルキル基(例:CCF3、CHCF2、CH2F、CCl3など)、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基やその塩、スルホン酸基やその塩、燐酸やその塩、またはC1−C20のアルキル基、C2−C20アルケニル基、C2−C20アルキニル基、C1−C20のヘテロアリール基、C6−C20のアリール基、C6−C20のアリールアルキル基、C6−C20のヘテロアリール基、またはC6−C20のヘテロアリールアルキル基に置換されうる。
【0162】
本実施形態に係る化学式で、前記非置換のC2−C20のアルケニル基の具体的な例には、ビニレン、アリレンなどを挙げることができ、前記アルケニルのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換されうる。
【0163】
本実施形態に係る化学式で、前記非置換のC2−C20のアルキニル基の具体的な例には、アセチレンなどを挙げることができ、前記アルキニルのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換できる。
【0164】
本実施形態に係る化学式で、前記非置換のC1−C20のアルキレン基の具体的な例には、メチレン、エチレン、プロピレン、イソブチレン、sec−ブチレン、ペンチレン、iso−アミレン、ヘキシレンなどを挙げることができ、前記アルキレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換できる。
【0165】
本実施形態に係る化学式で、前記非置換のC2−C20のアルケニレン基の具体的な例には、アリル基などを挙げることができ、前記アルケニレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0166】
本実施形態に係る化学式で、前記非置換のC2−C20のアルキニレン基の具体的な例には、アセチレン基などを挙げることができ、前記アルキニレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0167】
本実施形態で使われるアリール基は、単独または組み合わせて使われ、一つ以上の環を含む炭素原子数6〜20個のカルボ環芳香族システムを意味し、前記環は、ペンダント方法で共に付着されるか、または融合されうる。アリールという用語は、フェニル、ナフチル、テトラヒドロナフチルのような芳香族ラジカルを含む。前記アリール基は、ハロアルキレン、ニトロ、シアノ、アルコキシ及び低級アルキルアミノのような置換基を持つことができる。また、前記アリール基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0168】
本実施形態で使われるアリーレン基は、単独または組み合わせて使われ、一つ以上の環を含む炭素原子数6〜20個のカルボ環芳香族システムを意味し、前記環はペンダント方法で共に付着されるか、または融合されうる。アリーレンという用語は、フェニレン、ナフチレン、テトラヒドロナフチレンのような芳香族ラジカルを含む。前記アリーレン基は、ハロアルキレン、ニトロ、シアノ、アルコキシ及び低級アルキルアミノのような置換基を持つことができる。また、前記アリーレン基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0169】
本実施形態で使われるアリールアルキル基は、前記定義されたようなアリール基で、水素原子のうち一部が低級アルキル、例えば、メチル、エチル、プロピルのようなグループで置換されたことを意味する。例えば、ベンジル、フェニルエチルなどがある。前記アリールアルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0170】
本実施形態で使われるヘテロアリール基は、N、O、PまたはSのうち選択された1、2または3個のヘテロ原子を含む1が芳香族有機化合物を意味する。前記ヘテロアリール基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0171】
本実施形態で使われるヘテロアリーレン基は、N、O、PまたはSのうち選択された1、2または3個のヘテロ原子を含む2価芳香族有機化合物を意味する。前記ヘテロアリーレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0172】
本実施形態で使われるヘテロアリールアルキル基は、前記ヘテロアリール基の水素原子一部がアルキル基で置換されたことを意味する。前記ヘテロアリールアルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0173】
本実施形態で使われる炭素環基は、シクロヘキシル基のように5〜10個の炭素原子で構成された環基を称し、前記炭素環基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0174】
本実施形態で使われる炭素環アルキル基は、前記炭素環基の水素原子の一部がアルキル基で置換されたことを意味する。前記炭素環アルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0175】
本実施形態で使われるヘテロ環基は、窒素、硫黄、リン、酸素のようなヘテロ原子を含有している5〜10原子からなる環基を称し、このようなヘテロ環基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じく置換可能である。
【0176】
本実施形態で使われるヘテロ環アルキル基は、前記ヘテロ環基の水素原子の一部がアルキル基で置換されたことを意味する。前記ヘテロ環アルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【実施例】
【0177】
以下、本発明を、下記実施例を挙げて説明するが、本発明が下記実施例のみで限定されるものではない。
【0178】
<比較製造例1:ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)の製造>
3,3’−ジアミノベンジジン(4.84g、22.6mmol)とイソフタル酸(3.76g、22.6mmol)を、P2O5(8g)、CF3SO3H(30mL)、CH3SO3H(30mL)の混合溶液に溶解した。
【0179】
反応混合物を150℃、窒素雰囲気下で30分間反応させた。反応が進むにつれて反応混合物は段々均質溶液に変わり、粘度の増加が観測された。高分子を微細粉末の形態で得るために、高分子溶液を熱い状態でペリスタルティックポンプ(peristaltic pump)を利用して、約1.5Lの水に注いだ。生成された粉末を数回水洗した。次いで、前記結果物を10%水酸化アンモニウム溶液とソックスレー装置を利用して、高分子内に存在する余分のリン酸を除去した。前記リン酸除去過程は、元素分析でリン残留成分が確認されなくなるまで実施した。次いで、得られた高分子を、減圧下、50℃で3日間乾燥させて約6gの高分子を得た。
【0180】
前記過程によって得たPBIを、メタノールを利用して沈殿を形成し、形成された沈殿をメタノールで洗浄してPBIを収得した。
【0181】
<合成例1:化学式6のベンゾオキサジン系モノマー(以下“BOA”と称する)の製造>
ターシャリーブチルフェーノル1mol、パラホルムアルデヒド2.2mol及びアニリン1.1molを混合し、これを100℃で1時間溶媒なしに攪拌して粗生成物を得た。
【0182】
前記粗生成物を1N NaOH水溶液に2回、蒸溜水に1回洗浄する過程を順次に実施した後、これを、硫酸マグネシウムを利用して乾燥した。次いで、前記結果物をろ過してから溶媒を除去し、かつ真空乾燥して、化学式6のベンゾオキサジン系モノマーを95%の収率で収得した。
【0183】
前記過程によって得た化学式6のベンゾオキサジン系モノマーは、NMRスペクトルを通じてその構造を確認した。
【0184】
<合成例2:化学式16(R2=フェニル基である)のベンゾオキサジン系モノマー(以下“HFA”と称する)の製造>
4,4’−ヘキサフルオロイソプロピリデンジフェーノル(4,4’−HFIDPH)1mol、パラホルムアルデヒド4.4mol及びアニリン2.2molを混合し、これを100℃で1時間溶媒なしに攪拌して粗生成物を得た。
【0185】
前記粗生成物を1N NaOH水溶液に2回、蒸溜水に1回洗浄する過程を順次に実施した後、これを、硫酸マグネシウムを利用して乾燥した。次いで、前記結果物をろ過してから溶媒を除去して真空乾燥し、化学式16(R2=フェニル基)ベンゾオキサジン系モノマーを96%の収率で収得した。
【0186】
前記過程によって得た化学式16のベンゾオキサジン系モノマーのNMRスペクトルを通じてその構造を確認した。
【0187】
<製造例1:ポリベンズイミダゾール−塩基複合体の製造>
前記比較製造例1によって製造されたPBI粉末5gにジメチルアセトアミド50gを付加して、10質量%のPBI溶液を得た。
【0188】
前記PBI溶液に炭酸ナトリウム0.5gを付加してから、これを80℃で1時間以上攪拌した。次いで、前記結果物をろ過してポリベンズイミダゾール−塩基複合体を得た。
【0189】
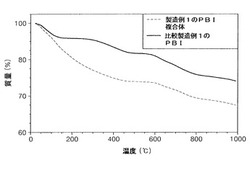
前記製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIにおいて、熱重量分析を実施して図1〜図3に示した。
【0190】
図1は、比較製造例1によって得たPBIに対するものであり、図2は、製造例1によって得たポリベンズイミダゾール−塩基複合体に対するものであり、図3は、図1及び図2を共に示したものである。
【0191】
これを参照すれば、製造例1のポリベンズイミダゾール−塩基複合体は、熱分解開始が比較製造例1のPBIとは異なって200℃で始まっており、200〜500℃で熱分解された。これに対し、比較製造例1のPBIは200〜500℃で急激に熱分解され、熱分解温度が500℃で開始された。
【0192】
前記製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIとにおいて、ゲル透過クロマトグラフィーを実施して分子量特性を分析し、その結果を下記の表1に表した。
【0193】
【表1】

【0194】
また製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIにおいて、核磁気共鳴分析を実施し、その結果をそれぞれ図4及び5に示した。
【0195】
図4及び図5を参照して、複合体形成前(図5)、形成後(図4)のピークパターンが明確に変わった。これをさらに説明すれば、複合体形成前13.2(NH、2H)、9.14(s、1H)、8.32(m、2H)、8.03(s、1H)、7.81(m、3H)のピークパターンが、9.14(s、1H)、8.32(d、2H、J=6。9Hz)、7.92(s、2H)、7.75(m、3H)、7.62(d、2H、8.3Hz)に変わった。このように複合体形成後に13.2ピークが消えた。そして、図4からポリベンズイミダゾール−塩基複合体の構造が確認できた。
【0196】
また、前記製造例1によって得たポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(Inductively Coupled Plasma:ICP)分析を実施した。ICP分析データ比較のために比較製造例1によって得たPBIにリン酸を含浸させたサンプルに対するICP分析も共に実施した。
【0197】
分析結果、製造例1によって得たポリベンズイミダゾール−塩基複合体は、ナトリウムの含有量が約1170ppmと現れ、比較製造例1によって得たPBIにリン酸を含浸させたサンプルの場合は、金属であるナトリウムが検出されていない。
【0198】
<製造例2:ポリベンゾオキサジン系化合物の架橋体の合成>
前記合成例1によって得たBOA 6質量部と、合成例2によって得たHFA 0.3質量部と、製造例1によって得たポリベンズイミダゾール−塩基複合体(Mw:69,000、Mn:29,000)3.7質量部とをブレンドした後、これを20℃/Hrの昇温速度で220℃まで加熱した後、この温度で硬化反応を実施してポリベンゾオキサジン系化合物の架橋体を合成した。
【0199】
<実施例1:燃料電池の製作>
前記製造例1によって得たポリベンズイミダゾール−塩基複合体を、リン酸に80℃で2時間30分ほど含浸して、電解質膜を形成した。ここでリン酸の含浸量は、電解質膜総質量100質量部に対して約375質量部であった。
【0200】
攪拌容器に、カーボンに50質量%PtCoが担持された触媒1g及び溶媒NMP 3gを付加し、これを、モルタルを利用して攪拌してスラリーを作った。
【0201】
次いで、前記スラリーに5質量%のフッ化ポリビニリデンのNMP溶液を付加して、フッ化ポリビニリデンが0.025gになるように添加して10分間混合して、カソード触媒層形成用スラリーを製造した。
【0202】
カーボンペーパーを4×7cm2サイズに切ってガラス板上に固定させてドクターブレード(Sheen instrument社製)でコーティングするが、この時、ギャップ間隔は600μmに調節した。
【0203】
前記カーボンペーパーの上部に前記カソード触媒層形成用スラリーをコーティングし、これを常温で1時間乾燥し、80℃で1時間乾燥し、120℃で30分乾燥し、150℃で15分間乾燥してカソード(燃料極)を製造した。完成されたカソードでの白金コバルトローディング量は、2.2〜2.4mg/cm2値を持つ。
【0204】
アノードとしては、下記過程によって得た電極を利用した。
【0205】
攪拌容器に、カーボンに50質量%Ptが担持された触媒2g及び溶媒NMP 9gを付加し、これを、高速攪拌器を利用して2分間攪拌した。次いで、前記混合物に、フッ化ポリビニリデン0.05gをNMP 1gに溶解した溶液を付加して2分間さらに攪拌して、アノード触媒層形成用スラリーを製作する。これを、微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。完成されたアノードの白金ローディング量は1.1〜1.34mg/cm2値を持つ。
【0206】
前記カソードとアノードとの間に前記電解質膜を介在してMEAを製作した。そして、前記カソードとアノードとはリン酸の含浸なしに使用した。
【0207】
前記カソードとアノード間のガス透過を防止するために、主ガスケット用で200μm厚のテフロン(登録商標)膜と、サブガスケット用で20μm厚のテフロン(登録商標)膜を電極と電解質膜との界面に重ねて使用した。
【0208】
温度150℃、電解質膜に対して加湿しない条件で、アノードに水素(流速:100ccm)、カソードに空気(250ccm)を流通させて発電させ、電池特性の測定を行った。この時、燐酸をドーピングした電解質を使用するため、経時的に燃料電池の性能が向上するので、作動電圧が最高点に至るまでエージングした後、最終評価する。
【0209】
<実施例2:燃料電池の製作>
前記製造例2によって合成したポリベンゾオキサジン系化合物の架橋体を、85質量%リン酸に80℃で2時間30分ほど含浸して電解質膜を形成した。ここで、リン酸の含有量は、電解質膜総質量100質量部に対して約500質量部であった。
【0210】
PBI電極は、PBI及びPVDFをバインダーとして使用して触媒層スラリーを製作し、これを微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。完成された電極の白金ローディング量は1.0〜1.4mg/cm2値を持つ。リン酸陰イオンの吸着を防止して触媒活性を向上させることが知られた白金−コバルト合金を触媒として使用する場合には、フッ化ビニリデンのみをバインダーとして使用して触媒インキを製作し、微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。この電極の白金ローディング量は2.2〜2.4mg/cm2値を持つ。前記電極の間にリン酸が含浸されたポリベンゾオキサジン系化合物の架橋体を導入して、膜電極組立体と燃料電池とを製作した。
【0211】
<比較例1>
電解質膜の製造時、前記製造例1によって得たポリベンズイミダゾール−塩基複合体の代わりに比較製造例1によって得たPBIを使用し、リン酸の含浸量が電解質膜総質量100質量部に対して約309質量部であることを除いては、実施例1と同じ方法によって燃料電池を製作し、その性能を評価した。
【0212】
前記実施例1及び比較例1による燃料電池において、性能評価結果は、図6及び図7にそれぞれ示した。
【0213】
これを参照すれば、図6の実施例1の燃料電池は、図7の比較例1の場合と比較して電流密度による電圧特性が改善されるということが分かった。
【0214】
また前記実施例1及び比較例1による燃料電池において、エージング速度を調べてその結果を図8に共に示した。
【0215】
図8を参照すれば、PBI複合体を使用する実施例1の燃料電池が、PBIを使用する比較例1の場合と比較して最高性能が22mVほど向上したことが分かった。
【0216】
前記実施例2及び比較例1による燃料電池において、電流密度によるセルポテンシャル変化を調べ、その結果を図9に示した。
【0217】
図9を参照して、同じ電極の触媒ローディング量で同じ活性化時間7日を基準として比較した。
【0218】
評価結果、実施例2の燃料電池は、比較例1の場合と比較してセルポテンシャル特性が改善されるということが分かった。
【0219】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明はかかる例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【産業上の利用可能性】
【0220】
本発明は、燃料電池関連の技術分野に好適に用いられる。
【図面の簡単な説明】
【0221】
【図1】比較製造例1によって製造されたPBIの熱重量分析結果を示すグラフである。
【図2】製造例1によって製造されたPBIの熱重量分析結果を示すグラフである。
【図3】図1及び図2の結果を共に示したグラフである。
【図4】製造例1のポリベンズイミダゾール−塩基複合体の核磁気共鳴分析データを示すグラフである。
【図5】比較製造例1によるPBIの核磁気共鳴分析データを示すグラフである。
【図6】実施例1による燃料電池において、電流密度による電圧特性を示すグラフである。
【図7】比較例1による燃料電池において、電流密度による電圧特性を示すグラフである。
【図8】実施例1及び比較例1による燃料電池において、エージング速度を比較して示すグラフである。
【図9】実施例2及び比較例1による燃料電池において、電流密度によるセルポテンシャル変化を示すグラフである。
【技術分野】
【0001】
本発明は、ポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体に関する。
【背景技術】
【0002】
従来、電圧を印加することによってイオンが移動するイオン伝導体が知られている。このイオン伝導体は、電池や電気化学センサーなどの電気化学装置として広く利用されている。
【0003】
例えば、燃料電池においては、発電効率、システム効率、構成部材の長期耐久性の観点で、100ないし300℃の作動温度で無加湿、あるいは相対湿度50%以下の低加湿作動条件で、良好なプロトン伝導性を長期安定的に表すプロトン伝導体が要求されている。
【0004】
従来の固体高分子型燃料電池の開発に当たっては、前記要求に鑑みて検討されてきたが、パーフルオロカルボンスルホン酸膜を電解質膜として利用した固体高分子型燃料電池では、100〜300℃の作動温度で相対湿度50%以下では、十分な発電性能を得られないという短所がある。
【0005】
また、従来プロトン伝導性付与剤を含有させた電解質膜を使用した燃料電池、シリカ分散膜を使用した燃料電池、無機−有機複合膜を使用した燃料電池、リン酸ドーピンググラフト膜を使用した燃料電池またはイオン性液体複合膜を使用した燃料電池がある。
【0006】
また、リン酸などの強酸をドーピングさせたポリベンズイミダゾール(以下、PBI)からなる固体高分子電解質膜が開示されている(例えば、以下の特許文献1を参照。)。
【0007】
前述のPBI電解質膜は、他の高分子電解質膜に比べて熱的安定性に優れて独歩的な優位を占めている。
【0008】
しかし、既知のPBI高分子の製造方法(例えば、非特許文献1および非特許文献2を参照。)は、強酸性雰囲気下で高い粘性度を持つ溶液状態で合成する工程であるため、各合成工程のバッチ(batch)ごとに一定の物性を持つPBIを得難いということも周知の事実である。
【0009】
特に、PBIの合成条件は、強酸性雰囲気下で熱を加えて合成する反応条件下で行われるだけではなく、反応物及び生成物が主に塩基性性質を有しているアミンまたはイミン作用基を有しており、周辺環境から容易に量子化されて正電荷を持つため、一般的なGPCやHPLCを利用して純粋な形態に分離し難いということは公知の事実である。
【0010】
また、特許文献1のように、PBIを燃料電池用高分子電解質膜として使用するためには、主に強リン酸のような強酸性溶液を含浸させて使用するため、未反応モノマーやオリゴマーレベルの不純物を、完成された高分子生成物から分離することも困難であるため、これら不純物による影響は無視して使用しているという実情である。
【0011】
しかし、既知の前記製造方法により作られたPBI高分子を利用してリン酸などの強酸をドーピングさせた後、固体高分子電解質膜に製作して燃料電池に適用すれば、燃料電池の特性が一定に現れないか、その機械的強度が容易に劣化するか、燃料電池の初期活性化時間が長くなる場合が頻繁に発生して、これに対する改善が必要である。
【0012】
【特許文献1】米国特許第5,525,436号明細書
【非特許文献1】Macromol.Rapid Commun.2004,25,1410.
【非特許文献2】J.Poly.Sci.Part A:Polym.Chem,1989,27,2815.
【発明の開示】
【発明が解決しようとする課題】
【0013】
そこで、本発明は、このような問題に鑑みてなされたもので、その目的は、熱的安定性及び伝導度に優れる、新規かつ改良されたポリベンズイミダゾール−塩基複合体、ポリベンズイミダゾール−塩基複合体の製造方法、燃料電池用電解質膜、燃料電池およびポリベンゾオキサジン系化合物の架橋体を提供することにある。
【課題を解決するための手段】
【0014】
上記課題を解決するために、本発明のある観点によれば、ポリベンズイミダゾール系物質と、塩基と、を含み、ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない、ポリベンズイミダゾール−塩基複合体が提供される。
【0015】
前記ポリベンズイミダゾール−塩基複合体は、300MHzで作動する1H−NMRにより、ケミカルシフト9.14±0.5、8.32±0.5、7.92±0.5、7.75±0.5、7.62±0.5でピークが検出されることが好ましい。
【0016】
前記ポリベンズイミダゾール−塩基複合体における前記塩基の含有量は、前記ポリベンズイミダゾール系物質100質量部を基準として、0.01〜20質量部であってもよい。
【0017】
前記ポリベンズイミダゾール−塩基複合体における前記塩基は、炭酸ナトリウム(Na2CO3)、炭酸水素ナトリウム(NaHCO3)、炭酸カルシウム(K2CO3)、炭酸水素カルシウム(KHCO3)、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)、炭酸アンモニウム((NH4)2CO3)及び炭酸水素アンモニウム((NH4)HCO3)からなる群より選択された一つ以上であってもよい。
【0018】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(ICP)分析によって測定される金属イオンの含有量は、300〜1200ppmであることが好ましい。
【0019】
前記ポリベンズイミダゾール−塩基複合体の熱分解開始温度は、180〜220℃であることが好ましい。
【0020】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量Mwと数平均分子量Mnとの比(Mw/Mn)は、2.1〜2.5であってもよい。
【0021】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000であり、前記ポリベンズイミダゾール−塩基複合体の数平均分子量は、25000〜30000であってもよい。
【0022】
前記ポリベンズイミダゾール系物質は、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)であることが好ましい。
【0023】
上記課題を解決するために、本発明の別の観点によれば、ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得て、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理して形成された、ポリベンズイミダゾール−塩基複合体が提供される。
【0024】
上記課題を解決するために、本発明の更に別の観点によれば、ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得る工程と、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理する工程と、を含むポリベンズイミダゾール−塩基複合体の製造方法が提供される。
【0025】
前記塩基は、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)からなる群で選択された一つ以上であることが好ましい。
【0026】
前記有機溶媒は、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリドンからなる群で選択された一つ以上であることが好ましい。
【0027】
前記熱処理は、60〜150℃で行われることが好ましい。
【0028】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンズイミダゾール−塩基複合体を含む、燃料電池用電解質膜が提供される。
【0029】
前記燃料電池用電解質膜は、リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含むことが好ましい。
【0030】
上記課題を解決するために、本発明の更に別の観点によれば、カソードと、アノードと、前記カソードと前記アノードとの間に設けられた電解質膜と、を備えた燃料電池において、前記電解質膜は、上記ポリベンズイミダゾール−塩基複合体を含むことを特徴とする燃料電池が提供される。
【0031】
上記課題を解決するために、本発明の更に別の観点によれば、(i)上記ポリベンズイミダゾール−塩基複合体と、(ii)下記化学式3で表示される第1ベンゾオキサジン系モノマー及び下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、の重合生成物であることを特徴とする、ポリベンゾオキサジン系化合物の架橋体が提供される。
【0032】
【化1】

・・・(化学式3)
【0033】
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【0034】
【化2】

・・・(化学式4)
【0035】
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群から選択される。
【0036】
前記ポリベンズイミダゾール−塩基複合体の含有量は、前記第1ベンゾオキサジン系モノマーと前記第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、5〜95質量部であることが好ましい。
【0037】
前記化学式3で表示される第1ベンゾオキサジン系モノマーは、下記化学式5〜化学式14で表示される化合物の中から選択された一つであることが好ましい。
【0038】
【化3】

・・・(化学式5)
【0039】
【化4】

・・・(化学式6)
【0040】
【化5】

・・・(化学式7)
【0041】
【化6】

・・・(化学式8)
【0042】
【化7】

・・・(化学式9)
【0043】
【化8】

・・・(化学式10)
【0044】
【化9】

・・・(化学式11)
【0045】
【化10】

・・・(化学式12)
【0046】
【化11】

・・・(化学式13)
【0047】
【化12】

・・・(化学式14)
【0048】
前記化学式4で表示される第2ベンゾオキサジン系モノマーは、下記化学式15〜化学式19で表示される化合物の中から選択された一つであることが好ましい。
【0049】
【化13】

・・・(化学式15)
【0050】
【化14】

・・・(化学式16)
【0051】
【化15】

・・・(化学式17)
【0052】
【化16】

・・・(化学式18)
【0053】
【化17】

・・・(化学式19)
【0054】
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【0055】
【化18】

【0056】
前記ポリベンゾオキサジン系化合物の架橋体は、下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体との3成分による重合生成物であることが好ましい。
【0057】
【化19】

・・・(化学式6)
【0058】
【化20】

・・・(化学式16)
【0059】
なお、前記化学式16において、R2は、フェニル基である。
【0060】
ポリベンズイミダゾール−塩基複合体と、化学式3で表示される第1ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、の重合生成物であることが好ましい。
【0061】
前記第2ベンゾオキサジン系モノマーのうち少なくとも一つの含有量は、前記第1ベンゾオキサジン系モノマー100質量部を基準として、0.5〜50質量部であってもよい。
【0062】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンゾオキサジン系化合物の架橋体を含む電解質膜が提供される。
【0063】
前記電解質膜は、リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含むことが好ましい。
【0064】
上記課題を解決するために、本発明の更に別の観点によれば、上記ポリベンゾオキサジン系化合物の架橋体を含む電解質膜を備えた燃料電池が提供される。
【発明の効果】
【0065】
本発明によれば、熱的安定性及び伝導度に優れるポリベンズイミダゾール−塩基複合体と、このポリベンズイミダゾール−塩基複合体を用いた燃料電池用電解質膜、燃料電池を提供することが可能である。
【発明を実施するための最良の形態】
【0066】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0067】
本実施形態は、ポリベンズイミダゾール系物質を有機溶媒に溶解して得たポリベンズイミダゾール溶液を塩基と反応させ、これを熱処理して得た生成物のポリベンズイミダゾール−塩基複合体を提供する。
【0068】
前記塩基は、弱塩基であることが望ましい。望ましくは、炭酸ナトリウム(Na2CO3)、炭酸水素ナトリウム(NaHCO3)、炭酸カルシウム(K2CO3)、炭酸水素カルシウム(KHCO3)、炭酸リチウム(Li2CO3)、炭酸ルビジウム(Rb2CO3)、炭酸セシウム(Cs2CO3)、炭酸アンモニウム((NH4)2CO3)及び炭酸水素アンモニウム((NH4)HCO3)からなる群から選択された一つ以上を使用する。前記塩基の含有量は、ポリベンズイミダゾール系物質100質量部を基準として、例えば、0.01〜20質量部であることが望ましい。
【0069】
もし、塩基の含有量が0.01質量部未満ならば、複合体の形成が不完全であり、20質量部を超過すれば、ポリベンズイミダゾール−塩基複合体形成用組成物の粘度増加によって組成物内の各成分の均一な分散が不可能となり、望ましくない。
【0070】
前記ポリベンズイミダゾール系物質の具体的な例には、例えば、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)がある。
【0071】
本実施形態に係るポリベンズイミダゾール−塩基複合体の製造過程を説明すれば、次の通りである。
【0072】
まず、ポリベンズイミダゾール系物質を有機溶媒に完全に溶解させて、ポリベンズイミダゾール溶液を得る。
【0073】
前記有機溶媒としては、ポリベンズイミダゾール系物質を溶解させるものならばいずれも使用でき、具体的な例として、例えば、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、1−メチル−2−ピロリジン(NMP)からなる群から選択された一つ以上を挙げることができる。
【0074】
前記有機溶媒の含有量は、ポリベンズイミダゾール系物質を溶解して、10〜20質量%のポリベンズイミダゾール溶液を得られるように調節する。もし、有機溶媒の含有量が前記範囲未満ならば、ポリベンズイミダゾール系物質が均等に溶解され難く、前記範囲を超過すれば、分散が容易でないだけではなく、完全な複合体の形成が難しくて望ましくない。
【0075】
次いで、前記ポリベンズイミダゾール溶液に塩基を付加し、これを熱処理する過程を経る。このような熱処理過程を経た結果物をろ過すれば、目的とするポリベンズイミダゾール−塩基複合体を収得できるようになる。
【0076】
前記熱処理温度は、例えば60〜150℃であることが望ましい。もし、熱処理温度が前記範囲未満ならば、混合及び分散が容易でなく、前記範囲を超過すれば、複合体の形成側面で望ましくない。
【0077】
ポリベンズイミダゾール−塩基複合体の形成は、核磁気共鳴スペクトル(NMR)を通じて確認できる。NMR分析に用いられる分析機器は、300MHzによる測定が可能な機器であれば、特に限定されるものではない。本実施形態においてNMR分析に使われた分析機器は、Bruker biospin社で販売するBruker NMR 300MHz(model名:DPX300)であり、分析サンプル10mg/0.7mL DMSO d6、0.8mlを利用して分析したものである。そして、熱重量分析(TGA)は、TA Instrument TGA 2050を使用し、温度条件は、常温〜1000℃(10℃/min)範囲で実施し、窒素(N2)ガス雰囲気下でPtパンを使用して分析する。
【0078】
前述した製造過程によって得られたポリベンズイミダゾール−塩基複合体の熱分解開始温度は、例えば、180〜220℃、特に200℃であり、加熱温度20〜1000℃でのポリベンズイミダゾール−塩基複合体の熱分解速度が8〜15℃/分、特に10℃/分であり、熱重量分析曲線で10%減量温度は、200〜280℃、特に約250℃の特性を表す。
【0079】
本実施形態において、熱分解開始温度、熱分解速度及び熱重量分析曲線での10%減量温度は、TA Instrument社の熱重量分析装置であるTGA 2050を利用し、窒素ガス雰囲気下で8〜15℃/分、特に10℃/分の昇温速度の条件下で測定したものである。なお、熱分解開始温度、熱分解速度及び熱重量分析曲線の測定に利用する機器は、上記のものに限定されるわけではない。
【0080】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量と数平均分子量との比(Mw/Mn、“分子量分布”という。)は、例えば、2.1〜2.5、特に2.4であることが望ましい。そして、前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000程度、特に約69000であり、数平均分子量は25000〜30000程度、特に約29000であり、粘度平均分子量は、80000〜83000程度、特に約82000である。
【0081】
前記分子量は、ゲル透過クロマトグラフィー(GPC)法によって測定したものであり、測定時に使われた分析機器は、Viscotek GPCma社製のTDA302である。分析時に溶離液としてはジメチルホルムアミド(DMF)と0.1質量%のLiBrとを利用し、カラムとしては、PLGel Mixed−C*2(temp:40℃)を使用し、流速は約1ml/minであり、注入体積(Inj.Volume)は約100μlを使用する。なお、ゲル透過クロマトグラフィーの測定や使用するカラム等は、上述のものに限定されるわけではない。
【0082】
また、前記ポリベンズイミダゾール−塩基複合体は、1H−核磁気共鳴(1H−NMR)分光分析により、ケミカルシフト12〜15ppmで一般的なポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない。そして、300MHzで作動する1H−NMRによりケミカルシフト9.15±0.5(s,1H)、8.30±0.5(d,2H)、7.92±0.5(s,1H)、7.75±0.5(m,3H)、7.62±0.5(m,3H)でピークが検出される。
【0083】
このように、300MHzで作動する1H−NMRにより複合体の形成前に見られたケミカルシフト12〜15ppm、特に約14ppm付近のNHピークが消えると同時に、8.2〜7.4ppm範囲でポリベンズイミダゾールピークが明確に積分値に合わせてスプリッティングされることが分かる。
【0084】
前記ケミカルシフト12〜15ppm、特に約14ppm付近のNHピークが消えるのは、ポリベンズイミダゾール系物質が塩基と反応してこれを熱処理する過程で、ポリベンズイミダゾールの−NHが反応に関与して、Hの磁気的環境が変化するためである。前記NMR分析時に、ポリベンズイミダゾール−塩基複合体を溶解する溶媒としては、例えば、DMSO−d6、DMF−d6などを使用することが可能であり、本実施形態によれば、DMSO−d6を使用する。
【0085】
前記分析に使われた機器は、Bruker biospin社製のDPX300であり、分析のために前記ポリベンズイミダゾール−塩基複合体を溶解するのに使われた溶媒は、ジメチルスルホキシド(DMSO)−d6である。
【0086】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(ICP)分析によって測定される金属イオン(代表的な例としては、例えば、Na+、K+、Ca2+など)の含有量は、例えば、300〜1200ppm、特に323〜1170ppmである。本実施形態でICP分析に使われた機器は、島津社製のICPS−8100シーケンシャル・スペクトロメーターである。なお、誘導結合プラズマ分析に用いられる機器は、上述のものに限定されるわけではない。
【0087】
本実施形態で使用するポリベンズイミダゾール系物質は、その例として、ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)またはポリ(2,5−ベンズイミダゾール)(ABPBI)を挙げることができる。
【0088】
本実施形態で使用するポリベンズイミダゾール系物質は、その製造方法が広く知られているが、その製造方法を、下記化学式1の化合物及び化学式2の化合物を一例として挙げて説明する。しかしながら、これら製造方法のみに限定されるものではない。
【0089】
最初の製造方法として、化学式1の化合物の製造方法を説明する(Macromol.Rapid Commun.2004,25,1410)。
【0090】
下記反応式1に示したように、出発物質として3,3’−ジアミノベンジジンとイソフタル酸を利用し、これに五酸化リン、メタンスルホン酸及びトリフルオロメタンスルホン酸を付加し、これらを窒素雰囲気下、150℃で熱処理すれば、化学式1の化合物を得ることができる。
【0091】
【化21】

【0092】
前記化学式1で表示される化合物の重量平均分子量は、40000〜44000であるため、このような分子量を持つようにnを調節する。
【0093】
第2の製造方法として、下記化学式2の化合物の製造方法を説明する(J.Poly.Sci.Part A:Polym.Chem,27,2815(1989))。
【0094】
下記反応式2に示したように、出発物質として3,3’−ジアミノベンジジンとメトキシイソフタル酸を利用し、これに五酸化リンとメタンスルホン酸を付加し、これらを窒素雰囲気下、140℃で熱処理すれば、化学式2の化合物を得ることができる。
【0095】
【化22】

【0096】
前記化学式2で表示される化合物の重量平均分子量は、40000〜45000であるため、このような分子量を持つようにnを調節する。
【0097】
本発明のポリベンズイミダゾール−塩基複合体は、熱的安定性及び伝導度に優れ、燃料電池用電解質膜の形成材料として有用である。これを酸のようなプロトン伝導体に含浸して電解質膜を形成する。前述した電解質膜を採用した高温無加湿条件下でも、発電性能の改善された燃料電池を製作できる。
【0098】
前記プロトン伝導体の非制限的な例としては、例えば、リン酸、ホスホン酸、C1−C20の有機ホスホン酸などを使用する。前記C1−C20の有機ホスホン酸の例として、例えば、エチルホスホン酸、メチルホスホン酸、ビニルホスホン酸などがある。
【0099】
前記プロトン伝導体の含有量は、電解質膜の総質量100質量部に対して、例えば、300〜1000質量部が使われる。本発明で使用する酸の濃度は特別に制限されないが、リン酸を使用する場合、85質量%のリン酸水溶液を使用し、リン酸含浸時間は80℃で2.5時間〜14時間の範囲等とすることが可能である。
【0100】
一方、本実施形態は、前述したポリベンズイミダゾール−塩基複合体と、下記化学式3で表示される第1ベンゾオキサジン系モノマーおよび下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、の重合の結果得られたポリベンゾオキサジン系化合物の架橋体を提供する。
【0101】
【化23】

・・・(化学式3)
【0102】
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【0103】
【化24】

・・・(化学式4)
【0104】
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または、置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群より選択される。
【0105】
前記ポリベンゾオキサジン系化合物の架橋体は、例えば、下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体と、の3成分重合生成物であることが望ましい。
【0106】
【数25】

・・・(化学式6)
【0107】
【化26】

・・・(化学式16)
【0108】
前記化学式16において、R2は、フェニル基である。
【0109】
本実施形態において、第1ベンゾオキサジン系モノマーと第2ベンゾオキサジン系モノマーとが共に使われる場合、前記第2ベンゾオキサジン系モノマーの含有量は、第1ベンゾオキサジン系モノマー100質量部を基準として、例えば、0.5〜50質量部であることが望ましく、特に1〜10質量部であることがさらに望ましい。
【0110】
このように、第1ベンゾオキサジン系モノマーは、架橋性化合物と重合されて電解質膜を形成するための高分子マトリックス形成用モノマーとして使われ、前記第2ベンゾオキサジン系モノマーは、電解質膜形成時に添加剤として使われる。前記化学式3及び化学式4でR2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示されるグループ(置換基)であることが望ましい。
【0111】
【化27】

【0112】
前記化学式4で、R3は、−C(CH3)2−、−C(CF3)2−、−C(=O)−、−SO2−、−CH2−、−C(CCl3)−、−CH(CH3)−、−CH(CF3)−である場合には、ベンゾオキサジン環を2つ含有する二官能性ベンゾオキサジン化合物であり、R3が下記化学式で表示されるグループである場合には、ベンゾオキサジン環を3つ含有する三官能性ベンゾオキサジン系化合物である。
【0113】
【化28】

【0114】
前記化学式3で表示される第1ベンゾオキサジン系モノマーの例として、例えば、下記化学式5〜化学式14で表示される化合物を挙げることができる。
【0115】
【化29】

・・・(化学式5)
【0116】
【化30】

・・・(化学式6)
【0117】
【化31】

・・・(化学式7)
【0118】
【化32】

・・・(化学式8)
【0119】
【化33】

・・・(化学式9)
【0120】
【化34】

・・・(化学式10)
【0121】
【化35】

・・・(化学式11)
【0122】
【化36】

・・・(化学式12)
【0123】
【化37】

・・・(化学式13)
【0124】
【化38】

・・・(化学式14)
【0125】
前記化学式4で表示される第2ベンゾオキサジン系モノマーの具体的な例として、例えば、下記化学式15〜化学式19で表示される化合物がある。
【0126】
【化39】

・・・(化学式15)
【0127】
【化40】

・・・(化学式16)
【0128】
【化41】

・・・(化学式17)
【0129】
【化42】

・・・(化学式18)
【0130】
【化43】

・・・(化学式19)
【0131】
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【0132】
【化44】

【0133】
前述した化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーと、前述したポリベンズイミダゾール−塩基複合体と、の重合生成物であるポリベンゾオキサジン系化合物の架橋体を合成する過程を説明すれば、次の通りである。
【0134】
前記化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、ポリベンズイミダゾール−塩基複合体とを、所定の混合比で混合する。
【0135】
前記ポリベンズイミダゾール−塩基複合体の含有量は、第1ベンゾオキサジン系モノマーと第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、例えば、5〜95質量部であることが望ましい。
【0136】
もし、ポリベンズイミダゾール−塩基複合体の含有量が5質量部未満ならば、リン酸が含浸されずにプロトン伝導性が落ち、ポリベンズイミダゾール−塩基複合体の含有量が95質量部を超過すれば、過剰リン酸の存在下で架橋体がポリリン酸に溶け、ガス透過が発生して望ましくない。
【0137】
前記化学式4で表示される第2ベンゾオキサジン系モノマーの含有量は、化学式3で表示される第1ベンゾオキサジン系モノマー100質量部を基準として、例えば、0.5〜50質量部であることが望ましく、特に1〜10質量部であることがさらに望ましい。
【0138】
もし、第2ベンゾオキサジン系モノマーの含有量が0.5質量部未満ならば、リン酸のようなプロトン伝導体を限界含浸量以上含有した場合、電解質膜の物理的及び化学的性質が欠け、50質量部を超過すれば、複合体の架橋密度の高集積化によってプロトン伝導体のドーピングが容易でなくて望ましくない。
【0139】
次いで、前記混合物の硬化反応を実施すれば、これらの相互架橋反応を通じてポリベンゾオキサジン系化合物の架橋体を得ることができる。すなわち、第1ベンゾオキサジン系モノマー及び第2ベンゾオキサジン系モノマーは、熱的開環重合を通じたポリベンズイミダゾール−塩基複合体と重合(硬化)して高分子マトリックスを形成し、前記重合反応は、順次の温度調節反応によって進み、硬化反応のための温度で最小限7時間以上の反応時間が確保されて始めて網状構造を形成できる。
【0140】
前記硬化反応の温度は、第1ベンゾオキサジン系モノマー、第2ベンゾオキサジン系モノマー、ポリベンズイミダゾール−塩基複合体の特性によって可変的であるが、例えば、50〜250℃の範囲内で実施する。もし、硬化反応の温度が50℃未満ならば、硬化反応自体が進まず、250℃範囲を超過すれば、副反応物質が得られて望ましくない。
【0141】
前記硬化反応時間は、硬化反応温度に依存的であるが、前述した温度範囲で7時間以上、特に、8〜20時間程度実施することが望ましい。
【0142】
前述した化学式1の第1ベンゾオキサジン系モノマーと、化学式2の第2ベンゾオキサジン系モノマーと架橋性化合物間の重合生成物であるポリベンゾオキサジン系化合物の架橋体の化学的及び物理的特性を説明すれば、次の通りである。
【0143】
本実施形態によって得たポリベンゾオキサジン系化合物の架橋体は、有機溶媒、酸、塩基にも溶けない熱硬化性特性がある。したがって、既存の高分子の分子量についての情報を得る最も一般的な方法であるGPC(Gel Permeation Chromatography)では、分子量測定が不可能である。
【0144】
本発明のポリベンゾオキサジン系化合物の架橋体は、ベンゾオキサジン系化合物の強い酸トラッピング能力を持ち、架橋により機械的特性向上及びポリリン酸に溶ける性質が除去されて、化学的に非常に安定している。これを利用して製造された電解質膜は、高温でリン酸保液能力に優れただけではなく機械的、化学的安定性が非常に改善される。また、本発明のポリベンゾオキサジン系化合物の架橋体は、他の重合開始剤や架橋剤を使用せずに単純な熱を通じた重合過程を経て得ることができ、別途の架橋剤をさらに必要としないため、工程上、量産面で望ましい。また、前記架橋体合成時に使われる出発物質が非常に安くてコストダウンできるという利点がある。
【0145】
特に、本発明のベンゾオキサジン系化合物の架橋体からなる電解質膜は、プロトン伝導度を高めるために、リン酸のようなプロトン伝導体の含浸量を増加させる場合にも機械的及び化学的安定性が優秀に保持されて、高温無加湿用燃料電池に有用に使われうる。
【0146】
本実施形態に係るベンゾオキサジン系化合物の架橋体を利用した電解質膜の製造過程を説明すれば、次の通りである。
【0147】
最初の方法によれば、前述した化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4の第2ベンゾオキサジン系モノマーのうち選択された一つ以上と、本実施形態に係るポリベンズイミダゾール−塩基複合体とをブレンドした後、これを50〜250℃程度、特に80〜220℃の範囲で硬化反応を実施する。次いで、これに酸のようなプロトン伝導体を含浸して、電解質膜を形成する。
【0148】
第2の方法によれば、化学式3で表示される第1ベンゾオキサジン系モノマーと、化学式4で表示される第2ベンゾオキサジン系モノマーのうち選択された一つ以上と、本実施形態に係るポリベンズイミダゾール−塩基複合体との混合物を利用して膜を形成する。
【0149】
前記膜を形成する方法としては、テープキャスティング法を利用することもでき、通例的なコーティング法を利用することもできる。前記コーティング法の例には、支持体上にドクターブレードを利用して前記混合物をキャスティングする方法を挙げることができる。ここで、ドクターブレードとしては、例えば250〜500μmギャップを持つものを使用する。
【0150】
もし、前記膜を形成する過程でドクターブレードを利用したキャスティング法を利用する場合には、硬化後、酸を含浸する工程以前に、支持体から電解質膜を分離して支持体を除去する工程がさらに実施される。このように支持体を除去しようとする場合には、60〜80℃の蒸溜水に浸漬する過程を経る。
【0151】
前記支持体としては、電解質膜を支持する役割を行えるものならばいずれも使用でき、支持体の例として、例えば、ガラス基板、ポリイミド、ポリエチレンテレフタレートフィルムなどを使用する。テープキャスティング法を利用する場合には、テープキャスティングされた膜を硬化する前に、ポリエチレンテレフタレートのような支持体から分離した後、硬化のためのオーブンに入れる。
【0152】
また、ベンゾオキサジン系モノマーとポリベンズイミダゾールとからなる混合物を利用して、膜をテープキャスティング法によって形成する場合、混合物をろ過する工程をさらに経ることができる。このように形成された膜を熱処理して硬化反応を実施した後、これを酸のようなプロトン伝導体に含浸して電解質膜を形成する。
【0153】
前記プロトン伝導体の含有量及び非制限的な例は、ポリベンズイミダゾール−塩基複合体を利用して電解質膜を形成する場合と同一である。
【0154】
前述したポリベンズイミダゾール−塩基複合体及びポリベンゾオキサジン系化合物の架橋体を利用して形成された電解質膜は、燃料電池の水素イオン伝導膜として使われうる。これを利用して燃料電池用電極−膜アセンブリを製造する過程を説明すれば、次の通りである。本発明で使用する用語である“電極−膜アセンブリ(MEA:Membrane and Electrode Assembly)”は、電解質膜を中心として、この両面に触媒層と拡散層とで構成された電極が順次に積層されている構造を称する。
【0155】
本実施形態に係るMEAは、触媒層を備えている電極を前記過程によって得た電解質膜の両面に位置させた後、高温及び高圧で接合して形成するか、または触媒金属を含有した電極触媒層形成用組成物を高分子膜上にコーティングした後、これに燃料拡散層を接合して形成できる。
【0156】
この時、前記接合のための加熱温度及び圧力は、水素イオン伝導膜が軟化する温度(ナフィオンの場合、約125℃)まで加熱した状態で、0.1〜3ton/cm2、特に、約1ton/cm2の圧力で加圧して実行する。
【0157】
次いで、前記電極−膜アセンブリにそれぞれバイポーラプレートを装着して、燃料電池を完成する。ここで、バイポーラとプレートは燃料供給用溝を持っており、集電体機能を持っている。
【0158】
前記電極膜アセンブリの製造時、触媒としては、例えば、白金(Pt)単独または金、パラジウム、ロジウム、イリジウム、ルテニウム、スズ、モリブデン、コバルト、クロムからなる群で選択された一種以上の金属と白金との合金あるいは混合物を使用する。
【0159】
本実施形態に係る燃料電池は、特別にその用途が限定されるものではないが、望ましい一面によれば、高分子電解質膜(Polymer Electrolyte Membrane:PEM)燃料電池として使われる。
【0160】
本実施形態に係る化学式1及び化学式2で使われる置換基の定義について説明すれば、次の通りである。
【0161】
本実施形態に係る化学式で前記非置換のC1−C20のアルキル基の具体的な例には、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、ヘキシルなどを挙げることができ、前記アルキル基のうち一つ以上の水素原子は、ハロゲン原子、ハロゲン原子で置換されたC1−C20のアルキル基(例:CCF3、CHCF2、CH2F、CCl3など)、ヒドロキシ基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボキシル基やその塩、スルホン酸基やその塩、燐酸やその塩、またはC1−C20のアルキル基、C2−C20アルケニル基、C2−C20アルキニル基、C1−C20のヘテロアリール基、C6−C20のアリール基、C6−C20のアリールアルキル基、C6−C20のヘテロアリール基、またはC6−C20のヘテロアリールアルキル基に置換されうる。
【0162】
本実施形態に係る化学式で、前記非置換のC2−C20のアルケニル基の具体的な例には、ビニレン、アリレンなどを挙げることができ、前記アルケニルのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換されうる。
【0163】
本実施形態に係る化学式で、前記非置換のC2−C20のアルキニル基の具体的な例には、アセチレンなどを挙げることができ、前記アルキニルのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換できる。
【0164】
本実施形態に係る化学式で、前記非置換のC1−C20のアルキレン基の具体的な例には、メチレン、エチレン、プロピレン、イソブチレン、sec−ブチレン、ペンチレン、iso−アミレン、ヘキシレンなどを挙げることができ、前記アルキレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換できる。
【0165】
本実施形態に係る化学式で、前記非置換のC2−C20のアルケニレン基の具体的な例には、アリル基などを挙げることができ、前記アルケニレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0166】
本実施形態に係る化学式で、前記非置換のC2−C20のアルキニレン基の具体的な例には、アセチレン基などを挙げることができ、前記アルキニレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0167】
本実施形態で使われるアリール基は、単独または組み合わせて使われ、一つ以上の環を含む炭素原子数6〜20個のカルボ環芳香族システムを意味し、前記環は、ペンダント方法で共に付着されるか、または融合されうる。アリールという用語は、フェニル、ナフチル、テトラヒドロナフチルのような芳香族ラジカルを含む。前記アリール基は、ハロアルキレン、ニトロ、シアノ、アルコキシ及び低級アルキルアミノのような置換基を持つことができる。また、前記アリール基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0168】
本実施形態で使われるアリーレン基は、単独または組み合わせて使われ、一つ以上の環を含む炭素原子数6〜20個のカルボ環芳香族システムを意味し、前記環はペンダント方法で共に付着されるか、または融合されうる。アリーレンという用語は、フェニレン、ナフチレン、テトラヒドロナフチレンのような芳香族ラジカルを含む。前記アリーレン基は、ハロアルキレン、ニトロ、シアノ、アルコキシ及び低級アルキルアミノのような置換基を持つことができる。また、前記アリーレン基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0169】
本実施形態で使われるアリールアルキル基は、前記定義されたようなアリール基で、水素原子のうち一部が低級アルキル、例えば、メチル、エチル、プロピルのようなグループで置換されたことを意味する。例えば、ベンジル、フェニルエチルなどがある。前記アリールアルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0170】
本実施形態で使われるヘテロアリール基は、N、O、PまたはSのうち選択された1、2または3個のヘテロ原子を含む1が芳香族有機化合物を意味する。前記ヘテロアリール基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0171】
本実施形態で使われるヘテロアリーレン基は、N、O、PまたはSのうち選択された1、2または3個のヘテロ原子を含む2価芳香族有機化合物を意味する。前記ヘテロアリーレンのうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0172】
本実施形態で使われるヘテロアリールアルキル基は、前記ヘテロアリール基の水素原子一部がアルキル基で置換されたことを意味する。前記ヘテロアリールアルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0173】
本実施形態で使われる炭素環基は、シクロヘキシル基のように5〜10個の炭素原子で構成された環基を称し、前記炭素環基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0174】
本実施形態で使われる炭素環アルキル基は、前記炭素環基の水素原子の一部がアルキル基で置換されたことを意味する。前記炭素環アルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【0175】
本実施形態で使われるヘテロ環基は、窒素、硫黄、リン、酸素のようなヘテロ原子を含有している5〜10原子からなる環基を称し、このようなヘテロ環基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じく置換可能である。
【0176】
本実施形態で使われるヘテロ環アルキル基は、前記ヘテロ環基の水素原子の一部がアルキル基で置換されたことを意味する。前記ヘテロ環アルキル基のうち一つ以上の水素原子は、前述したアルキル基の場合と同じ置換基で置換可能である。
【実施例】
【0177】
以下、本発明を、下記実施例を挙げて説明するが、本発明が下記実施例のみで限定されるものではない。
【0178】
<比較製造例1:ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール](PBI)の製造>
3,3’−ジアミノベンジジン(4.84g、22.6mmol)とイソフタル酸(3.76g、22.6mmol)を、P2O5(8g)、CF3SO3H(30mL)、CH3SO3H(30mL)の混合溶液に溶解した。
【0179】
反応混合物を150℃、窒素雰囲気下で30分間反応させた。反応が進むにつれて反応混合物は段々均質溶液に変わり、粘度の増加が観測された。高分子を微細粉末の形態で得るために、高分子溶液を熱い状態でペリスタルティックポンプ(peristaltic pump)を利用して、約1.5Lの水に注いだ。生成された粉末を数回水洗した。次いで、前記結果物を10%水酸化アンモニウム溶液とソックスレー装置を利用して、高分子内に存在する余分のリン酸を除去した。前記リン酸除去過程は、元素分析でリン残留成分が確認されなくなるまで実施した。次いで、得られた高分子を、減圧下、50℃で3日間乾燥させて約6gの高分子を得た。
【0180】
前記過程によって得たPBIを、メタノールを利用して沈殿を形成し、形成された沈殿をメタノールで洗浄してPBIを収得した。
【0181】
<合成例1:化学式6のベンゾオキサジン系モノマー(以下“BOA”と称する)の製造>
ターシャリーブチルフェーノル1mol、パラホルムアルデヒド2.2mol及びアニリン1.1molを混合し、これを100℃で1時間溶媒なしに攪拌して粗生成物を得た。
【0182】
前記粗生成物を1N NaOH水溶液に2回、蒸溜水に1回洗浄する過程を順次に実施した後、これを、硫酸マグネシウムを利用して乾燥した。次いで、前記結果物をろ過してから溶媒を除去し、かつ真空乾燥して、化学式6のベンゾオキサジン系モノマーを95%の収率で収得した。
【0183】
前記過程によって得た化学式6のベンゾオキサジン系モノマーは、NMRスペクトルを通じてその構造を確認した。
【0184】
<合成例2:化学式16(R2=フェニル基である)のベンゾオキサジン系モノマー(以下“HFA”と称する)の製造>
4,4’−ヘキサフルオロイソプロピリデンジフェーノル(4,4’−HFIDPH)1mol、パラホルムアルデヒド4.4mol及びアニリン2.2molを混合し、これを100℃で1時間溶媒なしに攪拌して粗生成物を得た。
【0185】
前記粗生成物を1N NaOH水溶液に2回、蒸溜水に1回洗浄する過程を順次に実施した後、これを、硫酸マグネシウムを利用して乾燥した。次いで、前記結果物をろ過してから溶媒を除去して真空乾燥し、化学式16(R2=フェニル基)ベンゾオキサジン系モノマーを96%の収率で収得した。
【0186】
前記過程によって得た化学式16のベンゾオキサジン系モノマーのNMRスペクトルを通じてその構造を確認した。
【0187】
<製造例1:ポリベンズイミダゾール−塩基複合体の製造>
前記比較製造例1によって製造されたPBI粉末5gにジメチルアセトアミド50gを付加して、10質量%のPBI溶液を得た。
【0188】
前記PBI溶液に炭酸ナトリウム0.5gを付加してから、これを80℃で1時間以上攪拌した。次いで、前記結果物をろ過してポリベンズイミダゾール−塩基複合体を得た。
【0189】
前記製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIにおいて、熱重量分析を実施して図1〜図3に示した。
【0190】
図1は、比較製造例1によって得たPBIに対するものであり、図2は、製造例1によって得たポリベンズイミダゾール−塩基複合体に対するものであり、図3は、図1及び図2を共に示したものである。
【0191】
これを参照すれば、製造例1のポリベンズイミダゾール−塩基複合体は、熱分解開始が比較製造例1のPBIとは異なって200℃で始まっており、200〜500℃で熱分解された。これに対し、比較製造例1のPBIは200〜500℃で急激に熱分解され、熱分解温度が500℃で開始された。
【0192】
前記製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIとにおいて、ゲル透過クロマトグラフィーを実施して分子量特性を分析し、その結果を下記の表1に表した。
【0193】
【表1】

【0194】
また製造例1によって得たポリベンズイミダゾール−塩基複合体と、前記比較製造例1によって得たPBIにおいて、核磁気共鳴分析を実施し、その結果をそれぞれ図4及び5に示した。
【0195】
図4及び図5を参照して、複合体形成前(図5)、形成後(図4)のピークパターンが明確に変わった。これをさらに説明すれば、複合体形成前13.2(NH、2H)、9.14(s、1H)、8.32(m、2H)、8.03(s、1H)、7.81(m、3H)のピークパターンが、9.14(s、1H)、8.32(d、2H、J=6。9Hz)、7.92(s、2H)、7.75(m、3H)、7.62(d、2H、8.3Hz)に変わった。このように複合体形成後に13.2ピークが消えた。そして、図4からポリベンズイミダゾール−塩基複合体の構造が確認できた。
【0196】
また、前記製造例1によって得たポリベンズイミダゾール−塩基複合体の誘導結合プラズマ(Inductively Coupled Plasma:ICP)分析を実施した。ICP分析データ比較のために比較製造例1によって得たPBIにリン酸を含浸させたサンプルに対するICP分析も共に実施した。
【0197】
分析結果、製造例1によって得たポリベンズイミダゾール−塩基複合体は、ナトリウムの含有量が約1170ppmと現れ、比較製造例1によって得たPBIにリン酸を含浸させたサンプルの場合は、金属であるナトリウムが検出されていない。
【0198】
<製造例2:ポリベンゾオキサジン系化合物の架橋体の合成>
前記合成例1によって得たBOA 6質量部と、合成例2によって得たHFA 0.3質量部と、製造例1によって得たポリベンズイミダゾール−塩基複合体(Mw:69,000、Mn:29,000)3.7質量部とをブレンドした後、これを20℃/Hrの昇温速度で220℃まで加熱した後、この温度で硬化反応を実施してポリベンゾオキサジン系化合物の架橋体を合成した。
【0199】
<実施例1:燃料電池の製作>
前記製造例1によって得たポリベンズイミダゾール−塩基複合体を、リン酸に80℃で2時間30分ほど含浸して、電解質膜を形成した。ここでリン酸の含浸量は、電解質膜総質量100質量部に対して約375質量部であった。
【0200】
攪拌容器に、カーボンに50質量%PtCoが担持された触媒1g及び溶媒NMP 3gを付加し、これを、モルタルを利用して攪拌してスラリーを作った。
【0201】
次いで、前記スラリーに5質量%のフッ化ポリビニリデンのNMP溶液を付加して、フッ化ポリビニリデンが0.025gになるように添加して10分間混合して、カソード触媒層形成用スラリーを製造した。
【0202】
カーボンペーパーを4×7cm2サイズに切ってガラス板上に固定させてドクターブレード(Sheen instrument社製)でコーティングするが、この時、ギャップ間隔は600μmに調節した。
【0203】
前記カーボンペーパーの上部に前記カソード触媒層形成用スラリーをコーティングし、これを常温で1時間乾燥し、80℃で1時間乾燥し、120℃で30分乾燥し、150℃で15分間乾燥してカソード(燃料極)を製造した。完成されたカソードでの白金コバルトローディング量は、2.2〜2.4mg/cm2値を持つ。
【0204】
アノードとしては、下記過程によって得た電極を利用した。
【0205】
攪拌容器に、カーボンに50質量%Ptが担持された触媒2g及び溶媒NMP 9gを付加し、これを、高速攪拌器を利用して2分間攪拌した。次いで、前記混合物に、フッ化ポリビニリデン0.05gをNMP 1gに溶解した溶液を付加して2分間さらに攪拌して、アノード触媒層形成用スラリーを製作する。これを、微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。完成されたアノードの白金ローディング量は1.1〜1.34mg/cm2値を持つ。
【0206】
前記カソードとアノードとの間に前記電解質膜を介在してMEAを製作した。そして、前記カソードとアノードとはリン酸の含浸なしに使用した。
【0207】
前記カソードとアノード間のガス透過を防止するために、主ガスケット用で200μm厚のテフロン(登録商標)膜と、サブガスケット用で20μm厚のテフロン(登録商標)膜を電極と電解質膜との界面に重ねて使用した。
【0208】
温度150℃、電解質膜に対して加湿しない条件で、アノードに水素(流速:100ccm)、カソードに空気(250ccm)を流通させて発電させ、電池特性の測定を行った。この時、燐酸をドーピングした電解質を使用するため、経時的に燃料電池の性能が向上するので、作動電圧が最高点に至るまでエージングした後、最終評価する。
【0209】
<実施例2:燃料電池の製作>
前記製造例2によって合成したポリベンゾオキサジン系化合物の架橋体を、85質量%リン酸に80℃で2時間30分ほど含浸して電解質膜を形成した。ここで、リン酸の含有量は、電解質膜総質量100質量部に対して約500質量部であった。
【0210】
PBI電極は、PBI及びPVDFをバインダーとして使用して触媒層スラリーを製作し、これを微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。完成された電極の白金ローディング量は1.0〜1.4mg/cm2値を持つ。リン酸陰イオンの吸着を防止して触媒活性を向上させることが知られた白金−コバルト合金を触媒として使用する場合には、フッ化ビニリデンのみをバインダーとして使用して触媒インキを製作し、微細多孔層がコーティングされたカーボンペーパー上にバーコーターでコーティングして製作した。この電極の白金ローディング量は2.2〜2.4mg/cm2値を持つ。前記電極の間にリン酸が含浸されたポリベンゾオキサジン系化合物の架橋体を導入して、膜電極組立体と燃料電池とを製作した。
【0211】
<比較例1>
電解質膜の製造時、前記製造例1によって得たポリベンズイミダゾール−塩基複合体の代わりに比較製造例1によって得たPBIを使用し、リン酸の含浸量が電解質膜総質量100質量部に対して約309質量部であることを除いては、実施例1と同じ方法によって燃料電池を製作し、その性能を評価した。
【0212】
前記実施例1及び比較例1による燃料電池において、性能評価結果は、図6及び図7にそれぞれ示した。
【0213】
これを参照すれば、図6の実施例1の燃料電池は、図7の比較例1の場合と比較して電流密度による電圧特性が改善されるということが分かった。
【0214】
また前記実施例1及び比較例1による燃料電池において、エージング速度を調べてその結果を図8に共に示した。
【0215】
図8を参照すれば、PBI複合体を使用する実施例1の燃料電池が、PBIを使用する比較例1の場合と比較して最高性能が22mVほど向上したことが分かった。
【0216】
前記実施例2及び比較例1による燃料電池において、電流密度によるセルポテンシャル変化を調べ、その結果を図9に示した。
【0217】
図9を参照して、同じ電極の触媒ローディング量で同じ活性化時間7日を基準として比較した。
【0218】
評価結果、実施例2の燃料電池は、比較例1の場合と比較してセルポテンシャル特性が改善されるということが分かった。
【0219】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明はかかる例に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【産業上の利用可能性】
【0220】
本発明は、燃料電池関連の技術分野に好適に用いられる。
【図面の簡単な説明】
【0221】
【図1】比較製造例1によって製造されたPBIの熱重量分析結果を示すグラフである。
【図2】製造例1によって製造されたPBIの熱重量分析結果を示すグラフである。
【図3】図1及び図2の結果を共に示したグラフである。
【図4】製造例1のポリベンズイミダゾール−塩基複合体の核磁気共鳴分析データを示すグラフである。
【図5】比較製造例1によるPBIの核磁気共鳴分析データを示すグラフである。
【図6】実施例1による燃料電池において、電流密度による電圧特性を示すグラフである。
【図7】比較例1による燃料電池において、電流密度による電圧特性を示すグラフである。
【図8】実施例1及び比較例1による燃料電池において、エージング速度を比較して示すグラフである。
【図9】実施例2及び比較例1による燃料電池において、電流密度によるセルポテンシャル変化を示すグラフである。
【特許請求の範囲】
【請求項1】
ポリベンズイミダゾール系物質と、塩基と、を含み、
ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない
ことを特徴とする、ポリベンズイミダゾール−塩基複合体。
【請求項2】
前記ポリベンズイミダゾール−塩基複合体は、
300MHzで作動する1H−NMRにより、ケミカルシフト9.14±0.5、8.32±0.5、7.92±0.5、7.75±0.5、7.62±0.5でピークが検出される
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項3】
前記ポリベンズイミダゾール−塩基複合体における前記塩基の含有量は、前記ポリベンズイミダゾール系物質100質量部を基準として、0.01〜20質量部である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項4】
前記ポリベンズイミダゾール−塩基複合体における前記塩基は、
炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム、炭酸ルビジウム、炭酸セシウム、炭酸アンモニウム及び炭酸水素アンモニウムからなる群より選択された一つ以上である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項5】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ分析によって測定される金属イオンの含有量は、300〜1200ppmである
ことを特徴とする、請求項4に記載のポリベンズイミダゾール−塩基複合体。
【請求項6】
前記ポリベンズイミダゾール−塩基複合体の熱分解開始温度は、180〜220℃である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項7】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量Mwと数平均分子量Mnとの比(Mw/Mn)は、2.1〜2.5である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項8】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000であり、
前記ポリベンズイミダゾール−塩基複合体の数平均分子量は、25000〜30000である
ことを特徴とする請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項9】
前記ポリベンズイミダゾール系物質は、
ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール]またはポリ(2,5−ベンズイミダゾール)である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール複合体。
【請求項10】
ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得て、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理して形成された、ポリベンズイミダゾール−塩基複合体。
【請求項11】
ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得る工程と、
前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理する工程と、
を含むことを特徴とする、ポリベンズイミダゾール−塩基複合体の製造方法。
【請求項12】
前記塩基は、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム、炭酸ルビジウム、炭酸セシウムからなる群で選択された一つ以上である
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項13】
前記有機溶媒は、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリドンからなる群で選択された一つ以上である
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項14】
前記熱処理は、60〜150℃で行われる
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項15】
請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体を含む、燃料電池用電解質膜。
【請求項16】
リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含む
ことを特徴とする、請求項15に記載の燃料電池用電解質膜。
【請求項17】
カソードと、アノードと、前記カソードと前記アノードとの間に設けられた電解質膜と、を備えた燃料電池において、
前記電解質膜は、請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体を含む
ことを特徴とする、燃料電池。
【請求項18】
(i)請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体と、
(ii)下記化学式3で表示される第1ベンゾオキサジン系モノマー及び下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、
の重合生成物である
ことを特徴とする、ポリベンゾオキサジン系化合物の架橋体。
【化1】

・・・(化学式3)
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、
R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【化2】

・・・(化学式4)
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、
R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群から選択される。
【請求項19】
前記ポリベンズイミダゾール−塩基複合体の含有量は、
前記第1ベンゾオキサジン系モノマーと前記第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、5〜95質量部である
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項20】
前記化学式3で表示される第1ベンゾオキサジン系モノマーは、
下記化学式5〜化学式14で表示される化合物の中から選択された一つである
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化3】

・・・(化学式5)
【化4】

・・・(化学式6)
【化5】

・・・(化学式7)
【化6】

・・・(化学式8)
【化7】

・・・(化学式9)
【化8】

・・・(化学式10)
【化9】

・・・(化学式11)
【化10】

・・・(化学式12)
【化11】

・・・(化学式13)
【化12】

・・・(化学式14)
【請求項21】
前記化学式4で表示される第2ベンゾオキサジン系モノマーは、
下記化学式15〜化学式19で表示される化合物の中から選択された一つである
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化13】

・・・(化学式15)
【化14】

・・・(化学式16)
【化15】

・・・(化学式17)
【化16】

・・・(化学式18)
【化17】

・・・(化学式19)
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【化18】

【請求項22】
前記ポリベンゾオキサジン系化合物の架橋体は、
下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体との3成分による重合生成物であることを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化19】

・・・(化学式6)
【化20】

・・・(化学式16)
前記化学式16において、R2は、フェニル基である。
【請求項23】
ポリベンズイミダゾール−塩基複合体と、化学式3で表示される第1ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、の重合生成物である
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項24】
前記第2ベンゾオキサジン系モノマーのうち少なくとも一つの含有量は、
前記第1ベンゾオキサジン系モノマー100質量部を基準として、0.5〜50質量部である
ことを特徴とする、請求項23に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項25】
請求項18に記載のポリベンゾオキサジン系化合物の架橋体を含む電解質膜。
【請求項26】
リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含む
ことを特徴とする、請求項25に記載の電解質膜。
【請求項27】
請求項18に記載のポリベンゾオキサジン系化合物の架橋体を含む電解質膜を備えた燃料電池。
【請求項1】
ポリベンズイミダゾール系物質と、塩基と、を含み、
ケミカルシフト12〜15ppmで、前記ポリベンズイミダゾール系物質のイミダゾール環のNHに該当するピークが現れない
ことを特徴とする、ポリベンズイミダゾール−塩基複合体。
【請求項2】
前記ポリベンズイミダゾール−塩基複合体は、
300MHzで作動する1H−NMRにより、ケミカルシフト9.14±0.5、8.32±0.5、7.92±0.5、7.75±0.5、7.62±0.5でピークが検出される
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項3】
前記ポリベンズイミダゾール−塩基複合体における前記塩基の含有量は、前記ポリベンズイミダゾール系物質100質量部を基準として、0.01〜20質量部である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項4】
前記ポリベンズイミダゾール−塩基複合体における前記塩基は、
炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム、炭酸ルビジウム、炭酸セシウム、炭酸アンモニウム及び炭酸水素アンモニウムからなる群より選択された一つ以上である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項5】
前記ポリベンズイミダゾール−塩基複合体の誘導結合プラズマ分析によって測定される金属イオンの含有量は、300〜1200ppmである
ことを特徴とする、請求項4に記載のポリベンズイミダゾール−塩基複合体。
【請求項6】
前記ポリベンズイミダゾール−塩基複合体の熱分解開始温度は、180〜220℃である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項7】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量Mwと数平均分子量Mnとの比(Mw/Mn)は、2.1〜2.5である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項8】
前記ポリベンズイミダゾール−塩基複合体の重量平均分子量は、65000〜70000であり、
前記ポリベンズイミダゾール−塩基複合体の数平均分子量は、25000〜30000である
ことを特徴とする請求項1に記載のポリベンズイミダゾール−塩基複合体。
【請求項9】
前記ポリベンズイミダゾール系物質は、
ポリ[2,2’−(m−フェニレン)−5,5’−ビベンズイミダゾール]またはポリ(2,5−ベンズイミダゾール)である
ことを特徴とする、請求項1に記載のポリベンズイミダゾール複合体。
【請求項10】
ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得て、前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理して形成された、ポリベンズイミダゾール−塩基複合体。
【請求項11】
ポリベンズイミダゾール系物質を有機溶媒に溶解してポリベンズイミダゾール溶液を得る工程と、
前記ポリベンズイミダゾール溶液に塩基を付加及び混合した後、前記塩基の付加された前記ポリベンズイミダゾール溶液を熱処理する工程と、
を含むことを特徴とする、ポリベンズイミダゾール−塩基複合体の製造方法。
【請求項12】
前記塩基は、炭酸ナトリウム、炭酸水素ナトリウム、炭酸カルシウム、炭酸水素カルシウム、炭酸リチウム、炭酸ルビジウム、炭酸セシウムからなる群で選択された一つ以上である
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項13】
前記有機溶媒は、ジメチルアセトアミド、ジメチルホルムアミド、ジメチルスルホキシド、N−メチルピロリドンからなる群で選択された一つ以上である
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項14】
前記熱処理は、60〜150℃で行われる
ことを特徴とする、請求項11に記載のポリベンズイミダゾール−塩基複合体の製造方法。
【請求項15】
請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体を含む、燃料電池用電解質膜。
【請求項16】
リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含む
ことを特徴とする、請求項15に記載の燃料電池用電解質膜。
【請求項17】
カソードと、アノードと、前記カソードと前記アノードとの間に設けられた電解質膜と、を備えた燃料電池において、
前記電解質膜は、請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体を含む
ことを特徴とする、燃料電池。
【請求項18】
(i)請求項1〜請求項10のうちいずれか1項に記載のポリベンズイミダゾール−塩基複合体と、
(ii)下記化学式3で表示される第1ベンゾオキサジン系モノマー及び下記化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択された一つ以上と、
の重合生成物である
ことを特徴とする、ポリベンゾオキサジン系化合物の架橋体。
【化1】

・・・(化学式3)
前記化学式3において、R1は、水素、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC4−C20のシクロアルキル基、置換もしくは非置換のC2−C20のヘテロ環基、ハロゲン原子、ヒドロキシ基、またはシアノ基であり、
R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基である。
【化2】

・・・(化学式4)
前記化学式4において、R2は、置換もしくは非置換のC1−C20のアルキル基、置換もしくは非置換のC2−C20のアルケニル基、置換もしくは非置換のC2−C20のアルキニル基、置換もしくは非置換のC6−C20のアリール基、置換もしくは非置換のC7−C20のアリールアルキル基、置換もしくは非置換のC2−C20のヘテロアリール基、置換もしくは非置換のC2−C20のヘテロアリールアルキル基、置換もしくは非置換のC4−C20の炭素環基、置換もしくは非置換のC4−C20の炭素環アルキル基、置換もしくは非置換のC2−C20のヘテロ環基、または置換もしくは非置換のC2−C20のヘテロ環アルキル基であり、
R3は、置換もしくは非置換のC1−C20のアルキレン基、置換もしくは非置換のC2−C20のアルケニレン基、置換もしくは非置換のC2−C20のアルキニレン基、置換もしくは非置換のC6−C20のアリーレン基、置換もしくは非置換のC2−C20のヘテロアリーレン基、−C(=O)−、−SO2−からなる群から選択される。
【請求項19】
前記ポリベンズイミダゾール−塩基複合体の含有量は、
前記第1ベンゾオキサジン系モノマーと前記第2ベンゾオキサジン系モノマーの中から選択された一つ以上の総質量100質量部を基準として、5〜95質量部である
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項20】
前記化学式3で表示される第1ベンゾオキサジン系モノマーは、
下記化学式5〜化学式14で表示される化合物の中から選択された一つである
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化3】

・・・(化学式5)
【化4】

・・・(化学式6)
【化5】

・・・(化学式7)
【化6】

・・・(化学式8)
【化7】

・・・(化学式9)
【化8】

・・・(化学式10)
【化9】

・・・(化学式11)
【化10】

・・・(化学式12)
【化11】

・・・(化学式13)
【化12】

・・・(化学式14)
【請求項21】
前記化学式4で表示される第2ベンゾオキサジン系モノマーは、
下記化学式15〜化学式19で表示される化合物の中から選択された一つである
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化13】

・・・(化学式15)
【化14】

・・・(化学式16)
【化15】

・・・(化学式17)
【化16】

・・・(化学式18)
【化17】

・・・(化学式19)
前記化学式15〜化学式19において、R2は、フェニル基、−CH2−CH=CH2、または下記置換基群で表示される置換基である。
【化18】

【請求項22】
前記ポリベンゾオキサジン系化合物の架橋体は、
下記化学式6で表示される第1ベンゾオキサジン系モノマーと、下記化学式16で表示される第2ベンゾオキサジン系モノマーと、前記ポリベンズイミダゾール−塩基複合体との3成分による重合生成物であることを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【化19】

・・・(化学式6)
【化20】

・・・(化学式16)
前記化学式16において、R2は、フェニル基である。
【請求項23】
ポリベンズイミダゾール−塩基複合体と、化学式3で表示される第1ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、化学式4で表示される第2ベンゾオキサジン系モノマーの中から選択される少なくとも一つと、の重合生成物である
ことを特徴とする、請求項18に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項24】
前記第2ベンゾオキサジン系モノマーのうち少なくとも一つの含有量は、
前記第1ベンゾオキサジン系モノマー100質量部を基準として、0.5〜50質量部である
ことを特徴とする、請求項23に記載のポリベンゾオキサジン系化合物の架橋体。
【請求項25】
請求項18に記載のポリベンゾオキサジン系化合物の架橋体を含む電解質膜。
【請求項26】
リン酸、ホスホン酸及びC1−C20の有機ホスホン酸の中から選択された一つ以上のプロトン伝導体をさらに含む
ことを特徴とする、請求項25に記載の電解質膜。
【請求項27】
請求項18に記載のポリベンゾオキサジン系化合物の架橋体を含む電解質膜を備えた燃料電池。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2009−91580(P2009−91580A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2008−264531(P2008−264531)
【出願日】平成20年10月10日(2008.10.10)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成20年10月10日(2008.10.10)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】SAMSUNG ELECTRONICS CO.,LTD.
【住所又は居所原語表記】416,Maetan−dong,Yeongtong−gu,Suwon−si,Gyeonggi−do 442−742(KR)
【Fターム(参考)】
[ Back to top ]

