ポリペプチド、ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物
【課題】大腸粘膜常在細胞に寄生し粘膜免疫調節作用を有する常在細菌種および細菌種由来誘導因子を解明し、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物を提供する。
【解決手段】大腸粘膜免疫制御ポリペプチドは、特定のアミノ酸配列、特定のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする。
【解決手段】大腸粘膜免疫制御ポリペプチドは、特定のアミノ酸配列、特定のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、大腸粘膜組織の腸管免疫系へ影響を与えるポリペプチド、該ポリペプチドの生産方法、および、大腸粘膜組織の免疫制御組成物に関する。
【背景技術】
【0002】
消化管、呼吸器などを被覆する粘膜には多数の微生物が棲息している。これら微生物の多くは真正細菌であり、一過性に生体に侵入し病原性を発現するものと区別して、常在細菌叢と称される。常在細菌叢の構成菌種は棲息部位によって大きく異なるが、腸内細菌叢が最も多くの細菌種によって構成されている。腸内細菌叢は、宿主の未消化食餌成分を代謝して、単糖、オリゴ糖、アミノ酸、ビタミンおよび短鎖脂肪酸を宿主に供給する。さらに、腸管粘膜上皮の増殖分化、血管新生、腸管神経叢の分化および腸管病原細菌に対する微生物バリアーとして、宿主の生存にとってかけがえのない有益な生理機能を数多く担うことが分かっている。
【0003】
微生物感染をはじめとしたストレス侵襲に対する定常時の抵抗力として、腸管粘膜では常在細菌叢の刺激を受け、エフェクターT細胞を中心とした免疫応答が恒常的に誘導、維持されている。これは粘膜における「生理的炎症」と呼ばれる。エフェクターT細胞が活性化した場合、生理的炎症下では、制御性T細胞(誘導性Treg(iTreg))が機能する。制御性T細胞は、エフェクターT細胞の場合と同様に、腸管細菌叢の刺激を受けて誘導、維持されていると考えられている。その為、腸内細菌叢の構成異常または該構成異常に起因するエフェクターT細胞の過剰活性化が、炎症性腸疾患、肥満、がん、関節リウマチまたはI型糖尿病等、様々な疾病の発症や重症化と密接に関わっていることが明らかになってきた(非特許文献1ないし非特許文献3参照)。
【0004】
さらに、腸内細菌叢ゲノムの網羅的解析手法の進歩に伴い、腸内細菌叢の腸管免疫系への影響についても次第に明らかとなってきており、例えば、非特許文献4ないし非特許文献8に記載されている。非特許文献4および非特許文献5には、フィルミクテス(Firmicutes)門に属するセグメント細菌(Segmented filamentous bacteria)が、免疫グロブリンA(IgA)に係る免疫応答の発達、および腸上皮細胞間リンパ球の発達に資することが記載されている。また、非特許文献6には、同細菌がヘルパーT細胞のTh17細胞の細胞分化に資することが記載されている。非特許文献7および非特許文献8には、polysaccharide antigen A(PSA)という莢膜多糖を産生する腸内細菌バクテロイデス・フラジリス(Bacteroides fragilis)が、制御性サイトカインインターロイキン−10(IL−10)を産生する制御性T 細胞の分化に資することが報告されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Turnbaugh PJ, Ley RE, Mahowald MA, Margrini V, Mardis ER, Gordon JI.、2006、An obesity−associated gut microbiome with increased capacity for energy harvest.、Nature 444、1027−1031
【非特許文献2】Wu HJ, Ivanov II, Darce J, Hattori K, Mathis D, et al.、2010、Gut−residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells.、Immunity 32、815−827
【非特許文献3】Wen L, Ley RE, Yu P, Gordon JI, Chervonsky AV, et al.、2008、 Innate immunity and intestinal microbiota in the development of Type 1 diabetes.、Nature 455、1109−1113
【非特許文献4】Talham GL, Jiang HQ, Bos NA, Cebra JJ.、1999、Segmented filamentous bacteria are potent stimuli of a physiologically normal state of the murine gut mucosal immune system.、Infection and Immunity 67、1992−2000
【非特許文献5】Umesaki Y, Okada Y, Matsumoto S, Imaoka A, Setoyama H.、1995、Segmented filamentous bacteria are indigenous intestinal bacteria that activate intraepithelial lymphocytes and induce MHC class II molecules and fucosyl asialo GM 1 glycolipids on the small intestinal epithelial cells in ex−germ−free mouse.、Microbiol. Immunol. 39、555−562
【非特許文献6】Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, et al.、2009、Induction of intestinal Th 17 cells by segmented filamentous bacteria.、Cell 139、1−14
【非特許文献7】Mazmanian SK, Round JL, Kasper DL.、2008、A microbial symbiosis factor prevents intestinal inflammatory disease.、Nature 453、620−625
【非特許文献8】Round JL, Mazmanian SK.、2010、Inducible Foxp 3+ regulatory T−cell development by a commensal bacterium of the intestinal microbiota.、Proc. Natl. Acad. Sci. USA. 107、12204−12209
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、前述の非特許文献4ないし非特許文献8において、これらに記載されているセグメント細菌、プロバイオティクスまたはバクテロイデス・フラジリスのいずれについても、粘膜内免疫担当細胞に直接的に取り込まれているわけではない。また、これらの細菌の産生するどのような菌体成分またはエフェクター分子が、宿主免疫系細胞のいかなる生体分子との相互作用を端緒とし、腸管免疫応答の発達、機能分化または成熟を担保しているのかは全く明らかになっていない。
【0007】
また、近年、粘膜免疫系に係る制御性T細胞が粘膜炎症の調整役として重要であり、さらには制御性T細胞を利用することにより、粘膜炎症性疾患の発症を予防および治療できることが明らかとなってきている。これらを考慮すると、制御性T細胞が含まれる粘膜免疫系がどのように腸管細菌叢と作用しているのかを解明すること、特に、大腸粘膜常在細胞に直接的に作用する腸管常在細菌種および細菌種由来誘導因子を解明することは極めて重要である。
【0008】
本発明は上記事情に鑑みてなされたものであり、大腸粘膜常在細胞に寄生し粘膜免疫制御作用を有する常在細菌種および細菌種由来誘導因子を解明し、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成する為、本発明者らが鋭意研究を行った結果、腸管粘膜における免疫応答発動の端緒となる大腸粘膜常在マクロファージには、平素より特定の環境細菌(特にプロテオバクテリア(Proteobacteria)門の環境細菌種)が寡占的に寄生していることを16Sリボソーム遺伝子法によって見出した。さらに、当該環境細菌のうち、ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)に着目し、標準株であるステノトロフォモナス・マルトフィリアATCC13636株を用い、マクロファージ細胞株RAW264.7に感染させた結果、制御性サイトカインインターロイキン−10の産生が亢進することを見出した。
【0010】
次いで本発明者らは、無菌マウスに同菌を経口感染し、ノトビオートマウスを作製した。ノトビオートマウスでは大腸粘膜常在マクロファージにおける制御性サイトカインインターロイキン−10の産生亢進のみならず、Foxp3+制御性T細胞応答までも誘導されることを見出した。さらには、25kDa(kilodalton)タンパク質を含むステノトロフォモナス・マルトフィリア培養上清濃縮画分においても、マクロファージ細胞株RAW264.7での制御性サイトカインインターロイキン−10の産生を亢進させる作用があることを発見し、MALDI−TOF MS解析の結果、同25kDaタンパク質は機能未知のsmlt2713遺伝子産物であることが明らかとなった。すなわち、ステノトロフォモナス・マルトフィリアから産生される25kDa smlt2713タンパク質が、大腸粘膜免疫の機能分化および成熟をつかさどる、大腸粘膜常在マクロファージのシンバイオシス因子である可能性が示唆された(実施例参照)。
【0011】
そこで、本発明の第1の態様に係るポリペプチドは、配列番号1に記載のアミノ酸配列、または、前記配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする。
【0012】
好ましくは、前記ポリペプチドによる前記大腸粘膜組織での免疫制御作用は、制御性サイトカインインターロイキン−10の産生亢進、および/または、Foxp3+制御性T細胞応答の誘導であることを特徴とする。
【0013】
本発明の第2の態様に係るポリペプチドの生産方法は、
ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を培養する培養工程と、
前記培養工程によって得られた菌体培養物から、第1の態様に係るポリペプチドを抽出する抽出工程と、
を含むことを特徴とする。
【0014】
本発明の第3の態様に係る大腸粘膜組織の免疫制御組成物は、第1の態様に係るポリペプチド、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、前記ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有することを特徴とする。
【発明の効果】
【0015】
本発明によれば、大腸粘膜常在細胞に寄生し粘膜免疫調節作用を有する常在細菌種および細菌種由来誘導因子が解明され、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物が提供される。
【図面の簡単な説明】
【0016】
【図1】実施例2に係るステノトロフォモナス・マルトフィリアの影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。
【図2】実施例2に係るFACSCaliburフローサイトメータにより測定したFoxp3+T細胞の割合を示す図である。
【図3】実施例4に係るSDS−PAGEの結果を示す図である。
【図4】実施例4に係るMALDI−TOF MS解析による結果を示す図である。
【図5】実施例4に係るMascot解析による結果を示す図である。
【図6】実施例5に係る25kDa smlt2713の影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0018】
(ポリペプチド)
本発明の実施の形態1は、特定のアミノ酸配列を有する粘膜免疫制御ポリペプチドに関する。具体的には、例えば、配列番号1に記載のアミノ酸配列を有する粘膜免疫制御ポリペプチド(ステノトロフォモナス・マルトフィリアATCC13636におけるsmlt2713遺伝子産物)を挙げることができる。なお、配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらす粘膜免疫制御ポリペプチドでも構わない。本明細書において、「免疫制御作用」とは、具体的には、主に、制御性サイトカインインターロイキン−10の産生亢進、およびFoxp3+制御性T細胞応答の誘導を示す。
【0019】
本実施の形態1に係るポリペプチドは、後の実施の形態2において詳細に述べるステノトロフォモナス・マルトフィリアを用いる方法により産生しても構わないが、ポリペプチド合成法または遺伝子工学的方法等の、当該技術分野における人工的な常法によって産生してもよい。
【0020】
例えば、ポリペプチド合成法の場合、液相法または固相法を挙げることができる。液相法は、反応を溶液状態で行い、反応混合物から生成物を単離精製し、この生成物を中間体として次のペプチド伸長反応に用いる方法である。一方固相法は、反応溶媒に対して不溶の固相担体にアミノ酸を結合させ、このアミノ酸に順次縮合反応を行い、ペプチド鎖を伸長させていく方法である。
【0021】
具体的に、ポリペプチド合成は、まず、カルボキシル基を保護したアミノ酸にアミノ基を保護したアミノ酸を脱水縮合させ、ペプチド結合を形成させる。次に、アミノ保護基を除去後、遊離したアミノ基に次のアミノ基保護アミノ酸をC末端からN末端に向かって一つずつ順次延長させていく。脱水縮合反応では、カルボキシル基を活性化し、結合させようとするアミノ基と反応させる。活性化にはジシクロへキシカルボジイミド(DCC)法、活性エステル法、酸無水物法またはアジド法等が挙げられるが、その反応性の高さ、ラセミ化およびその他の副反応を考慮し、適宜選択すればよい。縮合反応時の副反応を防止する為、アミノ酸のアミノ基、カルボキシル基および/または側鎖の官能基には保護基が導入される。これらの保護基は、縮合反応での条件において安定であり、必要な時には速やかに除去可能であるものが好ましい。また、アミノ基の保護基とカルボキシル基の保護基とは、互いに選択的に除去可能であることが好ましい。
【0022】
アミノ基の保護基としては、例えば、ベンジルオキシカルボニル(Bz)、t−ブチルオキシカルボニル(Boc)、p−ビフェニルイソプロピロオキシカルボニルまたは9−フルオレニルメチルオキシカルボニル(Fmoc)等を挙げることができる。カルボキシ基の保護基としては、例えば、アルキルエステルまたはベンジルエステル等を形成し得る基を挙げることができる。
【0023】
ただし、固相法の場合、C末端のカルボキシル基はクロロトリチル樹脂、クロルメチル樹脂、オキシメチル樹脂またはp−アルコキシベンジルアルコール樹脂等の担体に結合している為、縮合反応はカルボジイミド等の縮合剤の存在下、またはN保護アミノ酸活性エステルもしくはペプチド活性エステルを用いて実施すると好ましい。縮合反応終了後、保護基は除去される。固相法の場合、ペプチドのC末端と樹脂との結合も切断される。その後、化学合成されたペプチドは、例えば、イオン交換クロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相クロマトグラフィー、アフィニティークロマトグラフィー、エドマン分解法またはガスクロマトグラフィー質量分析(GC−MS)等により精製、解析をすることが可能である。
【0024】
遺伝子工学的方法では、本実施の形態1に係るポリペプチドをコードするsmlt2713遺伝子を用いる。smlt2713遺伝子は、当該技術分野の当業者であれば常法を用い、ステノトロフォモナス・マルトフィリアの種々の株(前述した標準株であるステノトロフォモナス・マルトフィリアATCC13636であってもK279aでも構わない)からDNAの分離精製を行うことが可能である。また、例えば、DNA合成キット等を使用し人工的にDNA合成を行っても構わない。
【0025】
その後、合成したsmlt2713遺伝子と、当該遺伝子を宿主細胞内で発現させる為の種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサーおよび/または発現レベルを制御する種々のシスエレメント等)とを用い、発現用遺伝子構築物を有する組換えベクターを宿主細胞に応じて構築する。このようにして構築した組換えベクターは、例えば、所定の宿主細胞に導入し、所定の条件で培養する。これにより、本実施の形態1に係るポリペプチドの、宿主細胞内での発現、産生および抽出が可能となる。
【0026】
このようなペプチド合成法または遺伝子工学的方法を用いる方法によって産生した本実施の形態1に係る粘膜免疫制御ポリペプチドは、薬学的に許容される該ポリペプチドの誘導体等も含め、後に述べる実施の形態3に係る大腸粘膜組織の免疫制御組成物の有効成分として利用することが可能となる。
【0027】
(ポリペプチドの生産方法)
本発明の実施の形態2は、前述の実施の形態1に係る粘膜免疫制御ポリペプチドの生産方法に関する。具体的には、ステノトロフォモナス・マルトフィリアを培養する培養工程と、該培養工程によって得られた菌体培養物(好ましくは、培養上清を分画濃縮(実施例参照))から、実施の形態1に係る粘膜免疫制御ポリペプチドを抽出する抽出工程とを含む。
【0028】
培養培地および培養方法は、静置培養、pHを一定にした中和培養、回転培養または連続培養等、当該ステノトロフォモナス・マルトフィリアが良好に生育する条件であれば特に制限はない。なお、ステノトロフォモナス・マルトフィリアの培養条件の一例については実施例を参照されたい。培養工程において、ステノトロフォモナス・マルトフィリア種の菌株を大量に培養し、当該技術分野におけるタンパク質抽出の常法(例えば、細胞破砕法等)を用いることにより、産生されたポリペプチド(smlt2713遺伝子産物)を容易に得ることが可能となる。また、実施例にて詳細に述べる方法を用い、smlt2713遺伝子産物を得ても構わない。
【0029】
(大腸粘膜組織の免疫制御組成物)
本発明の実施の形態3は、前述の実施の形態1に係る粘膜免疫制御ポリペプチドを利用した組成物に関する。具体的には、実施の形態1に係る粘膜免疫制御ポリペプチド、該ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、該ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有する、大腸粘膜組織の免疫制御組成物である。
【0030】
本明細書において、「大腸粘膜組織の免疫制御組成物」とは、具体的には、例えば、大腸粘膜組織の免疫を制御、調節すること(主に、制御性サイトカインインターロイキン−10の産生亢進およびFoxp3+制御性T細胞応答の誘導)ができる、食品または医薬品等を挙げることができる。
【0031】
さらに詳細には、食品の場合、例えば、大腸組織の免疫系疾病である炎症性腸疾患等の予防、改善および治療をコンセプトとした、健康食品、サプリメントまたは特定保健用食品等を挙げることができる。医薬品の場合、例えば、液剤、錠剤、顆粒剤、細粒剤、粉剤、タブレットまたはカプセル剤等を挙げることができ、経口投与の投与形態が好ましい。
【0032】
なお、本実施の形態3に係る大腸粘膜組織の免疫制御組成物において、種々の食品または医薬品等を調製する為、薬学的に許容される他の組成物を適宜組み合わせてもよいし、当該ポリペプチドおよび当該組成物を誘導体または塩の形態として使用しても構わない。誘導体としては、ポリペプチドの一部置換体または付加化合物等のポリペプチド誘導体を挙げることができる。さらに具体的には、例えば、カルボキシル基をアミド化またはアシル化した誘導体を例示することができる。塩の形態としては、塩酸塩、硝酸塩もしくは臭化水素酸塩等の無機酸塩、または、p−トルエンスルホン酸塩、メタスルホン酸塩、フマル酸塩、コハク酸塩もしくは乳酸塩等の有機酸塩等を挙げることができる。
【0033】
これらの食品または医薬品等において、前述の実施の形態1に係るポリペプチドの有効成分としての含有量および一日における投与量は、当該組成物等の種類によって適宜調節することが可能である。また、医薬等への直接的な利用だけでなく、大腸粘膜組織の免疫制御におけるシンバイオシス因子の作用機構を利用することにより、機能性ナノ磁性微粒子(半田ビーズ)を利用したシンバイオシス因子に対する生体内標的分子の探索、さらにはシンバイオシス因子を利用した粘膜免疫強化法の開発、ならびに粘膜炎症性疾患予防、改善および治療法の研究開発に役立つことが示唆される。
【実施例】
【0034】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものではない。
【0035】
(実施例1)
本実施例1では、大腸粘膜組織常在マクロファージ内に棲息する細菌種の特定に係る実施例について説明する。
【0036】
大腸粘膜常在マクロファージを調製する為、まず、雌8週齢のBALB/cマウス(日本クレア)を4週間飼育し、馴化させた。馴化マウスを炭酸ガス吸入によって安楽死させた後、クリーンベンチ内で滅菌眼科用ハサミを用いて開腹し、大腸組織を無菌的に摘出した。次いで、滅菌RPMI1640 培地(ナカライ)で湿潤させた滅菌キムタオル(登録商標、クレシア)上に置き、大腸組織に付着した腸間膜および脂肪組織を可能な限り慎重に除去した。さらに、腸間膜付着部に沿って縦切開を加えた後、冷却滅菌PBSで洗浄し、切開大腸に付着する腸管腔内容物(主に糞便および粘液)を、可能な限り除去した。
【0037】
次に、5mM EDTA(pH8.0)を含む滅菌RPMI1640培地20mlを添加した滅菌三角フラスコ内に、前述の大腸組織を移し、反応温度37℃で20分間スターラーを用いて撹拌し、大腸粘膜表在性の粘液層および上皮層を可能な限り除去した。さらに、滅菌RPMI1640培地(ナカライ)20mlのみを含む滅菌三角フラスコ内において、同様の撹拌操作を10分間行い、大腸組織に残存するEDTAを除去した。その後、酵素処理の効率を高める為、1mg/mlのコラゲナーゼS−1(新田ゼラチン)と2%ウシ胎児血清(2%FBS)とを含有する滅菌RPMI1640培地10mlを添加した滅菌シンチレーションバイアルに、前述の大腸組織を移し換え、滅菌眼科用ハサミを用いて、5mm程度に細かく細切した。
【0038】
当該バイアルに対し、37℃においてスターラーを用いて穏やかな攪拌操作を加えた。撹拌開始30分後、同バイアル内の上清を滅菌駒込ピペットで慎重に吸い取り、滅菌50ml遠沈管(BDファルコン)に、大腸粘膜固有層から遊出した細胞画分として回収し、氷冷下で静置した。さらに、前述のコラゲナーゼ処理を再度繰り返し、その上清を1回目のサンプルと合わせた。
【0039】
このように回収した細胞浮遊液を含む遠沈管を1300rpm、10分、4℃の条件下で遠心にかけ、上澄みを捨て、遠沈管底に残った細胞沈渣を慎重にほぐした。これに氷冷RPMI1640培地を30ml加え、細胞沈渣を均等に撹拌後、1300 rpm、10分、4℃の条件下の遠心操作を繰り返し、細胞洗浄操作とした。大腸単核球画分は、滅菌パーコール(GEヘルスケア)の75%/40%不連続密度勾配遠心(2000 rpm、20分、室温)で無菌的に回収した。回収した大腸単核球画分は、冷却2%FBS含有RPMI1640培地を用いて2回洗浄後、トリパンブルー法で生細胞数を算定した。107/mlの濃度になるように滅菌2%FBS/PBSで浮遊させた大腸単核球画分に、100倍希釈Fc−block抗体(精製抗マウスCD16/32モノクローナル抗体(BD Bioscience))を含む滅菌2%FBS/PBSで40倍に希釈したPE標識抗マウスCD11bモノクローナル抗体(BD Bioscience)、APC標識抗マウスCD11cモノクローナル抗体(BD Bioscience)、および、Pacific Blue標識抗マウスCD45モノクローナル抗体(BD Bioscience)を、それぞれ最終濃度が1μgになるように添加し、氷冷、遮光下で30分間無菌的に反応させた。反応は滅菌ポリスチレン製試験管(FALCON社の2058)で行った。反応後、滅菌2%FBS/PBSを用いて細胞を洗浄し、無菌的にFACSAria(BD Bioscience)に供し、forward scatter/side scatterで単核球画分であり、かつCD11bhighCD11cmediumCD45highを示す画分を無菌的に単離した。
【0040】
次に、大腸粘膜常在マクロファージ寄生細菌におけるゲノムDNA精製を行った。
【0041】
まず、FACSAriaによって無菌的に分取した前述のCD11bhighCD11cmediumCD45high細胞(105細胞)を、組立型吸引濾過装置(ミリポア)を使い、滅菌ポリカーボネート製メンブレンフィルター(孔径0.2μm、ミリポア)上に吸着させた。次に、このメンブレンを約50mlの滅菌水で吸引洗浄した。これらの操作により、メンブレン上のCD11bhighCD11cmediumCD45high細胞はほぼ完全に破砕され、当該細胞内に寄生する細菌のみがメンブレン上に保持される。このメンブレンを500μ1の滅菌水を含む滅菌エッペンチューブに移し、滅菌ハサミを使用して可能な限り細切した。このチューブをボルテックスミキサーで充分に撹拌後、液体窒素への浸漬、室温放置を行い、細切メンブレンを含むサンプルの凍結、融解を3回繰り返した。
【0042】
その後、等量のフェノール・クロロホルム・イソアミルアルコール(PCI)混液(日本ジーン)を加え、ボルテックスミキサーを使用しよく撹拌後、11000×g、室温において5分間遠心した。遠心後、上層(水層)を回収し、PCI抽出を繰り返した。水層を再度回収し、1/10容量の3M酢酸ナトリウム(日本ジーン)と2.5倍容量の100%エタノール(ナカライ)とを添加し、−20℃で16時間静置した。翌日、15000rpm、4℃において45分間遠心後、沈渣を70% エタノールで洗浄した。沈渣を真空乾燥後、20μ1のT10E1緩衝液(pH8.0、日本ジーン)に溶解した。その後、次いで行われるPCR(Polymerase chain reaction)反応の阻害因子となる多糖抗原に代表される細菌菌体成分等の夾雑物を除去する為、Wizard SV Genomic DNA Purification Kit(Promega)を用いて当該細菌のゲノムDNAを精製した。
【0043】
次に、大腸常在マクロファージに寄生する環境細菌解明の為の16SリボゾームRNA遺伝子を標的としたPCRを行った。
【0044】
当該PCRでは、Rudiらが真正細菌16SリボゾームRNA遺伝子解析用に考案したユニバーサルプライマーを使用した(Rudi K, et al.、1997、Strain characterization and classification of oxyphotobacteria in clone cultures on the basis of 16S rRNA sequences from the variable regions V6, V7, and V8.、Appl. Environ. Microbiol. 63、2593−2599参照)。当該プライマーの塩基配列は、フォワード(Bac334F)を配列番号2に、リバース(Bac939R)を配列番号3に示す。これらのプライマーは、グライナージャパンで受託合成した。PCR反応は、前述のRudiらの論文に記載された方法に準じて実施した。なお、PCR反応中に試薬および実験室環境を介した細菌ゲノムの汚染が生じないよう、細心の注意を払った。PCR産物は、Nucleospin(Macherey−Nagel)を用いて精製した。PCR反応には、Applied Biosystems社のサーマルサイクラーGeneAmp PCR System 9700およびTakaraのExTaq Hot Start Versionを使用し、反応条件は94℃/60℃/72℃、32サイクルを基本とした。
【0045】
次に、PCR産物のクローニング、組換えプラスミドの試験管内増幅を行い、DNA塩基配列を決定した。前述の工程において得たPCR産物のクローニングは、Promega社のpGEM−T Easy Vector Systemを利用して行った。また、形質転換に利用したコンピテント細胞(High efficiency competent E. coli HB101)は、東洋紡から入手した。形質転換の結果、得られた組換え大腸菌から無作為に96ないし192クローンを選別し、Maruyamaらの方法に準じ、phi29 DNA polymerase(New England Biolabs)によるDNA鎖伸長反応を利用して組換えプラスミドの試験管内増幅を行った(Maruyama et al.、2009、Cost effective DNA sequencing and template preparation from bacterial colonies and plasmids.、Journal of Bioscience and Bioengineering 107、471−473参照)。増幅した組換えプラスミドDNAは定量後、ABI Prism BigDye Terminator version 3.1 Cycle Sequencing Kit(Applied Biosystems)を用い、Sangerのジデオキシ法を基にした塩基配列決定のためのDNA鎖伸長反応を行った。なお、本シークエンス反応にはM13M4(フォワード)およびM13R(リバース)の2種類のプライマーを使用した。反応物の塩基配列解読は、北海道システムサイエンスの提供する受託シークエンスサービスに依頼して決定した。
【0046】
決定した塩基配列を、Ribosomal Datebase Project Virsion 10を用いたBlast searchにより調査したところ、Proteobacteria門の環境細菌種が寡占的に検出されることが判明した。これらの検出される環境細菌種のうち、本発明者らは多く検出されるステノトロフォモナス・マルトフィリアに着目した。
【0047】
(実施例2)
本実施例2では、ノトビオートマウスの作製、ならびに、該ノトビオートマウスにステノトロフォモナス・マルトフィリアを接種した場合における制御性サイトカインインターロイキン−10の濃度の測定およびフローサイトメータによる制御性T細胞の解析について詳細に説明する。
【0048】
ノトビオートマウスには、雌8週齢Germ−Free IQI/Jicマウスを使用した。ステノトロフォモナス・マルトフィリア腸管定着ノトビオートマウスを作製する為、標準株ステノトロフォモナス・マルトフィリアATCC13636をLuria Bertani液体培地で30℃、16時間振蘯培養にて増菌させた。滅菌ゾンデを用い、経口的胃内挿管法により増菌させた同菌をGerm−Free IQI/Jicマウス当たり1×108CFU接種するとともに、109CFU/mlの菌液を床敷きに混ぜたものを4日間連続して与えた。
【0049】
実験開始4週間後に炭酸ガス吸入によって安楽死させた後、安全キャビネット内で大腸組織を無菌的に摘出した。摘出大腸組織より前述の実施例1の方法に準じ、大腸粘膜常在単核球を単離した。次いで、同単核球画分から12穴細胞培養プレート(ファルコン)の底への付着性を利用してマクロファージを豊富に含む細胞画分を単離した。同細胞画分(5×105個)を、ペニシリンおよびストレプトマイシンを含む10%FBS/RPMI1640培地で37℃、5%CO2の条件下で24時間培養後、培養上清を回収し、上清中に含まれる制御性サイトカインインターロイキン−10をDuoSet mouse Cytokine ELISA Kit(R&D Systems)を利用して測定した。
【0050】
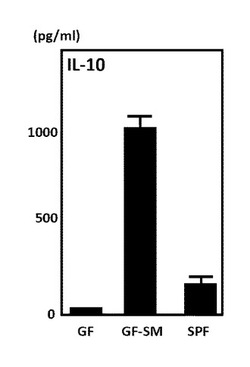
図1は、実施例2に係るステノトロフォモナス・マルトフィリアの影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。図1に示すように、ステノトロフォモナス・マルトフィリアを接種した無菌マウス(GF−SM)は、左端の無菌マウス(GF)および右端の一般的なマウス(SPF)よりも、制御性サイトカインインターロイキン−10(IL−10)の産生量が大きく増加していた。
【0051】
また、前述の大腸単核球画分に対して100倍希釈Fc−block抗体(精製抗マウスCD16/32モノクローナル抗体(BD Bioscience))を含む2%FBS/PBSで40倍に希釈したAPC標識抗マウスCD3モノクローナル抗体(BD Bioscience)を、最終濃度が1μgになるように添加し、氷冷、遮光下で30分間反応させた。反応終了後2%FBS/PBSを用いて抗体染色細胞を洗浄した。次いで、Foxp3 Staining Buffer Set(eBioscience)およびFITC標識抗Foxp3モノクローナル抗体(clone FJK−16s)を用い、細胞内のFoxp3に対する抗体染色を実施した。Foxp3+T細胞の割合はFACSCaliburフローサイトメータ(BD Bioscience)を用いて測定した。
【0052】
図2は、実施例2に係るFACSCaliburフローサイトメータにより測定したFoxp3+T細胞の割合を示す図である。図2に示すように、フローサイトメータによりFoxp3+T細胞の割合を測定した結果、無菌マウス(無菌動物、Germfree)よりも、ステノトロフォモナス・マルトフィリア(S. maltophilia)を接種したマウスの方がFoxp3+T細胞の割合が増加していた。
【0053】
(実施例3)
本実施例3では、ステノトロフォモナス・マルトフィリア内におけるシンバイオシス因子であることが示唆される、25kDaタンパク質の調製およびSDS−PAGEに係る実施例について詳細に説明する。
【0054】
まず、ステノトロフォモナス・マルトフィリア培養上清の調製および濃縮を行った。標準株ステノトロフォモナス・マルトフィリアATCC13636培養上清は、合成培地RPMI1640を使用して作製した。同菌株を塗抹したLuria Bertani寒天培地から、独立したコロニーをRPMI1640培地2ml(ナカライ)に植菌し、30℃、170rpmにおいて48時間の振蘯培養を行った。この培養液全量を、50mlコニカルチューブ (BD ファルコン)に分注したRPMI1640培地13mlに加え、蓋を緩めた状態で、さらに30℃、150rpmにおいて70時間振蘯培養を行った。培養後、4℃、3000rpmにおいて10分間遠心し、上清は0.22μmフィルター(アドバンテック)を使用して濾過滅菌を行った。当該ステノトロフォモナス・マルトフィリア培養上清の分画、濃縮およびPBS置換は、セントリプレップYM−10(ミリポア)を用いて行った。なお、セントリプレップYM−10を用いることで、10kDa以上の分子量の分画を濃縮することが可能である。さらに、4℃、2330×gで60分間、15分間、8分間と順次遠心し、濃縮を行った。 次いで、3mlのPBSを加え、4℃、2330×gで15分間、8分間と順次遠心を行った。さらに、再度3mlのPBSを加え、同様に遠心を行い、PMI1640培地からPBSへの置換を行った。
【0055】
セントリプレップYM−10により濃縮したステノトロフォモナス・マルトフィリア培養上清のSmlt2713相同タンパク質は、ポリアクリルアミドゲル電気泳動(SDS−PAGE)により解析した。電気泳動層はMODEL AE6530(アトー)を使用し、ポリアクリルアミドゲルおよび電気泳動バッファーはそれぞれe−PAGEL(アトー)およびEz Run C+(アトー)を使用した。電気泳動は20mAの定電流で1時間行った。Coomassie Brilliant Blue(CBB)染色はEz stain AQua (アトー)を使用し、室温で1時間の染色を行い、超純水を使用し脱色を行った。
【0056】
図3は、実施例3に係るSDS−PAGEの結果を示す図である。図3に示すように、SDS−PAGEの結果では、Lane1(4μl)、2(6μl)および3(8μl)のいずれにおいても、ステノトロフォモナス・マルトフィリアの培養上清の分画濃縮内には、約25kDa程度のタンパク質が検出された。すなわち、当該25kDaタンパク質が、環境細菌ステノトロフォモナス・マルトフィリア内においてシンバイオシス因子として機能している可能性が高いことを意味している。
【0057】
(実施例4)
本実施例4では、前述の25kDaタンパク質における、MALDI−TOF MS解析に係る実施例について説明する。
【0058】
SDS−PAGEにより分離後、クマシー染色した標的タンパク質のバンドを切り出し、ゲル片を1から2mm角程度のサイコロ状に切り分け、エッペンチューブに移した。次に、当該チューブ当たり100μlの脱色液(50%アセトニトリルおよび25mM重炭酸アンモニウム)を加え、室温で10分間振蘯した。次いで、脱色液をゲル片を吸い込まないよう取り除き、ゲル片から青い色が完全にぬけるまでこの操作を繰り返した。さらにはSpeed Vacを用い、真空にし、ゲルを乾燥させた。
【0059】
脱水操作後、チューブ当たり100μlの還元液(10mMジチオスレイトールおよび25mM重炭酸アンモニウム)を入れ、56℃で1時間振蘯し、その後室温に戻し液を廃棄した。さらに、チューブ当たり100μlの洗浄用バッファー(25mM重炭酸アンモニウム)を入れ10分間振蘯し、また、チューブ当たり100μlのアルキル化薬(55mMヨードアセトアミドおよび25mM重炭酸アンモニウム)を入れ、アルミホイル等で遮光し室温で45分間振蘯した。その後、液を取り除き、チューブ当たり100μlの洗浄用バッファー(25mM重炭酸アンモニウム)を入れ、10分間振蘯した。
【0060】
前述の操作により、還元およびアルキル化を行ったチューブに、チューブ当たり200μlの脱水液(50%アセトニトリルおよび25mM重炭酸アンモニウム)を加え、室温で10分間振蘯し、液を取り除いた。このような操作を繰り返し、ゲルを脱水した。さらに、Speed Vacを用いて真空にし、ゲルを乾燥させておいた。次いで、乾燥したゲル片に10μg/mlトリプシン溶液(修飾トリプシン(50mM重炭酸アンモニウム液にトリプシン10μgを含む)、Promega)を入れ、30分間氷上で放置しトリプシン溶液をしみこませ、余分なトリプシン溶液をピペットで取り除いた。この状態において、37℃で一晩反応させた。その後、チューブ当たり50μlの抽出液(50%アセトニトリルおよび5%トリフルオロ酢酸)を入れ、室温で30分間振蘯した後で、液を回収した。さらに、25μlの抽出液を加え、室温で30分間振蘯した後で、液を回収し、2回の抽出液を合わせてSpeed Vacで5から10μl程度になるまで濃縮した。このようにして、ゲル内消化を行った。
【0061】
次に、試料の脱塩を行った。前述のゲル内消化において濃縮した試料に、1%のトリフルオロ酢酸を1/10量加え、トリフルオロ酢酸終濃度を0.1%とした。次いで、脱塩用チップ(ZipTip C18、ミリポア)をアセトニトリルで膨潤した後、0.1%トリフルオロ酢酸溶液で置換し、平衡化した。さらに、P20のマイクロピペットに、置換、平衡化したZipTip C18を装着し、濃縮した試料をゆっくりと数回ピペッティングし、樹脂に添着した。その後、0.1%トリフルオロ酢酸を吸い上げ廃液用チューブに捨て、この操作を数回繰り返し、塩等の樹脂に吸着しなかったものを洗い流した。次に、少量の溶離液(50%アセトニトリルおよび0.1%トリフルオロ酢酸)2μl前後を用いトリプシン消化物を溶出した。その後、α−シアノ−4−ヒドロキシケイヒ酸(CHCA)の50%アセトニトリルおよび0.1%トリフルオロ酢酸の飽和液をマトリックス液として、溶離したサンプル液と1:1の割合でターゲットプレート(試料台)上で混合し、乾燥、結晶化させた。このようにして、試料の脱塩を行った。
【0062】
次に、MALDI−TOF MSによる測定および25kDaタンパクの同定を行った。MALDI−TOF MSは、Biflex IV(Bruker)の装置を使用して行った。前述の操作を行ったターゲットプレートを質量分析計に挿入し、試料の測定をレーザー強度、照射位置を変えながら行い、スペクトルを得た。また、データ解析ソフト(biotools)を用い、ピークリストを作成した。さらに、タンパクの同定については、ペプチド・マス・フィンガープリンテイング法によるタンパク同定ソフトMascotを用いて検索した。
【0063】
図4は、実施例4に係るMALDI−TOF MS解析による結果を示す図である。図5は、実施例4に係るMascot解析による結果を示す図である。図4のスペクトル、および図5のソフトでの解析結果から、該タンパク質は、ステノトロフォモナス・マルトフィリアK279a株の機能未知であるsmlt2713遺伝子産物のアミノ酸配列と99%の相同性を有するsmlt2713相同タンパク質であることがわかった。
【0064】
(実施例5)
本実施例5では、試験管内でのステノトロフォモナス・マルトフィリアおよびsmlt2713相同タンパク質に対する、マクロファージ細胞株RAW264.7の免疫応答に係る実施例について説明する。
【0065】
まず、前述の実施例1のように精製したマクロファージ細胞株RAW264.7を、10%FBS(JIH, lot.4L0299)、2−メルカプトエタノール(GIBCO)、100μg/mlストレプトマイシンおよび100units/mlペニシリン(明治製菓)を含んだRPMI1640培地(ナカライ)を用い、37℃、5%CO2条件下において培養を行った。
【0066】
その後、マクロファージ細胞RAW264.7を、12穴プレート(BD ファルコン) に1.5×105cells/wellずつ播種し、18時間前培養を行った。さらに、12穴プレートをRPMI1640培地(10%FBS、2−メルカプトエタノールおよびペニシリンを含む)で洗浄、および培地交換を行い、終濃度0.1μMになるように添加されたsmlt2713相同タンパク質で、24時間刺激した。
【0067】
次に、RAW264.7細胞培養上清中の制御性サイトカインインターロイキン−10の濃度測定を行った。濃度の測定は、R&D Systems社のDuoSet mouse Cytokine ELISA Kitを使用し、R&D Systems社が推奨する方法に準じて固相化、抗体反応およびストレプトアビジン−ビオチン反応を行い、TMB 1−Component Microwell Peroxidase Substrate, SureBlue(フナコシ)および2N硫酸(ナカライ)を用いて発色を行った。吸光度の測定は、マイクロプレートリーダーModel550(Bio−Rad)を使用し、450nmでの吸光度測定、および570nmでの吸光度補正を行った。
【0068】
図6は、実施例5に係る25kDa smlt2713の影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。図6に示すように、やはり、smlt2713相同タンパク質を添加することにより(smlt2713)、添加しない場合(None)と比較して、制御性サイトカインインターロイキン−10の産生量は増加することがわかった。すなわち、腸内細菌叢の構成異常または該構成異常に起因する免疫系異常である炎症性腸疾患、肥満、がん、関節リウマチまたはI型糖尿病等、様々な疾病の予防、改善および治療方法の開発の為に、ステノトロフォモナス・マルトフィリアおよびsmlt2713タンパク質の研究が極めて重要であることを示唆しており、またsmlt2713タンパク質自身についても炎症性腸疾患等に対する医薬の有効成分となる可能性があることを示唆している。
【0069】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0070】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0071】
本発明者らは、腸管粘膜における免疫応答発動の端緒となる大腸粘膜常在マクロファージには、平素より特定の環境細菌が寡占的に寄生していることを見出した。当該環境細菌のうち、ステノトロフォモナス・マルトフィリアに着目し、マクロファージ細胞株RAW264.7に感染させた結果、制御性サイトカインインターロイキン−10の産生が亢進することを見出した。また、無菌マウスに同菌を経口感染した結果、Foxp3+制御性T細胞応答までも誘導されることを見出した。さらには、25 kDaタンパク質を含むステノトロフォモナス・マルトフィリア培養上清濃縮画分においてもマクロファージ細胞株RAW264.7での制御性サイトカインインターロイキン−10の産生を亢進させる作用があることを発見し、MALDI−TOF MS解析の結果、同25kDaタンパク質は機能未知のsmlt2713遺伝子産物であることが明らかとなった。すなわち、ステノトロフォモナス・マルトフィリアから産生されるsmlt2713が、腸粘膜免疫の機能分化、成熟をつかさどるシンバイオシス因子である可能性が示唆された。
【0072】
そこで、本発明によれば、大腸粘膜常在細胞に寄生し粘膜免疫調節作用を有する常在細菌種および細菌種由来誘導因子が解明され、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物が提供される。
【技術分野】
【0001】
本発明は、大腸粘膜組織の腸管免疫系へ影響を与えるポリペプチド、該ポリペプチドの生産方法、および、大腸粘膜組織の免疫制御組成物に関する。
【背景技術】
【0002】
消化管、呼吸器などを被覆する粘膜には多数の微生物が棲息している。これら微生物の多くは真正細菌であり、一過性に生体に侵入し病原性を発現するものと区別して、常在細菌叢と称される。常在細菌叢の構成菌種は棲息部位によって大きく異なるが、腸内細菌叢が最も多くの細菌種によって構成されている。腸内細菌叢は、宿主の未消化食餌成分を代謝して、単糖、オリゴ糖、アミノ酸、ビタミンおよび短鎖脂肪酸を宿主に供給する。さらに、腸管粘膜上皮の増殖分化、血管新生、腸管神経叢の分化および腸管病原細菌に対する微生物バリアーとして、宿主の生存にとってかけがえのない有益な生理機能を数多く担うことが分かっている。
【0003】
微生物感染をはじめとしたストレス侵襲に対する定常時の抵抗力として、腸管粘膜では常在細菌叢の刺激を受け、エフェクターT細胞を中心とした免疫応答が恒常的に誘導、維持されている。これは粘膜における「生理的炎症」と呼ばれる。エフェクターT細胞が活性化した場合、生理的炎症下では、制御性T細胞(誘導性Treg(iTreg))が機能する。制御性T細胞は、エフェクターT細胞の場合と同様に、腸管細菌叢の刺激を受けて誘導、維持されていると考えられている。その為、腸内細菌叢の構成異常または該構成異常に起因するエフェクターT細胞の過剰活性化が、炎症性腸疾患、肥満、がん、関節リウマチまたはI型糖尿病等、様々な疾病の発症や重症化と密接に関わっていることが明らかになってきた(非特許文献1ないし非特許文献3参照)。
【0004】
さらに、腸内細菌叢ゲノムの網羅的解析手法の進歩に伴い、腸内細菌叢の腸管免疫系への影響についても次第に明らかとなってきており、例えば、非特許文献4ないし非特許文献8に記載されている。非特許文献4および非特許文献5には、フィルミクテス(Firmicutes)門に属するセグメント細菌(Segmented filamentous bacteria)が、免疫グロブリンA(IgA)に係る免疫応答の発達、および腸上皮細胞間リンパ球の発達に資することが記載されている。また、非特許文献6には、同細菌がヘルパーT細胞のTh17細胞の細胞分化に資することが記載されている。非特許文献7および非特許文献8には、polysaccharide antigen A(PSA)という莢膜多糖を産生する腸内細菌バクテロイデス・フラジリス(Bacteroides fragilis)が、制御性サイトカインインターロイキン−10(IL−10)を産生する制御性T 細胞の分化に資することが報告されている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Turnbaugh PJ, Ley RE, Mahowald MA, Margrini V, Mardis ER, Gordon JI.、2006、An obesity−associated gut microbiome with increased capacity for energy harvest.、Nature 444、1027−1031
【非特許文献2】Wu HJ, Ivanov II, Darce J, Hattori K, Mathis D, et al.、2010、Gut−residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells.、Immunity 32、815−827
【非特許文献3】Wen L, Ley RE, Yu P, Gordon JI, Chervonsky AV, et al.、2008、 Innate immunity and intestinal microbiota in the development of Type 1 diabetes.、Nature 455、1109−1113
【非特許文献4】Talham GL, Jiang HQ, Bos NA, Cebra JJ.、1999、Segmented filamentous bacteria are potent stimuli of a physiologically normal state of the murine gut mucosal immune system.、Infection and Immunity 67、1992−2000
【非特許文献5】Umesaki Y, Okada Y, Matsumoto S, Imaoka A, Setoyama H.、1995、Segmented filamentous bacteria are indigenous intestinal bacteria that activate intraepithelial lymphocytes and induce MHC class II molecules and fucosyl asialo GM 1 glycolipids on the small intestinal epithelial cells in ex−germ−free mouse.、Microbiol. Immunol. 39、555−562
【非特許文献6】Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, et al.、2009、Induction of intestinal Th 17 cells by segmented filamentous bacteria.、Cell 139、1−14
【非特許文献7】Mazmanian SK, Round JL, Kasper DL.、2008、A microbial symbiosis factor prevents intestinal inflammatory disease.、Nature 453、620−625
【非特許文献8】Round JL, Mazmanian SK.、2010、Inducible Foxp 3+ regulatory T−cell development by a commensal bacterium of the intestinal microbiota.、Proc. Natl. Acad. Sci. USA. 107、12204−12209
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、前述の非特許文献4ないし非特許文献8において、これらに記載されているセグメント細菌、プロバイオティクスまたはバクテロイデス・フラジリスのいずれについても、粘膜内免疫担当細胞に直接的に取り込まれているわけではない。また、これらの細菌の産生するどのような菌体成分またはエフェクター分子が、宿主免疫系細胞のいかなる生体分子との相互作用を端緒とし、腸管免疫応答の発達、機能分化または成熟を担保しているのかは全く明らかになっていない。
【0007】
また、近年、粘膜免疫系に係る制御性T細胞が粘膜炎症の調整役として重要であり、さらには制御性T細胞を利用することにより、粘膜炎症性疾患の発症を予防および治療できることが明らかとなってきている。これらを考慮すると、制御性T細胞が含まれる粘膜免疫系がどのように腸管細菌叢と作用しているのかを解明すること、特に、大腸粘膜常在細胞に直接的に作用する腸管常在細菌種および細菌種由来誘導因子を解明することは極めて重要である。
【0008】
本発明は上記事情に鑑みてなされたものであり、大腸粘膜常在細胞に寄生し粘膜免疫制御作用を有する常在細菌種および細菌種由来誘導因子を解明し、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物を提供することを目的とする。
【課題を解決するための手段】
【0009】
上記目的を達成する為、本発明者らが鋭意研究を行った結果、腸管粘膜における免疫応答発動の端緒となる大腸粘膜常在マクロファージには、平素より特定の環境細菌(特にプロテオバクテリア(Proteobacteria)門の環境細菌種)が寡占的に寄生していることを16Sリボソーム遺伝子法によって見出した。さらに、当該環境細菌のうち、ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)に着目し、標準株であるステノトロフォモナス・マルトフィリアATCC13636株を用い、マクロファージ細胞株RAW264.7に感染させた結果、制御性サイトカインインターロイキン−10の産生が亢進することを見出した。
【0010】
次いで本発明者らは、無菌マウスに同菌を経口感染し、ノトビオートマウスを作製した。ノトビオートマウスでは大腸粘膜常在マクロファージにおける制御性サイトカインインターロイキン−10の産生亢進のみならず、Foxp3+制御性T細胞応答までも誘導されることを見出した。さらには、25kDa(kilodalton)タンパク質を含むステノトロフォモナス・マルトフィリア培養上清濃縮画分においても、マクロファージ細胞株RAW264.7での制御性サイトカインインターロイキン−10の産生を亢進させる作用があることを発見し、MALDI−TOF MS解析の結果、同25kDaタンパク質は機能未知のsmlt2713遺伝子産物であることが明らかとなった。すなわち、ステノトロフォモナス・マルトフィリアから産生される25kDa smlt2713タンパク質が、大腸粘膜免疫の機能分化および成熟をつかさどる、大腸粘膜常在マクロファージのシンバイオシス因子である可能性が示唆された(実施例参照)。
【0011】
そこで、本発明の第1の態様に係るポリペプチドは、配列番号1に記載のアミノ酸配列、または、前記配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする。
【0012】
好ましくは、前記ポリペプチドによる前記大腸粘膜組織での免疫制御作用は、制御性サイトカインインターロイキン−10の産生亢進、および/または、Foxp3+制御性T細胞応答の誘導であることを特徴とする。
【0013】
本発明の第2の態様に係るポリペプチドの生産方法は、
ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を培養する培養工程と、
前記培養工程によって得られた菌体培養物から、第1の態様に係るポリペプチドを抽出する抽出工程と、
を含むことを特徴とする。
【0014】
本発明の第3の態様に係る大腸粘膜組織の免疫制御組成物は、第1の態様に係るポリペプチド、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、前記ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有することを特徴とする。
【発明の効果】
【0015】
本発明によれば、大腸粘膜常在細胞に寄生し粘膜免疫調節作用を有する常在細菌種および細菌種由来誘導因子が解明され、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物が提供される。
【図面の簡単な説明】
【0016】
【図1】実施例2に係るステノトロフォモナス・マルトフィリアの影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。
【図2】実施例2に係るFACSCaliburフローサイトメータにより測定したFoxp3+T細胞の割合を示す図である。
【図3】実施例4に係るSDS−PAGEの結果を示す図である。
【図4】実施例4に係るMALDI−TOF MS解析による結果を示す図である。
【図5】実施例4に係るMascot解析による結果を示す図である。
【図6】実施例5に係る25kDa smlt2713の影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0018】
(ポリペプチド)
本発明の実施の形態1は、特定のアミノ酸配列を有する粘膜免疫制御ポリペプチドに関する。具体的には、例えば、配列番号1に記載のアミノ酸配列を有する粘膜免疫制御ポリペプチド(ステノトロフォモナス・マルトフィリアATCC13636におけるsmlt2713遺伝子産物)を挙げることができる。なお、配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらす粘膜免疫制御ポリペプチドでも構わない。本明細書において、「免疫制御作用」とは、具体的には、主に、制御性サイトカインインターロイキン−10の産生亢進、およびFoxp3+制御性T細胞応答の誘導を示す。
【0019】
本実施の形態1に係るポリペプチドは、後の実施の形態2において詳細に述べるステノトロフォモナス・マルトフィリアを用いる方法により産生しても構わないが、ポリペプチド合成法または遺伝子工学的方法等の、当該技術分野における人工的な常法によって産生してもよい。
【0020】
例えば、ポリペプチド合成法の場合、液相法または固相法を挙げることができる。液相法は、反応を溶液状態で行い、反応混合物から生成物を単離精製し、この生成物を中間体として次のペプチド伸長反応に用いる方法である。一方固相法は、反応溶媒に対して不溶の固相担体にアミノ酸を結合させ、このアミノ酸に順次縮合反応を行い、ペプチド鎖を伸長させていく方法である。
【0021】
具体的に、ポリペプチド合成は、まず、カルボキシル基を保護したアミノ酸にアミノ基を保護したアミノ酸を脱水縮合させ、ペプチド結合を形成させる。次に、アミノ保護基を除去後、遊離したアミノ基に次のアミノ基保護アミノ酸をC末端からN末端に向かって一つずつ順次延長させていく。脱水縮合反応では、カルボキシル基を活性化し、結合させようとするアミノ基と反応させる。活性化にはジシクロへキシカルボジイミド(DCC)法、活性エステル法、酸無水物法またはアジド法等が挙げられるが、その反応性の高さ、ラセミ化およびその他の副反応を考慮し、適宜選択すればよい。縮合反応時の副反応を防止する為、アミノ酸のアミノ基、カルボキシル基および/または側鎖の官能基には保護基が導入される。これらの保護基は、縮合反応での条件において安定であり、必要な時には速やかに除去可能であるものが好ましい。また、アミノ基の保護基とカルボキシル基の保護基とは、互いに選択的に除去可能であることが好ましい。
【0022】
アミノ基の保護基としては、例えば、ベンジルオキシカルボニル(Bz)、t−ブチルオキシカルボニル(Boc)、p−ビフェニルイソプロピロオキシカルボニルまたは9−フルオレニルメチルオキシカルボニル(Fmoc)等を挙げることができる。カルボキシ基の保護基としては、例えば、アルキルエステルまたはベンジルエステル等を形成し得る基を挙げることができる。
【0023】
ただし、固相法の場合、C末端のカルボキシル基はクロロトリチル樹脂、クロルメチル樹脂、オキシメチル樹脂またはp−アルコキシベンジルアルコール樹脂等の担体に結合している為、縮合反応はカルボジイミド等の縮合剤の存在下、またはN保護アミノ酸活性エステルもしくはペプチド活性エステルを用いて実施すると好ましい。縮合反応終了後、保護基は除去される。固相法の場合、ペプチドのC末端と樹脂との結合も切断される。その後、化学合成されたペプチドは、例えば、イオン交換クロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相クロマトグラフィー、アフィニティークロマトグラフィー、エドマン分解法またはガスクロマトグラフィー質量分析(GC−MS)等により精製、解析をすることが可能である。
【0024】
遺伝子工学的方法では、本実施の形態1に係るポリペプチドをコードするsmlt2713遺伝子を用いる。smlt2713遺伝子は、当該技術分野の当業者であれば常法を用い、ステノトロフォモナス・マルトフィリアの種々の株(前述した標準株であるステノトロフォモナス・マルトフィリアATCC13636であってもK279aでも構わない)からDNAの分離精製を行うことが可能である。また、例えば、DNA合成キット等を使用し人工的にDNA合成を行っても構わない。
【0025】
その後、合成したsmlt2713遺伝子と、当該遺伝子を宿主細胞内で発現させる為の種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサーおよび/または発現レベルを制御する種々のシスエレメント等)とを用い、発現用遺伝子構築物を有する組換えベクターを宿主細胞に応じて構築する。このようにして構築した組換えベクターは、例えば、所定の宿主細胞に導入し、所定の条件で培養する。これにより、本実施の形態1に係るポリペプチドの、宿主細胞内での発現、産生および抽出が可能となる。
【0026】
このようなペプチド合成法または遺伝子工学的方法を用いる方法によって産生した本実施の形態1に係る粘膜免疫制御ポリペプチドは、薬学的に許容される該ポリペプチドの誘導体等も含め、後に述べる実施の形態3に係る大腸粘膜組織の免疫制御組成物の有効成分として利用することが可能となる。
【0027】
(ポリペプチドの生産方法)
本発明の実施の形態2は、前述の実施の形態1に係る粘膜免疫制御ポリペプチドの生産方法に関する。具体的には、ステノトロフォモナス・マルトフィリアを培養する培養工程と、該培養工程によって得られた菌体培養物(好ましくは、培養上清を分画濃縮(実施例参照))から、実施の形態1に係る粘膜免疫制御ポリペプチドを抽出する抽出工程とを含む。
【0028】
培養培地および培養方法は、静置培養、pHを一定にした中和培養、回転培養または連続培養等、当該ステノトロフォモナス・マルトフィリアが良好に生育する条件であれば特に制限はない。なお、ステノトロフォモナス・マルトフィリアの培養条件の一例については実施例を参照されたい。培養工程において、ステノトロフォモナス・マルトフィリア種の菌株を大量に培養し、当該技術分野におけるタンパク質抽出の常法(例えば、細胞破砕法等)を用いることにより、産生されたポリペプチド(smlt2713遺伝子産物)を容易に得ることが可能となる。また、実施例にて詳細に述べる方法を用い、smlt2713遺伝子産物を得ても構わない。
【0029】
(大腸粘膜組織の免疫制御組成物)
本発明の実施の形態3は、前述の実施の形態1に係る粘膜免疫制御ポリペプチドを利用した組成物に関する。具体的には、実施の形態1に係る粘膜免疫制御ポリペプチド、該ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、該ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有する、大腸粘膜組織の免疫制御組成物である。
【0030】
本明細書において、「大腸粘膜組織の免疫制御組成物」とは、具体的には、例えば、大腸粘膜組織の免疫を制御、調節すること(主に、制御性サイトカインインターロイキン−10の産生亢進およびFoxp3+制御性T細胞応答の誘導)ができる、食品または医薬品等を挙げることができる。
【0031】
さらに詳細には、食品の場合、例えば、大腸組織の免疫系疾病である炎症性腸疾患等の予防、改善および治療をコンセプトとした、健康食品、サプリメントまたは特定保健用食品等を挙げることができる。医薬品の場合、例えば、液剤、錠剤、顆粒剤、細粒剤、粉剤、タブレットまたはカプセル剤等を挙げることができ、経口投与の投与形態が好ましい。
【0032】
なお、本実施の形態3に係る大腸粘膜組織の免疫制御組成物において、種々の食品または医薬品等を調製する為、薬学的に許容される他の組成物を適宜組み合わせてもよいし、当該ポリペプチドおよび当該組成物を誘導体または塩の形態として使用しても構わない。誘導体としては、ポリペプチドの一部置換体または付加化合物等のポリペプチド誘導体を挙げることができる。さらに具体的には、例えば、カルボキシル基をアミド化またはアシル化した誘導体を例示することができる。塩の形態としては、塩酸塩、硝酸塩もしくは臭化水素酸塩等の無機酸塩、または、p−トルエンスルホン酸塩、メタスルホン酸塩、フマル酸塩、コハク酸塩もしくは乳酸塩等の有機酸塩等を挙げることができる。
【0033】
これらの食品または医薬品等において、前述の実施の形態1に係るポリペプチドの有効成分としての含有量および一日における投与量は、当該組成物等の種類によって適宜調節することが可能である。また、医薬等への直接的な利用だけでなく、大腸粘膜組織の免疫制御におけるシンバイオシス因子の作用機構を利用することにより、機能性ナノ磁性微粒子(半田ビーズ)を利用したシンバイオシス因子に対する生体内標的分子の探索、さらにはシンバイオシス因子を利用した粘膜免疫強化法の開発、ならびに粘膜炎症性疾患予防、改善および治療法の研究開発に役立つことが示唆される。
【実施例】
【0034】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものではない。
【0035】
(実施例1)
本実施例1では、大腸粘膜組織常在マクロファージ内に棲息する細菌種の特定に係る実施例について説明する。
【0036】
大腸粘膜常在マクロファージを調製する為、まず、雌8週齢のBALB/cマウス(日本クレア)を4週間飼育し、馴化させた。馴化マウスを炭酸ガス吸入によって安楽死させた後、クリーンベンチ内で滅菌眼科用ハサミを用いて開腹し、大腸組織を無菌的に摘出した。次いで、滅菌RPMI1640 培地(ナカライ)で湿潤させた滅菌キムタオル(登録商標、クレシア)上に置き、大腸組織に付着した腸間膜および脂肪組織を可能な限り慎重に除去した。さらに、腸間膜付着部に沿って縦切開を加えた後、冷却滅菌PBSで洗浄し、切開大腸に付着する腸管腔内容物(主に糞便および粘液)を、可能な限り除去した。
【0037】
次に、5mM EDTA(pH8.0)を含む滅菌RPMI1640培地20mlを添加した滅菌三角フラスコ内に、前述の大腸組織を移し、反応温度37℃で20分間スターラーを用いて撹拌し、大腸粘膜表在性の粘液層および上皮層を可能な限り除去した。さらに、滅菌RPMI1640培地(ナカライ)20mlのみを含む滅菌三角フラスコ内において、同様の撹拌操作を10分間行い、大腸組織に残存するEDTAを除去した。その後、酵素処理の効率を高める為、1mg/mlのコラゲナーゼS−1(新田ゼラチン)と2%ウシ胎児血清(2%FBS)とを含有する滅菌RPMI1640培地10mlを添加した滅菌シンチレーションバイアルに、前述の大腸組織を移し換え、滅菌眼科用ハサミを用いて、5mm程度に細かく細切した。
【0038】
当該バイアルに対し、37℃においてスターラーを用いて穏やかな攪拌操作を加えた。撹拌開始30分後、同バイアル内の上清を滅菌駒込ピペットで慎重に吸い取り、滅菌50ml遠沈管(BDファルコン)に、大腸粘膜固有層から遊出した細胞画分として回収し、氷冷下で静置した。さらに、前述のコラゲナーゼ処理を再度繰り返し、その上清を1回目のサンプルと合わせた。
【0039】
このように回収した細胞浮遊液を含む遠沈管を1300rpm、10分、4℃の条件下で遠心にかけ、上澄みを捨て、遠沈管底に残った細胞沈渣を慎重にほぐした。これに氷冷RPMI1640培地を30ml加え、細胞沈渣を均等に撹拌後、1300 rpm、10分、4℃の条件下の遠心操作を繰り返し、細胞洗浄操作とした。大腸単核球画分は、滅菌パーコール(GEヘルスケア)の75%/40%不連続密度勾配遠心(2000 rpm、20分、室温)で無菌的に回収した。回収した大腸単核球画分は、冷却2%FBS含有RPMI1640培地を用いて2回洗浄後、トリパンブルー法で生細胞数を算定した。107/mlの濃度になるように滅菌2%FBS/PBSで浮遊させた大腸単核球画分に、100倍希釈Fc−block抗体(精製抗マウスCD16/32モノクローナル抗体(BD Bioscience))を含む滅菌2%FBS/PBSで40倍に希釈したPE標識抗マウスCD11bモノクローナル抗体(BD Bioscience)、APC標識抗マウスCD11cモノクローナル抗体(BD Bioscience)、および、Pacific Blue標識抗マウスCD45モノクローナル抗体(BD Bioscience)を、それぞれ最終濃度が1μgになるように添加し、氷冷、遮光下で30分間無菌的に反応させた。反応は滅菌ポリスチレン製試験管(FALCON社の2058)で行った。反応後、滅菌2%FBS/PBSを用いて細胞を洗浄し、無菌的にFACSAria(BD Bioscience)に供し、forward scatter/side scatterで単核球画分であり、かつCD11bhighCD11cmediumCD45highを示す画分を無菌的に単離した。
【0040】
次に、大腸粘膜常在マクロファージ寄生細菌におけるゲノムDNA精製を行った。
【0041】
まず、FACSAriaによって無菌的に分取した前述のCD11bhighCD11cmediumCD45high細胞(105細胞)を、組立型吸引濾過装置(ミリポア)を使い、滅菌ポリカーボネート製メンブレンフィルター(孔径0.2μm、ミリポア)上に吸着させた。次に、このメンブレンを約50mlの滅菌水で吸引洗浄した。これらの操作により、メンブレン上のCD11bhighCD11cmediumCD45high細胞はほぼ完全に破砕され、当該細胞内に寄生する細菌のみがメンブレン上に保持される。このメンブレンを500μ1の滅菌水を含む滅菌エッペンチューブに移し、滅菌ハサミを使用して可能な限り細切した。このチューブをボルテックスミキサーで充分に撹拌後、液体窒素への浸漬、室温放置を行い、細切メンブレンを含むサンプルの凍結、融解を3回繰り返した。
【0042】
その後、等量のフェノール・クロロホルム・イソアミルアルコール(PCI)混液(日本ジーン)を加え、ボルテックスミキサーを使用しよく撹拌後、11000×g、室温において5分間遠心した。遠心後、上層(水層)を回収し、PCI抽出を繰り返した。水層を再度回収し、1/10容量の3M酢酸ナトリウム(日本ジーン)と2.5倍容量の100%エタノール(ナカライ)とを添加し、−20℃で16時間静置した。翌日、15000rpm、4℃において45分間遠心後、沈渣を70% エタノールで洗浄した。沈渣を真空乾燥後、20μ1のT10E1緩衝液(pH8.0、日本ジーン)に溶解した。その後、次いで行われるPCR(Polymerase chain reaction)反応の阻害因子となる多糖抗原に代表される細菌菌体成分等の夾雑物を除去する為、Wizard SV Genomic DNA Purification Kit(Promega)を用いて当該細菌のゲノムDNAを精製した。
【0043】
次に、大腸常在マクロファージに寄生する環境細菌解明の為の16SリボゾームRNA遺伝子を標的としたPCRを行った。
【0044】
当該PCRでは、Rudiらが真正細菌16SリボゾームRNA遺伝子解析用に考案したユニバーサルプライマーを使用した(Rudi K, et al.、1997、Strain characterization and classification of oxyphotobacteria in clone cultures on the basis of 16S rRNA sequences from the variable regions V6, V7, and V8.、Appl. Environ. Microbiol. 63、2593−2599参照)。当該プライマーの塩基配列は、フォワード(Bac334F)を配列番号2に、リバース(Bac939R)を配列番号3に示す。これらのプライマーは、グライナージャパンで受託合成した。PCR反応は、前述のRudiらの論文に記載された方法に準じて実施した。なお、PCR反応中に試薬および実験室環境を介した細菌ゲノムの汚染が生じないよう、細心の注意を払った。PCR産物は、Nucleospin(Macherey−Nagel)を用いて精製した。PCR反応には、Applied Biosystems社のサーマルサイクラーGeneAmp PCR System 9700およびTakaraのExTaq Hot Start Versionを使用し、反応条件は94℃/60℃/72℃、32サイクルを基本とした。
【0045】
次に、PCR産物のクローニング、組換えプラスミドの試験管内増幅を行い、DNA塩基配列を決定した。前述の工程において得たPCR産物のクローニングは、Promega社のpGEM−T Easy Vector Systemを利用して行った。また、形質転換に利用したコンピテント細胞(High efficiency competent E. coli HB101)は、東洋紡から入手した。形質転換の結果、得られた組換え大腸菌から無作為に96ないし192クローンを選別し、Maruyamaらの方法に準じ、phi29 DNA polymerase(New England Biolabs)によるDNA鎖伸長反応を利用して組換えプラスミドの試験管内増幅を行った(Maruyama et al.、2009、Cost effective DNA sequencing and template preparation from bacterial colonies and plasmids.、Journal of Bioscience and Bioengineering 107、471−473参照)。増幅した組換えプラスミドDNAは定量後、ABI Prism BigDye Terminator version 3.1 Cycle Sequencing Kit(Applied Biosystems)を用い、Sangerのジデオキシ法を基にした塩基配列決定のためのDNA鎖伸長反応を行った。なお、本シークエンス反応にはM13M4(フォワード)およびM13R(リバース)の2種類のプライマーを使用した。反応物の塩基配列解読は、北海道システムサイエンスの提供する受託シークエンスサービスに依頼して決定した。
【0046】
決定した塩基配列を、Ribosomal Datebase Project Virsion 10を用いたBlast searchにより調査したところ、Proteobacteria門の環境細菌種が寡占的に検出されることが判明した。これらの検出される環境細菌種のうち、本発明者らは多く検出されるステノトロフォモナス・マルトフィリアに着目した。
【0047】
(実施例2)
本実施例2では、ノトビオートマウスの作製、ならびに、該ノトビオートマウスにステノトロフォモナス・マルトフィリアを接種した場合における制御性サイトカインインターロイキン−10の濃度の測定およびフローサイトメータによる制御性T細胞の解析について詳細に説明する。
【0048】
ノトビオートマウスには、雌8週齢Germ−Free IQI/Jicマウスを使用した。ステノトロフォモナス・マルトフィリア腸管定着ノトビオートマウスを作製する為、標準株ステノトロフォモナス・マルトフィリアATCC13636をLuria Bertani液体培地で30℃、16時間振蘯培養にて増菌させた。滅菌ゾンデを用い、経口的胃内挿管法により増菌させた同菌をGerm−Free IQI/Jicマウス当たり1×108CFU接種するとともに、109CFU/mlの菌液を床敷きに混ぜたものを4日間連続して与えた。
【0049】
実験開始4週間後に炭酸ガス吸入によって安楽死させた後、安全キャビネット内で大腸組織を無菌的に摘出した。摘出大腸組織より前述の実施例1の方法に準じ、大腸粘膜常在単核球を単離した。次いで、同単核球画分から12穴細胞培養プレート(ファルコン)の底への付着性を利用してマクロファージを豊富に含む細胞画分を単離した。同細胞画分(5×105個)を、ペニシリンおよびストレプトマイシンを含む10%FBS/RPMI1640培地で37℃、5%CO2の条件下で24時間培養後、培養上清を回収し、上清中に含まれる制御性サイトカインインターロイキン−10をDuoSet mouse Cytokine ELISA Kit(R&D Systems)を利用して測定した。
【0050】
図1は、実施例2に係るステノトロフォモナス・マルトフィリアの影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。図1に示すように、ステノトロフォモナス・マルトフィリアを接種した無菌マウス(GF−SM)は、左端の無菌マウス(GF)および右端の一般的なマウス(SPF)よりも、制御性サイトカインインターロイキン−10(IL−10)の産生量が大きく増加していた。
【0051】
また、前述の大腸単核球画分に対して100倍希釈Fc−block抗体(精製抗マウスCD16/32モノクローナル抗体(BD Bioscience))を含む2%FBS/PBSで40倍に希釈したAPC標識抗マウスCD3モノクローナル抗体(BD Bioscience)を、最終濃度が1μgになるように添加し、氷冷、遮光下で30分間反応させた。反応終了後2%FBS/PBSを用いて抗体染色細胞を洗浄した。次いで、Foxp3 Staining Buffer Set(eBioscience)およびFITC標識抗Foxp3モノクローナル抗体(clone FJK−16s)を用い、細胞内のFoxp3に対する抗体染色を実施した。Foxp3+T細胞の割合はFACSCaliburフローサイトメータ(BD Bioscience)を用いて測定した。
【0052】
図2は、実施例2に係るFACSCaliburフローサイトメータにより測定したFoxp3+T細胞の割合を示す図である。図2に示すように、フローサイトメータによりFoxp3+T細胞の割合を測定した結果、無菌マウス(無菌動物、Germfree)よりも、ステノトロフォモナス・マルトフィリア(S. maltophilia)を接種したマウスの方がFoxp3+T細胞の割合が増加していた。
【0053】
(実施例3)
本実施例3では、ステノトロフォモナス・マルトフィリア内におけるシンバイオシス因子であることが示唆される、25kDaタンパク質の調製およびSDS−PAGEに係る実施例について詳細に説明する。
【0054】
まず、ステノトロフォモナス・マルトフィリア培養上清の調製および濃縮を行った。標準株ステノトロフォモナス・マルトフィリアATCC13636培養上清は、合成培地RPMI1640を使用して作製した。同菌株を塗抹したLuria Bertani寒天培地から、独立したコロニーをRPMI1640培地2ml(ナカライ)に植菌し、30℃、170rpmにおいて48時間の振蘯培養を行った。この培養液全量を、50mlコニカルチューブ (BD ファルコン)に分注したRPMI1640培地13mlに加え、蓋を緩めた状態で、さらに30℃、150rpmにおいて70時間振蘯培養を行った。培養後、4℃、3000rpmにおいて10分間遠心し、上清は0.22μmフィルター(アドバンテック)を使用して濾過滅菌を行った。当該ステノトロフォモナス・マルトフィリア培養上清の分画、濃縮およびPBS置換は、セントリプレップYM−10(ミリポア)を用いて行った。なお、セントリプレップYM−10を用いることで、10kDa以上の分子量の分画を濃縮することが可能である。さらに、4℃、2330×gで60分間、15分間、8分間と順次遠心し、濃縮を行った。 次いで、3mlのPBSを加え、4℃、2330×gで15分間、8分間と順次遠心を行った。さらに、再度3mlのPBSを加え、同様に遠心を行い、PMI1640培地からPBSへの置換を行った。
【0055】
セントリプレップYM−10により濃縮したステノトロフォモナス・マルトフィリア培養上清のSmlt2713相同タンパク質は、ポリアクリルアミドゲル電気泳動(SDS−PAGE)により解析した。電気泳動層はMODEL AE6530(アトー)を使用し、ポリアクリルアミドゲルおよび電気泳動バッファーはそれぞれe−PAGEL(アトー)およびEz Run C+(アトー)を使用した。電気泳動は20mAの定電流で1時間行った。Coomassie Brilliant Blue(CBB)染色はEz stain AQua (アトー)を使用し、室温で1時間の染色を行い、超純水を使用し脱色を行った。
【0056】
図3は、実施例3に係るSDS−PAGEの結果を示す図である。図3に示すように、SDS−PAGEの結果では、Lane1(4μl)、2(6μl)および3(8μl)のいずれにおいても、ステノトロフォモナス・マルトフィリアの培養上清の分画濃縮内には、約25kDa程度のタンパク質が検出された。すなわち、当該25kDaタンパク質が、環境細菌ステノトロフォモナス・マルトフィリア内においてシンバイオシス因子として機能している可能性が高いことを意味している。
【0057】
(実施例4)
本実施例4では、前述の25kDaタンパク質における、MALDI−TOF MS解析に係る実施例について説明する。
【0058】
SDS−PAGEにより分離後、クマシー染色した標的タンパク質のバンドを切り出し、ゲル片を1から2mm角程度のサイコロ状に切り分け、エッペンチューブに移した。次に、当該チューブ当たり100μlの脱色液(50%アセトニトリルおよび25mM重炭酸アンモニウム)を加え、室温で10分間振蘯した。次いで、脱色液をゲル片を吸い込まないよう取り除き、ゲル片から青い色が完全にぬけるまでこの操作を繰り返した。さらにはSpeed Vacを用い、真空にし、ゲルを乾燥させた。
【0059】
脱水操作後、チューブ当たり100μlの還元液(10mMジチオスレイトールおよび25mM重炭酸アンモニウム)を入れ、56℃で1時間振蘯し、その後室温に戻し液を廃棄した。さらに、チューブ当たり100μlの洗浄用バッファー(25mM重炭酸アンモニウム)を入れ10分間振蘯し、また、チューブ当たり100μlのアルキル化薬(55mMヨードアセトアミドおよび25mM重炭酸アンモニウム)を入れ、アルミホイル等で遮光し室温で45分間振蘯した。その後、液を取り除き、チューブ当たり100μlの洗浄用バッファー(25mM重炭酸アンモニウム)を入れ、10分間振蘯した。
【0060】
前述の操作により、還元およびアルキル化を行ったチューブに、チューブ当たり200μlの脱水液(50%アセトニトリルおよび25mM重炭酸アンモニウム)を加え、室温で10分間振蘯し、液を取り除いた。このような操作を繰り返し、ゲルを脱水した。さらに、Speed Vacを用いて真空にし、ゲルを乾燥させておいた。次いで、乾燥したゲル片に10μg/mlトリプシン溶液(修飾トリプシン(50mM重炭酸アンモニウム液にトリプシン10μgを含む)、Promega)を入れ、30分間氷上で放置しトリプシン溶液をしみこませ、余分なトリプシン溶液をピペットで取り除いた。この状態において、37℃で一晩反応させた。その後、チューブ当たり50μlの抽出液(50%アセトニトリルおよび5%トリフルオロ酢酸)を入れ、室温で30分間振蘯した後で、液を回収した。さらに、25μlの抽出液を加え、室温で30分間振蘯した後で、液を回収し、2回の抽出液を合わせてSpeed Vacで5から10μl程度になるまで濃縮した。このようにして、ゲル内消化を行った。
【0061】
次に、試料の脱塩を行った。前述のゲル内消化において濃縮した試料に、1%のトリフルオロ酢酸を1/10量加え、トリフルオロ酢酸終濃度を0.1%とした。次いで、脱塩用チップ(ZipTip C18、ミリポア)をアセトニトリルで膨潤した後、0.1%トリフルオロ酢酸溶液で置換し、平衡化した。さらに、P20のマイクロピペットに、置換、平衡化したZipTip C18を装着し、濃縮した試料をゆっくりと数回ピペッティングし、樹脂に添着した。その後、0.1%トリフルオロ酢酸を吸い上げ廃液用チューブに捨て、この操作を数回繰り返し、塩等の樹脂に吸着しなかったものを洗い流した。次に、少量の溶離液(50%アセトニトリルおよび0.1%トリフルオロ酢酸)2μl前後を用いトリプシン消化物を溶出した。その後、α−シアノ−4−ヒドロキシケイヒ酸(CHCA)の50%アセトニトリルおよび0.1%トリフルオロ酢酸の飽和液をマトリックス液として、溶離したサンプル液と1:1の割合でターゲットプレート(試料台)上で混合し、乾燥、結晶化させた。このようにして、試料の脱塩を行った。
【0062】
次に、MALDI−TOF MSによる測定および25kDaタンパクの同定を行った。MALDI−TOF MSは、Biflex IV(Bruker)の装置を使用して行った。前述の操作を行ったターゲットプレートを質量分析計に挿入し、試料の測定をレーザー強度、照射位置を変えながら行い、スペクトルを得た。また、データ解析ソフト(biotools)を用い、ピークリストを作成した。さらに、タンパクの同定については、ペプチド・マス・フィンガープリンテイング法によるタンパク同定ソフトMascotを用いて検索した。
【0063】
図4は、実施例4に係るMALDI−TOF MS解析による結果を示す図である。図5は、実施例4に係るMascot解析による結果を示す図である。図4のスペクトル、および図5のソフトでの解析結果から、該タンパク質は、ステノトロフォモナス・マルトフィリアK279a株の機能未知であるsmlt2713遺伝子産物のアミノ酸配列と99%の相同性を有するsmlt2713相同タンパク質であることがわかった。
【0064】
(実施例5)
本実施例5では、試験管内でのステノトロフォモナス・マルトフィリアおよびsmlt2713相同タンパク質に対する、マクロファージ細胞株RAW264.7の免疫応答に係る実施例について説明する。
【0065】
まず、前述の実施例1のように精製したマクロファージ細胞株RAW264.7を、10%FBS(JIH, lot.4L0299)、2−メルカプトエタノール(GIBCO)、100μg/mlストレプトマイシンおよび100units/mlペニシリン(明治製菓)を含んだRPMI1640培地(ナカライ)を用い、37℃、5%CO2条件下において培養を行った。
【0066】
その後、マクロファージ細胞RAW264.7を、12穴プレート(BD ファルコン) に1.5×105cells/wellずつ播種し、18時間前培養を行った。さらに、12穴プレートをRPMI1640培地(10%FBS、2−メルカプトエタノールおよびペニシリンを含む)で洗浄、および培地交換を行い、終濃度0.1μMになるように添加されたsmlt2713相同タンパク質で、24時間刺激した。
【0067】
次に、RAW264.7細胞培養上清中の制御性サイトカインインターロイキン−10の濃度測定を行った。濃度の測定は、R&D Systems社のDuoSet mouse Cytokine ELISA Kitを使用し、R&D Systems社が推奨する方法に準じて固相化、抗体反応およびストレプトアビジン−ビオチン反応を行い、TMB 1−Component Microwell Peroxidase Substrate, SureBlue(フナコシ)および2N硫酸(ナカライ)を用いて発色を行った。吸光度の測定は、マイクロプレートリーダーModel550(Bio−Rad)を使用し、450nmでの吸光度測定、および570nmでの吸光度補正を行った。
【0068】
図6は、実施例5に係る25kDa smlt2713の影響による制御性サイトカインインターロイキン−10の産生量の変化を示す図である。図6に示すように、やはり、smlt2713相同タンパク質を添加することにより(smlt2713)、添加しない場合(None)と比較して、制御性サイトカインインターロイキン−10の産生量は増加することがわかった。すなわち、腸内細菌叢の構成異常または該構成異常に起因する免疫系異常である炎症性腸疾患、肥満、がん、関節リウマチまたはI型糖尿病等、様々な疾病の予防、改善および治療方法の開発の為に、ステノトロフォモナス・マルトフィリアおよびsmlt2713タンパク質の研究が極めて重要であることを示唆しており、またsmlt2713タンパク質自身についても炎症性腸疾患等に対する医薬の有効成分となる可能性があることを示唆している。
【0069】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0070】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【産業上の利用可能性】
【0071】
本発明者らは、腸管粘膜における免疫応答発動の端緒となる大腸粘膜常在マクロファージには、平素より特定の環境細菌が寡占的に寄生していることを見出した。当該環境細菌のうち、ステノトロフォモナス・マルトフィリアに着目し、マクロファージ細胞株RAW264.7に感染させた結果、制御性サイトカインインターロイキン−10の産生が亢進することを見出した。また、無菌マウスに同菌を経口感染した結果、Foxp3+制御性T細胞応答までも誘導されることを見出した。さらには、25 kDaタンパク質を含むステノトロフォモナス・マルトフィリア培養上清濃縮画分においてもマクロファージ細胞株RAW264.7での制御性サイトカインインターロイキン−10の産生を亢進させる作用があることを発見し、MALDI−TOF MS解析の結果、同25kDaタンパク質は機能未知のsmlt2713遺伝子産物であることが明らかとなった。すなわち、ステノトロフォモナス・マルトフィリアから産生されるsmlt2713が、腸粘膜免疫の機能分化、成熟をつかさどるシンバイオシス因子である可能性が示唆された。
【0072】
そこで、本発明によれば、大腸粘膜常在細胞に寄生し粘膜免疫調節作用を有する常在細菌種および細菌種由来誘導因子が解明され、腸管粘膜において直接的に免疫系を制御するポリペプチド、該ポリペプチドの生産方法および大腸粘膜組織の免疫制御組成物が提供される。
【特許請求の範囲】
【請求項1】
配列番号1に記載のアミノ酸配列、または、前記配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする、ポリペプチド。
【請求項2】
前記ポリペプチドによる前記大腸粘膜組織での免疫制御作用は、制御性サイトカインインターロイキン−10の産生亢進、および/または、Foxp3+制御性T細胞応答の誘導であることを特徴とする、請求項1に記載のポリペプチド。
【請求項3】
ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を培養する培養工程と、
前記培養工程によって得られた菌体培養物から、請求項1または2に記載のポリペプチドを抽出する抽出工程と、
を含むことを特徴とする、ポリペプチドの生産方法。
【請求項4】
請求項1または2に記載のポリペプチド、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、前記ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有することを特徴とする、大腸粘膜組織の免疫制御組成物。
【請求項1】
配列番号1に記載のアミノ酸配列、または、前記配列番号1に記載のアミノ酸配列において1もしくは複数のアミノ酸が置換、欠失、挿入および/もしくは付加したアミノ酸配列を有し、かつ大腸粘膜組織での免疫制御作用をもたらすことを特徴とする、ポリペプチド。
【請求項2】
前記ポリペプチドによる前記大腸粘膜組織での免疫制御作用は、制御性サイトカインインターロイキン−10の産生亢進、および/または、Foxp3+制御性T細胞応答の誘導であることを特徴とする、請求項1に記載のポリペプチド。
【請求項3】
ステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を培養する培養工程と、
前記培養工程によって得られた菌体培養物から、請求項1または2に記載のポリペプチドを抽出する抽出工程と、
を含むことを特徴とする、ポリペプチドの生産方法。
【請求項4】
請求項1または2に記載のポリペプチド、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類、または、前記ポリペプチドを産生するステノトロフォモナス・マルトフィリア(Stenotrophomonas maltophilia)を有効成分として含有することを特徴とする、大腸粘膜組織の免疫制御組成物。
【図1】


【図6】


【図2】


【図3】


【図4】


【図5】




【図6】


【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−171896(P2012−171896A)
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2011−33867(P2011−33867)
【出願日】平成23年2月18日(2011.2.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 第14回国際免疫学会議、 日本免疫学会・国際免疫学会連合、平成22年8月26日
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【出願人】(598041566)学校法人北里研究所 (180)
【Fターム(参考)】
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成23年2月18日(2011.2.18)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 第14回国際免疫学会議、 日本免疫学会・国際免疫学会連合、平成22年8月26日
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【出願人】(598041566)学校法人北里研究所 (180)
【Fターム(参考)】
[ Back to top ]

