ポリペプチド、ポリペプチドの製造方法、摂食調節組成物および摂食量の調節方法
【課題】N1ペプチドおよびN1−likeペプチドの詳細な特性を解明し、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法を提供する。
【解決手段】摂食調節作用を有し、特定のアミノ酸配列からなるポリペプチド、前記アミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列からなるポリペプチド、または、前記アミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなるポリペプチド。
【解決手段】摂食調節作用を有し、特定のアミノ酸配列からなるポリペプチド、前記アミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列からなるポリペプチド、または、前記アミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなるポリペプチド。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、摂食調節中枢において合成される神経ペプチドに関連する、ポリペプチド、ポリペプチドの製造方法、摂食調節組成物および摂食量の調節方法に関する。
【背景技術】
【0002】
視床下部には摂食調節中枢が存在しており、多くの神経ペプチドが合成されていることが知られている。このような摂食調節に関連する神経ペプチドについては、数々の産業に利用できることもあり、多くの研究がなされている(非特許文献1ないし非特許文献3参照)。その中でも、摂食を調節する神経ペプチドとして、ニューロペプチドY(NPY)が最もよく知られている(特許文献1参照)。この神経ペプチドニューロペプチドYは、脳内に広く分布しており、摂食以外にもエネルギー調節に重要な役割を果たしていることが知られている。
【0003】
ニューロペプチドY以外の摂食に関連する神経ペプチドは、いくつか知られているが、それら因子のみで摂食調節機構の全容を説明することは困難である。そこで、本発明者らにより、同様の摂食調節遺伝子が視床下部に存在するか否かが検討された。その結果、摂食調節に関連する分泌性ペプチドの前駆体と考えられる新規遺伝子の存在が見出され、別の染色体に存在しているパラログ遺伝子も見出された。また、これらのホモログ遺伝子は魚類、両生類、鳥類および哺乳類を含めた多くの動物種に存在していることも明らかとなった。さらに、当該新規遺伝子mRNA発現量が、エネルギーホメオスタシスに関連して変動することも明らかとなった(非特許文献4および非特許文献5参照)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2003−528051号公報
【非特許文献】
【0005】
【非特許文献1】Shinsuke Oh−I,Hiroyuki Shimizu,Tetsurou Satoh,Shuichi Okada,Sachika Adachi,Kinji Inoue,Hiroshi Eguchi,Masanori Yamamoto,Toshihiro Imaki,Koushi Hashimoto,Takafumi Tsuchiya,Tsuyoshi Monden,Kazuhiko Horiguchi,Masanobu Yamada and Masatomo Mori、2006、Identification of nesfatin−1 as a satiety molecule in the hypothalamus.、Nature 443、709−712
【非特許文献2】A.Sainsbury,L. Zhang、2010、Role of the arcuate nucleus of the hypothalamus in regulation of body weight during energy deficit.、Molecular and Cellular Endocrinology 316、109−119
【非特許文献3】Elena Valassi, Massimo Scacchi, Francesco Cavagnini、2008、Neuroendocrine control of food intake.、Nutritin, Metabolism and Cardiovascular Diseases.18、158−168
【非特許文献4】浮穴和義、岩越−浮穴栄子、田中幸恵、橘哲也、2010、ニワトリの視床下部で見出した新規摂食調節関連遺伝子、(社)日本動物学会第81回大会予稿集、129
【非特許文献5】岩越栄子、田中幸恵、橘哲也、浮穴和義、2010、視床下部における新規摂食調節関連遺伝子の発見、第35回日本比較内分泌学会及びシンポジウム2010静岡、38
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前述の分泌性ペプチドのアミノ酸配列、ならびに、その前駆体と考えられる新規遺伝子の塩基配列およびアクセッション番号等については、未だ解明されていない。そのため、当該分泌性ペプチドを用い摂食調節を行おうとする場合、本発明者らが長期にわたり行った後述する研究および検討方法を再度経て、当該分泌性ペプチドのアミノ酸配列等を特定する必要があり、また、当該ペプチドの発現機構を解明する必要がある。
【0007】
さらに、当該分泌性ペプチドの詳細な特性についても未だ解明されていない。詳細な特性とは、神経ペプチド部分として機能しているアミノ酸配列部分、当該分泌性ペプチドを用いた具体的な摂食調節方法、すなわち摂食促進および/または抑制方法、ならびに、摂食調節作用が機能するペプチドのアミノ酸配列の状態等が挙げられる。このような詳細な特性が解明された際には、当該分泌性ペプチドの摂食調節効果を利用することにより、産業上非常に大きく有意な影響を与えることとなる。
【0008】
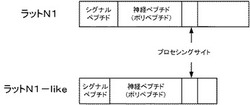
なお、当該新規遺伝子およびその分泌性ペプチド、ならびに前述した別の染色体に存在しているパラログ遺伝子およびその分泌性ペプチドについて、それぞれの脊椎動物等のホモログ遺伝子も含め、コードネームとして、以下、N1遺伝子およびN1ペプチド、ならびにN1−like遺伝子およびN1−likeペプチドと示す。図1は、本発明に係るラットのN1ペプチドおよびN1−likeペプチドを含む前駆体タンパク質の模式構造を示す図である。
【0009】
本発明は上記事情に鑑みてなされたものであり、N1ペプチドおよびN1−likeペプチドの詳細な特性を解明し、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記目的を達成する為に、本発明者らが行った研究の経緯および方法について説明する。まず、食欲旺盛なニワトリ(ブロイラー)の摂食調節中枢の1つである視床下部漏斗部において、小脳に発現している遺伝子と比較し、特異的に発現している遺伝子群に着目した。このような1000以上の遺伝子群から摂食調節に関連する神経ペプチドとなる遺伝子を網羅的に探索し、同定する為、ニワトリの雛の視床下部漏斗部と小脳から総RNAを抽出し、サブトラクティブ・ハイブリダイゼーションを行い、視床下部漏斗部において発現差のある遺伝子群をスクリーニングし、その後、DNAシークエンサーを用いて当該遺伝子群の配列を同定した。
【0011】
このように得られた遺伝子群の配列を、NCBIにおけるGenbank配列データベースに対するニワトリのBasic Local Alignment Search Tool(BLAST)検索を用いて解析した。その結果、機能既知のタンパク質をコードした遺伝子を除くと、20の遺伝子に選出することができた。
【0012】
さらに、選出した機能未知遺伝子20種類について、ニワトリの視床下部漏斗部にのみ特異的に発現している遺伝子であるかどうかを調べる為に、リアルタイムPCRによる二次スクリーニングを行った。このように、二度のスクリーニングによって選出した結果、ある1つの機能未知遺伝子が、ニワトリの視床下部漏斗部に特異的に発現していることが明らかとなった。なお、ここで選出された1つのニワトリの機能未知遺伝子のアクセッション番号は、XM_430126であった。また、前述したように、当該機能未知遺伝子は、ホモログ遺伝子として魚類、両生類、鳥類および哺乳類を含めた多くの動物種に存在していることもデータベース検索を行って確認できた。図2は、種々の脊椎動物のN1ペプチドおよびN1−likeペプチドに係るアミノ酸配列のアライメントを示す図である。図2において、黒色で示す部分は、検索、解析した全ての動物種で共通なアミノ酸配列の部分を示す。
【0013】
さらに、翻訳したアミノ酸配列中にシグナルペプチドがあるかどうかについて、コンピュータープログラムSignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP/)にて解析したところ、シグナルペプチドが含まれることも示唆された。また、当該アミノ酸配列中にプロセシングサイト(GKR)の存在も発見された為(図1参照)、シグナルペプチド以降の80アミノ酸残基のC末端がアミド化しており神経ペプチドとして製造されると予測された。このような経緯および方法を経て、本発明に係る摂食調節に関連するN1ペプチドおよびN1−likeペプチドの発見に至った。
【0014】
なお、ニワトリのN1ペプチドのアミノ酸配列を配列番号1に、ヒトのN1ペプチドのアミノ酸配列を配列番号2に、ラットのN1ペプチドのアミノ酸配列を配列番号3に、マウスのN1ペプチドのアミノ酸配列を配列番号4に、ニワトリのN1−likeペプチドのアミノ酸配列を配列番号5に、ヒトのN1−likeペプチドのアミノ酸配列を配列番号6に、ラットのN1−likeペプチドのアミノ酸配列を配列番号7に、マウスのN1−likeペプチドのアミノ酸配列を配列番号8に示す。また、ニワトリのN1遺伝子の塩基配列を配列番号9に、ヒトのN1遺伝子の塩基配列を配列番号10に、ラットのN1遺伝子の塩基配列を配列番号11に、マウスのN1遺伝子の塩基配列を配列番号12に、ニワトリのN1−like遺伝子の塩基配列を配列番号13に、ヒトのN1−like遺伝子の塩基配列を配列番号14に、ラットのN1−like遺伝子の塩基配列を配列番号15に、マウスのN1−like遺伝子の塩基配列を配列番号16に示す。
【0015】
このように、本発明者らが鋭意研究を行った結果、N1ペプチドおよびN1−likeペプチドの詳細な特性、すなわちアミノ酸配列およびその前駆体と考えられる新規遺伝子の塩基配列およびアクセッション番号等が解明された。
【0016】
本発明の第1の態様に係るポリペプチドは、以下の(a)ないし(f)のいずれかであり、かつ摂食調節作用を有することを特徴とする。
(a)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(b)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(c)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
(d)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(e)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(f)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
【0017】
好ましくは、前記ポリペプチドのC末端は、アミド化していることを特徴とする。
【0018】
より好ましくは、前記ポリペプチドは、少なくとも1つのジスルフィド結合を有することを特徴とする。
【0019】
さらに好ましくは、前記ポリペプチドは、ニワトリ(Gallus gallus)、ヒト(Homo sapiens)、ラット(Rattus norvegicus)、および/または、マウス(Mus musculus)に対する摂食調節作用を有することを特徴とする。
【0020】
本発明の第2の態様に係るポリペプチドの製造方法は、第1の態様に係るポリペプチドを作製することを特徴とする。
【0021】
好ましくは、前記製造方法は、大腸菌培養による遺伝子工学的製造方法を用いることを特徴とする。
【0022】
また、好ましくは、前記製造方法は、ネイティブケミカルライゲーション法を用いることを特徴とする。
【0023】
好ましくは、製造される前記ポリペプチドは、配列番号3もしくは7に記載のアミノ酸配列、配列番号3もしくは7に記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列、または、配列番号3もしくは7に記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列のいずれかであることを特徴とする。
【0024】
また、好ましくは、製造される前記ポリペプチドは、配列番号5に記載のアミノ酸配列を有するポリペプチドであり、ジスルフィド結合を再形成させる工程を含むことを特徴とする。
【0025】
本発明の第3の態様に係る摂食調節組成物は、第1の態様に係るポリペプチド、または、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有することを特徴とする。
【0026】
本発明の第4の態様に係る摂食量の調節方法は、第1の態様に係るポリペプチドまたは第3の態様に係る摂食調節組成物を投与する工程を含むことを特徴とする。
【0027】
好ましくは、前記ポリペプチドまたは前記摂食調節組成物を、脊椎動物の脳室内に投与することを特徴とする。
【0028】
より好ましくは、前記摂食量の調節方法は摂食量の抑制方法であり、ラットの脳室内に前記ポリペプチドまたは前記摂食調節組成物を長期間連続投与することを特徴とする。
【発明の効果】
【0029】
本発明によれば、N1ペプチドおよびN1−likeペプチドの詳細な特性が解明され、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法が提供される。
【図面の簡単な説明】
【0030】
【図1】本発明に係るラットのN1ペプチドおよびN1−likeペプチドを含む前駆体タンパク質の模式構造を示す図である。
【図2】種々の脊椎動物のN1ペプチドおよびN1−likeペプチドに係るアミノ酸配列のアライメントを示す図である。
【図3】ネイティブケミカルライゲーション法を用いて調製したラットN1−likeペプチドを示す概要図である。
【図4】実施例1に係るN1−likeペプチド単回投与後2時間におけるラットの摂食促進効果の結果を示す図である。
【図5】実施例2に係るN1ペプチド単回投与後22時間におけるラットの摂食促進効果の結果を示す図である。
【図6】実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重変化を示す図である。
【図7】実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重増加量を示す図である。
【図8】実施例3に係るN1ペプチド長期間連続投与におけるラットの明期12時間の総摂食量を示す図である。
【図9】実施例3に係るN1ペプチド長期間連続投与におけるラットの暗期12時間の総摂食量を示す図である。
【図10】実施例3に係るN1ペプチド長期間連続投与におけるラットの総摂食量を示す図である。
【図11】実施例4に係るN1−likeペプチド単回投与におけるニワトリ雛の摂食抑制効果の結果を示す図である。
【発明を実施するための形態】
【0031】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0032】
(ポリペプチド)
本発明の実施の形態1は、特定のアミノ酸配列を有し、摂食調節効果を有するポリペプチドに関する。特定のアミノ酸配列とは、好ましくは、ニワトリのN1ペプチドである配列番号1に記載のポリペプチド、ヒトのN1ペプチドである配列番号2に記載のポリペプチド、ラットのN1ペプチドである配列番号3に記載のポリペプチド、または、マウスのN1ペプチドである配列番号4に記載のポリペプチドのいずれかが挙げられるが、最も好ましくは、後述する実施例2および3にて確認されているラットのN1ペプチドである配列番号3に記載のポリペプチドである。N1−likeペプチドの場合、好ましくは、ニワトリのN1−likeペプチドである配列番号5に記載のポリペプチド、ヒトのN1−likeペプチドである配列番号6に記載のポリペプチド、ラットのN1−likeペプチドである配列番号7に記載のポリペプチド、または、マウスのN1−likeペプチドである配列番号8に記載のポリペプチドのいずれかが挙げられるが、同様に、最も好ましくは、後述する実施例1および4にて確認されている、ニワトリのN1−likeペプチドである配列番号5に記載のポリペプチド、または、ラットのN1−likeペプチドである配列番号7に記載のポリペプチドである。
【0033】
次に好ましい特定のアミノ酸配列とは、N1ペプチドの場合、配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。N1−likeペプチドの場合、配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。
【0034】
なお、「数個」とは、各々のポリペプチドのアミノ酸配列の長さによって異なり、例えば、15個ないし1個のいずれか、10個ないし1個のいずれか、5個ないし1個のいずれか、または、3個ないし1個のいずれか等の個数が挙げられる。また、本明細書において「摂食調節作用(効果)を有する(もたらす)」とは、摂食量の促進・増加および/もしくは抑制・減少作用を有する(もたらす)という意味を示し、さらに通常これらと同様の意味で使用される言語も含まれる。具体的には、例えば、ヒト、ラットまたはマウス等の脊椎動物に、当該ポリペプチドまたはコントロールとしての生理食塩水等を投与した際に、投与後の当該脊椎動物の摂食に対する作用(摂食量等)を比較し、ポリペプチドまたはコントロールの当該作用が異なる状況を示す。特に、このような摂食調節作用がもたらされる脊椎動物は、ニワトリ、ヒト、ラットまたはマウスのいずれかが好ましい。摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、それぞれの動物種(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)によって異なる。
【0035】
また、他の好ましい特定のアミノ酸配列には、N1ペプチドの場合、配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。N1−likeペプチドの場合、配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。なお、これらポリペプチドの配列の同一性に関しては、好ましくは60%以上、より好ましくは70%以上、さらに好ましくは80%以上、最も好ましくは90%以上の同一性を有する。
【0036】
前述のような、ニワトリ、ヒト、ラットまたはマウスのN1ペプチドまたはN1−likeペプチドのアミノ酸配列と相同性が高いポリペプチドであって、かつ摂食調節効果を有するポリペプチドであれば、前述した本発明者らが行った研究の経緯の結果から、これらのポリペプチドは、前述以外の他の脊椎動物(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)等のN1遺伝子またはN1−like遺伝子から翻訳されるN1ペプチドまたはN1−likeペプチドであることが示唆される(図2参照)。
【0037】
このような特定のアミノ酸配列を有する本実施の形態1に係るポリペプチドは、ポリペプチドのC末端がアミド化していることが好ましい。また、ポリペプチドが、少なくとも1つのジスルフィド結合を有しているとより好ましい。
【0038】
(ポリペプチドの製造方法)
本発明の実施の形態2は、前述の実施の形態1のポリペプチドを製造する方法に関する。そのため、本実施の形態2は、前述の実施の形態1のポリペプチドに特徴を有する。従って、本実施の形態2の製造方法は、当該技術分野の任意の方法で当該ポリペプチドのアミノ酸配列の長さが合成、製造可能である方法であれば限定されない。例えば、当該技術分野における常法である、人工的なポリペプチド合成法によって合成してもよいし、大腸菌等を用いた遺伝子工学的な方法を用いて製造してもよい(調製例参照)。具体的には、ポリペプチド合成法の場合、液相法または固相法を挙げることができる。液相法は、反応を溶液状態で行い、反応混合物から生成物を単離精製し、この生成物を中間体として次のペプチド伸長反応に用いる方法である。一方、固相法は、反応溶媒に対して不溶の固相担体にアミノ酸を結合させ、このアミノ酸に順次縮合反応を行い、ペプチド鎖を伸長させていく方法である。
【0039】
具体的に、ポリペプチド合成は、まず、カルボキシル基を保護したアミノ酸にアミノ基を保護したアミノ酸を脱水縮合させ、ペプチド結合を形成させる。次に、アミノ保護基を除去後、遊離したアミノ基に次のアミノ基保護アミノ酸をC末端からN末端に向かって1つずつ順次延長させていく。脱水縮合反応では、カルボキシル基を活性化し、結合させようとするアミノ基と反応させる。活性化にはジシクロへキシカルボジイミド(DCC)法、活性エステル法、酸無水物法またはアジド法等が挙げられるが、その反応性の高さ、ラセミ化およびその他の副反応を考慮し、適宜選択すればよい。縮合反応時の副反応を防止する為、アミノ酸のアミノ基、カルボキシル基および/または側鎖の官能基には保護基が導入される。これらの保護基は、縮合反応での条件において安定であり、必要な時には速やかに除去可能であるものが好ましい。また、アミノ基の保護基とカルボキシル基の保護基とは、互いに選択的に除去可能であることが好ましい。
【0040】
アミノ基の保護基としては、例えば、ベンジルオキシカルボニル(Bz)、t−ブチルオキシカルボニル(Boc)、p−ビフェニルイソプロピロオキシカルボニルまたは9−フルオレニルメチルオキシカルボニル(Fmoc)等を挙げることができる。カルボキシ基の保護基としては、例えば、アルキルエステルまたはベンジルエステル等を形成し得る基を挙げることができる。
【0041】
ただし、固相法の場合、C末端のカルボキシル基は、クロロトリチル樹脂、クロルメチル樹脂、オキシメチル樹脂またはp−アルコキシベンジルアルコール樹脂等の担体に結合している為、縮合反応はカルボジイミド等の縮合剤の存在下、またはN保護アミノ酸活性エステルもしくはペプチド活性エステルを用いて実施すると好ましい。縮合反応終了後、保護基は除去される。固相法の場合、ペプチドのC末端と樹脂との結合も切断される。その後、薬学合成されたポリペプチドは、例えば、イオン交換クロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相クロマトグラフィー、アフィニティークロマトグラフィー、エドマン分解法またはガスクロマトグラフィー質量分析(GC−MS)等により精製、解析をすることが可能である。
【0042】
遺伝子工学的方法では、本実施の形態1に係るポリペプチドをコードするN1遺伝子またはN1−like遺伝子を用いる。N1遺伝子およびN1−like遺伝子は、当該技術分野の当業者であれば常法を用い、前述の脊椎動物等からDNAの分離精製を行うことが可能である。また、例えば、DNA合成キット等を使用し、人工的にDNA合成を行っても構わない。
【0043】
その後、合成したN1遺伝子またはN1−like遺伝子と、当該遺伝子を宿主細胞内で発現させる為の種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサーおよび/または発現レベルを制御する種々のシスエレメント等)とを用い、発現用遺伝子構築物を有する組換えベクターを宿主細胞に応じて構築する。このようにして構築した組換えベクターは、例えば、所定の宿主細胞(大腸菌等)に導入し、所定の条件で培養する。これにより、本実施の形態1に係るポリペプチドの、宿主細胞内での発現、抽出が可能となる。特に、宿主細胞内での発現では、通常用いられる大腸菌培養による発現、抽出が好ましい。
【0044】
また、本実施の形態2に係るポリペプチドの製造方法には、より効率的な製造方法が存在する。当該製造方法とは、ネイティブケミカルライゲーション法(ネイティブケミカルライゲーション法:Nilsson BL,Soellner MB,Raines RT.、Chemical synthesis of proteins.、Annu.Rev.Biophys.Biomol.Struct.34、91−118、2005参照)を用いる製造方法である。ネイティブケミカルライゲーション法を用いることにより、効率的にN1ペプチドまたはN1−likeペプチドを産生することが可能となる。本発明におけるネイティブケミカルライゲーション法とは、C末端がチオエステル化しているペプチドフラグメントと、N末端にCys残基を持つペプチドフラグメントとを試験管内において混合することにより、分子内でS−Nアシル基転移反応を生じさせ、二つのペプチドフラグメントを連結させる方法を意味する。ネイティブケミカルライゲーション法を用いてのN1ペプチドまたはN1−likeペプチドの製造の詳細については、後述する調製例2を参照されたい。
【0045】
なお、前述の実施の形態1に係るポリペプチドのうち、ニワトリのN1ペプチドまたはN1−likeペプチド等の製造方法においては、ジスルフィド結合を再形成させる工程を含むと好ましい。当該理由および詳細については、実施例4を参照されたい。
【0046】
このようにペプチド合成法または遺伝子工学的方法を用いる方法によって製造した、前述の実施の形態1に係る摂食調節作用をもたらすポリペプチドは、後述の実施の形態3に係る摂食調節組成物の有効成分として利用することが可能となる。
【0047】
(摂食調節組成物)
本発明の実施の形態3は、前述の実施の形態1に係るポリペプチド等を利用した組成物に関する。具体的には、実施の形態1に係るポリペプチド、または、該ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有する、摂食調節組成物である。
【0048】
本明細書において、「摂食調節組成物」とは、具体的には、例えば、摂食調節作用をもたらすことができる、試薬、医薬品または食品等を挙げることができる。さらに詳細には、試薬または医薬品の場合、例えば、液剤、錠剤、顆粒剤、細粒剤、粉剤、タブレットまたはカプセル剤等を挙げることができる。食品の場合、例えば、摂食に関与する疾患等の予防、改善および治療等をコンセプトとした、健康食品、サプリメントまたは特定保健用食品等を挙げることができる。なお、これらの試薬、医薬品または食品等において、ポリペプチド等の有効成分としての含有量、一日における投与量および投与間隔等は、当該組成物等の種類によって適宜調節することが可能であるが、さらに、後述する実施の形態4の摂食量の調節方法も参照されたい。
【0049】
薬学的に許容される誘導体としては、ポリペプチドの一部置換体、ポリペプチドの一部架橋体、または、付加化合物等のポリペプチド誘導体を挙げることができる。さらに具体的には、例えば、カルボキシル基をアミド化またはアシル化した誘導体を例示することができる。薬学的に許容される塩類としては、塩酸塩、硝酸塩もしくは臭化水素酸塩等の無機酸塩、または、p−トルエンスルホン酸塩、メタスルホン酸塩、フマル酸塩、コハク酸塩もしくは乳酸塩等の有機酸塩等を挙げることができる。
【0050】
(摂食量の調節方法)
本発明の実施の形態4は、前述の実施の形態1のポリペプチドおよび実施の形態3の摂食調節組成物を利用する、摂食量の調節方法に関する。具体的には、該ポリペプチドまたは該摂食調節組成物を投与する工程を含む。好ましくは、該ポリペプチドまたは該摂食調節組成物を、非ヒト脊椎動物の脳室内に投与する工程を含む。例えば、ニワトリ、ラットまたはマウス等の脳室内に投与する。
【0051】
本明細書において、「摂食量の調節方法」とは、前述した「摂食調節作用」と同様に、摂食量を促進・増加および/もしくは抑制・減少させる方法という意味を示す。前述したように、摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、それぞれの動物種(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)によって異なるため、本実施の形態4に係る摂食量の調節方法でも、目的とする作用に適した動物種の当該ペプチドを用いればよい。さらに、摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、前述の実施の形態1に係るポリペプチドまたは実施の形態3に係る摂食調節組成物を、単回投与する方法か、または長期間連続投与する方法かによって異なる。本明細書において「単回投与」とは、例えば、1回投与した場合または長期間連続投与する場合でも投与初期の状態を意味する。本明細書において「長期間連続投与」とは、連続的に一定量を一定速度で投与する(例えば一日当たり15nmolの量を投与)という意味のほかに、例えば、定期的に間隔をおいて複数回長期にわたって投与することを意味する。より具体的には、長期間とは、少なくとも5日以上、好ましくは7日以上である。また、連続投与においては、対象動物に対して影響を与えない量および間隔で投与することが好ましい。定期的に間隔をおいての投与の場合、例えば1日に2〜10回、好ましくは1日に5〜7回程度の投与が挙げられる。
【0052】
例えば、ニワトリの場合について述べる。ニワトリにニワトリN1ペプチドもしくはN1−likeペプチドまたは当該ペプチドに係る実施の形態3の摂食調節組成物を単回投与した後、投与後少なくとも約90分までは摂食量は抑制される。
【0053】
例えば、ラットの場合について述べる。ラットにラットN1ペプチドもしくはN1−likeペプチドまたは当該ペプチドに係る実施の形態3の摂食調節組成物を投与(1回(単回)投与)した後、投与後10時間程度までは摂食量が促進する。しかし、当該ペプチドまたは当該摂食調節組成物を、長期間連続投与すると、摂食量は結果的に抑制される。
【0054】
ポリペプチドおよび摂食調節組成物の投与方法は、投与する動物の種類等によって適当な当該技術分野の任意の方法を利用すればよい。例えば、後述する実施例にて詳細に述べるように、手術においてカニューラ等を使用し、直接ラットまたは食用動物等の脳室内に投与する方法が挙げられる。連続投与の場合は、浸透圧ポンプを用いると好ましい。
【0055】
本発明を用いると、例えば、当該ポリペプチドまたは当該摂食調節組成物の摂食促進効果により、食肉用の動物等の生産量を膨大に増加させることも可能となる。さらには、本発明に係るN1ペプチドおよびN1−likeペプチドの生体内機構を研究することにより、摂食に関連する疾患(例えば、拒食症および糖尿病等)の医療および医薬への応用も期待できる。すなわち、当該N1ペプチドおよびN1−likeペプチドの様々な産業へ与える影響、効果は非常に大きなものである。
【実施例】
【0056】
以下、調製例および実施例を用いて本発明をより詳細に説明するが、調製例および実施例は本発明を限定するものではない。
【0057】
(調製例1)
本調製例1では、組み換えラットN1−likeペプチドの製造方法に係る調製例について詳細に述べる。
【0058】
まず、大腸菌を形質転換する為の発現プラスミドの構築を行った。成体ラット(Wistar、雄)の脳から、摂食調節中枢を含む視床下部基底部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。総RNAをOligotexTM−dT30<Super>mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと制限酵素EcoRIサイトを付加した逆方向プライマーとを用いてN1−like遺伝子をPCRにて80μlの系で増幅した。その際、SYBR Premix Ex Taq、ROX Reference Dye(タカラバイオ)を含む反応溶液を作成した。なお、反応条件は、95度20秒間でDNAを変性させ、95度20秒、55度20秒および72度20秒の増幅反応を40サイクル繰り返した。TAクローニングを行う為、最後に72度で10分反応させ、PCR産物にアデニン塩基を付加させた。
【0059】
得られたPCR産物を1.5%アガロースゲルで電気泳動し、N1−like遺伝子の大きさに相当する約300 bp弱のバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてTAクローニングのインサートN1−likeDNAとして回収した。精製したインサートを、pGEM−T Easyベクター(プロメガ)に挿入し、大腸菌のコンピテントセルDH5α株(ニッポンジーン)を形質転換した。得られたコロニーを鋳型にして、順方向プライマーM13FWと逆方向プライマーM13RVとを用いてコロニーPCRを行った。インサートが入っていることを確認したコロニーをアンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いてプラスミド抽出を行った。順方向プライマーM13FWと逆方向プライマーM13RVを用いてプラスミドを鋳型にBigDye反応をし、DNAシークエンサーによりインサートの配列の確認を行った。
【0060】
正しい配列であると確認されたN1−like遺伝子が挿入されたpGEM−T Easyベクター(プロメガ)を制限酵素NdeIとEcoRIで37度1時間で処理した後、1.5%アガロースゲルで電気泳動し、約300bpのバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−likeDNAとして回収した。同様に制限酵素処理して精製したpCold TF DNAベクター(タカラバイオ)にインサートN1−likeDNAを挿入して、DH5α株を形質転換した。得られたコロニーを鋳型にして順方向プライマーpCold−TF−F1と逆方向プライマーpCold−Rを用いてコロニーPCRを行い、インサートが入っているのを確認した。さらに、インサートN1−likeDNAの5’側にpGEM−T Easyベクター由来の配列がないかコロニーPCR産物の配列の確認を行い、付加配列がないと確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、His−TF−N1−likeタンパク質発現プラスミドを回収した。
【0061】
次に、His−TF−N1−likeタンパク質発現プラスミドで、大腸菌のコンピテントセルSHuffle株(NEB)を形質転換した。アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、15度で30分間冷却し、IPTGを終濃度0.1mMになるように添加して、24時間振とう培養した。大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0062】
なお、大量培養は、1Lのバッフル付きフラスコ中に200mlLB培地で振とう速度150 rpmにて行った。IPTGを終濃度0.1mM、菌回収時の遠心は4,000×g、4度、20分間の条件で行った。凍結大腸菌ペレット湿重量1gに対してBugBuster Reagent(Novagen)5mlの割合でタンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0063】
次に、N1−likeペプチドの精製を行った。空カラムに大腸菌ペレット湿重量1gに対してTALONレジン(クロンテック)3ml(50%懸濁液)を入れ、カラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。タンパク質抽出液の上清をカラムに添加し、His−TF−N1−likeタンパク質をTALONレジンに吸着させる為、4度で1時間撹拌した。素通り画分を回収し、カラム体積16倍量の洗浄溶液(50mM NaH2PO4、300mM NaCl、pH7.0)で洗浄した。カラム体積4倍量の溶出バッファー(50mM NaH2PO4、300mM NaCl、100mM イミダゾール、pH7.0)を用いて溶出した。TALONレジンカラム精製での各画分についてSDS−PAGEを行い、2D−銀染色試薬・IIキット(コスモバイオ)でゲルを染色し確認した。
【0064】
溶液交換のためTALONレジンカラム溶出液をFactor Xaプロテアーゼ反応バッファー(20mM Tris−HCl、100mM NaCl、2mM CaCl2、pH8.0)を2時間ごとに2回交換し、一晩4度にて透析した。透析膜チューブから液を回収し、BCA Protein Assay Reagent Kit(サーモフィッシャーサイエンティフィック)を用いてタンパク定量を行った。タンパク質濃度を1mg/mlになるようFactor Xaプロテアーゼ反応バッファー(NEB)を加え、Factor Xaプロテアーゼ(NEB)を終濃度2μg/mlになるように添加し、25度で16時間撹拌した。Factor Xaプロテアーゼ反応液に、PMSFを終濃度1mMになるように入れ、反応を停止させた。Factor Xaプロテアーゼ反応液の一部を用い、15%アクリルアミドゲル(オリエンタルインスツルメンツ)とSDSトリス・トリシン泳動バッファー(コスモ・バイオ)とを用いたSDS−PAGE、および、2D−銀染色試薬・IIキット(コスモ・バイオ)でのゲル染色を行い、タグ切断を確認した。
【0065】
Factor Xaプロテアーゼ反応液中のタグ除去の為、反応液を再度TALONレジンカラムへアプライし、素通り画分を回収した。その方法は次の通りである。まず、TALONレジンをカラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。Factor Xaプロテアーゼ反応液をカラムに添加し、His−TFタンパク質部分をTALONレジンに吸着させるため4度で1時間撹拌した。その後、N1−likeペプチドを含む素通り画分を回収し、0.45μm遠心フィルター(ミリポア)に通した。この液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH 2.2)中33−53%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0066】
さらに、N1−likeペプチドのC末端をアミド化するためにアミド化酵素反応を行った。なお、前述したとおり、ペプチドの形態としてC末端がアミド化されているポリペプチド誘導体が最も好ましい。C末端がアミド化したN1−likeペプチドを、次の組成にて反応させた。N1−likeペプチド0.05mg/ml、0.5%Nonidet P−40、1μg/ml カタラーゼ、10μM CuSO4、1mM アスコルビン酸、0.2M Tris−HCl(pH7.0)、および、10U/ml ペプチジルグリシンα−アミド化酵素(和光純薬工業)を用い、37度で一晩撹拌した。反応終了後、0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH 2.2)中33−53%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したアミド化N1−likeペプチドを凍結乾燥し、−20度で保存した。これを後述の行動実験に用いた。
【0067】
(調製例2)
本調製例2では、ラットのN1−likeペプチドの製造方法に係る調製例について、より効率的に製造できる方法について詳細に説明する。
【0068】
まず、概要について簡単に述べる。本調製例2では、前述した二つのペプチドフラグメントを縮合(ライゲーション)する手法であるネイティブケミカルライゲーション法を用いてラットのN1−likeペプチドを調製した。また、本調製例2では、インテインというタンパク質を使用している。インテインは、タンパク質スプライシング作用を有し、チオエステルを反応中間体としている。つまり、インテインとの組み換え融合タンパク質を構築することによりペプチドの末端がチオエステル化するシステムが開発されており、それを容易にするベクターも商品化されている(NEB)。
【0069】
ペプチド固相合成法によるペプチド製造は通常50アミノ酸残基程度であり、それ以上長いペプチドの製造には、組み換えタンパク質発現や、上記のライゲーション法が必要となる。本調製例2に関するラットのN1−likeペプチドは88アミノ酸残基であり、ペプチド固相合成法のみによるペプチド化学合成は出来ないことがこれまでの先行研究からわかった。一方、ラットのN1−likeペプチドはCys残基を三つ有する。ここで、N末端から二番目のCys残基以降のアミノ酸残基数が61残基で、当該C末端側61アミノ酸残基のペプチド部分をペプチド固相合成法により製造を行った。さらに、このC末端側61アミノ酸残基のペプチドフラグメントと、インテイン融合タンパク質により製造したN末端側のペプチドフラグメントとをライゲーションすることにより、C末端側がアミド化した全長88アミノ酸残基のラットのN1−likeペプチドの製造を、効率よく行うことが出来た。図3は、ネイティブケミカルライゲーション法を用いて調製したラットN1−likeペプチドを示す概要図である。
【0070】
次に、本調製例2の詳細な調製方法について述べる。
【0071】
最初に、大腸菌を形質転換するための発現プラスミドの構築を行った。成体ラット(Wistar、雄)の脳から、摂食調節中枢を含む視床下部基底部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。抽出した総RNAを、OligotexTM−dT30〈Super〉mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと制限酵素SapIサイトを付加した逆方向プライマーとを用いて、N1−likeペプチドのN末端側27アミノ酸残基に対応する遺伝子をPCRにて増幅した。その際、Ex Taqポリメラーゼ(タカラバイオ)を含む反応溶液を作成した。なお、反応条件は、94度3分間でDNAを変性させ、94度30秒、55度30秒および72度15秒の増幅反応を30サイクル繰り返した。
【0072】
得られたPCR産物を、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いて精製し、制限酵素NdeIとSapIで37度において3時間処理した。その後、2%アガロースゲルで電気泳動し、約85bpのバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−like DNAとして回収した。同様に制限酵素処理して精製したインテイン融合タンパク質発現用のpTXB1ベクター(NEB)に、インサートN1−like DNAを挿入して、DH5α株を形質転換した。得られたコロニーを鋳型にし、順方向プライマーT7と逆方向プライマーMxe Intein Reverse IIを用いてコロニーPCRを行い、インサートN1−like DNAが入っていることを確認した。さらに、BigDye反応をし、DNAシークエンサーによりインサートの配列の確認を行った。正しい配列が確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、Ni−likeペプチド27アミノ酸残基とインテインとの融合タンパク質発現プラスミドを回収した。
【0073】
次に、このタンパク質発現プラスミドで、大腸菌のコンピテントセルBL21(DE3)株(BioDynamics)を形質転換した。アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、IPTGを終濃度0.1mMになるように添加して、3時間振とう培養した。大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に、2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0074】
なお、大量培養は、1Lのバッフル付きフラスコ中に300ml LB培地で振とう速度150rpmにて行った。IPTGを終濃度0.1mM、菌回収時の遠心は4,000×g、4度、10分間の条件で行った。凍結大腸菌ペレット湿重量1gに対して、BugBuster Reagent(Novagen)5mlおよびBenzonase(Novagen)2μlの割合で加え、タンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0075】
次いで、N1−likeペプチド27アミノ酸残基とインテインとの融合タンパク質の精製を行った。この融合タンパク質の精製を容易にするためにC末端側にキチン結合ドメインが付加されている。培養液900ml分の抽出液に対してキチンビーズ(NEB)を400ml使用した。オープンカラムにキチンビーズを詰め、10倍量のカラムバッファー(200mM HEPES pH6.5、50mM NaCl)を添加し、カラムを平衡化した。その後、上記で調製した大腸菌抽出液をカラムにロードした。その際、3倍量のカラムバッファーを添加し、非特異的な吸着物を除去した。次いで、カラムの流れを止め、3倍量のクリーベイジバッファー(500mM 2−mercaptoethanesulfonic acid(MESNA)/カラムバッファー)を添加し、25度で16時間反応させた。その後、カラムの栓を開け、反応後の素通り画分を回収した。このクリーベイジによりN1−likeペプチド27アミノ酸残基とインテインとの結合が切れ、さらにC末端がチオエステル化したN1−likeペプチド27アミノ酸残基が得られる。
【0076】
回収した素通り画分を0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより、C18逆相カラム(ODS−80Ts、東ソー)を用いて、0.1%TFA(pH2.2)中32−72%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら精製した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したペプチドを凍結乾燥し、−20度で保存した。
【0077】
N1−likeペプチドのC末端側61アミノ酸残基は、Fmoc法によるペプチド固相合成により製造した。C末端アミド化を生じるレジンを用い、ペプチド合成機(PSSM8、島津)により自動合成を行った。保護基をクリーベイジ後、ジエチルエーテルで洗浄した後に乾燥させ、ジメチルスルホキシド(DMSO)で溶解した。HPLCにより、C18逆相カラム(YMC−Pack Pro C18、YMC)を用いて、0.1%TFA(pH2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収をモニターしながら溶出した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したペプチドを凍結乾燥し、−20度で保存した。
【0078】
このように得られたチオエステル化したN末端側27アミノ酸残基と、アミド化したC末端側61アミノ酸残基からなる二つのペプチドフラグメントを、ネイティブケミカルライゲーション(NCL)法によりライゲーションさせた。
【0079】
まず、ペプチドフラグメントを反応させるNCLバッファー(0.1M 4−mercaptophenylacetic acid(MPAA)、20mM TCEP、8M グアニジン塩酸塩、0.1M Na2HPO4、pH8.0)を調製した。このNCLバッファー1mlに対して、N末端側27アミノ酸残基ペプチド2.0mgと、C末端側61アミノ酸残基ペプチド4.7mgを溶解した(それぞれ0.5〜1.0mM)。その後、チューブ内を窒素で置換し、25度で約24時間静置することでライゲーション反応を行った。この反応液を0.45μm遠心フィルター(ミリポア)に通した後、HPCLによりCN逆相カラム(CN−80Ts、東ソー)を用いて、0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら溶出した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0080】
製造したN1−likeペプチド中のジスルフィド結合は、前述の調製例1と同様に活性発現に重要であると思われる。そのために、フェリシアン化カリウムを用いてジスルフィド結合を生じさせた。凍結乾燥したN1−likeペプチド1mgを、ジメチルスルホキシド(DMSO)0.3mlで溶解し、8M尿素/50mM酢酸アンモニウムバッファー2.7mlを加えた。その後、攪拌しながらさらに150mMフェリシアン化カリウム溶液を60μl加え、室温で1時間攪拌し続けた。次いで、酢酸600μlで反応を停止し、陰イオン交換樹脂(AG4−x4、バイオラッド)に通し過剰なフェリシアン化カリウムを除去した。素通り溶液をHPLCによりCN逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら精製した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0081】
すなわち、前述の調製例1と比較すると、本調製例2は、ラットのN1−likeペプチド(88アミノ酸残基)のN末端側27アミノ酸残基は大腸菌を用いてC末端がチオエステル化した組み換えペプチドとして製造し、C末端側61アミノ酸残基はC末端がアミド化したペプチドをペプチド化学合成により製造し、それぞれのペプチドフラグメントをライゲーションしている。これにより、ラットのN1−likeペプチドのC末端はペプチド固相合成により確実にアミド化しているために、アミド化酵素による翻訳後修飾を施さなくてもよく、より効率的にラットのN1−likeペプチドを製造可能であることが確認された。
【0082】
(実施例1)
本実施例1では、調製例1で製造したアミド化N1−likeペプチドのラットへの単回投与、および投与後2時間における観察実験について詳細に述べる。
【0083】
まず、ラットを購入後1週間程度飼育し、脳手術でのストレスを軽減させる目的でハンドリングを行って馴化させた。ジエチルエーテルでラットを軽く麻酔した後、ソムノペンチル(40mg/kg体重)を腹腔内投与して麻酔し、体が脱力したのを確認してから、イヤーバーを差し込み(7mm)、切歯バーを取り付け、脳定位固定装置(室町機械)に固定した。麻酔の効果で体温が下がるため、手術中はカイロで体温を温めながら行った。頭の毛を剃り70%エタノールで消毒した後、手術用ハサミを用いて正中に沿って頭皮を切り綿棒で止血した。その後、頭蓋骨をアセトンで拭いた。頭蓋骨にあるブレグマとラムダの位置を水平にし、マニュピレーターに取り付けたガイドカニューラの先端をブレグマの位置に合わせ、ラット脳地図を参考にして脳室(左側脳室、ブレグマより後位1mm、側位1.5mm)に先端を移動させて、印をつけた。電動ドリルで印の位置に穴を開け、カニューラを腹位3.7mmに挿入した。挿入後、瞬間接着剤(Loctite454)と歯科用セメントを用いて、カニューラを頭蓋に固定した。手術後、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)とを皮下投与した。投与時以外は挿入したガイドカニューラにダミーカニューラを挿入した。脳手術後1週間、回復期間に当てた。脳室内投与実験2日前に脳室内へカニューラが入っていることを確かめるために、アンギオテンシンII(40pmol)を脳室内投与し、飲水行動が惹起されることを確認した。
【0084】
先端にインターナルカニューラをつけたコネクターチューブに1mlシリンジで滅菌水を満たし、空気をはさんで、投与溶液を充填した。N1−likeペプチド投与は、暗期開始10分前に行い、実験群にはN1−likeペプチド(5nmol/5μl)を、コントロール群には溶媒である0.9%NaClおよび10%DMSO(Dimethyl sulfoxide)を、5μlずつ投与した。投与後は30秒間ほどカニューラをそのままにし、溶液を拡散させてからカニューラを抜き、ダミーカニューラを挿入しケージに戻した。投与後、1および2時間後に摂食量を測定した。
【0085】
図4は、実施例1に係るN1−likeペプチド投与後2時間におけるラットの摂食促進効果の結果を示す図である。なお、縦軸は累積の摂食量(g)を示す。図3に示すように、1時間後(1hr)および2時間後(2hr)のいずれも、コントロールと比較すると有意に摂食量を増加させた。1時間後では、約5倍も摂食量を増加させた。なお、この効果は投与後2時間まで統計的に有意であった(6時間後では有意差はなかった)。これらの結果から、最初、サブトラクション法によって発見した、N1−like遺伝子のパラログ遺伝子である新規摂食調節遺伝子N1遺伝子によりコードされるN1ペプチドであっても、脊椎動物に投与することにより摂食量が増すことが示唆される。また、これらのホモログ遺伝子を有する脊椎動物にも、同様のことが示唆される。
【0086】
(調製例3)
本調製例3では、ラットのN1ペプチドの製造方法に係る調製例について、詳細に説明する。
【0087】
ラットのN1ペプチドは、Fmoc固相法によるペプチド化学合成により製造した。なお、ラットのN1ペプチドのC末端はアミド化している。カップリング試薬としてHBTUを用い、脱保護試薬としてピペリジンを用いた。合成機はマイクロウェーブ法による自動合成が可能な、Liberty1(CEM)を用いた。保護基をクリーベイジ後、合成ペプチドをジエチルエーテルで洗浄した。その後、合成ペプチドをHPLCによりC18逆相カラム(YMC−Pack Pro C18、YMC)を用いて0.1%TFA(pH 2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。
【0088】
製造したN1ペプチド中において、ジスルフィド結合は活性発現に重要であると思われる。そのために、グルタチオンを用いてジスルフィド結合を生じさせた。凍結乾燥したN1ペプチド1mgをジメチルスルホキシド(DMSO)0.1mlで溶解し、1Mトリスバッファー(pH 8.5)0.4ml加えた。さらにアセトニトリル0.5ml、0.5Mエチレンジアミン四酢酸(EDTA)(pH 8.0)2μl、還元型グルタチオン1.5mg、および酸化型グルタチオン0.3mg加え、室温で3日間撹拌した。反応溶液をHPLCによりC18逆相カラム(YMC−Pack Pro C18、YMC)を用いて0.1%TFA(pH 2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。このようにジスルフィド結合を形成したラットのN1ペプチドを凍結乾燥し、−20度で保存した。
【0089】
(実施例2)
本実施例2では、前述の調製例3により製造したN1ペプチドのラットへの単回投与、および投与後22時間における観察実験について詳細に述べる。
【0090】
まず、ラットを購入後1週間程度飼育し、脳手術でのストレスを軽減させる目的でハンドリングを行って馴化させた。ジエチルエーテルでラットを軽く麻酔した後、ソムノペンチル(40mg/kg体重)を腹腔内投与して麻酔し、体が脱力したのを確認してから、イヤーバーを差し込み(7mm)、切歯バーを取り付け、脳定位固定装置(室町機械)に固定した。麻酔の効果で体温が下がるため、手術中はカイロで体温を温めながら行った。頭の毛を剃り70%エタノールで消毒した後、手術用ハサミを用いて正中に沿って頭皮を切り綿棒で止血した。その後、頭蓋骨をアセトンで拭いた。頭蓋骨にあるブレグマとラムダの位置を水平にし、マニュピレーターに取り付けたガイドカニューラの先端をブレグマの位置に合わせ、ラット脳地図を参考にして脳室(左側脳室、ブレグマより後位1mm、側位1.5mm)に先端を移動させて、印をつけた。電動ドリルで印の位置に穴を開け、カニューラを腹位3.5mmに挿入した。挿入後、瞬間接着剤(Loctite454)と歯科用セメントを用いて、カニューラを頭蓋に固定した。手術後、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)を皮下投与した。
【0091】
次に、先端にインターナルカニューラをつけたコネクターチューブに1mlシリンジで滅菌水を満たし、空気をはさんで、投与溶液を充填した。N1ペプチド投与は、明期2時間後に行い、実験群にはN1ペプチド(5nmol/5μl)を、コントロール群には溶媒であるPBS(Phosphate buffered saline,pH7−8)および10%DMSO(Dimethyl sulfoxide)を、5μlずつ投与した。投与後は30秒間ほどカニューラをそのままにし、溶液を拡散させてからカニューラを抜き、ダミーカニューラを挿入しケージに戻した。投与後、1、2、6、10および22時間後に摂食量を測定した。
【0092】
図5は、実施例2に係るN1ペプチド単回投与後22時間におけるラットの摂食促進効果の結果を示す図である。なお、縦軸は総摂食量(g)を示す。図5に示すように、30分後(0−0.5h)から10時間後(0−10h)のいずれも、コントロールと比較すると有意に摂食量を増加させた(n=4、*:p<0.05)。なお、22時間後では有意差がなかった。このように、ラットのN1−likeペプチドだけでなく、ラットのN1ペプチドの場合でも単回投与することによって、投与後10時間程度にわたって摂食量が促進するということが確認された。
【0093】
(実施例3)
本実施例3では、前述の調製例3により製造したN1ペプチドのラットへの長期間(1週間)にわたる連続投与の実験について詳細に述べる。
【0094】
ラットの飼育から、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)の皮下投与までの手順は、前述した実施例2と同様である。その後、浸透圧ポンプ(Alzet model2002)にN1ペプチド(1.25nmol/μl、pH7−8)の投与溶液を充填した。次にチューブ(5cm)を介してカニューラ(Brain infusion kit 1,Alzet)を浸透圧ポンプと連結させた。浸透圧ポンプは、カニューラの脳内への挿入前に37℃の0.9%NaClに12時間以上浸して可動させておいた。このカニューラをラットの脳室へ挿入した後、浸透圧ポンプをラットの肩甲骨の皮下へと埋め込み、1週間の長期間投与(15nmol/day)を行った。コントロール群には溶媒であるPBS(Phosphate buffered saline,pH7−8)および10%DMSO(Dimethl sulfoxide)を投与した。
【0095】
図6は、実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重変化を示す図である。なお、縦軸は体重(g)を示す。図6に示すように、6日目からコントロールと比較し、有意に体重が減少した(n=8、*:p<0.05)。なお、22時間後では有意差がなかった。また、この際の体重増加量についても確認した。図7は、実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重増加量を示す図である。なお、縦軸は体重増加量(g)を示し、手術当日の体重を0gとしている。図7に示すように、体重増加量(g)では、4日目からコントロールと比較し、有意に体重増加量が減少していた(n=8、*:p<0.05、**:p<0.01)。
【0096】
さらに、当該ラットの1日分の総摂食量の変化について確認した。その際、まず、明期12時間(昼夜を明期12時間と暗期12時間とした場合)における、総摂食量の変化について確認した。図8は、実施例3に係るN1ペプチド長期間連続投与におけるラットの明期12時間の総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05、**:p<0.01である。図8に示すように、明期12時間では摂食量を増やす効果があることが確認された。次いで、暗期12時間における、総摂食量の変化について確認した。図9は、実施例3に係るN1ペプチド長期間連続投与におけるラットの暗期12時間の総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05、**:p<0.01である。図9に示すように、手術日5日目から有意差を確認できた。暗期12時間では明期12時間とは逆で、摂食量を減少させる効果があることが確認された。
【0097】
これらを踏まえ、N1ペプチド1週間連続投与ラットの24時間単位での総摂食量の変化について確認した。図10は、実施例3に係るN1ペプチド長期間連続投与におけるラットの総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05である。図10に示すように、投与開始1日目では有意にN1ペプチド投与群の摂食量(g)が促進されるが、投与開始7日目となるとN1ペプチド投与群の摂食量(g)が減少することが確認された。
【0098】
当該N1ペプチド長期間連続投与での摂食量減少という実験結果は、前述の図6および図7の体重および体重増加量減少にも現れている。また、図8および図9のみの結果を比較すると、図8での明期の摂食量の増加は多い場合でも約4g程度であるが、図9での暗期の摂食量の減少は多い場合約15g程度まで達している。これは、暗期、すなわちラットの活動期に着目すれば摂食量の減少を顕著に多く起こすことを示しており、すなわち、活動期の摂食量の抑制がなされ、その結果、前述のとおり体重の減少という現象に現れたと考えられる。
【0099】
(調製例4)
本調製例4では、組み換えニワトリN1−likeペプチドの製造方法に係る調製例について詳細に述べる。
【0100】
まず、大腸菌を形質転換するための発現プラスミドの構築を行った。ニワトリ雛の脳から、摂食調節中枢を含む視床下部漏斗部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。抽出した総RNAを、OligotexTM−dT30〈Super〉mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。次いで、そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと、制限酵素EcoRIサイトを付加した逆方向プライマーとを用いてN1−like遺伝子をPCRにて100μlの系で増幅した。なお、N1−likeペプチド製造後にアミド化酵素によりC末端アミド化処理を行うために、C末端はGly残基が付加するように逆方向プライマーを設計した。その際、Ex Taqポリメラーゼ(タカラバイオ)を含む反応溶液を作成した。なお、当該反応条件は、94度3分間でDNAを変性させ、94度30秒、55度30秒および72度30秒の増幅反応を30サイクル繰り返した。
【0101】
得られたPCR産物を、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いて精製し、制限酵素NdeIとEcoRIで37度で1時間処理した後、1.5%アガロースゲルで電気泳動を行った。その後、電気泳動での約300bpのバンドを、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−like DNAとして回収した。同様に制限酵素処理して精製したpCold TF DNAベクター(タカラバイオ)にインサートN1−like DNAを挿入して、DH5α株を形質転換した。次に、得られたコロニーを鋳型にし、順方向プライマーpCold−TF−F1と、逆方向プライマーpCold−Rとを用いてコロニーPCRを行い、インサートが入っていることを確認した。さらに、BigDye反応を行い、DNAシークエンサーによりインサートの配列の確認も行った。正しい配列が確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、His−TF−N1−likeタンパク質発現プラスミドを回収した。
【0102】
次に、His−TF−N1−likeタンパク質発現プラスミドで、大腸菌のコンピテントセルBL21 Star(DE3)pLysS株(インビトロジェン)を形質転換した。その後、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、15度で30分間冷却し、IPTGを終濃度0.1mMになるように添加して、24時間振とう培養した。当該大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。次に、大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に、2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0103】
なお、大量培養は、1Lのバッフル付きフラスコ中に300ml LB培地で振とう速度150rpmにて行った。IPTGの添加は終濃度0.1mMとなるように行い、菌回収時の遠心は4,000×g、4度、20分間の条件で行った。なお、凍結大腸菌ペレット湿重量1gに対して、BugBuster Reagent(Novagen)5mlと、Benzonase(Novagen)5μlの割合で加え、タンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0104】
次に、ニワトリのN1−likeペプチドの精製を行った。空カラムに大腸菌ペレット湿重量約3gに対してTALONレジン(クロンテック)20ml(50%懸濁液)を入れ、カラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。タンパク質抽出液の上清をカラムに添加し、素通り画分を回収し、カラム体積5倍量の洗浄溶液(50mM NaH2PO4、300mM NaCl、pH7.0)で洗浄した。また、カラム体積3倍量の溶出バッファー(50mM NaH2PO4、300mM NaCl、200mM イミダゾール、pH7.0)を用いて溶出した。TALONレジンカラム精製での各画分については、SDS−PAGEを行い、2D−銀染色試薬・IIキット(コスモバイオ)でゲルを染色し、確認した。
【0105】
溶液交換のため、TALONレジンカラム溶出液を、Factor Xaプロテアーゼ反応バッファー(20mM Tris−HCl、100mM NaCl、2mM CaCl2、pH8.0)を2時間ごとに2回交換し、一晩4度にて透析した。その後、透析膜チューブから液を回収し、BCA Protein Assay Reagent Kit(サーモフィッシャーサイエンティフィック)を用いてタンパク定量を行った。タンパク質濃度を1mg/mlになるようFactor Xaプロテアーゼ反応バッファーを加え、Factor Xaプロテアーゼ(NEB)を終濃度1μg/mlになるよう添加し、25度で16時間攪拌した。その後、Factor Xaプロテアーゼ反応液に、トリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)(ナカライテスク)を終濃度50mMになるように加え、一晩4度で還元反応を行った。
【0106】
この工程は、本発明者らが研究した結果、発現したニワトリのN1−likeペプチドは、可溶化タグ(TF)と強い相互作用を有しており、可溶化タグ切断のためのプロテアーゼ(Factor Xa)を用いて切断した後も離れないことを解明し、強い還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)を作用させることによって、その相互作用を切断することを発見したことによる。
【0107】
還元処理を行ったサンプル中にはタグタンパク質が存在しているために、終濃度80%になるように冷アセトンを加え、氷水中で30分間冷却し、不要なタグタンパク質を沈殿させ、遠心分離し除去した。その後、上清のアセトンを遠心エバポレーターで蒸発させ、残りの溶液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0108】
なお、前述のTCEPによる還元処理のために、N1−likeペプチド中の二つのCys残基からなるジスルフィド結合は解離した状態となってしまう。そのため、再度酸化させ、ジスルフィド結合を再形成させる必要がある。ここで、凍結乾燥したN1−likeペプチド1mgを、8M尿素/50mM酢酸アンモニウムバッファー1mlで溶解させ、さらに150mMフェリシアン化カリウム溶液を20μl加え、室温にて1時間攪拌した。その後、酢酸200μlで反応を停止し、陰イオン交換樹脂(AG4−x4、バイオラッド)に通し、鉄イオンを除去した。素通り溶液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中32−52%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0109】
さらに、N1−likeペプチドのC末端をアミド化するために、アミド化酵素反応を行った。なお、ペプチドの形態として、C末端がアミド化されているポリペプチド誘導体が最も好ましい。C末端がGlyであるN1−likeペプチドを、次の組成にてアミド化反応させた。当該組成は、N1−likeペプチド0.5mg/ml、0.5%Nonidet P−40、100μg/mlカタラーゼ、20μM CuSO4、1mMアスコルビン酸、0.2M Tris−HCl(pH7.0)、および、10U/mlペプチジルグリシンα−アミド化酵素(和光純薬工業)であり、これらを37度で一晩攪拌した。反応終了後、0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中32−52%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。これを後述のニワトリの行動実験に用いた。
【0110】
(実施例4)
本実施例4では、調製例4で製造したニワトリのアミド化N1−likeペプチドを利用したニワトリ雛への投与実験について詳細に述べる。
【0111】
まず、ニワトリ雛を購入後3〜4日程度個別飼育した。その後、脳室内投与用の自作の脳定位固定装置にてニワトリ雛の頭部を保持し、マイクロシリンジを用いて脳室内投与を行った。N1−likeペプチド投与は、実験群(8個体)にはN1−likeペプチド(5nmol/5μl)を、コントロール群(11個体)には溶媒である10%DMSO(Dimethyl sulfoxide)を含んだ10mMリン酸緩衝食塩水をそれぞれ5μlずつ投与した。投与後、30、60および90分後に摂食量を測定した。なお、脳室内投与成功の有無は、投与液に青色の色素であるエバンスブルーを混合しておき、実験終了後に脳室内に色素が注入されていることで確認を行った。脳室内に色素が注入されていない個体はデータから排除した。
【0112】
図11は、実施例4に係るN1−likeペプチド単回投与におけるニワトリ雛の摂食抑制効果の結果を示す図である。なお、縦軸は累積の摂食量(g)を示す。図11に示すように、60分後および90分後のいずれも、コントロールと比較すると有意に摂食量が抑制されている。これらの結果から、ニワトリのN1−likeペプチドをニワトリ雛の脳室内に投与すると、ラットのN1−likeペプチドとは相反して、摂食量を抑制させる効果を有するということがわかった。
【0113】
このように、実施例1ないし実施例4の結果を考慮すると、N1ペプチドおよびN1−likeペプチドは、単回、複数回、連続投与および投与間隔等の投与方法によって、摂食量を促進または抑制させる摂食調節が可能であったり、同様の投与方法であっても他の動物種であったら相反する作用効果での摂食調節が可能であることが確認された。すなわち、種々の脊椎動物のホモログ遺伝子のN1ペプチドおよびN1−likeペプチドを利用することにより、任意の摂食調節が可能である。
【0114】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0115】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【0116】
本出願は、2011年3月24日に出願された日本国特許出願2011−65216号に基づく。本明細書中に、日本国特許出願2011−65216号の、明細書、特許請求の範囲、図面全体を参照として取り込むものとする。
【産業上の利用可能性】
【0117】
本発明者らが鋭意研究した結果、大腸菌を用いて製造させたラットのN1−likeペプチドをラットの脳室内に投与すると、投与後10時間程度はコントロール群と比較して摂取量を促進するようになるということを発見した。一方、ニワトリのN1−likeペプチドをニワトリの脳室内に投与すると、ラットとは逆に、投与後90分間程度はコントロール群と比較して摂取量を抑制するようになるということを発見した。さらに、ラットのN1ペプチドを長期間ラットに連続投与すると、6、7日以降には摂食抑制の効果を有するということも発見した。また、当該ラットのN1−likeペプチドはネイティブケミカルライゲーション法を用いることによって効率よく製造できることも見出した。
【0118】
そこで、本発明によれば、N1ペプチドおよびN1−likeペプチドの詳細な特性が開示、解明され、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法が提供される。すなわち、具体的には、食肉動物の生産量を膨大に増加させることも可能となり、さらには、摂食に関連する疾患(例えば拒食症および糖尿病等)の医療および医薬への応用も期待できる。
【技術分野】
【0001】
本発明は、摂食調節中枢において合成される神経ペプチドに関連する、ポリペプチド、ポリペプチドの製造方法、摂食調節組成物および摂食量の調節方法に関する。
【背景技術】
【0002】
視床下部には摂食調節中枢が存在しており、多くの神経ペプチドが合成されていることが知られている。このような摂食調節に関連する神経ペプチドについては、数々の産業に利用できることもあり、多くの研究がなされている(非特許文献1ないし非特許文献3参照)。その中でも、摂食を調節する神経ペプチドとして、ニューロペプチドY(NPY)が最もよく知られている(特許文献1参照)。この神経ペプチドニューロペプチドYは、脳内に広く分布しており、摂食以外にもエネルギー調節に重要な役割を果たしていることが知られている。
【0003】
ニューロペプチドY以外の摂食に関連する神経ペプチドは、いくつか知られているが、それら因子のみで摂食調節機構の全容を説明することは困難である。そこで、本発明者らにより、同様の摂食調節遺伝子が視床下部に存在するか否かが検討された。その結果、摂食調節に関連する分泌性ペプチドの前駆体と考えられる新規遺伝子の存在が見出され、別の染色体に存在しているパラログ遺伝子も見出された。また、これらのホモログ遺伝子は魚類、両生類、鳥類および哺乳類を含めた多くの動物種に存在していることも明らかとなった。さらに、当該新規遺伝子mRNA発現量が、エネルギーホメオスタシスに関連して変動することも明らかとなった(非特許文献4および非特許文献5参照)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2003−528051号公報
【非特許文献】
【0005】
【非特許文献1】Shinsuke Oh−I,Hiroyuki Shimizu,Tetsurou Satoh,Shuichi Okada,Sachika Adachi,Kinji Inoue,Hiroshi Eguchi,Masanori Yamamoto,Toshihiro Imaki,Koushi Hashimoto,Takafumi Tsuchiya,Tsuyoshi Monden,Kazuhiko Horiguchi,Masanobu Yamada and Masatomo Mori、2006、Identification of nesfatin−1 as a satiety molecule in the hypothalamus.、Nature 443、709−712
【非特許文献2】A.Sainsbury,L. Zhang、2010、Role of the arcuate nucleus of the hypothalamus in regulation of body weight during energy deficit.、Molecular and Cellular Endocrinology 316、109−119
【非特許文献3】Elena Valassi, Massimo Scacchi, Francesco Cavagnini、2008、Neuroendocrine control of food intake.、Nutritin, Metabolism and Cardiovascular Diseases.18、158−168
【非特許文献4】浮穴和義、岩越−浮穴栄子、田中幸恵、橘哲也、2010、ニワトリの視床下部で見出した新規摂食調節関連遺伝子、(社)日本動物学会第81回大会予稿集、129
【非特許文献5】岩越栄子、田中幸恵、橘哲也、浮穴和義、2010、視床下部における新規摂食調節関連遺伝子の発見、第35回日本比較内分泌学会及びシンポジウム2010静岡、38
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、前述の分泌性ペプチドのアミノ酸配列、ならびに、その前駆体と考えられる新規遺伝子の塩基配列およびアクセッション番号等については、未だ解明されていない。そのため、当該分泌性ペプチドを用い摂食調節を行おうとする場合、本発明者らが長期にわたり行った後述する研究および検討方法を再度経て、当該分泌性ペプチドのアミノ酸配列等を特定する必要があり、また、当該ペプチドの発現機構を解明する必要がある。
【0007】
さらに、当該分泌性ペプチドの詳細な特性についても未だ解明されていない。詳細な特性とは、神経ペプチド部分として機能しているアミノ酸配列部分、当該分泌性ペプチドを用いた具体的な摂食調節方法、すなわち摂食促進および/または抑制方法、ならびに、摂食調節作用が機能するペプチドのアミノ酸配列の状態等が挙げられる。このような詳細な特性が解明された際には、当該分泌性ペプチドの摂食調節効果を利用することにより、産業上非常に大きく有意な影響を与えることとなる。
【0008】
なお、当該新規遺伝子およびその分泌性ペプチド、ならびに前述した別の染色体に存在しているパラログ遺伝子およびその分泌性ペプチドについて、それぞれの脊椎動物等のホモログ遺伝子も含め、コードネームとして、以下、N1遺伝子およびN1ペプチド、ならびにN1−like遺伝子およびN1−likeペプチドと示す。図1は、本発明に係るラットのN1ペプチドおよびN1−likeペプチドを含む前駆体タンパク質の模式構造を示す図である。
【0009】
本発明は上記事情に鑑みてなされたものであり、N1ペプチドおよびN1−likeペプチドの詳細な特性を解明し、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記目的を達成する為に、本発明者らが行った研究の経緯および方法について説明する。まず、食欲旺盛なニワトリ(ブロイラー)の摂食調節中枢の1つである視床下部漏斗部において、小脳に発現している遺伝子と比較し、特異的に発現している遺伝子群に着目した。このような1000以上の遺伝子群から摂食調節に関連する神経ペプチドとなる遺伝子を網羅的に探索し、同定する為、ニワトリの雛の視床下部漏斗部と小脳から総RNAを抽出し、サブトラクティブ・ハイブリダイゼーションを行い、視床下部漏斗部において発現差のある遺伝子群をスクリーニングし、その後、DNAシークエンサーを用いて当該遺伝子群の配列を同定した。
【0011】
このように得られた遺伝子群の配列を、NCBIにおけるGenbank配列データベースに対するニワトリのBasic Local Alignment Search Tool(BLAST)検索を用いて解析した。その結果、機能既知のタンパク質をコードした遺伝子を除くと、20の遺伝子に選出することができた。
【0012】
さらに、選出した機能未知遺伝子20種類について、ニワトリの視床下部漏斗部にのみ特異的に発現している遺伝子であるかどうかを調べる為に、リアルタイムPCRによる二次スクリーニングを行った。このように、二度のスクリーニングによって選出した結果、ある1つの機能未知遺伝子が、ニワトリの視床下部漏斗部に特異的に発現していることが明らかとなった。なお、ここで選出された1つのニワトリの機能未知遺伝子のアクセッション番号は、XM_430126であった。また、前述したように、当該機能未知遺伝子は、ホモログ遺伝子として魚類、両生類、鳥類および哺乳類を含めた多くの動物種に存在していることもデータベース検索を行って確認できた。図2は、種々の脊椎動物のN1ペプチドおよびN1−likeペプチドに係るアミノ酸配列のアライメントを示す図である。図2において、黒色で示す部分は、検索、解析した全ての動物種で共通なアミノ酸配列の部分を示す。
【0013】
さらに、翻訳したアミノ酸配列中にシグナルペプチドがあるかどうかについて、コンピュータープログラムSignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP/)にて解析したところ、シグナルペプチドが含まれることも示唆された。また、当該アミノ酸配列中にプロセシングサイト(GKR)の存在も発見された為(図1参照)、シグナルペプチド以降の80アミノ酸残基のC末端がアミド化しており神経ペプチドとして製造されると予測された。このような経緯および方法を経て、本発明に係る摂食調節に関連するN1ペプチドおよびN1−likeペプチドの発見に至った。
【0014】
なお、ニワトリのN1ペプチドのアミノ酸配列を配列番号1に、ヒトのN1ペプチドのアミノ酸配列を配列番号2に、ラットのN1ペプチドのアミノ酸配列を配列番号3に、マウスのN1ペプチドのアミノ酸配列を配列番号4に、ニワトリのN1−likeペプチドのアミノ酸配列を配列番号5に、ヒトのN1−likeペプチドのアミノ酸配列を配列番号6に、ラットのN1−likeペプチドのアミノ酸配列を配列番号7に、マウスのN1−likeペプチドのアミノ酸配列を配列番号8に示す。また、ニワトリのN1遺伝子の塩基配列を配列番号9に、ヒトのN1遺伝子の塩基配列を配列番号10に、ラットのN1遺伝子の塩基配列を配列番号11に、マウスのN1遺伝子の塩基配列を配列番号12に、ニワトリのN1−like遺伝子の塩基配列を配列番号13に、ヒトのN1−like遺伝子の塩基配列を配列番号14に、ラットのN1−like遺伝子の塩基配列を配列番号15に、マウスのN1−like遺伝子の塩基配列を配列番号16に示す。
【0015】
このように、本発明者らが鋭意研究を行った結果、N1ペプチドおよびN1−likeペプチドの詳細な特性、すなわちアミノ酸配列およびその前駆体と考えられる新規遺伝子の塩基配列およびアクセッション番号等が解明された。
【0016】
本発明の第1の態様に係るポリペプチドは、以下の(a)ないし(f)のいずれかであり、かつ摂食調節作用を有することを特徴とする。
(a)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(b)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(c)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
(d)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(e)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(f)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
【0017】
好ましくは、前記ポリペプチドのC末端は、アミド化していることを特徴とする。
【0018】
より好ましくは、前記ポリペプチドは、少なくとも1つのジスルフィド結合を有することを特徴とする。
【0019】
さらに好ましくは、前記ポリペプチドは、ニワトリ(Gallus gallus)、ヒト(Homo sapiens)、ラット(Rattus norvegicus)、および/または、マウス(Mus musculus)に対する摂食調節作用を有することを特徴とする。
【0020】
本発明の第2の態様に係るポリペプチドの製造方法は、第1の態様に係るポリペプチドを作製することを特徴とする。
【0021】
好ましくは、前記製造方法は、大腸菌培養による遺伝子工学的製造方法を用いることを特徴とする。
【0022】
また、好ましくは、前記製造方法は、ネイティブケミカルライゲーション法を用いることを特徴とする。
【0023】
好ましくは、製造される前記ポリペプチドは、配列番号3もしくは7に記載のアミノ酸配列、配列番号3もしくは7に記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列、または、配列番号3もしくは7に記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列のいずれかであることを特徴とする。
【0024】
また、好ましくは、製造される前記ポリペプチドは、配列番号5に記載のアミノ酸配列を有するポリペプチドであり、ジスルフィド結合を再形成させる工程を含むことを特徴とする。
【0025】
本発明の第3の態様に係る摂食調節組成物は、第1の態様に係るポリペプチド、または、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有することを特徴とする。
【0026】
本発明の第4の態様に係る摂食量の調節方法は、第1の態様に係るポリペプチドまたは第3の態様に係る摂食調節組成物を投与する工程を含むことを特徴とする。
【0027】
好ましくは、前記ポリペプチドまたは前記摂食調節組成物を、脊椎動物の脳室内に投与することを特徴とする。
【0028】
より好ましくは、前記摂食量の調節方法は摂食量の抑制方法であり、ラットの脳室内に前記ポリペプチドまたは前記摂食調節組成物を長期間連続投与することを特徴とする。
【発明の効果】
【0029】
本発明によれば、N1ペプチドおよびN1−likeペプチドの詳細な特性が解明され、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法が提供される。
【図面の簡単な説明】
【0030】
【図1】本発明に係るラットのN1ペプチドおよびN1−likeペプチドを含む前駆体タンパク質の模式構造を示す図である。
【図2】種々の脊椎動物のN1ペプチドおよびN1−likeペプチドに係るアミノ酸配列のアライメントを示す図である。
【図3】ネイティブケミカルライゲーション法を用いて調製したラットN1−likeペプチドを示す概要図である。
【図4】実施例1に係るN1−likeペプチド単回投与後2時間におけるラットの摂食促進効果の結果を示す図である。
【図5】実施例2に係るN1ペプチド単回投与後22時間におけるラットの摂食促進効果の結果を示す図である。
【図6】実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重変化を示す図である。
【図7】実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重増加量を示す図である。
【図8】実施例3に係るN1ペプチド長期間連続投与におけるラットの明期12時間の総摂食量を示す図である。
【図9】実施例3に係るN1ペプチド長期間連続投与におけるラットの暗期12時間の総摂食量を示す図である。
【図10】実施例3に係るN1ペプチド長期間連続投与におけるラットの総摂食量を示す図である。
【図11】実施例4に係るN1−likeペプチド単回投与におけるニワトリ雛の摂食抑制効果の結果を示す図である。
【発明を実施するための形態】
【0031】
以下、本発明の実施の形態について詳細に説明する。なお、本明細書において「有する」、「含む」または「含有する」といった表現は、「からなる」または「から構成される」という意も含むものとする。
【0032】
(ポリペプチド)
本発明の実施の形態1は、特定のアミノ酸配列を有し、摂食調節効果を有するポリペプチドに関する。特定のアミノ酸配列とは、好ましくは、ニワトリのN1ペプチドである配列番号1に記載のポリペプチド、ヒトのN1ペプチドである配列番号2に記載のポリペプチド、ラットのN1ペプチドである配列番号3に記載のポリペプチド、または、マウスのN1ペプチドである配列番号4に記載のポリペプチドのいずれかが挙げられるが、最も好ましくは、後述する実施例2および3にて確認されているラットのN1ペプチドである配列番号3に記載のポリペプチドである。N1−likeペプチドの場合、好ましくは、ニワトリのN1−likeペプチドである配列番号5に記載のポリペプチド、ヒトのN1−likeペプチドである配列番号6に記載のポリペプチド、ラットのN1−likeペプチドである配列番号7に記載のポリペプチド、または、マウスのN1−likeペプチドである配列番号8に記載のポリペプチドのいずれかが挙げられるが、同様に、最も好ましくは、後述する実施例1および4にて確認されている、ニワトリのN1−likeペプチドである配列番号5に記載のポリペプチド、または、ラットのN1−likeペプチドである配列番号7に記載のポリペプチドである。
【0033】
次に好ましい特定のアミノ酸配列とは、N1ペプチドの場合、配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。N1−likeペプチドの場合、配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。
【0034】
なお、「数個」とは、各々のポリペプチドのアミノ酸配列の長さによって異なり、例えば、15個ないし1個のいずれか、10個ないし1個のいずれか、5個ないし1個のいずれか、または、3個ないし1個のいずれか等の個数が挙げられる。また、本明細書において「摂食調節作用(効果)を有する(もたらす)」とは、摂食量の促進・増加および/もしくは抑制・減少作用を有する(もたらす)という意味を示し、さらに通常これらと同様の意味で使用される言語も含まれる。具体的には、例えば、ヒト、ラットまたはマウス等の脊椎動物に、当該ポリペプチドまたはコントロールとしての生理食塩水等を投与した際に、投与後の当該脊椎動物の摂食に対する作用(摂食量等)を比較し、ポリペプチドまたはコントロールの当該作用が異なる状況を示す。特に、このような摂食調節作用がもたらされる脊椎動物は、ニワトリ、ヒト、ラットまたはマウスのいずれかが好ましい。摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、それぞれの動物種(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)によって異なる。
【0035】
また、他の好ましい特定のアミノ酸配列には、N1ペプチドの場合、配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。N1−likeペプチドの場合、配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなり、かつ摂食調節作用を有するポリペプチドが挙げられる。なお、これらポリペプチドの配列の同一性に関しては、好ましくは60%以上、より好ましくは70%以上、さらに好ましくは80%以上、最も好ましくは90%以上の同一性を有する。
【0036】
前述のような、ニワトリ、ヒト、ラットまたはマウスのN1ペプチドまたはN1−likeペプチドのアミノ酸配列と相同性が高いポリペプチドであって、かつ摂食調節効果を有するポリペプチドであれば、前述した本発明者らが行った研究の経緯の結果から、これらのポリペプチドは、前述以外の他の脊椎動物(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)等のN1遺伝子またはN1−like遺伝子から翻訳されるN1ペプチドまたはN1−likeペプチドであることが示唆される(図2参照)。
【0037】
このような特定のアミノ酸配列を有する本実施の形態1に係るポリペプチドは、ポリペプチドのC末端がアミド化していることが好ましい。また、ポリペプチドが、少なくとも1つのジスルフィド結合を有しているとより好ましい。
【0038】
(ポリペプチドの製造方法)
本発明の実施の形態2は、前述の実施の形態1のポリペプチドを製造する方法に関する。そのため、本実施の形態2は、前述の実施の形態1のポリペプチドに特徴を有する。従って、本実施の形態2の製造方法は、当該技術分野の任意の方法で当該ポリペプチドのアミノ酸配列の長さが合成、製造可能である方法であれば限定されない。例えば、当該技術分野における常法である、人工的なポリペプチド合成法によって合成してもよいし、大腸菌等を用いた遺伝子工学的な方法を用いて製造してもよい(調製例参照)。具体的には、ポリペプチド合成法の場合、液相法または固相法を挙げることができる。液相法は、反応を溶液状態で行い、反応混合物から生成物を単離精製し、この生成物を中間体として次のペプチド伸長反応に用いる方法である。一方、固相法は、反応溶媒に対して不溶の固相担体にアミノ酸を結合させ、このアミノ酸に順次縮合反応を行い、ペプチド鎖を伸長させていく方法である。
【0039】
具体的に、ポリペプチド合成は、まず、カルボキシル基を保護したアミノ酸にアミノ基を保護したアミノ酸を脱水縮合させ、ペプチド結合を形成させる。次に、アミノ保護基を除去後、遊離したアミノ基に次のアミノ基保護アミノ酸をC末端からN末端に向かって1つずつ順次延長させていく。脱水縮合反応では、カルボキシル基を活性化し、結合させようとするアミノ基と反応させる。活性化にはジシクロへキシカルボジイミド(DCC)法、活性エステル法、酸無水物法またはアジド法等が挙げられるが、その反応性の高さ、ラセミ化およびその他の副反応を考慮し、適宜選択すればよい。縮合反応時の副反応を防止する為、アミノ酸のアミノ基、カルボキシル基および/または側鎖の官能基には保護基が導入される。これらの保護基は、縮合反応での条件において安定であり、必要な時には速やかに除去可能であるものが好ましい。また、アミノ基の保護基とカルボキシル基の保護基とは、互いに選択的に除去可能であることが好ましい。
【0040】
アミノ基の保護基としては、例えば、ベンジルオキシカルボニル(Bz)、t−ブチルオキシカルボニル(Boc)、p−ビフェニルイソプロピロオキシカルボニルまたは9−フルオレニルメチルオキシカルボニル(Fmoc)等を挙げることができる。カルボキシ基の保護基としては、例えば、アルキルエステルまたはベンジルエステル等を形成し得る基を挙げることができる。
【0041】
ただし、固相法の場合、C末端のカルボキシル基は、クロロトリチル樹脂、クロルメチル樹脂、オキシメチル樹脂またはp−アルコキシベンジルアルコール樹脂等の担体に結合している為、縮合反応はカルボジイミド等の縮合剤の存在下、またはN保護アミノ酸活性エステルもしくはペプチド活性エステルを用いて実施すると好ましい。縮合反応終了後、保護基は除去される。固相法の場合、ペプチドのC末端と樹脂との結合も切断される。その後、薬学合成されたポリペプチドは、例えば、イオン交換クロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相クロマトグラフィー、アフィニティークロマトグラフィー、エドマン分解法またはガスクロマトグラフィー質量分析(GC−MS)等により精製、解析をすることが可能である。
【0042】
遺伝子工学的方法では、本実施の形態1に係るポリペプチドをコードするN1遺伝子またはN1−like遺伝子を用いる。N1遺伝子およびN1−like遺伝子は、当該技術分野の当業者であれば常法を用い、前述の脊椎動物等からDNAの分離精製を行うことが可能である。また、例えば、DNA合成キット等を使用し、人工的にDNA合成を行っても構わない。
【0043】
その後、合成したN1遺伝子またはN1−like遺伝子と、当該遺伝子を宿主細胞内で発現させる為の種々の調節エレメント(プロモーター、リボゾーム結合部位、ターミネーター、エンハンサーおよび/または発現レベルを制御する種々のシスエレメント等)とを用い、発現用遺伝子構築物を有する組換えベクターを宿主細胞に応じて構築する。このようにして構築した組換えベクターは、例えば、所定の宿主細胞(大腸菌等)に導入し、所定の条件で培養する。これにより、本実施の形態1に係るポリペプチドの、宿主細胞内での発現、抽出が可能となる。特に、宿主細胞内での発現では、通常用いられる大腸菌培養による発現、抽出が好ましい。
【0044】
また、本実施の形態2に係るポリペプチドの製造方法には、より効率的な製造方法が存在する。当該製造方法とは、ネイティブケミカルライゲーション法(ネイティブケミカルライゲーション法:Nilsson BL,Soellner MB,Raines RT.、Chemical synthesis of proteins.、Annu.Rev.Biophys.Biomol.Struct.34、91−118、2005参照)を用いる製造方法である。ネイティブケミカルライゲーション法を用いることにより、効率的にN1ペプチドまたはN1−likeペプチドを産生することが可能となる。本発明におけるネイティブケミカルライゲーション法とは、C末端がチオエステル化しているペプチドフラグメントと、N末端にCys残基を持つペプチドフラグメントとを試験管内において混合することにより、分子内でS−Nアシル基転移反応を生じさせ、二つのペプチドフラグメントを連結させる方法を意味する。ネイティブケミカルライゲーション法を用いてのN1ペプチドまたはN1−likeペプチドの製造の詳細については、後述する調製例2を参照されたい。
【0045】
なお、前述の実施の形態1に係るポリペプチドのうち、ニワトリのN1ペプチドまたはN1−likeペプチド等の製造方法においては、ジスルフィド結合を再形成させる工程を含むと好ましい。当該理由および詳細については、実施例4を参照されたい。
【0046】
このようにペプチド合成法または遺伝子工学的方法を用いる方法によって製造した、前述の実施の形態1に係る摂食調節作用をもたらすポリペプチドは、後述の実施の形態3に係る摂食調節組成物の有効成分として利用することが可能となる。
【0047】
(摂食調節組成物)
本発明の実施の形態3は、前述の実施の形態1に係るポリペプチド等を利用した組成物に関する。具体的には、実施の形態1に係るポリペプチド、または、該ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有する、摂食調節組成物である。
【0048】
本明細書において、「摂食調節組成物」とは、具体的には、例えば、摂食調節作用をもたらすことができる、試薬、医薬品または食品等を挙げることができる。さらに詳細には、試薬または医薬品の場合、例えば、液剤、錠剤、顆粒剤、細粒剤、粉剤、タブレットまたはカプセル剤等を挙げることができる。食品の場合、例えば、摂食に関与する疾患等の予防、改善および治療等をコンセプトとした、健康食品、サプリメントまたは特定保健用食品等を挙げることができる。なお、これらの試薬、医薬品または食品等において、ポリペプチド等の有効成分としての含有量、一日における投与量および投与間隔等は、当該組成物等の種類によって適宜調節することが可能であるが、さらに、後述する実施の形態4の摂食量の調節方法も参照されたい。
【0049】
薬学的に許容される誘導体としては、ポリペプチドの一部置換体、ポリペプチドの一部架橋体、または、付加化合物等のポリペプチド誘導体を挙げることができる。さらに具体的には、例えば、カルボキシル基をアミド化またはアシル化した誘導体を例示することができる。薬学的に許容される塩類としては、塩酸塩、硝酸塩もしくは臭化水素酸塩等の無機酸塩、または、p−トルエンスルホン酸塩、メタスルホン酸塩、フマル酸塩、コハク酸塩もしくは乳酸塩等の有機酸塩等を挙げることができる。
【0050】
(摂食量の調節方法)
本発明の実施の形態4は、前述の実施の形態1のポリペプチドおよび実施の形態3の摂食調節組成物を利用する、摂食量の調節方法に関する。具体的には、該ポリペプチドまたは該摂食調節組成物を投与する工程を含む。好ましくは、該ポリペプチドまたは該摂食調節組成物を、非ヒト脊椎動物の脳室内に投与する工程を含む。例えば、ニワトリ、ラットまたはマウス等の脳室内に投与する。
【0051】
本明細書において、「摂食量の調節方法」とは、前述した「摂食調節作用」と同様に、摂食量を促進・増加および/もしくは抑制・減少させる方法という意味を示す。前述したように、摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、それぞれの動物種(魚類、両生類、鳥類および哺乳類を含めた多くの動物種)によって異なるため、本実施の形態4に係る摂食量の調節方法でも、目的とする作用に適した動物種の当該ペプチドを用いればよい。さらに、摂食量の促進・増加および/もしくは抑制・減少作用のいずれを有するかは、前述の実施の形態1に係るポリペプチドまたは実施の形態3に係る摂食調節組成物を、単回投与する方法か、または長期間連続投与する方法かによって異なる。本明細書において「単回投与」とは、例えば、1回投与した場合または長期間連続投与する場合でも投与初期の状態を意味する。本明細書において「長期間連続投与」とは、連続的に一定量を一定速度で投与する(例えば一日当たり15nmolの量を投与)という意味のほかに、例えば、定期的に間隔をおいて複数回長期にわたって投与することを意味する。より具体的には、長期間とは、少なくとも5日以上、好ましくは7日以上である。また、連続投与においては、対象動物に対して影響を与えない量および間隔で投与することが好ましい。定期的に間隔をおいての投与の場合、例えば1日に2〜10回、好ましくは1日に5〜7回程度の投与が挙げられる。
【0052】
例えば、ニワトリの場合について述べる。ニワトリにニワトリN1ペプチドもしくはN1−likeペプチドまたは当該ペプチドに係る実施の形態3の摂食調節組成物を単回投与した後、投与後少なくとも約90分までは摂食量は抑制される。
【0053】
例えば、ラットの場合について述べる。ラットにラットN1ペプチドもしくはN1−likeペプチドまたは当該ペプチドに係る実施の形態3の摂食調節組成物を投与(1回(単回)投与)した後、投与後10時間程度までは摂食量が促進する。しかし、当該ペプチドまたは当該摂食調節組成物を、長期間連続投与すると、摂食量は結果的に抑制される。
【0054】
ポリペプチドおよび摂食調節組成物の投与方法は、投与する動物の種類等によって適当な当該技術分野の任意の方法を利用すればよい。例えば、後述する実施例にて詳細に述べるように、手術においてカニューラ等を使用し、直接ラットまたは食用動物等の脳室内に投与する方法が挙げられる。連続投与の場合は、浸透圧ポンプを用いると好ましい。
【0055】
本発明を用いると、例えば、当該ポリペプチドまたは当該摂食調節組成物の摂食促進効果により、食肉用の動物等の生産量を膨大に増加させることも可能となる。さらには、本発明に係るN1ペプチドおよびN1−likeペプチドの生体内機構を研究することにより、摂食に関連する疾患(例えば、拒食症および糖尿病等)の医療および医薬への応用も期待できる。すなわち、当該N1ペプチドおよびN1−likeペプチドの様々な産業へ与える影響、効果は非常に大きなものである。
【実施例】
【0056】
以下、調製例および実施例を用いて本発明をより詳細に説明するが、調製例および実施例は本発明を限定するものではない。
【0057】
(調製例1)
本調製例1では、組み換えラットN1−likeペプチドの製造方法に係る調製例について詳細に述べる。
【0058】
まず、大腸菌を形質転換する為の発現プラスミドの構築を行った。成体ラット(Wistar、雄)の脳から、摂食調節中枢を含む視床下部基底部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。総RNAをOligotexTM−dT30<Super>mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと制限酵素EcoRIサイトを付加した逆方向プライマーとを用いてN1−like遺伝子をPCRにて80μlの系で増幅した。その際、SYBR Premix Ex Taq、ROX Reference Dye(タカラバイオ)を含む反応溶液を作成した。なお、反応条件は、95度20秒間でDNAを変性させ、95度20秒、55度20秒および72度20秒の増幅反応を40サイクル繰り返した。TAクローニングを行う為、最後に72度で10分反応させ、PCR産物にアデニン塩基を付加させた。
【0059】
得られたPCR産物を1.5%アガロースゲルで電気泳動し、N1−like遺伝子の大きさに相当する約300 bp弱のバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてTAクローニングのインサートN1−likeDNAとして回収した。精製したインサートを、pGEM−T Easyベクター(プロメガ)に挿入し、大腸菌のコンピテントセルDH5α株(ニッポンジーン)を形質転換した。得られたコロニーを鋳型にして、順方向プライマーM13FWと逆方向プライマーM13RVとを用いてコロニーPCRを行った。インサートが入っていることを確認したコロニーをアンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いてプラスミド抽出を行った。順方向プライマーM13FWと逆方向プライマーM13RVを用いてプラスミドを鋳型にBigDye反応をし、DNAシークエンサーによりインサートの配列の確認を行った。
【0060】
正しい配列であると確認されたN1−like遺伝子が挿入されたpGEM−T Easyベクター(プロメガ)を制限酵素NdeIとEcoRIで37度1時間で処理した後、1.5%アガロースゲルで電気泳動し、約300bpのバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−likeDNAとして回収した。同様に制限酵素処理して精製したpCold TF DNAベクター(タカラバイオ)にインサートN1−likeDNAを挿入して、DH5α株を形質転換した。得られたコロニーを鋳型にして順方向プライマーpCold−TF−F1と逆方向プライマーpCold−Rを用いてコロニーPCRを行い、インサートが入っているのを確認した。さらに、インサートN1−likeDNAの5’側にpGEM−T Easyベクター由来の配列がないかコロニーPCR産物の配列の確認を行い、付加配列がないと確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、His−TF−N1−likeタンパク質発現プラスミドを回収した。
【0061】
次に、His−TF−N1−likeタンパク質発現プラスミドで、大腸菌のコンピテントセルSHuffle株(NEB)を形質転換した。アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、15度で30分間冷却し、IPTGを終濃度0.1mMになるように添加して、24時間振とう培養した。大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0062】
なお、大量培養は、1Lのバッフル付きフラスコ中に200mlLB培地で振とう速度150 rpmにて行った。IPTGを終濃度0.1mM、菌回収時の遠心は4,000×g、4度、20分間の条件で行った。凍結大腸菌ペレット湿重量1gに対してBugBuster Reagent(Novagen)5mlの割合でタンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0063】
次に、N1−likeペプチドの精製を行った。空カラムに大腸菌ペレット湿重量1gに対してTALONレジン(クロンテック)3ml(50%懸濁液)を入れ、カラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。タンパク質抽出液の上清をカラムに添加し、His−TF−N1−likeタンパク質をTALONレジンに吸着させる為、4度で1時間撹拌した。素通り画分を回収し、カラム体積16倍量の洗浄溶液(50mM NaH2PO4、300mM NaCl、pH7.0)で洗浄した。カラム体積4倍量の溶出バッファー(50mM NaH2PO4、300mM NaCl、100mM イミダゾール、pH7.0)を用いて溶出した。TALONレジンカラム精製での各画分についてSDS−PAGEを行い、2D−銀染色試薬・IIキット(コスモバイオ)でゲルを染色し確認した。
【0064】
溶液交換のためTALONレジンカラム溶出液をFactor Xaプロテアーゼ反応バッファー(20mM Tris−HCl、100mM NaCl、2mM CaCl2、pH8.0)を2時間ごとに2回交換し、一晩4度にて透析した。透析膜チューブから液を回収し、BCA Protein Assay Reagent Kit(サーモフィッシャーサイエンティフィック)を用いてタンパク定量を行った。タンパク質濃度を1mg/mlになるようFactor Xaプロテアーゼ反応バッファー(NEB)を加え、Factor Xaプロテアーゼ(NEB)を終濃度2μg/mlになるように添加し、25度で16時間撹拌した。Factor Xaプロテアーゼ反応液に、PMSFを終濃度1mMになるように入れ、反応を停止させた。Factor Xaプロテアーゼ反応液の一部を用い、15%アクリルアミドゲル(オリエンタルインスツルメンツ)とSDSトリス・トリシン泳動バッファー(コスモ・バイオ)とを用いたSDS−PAGE、および、2D−銀染色試薬・IIキット(コスモ・バイオ)でのゲル染色を行い、タグ切断を確認した。
【0065】
Factor Xaプロテアーゼ反応液中のタグ除去の為、反応液を再度TALONレジンカラムへアプライし、素通り画分を回収した。その方法は次の通りである。まず、TALONレジンをカラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。Factor Xaプロテアーゼ反応液をカラムに添加し、His−TFタンパク質部分をTALONレジンに吸着させるため4度で1時間撹拌した。その後、N1−likeペプチドを含む素通り画分を回収し、0.45μm遠心フィルター(ミリポア)に通した。この液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH 2.2)中33−53%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0066】
さらに、N1−likeペプチドのC末端をアミド化するためにアミド化酵素反応を行った。なお、前述したとおり、ペプチドの形態としてC末端がアミド化されているポリペプチド誘導体が最も好ましい。C末端がアミド化したN1−likeペプチドを、次の組成にて反応させた。N1−likeペプチド0.05mg/ml、0.5%Nonidet P−40、1μg/ml カタラーゼ、10μM CuSO4、1mM アスコルビン酸、0.2M Tris−HCl(pH7.0)、および、10U/ml ペプチジルグリシンα−アミド化酵素(和光純薬工業)を用い、37度で一晩撹拌した。反応終了後、0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH 2.2)中33−53%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したアミド化N1−likeペプチドを凍結乾燥し、−20度で保存した。これを後述の行動実験に用いた。
【0067】
(調製例2)
本調製例2では、ラットのN1−likeペプチドの製造方法に係る調製例について、より効率的に製造できる方法について詳細に説明する。
【0068】
まず、概要について簡単に述べる。本調製例2では、前述した二つのペプチドフラグメントを縮合(ライゲーション)する手法であるネイティブケミカルライゲーション法を用いてラットのN1−likeペプチドを調製した。また、本調製例2では、インテインというタンパク質を使用している。インテインは、タンパク質スプライシング作用を有し、チオエステルを反応中間体としている。つまり、インテインとの組み換え融合タンパク質を構築することによりペプチドの末端がチオエステル化するシステムが開発されており、それを容易にするベクターも商品化されている(NEB)。
【0069】
ペプチド固相合成法によるペプチド製造は通常50アミノ酸残基程度であり、それ以上長いペプチドの製造には、組み換えタンパク質発現や、上記のライゲーション法が必要となる。本調製例2に関するラットのN1−likeペプチドは88アミノ酸残基であり、ペプチド固相合成法のみによるペプチド化学合成は出来ないことがこれまでの先行研究からわかった。一方、ラットのN1−likeペプチドはCys残基を三つ有する。ここで、N末端から二番目のCys残基以降のアミノ酸残基数が61残基で、当該C末端側61アミノ酸残基のペプチド部分をペプチド固相合成法により製造を行った。さらに、このC末端側61アミノ酸残基のペプチドフラグメントと、インテイン融合タンパク質により製造したN末端側のペプチドフラグメントとをライゲーションすることにより、C末端側がアミド化した全長88アミノ酸残基のラットのN1−likeペプチドの製造を、効率よく行うことが出来た。図3は、ネイティブケミカルライゲーション法を用いて調製したラットN1−likeペプチドを示す概要図である。
【0070】
次に、本調製例2の詳細な調製方法について述べる。
【0071】
最初に、大腸菌を形質転換するための発現プラスミドの構築を行った。成体ラット(Wistar、雄)の脳から、摂食調節中枢を含む視床下部基底部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。抽出した総RNAを、OligotexTM−dT30〈Super〉mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと制限酵素SapIサイトを付加した逆方向プライマーとを用いて、N1−likeペプチドのN末端側27アミノ酸残基に対応する遺伝子をPCRにて増幅した。その際、Ex Taqポリメラーゼ(タカラバイオ)を含む反応溶液を作成した。なお、反応条件は、94度3分間でDNAを変性させ、94度30秒、55度30秒および72度15秒の増幅反応を30サイクル繰り返した。
【0072】
得られたPCR産物を、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いて精製し、制限酵素NdeIとSapIで37度において3時間処理した。その後、2%アガロースゲルで電気泳動し、約85bpのバンドをWizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−like DNAとして回収した。同様に制限酵素処理して精製したインテイン融合タンパク質発現用のpTXB1ベクター(NEB)に、インサートN1−like DNAを挿入して、DH5α株を形質転換した。得られたコロニーを鋳型にし、順方向プライマーT7と逆方向プライマーMxe Intein Reverse IIを用いてコロニーPCRを行い、インサートN1−like DNAが入っていることを確認した。さらに、BigDye反応をし、DNAシークエンサーによりインサートの配列の確認を行った。正しい配列が確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、Ni−likeペプチド27アミノ酸残基とインテインとの融合タンパク質発現プラスミドを回収した。
【0073】
次に、このタンパク質発現プラスミドで、大腸菌のコンピテントセルBL21(DE3)株(BioDynamics)を形質転換した。アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、IPTGを終濃度0.1mMになるように添加して、3時間振とう培養した。大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に、2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0074】
なお、大量培養は、1Lのバッフル付きフラスコ中に300ml LB培地で振とう速度150rpmにて行った。IPTGを終濃度0.1mM、菌回収時の遠心は4,000×g、4度、10分間の条件で行った。凍結大腸菌ペレット湿重量1gに対して、BugBuster Reagent(Novagen)5mlおよびBenzonase(Novagen)2μlの割合で加え、タンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0075】
次いで、N1−likeペプチド27アミノ酸残基とインテインとの融合タンパク質の精製を行った。この融合タンパク質の精製を容易にするためにC末端側にキチン結合ドメインが付加されている。培養液900ml分の抽出液に対してキチンビーズ(NEB)を400ml使用した。オープンカラムにキチンビーズを詰め、10倍量のカラムバッファー(200mM HEPES pH6.5、50mM NaCl)を添加し、カラムを平衡化した。その後、上記で調製した大腸菌抽出液をカラムにロードした。その際、3倍量のカラムバッファーを添加し、非特異的な吸着物を除去した。次いで、カラムの流れを止め、3倍量のクリーベイジバッファー(500mM 2−mercaptoethanesulfonic acid(MESNA)/カラムバッファー)を添加し、25度で16時間反応させた。その後、カラムの栓を開け、反応後の素通り画分を回収した。このクリーベイジによりN1−likeペプチド27アミノ酸残基とインテインとの結合が切れ、さらにC末端がチオエステル化したN1−likeペプチド27アミノ酸残基が得られる。
【0076】
回収した素通り画分を0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより、C18逆相カラム(ODS−80Ts、東ソー)を用いて、0.1%TFA(pH2.2)中32−72%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら精製した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したペプチドを凍結乾燥し、−20度で保存した。
【0077】
N1−likeペプチドのC末端側61アミノ酸残基は、Fmoc法によるペプチド固相合成により製造した。C末端アミド化を生じるレジンを用い、ペプチド合成機(PSSM8、島津)により自動合成を行った。保護基をクリーベイジ後、ジエチルエーテルで洗浄した後に乾燥させ、ジメチルスルホキシド(DMSO)で溶解した。HPLCにより、C18逆相カラム(YMC−Pack Pro C18、YMC)を用いて、0.1%TFA(pH2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収をモニターしながら溶出した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したペプチドを凍結乾燥し、−20度で保存した。
【0078】
このように得られたチオエステル化したN末端側27アミノ酸残基と、アミド化したC末端側61アミノ酸残基からなる二つのペプチドフラグメントを、ネイティブケミカルライゲーション(NCL)法によりライゲーションさせた。
【0079】
まず、ペプチドフラグメントを反応させるNCLバッファー(0.1M 4−mercaptophenylacetic acid(MPAA)、20mM TCEP、8M グアニジン塩酸塩、0.1M Na2HPO4、pH8.0)を調製した。このNCLバッファー1mlに対して、N末端側27アミノ酸残基ペプチド2.0mgと、C末端側61アミノ酸残基ペプチド4.7mgを溶解した(それぞれ0.5〜1.0mM)。その後、チューブ内を窒素で置換し、25度で約24時間静置することでライゲーション反応を行った。この反応液を0.45μm遠心フィルター(ミリポア)に通した後、HPCLによりCN逆相カラム(CN−80Ts、東ソー)を用いて、0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら溶出した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0080】
製造したN1−likeペプチド中のジスルフィド結合は、前述の調製例1と同様に活性発現に重要であると思われる。そのために、フェリシアン化カリウムを用いてジスルフィド結合を生じさせた。凍結乾燥したN1−likeペプチド1mgを、ジメチルスルホキシド(DMSO)0.3mlで溶解し、8M尿素/50mM酢酸アンモニウムバッファー2.7mlを加えた。その後、攪拌しながらさらに150mMフェリシアン化カリウム溶液を60μl加え、室温で1時間攪拌し続けた。次いで、酢酸600μlで反応を停止し、陰イオン交換樹脂(AG4−x4、バイオラッド)に通し過剰なフェリシアン化カリウムを除去した。素通り溶液をHPLCによりCN逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収をモニターしながら精製した。回収したピークをMALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0081】
すなわち、前述の調製例1と比較すると、本調製例2は、ラットのN1−likeペプチド(88アミノ酸残基)のN末端側27アミノ酸残基は大腸菌を用いてC末端がチオエステル化した組み換えペプチドとして製造し、C末端側61アミノ酸残基はC末端がアミド化したペプチドをペプチド化学合成により製造し、それぞれのペプチドフラグメントをライゲーションしている。これにより、ラットのN1−likeペプチドのC末端はペプチド固相合成により確実にアミド化しているために、アミド化酵素による翻訳後修飾を施さなくてもよく、より効率的にラットのN1−likeペプチドを製造可能であることが確認された。
【0082】
(実施例1)
本実施例1では、調製例1で製造したアミド化N1−likeペプチドのラットへの単回投与、および投与後2時間における観察実験について詳細に述べる。
【0083】
まず、ラットを購入後1週間程度飼育し、脳手術でのストレスを軽減させる目的でハンドリングを行って馴化させた。ジエチルエーテルでラットを軽く麻酔した後、ソムノペンチル(40mg/kg体重)を腹腔内投与して麻酔し、体が脱力したのを確認してから、イヤーバーを差し込み(7mm)、切歯バーを取り付け、脳定位固定装置(室町機械)に固定した。麻酔の効果で体温が下がるため、手術中はカイロで体温を温めながら行った。頭の毛を剃り70%エタノールで消毒した後、手術用ハサミを用いて正中に沿って頭皮を切り綿棒で止血した。その後、頭蓋骨をアセトンで拭いた。頭蓋骨にあるブレグマとラムダの位置を水平にし、マニュピレーターに取り付けたガイドカニューラの先端をブレグマの位置に合わせ、ラット脳地図を参考にして脳室(左側脳室、ブレグマより後位1mm、側位1.5mm)に先端を移動させて、印をつけた。電動ドリルで印の位置に穴を開け、カニューラを腹位3.7mmに挿入した。挿入後、瞬間接着剤(Loctite454)と歯科用セメントを用いて、カニューラを頭蓋に固定した。手術後、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)とを皮下投与した。投与時以外は挿入したガイドカニューラにダミーカニューラを挿入した。脳手術後1週間、回復期間に当てた。脳室内投与実験2日前に脳室内へカニューラが入っていることを確かめるために、アンギオテンシンII(40pmol)を脳室内投与し、飲水行動が惹起されることを確認した。
【0084】
先端にインターナルカニューラをつけたコネクターチューブに1mlシリンジで滅菌水を満たし、空気をはさんで、投与溶液を充填した。N1−likeペプチド投与は、暗期開始10分前に行い、実験群にはN1−likeペプチド(5nmol/5μl)を、コントロール群には溶媒である0.9%NaClおよび10%DMSO(Dimethyl sulfoxide)を、5μlずつ投与した。投与後は30秒間ほどカニューラをそのままにし、溶液を拡散させてからカニューラを抜き、ダミーカニューラを挿入しケージに戻した。投与後、1および2時間後に摂食量を測定した。
【0085】
図4は、実施例1に係るN1−likeペプチド投与後2時間におけるラットの摂食促進効果の結果を示す図である。なお、縦軸は累積の摂食量(g)を示す。図3に示すように、1時間後(1hr)および2時間後(2hr)のいずれも、コントロールと比較すると有意に摂食量を増加させた。1時間後では、約5倍も摂食量を増加させた。なお、この効果は投与後2時間まで統計的に有意であった(6時間後では有意差はなかった)。これらの結果から、最初、サブトラクション法によって発見した、N1−like遺伝子のパラログ遺伝子である新規摂食調節遺伝子N1遺伝子によりコードされるN1ペプチドであっても、脊椎動物に投与することにより摂食量が増すことが示唆される。また、これらのホモログ遺伝子を有する脊椎動物にも、同様のことが示唆される。
【0086】
(調製例3)
本調製例3では、ラットのN1ペプチドの製造方法に係る調製例について、詳細に説明する。
【0087】
ラットのN1ペプチドは、Fmoc固相法によるペプチド化学合成により製造した。なお、ラットのN1ペプチドのC末端はアミド化している。カップリング試薬としてHBTUを用い、脱保護試薬としてピペリジンを用いた。合成機はマイクロウェーブ法による自動合成が可能な、Liberty1(CEM)を用いた。保護基をクリーベイジ後、合成ペプチドをジエチルエーテルで洗浄した。その後、合成ペプチドをHPLCによりC18逆相カラム(YMC−Pack Pro C18、YMC)を用いて0.1%TFA(pH 2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。
【0088】
製造したN1ペプチド中において、ジスルフィド結合は活性発現に重要であると思われる。そのために、グルタチオンを用いてジスルフィド結合を生じさせた。凍結乾燥したN1ペプチド1mgをジメチルスルホキシド(DMSO)0.1mlで溶解し、1Mトリスバッファー(pH 8.5)0.4ml加えた。さらにアセトニトリル0.5ml、0.5Mエチレンジアミン四酢酸(EDTA)(pH 8.0)2μl、還元型グルタチオン1.5mg、および酸化型グルタチオン0.3mg加え、室温で3日間撹拌した。反応溶液をHPLCによりC18逆相カラム(YMC−Pack Pro C18、YMC)を用いて0.1%TFA(pH 2.2)中35−65%/30minのアセトニトリル直線濃度勾配により、流速1.0ml/minで280nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。このようにジスルフィド結合を形成したラットのN1ペプチドを凍結乾燥し、−20度で保存した。
【0089】
(実施例2)
本実施例2では、前述の調製例3により製造したN1ペプチドのラットへの単回投与、および投与後22時間における観察実験について詳細に述べる。
【0090】
まず、ラットを購入後1週間程度飼育し、脳手術でのストレスを軽減させる目的でハンドリングを行って馴化させた。ジエチルエーテルでラットを軽く麻酔した後、ソムノペンチル(40mg/kg体重)を腹腔内投与して麻酔し、体が脱力したのを確認してから、イヤーバーを差し込み(7mm)、切歯バーを取り付け、脳定位固定装置(室町機械)に固定した。麻酔の効果で体温が下がるため、手術中はカイロで体温を温めながら行った。頭の毛を剃り70%エタノールで消毒した後、手術用ハサミを用いて正中に沿って頭皮を切り綿棒で止血した。その後、頭蓋骨をアセトンで拭いた。頭蓋骨にあるブレグマとラムダの位置を水平にし、マニュピレーターに取り付けたガイドカニューラの先端をブレグマの位置に合わせ、ラット脳地図を参考にして脳室(左側脳室、ブレグマより後位1mm、側位1.5mm)に先端を移動させて、印をつけた。電動ドリルで印の位置に穴を開け、カニューラを腹位3.5mmに挿入した。挿入後、瞬間接着剤(Loctite454)と歯科用セメントを用いて、カニューラを頭蓋に固定した。手術後、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)を皮下投与した。
【0091】
次に、先端にインターナルカニューラをつけたコネクターチューブに1mlシリンジで滅菌水を満たし、空気をはさんで、投与溶液を充填した。N1ペプチド投与は、明期2時間後に行い、実験群にはN1ペプチド(5nmol/5μl)を、コントロール群には溶媒であるPBS(Phosphate buffered saline,pH7−8)および10%DMSO(Dimethyl sulfoxide)を、5μlずつ投与した。投与後は30秒間ほどカニューラをそのままにし、溶液を拡散させてからカニューラを抜き、ダミーカニューラを挿入しケージに戻した。投与後、1、2、6、10および22時間後に摂食量を測定した。
【0092】
図5は、実施例2に係るN1ペプチド単回投与後22時間におけるラットの摂食促進効果の結果を示す図である。なお、縦軸は総摂食量(g)を示す。図5に示すように、30分後(0−0.5h)から10時間後(0−10h)のいずれも、コントロールと比較すると有意に摂食量を増加させた(n=4、*:p<0.05)。なお、22時間後では有意差がなかった。このように、ラットのN1−likeペプチドだけでなく、ラットのN1ペプチドの場合でも単回投与することによって、投与後10時間程度にわたって摂食量が促進するということが確認された。
【0093】
(実施例3)
本実施例3では、前述の調製例3により製造したN1ペプチドのラットへの長期間(1週間)にわたる連続投与の実験について詳細に述べる。
【0094】
ラットの飼育から、抗生物質セファゾリンナトリウム(50mg/kg体重)と消炎鎮痛剤リマダイル(5mg/kg体重)の皮下投与までの手順は、前述した実施例2と同様である。その後、浸透圧ポンプ(Alzet model2002)にN1ペプチド(1.25nmol/μl、pH7−8)の投与溶液を充填した。次にチューブ(5cm)を介してカニューラ(Brain infusion kit 1,Alzet)を浸透圧ポンプと連結させた。浸透圧ポンプは、カニューラの脳内への挿入前に37℃の0.9%NaClに12時間以上浸して可動させておいた。このカニューラをラットの脳室へ挿入した後、浸透圧ポンプをラットの肩甲骨の皮下へと埋め込み、1週間の長期間投与(15nmol/day)を行った。コントロール群には溶媒であるPBS(Phosphate buffered saline,pH7−8)および10%DMSO(Dimethl sulfoxide)を投与した。
【0095】
図6は、実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重変化を示す図である。なお、縦軸は体重(g)を示す。図6に示すように、6日目からコントロールと比較し、有意に体重が減少した(n=8、*:p<0.05)。なお、22時間後では有意差がなかった。また、この際の体重増加量についても確認した。図7は、実施例3に係るN1ペプチド長期間連続投与におけるラットの24時間毎の体重増加量を示す図である。なお、縦軸は体重増加量(g)を示し、手術当日の体重を0gとしている。図7に示すように、体重増加量(g)では、4日目からコントロールと比較し、有意に体重増加量が減少していた(n=8、*:p<0.05、**:p<0.01)。
【0096】
さらに、当該ラットの1日分の総摂食量の変化について確認した。その際、まず、明期12時間(昼夜を明期12時間と暗期12時間とした場合)における、総摂食量の変化について確認した。図8は、実施例3に係るN1ペプチド長期間連続投与におけるラットの明期12時間の総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05、**:p<0.01である。図8に示すように、明期12時間では摂食量を増やす効果があることが確認された。次いで、暗期12時間における、総摂食量の変化について確認した。図9は、実施例3に係るN1ペプチド長期間連続投与におけるラットの暗期12時間の総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05、**:p<0.01である。図9に示すように、手術日5日目から有意差を確認できた。暗期12時間では明期12時間とは逆で、摂食量を減少させる効果があることが確認された。
【0097】
これらを踏まえ、N1ペプチド1週間連続投与ラットの24時間単位での総摂食量の変化について確認した。図10は、実施例3に係るN1ペプチド長期間連続投与におけるラットの総摂食量を示す図である。縦軸は摂食量(g)を示し、n=8、*:p<0.05である。図10に示すように、投与開始1日目では有意にN1ペプチド投与群の摂食量(g)が促進されるが、投与開始7日目となるとN1ペプチド投与群の摂食量(g)が減少することが確認された。
【0098】
当該N1ペプチド長期間連続投与での摂食量減少という実験結果は、前述の図6および図7の体重および体重増加量減少にも現れている。また、図8および図9のみの結果を比較すると、図8での明期の摂食量の増加は多い場合でも約4g程度であるが、図9での暗期の摂食量の減少は多い場合約15g程度まで達している。これは、暗期、すなわちラットの活動期に着目すれば摂食量の減少を顕著に多く起こすことを示しており、すなわち、活動期の摂食量の抑制がなされ、その結果、前述のとおり体重の減少という現象に現れたと考えられる。
【0099】
(調製例4)
本調製例4では、組み換えニワトリN1−likeペプチドの製造方法に係る調製例について詳細に述べる。
【0100】
まず、大腸菌を形質転換するための発現プラスミドの構築を行った。ニワトリ雛の脳から、摂食調節中枢を含む視床下部漏斗部を摘出し、総RNAをTRIzol試薬(インビトロジェン)を用いて、添付されたプロトコールに従って抽出した。抽出した総RNAを、OligotexTM−dT30〈Super〉mRNA purification kit(タカラバイオ)を用いてmRNAに精製した後、ReverTra ACE(東洋紡)を用いてcDNAを合成した。次いで、そのcDNAを鋳型に、制限酵素NdeIサイトを付加した順方向プライマーと、制限酵素EcoRIサイトを付加した逆方向プライマーとを用いてN1−like遺伝子をPCRにて100μlの系で増幅した。なお、N1−likeペプチド製造後にアミド化酵素によりC末端アミド化処理を行うために、C末端はGly残基が付加するように逆方向プライマーを設計した。その際、Ex Taqポリメラーゼ(タカラバイオ)を含む反応溶液を作成した。なお、当該反応条件は、94度3分間でDNAを変性させ、94度30秒、55度30秒および72度30秒の増幅反応を30サイクル繰り返した。
【0101】
得られたPCR産物を、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いて精製し、制限酵素NdeIとEcoRIで37度で1時間処理した後、1.5%アガロースゲルで電気泳動を行った。その後、電気泳動での約300bpのバンドを、Wizard SV Gel and PCR Clean−Up System(プロメガ)を用いてインサートN1−like DNAとして回収した。同様に制限酵素処理して精製したpCold TF DNAベクター(タカラバイオ)にインサートN1−like DNAを挿入して、DH5α株を形質転換した。次に、得られたコロニーを鋳型にし、順方向プライマーpCold−TF−F1と、逆方向プライマーpCold−Rとを用いてコロニーPCRを行い、インサートが入っていることを確認した。さらに、BigDye反応を行い、DNAシークエンサーによりインサートの配列の確認も行った。正しい配列が確認されたコロニーを、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養し、NucleoSpin Plasmid(MACHEREY−NAGEL)を用いて、His−TF−N1−likeタンパク質発現プラスミドを回収した。
【0102】
次に、His−TF−N1−likeタンパク質発現プラスミドで、大腸菌のコンピテントセルBL21 Star(DE3)pLysS株(インビトロジェン)を形質転換した。その後、アンピシリン(50μg/ml)が入った5ml LB培地で一晩37度にて培養したものを、50倍希釈にし、5mlでOD600=0.5まで37度で振とう培養した。目的のOD値になったところで、15度で30分間冷却し、IPTGを終濃度0.1mMになるように添加して、24時間振とう培養した。当該大腸菌培養液を10,000×g、4度、10分間の条件において遠心して集菌し、集菌した菌体を−80度で凍結した。次に、大腸菌培養液1.5ml分の凍結大腸菌ペレットに、BugBuster Reagent(Novagen)300μlを添加し、20,400×g、4度、20分間の条件において遠心して上清と沈殿とを回収し、SDS−PAGEを行った後に、2D−銀染色試薬・IIキット(コスモ・バイオ)でゲルを染色し、発現の確認を行った。
【0103】
なお、大量培養は、1Lのバッフル付きフラスコ中に300ml LB培地で振とう速度150rpmにて行った。IPTGの添加は終濃度0.1mMとなるように行い、菌回収時の遠心は4,000×g、4度、20分間の条件で行った。なお、凍結大腸菌ペレット湿重量1gに対して、BugBuster Reagent(Novagen)5mlと、Benzonase(Novagen)5μlの割合で加え、タンパク質抽出を行った。これら以外の方法および条件は前述と同様である。
【0104】
次に、ニワトリのN1−likeペプチドの精製を行った。空カラムに大腸菌ペレット湿重量約3gに対してTALONレジン(クロンテック)20ml(50%懸濁液)を入れ、カラム体積5倍量の平衡化バッファー(50mM NaH2PO4、300mM NaCl、pH7.0)で平衡化した。タンパク質抽出液の上清をカラムに添加し、素通り画分を回収し、カラム体積5倍量の洗浄溶液(50mM NaH2PO4、300mM NaCl、pH7.0)で洗浄した。また、カラム体積3倍量の溶出バッファー(50mM NaH2PO4、300mM NaCl、200mM イミダゾール、pH7.0)を用いて溶出した。TALONレジンカラム精製での各画分については、SDS−PAGEを行い、2D−銀染色試薬・IIキット(コスモバイオ)でゲルを染色し、確認した。
【0105】
溶液交換のため、TALONレジンカラム溶出液を、Factor Xaプロテアーゼ反応バッファー(20mM Tris−HCl、100mM NaCl、2mM CaCl2、pH8.0)を2時間ごとに2回交換し、一晩4度にて透析した。その後、透析膜チューブから液を回収し、BCA Protein Assay Reagent Kit(サーモフィッシャーサイエンティフィック)を用いてタンパク定量を行った。タンパク質濃度を1mg/mlになるようFactor Xaプロテアーゼ反応バッファーを加え、Factor Xaプロテアーゼ(NEB)を終濃度1μg/mlになるよう添加し、25度で16時間攪拌した。その後、Factor Xaプロテアーゼ反応液に、トリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)(ナカライテスク)を終濃度50mMになるように加え、一晩4度で還元反応を行った。
【0106】
この工程は、本発明者らが研究した結果、発現したニワトリのN1−likeペプチドは、可溶化タグ(TF)と強い相互作用を有しており、可溶化タグ切断のためのプロテアーゼ(Factor Xa)を用いて切断した後も離れないことを解明し、強い還元剤であるトリス(2−カルボキシエチル)ホスフィン塩酸塩(TCEP)を作用させることによって、その相互作用を切断することを発見したことによる。
【0107】
還元処理を行ったサンプル中にはタグタンパク質が存在しているために、終濃度80%になるように冷アセトンを加え、氷水中で30分間冷却し、不要なタグタンパク質を沈殿させ、遠心分離し除去した。その後、上清のアセトンを遠心エバポレーターで蒸発させ、残りの溶液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中35−55%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0108】
なお、前述のTCEPによる還元処理のために、N1−likeペプチド中の二つのCys残基からなるジスルフィド結合は解離した状態となってしまう。そのため、再度酸化させ、ジスルフィド結合を再形成させる必要がある。ここで、凍結乾燥したN1−likeペプチド1mgを、8M尿素/50mM酢酸アンモニウムバッファー1mlで溶解させ、さらに150mMフェリシアン化カリウム溶液を20μl加え、室温にて1時間攪拌した。その後、酢酸200μlで反応を停止し、陰イオン交換樹脂(AG4−x4、バイオラッド)に通し、鉄イオンを除去した。素通り溶液をHPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中32−52%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。
【0109】
さらに、N1−likeペプチドのC末端をアミド化するために、アミド化酵素反応を行った。なお、ペプチドの形態として、C末端がアミド化されているポリペプチド誘導体が最も好ましい。C末端がGlyであるN1−likeペプチドを、次の組成にてアミド化反応させた。当該組成は、N1−likeペプチド0.5mg/ml、0.5%Nonidet P−40、100μg/mlカタラーゼ、20μM CuSO4、1mMアスコルビン酸、0.2M Tris−HCl(pH7.0)、および、10U/mlペプチジルグリシンα−アミド化酵素(和光純薬工業)であり、これらを37度で一晩攪拌した。反応終了後、0.45μm遠心フィルター(ミリポア)に通した後、HPLCにより逆相カラム(CN−80Ts、東ソー)を用いて0.1%TFA(pH2.2)中32−52%/40minのアセトニトリル直線濃度勾配により、流速0.5ml/minで220nmの紫外線吸収でモニターしながら精製した。回収したピークを、MALDI−TOF−MSによる質量分析で確認した。精製したN1−likeペプチドを凍結乾燥し、−20度で保存した。これを後述のニワトリの行動実験に用いた。
【0110】
(実施例4)
本実施例4では、調製例4で製造したニワトリのアミド化N1−likeペプチドを利用したニワトリ雛への投与実験について詳細に述べる。
【0111】
まず、ニワトリ雛を購入後3〜4日程度個別飼育した。その後、脳室内投与用の自作の脳定位固定装置にてニワトリ雛の頭部を保持し、マイクロシリンジを用いて脳室内投与を行った。N1−likeペプチド投与は、実験群(8個体)にはN1−likeペプチド(5nmol/5μl)を、コントロール群(11個体)には溶媒である10%DMSO(Dimethyl sulfoxide)を含んだ10mMリン酸緩衝食塩水をそれぞれ5μlずつ投与した。投与後、30、60および90分後に摂食量を測定した。なお、脳室内投与成功の有無は、投与液に青色の色素であるエバンスブルーを混合しておき、実験終了後に脳室内に色素が注入されていることで確認を行った。脳室内に色素が注入されていない個体はデータから排除した。
【0112】
図11は、実施例4に係るN1−likeペプチド単回投与におけるニワトリ雛の摂食抑制効果の結果を示す図である。なお、縦軸は累積の摂食量(g)を示す。図11に示すように、60分後および90分後のいずれも、コントロールと比較すると有意に摂食量が抑制されている。これらの結果から、ニワトリのN1−likeペプチドをニワトリ雛の脳室内に投与すると、ラットのN1−likeペプチドとは相反して、摂食量を抑制させる効果を有するということがわかった。
【0113】
このように、実施例1ないし実施例4の結果を考慮すると、N1ペプチドおよびN1−likeペプチドは、単回、複数回、連続投与および投与間隔等の投与方法によって、摂食量を促進または抑制させる摂食調節が可能であったり、同様の投与方法であっても他の動物種であったら相反する作用効果での摂食調節が可能であることが確認された。すなわち、種々の脊椎動物のホモログ遺伝子のN1ペプチドおよびN1−likeペプチドを利用することにより、任意の摂食調節が可能である。
【0114】
本発明は、上記発明の実施の形態および実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0115】
本明細書の中で明示した論文および公開特許公報等の内容は、その全ての内容を援用によって引用することとする。
【0116】
本出願は、2011年3月24日に出願された日本国特許出願2011−65216号に基づく。本明細書中に、日本国特許出願2011−65216号の、明細書、特許請求の範囲、図面全体を参照として取り込むものとする。
【産業上の利用可能性】
【0117】
本発明者らが鋭意研究した結果、大腸菌を用いて製造させたラットのN1−likeペプチドをラットの脳室内に投与すると、投与後10時間程度はコントロール群と比較して摂取量を促進するようになるということを発見した。一方、ニワトリのN1−likeペプチドをニワトリの脳室内に投与すると、ラットとは逆に、投与後90分間程度はコントロール群と比較して摂取量を抑制するようになるということを発見した。さらに、ラットのN1ペプチドを長期間ラットに連続投与すると、6、7日以降には摂食抑制の効果を有するということも発見した。また、当該ラットのN1−likeペプチドはネイティブケミカルライゲーション法を用いることによって効率よく製造できることも見出した。
【0118】
そこで、本発明によれば、N1ペプチドおよびN1−likeペプチドの詳細な特性が開示、解明され、摂食調節効果を有するポリペプチド、該ポリペプチドの製造方法、該ポリペプチド等を有効成分として含有する摂食調節組成物、および、これらを用いる摂食量の調節方法が提供される。すなわち、具体的には、食肉動物の生産量を膨大に増加させることも可能となり、さらには、摂食に関連する疾患(例えば拒食症および糖尿病等)の医療および医薬への応用も期待できる。
【特許請求の範囲】
【請求項1】
以下の(a)ないし(f)のいずれかであり、かつ摂食調節作用を有することを特徴とする、ポリペプチド。
(a)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(b)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(c)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
(d)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(e)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(f)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
【請求項2】
前記ポリペプチドのC末端は、アミド化していることを特徴とする、請求項1に記載のポリペプチド。
【請求項3】
前記ポリペプチドは、少なくとも1つのジスルフィド結合を有することを特徴とする、請求項1または2に記載のポリペプチド。
【請求項4】
前記ポリペプチドは、ニワトリ(Gallus gallus)、ヒト(Homo sapiens)、ラット(Rattus norvegicus)、および/または、マウス(Mus musculus)に対する摂食調節作用を有することを特徴とする、請求項1ないし3のいずれか1項に記載のポリペプチド。
【請求項5】
請求項1ないし4のいずれか1項に記載のポリペプチドを作製することを特徴とする、ポリペプチドの製造方法。
【請求項6】
前記製造方法は、大腸菌培養による遺伝子工学的製造方法を用いることを特徴とする、請求項5に記載のポリペプチドの製造方法。
【請求項7】
前記製造方法は、ネイティブケミカルライゲーション法を用いることを特徴とする、請求項5に記載のポリペプチドの製造方法。
【請求項8】
製造される前記ポリペプチドは、配列番号3もしくは7に記載のアミノ酸配列、配列番号3もしくは7に記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列、または、配列番号3もしくは7に記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列のいずれかであることを特徴とする、請求項7に記載のポリペプチドの製造方法。
【請求項9】
製造される前記ポリペプチドは、配列番号5に記載のアミノ酸配列を有するポリペプチドであり、ジスルフィド結合を再形成させる工程を含むことを特徴とする、請求項6または7に記載のポリペプチドの製造方法。
【請求項10】
請求項1ないし4のいずれか1項に記載のポリペプチド、または、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有することを特徴とする、摂食調節組成物。
【請求項11】
請求項1ないし4のいずれか1項に記載のポリペプチドまたは請求項10に記載の摂食調節組成物を投与する工程を含むことを特徴とする、摂食量の調節方法。
【請求項12】
前記ポリペプチドまたは前記摂食調節組成物を、非ヒト脊椎動物の脳室内に投与することを特徴とする、請求項11に記載の摂食量の調節方法。
【請求項13】
前記摂食量の調節方法は摂食量の抑制方法であり、ラットの脳室内に前記ポリペプチドまたは前記摂食調節組成物を長期間連続投与することを特徴とする、請求項11または12に記載の摂食量の調節方法。
【請求項1】
以下の(a)ないし(f)のいずれかであり、かつ摂食調節作用を有することを特徴とする、ポリペプチド。
(a)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(b)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(c)配列番号1ないし配列番号4のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
(d)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列からなる、ポリペプチド。
(e)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/または付加したアミノ酸配列からなる、ポリペプチド。
(f)配列番号5ないし配列番号8のいずれかに記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列からなる、ポリペプチド。
【請求項2】
前記ポリペプチドのC末端は、アミド化していることを特徴とする、請求項1に記載のポリペプチド。
【請求項3】
前記ポリペプチドは、少なくとも1つのジスルフィド結合を有することを特徴とする、請求項1または2に記載のポリペプチド。
【請求項4】
前記ポリペプチドは、ニワトリ(Gallus gallus)、ヒト(Homo sapiens)、ラット(Rattus norvegicus)、および/または、マウス(Mus musculus)に対する摂食調節作用を有することを特徴とする、請求項1ないし3のいずれか1項に記載のポリペプチド。
【請求項5】
請求項1ないし4のいずれか1項に記載のポリペプチドを作製することを特徴とする、ポリペプチドの製造方法。
【請求項6】
前記製造方法は、大腸菌培養による遺伝子工学的製造方法を用いることを特徴とする、請求項5に記載のポリペプチドの製造方法。
【請求項7】
前記製造方法は、ネイティブケミカルライゲーション法を用いることを特徴とする、請求項5に記載のポリペプチドの製造方法。
【請求項8】
製造される前記ポリペプチドは、配列番号3もしくは7に記載のアミノ酸配列、配列番号3もしくは7に記載のアミノ酸配列において、1ないし数個のアミノ酸が欠失、置換、挿入および/もしくは付加したアミノ酸配列、または、配列番号3もしくは7に記載のアミノ酸配列に対して60%以上の同一性を有するアミノ酸配列のいずれかであることを特徴とする、請求項7に記載のポリペプチドの製造方法。
【請求項9】
製造される前記ポリペプチドは、配列番号5に記載のアミノ酸配列を有するポリペプチドであり、ジスルフィド結合を再形成させる工程を含むことを特徴とする、請求項6または7に記載のポリペプチドの製造方法。
【請求項10】
請求項1ないし4のいずれか1項に記載のポリペプチド、または、前記ポリペプチドにおいて薬学的に許容される誘導体もしくは薬学的に許容される塩類を有効成分として含有することを特徴とする、摂食調節組成物。
【請求項11】
請求項1ないし4のいずれか1項に記載のポリペプチドまたは請求項10に記載の摂食調節組成物を投与する工程を含むことを特徴とする、摂食量の調節方法。
【請求項12】
前記ポリペプチドまたは前記摂食調節組成物を、非ヒト脊椎動物の脳室内に投与することを特徴とする、請求項11に記載の摂食量の調節方法。
【請求項13】
前記摂食量の調節方法は摂食量の抑制方法であり、ラットの脳室内に前記ポリペプチドまたは前記摂食調節組成物を長期間連続投与することを特徴とする、請求項11または12に記載の摂食量の調節方法。
【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図3】




【図2】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図3】


【公開番号】特開2012−211121(P2012−211121A)
【公開日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願番号】特願2011−248006(P2011−248006)
【出願日】平成23年11月11日(2011.11.11)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター・イノベーション創出基礎的研究推進事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成24年11月1日(2012.11.1)
【国際特許分類】
【出願日】平成23年11月11日(2011.11.11)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター・イノベーション創出基礎的研究推進事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

