ポリマーの製造方法及び該方法により製造されたポリマー
【課題】分子量及び分子量分布が制御されたポリマーを、高い収率で、かつ短時間で製造する。
【解決手段】マクロリビング開始剤を調製する工程と、マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、前記化合物を添加した後、光照射することにより、前記化合物を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【解決手段】マクロリビング開始剤を調製する工程と、マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、前記化合物を添加した後、光照射することにより、前記化合物を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、リビングラジカル重合法により合成されたポリマーの成長末端での選択的かつ高効率的な二量化反応によるポリマーの製造方法及び該方法により製造されたポリマーに関するものである。
【背景技術】
【0002】
リビングラジカル重合は、ラジカル重合の簡便性と汎用性を保ちつつ分子構造の制御を可能にする重合法で、新しい高分子材料の合成に大きな威力を発揮している。なかでも、重合成長末端に対して異なるモノマーを加えて重合することで生成する、構造の制御されたブロック共重合体は機能性材料の宝庫であると期待されている。
【0003】
本発明者らは、有機テルル化合物を開始剤として用いたリビングラジカル重合法を報告している(特許文献1及び特許文献2)。例えば、特許文献1では、有機テルル化合物を用いて、80〜105℃にて重合することにより、分子量及び分子量分布(PDI)の精密制御されたリビングラジカルポリマーを得ている。また、特許文献2では、有機テルル化合物とジテルリド化合物を用いて、80〜120℃にて重合することにより、分子量及び分子量分布(PDI)の精密制御されたリビングラジカルポリマーを得ている。これらの重合方法により、多種のビニルモノマーの重合を可能としている。しかし、分子量が大きくなると反応時間が長く収率が悪いという問題がある。さらに、ブロック共重合体、特にトリブロック共重合体よりポリマーブロックの多い共重合体等を得るためには、使用できるブロックセグメント種に大きな制約がある。
【0004】
さらに、本発明者らは光照射による有機テルル重合開始剤を用いたビニルモノマーのリビングラジカル重合法を報告している(特許文献3)。光照射条件においても精密な分子量及び分子量分布を制御することが可能である。さらに、熱に不安定なモノマーの重合が可能であると共に、低温で重合をおこなうことができるため、熱による副反応を抑えて重合が可能である。しかし、熱重合と同じ問題、すなわち、高分子量体の合成が難しいことや、ブロック共重合体の合成に制約を持っている。
【0005】
従って、分子量及び分子量分布が制御された高分子量体のポリマーを高収率でかつ短時間に得ることができる製造方法や、マルチブロック共重合体を自由度高く得ることができる製造方法が望まれている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開2004/14848号パンフレット
【特許文献2】国際公開2004/14962号パンフレット
【特許文献3】特開2007−302737号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、分子量及び分子量分布が制御されたポリマーを、リビングラジカルポリマーのカップリング反応による二量化で、高効率的かつ選択的に製造する方法、及びブロック共重合体をリビングラジカルポリマーとして用いることで、マルチブロック共重合体を提供することにある。
【課題を解決するための手段】
【0008】
本発明の第1の局面に従うポリマーの製造方法は、マクロリビング開始剤を調製する工程と、マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、前記化合物を添加した後、光照射することにより、前記化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴としている。
【0009】
本発明の第1の局面に従う光照射する工程は、前記化合物を添加した後、加熱してマクロリビング開始剤で前記化合物を重合させ、その後に光照射する工程であってもよい。これにより、前記化合物の重合体からなるブロックを含むブロック共重合体を製造することができる。
【0010】
また、本発明の第2の局面に従うポリマーの製造方法は、共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビングラジカル開始剤を調整する工程と、マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とすることを特徴としている。
【0011】
以下、本発明の第1の局面及び第2の局面に共通する事項については、「本発明」として説明する。
【0012】
本発明において、光照射する工程は、波長300〜700nmの発光分布を有する光源を用いて行われることが好ましい。
【0013】
本発明において、光照射する工程は、−70℃〜80℃の範囲の温度で光照射することにより行われることが好ましい。
【0014】
本発明において、マクロリビング開始剤は、有機テルル系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより調製されることが好ましい。
【0015】
この場合において、有機テルル系重合開始剤は、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物のいずれかであることが好ましい。
【0016】
【化1】

【0017】
(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。R2及びR3は、水素原子又は炭素数1〜8のアルキル基を示す。R4は、炭素数1〜8のアルキル基、アリール基、芳香族ヘテロ環基、アシル基、アミド基、オキシカルボニル基又はシアノ基を示す。)
【0018】
【化2】

【0019】
(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。)
【0020】
本発明のポリマーは、上記本発明の製造方法で製造されたことを特徴としている。
【発明の効果】
【0021】
本発明によれば、分子量及び分子量分布が制御されたポリマーを、リビングラジカルポリマーのカップリング反応による二量化で、高収率、かつ短時間に製造することができる。さらに、構造の制御されたブロック共重合体からなるマクロリビング開始剤を出発基質として用いることで、対称な構造を持つマルチブロック共重合体を容易に製造することができる。
【図面の簡単な説明】
【0022】
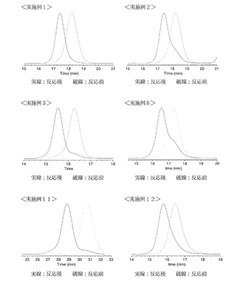
【図1】実施例1〜3、実施例8及び実施例11〜12における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図。
【図2】実施例16及び比較例1〜3における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図。
【図3】GPCチャートにおけるピーク分割法について説明するための図。
【発明を実施するための形態】
【0023】
本発明の第1の局面においては、上述のように、マクロリビング開始剤に、共役オレフィン化合物を添加した後、光照射することにより、前記化合物を重合成長末端とするラジカルを選択的にカップリング反応させて二量化している。
【0024】
本発明の第2の局面においては、上述のように、マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化している。
【0025】
以下、本発明についてさらに詳細に説明する。
【0026】
<マクロリビング開始剤の調製>
本発明においてマクロリビング開始剤とは、−TeR1の形態でテルル原子をポリマー末端に有する(R1は、上記と同じ)化合物のことをいう。
【0027】
マクロリビング開始剤は、例えば、特許文献1及び特許文献2に記載された有機テルル化合物系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより得ることができる。
【0028】
具体的には、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物
のいずれかである有機テルル化合物系重合開始剤を用いて重合する。
【0029】
本発明で使用する有機テルル化合物系開始剤としては、例えば、一般式(1)で表されるものが挙げられる。
【0030】
R1で示される基は、具体的には次の通りである。
【0031】
炭素数1〜8のアルキル基としては、メチル基、エチル基、n−プロピル基、イソプロピル基、シクロプロピル基、n−ブチル基、sec−ブチル基、tert−ブチル基、シクロブチル基、n−ペンチル基、n−ヘキシル基、n−ヘプチル基、n−オクチル基等の炭素数1〜8の直鎖状、分岐鎖状又は環状のアルキル基を挙げることができる。好ましいアルキル基としては、炭素数1〜4の直鎖状又は分岐鎖状のアルキル基が良い。より好ましくは、メチル基、エチル基又はn−ブチル基が良い。
【0032】
アリール基は、任意の位置にハロゲン原子、水酸基、アルコキシ基、アミノ基、ニトロ基、シアノ基、−CORaで示されるカルボニル含有基[Ra=炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、炭素数1〜8のアルコキシ基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルコキシ基)、アリール基、アリーロキシ基]、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個、パラ位又はオルト位)有していてもよい。アリール基としては、具体的にはフェニル基、ナフチル基、ハロゲン原子置換フェニル基、トリフルオロメチル置換フェニル基等を挙げることができ、好ましくはフェニル基が良い。
【0033】
芳香族へテロ環基としては、ピリジル基、ピロール基、フリル基、チエニル基等を挙げることができる。
【0034】
R2及びR3で示される各基は、具体的には次の通りである。
【0035】
炭素数1〜8のアルキル基としては、上記R1で示したアルキル基と同様のものを挙げることができる。
【0036】
R4で示される各基は、具体的には次の通りである。
【0037】
炭素数1〜8のアルキル基、アリール基、芳香族へテロ環基としては上記R1で示した基と同様のものを挙げることができる。
【0038】
アシル基としては、ホルミル基、アセチル基、ベンゾイル基等を挙げることができる。
【0039】
アミド基としては、アセトアミド、マロンアミド、スクシンアミド、マレアミド、ベンズアミド、2−フルアミド等のカルボン酸アミド、チオアセトアミド、ヘキサンジチオアミド、チオベンズアミド、メタンチオスルホンアミド等のチオアミド、セレノアセトアミド、ヘキサンジセレノアミド、セレノベンズアミド、メタンセレノスルホンアミド等のセレノアミド、N−メチルアセトアミド、ベンズアニリド、シクロヘキサンカルボキサニリド、2,4'−ジクロロアセトアニリド等のN−置換アミド等を挙げることができる。
【0040】
オキシカルボニル基としては、−COORb[Rb=H、炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、炭素数2〜8のアルケニル基(好ましくは炭素数2〜4の直鎖状又は分岐鎖状のアルケニル基)、炭素数2〜8のアルキニル基(好ましくは炭素数2〜4の直鎖状又は分岐鎖状のアルキニル基)、アリール基]で示される基を挙げることができる。Rbで示される炭素数1〜8のアルキル基、炭素数2〜8のアルケニル基、炭素数2〜8のアルキニル基、アリール基は、任意の位置にハロゲン原子、水酸基、炭素数1〜8のアルコキシ基、トリアルキルシリルエーテル基(該アルキルは炭素数1〜8)、トリアルキルシリル基(該アルキルは炭素数1〜8)、アミノ基、ニトロ基、シアノ基、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していても良い。オキシカルボニル基としては、具体的にはカルボキシル基、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、n−ブトキシカルボニル基、sec−ブトキシカルボニル基、tert−ブトキシカルボニル基、n−ペントキシカルボニル基、フェノキシカルボニル基等を挙げることができ、好ましくはメトキシカルボニル基、エトキシカルボニル基が良い。
【0041】
好ましいR4で示される各基としては、アリール基、オキシカルボニル基又はシアノ基が良い。
【0042】
好ましい一般式(1)で示される有機テルル化合物としては、R1が炭素数1〜4のアルキル基又はフェニル基を示し、R2及びR3が水素原子又は炭素数1〜4のアルキル基を示し、R4がアリール基、オキシカルボニル基で示される化合物が良い。特に好ましくは、R1が炭素数1〜4のアルキル基又はフェニル基を示し、R2及びR3が水素原子又は炭素数1〜4のアルキル基を示し、R4がフェニル基、メトキシカルボニル基、エトキシカルボニル基が良い。
【0043】
一般式(1)で示される有機テルル化合物は、具体的には(メチルテラニルメチル)ベンゼン、(メチルテラニルメチル)ナフタレン、エチル−2−メチル−2−メチルテラニル−プロピオネート、エチル−2−メチル−2−n−ブチルテラニル−プロピオネート、(2−トリメチルシロキシエチル)−2−メチル−2−メチルテラニル−プロピネート、(2−ヒドロキシエチル)−2−メチル−2−メチルテラニル−プロピネート、(3−トリメチルシリルプロパルギル)−2−メチル−2−メチルテラニル−プロピネートなど、特許文献1及び特許文献2等に記載された有機テルル化合物の全てを例示することができる。
【0044】
一般式(1)で示される有機テルル化合物の製造方法は特に限定されず、特許文献1及び特許文献2等に記載された公知の方法等により製造することができる。
【0045】
例えば、一般式(1)の化合物は、一般式(3)の化合物、一般式(4)の化合物及び金属テルルを反応させることにより製造することができる。
【0046】
【化3】

【0047】
(式中、R2、R3及びR4は、上記と同じ。Xは、ハロゲン原子を示す。)
Xで示される基としては、フッ素、塩素、臭素又はヨウ素等のハロゲン原子を挙げることができる。好ましくは、塩素、臭素が良い。
【0048】
【化4】

【0049】
(R1は、上記と同じ。Mは、アルカリ金属、アルカリ土類金属又は銅原子を示す。Mがアルカリ金属の時、mは1、Mがアルカリ土類金属の時、mは2、Mが銅原子の時、mは1または2を示す。)
【0050】
Mで示されるものとしては、リチウム、ナトリウム、カリウム等のアルカリ金属、マグネシウム、カルシウム等のアルカリ土類金属、銅を挙げることができる。好ましくは、リチウムが良い。
【0051】
なお、Mがマグネシウムの時、一般式(4)の化合物はMg(R1)2でも、或いはR1MgX(Xは、ハロゲン原子)で表される化合物(グリニャール試薬)でも良い。Xは、好ましくは、塩素、臭素が良い。
【0052】
本発明で使用する他の有機テルル化合物としては、例えば、一般式(2)で表されるものが挙げられる。
【0053】
R1で示される基は、一般式(1)に示した通りである。
【0054】
好ましい一般式(2)で示される化合物としては、R1が炭素数1〜4のアルキル基、フェニル基が良い。
【0055】
一般式(2)で示される化合物は、具体的には、ジメチルジテルリド、ジエチルジテルリド、ジ−n−プロピルジテルリド、ジイソプロピルジテルリド、ジシクロプロピルジテルリド、ジ−n−ブチルジテルリド、ジ−sec−ブチルジテルリド、ジ−tert−ブチルジテルリド、ジシクロブチルジテルリド、ジフェニルジテルリド、ビス−(p−メトキシフェニル)ジテルリド、ビス−(p−アミノフェニル)ジテルリド、ビス−(p−ニトロフェニル)ジテルリド、ビス−(p−シアノフェニル)ジテルリド、ビス−(p−スルホニルフェニル)ジテルリド、ジナフチルジテルリド、ジピリジルジテルリド等が挙げられる。好ましくは、ジメチルジテルリド、ジエチルジテルリド、ジ−n−プロピルジテルリド、ジ−n−ブチルジテルリド、ジフェニルジテルリドが良い。
【0056】
また本発明では重合速度の促進を目的にアゾ系重合開始剤を使用してもよい。アゾ系重合開始剤は、通常のラジカル重合で使用するアゾ系重合開始剤であれば特に制限なく使用することができる。
【0057】
例えば2,2′−アゾビス(イソブチロニトリル)(AIBN)、2,2′−アゾビス(2−メチルブチロニトリル)(AMBN)、2,2′−アゾビス(2,4−ジメチルバレロニトリル)(ADVN)、1,1′−アゾビス(1−シクロヘキサンカルボニトリル)(ACHN)、ジメチル−2,2′−アゾビスイソブチレート(MAIB)、4,4′−アゾビス(4−シアノバレリアン酸)(ACVA)、1,1′−アゾビス(1−アセトキシ−1−フェニルエタン)、2,2′−アゾビス(2−メチルブチルアミド)、2,2′−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、2,2′−アゾビス(2−メチルアミジノプロパン)二塩酸塩、2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2′−アゾビス(2,4,4−トリメチルペンタン)、2−シアノ−2−プロピルアゾホルムアミド、2,2′−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2′−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)等が挙げられる。
【0058】
これらのアゾ開始剤は反応条件に応じて適宜選択するのが好ましい。例えば低温重合(40℃以下)の場合は2,2′−アゾビス(2,4−ジメチルバレロニトリル)(ADVN)、2,2′−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、中温重合(40〜80℃)の場合は2,2′−アゾビス(イソブチロニトリル)(AIBN)、2,2′−アゾビス(2−メチルブチロニトリル)(AMBN)、ジメチル−2,2′−アゾビスイソブチレート(MAIB)、1,1′−アゾビス(1−アセトキシ−1−フェニルエタン)、4,4′−アゾビス(4−シアノバレリアン酸)(ACVA)、2,2′−アゾビス(2−メチルブチルアミド)、2,2′−アゾビス(2−メチルアミジノプロパン)二塩酸塩、2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、高温重合(80℃以上)の場合は1,1′−アゾビス(1−シクロヘキサンカルボニトリル)(ACHN)、2−シアノ−2−プロピルアゾホルムアミド、2,2′−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2′−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)、2,2′−アゾビス(2,4,4−トリメチルペンタン)、2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]を用いるのが良い。
【0059】
一般式(1)の化合物の使用量としては、得られるマクロリビング開始剤の分子量或いは分子量分布により適宜調節すれば良いが、通常、ビニルモノマー10molに対し一般式(1)の化合物を0.5〜200mmol、好ましくは1〜100mmolとするのが良い。
【0060】
一般式(1)の化合物とアゾ系重合開始剤の使用割合は、通常、一般式(1)の化合物1molに対して、アゾ系重合開始剤0.01〜100mol、好ましくは0.1〜10molmol、特に好ましくは0.1〜5molとするのが良い。
【0061】
一般式(1)の化合物と一般式(2)の化合物を併用する場合、その使用量としては、通常、一般式(1)の化合物1molに対して、一般式(2)の化合物0.01〜100mol、好ましくは0.05〜10mol、特に好ましくは0.1〜5molとするのが良い。
【0062】
一般式(1)の化合物、一般式(2)の化合物及びアゾ系重合開始剤を併用する場合、その使用量としては、通常、一般式(1)の化合物と一般式(2)の化合物の合計1molに対して、アゾ系重合開始剤0.01〜100mol、好ましくは0.1〜10mol、特に好ましくは0.1〜5molとするのが良い。
【0063】
マクロリビング開始剤を得る反応は、無溶剤でも行うことができるが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用して行うことができる。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパオール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、例えば、得られるマクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは、0.05〜10Lが、特に好ましくは、0.1〜5Lが良い。
【0064】
有機テルル化合物系重合開始剤とビニルモノマーの混合物を攪拌することにより、マクロリビング開始剤を得ることができる。反応温度、反応時間は、得られるマクロリビング開始剤の分子量或いは分子量分布により適宜調節すれば良いが、通常、0〜150℃で、1分〜100時間撹拌する。好ましくは、20〜100℃で、0.1〜30時間撹拌するのが良い。更に好ましくは、20〜80℃で、0.1〜15時間撹拌するのが良い。このように低い重合温度及び短い重合時間であっても高い収率と精密な分子量分布を得ることができる。この時、圧力は、通常、常圧で行われるが、加圧或いは減圧しても構わない。
【0065】
反応終了後、常法により使用溶媒や残存モノマーを減圧下除去して目的のマクロリビング開始剤を取り出したり、不溶溶媒を使用して再沈殿処理により目的のマクロリビング開始剤を単離することができる。反応処理については、目的物に支障がなければどのような処理方法でも行うことができる。また、マクロリビング開始剤は、単離せずそのまま用いることもできる。
【0066】
マクロリビング開始剤の分子量は、反応時間、一般式(1)の化合物の量および一般式(2)の化合物の量により調整可能であるが、重量平均分子量2000〜2000000の範囲とするのが良く、より好ましくは重量平均分子量5000〜1000000の範囲とするのがよい。
【0067】
マクロリビング開始剤の分子量分布(PDI=Mw/Mn)は、1.05〜2.00の間で制御される。更に、分子量分布1.05〜1.80、更には1.05〜1.50のより狭い分子量分布を持ったマクロリビング開始剤を得ることができる。
【0068】
本発明のマクロリビング開始剤を得るために用いるビニルモノマーとしては、ラジカル重合可能であれば特に制限なく使用することができる。これらは1種単独で又は2種以上混合して使用される。
【0069】
例えば、本発明に用いるビニルモノマーとして下記のものを挙げることができる。
【0070】
(メタ)アクリル酸メチル、(メタ)アクリル酸エチル、(メタ)アクリル酸プロピル、(メタ)アクリル酸ブチル、(メタ)アクリル酸オクチル、(メタ)アクリル酸ラウリル、(メタ)アクリル酸−2−ヒドロキシエチル等の(メタ)アクリル酸エステル。
【0071】
(メタ)アクリル酸シクロヘキシル、(メタ)アクリル酸メチルシクロヘキシル、(メタ)アクリル酸イソボルニル、(メタ)アクリル酸シクロドデシル等のシクロアルキル基含有不飽和モノマー。
【0072】
(メタ)アクリル酸、マレイン酸、フマル酸、イタコン酸、シトラコン酸、クロトン酸、無水マレイン酸等メチル等のカルボキシル基含有不飽和モノマー。
【0073】
N,N−ジメチルアミノプロピル(メタ)アクリルアミド、N,N−ジメチルアミノエチル(メタ)アクリルアミド、2−(ジメチルアミノ)エチル(メタ)アクリレート、N,N−ジメチルアミノプロピル(メタ)アクリレート等の3級アミン含有不飽和モノマー。
【0074】
N−2−ヒドロキシ−3−アクリロイルオキシプロピル−N,N,N−トリメチルアンモニウムクロライド、N−メタクリロイルアミノエチル−N,N,N−ジメチルベンジルアンモニウムクロライド等の4級アンモニウム塩基含有不飽和モノマー。
【0075】
(メタ)アクリル酸グリシジル等のエポキシ基含有不飽和モノマー。
【0076】
スチレン、α−メチルスチレン、4−メチルスチレン(p−メチルスチレン)、2−メチルスチレン(o−メチルスチレン)、3−メチルスチレン(m−メチルスチレン)、4−メトキシスチレン(p−メトキシスチレン)、p−tert−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブトキシスチレン、2−ヒドロキシメチルスチレン、2−クロロスチレン(o−クロロスチレン)、4−クロロスチレン(p−クロロスチレン)、2,4−ジクロロスチレン、1−ビニルナフタレン、ジビニルベンゼン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)等の芳香族不飽和モノマー(スチレン系モノマー)。
【0077】
2−ビニルチオフェン、N−メチル−2−ビニルピロール、1−ビニル−2−ピロリドン、2−ビニルピリジン、4−ビニルピリジン等のヘテロ環含有不飽和モノマー。
【0078】
N−ビニルホルムアミド、N−ビニルアセトアミド等のビニルアミド。
【0079】
(メタ)アクリルアミド、N−メチル(メタ)アクリルアミド、N−イソプロピル(メタ)アクリルアミド、N,N−ジメチル(メタ)アクリルアミド等の(メタ)アクリルアミド。
【0080】
1−ヘキセン、1−オクテン、1−デセン等のα−オレフィン。
【0081】
ブタジエン、イソプレン、4−メチル−1,4−ヘキサジエン、7−メチル−1,6−オクタジエン等のジエン類。
【0082】
酢酸ビニル、安息香酸ビニル等のカルボン酸ビニルエステル。
(メタ)アクリル酸ヒドロキシエチル。(メタ)アクリロニトリル。メチルビニルケトン。塩化ビニル。塩化ビニリデン。
【0083】
この中でも、好ましくは(メタ)アクリル酸エステル、シクロアルキル基含有不飽和モノマー、芳香族不飽和モノマー(スチレン系モノマー)、(メタ)アクリルアミド、(メタ)アクリロニトリル、メチルビニルケトンが良い。
【0084】
好ましい(メタ)アクリル酸エステルとしては、(メタ)アクリル酸メチル、(メタ)アクリル酸エチル、(メタ)アクリル酸プロピル、(メタ)アクリル酸ブチル、(メタ)アクリル酸−2−ヒドロキシエチルが挙げられる。特に好ましくは、メタアクリル酸メチル、メタアクリル酸エチル、メタアクリル酸プロピル、メタアクリル酸ブチル、メタアクリル酸−2−ヒドロキシエチルが良い。
【0085】
好ましいシクロアルキル基含有不飽和モノマーとしては、(メタ)アクリル酸シクロヘキシル、(メタ)アクリル酸イソボルニルが良い。特に好ましくは、メタアクリル酸シクロヘキシル、メタアクリル酸イソボルニルが良い。
【0086】
好ましいスチレン系モノマーとしては、スチレン、α−メチルスチレン、o−メチルスチレン、p−メチルスチレン、p−メトキシスチレン、p−t−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブチルスチレン、p−クロロスチレン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)が挙げられる。特に好ましくは、スチレン、p−クロロスチレンが良い。
【0087】
好ましい(メタ)アクリルアミドとしては、N−イソプロピル(メタ)アクリルアミドが挙げられる。特に好ましくは、N−イソプロピルメタアクリルアミドが良い。
【0088】
尚、上記の「(メタ)アクリル」は、「アクリル」及び「メタクリル」の総称である。
【0089】
マクロリビング開始剤は、モノマーの種類に関係なく、反応させるビニルモノマーの順番によるポリマーを得ることができる。ビニルモノマーAとビニルモノマーBを反応させブロック共重合体を得る場合、反応させる順番によりA−Bのものも、B−Aのものも得ることができる。上記で、各ブロックを製造後、そのまま次のブロックの反応を開始しても良いし、一度反応を終了後、精製してから次のブロックの反応を開始しても良い。ブロック共重合体の単離は通常の方法により行うことができる。
【0090】
<二量化反応>
二量化反応は、マクロリビング開始剤に共役オレフィン化合物を混合し、光照射することにより行うことができる。具体的には、不活性ガスで置換した容器で、マクロリビング開始剤と共役オレフィン化合物を混合する。この時、不活性ガスとしては、窒素、アルゴン、ヘリウム、二酸化炭素等を挙げることができる。好ましくは、アルゴン、窒素が良い。
【0091】
容器としては、特に制限なく使用することができる。例えば、UV透過ガラス、パイレックス(登録商標)ガラス等の硬質ガラス、石英ガラス等の軟質ガラスを利用することができる。
【0092】
光の照射方法としては、特に制限されることが無く、イマージョン型の光反応装置や通常の反応容器に光照射を行うことで重合を行うことができる。
【0093】
マクロリビング開始剤と共役オレフィン化合物の使用量としては、得られる二量体の分子量あるいは分子量分布により適宜調整すれば良いが、通常、マクロリビング重合開始剤1molに対して、共役オレフィン化合物を1〜20000mol、好ましくは10〜10000molが良い。
【0094】
反応は、通常、無溶媒で行うが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用しても構わない。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパノール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、例えば、マクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは0.05〜10Lが、特に好ましくは0.1〜5Lが良い。
【0095】
また、マクロリビング開始剤を単離せずに反応を行う場合は、通常、無溶媒で行うが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用(追加)しても構わない。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパノール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、マクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは0.05〜10Lが、特に好ましくは0.1〜5Lが良い。
【0096】
光照射、反応温度、反応時間は、得られる二量体の分子量或いは分子量分布により適宜調節すればよい。また、反応により有機ジテルル化合物(2)が定量的に副生し、有機ジテルル化合物(2)は光分解により金属テルルを析出し光を遮ることから、反応を高効率かつ短時間で行うためには、適宜下記反応条件で調節すれば良い。
【0097】
光照射は、光照射するために用いられるランプ類としては、光波長300〜700nmに発光分布を有するものが好適に用いられ、その例としては、低圧水銀灯、中圧水銀灯、高圧水銀灯、超高圧水銀灯、ケミカルランプ、ブラックライトランプ、マイクロウェーブ励起水銀灯、メタルハライドランプ、キセノンランプ、クリプトンランプ、LEDランプ、有機ELランプ等が挙げられる。
【0098】
また、照射する光源と、ガラス製のカットオフフィルター、減光フィルターや溶媒フィルターを組み合わせることで、照射波長の領域を制御して行うこともできる。好ましい照射波長は、300〜600nmに発光分布を持つ光源を用いるのが良く、さらに好ましくは300〜450nm領域の波長を有する光を照射することが良い。
【0099】
反応温度は−70℃〜80℃が良く、好ましくは−70〜60℃が良く、さらに好ましくは0〜35℃が良い。
【0100】
反応時間は光の照射強度や照射波長により変化するため、特に制限はない。通常は1分〜100時間程度で行うことができる。好ましくは0.1〜30時間が良い。更に好ましくは0.1〜15時間が良い。
【0101】
反応終了後、常法により使用溶媒や残存モノマーを減圧下除去して目的ポリマーを取り出したり、目的ポリマー不溶溶媒を使用して再沈殿処理により目的物を単離する。反応処理については、目的物に支障がなければどのような処理方法でも行うことができる。
【0102】
本発明の第1の局面において、二量化反応はマクロリビング開始剤に由来する重合成長末端ラジカルが共役オレフィン化合物と反応して生成したラジカルが、カップリング反応を起こすことで進行する。また、本発明の第2の局面のように、二量化反応に共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビング開始剤を使用する場合には、共役オレフィン化合物を混合することなく二量化反応を行うことができる。これらの反応に使用する共役オレフィン化合物は、ラジカルカップリングを起こす共役オレフィン化合物であれば特に制限なく使利用でき、これらは1種単独で又は2種以上混合して使用される。
【0103】
例えば、本発明に用いる共役オレフィン化合物としては、共役ジエンや共役トリエン等の共役ポリエン化合物や、スチレン誘導体などの芳香族基と共役したオレフィン化合物を挙げることができる。具体的には、下記のものを挙げることができるが、これらの化合物に限定されるものではない。
【0104】
共役ポリエン化合物は、任意の位置に後述する置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していてもよい。具体的には、1,3−ブタジエン、イソプレン、2−エチル−1,3−ブタジエン、2−t−ブチル−1,3−ブタジエン、2−フェニル−1,3−ブタジエン、2,3−ジメチル−1,3−ブタジエン、2,4−ジメチル−1,3−ブタジエン、1,3−ペンタジエン、2−メチル−1,3−ペンタジエン、3−メチル−1,3−ペンタジエン、1,3−ヘキサジエン、2−メチル−1,3−オクタジエン、4,5−ジエチル−1,3−オクタジエン、3−ブチル−1,3−オクタジエン、1,3−シクロペンタジエン、1,3−シクロヘキサジエン、1,3−シクロオクタジエン、1,3−トリシクロデカジエン、ミルセン、クロロプレン、1,3,5−ヘキサトリエン、1,3,5−ヘプタトリエン、トランス−2,4−ヘキサジエン−1−オール、ソルビン酸エチル等を挙げることができる。
【0105】
芳香族基と共役したオレフィン化合物は、任意の位置に後述する置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していてもよい。具体的には、スチレン、α−メチルスチレン、4−メチルスチレン(p−メチルスチレン)、2−メチルスチレン(o−メチルスチレン)、3−メチルスチレン(m−メチルスチレン)、4−メトキシスチレン(p−メトキシスチレン)、p−tert−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブトキシスチレン、2−ヒドロキシメチルスチレン、2−クロロスチレン(o−クロロスチレン)、4−クロロスチレン(p−クロロスチレン)、2,4−ジクロロスチレン、1−ビニルナフタレン、ジビニルベンゼン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)、2−ビニルピリジン、4−ビニルピリジン等を挙げることができる。
【0106】
共役ポリエン化合物、芳香族基と共役したオレフィン化合物の置換基としては、ハロゲン原子、水酸基、炭素数1〜8のアルコキシ基、−CORcで示されるカルボニル含有基[Rc=炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、アリール基]、−COORd[Rd=H、炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、アリール基]、トリアルキルシリルエーテル基(該アルキルは炭素数1〜8)、トリアルキルシリル基(該アルキルは炭素数1〜8)、アミノ基、ニトロ基、シアノ基、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していても良い。
【0107】
好ましい共役ポリエン化合物としては、1,3−ブタジエン、イソプレン、2−エチル−1,3−ブタジエン、2−t−ブチル−1,3−ブタジエン、2−フェニル−1,3−ブタジエン、2,3−ジメチル−1,3−ブタジエン、2,4−ジメチル−1,3−ブタジエン、1,3−ペンタジエン、2−メチル−1,3−ペンタジエン、3−メチル−1,3−ペンタジエン、1,3−ヘキサジエン、2−メチル−1,3−オクタジエン、ミルセン等の炭素数1〜10の直鎖状、分岐鎖状又は環状の共役ポリエン化合物が良い。
【0108】
好ましい芳香族基と共役したオレフィン化合物としては、スチレン、α−メチルスチレン、o−メチルスチレン、p−メチルスチレン、p−メトキシスチレン、p−t−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブチルスチレン、p−クロロスチレン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)が挙げられる。特に好ましくは、スチレン、p−クロロスチレンが良い。
【0109】
本発明の製造方法において、マクロリビング開始剤のセグメントと、共役オレフィン化合物のセグメントが選択的にカップリング反応したのちに二量化することで分子量が2倍になり、対称系のABAで示されるトリブロック共重合体を容易に得ることができる。さらに、ブロック共重合体であるマクロリビング開始剤を用いることで、ABCBAペンタブロック共重合体等も得ることができる。
【0110】
本発明の製造方法は、容易に分子量を2倍にする事ができる上に、更にその工程中に有機ジテルル化合物(2)が定量的に副生することから、有機ジテルル化合物(2)が回収できる。また、得られたブロック共重合体のポリマー末端からテルルを除去する処理を行う必要がないという利点もある。
【実施例】
【0111】
以下、本発明を実施例に基づいて具体的に説明するが、本発明は何らこれらに限定されるものではない。
【0112】
二量化反応は以下の機器を用いた。
【0113】
装置:USHIO Optcal Modulex SX−UI 501HQ型
水銀ランプ:超高圧水銀ランプ500W(BA−H501)
LEDランプ:365nmLEDランプ(1200mW、日亜化学工業社製)
フィルターA:L−39(50%光遮断波長390nm、旭テクノグラス社製)
フィルターB:Y−42(50%光遮断波長420nm、旭テクノグラス社製)
【0114】
数平均分子量(Mn)及び分子量分布(PDI)は、GPC[Shodex GPC−104(カラム:Shodex LF−604x2)、Shodex GPC−101(カラム:Shodex LF804・K−805F・K−800RL)]を用いて、ポリスチレン標準サンプル(東ソーTSK Standard)又はポリメチルメタクリレート標準サンプル(Shodex PMMS Standard)の分子量を基準に求めた。
【0115】
二量化反応のカップリング反応効率(xc)は、GPC分析におけるピーク分割法により求めた。なお、実施例1〜3、8、12、16、比較例1〜3においては、式xc=2*(1−Mn(マクロリビング開始剤)/Mn(生成物))より算出した。
【0116】
GPC分析におけるピーク分割法とは、反応前後のGPCチャートの比較において、ポリマーの濃度を一定にして測定を行うことで反応後の曲線中に反応前の曲線の成分がどれほどあるかを見積もることにより、反応前のポリマー(すなわち、反応しなかったポリマー)が生成物中にどれだけ含まれているかを算出する方法である。
【0117】
具体的には、以下の手順で行うことができる。
【0118】
1.反応前の反応溶液を一定量(Amg)取り、これにBgの溶媒を加えてGPC測定を行う。
【0119】
2.反応後の溶液を一定量(Cmg)取り、これにDgの溶媒を加えてGPC測定を行う。
【0120】
3.それぞれのGPC測定についてRI強度をA/BまたはC/Dで割り算する。
【0121】
図3は、ピーク分割法を説明するためのGPCチャートであり、上記RI強度を換算したピークを示している。(1)が反応前の曲線であり、(2)が反応後の曲線である。
【0122】
4.反応前の曲線(1)に係数Xをかけてピークを縮小し、反応後の曲線(2)に含まれる量を推定する。図3に示す例では、X=0.08(すなわち、残っている量は8%、カップリング効率は92%)である。(3)は反応前の曲線(1)を上記のように係数Xをかけて縮小した曲線である。(4)は反応後の曲線(2)から、曲線(3)の成分を差し引いたものである。(3)の成分を差し引くことにより、曲線(4)はガウス分布の曲線に近い形状になる。
【0123】
<有機テルル化合物の製造>
合成例1(CTA1)
金属テルル〔Aldrich社製、商品名:Tellurium(−40mesh)〕6.38g(50mmol)をTHF 50mLに懸濁させ、これにメチルリチウム 52.9mL(1.04Mジエチルエーテル溶液、55mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(20分間)。この反応溶液に、エチル−2−ブロモ−イソブチレート10.7g(55mmol)を室温で加え、2時間撹拌した。反応終了後、減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(6.53g、収率51%)を得た。
【0124】
1H−NMR、13C−NMR、HRMS、IRより、エチル−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0125】
1H−NMR(300MHz,CDCl3):δ1.27(t,J=6.9Hz,3H),1.74(s,6H),2.15(s,3H,TeCH3),4.16(q,J=7.2Hz,2H); 13C−NMR(75MHz,CDCl3):δ−17.38,13.89,23.42,27.93,60.80,176.75; HRMS(EI)m/z:found 260.0053,calcd for C7H14O2Te[M]+260.0056; IR(neat,cm−1):1700,1466,1385,1296,1146,1111,1028
【0126】
合成例2(CTA2)
金属テルル〔Aldrich社製、商品名:Tellurium(−200mesh)〕2.57g(20mmol)をTHF 15mLに懸濁させ、これにメチルリチウム 15.4mL(1.15Mジエチルエーテル溶液、21.3mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(30分間)。この反応溶液を氷浴で冷却し、(2−トリメチルシロキシエチル)−2−ブロモ−イソブチレート6.0g(21.3mmol)を加えた後、40℃で4.5時間撹拌した。反応終了後、反応溶液を塩化アンモニア水溶液および塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(3.48g、収率50%)を得た。
【0127】
1H−NMR、13C−NMR、HRMS、IRより、(2−トリメチルシロキシエチル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0128】
1H−NMR(400MHz,CDCl3):δ0.14(s,9H),1.75 (s,6H),2.17(s,3H),3.79(t,J=5.2Hz,2H),4.17(t,J=5.2Hz,2H); 13C−NMR(400MHz,CDCl3): δ−17.13,−0.53,23.18,27.97,60.31,66.05,176.92; HRMS(FAB)m/z:found 348.0399,calcd for C10H22O3SiTe[M]+348.0401; IR(neat,cm−1):2957,1717,1466,1252,1152,1105
【0129】
合成例3(CTA3)
CTA2(1.28g、3.7mmol)のメタノール(18mL)溶液に酢酸1.3mL(22.7 mmol)をゆっくりと加え、室温で2時間撹拌した。反応終了後、反応溶液を重炭酸ナトリウム水溶液で洗浄し、無水硫酸ナトリウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(0.71g、収率70%)を得た。
【0130】
1H−NMR、13C−NMR、HRMS、IRより、(2−ヒドロキシエチル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
1H−NMR(400MHz,CDCl3):δ1.76(s,6H),2.16(s,3H),3.84(br,2H),4.26(t,J=4.6Hz,2H); 13C−NMR(CDCl3):δ−16.89,23.63,27.67,61.12,66.42,177.01; HRMS(FAB)m/z:found 276.0005,calcd for C7H14O3Te[M]+276.0005; IR(neat,cm−1):3437 (br),2957,1710,1466,1387,1260,1150,1113,1080,1026
【0131】
合成例4(CTA4)
金属テルル〔Aldrich社製、商品名:Tellurium(−200mesh)〕1.23g(9.5mmol)をTHF 7.5mLに懸濁させ、これにメチルリチウム 7.25mL(1.38Mジエチルエーテル溶液、10mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(40分間)。この反応溶液を氷浴で冷却し、(3−トリメチルシリルプロパルギル)−2−ブロモ−イソブチレート 2.76g(10mmol)を加えた後、室温で2時間撹拌した。反応終了後、反応溶液を塩化アンモニア水溶液および塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(1.74g、収率54%)を得た。
【0132】
1H−NMRより、(3−トリメチルシリルプロパルギル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0133】
1H−NMR(400MHz,CDCl3):δ0.18(s,9H),1.76(s,6H),2.18(s,3H),4.70(s,2H)
CTA1〜CTA4の構造式は、以下に示す通りである。
【0134】
【化5】

【0135】
【化6】

【0136】
【化7】

【0137】
【化8】

【0138】
<有機ジテルル化合物の製造>
合成例5(ジメチルジテルリド)
金属テルル(上記と同じ)3.19g(25mmol)をTHF 25mLに懸濁させ、メチルリチウム(上記と同じ)25mL(28.5mmol)を0℃でゆっくり加えた(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(10分間)。この反応溶液に、塩化アンモニウム溶液 20mLを室温で加え、1時間撹拌した。有機層を分離し、水層をジエチルエーテルで3回抽出した。集めた有機層を無水硫酸ナトリウムで乾燥後、減圧濃縮し、黒紫色油状物(2.69g、収率75%)を得た。
【0139】
1H−NMR、MS(HRMS)より、ジメチルジテルリドであることを確認した。
【0140】
1H−NMR(300MHz,CDCl3):δ2.67(s,6H); HRMS(EI)m/z:found289.8593,calcd for C2H6Te2(M)+ 289.8594
【0141】
<マクロリビング開始剤の調製>
合成例6(PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン3.0mL(30mmol)、CTA1 38.7mg(0.15mmol)とジメチルジテルリド42.8mg(0.15mmol)を仕込んだ。この反応溶液を120℃で10時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp1溶液を得た。
【0142】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=1770、PDI=1.15であった。
【0143】
合成例7(PIp2)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン3.0mL(30mmol)、CTA1 8.3mg(0.03mmol)とジメチルジテルリド8.6mg(0.03mmol)を仕込んだ。この反応溶液を120℃で12時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp2溶液を得た。
【0144】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=9680、PDI=1.09であった。
【0145】
合成例8(PIp3)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン2.0mL(20 mmol)、CTA2 18μL(0.067mmol)とジメチルジテルリド6μL(0.067mmol)を仕込んだ。この反応溶液を120℃で8時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp3溶液を得た。
【0146】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=2300、PDI=1.11であった。
【0147】
合成例9(PIp4)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン2.3mL(23 mmol)、CTA3 20μL(0.11mmol)とジメチルジテルリド12μL(0.11mmol)を仕込んだ。この反応溶液を120℃で12時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp4溶液を得た。
【0148】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3200、PDI=1.09であった。
【0149】
合成例10(PMMA−b−PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート3.0 mL(28mmol)、CTA1 32μL(0.19mmol)とジメチルジテルリド20μL(0.19mmol)、AIBN 6mg(0.037mmol)を仕込んだ。この反応溶液を55℃で9時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりマクロリビング開始剤2.4g(収率86%)を得た。
【0150】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=13700、PDI=1.16であった。
【0151】
窒素置換したパイレックス(登録商標)ガラス管内で、得られたマクロリビング開始剤200mg(0.015mmol)、イソプレン0.6mL(6.0 mmol)とベンゼン0.6mLを仕込んだ。この反応溶液を120℃で8時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA−b−PIp1溶液を得た。
【0152】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=16600、PDI=1.18であった。
【0153】
合成例11(PSt−b−PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン7.5mL(65mmol)とCTA1 228μL(1.3mmol)を仕込んだ。この反応溶液を110℃で19.5時間撹拌した。反応後、α,α,α−トリフルオロメチルトルエン20mLを加えた。得られた溶液を撹拌しているメタノール700mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりマクロリビング開始剤6.2g(収率92%)を得た。
【0154】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=5900、PDI=1.15であった。
【0155】
窒素置換したパイレックス(登録商標)ガラス管内で、得られたマクロリビング開始剤354mg(0.06mmol)、イソプレン3.0mL(30 mmol)とジメチルジテルリド6.5μL(0.06mmol)を仕込んだ。この反応溶液を120℃で10時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PSt−b−PIp1溶液を得た。
【0156】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=9700、PDI=1.12であった。
【0157】
合成例12(PSt1)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン2.0mL(17.5mmol)、CTA1 96.3mg(0.35mmol)とAIBN 29.0mg(0.175mmol)を仕込んだ。この反応溶液を60℃で13.5時間撹拌した。反応終了後、DMF 4mLを加えた。得られた溶液を撹拌しているメタノール400mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPSt1(1.57g、収率85%)を得た。
【0158】
GPC分析(ポリスチレン標準サンプルの分子量を基準)により、Mn=4700、PDI=1.15であった。
【0159】
合成例13(PSt2)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン2.13mL(19 mmol)、CTA1 100μL(0.53mmol)、ジメチルジテルリド18μL(0.53 mmol)とACHN 39mg(0.16mmol)を仕込んだ。この反応溶液を80℃で7時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているメタノール400mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPSt2(1.52g、収率79%)を得た。
【0160】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3500、PDI=1.08であった。
【0161】
合成例14(PAN1)
窒素置換したパイレックス(登録商標)ガラス管内で、アクリロニトリル1.23mL(19mmol)、CTA1 100μL(0.53mmol)、ACHN 39mg(0.16mmol)とDMF 4mLを仕込んだ。この反応溶液を60℃で6時間撹拌した。反応後、DMF 4mLを加えた。得られた溶液を撹拌しているメタノール300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPAN1(870mg、収率82%)を得た。
【0162】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=4700、PDI=1.20であった。
【0163】
合成例15(PNVP1)
窒素置換したパイレックス(登録商標)ガラス管内で、N-ビニルピロリドン1.5mL(14.1mmol)、CTA1 120.5mg(0.47mmol)とAIBN 38.0mg(0.23mmol)を仕込んだ。この反応溶液を50℃で3時間撹拌した。反応終了後、クロロホルム5mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPNVP1(1.21g、収率80%)を得た。
【0164】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=2250、PDI=1.10であった。
【0165】
合成例16(PNVP2)
窒素置換したパイレックス(登録商標)ガラス管内で、N-ビニルピロリドン2.1mL(20.0mmol)、CTA1 102.9mg(0.40mmol)とAIBN 32.8mg(0.20mmol)を仕込んだ。この反応溶液を50℃で3時間撹拌した。反応終了後、クロロホルム5mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPNVP2(2.06g、収率89%)を得た。
【0166】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)により、Mn=4440、PDI=1.11であった。
【0167】
合成例17(PMMA1)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクレート2.25g(22.4mmol)、CTA1 103mg(0.37mmol)、ジメチルジテルリド106mg(0.37mmol)とAIBN 17.2mg(0.075mmol)を仕込んだ。この反応溶液を60℃で3.5時間撹拌した。反応終了後、クロロホルムを8mL加えた。得られた溶液を撹拌しているヘキサン350mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA1(1.88g、収率82%)を得た。
【0168】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5700、PDI=1.19であった。
【0169】
合成例18(PMMA2)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.98 mL(19mmol)、CTA1 100μL(0.53mmol)とジメチルジテルリド56μL(0.53mmol)とAIBN 24mg(0.11mmol)を仕込んだ。この反応溶液を60℃で8.5時間撹拌した。反応後、クロロホルム8mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA2(1.72g、収率90%)を得た。
【0170】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=4300、PDI=1.16であった。
【0171】
合成例19(PMMA3)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.07 mL(10mmol)、CTA2 27μL(0.10mmol)とジメチルジテルリド11μL(0.1mmol)を仕込んだ。この反応溶液を80℃で34時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA3溶液を得た。
【0172】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=9500、PD=1.14であった。
【0173】
合成例20(PMMA4)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート0.59 ml(5.5mmol)、CTA4 29μL(0.11mmol)とジメチルジテルリド5.8μL(0.055mmol)を仕込んだ。この反応溶液を80℃で32時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA4溶液を得た。
【0174】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5100、PDI=1.20であった。
【0175】
合成例21(PMMA5)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート0.79 ml(7.4mmol)、CTA1 43μL(0.25mmol)とジメチルジテルリド26μL(0.25mmol)とAIBN 21mg(0.13mmol)を仕込んだ。この反応溶液を60℃で6時間撹拌した。反応後、クロロホルム3mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA5(671mg、収率88%)を得た。
【0176】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=3300、PD=1.21であった。
【0177】
合成例22(PMMA6)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート2.2 mL(20.5mmol)、CTA1 120μL(0.68 mmol)とジメチルジテルリド65μL(0.68mmol)とAIBN 23 mg(0.141mmol)を仕込んだ。この反応溶液を60℃で5.2時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA6(2.1g、収率98%)を得た。
【0178】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=3800、PDI=1.17であった。
【0179】
合成例23(PMMA7)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.98 ml(19mmol)、CTA1 70μL(0.37mmol)、ジメチルジテルリド39μL(0.37mmol)とAIBN 17mg(0.074mmol)を仕込んだ。この反応溶液を60℃で4.5時間撹拌した。反応後、クロロホルム8mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA7(1.96g、収率89%)を得た。
【0180】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5100、PDI=1.19であった。
【0181】
<二量化反応>
実施例1
PIp1溶液を調製した容器から取り出すことなく、フィルターAを通して20℃で1時間、光照射を行った。光源は水銀ランプを用いた。
【0182】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3500、PDI=1.13、xc=0.99であった。
【0183】
実施例2
PIp1溶液を調製した容器から取り出すことなく、20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0184】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=3100、PDI=1.20、xc=0.85であった。また、反応管内部表面に金属テルルが析出していた。
【0185】
実施例3
PIp2溶液を調製した容器から取り出すことなく、フィルターAを通して20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0186】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=17200、PDI=1.11、xc=0.87であった。
【0187】
実施例4
PIp3溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0188】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=4450、PDI=1.11、xc=0.93であった。
【0189】
実施例5
PIp4溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0190】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=6400、PDI=1.10、xc=0.96であった
【0191】
実施例6
PMMA−b−PIp1溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0192】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=28900、PDI=1.15、xc=0.88であった。
【0193】
実施例7
PSt−b−PIp1溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0194】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=17000、PDI=1.18、xc=0.86であった。
【0195】
実施例8
窒素置換したパイレックス(登録商標)ガラス管内で、PSt1 380mgとベンゼン1mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で11時間、光照射を行った。光源は水銀ランプを用いた。
【0196】
GPC分析(ポリスチレン標準サンプルの分子量を基準)により、Mn=7200、PDI=1.27、xc=0.72であった。
【0197】
実施例9
窒素置換したパイレックス(登録商標)ガラス管内で、PSt2 80mg、イソプレン90μL(0.90mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0198】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=7100、PDI=1.13、xc=0.91であった。
【0199】
実施例10
窒素置換したパイレックス(登録商標)ガラス管内で、PAN1 80mg、イソプレン92μL(0.92mmol)とDMF 1.0mLを仕込んだ。この反応溶液に、フィルターB通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。光源は水銀ランプを用いた。
【0200】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=9700、PDI=1.17、xc=0.89であった。
【0201】
実施例11
窒素置換したパイレックス(登録商標)ガラス管内で、PNVP1 100mg、イソプレン0.22mL(2.2mmol)とDMF0.22mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0202】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5050、PDI=1.12、xc=0.94であった。
【0203】
実施例12
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mg、イソプレン82μL(0.82mmol)とDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0204】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=10100、PDI=1.22、xc=0.87であった。
【0205】
実施例13
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA2 74mg、イソプレン90μL(0.90mmol)とベンゼン0.7mLを仕込んだ。この反応溶液に、20℃で4時間、光照射を行った。光源はLEDランプを用いた。
【0206】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=7200、PDI=1.19、xc=0.80であった。
【0207】
実施例14
PMMA3溶液を調整した反応容器に、イソプレン0.5mL(5.0 mmol)と1,4−ジオキサン1mLを加えた。この反応溶液に、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0208】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=15200、PD=1.21、xc=0.86であった。
【0209】
実施例15
PMMA4溶液を調整した反応容器に、にイソプレン0.09mL(0.9mmol)と1,4−ジオキサン0.2mLを加えた。この反応溶液に、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0210】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=8700、PDI=1.21、xc=0.86であった。
【0211】
実施例16
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mg、2,3−ジメチル−1,3−ブタジエン93μL(0.82mmol)とDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0212】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=10700、PDI=1.20、xc=0.93であった。
【0213】
実施例17
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、2,3−ジメチル−1,3−ブタジエン102μL(0.10mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0214】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6500、PDI=1.15、xc=0.95であった。
【0215】
実施例18
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、1,3−シクロヘキサジエン34μL(0.36mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で2時間、光照射を行った。光源は水銀ランプを用いた。
【0216】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5300、PDI=1.26、xc=0.77であった。
【0217】
実施例19
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、トランス−2,4−ヘキサジエン−1−オール88mg(0.90mmol)とベンゼン0.4 mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0218】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5000、PDI=1.24、xc=0.63であった。
【0219】
実施例20
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA6 60mg、ソルビン酸エチル134μL(0.90mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0220】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5200、PDI=1.28、xc=0.62であった。
【0221】
実施例21
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA7 80mg、スチレン186μL(1.62mmol)と1,4−ジオキサン0.5mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0222】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=10200、PDI=1.24、xc=0.90であった。
【0223】
実施例22
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA2 60mg、4−ビニルピリジン74μL(0.70mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で4時間、光照射を行った。光源は水銀ランプを用いた。
【0224】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6400、PD=1.27、xc=0.70であった。
【0225】
比較例1
PIp2溶液を調製した容器から取り出すことなく、この反応溶液を遮光条件下140℃で24時間撹拌し、反応溶液を室温まで放冷して反応を停止した。
【0226】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=11800、PDI=1.19、xc=0.37であり、分子量が変化していない重合体が主生成物であった。
【0227】
比較例2
窒素置換したパイレックス(登録商標)ガラス管内で、PNVP2 100mgとDMF0.22mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0228】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)から、マクロリビング開始剤と同じ分子量を持ち(Mn=4400、PDI=1.12)、xc=0.00であり、二量化反応が進行していなかった。
【0229】
比較例3
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mgとDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0230】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6400、PDI=1.27、xc=0.22であり、分子量が変化していない重合体が主生成物であった。
【0231】
【表1】

【0232】
<GPCチャート>
図1〜2は、実施例1〜3、実施例8、実施例11〜12、実施例16及び比較例1〜比較例3における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図である。
【0233】
図1〜2において、実線は反応後のチャートを示し、破線は反応前のチャートを示している。また、図1〜2において図面左側に近づくにつれて分子量が高くなり、図面右側に近づくにつれて分子量が低くなっている。すなわち、時間の短い方が高分子量であり、時間の長い方が低分子量である。
【0234】
実施例においては、二量化反応後に、ピークがほぼ完全にシフトしており、高効率的かつ選択的に反応が起こっていることがわかる。
【0235】
これに対し、比較例1及び比較例3では、二量化反応後のGPGチャートにおいて、ショルダーのピークが形成されており、かつ二量化反応前のピークと同じ位置に最も大きなピークが存在している。従って、反応効率が低いため、反応前の分子量のものが多く残存していることがわかる。また、比較例2では、二量化反応後においてもピークが変化していなことから、反応が起こっていないことがわかる。
【技術分野】
【0001】
本発明は、リビングラジカル重合法により合成されたポリマーの成長末端での選択的かつ高効率的な二量化反応によるポリマーの製造方法及び該方法により製造されたポリマーに関するものである。
【背景技術】
【0002】
リビングラジカル重合は、ラジカル重合の簡便性と汎用性を保ちつつ分子構造の制御を可能にする重合法で、新しい高分子材料の合成に大きな威力を発揮している。なかでも、重合成長末端に対して異なるモノマーを加えて重合することで生成する、構造の制御されたブロック共重合体は機能性材料の宝庫であると期待されている。
【0003】
本発明者らは、有機テルル化合物を開始剤として用いたリビングラジカル重合法を報告している(特許文献1及び特許文献2)。例えば、特許文献1では、有機テルル化合物を用いて、80〜105℃にて重合することにより、分子量及び分子量分布(PDI)の精密制御されたリビングラジカルポリマーを得ている。また、特許文献2では、有機テルル化合物とジテルリド化合物を用いて、80〜120℃にて重合することにより、分子量及び分子量分布(PDI)の精密制御されたリビングラジカルポリマーを得ている。これらの重合方法により、多種のビニルモノマーの重合を可能としている。しかし、分子量が大きくなると反応時間が長く収率が悪いという問題がある。さらに、ブロック共重合体、特にトリブロック共重合体よりポリマーブロックの多い共重合体等を得るためには、使用できるブロックセグメント種に大きな制約がある。
【0004】
さらに、本発明者らは光照射による有機テルル重合開始剤を用いたビニルモノマーのリビングラジカル重合法を報告している(特許文献3)。光照射条件においても精密な分子量及び分子量分布を制御することが可能である。さらに、熱に不安定なモノマーの重合が可能であると共に、低温で重合をおこなうことができるため、熱による副反応を抑えて重合が可能である。しかし、熱重合と同じ問題、すなわち、高分子量体の合成が難しいことや、ブロック共重合体の合成に制約を持っている。
【0005】
従って、分子量及び分子量分布が制御された高分子量体のポリマーを高収率でかつ短時間に得ることができる製造方法や、マルチブロック共重合体を自由度高く得ることができる製造方法が望まれている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開2004/14848号パンフレット
【特許文献2】国際公開2004/14962号パンフレット
【特許文献3】特開2007−302737号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、分子量及び分子量分布が制御されたポリマーを、リビングラジカルポリマーのカップリング反応による二量化で、高効率的かつ選択的に製造する方法、及びブロック共重合体をリビングラジカルポリマーとして用いることで、マルチブロック共重合体を提供することにある。
【課題を解決するための手段】
【0008】
本発明の第1の局面に従うポリマーの製造方法は、マクロリビング開始剤を調製する工程と、マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、前記化合物を添加した後、光照射することにより、前記化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴としている。
【0009】
本発明の第1の局面に従う光照射する工程は、前記化合物を添加した後、加熱してマクロリビング開始剤で前記化合物を重合させ、その後に光照射する工程であってもよい。これにより、前記化合物の重合体からなるブロックを含むブロック共重合体を製造することができる。
【0010】
また、本発明の第2の局面に従うポリマーの製造方法は、共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビングラジカル開始剤を調整する工程と、マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とすることを特徴としている。
【0011】
以下、本発明の第1の局面及び第2の局面に共通する事項については、「本発明」として説明する。
【0012】
本発明において、光照射する工程は、波長300〜700nmの発光分布を有する光源を用いて行われることが好ましい。
【0013】
本発明において、光照射する工程は、−70℃〜80℃の範囲の温度で光照射することにより行われることが好ましい。
【0014】
本発明において、マクロリビング開始剤は、有機テルル系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより調製されることが好ましい。
【0015】
この場合において、有機テルル系重合開始剤は、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物のいずれかであることが好ましい。
【0016】
【化1】

【0017】
(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。R2及びR3は、水素原子又は炭素数1〜8のアルキル基を示す。R4は、炭素数1〜8のアルキル基、アリール基、芳香族ヘテロ環基、アシル基、アミド基、オキシカルボニル基又はシアノ基を示す。)
【0018】
【化2】

【0019】
(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。)
【0020】
本発明のポリマーは、上記本発明の製造方法で製造されたことを特徴としている。
【発明の効果】
【0021】
本発明によれば、分子量及び分子量分布が制御されたポリマーを、リビングラジカルポリマーのカップリング反応による二量化で、高収率、かつ短時間に製造することができる。さらに、構造の制御されたブロック共重合体からなるマクロリビング開始剤を出発基質として用いることで、対称な構造を持つマルチブロック共重合体を容易に製造することができる。
【図面の簡単な説明】
【0022】
【図1】実施例1〜3、実施例8及び実施例11〜12における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図。
【図2】実施例16及び比較例1〜3における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図。
【図3】GPCチャートにおけるピーク分割法について説明するための図。
【発明を実施するための形態】
【0023】
本発明の第1の局面においては、上述のように、マクロリビング開始剤に、共役オレフィン化合物を添加した後、光照射することにより、前記化合物を重合成長末端とするラジカルを選択的にカップリング反応させて二量化している。
【0024】
本発明の第2の局面においては、上述のように、マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化している。
【0025】
以下、本発明についてさらに詳細に説明する。
【0026】
<マクロリビング開始剤の調製>
本発明においてマクロリビング開始剤とは、−TeR1の形態でテルル原子をポリマー末端に有する(R1は、上記と同じ)化合物のことをいう。
【0027】
マクロリビング開始剤は、例えば、特許文献1及び特許文献2に記載された有機テルル化合物系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより得ることができる。
【0028】
具体的には、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物
のいずれかである有機テルル化合物系重合開始剤を用いて重合する。
【0029】
本発明で使用する有機テルル化合物系開始剤としては、例えば、一般式(1)で表されるものが挙げられる。
【0030】
R1で示される基は、具体的には次の通りである。
【0031】
炭素数1〜8のアルキル基としては、メチル基、エチル基、n−プロピル基、イソプロピル基、シクロプロピル基、n−ブチル基、sec−ブチル基、tert−ブチル基、シクロブチル基、n−ペンチル基、n−ヘキシル基、n−ヘプチル基、n−オクチル基等の炭素数1〜8の直鎖状、分岐鎖状又は環状のアルキル基を挙げることができる。好ましいアルキル基としては、炭素数1〜4の直鎖状又は分岐鎖状のアルキル基が良い。より好ましくは、メチル基、エチル基又はn−ブチル基が良い。
【0032】
アリール基は、任意の位置にハロゲン原子、水酸基、アルコキシ基、アミノ基、ニトロ基、シアノ基、−CORaで示されるカルボニル含有基[Ra=炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、炭素数1〜8のアルコキシ基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルコキシ基)、アリール基、アリーロキシ基]、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個、パラ位又はオルト位)有していてもよい。アリール基としては、具体的にはフェニル基、ナフチル基、ハロゲン原子置換フェニル基、トリフルオロメチル置換フェニル基等を挙げることができ、好ましくはフェニル基が良い。
【0033】
芳香族へテロ環基としては、ピリジル基、ピロール基、フリル基、チエニル基等を挙げることができる。
【0034】
R2及びR3で示される各基は、具体的には次の通りである。
【0035】
炭素数1〜8のアルキル基としては、上記R1で示したアルキル基と同様のものを挙げることができる。
【0036】
R4で示される各基は、具体的には次の通りである。
【0037】
炭素数1〜8のアルキル基、アリール基、芳香族へテロ環基としては上記R1で示した基と同様のものを挙げることができる。
【0038】
アシル基としては、ホルミル基、アセチル基、ベンゾイル基等を挙げることができる。
【0039】
アミド基としては、アセトアミド、マロンアミド、スクシンアミド、マレアミド、ベンズアミド、2−フルアミド等のカルボン酸アミド、チオアセトアミド、ヘキサンジチオアミド、チオベンズアミド、メタンチオスルホンアミド等のチオアミド、セレノアセトアミド、ヘキサンジセレノアミド、セレノベンズアミド、メタンセレノスルホンアミド等のセレノアミド、N−メチルアセトアミド、ベンズアニリド、シクロヘキサンカルボキサニリド、2,4'−ジクロロアセトアニリド等のN−置換アミド等を挙げることができる。
【0040】
オキシカルボニル基としては、−COORb[Rb=H、炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、炭素数2〜8のアルケニル基(好ましくは炭素数2〜4の直鎖状又は分岐鎖状のアルケニル基)、炭素数2〜8のアルキニル基(好ましくは炭素数2〜4の直鎖状又は分岐鎖状のアルキニル基)、アリール基]で示される基を挙げることができる。Rbで示される炭素数1〜8のアルキル基、炭素数2〜8のアルケニル基、炭素数2〜8のアルキニル基、アリール基は、任意の位置にハロゲン原子、水酸基、炭素数1〜8のアルコキシ基、トリアルキルシリルエーテル基(該アルキルは炭素数1〜8)、トリアルキルシリル基(該アルキルは炭素数1〜8)、アミノ基、ニトロ基、シアノ基、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していても良い。オキシカルボニル基としては、具体的にはカルボキシル基、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、n−ブトキシカルボニル基、sec−ブトキシカルボニル基、tert−ブトキシカルボニル基、n−ペントキシカルボニル基、フェノキシカルボニル基等を挙げることができ、好ましくはメトキシカルボニル基、エトキシカルボニル基が良い。
【0041】
好ましいR4で示される各基としては、アリール基、オキシカルボニル基又はシアノ基が良い。
【0042】
好ましい一般式(1)で示される有機テルル化合物としては、R1が炭素数1〜4のアルキル基又はフェニル基を示し、R2及びR3が水素原子又は炭素数1〜4のアルキル基を示し、R4がアリール基、オキシカルボニル基で示される化合物が良い。特に好ましくは、R1が炭素数1〜4のアルキル基又はフェニル基を示し、R2及びR3が水素原子又は炭素数1〜4のアルキル基を示し、R4がフェニル基、メトキシカルボニル基、エトキシカルボニル基が良い。
【0043】
一般式(1)で示される有機テルル化合物は、具体的には(メチルテラニルメチル)ベンゼン、(メチルテラニルメチル)ナフタレン、エチル−2−メチル−2−メチルテラニル−プロピオネート、エチル−2−メチル−2−n−ブチルテラニル−プロピオネート、(2−トリメチルシロキシエチル)−2−メチル−2−メチルテラニル−プロピネート、(2−ヒドロキシエチル)−2−メチル−2−メチルテラニル−プロピネート、(3−トリメチルシリルプロパルギル)−2−メチル−2−メチルテラニル−プロピネートなど、特許文献1及び特許文献2等に記載された有機テルル化合物の全てを例示することができる。
【0044】
一般式(1)で示される有機テルル化合物の製造方法は特に限定されず、特許文献1及び特許文献2等に記載された公知の方法等により製造することができる。
【0045】
例えば、一般式(1)の化合物は、一般式(3)の化合物、一般式(4)の化合物及び金属テルルを反応させることにより製造することができる。
【0046】
【化3】

【0047】
(式中、R2、R3及びR4は、上記と同じ。Xは、ハロゲン原子を示す。)
Xで示される基としては、フッ素、塩素、臭素又はヨウ素等のハロゲン原子を挙げることができる。好ましくは、塩素、臭素が良い。
【0048】
【化4】

【0049】
(R1は、上記と同じ。Mは、アルカリ金属、アルカリ土類金属又は銅原子を示す。Mがアルカリ金属の時、mは1、Mがアルカリ土類金属の時、mは2、Mが銅原子の時、mは1または2を示す。)
【0050】
Mで示されるものとしては、リチウム、ナトリウム、カリウム等のアルカリ金属、マグネシウム、カルシウム等のアルカリ土類金属、銅を挙げることができる。好ましくは、リチウムが良い。
【0051】
なお、Mがマグネシウムの時、一般式(4)の化合物はMg(R1)2でも、或いはR1MgX(Xは、ハロゲン原子)で表される化合物(グリニャール試薬)でも良い。Xは、好ましくは、塩素、臭素が良い。
【0052】
本発明で使用する他の有機テルル化合物としては、例えば、一般式(2)で表されるものが挙げられる。
【0053】
R1で示される基は、一般式(1)に示した通りである。
【0054】
好ましい一般式(2)で示される化合物としては、R1が炭素数1〜4のアルキル基、フェニル基が良い。
【0055】
一般式(2)で示される化合物は、具体的には、ジメチルジテルリド、ジエチルジテルリド、ジ−n−プロピルジテルリド、ジイソプロピルジテルリド、ジシクロプロピルジテルリド、ジ−n−ブチルジテルリド、ジ−sec−ブチルジテルリド、ジ−tert−ブチルジテルリド、ジシクロブチルジテルリド、ジフェニルジテルリド、ビス−(p−メトキシフェニル)ジテルリド、ビス−(p−アミノフェニル)ジテルリド、ビス−(p−ニトロフェニル)ジテルリド、ビス−(p−シアノフェニル)ジテルリド、ビス−(p−スルホニルフェニル)ジテルリド、ジナフチルジテルリド、ジピリジルジテルリド等が挙げられる。好ましくは、ジメチルジテルリド、ジエチルジテルリド、ジ−n−プロピルジテルリド、ジ−n−ブチルジテルリド、ジフェニルジテルリドが良い。
【0056】
また本発明では重合速度の促進を目的にアゾ系重合開始剤を使用してもよい。アゾ系重合開始剤は、通常のラジカル重合で使用するアゾ系重合開始剤であれば特に制限なく使用することができる。
【0057】
例えば2,2′−アゾビス(イソブチロニトリル)(AIBN)、2,2′−アゾビス(2−メチルブチロニトリル)(AMBN)、2,2′−アゾビス(2,4−ジメチルバレロニトリル)(ADVN)、1,1′−アゾビス(1−シクロヘキサンカルボニトリル)(ACHN)、ジメチル−2,2′−アゾビスイソブチレート(MAIB)、4,4′−アゾビス(4−シアノバレリアン酸)(ACVA)、1,1′−アゾビス(1−アセトキシ−1−フェニルエタン)、2,2′−アゾビス(2−メチルブチルアミド)、2,2′−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、2,2′−アゾビス(2−メチルアミジノプロパン)二塩酸塩、2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2′−アゾビス(2,4,4−トリメチルペンタン)、2−シアノ−2−プロピルアゾホルムアミド、2,2′−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2′−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)等が挙げられる。
【0058】
これらのアゾ開始剤は反応条件に応じて適宜選択するのが好ましい。例えば低温重合(40℃以下)の場合は2,2′−アゾビス(2,4−ジメチルバレロニトリル)(ADVN)、2,2′−アゾビス(4−メトキシ−2,4−ジメチルバレロニトリル)、中温重合(40〜80℃)の場合は2,2′−アゾビス(イソブチロニトリル)(AIBN)、2,2′−アゾビス(2−メチルブチロニトリル)(AMBN)、ジメチル−2,2′−アゾビスイソブチレート(MAIB)、1,1′−アゾビス(1−アセトキシ−1−フェニルエタン)、4,4′−アゾビス(4−シアノバレリアン酸)(ACVA)、2,2′−アゾビス(2−メチルブチルアミド)、2,2′−アゾビス(2−メチルアミジノプロパン)二塩酸塩、2,2′−アゾビス[2−(2−イミダゾリン−2−イル)プロパン]、高温重合(80℃以上)の場合は1,1′−アゾビス(1−シクロヘキサンカルボニトリル)(ACHN)、2−シアノ−2−プロピルアゾホルムアミド、2,2′−アゾビス(N−ブチル−2−メチルプロピオンアミド)、2,2′−アゾビス(N−シクロヘキシル−2−メチルプロピオンアミド)、2,2′−アゾビス(2,4,4−トリメチルペンタン)、2,2′−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]を用いるのが良い。
【0059】
一般式(1)の化合物の使用量としては、得られるマクロリビング開始剤の分子量或いは分子量分布により適宜調節すれば良いが、通常、ビニルモノマー10molに対し一般式(1)の化合物を0.5〜200mmol、好ましくは1〜100mmolとするのが良い。
【0060】
一般式(1)の化合物とアゾ系重合開始剤の使用割合は、通常、一般式(1)の化合物1molに対して、アゾ系重合開始剤0.01〜100mol、好ましくは0.1〜10molmol、特に好ましくは0.1〜5molとするのが良い。
【0061】
一般式(1)の化合物と一般式(2)の化合物を併用する場合、その使用量としては、通常、一般式(1)の化合物1molに対して、一般式(2)の化合物0.01〜100mol、好ましくは0.05〜10mol、特に好ましくは0.1〜5molとするのが良い。
【0062】
一般式(1)の化合物、一般式(2)の化合物及びアゾ系重合開始剤を併用する場合、その使用量としては、通常、一般式(1)の化合物と一般式(2)の化合物の合計1molに対して、アゾ系重合開始剤0.01〜100mol、好ましくは0.1〜10mol、特に好ましくは0.1〜5molとするのが良い。
【0063】
マクロリビング開始剤を得る反応は、無溶剤でも行うことができるが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用して行うことができる。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパオール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、例えば、得られるマクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは、0.05〜10Lが、特に好ましくは、0.1〜5Lが良い。
【0064】
有機テルル化合物系重合開始剤とビニルモノマーの混合物を攪拌することにより、マクロリビング開始剤を得ることができる。反応温度、反応時間は、得られるマクロリビング開始剤の分子量或いは分子量分布により適宜調節すれば良いが、通常、0〜150℃で、1分〜100時間撹拌する。好ましくは、20〜100℃で、0.1〜30時間撹拌するのが良い。更に好ましくは、20〜80℃で、0.1〜15時間撹拌するのが良い。このように低い重合温度及び短い重合時間であっても高い収率と精密な分子量分布を得ることができる。この時、圧力は、通常、常圧で行われるが、加圧或いは減圧しても構わない。
【0065】
反応終了後、常法により使用溶媒や残存モノマーを減圧下除去して目的のマクロリビング開始剤を取り出したり、不溶溶媒を使用して再沈殿処理により目的のマクロリビング開始剤を単離することができる。反応処理については、目的物に支障がなければどのような処理方法でも行うことができる。また、マクロリビング開始剤は、単離せずそのまま用いることもできる。
【0066】
マクロリビング開始剤の分子量は、反応時間、一般式(1)の化合物の量および一般式(2)の化合物の量により調整可能であるが、重量平均分子量2000〜2000000の範囲とするのが良く、より好ましくは重量平均分子量5000〜1000000の範囲とするのがよい。
【0067】
マクロリビング開始剤の分子量分布(PDI=Mw/Mn)は、1.05〜2.00の間で制御される。更に、分子量分布1.05〜1.80、更には1.05〜1.50のより狭い分子量分布を持ったマクロリビング開始剤を得ることができる。
【0068】
本発明のマクロリビング開始剤を得るために用いるビニルモノマーとしては、ラジカル重合可能であれば特に制限なく使用することができる。これらは1種単独で又は2種以上混合して使用される。
【0069】
例えば、本発明に用いるビニルモノマーとして下記のものを挙げることができる。
【0070】
(メタ)アクリル酸メチル、(メタ)アクリル酸エチル、(メタ)アクリル酸プロピル、(メタ)アクリル酸ブチル、(メタ)アクリル酸オクチル、(メタ)アクリル酸ラウリル、(メタ)アクリル酸−2−ヒドロキシエチル等の(メタ)アクリル酸エステル。
【0071】
(メタ)アクリル酸シクロヘキシル、(メタ)アクリル酸メチルシクロヘキシル、(メタ)アクリル酸イソボルニル、(メタ)アクリル酸シクロドデシル等のシクロアルキル基含有不飽和モノマー。
【0072】
(メタ)アクリル酸、マレイン酸、フマル酸、イタコン酸、シトラコン酸、クロトン酸、無水マレイン酸等メチル等のカルボキシル基含有不飽和モノマー。
【0073】
N,N−ジメチルアミノプロピル(メタ)アクリルアミド、N,N−ジメチルアミノエチル(メタ)アクリルアミド、2−(ジメチルアミノ)エチル(メタ)アクリレート、N,N−ジメチルアミノプロピル(メタ)アクリレート等の3級アミン含有不飽和モノマー。
【0074】
N−2−ヒドロキシ−3−アクリロイルオキシプロピル−N,N,N−トリメチルアンモニウムクロライド、N−メタクリロイルアミノエチル−N,N,N−ジメチルベンジルアンモニウムクロライド等の4級アンモニウム塩基含有不飽和モノマー。
【0075】
(メタ)アクリル酸グリシジル等のエポキシ基含有不飽和モノマー。
【0076】
スチレン、α−メチルスチレン、4−メチルスチレン(p−メチルスチレン)、2−メチルスチレン(o−メチルスチレン)、3−メチルスチレン(m−メチルスチレン)、4−メトキシスチレン(p−メトキシスチレン)、p−tert−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブトキシスチレン、2−ヒドロキシメチルスチレン、2−クロロスチレン(o−クロロスチレン)、4−クロロスチレン(p−クロロスチレン)、2,4−ジクロロスチレン、1−ビニルナフタレン、ジビニルベンゼン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)等の芳香族不飽和モノマー(スチレン系モノマー)。
【0077】
2−ビニルチオフェン、N−メチル−2−ビニルピロール、1−ビニル−2−ピロリドン、2−ビニルピリジン、4−ビニルピリジン等のヘテロ環含有不飽和モノマー。
【0078】
N−ビニルホルムアミド、N−ビニルアセトアミド等のビニルアミド。
【0079】
(メタ)アクリルアミド、N−メチル(メタ)アクリルアミド、N−イソプロピル(メタ)アクリルアミド、N,N−ジメチル(メタ)アクリルアミド等の(メタ)アクリルアミド。
【0080】
1−ヘキセン、1−オクテン、1−デセン等のα−オレフィン。
【0081】
ブタジエン、イソプレン、4−メチル−1,4−ヘキサジエン、7−メチル−1,6−オクタジエン等のジエン類。
【0082】
酢酸ビニル、安息香酸ビニル等のカルボン酸ビニルエステル。
(メタ)アクリル酸ヒドロキシエチル。(メタ)アクリロニトリル。メチルビニルケトン。塩化ビニル。塩化ビニリデン。
【0083】
この中でも、好ましくは(メタ)アクリル酸エステル、シクロアルキル基含有不飽和モノマー、芳香族不飽和モノマー(スチレン系モノマー)、(メタ)アクリルアミド、(メタ)アクリロニトリル、メチルビニルケトンが良い。
【0084】
好ましい(メタ)アクリル酸エステルとしては、(メタ)アクリル酸メチル、(メタ)アクリル酸エチル、(メタ)アクリル酸プロピル、(メタ)アクリル酸ブチル、(メタ)アクリル酸−2−ヒドロキシエチルが挙げられる。特に好ましくは、メタアクリル酸メチル、メタアクリル酸エチル、メタアクリル酸プロピル、メタアクリル酸ブチル、メタアクリル酸−2−ヒドロキシエチルが良い。
【0085】
好ましいシクロアルキル基含有不飽和モノマーとしては、(メタ)アクリル酸シクロヘキシル、(メタ)アクリル酸イソボルニルが良い。特に好ましくは、メタアクリル酸シクロヘキシル、メタアクリル酸イソボルニルが良い。
【0086】
好ましいスチレン系モノマーとしては、スチレン、α−メチルスチレン、o−メチルスチレン、p−メチルスチレン、p−メトキシスチレン、p−t−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブチルスチレン、p−クロロスチレン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)が挙げられる。特に好ましくは、スチレン、p−クロロスチレンが良い。
【0087】
好ましい(メタ)アクリルアミドとしては、N−イソプロピル(メタ)アクリルアミドが挙げられる。特に好ましくは、N−イソプロピルメタアクリルアミドが良い。
【0088】
尚、上記の「(メタ)アクリル」は、「アクリル」及び「メタクリル」の総称である。
【0089】
マクロリビング開始剤は、モノマーの種類に関係なく、反応させるビニルモノマーの順番によるポリマーを得ることができる。ビニルモノマーAとビニルモノマーBを反応させブロック共重合体を得る場合、反応させる順番によりA−Bのものも、B−Aのものも得ることができる。上記で、各ブロックを製造後、そのまま次のブロックの反応を開始しても良いし、一度反応を終了後、精製してから次のブロックの反応を開始しても良い。ブロック共重合体の単離は通常の方法により行うことができる。
【0090】
<二量化反応>
二量化反応は、マクロリビング開始剤に共役オレフィン化合物を混合し、光照射することにより行うことができる。具体的には、不活性ガスで置換した容器で、マクロリビング開始剤と共役オレフィン化合物を混合する。この時、不活性ガスとしては、窒素、アルゴン、ヘリウム、二酸化炭素等を挙げることができる。好ましくは、アルゴン、窒素が良い。
【0091】
容器としては、特に制限なく使用することができる。例えば、UV透過ガラス、パイレックス(登録商標)ガラス等の硬質ガラス、石英ガラス等の軟質ガラスを利用することができる。
【0092】
光の照射方法としては、特に制限されることが無く、イマージョン型の光反応装置や通常の反応容器に光照射を行うことで重合を行うことができる。
【0093】
マクロリビング開始剤と共役オレフィン化合物の使用量としては、得られる二量体の分子量あるいは分子量分布により適宜調整すれば良いが、通常、マクロリビング重合開始剤1molに対して、共役オレフィン化合物を1〜20000mol、好ましくは10〜10000molが良い。
【0094】
反応は、通常、無溶媒で行うが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用しても構わない。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパノール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、例えば、マクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは0.05〜10Lが、特に好ましくは0.1〜5Lが良い。
【0095】
また、マクロリビング開始剤を単離せずに反応を行う場合は、通常、無溶媒で行うが、ラジカル重合で一般に使用される有機溶媒或いは水性溶媒を使用(追加)しても構わない。使用できる有機溶媒としては、例えば、ベンゼン、トルエン、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、アセトン、2−ブタノン(メチルエチルケトン)、ジオキサン、ヘキサフルオロイソプロパノール、クロロホルム、四塩化炭素、テトラヒドロフラン(THF)、酢酸エチル、トリフルオロメチルベンゼンや、N−メチル−N−メトキシメチルピロリジウムテトラフルオロボレート、N−メチル−N−エトキシメチルテトラフルオロボレート1−メチル3−メチルイミダゾリウムテトラフルオロボレート、1−メチル3−メチルイミダゾリウムヘキサフルオロフォスフェート、1−メチル3−メチルイミダゾリウムクロライド等のイオン液体等が挙げられる。また、水性溶媒としては、例えば、水、メタノール、エタノール、イソプロパノール、n−ブタノール、エチルセロソルブ、ブチルセロソルブ、1−メトキシ−2−プロパノール、ジアセトンアルコール等が挙げられる。溶媒の使用量としては適宜調節すれば良いが、マクロリビング開始剤1000gに対して、溶媒を0.01〜50L、好ましくは0.05〜10Lが、特に好ましくは0.1〜5Lが良い。
【0096】
光照射、反応温度、反応時間は、得られる二量体の分子量或いは分子量分布により適宜調節すればよい。また、反応により有機ジテルル化合物(2)が定量的に副生し、有機ジテルル化合物(2)は光分解により金属テルルを析出し光を遮ることから、反応を高効率かつ短時間で行うためには、適宜下記反応条件で調節すれば良い。
【0097】
光照射は、光照射するために用いられるランプ類としては、光波長300〜700nmに発光分布を有するものが好適に用いられ、その例としては、低圧水銀灯、中圧水銀灯、高圧水銀灯、超高圧水銀灯、ケミカルランプ、ブラックライトランプ、マイクロウェーブ励起水銀灯、メタルハライドランプ、キセノンランプ、クリプトンランプ、LEDランプ、有機ELランプ等が挙げられる。
【0098】
また、照射する光源と、ガラス製のカットオフフィルター、減光フィルターや溶媒フィルターを組み合わせることで、照射波長の領域を制御して行うこともできる。好ましい照射波長は、300〜600nmに発光分布を持つ光源を用いるのが良く、さらに好ましくは300〜450nm領域の波長を有する光を照射することが良い。
【0099】
反応温度は−70℃〜80℃が良く、好ましくは−70〜60℃が良く、さらに好ましくは0〜35℃が良い。
【0100】
反応時間は光の照射強度や照射波長により変化するため、特に制限はない。通常は1分〜100時間程度で行うことができる。好ましくは0.1〜30時間が良い。更に好ましくは0.1〜15時間が良い。
【0101】
反応終了後、常法により使用溶媒や残存モノマーを減圧下除去して目的ポリマーを取り出したり、目的ポリマー不溶溶媒を使用して再沈殿処理により目的物を単離する。反応処理については、目的物に支障がなければどのような処理方法でも行うことができる。
【0102】
本発明の第1の局面において、二量化反応はマクロリビング開始剤に由来する重合成長末端ラジカルが共役オレフィン化合物と反応して生成したラジカルが、カップリング反応を起こすことで進行する。また、本発明の第2の局面のように、二量化反応に共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビング開始剤を使用する場合には、共役オレフィン化合物を混合することなく二量化反応を行うことができる。これらの反応に使用する共役オレフィン化合物は、ラジカルカップリングを起こす共役オレフィン化合物であれば特に制限なく使利用でき、これらは1種単独で又は2種以上混合して使用される。
【0103】
例えば、本発明に用いる共役オレフィン化合物としては、共役ジエンや共役トリエン等の共役ポリエン化合物や、スチレン誘導体などの芳香族基と共役したオレフィン化合物を挙げることができる。具体的には、下記のものを挙げることができるが、これらの化合物に限定されるものではない。
【0104】
共役ポリエン化合物は、任意の位置に後述する置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していてもよい。具体的には、1,3−ブタジエン、イソプレン、2−エチル−1,3−ブタジエン、2−t−ブチル−1,3−ブタジエン、2−フェニル−1,3−ブタジエン、2,3−ジメチル−1,3−ブタジエン、2,4−ジメチル−1,3−ブタジエン、1,3−ペンタジエン、2−メチル−1,3−ペンタジエン、3−メチル−1,3−ペンタジエン、1,3−ヘキサジエン、2−メチル−1,3−オクタジエン、4,5−ジエチル−1,3−オクタジエン、3−ブチル−1,3−オクタジエン、1,3−シクロペンタジエン、1,3−シクロヘキサジエン、1,3−シクロオクタジエン、1,3−トリシクロデカジエン、ミルセン、クロロプレン、1,3,5−ヘキサトリエン、1,3,5−ヘプタトリエン、トランス−2,4−ヘキサジエン−1−オール、ソルビン酸エチル等を挙げることができる。
【0105】
芳香族基と共役したオレフィン化合物は、任意の位置に後述する置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していてもよい。具体的には、スチレン、α−メチルスチレン、4−メチルスチレン(p−メチルスチレン)、2−メチルスチレン(o−メチルスチレン)、3−メチルスチレン(m−メチルスチレン)、4−メトキシスチレン(p−メトキシスチレン)、p−tert−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブトキシスチレン、2−ヒドロキシメチルスチレン、2−クロロスチレン(o−クロロスチレン)、4−クロロスチレン(p−クロロスチレン)、2,4−ジクロロスチレン、1−ビニルナフタレン、ジビニルベンゼン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)、2−ビニルピリジン、4−ビニルピリジン等を挙げることができる。
【0106】
共役ポリエン化合物、芳香族基と共役したオレフィン化合物の置換基としては、ハロゲン原子、水酸基、炭素数1〜8のアルコキシ基、−CORcで示されるカルボニル含有基[Rc=炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、アリール基]、−COORd[Rd=H、炭素数1〜8のアルキル基(好ましくは炭素数1〜4の直鎖状又は分岐鎖状のアルキル基)、アリール基]、トリアルキルシリルエーテル基(該アルキルは炭素数1〜8)、トリアルキルシリル基(該アルキルは炭素数1〜8)、アミノ基、ニトロ基、シアノ基、スルホニル基、トリフルオロメチル基等の置換基を1〜4個(好ましくは1〜3個、より好ましくは1個)有していても良い。
【0107】
好ましい共役ポリエン化合物としては、1,3−ブタジエン、イソプレン、2−エチル−1,3−ブタジエン、2−t−ブチル−1,3−ブタジエン、2−フェニル−1,3−ブタジエン、2,3−ジメチル−1,3−ブタジエン、2,4−ジメチル−1,3−ブタジエン、1,3−ペンタジエン、2−メチル−1,3−ペンタジエン、3−メチル−1,3−ペンタジエン、1,3−ヘキサジエン、2−メチル−1,3−オクタジエン、ミルセン等の炭素数1〜10の直鎖状、分岐鎖状又は環状の共役ポリエン化合物が良い。
【0108】
好ましい芳香族基と共役したオレフィン化合物としては、スチレン、α−メチルスチレン、o−メチルスチレン、p−メチルスチレン、p−メトキシスチレン、p−t−ブチルスチレン、p−n−ブチルスチレン、p−tert−ブチルスチレン、p−クロロスチレン、p−スチレンスルホン酸又はそのアルカリ金属塩(ナトリウム塩、カリウム塩等)が挙げられる。特に好ましくは、スチレン、p−クロロスチレンが良い。
【0109】
本発明の製造方法において、マクロリビング開始剤のセグメントと、共役オレフィン化合物のセグメントが選択的にカップリング反応したのちに二量化することで分子量が2倍になり、対称系のABAで示されるトリブロック共重合体を容易に得ることができる。さらに、ブロック共重合体であるマクロリビング開始剤を用いることで、ABCBAペンタブロック共重合体等も得ることができる。
【0110】
本発明の製造方法は、容易に分子量を2倍にする事ができる上に、更にその工程中に有機ジテルル化合物(2)が定量的に副生することから、有機ジテルル化合物(2)が回収できる。また、得られたブロック共重合体のポリマー末端からテルルを除去する処理を行う必要がないという利点もある。
【実施例】
【0111】
以下、本発明を実施例に基づいて具体的に説明するが、本発明は何らこれらに限定されるものではない。
【0112】
二量化反応は以下の機器を用いた。
【0113】
装置:USHIO Optcal Modulex SX−UI 501HQ型
水銀ランプ:超高圧水銀ランプ500W(BA−H501)
LEDランプ:365nmLEDランプ(1200mW、日亜化学工業社製)
フィルターA:L−39(50%光遮断波長390nm、旭テクノグラス社製)
フィルターB:Y−42(50%光遮断波長420nm、旭テクノグラス社製)
【0114】
数平均分子量(Mn)及び分子量分布(PDI)は、GPC[Shodex GPC−104(カラム:Shodex LF−604x2)、Shodex GPC−101(カラム:Shodex LF804・K−805F・K−800RL)]を用いて、ポリスチレン標準サンプル(東ソーTSK Standard)又はポリメチルメタクリレート標準サンプル(Shodex PMMS Standard)の分子量を基準に求めた。
【0115】
二量化反応のカップリング反応効率(xc)は、GPC分析におけるピーク分割法により求めた。なお、実施例1〜3、8、12、16、比較例1〜3においては、式xc=2*(1−Mn(マクロリビング開始剤)/Mn(生成物))より算出した。
【0116】
GPC分析におけるピーク分割法とは、反応前後のGPCチャートの比較において、ポリマーの濃度を一定にして測定を行うことで反応後の曲線中に反応前の曲線の成分がどれほどあるかを見積もることにより、反応前のポリマー(すなわち、反応しなかったポリマー)が生成物中にどれだけ含まれているかを算出する方法である。
【0117】
具体的には、以下の手順で行うことができる。
【0118】
1.反応前の反応溶液を一定量(Amg)取り、これにBgの溶媒を加えてGPC測定を行う。
【0119】
2.反応後の溶液を一定量(Cmg)取り、これにDgの溶媒を加えてGPC測定を行う。
【0120】
3.それぞれのGPC測定についてRI強度をA/BまたはC/Dで割り算する。
【0121】
図3は、ピーク分割法を説明するためのGPCチャートであり、上記RI強度を換算したピークを示している。(1)が反応前の曲線であり、(2)が反応後の曲線である。
【0122】
4.反応前の曲線(1)に係数Xをかけてピークを縮小し、反応後の曲線(2)に含まれる量を推定する。図3に示す例では、X=0.08(すなわち、残っている量は8%、カップリング効率は92%)である。(3)は反応前の曲線(1)を上記のように係数Xをかけて縮小した曲線である。(4)は反応後の曲線(2)から、曲線(3)の成分を差し引いたものである。(3)の成分を差し引くことにより、曲線(4)はガウス分布の曲線に近い形状になる。
【0123】
<有機テルル化合物の製造>
合成例1(CTA1)
金属テルル〔Aldrich社製、商品名:Tellurium(−40mesh)〕6.38g(50mmol)をTHF 50mLに懸濁させ、これにメチルリチウム 52.9mL(1.04Mジエチルエーテル溶液、55mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(20分間)。この反応溶液に、エチル−2−ブロモ−イソブチレート10.7g(55mmol)を室温で加え、2時間撹拌した。反応終了後、減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(6.53g、収率51%)を得た。
【0124】
1H−NMR、13C−NMR、HRMS、IRより、エチル−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0125】
1H−NMR(300MHz,CDCl3):δ1.27(t,J=6.9Hz,3H),1.74(s,6H),2.15(s,3H,TeCH3),4.16(q,J=7.2Hz,2H); 13C−NMR(75MHz,CDCl3):δ−17.38,13.89,23.42,27.93,60.80,176.75; HRMS(EI)m/z:found 260.0053,calcd for C7H14O2Te[M]+260.0056; IR(neat,cm−1):1700,1466,1385,1296,1146,1111,1028
【0126】
合成例2(CTA2)
金属テルル〔Aldrich社製、商品名:Tellurium(−200mesh)〕2.57g(20mmol)をTHF 15mLに懸濁させ、これにメチルリチウム 15.4mL(1.15Mジエチルエーテル溶液、21.3mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(30分間)。この反応溶液を氷浴で冷却し、(2−トリメチルシロキシエチル)−2−ブロモ−イソブチレート6.0g(21.3mmol)を加えた後、40℃で4.5時間撹拌した。反応終了後、反応溶液を塩化アンモニア水溶液および塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(3.48g、収率50%)を得た。
【0127】
1H−NMR、13C−NMR、HRMS、IRより、(2−トリメチルシロキシエチル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0128】
1H−NMR(400MHz,CDCl3):δ0.14(s,9H),1.75 (s,6H),2.17(s,3H),3.79(t,J=5.2Hz,2H),4.17(t,J=5.2Hz,2H); 13C−NMR(400MHz,CDCl3): δ−17.13,−0.53,23.18,27.97,60.31,66.05,176.92; HRMS(FAB)m/z:found 348.0399,calcd for C10H22O3SiTe[M]+348.0401; IR(neat,cm−1):2957,1717,1466,1252,1152,1105
【0129】
合成例3(CTA3)
CTA2(1.28g、3.7mmol)のメタノール(18mL)溶液に酢酸1.3mL(22.7 mmol)をゆっくりと加え、室温で2時間撹拌した。反応終了後、反応溶液を重炭酸ナトリウム水溶液で洗浄し、無水硫酸ナトリウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(0.71g、収率70%)を得た。
【0130】
1H−NMR、13C−NMR、HRMS、IRより、(2−ヒドロキシエチル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
1H−NMR(400MHz,CDCl3):δ1.76(s,6H),2.16(s,3H),3.84(br,2H),4.26(t,J=4.6Hz,2H); 13C−NMR(CDCl3):δ−16.89,23.63,27.67,61.12,66.42,177.01; HRMS(FAB)m/z:found 276.0005,calcd for C7H14O3Te[M]+276.0005; IR(neat,cm−1):3437 (br),2957,1710,1466,1387,1260,1150,1113,1080,1026
【0131】
合成例4(CTA4)
金属テルル〔Aldrich社製、商品名:Tellurium(−200mesh)〕1.23g(9.5mmol)をTHF 7.5mLに懸濁させ、これにメチルリチウム 7.25mL(1.38Mジエチルエーテル溶液、10mmol)を、室温でゆっくり滴下した(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(40分間)。この反応溶液を氷浴で冷却し、(3−トリメチルシリルプロパルギル)−2−ブロモ−イソブチレート 2.76g(10mmol)を加えた後、室温で2時間撹拌した。反応終了後、反応溶液を塩化アンモニア水溶液および塩化ナトリウム水溶液で洗浄し、無水硫酸マグネシウムで脱水した。減圧下で溶媒を濃縮し、続いて減圧蒸留して、黄色油状物(1.74g、収率54%)を得た。
【0132】
1H−NMRより、(3−トリメチルシリルプロパルギル)−2−メチル−2−メチルテラニル−プロピネートであることを確認した。
【0133】
1H−NMR(400MHz,CDCl3):δ0.18(s,9H),1.76(s,6H),2.18(s,3H),4.70(s,2H)
CTA1〜CTA4の構造式は、以下に示す通りである。
【0134】
【化5】

【0135】
【化6】

【0136】
【化7】

【0137】
【化8】

【0138】
<有機ジテルル化合物の製造>
合成例5(ジメチルジテルリド)
金属テルル(上記と同じ)3.19g(25mmol)をTHF 25mLに懸濁させ、メチルリチウム(上記と同じ)25mL(28.5mmol)を0℃でゆっくり加えた(10分間)。この反応溶液を金属テルルが完全に消失するまで撹拌した(10分間)。この反応溶液に、塩化アンモニウム溶液 20mLを室温で加え、1時間撹拌した。有機層を分離し、水層をジエチルエーテルで3回抽出した。集めた有機層を無水硫酸ナトリウムで乾燥後、減圧濃縮し、黒紫色油状物(2.69g、収率75%)を得た。
【0139】
1H−NMR、MS(HRMS)より、ジメチルジテルリドであることを確認した。
【0140】
1H−NMR(300MHz,CDCl3):δ2.67(s,6H); HRMS(EI)m/z:found289.8593,calcd for C2H6Te2(M)+ 289.8594
【0141】
<マクロリビング開始剤の調製>
合成例6(PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン3.0mL(30mmol)、CTA1 38.7mg(0.15mmol)とジメチルジテルリド42.8mg(0.15mmol)を仕込んだ。この反応溶液を120℃で10時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp1溶液を得た。
【0142】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=1770、PDI=1.15であった。
【0143】
合成例7(PIp2)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン3.0mL(30mmol)、CTA1 8.3mg(0.03mmol)とジメチルジテルリド8.6mg(0.03mmol)を仕込んだ。この反応溶液を120℃で12時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp2溶液を得た。
【0144】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=9680、PDI=1.09であった。
【0145】
合成例8(PIp3)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン2.0mL(20 mmol)、CTA2 18μL(0.067mmol)とジメチルジテルリド6μL(0.067mmol)を仕込んだ。この反応溶液を120℃で8時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp3溶液を得た。
【0146】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=2300、PDI=1.11であった。
【0147】
合成例9(PIp4)
窒素置換したパイレックス(登録商標)ガラス管内で、イソプレン2.3mL(23 mmol)、CTA3 20μL(0.11mmol)とジメチルジテルリド12μL(0.11mmol)を仕込んだ。この反応溶液を120℃で12時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PIp4溶液を得た。
【0148】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3200、PDI=1.09であった。
【0149】
合成例10(PMMA−b−PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート3.0 mL(28mmol)、CTA1 32μL(0.19mmol)とジメチルジテルリド20μL(0.19mmol)、AIBN 6mg(0.037mmol)を仕込んだ。この反応溶液を55℃で9時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりマクロリビング開始剤2.4g(収率86%)を得た。
【0150】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=13700、PDI=1.16であった。
【0151】
窒素置換したパイレックス(登録商標)ガラス管内で、得られたマクロリビング開始剤200mg(0.015mmol)、イソプレン0.6mL(6.0 mmol)とベンゼン0.6mLを仕込んだ。この反応溶液を120℃で8時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA−b−PIp1溶液を得た。
【0152】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=16600、PDI=1.18であった。
【0153】
合成例11(PSt−b−PIp1)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン7.5mL(65mmol)とCTA1 228μL(1.3mmol)を仕込んだ。この反応溶液を110℃で19.5時間撹拌した。反応後、α,α,α−トリフルオロメチルトルエン20mLを加えた。得られた溶液を撹拌しているメタノール700mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりマクロリビング開始剤6.2g(収率92%)を得た。
【0154】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=5900、PDI=1.15であった。
【0155】
窒素置換したパイレックス(登録商標)ガラス管内で、得られたマクロリビング開始剤354mg(0.06mmol)、イソプレン3.0mL(30 mmol)とジメチルジテルリド6.5μL(0.06mmol)を仕込んだ。この反応溶液を120℃で10時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PSt−b−PIp1溶液を得た。
【0156】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=9700、PDI=1.12であった。
【0157】
合成例12(PSt1)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン2.0mL(17.5mmol)、CTA1 96.3mg(0.35mmol)とAIBN 29.0mg(0.175mmol)を仕込んだ。この反応溶液を60℃で13.5時間撹拌した。反応終了後、DMF 4mLを加えた。得られた溶液を撹拌しているメタノール400mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPSt1(1.57g、収率85%)を得た。
【0158】
GPC分析(ポリスチレン標準サンプルの分子量を基準)により、Mn=4700、PDI=1.15であった。
【0159】
合成例13(PSt2)
窒素置換したパイレックス(登録商標)ガラス管内で、スチレン2.13mL(19 mmol)、CTA1 100μL(0.53mmol)、ジメチルジテルリド18μL(0.53 mmol)とACHN 39mg(0.16mmol)を仕込んだ。この反応溶液を80℃で7時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているメタノール400mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPSt2(1.52g、収率79%)を得た。
【0160】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3500、PDI=1.08であった。
【0161】
合成例14(PAN1)
窒素置換したパイレックス(登録商標)ガラス管内で、アクリロニトリル1.23mL(19mmol)、CTA1 100μL(0.53mmol)、ACHN 39mg(0.16mmol)とDMF 4mLを仕込んだ。この反応溶液を60℃で6時間撹拌した。反応後、DMF 4mLを加えた。得られた溶液を撹拌しているメタノール300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPAN1(870mg、収率82%)を得た。
【0162】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=4700、PDI=1.20であった。
【0163】
合成例15(PNVP1)
窒素置換したパイレックス(登録商標)ガラス管内で、N-ビニルピロリドン1.5mL(14.1mmol)、CTA1 120.5mg(0.47mmol)とAIBN 38.0mg(0.23mmol)を仕込んだ。この反応溶液を50℃で3時間撹拌した。反応終了後、クロロホルム5mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPNVP1(1.21g、収率80%)を得た。
【0164】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=2250、PDI=1.10であった。
【0165】
合成例16(PNVP2)
窒素置換したパイレックス(登録商標)ガラス管内で、N-ビニルピロリドン2.1mL(20.0mmol)、CTA1 102.9mg(0.40mmol)とAIBN 32.8mg(0.20mmol)を仕込んだ。この反応溶液を50℃で3時間撹拌した。反応終了後、クロロホルム5mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPNVP2(2.06g、収率89%)を得た。
【0166】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)により、Mn=4440、PDI=1.11であった。
【0167】
合成例17(PMMA1)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクレート2.25g(22.4mmol)、CTA1 103mg(0.37mmol)、ジメチルジテルリド106mg(0.37mmol)とAIBN 17.2mg(0.075mmol)を仕込んだ。この反応溶液を60℃で3.5時間撹拌した。反応終了後、クロロホルムを8mL加えた。得られた溶液を撹拌しているヘキサン350mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA1(1.88g、収率82%)を得た。
【0168】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5700、PDI=1.19であった。
【0169】
合成例18(PMMA2)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.98 mL(19mmol)、CTA1 100μL(0.53mmol)とジメチルジテルリド56μL(0.53mmol)とAIBN 24mg(0.11mmol)を仕込んだ。この反応溶液を60℃で8.5時間撹拌した。反応後、クロロホルム8mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA2(1.72g、収率90%)を得た。
【0170】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=4300、PDI=1.16であった。
【0171】
合成例19(PMMA3)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.07 mL(10mmol)、CTA2 27μL(0.10mmol)とジメチルジテルリド11μL(0.1mmol)を仕込んだ。この反応溶液を80℃で34時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA3溶液を得た。
【0172】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=9500、PD=1.14であった。
【0173】
合成例20(PMMA4)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート0.59 ml(5.5mmol)、CTA4 29μL(0.11mmol)とジメチルジテルリド5.8μL(0.055mmol)を仕込んだ。この反応溶液を80℃で32時間撹拌し、反応溶液を室温まで放冷して重合を停止して、PMMA4溶液を得た。
【0174】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5100、PDI=1.20であった。
【0175】
合成例21(PMMA5)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート0.79 ml(7.4mmol)、CTA1 43μL(0.25mmol)とジメチルジテルリド26μL(0.25mmol)とAIBN 21mg(0.13mmol)を仕込んだ。この反応溶液を60℃で6時間撹拌した。反応後、クロロホルム3mLを加えた。得られた溶液を撹拌しているヘキサン300mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA5(671mg、収率88%)を得た。
【0176】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=3300、PD=1.21であった。
【0177】
合成例22(PMMA6)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート2.2 mL(20.5mmol)、CTA1 120μL(0.68 mmol)とジメチルジテルリド65μL(0.68mmol)とAIBN 23 mg(0.141mmol)を仕込んだ。この反応溶液を60℃で5.2時間撹拌した。反応後、クロロホルム10mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA6(2.1g、収率98%)を得た。
【0178】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=3800、PDI=1.17であった。
【0179】
合成例23(PMMA7)
窒素置換したパイレックス(登録商標)ガラス管内で、メチルメタクリレート1.98 ml(19mmol)、CTA1 70μL(0.37mmol)、ジメチルジテルリド39μL(0.37mmol)とAIBN 17mg(0.074mmol)を仕込んだ。この反応溶液を60℃で4.5時間撹拌した。反応後、クロロホルム8mLを加えた。得られた溶液を撹拌しているヘキサン500mL中に注ぎ、沈殿したポリマーを吸引ろ過、乾燥することによりPMMA7(1.96g、収率89%)を得た。
【0180】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)より、Mn=5100、PDI=1.19であった。
【0181】
<二量化反応>
実施例1
PIp1溶液を調製した容器から取り出すことなく、フィルターAを通して20℃で1時間、光照射を行った。光源は水銀ランプを用いた。
【0182】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=3500、PDI=1.13、xc=0.99であった。
【0183】
実施例2
PIp1溶液を調製した容器から取り出すことなく、20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0184】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=3100、PDI=1.20、xc=0.85であった。また、反応管内部表面に金属テルルが析出していた。
【0185】
実施例3
PIp2溶液を調製した容器から取り出すことなく、フィルターAを通して20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0186】
GPC分析(ポリスチレン標準サンプルの分子量を基準)より、Mn=17200、PDI=1.11、xc=0.87であった。
【0187】
実施例4
PIp3溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0188】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=4450、PDI=1.11、xc=0.93であった。
【0189】
実施例5
PIp4溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0190】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=6400、PDI=1.10、xc=0.96であった
【0191】
実施例6
PMMA−b−PIp1溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0192】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=28900、PDI=1.15、xc=0.88であった。
【0193】
実施例7
PSt−b−PIp1溶液を調整した容器から取り出すことなく、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0194】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=17000、PDI=1.18、xc=0.86であった。
【0195】
実施例8
窒素置換したパイレックス(登録商標)ガラス管内で、PSt1 380mgとベンゼン1mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で11時間、光照射を行った。光源は水銀ランプを用いた。
【0196】
GPC分析(ポリスチレン標準サンプルの分子量を基準)により、Mn=7200、PDI=1.27、xc=0.72であった。
【0197】
実施例9
窒素置換したパイレックス(登録商標)ガラス管内で、PSt2 80mg、イソプレン90μL(0.90mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0198】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=7100、PDI=1.13、xc=0.91であった。
【0199】
実施例10
窒素置換したパイレックス(登録商標)ガラス管内で、PAN1 80mg、イソプレン92μL(0.92mmol)とDMF 1.0mLを仕込んだ。この反応溶液に、フィルターB通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。光源は水銀ランプを用いた。
【0200】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=9700、PDI=1.17、xc=0.89であった。
【0201】
実施例11
窒素置換したパイレックス(登録商標)ガラス管内で、PNVP1 100mg、イソプレン0.22mL(2.2mmol)とDMF0.22mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0202】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5050、PDI=1.12、xc=0.94であった。
【0203】
実施例12
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mg、イソプレン82μL(0.82mmol)とDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0204】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=10100、PDI=1.22、xc=0.87であった。
【0205】
実施例13
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA2 74mg、イソプレン90μL(0.90mmol)とベンゼン0.7mLを仕込んだ。この反応溶液に、20℃で4時間、光照射を行った。光源はLEDランプを用いた。
【0206】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=7200、PDI=1.19、xc=0.80であった。
【0207】
実施例14
PMMA3溶液を調整した反応容器に、イソプレン0.5mL(5.0 mmol)と1,4−ジオキサン1mLを加えた。この反応溶液に、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0208】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=15200、PD=1.21、xc=0.86であった。
【0209】
実施例15
PMMA4溶液を調整した反応容器に、にイソプレン0.09mL(0.9mmol)と1,4−ジオキサン0.2mLを加えた。この反応溶液に、フィルターAを通して室温で2時間、光照射を行った。光源は水銀ランプを用いた。
【0210】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=8700、PDI=1.21、xc=0.86であった。
【0211】
実施例16
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mg、2,3−ジメチル−1,3−ブタジエン93μL(0.82mmol)とDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0212】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=10700、PDI=1.20、xc=0.93であった。
【0213】
実施例17
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、2,3−ジメチル−1,3−ブタジエン102μL(0.10mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0214】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6500、PDI=1.15、xc=0.95であった。
【0215】
実施例18
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、1,3−シクロヘキサジエン34μL(0.36mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で2時間、光照射を行った。光源は水銀ランプを用いた。
【0216】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5300、PDI=1.26、xc=0.77であった。
【0217】
実施例19
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA5 58mg、トランス−2,4−ヘキサジエン−1−オール88mg(0.90mmol)とベンゼン0.4 mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0218】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5000、PDI=1.24、xc=0.63であった。
【0219】
実施例20
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA6 60mg、ソルビン酸エチル134μL(0.90mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0220】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=5200、PDI=1.28、xc=0.62であった。
【0221】
実施例21
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA7 80mg、スチレン186μL(1.62mmol)と1,4−ジオキサン0.5mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で3時間、光照射を行った。光源は水銀ランプを用いた。
【0222】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=10200、PDI=1.24、xc=0.90であった。
【0223】
実施例22
有窒素置換したパイレックス(登録商標)ガラス管内で、PMMA2 60mg、4−ビニルピリジン74μL(0.70mmol)とベンゼン0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で4時間、光照射を行った。光源は水銀ランプを用いた。
【0224】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6400、PD=1.27、xc=0.70であった。
【0225】
比較例1
PIp2溶液を調製した容器から取り出すことなく、この反応溶液を遮光条件下140℃で24時間撹拌し、反応溶液を室温まで放冷して反応を停止した。
【0226】
GPC分析(ポリスチレン標準サンプルの分子量を基準)よりMn=11800、PDI=1.19、xc=0.37であり、分子量が変化していない重合体が主生成物であった。
【0227】
比較例2
窒素置換したパイレックス(登録商標)ガラス管内で、PNVP2 100mgとDMF0.22mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で30分、光照射を行った。光源は水銀ランプを用いた。
【0228】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)から、マクロリビング開始剤と同じ分子量を持ち(Mn=4400、PDI=1.12)、xc=0.00であり、二量化反応が進行していなかった。
【0229】
比較例3
窒素置換したパイレックス(登録商標)ガラス管内で、PMMA1 100mgとDMF0.4mLを仕込んだ。この反応溶液に、フィルターAを通して20℃で1.5時間、光照射を行った。光源は水銀ランプを用いた。
【0230】
GPC分析(ポリメチルメタクリレート標準サンプルの分子量を基準)よりMn=6400、PDI=1.27、xc=0.22であり、分子量が変化していない重合体が主生成物であった。
【0231】
【表1】

【0232】
<GPCチャート>
図1〜2は、実施例1〜3、実施例8、実施例11〜12、実施例16及び比較例1〜比較例3における二量化反応前のマクロリビング開始剤及び二量化反応後のポリマーのGPCチャートを示す図である。
【0233】
図1〜2において、実線は反応後のチャートを示し、破線は反応前のチャートを示している。また、図1〜2において図面左側に近づくにつれて分子量が高くなり、図面右側に近づくにつれて分子量が低くなっている。すなわち、時間の短い方が高分子量であり、時間の長い方が低分子量である。
【0234】
実施例においては、二量化反応後に、ピークがほぼ完全にシフトしており、高効率的かつ選択的に反応が起こっていることがわかる。
【0235】
これに対し、比較例1及び比較例3では、二量化反応後のGPGチャートにおいて、ショルダーのピークが形成されており、かつ二量化反応前のピークと同じ位置に最も大きなピークが存在している。従って、反応効率が低いため、反応前の分子量のものが多く残存していることがわかる。また、比較例2では、二量化反応後においてもピークが変化していなことから、反応が起こっていないことがわかる。
【特許請求の範囲】
【請求項1】
マクロリビング開始剤を調製する工程と、
マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、
前記化合物を添加した後、光照射することにより、前記化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【請求項2】
光照射する工程が、前記化合物を添加した後、加熱してマクロリビング開始剤で前記化合物を重合させ、その後に光照射する工程であることを特徴とする請求項1に記載のポリマーの製造方法。
【請求項3】
共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビング開始剤を調整する工程と、
マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【請求項4】
光照射する工程が、波長300〜700nmの発光分布を有する光源を用いて行われることを特徴とする請求項1〜3のいずれか1項に記載のポリマーの製造方法。
【請求項5】
光照射する工程が、−70℃〜80℃の範囲の温度で光照射することにより行われることを特徴とする請求項1〜4のいずれか1項に記載のポリマーの製造方法。
【請求項6】
マクロリビング開始剤が、有機テルル系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより調製されることを特徴とする請求項1〜5のいずれか1項に記載のポリマーの製造方法。
【請求項7】
有機テルル化合物系重合開始剤が、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物
のいずれかであることを特徴とする請求項6に記載のポリマーの製造方法。
【化1】

(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。R2及びR3は、水素原子又は炭素数1〜8のアルキル基を示す。R4は、炭素数1〜8のアルキル基、アリール基、芳香族ヘテロ環基、アシル基、アミド基、オキシカルボニル基又はシアノ基を示す。)
【化2】

(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。)
【請求項8】
請求項1〜7のいずれか1項に記載の方法で製造されたことを特徴とするポリマー。
【請求項1】
マクロリビング開始剤を調製する工程と、
マクロリビング開始剤に、共役オレフィン化合物を添加する工程と、
前記化合物を添加した後、光照射することにより、前記化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【請求項2】
光照射する工程が、前記化合物を添加した後、加熱してマクロリビング開始剤で前記化合物を重合させ、その後に光照射する工程であることを特徴とする請求項1に記載のポリマーの製造方法。
【請求項3】
共役オレフィン化合物由来の構成単位を重合成長末端とするマクロリビング開始剤を調整する工程と、
マクロリビング開始剤に光照射することにより、共役オレフィン化合物由来の構成単位を重合成長末端とするラジカルを選択的にカップリング反応させて二量化する工程とを備えることを特徴とするポリマーの製造方法。
【請求項4】
光照射する工程が、波長300〜700nmの発光分布を有する光源を用いて行われることを特徴とする請求項1〜3のいずれか1項に記載のポリマーの製造方法。
【請求項5】
光照射する工程が、−70℃〜80℃の範囲の温度で光照射することにより行われることを特徴とする請求項1〜4のいずれか1項に記載のポリマーの製造方法。
【請求項6】
マクロリビング開始剤が、有機テルル系重合開始剤を用いたリビングラジカル重合法でビニルモノマーを重合することにより調製されることを特徴とする請求項1〜5のいずれか1項に記載のポリマーの製造方法。
【請求項7】
有機テルル化合物系重合開始剤が、
(a)一般式(1)で表される有機テルル化合物、
(b)一般式(1)で表される有機テルル化合物とアゾ系重合開始剤の混合物、
(c)一般式(1)で表される有機テルル化合物と一般式(2)で表される有機ジテルル化合物の混合物、又は
(d)一般式(1)で表される有機テルル化合物、アゾ系重合開始剤及び一般式(2)で表される有機ジテルル化合物の混合物
のいずれかであることを特徴とする請求項6に記載のポリマーの製造方法。
【化1】

(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。R2及びR3は、水素原子又は炭素数1〜8のアルキル基を示す。R4は、炭素数1〜8のアルキル基、アリール基、芳香族ヘテロ環基、アシル基、アミド基、オキシカルボニル基又はシアノ基を示す。)
【化2】

(式中、R1は、炭素数1〜8のアルキル基、アリール基又は芳香族ヘテロ環基を示す。)
【請求項8】
請求項1〜7のいずれか1項に記載の方法で製造されたことを特徴とするポリマー。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−236984(P2012−236984A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−97973(P2012−97973)
【出願日】平成24年4月23日(2012.4.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 1.発行者名 川島 信之 2.刊行物名 日本化学会第91春季年会 2011年 講演予稿集III 3.発行年月日 2011年3月11日
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000206901)大塚化学株式会社 (55)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年4月23日(2012.4.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 1.発行者名 川島 信之 2.刊行物名 日本化学会第91春季年会 2011年 講演予稿集III 3.発行年月日 2011年3月11日
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000206901)大塚化学株式会社 (55)
【Fターム(参考)】
[ Back to top ]

