ポリ乳酸の製造方法
【課題】糖類等の食糧と競合することがないカーボンニュートラルな材料を用いることができ、かつ、手続が煩雑な上に高価であり大量製造が困難な光学分割法によらずに、ステレオコンプレックス型ポリ乳酸を製造することができる方法を提供する。
【解決手段】本発明の製造方法は、高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、該ラセミ乳酸ナトリウム水溶液からナトリウムを分離してラセミ乳酸を回収する工程と、該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、該混合物からメソラクチドを分離してラセミラクチドを回収する工程と、サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程とを包含する。
【解決手段】本発明の製造方法は、高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、該ラセミ乳酸ナトリウム水溶液からナトリウムを分離してラセミ乳酸を回収する工程と、該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、該混合物からメソラクチドを分離してラセミラクチドを回収する工程と、サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程とを包含する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、グリセリンからポリ乳酸を製造する方法であって、製造されるポリ乳酸は、ポリ−L−乳酸とポリ−D−乳酸の共晶を形成することによりポリ−L−乳酸やポリ−D−乳酸よりも耐熱性の高い樹脂であることが知られているステレオコンプレックス型ポリ乳酸である、方法に関する。
【背景技術】
【0002】
近年、地球温暖化への懸念から天然の植物を原料としたバイオプラスチックが注目されている。バイオプラスチックの大きな利点は、元来地上にある植物を原料とするため、地上の二酸化炭素の増減に影響を与えないカーボンニュートラルの性質を持っていることである。バイオマス起源の素材を利用することで植物が大気中の二酸化炭素を固定して生成した物質を使ってつくるプラスチックであるため、それを燃焼廃棄しても二酸化炭素の収支はゼロとなり地球温暖化対策になるといわれている。
【0003】
ポリ乳酸は乳酸がエステル結合によって重合された高分子であり、植物起源の素材から合成できるバイオプラスチックの一つである。ブドウ糖(グルコース)・砂糖(スクロース)などに乳酸菌を作用させると、その発酵作用により乳酸が得られる。原料となる糖類はジャガイモやトウモロコシなどから得られるデンプンに酵素(アミラーゼなど)を作用させる、あるいはサトウキビなどから抽出することにより大量に得られる。「カーボンニュートラル」の観点から、近年、ポリ乳酸の需要が増加している。
【0004】
しかしながら、ポリ乳酸の原料であるトウモロコシやサトウキビは食糧としても利用されるため、食糧との競合が問題視されている。
【0005】
乳酸は1つの不斉炭素を持ち、L体とD体の2種が存在する。L体のみを重合させたものはポリ-L-乳酸、D体のみを重合させたものはポリ-D-乳酸と呼ばれる。これらはその立体配置により、互いに逆回りのらせん構造をとることが知られており、その融点は約175℃といわれている。
【0006】
これに対して、ポリ−L−乳酸とポリ−D−乳酸を混合したものは、ポリ−L−乳酸とポリ−D−乳酸の共晶を形成することにより、ポリ−L−乳酸やポリ−D−乳酸よりも耐熱性の高い樹脂となることが知られている。これをステレオコンプレックス型ポリ乳酸(SC−PLA)と呼んでおり、その融点は約225℃といわれている。
【0007】
一方、L−乳酸とD−乳酸が混合した状態から直接重合すると、一本の乳酸ポリマーの中にL−乳酸とD−乳酸が混ざったランダムな重合体、いわゆる、ポリ−DL−乳酸になる。これは、結晶性を示さず、50℃程度のガラス転移点で軟化するため実用的でない。
【0008】
従来、ステレオコンプレックス型ポリ乳酸を製造するためには、ポリ-L-乳酸とポリ-D-乳酸を別々に製造して混合する作業が必要であり効率が悪かった。乳酸菌のうち、L−乳酸生産株であるStc. Thermophilus等を作用させると糖類は主にL−乳酸に転換される。一方、乳酸菌のうち、高純度D−乳酸生産株であるLeus. Mesenteroides等を作用させると、糖類は主にD−乳酸に転換される。このように、L−乳酸とD−乳酸を製造するためには、それぞれ、別々の菌体を使用して、別々に発酵製造する必要があり効率が悪かった。
【0009】
他の乳酸の製造方法として、酵素の存在下でアセトアルデヒドからシアノヒドリンを生成させ、これを酸加水分解することにより製造する方法(非特許文献1参照)または、アセトアルデヒドと青酸からシアノヒドリンを生成させ、これを塩酸の存在下等にエステル化する方法が知られている。このような方法によると、L−乳酸とD−乳酸が等量混合したラセミ乳酸が製造される。
【0010】
しかしながら、ラセミ乳酸をそのまま重合すると、一本の乳酸ポリマーの中にL−乳酸とD−乳酸が混ざったポリ−DL−乳酸となるだけで、ステレオコンプレックス型のポリ乳酸を製造することはできない。ラセミ乳酸からステレオコンプレックス型ポリ乳酸を製造するためには、一旦、L乳酸とD乳酸を光学分割法により分離する必要がある。ラセミ乳酸の光学分割法は、結晶化法やクロマトグラフィーによる分離が知られているが、これらの方法はいずれも、煩雑な手順が必要な上に高価であり、また大量の化合物を分割するのは難しいという欠点があった。
【0011】
また、アセトアルデヒドはほとんど石油原料から作られているため、この方法で製造された乳酸から重合したポリ乳酸はバイオプラスチックと呼ぶことはできない。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Chem. Commun., 2001, p1800
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、上記事情に鑑みてなされたものであり、糖類等の食糧と競合することがないカーボンニュートラルな材料を用いることができ、かつ、手続が煩雑な上に高価であり大量製造が困難な光学分割法によらずに、ステレオコンプレックス型ポリ乳酸を製造することができる方法を提供することを目的とする。
【課題を解決するための手段】
【0014】
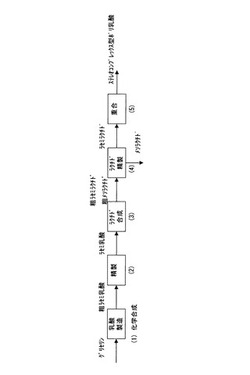
図1に本発明によるグリセリンからステレオコンプレックス型ポリ乳酸を製造するプロセスを示す。
【0015】
上記課題を解決するため、本発明は、ステレオコンプレックス型のポリ乳酸を製造する方法であって、
(1)高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、
(2)該ラセミ乳酸ナトリウム水溶液からラセミ乳酸を回収する工程と、
(3)該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、
(4)該混合物においてラセミラクチドをメソラクチドから分離する工程と、
(5)サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程と
を包含することを特徴とする。
【0016】
好ましくは、前記工程(1)は、グリセリンと水酸化ナトリウムを水に溶かして水溶液とし、これを250〜350℃の範囲の温度および5〜15MPaの範囲の圧力の高温高圧の条件下に保持することにより行われる。
【0017】
好ましくは、前記工程(2)は、ラセミ乳酸ナトリウム水溶液を酸性とし、これを有機溶媒と接触させることによりラセミ乳酸を有機溶媒に抽出し、続いて、有機溶媒を蒸発させることによりラセミ乳酸を回収することにより行われる。
【0018】
工程(2)において、好ましくは、前記有機溶媒は、プロパノール、ブタノール、酢酸メチル、トリエチルアミンおよびメチルエチルケトンからなる群から選択される1種である。
【0019】
好ましくは、前記工程(3)は、ラセミ乳酸の脱水縮合により乳酸のオリゴマーを前駆体として生じさせ、続いて、これを解重合・環化することによってメソラクチドおよびラセミラクチドのラクチド混合物を生成させ、これを蒸気として反応系外に取り出すことにより行われる。
【0020】
工程(3)において、前記オリゴマー前駆体を生じさせるための条件は、好ましくは、温度100〜200℃、圧力10〜80kPaである。
【0021】
工程(3)において、前記ラクチドを生成させるための条件は、好ましくは、温度150〜250℃、圧力0.5〜5kPaである。
【0022】
好ましくは、前記工程(4)は、融点118℃のラセミラクチドと融点約60℃のメソラクチドの融点差を利用する溶融晶析法により行われる。
【0023】
好ましくは、前記工程(5)は、一般式:
【0024】
【化1】

【0025】
で表されるサレン型金属錯体を触媒として利用することにより行われる。
【0026】
R1、R2は水素、炭素数1〜6のアルキル基、炭素数1〜6のアルコキシ基、塩素、臭素、フッ素等のハロゲン基、シリル基、核炭素数6〜18のアリール基、またはメトキシメチル基を表す。R3は炭素数2〜6の二価の脂肪族炭化水素基を表す。MはAl、Fe、TiまたはYを表す。
【0027】
また、本発明は、上記のいずれか1つに記載の方法により製造される、グリセリンから合成されたステレオコンプレックス型ポリ乳酸である。
【0028】
ここで比較のため、従来の発酵乳酸からステレオコンプレックス型ポリ乳酸を製造するプロセスを図2に示す。発酵法によると、ポリ-L-乳酸とポリ-D-乳酸を別々に製造した後、これらを混合してステレオコンプレックス型ポリ乳酸を製造する。(1)、(6)では、それぞれ、別種の微生物を用いてL-乳酸またはD-乳酸を製造する。(2)、(7)では発酵に用いた糖類、培地、pH調整用のアルカリ物質および水などを分離して乳酸を精製する。(3)、(8)ではL-ラクチドまたはD-ラクチドを製造する。(4)、(9)ではラクチド中の乳酸や直鎖2量体および水分などの不純物を除去する。(5)、(10)では、ラクチドからポリL乳酸またはポリD乳酸を製造する。(11)ではポリ-L-乳酸とポリ-D-乳酸を混合してステレオコンプレックス型ポリ乳酸を製造する。図2に示される従来の方法は、図1に示す本発明の方法に比べて多くの工程が必要であることが分かる。
【0029】
図3に石油合成乳酸からステレオコンプレックス型ポリ乳酸を製造するプロセスを示す。本方法では、L-乳酸とD-乳酸を同時に当量製造することができるが、途中で光学分割法によってL-乳酸とD-乳酸を分離する工程が要求される。(1)では石油を原料として乳酸を製造する。ここで製造される乳酸はL-乳酸とD-乳酸が当量混合したラセミ乳酸である。(2)ではラセミ乳酸中の不純物(未反応の原料など)を除去する。(3)では、ラセミ乳酸をL-乳酸とD-乳酸に分離する。ラセミ乳酸の光学分割法は、結晶化法やクロマトグラフィーによる分離が知られている。(4)、(7)ではL-ラクチドまたはD-ラクチドを別々に製造する。(5)、(8)ではラクチド中の乳酸や直鎖2量体および水分などの不純物を除去する。(6)、(9)ではラクチドからポリL乳酸またはポリD乳酸を製造する。(10)ではポリ-L-乳酸とポリ-D-乳酸を混合してステレオコンプレックス型ポリ乳酸を製造する。図3に示される従来の方法は、図1に示す本発明の方法に比べて多くの工程が必要であることが分かる。
【発明の効果】
【0030】
本発明の請求項1に規定する工程(1)〜(5)を行うことにより以下の種々の効果を得ることができる。
【0031】
(1)従来のポリ乳酸の原料は食糧であるトウモロコシやイモ類であったが、本発明で製造されるポリ乳酸の原料は工業的な副産物であるグリセリンであるため、食糧との競合を避けることができる。油脂産業における副産物であるグリセリンを、乳酸製造のための原料としているので、乳酸を安価にかつ大量にプラスチック産業へ供給することによって、ポリ乳酸の普及を推進することができ、ひいては循環型社会の形成に貢献することができることが期待される。
【0032】
(2)本発明では、スレレオコンプレックス型ポリ乳酸を製造する際、L−乳酸とD−乳酸あるいはLラクチドとDラクチドをいわゆる光学分割法によって分離する工程を含まない。光学分割操作は、操作が非常に煩雑でまたコストがかかるため、産業的には、高価な食糧品(アミノ酸など)や医薬品の分野で主に利用されている。このため、光学分割操作を含むことなく、ステレオコンプレックス型ポリ乳酸を製造できることは、産業的に大きなメリットがある。したがって、本発明では、従来の方法では、安価にかつ大量に供給することができなかった、熱的安定性に優れたステレオコンプレックス型ポリ乳酸を工業的に供給することが可能である。
【0033】
(3)本発明で製造されるポリ乳酸は、動植物油脂由来のバイオマスプラスチックであるため、カーボンニュートラルの観点から地球温暖化への対策に貢献できると期待される。
【図面の簡単な説明】
【0034】
【図1】グリセリンからステレオコンプレックス型ポリ乳酸を製造する本発明のプロセスを示す図である。
【図2】発酵乳酸からステレオコンプレックス型ポリ乳酸を製造する従来のプロセスを示す図である。
【図3】石油合成乳酸からステレオコンプレックス型ポリ乳酸を製造する従来のプロセスを示す図である。
【図4】本発明のステレオコンプレックス型ポリ乳酸の製造方法を説明するフローシートである。
【図5】ステレオコンプレックス型ポリ乳酸の重合原理を示す図である。
【図6】乳酸製造工程において用いられる乳酸製造装置のフロー図である。
【図7】ラクチド製造工程において用いられるラクチド製造装置を示す図である。
【図8】ラクチド精製工程において用いられるラクチド精製装置を示す図である。
【図9】グリセリンから合成したステレオコンプレックス型ポリ乳酸のX線回折スペクトルを示す図である。
【図10】実施例5aで得られたポリ乳酸のメチン基域の1H−NMRスペクトル図である。
【図11】比較例1で得られたポリ乳酸のメチン基域の1H−NMRスペクトル図である。
【発明を実施するための形態】
【0035】
以下、本発明のステレオコンプレックス型ポリ乳酸の製造方法について詳細に説明する。
【0036】
図4は、本発明のステレオコンプレックス型ポリ乳酸の製造方法を説明するフローシートである。
【0037】
本発明の製造方法では、原料としてグリセリンが用いられる。
【0038】
グリセリンは産業的に、石鹸や高級脂肪酸あるいはバイオディーゼル燃料の副産物として生産されている。石鹸や高級脂肪酸、バイオディーゼル燃料は、動植物油脂を原料として生産されているが、油脂はグリセリンと脂肪酸から構成されているため、その生産過程では必ず副産物としてグリセリンが産出される。石鹸や高級脂肪酸あるいはディーゼル燃料は、日常生活には欠かせないものであり、その生産量は年々増加している。したがって、その副産物であるグリセリンの生産量も増加しており、近年、その有効利用方法が求められており、本発明は、そのような社会的要請に沿っている。
【0039】
(乳酸製造工程)
乳酸製造工程(1)は、アルカリと高温高圧水の作用によってグリセリンを乳酸に転換する工程である。
【0040】
原料であるグリセリンと水酸化ナトリウムなどのアルカリ性物質を水に混合して水溶液として、これを、250〜350℃の範囲、例えば300℃の温度および5〜15MPaの範囲、例えば10MPaの圧力の高温高圧の条件下に10〜200分間の期間、例えば60分間にわたって保持することにより、70%以上の収率でグリセリンを乳酸に転換することができる。
【0041】
反応の化学量論式は式(1)のように表すことができる。
【0042】
【化2】

【0043】
式(1)から分かるように副産物として水素ガスが発生する。ここで合成される乳酸はラセミ乳酸である。
【0044】
(乳酸精製工程)
乳酸精製工程(2)は、工程(1)で得られた乳酸ナトリウム水溶液から、ナトリウムと水を分離して純粋な乳酸を取り出す工程である。
【0045】
乳酸の精製には、(i)抽出法、(ii)エステル化法、(iii)電気透析法などいくつかの方法を利用することができるが、ここでは溶媒抽出法について具体的に説明する。
【0046】
溶媒抽出法では、例えば、プロパノールやブタノールなどのアルコール系、酢酸メチルなどのエステル系、トリエチルアミンなどのアミン系、メチルエチルケトンなどのケトン系を使用することができる。乳酸ナトリウム水溶液から有機溶媒によって、乳酸を抽出するためには、まず、乳酸ナトリウム水溶液の酸性化が必要である。乳酸ナトリウム水溶液中で、乳酸はほとんど乳酸イオン(CH3−CH(OH)−COO−)として存在するが、水溶液のpHを2.0以下に下げることによって乳酸は乳酸(CH3−CH(OH)−COOH)として存在することになる。これにより、乳酸は有機溶媒に抽出されやすくなる。
【0047】
硫酸などの酸により酸性化した乳酸ナトリウム水溶液を、先述の有機溶媒と接触させることによって、大部分の乳酸は有機溶媒中に移行する。このとき、ほとんどのナトリウムイオンは、硫酸イオンと塩をなすカウンターカチオンの状態で水中に残留する。乳酸が抽出された溶媒相を水相から分離して、さらに蒸留法により、溶媒を揮発させることによって、ナトリウムと分離された乳酸を得ることができる。
【0048】
(ラクチド製造工程)
ラクチド製造工程(3)はラセミ乳酸からラクチドを合成する工程である。本工程により得られるラクチドは、ラセミラクチドとメソラクチドの混合物である。
【0049】
ラクチドとは、2分子の乳酸において、互いのヒドロキシル基とカルボキシル基が脱水縮合してできた環状化合物を指す。Lラクチドとは、2分子のL−乳酸が脱水縮合してできた環状化合物をさす。Dラクチドとは、2分子のD−乳酸が脱水縮合してできた環状化合物をさす。
【0050】
メソラクチドとは、1分子のL−乳酸と1分子のD−乳酸が脱水縮合してできた環状化合物をさす。
【0051】
ラセミラクチドとは、LラクチドとDラクチドの等量混合物、即ち、光学純度0%のラクチドをさす。
【0052】
乳酸からその環状2量体であるラクチドを合成する方法は各種報告されているが、オリゴマーと呼ばれるプレポリマーを合成してから、分子内エステル交換反応により環化して合成する方法が一般的である。この方法は、Kulkarin(R. K. Kulkarin, Arch. Uurg., 93. 839 (1966))により報告されている。本発明においてオリゴマーとは乳酸分子が2〜30個程度からなる乳酸ポリマーを指す。
【0053】
ラセミ乳酸からラクチドを合成すると、Lラクチド、Dラクチド、メソラクチドの3種の異性体が生成する。それぞれの存在比は、確率的には25:25:50であるが、ラクチドを合成する条件によってある程度変化する。しかし、LラクチドとDラクチドの重量比は必ず1:1になる。
【0054】
100kPa以下の減圧下で200℃に加熱することによって、乳酸は脱水縮合されて、10〜20量体のオリゴマーを生成することができる。乳酸縮合の化学量論式は下記式(2)のように表すことができる。
【0055】
【化3】

【0056】
オリゴマーとラクチドは次式(3)のような平衡関係にある。
【0057】
【化4】

【0058】
ラクチドの蒸気圧は、オリゴマーの蒸気圧より高いため、減圧加熱(210℃、2kPa)することで、ラクチドを反応蒸発させて系外に取り出すことができる。ラクチドが系外に出されることにより、式の平衡はラクチドが生成する方向に進行する。これを繰り返すことで、大部分のオリゴマーをラクチドに転換することができる。
【0059】
(ラクチド精製工程)
ラクチド精製工程(4)は、ラセミラクチドとメソラクチドの混合物からメソラクチドを除去する工程である。
【0060】
LラクチドとDラクチドの立体構造以外の物理的性状は全く同じであるが、LラクチドとDラクチドの混合体であるラセミラクチドとメソラクチドの物理的性状(沸点や融点や溶媒への溶解度など)は若干異なる。この物理的性状の差を利用してラセミラクチドとメソラクチドを分離することができる。例えば、溶媒からの晶析法、溶融晶析法あるいは蒸留法などである。
【0061】
溶融晶析法では、ラセミラクチドの融点が約118℃であるのに対して、メソラクチドの融点が約60℃であるので、これらの融点の差を利用して分離することができる。
【0062】
ラセミラクチドとメソラクチドの混合物をそれぞれの融点である60℃と118℃との間である65℃に加熱すると、混合物は液体相と固体相に分離する。液体相には液体状態のラセミラクチドとメソラクチドが存在するが、その存在比はメソラクチドの方が多い。
【0063】
一方、固体相にも固体状態のラセミラクチドとメソラクチドが存在するが、その存在比はラセミラクチドの方が多くなる。
【0064】
固体相のみを取り出し、これを65℃と118℃の間の75℃に加熱すると、再び、液体相と固体相に分離する。固体相中のラセミラクチドの組成は、先ほどよりも多くなっている。このような操作を繰り返すことで、純度の高いラセミラクチドを得ることができる。
【0065】
(ポリ乳酸製造工程)
ポリ乳酸製造工程(5)は、ラセミラクチドを重合することによってステレオコンプレックス型ポリ乳酸を製造する工程である。
【0066】
特定の置換基を有するサレン型配位子をもつアルミニウム錯体を触媒に用いることで、ラセミラクチドを立体選択的に開環重合させることができる。
【0067】
図5にその反応の原理を示す。まず、開始反応においては、触媒としてのアルミニウム錯体がDラクチドまたはLラクチドと反応して、それぞれのラクチド由来の不斉を有する複合体となる。次に、成長反応においては、次々とモノマーが反応してポリマーが成長するが、反応するモノマーはポリマー成長端に位置するモノマー由来の不斉によって立体的に選択されつつ反応していく。すなわち、ポリマー成長端が、例えばDラクチド由来である場合には、次に反応するモノマーもこれと同じDラクチドが立体選択されて反応していく。つまり、開始反応でアルミニウム錯体とDラクチドが反応すると成長反応でもラクチド中のDラクチドが次々と反応してポリD−乳酸を生成する。同様にして、反応開始反応でアルミニウム錯体とLラクチドが反応すると成長反応でもラセミラクチド中のLラクチドが次々と反応してポリL−乳酸を生成する。このようにして、ラセミラクチドを原料として、ポリD−乳酸とポリL−乳酸が同時に合成されるため、ステレオコンプレックス型のポリ乳酸を合成することができる。
【0068】
次に、本発明の実施例およびこれとの比較を示すための比較例により、本発明をより具体的に説明する。
【0069】
(実施例1:乳酸製造工程)
(操作手順)
図6に本発明に関わる乳酸製造装置のフローを示す。
【0070】
原料貯蔵槽(11)では、グリセリンと水酸化ナトリウムと水を混合して所定濃度のグリセリン水溶液を調合する。水酸化ナトリウムの量はグリセリンと等モルかそれ以上であることが望ましい。
【0071】
定量ポンプ(12)では、グリセリン水溶液を所定圧力に昇圧し、所定の流量で反応装置に送液する。送液量は20L/時である。圧力は、反応温度によって調節するが、概ね6〜20MPaである。
【0072】
予熱器(13)では、グリセリン水溶液を所定温度まで昇温する。反応温度は250〜350℃である。反応温度が低いと反応速度が遅くなり、また、反応温度が高いと生成した乳酸が分解する。このため、概ね280〜320℃が望ましい。ここでは、電気ヒータにより加熱をしているが、熱媒や水蒸気、その他の熱源を利用しても良い。
【0073】
反応塔(14)では、グリセリンが反応して乳酸と水素ガスに転換する。このため、反応器(14)出口の流体は乳酸ナトリウム水溶液と水素ガスの2相流体となる。反応器(14)の容積は20Lであり、滞留時間は1時間である。定量ポンプの送液量を調節することで、滞留時間は10〜200分に変化させることができる。
【0074】
冷却塔(15)では、乳酸ナトリウム水溶液と水素ガスの2相流体の温度を100℃以下に冷却する。ここでは、水により冷却しているが、予熱器との熱交換により冷却しても良い。
【0075】
圧力調節弁(16)では、乳酸ナトリウム水溶液と水素ガスの2相流体の圧力を大気圧に減圧する。
【0076】
気液分離器(17)では、乳酸ナトリウム水溶液と水素ガスの2相流体を水素ガスと乳酸ナトリウム水溶液に分離する。ここでは、サイクロンにより気液分離をしている。
【0077】
(結果)
表1に乳酸製造の結果をまとめる。
【0078】
実施例1aでは、グリセリン濃度300g/L、水酸化ナトリウム濃度130g/Lの水溶液を原料として、温度300℃、圧力10MPa、時間1時間の条件で乳酸製造を行った。反応液中の乳酸濃度は220g/L、未反応グリセリン濃度50g/Lであり、ガス発生量はグリセリン1gあたり、210mL/g−グリセリンであった。ガス組成は97vol%が水素であった。旋光計により乳酸水溶液の光学純度を測定したところ光学純度0%であり、得られた乳酸はラセミ体であることが分かった。
【0079】
実施例1bでは、温度を280℃に下げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が150g/Lと低くなった。この原因は、反応温度を下げることでグリセリンの反応速度が遅くなったからであると考えられる。
【0080】
実施例1cでは、温度を320℃に上げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が180g/Lと低くなった。この原因は、反応温度を上げることで生成した乳酸が分解したからであると考えられる。
【0081】
実施例1dでは、水酸化ナトリウム濃度を50g/Lに下げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が80g/Lと低くなった。この原因は、水酸化ナトリウム濃度を下げることで、グリセリンが反応しなくなったからであると考えられる。下記式(1)に示すように、水酸化ナトリウムはグリセリンと等モル以上加えることが必要だと考えられる。
【0082】
【化5】

【0083】
実施例1eでは、水酸化ナトリウム濃度を150g/Lに上げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が175g/Lと低くなった。この原因は、水酸化ナトリウム濃度を上げることで、生成した乳酸が分解しやすくなったからであると考えられる。
【0084】
【表1】

【0085】
(実施例2:乳酸精製工程)
(操作手順)
乳酸精製工程(2)は、工程(1)で得られた乳酸ナトリウム水溶液から、ナトリウムと水を分離して乳酸のみを取り出す工程である。表2に乳酸精製時の条件を示す。また、以下に操作手順を示す。
【0086】
(1)実施例1aで得られた乳酸ナトリウム水溶液を硫酸でpH1.0に調節する。
【0087】
(2)容積3Lの分液ロートに(1)で調節した乳酸ナトリウム水溶液1000gと有機溶媒800gを加えよく混合する。
【0088】
(3)水相と有機相に分離するまで、約40℃の恒温槽内で静置する。
【0089】
(4)水相と有機相を分離する。有機相には大部分の乳酸と若干の水が含まれるが硫酸ナトリウムはほとんど含まれていない。一方、水相には、大部分の硫酸ナトリウムが含まれており、若干の乳酸と有機溶媒も含まれている。
【0090】
(5)エバポレーターにより、有機相から有機溶媒と水を蒸発させて回収する。(4)で回収した有機相を40℃、7kPaの条件化で約5時間保持することで、水と有機溶媒が蒸発して乳酸のみ回収することができる。
【0091】
【表2】

【0092】
(結果)
表3に乳酸精製の結果をまとめる。
【0093】
実施例2aでは、抽出溶媒に酢酸メチルを使用した。抽出後の有機相の全重量は810gであり、その中に含まれる乳酸の重量は66gであった。また、有機相に含まれる硫酸ナトリウムの量は0.6gであり、大部分のナトリウム分を除去することができた。有機相には、乳酸以外に、水、グリセリン、その他の不純物が含まれていた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は70gであり、その中に含まれる乳酸の重量は63gであった。蒸留により、有機相から溶媒と水を蒸発させて、乳酸を分離回収することができた。以上の操作によって、乳酸ナトリウム水溶液から乳酸を回収することができた。
【0094】
実施例2bでは、抽出溶媒にプロパノールを使用した。抽出後の有機相の全重量は1320gであり、その中に含まれる乳酸の重量は132gであった。また、有機相に含まれる硫酸ナトリウムの量は7.3gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は140gであり、その中に含まれる乳酸の重量は128gであった。実施例2aと比べると回収された乳酸量は多いが、乳酸に含まれる硫酸ナトリウムの量も多い。また、有機相に多量の水が溶け込むため、その蒸発にエネルギーが必要であるため、実施例2aより不利である。
【0095】
実施例2cでは、抽出溶媒にブタノールを使用した。抽出後の有機相の全重量は930gであり、その中に含まれる乳酸の重量は60gであった。また、有機相に含まれる硫酸ナトリウムの量は3.0gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は60gであり、その中に含まれる乳酸の重量は55gであった。
【0096】
実施例2dでは、抽出溶媒にトリエチルアミンを使用した。抽出後の有機相の全重量は630gであり、その中に含まれる乳酸の重量は104gであった。また、有機相に含まれる硫酸ナトリウムの量は0.07gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液は70gであり、その中に含まれる乳酸の重量は50gであった。乳酸に含まれる硫酸ナトリウムは、実施例2aよりも少ないが、溶媒の蒸発工程で乳酸のロスが多い。
【0097】
実施例2eでは、抽出溶媒にメチルエチルケトンを使用した。抽出後の有機相の全重量は950gであり、その中に含まれる乳酸の重量は80gであった。また、有機相に含まれる硫酸ナトリウムの量は1.6gであり、大部分のナトリウム分を除去できた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は85gであり、その中に含まれる乳酸の重量は78gであった。実施例2aよりも乳酸の収率は大きいが、乳酸中に含まれる硫酸ナトリウムの量が多い。
【0098】
【表3】

【0099】
(実施例3:ラクチド合成工程)
(装置)
図7に本工程に用いられるラクチド製造装置を示す。
【0100】
フラスコ(21)は容量200mLのナス型フラスコであり、ここに原料である乳酸と触媒であるオクチル酸スズを供給する。フラスコ(21)には温度計T1が備えてあり、加熱中の試料温度を測定することができる。また、フラスコ(21)内には攪拌子(22)が入っておりスターラー(23)により加熱中に試料を良く攪拌することができる。フラスコ(21)の加熱および温度制御はオイルバス(24)によって行う。また、フラスコ(21)には真空ポンプ(25)がつながっており、所定の圧力に減圧することができる。
【0101】
乳酸を減圧下で加熱することで、乳酸が脱水縮合された縮合水が蒸発する。乳酸自体はオリゴマーに転換される。生成したオリゴマーを更に減圧し加熱することで、オリゴマーからラクチドが生じて、ラクチドが蒸発する。
【0102】
温度計T2は、フラスコ(21)の出口温度を測定する。
【0103】
冷却器(26)は、水冷式または空冷式のガラス管であり、蒸発した水蒸気あるいはラクチド蒸気を凝縮し液体状態にする。
【0104】
受器(27)は、目盛付きのガラス製容器であり発生した縮合水量またはラクチド量を計測することができる。
【0105】
真空トラップ(28)は、受器で回収できなかった水蒸気や乳酸蒸気を回収する。ドライアイスにより−79℃に冷却している。
【0106】
(操作手順)
・オリゴマーの合成
(1)実施例2aで得られた乳酸150gおよび触媒としてオクチル酸スズ0.75gを200mLのナス型フラスコ(21)に入れる。
【0107】
(2)オイルバス(24)を130℃に設定して、真空ポンプ(25)によりフラスコ(21)内を80kPaに減圧する。
【0108】
(3)乳酸の縮合により縮合水の蒸発が始まると、オイルバス(24)の温度を徐々に上げていき、また、真空ポンプ(25)により圧力を10kPaまで徐々に下げていく。
【0109】
(4)蒸発した縮合水は、冷却器(26)によって冷却、凝縮され受器(27)に回収される。
【0110】
(5)約4時間後、脱水量が27gに達した時点で、オリゴマー合成反応を終える。
【0111】
・ラクチドの合成
(1)オイルバス(24)の温度を210℃に設定して、真空ポンプ(25)によりフラスコ内を2kPaに減圧する。
【0112】
(2)オリゴマーからラクチドが生成して、ラクチドの蒸発が始まる。
【0113】
(3)蒸発したラクチドは冷却器(26)で冷却、凝縮されて受器(27)に回収される。
【0114】
(4)1.5時間後、オリゴマーが70g回収された時点で、ラクチド合成反応を終える。
【0115】
(結果)
表4にラクチド合成時の条件を、表5にラクチド合成工程の結果をまとめる。
【0116】
【表4】

【0117】
【表5】

【0118】
実施例3aでは、原料に実施例2aで製造した乳酸を150g使用した。触媒として、オクチル酸スズを0.75g使用した。オリゴマーの合成条件は温度130〜200℃、圧力80〜10kPa、時間4時間である。ラクチド合成条件は温度210℃、圧力2kPa、反応時間1.5時間である。オリゴマー合成工程では、回収された縮合水量は27gであった。ゲル浸透クロマトグラフ分析装置(GPC)により、得られたオリゴマーの数平均分子量を測定した結果、1600であった。また、ラクチド合成実験により回収されたラクチドの全量は76gであった。核磁気共鳴分析法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチドを34g含み、メソラクチドを27g含むことが分かった。回収されたラクチドはその他の不純物として水や乳酸、直鎖乳酸2量体などを含んでいた。
【0119】
実施例3bでは、オリゴマーの合成条件を、200℃の一定温度、80kPaの一定圧力、反応時間6時間とした。それ以外の条件は実施例3aと同様である。ゲル浸透クロマトグラフ分析装置(GPC)により、得られたオリゴマーの数平均分子量を測定した結果、1000であり、実施例3aで得られたオリゴマーより小さいことが分かった。また、ラクチド合成実験により回収されたラクチドの全量は60gであり、実施例3aで得られたラクチドより少なかった。核磁気共鳴分析法(1H−NMR)により回収されたラクチドの組成を分析した結果、水や乳酸、直鎖乳酸2量体など不純物を21g含んでおり、不純物量は実施例3aで得られたラクチドより多かった。
【0120】
実施例3cでは、ラクチドの合成条件を圧力10kPaとした。それ以外の条件は実施例3aと同様である。ラクチド合成実験により回収されたラクチドの全量は45gであり、実施例3aで得られたラクチドより少なかった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、水や乳酸、直鎖乳酸2量体など不純物を21g含んでおり、不純物量は実施例3aで得られたラクチドより多かった。
【0121】
(実施例4:ラクチド精製工程)
(操作手順)
図8に本ラクチド精製工程において用いられるラクチド精製装置を示す。表6にラクチド精製工程の条件と結果を示す。以下に操作手順を示す。
【0122】
(1)原料として実施例3aで得られたラクチドを使用する。使用した原料ラクチドは、表6に示すように、ラセミラクチドとメソラクチドの混合物である。また、不純物として乳酸や直鎖乳酸2量体を含む。
【0123】
(2)原料ラクチド100gを容量200mLのガラス製ビーカ(31)に入れる。
【0124】
(3)ビーカ(31)をオイルバス(32)に浸して、ラクチドを130℃に昇温して原料を全て溶融する。ラクチド温度は温度計Tで測定する。また、昇温中ラクチドはスターラ(33)により攪拌子(34)を回転させてよく攪拌する。
【0125】
(4)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を65℃に設定し、約1時間放置する。
【0126】
(5)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0127】
(6)プロパノールで洗浄したラクチドを再び130℃に加熱して全て溶融する。
【0128】
(7)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を75℃に設定し、約1時間放置する。
【0129】
(8)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0130】
(9)プロパノールで洗浄したラクチドを再び130℃に加熱して全て溶融する。
【0131】
(10)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を95℃に設定し、約1時間放置する。
【0132】
(11)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0133】
(結果)
表6に条件と結果を示す。
【0134】
【表6】

【0135】
精製に使用したラクチドは実施例3aで合成したもので、その組成はラセミラクチド45重量%、メソラクチド30重量%、その他(水、乳酸、直鎖乳酸2量体など)20重量%である。
【0136】
原料ラクチドを130℃で完全に溶融した後、65℃に冷却して約1時間放置し、これをプロパノールで洗浄した。1回目の溶融晶析操作で回収されたラクチドは65gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチド41g、メソラクチド24g含んでいた。水や乳酸その他の直鎖乳酸2量体などはほとんど含まれていなかった。
【0137】
このラクチドを75℃で2回目の溶融晶析操作を行った結果で回収されたラクチドは35gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチド33g、メソラクチド24g含んでいた。
【0138】
このラクチドを95℃で3回目の溶融晶析操作を行った結果で回収されたラクチドは25gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチドを25g含んでおり、メソラクチドはほとんど含んでいなかった。
【0139】
(実施例5:ステレオコンプレックス型ポリ乳酸の重合工程)
実施例5aでは、実施例4で精製したラセミラクチドを原料として使用し、また、下記のC1、C2およびC3に示される構造のサレン型アルミニウム錯体を触媒として使用した。
【0140】
【化6】

【0141】
(触媒の調製)
窒素置換した試験管に、下記のL1で示される配位子0.5mmolおよびトルエンを5.0mL加え、配位子を溶解させる。この溶液を0℃に冷却後、トリメチルアルミニウムを0.7g(0.5mol)加え、室温に戻し約1時間攪拌して、触媒を調製した。
【0142】
【化7】

【0143】
(ポリ乳酸の重合)
窒素置換した試験管に、ラセミラクチド7,200mg(50.0mmol)と開始剤としてベンジルアルコール0.5mmolを入れ、これにトルエン45mLを加えてよく攪拌して、ラセミラクチドを溶解した。この溶液に、触媒溶液を加えラクチドの重合を開始する。溶液は70℃に加熱して反応時間は6時間とした。
【0144】
(結果)
得られたポリ乳酸のX線回折スペクトルを図9に示す。図9より、2θ=12°、21°、24°にピークが観察される。ポリ乳酸のステレオコンプレックスは2θ=12°、21°、24°に特有のピークが検出されることが知られていることから、実施例5aで得られたポリ乳酸はステレオコンプレックスを形成していることが確認された(Ikeda, Y.; Jamshidi, K; Tuji, H; Hyon, S. H. Macromolecules 1987, 20, 904)。
【0145】
得られたポリ乳酸のメチン基域の1H−NMRスペクトルを図10に示す。メチン基の4重線が明確に観察される。このことからも、重合されたポリ乳酸はL−乳酸のみが結合したポリマーおよびD−乳酸のみが結合したポリマーから構成され、規則正しい構造を有するステレオコンプレックス型のポリ乳酸であることが分かる。
【0146】
表7に本実施例5aにより得られたポリ乳酸の性状をまとめる。得られたポリ乳酸の重量収率は93重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、14,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、192℃であった。L−乳酸のみで構成されるポリ−L−乳酸、または、D−乳酸のみで構成されるポリ−D−乳酸の融点は約175℃であることから、得られたポリ乳酸の熱安定性はより向上しているといえる。
【0147】
純粋なLポリ乳酸とDポリ乳酸からなるステレオコンプレックス型ポリ乳酸の融点は約225℃といわれているが、本実施例5aにおいて製造したステレオコンプレックス型ポリ乳酸の融点が225℃より低い。この原因は、Lポリ乳酸分子の鎖中に少量のD乳酸が混入して、(または、Dポリ乳酸分子の鎖中に少量のL乳酸が混入する)その立体規則性が一部失われたために、若干融点が低下したと考えられる。
【0148】
実施例5bでは触媒として化8のL2に示される配位子を使用した。また重合の反応時間は0.4時間である。
【0149】
【化8】

【0150】
表7に実施例5bにより得られたポリ乳酸の性状をまとめる。
【0151】
得られたポリ乳酸の重量収率は95重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、10,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、171℃であった。
【0152】
実施例5cでは触媒として化9のL3に示される配位子を使用した。触媒C3と開始剤ベンジルアルコールの量は0.25mmolに減じて、重合の反応時間は19時間に増加させた。その他の条件は実施例5aと同様である。
【0153】
【化9】

【0154】
表7に実施例5cにより得られたポリ乳酸の性状をまとめる。
【0155】
得られたポリ乳酸の重量収率は90重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、23,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、207℃であった。
【0156】
実施例5dでは、トルエン溶媒を使用しない、いわゆるバルグ重合を行った。トルエン溶媒を使用せず、触媒は化6のC3を使用し、反応温度は130℃、反応時間は0.5時間とした。その他の条件は、実施例5aと同様である。
【0157】
表7に得られたポリ乳酸の性状をまとめる。得られたポリ乳酸の重量収率は98重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、12,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、160℃であった。バルグ重合法によると重合したポリ乳酸の融点が若干低下するが、反応時間が大幅に短縮できた。
【0158】
比較例1では、触媒としてアルミニウムイソプロポキシド(Al(O−i−Pr)3)を使用して、重合時間を3時間とした。それ以外の条件は実施例5aと同じである。図11に得られたポリ乳酸のメチン基域の1H−NMRスペクトルを示す。メチン基の4重線が明確に観察されないことから、重合されたポリ乳酸はL−乳酸およびD−乳酸のみがランダムに結合したランダム構造のポリ乳酸であると推測される。
【0159】
得られたポリ乳酸の重量収率は88重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クロマトグラフ分析装置(GPC)により測定した結果、10,000であった。得られたポリ乳酸はアモルファス(ランダム構造)なポリマーであるため融点を示さなかった。
【0160】
【表7】

【符号の説明】
【0161】
1 乳酸製造工程
2 乳酸精製工程
3 ラクチド製造工程
4 ラクチド精製工程
5 ポリ乳酸製造工程
【技術分野】
【0001】
本発明は、グリセリンからポリ乳酸を製造する方法であって、製造されるポリ乳酸は、ポリ−L−乳酸とポリ−D−乳酸の共晶を形成することによりポリ−L−乳酸やポリ−D−乳酸よりも耐熱性の高い樹脂であることが知られているステレオコンプレックス型ポリ乳酸である、方法に関する。
【背景技術】
【0002】
近年、地球温暖化への懸念から天然の植物を原料としたバイオプラスチックが注目されている。バイオプラスチックの大きな利点は、元来地上にある植物を原料とするため、地上の二酸化炭素の増減に影響を与えないカーボンニュートラルの性質を持っていることである。バイオマス起源の素材を利用することで植物が大気中の二酸化炭素を固定して生成した物質を使ってつくるプラスチックであるため、それを燃焼廃棄しても二酸化炭素の収支はゼロとなり地球温暖化対策になるといわれている。
【0003】
ポリ乳酸は乳酸がエステル結合によって重合された高分子であり、植物起源の素材から合成できるバイオプラスチックの一つである。ブドウ糖(グルコース)・砂糖(スクロース)などに乳酸菌を作用させると、その発酵作用により乳酸が得られる。原料となる糖類はジャガイモやトウモロコシなどから得られるデンプンに酵素(アミラーゼなど)を作用させる、あるいはサトウキビなどから抽出することにより大量に得られる。「カーボンニュートラル」の観点から、近年、ポリ乳酸の需要が増加している。
【0004】
しかしながら、ポリ乳酸の原料であるトウモロコシやサトウキビは食糧としても利用されるため、食糧との競合が問題視されている。
【0005】
乳酸は1つの不斉炭素を持ち、L体とD体の2種が存在する。L体のみを重合させたものはポリ-L-乳酸、D体のみを重合させたものはポリ-D-乳酸と呼ばれる。これらはその立体配置により、互いに逆回りのらせん構造をとることが知られており、その融点は約175℃といわれている。
【0006】
これに対して、ポリ−L−乳酸とポリ−D−乳酸を混合したものは、ポリ−L−乳酸とポリ−D−乳酸の共晶を形成することにより、ポリ−L−乳酸やポリ−D−乳酸よりも耐熱性の高い樹脂となることが知られている。これをステレオコンプレックス型ポリ乳酸(SC−PLA)と呼んでおり、その融点は約225℃といわれている。
【0007】
一方、L−乳酸とD−乳酸が混合した状態から直接重合すると、一本の乳酸ポリマーの中にL−乳酸とD−乳酸が混ざったランダムな重合体、いわゆる、ポリ−DL−乳酸になる。これは、結晶性を示さず、50℃程度のガラス転移点で軟化するため実用的でない。
【0008】
従来、ステレオコンプレックス型ポリ乳酸を製造するためには、ポリ-L-乳酸とポリ-D-乳酸を別々に製造して混合する作業が必要であり効率が悪かった。乳酸菌のうち、L−乳酸生産株であるStc. Thermophilus等を作用させると糖類は主にL−乳酸に転換される。一方、乳酸菌のうち、高純度D−乳酸生産株であるLeus. Mesenteroides等を作用させると、糖類は主にD−乳酸に転換される。このように、L−乳酸とD−乳酸を製造するためには、それぞれ、別々の菌体を使用して、別々に発酵製造する必要があり効率が悪かった。
【0009】
他の乳酸の製造方法として、酵素の存在下でアセトアルデヒドからシアノヒドリンを生成させ、これを酸加水分解することにより製造する方法(非特許文献1参照)または、アセトアルデヒドと青酸からシアノヒドリンを生成させ、これを塩酸の存在下等にエステル化する方法が知られている。このような方法によると、L−乳酸とD−乳酸が等量混合したラセミ乳酸が製造される。
【0010】
しかしながら、ラセミ乳酸をそのまま重合すると、一本の乳酸ポリマーの中にL−乳酸とD−乳酸が混ざったポリ−DL−乳酸となるだけで、ステレオコンプレックス型のポリ乳酸を製造することはできない。ラセミ乳酸からステレオコンプレックス型ポリ乳酸を製造するためには、一旦、L乳酸とD乳酸を光学分割法により分離する必要がある。ラセミ乳酸の光学分割法は、結晶化法やクロマトグラフィーによる分離が知られているが、これらの方法はいずれも、煩雑な手順が必要な上に高価であり、また大量の化合物を分割するのは難しいという欠点があった。
【0011】
また、アセトアルデヒドはほとんど石油原料から作られているため、この方法で製造された乳酸から重合したポリ乳酸はバイオプラスチックと呼ぶことはできない。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Chem. Commun., 2001, p1800
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、上記事情に鑑みてなされたものであり、糖類等の食糧と競合することがないカーボンニュートラルな材料を用いることができ、かつ、手続が煩雑な上に高価であり大量製造が困難な光学分割法によらずに、ステレオコンプレックス型ポリ乳酸を製造することができる方法を提供することを目的とする。
【課題を解決するための手段】
【0014】
図1に本発明によるグリセリンからステレオコンプレックス型ポリ乳酸を製造するプロセスを示す。
【0015】
上記課題を解決するため、本発明は、ステレオコンプレックス型のポリ乳酸を製造する方法であって、
(1)高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、
(2)該ラセミ乳酸ナトリウム水溶液からラセミ乳酸を回収する工程と、
(3)該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、
(4)該混合物においてラセミラクチドをメソラクチドから分離する工程と、
(5)サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程と
を包含することを特徴とする。
【0016】
好ましくは、前記工程(1)は、グリセリンと水酸化ナトリウムを水に溶かして水溶液とし、これを250〜350℃の範囲の温度および5〜15MPaの範囲の圧力の高温高圧の条件下に保持することにより行われる。
【0017】
好ましくは、前記工程(2)は、ラセミ乳酸ナトリウム水溶液を酸性とし、これを有機溶媒と接触させることによりラセミ乳酸を有機溶媒に抽出し、続いて、有機溶媒を蒸発させることによりラセミ乳酸を回収することにより行われる。
【0018】
工程(2)において、好ましくは、前記有機溶媒は、プロパノール、ブタノール、酢酸メチル、トリエチルアミンおよびメチルエチルケトンからなる群から選択される1種である。
【0019】
好ましくは、前記工程(3)は、ラセミ乳酸の脱水縮合により乳酸のオリゴマーを前駆体として生じさせ、続いて、これを解重合・環化することによってメソラクチドおよびラセミラクチドのラクチド混合物を生成させ、これを蒸気として反応系外に取り出すことにより行われる。
【0020】
工程(3)において、前記オリゴマー前駆体を生じさせるための条件は、好ましくは、温度100〜200℃、圧力10〜80kPaである。
【0021】
工程(3)において、前記ラクチドを生成させるための条件は、好ましくは、温度150〜250℃、圧力0.5〜5kPaである。
【0022】
好ましくは、前記工程(4)は、融点118℃のラセミラクチドと融点約60℃のメソラクチドの融点差を利用する溶融晶析法により行われる。
【0023】
好ましくは、前記工程(5)は、一般式:
【0024】
【化1】

【0025】
で表されるサレン型金属錯体を触媒として利用することにより行われる。
【0026】
R1、R2は水素、炭素数1〜6のアルキル基、炭素数1〜6のアルコキシ基、塩素、臭素、フッ素等のハロゲン基、シリル基、核炭素数6〜18のアリール基、またはメトキシメチル基を表す。R3は炭素数2〜6の二価の脂肪族炭化水素基を表す。MはAl、Fe、TiまたはYを表す。
【0027】
また、本発明は、上記のいずれか1つに記載の方法により製造される、グリセリンから合成されたステレオコンプレックス型ポリ乳酸である。
【0028】
ここで比較のため、従来の発酵乳酸からステレオコンプレックス型ポリ乳酸を製造するプロセスを図2に示す。発酵法によると、ポリ-L-乳酸とポリ-D-乳酸を別々に製造した後、これらを混合してステレオコンプレックス型ポリ乳酸を製造する。(1)、(6)では、それぞれ、別種の微生物を用いてL-乳酸またはD-乳酸を製造する。(2)、(7)では発酵に用いた糖類、培地、pH調整用のアルカリ物質および水などを分離して乳酸を精製する。(3)、(8)ではL-ラクチドまたはD-ラクチドを製造する。(4)、(9)ではラクチド中の乳酸や直鎖2量体および水分などの不純物を除去する。(5)、(10)では、ラクチドからポリL乳酸またはポリD乳酸を製造する。(11)ではポリ-L-乳酸とポリ-D-乳酸を混合してステレオコンプレックス型ポリ乳酸を製造する。図2に示される従来の方法は、図1に示す本発明の方法に比べて多くの工程が必要であることが分かる。
【0029】
図3に石油合成乳酸からステレオコンプレックス型ポリ乳酸を製造するプロセスを示す。本方法では、L-乳酸とD-乳酸を同時に当量製造することができるが、途中で光学分割法によってL-乳酸とD-乳酸を分離する工程が要求される。(1)では石油を原料として乳酸を製造する。ここで製造される乳酸はL-乳酸とD-乳酸が当量混合したラセミ乳酸である。(2)ではラセミ乳酸中の不純物(未反応の原料など)を除去する。(3)では、ラセミ乳酸をL-乳酸とD-乳酸に分離する。ラセミ乳酸の光学分割法は、結晶化法やクロマトグラフィーによる分離が知られている。(4)、(7)ではL-ラクチドまたはD-ラクチドを別々に製造する。(5)、(8)ではラクチド中の乳酸や直鎖2量体および水分などの不純物を除去する。(6)、(9)ではラクチドからポリL乳酸またはポリD乳酸を製造する。(10)ではポリ-L-乳酸とポリ-D-乳酸を混合してステレオコンプレックス型ポリ乳酸を製造する。図3に示される従来の方法は、図1に示す本発明の方法に比べて多くの工程が必要であることが分かる。
【発明の効果】
【0030】
本発明の請求項1に規定する工程(1)〜(5)を行うことにより以下の種々の効果を得ることができる。
【0031】
(1)従来のポリ乳酸の原料は食糧であるトウモロコシやイモ類であったが、本発明で製造されるポリ乳酸の原料は工業的な副産物であるグリセリンであるため、食糧との競合を避けることができる。油脂産業における副産物であるグリセリンを、乳酸製造のための原料としているので、乳酸を安価にかつ大量にプラスチック産業へ供給することによって、ポリ乳酸の普及を推進することができ、ひいては循環型社会の形成に貢献することができることが期待される。
【0032】
(2)本発明では、スレレオコンプレックス型ポリ乳酸を製造する際、L−乳酸とD−乳酸あるいはLラクチドとDラクチドをいわゆる光学分割法によって分離する工程を含まない。光学分割操作は、操作が非常に煩雑でまたコストがかかるため、産業的には、高価な食糧品(アミノ酸など)や医薬品の分野で主に利用されている。このため、光学分割操作を含むことなく、ステレオコンプレックス型ポリ乳酸を製造できることは、産業的に大きなメリットがある。したがって、本発明では、従来の方法では、安価にかつ大量に供給することができなかった、熱的安定性に優れたステレオコンプレックス型ポリ乳酸を工業的に供給することが可能である。
【0033】
(3)本発明で製造されるポリ乳酸は、動植物油脂由来のバイオマスプラスチックであるため、カーボンニュートラルの観点から地球温暖化への対策に貢献できると期待される。
【図面の簡単な説明】
【0034】
【図1】グリセリンからステレオコンプレックス型ポリ乳酸を製造する本発明のプロセスを示す図である。
【図2】発酵乳酸からステレオコンプレックス型ポリ乳酸を製造する従来のプロセスを示す図である。
【図3】石油合成乳酸からステレオコンプレックス型ポリ乳酸を製造する従来のプロセスを示す図である。
【図4】本発明のステレオコンプレックス型ポリ乳酸の製造方法を説明するフローシートである。
【図5】ステレオコンプレックス型ポリ乳酸の重合原理を示す図である。
【図6】乳酸製造工程において用いられる乳酸製造装置のフロー図である。
【図7】ラクチド製造工程において用いられるラクチド製造装置を示す図である。
【図8】ラクチド精製工程において用いられるラクチド精製装置を示す図である。
【図9】グリセリンから合成したステレオコンプレックス型ポリ乳酸のX線回折スペクトルを示す図である。
【図10】実施例5aで得られたポリ乳酸のメチン基域の1H−NMRスペクトル図である。
【図11】比較例1で得られたポリ乳酸のメチン基域の1H−NMRスペクトル図である。
【発明を実施するための形態】
【0035】
以下、本発明のステレオコンプレックス型ポリ乳酸の製造方法について詳細に説明する。
【0036】
図4は、本発明のステレオコンプレックス型ポリ乳酸の製造方法を説明するフローシートである。
【0037】
本発明の製造方法では、原料としてグリセリンが用いられる。
【0038】
グリセリンは産業的に、石鹸や高級脂肪酸あるいはバイオディーゼル燃料の副産物として生産されている。石鹸や高級脂肪酸、バイオディーゼル燃料は、動植物油脂を原料として生産されているが、油脂はグリセリンと脂肪酸から構成されているため、その生産過程では必ず副産物としてグリセリンが産出される。石鹸や高級脂肪酸あるいはディーゼル燃料は、日常生活には欠かせないものであり、その生産量は年々増加している。したがって、その副産物であるグリセリンの生産量も増加しており、近年、その有効利用方法が求められており、本発明は、そのような社会的要請に沿っている。
【0039】
(乳酸製造工程)
乳酸製造工程(1)は、アルカリと高温高圧水の作用によってグリセリンを乳酸に転換する工程である。
【0040】
原料であるグリセリンと水酸化ナトリウムなどのアルカリ性物質を水に混合して水溶液として、これを、250〜350℃の範囲、例えば300℃の温度および5〜15MPaの範囲、例えば10MPaの圧力の高温高圧の条件下に10〜200分間の期間、例えば60分間にわたって保持することにより、70%以上の収率でグリセリンを乳酸に転換することができる。
【0041】
反応の化学量論式は式(1)のように表すことができる。
【0042】
【化2】

【0043】
式(1)から分かるように副産物として水素ガスが発生する。ここで合成される乳酸はラセミ乳酸である。
【0044】
(乳酸精製工程)
乳酸精製工程(2)は、工程(1)で得られた乳酸ナトリウム水溶液から、ナトリウムと水を分離して純粋な乳酸を取り出す工程である。
【0045】
乳酸の精製には、(i)抽出法、(ii)エステル化法、(iii)電気透析法などいくつかの方法を利用することができるが、ここでは溶媒抽出法について具体的に説明する。
【0046】
溶媒抽出法では、例えば、プロパノールやブタノールなどのアルコール系、酢酸メチルなどのエステル系、トリエチルアミンなどのアミン系、メチルエチルケトンなどのケトン系を使用することができる。乳酸ナトリウム水溶液から有機溶媒によって、乳酸を抽出するためには、まず、乳酸ナトリウム水溶液の酸性化が必要である。乳酸ナトリウム水溶液中で、乳酸はほとんど乳酸イオン(CH3−CH(OH)−COO−)として存在するが、水溶液のpHを2.0以下に下げることによって乳酸は乳酸(CH3−CH(OH)−COOH)として存在することになる。これにより、乳酸は有機溶媒に抽出されやすくなる。
【0047】
硫酸などの酸により酸性化した乳酸ナトリウム水溶液を、先述の有機溶媒と接触させることによって、大部分の乳酸は有機溶媒中に移行する。このとき、ほとんどのナトリウムイオンは、硫酸イオンと塩をなすカウンターカチオンの状態で水中に残留する。乳酸が抽出された溶媒相を水相から分離して、さらに蒸留法により、溶媒を揮発させることによって、ナトリウムと分離された乳酸を得ることができる。
【0048】
(ラクチド製造工程)
ラクチド製造工程(3)はラセミ乳酸からラクチドを合成する工程である。本工程により得られるラクチドは、ラセミラクチドとメソラクチドの混合物である。
【0049】
ラクチドとは、2分子の乳酸において、互いのヒドロキシル基とカルボキシル基が脱水縮合してできた環状化合物を指す。Lラクチドとは、2分子のL−乳酸が脱水縮合してできた環状化合物をさす。Dラクチドとは、2分子のD−乳酸が脱水縮合してできた環状化合物をさす。
【0050】
メソラクチドとは、1分子のL−乳酸と1分子のD−乳酸が脱水縮合してできた環状化合物をさす。
【0051】
ラセミラクチドとは、LラクチドとDラクチドの等量混合物、即ち、光学純度0%のラクチドをさす。
【0052】
乳酸からその環状2量体であるラクチドを合成する方法は各種報告されているが、オリゴマーと呼ばれるプレポリマーを合成してから、分子内エステル交換反応により環化して合成する方法が一般的である。この方法は、Kulkarin(R. K. Kulkarin, Arch. Uurg., 93. 839 (1966))により報告されている。本発明においてオリゴマーとは乳酸分子が2〜30個程度からなる乳酸ポリマーを指す。
【0053】
ラセミ乳酸からラクチドを合成すると、Lラクチド、Dラクチド、メソラクチドの3種の異性体が生成する。それぞれの存在比は、確率的には25:25:50であるが、ラクチドを合成する条件によってある程度変化する。しかし、LラクチドとDラクチドの重量比は必ず1:1になる。
【0054】
100kPa以下の減圧下で200℃に加熱することによって、乳酸は脱水縮合されて、10〜20量体のオリゴマーを生成することができる。乳酸縮合の化学量論式は下記式(2)のように表すことができる。
【0055】
【化3】

【0056】
オリゴマーとラクチドは次式(3)のような平衡関係にある。
【0057】
【化4】

【0058】
ラクチドの蒸気圧は、オリゴマーの蒸気圧より高いため、減圧加熱(210℃、2kPa)することで、ラクチドを反応蒸発させて系外に取り出すことができる。ラクチドが系外に出されることにより、式の平衡はラクチドが生成する方向に進行する。これを繰り返すことで、大部分のオリゴマーをラクチドに転換することができる。
【0059】
(ラクチド精製工程)
ラクチド精製工程(4)は、ラセミラクチドとメソラクチドの混合物からメソラクチドを除去する工程である。
【0060】
LラクチドとDラクチドの立体構造以外の物理的性状は全く同じであるが、LラクチドとDラクチドの混合体であるラセミラクチドとメソラクチドの物理的性状(沸点や融点や溶媒への溶解度など)は若干異なる。この物理的性状の差を利用してラセミラクチドとメソラクチドを分離することができる。例えば、溶媒からの晶析法、溶融晶析法あるいは蒸留法などである。
【0061】
溶融晶析法では、ラセミラクチドの融点が約118℃であるのに対して、メソラクチドの融点が約60℃であるので、これらの融点の差を利用して分離することができる。
【0062】
ラセミラクチドとメソラクチドの混合物をそれぞれの融点である60℃と118℃との間である65℃に加熱すると、混合物は液体相と固体相に分離する。液体相には液体状態のラセミラクチドとメソラクチドが存在するが、その存在比はメソラクチドの方が多い。
【0063】
一方、固体相にも固体状態のラセミラクチドとメソラクチドが存在するが、その存在比はラセミラクチドの方が多くなる。
【0064】
固体相のみを取り出し、これを65℃と118℃の間の75℃に加熱すると、再び、液体相と固体相に分離する。固体相中のラセミラクチドの組成は、先ほどよりも多くなっている。このような操作を繰り返すことで、純度の高いラセミラクチドを得ることができる。
【0065】
(ポリ乳酸製造工程)
ポリ乳酸製造工程(5)は、ラセミラクチドを重合することによってステレオコンプレックス型ポリ乳酸を製造する工程である。
【0066】
特定の置換基を有するサレン型配位子をもつアルミニウム錯体を触媒に用いることで、ラセミラクチドを立体選択的に開環重合させることができる。
【0067】
図5にその反応の原理を示す。まず、開始反応においては、触媒としてのアルミニウム錯体がDラクチドまたはLラクチドと反応して、それぞれのラクチド由来の不斉を有する複合体となる。次に、成長反応においては、次々とモノマーが反応してポリマーが成長するが、反応するモノマーはポリマー成長端に位置するモノマー由来の不斉によって立体的に選択されつつ反応していく。すなわち、ポリマー成長端が、例えばDラクチド由来である場合には、次に反応するモノマーもこれと同じDラクチドが立体選択されて反応していく。つまり、開始反応でアルミニウム錯体とDラクチドが反応すると成長反応でもラクチド中のDラクチドが次々と反応してポリD−乳酸を生成する。同様にして、反応開始反応でアルミニウム錯体とLラクチドが反応すると成長反応でもラセミラクチド中のLラクチドが次々と反応してポリL−乳酸を生成する。このようにして、ラセミラクチドを原料として、ポリD−乳酸とポリL−乳酸が同時に合成されるため、ステレオコンプレックス型のポリ乳酸を合成することができる。
【0068】
次に、本発明の実施例およびこれとの比較を示すための比較例により、本発明をより具体的に説明する。
【0069】
(実施例1:乳酸製造工程)
(操作手順)
図6に本発明に関わる乳酸製造装置のフローを示す。
【0070】
原料貯蔵槽(11)では、グリセリンと水酸化ナトリウムと水を混合して所定濃度のグリセリン水溶液を調合する。水酸化ナトリウムの量はグリセリンと等モルかそれ以上であることが望ましい。
【0071】
定量ポンプ(12)では、グリセリン水溶液を所定圧力に昇圧し、所定の流量で反応装置に送液する。送液量は20L/時である。圧力は、反応温度によって調節するが、概ね6〜20MPaである。
【0072】
予熱器(13)では、グリセリン水溶液を所定温度まで昇温する。反応温度は250〜350℃である。反応温度が低いと反応速度が遅くなり、また、反応温度が高いと生成した乳酸が分解する。このため、概ね280〜320℃が望ましい。ここでは、電気ヒータにより加熱をしているが、熱媒や水蒸気、その他の熱源を利用しても良い。
【0073】
反応塔(14)では、グリセリンが反応して乳酸と水素ガスに転換する。このため、反応器(14)出口の流体は乳酸ナトリウム水溶液と水素ガスの2相流体となる。反応器(14)の容積は20Lであり、滞留時間は1時間である。定量ポンプの送液量を調節することで、滞留時間は10〜200分に変化させることができる。
【0074】
冷却塔(15)では、乳酸ナトリウム水溶液と水素ガスの2相流体の温度を100℃以下に冷却する。ここでは、水により冷却しているが、予熱器との熱交換により冷却しても良い。
【0075】
圧力調節弁(16)では、乳酸ナトリウム水溶液と水素ガスの2相流体の圧力を大気圧に減圧する。
【0076】
気液分離器(17)では、乳酸ナトリウム水溶液と水素ガスの2相流体を水素ガスと乳酸ナトリウム水溶液に分離する。ここでは、サイクロンにより気液分離をしている。
【0077】
(結果)
表1に乳酸製造の結果をまとめる。
【0078】
実施例1aでは、グリセリン濃度300g/L、水酸化ナトリウム濃度130g/Lの水溶液を原料として、温度300℃、圧力10MPa、時間1時間の条件で乳酸製造を行った。反応液中の乳酸濃度は220g/L、未反応グリセリン濃度50g/Lであり、ガス発生量はグリセリン1gあたり、210mL/g−グリセリンであった。ガス組成は97vol%が水素であった。旋光計により乳酸水溶液の光学純度を測定したところ光学純度0%であり、得られた乳酸はラセミ体であることが分かった。
【0079】
実施例1bでは、温度を280℃に下げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が150g/Lと低くなった。この原因は、反応温度を下げることでグリセリンの反応速度が遅くなったからであると考えられる。
【0080】
実施例1cでは、温度を320℃に上げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が180g/Lと低くなった。この原因は、反応温度を上げることで生成した乳酸が分解したからであると考えられる。
【0081】
実施例1dでは、水酸化ナトリウム濃度を50g/Lに下げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が80g/Lと低くなった。この原因は、水酸化ナトリウム濃度を下げることで、グリセリンが反応しなくなったからであると考えられる。下記式(1)に示すように、水酸化ナトリウムはグリセリンと等モル以上加えることが必要だと考えられる。
【0082】
【化5】

【0083】
実施例1eでは、水酸化ナトリウム濃度を150g/Lに上げたが、その他の条件は実施例1aと同じ条件である。実施例1aと比較して、乳酸濃度が175g/Lと低くなった。この原因は、水酸化ナトリウム濃度を上げることで、生成した乳酸が分解しやすくなったからであると考えられる。
【0084】
【表1】

【0085】
(実施例2:乳酸精製工程)
(操作手順)
乳酸精製工程(2)は、工程(1)で得られた乳酸ナトリウム水溶液から、ナトリウムと水を分離して乳酸のみを取り出す工程である。表2に乳酸精製時の条件を示す。また、以下に操作手順を示す。
【0086】
(1)実施例1aで得られた乳酸ナトリウム水溶液を硫酸でpH1.0に調節する。
【0087】
(2)容積3Lの分液ロートに(1)で調節した乳酸ナトリウム水溶液1000gと有機溶媒800gを加えよく混合する。
【0088】
(3)水相と有機相に分離するまで、約40℃の恒温槽内で静置する。
【0089】
(4)水相と有機相を分離する。有機相には大部分の乳酸と若干の水が含まれるが硫酸ナトリウムはほとんど含まれていない。一方、水相には、大部分の硫酸ナトリウムが含まれており、若干の乳酸と有機溶媒も含まれている。
【0090】
(5)エバポレーターにより、有機相から有機溶媒と水を蒸発させて回収する。(4)で回収した有機相を40℃、7kPaの条件化で約5時間保持することで、水と有機溶媒が蒸発して乳酸のみ回収することができる。
【0091】
【表2】

【0092】
(結果)
表3に乳酸精製の結果をまとめる。
【0093】
実施例2aでは、抽出溶媒に酢酸メチルを使用した。抽出後の有機相の全重量は810gであり、その中に含まれる乳酸の重量は66gであった。また、有機相に含まれる硫酸ナトリウムの量は0.6gであり、大部分のナトリウム分を除去することができた。有機相には、乳酸以外に、水、グリセリン、その他の不純物が含まれていた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は70gであり、その中に含まれる乳酸の重量は63gであった。蒸留により、有機相から溶媒と水を蒸発させて、乳酸を分離回収することができた。以上の操作によって、乳酸ナトリウム水溶液から乳酸を回収することができた。
【0094】
実施例2bでは、抽出溶媒にプロパノールを使用した。抽出後の有機相の全重量は1320gであり、その中に含まれる乳酸の重量は132gであった。また、有機相に含まれる硫酸ナトリウムの量は7.3gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は140gであり、その中に含まれる乳酸の重量は128gであった。実施例2aと比べると回収された乳酸量は多いが、乳酸に含まれる硫酸ナトリウムの量も多い。また、有機相に多量の水が溶け込むため、その蒸発にエネルギーが必要であるため、実施例2aより不利である。
【0095】
実施例2cでは、抽出溶媒にブタノールを使用した。抽出後の有機相の全重量は930gであり、その中に含まれる乳酸の重量は60gであった。また、有機相に含まれる硫酸ナトリウムの量は3.0gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は60gであり、その中に含まれる乳酸の重量は55gであった。
【0096】
実施例2dでは、抽出溶媒にトリエチルアミンを使用した。抽出後の有機相の全重量は630gであり、その中に含まれる乳酸の重量は104gであった。また、有機相に含まれる硫酸ナトリウムの量は0.07gであり、大部分のナトリウム分を除去することができた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液は70gであり、その中に含まれる乳酸の重量は50gであった。乳酸に含まれる硫酸ナトリウムは、実施例2aよりも少ないが、溶媒の蒸発工程で乳酸のロスが多い。
【0097】
実施例2eでは、抽出溶媒にメチルエチルケトンを使用した。抽出後の有機相の全重量は950gであり、その中に含まれる乳酸の重量は80gであった。また、有機相に含まれる硫酸ナトリウムの量は1.6gであり、大部分のナトリウム分を除去できた。この有機相をエバポレーターで蒸留したところ、蒸留後の残留液の全重量は85gであり、その中に含まれる乳酸の重量は78gであった。実施例2aよりも乳酸の収率は大きいが、乳酸中に含まれる硫酸ナトリウムの量が多い。
【0098】
【表3】

【0099】
(実施例3:ラクチド合成工程)
(装置)
図7に本工程に用いられるラクチド製造装置を示す。
【0100】
フラスコ(21)は容量200mLのナス型フラスコであり、ここに原料である乳酸と触媒であるオクチル酸スズを供給する。フラスコ(21)には温度計T1が備えてあり、加熱中の試料温度を測定することができる。また、フラスコ(21)内には攪拌子(22)が入っておりスターラー(23)により加熱中に試料を良く攪拌することができる。フラスコ(21)の加熱および温度制御はオイルバス(24)によって行う。また、フラスコ(21)には真空ポンプ(25)がつながっており、所定の圧力に減圧することができる。
【0101】
乳酸を減圧下で加熱することで、乳酸が脱水縮合された縮合水が蒸発する。乳酸自体はオリゴマーに転換される。生成したオリゴマーを更に減圧し加熱することで、オリゴマーからラクチドが生じて、ラクチドが蒸発する。
【0102】
温度計T2は、フラスコ(21)の出口温度を測定する。
【0103】
冷却器(26)は、水冷式または空冷式のガラス管であり、蒸発した水蒸気あるいはラクチド蒸気を凝縮し液体状態にする。
【0104】
受器(27)は、目盛付きのガラス製容器であり発生した縮合水量またはラクチド量を計測することができる。
【0105】
真空トラップ(28)は、受器で回収できなかった水蒸気や乳酸蒸気を回収する。ドライアイスにより−79℃に冷却している。
【0106】
(操作手順)
・オリゴマーの合成
(1)実施例2aで得られた乳酸150gおよび触媒としてオクチル酸スズ0.75gを200mLのナス型フラスコ(21)に入れる。
【0107】
(2)オイルバス(24)を130℃に設定して、真空ポンプ(25)によりフラスコ(21)内を80kPaに減圧する。
【0108】
(3)乳酸の縮合により縮合水の蒸発が始まると、オイルバス(24)の温度を徐々に上げていき、また、真空ポンプ(25)により圧力を10kPaまで徐々に下げていく。
【0109】
(4)蒸発した縮合水は、冷却器(26)によって冷却、凝縮され受器(27)に回収される。
【0110】
(5)約4時間後、脱水量が27gに達した時点で、オリゴマー合成反応を終える。
【0111】
・ラクチドの合成
(1)オイルバス(24)の温度を210℃に設定して、真空ポンプ(25)によりフラスコ内を2kPaに減圧する。
【0112】
(2)オリゴマーからラクチドが生成して、ラクチドの蒸発が始まる。
【0113】
(3)蒸発したラクチドは冷却器(26)で冷却、凝縮されて受器(27)に回収される。
【0114】
(4)1.5時間後、オリゴマーが70g回収された時点で、ラクチド合成反応を終える。
【0115】
(結果)
表4にラクチド合成時の条件を、表5にラクチド合成工程の結果をまとめる。
【0116】
【表4】

【0117】
【表5】

【0118】
実施例3aでは、原料に実施例2aで製造した乳酸を150g使用した。触媒として、オクチル酸スズを0.75g使用した。オリゴマーの合成条件は温度130〜200℃、圧力80〜10kPa、時間4時間である。ラクチド合成条件は温度210℃、圧力2kPa、反応時間1.5時間である。オリゴマー合成工程では、回収された縮合水量は27gであった。ゲル浸透クロマトグラフ分析装置(GPC)により、得られたオリゴマーの数平均分子量を測定した結果、1600であった。また、ラクチド合成実験により回収されたラクチドの全量は76gであった。核磁気共鳴分析法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチドを34g含み、メソラクチドを27g含むことが分かった。回収されたラクチドはその他の不純物として水や乳酸、直鎖乳酸2量体などを含んでいた。
【0119】
実施例3bでは、オリゴマーの合成条件を、200℃の一定温度、80kPaの一定圧力、反応時間6時間とした。それ以外の条件は実施例3aと同様である。ゲル浸透クロマトグラフ分析装置(GPC)により、得られたオリゴマーの数平均分子量を測定した結果、1000であり、実施例3aで得られたオリゴマーより小さいことが分かった。また、ラクチド合成実験により回収されたラクチドの全量は60gであり、実施例3aで得られたラクチドより少なかった。核磁気共鳴分析法(1H−NMR)により回収されたラクチドの組成を分析した結果、水や乳酸、直鎖乳酸2量体など不純物を21g含んでおり、不純物量は実施例3aで得られたラクチドより多かった。
【0120】
実施例3cでは、ラクチドの合成条件を圧力10kPaとした。それ以外の条件は実施例3aと同様である。ラクチド合成実験により回収されたラクチドの全量は45gであり、実施例3aで得られたラクチドより少なかった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、水や乳酸、直鎖乳酸2量体など不純物を21g含んでおり、不純物量は実施例3aで得られたラクチドより多かった。
【0121】
(実施例4:ラクチド精製工程)
(操作手順)
図8に本ラクチド精製工程において用いられるラクチド精製装置を示す。表6にラクチド精製工程の条件と結果を示す。以下に操作手順を示す。
【0122】
(1)原料として実施例3aで得られたラクチドを使用する。使用した原料ラクチドは、表6に示すように、ラセミラクチドとメソラクチドの混合物である。また、不純物として乳酸や直鎖乳酸2量体を含む。
【0123】
(2)原料ラクチド100gを容量200mLのガラス製ビーカ(31)に入れる。
【0124】
(3)ビーカ(31)をオイルバス(32)に浸して、ラクチドを130℃に昇温して原料を全て溶融する。ラクチド温度は温度計Tで測定する。また、昇温中ラクチドはスターラ(33)により攪拌子(34)を回転させてよく攪拌する。
【0125】
(4)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を65℃に設定し、約1時間放置する。
【0126】
(5)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0127】
(6)プロパノールで洗浄したラクチドを再び130℃に加熱して全て溶融する。
【0128】
(7)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を75℃に設定し、約1時間放置する。
【0129】
(8)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0130】
(9)プロパノールで洗浄したラクチドを再び130℃に加熱して全て溶融する。
【0131】
(10)ラクチドが全て溶融したことを確認した後、オイルバス(32)の温度を95℃に設定し、約1時間放置する。
【0132】
(11)ラクチドが固相と液相に分離するので、固相のみ取り出す。取り出した固相はプロパノールで洗浄する。
【0133】
(結果)
表6に条件と結果を示す。
【0134】
【表6】

【0135】
精製に使用したラクチドは実施例3aで合成したもので、その組成はラセミラクチド45重量%、メソラクチド30重量%、その他(水、乳酸、直鎖乳酸2量体など)20重量%である。
【0136】
原料ラクチドを130℃で完全に溶融した後、65℃に冷却して約1時間放置し、これをプロパノールで洗浄した。1回目の溶融晶析操作で回収されたラクチドは65gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチド41g、メソラクチド24g含んでいた。水や乳酸その他の直鎖乳酸2量体などはほとんど含まれていなかった。
【0137】
このラクチドを75℃で2回目の溶融晶析操作を行った結果で回収されたラクチドは35gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチド33g、メソラクチド24g含んでいた。
【0138】
このラクチドを95℃で3回目の溶融晶析操作を行った結果で回収されたラクチドは25gであった。核磁気共鳴分光法(1H−NMR)により回収されたラクチドの組成を分析した結果、ラセミラクチドを25g含んでおり、メソラクチドはほとんど含んでいなかった。
【0139】
(実施例5:ステレオコンプレックス型ポリ乳酸の重合工程)
実施例5aでは、実施例4で精製したラセミラクチドを原料として使用し、また、下記のC1、C2およびC3に示される構造のサレン型アルミニウム錯体を触媒として使用した。
【0140】
【化6】

【0141】
(触媒の調製)
窒素置換した試験管に、下記のL1で示される配位子0.5mmolおよびトルエンを5.0mL加え、配位子を溶解させる。この溶液を0℃に冷却後、トリメチルアルミニウムを0.7g(0.5mol)加え、室温に戻し約1時間攪拌して、触媒を調製した。
【0142】
【化7】

【0143】
(ポリ乳酸の重合)
窒素置換した試験管に、ラセミラクチド7,200mg(50.0mmol)と開始剤としてベンジルアルコール0.5mmolを入れ、これにトルエン45mLを加えてよく攪拌して、ラセミラクチドを溶解した。この溶液に、触媒溶液を加えラクチドの重合を開始する。溶液は70℃に加熱して反応時間は6時間とした。
【0144】
(結果)
得られたポリ乳酸のX線回折スペクトルを図9に示す。図9より、2θ=12°、21°、24°にピークが観察される。ポリ乳酸のステレオコンプレックスは2θ=12°、21°、24°に特有のピークが検出されることが知られていることから、実施例5aで得られたポリ乳酸はステレオコンプレックスを形成していることが確認された(Ikeda, Y.; Jamshidi, K; Tuji, H; Hyon, S. H. Macromolecules 1987, 20, 904)。
【0145】
得られたポリ乳酸のメチン基域の1H−NMRスペクトルを図10に示す。メチン基の4重線が明確に観察される。このことからも、重合されたポリ乳酸はL−乳酸のみが結合したポリマーおよびD−乳酸のみが結合したポリマーから構成され、規則正しい構造を有するステレオコンプレックス型のポリ乳酸であることが分かる。
【0146】
表7に本実施例5aにより得られたポリ乳酸の性状をまとめる。得られたポリ乳酸の重量収率は93重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、14,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、192℃であった。L−乳酸のみで構成されるポリ−L−乳酸、または、D−乳酸のみで構成されるポリ−D−乳酸の融点は約175℃であることから、得られたポリ乳酸の熱安定性はより向上しているといえる。
【0147】
純粋なLポリ乳酸とDポリ乳酸からなるステレオコンプレックス型ポリ乳酸の融点は約225℃といわれているが、本実施例5aにおいて製造したステレオコンプレックス型ポリ乳酸の融点が225℃より低い。この原因は、Lポリ乳酸分子の鎖中に少量のD乳酸が混入して、(または、Dポリ乳酸分子の鎖中に少量のL乳酸が混入する)その立体規則性が一部失われたために、若干融点が低下したと考えられる。
【0148】
実施例5bでは触媒として化8のL2に示される配位子を使用した。また重合の反応時間は0.4時間である。
【0149】
【化8】

【0150】
表7に実施例5bにより得られたポリ乳酸の性状をまとめる。
【0151】
得られたポリ乳酸の重量収率は95重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、10,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、171℃であった。
【0152】
実施例5cでは触媒として化9のL3に示される配位子を使用した。触媒C3と開始剤ベンジルアルコールの量は0.25mmolに減じて、重合の反応時間は19時間に増加させた。その他の条件は実施例5aと同様である。
【0153】
【化9】

【0154】
表7に実施例5cにより得られたポリ乳酸の性状をまとめる。
【0155】
得られたポリ乳酸の重量収率は90重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、23,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、207℃であった。
【0156】
実施例5dでは、トルエン溶媒を使用しない、いわゆるバルグ重合を行った。トルエン溶媒を使用せず、触媒は化6のC3を使用し、反応温度は130℃、反応時間は0.5時間とした。その他の条件は、実施例5aと同様である。
【0157】
表7に得られたポリ乳酸の性状をまとめる。得られたポリ乳酸の重量収率は98重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クトマトグラフ分析装置(GPC)により測定した結果、12,000であった。得られたポリ乳酸の融点を示差走査熱量分析計(DSC)により測定した結果、160℃であった。バルグ重合法によると重合したポリ乳酸の融点が若干低下するが、反応時間が大幅に短縮できた。
【0158】
比較例1では、触媒としてアルミニウムイソプロポキシド(Al(O−i−Pr)3)を使用して、重合時間を3時間とした。それ以外の条件は実施例5aと同じである。図11に得られたポリ乳酸のメチン基域の1H−NMRスペクトルを示す。メチン基の4重線が明確に観察されないことから、重合されたポリ乳酸はL−乳酸およびD−乳酸のみがランダムに結合したランダム構造のポリ乳酸であると推測される。
【0159】
得られたポリ乳酸の重量収率は88重量%であった。得られたポリ乳酸の数平均分子量をゲル浸透クロマトグラフ分析装置(GPC)により測定した結果、10,000であった。得られたポリ乳酸はアモルファス(ランダム構造)なポリマーであるため融点を示さなかった。
【0160】
【表7】

【符号の説明】
【0161】
1 乳酸製造工程
2 乳酸精製工程
3 ラクチド製造工程
4 ラクチド精製工程
5 ポリ乳酸製造工程
【特許請求の範囲】
【請求項1】
ステレオコンプレックス型のポリ乳酸を製造する方法であって、
(1)高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、
(2)該ラセミ乳酸ナトリウム水溶液からナトリウムを分離してラセミ乳酸を回収する工程と、
(3)該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、
(4)該混合物からメソラクチドを分離してラセミラクチドを回収する工程と、
(5)サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程と
を包含することを特徴とする、方法。
【請求項2】
前記工程(1)は、グリセリンと水酸化ナトリウムを水に溶かして水溶液とし、これを250〜350℃の範囲の温度および5〜15MPaの範囲の圧力の高温高圧の条件下に保持することにより行われる、請求項1に記載の方法。
【請求項3】
前記工程(2)は、ラセミ乳酸ナトリウム水溶液を酸性とし、これを有機溶媒と接触させることによりラセミ乳酸を有機溶媒に抽出し、続いて、有機溶媒を蒸発させることによりラセミ乳酸を回収することにより行われる、請求項1に記載の方法。
【請求項4】
前記有機溶媒は、プロパノール、ブタノール、酢酸メチル、トリエチルアミンおよびメチルエチルケトンからなる群から選択される1種である、請求項3に記載の方法。
【請求項5】
前記工程(3)は、ラセミ乳酸の脱水縮合により乳酸のオリゴマーを前駆体として生じさせ、続いて、これを解重合・環化することによってメソラクチドおよびラセミラクチドのラクチド混合物を生成させ、これを蒸気として反応系外に取り出すことにより行われる、請求項1に記載の方法。
【請求項6】
前記オリゴマー前駆体を生じさせるための条件は、温度100〜200℃、圧力10〜80kPaである、請求項5に記載の方法。
【請求項7】
前記ラクチドを生成させるための条件は、温度150〜250℃、圧力0.5〜5kPaである、請求項5または6に記載の方法。
【請求項8】
前記工程(4)は、融点118℃のラセミラクチドと融点60℃のメソラクチドの融点差を利用する溶融晶析法により行われる、請求項1に記載の方法。
【請求項9】
前記工程(5)は、一般式:
【化1】

(式中、R1、R2は水素、炭素数1〜6のアルキル基、炭素数1〜6のアルコキシ基、ハロゲン基、シリル基、核炭素数6〜18のアリール基、またはメトキシメチル基を表し、R3は炭素数2〜6の二価の脂肪族炭化水素基を表し、MはAl、Fe、Ti、Yを表す)
で表されるサレン型金属錯体を触媒として利用することにより行われる、請求項1に記載の方法。
【請求項10】
前記請求項1〜9のいずれか1つに記載の方法により製造される、グリセリンから合成されたステレオコンプレックス型ポリ乳酸。
【請求項1】
ステレオコンプレックス型のポリ乳酸を製造する方法であって、
(1)高温高圧水中でグリセリンを水酸化ナトリウムと反応させることによって、ラセミ乳酸ナトリウム水溶液を製造する工程と、
(2)該ラセミ乳酸ナトリウム水溶液からナトリウムを分離してラセミ乳酸を回収する工程と、
(3)該ラセミ乳酸を二量化することによりメソラクチドおよびラセミラクチドからなるラクチド混合物を生じさせる工程と、
(4)該混合物からメソラクチドを分離してラセミラクチドを回収する工程と、
(5)サレン型金属錯体を触媒として、該ラセミラクチドを重合することにより、ステレオコンプレックス型のポリ乳酸を製造する工程と
を包含することを特徴とする、方法。
【請求項2】
前記工程(1)は、グリセリンと水酸化ナトリウムを水に溶かして水溶液とし、これを250〜350℃の範囲の温度および5〜15MPaの範囲の圧力の高温高圧の条件下に保持することにより行われる、請求項1に記載の方法。
【請求項3】
前記工程(2)は、ラセミ乳酸ナトリウム水溶液を酸性とし、これを有機溶媒と接触させることによりラセミ乳酸を有機溶媒に抽出し、続いて、有機溶媒を蒸発させることによりラセミ乳酸を回収することにより行われる、請求項1に記載の方法。
【請求項4】
前記有機溶媒は、プロパノール、ブタノール、酢酸メチル、トリエチルアミンおよびメチルエチルケトンからなる群から選択される1種である、請求項3に記載の方法。
【請求項5】
前記工程(3)は、ラセミ乳酸の脱水縮合により乳酸のオリゴマーを前駆体として生じさせ、続いて、これを解重合・環化することによってメソラクチドおよびラセミラクチドのラクチド混合物を生成させ、これを蒸気として反応系外に取り出すことにより行われる、請求項1に記載の方法。
【請求項6】
前記オリゴマー前駆体を生じさせるための条件は、温度100〜200℃、圧力10〜80kPaである、請求項5に記載の方法。
【請求項7】
前記ラクチドを生成させるための条件は、温度150〜250℃、圧力0.5〜5kPaである、請求項5または6に記載の方法。
【請求項8】
前記工程(4)は、融点118℃のラセミラクチドと融点60℃のメソラクチドの融点差を利用する溶融晶析法により行われる、請求項1に記載の方法。
【請求項9】
前記工程(5)は、一般式:
【化1】

(式中、R1、R2は水素、炭素数1〜6のアルキル基、炭素数1〜6のアルコキシ基、ハロゲン基、シリル基、核炭素数6〜18のアリール基、またはメトキシメチル基を表し、R3は炭素数2〜6の二価の脂肪族炭化水素基を表し、MはAl、Fe、Ti、Yを表す)
で表されるサレン型金属錯体を触媒として利用することにより行われる、請求項1に記載の方法。
【請求項10】
前記請求項1〜9のいずれか1つに記載の方法により製造される、グリセリンから合成されたステレオコンプレックス型ポリ乳酸。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2012−1634(P2012−1634A)
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願番号】特願2010−137992(P2010−137992)
【出願日】平成22年6月17日(2010.6.17)
【出願人】(000005119)日立造船株式会社 (764)
【出願人】(000222037)東北電力株式会社 (228)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成24年1月5日(2012.1.5)
【国際特許分類】
【出願日】平成22年6月17日(2010.6.17)
【出願人】(000005119)日立造船株式会社 (764)
【出願人】(000222037)東北電力株式会社 (228)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

