ポルフィリン誘導体及び光子活性化療法におけるその使用
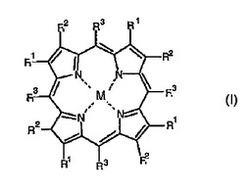
本発明は、光子活性化療法による細胞死のための製薬組成物の製造における式(I)の化合物の使用、並びに癌の予防及び/又は治療における前記化合物の使用に関する。


【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光子活性化療法用の改善された組成物、並びに腫瘍等のターゲット細胞を死滅させる際のその使用法を提供する。本発明の手段及び方法によって、臨床用途のための光子活性化療法の最適化が可能となる。
【背景技術】
【0002】
癌の治療には、種々の並行療法が用いられる。通常、これらの療法では2つのステップが必要となり、まずはじめに、製薬的に不活性な薬剤を患者に投与し、体内のターゲット部位に到達させる。次に、不活性種を、ターゲット細胞を死滅させる毒性種へと活性化させる。当分野で既知のかかる並行療法としては、光線力学療法(PDT)、ホウ素中性子捕捉療法(BNCT)、及び放射線増感が挙げられる。療法の生物学的影響が照射領域全体へと拡がり且つ所望の効果をもたらすべく破壊的なイオン化軌道を生成するために高い照射量が必要とされる従来の放射線療法に対し、これらの並行療法は利点をもたらす。
【0003】
光子活性化療法は、放射線増感の一態様である。一般に、それは、ターゲット細胞内に蓄積する製薬的に不活性な薬剤を用いる。当該薬剤は、ターゲット細胞及び周囲組織へのX線照射によりin vivoにて活性化される。
【発明の開示】
【発明が解決しようとする課題】
【0004】
ガドリニウムテクスフリン(gadolinium teaxfrin)は、光子活性化療法を利用する脳腫瘍の治療のために開発された。全脳照射して薬剤を活性化させ、患者を神経発芽に関しモニタする。イオン化放射線によるガドリニウムテクスフリンの活性化によって、細胞及び細胞器官に対し高い有害性を示す短命の細胞毒性ラジカルが生成される。従って、周囲の細胞及び組織に対する望ましくない損傷を最小限としつつ利用することのできる光子活性化療法薬剤が、当分野で必要とされている。
【0005】
ポルフィリンは、前々から薬剤中に用いられてきた。これらの化合物は、ほ乳動物の腫瘍組織に高い親和性を示し、PDTにおいて利用されてきた。しかしながら、ポルフィリンの臨床的な使用は、ポルフィリンを活性化させるのに必要な可視光の不十分な透過力により制限されてきた。
【課題を解決するための手段】
【0006】
本発明は、イオン化放射線により活性化されると安定で長寿命のラジカルをもたらすことのできるポルフィリン誘導体を提供する。ハロゲン化ポルフィリンは、その配座並びに光物性や化学特性が変化する。例えば、メソテトラフェニルポルフィリンのピロール環位置を8つの臭素原子で置換すると、酸化ポテンシャルが550mVシフトする。この酸化ポテンシャルの増大により、ハロゲン化ポルフィリンの酸化劣化に対する耐性は高まり、光子活性化療法に用いることが可能となるものと考えられる。これらのポルフィリンは、触媒又は非線形吸収物質として用いることができる。かかる安定で長寿命のラジカルの生成により、薬剤を活性化させるのに必要とされる有害な照射の量を低減させることができる。当該薬剤はまた、BNCTなどの他の技術にとって必要となる濃度よりも低い濃度にて供給することができる。組織毒性が低く、腫瘍選択性が高く、且つ血液から迅速に排除されるため、本発明の化合物の使用はin vivoにおいて多くの利点をもたらす。さらに、ハロゲン化ポルフィリンは、X線と組み合わされる際に効果が高まり、腫瘍組織に選択性を示す。
【発明を実施するための最良の形態】
【0007】
従って、本発明の第1の態様では、光子活性化療法による細胞死のための製薬組成物の製造における式(I)の化合物の使用が提供される。
【0008】
【化16】

【0009】
式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;
C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、ハライド、SO3R4、NO2、C1-6アルキル又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-6ハロアルキル、C3-12アリール若しくはC3-12ヘテロアリール、C1-20アルキルオキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C3-12アリールオキシ、C3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アルケニル、アルケニルオキシ、アルキニル、アルキニルオキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、アリール、R5、OR5、NR62、SO3R4、NO2、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、C6-12アリール、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールで任意に置換されており;R6は、水素又はC1-6アルキルであり、R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Ga、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。第1の態様の好ましい実施形態では、金属は、Au、Pb、又はX線照射時に電子シャワーを生成する他の任意の金属である。前記電子シャワーの生成によって、本発明の化合物の効果が高まる。
【0010】
第1の態様の好ましい実施形態では、R1基の1つ又は複数は、ハライド又はNO2のような電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3又は4個が、ハライドである。当業者であれば、R1を任意の電子求引性基とし得ることは理解されよう。R1基は、ハライド基と同程度の電気陰性をもたらすのが好ましい。
【0011】
第1の態様のさらに好ましい実施形態では、R2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R2基の2、3、又は4個が、ハライドである。
【0012】
第1の態様のさらに好ましい実施形態では、R3基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R3基の2、3、又は4個が、ハライドである。
【0013】
第1の態様の好ましい実施形態では、R1基の1つ又は複数及びR2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3、又は4個と、R2基の2、3、又は4個とは、ハライドである。
【0014】
第1の態様の好ましい実施形態では、本発明の化合物は、4、5、6、7、8、9又は10個のハロゲン原子、好ましくは8個のハロゲン原子で置換されており、この場合、前記ハロゲン原子はBrであるのが好ましい。
【0015】
本発明の目的のために、アルキルは、直鎖及び分岐鎖両方の、炭素数1〜20、好ましくは炭素数1〜8、より好ましくは炭素数1〜6、最も好ましくは炭素数1〜4のアルキル基を意味し、限定はしないが、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、sec-ブチル、イソブチル、tert-ブチルが挙げられる。用語アルキルはまた、シクロアルキルも包含し、それには、限定はしないが、シクロプロピル、シクロブチル、CH2-シクロプロピル、CH2-シクロブチルが含まれる。
【0016】
ハロアルキルは、1つ又は複数のハロゲン原子で置換された、炭素数1〜8の、好ましくは炭素数1〜4のアルキル基を表し、例えば、CH2CH2Br、CF3又はCCl3がある。
【0017】
用語「アルケニル」は、1つ又は複数の炭素−炭素二重結合を含有する、炭素数2〜20、好ましくは2〜8、より好ましくは炭素数2〜6、最も好ましくは炭素数2〜4の直鎖若しくは分岐鎖アルケニル基を意味し、限定はしないが、エチレン、n-プロピル-1-エン、n-プロピル-2-エン、イソプロピレン等が挙げられる。「アルキニル」は、炭素数2〜20、好ましくは炭素数2〜8、より好ましくは炭素数2〜6、最も好ましくは炭素数2〜4の直鎖若しくは分岐鎖アルキニル基を意味し、限定はしないが、エチニル、2-メチルエチニルが挙げられる。本発明のアルキル、アルケニル及び/又はアルキニル基は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19又は20個の炭素原子から構成することができる。
【0018】
「アリール」は、3−12員の芳香族炭化水素、好ましくは、1つの環を含有するか又は1つ若しくは複数の飽和環あるいは不飽和環と縮合している、5員若しくは6員の炭化水素を意味し、限定はしないが、フェニル、ナフチル、アントラセニル又はフェナントラセニルが挙げられる。
【0019】
「ヘテロアリール」は、3〜12員の芳香族アリール、好ましくは、N、O若しくはSから選択される1つあるいは複数のヘテロ原子を含有し、且つ1つの環を含有するか又は1つ若しくは複数の飽和環あるいは不飽和環と縮合している、5員若しくは6員の炭化水素を意味する。当該ヘテロアリールは、完全に飽和していても、部分的に飽和していても、又は不飽和であってもよい。アリール基又はヘテロアリール基の例として、限定はしないが、フェニル、アクリジン、ベンズイミダゾール、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンゾチアゾール、カルバゾール、シンノリン、ジオキシン、ジオキサン、ジオキソラン、ジチアン、ジチアジン、ジチアゾール、ジチオラン、フラン、イミダゾール、イミダゾリン、イミダゾリジン、インドール、インドリン、インドリジン、インダゾール、イソインドール、イソキノリン、イソキサゾール、イソチアゾール、モルホリン、ナフチリジン、オキサゾール、オキサジアゾール、オキサチアゾール、オキサチアゾリジン、オキサジン、オキサジアジン、フェナジン、フェノチアジン、フェノキサジン、フタラジン、ピペラジン、ピペリジン、プテリジン、プリン、ピラン、ピラジン、ピラゾール、ピラゾリン、ピラゾリジン、ピリダジン、ピリジン、ピリミジン、ピロール、ピロリジン、ピロリン、キノリン、キノキサリン、キナゾリン、キノリジン、テトラヒドロフラン、テトラジン、テトラゾール、チオフェン、チアジアジン、チアジアゾール、チアトリアゾール、チアジン、チアゾール、チオモルホリン、チアナフタレン、チオピラン、トリアジン、トリアゾール、又はトリチアンが挙げられる。
【0020】
ハロゲンは、F、Cl、Br又はIを意味し、好ましくはBr又はClである。
【0021】
第1の態様の好ましい実施形態では、基R5は、生体適合性ポリマーである。生体適合性ポリマーの存在によって、本発明の化合物の物理的特性及び化学的特性を変化させることができる。かかる生体適合性ポリマーの存在によって、例えば、水溶性を高めたり、腫瘍ターゲット能を高めたり、また、例えば、血液細胞及び/又は血小板への干渉を軽減及び/又は防止することによって、又は肝臓、脾臓、骨髄及び/又は肺中への当該化合物の蓄積を低減させることによって、毒性プロファイルを低減させることができる。かかる生体適合性ポリマーの例として、N-(2-ヒドロキシプロピル)メタクリルアミド(HPMAコポリマー)−ペンダント鎖、ポリエチレングリコール(PEG)、エチレングリコールコポリマー、多糖、例えばデキストリン、デキストランキトサン(N-スクシニルキトサン)、カルボキシメチルキチン、カルボキシメチルプルラン、アルギネート、ポリ(アミノ酸)、ポリ[N-(2-ヒドロキシエチル)-L-グルタミン] PHEG、β-ポリ(2-ヒドロキシエチルアスパルトアミド) PHEA、ポリ(グルタミン酸)、ポリ(アスパラギン酸)、ポリリシン(ポリ(L-リシン)ポリエステル、ポリ(α若しくはβ-マレイン酸)、交互ポリマー(alternating polymer)、PEGリシン、ブロックコポリマー、ポリ(エチレングリコール−アスパルテート)、スチレンと無水マレイン酸とのコポリマー、ポリガラクツロン酸、ヒドロキシアルキル(メタ)アクリレートのコポリマー、例えばN-フェニルピロリドン、ポリ(L-グルタミン酸及びヒドロキシエチル-L-グルタミン)、ポリ(α-リンゴ酸)、ポリアスパラギン酸−PEGコポリマー、ポリ-L-リシン、ポリエチレンイミンのコポリマー、ポリ(α-L-グルタミン酸)(PGA)、生分解性ジアミド−ジアミンポリマー、又はエストラジオールなどのステロイド、又はコレステロールが挙げられる。R5はまた、C1-4アルキル、OH、NH2又はハライドのうちの1つ又は複数で任意に置換されたカルボランとし得る。
【0022】
本発明の化合物を1つ又は複数の生体適合性ポリマーで誘導体化することができ、かかる誘導体化された化合物も本発明に含まれることは、当業者には理解されよう。そのような誘導体化は、官能部分を有する式Iの任意の位置で起こすことができる。そのような成分の例としては、-CO2H、OH、Br、-CH=CH-、C=O、NH2等が挙げられる。
【0023】
第1の態様のより好ましい実施形態では、
R1は、C1-4アルキル、より好ましくはメチルであるか、又はハライド、より好ましくはBrであり、
R2は、CO2R5で任意に置換されたC1-4アルキルであるか、又はハライド、より好ましくはBrであり、
R3は、C6-12アリール、好ましくはCO2R5若しくはOR5で任意に置換されたフェニルであるか、又はハライド、好ましくはBrであり、
R5は、先に定義した生体適合性ポリマーであることが好ましい。
【0024】
癌、好ましくは固形腫瘍及び/又は転移、の予防及び/又は治療のために、本発明の第1の態様の化合物が提供される。本発明の化合物は、リンパ腫及び皮膚癌の予防及び/又は治療のために提供される。当該腫瘍は、扁平上皮細胞癌、メルケル細胞癌及び基底細胞癌をはじめとする悪性黒色腫のような皮膚癌、肺癌、頭部及び頸部腫瘍、骨癌、前立腺癌、腸癌、頸部癌、乳癌、脳腫瘍、肝臓癌、又は膵臓癌であり得る。当該化合物はまた、外科法と組み合わせて用いることで、腫瘍サイズの減少及び正常組織の損失低下の手助けとなる。
【0025】
本発明の化合物は、それを必要としている被験者のために提供される。当該被験者は、人間あるいはペット、動物園の動物、若しくは飼育動物のような家畜をはじめとする哺乳動物であり得る。詳細には、当該化合物は、ネコ、イヌ、ウマ、ウシ、ブタ、ヤギ、ヒツジ、鳥、霊長類、象、又はネコ科の動物などの動物の治療に用いることができる。
【0026】
本発明は、光子活性化療法による癌の治療に制限されるものではなく、組織を壊死させるのに光子活性化療法が必要となる任意の方法に利用することができる。本発明のかかる目的のために、用語「細胞死」には、組織壊死も包含される。光子活性化療法の恩恵を受ける疾患の例として、不妊症、非転移性良性腫瘍、子宮繊維腫、喘息、乳線種、menohrragina、良性前立腺過形成、及び選択的心臓構造(selective cardiac structure)の破壊又はクロット(clot)が挙げられる。光子活性化療法はまた、手術、光線力学療法、凍結手術、熱レーザ融除及び蒸気療法にとって組織壊死が望ましい場合に用いることができる。さらに、本発明の化合物は、動脈硬化のような血管疾患、年齢に伴う筋変性疾患のような他の疾患の治療のために提供される。
【0027】
本発明の目的において、「細胞死」には、細胞の破壊と、細胞の損傷若しくは劣化の両方が包含される。本発明の目的においては、腫瘍組織や細胞はPAT後に体内から除去される必要はないが、用語「細胞死」には、細胞融除も包含される。細胞の劣化は、永久的なものでも、一時的なものでもよい。
【0028】
本発明の第2の態様では、式(I)の化合物が提供される。
【0029】
【化17】

【0030】
式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、C1-6アルキル、ハライド、SO3R4、NO2、又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-6アルキル、C1-6ハロアルキル、NO2、C3-12アリール、C3-12ヘテロアリール、C1-6アルコキシ、C3-12アリールオキシ、又はC3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、R5、C3-12アリール、OR5、NR6、SO3R4、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールであり;R6は、水素又はC1-6アルキルであり;R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。但し、R1及びR2の両方が臭素であるか、又は両方が塩素である場合、R3は、水素、又はF、Br、CO2Me、CO2Et、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2が臭素又は塩素である場合、R3はF、Br、CO2Me、CO2Et、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2の両方が水素である場合、R3はCl、Br、F、Cf3、又はCl若しくはFで置換されたフェニルではなく;
R1が水素であり、R3がフェニルである場合、R2はNO2、Cl又はCH2OHではなく;
R2が水素であり、R1がNO2である場合、R3はメチルで置換されたフェニルではなく;
R2が水素であり、R1がFである場合、R3は水素ではなく;
R1及びR2が両方エチルである場合、R3はNO2ではない。
【0031】
第2の態様の好ましい実施形態では、R1基の1つ又は複数は、電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3又は4個が、ハライドである。
【0032】
第2の態様のさらに好ましい実施形態では、R2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R2基の2、3、又は4個が、ハライドである。
【0033】
第2の態様のさらに好ましい実施形態では、R3基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R3基の2、3、又は4個が、ハライドである。
【0034】
第2の態様の好ましい実施形態では、R1基の1つ又は複数及びR2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3、又は4個と、R2基の2、3、又は4個とは、ハライドである。
【0035】
本発明の第1及び第2の態様のために好ましい化合物は以下のものである。
【0036】
【化18】

【0037】
【化19】

【0038】
【化20】

【0039】
【化21】

【0040】
【化22】

【0041】
本発明のさらに好ましい化合物は、以下のものである。
【0042】
【化23】

【0043】
式中、R11は、NH2で置換されたフェニル又はベンジルであり、R12は、NO2又は
【0044】
【化24】

【0045】
で置換されたフェニルである。
【0046】
【化25】

【0047】
式中、Rは、OH、NH2、MeO若しくはCO2Meで置換されたフェニルであるか;又はベンジル、ピリジル、(CH2)17CH3、水素、又はステロイドである。
【0048】
【化26】

【0049】
式中、nは1〜20、好ましくは2〜15、より好ましくは2、3、4、5、6、7、8、9、10、11、12又は13である。
【0050】
【化27】

【0051】
式中、R13は、(CH2)5CH3、(CH2)5CH2OH、又はエストラジオールである。
【0052】
【化28】

【0053】
式中、R14は、Br、水素、メチル又はN(CH3)2であり、R15は、H又はOMeであり、R16はメチルである。
【0054】
【化29】

【0055】
式中、Xは、CH2、O、OCH2であるか、又は存在しない。
【0056】
【化30】

【0057】
【化31】

【0058】
式中、R15は、4-(1-メチル-o-カルボラニルメチル)である。
【0059】
上記の好ましい化合物はまた、金属との組み合わせにおいて提供され、この場合、金属は、V、Ga、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb、Al、又はPtとし得、好ましくは、Au、Zn、Fe、Cr、Sn、Ni、Pt、V、Al、Co、Mn、Cu、又はPdである。
【0060】
本発明の第3の態様では、本発明の第1の態様で定義した化合物と、製薬的に許容し得る添加剤とを含んで成る製薬組成物が提供される。
【0061】
既知の方法に従って式(I)の化合物を調合することができ、そして式(I)の化合物を製薬的に許容し得る担体と組み合わせて混合物とすることにより、製薬的に有用な組成物を製造することができる。生じた組成物は、被験者により許容されれば、製薬的に許容し得る。適切な担体の例は当業者には知られており、また、RemingtonのPharmaceutical Sciences(ペンシルバニア州イーストンのMaack Publishing社)に記載されている。
【0062】
本発明の第4の態様は、光子活性化療法による細胞融除のための、本発明の第2の態様において定義した式(I)の化合物に関する。
【0063】
本発明の第5の態様では、ポルフィリン化合物をハロゲン化することを包含する、式(I)の化合物の製造方法が提供される。式(I)の化合物を調製するのに用いることができる試薬の例には、臭素分子及びN-ブロモスクシンイミド(NBS)などの臭化剤が含まれる。塩素化剤としては、N-クロロスクシンイミドが挙げられる。
【0064】
本発明の第6の態様では、本発明の第1の態様において定義した式(I)の化合物を、それを必要としている被験者に投与することを包含する、光子活性化療法による細胞死の方法が提供される。
【0065】
式(I)の化合物の投薬量は、患者の年齢、体重、身長、性別、医学的状態、過去の医学的履歴のような因子のみならず、治療しようとする疾患の部位や程度、ターゲット部位における本発明の化合物の蓄積の程度や速度、複合物の取り込みの程度や速度、式(I)の化合物の除去速度などの因子に応じて変化されよう。
【0066】
被験者に投与される式(I)の化合物の量は、治療効果のある量でなければならない。即ち、それは、X線の照射時に細胞の損傷若しくは壊死を引き起こすのに十分な量で存在しなければならない。
【0067】
腫瘍組織内部の薬剤量は、細胞死をもたらすのに十分な量である必要がある。これを達成するためには、投薬量は、0.1mg/kg〜100mg/kg、好ましくは1mg〜50mg/kg、より好ましくは5mg/kg〜25mg/kgの範囲である。当該化合物は、理想的には、腫瘍組織内部に均一に分配される。当該化合物の腫瘍:周囲組織選択比は、500:1、好ましくは100:1、より好ましくは20:1〜1:1である。腫瘍組織中の化合物量は、ならすと、0.1μg〜200μg−腫瘍組織中の化合物/gである。これらの減少しやすいポルフィリン(電子求引性基を備えたポルフィリン)は、イオン化放射線と共に用いることができる。イオン化放射線は、外部源(例えば、従来の放射線治療リニアアクセラレータ、炭素イオンのような重イオンビーム、ガンマナイフ、電子ビーム、陽子ビーム、高速中性子ビーム)から照射したり、又はイリジウム192シード、パラジウム103シード、ヨウ素125シード、ラジウム226シード、セシウム137シード、コバルト60シード、金198シード、ストロンチウム90シード、イットリウム90シードのような従来の放射性シードを用いて腫瘍組織内部に適用することができる(Brachytherapy)。
【0068】
本発明の化合物は、陽子療法、非陽子療法、パイ中間子療法、放射免疫療法、電子線療法、並びに従来の放射線療法と共に用いることができる。
【0069】
薬剤物質は、照射処理前に患者に投与することができる。通常、薬剤は、放射線処理前、10−180分乃至48−96時間の範囲において投与することができる。腫瘍組織内部に治療効果のある量が維持されるように、薬剤は、毎日、又は5−21日、好ましくは7−10日のような定期間隔若しくは不定期間隔にて投与することができる。例えば、従来の放射線治療薬は、4〜6週間の間、1週間に5日毎日投与される。当該化合物はまた、連続超加速放射線治療(CHART)として知られる、異形の従来型放射線療法において用いることもできる。例えば、11日間にわたって、1.2Gy〜1.5Gyの分割放射線をおよそ39回適用することができる。当該化合物はまた、強度変調放射線治療(IMRT)と共に用いることができる。IMRTは、所与の領域にわたって放射線量を変化させることによって、ターゲットへとX線を正確に与える技術である。
【0070】
本発明の目的のために、薬剤投与の形態は、静脈、経口、腹腔内、粘膜、経皮、経膣若しくは経口である。
【0071】
本発明の目的のために有用なX線総量は、およそ0.1Gy〜200Gy、好ましくは1Gy〜120Gy、より好ましくは15Gy〜100Gyである。分割X線量は、0.1〜10Gy、好ましくは0.5Gy〜3Gy、より好ましくは0.5Gy〜2Gyである。分割総数は、1〜100回、好ましくは1〜70回、より好ましくは1〜40回である。放射線は、1〜100日間、好ましくは1〜70日間、より好ましくは1〜40日間照射される。
【0072】
当該化合物は、従来の放射線治療、過分割加速放射線治療及び強度変調放射線治療に特に有用である。
【0073】
好ましいイオン化源は、X線である。本発明の目的のために有用なX線は、およそ10keV〜1000MeVのエネルギーを有し、好ましい範囲は100keV〜50MeVであり、より好ましい範囲は1MeV〜20MeVである。
【0074】
以下の非限定的な例を参照することによって、本発明を説明することとする。
【0075】
例
5,10,15,20-テトラフェニル-21H,23H-ポルフィリン
5,10,15,20-テトラフェニル-21H,23H-ポルフィリン(600mg、0.976mmol)をCCl4(80ml)中に含有して成る撹拌溶液に、臭素(1.55ml、30mmol)をCCl4(20ml)中に含有して成る溶液を20分かけて滴下添加し、生じた混合物を1時間撹拌した。当該混合物をジクロロメタン(100ml)で希釈し、10%メタ重亜硫酸ナトリウム水溶液(100ml)で洗浄した。有機層を収集し、ブラインで洗浄し、乾燥させ(MgSO4)、溶媒を蒸発させた。
【0076】
細胞増殖の阻害
当該化合物は、動物及びヒトの腫瘍細胞株培養物(ヒト乳癌細胞株(MCF−7、ZR−75−1)、マウスアンドロゲン依存性のShionogi乳癌(SC115)細胞株、ヒト腸腫瘍細胞株HT29及びSW480)を用いたin vitro細胞培養において、細胞増殖を抑制するための前処理剤として用いる。暗毒性及びX線+薬剤化合物によって、ハロゲン化化合物が活性化され、基準IC50値により測定されるように、細胞増殖が著しく低下することが示された。滴定試験によって、X線+薬剤研究において用いるのに必要とされる薬剤量の指針がもたらされる。X線の一回照射及び分割照射を用いて、分割照射50〜70Gyに相当する、典型的に25Gy、35Gy、45Gyへと基準を合わせた。分割照射試験は、2〜5日間にわたって、1回当たり1〜2Gyにて実施した。増殖の低下は、100%〜10%であり、典型的に85%〜95%の阻害が確認された。
【0077】
治療効果の実験評価では、ハロゲン化化合物の存在下、腫瘍を有する動物に局部照射した。投薬プロトコル及び投薬後の照射開始時期は、予め行った薬物動態学試験及び生体分布試験により決定した。評価は、腫瘍容積の変化、腫瘍融除率、及び長期寿命を定量化して行った。比較のために、また、RBE/CBE因子の算出を可能とするために、段階的なX線量並びに熱線のみの照射を行った。
【0078】
In vivo試験:これらは、例えばヒト異種移植腫瘍神経膠種U343、前立腺癌pc−3、頭部及び頸部扁平上皮癌−pharynx htb−43 fadu、乳癌htb−19、エストロゲン非依存性転移乳癌、ヒト腸癌t−84、肺扁平上皮癌mri−h−165を用いて、標準の齧歯類動物腫瘍モデルにて実施した。
【0079】
Balb/cマウスにおける重さ16〜22gのマウス乳腺肉腫EMT6腫瘍モデルを用いて、生体分布並びに化合物活性を実証した。腫瘍は、直径7〜9mmに達し得た。化合物は、例えば、5%cremophore EL、3%エタノール及び3%PEG800溶液、又は5%cremophore EL及び3%エタノール/生理食塩水に入れて、静脈若しくは腹腔内投与する。50〜100mg/mlの薬剤濃度を用いる。薬剤投与後2時間、12時間、24時間、及び48時間、腫瘍は、1回又は複数回の照射を受けることができる。平均線量率は、100〜200cGy/分である。腫瘍サイズを、照射前後で測定する。1回照射では、25、35及び45Gyを用いる。
【0080】
標準的な方法を用いて、照射処理された正常組織及び腫瘍に関して、標準的な組織病理学的分析を実施する。動物は、10%緩衝生理食塩水を用いて灌流固定される。
【0081】
プロビット分析を用いて、種々の終点を用いる線量反応データを評価し、そしてED50及びTCP50値を近似曲線から得る。これらの値を用いて、RBE/CBE因子値を算出する。全ての試験において、適切な比較対照グループを用いる。治療効果実験では、Kaplan−Meier法を用いて、生存割合対照射後時間を分析する。非統計的技術Wilcoxin 2−Sample Testによる比較のために、各実験グループの生存時間を順序だてて並べランク付けする。
【0082】
結果:上記実験によって、本発明の化合物が腫瘍内に蓄積し且つ1〜2日間で血液から除去されることが示された。X線照射のみでは、およそ30%が腫瘍フリーとなったが、ハロゲン化化合物+X線照射による治療によれば、40〜100日後には40%〜>90%が腫瘍フリーとなった。腫瘍フリーの数や腫瘍制御レベルは、化合物の効果及び用いられるX線量の関数である。
【0083】
患者の治療:当該化合物を用いて、放射線治療を受ける全患者について前処置した。患者は、一連の放射線治療(従来型の放射線治療、CHART又はIMRT)の前に薬剤物質を投与され、放射線治療過程が完了するまで、必要とされる際に投与される。従来型の放射線治療では、標準の4〜10MeVの放射線治療リニアアクセラレータを用いて、1回当たりおよそ2Gyを週に5日与えられ、4〜6週間の期間にかけて50Gy〜60Gyの線量のX線が与えられる。CHARTを利用する場合には、治療期間中、毎日、1日当たり平均3.5回、1回当たり1.2〜1.5Gyにて合計線量50〜60Gy与えるように、放射線治療を11日間続ける。上記薬剤化合物を用いると、著しく治療結果が改善される。これは、放射線治療のみの処置に対し、20〜80%あるいはより高い改善である。
【図面の簡単な説明】
【0084】
【図1】%腫瘍フリーに関する、本発明の化合物の投与効果
【技術分野】
【0001】
本発明は、光子活性化療法用の改善された組成物、並びに腫瘍等のターゲット細胞を死滅させる際のその使用法を提供する。本発明の手段及び方法によって、臨床用途のための光子活性化療法の最適化が可能となる。
【背景技術】
【0002】
癌の治療には、種々の並行療法が用いられる。通常、これらの療法では2つのステップが必要となり、まずはじめに、製薬的に不活性な薬剤を患者に投与し、体内のターゲット部位に到達させる。次に、不活性種を、ターゲット細胞を死滅させる毒性種へと活性化させる。当分野で既知のかかる並行療法としては、光線力学療法(PDT)、ホウ素中性子捕捉療法(BNCT)、及び放射線増感が挙げられる。療法の生物学的影響が照射領域全体へと拡がり且つ所望の効果をもたらすべく破壊的なイオン化軌道を生成するために高い照射量が必要とされる従来の放射線療法に対し、これらの並行療法は利点をもたらす。
【0003】
光子活性化療法は、放射線増感の一態様である。一般に、それは、ターゲット細胞内に蓄積する製薬的に不活性な薬剤を用いる。当該薬剤は、ターゲット細胞及び周囲組織へのX線照射によりin vivoにて活性化される。
【発明の開示】
【発明が解決しようとする課題】
【0004】
ガドリニウムテクスフリン(gadolinium teaxfrin)は、光子活性化療法を利用する脳腫瘍の治療のために開発された。全脳照射して薬剤を活性化させ、患者を神経発芽に関しモニタする。イオン化放射線によるガドリニウムテクスフリンの活性化によって、細胞及び細胞器官に対し高い有害性を示す短命の細胞毒性ラジカルが生成される。従って、周囲の細胞及び組織に対する望ましくない損傷を最小限としつつ利用することのできる光子活性化療法薬剤が、当分野で必要とされている。
【0005】
ポルフィリンは、前々から薬剤中に用いられてきた。これらの化合物は、ほ乳動物の腫瘍組織に高い親和性を示し、PDTにおいて利用されてきた。しかしながら、ポルフィリンの臨床的な使用は、ポルフィリンを活性化させるのに必要な可視光の不十分な透過力により制限されてきた。
【課題を解決するための手段】
【0006】
本発明は、イオン化放射線により活性化されると安定で長寿命のラジカルをもたらすことのできるポルフィリン誘導体を提供する。ハロゲン化ポルフィリンは、その配座並びに光物性や化学特性が変化する。例えば、メソテトラフェニルポルフィリンのピロール環位置を8つの臭素原子で置換すると、酸化ポテンシャルが550mVシフトする。この酸化ポテンシャルの増大により、ハロゲン化ポルフィリンの酸化劣化に対する耐性は高まり、光子活性化療法に用いることが可能となるものと考えられる。これらのポルフィリンは、触媒又は非線形吸収物質として用いることができる。かかる安定で長寿命のラジカルの生成により、薬剤を活性化させるのに必要とされる有害な照射の量を低減させることができる。当該薬剤はまた、BNCTなどの他の技術にとって必要となる濃度よりも低い濃度にて供給することができる。組織毒性が低く、腫瘍選択性が高く、且つ血液から迅速に排除されるため、本発明の化合物の使用はin vivoにおいて多くの利点をもたらす。さらに、ハロゲン化ポルフィリンは、X線と組み合わされる際に効果が高まり、腫瘍組織に選択性を示す。
【発明を実施するための最良の形態】
【0007】
従って、本発明の第1の態様では、光子活性化療法による細胞死のための製薬組成物の製造における式(I)の化合物の使用が提供される。
【0008】
【化16】

【0009】
式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;
C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、ハライド、SO3R4、NO2、C1-6アルキル又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-6ハロアルキル、C3-12アリール若しくはC3-12ヘテロアリール、C1-20アルキルオキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C3-12アリールオキシ、C3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アルケニル、アルケニルオキシ、アルキニル、アルキニルオキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、アリール、R5、OR5、NR62、SO3R4、NO2、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、C6-12アリール、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールで任意に置換されており;R6は、水素又はC1-6アルキルであり、R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Ga、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。第1の態様の好ましい実施形態では、金属は、Au、Pb、又はX線照射時に電子シャワーを生成する他の任意の金属である。前記電子シャワーの生成によって、本発明の化合物の効果が高まる。
【0010】
第1の態様の好ましい実施形態では、R1基の1つ又は複数は、ハライド又はNO2のような電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3又は4個が、ハライドである。当業者であれば、R1を任意の電子求引性基とし得ることは理解されよう。R1基は、ハライド基と同程度の電気陰性をもたらすのが好ましい。
【0011】
第1の態様のさらに好ましい実施形態では、R2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R2基の2、3、又は4個が、ハライドである。
【0012】
第1の態様のさらに好ましい実施形態では、R3基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R3基の2、3、又は4個が、ハライドである。
【0013】
第1の態様の好ましい実施形態では、R1基の1つ又は複数及びR2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3、又は4個と、R2基の2、3、又は4個とは、ハライドである。
【0014】
第1の態様の好ましい実施形態では、本発明の化合物は、4、5、6、7、8、9又は10個のハロゲン原子、好ましくは8個のハロゲン原子で置換されており、この場合、前記ハロゲン原子はBrであるのが好ましい。
【0015】
本発明の目的のために、アルキルは、直鎖及び分岐鎖両方の、炭素数1〜20、好ましくは炭素数1〜8、より好ましくは炭素数1〜6、最も好ましくは炭素数1〜4のアルキル基を意味し、限定はしないが、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、sec-ブチル、イソブチル、tert-ブチルが挙げられる。用語アルキルはまた、シクロアルキルも包含し、それには、限定はしないが、シクロプロピル、シクロブチル、CH2-シクロプロピル、CH2-シクロブチルが含まれる。
【0016】
ハロアルキルは、1つ又は複数のハロゲン原子で置換された、炭素数1〜8の、好ましくは炭素数1〜4のアルキル基を表し、例えば、CH2CH2Br、CF3又はCCl3がある。
【0017】
用語「アルケニル」は、1つ又は複数の炭素−炭素二重結合を含有する、炭素数2〜20、好ましくは2〜8、より好ましくは炭素数2〜6、最も好ましくは炭素数2〜4の直鎖若しくは分岐鎖アルケニル基を意味し、限定はしないが、エチレン、n-プロピル-1-エン、n-プロピル-2-エン、イソプロピレン等が挙げられる。「アルキニル」は、炭素数2〜20、好ましくは炭素数2〜8、より好ましくは炭素数2〜6、最も好ましくは炭素数2〜4の直鎖若しくは分岐鎖アルキニル基を意味し、限定はしないが、エチニル、2-メチルエチニルが挙げられる。本発明のアルキル、アルケニル及び/又はアルキニル基は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19又は20個の炭素原子から構成することができる。
【0018】
「アリール」は、3−12員の芳香族炭化水素、好ましくは、1つの環を含有するか又は1つ若しくは複数の飽和環あるいは不飽和環と縮合している、5員若しくは6員の炭化水素を意味し、限定はしないが、フェニル、ナフチル、アントラセニル又はフェナントラセニルが挙げられる。
【0019】
「ヘテロアリール」は、3〜12員の芳香族アリール、好ましくは、N、O若しくはSから選択される1つあるいは複数のヘテロ原子を含有し、且つ1つの環を含有するか又は1つ若しくは複数の飽和環あるいは不飽和環と縮合している、5員若しくは6員の炭化水素を意味する。当該ヘテロアリールは、完全に飽和していても、部分的に飽和していても、又は不飽和であってもよい。アリール基又はヘテロアリール基の例として、限定はしないが、フェニル、アクリジン、ベンズイミダゾール、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンゾチアゾール、カルバゾール、シンノリン、ジオキシン、ジオキサン、ジオキソラン、ジチアン、ジチアジン、ジチアゾール、ジチオラン、フラン、イミダゾール、イミダゾリン、イミダゾリジン、インドール、インドリン、インドリジン、インダゾール、イソインドール、イソキノリン、イソキサゾール、イソチアゾール、モルホリン、ナフチリジン、オキサゾール、オキサジアゾール、オキサチアゾール、オキサチアゾリジン、オキサジン、オキサジアジン、フェナジン、フェノチアジン、フェノキサジン、フタラジン、ピペラジン、ピペリジン、プテリジン、プリン、ピラン、ピラジン、ピラゾール、ピラゾリン、ピラゾリジン、ピリダジン、ピリジン、ピリミジン、ピロール、ピロリジン、ピロリン、キノリン、キノキサリン、キナゾリン、キノリジン、テトラヒドロフラン、テトラジン、テトラゾール、チオフェン、チアジアジン、チアジアゾール、チアトリアゾール、チアジン、チアゾール、チオモルホリン、チアナフタレン、チオピラン、トリアジン、トリアゾール、又はトリチアンが挙げられる。
【0020】
ハロゲンは、F、Cl、Br又はIを意味し、好ましくはBr又はClである。
【0021】
第1の態様の好ましい実施形態では、基R5は、生体適合性ポリマーである。生体適合性ポリマーの存在によって、本発明の化合物の物理的特性及び化学的特性を変化させることができる。かかる生体適合性ポリマーの存在によって、例えば、水溶性を高めたり、腫瘍ターゲット能を高めたり、また、例えば、血液細胞及び/又は血小板への干渉を軽減及び/又は防止することによって、又は肝臓、脾臓、骨髄及び/又は肺中への当該化合物の蓄積を低減させることによって、毒性プロファイルを低減させることができる。かかる生体適合性ポリマーの例として、N-(2-ヒドロキシプロピル)メタクリルアミド(HPMAコポリマー)−ペンダント鎖、ポリエチレングリコール(PEG)、エチレングリコールコポリマー、多糖、例えばデキストリン、デキストランキトサン(N-スクシニルキトサン)、カルボキシメチルキチン、カルボキシメチルプルラン、アルギネート、ポリ(アミノ酸)、ポリ[N-(2-ヒドロキシエチル)-L-グルタミン] PHEG、β-ポリ(2-ヒドロキシエチルアスパルトアミド) PHEA、ポリ(グルタミン酸)、ポリ(アスパラギン酸)、ポリリシン(ポリ(L-リシン)ポリエステル、ポリ(α若しくはβ-マレイン酸)、交互ポリマー(alternating polymer)、PEGリシン、ブロックコポリマー、ポリ(エチレングリコール−アスパルテート)、スチレンと無水マレイン酸とのコポリマー、ポリガラクツロン酸、ヒドロキシアルキル(メタ)アクリレートのコポリマー、例えばN-フェニルピロリドン、ポリ(L-グルタミン酸及びヒドロキシエチル-L-グルタミン)、ポリ(α-リンゴ酸)、ポリアスパラギン酸−PEGコポリマー、ポリ-L-リシン、ポリエチレンイミンのコポリマー、ポリ(α-L-グルタミン酸)(PGA)、生分解性ジアミド−ジアミンポリマー、又はエストラジオールなどのステロイド、又はコレステロールが挙げられる。R5はまた、C1-4アルキル、OH、NH2又はハライドのうちの1つ又は複数で任意に置換されたカルボランとし得る。
【0022】
本発明の化合物を1つ又は複数の生体適合性ポリマーで誘導体化することができ、かかる誘導体化された化合物も本発明に含まれることは、当業者には理解されよう。そのような誘導体化は、官能部分を有する式Iの任意の位置で起こすことができる。そのような成分の例としては、-CO2H、OH、Br、-CH=CH-、C=O、NH2等が挙げられる。
【0023】
第1の態様のより好ましい実施形態では、
R1は、C1-4アルキル、より好ましくはメチルであるか、又はハライド、より好ましくはBrであり、
R2は、CO2R5で任意に置換されたC1-4アルキルであるか、又はハライド、より好ましくはBrであり、
R3は、C6-12アリール、好ましくはCO2R5若しくはOR5で任意に置換されたフェニルであるか、又はハライド、好ましくはBrであり、
R5は、先に定義した生体適合性ポリマーであることが好ましい。
【0024】
癌、好ましくは固形腫瘍及び/又は転移、の予防及び/又は治療のために、本発明の第1の態様の化合物が提供される。本発明の化合物は、リンパ腫及び皮膚癌の予防及び/又は治療のために提供される。当該腫瘍は、扁平上皮細胞癌、メルケル細胞癌及び基底細胞癌をはじめとする悪性黒色腫のような皮膚癌、肺癌、頭部及び頸部腫瘍、骨癌、前立腺癌、腸癌、頸部癌、乳癌、脳腫瘍、肝臓癌、又は膵臓癌であり得る。当該化合物はまた、外科法と組み合わせて用いることで、腫瘍サイズの減少及び正常組織の損失低下の手助けとなる。
【0025】
本発明の化合物は、それを必要としている被験者のために提供される。当該被験者は、人間あるいはペット、動物園の動物、若しくは飼育動物のような家畜をはじめとする哺乳動物であり得る。詳細には、当該化合物は、ネコ、イヌ、ウマ、ウシ、ブタ、ヤギ、ヒツジ、鳥、霊長類、象、又はネコ科の動物などの動物の治療に用いることができる。
【0026】
本発明は、光子活性化療法による癌の治療に制限されるものではなく、組織を壊死させるのに光子活性化療法が必要となる任意の方法に利用することができる。本発明のかかる目的のために、用語「細胞死」には、組織壊死も包含される。光子活性化療法の恩恵を受ける疾患の例として、不妊症、非転移性良性腫瘍、子宮繊維腫、喘息、乳線種、menohrragina、良性前立腺過形成、及び選択的心臓構造(selective cardiac structure)の破壊又はクロット(clot)が挙げられる。光子活性化療法はまた、手術、光線力学療法、凍結手術、熱レーザ融除及び蒸気療法にとって組織壊死が望ましい場合に用いることができる。さらに、本発明の化合物は、動脈硬化のような血管疾患、年齢に伴う筋変性疾患のような他の疾患の治療のために提供される。
【0027】
本発明の目的において、「細胞死」には、細胞の破壊と、細胞の損傷若しくは劣化の両方が包含される。本発明の目的においては、腫瘍組織や細胞はPAT後に体内から除去される必要はないが、用語「細胞死」には、細胞融除も包含される。細胞の劣化は、永久的なものでも、一時的なものでもよい。
【0028】
本発明の第2の態様では、式(I)の化合物が提供される。
【0029】
【化17】

【0030】
式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、C1-6アルキル、ハライド、SO3R4、NO2、又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-6アルキル、C1-6ハロアルキル、NO2、C3-12アリール、C3-12ヘテロアリール、C1-6アルコキシ、C3-12アリールオキシ、又はC3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、R5、C3-12アリール、OR5、NR6、SO3R4、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールであり;R6は、水素又はC1-6アルキルであり;R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。但し、R1及びR2の両方が臭素であるか、又は両方が塩素である場合、R3は、水素、又はF、Br、CO2Me、CO2Et、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2が臭素又は塩素である場合、R3はF、Br、CO2Me、CO2Et、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2の両方が水素である場合、R3はCl、Br、F、Cf3、又はCl若しくはFで置換されたフェニルではなく;
R1が水素であり、R3がフェニルである場合、R2はNO2、Cl又はCH2OHではなく;
R2が水素であり、R1がNO2である場合、R3はメチルで置換されたフェニルではなく;
R2が水素であり、R1がFである場合、R3は水素ではなく;
R1及びR2が両方エチルである場合、R3はNO2ではない。
【0031】
第2の態様の好ましい実施形態では、R1基の1つ又は複数は、電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3又は4個が、ハライドである。
【0032】
第2の態様のさらに好ましい実施形態では、R2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R2基の2、3、又は4個が、ハライドである。
【0033】
第2の態様のさらに好ましい実施形態では、R3基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R3基の2、3、又は4個が、ハライドである。
【0034】
第2の態様の好ましい実施形態では、R1基の1つ又は複数及びR2基の1つ又は複数は電子求引性基であり、好ましくはF、Cl、Br又はIから選択されるハライドであり、より好ましくはBr又はClであり、最も好ましくはBrである。より好ましくは、R1基の2、3、又は4個と、R2基の2、3、又は4個とは、ハライドである。
【0035】
本発明の第1及び第2の態様のために好ましい化合物は以下のものである。
【0036】
【化18】

【0037】
【化19】

【0038】
【化20】

【0039】
【化21】

【0040】
【化22】

【0041】
本発明のさらに好ましい化合物は、以下のものである。
【0042】
【化23】

【0043】
式中、R11は、NH2で置換されたフェニル又はベンジルであり、R12は、NO2又は
【0044】
【化24】

【0045】
で置換されたフェニルである。
【0046】
【化25】

【0047】
式中、Rは、OH、NH2、MeO若しくはCO2Meで置換されたフェニルであるか;又はベンジル、ピリジル、(CH2)17CH3、水素、又はステロイドである。
【0048】
【化26】

【0049】
式中、nは1〜20、好ましくは2〜15、より好ましくは2、3、4、5、6、7、8、9、10、11、12又は13である。
【0050】
【化27】

【0051】
式中、R13は、(CH2)5CH3、(CH2)5CH2OH、又はエストラジオールである。
【0052】
【化28】

【0053】
式中、R14は、Br、水素、メチル又はN(CH3)2であり、R15は、H又はOMeであり、R16はメチルである。
【0054】
【化29】

【0055】
式中、Xは、CH2、O、OCH2であるか、又は存在しない。
【0056】
【化30】

【0057】
【化31】

【0058】
式中、R15は、4-(1-メチル-o-カルボラニルメチル)である。
【0059】
上記の好ましい化合物はまた、金属との組み合わせにおいて提供され、この場合、金属は、V、Ga、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb、Al、又はPtとし得、好ましくは、Au、Zn、Fe、Cr、Sn、Ni、Pt、V、Al、Co、Mn、Cu、又はPdである。
【0060】
本発明の第3の態様では、本発明の第1の態様で定義した化合物と、製薬的に許容し得る添加剤とを含んで成る製薬組成物が提供される。
【0061】
既知の方法に従って式(I)の化合物を調合することができ、そして式(I)の化合物を製薬的に許容し得る担体と組み合わせて混合物とすることにより、製薬的に有用な組成物を製造することができる。生じた組成物は、被験者により許容されれば、製薬的に許容し得る。適切な担体の例は当業者には知られており、また、RemingtonのPharmaceutical Sciences(ペンシルバニア州イーストンのMaack Publishing社)に記載されている。
【0062】
本発明の第4の態様は、光子活性化療法による細胞融除のための、本発明の第2の態様において定義した式(I)の化合物に関する。
【0063】
本発明の第5の態様では、ポルフィリン化合物をハロゲン化することを包含する、式(I)の化合物の製造方法が提供される。式(I)の化合物を調製するのに用いることができる試薬の例には、臭素分子及びN-ブロモスクシンイミド(NBS)などの臭化剤が含まれる。塩素化剤としては、N-クロロスクシンイミドが挙げられる。
【0064】
本発明の第6の態様では、本発明の第1の態様において定義した式(I)の化合物を、それを必要としている被験者に投与することを包含する、光子活性化療法による細胞死の方法が提供される。
【0065】
式(I)の化合物の投薬量は、患者の年齢、体重、身長、性別、医学的状態、過去の医学的履歴のような因子のみならず、治療しようとする疾患の部位や程度、ターゲット部位における本発明の化合物の蓄積の程度や速度、複合物の取り込みの程度や速度、式(I)の化合物の除去速度などの因子に応じて変化されよう。
【0066】
被験者に投与される式(I)の化合物の量は、治療効果のある量でなければならない。即ち、それは、X線の照射時に細胞の損傷若しくは壊死を引き起こすのに十分な量で存在しなければならない。
【0067】
腫瘍組織内部の薬剤量は、細胞死をもたらすのに十分な量である必要がある。これを達成するためには、投薬量は、0.1mg/kg〜100mg/kg、好ましくは1mg〜50mg/kg、より好ましくは5mg/kg〜25mg/kgの範囲である。当該化合物は、理想的には、腫瘍組織内部に均一に分配される。当該化合物の腫瘍:周囲組織選択比は、500:1、好ましくは100:1、より好ましくは20:1〜1:1である。腫瘍組織中の化合物量は、ならすと、0.1μg〜200μg−腫瘍組織中の化合物/gである。これらの減少しやすいポルフィリン(電子求引性基を備えたポルフィリン)は、イオン化放射線と共に用いることができる。イオン化放射線は、外部源(例えば、従来の放射線治療リニアアクセラレータ、炭素イオンのような重イオンビーム、ガンマナイフ、電子ビーム、陽子ビーム、高速中性子ビーム)から照射したり、又はイリジウム192シード、パラジウム103シード、ヨウ素125シード、ラジウム226シード、セシウム137シード、コバルト60シード、金198シード、ストロンチウム90シード、イットリウム90シードのような従来の放射性シードを用いて腫瘍組織内部に適用することができる(Brachytherapy)。
【0068】
本発明の化合物は、陽子療法、非陽子療法、パイ中間子療法、放射免疫療法、電子線療法、並びに従来の放射線療法と共に用いることができる。
【0069】
薬剤物質は、照射処理前に患者に投与することができる。通常、薬剤は、放射線処理前、10−180分乃至48−96時間の範囲において投与することができる。腫瘍組織内部に治療効果のある量が維持されるように、薬剤は、毎日、又は5−21日、好ましくは7−10日のような定期間隔若しくは不定期間隔にて投与することができる。例えば、従来の放射線治療薬は、4〜6週間の間、1週間に5日毎日投与される。当該化合物はまた、連続超加速放射線治療(CHART)として知られる、異形の従来型放射線療法において用いることもできる。例えば、11日間にわたって、1.2Gy〜1.5Gyの分割放射線をおよそ39回適用することができる。当該化合物はまた、強度変調放射線治療(IMRT)と共に用いることができる。IMRTは、所与の領域にわたって放射線量を変化させることによって、ターゲットへとX線を正確に与える技術である。
【0070】
本発明の目的のために、薬剤投与の形態は、静脈、経口、腹腔内、粘膜、経皮、経膣若しくは経口である。
【0071】
本発明の目的のために有用なX線総量は、およそ0.1Gy〜200Gy、好ましくは1Gy〜120Gy、より好ましくは15Gy〜100Gyである。分割X線量は、0.1〜10Gy、好ましくは0.5Gy〜3Gy、より好ましくは0.5Gy〜2Gyである。分割総数は、1〜100回、好ましくは1〜70回、より好ましくは1〜40回である。放射線は、1〜100日間、好ましくは1〜70日間、より好ましくは1〜40日間照射される。
【0072】
当該化合物は、従来の放射線治療、過分割加速放射線治療及び強度変調放射線治療に特に有用である。
【0073】
好ましいイオン化源は、X線である。本発明の目的のために有用なX線は、およそ10keV〜1000MeVのエネルギーを有し、好ましい範囲は100keV〜50MeVであり、より好ましい範囲は1MeV〜20MeVである。
【0074】
以下の非限定的な例を参照することによって、本発明を説明することとする。
【0075】
例
5,10,15,20-テトラフェニル-21H,23H-ポルフィリン
5,10,15,20-テトラフェニル-21H,23H-ポルフィリン(600mg、0.976mmol)をCCl4(80ml)中に含有して成る撹拌溶液に、臭素(1.55ml、30mmol)をCCl4(20ml)中に含有して成る溶液を20分かけて滴下添加し、生じた混合物を1時間撹拌した。当該混合物をジクロロメタン(100ml)で希釈し、10%メタ重亜硫酸ナトリウム水溶液(100ml)で洗浄した。有機層を収集し、ブラインで洗浄し、乾燥させ(MgSO4)、溶媒を蒸発させた。
【0076】
細胞増殖の阻害
当該化合物は、動物及びヒトの腫瘍細胞株培養物(ヒト乳癌細胞株(MCF−7、ZR−75−1)、マウスアンドロゲン依存性のShionogi乳癌(SC115)細胞株、ヒト腸腫瘍細胞株HT29及びSW480)を用いたin vitro細胞培養において、細胞増殖を抑制するための前処理剤として用いる。暗毒性及びX線+薬剤化合物によって、ハロゲン化化合物が活性化され、基準IC50値により測定されるように、細胞増殖が著しく低下することが示された。滴定試験によって、X線+薬剤研究において用いるのに必要とされる薬剤量の指針がもたらされる。X線の一回照射及び分割照射を用いて、分割照射50〜70Gyに相当する、典型的に25Gy、35Gy、45Gyへと基準を合わせた。分割照射試験は、2〜5日間にわたって、1回当たり1〜2Gyにて実施した。増殖の低下は、100%〜10%であり、典型的に85%〜95%の阻害が確認された。
【0077】
治療効果の実験評価では、ハロゲン化化合物の存在下、腫瘍を有する動物に局部照射した。投薬プロトコル及び投薬後の照射開始時期は、予め行った薬物動態学試験及び生体分布試験により決定した。評価は、腫瘍容積の変化、腫瘍融除率、及び長期寿命を定量化して行った。比較のために、また、RBE/CBE因子の算出を可能とするために、段階的なX線量並びに熱線のみの照射を行った。
【0078】
In vivo試験:これらは、例えばヒト異種移植腫瘍神経膠種U343、前立腺癌pc−3、頭部及び頸部扁平上皮癌−pharynx htb−43 fadu、乳癌htb−19、エストロゲン非依存性転移乳癌、ヒト腸癌t−84、肺扁平上皮癌mri−h−165を用いて、標準の齧歯類動物腫瘍モデルにて実施した。
【0079】
Balb/cマウスにおける重さ16〜22gのマウス乳腺肉腫EMT6腫瘍モデルを用いて、生体分布並びに化合物活性を実証した。腫瘍は、直径7〜9mmに達し得た。化合物は、例えば、5%cremophore EL、3%エタノール及び3%PEG800溶液、又は5%cremophore EL及び3%エタノール/生理食塩水に入れて、静脈若しくは腹腔内投与する。50〜100mg/mlの薬剤濃度を用いる。薬剤投与後2時間、12時間、24時間、及び48時間、腫瘍は、1回又は複数回の照射を受けることができる。平均線量率は、100〜200cGy/分である。腫瘍サイズを、照射前後で測定する。1回照射では、25、35及び45Gyを用いる。
【0080】
標準的な方法を用いて、照射処理された正常組織及び腫瘍に関して、標準的な組織病理学的分析を実施する。動物は、10%緩衝生理食塩水を用いて灌流固定される。
【0081】
プロビット分析を用いて、種々の終点を用いる線量反応データを評価し、そしてED50及びTCP50値を近似曲線から得る。これらの値を用いて、RBE/CBE因子値を算出する。全ての試験において、適切な比較対照グループを用いる。治療効果実験では、Kaplan−Meier法を用いて、生存割合対照射後時間を分析する。非統計的技術Wilcoxin 2−Sample Testによる比較のために、各実験グループの生存時間を順序だてて並べランク付けする。
【0082】
結果:上記実験によって、本発明の化合物が腫瘍内に蓄積し且つ1〜2日間で血液から除去されることが示された。X線照射のみでは、およそ30%が腫瘍フリーとなったが、ハロゲン化化合物+X線照射による治療によれば、40〜100日後には40%〜>90%が腫瘍フリーとなった。腫瘍フリーの数や腫瘍制御レベルは、化合物の効果及び用いられるX線量の関数である。
【0083】
患者の治療:当該化合物を用いて、放射線治療を受ける全患者について前処置した。患者は、一連の放射線治療(従来型の放射線治療、CHART又はIMRT)の前に薬剤物質を投与され、放射線治療過程が完了するまで、必要とされる際に投与される。従来型の放射線治療では、標準の4〜10MeVの放射線治療リニアアクセラレータを用いて、1回当たりおよそ2Gyを週に5日与えられ、4〜6週間の期間にかけて50Gy〜60Gyの線量のX線が与えられる。CHARTを利用する場合には、治療期間中、毎日、1日当たり平均3.5回、1回当たり1.2〜1.5Gyにて合計線量50〜60Gy与えるように、放射線治療を11日間続ける。上記薬剤化合物を用いると、著しく治療結果が改善される。これは、放射線治療のみの処置に対し、20〜80%あるいはより高い改善である。
【図面の簡単な説明】
【0084】
【図1】%腫瘍フリーに関する、本発明の化合物の投与効果
【特許請求の範囲】
【請求項1】
光子活性化療法による細胞死のための製薬組成物の製造における、式(I)の化合物の使用。
【化1】

式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、ハライド、SO3R4、NO2、C1-6アルキル又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-6ハロアルキル、C3-12アリール若しくはC3-12ヘテロアリール、C1-20アルキルオキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C3-12アリールオキシ、C3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アルケニル、アルケニルオキシ、アルキニル、アルキニルオキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシ基は、任意に、C1-6アルキル、アリール、R5、OR5、NR62、SO3R4、NO2、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、C6-12アリール、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールで任意に置換されており;R6は、水素又はC1-6アルキルであり、R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択され;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrである。
【請求項2】
R1基の1つ又は複数が、F、Cl、Br又はIである、請求項1に記載の使用。
【請求項3】
R2基の1つ又は複数が、F、Cl、Br又はIである、請求項1又は2に記載の使用。
【請求項4】
R3基の1つ又は複数が、F、Cl、Br又はIである、請求項1〜3の何れか1項に記載の使用。
【請求項5】
癌の予防及び/又は治療のための、請求項1の何れか1項に記載の使用。
【請求項6】
前記癌が、固形腫瘍及び/又は転移である、請求項5に記載の使用。
【請求項7】
リンパ腫、皮膚癌、肺癌、頭部及び/又は頸部癌、骨癌、前立腺癌、腸癌、頸部癌、乳癌、脳腫瘍、肝臓癌、又は膵臓癌の予防及び/又は治療のための、請求項5又は6に記載の使用。
【請求項8】
前記皮膚癌が、扁平上皮細胞癌、メルケル細胞癌、又は基底細胞癌をはじめとする、悪性黒色腫である、請求項7に記載の使用。
【請求項9】
哺乳動物のための、請求項1〜8の何れか1項に記載の使用。
【請求項10】
非転移性良性腫瘍、子宮繊維腫、喘息、乳腺腫、menohrragina、良性前立腺過形成、選択的心臓構造(selective cardiac structure)の破壊、クロット、アテローム性動脈硬化プラーク、又は年齢に伴う筋変性疾患の予防及び/又は治療のための、請求項1〜5の何れか1項に記載の使用。
【請求項11】
式(I)の化合物。
【化2】

式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、C1-6アルキル、ハライド、SO3R4、NO2、又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-6アルキル、C1-6ハロアルキル、NO2、C3-12アリール、C3-12ヘテロアリール、C1-6アルコキシ、C3-12アリールオキシ、又はC3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、R5、C3-12アリール、OR5、NR6、SO3R4、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり;R6は、水素又はC1-6アルキルであり;R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。
但し、R1及びR2の両方が臭素であるか、又は両方が塩素である場合、R3は、水素、又はF、Br、CO2Me、CO2H、CH3、CF3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2が臭素又は塩素である場合、R3はF、Br、CO2Me、CO2H、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2の両方が水素である場合、R3はCl、Br、F、Cf3、又はCl若しくはFで置換されたフェニルではなく;
R1が水素であり、R3がフェニルである場合、R2はNO2、Cl又はCH2OHではなく;
R2が水素であり、R1がNO2である場合、R3はメチルで置換されたフェニルではなく;
R2が水素であり、R1がFである場合、R3は水素ではなく;
R1及びR2が両方エチルである場合、R3はNO2ではない。
【請求項12】
以下から選択される1つ又は複数である、請求項11に記載の化合物。
【化3】

【化4】

【化5】

【化6】

【化7】

【請求項13】
以下の、請求項11に記載の化合物。
【化8】

式中、R11は、NH2で置換されたフェニル又はベンジルであり、R12はNO2で置換されたフェニル又は
【化9】

である。
【請求項14】
以下の、請求項11に記載の化合物。
【化10】

式中、R11は、(CH2)17CH3、水素、ステロイド、ベンジル、ピリジル、又はOH、NH2、MeO若しくはCO2Meで任意に置換されたフェニルである。
【請求項15】
以下の、請求項11に記載の化合物。
【化11】

式中、nは、1〜20である。
【請求項16】
以下の、請求項11に記載の化合物。
【化12】

式中、R13は、(CH2)5CH3、(CH2)5CH2OH、又はエストラジオールである。
【請求項17】
以下の、請求項11に記載の化合物。
【化13】

式中、R14は、Br、水素、メチル又はN(CH3)2であり、R15は、H又はOMeであり、R16はメチルである。
【請求項18】
以下の、請求項11に記載の化合物。
【化14】

式中、Xは、CH2、O、OCH2であるか、又は存在しない。
【請求項19】
以下の、請求項11に記載の化合物。
【化15】

式中、R15は、4-(1-メチル-o-カルボラニルメチル)である。
【請求項20】
V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Ga、Pb、Al又はPtのうちの1つ又は複数をさらに含む、請求項11〜19の何れか1項に記載の化合物。
【請求項21】
請求項11〜20の何れか1項に記載の化合物と、製薬的に許容し得る添加剤とを含んで成る製薬組成物。
【請求項22】
光子活性化療法による細胞死のための、請求項11〜20の何れか1項に記載の式(I)の化合物又は請求項21に記載の組成物。
【請求項23】
ポルフィリン化合物をハロゲン化することを包含する、請求項11〜20の何れか1項に記載の式(I)の化合物の製造方法。
【請求項24】
請求項1〜5の何れか1項に記載の式(I)の化合物を、それを必要としている被験者に投与することを包含する、光子活性化療法により細胞死を引き起こす方法。
【請求項1】
光子活性化療法による細胞死のための製薬組成物の製造における、式(I)の化合物の使用。
【化1】

式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、ハライド、SO3R4、NO2、C1-6アルキル又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-6ハロアルキル、C3-12アリール若しくはC3-12ヘテロアリール、C1-20アルキルオキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C3-12アリールオキシ、C3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アルケニル、アルケニルオキシ、アルキニル、アルキニルオキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシ基は、任意に、C1-6アルキル、アリール、R5、OR5、NR62、SO3R4、NO2、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、C6-12アリール、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり、前記アルキル又はアリール基は、NR62、NO2、C1-4アルキル又はC6-12アリールで任意に置換されており;R6は、水素又はC1-6アルキルであり、R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択され;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrである。
【請求項2】
R1基の1つ又は複数が、F、Cl、Br又はIである、請求項1に記載の使用。
【請求項3】
R2基の1つ又は複数が、F、Cl、Br又はIである、請求項1又は2に記載の使用。
【請求項4】
R3基の1つ又は複数が、F、Cl、Br又はIである、請求項1〜3の何れか1項に記載の使用。
【請求項5】
癌の予防及び/又は治療のための、請求項1の何れか1項に記載の使用。
【請求項6】
前記癌が、固形腫瘍及び/又は転移である、請求項5に記載の使用。
【請求項7】
リンパ腫、皮膚癌、肺癌、頭部及び/又は頸部癌、骨癌、前立腺癌、腸癌、頸部癌、乳癌、脳腫瘍、肝臓癌、又は膵臓癌の予防及び/又は治療のための、請求項5又は6に記載の使用。
【請求項8】
前記皮膚癌が、扁平上皮細胞癌、メルケル細胞癌、又は基底細胞癌をはじめとする、悪性黒色腫である、請求項7に記載の使用。
【請求項9】
哺乳動物のための、請求項1〜8の何れか1項に記載の使用。
【請求項10】
非転移性良性腫瘍、子宮繊維腫、喘息、乳腺腫、menohrragina、良性前立腺過形成、選択的心臓構造(selective cardiac structure)の破壊、クロット、アテローム性動脈硬化プラーク、又は年齢に伴う筋変性疾患の予防及び/又は治療のための、請求項1〜5の何れか1項に記載の使用。
【請求項11】
式(I)の化合物。
【化2】

式中、各R1は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-8アルケニル、ハライド、SO3R4、=O又はNO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6のうちの1つ又は複数から選択され、そして各置換基はさらにCO2R5又はOR5の1つ又は複数でさらに置換されていてよく;
各R2は、水素、任意に置換されたC1-8アルキル、任意に置換されたC2-6アルケニル、ハライド、SO3R4、NO2から個々独立して選択され、ここで、置換基は、C1-6アルキル、R5、=O、OR5、CO2R5、CONR6R6から選択され、そして各置換基は、CO2R5又はOR5の1つ又は複数でさらに置換されていてもよく;C1-8アルキル基は、O、CO2、又はNR7のうちの1つ又は複数で任意に中断されていてよく;
R1及びR2は一緒になって6員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は未飽和でもよく、且つ=O、C1-6アルキル、ハライド、SO3R4、NO2、又はCO2R5のうちの1つ又は複数で任意に置換されており;
各R3は、個々独立して、水素、ハライド、C1-6アルキル、C1-6ハロアルキル、NO2、C3-12アリール、C3-12ヘテロアリール、C1-6アルコキシ、C3-12アリールオキシ、又はC3-12ヘテロアリールオキシであり;ここで、前記アルキル、アルコキシ、アリール、アリールオキシ、ヘテロアリール及びヘテロアリールオキシは、任意に、C1-6アルキル、R5、C3-12アリール、OR5、NR6、SO3R4、ハライド、CO2R5又はB(OR6)2のうちの1つ又は複数で置換されており、そして各置換基は、ハライド、C1-6アルキルの1つ又は複数で任意に置換されていてもよく;
R2とR3、又はR1とR3は一緒になって5員環を形成することができ、この場合、前記環は、完全に飽和していても、部分的に飽和していても、又は不飽和でもよく、且つ=O、C1-8アルキル、又はCO2R5のうちの1つ又は複数で任意に置換されており;
R1、R2又はR3の1つ又は複数は、F、Cl、Br、I、NO2から選択される電子求引性基であり、好ましくはBrであり;
R4は、水素又はC1-6アルキルであり;R5は、水素、C1-6アルキル、任意に置換されたカルボラン、生体適合性ポリマー、又はNa若しくはKのような対イオンであり;R6は、水素又はC1-6アルキルであり;R7は、水素、又はCO2R5により任意に置換されているC1-6アルキルであり;
Mは、金属又は水素であり、好ましくは、V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Pb又はPtから選択される。
但し、R1及びR2の両方が臭素であるか、又は両方が塩素である場合、R3は、水素、又はF、Br、CO2Me、CO2H、CH3、CF3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2が臭素又は塩素である場合、R3はF、Br、CO2Me、CO2H、CH3、Cf3、Cl又はNO2で置換されたフェニルではなく;
R1及びR2の両方が水素である場合、R3はCl、Br、F、Cf3、又はCl若しくはFで置換されたフェニルではなく;
R1が水素であり、R3がフェニルである場合、R2はNO2、Cl又はCH2OHではなく;
R2が水素であり、R1がNO2である場合、R3はメチルで置換されたフェニルではなく;
R2が水素であり、R1がFである場合、R3は水素ではなく;
R1及びR2が両方エチルである場合、R3はNO2ではない。
【請求項12】
以下から選択される1つ又は複数である、請求項11に記載の化合物。
【化3】

【化4】

【化5】

【化6】

【化7】

【請求項13】
以下の、請求項11に記載の化合物。
【化8】

式中、R11は、NH2で置換されたフェニル又はベンジルであり、R12はNO2で置換されたフェニル又は
【化9】

である。
【請求項14】
以下の、請求項11に記載の化合物。
【化10】

式中、R11は、(CH2)17CH3、水素、ステロイド、ベンジル、ピリジル、又はOH、NH2、MeO若しくはCO2Meで任意に置換されたフェニルである。
【請求項15】
以下の、請求項11に記載の化合物。
【化11】

式中、nは、1〜20である。
【請求項16】
以下の、請求項11に記載の化合物。
【化12】

式中、R13は、(CH2)5CH3、(CH2)5CH2OH、又はエストラジオールである。
【請求項17】
以下の、請求項11に記載の化合物。
【化13】

式中、R14は、Br、水素、メチル又はN(CH3)2であり、R15は、H又はOMeであり、R16はメチルである。
【請求項18】
以下の、請求項11に記載の化合物。
【化14】

式中、Xは、CH2、O、OCH2であるか、又は存在しない。
【請求項19】
以下の、請求項11に記載の化合物。
【化15】

式中、R15は、4-(1-メチル-o-カルボラニルメチル)である。
【請求項20】
V、Mn、Fe、Ru、Tc、Cr、Pt、Co、Ni、Cu、Zn、Ge、In、Sn、Y、Au、Ba、W、Gd、Ga、Pb、Al又はPtのうちの1つ又は複数をさらに含む、請求項11〜19の何れか1項に記載の化合物。
【請求項21】
請求項11〜20の何れか1項に記載の化合物と、製薬的に許容し得る添加剤とを含んで成る製薬組成物。
【請求項22】
光子活性化療法による細胞死のための、請求項11〜20の何れか1項に記載の式(I)の化合物又は請求項21に記載の組成物。
【請求項23】
ポルフィリン化合物をハロゲン化することを包含する、請求項11〜20の何れか1項に記載の式(I)の化合物の製造方法。
【請求項24】
請求項1〜5の何れか1項に記載の式(I)の化合物を、それを必要としている被験者に投与することを包含する、光子活性化療法により細胞死を引き起こす方法。
【図1】




【公表番号】特表2008−506675(P2008−506675A)
【公表日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願番号】特願2007−520882(P2007−520882)
【出願日】平成17年7月8日(2005.7.8)
【国際出願番号】PCT/GB2005/002693
【国際公開番号】WO2006/005924
【国際公開日】平成18年1月19日(2006.1.19)
【出願人】(507012386)サイメイ ファーマスーティカルズ ピーエルシー (2)
【Fターム(参考)】
【公表日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願日】平成17年7月8日(2005.7.8)
【国際出願番号】PCT/GB2005/002693
【国際公開番号】WO2006/005924
【国際公開日】平成18年1月19日(2006.1.19)
【出願人】(507012386)サイメイ ファーマスーティカルズ ピーエルシー (2)
【Fターム(参考)】
[ Back to top ]

