マイクロチップに用いられる検査試薬
【課題】マイクロチップに遠心力を印加した場合でも分散質の分離が生じにくい、分散液からなる検査試薬を提供すること。
【解決手段】本発明は、被測定物を測定するためのマイクロチップに用いられる検査試薬であって、コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、前記複合粒子の比重が10以下であることを特徴とする、検査試薬である。前記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。また、前記コア粒子は、樹脂からなることが好ましい。さらに、上記分散液はコロイド分散液であることが好ましい。
【解決手段】本発明は、被測定物を測定するためのマイクロチップに用いられる検査試薬であって、コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、前記複合粒子の比重が10以下であることを特徴とする、検査試薬である。前記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。また、前記コア粒子は、樹脂からなることが好ましい。さらに、上記分散液はコロイド分散液であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロチップに用いられる検査試薬に関する。マイクロチップは、DNA、タンパク質、細胞、免疫および血液等の生化学検査や環境分析、化学物質の合成などに使用されるものである。
【背景技術】
【0002】
近年、医療や健康、食品、創薬などの分野で、DNA(Deoxyribo Nucleic Acid)や酵素、抗原、抗体、タンパク質、ウィルスおよび細胞などの生体物質、ならびに化学物質を検出あるいは定量する重要性が増してきており、それらを簡便に測定できる様々なバイオチップおよびマイクロ化学チップ(以下、これらを総称してマイクロチップと称する。)が提案されている。
【0003】
マイクロチップは、実験室で行なっている一連の実験または分析操作を、数cm〜10cm角で、厚さ数mm〜数cm程度のチップ内で行なえることから、検体および試薬が微量で済み、コストが安く、反応速度が速く、ハイスループットな検査または分析ができ、検体を採取した現場で直ちに検査結果を得ることができるなど多くの利点を有している。
【0004】
マイクロチップは、その内部に流体回路を有しており、該流体回路は、たとえば検査または分析の対象である検体(たとえば、血液等)と混合あるいは反応させる、または該検体を処理するための検査試薬を保持するための試薬保持部;該検体や検査試薬を計量するための計量部;検体と検査試薬とを混合するための混合部;該混合液について検査または分析を行なうための検出部などの各部位と、これら各部位を適切に接続する微細な流路とから主に構成される。マイクロチップは、典型的には、これに遠心力を印加可能な装置に載置して使用される。マイクロチップに適切な方向の遠心力を印加することにより、検体(または検体中の特定成分)および/または検査試薬の計量、検体(または検体中の特定成分)と検査試薬との混合、ならびに得られた混合液の検出部への導入等の処理を行なうことができる。なお、マイクロチップ内でなされる、各種液体(検体、検体中の特定成分、検査試薬、またはこれらのうちの2種以上の混合物もしくは反応物など)のある部位から他の部位への移送、計量、混合などの処理を以下では「流体処理」ということがある。
【0005】
このような流体回路を備えた種々のマイクロチップが開示されている(たとえば、特許文献1:特開2006−239538号公報参照)。しかしながら、このような遠心力を印加することにより流体処理を行う場合において、検査試薬として金属コロイド試薬を用いる場合、金属の比重(たとえば、Au:19.3、Pt:21.45、Ag:10.49)は水の比重1に比べて重いため、流体処理における遠心力の印加により、図14に示すように、金コロイド試薬を含む混合液31中で金属5が分離してしまう場合があった。。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−239538号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、マイクロチップに遠心力を印加した場合でも分散質の分離が生じにくい、分散液からなる検査試薬を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明は、被測定物を測定するためのマイクロチップに用いられる検査試薬であって、
コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、
前記複合粒子の比重が10以下であることを特徴とする、検査試薬である。
【0009】
前記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。また、前記コア粒子は、樹脂からなることが好ましい。さらに、上記分散液はコロイド分散液であることが好ましい。
【0010】
上記金属層の表面に、上記被測定物と特異的に結合する性質を有する分子が固定化されていることが好ましい。
【0011】
上記マイクロチップは、少なくとも上記被測定物および上記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有することが好ましい。
【発明の効果】
【0012】
本発明によれば、検査試薬としての特性は維持したまま、マイクロチップに遠心力を印加した場合でも分散質の分離が生じにくい、分散液からなる検査試薬を提供することができる。
【図面の簡単な説明】
【0013】
【図1】実施形態1の測定方法を説明するための模式的なグラフである。
【図2】実施形態2の測定方法を説明するための模式的なグラフである。
【図3】実施形態3の測定方法を説明するための模式的なグラフである。
【図4】(a)〜(d)は、実施例1の測定方法の各工程におけるマイクロチップの上面模式図である。
【図5】実施例1の測定結果を示すグラフである。
【図6】(a)〜(d)は、実施例2の測定方法の各工程におけるマイクロチップの上面模式図である。
【図7】実施例3の測定結果を示すグラフである。
【図8】実施例3の別の測定結果を示すグラフである。
【図9】(a)〜(e)は、実施例4の測定方法の各工程におけるマイクロチップの上面模式図である。
【図10】実施例4の測定結果を示すグラフである。
【図11】実施例4の測定結果を示す別のグラフである。
【図12】実施例4の測定結果を示す別のグラフである。
【図13】実施例5の測定方法に用いられる検査試薬の模式断面図である。
【図14】実施例5の測定方法の効果を説明するための模式上面図である。
【発明を実施するための形態】
【0014】
本発明のマイクロチップは、各種化学合成、検査または分析等を、それが有する流体回路を用いて行なうことができるチップである。マイクロチップの大きさは、特に限定されず、たとえば縦横数cm〜10cm程度、厚さ数mm〜数cm程度とすることができる。
【0015】
マイクロチップは、例えば、少なくとも一方の表面に隔壁で区画された凹部を有する第1の基板と、この第1の基板の少なくとも上記一方の表面に貼合された第2の基板と、から構成される。マイクロチップの流体回路は、上記凹部および第2の基板の表面から構成される空間を含む。
【0016】
また、マイクロチップは、さらに3層以上の基板から構成されたものであってもよい。例えば、さらに、第1の基板が、第2の基板とは反対側の表面にも凹部を有しており、この凹部側に第2の基板と同様の第3の基板が貼合されていてもよい。この場合、流体回路は、第1の基板の第2の基板側表面に設けられた凹部と第2の基板の表面とから構成される空間からなる第1の流体回路、および、第1の基板の第3の基板側表面に設けられた凹部と第3の基板の表面とから構成される空間からなる第2の流体回路からなる2層構造を有する。ここで、「2層」とは、マイクロチップの厚み方向に関して異なる2つの位置に流体回路が設けられていることを意味する。かかる2層の流体回路は、第1の基板を厚み方向に貫通する貫通穴によって接続することができる。
【0017】
基板同士を貼り合わせる方法としては、特に限定されるものではなく、たとえば貼り合わせる基板のうち、少なくとも一方の基板の貼り合わせ面を融解させて溶着させる方法(溶着法)、接着剤を用いて接着させる方法などを挙げることができる。溶着法としては、基板を加熱して溶着させる方法;レーザー等の光を照射して、光吸収時に発生する熱により溶着する方法(レーザー溶着);超音波を用いて溶着する方法などを挙げることができる。
【0018】
本発明のマイクロチップを構成する上記各基板の材質は、特に制限されず、たとえば、ポリエチレンテレフタレート(PET)、ポリエチレンナフタレート(PEN)、ポリブチレンテレフタレート(PBT)、ポリメチルメタクリレート(PMMA)、ポリカーボネート(PC)、ポリスチレン(PS)、ポリプロピレン(PP)、ポリエチレン(PE)、ポリアリレート樹脂(PAR)、アクリロニトリル・ブタジエン・スチレン樹脂(ABS)、スチレン−ブタジエン樹脂(スチレン−ブタジエン共重合体)、塩化ビニル樹脂(PVC)、ポリメチルペンテン樹脂(PMP)、ポリブタジエン樹脂(PBD)、生分解性ポリマー(BP)、シクロオレフィンポリマー(COP)、ポリジメチルシロキサン(PDMS)、ポリアセタール(POM)、ポリアミド(PA)などの有機材料;シリコン、ガラス、石英などの無機材料等を用いることができる。なかでも、流体回路の形成のし易さ等を考慮すると、樹脂を用いることが好ましい。
【0019】
第1の基板の表面に、流体回路を構成する凹部(パターン溝)および隔壁を形成する方法としては、特に制限されず、転写構造を有する金型を用いた射出成形法、インプリント法などを挙げることができる。凹部および隔壁の形状は適切な流体回路構造となるように決定される。
【0020】
マイクロチップにおいて、流体回路は、流体回路内の液体(検体、検体中の特定成分、液体試薬、および、これらのうちの2種以上の混合液または反応液など)に対して適切な流体処理を行なうことができるよう、流体回路内の適切な位置に配置された種々の部位を備えており、これらの部位は、微細な流路(接続流路)を介して適切に接続されている。流体回路内の部位としては、検査試薬を保持するための試薬保持部;検査試薬と検体とを混合するための混合部;得られた混合液についての検査または分析(たとえば、混合液中の特定成分の検出)を行なうための検出部などを挙げることができる。本発明のマイクロチップは、少なくとも試薬保持部と検出部とを備えている。1つのマイクロチップ内の検出部は1つであることが好ましい。
【0021】
ここで、「検体」とは、流体回路内に導入される、マイクロチップが行なう検査または分析等の対象となる物質であり、たとえば、全血、血漿、血清、尿、鼻腔ぬぐい液、鼻腔吸引液、鼻汁鼻かみ液、咽頭ぬぐい液が挙げられる。また、「検査試薬」とは、マイクロチップが行なう検査または分析の対象となる検体を処理する、または該検体と混合あるいは反応される試薬であり、通常、マイクロチップ使用前にあらかじめ流体回路の試薬保持部に内蔵されている。検体と検査試薬の少なくともいずれかは液体であることが好ましい。検体と検査試薬とを混合させることによって最終的に得られた混合液または反応液等は、たとえば、混合液を収容した検出部に光を照射し、透過する光の強度(透過率)を検出する方法や、検出部に保持された混合液についての吸収スペクトルを測定する方法等の光学測定などに供され、検査または分析が行なわれる。
【0022】
検体と検査試薬との混合、得られた混合液の検出部への導入などのような流体回路内における種々の流体処理は、たとえば、マイクロチップに対して、適切な方向の遠心力を順次印加することにより行なうことができる。マイクロチップへの遠心力の印加は、マイクロチップを、遠心力を印加可能な装置(遠心装置)に載置して行なうことができる。遠心装置は、通常、回転自在なローター(回転子)と、該ローター上に配置された回転自在なステージとを備えている。該ステージ上にマイクロチップを載置し、該ステージを回転させてローターに対するマイクロチップの角度を任意に設定することにより、マイクロチップに対して任意の方向の遠心力を印加することができる。
【0023】
検体と検査試薬とを混合させることによって最終的に得られた混合液は、たとえば、混合液を収容した検出部に光を照射し、透過する光の強度(透過率)を検出する方法;検出部に保持された混合液についての吸収スペクトルを測定する方法等の光学測定などに供され、検査または分析が行なわれる。
【0024】
マイクロチップは、複数種の被測定物を測定するために用いられるマイクロチップであってもよく、試薬保持部に、複数種の被測定物の各々に対応する複数種の検査試薬を備えていてもよい。この場合、複数種の検査試薬は、該検査試薬の各々とそれに対応する被測定物との反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。ここで、タイムコースとは、時間経過に伴う検出値の変化の様子を意味する。
【0025】
複数種の検査試薬は、1つの試薬保持部に複数種の検査試薬の混合液等として内蔵されていてもよく、別々の試薬保持部に各々の検査試薬が内蔵されていてもよい。
【0026】
マイクロチップは、特に臨床現場即時検査に好適に用いることができる。臨床現場即時検査(Point of Care Testing:POCT)とは、小型分析器や迅速診断キットを用いて医療現場で行うリアルタイム検査である。例えば、インフルエンザウイルス検査、アデノウイルス検査などの感染症検査や、心筋梗塞または心筋傷害の有無を確認するトロポニンTの検査、全身状態を把握するための血液ガスや血球計数の検査、電解質や血糖の検査が挙げられる。
【0027】
本発明は、このような被測定物を測定するためのマイクロチップに用いられる検査試薬に関する。本発明の検査試薬は、コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を分散質として含有する分散液からなり、上記複合粒子の比重が10以下であることを特徴とする。複合粒子の比重は、好ましくは5以下であり、より好ましくは2以下である。
【0028】
上記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。これにより、分散質となる粒子の比重を、金属のみからなる粒子よりも小さくすることができる。
【0029】
また、上記コア粒子は、樹脂からなることが好ましい。樹脂からなるコア粒子は、種々公知の方法により容易に粒子径を制御することが可能であるため、測定に最適な粒子径である金属コーティング分散質を作製でき、これにより測定感度を向上させることが可能となる。樹脂としては、たとえば、ポリエチレン(PE)、ポリプロピレン(PP)、ポリスチレン(PS)、ABS樹脂、AS樹脂、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリメチルペンテン(PMP)等が挙げられる。
【0030】
金属層は、コア粒子の直径に対して十分に薄い層であることが好ましい。金属層を十分に薄くすることで、分散質である粒子全体の比重を1に近づけることができるため、遠心力を印加した際の検査試薬の分離を抑制することができる。好ましくは、金属層の厚さは、コア粒子の直径の10%以下であることが好ましく、より好ましくは3%以下、さらに好ましくは1%以下である。具体的な金属層の厚さは、好ましくは0.3〜100nmであり、より好ましくは1〜5nmである。金属層の材料としては、たとえば、金、白金、銀が挙げられる。
【0031】
上記分散液はコロイド分散液であることが好ましい。本発明において、コロイド分散液とは、直径が1〜1000nmの粒子を分散質として含有する分散液である。
【0032】
上記金属層の表面に、上記被測定物と特異的に結合する性質を有する分子が固定化されていることが好ましい。被測定物に特異的に結合する性質を有する分子と被測定物の組み合わせとしては、たとえば、抗体と抗原、糖鎖とタンパク質、脂質とタンパク質、リガンド(低分子化合物)とタンパク質、タンパク質とタンパク質、一本鎖DNAと一本鎖DNAなどの組み合わせが挙げられる。
【0033】
上記マイクロチップは、少なくとも上記被測定物および上記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有することが好ましい。
【0034】
以下、実施形態を示して、本発明を詳細に説明する。
(実施形態1)
図1は、実施形態1の測定方法を説明するための模式的なグラフである。
【0035】
図1において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0036】
B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースも、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0037】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。
【0038】
なお、本実施形態では、検査試薬1、2は、その各々についてのタイムコースがいずれも正のタイムコースとなるように選択されているが、本発明においては、このように、複数のタイムコースの全てが、正のタイムコースまたは負のタイムコースのいずれかであってもよく、また、後述する実施形態2のように、複数のタイムコースが正のタイムコースおよび負のタイムコースの両者を含んでいてもよい。
【0039】
また、本実施形態では、被測定物Aと検査試薬1との反応、および、被測定物Bと検査試薬2との反応のいずれにおいても反応は緩やかであるため、A1〜A3のタイムコースおよびB1〜B3のタイムコースは、いずれも、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0040】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いることで、検査試薬1および2についてのタイムコースの違いから、被測定物AまたはBのいずれが検体中に含まれているかを検出することができる。また、予備的な測定により、あらかじめ図1のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。なお、本実施形態は、検体が通常は被測定物AまたはBのいずれか一方のみしか含まないものである場合に好適に使用される。
【0041】
(実施形態2)
図2は、実施形態2の測定方法を説明するための模式的なグラフである。
【0042】
図2において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0043】
これに対して、B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースは、時間の経過に伴って上記検出値が減少する傾向を示す負のタイムコースである。
【0044】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。また、検査試薬1、2は、その複数のタイムコースが正のタイムコースおよび負のタイムコースの両者を含むように、選択される。このような各タイムコースは、通常、検査試薬の種類を選択することによって得ることができる。
【0045】
なお、本実施形態では、被測定物Aと検査試薬1との反応、および、被測定物Bと検査試薬2との反応のいずれにおいても反応は緩やかであるため、A1〜A3のタイムコースおよびB1〜B3のタイムコースは、いずれも、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0046】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いることで、検査試薬1および2についてのタイムコースの違いから、被測定物AまたはBのいずれが検体中に含まれているかを検出することができる。本実施形態では、特に、検査試薬1および2についてのタイムコースが正と負のタイムコースであるため、検出結果におけるタイムコースが正または負のいずれであるかのみで、検体中に被測定物AまたはBのいずれが含まれているかを判別することができる。また、予備的な測定により、あらかじめ図2のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。なお、本実施形態は、検体が通常は被測定物AまたはBのいずれか一方のみしか含まないものである場合に好適に使用される。
【0047】
(実施形態3)
図3は、実施形態3の測定方法を説明するための模式的なグラフである。
【0048】
図3において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。また、A1〜A3のタイムコースは、被測定物Aと検査試薬1との反応速度が速く、吸光度(検出値)が初期の段階でほぼ定常状態となっているため、検出値の初期値に対する所定時間が経過した時点における検出値の変化量に基づいて被測定物の検出を行うエンドポイント法に適したタイムコースである。
【0049】
B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースも、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。また、B1〜B3のタイムコースは、被測定物Bと検査試薬2との反応が緩やかであるため、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0050】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についてのタイムコースが、共に正のタイムコースであるが、一方がエンドポイント法に適したタイムコースであり、他方がレート法に適したタイムコースである。このような各タイムコースは、通常、検査試薬の種類を選択することによって得ることができる。
【0051】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いた場合、各検査試薬についてのタイムコースがいずれも正(または負)のタイムコースであっても、検体中に含まれる被測定物の判別が容易になる。また、予備的な測定により、あらかじめ図3のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。
【実施例】
【0052】
(実施例1)
本実施例のマイクロチップ1を用いた流体処理の概要を、図4(a)〜(d)を参照して説明する。図4(a)〜(d)は、実施例1の測定方法の各工程におけるマイクロチップの上面模式図である。
【0053】
(1)混合工程
まず、図4(a)に示される状態にあるマイクロチップ1に対して、下向き(図4(a)の矢印の方向)に遠心力を印加する。これにより、試薬保持部10に内蔵された検査試薬11と、検体保持部20に導入された検体21とが、混合部30に導入され、混合液31となる(図4(b))。なお、検査試薬11は、インフルエンザAウィルス抗体が固定化されたラテックス試薬と、インフルエンザBウィルス抗体が固定化された金コロイド試薬との混合液である。
【0054】
(2)検出部導入工程
次に、右向き(図4(b)の矢印の方向)に遠心力を印加する。これにより、混合液31は、接続流路を通って検出部40に導入される(図4(c))。
【0055】
(3)検出工程
検出部に充填された混合液31は、光学測定に供され、検査・分析が行なわれる。たとえば、図4(d)に示される矢印の方向から光を照射し、その透過光を測定することにより、混合液中の特定成分の検出等がなされる。
【0056】
本実施例では、インフルエンザA陽性の罹患者およびインフルエンザB陽性の罹患者の各々から採取した鼻汁(鼻をかむことによって排出された液)、両者の等量混合液を検体として用いた。また、対照として、インフルエンザAおよびBに陰性の健常人から採取した鼻汁を用いた。
【0057】
被測定物であるインフルエンザAウィルスに対する検査試薬としては、インフルエンザAウィルス抗体が固定化されたラテックス試薬を用いた。インフルエンザBウィルスに対する検査試薬としては、インフルエンザBウィルス抗体が固定化された金コロイド試薬を用いた。測定に用いた光の波長は505nmとし、各検体につき3回の測定を行った。
【0058】
図5は、実施例1の測定結果を示すグラフである。なお、図5では、全ての測定結果を重ねて表示している。図5に示されるように、インフルエンザA陽性、インフルエンザB陽性、両陽性、および、両陰性の全てを吸光度のタイムコースから判別できることが分かる。ここで、インフルエンザA陽性の検体についてのタイムコースは正のタイムコースであり、インフルエンザB陽性の検体についてのタイムコースは負のタイムコースである。なお、通常はインフルエンザAとインフルエンザBの両方に罹患すること(両陽性)はないと考えられているが、両陽性の場合も考慮して、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁の等量混合液についても測定を行った。図5に示されるように両陽性の検体のタイムコースは、吸光度の変化速度が正から負に変化するという特徴を有している。これに対して、インフルエンザAまたはインフルエンザBのいずれかにのみ陽性の検体のタイムコースは、吸光度の変化速度が常に正であるか、または、常に負であるという特徴を有している。このタイムコースの違いに基づいて、両陽性の検体と、インフルエンザAまたはインフルエンザBのいずれかにのみ陽性の検体とを判別することが可能である。
【0059】
(実施例2)
図6(a)〜(d)は、実施例2の測定方法の各工程におけるマイクロチップの上面模式図である。本実施例では、図6(a)に示されるように、検査試薬11a,11bが別々の試薬保持部10a,10bに内蔵されている。それ以外の点は、実施例1と同様であるため説明は省略する。このような形態は、複数種の検査試薬を測定時まで分離して保持する必要がある場合に有効である。
【0060】
(実施例3)
本実施例では検出部における光学測定を、450nmおよび505nmの2波長を用いて行った。測定は、インフルエンザA陽性の検体(インフルエンザA罹患者の鼻汁)、インフルエンザB陽性の検体(インフルエンザB罹患者の鼻汁)、陰性の検体(健常人の鼻汁)について行った。それ以外の点は、実施例1と同様であるため説明は省略する。
【0061】
図7に、波長450nmの光の吸光度(A450)のグラフを示す。なお、インフルエンザB陽性の検体については、1/2希釈液、1/4希釈液についての測定結果も示す。図7から、波長450nmの光を用いた光学測定により、インフルエンザBウィルスのみを測定できることが分かる。
【0062】
一方、図8は、波長505nmの光の吸光度(A505)から、波長450nmの光の吸光度(A450)×a(定数)を差し引いた値(A505−a×A450)のグラフである。ここで、定数aは、0.79である。この定数aは、ラテックス試薬とインフルエンザAウィルスの反応液についての、波長450nmの光の吸光度に対する波長505nmの光の吸光度の比率であり、ラテックス試薬に固有の値である。インフルエンザウィルスの濃度が変化してもこの比率aはほぼ一定であるとみなしている。なお、インフルエンザA陽性の検体については、1/2希釈液、1/4希釈液についての測定結果も示す。図8から、波長450nmおよび505nmの光を用いた光学測定により、インフルエンザBウィルスのみを測定できることが分かる。このように、複数の波長を用いて測定した場合、全体の測定結果(個々のタイムコースが合成されたタイムコース)から個々の測定結果(個々のタイムコース)を分離して、被測定物の濃度等を調べることができる。
【0063】
(実施例4)
本実施例のマイクロチップ1を用いた流体処理の概要を、図9(a)〜(e)を参照して説明する。図9(a)〜(e)は、実施例4の測定方法の各工程におけるマイクロチップの上面模式図である。
【0064】
(1)第1混合工程
まず、図9(a)に示される状態にあるマイクロチップ1に対して、左向き(図9(a)の矢印の方向)に遠心力を印加する。これにより、試薬保持部10aに内蔵された検査試薬11a(インフルエンザAウィルス抗体が固定化されたラテックス試薬)と、検体保持部20に導入された検体21とが、混合部30aに導入され、混合液31aとなる(図9(b))。
【0065】
(2)第2混合工程
検査試薬11aと検体21とが混合されてから60秒後に、図9(b)に示される状態にあるマイクロチップ1に対して、下向き(図9(b)の矢印の方向)に遠心力を印加する。これにより、混合物30aに導入された混合液31aと、試薬保持部10bに内蔵された検査試薬11b(インフルエンザBウィルス抗体が固定化された金コロイド試薬)とが、混合部30bに導入され、混合液31bとなる(図9(c))。
【0066】
(3)検出部導入工程
次に、右向き(図9(c)の矢印の方向)に遠心力を印加する。これにより、混合液31bは、接続流路を通って検出部40に導入される(図9(d))。
【0067】
(4)検出工程
検出部に充填された混合液31bは、光学測定に供され、検査・分析が行なわれる。たとえば、図9(d)に示される矢印の方向から光を照射し、その透過光を測定することにより、混合液中の特定成分の検出等がなされる。本実施例では波長505nmの光の吸光度を測定した。
【0068】
本実施例では、インフルエンザA罹患者の鼻汁またはその希釈液と、インフルエンザB罹患者の鼻汁またはその希釈液とを、組み合わせた液を検体として用いた。
【0069】
被測定物であるインフルエンザAウィルスに対する検査試薬としては、インフルエンザAウィルス抗体が固定化されたラテックス試薬を用いた。インフルエンザBウィルスに対する検査試薬としては、インフルエンザBウィルス抗体が固定化された金コロイド試薬を用いた。測定に用いた光の波長は505nmとし、各検体につき1回の測定を行った。
【0070】
測定結果を図10に示す。図10において、A0は、健常人の鼻汁のみの測定結果であり、A1は、インフルエンザB罹患者の鼻汁の1/2希釈液のみの測定結果であり、A2は、インフルエンザB罹患者の鼻汁のみの測定結果である。E0は、インフルエンザA罹患者の鼻汁のみの測定結果であり、D0、C0、B0は、それぞれ、インフルエンザA罹患者の鼻汁の1/2希釈液、1/4希釈液、1/8希釈液のみの測定結果である。E1は、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁の1/2希釈液との等量混合液の測定結果であり、E2は、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁との等量混合液の測定結果である。
【0071】
図11は、図10に示す測定結果から、ラテックス試薬(検査試薬11a)の混合時から金コロイド試薬(検査試薬11b)の混合時までのグラフを外挿したグラフである。このように、図10の0時間の吸光度(図10の矢印で示す部分)に基づいてインフルエンザAウィルスの測定が可能であることが分かる。
【0072】
図12の「E1−E0」は、図10に示すE1の吸光度からE0の吸光度を引いた値のグラフであり、「E2−E0」は、図10に示すE2の吸光度からE0の吸光度を引いた値のグラフである。このようにして、インフルエンザBウィルスの測定が可能であることが分かる。
【0073】
(実施例5)
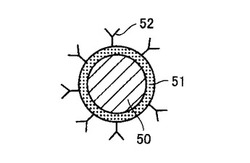
本実施例では、実施例1で用いた金コロイド試薬に(金粒子の表面にインフルエンザAウィルス抗体が固定化された金粒子のコロイド分散液)に代えて、図13に示すような2層構造の粒子の表面に抗体が固定化された複合粒子のコロイド分散液を使用する。図13では、比重1程度の材料(樹脂など)からなるコア粒子50の表面に薄い金属コーティング(金属層)51が形成されている。そして、該金属コーティング51の表面には、インフルエンザAウィルス抗体などの抗体52が固定化されている。
【0074】
遠心力を利用して流体処理を行うマイクロチップにおいて、検査試薬として金属コロイド試薬を用いる場合、金属の比重(たとえば、Au:19.3、Pt:21.45、Ag:10.49)は水の比重1に比べて重いため、流体処理における遠心力の印加により、図14に示すように、金コロイド試薬を含む混合液31中で金属5が分離してしまう場合があった。
【0075】
これに対して、本実施例では、試薬中の複合粒子の比重は、コア材料50の比重と同程度であるため、流体処理における遠心力の印加によりバイオチップ内の混合液中で抗体が固定化された粒子が分離してしまう現象を抑制することができる。
【0076】
また、比重1程度の材料が樹脂である場合、該樹脂からなるコア粒子50は、種々公知の方法により容易に粒子径を制御することが可能であるため、これにより測定感度を向上させることが可能である。樹脂としては、たとえば、ポリエチレン(PE)、ポリプロピレン(PP)、ポリスチレン(PS)、ABS樹脂、AS樹脂、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリメチルペンテン(PMP)が挙げられる。金属コーティング51の材料としては、たとえば、金、白金、銀等が挙げられる。
【0077】
なお、金属コロイド試薬を用いる場合、光と金属表面に存在する自由電子と相互作用による表面プラズモン共鳴を利用して測定が行われる。本実施例の金属コロイド試薬においても、金属コーティング(金属層)の表面に自由電子が存在し、表面プラズモン現象が発現するため、免疫反応等の体外診断用の検査試薬として必要な特性は維持している。このように、本実施例の金属コロイド試薬は、検査試薬としての特性は維持したまま、遠心力を印加しても分離しないという好ましい特性を有しており、特に遠心力を利用して流体処理を行うマイクロチップに好適に用いることができる。
【0078】
今回開示された実施の形態および実施例はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【符号の説明】
【0079】
1 マイクロチップ、10,10a,10b 試薬保持部、11,11a,11b 検査試薬、20,20a,20b 検体保持部、21,21a,21b 検体、30,30a,30b 混合部、31,31a,31b 混合液、40 検出部、5 金属、50 コア粒子、51 金属コーティング(金属層)、52 抗体。
【技術分野】
【0001】
本発明は、マイクロチップに用いられる検査試薬に関する。マイクロチップは、DNA、タンパク質、細胞、免疫および血液等の生化学検査や環境分析、化学物質の合成などに使用されるものである。
【背景技術】
【0002】
近年、医療や健康、食品、創薬などの分野で、DNA(Deoxyribo Nucleic Acid)や酵素、抗原、抗体、タンパク質、ウィルスおよび細胞などの生体物質、ならびに化学物質を検出あるいは定量する重要性が増してきており、それらを簡便に測定できる様々なバイオチップおよびマイクロ化学チップ(以下、これらを総称してマイクロチップと称する。)が提案されている。
【0003】
マイクロチップは、実験室で行なっている一連の実験または分析操作を、数cm〜10cm角で、厚さ数mm〜数cm程度のチップ内で行なえることから、検体および試薬が微量で済み、コストが安く、反応速度が速く、ハイスループットな検査または分析ができ、検体を採取した現場で直ちに検査結果を得ることができるなど多くの利点を有している。
【0004】
マイクロチップは、その内部に流体回路を有しており、該流体回路は、たとえば検査または分析の対象である検体(たとえば、血液等)と混合あるいは反応させる、または該検体を処理するための検査試薬を保持するための試薬保持部;該検体や検査試薬を計量するための計量部;検体と検査試薬とを混合するための混合部;該混合液について検査または分析を行なうための検出部などの各部位と、これら各部位を適切に接続する微細な流路とから主に構成される。マイクロチップは、典型的には、これに遠心力を印加可能な装置に載置して使用される。マイクロチップに適切な方向の遠心力を印加することにより、検体(または検体中の特定成分)および/または検査試薬の計量、検体(または検体中の特定成分)と検査試薬との混合、ならびに得られた混合液の検出部への導入等の処理を行なうことができる。なお、マイクロチップ内でなされる、各種液体(検体、検体中の特定成分、検査試薬、またはこれらのうちの2種以上の混合物もしくは反応物など)のある部位から他の部位への移送、計量、混合などの処理を以下では「流体処理」ということがある。
【0005】
このような流体回路を備えた種々のマイクロチップが開示されている(たとえば、特許文献1:特開2006−239538号公報参照)。しかしながら、このような遠心力を印加することにより流体処理を行う場合において、検査試薬として金属コロイド試薬を用いる場合、金属の比重(たとえば、Au:19.3、Pt:21.45、Ag:10.49)は水の比重1に比べて重いため、流体処理における遠心力の印加により、図14に示すように、金コロイド試薬を含む混合液31中で金属5が分離してしまう場合があった。。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2006−239538号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、マイクロチップに遠心力を印加した場合でも分散質の分離が生じにくい、分散液からなる検査試薬を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明は、被測定物を測定するためのマイクロチップに用いられる検査試薬であって、
コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、
前記複合粒子の比重が10以下であることを特徴とする、検査試薬である。
【0009】
前記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。また、前記コア粒子は、樹脂からなることが好ましい。さらに、上記分散液はコロイド分散液であることが好ましい。
【0010】
上記金属層の表面に、上記被測定物と特異的に結合する性質を有する分子が固定化されていることが好ましい。
【0011】
上記マイクロチップは、少なくとも上記被測定物および上記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有することが好ましい。
【発明の効果】
【0012】
本発明によれば、検査試薬としての特性は維持したまま、マイクロチップに遠心力を印加した場合でも分散質の分離が生じにくい、分散液からなる検査試薬を提供することができる。
【図面の簡単な説明】
【0013】
【図1】実施形態1の測定方法を説明するための模式的なグラフである。
【図2】実施形態2の測定方法を説明するための模式的なグラフである。
【図3】実施形態3の測定方法を説明するための模式的なグラフである。
【図4】(a)〜(d)は、実施例1の測定方法の各工程におけるマイクロチップの上面模式図である。
【図5】実施例1の測定結果を示すグラフである。
【図6】(a)〜(d)は、実施例2の測定方法の各工程におけるマイクロチップの上面模式図である。
【図7】実施例3の測定結果を示すグラフである。
【図8】実施例3の別の測定結果を示すグラフである。
【図9】(a)〜(e)は、実施例4の測定方法の各工程におけるマイクロチップの上面模式図である。
【図10】実施例4の測定結果を示すグラフである。
【図11】実施例4の測定結果を示す別のグラフである。
【図12】実施例4の測定結果を示す別のグラフである。
【図13】実施例5の測定方法に用いられる検査試薬の模式断面図である。
【図14】実施例5の測定方法の効果を説明するための模式上面図である。
【発明を実施するための形態】
【0014】
本発明のマイクロチップは、各種化学合成、検査または分析等を、それが有する流体回路を用いて行なうことができるチップである。マイクロチップの大きさは、特に限定されず、たとえば縦横数cm〜10cm程度、厚さ数mm〜数cm程度とすることができる。
【0015】
マイクロチップは、例えば、少なくとも一方の表面に隔壁で区画された凹部を有する第1の基板と、この第1の基板の少なくとも上記一方の表面に貼合された第2の基板と、から構成される。マイクロチップの流体回路は、上記凹部および第2の基板の表面から構成される空間を含む。
【0016】
また、マイクロチップは、さらに3層以上の基板から構成されたものであってもよい。例えば、さらに、第1の基板が、第2の基板とは反対側の表面にも凹部を有しており、この凹部側に第2の基板と同様の第3の基板が貼合されていてもよい。この場合、流体回路は、第1の基板の第2の基板側表面に設けられた凹部と第2の基板の表面とから構成される空間からなる第1の流体回路、および、第1の基板の第3の基板側表面に設けられた凹部と第3の基板の表面とから構成される空間からなる第2の流体回路からなる2層構造を有する。ここで、「2層」とは、マイクロチップの厚み方向に関して異なる2つの位置に流体回路が設けられていることを意味する。かかる2層の流体回路は、第1の基板を厚み方向に貫通する貫通穴によって接続することができる。
【0017】
基板同士を貼り合わせる方法としては、特に限定されるものではなく、たとえば貼り合わせる基板のうち、少なくとも一方の基板の貼り合わせ面を融解させて溶着させる方法(溶着法)、接着剤を用いて接着させる方法などを挙げることができる。溶着法としては、基板を加熱して溶着させる方法;レーザー等の光を照射して、光吸収時に発生する熱により溶着する方法(レーザー溶着);超音波を用いて溶着する方法などを挙げることができる。
【0018】
本発明のマイクロチップを構成する上記各基板の材質は、特に制限されず、たとえば、ポリエチレンテレフタレート(PET)、ポリエチレンナフタレート(PEN)、ポリブチレンテレフタレート(PBT)、ポリメチルメタクリレート(PMMA)、ポリカーボネート(PC)、ポリスチレン(PS)、ポリプロピレン(PP)、ポリエチレン(PE)、ポリアリレート樹脂(PAR)、アクリロニトリル・ブタジエン・スチレン樹脂(ABS)、スチレン−ブタジエン樹脂(スチレン−ブタジエン共重合体)、塩化ビニル樹脂(PVC)、ポリメチルペンテン樹脂(PMP)、ポリブタジエン樹脂(PBD)、生分解性ポリマー(BP)、シクロオレフィンポリマー(COP)、ポリジメチルシロキサン(PDMS)、ポリアセタール(POM)、ポリアミド(PA)などの有機材料;シリコン、ガラス、石英などの無機材料等を用いることができる。なかでも、流体回路の形成のし易さ等を考慮すると、樹脂を用いることが好ましい。
【0019】
第1の基板の表面に、流体回路を構成する凹部(パターン溝)および隔壁を形成する方法としては、特に制限されず、転写構造を有する金型を用いた射出成形法、インプリント法などを挙げることができる。凹部および隔壁の形状は適切な流体回路構造となるように決定される。
【0020】
マイクロチップにおいて、流体回路は、流体回路内の液体(検体、検体中の特定成分、液体試薬、および、これらのうちの2種以上の混合液または反応液など)に対して適切な流体処理を行なうことができるよう、流体回路内の適切な位置に配置された種々の部位を備えており、これらの部位は、微細な流路(接続流路)を介して適切に接続されている。流体回路内の部位としては、検査試薬を保持するための試薬保持部;検査試薬と検体とを混合するための混合部;得られた混合液についての検査または分析(たとえば、混合液中の特定成分の検出)を行なうための検出部などを挙げることができる。本発明のマイクロチップは、少なくとも試薬保持部と検出部とを備えている。1つのマイクロチップ内の検出部は1つであることが好ましい。
【0021】
ここで、「検体」とは、流体回路内に導入される、マイクロチップが行なう検査または分析等の対象となる物質であり、たとえば、全血、血漿、血清、尿、鼻腔ぬぐい液、鼻腔吸引液、鼻汁鼻かみ液、咽頭ぬぐい液が挙げられる。また、「検査試薬」とは、マイクロチップが行なう検査または分析の対象となる検体を処理する、または該検体と混合あるいは反応される試薬であり、通常、マイクロチップ使用前にあらかじめ流体回路の試薬保持部に内蔵されている。検体と検査試薬の少なくともいずれかは液体であることが好ましい。検体と検査試薬とを混合させることによって最終的に得られた混合液または反応液等は、たとえば、混合液を収容した検出部に光を照射し、透過する光の強度(透過率)を検出する方法や、検出部に保持された混合液についての吸収スペクトルを測定する方法等の光学測定などに供され、検査または分析が行なわれる。
【0022】
検体と検査試薬との混合、得られた混合液の検出部への導入などのような流体回路内における種々の流体処理は、たとえば、マイクロチップに対して、適切な方向の遠心力を順次印加することにより行なうことができる。マイクロチップへの遠心力の印加は、マイクロチップを、遠心力を印加可能な装置(遠心装置)に載置して行なうことができる。遠心装置は、通常、回転自在なローター(回転子)と、該ローター上に配置された回転自在なステージとを備えている。該ステージ上にマイクロチップを載置し、該ステージを回転させてローターに対するマイクロチップの角度を任意に設定することにより、マイクロチップに対して任意の方向の遠心力を印加することができる。
【0023】
検体と検査試薬とを混合させることによって最終的に得られた混合液は、たとえば、混合液を収容した検出部に光を照射し、透過する光の強度(透過率)を検出する方法;検出部に保持された混合液についての吸収スペクトルを測定する方法等の光学測定などに供され、検査または分析が行なわれる。
【0024】
マイクロチップは、複数種の被測定物を測定するために用いられるマイクロチップであってもよく、試薬保持部に、複数種の被測定物の各々に対応する複数種の検査試薬を備えていてもよい。この場合、複数種の検査試薬は、該検査試薬の各々とそれに対応する被測定物との反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。ここで、タイムコースとは、時間経過に伴う検出値の変化の様子を意味する。
【0025】
複数種の検査試薬は、1つの試薬保持部に複数種の検査試薬の混合液等として内蔵されていてもよく、別々の試薬保持部に各々の検査試薬が内蔵されていてもよい。
【0026】
マイクロチップは、特に臨床現場即時検査に好適に用いることができる。臨床現場即時検査(Point of Care Testing:POCT)とは、小型分析器や迅速診断キットを用いて医療現場で行うリアルタイム検査である。例えば、インフルエンザウイルス検査、アデノウイルス検査などの感染症検査や、心筋梗塞または心筋傷害の有無を確認するトロポニンTの検査、全身状態を把握するための血液ガスや血球計数の検査、電解質や血糖の検査が挙げられる。
【0027】
本発明は、このような被測定物を測定するためのマイクロチップに用いられる検査試薬に関する。本発明の検査試薬は、コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を分散質として含有する分散液からなり、上記複合粒子の比重が10以下であることを特徴とする。複合粒子の比重は、好ましくは5以下であり、より好ましくは2以下である。
【0028】
上記コア粒子は、比重が0.8〜1.2である材料からなることが好ましい。これにより、分散質となる粒子の比重を、金属のみからなる粒子よりも小さくすることができる。
【0029】
また、上記コア粒子は、樹脂からなることが好ましい。樹脂からなるコア粒子は、種々公知の方法により容易に粒子径を制御することが可能であるため、測定に最適な粒子径である金属コーティング分散質を作製でき、これにより測定感度を向上させることが可能となる。樹脂としては、たとえば、ポリエチレン(PE)、ポリプロピレン(PP)、ポリスチレン(PS)、ABS樹脂、AS樹脂、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリメチルペンテン(PMP)等が挙げられる。
【0030】
金属層は、コア粒子の直径に対して十分に薄い層であることが好ましい。金属層を十分に薄くすることで、分散質である粒子全体の比重を1に近づけることができるため、遠心力を印加した際の検査試薬の分離を抑制することができる。好ましくは、金属層の厚さは、コア粒子の直径の10%以下であることが好ましく、より好ましくは3%以下、さらに好ましくは1%以下である。具体的な金属層の厚さは、好ましくは0.3〜100nmであり、より好ましくは1〜5nmである。金属層の材料としては、たとえば、金、白金、銀が挙げられる。
【0031】
上記分散液はコロイド分散液であることが好ましい。本発明において、コロイド分散液とは、直径が1〜1000nmの粒子を分散質として含有する分散液である。
【0032】
上記金属層の表面に、上記被測定物と特異的に結合する性質を有する分子が固定化されていることが好ましい。被測定物に特異的に結合する性質を有する分子と被測定物の組み合わせとしては、たとえば、抗体と抗原、糖鎖とタンパク質、脂質とタンパク質、リガンド(低分子化合物)とタンパク質、タンパク質とタンパク質、一本鎖DNAと一本鎖DNAなどの組み合わせが挙げられる。
【0033】
上記マイクロチップは、少なくとも上記被測定物および上記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有することが好ましい。
【0034】
以下、実施形態を示して、本発明を詳細に説明する。
(実施形態1)
図1は、実施形態1の測定方法を説明するための模式的なグラフである。
【0035】
図1において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0036】
B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースも、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0037】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。
【0038】
なお、本実施形態では、検査試薬1、2は、その各々についてのタイムコースがいずれも正のタイムコースとなるように選択されているが、本発明においては、このように、複数のタイムコースの全てが、正のタイムコースまたは負のタイムコースのいずれかであってもよく、また、後述する実施形態2のように、複数のタイムコースが正のタイムコースおよび負のタイムコースの両者を含んでいてもよい。
【0039】
また、本実施形態では、被測定物Aと検査試薬1との反応、および、被測定物Bと検査試薬2との反応のいずれにおいても反応は緩やかであるため、A1〜A3のタイムコースおよびB1〜B3のタイムコースは、いずれも、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0040】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いることで、検査試薬1および2についてのタイムコースの違いから、被測定物AまたはBのいずれが検体中に含まれているかを検出することができる。また、予備的な測定により、あらかじめ図1のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。なお、本実施形態は、検体が通常は被測定物AまたはBのいずれか一方のみしか含まないものである場合に好適に使用される。
【0041】
(実施形態2)
図2は、実施形態2の測定方法を説明するための模式的なグラフである。
【0042】
図2において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。
【0043】
これに対して、B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースは、時間の経過に伴って上記検出値が減少する傾向を示す負のタイムコースである。
【0044】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についての複数のタイムコースが、全て異なるように選択される。また、検査試薬1、2は、その複数のタイムコースが正のタイムコースおよび負のタイムコースの両者を含むように、選択される。このような各タイムコースは、通常、検査試薬の種類を選択することによって得ることができる。
【0045】
なお、本実施形態では、被測定物Aと検査試薬1との反応、および、被測定物Bと検査試薬2との反応のいずれにおいても反応は緩やかであるため、A1〜A3のタイムコースおよびB1〜B3のタイムコースは、いずれも、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0046】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いることで、検査試薬1および2についてのタイムコースの違いから、被測定物AまたはBのいずれが検体中に含まれているかを検出することができる。本実施形態では、特に、検査試薬1および2についてのタイムコースが正と負のタイムコースであるため、検出結果におけるタイムコースが正または負のいずれであるかのみで、検体中に被測定物AまたはBのいずれが含まれているかを判別することができる。また、予備的な測定により、あらかじめ図2のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。なお、本実施形態は、検体が通常は被測定物AまたはBのいずれか一方のみしか含まないものである場合に好適に使用される。
【0047】
(実施形態3)
図3は、実施形態3の測定方法を説明するための模式的なグラフである。
【0048】
図3において、A1〜A3は、被測定物Aを含む検体と検査試薬1の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。A1、A2、A3の順に、検体中の被測定物Aの濃度は高くなっている。このタイムコースは、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。また、A1〜A3のタイムコースは、被測定物Aと検査試薬1との反応速度が速く、吸光度(検出値)が初期の段階でほぼ定常状態となっているため、検出値の初期値に対する所定時間が経過した時点における検出値の変化量に基づいて被測定物の検出を行うエンドポイント法に適したタイムコースである。
【0049】
B1〜B3は、被測定物Bを含む検体と検査試薬2の混合液について、吸光度(検出値)のタイムコースを示す模式的なグラフである。B1、B2、B3の順に、検体中の被測定物Bの濃度は高くなっている。このタイムコースも、時間の経過に伴って検出値が増加する傾向を示す正のタイムコースである。また、B1〜B3のタイムコースは、被測定物Bと検査試薬2との反応が緩やかであるため、所定時間が経過した時点における検出値の変化速度に基づいて被測定物の検出を行うレート法に適したタイムコースである。
【0050】
すなわち、本実施形態において、検査試薬1および2は、該検査試薬1、2の各々とそれに対応する被測定物A、Bとの反応によって生じる検出部での検出値の変化についてのタイムコースが、共に正のタイムコースであるが、一方がエンドポイント法に適したタイムコースであり、他方がレート法に適したタイムコースである。このような各タイムコースは、通常、検査試薬の種類を選択することによって得ることができる。
【0051】
このような複数種の検査試薬を試薬保持部に備えたマイクロチップを用いた場合、各検査試薬についてのタイムコースがいずれも正(または負)のタイムコースであっても、検体中に含まれる被測定物の判別が容易になる。また、予備的な測定により、あらかじめ図3のA1〜A3やB1〜B3のような測定結果を得ておき、その測定結果に基づいて検量線を作成しておけば、被測定物A、Bの濃度等を測定することもできる。
【実施例】
【0052】
(実施例1)
本実施例のマイクロチップ1を用いた流体処理の概要を、図4(a)〜(d)を参照して説明する。図4(a)〜(d)は、実施例1の測定方法の各工程におけるマイクロチップの上面模式図である。
【0053】
(1)混合工程
まず、図4(a)に示される状態にあるマイクロチップ1に対して、下向き(図4(a)の矢印の方向)に遠心力を印加する。これにより、試薬保持部10に内蔵された検査試薬11と、検体保持部20に導入された検体21とが、混合部30に導入され、混合液31となる(図4(b))。なお、検査試薬11は、インフルエンザAウィルス抗体が固定化されたラテックス試薬と、インフルエンザBウィルス抗体が固定化された金コロイド試薬との混合液である。
【0054】
(2)検出部導入工程
次に、右向き(図4(b)の矢印の方向)に遠心力を印加する。これにより、混合液31は、接続流路を通って検出部40に導入される(図4(c))。
【0055】
(3)検出工程
検出部に充填された混合液31は、光学測定に供され、検査・分析が行なわれる。たとえば、図4(d)に示される矢印の方向から光を照射し、その透過光を測定することにより、混合液中の特定成分の検出等がなされる。
【0056】
本実施例では、インフルエンザA陽性の罹患者およびインフルエンザB陽性の罹患者の各々から採取した鼻汁(鼻をかむことによって排出された液)、両者の等量混合液を検体として用いた。また、対照として、インフルエンザAおよびBに陰性の健常人から採取した鼻汁を用いた。
【0057】
被測定物であるインフルエンザAウィルスに対する検査試薬としては、インフルエンザAウィルス抗体が固定化されたラテックス試薬を用いた。インフルエンザBウィルスに対する検査試薬としては、インフルエンザBウィルス抗体が固定化された金コロイド試薬を用いた。測定に用いた光の波長は505nmとし、各検体につき3回の測定を行った。
【0058】
図5は、実施例1の測定結果を示すグラフである。なお、図5では、全ての測定結果を重ねて表示している。図5に示されるように、インフルエンザA陽性、インフルエンザB陽性、両陽性、および、両陰性の全てを吸光度のタイムコースから判別できることが分かる。ここで、インフルエンザA陽性の検体についてのタイムコースは正のタイムコースであり、インフルエンザB陽性の検体についてのタイムコースは負のタイムコースである。なお、通常はインフルエンザAとインフルエンザBの両方に罹患すること(両陽性)はないと考えられているが、両陽性の場合も考慮して、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁の等量混合液についても測定を行った。図5に示されるように両陽性の検体のタイムコースは、吸光度の変化速度が正から負に変化するという特徴を有している。これに対して、インフルエンザAまたはインフルエンザBのいずれかにのみ陽性の検体のタイムコースは、吸光度の変化速度が常に正であるか、または、常に負であるという特徴を有している。このタイムコースの違いに基づいて、両陽性の検体と、インフルエンザAまたはインフルエンザBのいずれかにのみ陽性の検体とを判別することが可能である。
【0059】
(実施例2)
図6(a)〜(d)は、実施例2の測定方法の各工程におけるマイクロチップの上面模式図である。本実施例では、図6(a)に示されるように、検査試薬11a,11bが別々の試薬保持部10a,10bに内蔵されている。それ以外の点は、実施例1と同様であるため説明は省略する。このような形態は、複数種の検査試薬を測定時まで分離して保持する必要がある場合に有効である。
【0060】
(実施例3)
本実施例では検出部における光学測定を、450nmおよび505nmの2波長を用いて行った。測定は、インフルエンザA陽性の検体(インフルエンザA罹患者の鼻汁)、インフルエンザB陽性の検体(インフルエンザB罹患者の鼻汁)、陰性の検体(健常人の鼻汁)について行った。それ以外の点は、実施例1と同様であるため説明は省略する。
【0061】
図7に、波長450nmの光の吸光度(A450)のグラフを示す。なお、インフルエンザB陽性の検体については、1/2希釈液、1/4希釈液についての測定結果も示す。図7から、波長450nmの光を用いた光学測定により、インフルエンザBウィルスのみを測定できることが分かる。
【0062】
一方、図8は、波長505nmの光の吸光度(A505)から、波長450nmの光の吸光度(A450)×a(定数)を差し引いた値(A505−a×A450)のグラフである。ここで、定数aは、0.79である。この定数aは、ラテックス試薬とインフルエンザAウィルスの反応液についての、波長450nmの光の吸光度に対する波長505nmの光の吸光度の比率であり、ラテックス試薬に固有の値である。インフルエンザウィルスの濃度が変化してもこの比率aはほぼ一定であるとみなしている。なお、インフルエンザA陽性の検体については、1/2希釈液、1/4希釈液についての測定結果も示す。図8から、波長450nmおよび505nmの光を用いた光学測定により、インフルエンザBウィルスのみを測定できることが分かる。このように、複数の波長を用いて測定した場合、全体の測定結果(個々のタイムコースが合成されたタイムコース)から個々の測定結果(個々のタイムコース)を分離して、被測定物の濃度等を調べることができる。
【0063】
(実施例4)
本実施例のマイクロチップ1を用いた流体処理の概要を、図9(a)〜(e)を参照して説明する。図9(a)〜(e)は、実施例4の測定方法の各工程におけるマイクロチップの上面模式図である。
【0064】
(1)第1混合工程
まず、図9(a)に示される状態にあるマイクロチップ1に対して、左向き(図9(a)の矢印の方向)に遠心力を印加する。これにより、試薬保持部10aに内蔵された検査試薬11a(インフルエンザAウィルス抗体が固定化されたラテックス試薬)と、検体保持部20に導入された検体21とが、混合部30aに導入され、混合液31aとなる(図9(b))。
【0065】
(2)第2混合工程
検査試薬11aと検体21とが混合されてから60秒後に、図9(b)に示される状態にあるマイクロチップ1に対して、下向き(図9(b)の矢印の方向)に遠心力を印加する。これにより、混合物30aに導入された混合液31aと、試薬保持部10bに内蔵された検査試薬11b(インフルエンザBウィルス抗体が固定化された金コロイド試薬)とが、混合部30bに導入され、混合液31bとなる(図9(c))。
【0066】
(3)検出部導入工程
次に、右向き(図9(c)の矢印の方向)に遠心力を印加する。これにより、混合液31bは、接続流路を通って検出部40に導入される(図9(d))。
【0067】
(4)検出工程
検出部に充填された混合液31bは、光学測定に供され、検査・分析が行なわれる。たとえば、図9(d)に示される矢印の方向から光を照射し、その透過光を測定することにより、混合液中の特定成分の検出等がなされる。本実施例では波長505nmの光の吸光度を測定した。
【0068】
本実施例では、インフルエンザA罹患者の鼻汁またはその希釈液と、インフルエンザB罹患者の鼻汁またはその希釈液とを、組み合わせた液を検体として用いた。
【0069】
被測定物であるインフルエンザAウィルスに対する検査試薬としては、インフルエンザAウィルス抗体が固定化されたラテックス試薬を用いた。インフルエンザBウィルスに対する検査試薬としては、インフルエンザBウィルス抗体が固定化された金コロイド試薬を用いた。測定に用いた光の波長は505nmとし、各検体につき1回の測定を行った。
【0070】
測定結果を図10に示す。図10において、A0は、健常人の鼻汁のみの測定結果であり、A1は、インフルエンザB罹患者の鼻汁の1/2希釈液のみの測定結果であり、A2は、インフルエンザB罹患者の鼻汁のみの測定結果である。E0は、インフルエンザA罹患者の鼻汁のみの測定結果であり、D0、C0、B0は、それぞれ、インフルエンザA罹患者の鼻汁の1/2希釈液、1/4希釈液、1/8希釈液のみの測定結果である。E1は、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁の1/2希釈液との等量混合液の測定結果であり、E2は、インフルエンザA罹患者の鼻汁とインフルエンザB罹患者の鼻汁との等量混合液の測定結果である。
【0071】
図11は、図10に示す測定結果から、ラテックス試薬(検査試薬11a)の混合時から金コロイド試薬(検査試薬11b)の混合時までのグラフを外挿したグラフである。このように、図10の0時間の吸光度(図10の矢印で示す部分)に基づいてインフルエンザAウィルスの測定が可能であることが分かる。
【0072】
図12の「E1−E0」は、図10に示すE1の吸光度からE0の吸光度を引いた値のグラフであり、「E2−E0」は、図10に示すE2の吸光度からE0の吸光度を引いた値のグラフである。このようにして、インフルエンザBウィルスの測定が可能であることが分かる。
【0073】
(実施例5)
本実施例では、実施例1で用いた金コロイド試薬に(金粒子の表面にインフルエンザAウィルス抗体が固定化された金粒子のコロイド分散液)に代えて、図13に示すような2層構造の粒子の表面に抗体が固定化された複合粒子のコロイド分散液を使用する。図13では、比重1程度の材料(樹脂など)からなるコア粒子50の表面に薄い金属コーティング(金属層)51が形成されている。そして、該金属コーティング51の表面には、インフルエンザAウィルス抗体などの抗体52が固定化されている。
【0074】
遠心力を利用して流体処理を行うマイクロチップにおいて、検査試薬として金属コロイド試薬を用いる場合、金属の比重(たとえば、Au:19.3、Pt:21.45、Ag:10.49)は水の比重1に比べて重いため、流体処理における遠心力の印加により、図14に示すように、金コロイド試薬を含む混合液31中で金属5が分離してしまう場合があった。
【0075】
これに対して、本実施例では、試薬中の複合粒子の比重は、コア材料50の比重と同程度であるため、流体処理における遠心力の印加によりバイオチップ内の混合液中で抗体が固定化された粒子が分離してしまう現象を抑制することができる。
【0076】
また、比重1程度の材料が樹脂である場合、該樹脂からなるコア粒子50は、種々公知の方法により容易に粒子径を制御することが可能であるため、これにより測定感度を向上させることが可能である。樹脂としては、たとえば、ポリエチレン(PE)、ポリプロピレン(PP)、ポリスチレン(PS)、ABS樹脂、AS樹脂、ポリカーボネート(PC)、ポリエチレンテレフタレート(PET)、ポリメチルペンテン(PMP)が挙げられる。金属コーティング51の材料としては、たとえば、金、白金、銀等が挙げられる。
【0077】
なお、金属コロイド試薬を用いる場合、光と金属表面に存在する自由電子と相互作用による表面プラズモン共鳴を利用して測定が行われる。本実施例の金属コロイド試薬においても、金属コーティング(金属層)の表面に自由電子が存在し、表面プラズモン現象が発現するため、免疫反応等の体外診断用の検査試薬として必要な特性は維持している。このように、本実施例の金属コロイド試薬は、検査試薬としての特性は維持したまま、遠心力を印加しても分離しないという好ましい特性を有しており、特に遠心力を利用して流体処理を行うマイクロチップに好適に用いることができる。
【0078】
今回開示された実施の形態および実施例はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【符号の説明】
【0079】
1 マイクロチップ、10,10a,10b 試薬保持部、11,11a,11b 検査試薬、20,20a,20b 検体保持部、21,21a,21b 検体、30,30a,30b 混合部、31,31a,31b 混合液、40 検出部、5 金属、50 コア粒子、51 金属コーティング(金属層)、52 抗体。
【特許請求の範囲】
【請求項1】
被測定物を測定するためのマイクロチップに用いられる検査試薬であって、
コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、
前記複合粒子の比重が10以下であることを特徴とする、検査試薬。
【請求項2】
前記コア粒子は、比重が0.8〜1.2である材料からなる、請求項1に記載の検査試薬。
【請求項3】
前記コア粒子は、樹脂からなる、請求項1または2に記載の検査試薬。
【請求項4】
前記分散液はコロイド分散液である、請求項1に記載の検査試薬。
【請求項5】
前記金属層の表面に、前記被測定物と特異的に結合する性質を有する分子が固定化されている、請求項1に記載の検査試薬。
【請求項6】
前記マイクロチップは、少なくとも前記被測定物および前記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有する、請求項1に記載の検査試薬。
【請求項1】
被測定物を測定するためのマイクロチップに用いられる検査試薬であって、
コア粒子と該コア粒子の表面を覆う金属層とを備える複合粒子を、分散質として含有する分散液からなり、
前記複合粒子の比重が10以下であることを特徴とする、検査試薬。
【請求項2】
前記コア粒子は、比重が0.8〜1.2である材料からなる、請求項1に記載の検査試薬。
【請求項3】
前記コア粒子は、樹脂からなる、請求項1または2に記載の検査試薬。
【請求項4】
前記分散液はコロイド分散液である、請求項1に記載の検査試薬。
【請求項5】
前記金属層の表面に、前記被測定物と特異的に結合する性質を有する分子が固定化されている、請求項1に記載の検査試薬。
【請求項6】
前記マイクロチップは、少なくとも前記被測定物および前記検査試薬を遠心力を利用してある部位から他の部位へ移送するための構造を有する、請求項1に記載の検査試薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−242278(P2012−242278A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−113588(P2011−113588)
【出願日】平成23年5月20日(2011.5.20)
【出願人】(000116024)ローム株式会社 (3,539)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月20日(2011.5.20)
【出願人】(000116024)ローム株式会社 (3,539)
【Fターム(参考)】
[ Back to top ]

