マイクロニードル溶着法
【課題】マイクロニードルの先端部のみに薬物を保持させたマイクロニードルアレイとその製造方法を提供する。
【解決手段】マイクロニードルの先端部のみに薬物を保持させたマイクロニードルアレイは、マイクロニードル溶着法すなわちa)水溶性高分子を素材としてマイクロニードルアレイを作成し、b)マイクロニードルアレイ先端に付着させる薬物溶液を作成し、c)マイクロニードルアレイの先端を該薬物溶液に短時間接触させて、製造する。このとき薬物溶液には薬物のほか水溶性高分子をも高濃度に溶解して粘度を高くしておくならば、付着した薬物はマイクロニードルと一体的となり、刺入に際し薬物のみが剥がれ落ちることがない。
【解決手段】マイクロニードルの先端部のみに薬物を保持させたマイクロニードルアレイは、マイクロニードル溶着法すなわちa)水溶性高分子を素材としてマイクロニードルアレイを作成し、b)マイクロニードルアレイ先端に付着させる薬物溶液を作成し、c)マイクロニードルアレイの先端を該薬物溶液に短時間接触させて、製造する。このとき薬物溶液には薬物のほか水溶性高分子をも高濃度に溶解して粘度を高くしておくならば、付着した薬物はマイクロニードルと一体的となり、刺入に際し薬物のみが剥がれ落ちることがない。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は皮膚表層及び/又は皮膚角質層に修飾効果及び/又は機能効果を与えるためのマイクロニードル溶着法に関する。
【背景技術】
【0002】
薬物を人の体内に投与する手法として、経口的投与と経皮的投与がよく用いられている。注射は代表的な経皮的投与法である。しかし、注射は医師・看護師のような専門家の手を煩わせねばならず、苦痛を伴い、更にエイズやB型肝炎などの感染もあり得る、多くの人にとって歓迎すべからざる手法である。これに対し、最近マイクロニードルアレイを利用した、苦痛を伴わない経皮的投与法が注目されてきた(非特許文献1)。
【0003】
薬物の経皮的投与の際、皮膚角質層は薬物透過のバリアとして働き、単に皮膚表面に薬物を塗布するだけでは透過性は必ずしも十分ではない。これに対し微小な針、すなわちマイクロニードルを用いて角質層を穿孔することにより、塗布法より薬物投与効率を格段に向上させることができる。このマイクロニードルを基板上に多数集積したものがマイクロニードルアレイである。また、マイクロニードルアレイに、マイクロニードルアレイを皮膚に付着させるための粘着テープや使用まで無菌状態を維持するためのカバーシートなど各種テープを付加して使用しやすい製品としたものをマイクロニードルパッチという。
ここにテープとは、フィルムに粘着剤を塗布したものをいう。
【0004】
マイクロニードルの素材としては、当初、金属やシリコンが用いられていた。ステンレス針で皮膚を穿孔し、その上に薬液を流してその穴より薬物を吸収させる方法(特許文献1)や、ステンレス針の表面に薬物を被覆したうえ刺入して薬物を投与する方法(特許文献2)が提案された。さらには、単に注射針を微小化した中空マイクロニードルにより薬液を注入することも提案された(特許文献3)。
しかし、薬液流延法は薬物取込効率が悪いのみか滅菌性に疑問があり、被覆法は被覆薬物が刺入時に剥がれて薬物取込効率が低く、微小注射針法は構造が複雑となる等の欠点があった。さらに金属やシリコンマイクロニードルは、体内で折れたとき事故となる欠点があった。
【0005】
これに対し、体内で溶解する物質を用いてマイクロニードルを作成すればこのような諸問題を解決することができる(特許文献4)。また、マイクロニードルの素材として皮膚投与後皮膚内で水分により溶解する高分子(生体溶解性高分子)を用いると、マイクロニードルの皮膚適用により皮膚内水分が針部に拡散し、皮膚に差し込まれた針部が膨潤しその後溶解する。針部の溶解によるヒアルロン酸やコラーゲンの皮膚内拡散により抗しわ作用を発現し、あるいは針部に前もって溶解させている薬物や有価物質を皮膚内に放散する(特許文献5、6)。
【0006】
生体溶解性高分子からなるマイクロニードルアレイは、鋳型を用いて製造されることが多い(特許文献5)。感光性樹脂を用いてリソグラフィ法によりマイクロニードルパターンを形成した後転写し、マイクロニードル形成用凹部を有する鋳型を作成する。マイクロニードル素材をこの鋳型上に流延し、次に加熱して水分を蒸発させた後、固化したものを鋳型から剥離してマイクロニードルアレイを得ることができる。
【0007】
マイクロニードルアレイに含有させる薬物には非常に高価なものや微量しか得られないものもある。そのような高価貴重な薬物を素材に含有させて常法によりマイクロニードルアレイを作成すると、薬物はマイクロニードル部分のみならず基板部分にも含まれることとなる(特許文献7)。このマイクロニードルアレイを皮膚に刺入すると、マイクロニードル部分に含まれる薬物は体内に取り込まれ拡散するが、基板部分に存在する薬物は利用されることなく廃棄され、高価な薬物の利用効率が低い結果となる。
【0008】
高価な薬物を効率的に利用する試みはすでにいくつか知られている。マイクロニードル表面を被覆する方法(特許文献2)の他、薬物をマイクロニードル先端に付着させる方法(特許文献8)、マイクロニードルが柔らかい内に遠心分離して薬物をニードル先端に集める方法(特許文献9)、鋳型に薬物入り素材溶液を充填し乾燥後薬物を含まない素材溶液を充填してマイクロニードル先端部にのみ薬物を保持させる方法(特許文献10)などが報告されている。この薬物を先端に付着させる特許文献8の方法は、薬物を約100℃に加温し溶解させてマイクロニードル先端部に付着させる点に特色がある。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平3−151982号公報
【特許文献2】特開2008−029710号公報
【特許文献3】特表2002−517300号公報
【特許文献4】特開2003−238347号公報
【特許文献5】特開2009−273872号公報
【特許文献6】特開2010−029634号公報
【特許文献7】特開2008−303162号公報
【特許文献8】特開2006−346127号公報
【特許文献9】特表2009−507573号公報
【特許文献10】特再表2009−066763号公報
【非特許文献】
【0010】
【非特許文献1】権英淑、神山文男「マイクロニードル製品化への道程」、薬剤学、社団法人日本薬剤学会、平成21年9月、第69巻、第4号、p.272−276.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明が解決しようとする課題は、従来技術の問題点を解決し、高価な薬物の有効利用を図る新しい方法を提供することである。
薬物をマイクロニードルの先端に付着させる特許文献8の方法はそのため薬物を100℃以上に加温するならば、高価貴重な薬物が熱分解する場合が多い。従って、薬物をマイクロニードル先端に付着させるとき、加温することは避けるべきである。
また特許文献8の方法では、薬物は単にマイクロニードル先端に付着したものであるため、薬物の付着強度が弱くマイクロニードルを皮膚に刺入するに際し付着部分が折れて薬物が剥がれたりし、薬物が十分取り込まれない問題点を有している。これらの問題点を解決する必要がある。
【課題を解決するための手段】
【0012】
上記課題を解決するためになされた本発明に係わるマイクロニードル溶着法は、
a)水溶性高分子を素材としてマイクロニードルアレイを作成し、
b)該マイクロニードルアレイ先端に付着させる薬物溶液を作成し、
c)該マイクロニードルアレイの先端を該薬物溶液に短時間接触させて製造し、
このとき、前記薬物溶液には前記薬物のほか水溶性高分子をも溶解しておき、前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、少なくとも1種の同一成分を含み、かつ前記薬物は水溶性高分子と一体的にマイクロニードル先端部位取り込まれていることを特徴とする。
【0013】
マイクロニードルアレイ先端に効率よく薬物を付着させるためには、マイクロニードルアレイ素材と薬物溶液は相溶性があることが好ましい。そのためには薬物とマイクロニードル素材が共に水溶性であることが好ましい。薬物溶液は水を主としてそれに混和する有機溶媒との混合液であってもよい。水に混和する有機溶媒の例は、エタノール、アセトンである。
【0014】
さらに薬物溶液に水溶性高分子を溶解させて薬物溶液の粘度を高めておくことが好ましい。水溶性高分子の溶解により粘度が上昇し、マイクロニードル先端部への薬物溶液の溶着量が増大するからである。水溶性高分子の水溶液中の濃度は1〜20%、好ましくは2〜15%である。水溶性高分子の濃度が小さければ薬物溶液のニードル接触による溶着量が少なく、また濃度が高すぎると流動性がなくなり溶着操作がスムースに行われにくくなる。
薬物溶液中の水溶性高分子の適正な濃度は、薬物溶液の溶液粘度により決めることができる。薬物溶着に好ましい薬物溶液の粘度は、1.0dPa・s〜90dPa・sの範囲である。薬物溶液の粘度が1.0dPa・s未満であると、粘度が低すぎて溶着量が少なくなる。また90dPa・sを超えると薬物溶液への接触後引き離しても糸引きが起こりがちである。なお、粘度はいずれも室温(25℃)での値とする。
【0015】
該マイクロニードルアレイの先端を該薬物溶液に接触させる時間は、長すぎると水溶性マイクロニードル素材が薬物溶液中で溶解してしまうので、0.01〜5秒が望ましい。
【0016】
薬物とマイクロニードル素材である水溶性高分子を併せて薬物水溶液とすることにより、マイクロニードル先端部を薬物水溶液に浸したとき、先端部が部分的に溶解するため薬物は水溶性高分子と一体的にマイクロニードル先端に取り込まれることとなる。このように薬物と素材が一体化したマイクロニードルは皮膚刺入の際、溶着部分すなわち薬物が剥がれ落ちることがなく、薬物が体内に完全に取り込まれることとなる。
ここに、一体的とは、元のマイクロニードル先端部と新たに溶着した部分との間に明確な境界面が存在しないことをいう。境界部分では、薬物は濃度勾配を有しているものと思われる。このような一体化することを特徴とする方法を溶着法という。
【0017】
本発明でいう薬物には、体内に取り込まれることにより何らかの効果を生じる全ての物質を含むものとする。
高価な薬物や大量に得ることが困難な薬物を経皮的に人体に投与したいとき、本方法を用いるのが適当である。安価な薬物や大量に得られる薬物については、常法に従い、当初より薬物をマイクロニードル素材に混合し、その混合素材よりマイクロニードルを作成すればよい。
【0018】
薬物が有機溶剤にのみ溶解するときは、その有機溶剤に薬物を溶解した溶液を水溶性高分子水溶液中に混合して薬物水溶液を作製し同様な手順の手順を用いることができる。また薬物が完全に水溶性高分子溶液中に溶解せずに粒子状に懸濁した場合であっても懸濁が均一でありかつ粒子径が数μm以下であれば溶着及び体内投与は薬物が溶解した場合と同様に挙動する。
【0019】
本発明の目的に適した薬物の例としては数mgの体内投与で有効性を発揮する薬物であればあらゆる薬物が対象となるが特に高分子医薬に有効である。例えば、生理活性ペプチド類とその誘導体、核酸、オリゴヌクレオチド、各種の抗原蛋白質、バクテリア、ウイルスの断片等が挙げられる。 上記生理活性ペプチド類とは、例えば、インスリン、エクセンジン−4、エクセンジン−4誘導体、カルシトニン、副腎皮質刺激ホルモン、副甲状腺ホルモン(PTH)、hPTH(1→34)、セクレチン、オキシトシン、アンギオテンシン、β−エンドルフィン、グルカゴン、バソプレッシン、ソマトスタチン、ガストリン、黄体形成ホルモン放出ホルモン、エンケファリン、ニューロテンシン、心房性ナトリウム利尿ペプチド、成長ホルモン、成長ホルモン放出ホルモン、ブラジキニン、サブスタンスP、ダイノルフィン、甲状腺刺激ホルモン、プロラクチン、インターフェロン、インターロイキン、G−CSF、グルタチオンパーオキシダーゼ、スーパーオキシドディスムターゼ、デスモプレシン、ソマトメジン、エンドセリン、EGF、FGFなど皮膚関連成長因子、ボツリヌストキシン、及びこれらの塩等が挙げられる。抗原蛋白質ないしはウイルス断片としては、インフルエンザ抗原、破傷風抗原、ジフテリア抗原、HBs表面抗原、HBe抗原等が挙げられる。が挙げられる。これらは本発明の薬物水溶液中に溶解あるいは懸濁状態で均一に分散していることが必要である。
【0020】
本発明のマイクロニードル素材として、ヒアルロン酸、コラーゲンやデキストリン、デキストラン、コンドロイチン硫酸、ゼラチン、プロテオグリカン等の水溶性天然物高分子物質が適当である。ポリビニルピロリドン、ポリビルルアルコール(部分ケン化物)、ポリアクリル酸(塩)等の合成高分子物質も使用し得る。またそれら高分子同士のブレンドあるいは低分子水溶性物質をブレンドしてマイクロニードルの物性を改善することも可能である。このようにして製造したマイクロニードルアレイに、粘着テープやバーシートなど各種テープを付加して使用しやすい製品とすれば、薬物を先端にのみ有するマイクロニードルパッチとなる。
【0021】
従来多くの報告があるような薬物をニードル部と基板部双方に含浸させる方法では、基板部を薄くしてもその限界があり50μmは必要である。その場合はマイクロニードルアレイ中の薬物に比べさらに多くの薬物が基板部に存在し、基板部に存在する薬物は皮膚内に投与されないという欠点を有する(特許文献7)。
また、上記欠点を補うためにマイクロニードル用鋳型に薬物入り素材溶液を流延し、乾燥後マイクロニードルを残して基板素材を除去後に薬物を含まない素材溶液を流延し、乾燥させて基板を形成する試みもある(特許文献10)。しかしながらこの方法では素材溶液を塗布した時点において薬物が基板素材溶液中に拡散してしまい針部の薬物量が減少するという欠点を有する。
これらの点については、実施例中の比較例1、2を参照されたい。
【発明の効果】
【0022】
高価かつ貴重な薬物を、マイクロニードルの先端部のみに保持することにより、薬物の無駄を防ぎ、薬物を経済的かつ有効に利用することができる。基板内に薬物が存在していても、マイクロニードルの皮膚刺入により体内に吸収されることがないためである。
【0023】
本方法は、薬物を溶媒に溶かしてマイクロニードルの先端に溶着させるものであるから、薬物を加熱する必要がない。有用な薬物の中には100℃程度の加熱で分解するものが多く、従来法の適用が困難であったが、本方法にはその弱点がない。
薬物とマイクロニードル素材とを共に含む溶液にマイクロニードル先端部を接触させてマイクロニードルに薬物を取り込む方式とすれば、元の部分と新たに付着した部分との境界面がなくなり、マイクロニードルは一体的となる。一体的であるときは、マイクロニードルを皮膚に刺入するに際し、薬物のみが剥がれ落ちることがない。
本方法においては乾燥は風乾、空気吹き付け、熱風吹き付け、窒素ガス吹き付け、などを必要に応じて採用することができる。また乾燥することなくアルミパウチ等に乾燥剤とともに密封することも可能である。
また本方法において、薬物溶液との接触時間、ニードルの接触深さ、などを変化させることによりニードルの長さを調整することが可能であり、これは本溶着法の他法に比べての大きな特徴である。
【図面の簡単な説明】
【0024】
【図1】本発明のマイクロニードル溶着法の概略図。
【図2】糖尿病モデルラットのインスリン投与後の血糖値の時間変化を示す図
【図3】GKラットのエクセンジン−4投与後の血糖値の時間変化を示す図
【図4】GKラットのエクセンジン−4投与後の薬物濃度の時間変化を示す図
【図5】 薬物溶液へのマイクロニードルアレイ接触深さを変え作成した溶着後マイクロニードル写真
【発明を実施するための形態】
【0025】
薬物溶液とマイクロニードルの先端部とを接触させるには次のような方法がある。
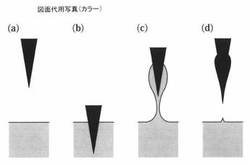
(1)薬物溶液面にマイクロニードルアレイを上から浸漬する(図1)。
(2)マイクロニードルアレイを上向きに置きスポンジに含浸させた薬液を上から接触させる。
(3)薬液を層流として上から流しマイクロニードルアレイを横向きにして短時間接触させる。
以下の実施例においては(1)の方法によっているが、(2)、(3)の方法を採用することもできる。
次に、本発明の実施例を図面を参照して詳細に説明するが、本発明は実施例に限定されるものではない。
【実施例1】
【0026】
(溶着法による薬物含有マイクロニードルの製造)
本発明のマイクロニードルアレイは、鋳型を用いて製造した。感光性樹脂に光照射するリソグラフィ法により円錐台型のマイクロニードルパターンを形成した後、電鋳加工することにより円錐台型のマイクロニードルパターンを転写した円錐台型のマイクロニードル形成用凹部が形成された鋳型を用いた。
【0027】
マイクロニードル形成用鋳型凹部は根元の直径が0.16mm、先端直径が0.03mm、深さ0.8mmの円錐台状であり、0.6mm間隔に格子状に配列されており、1cm2あたり250個形成されている。又、マイクロニードルアレイは直径10mmの円形に形成した。
【0028】
水溶性高分子としてヒアルロン酸を用いた。ヒアルロン酸水溶液は、重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名「FCH−SU」)、培養由来)13.5重量部と重量平均分子量1万の低分子量ヒアルロン酸(キューピー株式会社製、商品名「ヒアルオリゴ」、培養由来)1.5重量部を水85重量部に溶解して得た。このヒアルロン酸水溶液を鋳型上に流延し、加熱して水分を蒸発させ、鋳型から剥離しヒアルロン酸マイクロニードルアレイを得た。得られたマイクロニードルは上記金型の形を反映したものであり、根元の直径が0.16mm、先端直径が0.03mm、高さ0.8mmの円錐台状であった。マイクロニードルアレイは、マイクロニードルが0.6mm間隔に格子状に配列されており、直径10mmの円形であった。
【0029】
別途、牛インスリン(ナカライテスク株式会社)をpH2.5の塩酸水溶液に溶解し水溶液を上記ヒアルロン酸水溶液に添加し1.0ユニット(U)/ml濃度の薬物溶液を得た。粘度は25dPa・sであった。
【0030】
薬物溶液上方に得られたマイクロニードルアレイを置き(図1(a))、マイクロニードルアレイを降下させてマイクロニードルの先端部100μmを1秒間接触させ(図1(b))た。その後引き上げ(図1(c))、取り出し(図1(d))、風乾して先端部インスリン濃縮マイクロニードルアレイを20枚得た。
【0031】
得られたマイクロニードルアレイを顕微鏡観察するとニードル先端部は図1(d)のように膨れていた。元のマイクロニードルと溶着部分であるインスリン含有ヒアルロン酸とはまったく一体化していることが観察された。
得られたマイクロニードルアレイ3枚を使用して先端に付着したインスリン量を測定した。測定はグラザイムinsulin−EIA TEST キット(和光純薬工業株式会社)を利用した。マイクロニードルアレイ1枚にインスリン0.25ユニットを含有していることを確認した。含有量のばらつきは20%以内であった。
【0032】
(血糖値測定試験)
製造したマイクロニードルアレイを用い、ラットにインスリンを経皮投与した。
ストレプトゾトシン投与により作成した糖尿病モデルラット(体重約300g)の腹部を除毛した。このラットを14時間以上絶食させた後、除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)でマイクロニードルアレイを皮膚に固定した。マイクロニードルアレイ投与後、0.5、1、2時間経過後に採血し血糖値を測定した。血糖値の測定はGlucoseCII−test kit(和光純薬工業株式会社)を用いた。試験数は4例であった。
【0033】
皮下注射によりラットにインスリンを投与した。
糖尿病モデルラットを14時間以上絶食させた後、皮下注射により0.25ユニットのインスリンを投与した。インスリン投与後、0.5,1、2時間経過後に採血し血糖値を測定した。血糖値の測定は実施例1と同様にGlucoseCII−test kitを用いた。試験数は4例であった。
【0034】
血糖値測定試験の基準として、コントロール(インスリン投与なし)の測定を行った。
糖尿病モデルラットを14時間以上絶食させた後、0.5、1、2時間経過後に採血し血糖値を測定した。血糖値の測定は実施例1と同様にGlucoseCII−test kitを用いた。試験数は4例であった。
【0035】
(血糖値試験の結果と考察)
上記3つの試験結果を血糖値の時間変化として図2に示した。それぞれの0時間値(初期値)を100として、血糖値の相対値を示す。本図から明らかなように、血糖値は、マイクロニードル投与法によれば皮下注射投与法と同様に降下した。
【実施例2】
【0036】
(溶着法による薬物含有マイクロニードルの製造:ヒアルロン酸が主成分の場合)
水溶性高分子溶液はヒアルロン酸(株式会社紀文フードケミファ製、重量平均分子量80万、商品名FCH−80L)6重量部及びポリビニルピロリドン(BASFジャパン株式会社製、商品名コリドン12PF)3重量部を水91部に溶解して得た。水溶性高分子溶液組成及び乾燥を風乾でなく窒素ガス吹き付けであることを除いては実施例1と同様の操作でマイクロニードルアレイを製造した。マイクロニードル及びマイクロニードルアレイの形状・寸法は実施例1と同じである。
【0037】
薬物としてエクセンジン−4(和光純薬工業株式会社)を使用した。エクセンジン−4はII型糖尿病治療薬であり、分子量4200のたんぱく質であり、血糖値降下作用を有する。重量平均分子量10万の高分子量ヒアルロン酸(紀文フードケミカル社製、商品名FCH−SU、培養由来)の10重量%の水溶液にエクセンジン−4を30mg/mlになるよう溶解して薬物溶液を調整した。
冶具を用いてマイクロニードルアレイの先端200μmを薬物溶液に接触しただちに取出して窒素ガスを吹き付けて乾燥させ、薬物先端溶着マイクロニードルアレイを20枚作製した。
【0038】
(溶着法による薬物含有マイクロニードルの製造:ポリメチルメタクリレートの場合)
実施例1に用いたと同様の鋳型を用いてポリメチルメタクリレート(MMA)を素材とするマイクロニードルアレイを作製した。MMA(和光純薬工業株式会社)の10%トルエン溶液を鋳型に注入し40℃で48時間乾燥させて実施例2と同一形状のMMAマイクロニードルアレイを作製した。冶具を用いてマイクロニードルアレイの先端200μmを実施例2と同様の薬物溶液に接触し、ただちに取出して窒素ガスを吹き付けて乾燥させて薬物先端溶着マイクロニードルを作製した。
【0039】
(エクセンジン−4の存在量の確認)
エクセンジン−4の存在量は酵素免疫測定法により決定した。薬物溶着マイクロニードルをイオン交換水に溶解させた溶液、又はラット静脈から採血した血液を試料とし、Exendin−4 EIA kit(和光純薬工業株式会社)により試料中のエクセンジン−4濃度を決定した。
作成したマイクロニードルアレイ3枚を使用して先端に付着したエクセンジン−4の量をこの方法で測定した。ヒアルロン酸が主成分の場合もMMAの場合も、マイクロニードルアレイ1枚にエクセンジン−4が10μg含まれていることを確認した。含有量のばらつきは15%以内であった。
【0040】
(血糖値測定試験)
製造したマイクロニードルアレイを用い、ラットにエクセンジン−4を経皮投与して糖負荷試験を行い、皮下注射法及びコントロールと比較した。
GKラット、自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社より購入)を麻酔後、背部を除毛した。14時間以上絶食させた後、除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)で皮膚に固定した。マイクロニードルアレイ投与30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。投与後、15、30、60、90、120分経過後に採血し血糖値を測定した。試験数は5例であった。
血糖値の測定はGlucose CII−test kit(和光純薬工業株式会社)を用いた。
【0041】
(エクセンジン−4血中濃度変化試験)
製造したマイクロニードルアレイを用い、ラットにエクセンジン−4を経皮投与してエクセンジン−4血中濃度変化試験を行い、皮下注射法及びコントロールと比較した。
GKラット、自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社より購入)を麻酔後、背部を除毛した。14時間以上絶食させた後除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)で皮膚に固定した。マイクロニードルアレイ投与30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。糖投与後、15、30、60、90、120分経過後に採血し、エクセンジン−4の濃度を測定した。試験数は5例であった。
【0042】
血糖値測定試験及び薬物血中濃度変化試験のいずれにおいても、マイクロニードル経皮投与法と比較するため、皮下注射投与法と薬物を投与しないコントロール試験を行った。
皮下注射投与法は次のように行った。GKラット自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社)を14時間以上絶食させた後皮下注射により10μgのエクセンジン−4を投与した。その30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。ブドウ糖投与後、15、30、60、90、120分経過後に採血し、血糖値及びエクセンジン−4の濃度を測定した。試験数は5例であった。
コントロールは次のように行った。GKラット自然発症2型糖尿病モデル(同上)を14時間以上絶食させた30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。ブドウ糖投与後、15、30、60、90、120分経過後に採血し、血糖値及びエクセンジン−4の濃度を測定した。試験数は3例であった。
【0043】
糖負荷後の血糖値の時間変化を図3に示す。図における記号は以下のようである。
Control:エクセンジン−4投与なし
S.C.10μg:エクセンジン−4を皮下注射により投与
MN(HA)10μg:エクセンジン−4をヒアルロン酸が主成分のマイクロニードルにより投与
MN(MMA)10μg:エクセンジン−4をMMAのマイクロニードルにより投与
【0044】
薬物投与30分後に糖負荷し、その後の血中エクセンジン−4濃度の時間変化を図4に示す。図中の記号は図3と同じである。
【0045】
(試験結果及び考察)
図3によれば、ブドウ糖負荷後Control群の血糖値は急激に上昇しているが、S.C.10μg群及びMN(HA)10μg群では血糖値の上昇が抑えられている。一方、MN(MMA)群の血糖値はControl群よりは低いがMN(HA)10μg群の血糖値に比較してはるかに高い。この結果は同じ10μgを先端塗布したマイクロニードルであってもヒアルロン酸からなるマイクロニードルはポリメチルメタクリレートからなるマイクロニードルよりも血糖値を抑える効果が高いことを示している。
【0046】
図4によれば、ブドウ糖負荷30分前にエクセンジン−4を投与した3群において、S.C.10μg群及びMN(HA)10μg群では急激に血中エクセンジン−4濃度が増加し、投与後45分(ブドウ糖負荷後15分)に濃度は最大となっている。一方、MN(MMA)10μg群の血中エクセンジン−4濃度は、MN(HA)10μg群の濃度に比較してはるかに低い。
【0047】
図3、4の結果は、ヒアルロン酸マイクロニードルに溶着させた薬物(エクセンジン−4)はポリメチルメタクリレートマイクロニードルに付着させた場合に比べてマイクロニードルの皮膚適用による薬物体内浸透量が極めて大きく、それにより血糖値の低下作用も大きいことを示している。MN(HA)による投与は皮下注射と同様の挙動を示すことから、マイクロニードルに溶着されたすべての薬物が体内浸透することを示している。一方、MN(MMA)においてはニードルに付着した薬物はその数分の1しか体内に浸透していないことを示している。
この原因として、MN(MMA)先端に付着した薬物の付着強度が弱いためマイクロニードル刺入に際し角質を通過する時薬物がマイクロニードルから剥がれて体内吸収されないことが考えられる。それに反しMN(HA)においては、薬物は溶着のさいマイクロニードルと一体化しているので刺入の際剥がれおちることは一切なく、全量が体内吸収されるものと思われる。
【実施例3】
【0048】
重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名FCH−SU、培養由来)の種々の濃度の水溶液を作成し、以下の粘度になるようにヒアルロン酸と水の割合を調整した。調整した溶液の粘度は、0.5、1.0、5.0、20、50、90、150dPa・sであった。室温は25度であった。それらの7種の濃度の異なった水溶液中に赤色102号(和光純薬工業株式会社)を濃度0.5%になるように均一に溶解させた。
マイクロニードルアレイは、実施例1と同様にして直径1.0cmの円形のマイクロニードルアレイを作成した。
【0049】
得られた種々の粘度のヒアルロン酸水溶液にマイクロニードルアレイの先端部150μmを1秒間接触した後、取り出し風乾した。接触により溶着したヒアルロン酸水溶液量を評価するためにマイクロニードルアレイ1枚を2mlのイオン交換水に溶解し赤色102号の濃度を510nmでの吸光度により測定した。その測定値から各種ヒアルロン酸濃度の異なる水溶液のマイクロニードルアレイ1枚当たりの溶着量を算定し、結果を下表に示す。
【0050】
【表1】


【0051】
水溶液粘度が低いと溶着量が低い。高くなるに従い取り扱い性が悪くなり、かつ針の形状も不規則となる。適切な水溶液粘度は1.0〜90dPa・sであり、より望ましくは5.0〜50dPa・sであることがわかった。
【0052】
(比較例1)
実施例1において使用したマイクロニードル形成用鋳型凹部を用い、次のような直径1cmのマイクロニードルアレイを作製した。
水溶性高分子溶液がヒアルロン酸(株式会社紀文フードケミファ製、分子量80万、商品名FCH−80L)14.995重量部、モデル薬物として赤色102号色素0.005重量部、水85部からなる水溶液を用いた。この水溶液0.3mlを鋳型に流延し、室温で乾燥させてマイクロニードルアレイ(直径1cm)を成形した。マイクロニードルアレイを鋳型から取り出し、顕微鏡にて観察下そのマイクロニードルアレイの針部を鋭利なカッターナイフで注意深く削り取り、針部部と基板部に分離した。それぞれをイオン交換水に溶解させ、510nmの吸光度を測定してモデル薬物の針部と基板部への分配比を求めた。
針部存在量:基板部存在量 = 0.048:0.952
よって、このような方法でマイクロニードルアレイを作成すると、薬物の大部分が基板部に未利用で残ることが予想される。
【0053】
(比較例2)
水溶液の鋳型充填量が0.15mlであることを除き比較例1と同様にして鋳型上にマイクロニードルアレイを成形した。次いで鋳型表面に皮膜状に存在する基板部を濡れたコットンで丁寧に拭き取った。
次いで、ヒアルロン酸(紀文フードケミファ製、分子量80万、商品名FCH−80L)15重量部、水85部からなる赤色102号色素を含まない水溶液の0.3mlを鋳型に流延し、40℃で乾燥させてマイクロニードルアレイ(直径1cm)を成形した。マイクロニードルアレイを鋳型から取り出し、顕微鏡にて観察下そのマイクロニードルアレイの針部を鋭利なカッターナイフで注意深く削り取り、針部と基板部に分離した。それぞれをイオン交換水に溶解させ、510nmの吸光度を測定してモデル薬物の針部と基板部への分配比を求めた。
針部存在量:基板部存在量 = 0.62:0.38
赤色102号モデル薬物は、本来針部にのみ存在していたものである。しかしこの結果は、基板部形成のためヒアルロン酸水溶液を鋳型上に流延し乾燥させる工程の中で、針部から基板部へ薬物が拡散することを示している。
よって、このような方法では、マイクロニードル部分にのみ薬物を保持するマイクロニードルアレイを作成することはできない。
【実施例4】
【0054】
重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名FCH−SU、培養由来)の水溶液を作成した。溶液の粘度は、5.0dPa・sであった。室温は25℃であった。本水溶液中にFD4、(フルオレセンデキストラン、モデル化合物、和光純薬工業株式会社)を濃度5%になるように均一に溶解させた。マイクロニードルアレイは高さが0.65μmであること除いては実施例1と同様の鋳型を用いて直径1.0cmの円形のマイクロニードルアレイを作成した。
【0055】
得られたヒアルロン酸水溶液にマイクロニードルアレイの先端部を1秒間接触した後、取り出し風乾した。その際先端部の接触深さを150μmと250μmとすることにより針長さを調整した。先端にモデル薬物を溶着したマイクロニードルは先端部を一部溶解させることにより長さを短くした。未接触時の針長さは650μmであるが150μm、及び250μmの接触によって、それぞれ約640μm、約570μm、とすることができた。図5参照。マイクロニードルの薬液への接触深さを変化させることにより針長さを調節できたことを示している。
【産業上の利用可能性】
【0056】
本発明によるマイクロニードルパッチは、医療や美容の分野において広く利用されるものと期待される。
【技術分野】
【0001】
本発明は皮膚表層及び/又は皮膚角質層に修飾効果及び/又は機能効果を与えるためのマイクロニードル溶着法に関する。
【背景技術】
【0002】
薬物を人の体内に投与する手法として、経口的投与と経皮的投与がよく用いられている。注射は代表的な経皮的投与法である。しかし、注射は医師・看護師のような専門家の手を煩わせねばならず、苦痛を伴い、更にエイズやB型肝炎などの感染もあり得る、多くの人にとって歓迎すべからざる手法である。これに対し、最近マイクロニードルアレイを利用した、苦痛を伴わない経皮的投与法が注目されてきた(非特許文献1)。
【0003】
薬物の経皮的投与の際、皮膚角質層は薬物透過のバリアとして働き、単に皮膚表面に薬物を塗布するだけでは透過性は必ずしも十分ではない。これに対し微小な針、すなわちマイクロニードルを用いて角質層を穿孔することにより、塗布法より薬物投与効率を格段に向上させることができる。このマイクロニードルを基板上に多数集積したものがマイクロニードルアレイである。また、マイクロニードルアレイに、マイクロニードルアレイを皮膚に付着させるための粘着テープや使用まで無菌状態を維持するためのカバーシートなど各種テープを付加して使用しやすい製品としたものをマイクロニードルパッチという。
ここにテープとは、フィルムに粘着剤を塗布したものをいう。
【0004】
マイクロニードルの素材としては、当初、金属やシリコンが用いられていた。ステンレス針で皮膚を穿孔し、その上に薬液を流してその穴より薬物を吸収させる方法(特許文献1)や、ステンレス針の表面に薬物を被覆したうえ刺入して薬物を投与する方法(特許文献2)が提案された。さらには、単に注射針を微小化した中空マイクロニードルにより薬液を注入することも提案された(特許文献3)。
しかし、薬液流延法は薬物取込効率が悪いのみか滅菌性に疑問があり、被覆法は被覆薬物が刺入時に剥がれて薬物取込効率が低く、微小注射針法は構造が複雑となる等の欠点があった。さらに金属やシリコンマイクロニードルは、体内で折れたとき事故となる欠点があった。
【0005】
これに対し、体内で溶解する物質を用いてマイクロニードルを作成すればこのような諸問題を解決することができる(特許文献4)。また、マイクロニードルの素材として皮膚投与後皮膚内で水分により溶解する高分子(生体溶解性高分子)を用いると、マイクロニードルの皮膚適用により皮膚内水分が針部に拡散し、皮膚に差し込まれた針部が膨潤しその後溶解する。針部の溶解によるヒアルロン酸やコラーゲンの皮膚内拡散により抗しわ作用を発現し、あるいは針部に前もって溶解させている薬物や有価物質を皮膚内に放散する(特許文献5、6)。
【0006】
生体溶解性高分子からなるマイクロニードルアレイは、鋳型を用いて製造されることが多い(特許文献5)。感光性樹脂を用いてリソグラフィ法によりマイクロニードルパターンを形成した後転写し、マイクロニードル形成用凹部を有する鋳型を作成する。マイクロニードル素材をこの鋳型上に流延し、次に加熱して水分を蒸発させた後、固化したものを鋳型から剥離してマイクロニードルアレイを得ることができる。
【0007】
マイクロニードルアレイに含有させる薬物には非常に高価なものや微量しか得られないものもある。そのような高価貴重な薬物を素材に含有させて常法によりマイクロニードルアレイを作成すると、薬物はマイクロニードル部分のみならず基板部分にも含まれることとなる(特許文献7)。このマイクロニードルアレイを皮膚に刺入すると、マイクロニードル部分に含まれる薬物は体内に取り込まれ拡散するが、基板部分に存在する薬物は利用されることなく廃棄され、高価な薬物の利用効率が低い結果となる。
【0008】
高価な薬物を効率的に利用する試みはすでにいくつか知られている。マイクロニードル表面を被覆する方法(特許文献2)の他、薬物をマイクロニードル先端に付着させる方法(特許文献8)、マイクロニードルが柔らかい内に遠心分離して薬物をニードル先端に集める方法(特許文献9)、鋳型に薬物入り素材溶液を充填し乾燥後薬物を含まない素材溶液を充填してマイクロニードル先端部にのみ薬物を保持させる方法(特許文献10)などが報告されている。この薬物を先端に付着させる特許文献8の方法は、薬物を約100℃に加温し溶解させてマイクロニードル先端部に付着させる点に特色がある。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平3−151982号公報
【特許文献2】特開2008−029710号公報
【特許文献3】特表2002−517300号公報
【特許文献4】特開2003−238347号公報
【特許文献5】特開2009−273872号公報
【特許文献6】特開2010−029634号公報
【特許文献7】特開2008−303162号公報
【特許文献8】特開2006−346127号公報
【特許文献9】特表2009−507573号公報
【特許文献10】特再表2009−066763号公報
【非特許文献】
【0010】
【非特許文献1】権英淑、神山文男「マイクロニードル製品化への道程」、薬剤学、社団法人日本薬剤学会、平成21年9月、第69巻、第4号、p.272−276.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明が解決しようとする課題は、従来技術の問題点を解決し、高価な薬物の有効利用を図る新しい方法を提供することである。
薬物をマイクロニードルの先端に付着させる特許文献8の方法はそのため薬物を100℃以上に加温するならば、高価貴重な薬物が熱分解する場合が多い。従って、薬物をマイクロニードル先端に付着させるとき、加温することは避けるべきである。
また特許文献8の方法では、薬物は単にマイクロニードル先端に付着したものであるため、薬物の付着強度が弱くマイクロニードルを皮膚に刺入するに際し付着部分が折れて薬物が剥がれたりし、薬物が十分取り込まれない問題点を有している。これらの問題点を解決する必要がある。
【課題を解決するための手段】
【0012】
上記課題を解決するためになされた本発明に係わるマイクロニードル溶着法は、
a)水溶性高分子を素材としてマイクロニードルアレイを作成し、
b)該マイクロニードルアレイ先端に付着させる薬物溶液を作成し、
c)該マイクロニードルアレイの先端を該薬物溶液に短時間接触させて製造し、
このとき、前記薬物溶液には前記薬物のほか水溶性高分子をも溶解しておき、前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、少なくとも1種の同一成分を含み、かつ前記薬物は水溶性高分子と一体的にマイクロニードル先端部位取り込まれていることを特徴とする。
【0013】
マイクロニードルアレイ先端に効率よく薬物を付着させるためには、マイクロニードルアレイ素材と薬物溶液は相溶性があることが好ましい。そのためには薬物とマイクロニードル素材が共に水溶性であることが好ましい。薬物溶液は水を主としてそれに混和する有機溶媒との混合液であってもよい。水に混和する有機溶媒の例は、エタノール、アセトンである。
【0014】
さらに薬物溶液に水溶性高分子を溶解させて薬物溶液の粘度を高めておくことが好ましい。水溶性高分子の溶解により粘度が上昇し、マイクロニードル先端部への薬物溶液の溶着量が増大するからである。水溶性高分子の水溶液中の濃度は1〜20%、好ましくは2〜15%である。水溶性高分子の濃度が小さければ薬物溶液のニードル接触による溶着量が少なく、また濃度が高すぎると流動性がなくなり溶着操作がスムースに行われにくくなる。
薬物溶液中の水溶性高分子の適正な濃度は、薬物溶液の溶液粘度により決めることができる。薬物溶着に好ましい薬物溶液の粘度は、1.0dPa・s〜90dPa・sの範囲である。薬物溶液の粘度が1.0dPa・s未満であると、粘度が低すぎて溶着量が少なくなる。また90dPa・sを超えると薬物溶液への接触後引き離しても糸引きが起こりがちである。なお、粘度はいずれも室温(25℃)での値とする。
【0015】
該マイクロニードルアレイの先端を該薬物溶液に接触させる時間は、長すぎると水溶性マイクロニードル素材が薬物溶液中で溶解してしまうので、0.01〜5秒が望ましい。
【0016】
薬物とマイクロニードル素材である水溶性高分子を併せて薬物水溶液とすることにより、マイクロニードル先端部を薬物水溶液に浸したとき、先端部が部分的に溶解するため薬物は水溶性高分子と一体的にマイクロニードル先端に取り込まれることとなる。このように薬物と素材が一体化したマイクロニードルは皮膚刺入の際、溶着部分すなわち薬物が剥がれ落ちることがなく、薬物が体内に完全に取り込まれることとなる。
ここに、一体的とは、元のマイクロニードル先端部と新たに溶着した部分との間に明確な境界面が存在しないことをいう。境界部分では、薬物は濃度勾配を有しているものと思われる。このような一体化することを特徴とする方法を溶着法という。
【0017】
本発明でいう薬物には、体内に取り込まれることにより何らかの効果を生じる全ての物質を含むものとする。
高価な薬物や大量に得ることが困難な薬物を経皮的に人体に投与したいとき、本方法を用いるのが適当である。安価な薬物や大量に得られる薬物については、常法に従い、当初より薬物をマイクロニードル素材に混合し、その混合素材よりマイクロニードルを作成すればよい。
【0018】
薬物が有機溶剤にのみ溶解するときは、その有機溶剤に薬物を溶解した溶液を水溶性高分子水溶液中に混合して薬物水溶液を作製し同様な手順の手順を用いることができる。また薬物が完全に水溶性高分子溶液中に溶解せずに粒子状に懸濁した場合であっても懸濁が均一でありかつ粒子径が数μm以下であれば溶着及び体内投与は薬物が溶解した場合と同様に挙動する。
【0019】
本発明の目的に適した薬物の例としては数mgの体内投与で有効性を発揮する薬物であればあらゆる薬物が対象となるが特に高分子医薬に有効である。例えば、生理活性ペプチド類とその誘導体、核酸、オリゴヌクレオチド、各種の抗原蛋白質、バクテリア、ウイルスの断片等が挙げられる。 上記生理活性ペプチド類とは、例えば、インスリン、エクセンジン−4、エクセンジン−4誘導体、カルシトニン、副腎皮質刺激ホルモン、副甲状腺ホルモン(PTH)、hPTH(1→34)、セクレチン、オキシトシン、アンギオテンシン、β−エンドルフィン、グルカゴン、バソプレッシン、ソマトスタチン、ガストリン、黄体形成ホルモン放出ホルモン、エンケファリン、ニューロテンシン、心房性ナトリウム利尿ペプチド、成長ホルモン、成長ホルモン放出ホルモン、ブラジキニン、サブスタンスP、ダイノルフィン、甲状腺刺激ホルモン、プロラクチン、インターフェロン、インターロイキン、G−CSF、グルタチオンパーオキシダーゼ、スーパーオキシドディスムターゼ、デスモプレシン、ソマトメジン、エンドセリン、EGF、FGFなど皮膚関連成長因子、ボツリヌストキシン、及びこれらの塩等が挙げられる。抗原蛋白質ないしはウイルス断片としては、インフルエンザ抗原、破傷風抗原、ジフテリア抗原、HBs表面抗原、HBe抗原等が挙げられる。が挙げられる。これらは本発明の薬物水溶液中に溶解あるいは懸濁状態で均一に分散していることが必要である。
【0020】
本発明のマイクロニードル素材として、ヒアルロン酸、コラーゲンやデキストリン、デキストラン、コンドロイチン硫酸、ゼラチン、プロテオグリカン等の水溶性天然物高分子物質が適当である。ポリビニルピロリドン、ポリビルルアルコール(部分ケン化物)、ポリアクリル酸(塩)等の合成高分子物質も使用し得る。またそれら高分子同士のブレンドあるいは低分子水溶性物質をブレンドしてマイクロニードルの物性を改善することも可能である。このようにして製造したマイクロニードルアレイに、粘着テープやバーシートなど各種テープを付加して使用しやすい製品とすれば、薬物を先端にのみ有するマイクロニードルパッチとなる。
【0021】
従来多くの報告があるような薬物をニードル部と基板部双方に含浸させる方法では、基板部を薄くしてもその限界があり50μmは必要である。その場合はマイクロニードルアレイ中の薬物に比べさらに多くの薬物が基板部に存在し、基板部に存在する薬物は皮膚内に投与されないという欠点を有する(特許文献7)。
また、上記欠点を補うためにマイクロニードル用鋳型に薬物入り素材溶液を流延し、乾燥後マイクロニードルを残して基板素材を除去後に薬物を含まない素材溶液を流延し、乾燥させて基板を形成する試みもある(特許文献10)。しかしながらこの方法では素材溶液を塗布した時点において薬物が基板素材溶液中に拡散してしまい針部の薬物量が減少するという欠点を有する。
これらの点については、実施例中の比較例1、2を参照されたい。
【発明の効果】
【0022】
高価かつ貴重な薬物を、マイクロニードルの先端部のみに保持することにより、薬物の無駄を防ぎ、薬物を経済的かつ有効に利用することができる。基板内に薬物が存在していても、マイクロニードルの皮膚刺入により体内に吸収されることがないためである。
【0023】
本方法は、薬物を溶媒に溶かしてマイクロニードルの先端に溶着させるものであるから、薬物を加熱する必要がない。有用な薬物の中には100℃程度の加熱で分解するものが多く、従来法の適用が困難であったが、本方法にはその弱点がない。
薬物とマイクロニードル素材とを共に含む溶液にマイクロニードル先端部を接触させてマイクロニードルに薬物を取り込む方式とすれば、元の部分と新たに付着した部分との境界面がなくなり、マイクロニードルは一体的となる。一体的であるときは、マイクロニードルを皮膚に刺入するに際し、薬物のみが剥がれ落ちることがない。
本方法においては乾燥は風乾、空気吹き付け、熱風吹き付け、窒素ガス吹き付け、などを必要に応じて採用することができる。また乾燥することなくアルミパウチ等に乾燥剤とともに密封することも可能である。
また本方法において、薬物溶液との接触時間、ニードルの接触深さ、などを変化させることによりニードルの長さを調整することが可能であり、これは本溶着法の他法に比べての大きな特徴である。
【図面の簡単な説明】
【0024】
【図1】本発明のマイクロニードル溶着法の概略図。
【図2】糖尿病モデルラットのインスリン投与後の血糖値の時間変化を示す図
【図3】GKラットのエクセンジン−4投与後の血糖値の時間変化を示す図
【図4】GKラットのエクセンジン−4投与後の薬物濃度の時間変化を示す図
【図5】 薬物溶液へのマイクロニードルアレイ接触深さを変え作成した溶着後マイクロニードル写真
【発明を実施するための形態】
【0025】
薬物溶液とマイクロニードルの先端部とを接触させるには次のような方法がある。
(1)薬物溶液面にマイクロニードルアレイを上から浸漬する(図1)。
(2)マイクロニードルアレイを上向きに置きスポンジに含浸させた薬液を上から接触させる。
(3)薬液を層流として上から流しマイクロニードルアレイを横向きにして短時間接触させる。
以下の実施例においては(1)の方法によっているが、(2)、(3)の方法を採用することもできる。
次に、本発明の実施例を図面を参照して詳細に説明するが、本発明は実施例に限定されるものではない。
【実施例1】
【0026】
(溶着法による薬物含有マイクロニードルの製造)
本発明のマイクロニードルアレイは、鋳型を用いて製造した。感光性樹脂に光照射するリソグラフィ法により円錐台型のマイクロニードルパターンを形成した後、電鋳加工することにより円錐台型のマイクロニードルパターンを転写した円錐台型のマイクロニードル形成用凹部が形成された鋳型を用いた。
【0027】
マイクロニードル形成用鋳型凹部は根元の直径が0.16mm、先端直径が0.03mm、深さ0.8mmの円錐台状であり、0.6mm間隔に格子状に配列されており、1cm2あたり250個形成されている。又、マイクロニードルアレイは直径10mmの円形に形成した。
【0028】
水溶性高分子としてヒアルロン酸を用いた。ヒアルロン酸水溶液は、重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名「FCH−SU」)、培養由来)13.5重量部と重量平均分子量1万の低分子量ヒアルロン酸(キューピー株式会社製、商品名「ヒアルオリゴ」、培養由来)1.5重量部を水85重量部に溶解して得た。このヒアルロン酸水溶液を鋳型上に流延し、加熱して水分を蒸発させ、鋳型から剥離しヒアルロン酸マイクロニードルアレイを得た。得られたマイクロニードルは上記金型の形を反映したものであり、根元の直径が0.16mm、先端直径が0.03mm、高さ0.8mmの円錐台状であった。マイクロニードルアレイは、マイクロニードルが0.6mm間隔に格子状に配列されており、直径10mmの円形であった。
【0029】
別途、牛インスリン(ナカライテスク株式会社)をpH2.5の塩酸水溶液に溶解し水溶液を上記ヒアルロン酸水溶液に添加し1.0ユニット(U)/ml濃度の薬物溶液を得た。粘度は25dPa・sであった。
【0030】
薬物溶液上方に得られたマイクロニードルアレイを置き(図1(a))、マイクロニードルアレイを降下させてマイクロニードルの先端部100μmを1秒間接触させ(図1(b))た。その後引き上げ(図1(c))、取り出し(図1(d))、風乾して先端部インスリン濃縮マイクロニードルアレイを20枚得た。
【0031】
得られたマイクロニードルアレイを顕微鏡観察するとニードル先端部は図1(d)のように膨れていた。元のマイクロニードルと溶着部分であるインスリン含有ヒアルロン酸とはまったく一体化していることが観察された。
得られたマイクロニードルアレイ3枚を使用して先端に付着したインスリン量を測定した。測定はグラザイムinsulin−EIA TEST キット(和光純薬工業株式会社)を利用した。マイクロニードルアレイ1枚にインスリン0.25ユニットを含有していることを確認した。含有量のばらつきは20%以内であった。
【0032】
(血糖値測定試験)
製造したマイクロニードルアレイを用い、ラットにインスリンを経皮投与した。
ストレプトゾトシン投与により作成した糖尿病モデルラット(体重約300g)の腹部を除毛した。このラットを14時間以上絶食させた後、除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)でマイクロニードルアレイを皮膚に固定した。マイクロニードルアレイ投与後、0.5、1、2時間経過後に採血し血糖値を測定した。血糖値の測定はGlucoseCII−test kit(和光純薬工業株式会社)を用いた。試験数は4例であった。
【0033】
皮下注射によりラットにインスリンを投与した。
糖尿病モデルラットを14時間以上絶食させた後、皮下注射により0.25ユニットのインスリンを投与した。インスリン投与後、0.5,1、2時間経過後に採血し血糖値を測定した。血糖値の測定は実施例1と同様にGlucoseCII−test kitを用いた。試験数は4例であった。
【0034】
血糖値測定試験の基準として、コントロール(インスリン投与なし)の測定を行った。
糖尿病モデルラットを14時間以上絶食させた後、0.5、1、2時間経過後に採血し血糖値を測定した。血糖値の測定は実施例1と同様にGlucoseCII−test kitを用いた。試験数は4例であった。
【0035】
(血糖値試験の結果と考察)
上記3つの試験結果を血糖値の時間変化として図2に示した。それぞれの0時間値(初期値)を100として、血糖値の相対値を示す。本図から明らかなように、血糖値は、マイクロニードル投与法によれば皮下注射投与法と同様に降下した。
【実施例2】
【0036】
(溶着法による薬物含有マイクロニードルの製造:ヒアルロン酸が主成分の場合)
水溶性高分子溶液はヒアルロン酸(株式会社紀文フードケミファ製、重量平均分子量80万、商品名FCH−80L)6重量部及びポリビニルピロリドン(BASFジャパン株式会社製、商品名コリドン12PF)3重量部を水91部に溶解して得た。水溶性高分子溶液組成及び乾燥を風乾でなく窒素ガス吹き付けであることを除いては実施例1と同様の操作でマイクロニードルアレイを製造した。マイクロニードル及びマイクロニードルアレイの形状・寸法は実施例1と同じである。
【0037】
薬物としてエクセンジン−4(和光純薬工業株式会社)を使用した。エクセンジン−4はII型糖尿病治療薬であり、分子量4200のたんぱく質であり、血糖値降下作用を有する。重量平均分子量10万の高分子量ヒアルロン酸(紀文フードケミカル社製、商品名FCH−SU、培養由来)の10重量%の水溶液にエクセンジン−4を30mg/mlになるよう溶解して薬物溶液を調整した。
冶具を用いてマイクロニードルアレイの先端200μmを薬物溶液に接触しただちに取出して窒素ガスを吹き付けて乾燥させ、薬物先端溶着マイクロニードルアレイを20枚作製した。
【0038】
(溶着法による薬物含有マイクロニードルの製造:ポリメチルメタクリレートの場合)
実施例1に用いたと同様の鋳型を用いてポリメチルメタクリレート(MMA)を素材とするマイクロニードルアレイを作製した。MMA(和光純薬工業株式会社)の10%トルエン溶液を鋳型に注入し40℃で48時間乾燥させて実施例2と同一形状のMMAマイクロニードルアレイを作製した。冶具を用いてマイクロニードルアレイの先端200μmを実施例2と同様の薬物溶液に接触し、ただちに取出して窒素ガスを吹き付けて乾燥させて薬物先端溶着マイクロニードルを作製した。
【0039】
(エクセンジン−4の存在量の確認)
エクセンジン−4の存在量は酵素免疫測定法により決定した。薬物溶着マイクロニードルをイオン交換水に溶解させた溶液、又はラット静脈から採血した血液を試料とし、Exendin−4 EIA kit(和光純薬工業株式会社)により試料中のエクセンジン−4濃度を決定した。
作成したマイクロニードルアレイ3枚を使用して先端に付着したエクセンジン−4の量をこの方法で測定した。ヒアルロン酸が主成分の場合もMMAの場合も、マイクロニードルアレイ1枚にエクセンジン−4が10μg含まれていることを確認した。含有量のばらつきは15%以内であった。
【0040】
(血糖値測定試験)
製造したマイクロニードルアレイを用い、ラットにエクセンジン−4を経皮投与して糖負荷試験を行い、皮下注射法及びコントロールと比較した。
GKラット、自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社より購入)を麻酔後、背部を除毛した。14時間以上絶食させた後、除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)で皮膚に固定した。マイクロニードルアレイ投与30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。投与後、15、30、60、90、120分経過後に採血し血糖値を測定した。試験数は5例であった。
血糖値の測定はGlucose CII−test kit(和光純薬工業株式会社)を用いた。
【0041】
(エクセンジン−4血中濃度変化試験)
製造したマイクロニードルアレイを用い、ラットにエクセンジン−4を経皮投与してエクセンジン−4血中濃度変化試験を行い、皮下注射法及びコントロールと比較した。
GKラット、自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社より購入)を麻酔後、背部を除毛した。14時間以上絶食させた後除毛皮膚にマイクロニードルアレイを刺入し、優肌絆(日東電工製)で皮膚に固定した。マイクロニードルアレイ投与30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。糖投与後、15、30、60、90、120分経過後に採血し、エクセンジン−4の濃度を測定した。試験数は5例であった。
【0042】
血糖値測定試験及び薬物血中濃度変化試験のいずれにおいても、マイクロニードル経皮投与法と比較するため、皮下注射投与法と薬物を投与しないコントロール試験を行った。
皮下注射投与法は次のように行った。GKラット自然発症2型糖尿病モデル(8週齢オス、清水実験材料株式会社)を14時間以上絶食させた後皮下注射により10μgのエクセンジン−4を投与した。その30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。ブドウ糖投与後、15、30、60、90、120分経過後に採血し、血糖値及びエクセンジン−4の濃度を測定した。試験数は5例であった。
コントロールは次のように行った。GKラット自然発症2型糖尿病モデル(同上)を14時間以上絶食させた30分後に2g/kg体重相当量のぶどう糖を腹腔内投与した。ブドウ糖投与後、15、30、60、90、120分経過後に採血し、血糖値及びエクセンジン−4の濃度を測定した。試験数は3例であった。
【0043】
糖負荷後の血糖値の時間変化を図3に示す。図における記号は以下のようである。
Control:エクセンジン−4投与なし
S.C.10μg:エクセンジン−4を皮下注射により投与
MN(HA)10μg:エクセンジン−4をヒアルロン酸が主成分のマイクロニードルにより投与
MN(MMA)10μg:エクセンジン−4をMMAのマイクロニードルにより投与
【0044】
薬物投与30分後に糖負荷し、その後の血中エクセンジン−4濃度の時間変化を図4に示す。図中の記号は図3と同じである。
【0045】
(試験結果及び考察)
図3によれば、ブドウ糖負荷後Control群の血糖値は急激に上昇しているが、S.C.10μg群及びMN(HA)10μg群では血糖値の上昇が抑えられている。一方、MN(MMA)群の血糖値はControl群よりは低いがMN(HA)10μg群の血糖値に比較してはるかに高い。この結果は同じ10μgを先端塗布したマイクロニードルであってもヒアルロン酸からなるマイクロニードルはポリメチルメタクリレートからなるマイクロニードルよりも血糖値を抑える効果が高いことを示している。
【0046】
図4によれば、ブドウ糖負荷30分前にエクセンジン−4を投与した3群において、S.C.10μg群及びMN(HA)10μg群では急激に血中エクセンジン−4濃度が増加し、投与後45分(ブドウ糖負荷後15分)に濃度は最大となっている。一方、MN(MMA)10μg群の血中エクセンジン−4濃度は、MN(HA)10μg群の濃度に比較してはるかに低い。
【0047】
図3、4の結果は、ヒアルロン酸マイクロニードルに溶着させた薬物(エクセンジン−4)はポリメチルメタクリレートマイクロニードルに付着させた場合に比べてマイクロニードルの皮膚適用による薬物体内浸透量が極めて大きく、それにより血糖値の低下作用も大きいことを示している。MN(HA)による投与は皮下注射と同様の挙動を示すことから、マイクロニードルに溶着されたすべての薬物が体内浸透することを示している。一方、MN(MMA)においてはニードルに付着した薬物はその数分の1しか体内に浸透していないことを示している。
この原因として、MN(MMA)先端に付着した薬物の付着強度が弱いためマイクロニードル刺入に際し角質を通過する時薬物がマイクロニードルから剥がれて体内吸収されないことが考えられる。それに反しMN(HA)においては、薬物は溶着のさいマイクロニードルと一体化しているので刺入の際剥がれおちることは一切なく、全量が体内吸収されるものと思われる。
【実施例3】
【0048】
重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名FCH−SU、培養由来)の種々の濃度の水溶液を作成し、以下の粘度になるようにヒアルロン酸と水の割合を調整した。調整した溶液の粘度は、0.5、1.0、5.0、20、50、90、150dPa・sであった。室温は25度であった。それらの7種の濃度の異なった水溶液中に赤色102号(和光純薬工業株式会社)を濃度0.5%になるように均一に溶解させた。
マイクロニードルアレイは、実施例1と同様にして直径1.0cmの円形のマイクロニードルアレイを作成した。
【0049】
得られた種々の粘度のヒアルロン酸水溶液にマイクロニードルアレイの先端部150μmを1秒間接触した後、取り出し風乾した。接触により溶着したヒアルロン酸水溶液量を評価するためにマイクロニードルアレイ1枚を2mlのイオン交換水に溶解し赤色102号の濃度を510nmでの吸光度により測定した。その測定値から各種ヒアルロン酸濃度の異なる水溶液のマイクロニードルアレイ1枚当たりの溶着量を算定し、結果を下表に示す。
【0050】
【表1】


【0051】
水溶液粘度が低いと溶着量が低い。高くなるに従い取り扱い性が悪くなり、かつ針の形状も不規則となる。適切な水溶液粘度は1.0〜90dPa・sであり、より望ましくは5.0〜50dPa・sであることがわかった。
【0052】
(比較例1)
実施例1において使用したマイクロニードル形成用鋳型凹部を用い、次のような直径1cmのマイクロニードルアレイを作製した。
水溶性高分子溶液がヒアルロン酸(株式会社紀文フードケミファ製、分子量80万、商品名FCH−80L)14.995重量部、モデル薬物として赤色102号色素0.005重量部、水85部からなる水溶液を用いた。この水溶液0.3mlを鋳型に流延し、室温で乾燥させてマイクロニードルアレイ(直径1cm)を成形した。マイクロニードルアレイを鋳型から取り出し、顕微鏡にて観察下そのマイクロニードルアレイの針部を鋭利なカッターナイフで注意深く削り取り、針部部と基板部に分離した。それぞれをイオン交換水に溶解させ、510nmの吸光度を測定してモデル薬物の針部と基板部への分配比を求めた。
針部存在量:基板部存在量 = 0.048:0.952
よって、このような方法でマイクロニードルアレイを作成すると、薬物の大部分が基板部に未利用で残ることが予想される。
【0053】
(比較例2)
水溶液の鋳型充填量が0.15mlであることを除き比較例1と同様にして鋳型上にマイクロニードルアレイを成形した。次いで鋳型表面に皮膜状に存在する基板部を濡れたコットンで丁寧に拭き取った。
次いで、ヒアルロン酸(紀文フードケミファ製、分子量80万、商品名FCH−80L)15重量部、水85部からなる赤色102号色素を含まない水溶液の0.3mlを鋳型に流延し、40℃で乾燥させてマイクロニードルアレイ(直径1cm)を成形した。マイクロニードルアレイを鋳型から取り出し、顕微鏡にて観察下そのマイクロニードルアレイの針部を鋭利なカッターナイフで注意深く削り取り、針部と基板部に分離した。それぞれをイオン交換水に溶解させ、510nmの吸光度を測定してモデル薬物の針部と基板部への分配比を求めた。
針部存在量:基板部存在量 = 0.62:0.38
赤色102号モデル薬物は、本来針部にのみ存在していたものである。しかしこの結果は、基板部形成のためヒアルロン酸水溶液を鋳型上に流延し乾燥させる工程の中で、針部から基板部へ薬物が拡散することを示している。
よって、このような方法では、マイクロニードル部分にのみ薬物を保持するマイクロニードルアレイを作成することはできない。
【実施例4】
【0054】
重量平均分子量10万の高分子量ヒアルロン酸(株式会社紀文フードケミファ製、商品名FCH−SU、培養由来)の水溶液を作成した。溶液の粘度は、5.0dPa・sであった。室温は25℃であった。本水溶液中にFD4、(フルオレセンデキストラン、モデル化合物、和光純薬工業株式会社)を濃度5%になるように均一に溶解させた。マイクロニードルアレイは高さが0.65μmであること除いては実施例1と同様の鋳型を用いて直径1.0cmの円形のマイクロニードルアレイを作成した。
【0055】
得られたヒアルロン酸水溶液にマイクロニードルアレイの先端部を1秒間接触した後、取り出し風乾した。その際先端部の接触深さを150μmと250μmとすることにより針長さを調整した。先端にモデル薬物を溶着したマイクロニードルは先端部を一部溶解させることにより長さを短くした。未接触時の針長さは650μmであるが150μm、及び250μmの接触によって、それぞれ約640μm、約570μm、とすることができた。図5参照。マイクロニードルの薬液への接触深さを変化させることにより針長さを調節できたことを示している。
【産業上の利用可能性】
【0056】
本発明によるマイクロニードルパッチは、医療や美容の分野において広く利用されるものと期待される。
【特許請求の範囲】
【請求項1】
a)水溶性高分子を素材としてマイクロニードルアレイを作成し、
b)該マイクロニードルアレイ先端に付着させる薬物溶液を作成し、
c)該マイクロニードルアレイの先端を該薬物溶液に短時間接触させて、
先端に薬物を付着させたマイクロニードルアレイを製造するにさいし、
前記薬物溶液には前記薬物のほか水溶性高分子をも溶解しておき、
前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、少なくとも1種の同一成分を含み、
かつ前記薬物は水溶性高分子と一体的にマイクロニードル先端部位取り込まれていることを特徴とする、
先端に薬物を付着させたマイクロニードルアレイを製造するマイクロニードル溶着法。
【請求項2】
前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、主成分が同一であることを特徴とする請求項1に記載のマイクロニードル溶着法
【請求項3】
前記薬物溶液に含まれる水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とが同一であることを特徴とする請求項1に記載のマイクロニードル溶着法。
【請求項4】
前記薬物溶液の粘度を1.0dPa・s以上90dPa・s以下とすることを特徴とする請求項1〜3のいずれか1項に記載のマイクロニードル溶着法。
【請求項5】
前記薬物溶液の溶媒の主成分が水であることを特徴とする請求項1に記載のマイクロニードル溶着法。
【請求項6】
マイクロニードルの針長さが100−2,000ミクロンの長さを有することを特徴とする請求項1〜5のいずれか1項に記載のマイクロニードル溶着法
【請求項7】
前記薬物が、PTH、インターフェロン、インスリン、エクセンジン−4、エクセンジン誘導体、EGF,FGF,ボツリヌストキシン、各種抗原蛋白又はウイルス断片のいずれかであることを特徴とする請求項1〜6のいずれか1項に記載のマイクロニードル溶着法。
【請求項8】
前記水溶性高分子が、ヒアルロン酸、デキストリン、デキストラン、カルボキシメチルセルロース、コンドロイチン硫酸、プロテオグリカン、ポリアクリル酸(塩)、ポリビニルピロリドン、ポリビニルアルコール、から選ばれた1種あるいはそれ以上であることを特徴とする請求項1〜6のいずれか1項に記載のマイクロニードル溶着法。
【請求項9】
マイクロニードル先端部に、マイクロニードル素材と薬物の混合物が一体的に溶着していることを特徴とするマイクロニードルアレイ。
【請求項10】
マイクロニードル素材と、溶着した薬物を含有する素材とが同一の水溶性高分子であることを特徴とする請求項9に記載のマイクロニードルアレイ。
【請求項11】
前記薬物が、PTH、インターフェロン、インスリン、エクセンジン−4、エクセンジン誘導体、EGF,FGF,ボツリヌストキシン、各種抗原蛋白又はウイルス断片のいずれかであることを特徴とする請求項9又は請求項10に記載のマイクロニードルアレイ。
【請求項12】
前記水溶性高分子が、ヒアルロン酸、デキストリン、デキストラン、カルボキシメチルセルロース、コンドロイチン硫酸、プロテオグリカン、ポリアクリル酸(塩)、ポリビニルピロリドン、ポリビニルアルコール、から選ばれた1種あるいはそれ以上であることを特徴とする請求項9〜11のいずれか1項に記載のマイクロニードルアレイ。
【請求項1】
a)水溶性高分子を素材としてマイクロニードルアレイを作成し、
b)該マイクロニードルアレイ先端に付着させる薬物溶液を作成し、
c)該マイクロニードルアレイの先端を該薬物溶液に短時間接触させて、
先端に薬物を付着させたマイクロニードルアレイを製造するにさいし、
前記薬物溶液には前記薬物のほか水溶性高分子をも溶解しておき、
前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、少なくとも1種の同一成分を含み、
かつ前記薬物は水溶性高分子と一体的にマイクロニードル先端部位取り込まれていることを特徴とする、
先端に薬物を付着させたマイクロニードルアレイを製造するマイクロニードル溶着法。
【請求項2】
前記薬物溶液における水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とは、主成分が同一であることを特徴とする請求項1に記載のマイクロニードル溶着法
【請求項3】
前記薬物溶液に含まれる水溶性高分子と前記マイクロニードルアレイの素材である水溶性高分子とが同一であることを特徴とする請求項1に記載のマイクロニードル溶着法。
【請求項4】
前記薬物溶液の粘度を1.0dPa・s以上90dPa・s以下とすることを特徴とする請求項1〜3のいずれか1項に記載のマイクロニードル溶着法。
【請求項5】
前記薬物溶液の溶媒の主成分が水であることを特徴とする請求項1に記載のマイクロニードル溶着法。
【請求項6】
マイクロニードルの針長さが100−2,000ミクロンの長さを有することを特徴とする請求項1〜5のいずれか1項に記載のマイクロニードル溶着法
【請求項7】
前記薬物が、PTH、インターフェロン、インスリン、エクセンジン−4、エクセンジン誘導体、EGF,FGF,ボツリヌストキシン、各種抗原蛋白又はウイルス断片のいずれかであることを特徴とする請求項1〜6のいずれか1項に記載のマイクロニードル溶着法。
【請求項8】
前記水溶性高分子が、ヒアルロン酸、デキストリン、デキストラン、カルボキシメチルセルロース、コンドロイチン硫酸、プロテオグリカン、ポリアクリル酸(塩)、ポリビニルピロリドン、ポリビニルアルコール、から選ばれた1種あるいはそれ以上であることを特徴とする請求項1〜6のいずれか1項に記載のマイクロニードル溶着法。
【請求項9】
マイクロニードル先端部に、マイクロニードル素材と薬物の混合物が一体的に溶着していることを特徴とするマイクロニードルアレイ。
【請求項10】
マイクロニードル素材と、溶着した薬物を含有する素材とが同一の水溶性高分子であることを特徴とする請求項9に記載のマイクロニードルアレイ。
【請求項11】
前記薬物が、PTH、インターフェロン、インスリン、エクセンジン−4、エクセンジン誘導体、EGF,FGF,ボツリヌストキシン、各種抗原蛋白又はウイルス断片のいずれかであることを特徴とする請求項9又は請求項10に記載のマイクロニードルアレイ。
【請求項12】
前記水溶性高分子が、ヒアルロン酸、デキストリン、デキストラン、カルボキシメチルセルロース、コンドロイチン硫酸、プロテオグリカン、ポリアクリル酸(塩)、ポリビニルピロリドン、ポリビニルアルコール、から選ばれた1種あるいはそれ以上であることを特徴とする請求項9〜11のいずれか1項に記載のマイクロニードルアレイ。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−94662(P2013−94662A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2012−115983(P2012−115983)
【出願日】平成24年5月2日(2012.5.2)
【分割の表示】特願2011−252044(P2011−252044)の分割
【原出願日】平成23年10月31日(2011.10.31)
【出願人】(501296380)コスメディ製薬株式会社 (42)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成24年5月2日(2012.5.2)
【分割の表示】特願2011−252044(P2011−252044)の分割
【原出願日】平成23年10月31日(2011.10.31)
【出願人】(501296380)コスメディ製薬株式会社 (42)
【Fターム(参考)】
[ Back to top ]

