マイクロビーズの配列方法及びその配列装置
【課題】マイクロフルイディクスを用いて均質なビーズを配列することができるマイクロビーズの配列方法及びその配列装置を提供する。
【解決手段】マイクロビーズの配列方法において、マイクロビーズ21が流されるとともに、狭窄領域24を有する直線状チャンネル22とこの直線状チャンネル22と順次交差する方形波形状のチャンネル23とを配置し、マイクロビーズ21が捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域でマイクロビーズ21を捕捉し、マイクロビーズ21が捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスしてマイクロビーズ21を下流に移動させる。
【解決手段】マイクロビーズの配列方法において、マイクロビーズ21が流されるとともに、狭窄領域24を有する直線状チャンネル22とこの直線状チャンネル22と順次交差する方形波形状のチャンネル23とを配置し、マイクロビーズ21が捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域でマイクロビーズ21を捕捉し、マイクロビーズ21が捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスしてマイクロビーズ21を下流に移動させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロビーズの配列(捕捉・解放)方法及びその配列(捕捉・解放)装置に関するものである。
【背景技術】
【0002】
アルギン酸高分子は生体適合性が良く、食材や細胞のカプセル化など用途の多い材料である。これを利用して、ドラッグデリバリーや、再生医工学の材料に使う例は多い。
ところで、ヒドロゲル中にセルをカプセル化することはセルに保護を与えるものであり、バイオリアクターや組織工学と関連する(下記非特許文献1参照)。アルギン酸はその生体適合性、入手の容易さ、比較的低いコストから、最も良く用いられ、研究されるヒドロゲルである。アルギン酸中にセルをカプセル化し、アレイを形成することができれば、セルを保護膜中に包み込みながら、多くのセルを同時に視覚化し分析することができるようになるので、診断研究、薬理学的研究やセロミクスの研究に多く応用されるだろう。
【0003】
微小な単一直径(単分散)カプセルの生成は、良く研究されるものの一つである(下記非特許文献2参照)。セルをマイクロビーズ中にカプセル化すれば、カプセルへ栄養を与え不要物を排出する交換が拡散によって短時間にできるようになり、カプセル化されたセルの生存可能性を向上させることができる(下記非特許文献3参照)。さらに、マイクロビーズを単分散化することによって、個々のマイクロビーズ中のカプセル化されたセルの数を、より正確に制御することができるようになる。
【0004】
マイクロデバイス中でアルギン酸ナトリウムと塩化カルシウム液滴を用いて、セルをカプセル化するために微小な不均一直径(多分散)のアルギン酸マイクロビーズを形成することは、Sugiuraら(下記非特許文献4参照)によって報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO 02/068104 A1
【非特許文献】
【0006】
【非特許文献1】M.M.Stevens et al.,”A Rapid−Curing Alginate Gel System:Utility in Periosteum−derived Cartilage Tissue Engineering”,Biomaterials,25,pp.887−894,2004.
【非特許文献2】G.Orive et al.,”Cell Encapsulation:Promise and Progress” Nature Medicine,9,pp.104−107,2003.
【非特許文献3】W.M.Ku(uはウムラウト付き)htreiber,R.P.Lanza,and W.L.Chick,Cell encapsulation technology and therapeutics,Birkha(aはウムラウト付き)user Boston,1999.
【非特許文献4】S.Sugiura,T.Oda,Y.Izumida,Y.Aoyagi,M.Satake,A.Ochiai,N.Ohkohchi,M.Nakajima,”Size Control of Calcium Alginate Beads containing Living Cells using Micro−Nozzle Array”,Biomaterials,26,pp.3327−3331,2005.
【非特許文献5】D.Poncelet,”Production of Alginate Beads by Emulsification/Internal Gelation”,2001,Annals of the New York Academy of Sciences,944,pp.74−82.
【非特許文献6】A Tixier−Mita,Y.Mita,K.Cozic,F.M.,B.LePioufle,and H.Fujita,”To place cells an array using aspiration technique,”Micro Total Analysis Systems,Nara,Japan,2002.
【非特許文献7】B.Le.Pioufle,P.Surbled,H.Nagai,Y.Murakami,H.S.Chun,E.Tamiya,and H.Fujita,”Living cells captured on a biomicrosystem devoted to DNA injection,”Materials Science and Engineering:C,vol.12,pp.77−81,2000.
【非特許文献8】B.M.Taff and J.Voldman,”A Scalable Row/Column− Addressable Dielectrophoretic Cell−Trapping Array”,Micro Total Analysis Systems,Boston,USA,pp.865−867,2005.
【非特許文献9】F.M.White, Fluid Mechanics,3rd ed.,New York,NY:McGraw Hill,1994
【非特許文献10】Stefan Fiedler et al.,”Dielectrophoretic Sorting of Particles and Cells in a Microsystem”,Anal.Chem.1998,70,pp.1909−1915
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、マイクロビーズの均一性とサイズ分布を向上するために、以下の2つの問題を解決する必要がある。すなわち、(1)ゲル化のために微小アルギン酸ナトリウム液滴に外部から多価陽イオンが添加されるときの変形の問題と、(2)ゲル化前のアルギン酸ナトリウム液滴の不要な融合の問題、である。
そこで、本発明では、これまでに提案された内部ゲル化法(上記非特許文献5参照)とT字交差路液滴生成法(上記特許文献1参照)をも参照し研究を重ねながら、アルギン酸マイクロビーズ(MAB)を生成するようにした。
【0008】
さらに、セルアセイのためMAB中にセルをカプセル化することも試みる。吸引法(上記非特許文献6参照)のようなフルイディック法や、金表面へのケミカルパターニングのような生化学的手法(上記非特許文献7参照)や、誘電泳動トラップ(捕捉)(上記非特許文献8参照)に基づくセルアレイがこれまでに報告されている。しかしながら、これらのセルアレイの多くは、複雑な作成手順と制御を必要としている。
【0009】
そこで、本発明者らは、「1トラップあたり1ビーズ」の固定化を達成するために、パッシブマイクロフルイディックトラップデバイス(マイクロチャンネルからなるマイクロビーズ捕捉装置)を提案する。単一直径アルギン酸マイクロビーズ(MAB)を生成する技術だけでなく、穏やかで扱い易い、マイクロビーズベースのセルアセイシステムの開発に向けて研究を行っている。
【0010】
本発明は、上記状況に鑑みて、マイクロビーズの配列方法及びその配列装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は、上記目的を達成するために、
〔1〕マイクロビーズの配列方法において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させることを特徴とする。
【0012】
〔2〕上記〔1〕に記載のマイクロビーズの配列方法によって配列された前記マイクロビーズが位置する狭窄領域の終端部を加熱することにより、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔3〕マイクロビーズの配列方法において、上記〔1〕に記載のマイクロビーズの配列方法によって配列されたマイクロビーズが位置する狭窄領域の終端部に誘電泳動力を作用させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
【0013】
〔4〕マイクロビーズの配列装置において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと、この直線状チャンネルと順次交差する方形波形状のチャンネルと、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、この空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、この狭窄領域をバイパスして前記マイクロビーズを下流に移動させるマイクロビーズ移動手段を具備することを特徴とする。
【0014】
〔5〕上記〔4〕記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部を加熱手段により加熱することで泡を生成させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔6〕上記〔5〕記載のマイクロビーズの配列装置において、前記加熱手段はターゲットへレーザー光を照射するレーザーであることを特徴とする。
【0015】
〔7〕上記〔4〕記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部に誘電泳動手段を設けて、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔8〕上記〔4〕〜〔7〕の何れか一項記載のマイクロビーズの配列装置において、前記狭窄領域を水平方向に複数個配置し、前記マイクロビーズをチップ上にアレイ化して配置することを特徴とする。
【発明の効果】
【0016】
本発明によれば、マイクロビーズをチップ上にアレイ化させることも可能である。
【図面の簡単な説明】
【0017】
【図1】本発明の参考例を示すMAB製造装置の模式図である。
【図2】本発明の参考例を示すMABの図面代用写真である。
【図3】本発明の参考例における完全ゲル化の前後におけるMABの直径分布を示す図である。
【図4】本発明の参考例を示すMAB中にカプセル化されたHep G2セルを示す図である。
【図5】本発明にかかるマイクロビーズ(μ液滴)の捕捉装置(マイクロアレイ)の模式図である。
【図6】本発明の実験例を示すマイクロビーズ(μ液滴)の捕捉アレイで捕捉されるMABの図面代用写真である。
【図7】本発明にかかる長方形のマイクロチャンネルの断面図である。
【図8】本発明にかかるマイクロ液滴トラップの詳細な説明図である。
【図9】本発明の実施例を示す体積流量比Q1 /Q2 が3.66で設計されたマイクロ液滴の捕捉装置中に捕捉されたビーズを示す図である。
【図10】本発明の実施例を示す捕捉されたビーズの解放(リリース)装置(その1)を示す図である。
【図11】本発明の実施例を示す捕捉されたビーズの解放装置(その2)の動作を示す図である。
【図12】本発明の実施例を示す捕捉されたビーズの解放装置(その2)とその動作を示す図である。
【発明を実施するための形態】
【0018】
本発明のマイクロビーズの配列方法において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させる。
【実施例】
【0019】
以下、本発明の実施の形態について詳細に説明する。
図1は本発明の参考例を示すMAB製造装置の模式図である。
この図において、1は連続相である油2を流す第1のマイクロチャンネル(例えば幅は直径150μm、高さは55μm)、3は分散相であるCaCO3 粉末を含むアルギン酸ナトリウム溶液4を流す第2のマイクロチャンネル(例えば幅は直径50μm、高さは55μm)、5はその第1のマイクロチャンネル1と第2のマイクロチャンネル3が交差するT字交差路、6はそのT字交差路5で形成されるCaCO3 粉末を含むアルギン酸ナトリウムからなる液滴、7はレシチン(lecithin:燐脂質の一種)及び酢酸を含む油8が流れる第3のマイクロチャンネル、9は第1のマイクロチャンネル1と第3のマイクロチャンネル7が合流する二路合流チャンバー、10は二路合流チャンバー9にて形成されるマイクロビーズ(μ液滴)、11はその二路合流チャンバー9に連通する混合及び反応チャンネル、12はゲル化が進んだマイクロビーズ(μ液滴)である。
【0020】
ここで、不溶性炭酸カルシウム粒子を含んだアルギン酸ナトリウム溶液4をT字交差路5で油2の流れに流すと、液滴6が生成される。次いで、レシチンと酢酸を含む油8が第3のマイクロチャンネル7から下流に加えられる。次いで、曲がりくねったチャンネルからなる混合及び反応チャンネル11で、酸性油、つまりレシチンと酢酸を含む油8とメインストリームを流れる油2との混合が促進される。CaCO3 粉末を含むアルギン酸ナトリウムからなる液滴6は、ペーハー(ph)値が減少し、Ca2+(カルシウムイオン)が組み合わされるとゲル化が起こり、下流にアルギン酸カルシウムゲルが形成される。つまり、pH値の減少により、不溶性カルシウム錯体からCa2+が放出されて、ゲル化が起こる。続いて、MABはマイクロチューブで捕捉され、さらにゲル化を進めるため遠心力により水性塩化カルシウム水溶液中に分離される。
【0021】
この単一直径アルギン酸マイクロビーズの製造装置を用いると、セルをアルギン酸ナトリウム溶液に加えるだけで、セルをMABにカプセル化することができる。しかしながら、この場合、溶液は浸透圧に合わせて、水の代わりに生理食塩水を用いて調節される必要がある。
なお、上記実施例では、分散相として不溶性CaCO3 粉末を含んだアルギン酸ナトリウム溶液について述べたが、ph7以上の水溶液に溶けない物質であればよい。例えばバリウム化合物粉末などであってもよい。
【0022】
また、交差路は、T字交差路に限らず、フローフォーカシング(flow focusing)によってもよい。
さらに、界面活性剤としては、レシチンに限られるものではなく、両親媒性分子であれば、他のものであってもよい。
図2は本発明の参考例を示すMABの図面代用写真であり、図2(a)は完全にゲル化される前の油を、図2(b)は完全にゲル化された後の水中における状態を示す図、図3は本発明の参考例における完全にゲル化する前後におけるMABの直径分布を示す図である。
【0023】
変動係数(C.V.)は直径の標準偏差と平均径の比として定義される。平均径と変動係数(C.V.)は、完全ゲル化前はそれぞれ116.93μmと1.9%であり、完全ゲル化後はそれぞれ81.91μmと2.7%であった。生成されたMABの8.9%は球形ではなく、計測に含まれなかった。T字交差路を用いた液滴形成によって、単一直径のアルギン酸ナトリウム液滴を生成することが可能となった。界面活性剤(レシチン)を加えることによって、形成された液滴間の不要な癒着を防ぎ、マイクロビーズが徐々にゲル化していく間もマイクロビーズの単一直径を維持することができた。この手法で、ゲルは遠心分離による水相への分離前に硬化した。その結果、マイクロビーズ(MAB)は球形であり、サイズ分布も小さかった。Ca2+濃度とpHのような微調整パラメータによって、不良は低減または除去される。
【0024】
形成されたマイクロビーズの直径はチャンネルの深さ(55μm)よりも大きかった。これは、ゲル化が緩やかなプロセスであり、アルギン酸ナトリウム液滴が装置内では完全に硬化しないためである。これら液滴は装置を出て、完全にゲル化する前にマイクロチューブ中で球形をとる。
図3から明らかなように、その直径はゲル化中に29.9%だけ減少している。
【0025】
図4は本発明の参考例を示すMAB中にカプセル化されたHep G2セル(ヒト肝癌由来細胞)を示す図である。
この図には、MAB16中でカプセル化に成功したHep G2セル15が示されている。このように、内部ゲル化法とT字交差路液滴生成法を組み合わせることで、単一直径MAB16を生成し、Hep G2セル15をMAB16中にカプセル化することに成功した。MAB中でカプセル化されたセルの数は、アルギン酸ナトリウムにおけるセルの密度を調整することにより制御することができる。
【0026】
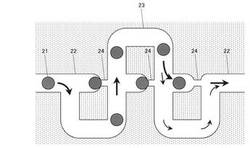
図5は本発明の実施例を示すマイクロビーズ(μ液滴)捕捉装置(マイクロアレイ)の模式図である。
この図において、21はマイクロビーズ(μ液滴)、22は直線状チャンネル、23は方形波形状のチャンネル、24は直線状チャンネル22に形成される狭窄領域、である。なお、図5において、太い矢印はメインストリームを、小さい矢印はサブストリームを示している。
【0027】
そこで、マイクロビーズ(μ液滴)の捕捉装置は、直線状チャンネル22と交差するように形成された方形波形状のチャンネル23からなり、マイクロビーズ(μ液滴)21の捕捉は、直線状チャンネル22に沿った狭窄領域24で行われる。マイクロビーズ(μ液滴)21が捕捉されておらず狭窄領域24が空の場合、直線状チャンネル22から狭窄領域24への流れに対する抵抗は、方形波形状のチャンネル23沿いの流れに対する抵抗よりも低い、つまり、メインストリーム(太い矢印)は直線状チャンネル22から狭窄領域24に沿って流れ、マイクロビーズ(μ液滴)21は直線状チャンネル22から狭窄領域24へ移動しやすくなる。したがって、流れの中のマイクロビーズ(μ液滴)21は、メインストリーム(太い矢印)によって狭窄領域24で捕捉される(トラップモード)。一旦、マイクロビーズ(μ液滴)21が捕捉され、狭窄領域24が埋まると、直線状チャンネル22から狭窄領域24への流れに対する抵抗は大幅に上昇し、メインストリームは方形波形状のチャンネル23沿いへと方向が変更される。従って、次のマイクロビーズ(μ液滴)は、埋められた狭窄領域24をバイパスして方形波形状のチャンネル23沿いに運ばれる(バイパスモード)。直線状チャンネル22と狭窄領域24の幅はそれぞれ150μmと35μmである。チャンネルの高さはそれぞれ85μmである。
【0028】
このように、マイクロビーズ(μ液滴)21は流される順番に直線状チャンネル22に形成された狭窄領域24を塞いでいくため、結果として、マイクロビーズ(μ液滴)21をアレイ化して配置することができる。
次に、上記した装置の作製について説明する。
ラピッドプロトタイピングが可能であること、作製の容易さ、そして最も重要な、生体適合性を有するといった利点があるため、MAB製造装置とマイクロアレイ装置の両方の作製には、エラストマーPDMS(Dow Corning社製シリコーンエラストマー Sylgard)を用いたソフトリソグラフィーが選択される。まず、シリコンウエハ上に通常のリソグラフィ技術を用いてSU−8金型を形成する。次いでPDMS膜をSU−8のマスター金型から成形する。注入口及び排出口用のアクセスホールがPDMS板に開けられる。PDMSをペトリ皿で硬化させることで別のPDMS板を生成する。最後に、2つのPDMS板の表面を酸素プラズマで処理し、恒久的に接着する。
【0029】
次にこの装置で用いられる材料について説明する。
この装置では、アルギン酸ナトリウム及びトウモロコシ油、大豆から抽出したレシチン(和光純薬工業株式会社製)を用いた。さらに、塩化カルシウム(CaCl2 )、塩化ナトリウム(NaCl)、及びTween20(関東化学株式会社製)を用いた。また、酢酸(ナカライテスク株式会社製)を用いた。炭酸カルシウム(CaCo3 )粉末はYHNANO co.,Ltd.から提供を受けた。全ての化学薬品及び試薬は入手したままの状態で、更なる精製は行わずに使用した。全ての実験に用いた超純水は18MΩ・cmの比抵抗を有するミリポアシステムから得た。
【0030】
次に、MABの生成手順について説明する。
全ての相の流速の制御にはシリンジポンプ(図示なし)を用いた。連続相はトウモロコシ油(メインストリーム)、及びレシチン(2wt%)と酢酸(0.67μl/ml)を含んだトウモロコシ油を用いた。CaCO3 粒子を含んだアルギン酸ナトリウム(2wt%)溶液を分散相として用いた。メインストリームのトウモロコシ油と、酢酸により酸性化されたトウモロコシ油、及びCaCO3 入りアルギン酸懸濁液の流速はそれぞれ0.25ml/h、0.25ml/h、及び0.018ml/hであった。
【0031】
作製されたマイクロビーズはマイクロチューブ中で捕捉した。マイクロチューブは遠心分離にかけられ、上澄みは除去された。マイクロビーズはそっとピペット操作して、CaCl2 (2wt%)溶液(1wt% Tween20)で洗浄された。次いで、混合物は再度遠心分離された。この洗浄処理はあと2回繰り返された。MABの写真はVH−Z450 高倍率ズームレンズ(450X)とKeyence VHX−100 デジタルマイクロスコープシステムで撮影された。直径はKeyence イメージソフトウェアで計測された。
【0032】
次に、セルをカプセル化するMABの生成について説明する。
MABの手順と同様だが、セルの生存可能性を維持するために、全ての溶液は浸透圧に合わせて調節されなければならなかった。アルギン酸ナトリウム(2wt%)溶液は、水の代わりにNaCl(0.9wt%)溶液を用いて調製された。洗浄には、CaCl2 (155mM)溶液(1wt% Tween20)が用いられた。最終洗浄には培地を使用した。
【0033】
次に、マイクロアレイへのマイクロビーズの捕捉について説明する。
上記手順で調製されたMABはシリンジポンプを用いてマイクロアレイに導入された。実験は逆さにしたNikon顕微鏡(Nicon eclipse,TE300)上に搭載したCCDカメラ(Hamamatsu C5405−05)を用いて視覚化した。
図6は本発明の実験例を示すマイクロビーズ(μ液滴)の捕捉アレイで捕捉されるMABの図面代用写真である。
【0034】
ここで、マイクロビーズ(μ液滴)捕捉アレイは直列に100液滴の捕捉を行うことができる。
図6(a)はマイクロビーズ(μ液滴)捕捉アレイにマイクロビーズ(μ液滴)が捕捉された状態を、図6(b)はバイパスモードのスーパーインポーズ画像を、図6(c)は捕捉モードのスーパーインポーズ画像をそれぞれ示している。
【0035】
この図から明らかなように、マイクロビーズ(μ液滴)は既に他のマイクロビーズ(μ液滴)がある狭窄領域には捕捉されなかった。この捕捉の効率はほぼ100%なので、少数のマイクロビーズ(μ液滴)を捕捉しアレイ化するのに好適である。図6(a)の四角で囲まれた領域はそれぞれバイパスモードと捕捉モードを示している。この装置は、マイクロビーズ(μ液滴)を固定することができ、この捕捉を連続してつなげることでマイクロアレイが形成された。
【0036】
このように、連続したマイクロフルイディックトラップを用いることで、マイクロビーズが固定され、アレイ化された。単一直径MABを生成することができることで、セロミクス研究と治療目的の両方でアルギン酸の利用を促進することができる。ここで提案されたパッシブマイクロフルイディックトラップは、操作が簡単かつロバストであり、高効率である。セルをカプセル化した、トラップされたマイクロビーズを壊すことなく、上流に薬品/医薬品を簡単に導入することができ、セルアセイのために有用なツールとなる。さらに、セルをアルギン酸中にカプセル化することで、非接着細胞だけでなく、より難しい接着細胞も扱うことができるようになる。
【0037】
本発明によれば、薬剤等を均一直径のマイクロビーズに導入することによって、内部に混入している薬剤の量を調整できる。また、インシュリンなどの有益な物質を放出したり、分解したりする細胞をカプセル化し、体内に導入すれば、体内に入れた場合の免疫反応を防ぎつつ活用させることができる。
以下、マイクロチャンネル中の圧力低下について説明する。
【0038】
Darcy−Weisbachの式を用いてマイクロチャンネル中の圧力低下あるいは圧力差を割り出し、Hagen−Poiseuille流れの問題のための連続方程式及び運動量方程式を解くことで、以下の式(1)が得られた。
Δp=(fL/D)・(ρV2 /2) …(1)
ここで、Δpは圧力差、fはDarcy摩擦係数、Lはチャンネル長、Dは流体直径、ρは流体密度、Vは流体の平均速度である。
【0039】
マイクロチャンネルの流体直径Dは、
D=4A/P …(2)
ここで、Aはマイクロチャンネルの断面積、Pはマイクロチャンネルの潤辺である。
図7に示される幅を有する長方形チャンネル(Wは幅、Hは高さ)の断面積及び潤辺は次のように示される。
【0040】
A=WH …(3)
P=2(W+H) …(4)
Darcy摩擦係数fはReynolds数Re、及びアスペクト比αに関連する。アスペクト比αは、高さ/幅あるいは幅/高さのどちらかで定義され、0≦α≦1となる。Darcy摩擦係数f及びReynolds数Reの積は、アスペクト比に依存する定数であるか、また、
f・Re=C(α) …(5)
であり、ここでC(α)はαの関数である定数Cであり、Reは
Re=ρVD/μ …(6)
でも表され、μは流体粘性である。
【0041】
次に、様々なアスペクト比の長方形チャンネルの層流摩擦係数について説明する。
表1はWhite(上記非特許文献9参照)によって与えられた解である。
【0042】
【表1】

式(5)及び(6)を式(1)に代入すると、下記式(7)が得られる。
Δp=〔C(α)/2)〕・(μLV/D2 ) …(7)
流体の平均速度Vは
V=Q/A …(8)
で表され、ここでQは体積流量である。
【0043】
式(2)と式(8)を式(7)に代入すると、下記式(9)が得られる。
Δp=〔C(α)/32)〕・(μLQP2 /A3 ) …(9)
図8は本発明にかかるマイクロ液滴トラップの詳細な説明図である。
上記したが、マイクロ液滴の捕捉は直線状チャンネルに形成された方形波チャンネル(ループチャンネル)で行われる。マイクロ液滴のトラップは直線状チャンネルに沿った狭窄領域でなされ、トラップが空であると、直線状チャンネルに沿った流体抵抗はループチャンネルに沿った流体抵抗よりも低くなる。流れにおけるビーズはメインストリームによって運ばれ捕捉される(捕捉モード)。捕捉されると流体抵抗は直線状チャンネルに沿って急激に増加し、そして、そのメインストリームはループチャンネルに向きが変えられ、続いてビーズは埋められたトラップをバイパスすることによりループチャンネルに沿って運ばれる。
【0044】
ここで、図8(b)にその捕捉の簡略化された回路図を示す。図8(b)における2つの交差路A,Bは図8(a)の中でXによってマークされた交差路に対応する。交差路Aの流体は、流路1又は流路2を介して交差路Bへ流れる。曲がり、幅の拡張等による小さなロスを無視すると、流路1及び流路2の圧力差は式(9)で計算される。どちらの流路も圧力低下は同じなので、両方の式を等しいとして、以下の式(10)が得られる。
【0045】
Q1 /Q2 =〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
(P2 /P1 )2 ・(P2 /P1 )2 ・(A1 /A2 )3 …(10)
ここで、添字の1及び2はそれぞれ流路1及び流路2を示す。流路1については、分析を簡略化するために、長さL1 の幅を狭くしたチャンネルの長さとすることに注意されたい。大半の圧力低下は幅を狭くしたチャンネル沿いに起こるので、これは有効である。
【0046】
面積と周囲の関係は以下の通りであり、
A1 =W1 H …(11)
A2 =W2 H …(12)
P1 =2(W1 +H) …(13)
P2 =2(W2 +H) …(14)
高さHが両方の流路において同じであることに留意されたい。
【0047】
上記の関係を式(10)に代入すると、以下の式(15)が得られる。
Q1 /Q2 =〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
〔(W2 +H)/(W1 +H)〕2 ・(W1 /W2 )3 …(15)
捕捉が動作するためには、流路1沿いの体積流量は流路2沿いの体積流量よりも大きくなくてはならない。すなわち、
Q1 /Q2 ≧1
または
〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
〔(W2 +H)/(W1 +H)〕2 ・(W1 /W2 )3 ≧1 …(16)
である。
【0048】
上記式が流速の項を含まないことに留意されたい。換言すれば、正しく設計された捕捉は層流中で全ての速度で行われる。
図9は本発明の実施例を示す体積流量比Q1 /Q2 が3.66で設計されたマイクロ液滴の捕捉装置中に捕捉されたビーズを示す図である。
このマイクロ液滴の装置31においては、体積流量比Q1 /Q2 は1よりも大きく、結果的に、メインストリームは直線状チャンネル32沿いであり、ビーズ(15μm)34を直線状チャンネル32の狭窄領域33に捕捉し、アレイ状に配置することができた。
【0049】
なお、体積流量比Q1 /Q2 が0.76で設計されたマイクロ液滴の捕捉装置中に捕捉しようと試みたが、体積流量比Q1 /Q2 が1より小さく、結果的に、メインストリームはループチャンネル(方形波チャンネル)沿いであり、捕捉することはできなかった。
図10は本発明の実施例を示す捕捉されたビーズの解放(リリース)装置(その1)を示す図であり、図10(a)はそのビーズの捕捉した状態を示す図、図10(b)はその捕捉されたビーズを解放する状態を示す図である。
【0050】
図10(a)に示すように、直線状チャンネル41の狭窄領域42の終端部にアルミニウム43がパターニングされており、その狭窄領域42にビーズ44が捕捉されている。そこで、図10(b)に示すように、その狭窄領域42の終端部のアルミニウム43にレーザー(例えば、出力1.5W)45を照射する。すると、その狭窄領域42の終端部に泡46が生成されて、狭窄領域42に捕捉されていたビーズ44を狭窄領域42から解放することができる。
【0051】
なお、上記実施例では、パターニングされたアルミニウム43にレーザー45を照射するようにしたが、狭窄領域の終端部をターゲットとしてそのターゲットとなる基板をレーザーで照射することにより泡46を発生させることができればよい。
このように、レーザーを用いた狭窄領域の終端部の加熱により泡を発生させることによって、一度捕捉したビーズを解放する。つまり、一旦捕捉したビーズの並べ換えを自在に行うことができる。
【0052】
また、マイクロシステムにおいてビーズ及びセルを分類するために誘電泳動を用いるようにしたもの(上記非特許文献10参照)が提案されている。
図11は本発明の実施例を示す捕捉されたビーズの解放装置(その2)の動作を示す図、図12はそのビーズの解放装置とその動作を示す図であり、図12(a)はビーズ(セル)が捕捉された状態を、図12(b)は試薬の吹き込み状態を、図12(c)はビーズ(セル)が選択された状態を、図12(d)は電極への電位の印加状態を、図12(e)はビーズ(セル)が解放された状態を示す図である。
【0053】
図11に示すように、第1電極51は直角三角形状をなし、斜辺52,水平辺53及び垂直辺54を有している。一方、第2電極55も直角三角形状をなし、斜辺56,水平辺57及び垂直辺58を有している。これらの第1電極51の斜辺52と第2電極55の垂直辺58とは対向している。
そこで、図11(a)に示すように、第1電極51に+電位が、第2電極55に−電位が印加されると、第1電極51の斜辺52と水平辺53が交わった下部先端部59は尖っており、一方、第2電極55の垂直辺58は平坦となっているので、第1電極51と第2電極55との間には不平等電界が生成される。つまり、下部先端部59には傾斜度の大きい電界が生成され、第2電極55の垂直辺58には傾斜度の小さい電界が生成される。このように第1電極51と第2電極55との間には不平等電界が生成されるので、図11(b)に示すように、下部先端部59の近傍にビーズ(セル)60が配置される場合には、矢印のように誘電泳動力61Aが働くことになり、ビーズ(セル)60は傾斜度の大きい電界が生じている下部先端部59から傾斜度の小さい電界が生じている第2電極55の垂直辺58へと吸引されることになる。
【0054】
このような誘電泳動力を生じさせる手段を、上記したビーズ(セル)の捕捉装置において、捕捉状態から解放するために用いることができる。
以下、具体的に説明する。
まず、図12(a)に示すように、マイクロビーズの捕捉アレイ装置でビーズ(セル)65を捕捉する。その捕捉アレイ装置には、上記した第1電極と第2電極からなる電極64が直線状チャンネル61の狭窄領域63に配置されている。
【0055】
次に、図12(b)に示すように、試薬66がビーズ(セル)65の捕捉アレイ装置へ導入され、ビーズ(セル)65の試薬66に対する反応が観察される。
次に、図12(c)に示すように、解放したい所望のビーズ(セル)65′がある場合は、そのビーズ(セル)65′を解放するために電極64′を選択して電極64′へ任意の電圧を印加する。
【0056】
次に、図12(d)に示すように、電極64′への電圧の印加により、電極64′間には不平等電界が生成されるので、ビーズ(セル)65′は誘電泳動力により直線状チャンネル61の狭窄領域63から解放される。
次に、図12(e)に示すように、解放されたビーズ(セル)65′はメインストリーム67に乗り、方形波形状のチャンネル62を流れていくことになる。
【0057】
その解放されたビーズ(セル)65′は、この捕捉アレイ装置から運ばれ、更なる分析のために収集される。誘電泳動力を生じさせるための電位は5−15Vである。
なお、本発明は上記実施例に限定されるものではなく、本発明の趣旨に基づき種々の変形が可能であり、これらを本発明の範囲から排除するものではない。
【産業上の利用可能性】
【0058】
本発明のマイクロビーズの捕捉方法及びその配列装置は、再生医工学、細胞研究、創薬などに有効利用できる。
【符号の説明】
【0059】
1 第1のマイクロチャンネル
2 油(連続相)
3 第2のマイクロチャンネル
4 CaCO3 粉末を含むアルギン酸ナトリウム溶液(分散相)
5 T字交差路
6 CaCO3 粉末を含むアルギン酸ナトリウムからなる液滴
7 第3のマイクロチャンネル
8 レシチン及び酢酸を含む油
9 二路合流チャンバー
10 二路合流チャンバーにて形成されるマイクロビーズ(μ液滴)
11 混合及び反応チャンネル
12 ゲル化が進んだマイクロビーズ(μ液滴)
15 Hep G2セル
16,21 マイクロビーズ(μ液滴)
22,32,41,61 直線状チャンネル
23,62 方形波形状のチャンネル
24,33,42,63 直線状チャンネルに形成される狭窄領域
31 マイクロ液滴の装置
34 ビーズ(15μm)
43 アルミニウム
44 ビーズ
45 レーザー
46 泡
51 第1電極
52,56 斜辺
53,57 水平辺
54,58 垂直辺
55 第2電極
59 下部先端部
60,65 ビーズ(セル)
61A 誘電泳動力
64 第1電極と第2電極からなる電極
64′ 電圧を印加したい電極
65′ 解放したい所望のビーズ(セル)
66 試薬
67 メインストリーム
【技術分野】
【0001】
本発明は、マイクロビーズの配列(捕捉・解放)方法及びその配列(捕捉・解放)装置に関するものである。
【背景技術】
【0002】
アルギン酸高分子は生体適合性が良く、食材や細胞のカプセル化など用途の多い材料である。これを利用して、ドラッグデリバリーや、再生医工学の材料に使う例は多い。
ところで、ヒドロゲル中にセルをカプセル化することはセルに保護を与えるものであり、バイオリアクターや組織工学と関連する(下記非特許文献1参照)。アルギン酸はその生体適合性、入手の容易さ、比較的低いコストから、最も良く用いられ、研究されるヒドロゲルである。アルギン酸中にセルをカプセル化し、アレイを形成することができれば、セルを保護膜中に包み込みながら、多くのセルを同時に視覚化し分析することができるようになるので、診断研究、薬理学的研究やセロミクスの研究に多く応用されるだろう。
【0003】
微小な単一直径(単分散)カプセルの生成は、良く研究されるものの一つである(下記非特許文献2参照)。セルをマイクロビーズ中にカプセル化すれば、カプセルへ栄養を与え不要物を排出する交換が拡散によって短時間にできるようになり、カプセル化されたセルの生存可能性を向上させることができる(下記非特許文献3参照)。さらに、マイクロビーズを単分散化することによって、個々のマイクロビーズ中のカプセル化されたセルの数を、より正確に制御することができるようになる。
【0004】
マイクロデバイス中でアルギン酸ナトリウムと塩化カルシウム液滴を用いて、セルをカプセル化するために微小な不均一直径(多分散)のアルギン酸マイクロビーズを形成することは、Sugiuraら(下記非特許文献4参照)によって報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO 02/068104 A1
【非特許文献】
【0006】
【非特許文献1】M.M.Stevens et al.,”A Rapid−Curing Alginate Gel System:Utility in Periosteum−derived Cartilage Tissue Engineering”,Biomaterials,25,pp.887−894,2004.
【非特許文献2】G.Orive et al.,”Cell Encapsulation:Promise and Progress” Nature Medicine,9,pp.104−107,2003.
【非特許文献3】W.M.Ku(uはウムラウト付き)htreiber,R.P.Lanza,and W.L.Chick,Cell encapsulation technology and therapeutics,Birkha(aはウムラウト付き)user Boston,1999.
【非特許文献4】S.Sugiura,T.Oda,Y.Izumida,Y.Aoyagi,M.Satake,A.Ochiai,N.Ohkohchi,M.Nakajima,”Size Control of Calcium Alginate Beads containing Living Cells using Micro−Nozzle Array”,Biomaterials,26,pp.3327−3331,2005.
【非特許文献5】D.Poncelet,”Production of Alginate Beads by Emulsification/Internal Gelation”,2001,Annals of the New York Academy of Sciences,944,pp.74−82.
【非特許文献6】A Tixier−Mita,Y.Mita,K.Cozic,F.M.,B.LePioufle,and H.Fujita,”To place cells an array using aspiration technique,”Micro Total Analysis Systems,Nara,Japan,2002.
【非特許文献7】B.Le.Pioufle,P.Surbled,H.Nagai,Y.Murakami,H.S.Chun,E.Tamiya,and H.Fujita,”Living cells captured on a biomicrosystem devoted to DNA injection,”Materials Science and Engineering:C,vol.12,pp.77−81,2000.
【非特許文献8】B.M.Taff and J.Voldman,”A Scalable Row/Column− Addressable Dielectrophoretic Cell−Trapping Array”,Micro Total Analysis Systems,Boston,USA,pp.865−867,2005.
【非特許文献9】F.M.White, Fluid Mechanics,3rd ed.,New York,NY:McGraw Hill,1994
【非特許文献10】Stefan Fiedler et al.,”Dielectrophoretic Sorting of Particles and Cells in a Microsystem”,Anal.Chem.1998,70,pp.1909−1915
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、マイクロビーズの均一性とサイズ分布を向上するために、以下の2つの問題を解決する必要がある。すなわち、(1)ゲル化のために微小アルギン酸ナトリウム液滴に外部から多価陽イオンが添加されるときの変形の問題と、(2)ゲル化前のアルギン酸ナトリウム液滴の不要な融合の問題、である。
そこで、本発明では、これまでに提案された内部ゲル化法(上記非特許文献5参照)とT字交差路液滴生成法(上記特許文献1参照)をも参照し研究を重ねながら、アルギン酸マイクロビーズ(MAB)を生成するようにした。
【0008】
さらに、セルアセイのためMAB中にセルをカプセル化することも試みる。吸引法(上記非特許文献6参照)のようなフルイディック法や、金表面へのケミカルパターニングのような生化学的手法(上記非特許文献7参照)や、誘電泳動トラップ(捕捉)(上記非特許文献8参照)に基づくセルアレイがこれまでに報告されている。しかしながら、これらのセルアレイの多くは、複雑な作成手順と制御を必要としている。
【0009】
そこで、本発明者らは、「1トラップあたり1ビーズ」の固定化を達成するために、パッシブマイクロフルイディックトラップデバイス(マイクロチャンネルからなるマイクロビーズ捕捉装置)を提案する。単一直径アルギン酸マイクロビーズ(MAB)を生成する技術だけでなく、穏やかで扱い易い、マイクロビーズベースのセルアセイシステムの開発に向けて研究を行っている。
【0010】
本発明は、上記状況に鑑みて、マイクロビーズの配列方法及びその配列装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は、上記目的を達成するために、
〔1〕マイクロビーズの配列方法において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させることを特徴とする。
【0012】
〔2〕上記〔1〕に記載のマイクロビーズの配列方法によって配列された前記マイクロビーズが位置する狭窄領域の終端部を加熱することにより、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔3〕マイクロビーズの配列方法において、上記〔1〕に記載のマイクロビーズの配列方法によって配列されたマイクロビーズが位置する狭窄領域の終端部に誘電泳動力を作用させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
【0013】
〔4〕マイクロビーズの配列装置において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと、この直線状チャンネルと順次交差する方形波形状のチャンネルと、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、この空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、この狭窄領域をバイパスして前記マイクロビーズを下流に移動させるマイクロビーズ移動手段を具備することを特徴とする。
【0014】
〔5〕上記〔4〕記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部を加熱手段により加熱することで泡を生成させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔6〕上記〔5〕記載のマイクロビーズの配列装置において、前記加熱手段はターゲットへレーザー光を照射するレーザーであることを特徴とする。
【0015】
〔7〕上記〔4〕記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部に誘電泳動手段を設けて、前記マイクロビーズを前記狭窄領域から解放することを特徴とする。
〔8〕上記〔4〕〜〔7〕の何れか一項記載のマイクロビーズの配列装置において、前記狭窄領域を水平方向に複数個配置し、前記マイクロビーズをチップ上にアレイ化して配置することを特徴とする。
【発明の効果】
【0016】
本発明によれば、マイクロビーズをチップ上にアレイ化させることも可能である。
【図面の簡単な説明】
【0017】
【図1】本発明の参考例を示すMAB製造装置の模式図である。
【図2】本発明の参考例を示すMABの図面代用写真である。
【図3】本発明の参考例における完全ゲル化の前後におけるMABの直径分布を示す図である。
【図4】本発明の参考例を示すMAB中にカプセル化されたHep G2セルを示す図である。
【図5】本発明にかかるマイクロビーズ(μ液滴)の捕捉装置(マイクロアレイ)の模式図である。
【図6】本発明の実験例を示すマイクロビーズ(μ液滴)の捕捉アレイで捕捉されるMABの図面代用写真である。
【図7】本発明にかかる長方形のマイクロチャンネルの断面図である。
【図8】本発明にかかるマイクロ液滴トラップの詳細な説明図である。
【図9】本発明の実施例を示す体積流量比Q1 /Q2 が3.66で設計されたマイクロ液滴の捕捉装置中に捕捉されたビーズを示す図である。
【図10】本発明の実施例を示す捕捉されたビーズの解放(リリース)装置(その1)を示す図である。
【図11】本発明の実施例を示す捕捉されたビーズの解放装置(その2)の動作を示す図である。
【図12】本発明の実施例を示す捕捉されたビーズの解放装置(その2)とその動作を示す図である。
【発明を実施するための形態】
【0018】
本発明のマイクロビーズの配列方法において、マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、前記空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させる。
【実施例】
【0019】
以下、本発明の実施の形態について詳細に説明する。
図1は本発明の参考例を示すMAB製造装置の模式図である。
この図において、1は連続相である油2を流す第1のマイクロチャンネル(例えば幅は直径150μm、高さは55μm)、3は分散相であるCaCO3 粉末を含むアルギン酸ナトリウム溶液4を流す第2のマイクロチャンネル(例えば幅は直径50μm、高さは55μm)、5はその第1のマイクロチャンネル1と第2のマイクロチャンネル3が交差するT字交差路、6はそのT字交差路5で形成されるCaCO3 粉末を含むアルギン酸ナトリウムからなる液滴、7はレシチン(lecithin:燐脂質の一種)及び酢酸を含む油8が流れる第3のマイクロチャンネル、9は第1のマイクロチャンネル1と第3のマイクロチャンネル7が合流する二路合流チャンバー、10は二路合流チャンバー9にて形成されるマイクロビーズ(μ液滴)、11はその二路合流チャンバー9に連通する混合及び反応チャンネル、12はゲル化が進んだマイクロビーズ(μ液滴)である。
【0020】
ここで、不溶性炭酸カルシウム粒子を含んだアルギン酸ナトリウム溶液4をT字交差路5で油2の流れに流すと、液滴6が生成される。次いで、レシチンと酢酸を含む油8が第3のマイクロチャンネル7から下流に加えられる。次いで、曲がりくねったチャンネルからなる混合及び反応チャンネル11で、酸性油、つまりレシチンと酢酸を含む油8とメインストリームを流れる油2との混合が促進される。CaCO3 粉末を含むアルギン酸ナトリウムからなる液滴6は、ペーハー(ph)値が減少し、Ca2+(カルシウムイオン)が組み合わされるとゲル化が起こり、下流にアルギン酸カルシウムゲルが形成される。つまり、pH値の減少により、不溶性カルシウム錯体からCa2+が放出されて、ゲル化が起こる。続いて、MABはマイクロチューブで捕捉され、さらにゲル化を進めるため遠心力により水性塩化カルシウム水溶液中に分離される。
【0021】
この単一直径アルギン酸マイクロビーズの製造装置を用いると、セルをアルギン酸ナトリウム溶液に加えるだけで、セルをMABにカプセル化することができる。しかしながら、この場合、溶液は浸透圧に合わせて、水の代わりに生理食塩水を用いて調節される必要がある。
なお、上記実施例では、分散相として不溶性CaCO3 粉末を含んだアルギン酸ナトリウム溶液について述べたが、ph7以上の水溶液に溶けない物質であればよい。例えばバリウム化合物粉末などであってもよい。
【0022】
また、交差路は、T字交差路に限らず、フローフォーカシング(flow focusing)によってもよい。
さらに、界面活性剤としては、レシチンに限られるものではなく、両親媒性分子であれば、他のものであってもよい。
図2は本発明の参考例を示すMABの図面代用写真であり、図2(a)は完全にゲル化される前の油を、図2(b)は完全にゲル化された後の水中における状態を示す図、図3は本発明の参考例における完全にゲル化する前後におけるMABの直径分布を示す図である。
【0023】
変動係数(C.V.)は直径の標準偏差と平均径の比として定義される。平均径と変動係数(C.V.)は、完全ゲル化前はそれぞれ116.93μmと1.9%であり、完全ゲル化後はそれぞれ81.91μmと2.7%であった。生成されたMABの8.9%は球形ではなく、計測に含まれなかった。T字交差路を用いた液滴形成によって、単一直径のアルギン酸ナトリウム液滴を生成することが可能となった。界面活性剤(レシチン)を加えることによって、形成された液滴間の不要な癒着を防ぎ、マイクロビーズが徐々にゲル化していく間もマイクロビーズの単一直径を維持することができた。この手法で、ゲルは遠心分離による水相への分離前に硬化した。その結果、マイクロビーズ(MAB)は球形であり、サイズ分布も小さかった。Ca2+濃度とpHのような微調整パラメータによって、不良は低減または除去される。
【0024】
形成されたマイクロビーズの直径はチャンネルの深さ(55μm)よりも大きかった。これは、ゲル化が緩やかなプロセスであり、アルギン酸ナトリウム液滴が装置内では完全に硬化しないためである。これら液滴は装置を出て、完全にゲル化する前にマイクロチューブ中で球形をとる。
図3から明らかなように、その直径はゲル化中に29.9%だけ減少している。
【0025】
図4は本発明の参考例を示すMAB中にカプセル化されたHep G2セル(ヒト肝癌由来細胞)を示す図である。
この図には、MAB16中でカプセル化に成功したHep G2セル15が示されている。このように、内部ゲル化法とT字交差路液滴生成法を組み合わせることで、単一直径MAB16を生成し、Hep G2セル15をMAB16中にカプセル化することに成功した。MAB中でカプセル化されたセルの数は、アルギン酸ナトリウムにおけるセルの密度を調整することにより制御することができる。
【0026】
図5は本発明の実施例を示すマイクロビーズ(μ液滴)捕捉装置(マイクロアレイ)の模式図である。
この図において、21はマイクロビーズ(μ液滴)、22は直線状チャンネル、23は方形波形状のチャンネル、24は直線状チャンネル22に形成される狭窄領域、である。なお、図5において、太い矢印はメインストリームを、小さい矢印はサブストリームを示している。
【0027】
そこで、マイクロビーズ(μ液滴)の捕捉装置は、直線状チャンネル22と交差するように形成された方形波形状のチャンネル23からなり、マイクロビーズ(μ液滴)21の捕捉は、直線状チャンネル22に沿った狭窄領域24で行われる。マイクロビーズ(μ液滴)21が捕捉されておらず狭窄領域24が空の場合、直線状チャンネル22から狭窄領域24への流れに対する抵抗は、方形波形状のチャンネル23沿いの流れに対する抵抗よりも低い、つまり、メインストリーム(太い矢印)は直線状チャンネル22から狭窄領域24に沿って流れ、マイクロビーズ(μ液滴)21は直線状チャンネル22から狭窄領域24へ移動しやすくなる。したがって、流れの中のマイクロビーズ(μ液滴)21は、メインストリーム(太い矢印)によって狭窄領域24で捕捉される(トラップモード)。一旦、マイクロビーズ(μ液滴)21が捕捉され、狭窄領域24が埋まると、直線状チャンネル22から狭窄領域24への流れに対する抵抗は大幅に上昇し、メインストリームは方形波形状のチャンネル23沿いへと方向が変更される。従って、次のマイクロビーズ(μ液滴)は、埋められた狭窄領域24をバイパスして方形波形状のチャンネル23沿いに運ばれる(バイパスモード)。直線状チャンネル22と狭窄領域24の幅はそれぞれ150μmと35μmである。チャンネルの高さはそれぞれ85μmである。
【0028】
このように、マイクロビーズ(μ液滴)21は流される順番に直線状チャンネル22に形成された狭窄領域24を塞いでいくため、結果として、マイクロビーズ(μ液滴)21をアレイ化して配置することができる。
次に、上記した装置の作製について説明する。
ラピッドプロトタイピングが可能であること、作製の容易さ、そして最も重要な、生体適合性を有するといった利点があるため、MAB製造装置とマイクロアレイ装置の両方の作製には、エラストマーPDMS(Dow Corning社製シリコーンエラストマー Sylgard)を用いたソフトリソグラフィーが選択される。まず、シリコンウエハ上に通常のリソグラフィ技術を用いてSU−8金型を形成する。次いでPDMS膜をSU−8のマスター金型から成形する。注入口及び排出口用のアクセスホールがPDMS板に開けられる。PDMSをペトリ皿で硬化させることで別のPDMS板を生成する。最後に、2つのPDMS板の表面を酸素プラズマで処理し、恒久的に接着する。
【0029】
次にこの装置で用いられる材料について説明する。
この装置では、アルギン酸ナトリウム及びトウモロコシ油、大豆から抽出したレシチン(和光純薬工業株式会社製)を用いた。さらに、塩化カルシウム(CaCl2 )、塩化ナトリウム(NaCl)、及びTween20(関東化学株式会社製)を用いた。また、酢酸(ナカライテスク株式会社製)を用いた。炭酸カルシウム(CaCo3 )粉末はYHNANO co.,Ltd.から提供を受けた。全ての化学薬品及び試薬は入手したままの状態で、更なる精製は行わずに使用した。全ての実験に用いた超純水は18MΩ・cmの比抵抗を有するミリポアシステムから得た。
【0030】
次に、MABの生成手順について説明する。
全ての相の流速の制御にはシリンジポンプ(図示なし)を用いた。連続相はトウモロコシ油(メインストリーム)、及びレシチン(2wt%)と酢酸(0.67μl/ml)を含んだトウモロコシ油を用いた。CaCO3 粒子を含んだアルギン酸ナトリウム(2wt%)溶液を分散相として用いた。メインストリームのトウモロコシ油と、酢酸により酸性化されたトウモロコシ油、及びCaCO3 入りアルギン酸懸濁液の流速はそれぞれ0.25ml/h、0.25ml/h、及び0.018ml/hであった。
【0031】
作製されたマイクロビーズはマイクロチューブ中で捕捉した。マイクロチューブは遠心分離にかけられ、上澄みは除去された。マイクロビーズはそっとピペット操作して、CaCl2 (2wt%)溶液(1wt% Tween20)で洗浄された。次いで、混合物は再度遠心分離された。この洗浄処理はあと2回繰り返された。MABの写真はVH−Z450 高倍率ズームレンズ(450X)とKeyence VHX−100 デジタルマイクロスコープシステムで撮影された。直径はKeyence イメージソフトウェアで計測された。
【0032】
次に、セルをカプセル化するMABの生成について説明する。
MABの手順と同様だが、セルの生存可能性を維持するために、全ての溶液は浸透圧に合わせて調節されなければならなかった。アルギン酸ナトリウム(2wt%)溶液は、水の代わりにNaCl(0.9wt%)溶液を用いて調製された。洗浄には、CaCl2 (155mM)溶液(1wt% Tween20)が用いられた。最終洗浄には培地を使用した。
【0033】
次に、マイクロアレイへのマイクロビーズの捕捉について説明する。
上記手順で調製されたMABはシリンジポンプを用いてマイクロアレイに導入された。実験は逆さにしたNikon顕微鏡(Nicon eclipse,TE300)上に搭載したCCDカメラ(Hamamatsu C5405−05)を用いて視覚化した。
図6は本発明の実験例を示すマイクロビーズ(μ液滴)の捕捉アレイで捕捉されるMABの図面代用写真である。
【0034】
ここで、マイクロビーズ(μ液滴)捕捉アレイは直列に100液滴の捕捉を行うことができる。
図6(a)はマイクロビーズ(μ液滴)捕捉アレイにマイクロビーズ(μ液滴)が捕捉された状態を、図6(b)はバイパスモードのスーパーインポーズ画像を、図6(c)は捕捉モードのスーパーインポーズ画像をそれぞれ示している。
【0035】
この図から明らかなように、マイクロビーズ(μ液滴)は既に他のマイクロビーズ(μ液滴)がある狭窄領域には捕捉されなかった。この捕捉の効率はほぼ100%なので、少数のマイクロビーズ(μ液滴)を捕捉しアレイ化するのに好適である。図6(a)の四角で囲まれた領域はそれぞれバイパスモードと捕捉モードを示している。この装置は、マイクロビーズ(μ液滴)を固定することができ、この捕捉を連続してつなげることでマイクロアレイが形成された。
【0036】
このように、連続したマイクロフルイディックトラップを用いることで、マイクロビーズが固定され、アレイ化された。単一直径MABを生成することができることで、セロミクス研究と治療目的の両方でアルギン酸の利用を促進することができる。ここで提案されたパッシブマイクロフルイディックトラップは、操作が簡単かつロバストであり、高効率である。セルをカプセル化した、トラップされたマイクロビーズを壊すことなく、上流に薬品/医薬品を簡単に導入することができ、セルアセイのために有用なツールとなる。さらに、セルをアルギン酸中にカプセル化することで、非接着細胞だけでなく、より難しい接着細胞も扱うことができるようになる。
【0037】
本発明によれば、薬剤等を均一直径のマイクロビーズに導入することによって、内部に混入している薬剤の量を調整できる。また、インシュリンなどの有益な物質を放出したり、分解したりする細胞をカプセル化し、体内に導入すれば、体内に入れた場合の免疫反応を防ぎつつ活用させることができる。
以下、マイクロチャンネル中の圧力低下について説明する。
【0038】
Darcy−Weisbachの式を用いてマイクロチャンネル中の圧力低下あるいは圧力差を割り出し、Hagen−Poiseuille流れの問題のための連続方程式及び運動量方程式を解くことで、以下の式(1)が得られた。
Δp=(fL/D)・(ρV2 /2) …(1)
ここで、Δpは圧力差、fはDarcy摩擦係数、Lはチャンネル長、Dは流体直径、ρは流体密度、Vは流体の平均速度である。
【0039】
マイクロチャンネルの流体直径Dは、
D=4A/P …(2)
ここで、Aはマイクロチャンネルの断面積、Pはマイクロチャンネルの潤辺である。
図7に示される幅を有する長方形チャンネル(Wは幅、Hは高さ)の断面積及び潤辺は次のように示される。
【0040】
A=WH …(3)
P=2(W+H) …(4)
Darcy摩擦係数fはReynolds数Re、及びアスペクト比αに関連する。アスペクト比αは、高さ/幅あるいは幅/高さのどちらかで定義され、0≦α≦1となる。Darcy摩擦係数f及びReynolds数Reの積は、アスペクト比に依存する定数であるか、また、
f・Re=C(α) …(5)
であり、ここでC(α)はαの関数である定数Cであり、Reは
Re=ρVD/μ …(6)
でも表され、μは流体粘性である。
【0041】
次に、様々なアスペクト比の長方形チャンネルの層流摩擦係数について説明する。
表1はWhite(上記非特許文献9参照)によって与えられた解である。
【0042】
【表1】

式(5)及び(6)を式(1)に代入すると、下記式(7)が得られる。
Δp=〔C(α)/2)〕・(μLV/D2 ) …(7)
流体の平均速度Vは
V=Q/A …(8)
で表され、ここでQは体積流量である。
【0043】
式(2)と式(8)を式(7)に代入すると、下記式(9)が得られる。
Δp=〔C(α)/32)〕・(μLQP2 /A3 ) …(9)
図8は本発明にかかるマイクロ液滴トラップの詳細な説明図である。
上記したが、マイクロ液滴の捕捉は直線状チャンネルに形成された方形波チャンネル(ループチャンネル)で行われる。マイクロ液滴のトラップは直線状チャンネルに沿った狭窄領域でなされ、トラップが空であると、直線状チャンネルに沿った流体抵抗はループチャンネルに沿った流体抵抗よりも低くなる。流れにおけるビーズはメインストリームによって運ばれ捕捉される(捕捉モード)。捕捉されると流体抵抗は直線状チャンネルに沿って急激に増加し、そして、そのメインストリームはループチャンネルに向きが変えられ、続いてビーズは埋められたトラップをバイパスすることによりループチャンネルに沿って運ばれる。
【0044】
ここで、図8(b)にその捕捉の簡略化された回路図を示す。図8(b)における2つの交差路A,Bは図8(a)の中でXによってマークされた交差路に対応する。交差路Aの流体は、流路1又は流路2を介して交差路Bへ流れる。曲がり、幅の拡張等による小さなロスを無視すると、流路1及び流路2の圧力差は式(9)で計算される。どちらの流路も圧力低下は同じなので、両方の式を等しいとして、以下の式(10)が得られる。
【0045】
Q1 /Q2 =〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
(P2 /P1 )2 ・(P2 /P1 )2 ・(A1 /A2 )3 …(10)
ここで、添字の1及び2はそれぞれ流路1及び流路2を示す。流路1については、分析を簡略化するために、長さL1 の幅を狭くしたチャンネルの長さとすることに注意されたい。大半の圧力低下は幅を狭くしたチャンネル沿いに起こるので、これは有効である。
【0046】
面積と周囲の関係は以下の通りであり、
A1 =W1 H …(11)
A2 =W2 H …(12)
P1 =2(W1 +H) …(13)
P2 =2(W2 +H) …(14)
高さHが両方の流路において同じであることに留意されたい。
【0047】
上記の関係を式(10)に代入すると、以下の式(15)が得られる。
Q1 /Q2 =〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
〔(W2 +H)/(W1 +H)〕2 ・(W1 /W2 )3 …(15)
捕捉が動作するためには、流路1沿いの体積流量は流路2沿いの体積流量よりも大きくなくてはならない。すなわち、
Q1 /Q2 ≧1
または
〔C2 (α2 )/C1 (α1 )〕・(L2 /L1 )・
〔(W2 +H)/(W1 +H)〕2 ・(W1 /W2 )3 ≧1 …(16)
である。
【0048】
上記式が流速の項を含まないことに留意されたい。換言すれば、正しく設計された捕捉は層流中で全ての速度で行われる。
図9は本発明の実施例を示す体積流量比Q1 /Q2 が3.66で設計されたマイクロ液滴の捕捉装置中に捕捉されたビーズを示す図である。
このマイクロ液滴の装置31においては、体積流量比Q1 /Q2 は1よりも大きく、結果的に、メインストリームは直線状チャンネル32沿いであり、ビーズ(15μm)34を直線状チャンネル32の狭窄領域33に捕捉し、アレイ状に配置することができた。
【0049】
なお、体積流量比Q1 /Q2 が0.76で設計されたマイクロ液滴の捕捉装置中に捕捉しようと試みたが、体積流量比Q1 /Q2 が1より小さく、結果的に、メインストリームはループチャンネル(方形波チャンネル)沿いであり、捕捉することはできなかった。
図10は本発明の実施例を示す捕捉されたビーズの解放(リリース)装置(その1)を示す図であり、図10(a)はそのビーズの捕捉した状態を示す図、図10(b)はその捕捉されたビーズを解放する状態を示す図である。
【0050】
図10(a)に示すように、直線状チャンネル41の狭窄領域42の終端部にアルミニウム43がパターニングされており、その狭窄領域42にビーズ44が捕捉されている。そこで、図10(b)に示すように、その狭窄領域42の終端部のアルミニウム43にレーザー(例えば、出力1.5W)45を照射する。すると、その狭窄領域42の終端部に泡46が生成されて、狭窄領域42に捕捉されていたビーズ44を狭窄領域42から解放することができる。
【0051】
なお、上記実施例では、パターニングされたアルミニウム43にレーザー45を照射するようにしたが、狭窄領域の終端部をターゲットとしてそのターゲットとなる基板をレーザーで照射することにより泡46を発生させることができればよい。
このように、レーザーを用いた狭窄領域の終端部の加熱により泡を発生させることによって、一度捕捉したビーズを解放する。つまり、一旦捕捉したビーズの並べ換えを自在に行うことができる。
【0052】
また、マイクロシステムにおいてビーズ及びセルを分類するために誘電泳動を用いるようにしたもの(上記非特許文献10参照)が提案されている。
図11は本発明の実施例を示す捕捉されたビーズの解放装置(その2)の動作を示す図、図12はそのビーズの解放装置とその動作を示す図であり、図12(a)はビーズ(セル)が捕捉された状態を、図12(b)は試薬の吹き込み状態を、図12(c)はビーズ(セル)が選択された状態を、図12(d)は電極への電位の印加状態を、図12(e)はビーズ(セル)が解放された状態を示す図である。
【0053】
図11に示すように、第1電極51は直角三角形状をなし、斜辺52,水平辺53及び垂直辺54を有している。一方、第2電極55も直角三角形状をなし、斜辺56,水平辺57及び垂直辺58を有している。これらの第1電極51の斜辺52と第2電極55の垂直辺58とは対向している。
そこで、図11(a)に示すように、第1電極51に+電位が、第2電極55に−電位が印加されると、第1電極51の斜辺52と水平辺53が交わった下部先端部59は尖っており、一方、第2電極55の垂直辺58は平坦となっているので、第1電極51と第2電極55との間には不平等電界が生成される。つまり、下部先端部59には傾斜度の大きい電界が生成され、第2電極55の垂直辺58には傾斜度の小さい電界が生成される。このように第1電極51と第2電極55との間には不平等電界が生成されるので、図11(b)に示すように、下部先端部59の近傍にビーズ(セル)60が配置される場合には、矢印のように誘電泳動力61Aが働くことになり、ビーズ(セル)60は傾斜度の大きい電界が生じている下部先端部59から傾斜度の小さい電界が生じている第2電極55の垂直辺58へと吸引されることになる。
【0054】
このような誘電泳動力を生じさせる手段を、上記したビーズ(セル)の捕捉装置において、捕捉状態から解放するために用いることができる。
以下、具体的に説明する。
まず、図12(a)に示すように、マイクロビーズの捕捉アレイ装置でビーズ(セル)65を捕捉する。その捕捉アレイ装置には、上記した第1電極と第2電極からなる電極64が直線状チャンネル61の狭窄領域63に配置されている。
【0055】
次に、図12(b)に示すように、試薬66がビーズ(セル)65の捕捉アレイ装置へ導入され、ビーズ(セル)65の試薬66に対する反応が観察される。
次に、図12(c)に示すように、解放したい所望のビーズ(セル)65′がある場合は、そのビーズ(セル)65′を解放するために電極64′を選択して電極64′へ任意の電圧を印加する。
【0056】
次に、図12(d)に示すように、電極64′への電圧の印加により、電極64′間には不平等電界が生成されるので、ビーズ(セル)65′は誘電泳動力により直線状チャンネル61の狭窄領域63から解放される。
次に、図12(e)に示すように、解放されたビーズ(セル)65′はメインストリーム67に乗り、方形波形状のチャンネル62を流れていくことになる。
【0057】
その解放されたビーズ(セル)65′は、この捕捉アレイ装置から運ばれ、更なる分析のために収集される。誘電泳動力を生じさせるための電位は5−15Vである。
なお、本発明は上記実施例に限定されるものではなく、本発明の趣旨に基づき種々の変形が可能であり、これらを本発明の範囲から排除するものではない。
【産業上の利用可能性】
【0058】
本発明のマイクロビーズの捕捉方法及びその配列装置は、再生医工学、細胞研究、創薬などに有効利用できる。
【符号の説明】
【0059】
1 第1のマイクロチャンネル
2 油(連続相)
3 第2のマイクロチャンネル
4 CaCO3 粉末を含むアルギン酸ナトリウム溶液(分散相)
5 T字交差路
6 CaCO3 粉末を含むアルギン酸ナトリウムからなる液滴
7 第3のマイクロチャンネル
8 レシチン及び酢酸を含む油
9 二路合流チャンバー
10 二路合流チャンバーにて形成されるマイクロビーズ(μ液滴)
11 混合及び反応チャンネル
12 ゲル化が進んだマイクロビーズ(μ液滴)
15 Hep G2セル
16,21 マイクロビーズ(μ液滴)
22,32,41,61 直線状チャンネル
23,62 方形波形状のチャンネル
24,33,42,63 直線状チャンネルに形成される狭窄領域
31 マイクロ液滴の装置
34 ビーズ(15μm)
43 アルミニウム
44 ビーズ
45 レーザー
46 泡
51 第1電極
52,56 斜辺
53,57 水平辺
54,58 垂直辺
55 第2電極
59 下部先端部
60,65 ビーズ(セル)
61A 誘電泳動力
64 第1電極と第2電極からなる電極
64′ 電圧を印加したい電極
65′ 解放したい所望のビーズ(セル)
66 試薬
67 メインストリーム
【特許請求の範囲】
【請求項1】
マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、該空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させることを特徴とするマイクロビーズの配列方法。
【請求項2】
請求項1に記載のマイクロビーズの配列方法によって配列された前記マイクロビーズが位置する狭窄領域の終端部を加熱することにより、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列方法。
【請求項3】
請求項1に記載のマイクロビーズの配列方法によって配列されたマイクロビーズが位置する狭窄領域の終端部に誘電泳動力を作用させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列方法。
【請求項4】
(a)マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと、
(b)該直線状チャンネルと順次交差する方形波形状のチャンネルと、
(c)前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、該空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、該狭窄領域をバイパスして前記マイクロビーズを下流に移動させるマイクロビーズ移動手段を具備することを特徴とするマイクロビーズの配列装置。
【請求項5】
請求項4記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部を加熱手段により加熱することで泡を生成させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列装置。
【請求項6】
請求項5記載のマイクロビーズの配列装置において、前記加熱手段はターゲットへレーザー光を照射するレーザーであることを特徴とするマイクロビーズの配列装置。
【請求項7】
請求項4記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部に誘電泳動手段を設けて、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列装置。
【請求項8】
請求項4〜7の何れか一項記載のマイクロビーズの配列装置において、前記狭窄領域を水平方向に複数個配置し、前記マイクロビーズをチップ上にアレイ化して配置することを特徴とするマイクロビーズの配列装置。
【請求項1】
マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと該直線状チャンネルと順次交差する方形波形状のチャンネルとを配置し、前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、該空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、前記狭窄領域をバイパスして前記マイクロビーズを下流に移動させることを特徴とするマイクロビーズの配列方法。
【請求項2】
請求項1に記載のマイクロビーズの配列方法によって配列された前記マイクロビーズが位置する狭窄領域の終端部を加熱することにより、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列方法。
【請求項3】
請求項1に記載のマイクロビーズの配列方法によって配列されたマイクロビーズが位置する狭窄領域の終端部に誘電泳動力を作用させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列方法。
【請求項4】
(a)マイクロビーズが流されるとともに、狭窄領域を有する直線状チャンネルと、
(b)該直線状チャンネルと順次交差する方形波形状のチャンネルと、
(c)前記マイクロビーズが捕捉されていない空の狭窄領域がある場合は、該空の狭窄領域で前記マイクロビーズを捕捉し、前記マイクロビーズが捕捉されている狭窄領域がある場合は、該狭窄領域をバイパスして前記マイクロビーズを下流に移動させるマイクロビーズ移動手段を具備することを特徴とするマイクロビーズの配列装置。
【請求項5】
請求項4記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部を加熱手段により加熱することで泡を生成させ、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列装置。
【請求項6】
請求項5記載のマイクロビーズの配列装置において、前記加熱手段はターゲットへレーザー光を照射するレーザーであることを特徴とするマイクロビーズの配列装置。
【請求項7】
請求項4記載のマイクロビーズの配列装置において、前記マイクロビーズが位置する狭窄領域の終端部に誘電泳動手段を設けて、前記マイクロビーズを前記狭窄領域から解放することを特徴とするマイクロビーズの配列装置。
【請求項8】
請求項4〜7の何れか一項記載のマイクロビーズの配列装置において、前記狭窄領域を水平方向に複数個配置し、前記マイクロビーズをチップ上にアレイ化して配置することを特徴とするマイクロビーズの配列装置。
【図3】


【図7】


【図8】


【図1】


【図2】


【図4】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】




【図7】


【図8】


【図1】


【図2】


【図4】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−81471(P2012−81471A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2011−285190(P2011−285190)
【出願日】平成23年12月27日(2011.12.27)
【分割の表示】特願2006−5923(P2006−5923)の分割
【原出願日】平成18年1月13日(2006.1.13)
【出願人】(801000049)財団法人生産技術研究奨励会 (72)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成23年12月27日(2011.12.27)
【分割の表示】特願2006−5923(P2006−5923)の分割
【原出願日】平成18年1月13日(2006.1.13)
【出願人】(801000049)財団法人生産技術研究奨励会 (72)
【Fターム(参考)】
[ Back to top ]

