マイクロフルイディックシステム
【課題】マイクロフルイディック技術を提供すること。
【解決手段】本発明は、マイクロフルイディック技術を提供し、フェムトリッターからマイクロリッターまでの尺度での反応に対する迅速かつ経済的な操作可能にする。本発明は、非常に多くの数の反応、例えば結晶化またはアッセイを平行して行い、迅速かつ経済的な反応を可能にする方法を提供する。本発明は、タンパク質、生体分子、生体分子と束縛リガンドとの錯体などの結晶化に特に良く適している。本発明は、結晶の回折の質に関する直接的なテストを可能にする。本発明はまた、コンビナトリアルケミストリの分野に適用可能であり得、反応速度および反応生成物の両方のモニタリングを可能にする。
【解決手段】本発明は、マイクロフルイディック技術を提供し、フェムトリッターからマイクロリッターまでの尺度での反応に対する迅速かつ経済的な操作可能にする。本発明は、非常に多くの数の反応、例えば結晶化またはアッセイを平行して行い、迅速かつ経済的な反応を可能にする方法を提供する。本発明は、タンパク質、生体分子、生体分子と束縛リガンドとの錯体などの結晶化に特に良く適している。本発明は、結晶の回折の質に関する直接的なテストを可能にする。本発明はまた、コンビナトリアルケミストリの分野に適用可能であり得、反応速度および反応生成物の両方のモニタリングを可能にする。
【発明の詳細な説明】
【技術分野】
【0001】
(連邦政府後援の研究開発)
本研究は、NIH(R01 EB001903)によってサポートされた。さらに、本研究の一部は、NSFによって資金を提供されたMRSECマイクロフルイディック機関において行われた。米国政府は本出願において一定の権利を有し得る。
【0002】
(技術分野)
本発明は、マイクロフルイディック(微細流体)の分野に関する。本発明は、マイクロフルイディック技術を提供し、フェムトリッター未満からミリリッターまでの尺度での反応の迅速かつ経済的な操作を可能にする。
【背景技術】
【0003】
(発明の背景)
最少量の試剤を使用して非常に多くの反応を行う能力が所望される。ロボット、マイクロフルイディック、96−ウェルプレートにおけるコンビナトリアルケミストリなどを含み、この目的に対する様々な解決策が提案されてきた。様々な反応に対するこれらの方法のアプリケーションが提案されてきた。
【0004】
例えば、膜タンパク質は、人間の健康にとって重要である多くの細胞学的および生理学的プロセスにおいて、重要な役割を果たしている。膜タンパク質の構造の決定は、膜タンパク質の機能の理解における重要なステップである。X線結晶化は、膜タンパク質の構造の決定に対する強力なツールである。膜タンパク質に対する結晶化の状態は、非常に多くの数のスクリーニング実験によって決定される。膜タンパク質は、多くの場合に生成することが困難であり、従って、結晶化スクリーンの小型化が、構造研究を加速するために不可欠である。膜タンパク質の結晶は、多くの場合に壊れやすく、処理によって損傷され得るので、結晶の回折の質の直接的なインサイチュでのテストを可能にする技術が必要とされる。ナノリッター量の膜タンパク質溶液の処理は、粘度が高く表面張力が低いために困難である。
【0005】
特許文献1は、タンパク質結晶化のハイスループットスクリーニングに関するマイクロフルイディック構造の使用を記述する。一実施形態において、統合された組み合わせ混合チップは、試剤の正確な測定が、チップ上で観察された可能な結晶形成を用いて、非常の多くのタンパク質結晶化状態を急速に作成することを可能にする。代替的な実施形態において、マイクロフルイディック構造が利用され得ることにより、特定のタンパク質と結晶化試剤との組み合わせの位相空間を調査し、それにより、有望な状態を識別し、続く集中的な試みが結晶の成長を取得することを可能にする。残念ながら、このシステムは動作するためには費用がかかり;組み合わせ混合チップは、従来の結晶化プレートよりも明らかに高価であり;組み合わせ混合チップは、水および気体に対して透過性があり、有機溶媒に対して適合性がない。従って、膜タンパク質の迅速かつ経済的な結晶化に対するニーズが存在する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第04/104228号パンフレット
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、非常に多くの数の反応、例えば結晶化またはアッセイを平行して行い、迅速かつ経済的な反応を可能にする方法を提供する。
【0008】
本発明は、タンパク質、生体分子、生体分子と束縛リガンドとの錯体などの結晶化に特に良く適している。本発明は、結晶の回折の質に関する直接的なテストを可能にする。本発明はまた、コンビナトリアルケミストリの分野に適用可能であり得、反応速度および反応生成物の両方のモニタリングを可能にする。
【0009】
本発明は以下の魅力的な特徴のうちの1つ以上を有する:(1)方法は、大規模に実現可能である−スクリーンにおいて使用される試剤の数を増加させることが、さらに複雑な構成を必要とせず、より長い収容構成要素のみを必要とする。(2)一部の実施形態において、方法は、三相流におけるスペーサの使用を含む。例えば、フッ化搬送流体の使用は、プラグの保護および表面の化学性質の制御を提供し得、気泡の使用は、水溶性のプラグが融合することを防止し得る。(3)アレイは、シリンジを使用する単純な方法からロボット工学までの様々な方法によって事前に製作され得る。キャピラリー内の事前に製作されたプラグのアレイは、数ヶ月間、格納され得、滅菌され得るか、または不活性環境の下で準備され得、可能なアプリケーションの範囲を拡大する。(4)方法は、エンドユーザにとって非常に単純である−複数の流れを駆動して組み合わせる一定の流れの源を除いて、高性能な機器はユーザ側に必要とされない。全体として、本方法は試剤が格納され、単純で信頼の置けるフォーマット、例えば診断および感知で使用されなければならないアプリケーションにとって魅力的である。さらに、本方法は、化学および生化学における広い範囲のアプリケーションを見出し得、96−、384−、および1536−ウェルプレートにおける試剤が格納されるか、または分配される最新の方法、例えば、コンビナトリアルケミストリ、タンパク質結晶化、および生化学的アッセイを促進し、かつ、小型化する。
本発明は、例えば、以下を提供する。
(項目1)
少なくとも1つのマイクロチャンネルを備えている装填構成要素であって、該装填構成要素は、プラグのアレイを形成することに適し、各プラグはプラグ流体を備え、各プラグは、該プラグ流体と非混和性である搬送流体および/またはスペーサによって、別のプラグから分離されている、装填構成要素と、
少なくとも1つのマイクロチャンネルを備えている少なくとも1つの着脱式の保持構成要素であって、該マイクロチャンネルは、該保持構成要素に流体接続するように構成されている、保持構成要素と
を備え、
該保持構成要素は、該プラグのアレイで装填され、該装填構成要素から取り外される際、プラグは直ちに融合または混合しない、マイクロフルイディックデバイス。
(項目2)
上記保持構成要素は、キャピラリー管である、項目1に記載のマイクロフルイディックデバイス。
(項目3)
上記保持構成要素は、パイプの一部分である、項目1に記載のマイクロフルイディックデバイス。
(項目4)
上記保持構成要素は、チップである、項目1に記載のマイクロフルイディックデバイス。
(項目5)
上記保持構成要素または上記装填構成要素のうちの一方はメス端を有し、他方はオス端を有する、項目1、項目2、項目3、または項目4に記載のマイクロフルイディックデバイス。
(項目6)
少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備えている保持構成要素であって、該少なくとも1つのオープンエンドは、別のマイクロチャンネルに流体接続するように構成されている、保持構成要素と、
該保持構成の該第1のマイクロチャンネル内に置かれているプラグ流体のプラグの1つ以上の線形のアレイと
を備え、
各プラグは搬送流体および/またはスペーサのいずれかによって別のプラグから分離され、
該搬送流体および該スペーサは、該プラグ流体におよび互いに非混和性であり、
該マイクロチャンネルは、該搬送流体によって湿潤される、キット。
(項目7)
キャピラリー管である、項目6に記載のキット。
(項目8)
1mmを下回る直径を有するパイプである、項目6に記載のキット。
(項目9)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および1つ以上の試剤を備え、該各プラグは、同じ試剤の異なった濃度または複数の試剤の異なった濃度を備えている、項目6、項目7、または項目8に記載のキット。
(項目10)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え、該線形のアレイ内の2つのプラグは、異なる試剤を備えている、項目6、項目7、または項目8に記載のキット。
(項目11)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え、該線形のアレイは、ケミカルスペースの領域をスパンする特性を有する物質を含んでいる、項目6、項目7、または項目8に記載のキット。
(項目12)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および1つ以上の試剤を備え、該線形のアレイは、結晶化スクリーンを行うことに適している、項目6、項目7、または8項目に記載のキット。
(項目13)
上記線形のアレイ内の1つ毎のプラグは、少なくとも1つの溶媒および試剤を備え、残りのプラグは、少なくとも1つの溶媒および少なくとも1つの標識を備えている、項目6、項目7、または項目8に記載のキット。
(項目14)
上記流体プラグの線形のアレイは、少なくとも2つの流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目15)
上記流体プラグの線形のアレイは、少なくとも10個の流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目16)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1000個の流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目17)
上記流体プラグの線形のアレイ内の各プラグは、約0.001fL〜10mLのプラグ流体を備えている、項目6から項目16のいずれかに記載のキット。
(項目18)
上記流体プラグの線形のアレイ内の各プラグは、約10M未満の試剤を備えている、項目6から項目16のいずれかに記載のキット。
(項目19)
上記各プラグは、上記搬送流体によって分離されている、項目6から項目18のいずれかに記載のキット。
(項目20)
上記線形のアレイ内の少なくとも2つのプラグは、上記スペーサによって分離されている、項目6から項目18のいずれかに記載のキット。
(項目21)
上記スペーサは、液体、気体、ゲルまたは固体である、項目6から項目20のいずれかに記載のキット。
(項目22)
上記スペーサは、液体または気体である、項目6から項目21のいずれかに記載のキット。
(項目23)
入口および出口を有する第1のマイクロチャンネルと、
試剤の入口および1つ以上の送達チャンネルを有し、該第1のマイクロチャンネルに流体連通する第2のマイクロチャンネルであって、該送達チャンネルは実質的に同じ流体抵抗を有する、第2のマイクロチャンネルと
を備えている組み合わせ構成要素。
(項目24)
上記入口は、保持構成要素に流体接続するように構成されている、項目23に記載の組み合わせ構成要素。
(項目25)
上記出口は、収容構成要素に流体接続するように構成されている、項目23または項目24に記載の組み合わせ構成要素。
(項目26)
フッ素含有の分子を備えている少なくとも1つの搬送流体と、
搬送流体によって分離されているプラグ流体の1つ以上のプラグであって、該プラグ流体は、該搬送流体に非混和性である、プラグと、
該プラグ流体内で実質的に不溶性であり、かつ、該搬送流体内で可溶性である界面活性剤と
を備えている、マイクロフルイディックシステム。
(項目27)
少なくとも1つのマイクロチャンネルを備えている保持構成要素であって、該保持構成要素は、プラグ流体のプラグを備えているプラグのアレイを格納および輸送することに適し、該プラグは、該プラグ流体と非混和性である搬送流体によって互いに分離されている、保持構成要素と、
(a)入口および出口を有する第1のマイクロチャンネルと、(b)試剤の入口および1つ以上の送達チャンネルを有し、該第1のマイクロチャンネルに流体連通する第2のマイクロチャンネルとを備えている組み合わせ構成要素であって、該送達チャンネルは、実質的に同じ流体抵抗を有する、組み合わせ構成要素と
を備え、
該保持構成要素は、該組み合わせ構成要素から着脱可能である、マイクロフルイディックシステム。
(項目28)
少なくとも1つのマイクロチャンネルを備えている装填構成要素をさらに備え、該装填構成要素は、上記アレイの形成に適している、項目27に記載のマイクロフルイディックシステム。
(項目29)
1つ以上のマイクロチャンネルを備えている収容構成要素をさらに備え、該収容構成要素は、上記アレイを操作することに適している、項目27または項目28に記載のマイクロフルイディックシステム。
(項目30)
(a)第1のプラグ流体のプラグの線形のアレイをマイクロフルイディック装置内の第1のマイクロチャンネルの中に第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該搬送流体および該スペーサは、プラグ流体および互いに非混和性である、ことと、
(b)第2のプラグ流体の流れをマイクロフルイディック装置内の第2のマイクロチャンネルの中に第2の流量で導入することであって、該第1のマイクロチャンネルと該第2のマイクロチャンネルとは互いに流体連通する、ことと、
(c)該第1のプラグ流体の少なくとも1つのプラグを少なくとも一部の該第2の流体プラグに融合し、融合されたプラグを形成することであって、該融合は該第1のマイクロチャンネルと該第2のマイクロチャンネルとの1つ以上の合流地点において生じる、ことと
を包含する、方法。
(項目31)
(d)上記融合されたプラグをモニタリングすることをさらに包含する、項目30に記載の方法。
(項目32)
上記第1のプラグ流体のプラグの線形のアレイは、保持構成要素を取り付けることによって上記第1のマイクロチャンネルの中に導入され、該保持構成要素は、
2つのオープンエンドを有する第3のマイクロチャンネルであって、少なくとも1つのオープンエンドは、上記装置内の上記第1のマイクロチャンネルに流体連通するように構成されている、第3のマイクロチャンネルと、
該第1のプラグ流体のプラグの線形のアレイと
を備えている、項目30または項目31に記載の方法。
(項目33)
上記第2のマイクロチャンネルは、上記第1のマイクロチャンネルに交差する複数の送達チャンネルに分裂される、項目30、項目31、または項目32に記載の方法。
(項目34)
試剤、搬送流体、およびプラグ流体の一覧表をオファーするステップと、
所望の試剤のサブセット、搬送流体およびプラグ流体を顧客から収容するステップと、
該搬送流体および/またはスペーサを用いて互いから分離されている該プラグ流体のプラグのアレイを含む保持構成要素を該顧客に送達するステップであって、該搬送流体および該スペーサは、プラグ流体および互いに非混和性であり、各プラグは所望の試剤のサブセットの要素を含んでいる、ステップと
包含する、方法。
(項目35)
所望の試剤のサブセットに対する値段を計算するステップをさらに備えている、項目34に記載の方法。
(項目36)
少なくとも1つのオープンエンドを有する収容マイクロチャンネルを備えている収容構成要素であって、該オープンエンドは、別のマイクロチャンネルと流体連通するように、かつ、プラグ流体の線形のアレイを収容するように構成されている、収容構成要素と、
第1のマイクロチャンネル内の流体プラグの位置を識別する測定装置と
を備えている、キット。
(項目37)
(a)入口および出口を有する第1のマイクロチャンネルと(b)試剤の入口と、該第1のマイクロチャンネルと流体連通する1つ以上の送達チャンネルとを有する第2のマイクロチャンネルとを備えている組み合わせ構成要素であって、該送達チャンネルは実質的に同じ流体抵抗を有する、組み合わせ構成要素と、
ポンプと
を備えている、キット。
(項目38)
上記第2のマイクロチャンネルの上記試剤の入口に流体連通するように構成されている貯水溝をさらに備えている、項目37に記載のキット。
(項目39)
少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備えている収容構成要素であって、該オープンエンドは、別のマイクロチャンネルに流体連通するように構成され、該第1のマイクロチャンネルは、該マイクロチャンネル内のプラグの位置を識別する1つ以上の物理標識を含む、収容構成要素。
【図面の簡単な説明】
【0010】
【図1】図1は、再利用可能なマイクロフルイディックシステムの設計の概略図である。搬送流体6内のプラグ9は、(a)マイクロフルイディック装置内のマイクロチャンネルからキャピラリー3、または(b)結合器2を介してキャピラリーからマイクロフルイディック装置上のマイクロチャンネルのいずれかに輸送され得る。
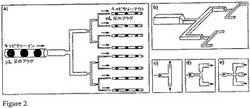
【図2】図2は、プラグを含んでいる大量生産の保持構成要素である。a)装置の概略図。搬送流体によって分離された一連の異なるプラグを含む大きいチャンネルは、分裂した構成要素に送られる。各合流地点は、各プラグを2つの別個のプラグに分裂させる。3回の反復の後に、8個の小さい保持構成要素はそれぞれ、同一の一連のプラグで満たされる。b)分裂したチャンネルの立体図。全ての反復が共通の平面上にあるので、連続する層が多層フォトリソグラフィを用いて確立された。c)単純なT字型合流地点。d)狭められた合流地点。e)複数の出口を有する合流地点。
【図3】図3は、プラグのアレイ7のタンパク質プラグの別のアレイ13との融合の概略図である。タンパク質の結晶化に対するこの概念のアプリケーションが、以下で記述される。同じ原理が反応、アッセイ、および分析に適用され得る。例えば、様々な反応物のセットは、プラグのアレイ内に配置され、次に、サンプルを含んだ流れに融合され得る。
【図4】図4は、複数の分裂したマイクロチャンネルとの融合である。a)マイクロチャンネルの立体断面図が、分裂されたチャンネルを通って流される流れに融合するプラグを示す。b)単一の送達チャンネル起源の複数の水溶液の流れが、赤い無機色素に融合しているマイクロ写真である。c)(タンパク質を含んだ流れによって図示された)流れのプラグのアレイとの融合である。
【図5】図5は、2つのプラグを接触させる方法の概略図である。a)プラグ流体によるチャンネルの湿潤が防止されるチャンネル内のプラグである。b)プラグ流体によるチャンネルの湿潤が可能にされるチャンネル内のプラグである。c)流れが確立され、プラグ流体によるチャンネルの湿潤が防止されるチャンネル内のプラグである。d)チャンネル内で流れず、プラグ流体によるチャンネルの湿潤が可能とされるプラグである。e)最初に湿潤を防止する光スイッチ可能な単分子層を有するチャンネル内のプラグである。f)光スイッチ可能な単分子層が特定の波長の光で作動された後のチャンネル内のプラグである。g)保持構成要素の内側にある水溶性のプラグである。h)力が加えられることにより、対称性が破壊され、2つのプラグ間の液体架橋が形成される。該力は、磁力、電力、光学力、または(例えば、遠心分離における)加速力などであり得る。力は、実験の型に従って、搬送流体、結晶化溶液、またはその両方に対して行使され得る。好適には、力は、保持構成要素の部分に垂直に加えられる。磁力が使用される場合には、好適には、搬送流体とプラグ流体とは、異なる磁気特性を有する。遠心力が使用される場合には、好適には、搬送流体とプラグ流体とは、異なる密度を有し、水溶性のプラグ流体とフッ化搬送流体とが使用されるときも同様である。
【図6】図6は、a)キャピラリー内の4つの異なる試剤のプラグのアレイである。プラグは、左から右にKMnO4、NaCl、CuSO4、Fe(SCN)3を含む。搬送流体は、界面活性剤を有するフルオロカーボンである。b、c)フルオロカーボン内で形成され、キャピラリー内で気泡(濃色)によって分離された異なる試剤のプラグのアレイである。b)において、水溶性のプラグは、フルオロカーボンのスペーサによって気泡から分離され、プラグ間の交差連通を防止する。スケールバーは200μmである。
【図7】図7は、プラグ間の距離を制御、一部の事例においてはプラグを融合するためのマイクロフルイディックのセットアップの概略図である。搬送流体は側面の小さい分岐チャンネルを通じて排出される。(a)プラグ間の間隔は結果的に減少する。(b)搬送流体は、完全に取り除かれ、プラグの内容の全ては、プラグ流体の流れの中に融合される。
【図8】図8は、a)タンパク質の結晶化のためのPDMS−ガラスの複合システムである。b)キャピラリー内のプラグの内側で成長および回折され、1.8Åを上回る解像度(1.8Åにおいて、I/σ(I)z=4.7)を有する構造をもたらすタウマチン結晶(左側)のシンクロトロン回折画像(右側)である。
【図9】図9は、膜タンパク質FAAHの結晶化である。プラグベースのマイクロフルイディックが使用され得ることにより、膜タンパク質を結晶化し、少量のサンプルを用いた多くの結晶化試験を行う。a)10セント硬貨の回りに巻かれた1メートルのテフロン(登録商標)キャピラリーのマイクロ写真である。該キャピラリーは、〜1,000ナノリッターサイズのプラグを含む。10μLほどの膜タンパク質溶液が、1000回の結晶化試験をセットアップするために必要とされる。b)キャピラリー内のプラグを示すa)のマイクロ写真の拡大された部分である。c)プラグ内で成長した膜タンパク質(FAAH)の結晶の2つのマイクロ写真である。
【図10】図10は、本発明のマイクロフルイディックシステムの一実施形態を示す流れ図である。装填構成要素は、第1の試剤のセットを含んだプラグの線形のアレイを準備する。装填構成要素は、保持構成要素に取付け可能であり、その結果、アレイは流体の流れを用いて移送され得る。保持構成要素は、組み合わせ構成要素に取付け可能であり得、その結果、第2の試剤または試剤のセットは、アレイ内のプラグの中に導入され得る。アレイは、さらなる操作のために、収容構成要素に移動され得る。
【図11】図11は、単一のタンパク質の基質8に対する異なる酵素を含んだ複数のプラグのアッセイの概略図である。酵素22を含んだ各プラグは、搬送流体、スペーサ21、および少なくとも1つの洗浄剤のプラグ23によって、異なる酵素を有する別のプラグから分離される。
【図12】図12は、プラグ9を流れ8に融合し、二次汚染なく融合されたプラグ10を作成するための可能な形状の概略図である。短く狭い側面のチャンネルが使用され得ることにより、搬送流体6が多量の融合している流れ8をスナッピングオフ(snapping off)することを助ける。台形状の拡がりの程度が、融合される流体の量を定義するために使用され得る。台形状の拡張以外の他の形状が使用され得ることにより、能力を最適化する。太い線で示された主チャンネルは、より細い線で示された他のチャンネルよりもz軸において大きい。
【図13】図13は、PDMS内の単純なT字型の合流地点がテフロン(登録商標)キャピラリーと嵌合されている図である。PDMSチップは、マイクロフルイディックチャンネルを有するPDMSの一部分をPDMSの別の平坦な部分に密閉することによって、通常、製作される。密閉に先立って、テフロン(登録商標)キャピラリーがチャンネル内に置かれる。次に、テフロン(登録商標)キャピラリーと正方形のマイクロフルイディックチャンネルとの間の間隔は、硬化されていないPDMS混合物で満たされ、硬化される。その結果の合流地点が使用され得ることにより、事前に形成されたプラグのアレイを別の流れに融合するか、またはプラグを形成する。フッ化搬送流体は、テフロン(登録商標)面を優先的に湿潤するので、テフロン(登録商標)キャピラリーは、使用に先立つ表面処置を必要としない。a)は、別の流れ(チャンネルa)に融合する事前に形成されたプラグのアレイ(チャンネルb)を示す。b)は、プラグを形成するために、水溶性の流れは、チャンネルaを通ってポンプ注入され得、搬送流体は、チャンネルbを通ってポンプ注入されるということを示す。合流地点において、水溶性の液滴またはプラグは自然に形成し、テフロン(登録商標)キャピラリーを通って輸送される。これは水溶性の洗浄剤溶液に対して特に有益であり、さもなければ、水溶性の洗浄溶液はプラグを形成することが可能となり得ない。
【図14】図14は、膜タンパク質の結晶化実験に対して使用されるテフロン(登録商標)キャピラリーとPDMSとの複合装置のa)概略図およびb)マイクロ写真である。膜タンパク質および沈殿剤を含んだプラグは、パーフルオロトリアリキルアミンから成る非混和性の搬送流体の流れ内で形成された。使用される膜タンパク質は、脂肪酸アミドヒドロラーゼの非晶質ポリオフィレンの形式であり、搬送流体は、パーフルオロ化合物FC−70であり、沈殿剤は、24%のPEG 4000、0.20MのLiSO4、0.40MのNaCl、0.10MのTris pH=8.2であった。流量は、以下の通りであった:搬送流体−1μL/min;タンパク質−0.5μL/min;各沈殿剤の流れ−0.25μL/min。
【図15】図15は、パイプまたはキャピラリーがまた使用され得ることにより、いくつかのチップ24を接続する図である。例えば、プラグ9は、1つの装置上で流れ8と共に形成またはそれに融合され得、パイプおよび/またはキャピラリーを通って別のチップ24に移送され得る。1つの装置に接続するための挿入されたキャピラリー3の使用、および別の装置に接続するための漏斗状のアダプタ2の使用が図に示されている。様々な接続方法が、任意の組み合わせで使用され得る。
【図16】図16は、パイプ25とチップ24との間の接続が、チップ平面から外れ得る図である。パイプは、マイクロフルイディックチップ上の穴を通じてチップに接続され得る。事前に形成されたプラグのアレイは、さらなる操作のためにマイクロフルイディックチップに輸送され得る。
【図17】図17は、(a)プラグ9の2つのアレイが保持構成要素内に格納され得る図である。(b)において示されるように、プラグの2つのアレイが融合され得るように、保持構成要素は構成され得る。次に、融合されたプラグ10は、さらなる反応のために組み合わせ構成要素に移送され得る。
【図18】図18は、(a)プラグ9と流れ8とのアレイがまた保持構成要素内に格納され得る図である。融合されたプラグ10は、さらなる反応のために組み合わせ構成要素に移送される前に形成され得る。
【発明を実施するための形態】
【0011】
(発明の詳細な説明)
本発明は、少量の溶液のプラグを基盤とするマイクロフルイディック操作のためのシステムを提供する。該システムの特定の実施形態は、装填構成要素、保持構成要素、組み合せ構成要素、および収容構成要素を備えている。図10は、本発明のシステムの一実施形態を図示している。様々な構成要素が単一のシステムに統合され得るか、または構成要素のうちの1つ以上は、マイクロフルイディックシステムから着脱可能であり得る。例えば、各構成要素は別々に着脱可能であり、したがって、保持構成要素は、装填構成要素および組み合せ構成要素の両方に装着可能であるスタンドアロンの構成要素であり得る。別の例において、収容構成要素は、組み合せ構成要素と統合され得る。
【0012】
本開示を通して、本発明の使用は、タンパク質の結晶化へのアプリケーションにより例示される。本発明は、他の反応に等しく適用可能であるということを理解されたい。
【0013】
溶液のプラグを基盤とするマイクロフルイディック操作は、以前に本発明者によって、米国特許出願第10/434,970号および米国特許出願第10/765,718号において開示され、該出願は、本明細書において、その全体が参照により援用される。
【0014】
(装填構成要素)
装填構成要素は、少なくとも1つのマイクロチャンネルを備え、該チャンネルは、流体プラグを備えたアレイを形成することに適し、該プラグは、搬送流体と、保持構成要素と流体接続し得るように構成された少なくとも1つの出口とによって互いに分離されている。
【0015】
装填構成要素は、所望の搬送流体または複数の流体によって分離されたプラグの所望のアレイで、保持構成要素を満たすことの可能である任意の装置であり得る。そのプロセスは、例えば、手動で動作されるピペットまたは注射器を用いて、あるいはピペッティングロボットの使用を通じて手動で実行され得る。代替的に、装填構成要素は、少なくとも1つのチャンネル、および収容構成要素と流体接続し得るように構成された少なくとも1つの出口を有するマイクロフルイディック装置であり得る。装填構成要素は、Laura Lane、The Scientist、2004年1月19日、Volume 18、Issue 1(34)によって記述されたタイプの装置をも基盤とし得、該装置は、少量の変化溶液を準備することが可能である。そのような装置は、例えば、Syrrxによって製造されたAgincourtTM system、Gilson’s 925 PC Workstaiton、deCODE’s MatrixMakerTM、Matrix Technologies’s Hydra(登録商標)Plus−One System、およびthe Fluidigm TopazTM Crystallizerを含む。装填構成要素は、保持構成要素の端を密閉または蓋をするための統合手段を有することか、または有さないことがあり得る。
【0016】
(保持構成要)
保持構成要素は、プラグの少なくとも1つの線形のアレイを格納および輸送することに有益である。
【0017】
着脱式保持構成要素は、装填構成要素と流体接続し得るように構成された少なくとも1つのマイクロチャンネルを有する。保持構成要素が装填構成要素から外されたときには、流体プラグは、一般的には、すぐに融合または混合されない。着脱式保持構成要素は、事前形成されたカートリッジであり得、該カートリッジは、市販の独立したアイテムとして販売され得る。用語「保持構成要素」および「事前形成されたカートリッジ」は、本出願において相互置換可能に使用され得る。保持構成要素材料の例は、限定するわけではないが、PDMS、ガラス管(例えばキャピラリー)、パイプ(例えば、Teflonパイプ、またはポリイミドパイプ)、および合成管(例えば、ポリイミドでコーティングされたガラスキャピラリー、またはガラスキャピラリーの内側のTeflonパイプ)を含む。保持構成要素のマイクロチャンネルは、装填構成要素、組み合せ構成要素または収容構成要素のマイクロチャンネルと似たサイズまたは異なるサイズの内径を有し得る。保持構成要素は、らせん状またはシリンダ状に曲げられ得、スプールを用いて、または用いずに輸送され、処理を容易にする。本出願の目的のために、そのような構成のプラグは、「線形のアレイ」に配置されることがさらに考えられる。
【0018】
本発明の一実施形態は、プラグの少なくとも1つの線形のアレイを有する保持構成要素を含むキットである。キット内の保持構成要素は、プラグの1つよりも多いアレイを有し得る。例えば、プラグの2つのアレイが保持構成要素内に格納され得る。保持構成要素は、プラグの2つのアレイが融合され得るように構成され得る。次に、融合されたプラグは、さらなる反応のために組み合せ構成要素に移転され得る。また、プラグのアレイは、試剤または溶媒の流れと共に保持構造内に格納され得る。保持構成要素は、プラグと流れの融合を誘発するように構成され、この融合されたプラグのアレイは、さらなる反応のために組み合せ構成要素の中に移転され得る。そのようなシステムは、例えば、より安定した2つ以上の構成要素を混合する際の不安定な核種の析出を含む反応に有益である。
【0019】
一実施形態において、保持構成要素は、一端または両端上で蓋をされるか、または密閉され得ることにより、格納または輸送を容易にする。搬送流体が揮発性でない場合には、端を密閉すること、または蓋をすることは必要ではないこともあり得る。また、密閉されていない保持構成要素は、搬送流体内で一端または両端を浸水させることにより輸送され得る。
【0020】
一部の実施形態、特に、プラスチックを通過する液体またはガスの透過率が、長期格納の課題となる場合において、内側にプラグを有する保持構成要素は凍結され得る。
【0021】
保持構成要素は、制御された環境において試剤を格納することに理想的である。保持構成要素は、マイクロフルイディックシステム内の別のコンポーネントの中にプラグを分布するために使用され得るか、または体積の中または表面上(例えば、ウェルプレート(例えば、市販の96−、384−、または1536−ウェルプレート)、顕微鏡のスライド、細胞培養媒体など)にプラグを分布するために使用され得る。プラグ流体が(フルオロロカーボン(過フッ化炭化水素)のように)低い表面張力を有する場合には、プラグは、単にプラグを保持構成要素から落とすことによって分布され得る。単一のプラグ分布を容易にするために、標識またはスペーサは、ユーザが単一の降下を視覚化することに役立つように使用され得る。さらに、分布が行なわれるにつれ、スペーサは独立したプラグ流体を含んでいる部分への流体の分散を容易にし得る。揮発性搬送流体は、搬送流体が蒸発により除去されるように使用され得る。揮発性搬送流体の例は、ブタン、パーフルオロブタン、パーフルオロペンタンを含む。
【0022】
保持構成要素は、結晶化実験を準備することに理想的である。マイクロバッチ実験に関しては、事前装填されたカートリッジは、様々な濃度の沈殿剤プラグを含み得る。これらのプラグは、タンパク質溶液の流れと融合され、結晶化スクリーンをセットアップする。気相拡散実験に関しては、代替プラグ(乾燥剤と代替の沈殿剤)の事前装填されたカートリッジが使用され得る。気相拡散実験に関しては、システムは、沈殿剤プラグのみがタンパク質の流れと融合するように構成され得る。タンパク質の流れを様々な試剤と融合する代わりに、自由界面拡散実験を行なうために、タンパク質は、タンパク質自身のプラグをストリームフォームし、該プラグは、流れが停止した後、隣接する沈殿剤プラグと接触することを可能にし、自由界面を形成する。保持構成要素は、アッセイ、反応、スクリーンなどを行なうことにも理想的である。
【0023】
事前に装填されたカートリッジにおけるプラグの融合をさらに防ぐために、各一対のプラグは、(以下に記述されるように)スペーサによって分離され得る。
【0024】
保持構成要素における流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え得る。溶媒と試剤との混合物が使用され得る。一部の実施形態において、各プラグは、異なる濃度の同じ試剤または試剤の混合物を含み得る。他の実施形態において、線形のアレイ内の少なくとも2つのプラグは、異なる試剤を含み得る。線形のアレイの構成要素は、ケミカルスペース(chemical space)の特定の部分をスパンするように選択され得る。本明細書において使用されるように、ケミカルスペースは、全ての可能な濃度で、生態系内に存在する分子および材料を含む全ての可能な小さい有機および無機の分子および材料を包含する。アレイを備えるプラグが同様な特徴(例えば、同様な分子量、親油性、位相特徴、反応基、コア構造など)を共有するように、アレイを備えるプラグが選択されるときには、線形のアレイは、ケミカルスペースの一部分をスパンし得る。同様な特徴を有する化合物は、様々な既存のデータベースの中に既に分類されている(例えば、Dobson、Nature、432:824〜828(2004)およびFeher、J.Chem.Inf.Comput.Sci.43:218〜227(2003)を参照)。
【0025】
結晶化スクリーンを行なうことに適している流体プラグの線形のアレイが選択される。タンパク質の結晶化に関しては、異なる「高感度」を有するアレイが使用され得る。つまり、粗いスクリーンに関しては、アレイは異なる試剤を有するプラグを含み得る。精細なスクリーンは、関連する特性を有する試剤または異なる濃度の同じ試剤を含み得る。
【0026】
標識は、本明細書において参照により援用される同時係属出願の米国特許出願第10/765,718号において記述されたような線形のアレイを指標とするために使用され得る。特定の実施形態において、線形のアレイ内の1つおきのプラグが、少なくとも1つの溶媒および少なくとも1つの試剤を備え、残りのプラグは少なくとも1つの溶媒および少なくとも1つの標識を備える。
【0027】
流体プラグを標識として使用することに加え、標識付けられたスペーサもまた、指標標識として使用され得る。そのようなスペーサは色付けられ得るか、または他の手段によって検出可能である構成要素を含み得る。
【0028】
他の実施形態において、標識は、より大きな間隔、例えば、約5、25、50、または100プラグごとに注入され得る。標識の使用は、測定構成要素の使用と組み合され得る。そのような組み合わせは、測定コンポーネントの標識をアレイと整列させることを容易にし得、注入される量のわずかな変化および収容構成要素の内径の任意の変化は、明らかなエラーを誘発しない(つまり、エラーは蓄積しない)。なぜならば、測定構成要素は、収容構成要素と直ちに再整列され得るからである。
【0029】
保持構成要素は、2つ以上の流体プラグを含む。一般的には、少なくとも約10、20、30、40、50、60、70、80、90、100、1000、2000、3000または10000個の流体プラグである。
【0030】
流体プラグ内の試剤の濃度は、反応の目的に依存する。結晶化実験に関しては、流体プラグの線形のアレイ内の各プラグは、一般的には、約1pL〜10μL、好適には約1〜50nLのプラグ流体を含む。結晶化実験に関しては、流体プラグの線形のアレイ内の各プラグは、一般的には、約10Mを下回る試剤を含む。一部の反応に関しては、プラグは、約1fMを下回る濃度を有する試剤を含み得る。他の反応、例えば、酵素に対するナノモルまたはフェムトモルの抑制剤、またはタンパク質に対する配位子に対するスクリーニングに関しては、プラグ内の溶液は、さらにより希釈される。結晶化以外へのアプリケーションに関しては、他の量および濃度が使用され得る。例えば、線形のアレイ内の各プラグは、約0.001fL〜10mLのプラグ流体を含み得る。
【0031】
(組み合わせ構成要素)
組み合せ構成要素が使用され、(a)プラグを試剤流体の流れに融合し、(b)プラグを他のプラグに融合し、(c)プラグの第1の集合体の間に、試剤流体の流れまたはプラグの第2の集合体を注入することによって代替プラグを形成する。(a)および(b)において、融合されたプラグは、均一であり得るか、内側に降下するプラグ、またはプラグに触れるプラグであり得る。(c)において、融合が以下に記述されるように誘発される場合には、代替プラグは後に融合する。さらに、第1の流体を備えたプラグの第1の集合体は、第2の流体からなる流れに融合され得、該第2の流体は、搬送流体、第1の流体、および存在する場合には、スペーサと非混和性である。この方法を使用して、結果としてのプラグの集合体における各プラグは、第1の流体を分割し、その結果としての第1の流体の2つの部位に直接的に接触する第2の流体の1つの部位を含む。
【0032】
組み合せ構成要素は、オンチップまたはオフチップのアクティブな構成要素(例えばバルブなど)を使用し得、流れを制御する。パッシブな構成要素のみを、または大部分はパッシブな構成要素を含む単純な組み合せ構成要素は、一部のアプリケーションに対して好ましい。パッシブな組み合せ構成要素が以下に記述される。
【0033】
一部の実施形態において、組み合せ構成要素は、少なくとも一つの送達マイクロチャンネルを備え、該マイクロチャンネルは、さらなる試剤をプラグに送達することに適しているが、そのさらなる試剤を含む新たなプラグを充分に形成することはない。他の実施形態、例えば、自由界面拡散結晶化実験のためのシステムにおいて、さらなる試剤を含む新たなプラグが、組み合せ構成要素において形成される。
【0034】
一実施形態において、組み合せ構成要素は、少なくとも一つのチャンネルを通じて融合された試剤流体の流れを使用し得る。流体の流れを誘発および制御する様々な方法が使用され得る。例えば、試剤流体の流れは、一定の圧力を生成する方法によって駆動され得る。圧力が、搬送流体に入る試剤の流れのキャピラリー圧力を下回るように、圧力は選択され得る。これが事実である場合には、流れは搬送流体に入らず、優先的にプラグの中に注入する。試剤の流れのキャピラリー圧力は、試剤の流れが適用されるチャンネルの(合流地点における)直径を減少させることによって増加され得る。さらに、圧力は、搬送流体/試剤の流れの界面における表面張力を増加させることによって増加され得る。流量が、例えば、シリンジポンプによって量的に制御される場合には、同様の効果が、ポンプと融合合流地点との間に弾力のある要素を導入することによって取得され得る。むしろ、キャピラリー圧力は、プラグの中に注入されることが所望される試剤の流れのおおよその量だけ、弾力のある要素の容量を変化させることに充分である。弾力のある材料は、例えば、(キャピラリー圧力によって圧縮された)気泡、またはマイクロチャンネルの屈曲性の要素(例えば、マイクロチャンネルの膨張を可能にする弾力のある部分)であり得る。
【0035】
特定の実施形態において、組み合せ構成要素は、(1)試剤の流れ(例えばタンパク質の流れ)、または(2)試剤プラグの流れのいずれかと融合されるプラグのアレイを可能にする任意のマイクロフルイディックであり得る。いずれの場合においても、いったん、プラグのアレイが、組み合せ構成要素のマイクロチャンネルを通過すると、少なくとも1つの融合されたプラグが生じる。試剤は、アレイ内の少なくとも1つのプラグの中に移転される。なぜならば、アレイは、マイクロチャンネルと流体接続する送達チャンネルを通過するからである。次に、融合されたプラグは、下流のチャンネルを通って流れ、下流のチャンネルにおいて、プラグはさらに、操作、混合、監視、選別、収集などに使用され得る。他の実施形態、例えば、自由界面拡散結晶化実験のためのシステムにおいて、組み合せ構成要素は、保持構成要素からのプラグのアレイが、プラグの新たな線形のアレイが形成される方法で、(1)試剤の流れ(例えばタンパク質の流れ)または(2)試剤プラグの流れと組み合わせられることが可能である任意のマイクロフルイディック装置であり得、該方法において、保持構成要素からのオリジナルのプラグは、導入された試剤を含む新たなプラグに換わる。
【0036】
図4aは、互いに実質的に平行になるように構成されている複数の送達チャンネル22を備えた組み合わせ構成要素を図示し、該送達チャンネルのそれぞれは、マイクロフルイディック組み合わせチャンネル23に対して垂直であり、かつ、それと流体交流(伝達)している。送達チャンネルは、共通の入口24から分岐し、チャンネルの相対距離が短いために、一斉に機能する。この実施形態において、保持構成要素内のプラグのアレイは、マイクロフルイディック組み合わせチャンネル23の一端を通じて、組み合わせ構成要素に送達され得る。試剤溶液(例えば、タンパク質水溶液の流れ)は、入口チャンネル24に送達される。プラグが送達チャンネルを通過するので、試剤溶液がプラグに送達される。融合されたプラグは組み合わせ構成要素を通って流れ、さらなる操作のために、第2の保持構成要素に収集され得るか、または収容構成要素に送達され得る。
【0037】
狭められた合流部分を有するチャンネルが使用され得ることにより、融合の間、流体プラグのアレイ内の試剤による導入された試剤の流れの二次汚染の潜在的な問題を低減する。例えば、タンパク質の流れが、様々な沈殿試剤を含む流体プラグのアレイに導入されるタンパク質結晶化実験において、タンパク質の流れの汚染による1つプラグから別の上流プラグへの1つの沈殿剤の二次汚染を防止することが所望される。しかしながら、より小さい送達チャンネルの使用は、各プラグに添加され得る試剤の量を限定する。より多い量の試剤の導入を可能にするが、狭められた合流地点の利点を維持するために、融合合流地点は、複数の分割されたチャンネルと共に製造され得る。横断面積および量的な流量の合計が同一である単一のチャンネルと比較すると、分割されたチャンネルは単一の幅のチャンネルよりも明らかに高いずれ速度を有し、その結果、拡散による汚染を低減する。より小さいチャンネルがまた機能して、任意の表面張力駆動の対流を低減する。そのような複数の小さいチャンネルがまた使用され得ることにより、気相拡散における選択的融合プロセスを助ける。
【0038】
送達チャンネルを通って送達される流れのキャピラリー圧力が、送達チャンネル全体の圧力降下とほぼ等しいか、またはそれよりも大きいときには、チャンネルは一斉に機能する。プラグが送達チャンネルのうちの1つの近位にあり、試剤の流れが、そのプラグと融合する場合には、試剤の流れはプラグの中に流れる。搬送流体/融合の流れの界面における表面張力による圧力は、他の送達チャンネルを通った搬送流体の中への試剤の流れに抵抗する。例えば、3つの送達チャンネルが使用され、試剤の流れがチャンネルのうちの1つを通ってのみ流れる場合には、他の2つのチャンネルにおける搬送流体/融合の流れの界面における表面張力による圧力は、その1つのチャンネルを通った試剤流体の流れによる圧力降下に等しい圧力を維持することができるように、充分に高くなければならない。搬送流体/融合の流れの界面における表面張力による圧力は、送達チャンネルと組み合わせチャンネルとの間の合流地点の幾何学様式(形状)に依存する。圧力降下は送達チャンネルの長さ、それらの断面寸法、試剤流体の粘度、および流量に依存する。従って、多くのパラメータが調節され得ることにより、搬送流体/融合の流れの界面における表面張力による圧力と圧力降下との間の所望の関係が達成される。
【0039】
複数の送達チャンネルおよびプラグの間の間隔は、送達チャンネルの周辺に少なくとも1つのプラグが常に存在するように設計され得る。この型は、搬送流体の中に試剤の流れを注入することなく、プラグと流れの一定の融合を可能にする。さらに、そのような型が使用され得ることにより、選択的融合が達成され、そのような型において、プラグのうちの一部のみが試剤の流れと融合する。例えば、第1のタイプのプラグは流れと融合するが、第2のタイプは融合しない。第2のタイプのプラグが、試剤の流れと融合する傾向がより低いときに、選択的融合は達成され得る(この選択性は、例えば、第2のタイプのプラグ流体の粘度を増加させること、または第2のプラグ流体/搬送流体の界面における表面張力を減少させることによって達成され得る)。さらに、重合体(ポリマー)は、第2のプラグ流体、特に、界面の粘度を増加させる界面活性重合体に添加され得る。選択的融合を達成するために、特に、送達チャンネルの周辺において、少なくとも1つの第1のタイプのプラグが常に存在するように、送達チャンネルおよびプラグの間の間隔が存在するときに、この型が使用され得る。
【0040】
図12は、考えられる別の融合形状の例を示し、該例はまた、二次汚染を最小化するように設計される。この形状において、小さい横のチャンネルが使用されることにより、搬送流体が導かれ、試剤の流れを分けることを補助する。
【0041】
一部のアプリケーションにおいて、単純な方法、例えば、実質的に一定の圧力または一定量の流れを1つ以上の入口に提供することが可能ではない方法を使用して、組み合わせ構成要素の中に流れを押し流すことが好ましいことがあり得る。一部の方法は、電力またはコンピュータ制御を必要としないように設計され得る。そのような方法は、野外の診断およびテスト、ならびに単純さと低コストが所望される他のアプリケーションに対して有益である。例えば、組み合わせ構成要素において、保持構成要素および組み合わせられる試剤の流れを通ったプラグの相対流量は制御されなければならない。この制御は、複数のシリンジポンプまたは他の確立されたポンプ方法を用いて容易に達成され得る。さらに、流体割り当て装置を使用し得る。この装置は、圧力源、例えば、シリンジまたはポンプと、押される流体の流れまたはアレイとの間に置かれ得る。この装置は、Y字型の合流地点として設計され得、Y字の底部に対応する入口、およびY字の頂上部に対応する2つの出口を有する。装置は、1つの搬送流体または複数の搬送流体で満たされ得、出口は、保持構成要素の入口および組み合わせ構成要素の試剤の流れに対応する入口に接続されている。2つの出口の流体の抵抗の比率は、流量の所望の比率に対応するように構成されている。2つの出口の個々の流体の抵抗は、Y字の2つの腕の相対的長さおよび/または直径を個々に変化させることによって制御され得る。好ましくは、Y字の2つの出口の流体の抵抗は、保持構成要素および組み合わせ構成要素の流体の抵抗よりも充分に高く(例えば、100倍)、その結果、保持構成要素および組み合わせ構成要素を通る流量は、Y字の2つの出口の流体の抵抗の比率によって決定される。同様のアプローチが使用され得ることにより、2つよりも多い流れの流量を制御する。このアプローチは魅力的である。なぜならば、多くのアプリケーションにおいて、キャピラリーの数が正常な範囲にある限り、プラグの挙動は、流量の絶対値よりも、むしろ流量の比率によって決定される。このアプローチにおいて、流れは、単一のポンプまたは手動で駆動され得、それでも正常な比率の複数の流量を提供する。そのような流体割り当て装置は、保持構成要素を有するキット内で提供され得る。
【0042】
任意の量の試剤溶液は流体プラグと融合され得る。試剤溶液の流量は、融合されたプラグ内の試剤の濃度を変化させるために組み合わせる間に変化され得る。送達される試剤の量は、検出を意図した技術によって実質的に決定され得る。例えば、反応生成物が検出された場合には、フェムトリットル(またはそれを下回る)の量の試剤溶液が送達され得る。
【0043】
タンパク質の結晶化に関しては、一般的には、プラグ流体と組み合わせられるタンパク質溶液の量は、プラグ流体の量と同様である(一般的には、1:5〜5:1であるプラグ流体に対するタンパク質溶液の比率が使用される)。プラグと組み合わせられるタンパク質溶液の量は、プラグの流れとタンパク質の流れとの流量の比率によって制御され得る。さらに、送達されるタンパク質溶液の量は実験の目的に依存する。目的が、結晶または沈殿剤の形成を単に検出することである場合には、pLの量が使用され得る。目的が結晶構造を取得することである場合には、10nL以上の量が必要とされ得る。概して、約1nL〜100nL、好適には約10nLのタンパク質溶液が、各プラグに送達される。タンパク質の結晶化に関しては、タンパク質の濃度は、一般的には約0.001mg/mL〜100mg/mL、好適には0.1mg/mL〜50mg/mLである。
【0044】
(収容構成要素)
収容構成要素は、組み合わせ構成要素または他のマイクロチャンネルと流体接続するように構成された少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備える。収容構成要素は、本出願の別の場所で記述されたようなマイクロフルイディク装置であり得る。収容構成要素は、上記の保持構成要素と同一であるように構成され得る。タンパク質の結晶化実験を行なうために用いられるときには、収容構成要素は、プラグ内で形成される結晶の構成要素上でのx線回折に適した材料、例えばガラスで構成されることが有益であり得る。アッセイのために使用されるときには、収容構成要素は、光学的検出に適した材料、例えばガラスまたはプラスチックで構成され得る。
【0045】
収容構成要素は、プラグ内容の温度を制御する装置を備え得ることにより、例えば反応量を制御する。収容構成要素はまた、プラグ内容を照射または放射する装置を備え、例えば光化学反応を開始する。収容構成要素は、プラグを選別または監視するように設計され得る。収容構成要素は、プラグ内容を検出または分析する装置から分離され得るか、またはそれに統合され得る。
【0046】
収容構成要素は、アクティブな表面を備え得る。このアクティブな表面は、プラグ流体による湿潤を誘発し得る。プラグ流体による湿潤は、例えば、自由界面拡散による高分子の結晶化において、例えば、プラグ流体間の接触を作り出すために使用され得る。このアクティブな表面はまた反応性であり得る。反応は、プラグ流体との接触、および/または搬送流体、スペーサ、または標識を通じて、プラグ流体と表面との間での(いずれかの方向または両方の方向への)試剤の輸送によって生じ得る。
【0047】
(測定構成要素)
測定構成要素は、ユーザが、マイクロチャンネル内のプラグの位置から個々のプラグを識別することを可能にする。線形のアレイ内のプラグの数があまりにも多く、プラグを手動で数えることが可能ではない場合には、測定構成要素は有益であり得る。プラグを自動的に数えることが所望される場合には、測定構成要素はまた有益であり得る。
【0048】
収容構成要素は、マイクロチャンネル内の流体プラグの配置を識別するために、統合測定構成要素(例えば、1つ以上の物理的標識)を備え得る。代替的に、収容構成要素から分離した測定構成要素が使用され得る。分離測定構成要素が使用されるときには、測定装置および収容構成要素を含んでいるキットを提供することが好ましい。特定の実施形態において、キットは、保持構成要素と、保持構成要素の内容が収容構成要素に移動させられた後で、保持構成要素の内容の1つの位置または複数の位置を示すように設計された調和測定構成要素とを備え得る。測定構成要素は、例えば、収容構成要素上に嵌合するように設計されたカードであり得る。
【0049】
測定構成要素はルーラであり得、ルーラにおいて、測定標識は、収容構成要素におけるアレイ内のプラグの位置に相関する。測定標識は、点、線、線分などで形成され得る。標識は、屈折率の違いに基づいて、発光性(蛍光性、燐光性、化学発光性など)、反射性ま
たは吸収性であり得、かつ、他の形式の光学標識であり得る。
【0050】
標識は数字でもあり得る。標識は、人間が判読可能であり得、文字を含み得るか、機械が判読可能であるか、またはその両方であり得る。考えられる機械が判読可能な標識は、例えば上記の方法の任意のものを使用して実装されるバーコードを含み、Nicewarner−Penaら、Science294:137〜141(2001)において記述されたようなナノスケールのバーコードも含む。
【0051】
プラグが視覚的に位置付けすることが困難であるときには、搬送流体およびプラグ流体が調和屈折率を有するときに生じ得るように、測定構成要素が視覚化を助け得る。屈折率調和は、プラグの内容を視覚化することに役立つ。
【0052】
測定構成要素は、あらゆるプラグの位置を標識付ける必要はない。測定構成要素は、例えば、3つのプラグごと、または5つのプラグごとのように複数のプラグを単に標識付け得るか、プラグの線形のアレイに沿って、試剤化合物に関する充分な変化の1つの位置または複数の位置を標識付けし得る。
【0053】
ユーザを助けるために、プラグのアレイは、標識プラグまたはスペーサを備え得る。次に、標識プラグまたはスペーサは、ユーザが測定構成要素をアレイに最初に整列することか、またはユーザが、測定構成要素を使用することなく、収容構成要素内のプラグを識別することに役立つ。いくつかのタイプの標識が使用され得る。例えば、第1のタイプの標識が10個のプラグ毎に、第2のタイプの標識が50個のプラグ毎に、第3のタイプの標識が250個のプラグ毎などに使用される。異なるタイプのプラグは、例えば色が異なり得る。
【0054】
(構成要素の形成)
構成要素は、当該分野において公知の方法を使用して形成され得るマイクロチャンネルを備え得る。例えば、係属中の米国特許出願第10/765,718号は、マイクロチャンネルの製造、ならびに流体プラグを分裂、融合、および操作するためにそれらを使用する方法を記述する。
【0055】
本発明の構成要素は、キャピラリー、(約10mmを下回り、好適には1mmを下回る直径を有する管状にした)エッチングまたはモールドまたはエンボスされたマイクロチャンネルを有する基板、またはそれらの組み合わせから形成され得る。構成要素は、接合されたかまたは分離されたかのいずれかで複数のチャンネルを備え得る。好適には、マイクロチャンネルは、長方形の断面よりも、むしろ円形または丸い断面を有することにより、プラグの輸送を容易にし、プラグの合体を減少させる。しかしながら、任意の形状が使用され得る。
【0056】
円形または概ね円形の断面を有するチャンネルを製作するために、薄片の管またはキャピラリーが、長方形のチャンネルに挿入され得る。この技術は、プラグの形成を容易にし得、チップを他の構成要素に接続する方法も提供し得る。複数の管が複数のチャンネルに挿入され得る。管またはキャピラリーが搬送流体によって優先的に湿潤されるように、管またはキャピラリーは選択され得る。例えば、テフロン(登録商標)は、水溶性流体よりも優先的にフッ化流体によって湿潤される。管またはキャピラリーは、必要に応じて、フレアのついた漏斗状の縁(または狭められた縁)を有し得ることにより、他の構成要素との接続を容易にする。そのような装置を製作するために、層を密閉する(例えば、PDMS層の密閉)前、または長方形のチャンネルが製作された後のいずれかに、管またはキャピラリーはチャンネルの中に挿入され得る。管またはキャピラリーの外表面と長方形のチャンネルとの間の空間を満たすことがまた所望される。この空間は粘着性の液体または重合体で満たされ得る。例えば、PDMSが使用され得る。
【0057】
個々の構成要素は、同じか、または異なる材料から形成され得る。構成要素は、水と接触することに反応する材料から形成され得る。水と接触することに反応する重合体が合成される(Senshuら、Langmuir、15、1754〜1762(1999);Moriら、Macromolecules 27、4093〜4100(1994))。これらのダイブロック重合体は、親水性および疎水性のドメインを含む。空気にさらされたときに、疎水性のブロックは表面に遊走し、表面エネルギーを最小化し、該表面は疎水性となる。水と接触すると、表面の再構成が生じ、水が親水性のブロックのみと接触するまで、親水性のブロックは、重合体と水との界面に遊走する。例示的な重合体は、ポリ(スチレン−b−2,3−デヒドロキシプロピルメタクリル酸塩)およびポリ(4−オクチルスチレン−b−2,3−デヒドロキシプロピルメタクリル酸塩)を含む。
【0058】
不透明な粒子、例えば、カーボンブラック粒子(好適には、約5ミクロンを下回る直径を有するカーボンブラック粒子)が、構成要素を作るために使用される材料に統合され得る。このように、実質的に黒いチャンネルが製作され得ることにより、背景光に関する問題(例えば、蛍光分析の感度を増加させる)を消去する。
【0059】
アダプタが、例えば、キャピラリーまたは複数の管を接続する接続部として使用され得る。アダプタは、中央において狭まるI.D.(内径)を有する小さいガラス管であり得る。異なるI.D.のアダプタが市販されている。ガラスアダプタの内壁の表面の化学的性質は、シラン処理によって疎水性に作られ得る。アダプタは、伸長テフロン(登録商標)パイプからも容易に創作され得る。これを行なうために、1本のテフロン(登録商標)パイプの一部が、ある地点で伸長される。伸長地点のI.D.およびO.D.(外径)の両方は減少し、アダプタとしての使用に適したチューブとなる。
【0060】
(プラグ形成)
本明細書において使用されるように、少なくとも1つのプラグ流体が、プラグ流体が非混和性である搬送流体の流れの中に導入されたときに、「プラグ」は形成される。マイクロフルイディック装置内の流体の流れは、例えば、圧力、放射線、熱、振動、超音波、電場、または磁場の存在または適用から、直接的または間接的に生じる駆動力または刺激によって誘発される。プラグは、サイズが変化し得るが、形成されるときに、それらの断面は、一般的には、プラグが形成されるチャンネルの断面と同じである。円形ではない形状のチャンネルにおいて、プラグは、チャンネルの断面の少なくとも1つの寸法と断面のサイズが同じでなければならない。プラグは搬送流体によって実質的に取り囲まれなければならない。つまり、搬送流体は、プラグ流体がマイクロチャンネルを湿潤するよりも広い範囲を湿潤しなければならない。プラグが、異なる直径の下流のチャンネルを通過する場合、またはプラグが、さらなるプラグと融合するときに、プラグの断面は変化し得る。プラグは形状が変化し得る。用語「プラグ」はまた、プラグ内プラグ、プラグ内ドロップ、およびプラグ内固体(例えばビーズ)を含む。この概略的な定義に対する例外は、スペーサが使用されたときには、プラグがマイクロチャンネルの断面よりも小さくなり得るということである。
【0061】
本明細書において使用されるように、「融合されたプラグ」は、(1)単一のプラグを形成する2つ以上のプラグの組み合わせ、または(2)2つ以上のプラグがときとともに融合するような、マイクロチャンネル内での2つのプラグの並列のいずれかを呼ぶ。
【0062】
分散を最小化して、マイクロチャンネルを通してプラグを形成および移動するために、プラグの内側の流体が、マイクロチャンネルの壁に粘着してはいけない。これを達成するために、プラグ/チャンネルの界面における表面張力は、プラグ/搬送流体の界面における表面張力よりも高くなければならない。プラグが水溶性であり、搬送流体が油であるときには、無数のキャピラリーの数Caは、理想的には、約0.1を下回り:
Ca=Uμ/γ
となり、γ[N m−1]は、油/水の界面における表面張力であり、Uは、m/secでの速度であり、μは粘度(Pa・sec)である。
【0063】
本発明において使用されているマイクロチャンネルは、プラグ流体による湿潤よりも優先的に、搬送流体によってマイクロチャンネルを湿潤可能にするように表面処理され得る。例えば、ガラスキャピラリーが、シラン処理され得ることにより、搬送流体に対する水溶性のプラグの湿潤を減少させる。さらに、マイクロチャンネルは、プラグの導入前に搬送流体を用いて、最初に洗い流され得る。
【0064】
プラグは、実質的に任意の流体、例えば、1つ以上の水溶液、1つ以上の有機溶液、1つ以上の無機溶液、またはそれらの組み合わせから形成され得る。プラグは、水、保存溶液、緩衝液、試剤、溶媒、食塩水、重合体溶液、沈殿剤溶液、金属懸濁液、細胞浮遊液などから形成され得る。
【0065】
プラグのサイズは、本出願を通して記述されているように、例えばプラグ流体および搬送流体のマイクロチャンネルの中への相対流速量によって制御され得る。流速量は好適にはポンプを使用して制御され得る。
【0066】
プラグの形成の間に、様々なプロセスが生じ得る。例えば、脂質(例えばMO、モノオレイン)の流れが、水溶液を有するプラグに組み合わせられ、2つの液体がプラグの内側で活発に混合されるときに、脂質立法相(LCP)の形成が生じ得る。高分子、例えば、タンパク質または膜タンパク質の水溶液が使用され得る。この混合は、(本発明者によって以前に記述されたように)プラグが湾曲するチャンネルにおける複数の屈曲を通って移動するときに誘発される無秩序な移流によって実行され得る。粘着性の搬送流体が使用され得ることにより、プラグの内側でより高いずれを誘発し、さらに効果的な混合を確実にする。この方法は、例えば、LCPに関する結晶化を最小化することに対して魅力がある。
【0067】
マイクロチャンネル内のプラグの間隔は、様々な方法で制御され得る。一実施形態において、試剤溶液の1つの集合体が、非混和性の搬送流体の流れの中に継続的に注入され、プラグを形成し、第2の集合体は、さらに下流に継続的に注入される。安定した界面活性剤を有する搬送流体が使用される場合には、溶液の第2の集合体は、プラグの中に注入されるよりも、既に形成されたプラグに直に隣接して分布されるプラグを形成することが好まれる。試剤溶液と搬送流体との間の界面における界面活性剤集合体、および2つのプラグ流体の間の搬送流体の層によって癒着することを防止される。プラグ流体が異なる特性、例えば異なる粘度を有する場合に、主チャンネルにおいてプラグを対にすることが生じる。この対にすることは、例えば、気相拡散の使用および自由界面拡散方法による高分子の結晶化に対するアプリケーションに対して有益であり得る。
【0068】
互い違いの構造のプラグは、水溶液を正面から搬送流体の中に流すことによって形成され得る。流れている搬送流体はプラグ間にバリアを提供し、該バリアはプラグが癒着することを防止する。互い違いのプラグの形成はキャピラリー数によって制御される。同じ幅のマイクロチャンネルの入口に対して、水溶液の流れの流量の割合が、液滴のサイズの割合を決定する。水溶液の上部の流れの流量が、水溶液の底部の流れの流量よりも2倍速い場合に、その結果生じる液滴のサイズは、約2:1の割合にある。一部の場合において、ほぼ同じサイズのプラグが形成され得るが、速い流れから2つのプラグか、遅い流れの1つのプラグごとに対して形成され得る。マイクロチャンネルの入口の寸法の割合はまた、液滴のサイズの割合に影響するように設計され得る。水溶液の上部の流れに対するマイクロチャンネルが、水溶液の底部の流れに対するマイクロチャンネルに対して2倍以上の幅である場合に、その結果生じる液滴は、約2:1の割合であり得る。プラグ流体が異なる特性、例えば、異なる粘度を有する場合に、主チャンネル内で互い違いのプラグを対にすることが生じる。
【0069】
アレイに沿ったプラグの溶液の濃度は、プラグ流体の流れの構成要素の相対流量を単に変化させることによって急激に変化され得る。この法則は、マイクロチャンネル内のプラグの線形のアレイをセットアップするために使用され得る。例えば、この法則は、様々な濃度のタンパク質および/または水溶性のプラグのアレイ内の様々な濃度の沈殿剤試剤を形成することによって結晶化試験をセットアップするために使用され得る。そのような線形のアレイを含む事前装填されたカートリッジは、結晶化状態を最適化するために使用され得る。
【0070】
一部の実施形態において、アプリケーションに必要とされるプラグよりも大きいプラグを形成することが、より簡単であるか、またはより安価であり得る。例えば、タンパク質結晶化スクリーニングに対して所望されるより小さい10nLのプラグよりも、むしろ約1マイクロリッターの量のより大きいプラグをより確実に作ることが簡単であり得る。装填構成要素が、大量の流体を制御するために利用可能である場合に、複数の保持構成要素を1つの装填構成要素に接続し、複数の保持構成要素をより小さいプラグと並列して製作することが好ましいことがあり得る。例えば、自動的な保持構成要素が、1マイクロリッターの量を吸引することが可能であり、25個のキャピラリーが、この装填構成要素に並列して接続され、その結果、同じ量が各キャピラリーの中に吸引された場合に、1マイクロリッターの量のプラグ流体、搬送流体、およびスペーサを首尾よく吸引することによって、キャピラリーのアレイが約40nLの搬送流体と約40nLのスペーサとによって分離された約40nLのより小さいサイズのプラグを備えるように、キャピラリーのアレイは作成される。例えば、自動的な装填構成要素は、搬送流体、スペーサ(例えば、空気)、搬送流体、第1の試剤混合物、搬送流体、スペーサ、搬送流体、第2の試剤混合物、搬送流体、スペーサ、搬送流体、第3の試剤混合物、搬送流体などを続けて吸引し得る。保持構成要素に入る溶液に対するキャピラリーの圧力は、流れを駆動するために使用される圧力(または圧力差)よりも充分に低いことが好ましい。これは、流体が実質的に同じ量だけ全ての保持構成要素に入ることを確実にする。さらに、プラグ流体が保持構成要素の中に入って進むにつれ、キャピラリーの圧力が増加するように、保持構成要素の入口は設計され得る(一実施形態において、この増加は、入口地点から狭まっていく保持構成要素を使用することによって達成され得る)。そのような入口は、保持構成要素に入る量のより均等な分布を容易にし得る。好適には、保持構成要素は、プラグ流体によって湿潤されないことにより、プラグ流体が保持構成要素に吸着すること、および二次汚染を引き起こすことを防止する。
【0071】
上記のこのアプローチは、複数の保持構成要素の中への吸引に限定されず、他の分布方法にも有益である。
【0072】
プラグは、より大きいプラグをより小さいプラグに分裂させることによっても作られ得る。この実施形態において、マイクロチャンネルは、単一の合流地点において、1つ以上のより小さい収容マイクロチャンネルに分裂される。この合流地点は狭まるように製作され、その結果、キャピラリーの数が増加される。プラグを分割するプロセスは、収容チャンネル内の圧力または圧力降下を調節することによって制御され得る。出口における表面張力による圧力が、収容チャンネル全体の圧力降下よりも充分に低い(例えば、10倍、好適には、100倍または1000倍以上)ように、収容チャンネルが設計されることが好ましい。これは、分裂が出口において分散される流体よりも、むしろチャンネル全体の圧力降下によって制御されることを確実にする。出口におけるキャピラリーの圧力は、保持構成要素を搬送流体で事前に満たし、搬送流体、プラグ流体、およびスペーサを有する低い表面張力を有する流体を用いて、保持構成要素の出口を貯水溝の中に浸すことによって減少され得る。同様に、分裂合流地点におけるキャピラリーの圧力は、収容チャンネル全体の圧力降下よりも充分に低いことが好ましい。同様に、分裂合流地点におけるキャピラリーの数は、分裂が生じることを可能にするように充分に多くなければならない。
【0073】
代替的に、長いプラグが、合流地点において搬送流体の流れの中に流され得る。長いプラグは、搬送流体によって分離された一連の小さいプラグに分かれる。
【0074】
大きいプラグは小さいプラグに分けられ、その結果、小さいプラグは、大きいプラグに最初に含まれた溶液を異なる濃度で含む。タンパク質の結晶化に適用されたときに、この方法は、同じアレイを用いて、スパース行列スクリーンおよび勾配スクリーンを実行することを可能にする。一実施形態において、保持構成要素は、スパース行列スクリーンのために、適切な溶液の大きい(例えば、約100nL)プラグを含む。これらの大きく長いプラグは、搬送流体の流れの中に流され、その結果、プラグは一連の小さく短いプラグに分かれる。搬送流体の流量に対する大きいプラグの流量は、小さいプラグのサイズを制御する。続けて、タンパク質溶液が、下流のチャンネルの末端を通して、より小さいサイズのプラグに組み合わせられ、プラグを含んでいる流れの流量に対するこの末端の流れの流量は、より小さいサイズのプラグ内のタンパク質の濃度を制御する。同様に、緩衝液が小さいプラグに添加され得ることにより、各結晶化アッセイが同じ量で行なわれることを確実にする。スペーサ(例えば、気泡)は、大きいプラグの間の保持構成要素内に含まれ、プラグの操作の間に、さらに導入され得る。
【0075】
代替的に、大きいプラグは水溶性の流れの中に流され得る。この流れは1つ以上の溶液を含み得る。タンパク質の結晶化に適用されたときに、流れは、タンパク質溶液と緩衝液との層流を含み得る。その結果生じる複数の構成要素の流れが、搬送流体の流れの中に流され、搬送流体の流れにおいて、組み合わされた水溶性の流れは、一連のプラグに分かれる。さらに、このアプリケーションにおいて、大きな液滴は、スパース行列スクリーンのために溶液を含み得、水溶性の流れおよび大きいプラグの流量が変化し得ることにより、これらの試剤のうちの任意の試剤に関する濃度の勾配を作成し、ハイブリッドスクリーンをもたらす。スペーサは、大きいプラグの間の保持構成要素において使用され得る。標識もまた、大きいプラグの間で使用され得る。
【0076】
(搬送流体)
搬送流体は、プラグ流体と実質的に非混和性である任意の液体または気体であり得る。好適には、プラグが水溶性であるときに、搬送流体は液体である。搬送流体内のプラグ流体の表面張力は、理論的には約5〜15mN/mの間にあり、好適には約10mN/mである。他のゼロではない表面張力の値が使用され得る。搬送流体は、プラグ流体または試剤に対して透過性があり得る。
【0077】
膜タンパク質の結晶化に関しては、パーフルオロアミンまたはそれらの混合物が理想的な搬送流体である。なぜならば、それらは水溶性のプラグに対して表面(特にテフロン(登録商標)装置におけるフッ化処理された表面)を優先的に湿潤する。
【0078】
一部の実施形態において、キャリア流体に界面活性剤を添加することが所望される。界面活性剤が使用され得ることにより、表面張力および搬送流体の湿潤特性を制御する。フッ化流体が搬送流体として使用されたときに、本発明者らは、1H,1H,2H,2H−パーフルオロクタノールを界面活性剤として使用した。界面活性剤はまた、プラグと搬送流体との間の界面に対するプラグの内容の非特異的吸着を制御するために使用され得る。例えば、可溶性フルオラス(fluorous)界面活性剤は、フッ化搬送流体と水溶液との界面における非特異的タンパク質吸着を制御するために使用され得る。例示的な可溶性フッ化界面活性剤は、オリゴエチレングリコール分子トリエチレングリコールモノ[1H,1H−パーフルオロクチル]エチルCF3(CF2)7CH2O(CH2CH2O)3H)である。この界面活性剤は、プラグ形成の間、フッ化搬送流体と水溶液との界面に自身を配置し、オリゴエチレングリコール基の単分子層に存在する。この界面は、表面に対して素早く強力に吸着することで公知のタンパク質であるフィブリノゲンの濃縮溶液を含む多種多様なタンパク質および酵素の吸着に抵抗した。非特異的吸着に抵抗する同じ能力を有する界面活性剤が、フルオラス水溶液抽出(fluorous−aqueous extraction)を介して、DuPontから市販されているZonyl FSO−100から抽出され得る。可変フッ化アルカン鎖長、可変グリコール長、および様々なスペーサ連結を有する他のオリゴエチレングリコールコンジナーはまた、水溶液とフルオラスとの界面におけるタンパク質の吸着を防止する。逆に、不活性ではない官能基を用いて冠着された界面活性剤は、タンパク質を液体間界面に引き寄せて結合する。
【0079】
(スペーサ)
本発明のアレイは、必要に応じてスペーサを含み得る。適切なスペーサは、少なくとも1つの液体(例えば、イオン性の液体、フルオロシリコーン、炭化水素、フッ化液体)、気体(好適には、不活性の気体、例えば、窒素、アルゴンまたはキセノン)、ゲルまたは固体(例えば、ポリスチレンのような重合体)から成り、それらはプラグ流体と搬送流体との両方に対して非混和性である。本発明のアレイは、複数のタイプのスペーサを含み得る。
【0080】
スペーサはまた標識を含み得、その結果、スペーサは、上記のようにプラグを示すために使用され得る。スペーサはまた、(例えば、光学的伝達を防止すること、または透過を防止することによって)プラグ間の交差連通を減少させるために使用され得る。スペーサはまた、機能特性を有し得る。例えば、キセノンの気泡が、高分子の結晶化においてスペーサとして使用されるとき、特に、実験が圧力を増加された下で行なわれるときに、キセノンが生長している高分子結晶に統合され得、その回折特性を改善する。
【0081】
スペーサは、液体から成るプラグの形成および操作(例えば、分裂)に関して記述された同じ方法を使用して、形成および操作され得る。特に、液体のプラグと気泡との両方から成る流れは、互い違いの液体構成のプラグの流れを形成するために使用される同じ方法を使用して形成され得る。スペーサは、アレイの自動的な製作の間に導入され得る。スペーサによって分離された大きいプラグのアレイが分裂され、小さいプラグのいくつかのアレイを製作する場合に、スペーサもまた分裂されることが好ましい。
【0082】
スペーサはプラグの操作において重要な役割を担い得る。第1に、所望されないプラグの融合が生じる場合に、スペーサはプラグの間に挿入され得ることにより、融合を最小化する。そのようなスペーサは、スペーサを用いないよりも長い距離を通したプラグのアレイの輸送を可能にし得る。そのようなスペーサはまた、装置およびキャピラリーの内外へのプラグの移送(または装置およびキャピラリーの組み合わせで作られた合成装置を通じた移送)を容易にする。
【0083】
スペーサはまた、プラスチックまたはPDMSのチャンネルの内側の自由界面拡散を容易にするために使用され得る。反応構成要素を含んでいるプラグの間の気泡に関しては、両端から圧力を加えることによって、気泡は、プラスチックまたはPDMSの壁を通して取り除かれる。次に、2つのプラグが充分に近付けられることにより、新たに形成されたプラグ間界面全体で拡散を可能にする。そのようなシステムは、タンパク質の結晶化に適用され得、タンパク質の結晶化において、1つのプラグはタンパク質を含み、他のプラグは沈殿剤を含む。圧力が加えられ、気泡が圧縮された場合に、スペーサによって分離されたプラグは接触し得る。
【0084】
(キット)
上記のように、キットの一実施形態は、収容構成要素および測定構成要素を備える。
【0085】
別の実施形態において、本発明のキットは、組み合わせ構成要素、貯水溝およびポンプを備え得る。この実施形態における使用に適したポンプは、充分な圧力を提供し得ることにより、貯水溝から入口を通って、送達チャンネルを通り、組み合わせ構成要素のマイクロチャンネルの中に溶液、例えばタンパク質溶液を駆動する。
【0086】
別の実施形態において、キットは2つ以上の保持構成要素を備える。例えば、キット内の保持構成要素は、ケミカルスペースの一部分をスパンし得る。別の実施形態において、キットは、ゲノムをスパンしている複数の保持構成要素を備え得る。
【0087】
別の実施形態において、キットは、組み合わせ構成要素および1つ以上の収容構成要素を備え、組み合わせ構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。キットはまた、2個、3個、4個、5個、10個、20個、50個またはそれ以上の収容構成要素を含み得る。
【0088】
別の実施形態において、キットは、1つ以上の保持構成要素および組み合わせ構成要素を備え、組み合わせ構成要素および保持構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0089】
別の実施形態において、キットは、1つ以上の保持構成要素、1つ以上の組み合わせ構成要素、および1つ以上の収容構成要素を備え、組み合わせ構成要素、保持構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0090】
別の実施形態において、キットは、1つ以上の装填構成要素、1つ以上の保持構成要素、1つ以上の組み合わせ構成要素、および1つ以上の収容構成要素を備え、装填構成要素、組み合わせ構成要素、保持構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0091】
(様々な構成要素の中へのプラグのアレイの移送)
プラグは、構成要素の一端を他の構成要素の一端に直接的に挿入し、合流地点を密閉し、漏洩を抑制することによって、1つの構成要素から他の構成要素に移送され得る。代替的に、アダプタ(例えば漏斗)が、様々な構成要素を接続するために使用され得る。
【0092】
プラグは、第1の構成要素の出口の反対側の端に圧力を加えることにより、第1の構成要素のマイクロチャンネルから第2の構成要素のマイクロチャンネルの中に押され得るか、または第2の構成要素のチャンネルの内側に減圧を加えることによって、第2の構成要素の中に引き込まれ得る。流体の流れを駆動する他の標準的な方法がまた、上記のように使用され得る。
【0093】
プラグ内の様々な流体の混合率は、同時係属中の米国特許出願第10/765,718号において記述されたように制御され得る。例えば、プラグが湾曲するチャンネルを通って輸送されるときには、急速な混合が誘発され得る。装填構成要素から保持構成要素の中に、もしくは保持構成要素から組み合わせ構成要素の中に、または組み合わせ構成要素から収容構成要素に輸送されるプラグ内の反応時間を増加させるために、プラグは、充分に遅い速度で輸送され得るか、または流れを完全に止めるか、もしくは充分に減少させるかのいずれかであり得る。
【0094】
本発明の一部のアプリケーションにおいて、すぐに続けてまたは組み合わせのイベントの間にある程度の遅延を伴ってのいずれかで、プラグが1つよりも多い次のプラグまたは流れと組み合わされることを可能にすることが所望される。一部の実施形態において、組み合わせ構成要素は、対応する数の貯水溝に接続された1つよりも多い送達チャンネルを含み得、プラグのアレイが送達チャンネルを連続して通過することを可能にする。従って、試剤が各入口を通過するので、各送達チャンネルからの試剤は、各プラグの中に輸送される。そのような実施形態において、試剤の各移送の間の遅延は、送達チャンネル間の距離とプラグのアレイの流量とによって制御され得る。他の実施形態において、組み合わせ構成要素を使用して以前に第1の試剤と組み合わせられたプラグのアレイを含む収容構成要素は、組み合わせ構成要素を使用して第2の試剤と続けて組み合わせられ得る。第1の試剤と組み合わせる際に使用される組み合わせ構成要素は、第2の試剤と組み合わせる際に使用される装置と同じ装置か、または異なる装置かのいずれかであり得る。例えば、酵素の潜在的な防止剤である小分子のライブラリを含むプラグのアレイは、最初に酵素溶液と組み合わせられ、平衡になることを可能にされ得る。続けて、酵素および小分子を含んでいるこのプラグのアレイは、酵素の基質と組み合わされ得、酵素触媒反応がモニタリングされ得ることにより、潜在的な防止剤の有効性が決定する。ほぼ円形の断面を有するパイプの使用は、長い距離にわたるプラグの確かな輸送を達成することに特に有益であり得、該パイプは、反応に対して適切な長さの遅延を達成するためにも使用され得る。
【0095】
構成要素は再利用され得る。例えば、装填構成要素の入口は、第1の保持構成要素(例えばキャピラリー)に接続され得ることにより、プラグのアレイを収集する。アレイの移送の後に、第1の保持構成要素は、装填構成要素から取り外され得、必要である場合には、密閉または冠着される。次に、第2の保持構成要素は、装填構成要素に接続され得、満たされ得る。組み合わせ構成要素は同様な方法で再利用され得る。
【0096】
自動化された装置が、複数の装填構成要素と保持構成要素と収容構成要素とを相互作用するように使用され得る。例えば、1つの装填構成要素は、多数の保持構成要素の中にプラグを装填するために使用され得、該保持構成要素は、自動化された器具によって場所を換えられる。定温放置の間に、保持構成要素または収容構成要素は、プラグ内の反応または結晶化の程度をモニタリングするモニタリングステーションに輸送され得る。保持構成要素または収容構成要素は、モニタリングステーションまたはいくつかのステーションを通過して継続的に輸送され得る。このモニタリングが使用され得ることにより、例えば、結晶化または反応が起こったプラグまたは一連のプラグを検出する。収容構成要素が使用され得ることにより、例えば、所望のプロセスが起こったプラグを検出、選別および/または分離する。
【0097】
図1は、保持構成要素と装填構成要素との間の接続を行なうために使用され得る漏斗状のアダプタ2を図示している。この図示において、保持構成要素はキャピラリー3であり、装填構成要素はマイクロフルイディック装置1である。代替的に、アダプタはマイクロフルイディック装置またはキャピラリーのいずれかに吸着され得る。
【0098】
図2aは、大きいプラグの単一のアレイが、どのように実質的に同一の特性の複数のアレイに分裂され得るかを図示し、各アレイは、より小さいプラグを含む。この分裂は、実質的に同じサイズのより小さくサイズされたチャンネルの対の中に最初の流体の流れを継続的に導くことによって達成される。そのような装置が使用され得ることにより、大きい(例えば、〜800μm)チャンネルを有するマイクロフルイディック装置内のマイクロリッターサイズのプラグのアレイを小さいチャンネル内のnLのプラグに分裂させる。
【0099】
(プラグ内の反応)
本発明は、少ない量の溶液のプラグベースのマイクロフルイディック操作に関するシステムを提供する。該システムは、装填構成要素、着脱式保持構成要素、組み合わせ構成要素および収容構成要素を含む。
【0100】
反応は、これらの構成要素内の任意のものにおけるプラグ内で生じ得る。反応は、これらの構成要素の表面を含んでも起こり得る。構成要素は、所望の反応を最大化する状態(例えば、温度、光の照射、他の形状の放射、様々な場への曝露など)に置かれ得る。例えば、リガンドおよび金属イオンが構成要素のプラグの中に装填された場合に、リガンドと金属との錯体の形成がプラグ内で生じ得る。構成要素は、所望されない反応を最小化する状況の下に置かれ得る。例えば、生体分子および/または有機分子の水溶液がプラグ内にあるときに、所望されない加水分解が生じ得る。この加水分解は、構成要素の温度を制御すること、および構成要素の内側のプラグを凍結することによっても最小化され得る。構成要素の内側のプラグの内側の試剤の光退色は、光に対して実質的に透過性のない構成要素を使用することか、または光に対する構成要素の曝露を最小化することのいずれかによって、光に対するプラグの曝露を最小化することによって最小化され得る。酸素とのプラグの内側の試剤の反応が所望されない場合には、構成要素は、気体に対して透過性のない材料、例えばガラスを用いて製作され得るか、または構成要素は、酸素のない環境の下に維持され得るかである。さらに、搬送流体(例えばフッ化流体)は、(例えば、凍結−ポンプ−解凍のサイクルまたは不活性の気体、例えばアルゴンを用いたバブリングによって)脱気され得ることにより、溶解されたあらゆる酸素を取り除く。
【0101】
プラグ内で行われ得る反応のタイプは限定されない。例としては、限定するわけではないが、タンパク質の結晶化、合成反応、スクリーニングおよび酵素反応、診断用アッセイを含むが、これらに限定されない。本開示全体を通して、本発明の使用はタンパク質の結晶化に対する適用によって例示されている。本発明は他の反応に等しく適用可能であることを理解されたい。
【0102】
溶液のプラグベースのマイクロフルイディック操作は、米国特許出願第10/434,970号および米国特許出願第10/765,718号において、本発明者らによって以前に開示されており、該出願は本明細書においてその全体が参照により援用される。
【0103】
本発明はまた、プラグ内で反応を行うための方法を提供する。該方法は、(a)第1の搬送流体のプラグの線形のアレイおよび/またはスペーサによって互いに分離された第1のプラグ流体は、保持構成要素から組み合わせ構成要素内の第1のマイクロチャンネルの中に第1の流量で導入することと;(b)第2の搬送流体によって互いに分離された(i)第2のプラグ流体の流れまたは(ii)第2のプラグ流体のプラグの流れを、組み合わせ構成要素内の第2のマイクロチャンネルの中に第2の流量で導入することと;(c)第1のプラグ流体のうちの少なくとも1つのプラグを少なくとも一部の第2のプラグ流体に融合し、融合されたプラグを形成することを包含し、該融合は、第1のマイクロチャンネルと第2のマイクロチャンネルとが流体連通している合流地点において生じる。
【0104】
別の実施形態において、試剤プラグの線形のアレイが中に配置されている保持構成要素を吸着することによって、試剤のプラグの線形のアレイはマイクロチャンネルの中に導入される。試剤プラグは、長期間、完全性を失うことなく、保持構成要素の中に格納され得るので、プラグのアレイは、活性核形成粒子(例えば、タンパク質分子または単なるナノ粒子の凝集体)を含み得る。試剤のプラグは、格納および/または輸送され、後に使用され得ることにより、タンパク質または他の分子または材料の結晶化または沈殿のために核形成を誘発する。例えば、研究者は、タンパク質の結晶化スクリーンのために試剤のプラグのアレイを含んでいる保持構成要素を購入し得、それから単純な合流地点および単純な流源(例えば、シリンジまたは圧力)を使用することにより、融合されたプラグのアレイを試剤の流れまたはプラグの流れに融合する。
【0105】
一部のアプリケーションに関しては、複数の異なる保持構成要素が共に使用され得る。例えば、プラグ内に、タンパク質の結晶化のために96個の沈殿剤を含んでいるキャピラリー(第1の保持構成要素)は、装填構成要素を使用して準備され得る。別個に、第2の保持構成要素(例えば、別のキャピラリー)は、結晶化されるタンパク質を含んでいるプラグを用いて準備され得る。この例において、(本出願の別の箇所、または同時係属の米国特許出願第10/434,970号または米国特許出願第10/765,718号において記述されている技術を使用して)タンパク質サンプルのプラグを沈殿剤のプラグに融合することによって、結晶化実験は実行される。例えば、第1の保持構成要素および第2の保持構成要素は、T字型の合流地点によって接続され得、それらの内容は第3の保持構成要素の中に押し流される。
【0106】
融合されたプラグを含んでいる構成要素はまた、光、電場、磁場、熱、放射線などのうちの1つ以上にさらされ得ることにより、融合されたプラグに関する(タンパク質の結晶化を含む)反応および様々な研究を行なう。例えば、タンパク質結晶の核形成は、この方法で誘発され得る。例えば、融合されたプラグを含んでいる構成要素は、温度勾配にさらされ得ることにより、反応に関する温度の影響を理解する。最終的に、反応を追跡することおよび温度を操作することによって、反応のアクティブな制御は達成され得る。
【0107】
プラグは選別され得る。例えば、プラグはまた、それらのサイズに従って選別され得る。代替的に、プラグは、搬送流体の密度に対するプラグの密度によって選別され得る。代替的に、一群のプラグが、磁気のある材料、例えば、鉄もしくはコバルトのナノ粒子または鉄を含む流体を含む場合に、プラグはまた、磁場を適用することによって選別され得る。
【0108】
プラグ内の反応は、マイクロフルイディックシステムの構成要素の任意のものにおいてモニタリングされ得るか、またはマイクロフルイディックシステムの構成要素を出た後にモニタリングされ得る。プラグは、蛍光分極、蛍光摂動、蛍光相関分光分析、質量分析などを含む様々な技術を使用してモニタリングされ得る。例えば、結晶はマイクロフルイディックシステムから取り除かれ、x線の回折を用いて分析され得る。プラグはマイクロフルイディックシステムから取り除かれ、質量分析を用いて分析され得る。
【0109】
(プラグ間の距離の制御)
搬送流体が適切に選ばれた場合に、2つのプラグを分離している距離は、流れを用いて制御され得る。図5cにおいて、流れがチャンネルに適用され、その結果、プラグは分離されたままとなる。図5dにおいて、チャンネルを通して流れは生じない;搬送流体が適切に選ばれた場合に、プラグ間の距離は減少し、最終的に、可能である場合には、プラグは融合する。
【0110】
2つのプラグの距離は、様々な方法で減少され得る。例えば、直径が長手方向に沿って増加するチャンネルが使用され得る。プラグがチャンネルの広がりに向けて移動される場合に、プラグ間の距離は減少する。一部の事例において、融合はまた、マイクロチャンネルの直径を増加させることによって促進され得る。なぜならば、プラグがそのようなチャンネルを通って移動すると、プラグは最終的に融合するからである。一部の事例において、障害物、膨張または収縮が導入され得ることにより、プラグの速度を変化させ、かつ、融合を制御する。
【0111】
2つのプラグの距離を減少させる別の方法は、2つのプラグの間の流体を逐次的に取り除くことである。例えば、気泡によって分離された2つのプラグは、プラグのいずれか側に圧力を加えることによって、より近くに移動され得る。マイクロチャンネルの壁が、気体に対して透過性がある場合に、気体は取り除かれ得る。その結果、2つのプラグは互いに近付き、最終的に融合する。ガラスキャピラリーの事例のように、壁が透過性ではない場合に、気体は圧縮され、量が減少し、その結果、2つのプラグの間の距離はさらに減少するが、融合は妨げられる。
【0112】
図7は、プラグ間の距離を変化させるための手段を示す。マイクロチャンネル内の圧力が、側面分岐チャンネル内の圧力よりも高いときに、搬送流体は取り除かれ、プラグ間の距離は減少する(最終的には融合する)。側面分岐チャンネル内の圧力が、マイクロチャンネル内の圧力よりも高いときに、搬送流体は添加され、プラグ間の距離は増加する。この設計を使用して、一方側に搬送流体を取り除く分岐チャンネルと別側に別の搬送流体を添加する分岐チャンネルとを有することによって、搬送流体は取り替えられ得る。
【0113】
さらなる操作(例えば、さらなる反応、処置、融合、および/または選別)が必要とされる場合に、融合されたプラグは、別の保持構成要素または収容構成要素に輸送され得る。
【0114】
(生物学的高分子の結晶化)
マイクロバッチおよび気相拡散は、プラグベースのマイクロフルイディックシステムに対する2つの基本的な結晶化方法である。係属中の米国特許出願第10/765,718号は、プラグベースのマイクロフルイディックシステムにおけるこれらの技術を記述し、本明細書において参照により援用される。
【0115】
本発明を使用して、結晶化のための溶液を含んでいるプラグは、装填構成要素を使用して、保持構成要素の中に装填され得る。組み合わせ構成要素を使用して、目的の高分子の溶液を添加した後、流れが停止されたときに、結晶化試験は収容構成要素内で行われ得る。本発明は、多種多様な表面張力、粘度および湿潤の性質を有する溶液を処理することが可能である。さらに、本発明は、回折によって、結晶の質に関する最小侵襲性の評価を可能にし、同時に、収容構成要素において、処理によって、壊れやすい結晶の損傷を避けることを可能にする。さらに、結晶は収容構成要素から取り除かれ得る。収容構成要素は、切られ得るか、もしくは解体され得ることにより、結晶の除去を可能にするか、または結晶は未処理の収容構成要素の外に流され得る。結晶の除去は、回折データを取得するために、必要に応じた凍結防止および凍結を可能にし得る。
【0116】
収容構成要素における定温放置の間、(限定するわけではないが、光、磁気、および電気を含む)様々な場が適用され得ることにより、核形成を誘発し、結晶の成長を制御する。保持構成要素の環境がまた制御され得ることにより、核形成および結晶の成長を最適化する。収容構成要素は、プラグ流体、搬送流体、およびスペーサの構成要素に対して、ならびに外部の要素に対しても実質的に透過性がない(例えばガラス)ように設計され得る。代替的に、収容構成要素は、プラグ流体、搬送流体、およびスペーサの構成要素のうちの一部、および/または外部の要素に対する透過性を可能にするように設計され得る。そのような透過性が使用され得ることにより、核形成および結晶の成長を制御および最適化する。例えば、(例えば、PDMSで作られた)保持構成要素の壁を通した水の選択的な除去または添加が使用され得ることにより、核形成および成長の割合を制御する。
【0117】
これらの技術は、例えば、マイクロバッチ、気相拡散、および自由界面拡散の結晶化方法の状況において、例えば、スパース行列スクリーニングの方法、勾配スクリーニングの方法、またはハイブリッドスクリーニングの方法に統合され得る。
【0118】
本開示は多くの場合に高分子の結晶化に関するが、これらの方法は、いくつかの高分子、およびそれらの錯体の結晶化および共結晶化に等しく適用可能であるということを理解されたい。
【0119】
結晶化に関して本明細書において記述された本発明のアプリケーションは、高分子の結晶化を例として使用して説明されているが、該アプリケーションは、高分子の結晶化に限定されない。
【0120】
(膜タンパク質の結晶化)
膜タンパク質の構造的特徴付けは、人間の健康に関する重要な問題であるが、構造決定は困難な問題である。膜タンパク質の利用可能性の低さと、スクリーンされる必要のある状態が非常に多いこととが、この問題に寄与しているが、本発明によって克服される。膜タンパク質は、疎水性の膜貫通部分のために、さらなる難題を引き起こし、該膜貫通部分は、一般的には、膜の抽出および結晶化のために洗浄剤の使用を必要とする。表面張力および湿潤が制御される場合でなければ、洗浄剤の存在が、疎水性のマイクロチャンネルの内側の油ベースの搬送流体内で形成された水溶性のプラグの適切な形成を修正し得る。
【0121】
適切な搬送流体は、上記のものを含み得る。パーフルオロアミンの混合物、例えば、パーフルオロ−トリ−n−ブチルアミンおよびパーフルオロ−トリ−n−ジブチルメチルアミン(FC−40およびFC−70化合物としても公知)は、搬送流体として使用され得る。プラグが洗浄剤溶液を使用して形成されるときに、そのような混合物は、プラグの形成にとって有益であることが発見された。これは、洗浄剤溶液内で可溶性にされた膜タンパク質を含むプラグが、本発明を使用して好都合に処理されることを可能にする。代替的に、適切な湿潤および表面張力の特性を有する他の流体が使用され得る。特性、例えば粘度を調整するために、適切な搬送流体の混合物が準備され得る。
【0122】
(結晶化の状態をスクリーニングするためのアプローチ)
スパース行列スクリーニングは、多くの場合に、最適な結晶化状態を見つけるために使用される第1のステップとなる。スパース行列スクリーンは、可能な構成要素の非常に大きい行列と、結晶化を容易にする溶液を備え得る構成要素の濃度とを希薄にサンプルするように設計されている。スパース行列スクリーニングの方法は、必要に応じてスペーサによって分離される、搬送流体内のプラグのアレイを生成することによって実装され得る。そのようなプラグは多様な結晶化の状態を含み得、該結晶化の状態は、沈殿剤のタイプおよび濃度のバリエーション、pHおよびイオンの強度のバリエーション、および添加剤または凍結防止剤のタイプおよび濃度のバリエーションを含む。そのようなプラグのアレイは、本出願の他の箇所において記述されたように生成され得る。好適には、そのようなアレイは、保持構成要素内で装填構成要素によって生成される。スパース行列のアプローチの不利な点は、各試剤または試剤の組み合わせに対して、2〜3の濃度のみがテストされ、最良の結晶化の状態が見過ごされ得るということである。スパース行列スクリーンは、ケミカルスペースの広い領域をサンプルするが、該スクリーンはケミカルスペースを低い密度でサンプルする。
【0123】
勾配スクリーンは、この不利な点を克服するさらなるアプローチである。勾配スクリーンは、様々な結晶化の状態、例えば、溶液構成要素の濃度または溶液のpHをテストするように設計され得る。これらの勾配は、通常、成功の可能性を高くするために、当該分野において公知である様々な状態をテストするか、または他のスクリーニングのアプローチを使用して成功の兆候を示す状態を取り巻く様々な状態をテストするように設計される。勾配スクリーニングは、本出願の別の箇所において記述されたように、本発明によって好都合に実装され得る。勾配スクリーニングのアプローチの不利な点は、勾配スクリーニングが、可能な状態のうちの1つを完全に調査する間に、非常に多くの関係のない状態はテストされないということである。勾配スクリーンは、ケミカルスペースの狭い領域をサンプルするが、該スクリーンは、ケミカルスペースを高い密度でサンプルする。
【0124】
ハイブリッドスクリーニングのアプローチは、スパース行列スクリーンのアプローチおよび勾配スクリーンのアプローチを組み合わせ得る。このアプローチは、可能な結晶化の状態の広範囲のスクリーニングと、成功すると証明されそうな状態のより完全なサンプリングとの両方を可能にする。ハイブリッドスクリーンは、複数の結晶化混合物を有するプラグを含む保持構成要素を使用して実行され得、該保持構成要素において、各混合物は、いくつかのプラグ内においていくつかの濃度で存在する。本発明において記述されたように、プラグの大きいアレイを生成することは、このハイブリッドスクリーニングのアプローチが効果的に使用され、サンプルの消費を最小化して、理想的またはほぼ理想的な結晶化の状態の迅速な識別を容易にすることを可能にする。
【0125】
全てのスクリーニングのアプローチは余分に実装され得、該スクリーニングのアプローチにおいて、実質的に同じいくつかのプラグが各結晶化の状態に対して使用される。一般的には、いったん、最初の保持構成要素が構成され、タンパク質溶液と組み合わせられ、収容構成要素において定温放置することが可能にされると、プラグは結晶化のサインに関して観察される。本発明を使用した第1の実験、または当該分野において公知の他の技術を使用した別個の実験において、(例えば、構造決定のためにはあまりにも小さい結晶の形成の観察、または規則正しい沈殿剤、球顆などの観察によって)結晶化に対して修正可能な最初の状態が決定される場合に、次の保持構成要素は結晶の成長の状態を最適化するように設計され得る。最適化のために次の保持構成要素内に含まれる溶液は、成功の兆候を示す状態を取り巻く様々な状態、およびプラグの第1のアレイにおいて成功することが見られた特性と同じような特性を有する様々な溶液を含み得る。例えば、最初のスクリーンの間に、結晶針が10%のPEG 5000を含むプラグ内で成長することが見られた場合に、結晶の成長を最適化するように設計された次の保持構成要素は、約1%〜約20%のPEG 5000の濃度勾配、および他のPEG、例えば、PEG 2000、PEG 8000、またはPEG−MME 5000の勾配を生成するように設計され得る。必要に応じて、プラグの第1のアレイに含まれない一連の他の結晶化添加剤は、プラグの次のアレイに含まれ得る。プラグの次のアレイは、プラグの第1のアレイを使用した実験における一定の定義された結果を有するタンパク質を用いて使用されるように事前設計され得るか、または第1のアレイを使用した実験における結果としての一定の高分子に基づいてカスタム設計され得る。
【0126】
そのような実験を容易にするために、スパース行列スクリーン試剤を有する保持構成要素、およびスパース行列スクリーンの保持構成要素内に存在する選択された状態に対する細かなスクリーンを含む保持構成要素を含んで、キットは構成され得る。特定の代替的な実施形態において、保持構成要素は、非常に多数の細かなスクリーンを含み得る。しかしながら、このアプローチは、逐次的に、スパーススクリーン保持構成要素を使用し、次に1つ以上の選択された良好なスクリーンの保持構成要素を使用することよりも多くのタンパク質を消費する。
【0127】
コンピュータソフトウェアは、キットの一部分として提供され得る。このソフトウェアは、実験の第1のセットの結果を分析することに役立ち、次に、ユーザが実験の次のセットを設計することに役立つ。必要に応じて、このソフトウェアは、方法のデータベースを含み得、実験の1つのセットの結果を使用して、実験の次のセットを設計するための規則を含み得る。そのようなソフトウェアがまた使用され得ることにより、結晶化される高分子に関する利用可能な情報(例えば、タンパク質の配列ならびに合成および精製の方法)を処理し、結晶化の状態の最初のセットを提示する。ソフトウェアは、実験の次のセットの設計の間にも、この情報を使用し得る。
【0128】
(マイクロバッチ結晶化)
マイクロバッチスクリーニングを実行するために、組み合わせ構成要素が使用されることにより、結晶化試剤を含む保持構成要素内のプラグのアレイに高分子の溶液を融合する。次に、プラグは、定温放置および結晶成長のために、収容構成要素の中に輸送される。使用される高分子の溶液は、プラグのアレイまたは高分子の溶液の継続的な流れであり得る。高分子の溶液のプラグは、本出願の別の箇所に記述されているように生成され得る。
【0129】
(気相拡散結晶化)
本発明は、気相拡散(VD)結晶化を実行するために使用され得る。VD結晶化に対するこのアプローチにおいて、互い違いに続く一対のプラグに関して考えることは有益であり、その場合に、プラグは搬送流体内にあり、必要に応じて、そのような対の一部の間、および/またはプラグの集団の間にスペーサを含む。一実施形態において、プラグの第1のセットは高分子と沈殿剤との溶液を含み、乾燥溶液を含む「空」のプラグ(つまり、高分子が実質的に存在しない)と互い違いになっている。例えば、乾燥溶液は、高分子と沈殿剤との溶液よりも高い濃度で、高分子と沈殿剤との溶液からの沈殿剤を含み得る。定温放置の間、搬送流体が実質的に透水性であるか、またはプラグが透過性のスペーサ、例えば気泡によって分離されるときに、水の分子は、低い浸透性の圧力を有するプラグの第1のセットから高い浸透圧を有する乾燥剤プラグの第2の「空」のセットへと時と共に拡散する。例えば、水は、濃度の低い高分子と沈殿剤とを含む第1のプラグから濃度の高い食塩水に拡散し、その結果、第1のプラグ内の高分子と沈殿剤との濃度を増加させる。この濃度に関する増加は、高分子の結晶化をもたらし得る。しかしながら、この技術による結晶化は、高分子および沈殿剤を含むプラグの濃度が、濃度に関して増加するシナリオに限定されない。例えば、高分子の溶液のイオン強度を低下することにより、高分子が結晶化するときのように、結晶化はまた、高分子を含むプラグ内の濃度の減少によって生じ得る。この変化は代替的な実施形態において達成され得、該代替的な実施形態において、プラグの第2の「空」のセットが、高分子を含むプラグの第1のセットよりも低いイオン強度を有し、その結果、水の分子がプラグの第1のセットの中に拡散し、イオン強度を低下させる。
【0130】
プラグ流体の濃度を変化させることによって、高分子と沈殿剤との様々な溶液は、様々な浸透圧で、溶液を含む「空」のプラグと対にされ得、単一の装置内での複数の結晶化実験の確立を可能にする。水の移送の割合および程度は、浸透圧および各対におけるプラグ間の間隔に関する差を変化させること、ならびに「空」のプラグと高分子を含むプラグとの相対的なサイズによって制御され得る。高分子の結晶化におけるプラグ流体は、通常、水を含むが、プラグ流体は水に限定されないということに留意されたい。「空」のプラグ内の溶液は、好適には、高分子と沈殿剤との溶液の浸透圧とは異なる浸透圧を有する。「空」のプラグはまた、異なる濃度の構成要素を含み得、該構成要素は、「空」のプラグと結晶化プラグとの間に移送され得る。
【0131】
組み合わせ構成要素において、「空」のプラグの互い違いのセットを作成するために、高分子の溶液の流れは沈殿剤プラグと選択的に融合するが、プラグの第2のセットと融合しないことが好ましい。上記のように、沈殿剤プラグと高分子の流れとの選択的な融合は、相対的な表面張力および/または「空」のプラグおよび沈殿剤プラグの内側の粘度の操作を通じて可能であり、かつ、組み合わせ構成要素の形状に基づいている。このシステムは、本出願の他の箇所で記述したように、二次汚染を伴うことなく確かな融合を提供し得る。沈殿剤プラグと乾燥剤プラグとの対の準備は、装填構成要素によって生成され得、プラグの間隔およびスペーサの存在または不在を制御し、本出願の別の箇所で記述したように保持構成要素の中に装填される。次に、高分子の溶液は、組み合わせ構成要素を使用して沈殿剤構成要素と選択的に融合され、次に、収容構成要素において定温放置され得る。
【0132】
気相拡散結晶化のこの記述は、高分子を有するプラグの1つのセットおよびプラグの第2の「空」のセットを含み、プラグの第2のセットが「空」でなく、代わりにまた高分子を含んだ場合であっても、本方法は動作可能であるであるということに留意されたい。しかしながら、本明細書において記述された選択的融合技術は、より少ない量のタンパク質の使用を可能にする。
【0133】
(自由界面拡散結晶化)
自由界面拡散は、充分に規則正しい結晶を生成する可能性を有する。本発明はまた、自由界面拡散(FID)結晶化を実行するために使用され得る。FID方法によって高分子を結晶化するために、高分子の溶液の貯水溝は、沈殿剤溶液の貯水溝と接触させなければならず、その結果、自立界面が形成される。試剤は、好適には、単純な拡散によって混合され、対流が、好適には、最小化される。界面において、グラスホフ数、つまり、浮力に対する対流の割合を最小化することによって、対流は最小化され得る。さらに、対流は、液体間界面および液体と固体との界面において、表面張力の勾配を減少することによって最小化され得る。
【0134】
本発明は、2つのプラグ間に自由界面を形成するためのマイクロフルイディック方法を包含する。2つのプラグは、マイクロチャンネル装置内に、好適には収容構成要素内に共にもたらされ、その結果、2つのプラグは、非混和性の搬送流体および/またはスペーサによって部分的に分離される。プラグは非混和性の流体が存在しない地点において接触することを可能にされ、それにより自立界面か確立され、流体および試剤がプラグ間で拡散する。一部の実施形態において、プラグ間の接触は親水性のマイクロチャンネルにおいて生じ、該マイクロチャンネルにおいて、プラグ流体は壁を湿潤し、2つのプラグの内容を接触させ、試剤が薄い流体の界面を通じて混合することを可能にする。スペーサまたは多量の搬送流体が使用され得ることにより、この界面を束縛する。他の実施形態において、プラグ流体は薄いフィラメントを湿潤し得、界面を確立する。
【0135】
プラグの間隔を制御する方法およびプラグ流体によるマイクロチャンネルの湿潤の制御が以下に述べられる。
【0136】
(VDおよびFID結晶化におけるプラグ操作)
FIDおよびVDの両方において、プラグ間の間隔および湿潤現象は、プラグが形成されたチャンネルとは別個のチャンネルにおいてプラグを残すことによって同時に制御され得る。一実施形態において、第1に、任意の間隔を有するプラグの任意の配列が、第1のマイクロフルイディック装置において形成され、該マイクロフルイディック装置においては、プラグはチャンネルの壁を湿潤しない。第1の装置の出口は、第1の装置を含むことに充分な大きさの内径を有する第2の装置の中に置かれる。第1および第2のマイクロフルイディック装置は互いに移され(例えば、第1のマイクロフルイディック装置が第2のマイクロフルイディック装置から引き出される)、同時に、プラグが第1のマイクロフルイディック装置の出口の外に移され、プラグは第2のマイクロフルイディック装置の中に続けて残される。第2のマイクロフルイディック装置の表面は処置され、その結果、プラグ流体は、第2の装置を湿潤し、界面を形成することを可能にされる。プラグが残される割合と、2つの装置が互いに移動される割合とは、プラグ間の間隔を決定し、ユーザがこの間隔を任意に制御することを可能にする。
【0137】
さらに、第2のマイクロフルイディック装置は変更され得、その結果、湿潤が正確に制御される。親水性のパッチおよび疎水性のパッチ(または表面エネルギーの変動性を可能にし、プラグ流体および搬送流体の湿潤特性を制御し得るパッチ)は、チャンネルの壁の内側に直接的にパターン付けされ得、その結果、プラグは限られた領域において湿潤するのみである。これらのパッチは、マスクされ得、外部または内部の誘因、例えば、温度変化、または光の照射、またはプラグ流体または搬送流体内の特定の構成要素の存在によって作動され得る。また、フィラメント、ワイヤ、または他の表面が、同様なパターン付けを有するマイクロフルイディック装置の中に挿入され得ることにより、壁の代わりにフィラメントまたはワイヤの長手方向に沿ってのみ湿潤を導く。第2のマイクロフルイディック装置が、ガラスまたは別の流体に対して透過性のない材料から構築された場合に、第2のマイクロフルイディック装置は搬送流体および試剤流体の蒸発を防止する。
【0138】
マイクロチャンネルの表面が準備され、その結果、湿潤が可能でない場合に、プラグは離れた距離を維持する(図5aを参照)。プラグ流体による湿潤が可能である場合に、プラグ流体は接触する(図5bを参照)。マイクロチャンネルの表面は、異なる湿潤特性を有し得る。例えば、マイクロチャンネルの一部分は疎水性であり得る。水溶性のプラグが使用されるときに、この疎水性の表面が湿潤を防止する。マイクロチャンネルの別の部分が、(表面においてか、または疎水性のファイバの存在のために)親水性である場合に、互い違いのプラグのプラグ流体は相互拡散される。なぜならば、親水性の表面は湿潤を促進するからである。代替的に、マイクロフルイディック装置の内面の湿潤は、光スイッチ可能な単分子層を適用することによって制御され得る。最初に、単分子層は湿潤を防止する(図5eを参照)が、光を用いて作動されたときには、湿潤を促進する(図5fを参照)。
【0139】
2つのプラグを1つにして、自立界面を形成するための方法のいくつかのさらなる例が図5に示されている。プラグがチャンネルの壁を湿潤することを防止する状態の下で、試剤溶液のプラグは、最初に、チャンネル内で形成される(図5a)。次に、状態が変化され、その結果、プラグは壁を湿潤する(図5b)。プラグが充分に近くにある場合に、湿潤現象は、プラグ流体が互いに接触することを可能にする。例えば、水溶性のプラグは、親水性のチャンネルの中に輸送され得るが、搬送流体の薄い層は、流れが維持されている間に、そのプラグが湿潤することを防止する(図5c)。流れが止まったときに、搬送流体の薄い層は分散し、プラグ流体が壁を湿潤することを可能にする(図5d)。別の例として、マイクロチャンネルの壁は、光スイッチ可能な単分子層を用いて処置され得、該単分子層は、最初に疎水性の特性を現す(図5e)が、次に、特定の波長の光に曝露すると親水性の特性を現す(図5f)。
【0140】
さらなる例において、マイクロフルイディックシステムは、全体的または部分的に、熱応答性の材料から形成され得る。粗いシリコン基質でコーティングされたポリ(N−イソプロピルアクリルアミド)を有する合成材料は、低い気温においては親水性であり(〜0°の水の接触角度)、高い気温においては疎水性である(〜150°の水の接触角度)。親水性/疎水性の転移温度は29℃〜40℃の間であり、プロセスは数分以内で行なわれる。高分子はこれらの温度において変性するが、熱応答性のファイバを有する疎水性のマイクロチャンネルを40℃を上回る温度に加熱し、それを25℃(または18℃または4℃)まで素早く冷却し、転移が生じる前に、高分子のプラグおよび沈殿剤のプラグをマイクロチャンネルの中に注入することは可能である。数分後、ファイバは親水性になり、液体のブリッジは高分子と沈殿剤との間で形成し、拡散が生じることを可能にする。
【0141】
(X線結晶学)
収容構成要素内のプラグ内で成長した結晶の質は、最初の母溶剤における室温または他の所望の温度(例えば、結晶が成長する温度)での回折によって、直接的に評価され得る(図8)。一部の実施形態において、構造情報は、1つの結晶、または同じプラグ内もしくは異なるプラグ内のいずれかのいくつかの結晶のいずれかから取得され得る。代替的に、キャピラリーの内側のプラグ内で形成する結晶は、容易に抽出、凍結防止、凍結、および回折され得る。結晶は液体間界面において成長され得るので、結晶は固体の表面から擦り取る必要はなく、損傷を最小化する。
【0142】
図3は、マイクロフルイディック装置1を図示し、該装置において、搬送流体6によって分離された様々な沈殿剤プラグ7が、搬送流体によって分離された高分子のプラグ13と融合される。沈殿剤のプラグは、一般的には、様々な濃度の沈殿剤を有する。次に、融合されたプラグ10は下流のチャンネルを通って流れ、該下流のチャンネルにおいて、プラグはさらに操作、モニタリング、制御などをされ得る。沈殿剤のプラグおよび高分子のプラグを分離するために使用される搬送流体6は、同じであり得るかまたは異なり得る。図4cは、タンパク質の流れを一連のプラグに融合する例を図示する。
【0143】
(プラグのアレイを提供する方法)
本発明はまた、保持構成要素内のプラグのアレイ提供する方法を顧客に提供し、該方法は、試剤流体、搬送流体およびプラグ流体の一覧表をオファーするステップと、顧客から所望の試剤のサブセット、所望の搬送流体および所望のプラグ流体を収容するステップと、保持構成要素内でプラグのアレイを形成するステップであって、該保持構成要素において、プラグは搬送流体を用いて互いに分離され、各プラグは所望の試剤のサブセットの要素を含む、ステップと、保持構成要素を顧客に送達するステップとを包含している。該方法は、所望の試剤のサブセットに対する評価を計算することをさらに包含し得る。
【0144】
方法は、所望の構成のプラグのアレイを事前に製作し、これらのアレイを格納し、それらを顧客に提供することを含み得る。
【0145】
顧客はまた、装填構成要素、および一連の保持構成要素、組み合わせ構成要素、および収容構成要素を備えたキットを提供され得る。構成要素は完全な調和流体接続を有し得るか、もしくは分離接続が使用され得ることにより、構成要素を結合するか、またはその両方である。顧客はこれらのキットを利用し得ることにより、所望の構成のプラグのアレイを生成する。顧客専用の試剤と顧客専用ではない試剤との両方が使用され得る。
【0146】
試剤、搬送流体、およびプラグ流体の一覧表は、紙または電子のいずれかの形式において、カタログとしてオファーされ得る(一部の実施形態において、インターネットを介してアクセス可能である)。適切な試剤、搬送流体およびプラグ流体が、本開示の全体を通して記述される。タンパク質の結晶化に関しては、試剤は、結晶の形成のためにスクリーンするために使用される任意の化合物を含み得る。例えば、試剤は、沈殿剤、添加剤、凍結防止剤、緩衝材などを含み得る。
【0147】
例えば、タンパク質の結晶化に対する試剤およびキットに関する会社および製品のリストは、
http://www.structmed.cimr.cam.ac.uk/Course/Crystals/screening.html.に記述されている。
【0148】
この方法において、顧客は、保持構成要素内のプラグのアレイの様々な特徴:例えば、一つ以上の沈殿剤、搬送流体、プラグ流体、プラグ流体のpH、添加剤、凍結防止剤などを選択する。
【0149】
膜タンパク質および他の高分子に関しては、プラグ流体は脂質立法相であり得る(例えば、Landau、E.M.およびRosenbusch、J.P.Lipidic cubic phases:A novel concept for the crystallization of membrane proteins.Proceedings of the National Academy of Sciences
of the United States of America93、14532〜14535(1996)ならびにNollert、Methods.34(3):348〜53(2004年11月)を参照)。
【0150】
沈殿剤として使用され得る塩類の非排他的なリストは以下の通りである:酒石酸塩(Li、Na、K、Na/K、NH4);燐酸塩(Li、Na、K、Na/K、NH4);酢酸塩(Li、Na、K、Na/K、Mg、Ca、Zn、NH4);蟻酸塩(Li、Na、K、Na/K、Mg、NH4);クエン酸塩(Li、Na、K、Na/K、NH4);塩化物(Li、Na、K、Na/K、Mg、Ca、Zn、Mn、Cs、Rb、NH4);硫酸塩(Li、Na、K、Na/K、NH4)、マレイン酸塩(Li、Na、K、Na/K、NH4);グルタミン酸塩(Li、Na、K、Na/K、NH4);テトラアリールホウ酸塩(Li、Na、K、Na/K、NH4)。
【0151】
沈殿剤として使用され得る有機材料の非排他的なリストは以下の通りである:PEG 400;PEG 1000;PEG 1500;PEG 2K;PEG 3350;PEG 4K;PEG 6K;PEG 8K;PEG 10K;PEG 20K;PEG−MME 550;PEG−MME 750;PEG−MME 2K;PEGMME 5K;PEG−DME 2K;ジオキサン;メタノール;エタノール;2−ブタノール;n−ブタノール;t−ブタノール;ジェファミンM−600;イソプロパノール;2−メチル−2、4−ペンタンジオール;1,6−ヘキサンジオール。
【0152】
溶液のpHは緩衝材を含むことによって変化され得る;生物学的材料に対するpHの一般的な範囲は、概ね3〜10.5の間の値であり、緩衝剤の濃度は、概して0.01から0.25Mまでの間の値である。この書類において記述されているマイクロフルイディック装置は、広い範囲のpH値、特に生物学的標的に適した値に容易に適合性がある。
【0153】
本発明に従って使用され得る可能な緩衝剤の非排他的なリストは以下の通りである:酢酸ナトリウム;HEPES;カコジル酸ナトリウム;琥珀酸ナトリウム;燐酸ナトリウムカリウム;TRIS;マレイン酸TRIS;マレイン酸イミダゾール;ビストリスプロパン;CAPSO、CHAPS、MES、およびイミダゾール。
【0154】
添加剤は、標的の溶解性および/または活性行動に影響する小分子である。そのような化合物は、結晶化スクリーニングを加速し得るか、または標的の互い違いの結晶形式または多形体を生成し得る。添加剤は、化学物質の考えられるほぼ全ての形式を取り得るが、一般的には、単一および多価の塩類(無機または有機)、酵素リガンド(基板、生成物、アロステリックなエフェクタ)、化学物質架橋剤、洗浄剤および/または脂質、重金属、有機金属化合物、ごくわずかな量の沈殿剤、および分子量小型有機物。
【0155】
以下は本発明に従って使用され得る添加剤の非排他的なリストである:2−ブタノール、DMSO、ヘキサンジオール、エタノール、メタノール、イソプロピルアルコール、フッ化ナトウム、フッ化カリウム、フッ化アンモニウム、無水塩化リチウム、塩化マグネシウム6水化物、塩化ナトリウム、塩化カルシウム二水和物、塩化カリウム、塩化アンモニウム、ヨウ化ナトリウム、ヨウ化カリウム、ヨウ化アンモニウム、チオシアン酸ナトリウム、チオシアン酸カリウム、リチウム硝酸塩、マグネシウム硝エステル6水化物、硝酸ナトリウム、硝酸カリウム、硝酸アンモニウム、ギ酸マグネシウム、ギ酸ナトリウム、ギ酸カリウム、ギ酸アンモニウム、リチウム酢酸エステル二水和物、マグネシウム酢酸エステル四水和物、酢酸亜鉛二水和物、酢酸ナトリウム三水和物、酢酸カルシウム水和物、酢酸カリウム、酢酸アンモニウム、リチウム硫酸塩一水化物、リチウム硫酸エステル7水化物、硫酸ナトリウム十水塩、硫酸カリウム、硫酸アンモニウム、酒石酸塩二水和物2ナトリウム、酒石酸ナトリウムカリウム四水和物、酒石酸2アンモニウム、リン酸二水素ナトリウム一水化物、水素リン酸エステル2ナトリウム二水和物、カリウム二水素リン酸塩、水素リン酸エステル2カリウム、燐酸二水素アンモニウム、塩基水素リン酸エステル2アンモニウム、クエン酸3リチウム四水和物、クエン酸3ナトリウム二四水和物、クエン酸3カリウム一水化物、クエン酸水素2アンモニウム、塩化バリウム、塩化カドミウム二水和物、塩化カドミウム二水和物、塩化第二銅二水和物、塩化ストロンチウム6水化物、イットリウム塩化物6水化物、エチレングリコール、無水グリセリン、1,6ヘキサンジオール、MPD、ポリエチレングリコール400、トリメチルアミンHCI、グアニジンHCI、尿素、1,2,3−ヘプタントリオール,ベンズアミジンHCI、ジオキサン、エタ
ノール、イソプロパノール、メタノール、ヨウ化ナトリウム、L−システイン、EDTAナトリウム塩、NAD、ATPジナトリウム塩、D(+)−グルコース一水化物、D(+)−スクロース、キシリトール、スペルミジン、スペルミン4HCI、6−アミノカプロン酸、1,5−2アミノペンタン2HCl、1,6−2アミノヘクサン、1,8−アミノオクタン、グリシン、グリシル・グリシル・グリシン、ヘキサミンコバルト三塩化物、タウリン、ベタイン一水化物、ポリビニルピロリドンK15、非洗浄性スルホベタイン195、非洗浄性スルホベタイン201、フェノール、DMSO、硫酸デキストランナトリウム塩、ジェファミンM−600、2、5つのヘキサンジオール、(+/−)−1,3ブタンジオール、ポリプロピレングリコールP400、1,4ブタンジオール、三次ブタノール、1,3プロパンジオール、アセトニトリル、ガンマ・ブチロラクトン、プロパノール、酢酸エチル、アセトン、ジクロロメタン、n−ブタノール、2,2,2トリフルオロエタノール、DTT、TCEP、ノナエチレングリコールモノドデシルエーテル、ノナエチレングリコールモノラウリルエーテル、ポリオキシエチレン(9)エチル、オクタエチレングリコールモノドデシルエーテル(オクタエチレングリコールモノラウリルエーテル)、ポリオキシエチレン(8)ラウリルエーテル、ドデシル−β−Dマルトピラノシド、ラウリン酸スクロースエステル、シクロヘキシルペンチル−β−Dマルトース配糖体、ノナエチレングリコールオクチルフェノールエーテル、N,N−bis(3−D−グルコン酸アミドプロピル−デオキシコール酸アミン、デシル−β−Dマルトピラノシド、ラウリルジメチルアミン酸化物、シクロヘキシルペンチル基−β−Dマルトース配糖体、ra−ドデシルスルホベタイン3−(ドデシルジメチルアンモニア)プロパン−l−スルフォナート)、ノニル−β−D−グルコピラノシド、オクチル−β−D−チオグルコピラノシド,OSG、N,N−ジメチルデシルアミン−β−酸化物、メチl0−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド、スクロースモノカプロイル基、n−オクタノイル−β−D−フルクトフラノシル−α−D−グルコピラノシド、ヘプチル基−β−D−チオグルコピラノシド、オクチル−β−D−グルコピラノシド,OG、シクロヘキシルプロピル
基−β−D−マルトース配糖体、シクロヘキシルブタノイル−N−ヒドロキシエチルグルクアミド、n−デシルスルホベタイン:3−(デシルジメチルアンモニウム)プロパン-1スルフォナート、オクタノイル−N−メチルグルカミン,OMEGA、ヘキシル−β−D
−グルコピラノシド、Brij 35、Brij 58、トリトンX−114、トリトンX−305、トリトンX−405、トゥイーン20、トゥイーン80、ポリオキシエチレン(6)デシルエーテル、ポリオキシエチレン(9)デシルエーテル、ポリオキシエチレン(10)ドデシルエーテル、ポリオキシエチレン(8)トリデシルエーテル、デカノイル−N−ヒドロキシエチルグルカミン、ペンタエチレングリコールモノオクチルエーテル、3−[(3−コールアミドプロピル)−ジメチルアンモニウム]−l−プロパンスルフ
ォナート、3−[(3−コールアミドプロピル)−ジメチルアンモニウム]ヒドロキシ−
1−プロパンスルフォナート、シクロヘキシルペンタノイル−N−ヒドロキシエチルグルクアミド、ノナノイル−N−ヒドロキシエチルグルクアミド、シクロヘキシルプロパノール−N−ヒドロキシエチルグルクアミド、オクタノイル−N−ヒドロキシエチルグルクアミド、シクロヘキシルエタノイル−N−ヒドロキシエチルグルクアミド、ベンジルジメチルドデシル臭化アンモニウム、n−ヘキサデシル−β−Dマルトピラノシド、n−テトラデシル−β−Dマルトピラノシド、n−トリデシル−β−Dマルトピラノシド、ドデシルポリ(エチレングリコエーテル)、n−テトラデシル−N,N−ジメチルアンモニウム−1−プロパンスルフォナート、n−アンデシル−β−Dマルトピラノシド、n−デシルD−チオマルトピラノシド、n−ドデシルホスホコリン、α−D−グルコピラノシド,β−D
−フルクトフラノシルモノデカン酸エステル(スクロースモノカプリン酸塩)、1−s−ノニル−β−D−チオグルコピラノシド、n−ノニル−β−D−チオマルトイラノシド、N−ドデシル−N,N−(ジメチルアンモニオ)−酪酸塩、n−ノニル−β−D−マルトピラノシド、シクロヘキシルブチルD−マルトース配糖体、n−オクチル−β−D−チオマルトピラノシド、n−デシルホスホコリン、n−ノニルホスホコリン、ノナノイルN−メチルグルカミン、1−s−ヘプチル基−β−D−チオグルコピラノシド、n−オクチルホスホコリン、シクロヘキシルエチルDマルトース配糖体、n−オクチル−N,N-ジメ
チルアンモニウム−l−プロパンスルフォナート、シクロヘキシル・メチル−β−D-マ
ルトース配糖体。
【0156】
凍結剤とは、結晶が氷ではなくむしろ硝子体ガラスに埋め込まれるように、液体窒素、液体プロパン、液体エタン、または窒素ガスもしくはヘリウム(全て約100−120°K)などの起寒剤の瞬間冷凍において、標的結晶を安定させる試剤である。いかなる分量の塩類または分子量小型有機化合物は凍結防止剤として使用され得る。一般的には、限定するわけではないが、MPD、PEG−400(および両方のPEG誘導体およびより高
分子量のPEG化合物)、グリセリン、糖(キシリトール、ソルビトール、エリトリトール、スクロース、グルコースなど)、エチレングリコール、アルコール(短鎖と超鎖との両方、揮発性と不揮発性との両方)、LiOAc、LiCl、LiCHO2、LiNO3、Li2SO4、Mg(OAc)2、NaCl、NaCHO2、NaNO3などを含む。また、本発明に従ったマイクロフルイディック装置が製作される材料は、このような一連の化合物と適合性をもち得る。
【0157】
化学物質の変動性に加えて、結晶化スクリーニングの間に、多数の他のパラメータが変化され得る。そのようなパラメータは、限定するわけではないが、(1)結晶化試験回数、(2)標的溶液と結晶化溶液の比率、(3)標的濃度、(4)標的の二次的小型分子または高分子との共結晶化、(5)水和、(6)接触面、(7)分子を標的とする修正などを含む。
【0158】
アプリケーション(4)共結晶化に関しては、アレイは、ケミカルスペースの一部分をスパンする小分子のサブセットを表し得る。代替的に、アレイは、ゲノムまたはゲノムの一部分をスパンしているオリゴヌクレオチドのサブセットを表し得る。
【0159】
(他のアプリケーション)
本発明は任意の実験において使用され、該実験において、多種多様な反応が平行して行われ得る。例えば、96−、384−、または1536−ウェルプレートにおいて、現在、一般的に適用される任意のアプリケーションである。本発明において記述されたような保持構成要素は、これらのアプリケーションの任意のもののために準備され得る。
【0160】
そのようなアプリケーションの1つは、コンビナトリアルケミストリである。構成要素内での組み合わせの後に、第2の試剤または試剤のセットと反応させられる様々な試剤を含む保持構成要素が準備され得る。これらの試剤は溶液の中に存在することに限定されず、ビーズまたは他の形式でも存在し得る。コンビナトリアルケミストリの一般的なアプリケーションは、薬学的または農学的作用のためにテストされる様々な化合物の合成を含む。別のアプリケーションは、様々な無機、有機、または有機金属の触媒の合成である。例えば、保持構成要素は、金属に対する多数の異なる潜在的なリガンドを含み得、組み合わせ構成要素内の金属または様々な金属との組み合わせの後に、リガンドは、金属または複数の金属と反応することを可能にされることにより、潜在的な触媒を含むプラグのアレイを提供する。続いて、プラグは、第2の組み合わせ構成要素内でテスト試剤と組み合わせられ得ることにより、触媒が触媒作用ためにテストされることを可能にする。第2の試剤と組み合わされた後か、または試剤が送られ、反応することを可能にされた後に、最終的な生成物がケミカルスペースの所望の領域をスパンするように、保持構成要素内のコンビナトリアルケミストリ試剤は選択される。さらに、保持構成要素内のプラグは、懸濁液内に試剤を含み得る。これは、安定性を増加させること、または溶解性が制限されるときに有益であり得る。保持構成要素はまた、安定性を増加させるために凍結され得る。
【0161】
別のアプリケーションは、所望の特性に対する化合物の様々なライブラリのスクリーニングであり、多くの場合に「ハイスループットスクリーニング」と呼ばれている。例えば、触媒が特定の反応を実行して物質Aを物質Bに変換することを必要とされる場合に、多数の潜在的な触媒は、保持構成要素の中に装填され、物質Aと組み合わせられ、反応することを可能にし得、その結果、収容構成要素内にその結果として生じるプラグは、物質Bの存在に関してモニタリングされ得る。この例において、触媒は、無機、有機金属、有機、酵素、または核酸で構成されたものであり得る。代替的に、保持構成要素は、潜在的な触媒の作用をテストするために、反応原系の様々なセットを含み得る。組み合わせ構成要素において、反応原系のセットは、潜在的な触媒に組み合わせられ、収容構成要素内で反応することを可能にされる。次に、反応の進行は、例えば、紫外可視分光分析、蛍光分析、または質量分析によってモニタリングされ、触媒の反応性を決定する。
【0162】
同様に、化合物の様々なセットまたは「ライブラリ」は、保持構成要素内にロードされ得ることにより、所望の生物学的作用、例えば、薬学的または農学的化合物の使用に関してテストされる。一般的なライブラリの例は、Sigma−Aldrich and PhytoMyco Research Corporationによってオファーされている10,000を超える植物および微生物抽出物のセットと、Sigma−Aldrichによってオファーされているthe Library of Pharmacologically−Active Compound(Product No.LO1280)と、the Aldrich Library of Rare Chemicalsからの化合物とを含む。他の例は、Nanosyn,Inc.によってオファーされているPharma Library Collectionを含み、該Pharma Library Collectionは、公知の特性およびまたもNanosyn,Inc.からのExplore Library Collectionに基づいて、薬剤となる可能性のあるもののために事前に選択された化合物を含み、該Explore Library Collectionは、より反応性のある化合物を含む。他の例は、Nikem ResearchによるDouble Diversity arraysを含み、該Double Diversity arraysは、単一の反応官能基を含むことにより、顧客専用の化合物およびNickem’s coMerge arraysの吸着を可能にする。
【0163】
化合物ライブラリの他の使用および例は、米国特許第6、740、506号において記述され、該特許は本明細書において参照により援用される。さらに、保持構成要素は、米国特許第6、740、506号において記述されたもののような定方向進化を介して合成されたライブラリを備え得る。
【0164】
同様に、保持構成要素は、様々な生体分子を含み得る。例えば、以下で実施例10において記述されるように、保持構成要素は、単一の基質または1セットの基質に対する結合またはそれらとの反応に関してテストをするために、タンパク質の様々なセットを備え得る。タンパク質ライブラリの例は、Tsujiら、Nucleic Acids Research29(20):e97(2001)において記述されている。保持構成要素はまた、ゲノムによって表わされたタンパク質のライブラリを備え得る。同様に、保持構成要素はまた、オリゴペプチドまたはオリゴ糖もしくは多糖を含み得る。代替的に、保持構成要素は、核酸、例えばDNAまたはRNAを含み得る。
【0165】
実施形態の1つのセットにおいて、保持構成要素は、動物、菌類、古細菌、バクテリア、植物、哺乳類、人間などを含む任意の生物の完全なゲノムに由来する生体分子のセットを含み得、該生体分子のセットは、当該分野において公知の方法によって配列されている。保持構成要素は、生物の全ゲノムまたはゲノムのサブセットを表わす生体分子を含み得る。例えば、保持構成要素は、生物のゲノムを表す核酸を含み得る。核酸は、RNA、DNA、cDNA、またはESTクローンであり得る。1つの例としては、Matrix Technologiesによって販売されているthe ez−raysTMhuman Oligonucleotide Libraryであり、該ライブラリは、15,000を超える人間のmRNA配列を標的とした50−merDNAプローブおよび制御プローブを含む。
【0166】
実施形態の別のセットにおいて、保持構成要素は生きている細胞を含み得る。例えば、細胞の有益なセットは、生物の欠失変異体の多様なセットを含む欠失ライブラリを含む。例えば、Saccharomyces Genome Deletion Project(Giaeverら、Nature.418(6896):387−91(2002))によって生成された欠失ライブラリである。他の有益な細胞収集は、例えば、Invitrogen CorporationによってオファーされているようなESTクローン、BACクローン、ORFクローンおよびPACクローンのセットを含む。別の実施形態において、単一のタイプの細胞が、複数の試剤と組み合わせるために保持構成要素内でオファーされる。例えば、O’Connorら、Cytometry A.63(1):48〜58(2005)において記述されたもののような肝細胞は、保持構成要素内で装填され、次に、組み合わせ構成要素内で、様々な潜在的な薬と組み合され得る。細胞の活性または変動性に対する続けてのモニタリングは、肝臓の毒性に関してテストするために使用され得る。代替的に、O’Connorら、Cytometry A.63(1):48〜58(2005)においてまた記述された特定生物型群を表す様々な細胞系は、保持構成要素の中に装填され得る。
【0167】
ハイスループットスクリーニングまたはコンビナトリアルケミストリのいずれかのアプリケーションに関しては、数千もの化合物の全ライブラリが、単一の保持構成要素内でオファーされ得る。代替的に、タンパク質の結晶化に関して上記されたように、全ライブラリのスパースサブセットが、単一の保持構成要素内でオファーされ得、次に、ケミカルスペースの特定の領域が所望の特性を有することが見つけられた後に、全ライブラリのより細かいサブセットが使用のためにオファーされ得る。
【0168】
実施形態の別のセットにおいて、保持構成要素は、診断および検出のために使用され得る。限定ではない例として、医療的診断、獣医的診断、作物と動物と農産物とのテスト、および水質と大気とのテストを含む環境テストを含む。好適には、保持構成要素は、複数のテスト、および/または同じテストの複数の写しを含む。保持構成要素はまた対照実験を含み得る。
【0169】
本発明の一部の実施形態において、物質のスパースライブラリを含む特定の保持構成要素を使用した最初のテストの後に、第2のカスタムの保持構成要素が準備され得、最初のテストにおいて見つけられた「ヒット」に特性の近い(ケミカルスペースにおいて近くにある)物質を含む。このプロセスは無期限に反復され得る。
【実施例】
【0170】
以下の実施例において、ガラスキャピラリーはシラン処理され、それらは疎水性となった。
【0171】
(実施例1:μLを下回る量の溶液をマイクロフルイディック装置の中への損失を伴わない注入。)
10μLのシリンジおよびテフロン(登録商標)パイプの一部がパーフルオロアミンで満たされ、(1μLを下回る)少量の膜タンパク質溶液の吸引が続いた。パーフルオロアミンの搬送流体はテフロン(登録商標)パイプを優先的に湿潤するので、該搬送流体はタンパク質とテフロン(登録商標)との間で薄い層を形成し、タンパク質溶液のパイプの壁への付着を防止し、マイクロフルイディック装置の中への損失のない完全な分配を可能にした。
【0172】
(実施例2:保持構成要素内で、異なる組成物のプラグのアレイを形成すること。)
この実験において、異なる組成物を含むプラグのアレイが、テフロン(登録商標)パイプまたはガラスキャピラリーにおいて生成された。テフロン(登録商標)パイプの一部(OD:760μm、ID:305μm)が5μLのシリンジ(Hamilton)の針に取り付けられた。より小さい直径(OD:250μm、ID:200μm)を有する別のテフロン(登録商標)パイプが、大きいテフロン(登録商標)パイプに取り付けられ、エポキシ樹脂または蝋のいずれかによって密閉された。油(50:1のFC−3283/PFO)は、パイプおよびシリンジに吸引された。パイプは、組成物Aの水溶液(溶液A)の中に沈められ、プランジャが後ろに引かれて少量(0.1〜0.5μL)の溶液Aを吸引した。次に、パイプが油の中に沈められ、同じ量の油がパイプの中に吸引された。この2つのステップの吸引プロセスが、溶液B、C、…に対して繰り返されることにより、全ての溶液が使用され、組成物A、B、…のプラグのアレイがテフロン(登録商標)パイプの内側で形成された。
【0173】
ガラスキャピラリー内でそのようなプラグのアレイを形成するために、テフロン(登録商標)パイプが、(OD200μm、ID180μm、一端に漏斗状の約2mmの幅の間隔を有する)Hampton Research glass capillaryの幅の広い端の中に挿入された。全システム(シリンジ、テフロン(登録商標)パイプおよびキャピラリー)が油で満たされた後に、等量の溶液A、油、溶液B、油…は、上記のような同じ手順に従ってキャピラリーの中に吸引された。
【0174】
プラグのアレイが、テフロン(登録商標)パイプの内側で形成されたときには、テフロン(登録商標)パイプは切り離され、内側の液体を用いて凍結された。凍結プロセスは、テフロン(登録商標)を通した浸透による液体の損失を防止し、それによりプラグの長期間の格納に役立つ。プラグのアレイが、ガラスキャピラリーの内側で形成されたときには、キャピラリーはテフロン(登録商標)パイプから取り除かれ、蝋を用いて密閉された。この方法で、プラグは長期間(6ヶ月を超えて)格納され得る。
【0175】
(実施例3:プラグのアレイをPDMSマイクロチャンネルの中に輸送すること。)
この実験において、テフロン(登録商標)パイプまたはガラスキャピラリー(保持構成要素)の内側に格納されたプラグのアレイは、PDMSマイクロチャンネル(収容構成要素)の中に輸送された。
【0176】
3つの異なる型が使用された。第1の型において、PDMSマイクロチャンネルの入口は、Hampton researchから取得したガラスキャピラリーに結合された。このキャピラリーはアダプタとして使用され、そのキャピラリーは漏斗の形状を有していた。キャピラリーの小さい端は、PDMSマイクロチャンネルの中に挿入され、キャピラリーとPDMSマイクロチャンネルの壁との間のギャップは、半硬化PDMSで満たされた。110℃で5分間の定温放置の後に、半硬化PDMSは凝固され、合流地点は漏洩耐性となった。内側にプラグのアレイを有するキャピラリーは、アダプタキャピラリーのより大きい端にしっかりと挿入された。接続部はどのような密閉材も用いることなく漏洩耐性となった。セットアップ全体を傾けることによって、重力が、プラグのアレイをPDMSマイクロチャンネルの中に引き込んだ。代替的に、シリンジを使用して、アレイを含んでいるキャピラリーのオープンエンド上に圧力を適用することによって、プラグの輸送は達成され得る。
【0177】
第2の構成において、PDMSマイクロチャンネルの入口は、小さいテフロン(登録商標)パイプ(OD:250μm、ID:200μm)に結合された。合流地点は、第1の型において記述された同じ方法(半硬化PDMSを用いて)で漏洩耐性にされた。次に、テフロン(登録商標)パイプの自由端は、プラグのアレイを保持したガラスキャピラリーの大きい端の中に挿入された。さらに、シリンジによって加えられたガラスキャピラリーの小さい端上の重力または圧力は、PDMSマイクロチャンネルの中にプラグのアレイを移送するように加えられた。
【0178】
第3の型において、最初に、プラグのアレイは、上記のような同じセットアップにおいてシリンジに接続されたテフロン(登録商標)パイプの小さい部分の中に輸送された。次に、内側にプラグのアレイを有する小さいテフロン(登録商標)パイプは、キャピラリー結合器の中に挿入された。シリンジを通じて圧力を加えることによって、プラグのアレイは、PDMSマイクロチャンネルの中に押され得る。
【0179】
プラグの流れは、プラグをマイクロチャンネルの中に押すシリンジによって制御され得る。代替的に、プラグのアレイがPDMSマイクロチャンネルの中に入り、油の入口を通過した後で、入口は蝋によって密閉され得る。次に、プラグの移動は油の流れによって制御され得、該油の流れは、シリンジまたはシリンジポンプによって押される。
【0180】
(実施例4:PDMSマイクロチャンネル(収容構成要素)からガラスキャピラリー(保持構成要素)の中にプラグを輸送すること。)
この実験において、個々にタンパク質溶液に融合されるプラグのアレイは、PDMSマイクロチャンネルの出口に接続されたガラスキャピラリーの中に輸送された。再利用可能な型が、ここで使用され得ることにより、PDMSマイクロフルイディックデバイスを再利用する。これは、薄い壁(OD:250μm、ID:200μm)のテフロン(登録商標)パイプをPDMSマイクロチャンネルの出口に取り付けることによって達成された。Hampton researchからのガラスキャピラリー(OD:200μm、ID:180μm)は、パイプの自由端をガラスキャピラリーの大きい端に挿入することによって、テフロン(登録商標)パイプに結合され得る。結合のために密閉材は必要とされず、漏洩は認められなかった。1つのガラスのキャピラリーが、タンパク質溶液と様々な沈殿剤との混合物を含むプラグの1つのアレイで満たされた後に、該ガラスのキャピラリーはテフロン(登録商標)パイプから取り外され、蝋で密閉された。別のガラスのキャピラリーが、次のプラグのアレイのために、テフロン(登録商標)パイプに結合するように使用され得る。
【0181】
(実施例5:アレイ内の各プラグをPDMSマイクロチャンネル内のタンパク質溶液に融合すること。)
この実験において、融合を実行する2つの型が存在する。第1の型において、プラグのアレイは、融合構成要素内で押され、タンパク質溶液の流れを流されたチャンネルを有する合流地点を通過した。各プラグは少量のタンパク質溶液と融合した。プラグの流量またはタンパク質の流れの流量を変化させることによって、各沈殿剤のタンパク質に対する相対量の割合が制御され得る。
【0182】
第2の型において、まず、タンパク質の流れは、油の流れの中に注入され、その結果、タンパク質溶液のプラグの別のアレイが形成された。沈殿剤を含んだプラグのアレイは、融合構成要素におけるT字型の合流地点において、タンパク質溶液のプラグのアレイに1つずつ融合され得る。
【0183】
(実施例6:PDMSマイクロチャンネル内のタンパク質溶液にプラグを1つおきに融合すること。)
プラグのアレイは多くの群のプラグからなり得る。組み合わせ構成要素が、これらの群内で選択的に溶液を融合することが、時として所望される。例えば、VD結晶化の事例において、第1群のプラグは沈殿剤溶液を含み、第2群のプラグは、乾燥溶液を含む。気相拡散による結晶化を実行するために、タンパク質溶液の流れは、沈殿剤のプラグに融合することを所望されるが、乾燥剤のプラグに融合することは所望されない。試剤溶液を有するプラグのアレイの融合は、キャピラリー数によって記述され得、該キャピラリー数は、表面張力と粘度とに依存する。好適な実施形態において、プラグと搬送流体との間の表面張力が制御され得、選択的な融合の制御を可能にする。表面張力は、プラグ内の界面活性剤の濃度の操作を通じて修正され得る。粘度はまた、例えば、乾燥剤のプラグを粘着性にする構成要素(例えば、ポリエチレングリコール)を追加することによって制御され得る。他の実施形態において、プラグのアレイの流量とタンパク質の流れの流量とがまた使用され得ることにより、選択的な融合を制御する。
【0184】
沈殿剤溶液および洗浄剤溶液を使用した選択的融合を実証する一連の実験が行なわれた。第1の実験において、沈殿剤を含んだプラグは、オクチル−β−D−グルコピラノシド(OG)洗浄剤の1%の溶液の流れと融合した。第1の実験において使用された装置と同一であるが別個の装置上で、同一の流量で行なわれた第2の実験において、ポリエチレングリコール5000モノメチルエチル、ならびに半フッ化界面活性剤および非フッ化界面活性剤の混合物を含んだ乾燥剤のプラグは、1%のOGの流れの付近で、屈曲し、融合しなかった。1%のOGの流れが、乾燥剤のプラグと互い違いにある沈殿剤のプラグのアレイと共に、組み合わせ構成要素において使用された第3の実験において、1%のOGの流れは沈殿剤のプラグのみと融合した。
【0185】
従って、融合されていないプラグ内の塩濃度は、融合されたプラグ内の塩濃度よりも高くなり得る。油が親水性である場合には、濃度差による浸透圧は、融合したプラグから融合していないプラグに水を拡散させ得る。融合したプラグはこの方法で濃縮され、タンパク質の核形成および結晶化は高められ得る。
【0186】
(実施例7:膜タンパク質の結晶化)
脂肪酸アミドヒドロラーゼ(FAAH)は、ニューロン表面において、エンドカンナビノイド信号分子を分解する完全な膜タンパク質である。FAAHの除去は鎮痛効果を増加させることに関連している。つまり、エンドカンナビノイドは、痛みおよびそれに関連する神経障害の緩和を標的とした最高の薬剤と考えられている。アラキドニル阻害剤と錯体化されたラットのFAAHの構造は公知である。その錯体は、どのようにFAAHが細胞膜に統合されるか、およびどのようにFAAHが活性部位から二重層にアクセスを確立するかを示した。
【0187】
FAAHの結晶は、タンパク質結晶化のマイクロバッチ方法を使用して、チップ上で生成された。3つの水溶液の入口および1つの搬送流体の入口を有するPDMSとテフロン(登録商標)との複合キャピラリー装置が構成された。この装置は、出口から搬送流体と水溶液との合流地点に直接的にキャピラリーを挿入され、膜タンパク質界面活性剤を含むプラグの形成を容易にした。使用された搬送流体は、パーフルオロトリペンチルアミン(3MのFC−70)であり、該FC−70は、膜タンパク質界面活性剤と適合性があることを示した。この装置を使用して、〜40cmのパイプは、マイクロバッチの液滴で満たされた。プラグ内の沈殿剤の濃度の勾配は、沈殿剤と緩衝剤との流れの流量を変化させることによって達成された。アラキドニル阻害剤と錯体化されたFAAHに対する沈殿剤溶液は、16%のPEG 6000、200mMのLi2SO4、10%のエチレングリコール、14%の2−メチル−2,4−ペンタンジオールおよび5.6のpHにおいて緩衝剤で処理された200mMのクエン酸塩からなった。非晶質ポリオフィレンの形式におけるFAAHに対する沈殿剤は、24%のPEG 4000、200mMのLi2SO4、10%の2−メチル−2,4−ペンタンジオール、400mMのNaClおよび8.2のpHにおいて緩衝剤で処理された100mMのTrisであった。
【0188】
(実施例8:VD結晶化スクリーン:プラグのアレイの準備および輸送)
第1に、テフロン(登録商標)パイプの小さい部分(外径250μm、内径200μm)が10μLのシリンジ(Hamilton)に接続された。この接続は、「管内管」方法を使用することによって行われた。テフロン(登録商標)パイプのより厚い部分(約30G)がシリンジに接続され、パイプの薄い部分がより暑い部分の中に挿入され、接続は(例えば、蝋を用いて)密閉された。パイプのその部分が伸張され得ることにより、直径を減少させた。シリンジとテフロン(登録商標)パイプとは、フルオロカーボン搬送流体で満たされた。フルオロカーボンは、量的割合が10:1であるパーフルオロパーヒドロフェナントレン(PFP)および1H,1H,2H,2H−パーフルオロオクタノール(PFO)との混合物である。プラグのアレイを準備するために、異なる試剤、フルオロカーボン、および気泡が、小さいテフロン(登録商標)パイプのその部分に連続して吸引された。これは、テフロン(登録商標)パイプに接続されたシリンジのプランジャを引き、テフロン(登録商標)パイプの他の端が対応する溶液の中にあることによって達成された。吸引プロセスの間に、プランジャの移動は、手動のマイクロメータシリンジドライバ(Stoelting Co.)によって制御された。各試剤の吸引の前に、少量のフルオロカーボンは、テフロン(登録商標)パイプの中に吸引されたことにより、プラグを分離した。一部の実験において、フルオロカーボンの吸引の後に、気泡がまたテフロン(登録商標)パイプの中に吸引された。これらの気泡は、対照的な粘度の溶液を含むプラグの偶然的な癒着を防止した。プラグのアレイが、テフロン(登録商標)パイプの内側で準備された後に、フルオロカーボンがさらにパイプの中に吸引された。次に、テフロン(登録商標)パイプは、漏斗状のキャピラリー(Hampton Research)の中に挿入された。テフロン(登録商標)パイプに接続されたシリンジのプランジャを押すことによって、プラグのアレイはキャピラリー(OD 0.20mm、ID 0.18mm)の中に移送された。次に、キャピラリーはパイプから切り離され、長期保存のために蝋によって密閉された。マイクロフルイディックチャンネルにおける実験のためにアレイを利用するために、まず、アレイはキャピラリーからテフロン(登録商標)パイプの中に輸送された。次に、テフロン(登録商標)パイプは漏斗状の結合器の中に挿入され、該結合器はマイクロフルイディックチャンネルの入口に結合された。アレイの輸送はテフロン(登録商標)パイプに接続されたシリンジによって制御された。同時に、標的溶液の流れは、側面のチャンネルの中に注入され、この流れはプラグのアレイに融合し、混合し、反応が生じた。プラグのアレイは、混合の後に、同様の漏斗状の結合器を使用してキャピラリーの中に輸送された。キャピラリーがプラグのアレイで満たされた後に、キャピラリーはマイクロフルイディックチャンネルから取り外され、定温放置または分析のために密閉され得る。
【0189】
(実施例9:1つの基質に対するいくつかの酵素の機能的アッセイ)
プラグのアレイが準備され、該プラグは、アルカリ性のリン酸塩(AP)(0.2Mのジエタノールアミン内に0.02mg/ml、pH10.5)、カタラーゼ(PBS内に0.02mg/ml、pH7.3)、リボヌクレアーゼA(RNase)(0.05MのTris緩衝剤内に0.02mg/ml、pH7.5)、およびリソチーム(0.05MのNaAc緩衝剤内に0.02mg/ml、pH4.5)を含んでいた。アレイは、各酵素のプラグを1つ有し、2つ毎に隣接する酵素のプラグは、PBS緩衝剤の2つのプラグによって分離される。これらのプラグは「洗浄剤のプラグ」として作用し、基質の流れのあらゆる二次汚染を取り除く(酵素が基質の流れの中への拡散または表面張力駆動の流れによって輸送された場合には、この二次汚染は基質の流れに融合する間に生じ得る。)。気泡が2つ毎に隣接する水溶性のプラグの間に挿入された。基質二燐酸フルオレセイン(FDP)(11μM、0.5MのNaClを有する)上の4つの酵素の活性をアッセイするために、プラグのアレイはT字型の合流地点においてFDPの溶液に融合された(図11を参照)。アレイおよびFDPの流れの流量は、それぞれ1.2μL/minおよび0.5μL/minであった。融合されたプラグのアレイは、キャピラリー内に収集され、各プラグの蛍光画像が、デジタルカメラ(Hamamatsu、ORCA−ER)を装備した蛍光顕微鏡(Leica DMIRE2)によって撮影された。画像内の蛍光強度は、Metamorph Imaging System(Universal Imaging)を使用して分析され、アルカリ性の燐酸塩の活性を示した。
【0190】
(実施例10:VD結晶化スクリーン:タウマチンの結晶化状態に関する沈殿剤のスクリーニング)
Crystal Screen Kit(Hampton Research)からの48個の沈殿剤をスクリーンするために、48個の沈殿剤(No.1〜No.48)の48個のプラグのアレイが準備された。沈殿剤の試剤の処方は、Hampton Researchのウェブサイト
(http://www.hamptonresearch.com/support/guides/2110F.pdf)において見つけられ得る。沈殿剤試剤は、様々な塩濃度(例えば、No.44は0.2Mのギ酸アンモニウムおよびNo.33は4.0Mのギ酸ナトリウム)および様々な粘度(例えば、No.30は30%のw/vのPEG8000)を有する。2つ毎に隣接するプラグは気泡によって分離された。搬送流体はPFPとPFOとの混合物(量的割合は10:1)であった。アレイが準備された後に、アレイはスクリーニングのためにマイクロチャンネルの中に輸送された。テフロン(登録商標)パイプの別の部分は10μLのシリンジに接続され、シリンジとパイプとのアセンブリはPFPで満たされた。わずかに1.0μLを下回るタウマチンの溶液(0.1MのN−(2−アセトアミド)イミンアセト酢酸緩衝剤、pH6.5)がパイプの中に吸引された。次に、パイプはT字型の合流地点の側面のマイクロチャンネルの入り口の中に挿入された。タウマチン溶液は、主チャンネルの中に駆動され、沈殿剤のプラグのアレイに融合された。タウマチン溶液およびアレイの流量は、それぞれ0.5μL/minおよび1.2μL/minであった。プラグがタウマチン溶液に融合された後に、プラグはキャピラリー内に収集され、定温放置のために蝋によって密閉された。18℃におけるプラグの定温放置は、沈殿剤No.29およびタウマチンを含むプラグ内でタウマチンの結晶化をもたらした。〜0.1μLを下回るタウマチン溶液がチャンネル内に残った。この方法は、複数の試剤のナノリッターのプラグに対してスクリーンされる多量の溶液を必要とせず、あまり多くの廃棄物を生成せず、マイクロリッターを下回るような少ない量に有益である。
【0191】
Crystal Screen Kitからの5つの沈殿剤をスクリーンするために、プラグのアレイは準備され、該プラグはスクリーニングキットからの5つの異なる沈殿剤:No.13(0.2Mのクエン酸ナトリウム/0.1MのTrisHCl/30%のv/vのPEG 400、pH8.5)、No.24(0.2MのCaCl2/0.1MのNaAc/20%のv/vのイソプロパノール、pH4.6)、No.25(0.1Mのイミダゾール/1.0MのNaAc、pH6.5)、No.29(0.1MのHEPES/0.8Mの酒石酸ナトリウムカリウム、pH7.5)、およびNo.33(4.0Mのギ酸ナトリウム)を含んでいた。アレイは、各試剤のプラグを2つ、合計で10個のプラグを含む。気泡は、2つ毎に隣接するプラグの間に挿入された。PFPとPFOとの混合物(体積割合は10:1)は搬送流体として使用された。タウマチンの水溶性の流れ(0.1MのADA緩衝剤内で〜60mg/ml、pH6.5)は結晶化のためにプラグのアレイの中に注入された。アレイおよびタウマチンの流れの流量は、それぞれ1.2μL/minおよび0.5μL/minであった。18℃におけるプラグの定温放置は、沈殿剤No.29およびタウマチンを含むプラグ内でタウマチンの結晶化をもたらした。
【0192】
(実施例11:自由界面拡散結晶化スクリーン)
自由界面拡散試験は、タンパク質のプラグを沈殿剤のプラグと互い違いにすることによってセットアップされた。密閉されたキャピラリーに輸送される前に、互い違いの対のプラグは、狭いテフロン(登録商標)パイプの部分にポンプ注入された。(密閉されたキャピラリーはシラン処理によって疎水性にされた)。親水性のガラスファイバはキャピラリーの中に挿入された。プラグが残されるにつれ、キャピラリーが一定の割合で移動されることにより、プラグ間の距離を制御した。液滴はガラスファイバを自動的に湿潤し、ドロップ間に小さい相互接続を形成し、拡散が生じることを可能にした。
【0193】
(実施例12:自由界面拡散結晶化スクリーン)
テフロン(登録商標)キャピラリー(ID0.008±0.001内;壁0.001±0.001内)は、3MのFC−3283:1H,1H,2H,2H−パーフルオロ−1−オクタノールの5:1のv/vの混合物で満たされた。ADA緩衝剤内の25mg/mLのタウマチンの〜300nLのプラグはキャピラリーの中に吸引され、次に、フルオロカーボン混合物の〜200nLの小さいプラグ、2Mの酒石酸カルシウムナトリウムの〜300nLのプラグ、およびフルオロカーボンの混合物の別のプラグがこの順序で吸引された。キャピラリーのオープンエンドは、キャピラリー蝋で密閉され、キャピラリーはeppendorf 5415 D遠心分離器内に固定され、その結果、加速力がキャピラリーの長手方向にほぼ垂直に及ぼされた(キャピラリーはロータ上に置かれ、遠心分離器の管の上にテープを用いて固定された)。遠心分離は、30秒間、2000rpmで適用された。遠心分離プロセスは、2つの水溶性のプラグ間からのより密度の高い搬送流体を消散させ、2つの水溶性のプラグが近付き、界面を確立することを可能にした。溶質は界面全体に拡散するように混合し、遠心分離の直後に、沈殿剤が2つの水溶性のプラグ間の界面において観察された。1日後、たんぱく質タウマチンの結晶が形成された。
【技術分野】
【0001】
(連邦政府後援の研究開発)
本研究は、NIH(R01 EB001903)によってサポートされた。さらに、本研究の一部は、NSFによって資金を提供されたMRSECマイクロフルイディック機関において行われた。米国政府は本出願において一定の権利を有し得る。
【0002】
(技術分野)
本発明は、マイクロフルイディック(微細流体)の分野に関する。本発明は、マイクロフルイディック技術を提供し、フェムトリッター未満からミリリッターまでの尺度での反応の迅速かつ経済的な操作を可能にする。
【背景技術】
【0003】
(発明の背景)
最少量の試剤を使用して非常に多くの反応を行う能力が所望される。ロボット、マイクロフルイディック、96−ウェルプレートにおけるコンビナトリアルケミストリなどを含み、この目的に対する様々な解決策が提案されてきた。様々な反応に対するこれらの方法のアプリケーションが提案されてきた。
【0004】
例えば、膜タンパク質は、人間の健康にとって重要である多くの細胞学的および生理学的プロセスにおいて、重要な役割を果たしている。膜タンパク質の構造の決定は、膜タンパク質の機能の理解における重要なステップである。X線結晶化は、膜タンパク質の構造の決定に対する強力なツールである。膜タンパク質に対する結晶化の状態は、非常に多くの数のスクリーニング実験によって決定される。膜タンパク質は、多くの場合に生成することが困難であり、従って、結晶化スクリーンの小型化が、構造研究を加速するために不可欠である。膜タンパク質の結晶は、多くの場合に壊れやすく、処理によって損傷され得るので、結晶の回折の質の直接的なインサイチュでのテストを可能にする技術が必要とされる。ナノリッター量の膜タンパク質溶液の処理は、粘度が高く表面張力が低いために困難である。
【0005】
特許文献1は、タンパク質結晶化のハイスループットスクリーニングに関するマイクロフルイディック構造の使用を記述する。一実施形態において、統合された組み合わせ混合チップは、試剤の正確な測定が、チップ上で観察された可能な結晶形成を用いて、非常の多くのタンパク質結晶化状態を急速に作成することを可能にする。代替的な実施形態において、マイクロフルイディック構造が利用され得ることにより、特定のタンパク質と結晶化試剤との組み合わせの位相空間を調査し、それにより、有望な状態を識別し、続く集中的な試みが結晶の成長を取得することを可能にする。残念ながら、このシステムは動作するためには費用がかかり;組み合わせ混合チップは、従来の結晶化プレートよりも明らかに高価であり;組み合わせ混合チップは、水および気体に対して透過性があり、有機溶媒に対して適合性がない。従って、膜タンパク質の迅速かつ経済的な結晶化に対するニーズが存在する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第04/104228号パンフレット
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、非常に多くの数の反応、例えば結晶化またはアッセイを平行して行い、迅速かつ経済的な反応を可能にする方法を提供する。
【0008】
本発明は、タンパク質、生体分子、生体分子と束縛リガンドとの錯体などの結晶化に特に良く適している。本発明は、結晶の回折の質に関する直接的なテストを可能にする。本発明はまた、コンビナトリアルケミストリの分野に適用可能であり得、反応速度および反応生成物の両方のモニタリングを可能にする。
【0009】
本発明は以下の魅力的な特徴のうちの1つ以上を有する:(1)方法は、大規模に実現可能である−スクリーンにおいて使用される試剤の数を増加させることが、さらに複雑な構成を必要とせず、より長い収容構成要素のみを必要とする。(2)一部の実施形態において、方法は、三相流におけるスペーサの使用を含む。例えば、フッ化搬送流体の使用は、プラグの保護および表面の化学性質の制御を提供し得、気泡の使用は、水溶性のプラグが融合することを防止し得る。(3)アレイは、シリンジを使用する単純な方法からロボット工学までの様々な方法によって事前に製作され得る。キャピラリー内の事前に製作されたプラグのアレイは、数ヶ月間、格納され得、滅菌され得るか、または不活性環境の下で準備され得、可能なアプリケーションの範囲を拡大する。(4)方法は、エンドユーザにとって非常に単純である−複数の流れを駆動して組み合わせる一定の流れの源を除いて、高性能な機器はユーザ側に必要とされない。全体として、本方法は試剤が格納され、単純で信頼の置けるフォーマット、例えば診断および感知で使用されなければならないアプリケーションにとって魅力的である。さらに、本方法は、化学および生化学における広い範囲のアプリケーションを見出し得、96−、384−、および1536−ウェルプレートにおける試剤が格納されるか、または分配される最新の方法、例えば、コンビナトリアルケミストリ、タンパク質結晶化、および生化学的アッセイを促進し、かつ、小型化する。
本発明は、例えば、以下を提供する。
(項目1)
少なくとも1つのマイクロチャンネルを備えている装填構成要素であって、該装填構成要素は、プラグのアレイを形成することに適し、各プラグはプラグ流体を備え、各プラグは、該プラグ流体と非混和性である搬送流体および/またはスペーサによって、別のプラグから分離されている、装填構成要素と、
少なくとも1つのマイクロチャンネルを備えている少なくとも1つの着脱式の保持構成要素であって、該マイクロチャンネルは、該保持構成要素に流体接続するように構成されている、保持構成要素と
を備え、
該保持構成要素は、該プラグのアレイで装填され、該装填構成要素から取り外される際、プラグは直ちに融合または混合しない、マイクロフルイディックデバイス。
(項目2)
上記保持構成要素は、キャピラリー管である、項目1に記載のマイクロフルイディックデバイス。
(項目3)
上記保持構成要素は、パイプの一部分である、項目1に記載のマイクロフルイディックデバイス。
(項目4)
上記保持構成要素は、チップである、項目1に記載のマイクロフルイディックデバイス。
(項目5)
上記保持構成要素または上記装填構成要素のうちの一方はメス端を有し、他方はオス端を有する、項目1、項目2、項目3、または項目4に記載のマイクロフルイディックデバイス。
(項目6)
少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備えている保持構成要素であって、該少なくとも1つのオープンエンドは、別のマイクロチャンネルに流体接続するように構成されている、保持構成要素と、
該保持構成の該第1のマイクロチャンネル内に置かれているプラグ流体のプラグの1つ以上の線形のアレイと
を備え、
各プラグは搬送流体および/またはスペーサのいずれかによって別のプラグから分離され、
該搬送流体および該スペーサは、該プラグ流体におよび互いに非混和性であり、
該マイクロチャンネルは、該搬送流体によって湿潤される、キット。
(項目7)
キャピラリー管である、項目6に記載のキット。
(項目8)
1mmを下回る直径を有するパイプである、項目6に記載のキット。
(項目9)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および1つ以上の試剤を備え、該各プラグは、同じ試剤の異なった濃度または複数の試剤の異なった濃度を備えている、項目6、項目7、または項目8に記載のキット。
(項目10)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え、該線形のアレイ内の2つのプラグは、異なる試剤を備えている、項目6、項目7、または項目8に記載のキット。
(項目11)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え、該線形のアレイは、ケミカルスペースの領域をスパンする特性を有する物質を含んでいる、項目6、項目7、または項目8に記載のキット。
(項目12)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および1つ以上の試剤を備え、該線形のアレイは、結晶化スクリーンを行うことに適している、項目6、項目7、または8項目に記載のキット。
(項目13)
上記線形のアレイ内の1つ毎のプラグは、少なくとも1つの溶媒および試剤を備え、残りのプラグは、少なくとも1つの溶媒および少なくとも1つの標識を備えている、項目6、項目7、または項目8に記載のキット。
(項目14)
上記流体プラグの線形のアレイは、少なくとも2つの流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目15)
上記流体プラグの線形のアレイは、少なくとも10個の流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目16)
上記流体プラグの線形のアレイ内の各プラグは、少なくとも1000個の流体プラグを備えている、項目6から項目13のいずれかに記載のキット。
(項目17)
上記流体プラグの線形のアレイ内の各プラグは、約0.001fL〜10mLのプラグ流体を備えている、項目6から項目16のいずれかに記載のキット。
(項目18)
上記流体プラグの線形のアレイ内の各プラグは、約10M未満の試剤を備えている、項目6から項目16のいずれかに記載のキット。
(項目19)
上記各プラグは、上記搬送流体によって分離されている、項目6から項目18のいずれかに記載のキット。
(項目20)
上記線形のアレイ内の少なくとも2つのプラグは、上記スペーサによって分離されている、項目6から項目18のいずれかに記載のキット。
(項目21)
上記スペーサは、液体、気体、ゲルまたは固体である、項目6から項目20のいずれかに記載のキット。
(項目22)
上記スペーサは、液体または気体である、項目6から項目21のいずれかに記載のキット。
(項目23)
入口および出口を有する第1のマイクロチャンネルと、
試剤の入口および1つ以上の送達チャンネルを有し、該第1のマイクロチャンネルに流体連通する第2のマイクロチャンネルであって、該送達チャンネルは実質的に同じ流体抵抗を有する、第2のマイクロチャンネルと
を備えている組み合わせ構成要素。
(項目24)
上記入口は、保持構成要素に流体接続するように構成されている、項目23に記載の組み合わせ構成要素。
(項目25)
上記出口は、収容構成要素に流体接続するように構成されている、項目23または項目24に記載の組み合わせ構成要素。
(項目26)
フッ素含有の分子を備えている少なくとも1つの搬送流体と、
搬送流体によって分離されているプラグ流体の1つ以上のプラグであって、該プラグ流体は、該搬送流体に非混和性である、プラグと、
該プラグ流体内で実質的に不溶性であり、かつ、該搬送流体内で可溶性である界面活性剤と
を備えている、マイクロフルイディックシステム。
(項目27)
少なくとも1つのマイクロチャンネルを備えている保持構成要素であって、該保持構成要素は、プラグ流体のプラグを備えているプラグのアレイを格納および輸送することに適し、該プラグは、該プラグ流体と非混和性である搬送流体によって互いに分離されている、保持構成要素と、
(a)入口および出口を有する第1のマイクロチャンネルと、(b)試剤の入口および1つ以上の送達チャンネルを有し、該第1のマイクロチャンネルに流体連通する第2のマイクロチャンネルとを備えている組み合わせ構成要素であって、該送達チャンネルは、実質的に同じ流体抵抗を有する、組み合わせ構成要素と
を備え、
該保持構成要素は、該組み合わせ構成要素から着脱可能である、マイクロフルイディックシステム。
(項目28)
少なくとも1つのマイクロチャンネルを備えている装填構成要素をさらに備え、該装填構成要素は、上記アレイの形成に適している、項目27に記載のマイクロフルイディックシステム。
(項目29)
1つ以上のマイクロチャンネルを備えている収容構成要素をさらに備え、該収容構成要素は、上記アレイを操作することに適している、項目27または項目28に記載のマイクロフルイディックシステム。
(項目30)
(a)第1のプラグ流体のプラグの線形のアレイをマイクロフルイディック装置内の第1のマイクロチャンネルの中に第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該搬送流体および該スペーサは、プラグ流体および互いに非混和性である、ことと、
(b)第2のプラグ流体の流れをマイクロフルイディック装置内の第2のマイクロチャンネルの中に第2の流量で導入することであって、該第1のマイクロチャンネルと該第2のマイクロチャンネルとは互いに流体連通する、ことと、
(c)該第1のプラグ流体の少なくとも1つのプラグを少なくとも一部の該第2の流体プラグに融合し、融合されたプラグを形成することであって、該融合は該第1のマイクロチャンネルと該第2のマイクロチャンネルとの1つ以上の合流地点において生じる、ことと
を包含する、方法。
(項目31)
(d)上記融合されたプラグをモニタリングすることをさらに包含する、項目30に記載の方法。
(項目32)
上記第1のプラグ流体のプラグの線形のアレイは、保持構成要素を取り付けることによって上記第1のマイクロチャンネルの中に導入され、該保持構成要素は、
2つのオープンエンドを有する第3のマイクロチャンネルであって、少なくとも1つのオープンエンドは、上記装置内の上記第1のマイクロチャンネルに流体連通するように構成されている、第3のマイクロチャンネルと、
該第1のプラグ流体のプラグの線形のアレイと
を備えている、項目30または項目31に記載の方法。
(項目33)
上記第2のマイクロチャンネルは、上記第1のマイクロチャンネルに交差する複数の送達チャンネルに分裂される、項目30、項目31、または項目32に記載の方法。
(項目34)
試剤、搬送流体、およびプラグ流体の一覧表をオファーするステップと、
所望の試剤のサブセット、搬送流体およびプラグ流体を顧客から収容するステップと、
該搬送流体および/またはスペーサを用いて互いから分離されている該プラグ流体のプラグのアレイを含む保持構成要素を該顧客に送達するステップであって、該搬送流体および該スペーサは、プラグ流体および互いに非混和性であり、各プラグは所望の試剤のサブセットの要素を含んでいる、ステップと
包含する、方法。
(項目35)
所望の試剤のサブセットに対する値段を計算するステップをさらに備えている、項目34に記載の方法。
(項目36)
少なくとも1つのオープンエンドを有する収容マイクロチャンネルを備えている収容構成要素であって、該オープンエンドは、別のマイクロチャンネルと流体連通するように、かつ、プラグ流体の線形のアレイを収容するように構成されている、収容構成要素と、
第1のマイクロチャンネル内の流体プラグの位置を識別する測定装置と
を備えている、キット。
(項目37)
(a)入口および出口を有する第1のマイクロチャンネルと(b)試剤の入口と、該第1のマイクロチャンネルと流体連通する1つ以上の送達チャンネルとを有する第2のマイクロチャンネルとを備えている組み合わせ構成要素であって、該送達チャンネルは実質的に同じ流体抵抗を有する、組み合わせ構成要素と、
ポンプと
を備えている、キット。
(項目38)
上記第2のマイクロチャンネルの上記試剤の入口に流体連通するように構成されている貯水溝をさらに備えている、項目37に記載のキット。
(項目39)
少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備えている収容構成要素であって、該オープンエンドは、別のマイクロチャンネルに流体連通するように構成され、該第1のマイクロチャンネルは、該マイクロチャンネル内のプラグの位置を識別する1つ以上の物理標識を含む、収容構成要素。
【図面の簡単な説明】
【0010】
【図1】図1は、再利用可能なマイクロフルイディックシステムの設計の概略図である。搬送流体6内のプラグ9は、(a)マイクロフルイディック装置内のマイクロチャンネルからキャピラリー3、または(b)結合器2を介してキャピラリーからマイクロフルイディック装置上のマイクロチャンネルのいずれかに輸送され得る。
【図2】図2は、プラグを含んでいる大量生産の保持構成要素である。a)装置の概略図。搬送流体によって分離された一連の異なるプラグを含む大きいチャンネルは、分裂した構成要素に送られる。各合流地点は、各プラグを2つの別個のプラグに分裂させる。3回の反復の後に、8個の小さい保持構成要素はそれぞれ、同一の一連のプラグで満たされる。b)分裂したチャンネルの立体図。全ての反復が共通の平面上にあるので、連続する層が多層フォトリソグラフィを用いて確立された。c)単純なT字型合流地点。d)狭められた合流地点。e)複数の出口を有する合流地点。
【図3】図3は、プラグのアレイ7のタンパク質プラグの別のアレイ13との融合の概略図である。タンパク質の結晶化に対するこの概念のアプリケーションが、以下で記述される。同じ原理が反応、アッセイ、および分析に適用され得る。例えば、様々な反応物のセットは、プラグのアレイ内に配置され、次に、サンプルを含んだ流れに融合され得る。
【図4】図4は、複数の分裂したマイクロチャンネルとの融合である。a)マイクロチャンネルの立体断面図が、分裂されたチャンネルを通って流される流れに融合するプラグを示す。b)単一の送達チャンネル起源の複数の水溶液の流れが、赤い無機色素に融合しているマイクロ写真である。c)(タンパク質を含んだ流れによって図示された)流れのプラグのアレイとの融合である。
【図5】図5は、2つのプラグを接触させる方法の概略図である。a)プラグ流体によるチャンネルの湿潤が防止されるチャンネル内のプラグである。b)プラグ流体によるチャンネルの湿潤が可能にされるチャンネル内のプラグである。c)流れが確立され、プラグ流体によるチャンネルの湿潤が防止されるチャンネル内のプラグである。d)チャンネル内で流れず、プラグ流体によるチャンネルの湿潤が可能とされるプラグである。e)最初に湿潤を防止する光スイッチ可能な単分子層を有するチャンネル内のプラグである。f)光スイッチ可能な単分子層が特定の波長の光で作動された後のチャンネル内のプラグである。g)保持構成要素の内側にある水溶性のプラグである。h)力が加えられることにより、対称性が破壊され、2つのプラグ間の液体架橋が形成される。該力は、磁力、電力、光学力、または(例えば、遠心分離における)加速力などであり得る。力は、実験の型に従って、搬送流体、結晶化溶液、またはその両方に対して行使され得る。好適には、力は、保持構成要素の部分に垂直に加えられる。磁力が使用される場合には、好適には、搬送流体とプラグ流体とは、異なる磁気特性を有する。遠心力が使用される場合には、好適には、搬送流体とプラグ流体とは、異なる密度を有し、水溶性のプラグ流体とフッ化搬送流体とが使用されるときも同様である。
【図6】図6は、a)キャピラリー内の4つの異なる試剤のプラグのアレイである。プラグは、左から右にKMnO4、NaCl、CuSO4、Fe(SCN)3を含む。搬送流体は、界面活性剤を有するフルオロカーボンである。b、c)フルオロカーボン内で形成され、キャピラリー内で気泡(濃色)によって分離された異なる試剤のプラグのアレイである。b)において、水溶性のプラグは、フルオロカーボンのスペーサによって気泡から分離され、プラグ間の交差連通を防止する。スケールバーは200μmである。
【図7】図7は、プラグ間の距離を制御、一部の事例においてはプラグを融合するためのマイクロフルイディックのセットアップの概略図である。搬送流体は側面の小さい分岐チャンネルを通じて排出される。(a)プラグ間の間隔は結果的に減少する。(b)搬送流体は、完全に取り除かれ、プラグの内容の全ては、プラグ流体の流れの中に融合される。
【図8】図8は、a)タンパク質の結晶化のためのPDMS−ガラスの複合システムである。b)キャピラリー内のプラグの内側で成長および回折され、1.8Åを上回る解像度(1.8Åにおいて、I/σ(I)z=4.7)を有する構造をもたらすタウマチン結晶(左側)のシンクロトロン回折画像(右側)である。
【図9】図9は、膜タンパク質FAAHの結晶化である。プラグベースのマイクロフルイディックが使用され得ることにより、膜タンパク質を結晶化し、少量のサンプルを用いた多くの結晶化試験を行う。a)10セント硬貨の回りに巻かれた1メートルのテフロン(登録商標)キャピラリーのマイクロ写真である。該キャピラリーは、〜1,000ナノリッターサイズのプラグを含む。10μLほどの膜タンパク質溶液が、1000回の結晶化試験をセットアップするために必要とされる。b)キャピラリー内のプラグを示すa)のマイクロ写真の拡大された部分である。c)プラグ内で成長した膜タンパク質(FAAH)の結晶の2つのマイクロ写真である。
【図10】図10は、本発明のマイクロフルイディックシステムの一実施形態を示す流れ図である。装填構成要素は、第1の試剤のセットを含んだプラグの線形のアレイを準備する。装填構成要素は、保持構成要素に取付け可能であり、その結果、アレイは流体の流れを用いて移送され得る。保持構成要素は、組み合わせ構成要素に取付け可能であり得、その結果、第2の試剤または試剤のセットは、アレイ内のプラグの中に導入され得る。アレイは、さらなる操作のために、収容構成要素に移動され得る。
【図11】図11は、単一のタンパク質の基質8に対する異なる酵素を含んだ複数のプラグのアッセイの概略図である。酵素22を含んだ各プラグは、搬送流体、スペーサ21、および少なくとも1つの洗浄剤のプラグ23によって、異なる酵素を有する別のプラグから分離される。
【図12】図12は、プラグ9を流れ8に融合し、二次汚染なく融合されたプラグ10を作成するための可能な形状の概略図である。短く狭い側面のチャンネルが使用され得ることにより、搬送流体6が多量の融合している流れ8をスナッピングオフ(snapping off)することを助ける。台形状の拡がりの程度が、融合される流体の量を定義するために使用され得る。台形状の拡張以外の他の形状が使用され得ることにより、能力を最適化する。太い線で示された主チャンネルは、より細い線で示された他のチャンネルよりもz軸において大きい。
【図13】図13は、PDMS内の単純なT字型の合流地点がテフロン(登録商標)キャピラリーと嵌合されている図である。PDMSチップは、マイクロフルイディックチャンネルを有するPDMSの一部分をPDMSの別の平坦な部分に密閉することによって、通常、製作される。密閉に先立って、テフロン(登録商標)キャピラリーがチャンネル内に置かれる。次に、テフロン(登録商標)キャピラリーと正方形のマイクロフルイディックチャンネルとの間の間隔は、硬化されていないPDMS混合物で満たされ、硬化される。その結果の合流地点が使用され得ることにより、事前に形成されたプラグのアレイを別の流れに融合するか、またはプラグを形成する。フッ化搬送流体は、テフロン(登録商標)面を優先的に湿潤するので、テフロン(登録商標)キャピラリーは、使用に先立つ表面処置を必要としない。a)は、別の流れ(チャンネルa)に融合する事前に形成されたプラグのアレイ(チャンネルb)を示す。b)は、プラグを形成するために、水溶性の流れは、チャンネルaを通ってポンプ注入され得、搬送流体は、チャンネルbを通ってポンプ注入されるということを示す。合流地点において、水溶性の液滴またはプラグは自然に形成し、テフロン(登録商標)キャピラリーを通って輸送される。これは水溶性の洗浄剤溶液に対して特に有益であり、さもなければ、水溶性の洗浄溶液はプラグを形成することが可能となり得ない。
【図14】図14は、膜タンパク質の結晶化実験に対して使用されるテフロン(登録商標)キャピラリーとPDMSとの複合装置のa)概略図およびb)マイクロ写真である。膜タンパク質および沈殿剤を含んだプラグは、パーフルオロトリアリキルアミンから成る非混和性の搬送流体の流れ内で形成された。使用される膜タンパク質は、脂肪酸アミドヒドロラーゼの非晶質ポリオフィレンの形式であり、搬送流体は、パーフルオロ化合物FC−70であり、沈殿剤は、24%のPEG 4000、0.20MのLiSO4、0.40MのNaCl、0.10MのTris pH=8.2であった。流量は、以下の通りであった:搬送流体−1μL/min;タンパク質−0.5μL/min;各沈殿剤の流れ−0.25μL/min。
【図15】図15は、パイプまたはキャピラリーがまた使用され得ることにより、いくつかのチップ24を接続する図である。例えば、プラグ9は、1つの装置上で流れ8と共に形成またはそれに融合され得、パイプおよび/またはキャピラリーを通って別のチップ24に移送され得る。1つの装置に接続するための挿入されたキャピラリー3の使用、および別の装置に接続するための漏斗状のアダプタ2の使用が図に示されている。様々な接続方法が、任意の組み合わせで使用され得る。
【図16】図16は、パイプ25とチップ24との間の接続が、チップ平面から外れ得る図である。パイプは、マイクロフルイディックチップ上の穴を通じてチップに接続され得る。事前に形成されたプラグのアレイは、さらなる操作のためにマイクロフルイディックチップに輸送され得る。
【図17】図17は、(a)プラグ9の2つのアレイが保持構成要素内に格納され得る図である。(b)において示されるように、プラグの2つのアレイが融合され得るように、保持構成要素は構成され得る。次に、融合されたプラグ10は、さらなる反応のために組み合わせ構成要素に移送され得る。
【図18】図18は、(a)プラグ9と流れ8とのアレイがまた保持構成要素内に格納され得る図である。融合されたプラグ10は、さらなる反応のために組み合わせ構成要素に移送される前に形成され得る。
【発明を実施するための形態】
【0011】
(発明の詳細な説明)
本発明は、少量の溶液のプラグを基盤とするマイクロフルイディック操作のためのシステムを提供する。該システムの特定の実施形態は、装填構成要素、保持構成要素、組み合せ構成要素、および収容構成要素を備えている。図10は、本発明のシステムの一実施形態を図示している。様々な構成要素が単一のシステムに統合され得るか、または構成要素のうちの1つ以上は、マイクロフルイディックシステムから着脱可能であり得る。例えば、各構成要素は別々に着脱可能であり、したがって、保持構成要素は、装填構成要素および組み合せ構成要素の両方に装着可能であるスタンドアロンの構成要素であり得る。別の例において、収容構成要素は、組み合せ構成要素と統合され得る。
【0012】
本開示を通して、本発明の使用は、タンパク質の結晶化へのアプリケーションにより例示される。本発明は、他の反応に等しく適用可能であるということを理解されたい。
【0013】
溶液のプラグを基盤とするマイクロフルイディック操作は、以前に本発明者によって、米国特許出願第10/434,970号および米国特許出願第10/765,718号において開示され、該出願は、本明細書において、その全体が参照により援用される。
【0014】
(装填構成要素)
装填構成要素は、少なくとも1つのマイクロチャンネルを備え、該チャンネルは、流体プラグを備えたアレイを形成することに適し、該プラグは、搬送流体と、保持構成要素と流体接続し得るように構成された少なくとも1つの出口とによって互いに分離されている。
【0015】
装填構成要素は、所望の搬送流体または複数の流体によって分離されたプラグの所望のアレイで、保持構成要素を満たすことの可能である任意の装置であり得る。そのプロセスは、例えば、手動で動作されるピペットまたは注射器を用いて、あるいはピペッティングロボットの使用を通じて手動で実行され得る。代替的に、装填構成要素は、少なくとも1つのチャンネル、および収容構成要素と流体接続し得るように構成された少なくとも1つの出口を有するマイクロフルイディック装置であり得る。装填構成要素は、Laura Lane、The Scientist、2004年1月19日、Volume 18、Issue 1(34)によって記述されたタイプの装置をも基盤とし得、該装置は、少量の変化溶液を準備することが可能である。そのような装置は、例えば、Syrrxによって製造されたAgincourtTM system、Gilson’s 925 PC Workstaiton、deCODE’s MatrixMakerTM、Matrix Technologies’s Hydra(登録商標)Plus−One System、およびthe Fluidigm TopazTM Crystallizerを含む。装填構成要素は、保持構成要素の端を密閉または蓋をするための統合手段を有することか、または有さないことがあり得る。
【0016】
(保持構成要)
保持構成要素は、プラグの少なくとも1つの線形のアレイを格納および輸送することに有益である。
【0017】
着脱式保持構成要素は、装填構成要素と流体接続し得るように構成された少なくとも1つのマイクロチャンネルを有する。保持構成要素が装填構成要素から外されたときには、流体プラグは、一般的には、すぐに融合または混合されない。着脱式保持構成要素は、事前形成されたカートリッジであり得、該カートリッジは、市販の独立したアイテムとして販売され得る。用語「保持構成要素」および「事前形成されたカートリッジ」は、本出願において相互置換可能に使用され得る。保持構成要素材料の例は、限定するわけではないが、PDMS、ガラス管(例えばキャピラリー)、パイプ(例えば、Teflonパイプ、またはポリイミドパイプ)、および合成管(例えば、ポリイミドでコーティングされたガラスキャピラリー、またはガラスキャピラリーの内側のTeflonパイプ)を含む。保持構成要素のマイクロチャンネルは、装填構成要素、組み合せ構成要素または収容構成要素のマイクロチャンネルと似たサイズまたは異なるサイズの内径を有し得る。保持構成要素は、らせん状またはシリンダ状に曲げられ得、スプールを用いて、または用いずに輸送され、処理を容易にする。本出願の目的のために、そのような構成のプラグは、「線形のアレイ」に配置されることがさらに考えられる。
【0018】
本発明の一実施形態は、プラグの少なくとも1つの線形のアレイを有する保持構成要素を含むキットである。キット内の保持構成要素は、プラグの1つよりも多いアレイを有し得る。例えば、プラグの2つのアレイが保持構成要素内に格納され得る。保持構成要素は、プラグの2つのアレイが融合され得るように構成され得る。次に、融合されたプラグは、さらなる反応のために組み合せ構成要素に移転され得る。また、プラグのアレイは、試剤または溶媒の流れと共に保持構造内に格納され得る。保持構成要素は、プラグと流れの融合を誘発するように構成され、この融合されたプラグのアレイは、さらなる反応のために組み合せ構成要素の中に移転され得る。そのようなシステムは、例えば、より安定した2つ以上の構成要素を混合する際の不安定な核種の析出を含む反応に有益である。
【0019】
一実施形態において、保持構成要素は、一端または両端上で蓋をされるか、または密閉され得ることにより、格納または輸送を容易にする。搬送流体が揮発性でない場合には、端を密閉すること、または蓋をすることは必要ではないこともあり得る。また、密閉されていない保持構成要素は、搬送流体内で一端または両端を浸水させることにより輸送され得る。
【0020】
一部の実施形態、特に、プラスチックを通過する液体またはガスの透過率が、長期格納の課題となる場合において、内側にプラグを有する保持構成要素は凍結され得る。
【0021】
保持構成要素は、制御された環境において試剤を格納することに理想的である。保持構成要素は、マイクロフルイディックシステム内の別のコンポーネントの中にプラグを分布するために使用され得るか、または体積の中または表面上(例えば、ウェルプレート(例えば、市販の96−、384−、または1536−ウェルプレート)、顕微鏡のスライド、細胞培養媒体など)にプラグを分布するために使用され得る。プラグ流体が(フルオロロカーボン(過フッ化炭化水素)のように)低い表面張力を有する場合には、プラグは、単にプラグを保持構成要素から落とすことによって分布され得る。単一のプラグ分布を容易にするために、標識またはスペーサは、ユーザが単一の降下を視覚化することに役立つように使用され得る。さらに、分布が行なわれるにつれ、スペーサは独立したプラグ流体を含んでいる部分への流体の分散を容易にし得る。揮発性搬送流体は、搬送流体が蒸発により除去されるように使用され得る。揮発性搬送流体の例は、ブタン、パーフルオロブタン、パーフルオロペンタンを含む。
【0022】
保持構成要素は、結晶化実験を準備することに理想的である。マイクロバッチ実験に関しては、事前装填されたカートリッジは、様々な濃度の沈殿剤プラグを含み得る。これらのプラグは、タンパク質溶液の流れと融合され、結晶化スクリーンをセットアップする。気相拡散実験に関しては、代替プラグ(乾燥剤と代替の沈殿剤)の事前装填されたカートリッジが使用され得る。気相拡散実験に関しては、システムは、沈殿剤プラグのみがタンパク質の流れと融合するように構成され得る。タンパク質の流れを様々な試剤と融合する代わりに、自由界面拡散実験を行なうために、タンパク質は、タンパク質自身のプラグをストリームフォームし、該プラグは、流れが停止した後、隣接する沈殿剤プラグと接触することを可能にし、自由界面を形成する。保持構成要素は、アッセイ、反応、スクリーンなどを行なうことにも理想的である。
【0023】
事前に装填されたカートリッジにおけるプラグの融合をさらに防ぐために、各一対のプラグは、(以下に記述されるように)スペーサによって分離され得る。
【0024】
保持構成要素における流体プラグの線形のアレイ内の各プラグは、少なくとも1つの溶媒および少なくとも1つの試剤を備え得る。溶媒と試剤との混合物が使用され得る。一部の実施形態において、各プラグは、異なる濃度の同じ試剤または試剤の混合物を含み得る。他の実施形態において、線形のアレイ内の少なくとも2つのプラグは、異なる試剤を含み得る。線形のアレイの構成要素は、ケミカルスペース(chemical space)の特定の部分をスパンするように選択され得る。本明細書において使用されるように、ケミカルスペースは、全ての可能な濃度で、生態系内に存在する分子および材料を含む全ての可能な小さい有機および無機の分子および材料を包含する。アレイを備えるプラグが同様な特徴(例えば、同様な分子量、親油性、位相特徴、反応基、コア構造など)を共有するように、アレイを備えるプラグが選択されるときには、線形のアレイは、ケミカルスペースの一部分をスパンし得る。同様な特徴を有する化合物は、様々な既存のデータベースの中に既に分類されている(例えば、Dobson、Nature、432:824〜828(2004)およびFeher、J.Chem.Inf.Comput.Sci.43:218〜227(2003)を参照)。
【0025】
結晶化スクリーンを行なうことに適している流体プラグの線形のアレイが選択される。タンパク質の結晶化に関しては、異なる「高感度」を有するアレイが使用され得る。つまり、粗いスクリーンに関しては、アレイは異なる試剤を有するプラグを含み得る。精細なスクリーンは、関連する特性を有する試剤または異なる濃度の同じ試剤を含み得る。
【0026】
標識は、本明細書において参照により援用される同時係属出願の米国特許出願第10/765,718号において記述されたような線形のアレイを指標とするために使用され得る。特定の実施形態において、線形のアレイ内の1つおきのプラグが、少なくとも1つの溶媒および少なくとも1つの試剤を備え、残りのプラグは少なくとも1つの溶媒および少なくとも1つの標識を備える。
【0027】
流体プラグを標識として使用することに加え、標識付けられたスペーサもまた、指標標識として使用され得る。そのようなスペーサは色付けられ得るか、または他の手段によって検出可能である構成要素を含み得る。
【0028】
他の実施形態において、標識は、より大きな間隔、例えば、約5、25、50、または100プラグごとに注入され得る。標識の使用は、測定構成要素の使用と組み合され得る。そのような組み合わせは、測定コンポーネントの標識をアレイと整列させることを容易にし得、注入される量のわずかな変化および収容構成要素の内径の任意の変化は、明らかなエラーを誘発しない(つまり、エラーは蓄積しない)。なぜならば、測定構成要素は、収容構成要素と直ちに再整列され得るからである。
【0029】
保持構成要素は、2つ以上の流体プラグを含む。一般的には、少なくとも約10、20、30、40、50、60、70、80、90、100、1000、2000、3000または10000個の流体プラグである。
【0030】
流体プラグ内の試剤の濃度は、反応の目的に依存する。結晶化実験に関しては、流体プラグの線形のアレイ内の各プラグは、一般的には、約1pL〜10μL、好適には約1〜50nLのプラグ流体を含む。結晶化実験に関しては、流体プラグの線形のアレイ内の各プラグは、一般的には、約10Mを下回る試剤を含む。一部の反応に関しては、プラグは、約1fMを下回る濃度を有する試剤を含み得る。他の反応、例えば、酵素に対するナノモルまたはフェムトモルの抑制剤、またはタンパク質に対する配位子に対するスクリーニングに関しては、プラグ内の溶液は、さらにより希釈される。結晶化以外へのアプリケーションに関しては、他の量および濃度が使用され得る。例えば、線形のアレイ内の各プラグは、約0.001fL〜10mLのプラグ流体を含み得る。
【0031】
(組み合わせ構成要素)
組み合せ構成要素が使用され、(a)プラグを試剤流体の流れに融合し、(b)プラグを他のプラグに融合し、(c)プラグの第1の集合体の間に、試剤流体の流れまたはプラグの第2の集合体を注入することによって代替プラグを形成する。(a)および(b)において、融合されたプラグは、均一であり得るか、内側に降下するプラグ、またはプラグに触れるプラグであり得る。(c)において、融合が以下に記述されるように誘発される場合には、代替プラグは後に融合する。さらに、第1の流体を備えたプラグの第1の集合体は、第2の流体からなる流れに融合され得、該第2の流体は、搬送流体、第1の流体、および存在する場合には、スペーサと非混和性である。この方法を使用して、結果としてのプラグの集合体における各プラグは、第1の流体を分割し、その結果としての第1の流体の2つの部位に直接的に接触する第2の流体の1つの部位を含む。
【0032】
組み合せ構成要素は、オンチップまたはオフチップのアクティブな構成要素(例えばバルブなど)を使用し得、流れを制御する。パッシブな構成要素のみを、または大部分はパッシブな構成要素を含む単純な組み合せ構成要素は、一部のアプリケーションに対して好ましい。パッシブな組み合せ構成要素が以下に記述される。
【0033】
一部の実施形態において、組み合せ構成要素は、少なくとも一つの送達マイクロチャンネルを備え、該マイクロチャンネルは、さらなる試剤をプラグに送達することに適しているが、そのさらなる試剤を含む新たなプラグを充分に形成することはない。他の実施形態、例えば、自由界面拡散結晶化実験のためのシステムにおいて、さらなる試剤を含む新たなプラグが、組み合せ構成要素において形成される。
【0034】
一実施形態において、組み合せ構成要素は、少なくとも一つのチャンネルを通じて融合された試剤流体の流れを使用し得る。流体の流れを誘発および制御する様々な方法が使用され得る。例えば、試剤流体の流れは、一定の圧力を生成する方法によって駆動され得る。圧力が、搬送流体に入る試剤の流れのキャピラリー圧力を下回るように、圧力は選択され得る。これが事実である場合には、流れは搬送流体に入らず、優先的にプラグの中に注入する。試剤の流れのキャピラリー圧力は、試剤の流れが適用されるチャンネルの(合流地点における)直径を減少させることによって増加され得る。さらに、圧力は、搬送流体/試剤の流れの界面における表面張力を増加させることによって増加され得る。流量が、例えば、シリンジポンプによって量的に制御される場合には、同様の効果が、ポンプと融合合流地点との間に弾力のある要素を導入することによって取得され得る。むしろ、キャピラリー圧力は、プラグの中に注入されることが所望される試剤の流れのおおよその量だけ、弾力のある要素の容量を変化させることに充分である。弾力のある材料は、例えば、(キャピラリー圧力によって圧縮された)気泡、またはマイクロチャンネルの屈曲性の要素(例えば、マイクロチャンネルの膨張を可能にする弾力のある部分)であり得る。
【0035】
特定の実施形態において、組み合せ構成要素は、(1)試剤の流れ(例えばタンパク質の流れ)、または(2)試剤プラグの流れのいずれかと融合されるプラグのアレイを可能にする任意のマイクロフルイディックであり得る。いずれの場合においても、いったん、プラグのアレイが、組み合せ構成要素のマイクロチャンネルを通過すると、少なくとも1つの融合されたプラグが生じる。試剤は、アレイ内の少なくとも1つのプラグの中に移転される。なぜならば、アレイは、マイクロチャンネルと流体接続する送達チャンネルを通過するからである。次に、融合されたプラグは、下流のチャンネルを通って流れ、下流のチャンネルにおいて、プラグはさらに、操作、混合、監視、選別、収集などに使用され得る。他の実施形態、例えば、自由界面拡散結晶化実験のためのシステムにおいて、組み合せ構成要素は、保持構成要素からのプラグのアレイが、プラグの新たな線形のアレイが形成される方法で、(1)試剤の流れ(例えばタンパク質の流れ)または(2)試剤プラグの流れと組み合わせられることが可能である任意のマイクロフルイディック装置であり得、該方法において、保持構成要素からのオリジナルのプラグは、導入された試剤を含む新たなプラグに換わる。
【0036】
図4aは、互いに実質的に平行になるように構成されている複数の送達チャンネル22を備えた組み合わせ構成要素を図示し、該送達チャンネルのそれぞれは、マイクロフルイディック組み合わせチャンネル23に対して垂直であり、かつ、それと流体交流(伝達)している。送達チャンネルは、共通の入口24から分岐し、チャンネルの相対距離が短いために、一斉に機能する。この実施形態において、保持構成要素内のプラグのアレイは、マイクロフルイディック組み合わせチャンネル23の一端を通じて、組み合わせ構成要素に送達され得る。試剤溶液(例えば、タンパク質水溶液の流れ)は、入口チャンネル24に送達される。プラグが送達チャンネルを通過するので、試剤溶液がプラグに送達される。融合されたプラグは組み合わせ構成要素を通って流れ、さらなる操作のために、第2の保持構成要素に収集され得るか、または収容構成要素に送達され得る。
【0037】
狭められた合流部分を有するチャンネルが使用され得ることにより、融合の間、流体プラグのアレイ内の試剤による導入された試剤の流れの二次汚染の潜在的な問題を低減する。例えば、タンパク質の流れが、様々な沈殿試剤を含む流体プラグのアレイに導入されるタンパク質結晶化実験において、タンパク質の流れの汚染による1つプラグから別の上流プラグへの1つの沈殿剤の二次汚染を防止することが所望される。しかしながら、より小さい送達チャンネルの使用は、各プラグに添加され得る試剤の量を限定する。より多い量の試剤の導入を可能にするが、狭められた合流地点の利点を維持するために、融合合流地点は、複数の分割されたチャンネルと共に製造され得る。横断面積および量的な流量の合計が同一である単一のチャンネルと比較すると、分割されたチャンネルは単一の幅のチャンネルよりも明らかに高いずれ速度を有し、その結果、拡散による汚染を低減する。より小さいチャンネルがまた機能して、任意の表面張力駆動の対流を低減する。そのような複数の小さいチャンネルがまた使用され得ることにより、気相拡散における選択的融合プロセスを助ける。
【0038】
送達チャンネルを通って送達される流れのキャピラリー圧力が、送達チャンネル全体の圧力降下とほぼ等しいか、またはそれよりも大きいときには、チャンネルは一斉に機能する。プラグが送達チャンネルのうちの1つの近位にあり、試剤の流れが、そのプラグと融合する場合には、試剤の流れはプラグの中に流れる。搬送流体/融合の流れの界面における表面張力による圧力は、他の送達チャンネルを通った搬送流体の中への試剤の流れに抵抗する。例えば、3つの送達チャンネルが使用され、試剤の流れがチャンネルのうちの1つを通ってのみ流れる場合には、他の2つのチャンネルにおける搬送流体/融合の流れの界面における表面張力による圧力は、その1つのチャンネルを通った試剤流体の流れによる圧力降下に等しい圧力を維持することができるように、充分に高くなければならない。搬送流体/融合の流れの界面における表面張力による圧力は、送達チャンネルと組み合わせチャンネルとの間の合流地点の幾何学様式(形状)に依存する。圧力降下は送達チャンネルの長さ、それらの断面寸法、試剤流体の粘度、および流量に依存する。従って、多くのパラメータが調節され得ることにより、搬送流体/融合の流れの界面における表面張力による圧力と圧力降下との間の所望の関係が達成される。
【0039】
複数の送達チャンネルおよびプラグの間の間隔は、送達チャンネルの周辺に少なくとも1つのプラグが常に存在するように設計され得る。この型は、搬送流体の中に試剤の流れを注入することなく、プラグと流れの一定の融合を可能にする。さらに、そのような型が使用され得ることにより、選択的融合が達成され、そのような型において、プラグのうちの一部のみが試剤の流れと融合する。例えば、第1のタイプのプラグは流れと融合するが、第2のタイプは融合しない。第2のタイプのプラグが、試剤の流れと融合する傾向がより低いときに、選択的融合は達成され得る(この選択性は、例えば、第2のタイプのプラグ流体の粘度を増加させること、または第2のプラグ流体/搬送流体の界面における表面張力を減少させることによって達成され得る)。さらに、重合体(ポリマー)は、第2のプラグ流体、特に、界面の粘度を増加させる界面活性重合体に添加され得る。選択的融合を達成するために、特に、送達チャンネルの周辺において、少なくとも1つの第1のタイプのプラグが常に存在するように、送達チャンネルおよびプラグの間の間隔が存在するときに、この型が使用され得る。
【0040】
図12は、考えられる別の融合形状の例を示し、該例はまた、二次汚染を最小化するように設計される。この形状において、小さい横のチャンネルが使用されることにより、搬送流体が導かれ、試剤の流れを分けることを補助する。
【0041】
一部のアプリケーションにおいて、単純な方法、例えば、実質的に一定の圧力または一定量の流れを1つ以上の入口に提供することが可能ではない方法を使用して、組み合わせ構成要素の中に流れを押し流すことが好ましいことがあり得る。一部の方法は、電力またはコンピュータ制御を必要としないように設計され得る。そのような方法は、野外の診断およびテスト、ならびに単純さと低コストが所望される他のアプリケーションに対して有益である。例えば、組み合わせ構成要素において、保持構成要素および組み合わせられる試剤の流れを通ったプラグの相対流量は制御されなければならない。この制御は、複数のシリンジポンプまたは他の確立されたポンプ方法を用いて容易に達成され得る。さらに、流体割り当て装置を使用し得る。この装置は、圧力源、例えば、シリンジまたはポンプと、押される流体の流れまたはアレイとの間に置かれ得る。この装置は、Y字型の合流地点として設計され得、Y字の底部に対応する入口、およびY字の頂上部に対応する2つの出口を有する。装置は、1つの搬送流体または複数の搬送流体で満たされ得、出口は、保持構成要素の入口および組み合わせ構成要素の試剤の流れに対応する入口に接続されている。2つの出口の流体の抵抗の比率は、流量の所望の比率に対応するように構成されている。2つの出口の個々の流体の抵抗は、Y字の2つの腕の相対的長さおよび/または直径を個々に変化させることによって制御され得る。好ましくは、Y字の2つの出口の流体の抵抗は、保持構成要素および組み合わせ構成要素の流体の抵抗よりも充分に高く(例えば、100倍)、その結果、保持構成要素および組み合わせ構成要素を通る流量は、Y字の2つの出口の流体の抵抗の比率によって決定される。同様のアプローチが使用され得ることにより、2つよりも多い流れの流量を制御する。このアプローチは魅力的である。なぜならば、多くのアプリケーションにおいて、キャピラリーの数が正常な範囲にある限り、プラグの挙動は、流量の絶対値よりも、むしろ流量の比率によって決定される。このアプローチにおいて、流れは、単一のポンプまたは手動で駆動され得、それでも正常な比率の複数の流量を提供する。そのような流体割り当て装置は、保持構成要素を有するキット内で提供され得る。
【0042】
任意の量の試剤溶液は流体プラグと融合され得る。試剤溶液の流量は、融合されたプラグ内の試剤の濃度を変化させるために組み合わせる間に変化され得る。送達される試剤の量は、検出を意図した技術によって実質的に決定され得る。例えば、反応生成物が検出された場合には、フェムトリットル(またはそれを下回る)の量の試剤溶液が送達され得る。
【0043】
タンパク質の結晶化に関しては、一般的には、プラグ流体と組み合わせられるタンパク質溶液の量は、プラグ流体の量と同様である(一般的には、1:5〜5:1であるプラグ流体に対するタンパク質溶液の比率が使用される)。プラグと組み合わせられるタンパク質溶液の量は、プラグの流れとタンパク質の流れとの流量の比率によって制御され得る。さらに、送達されるタンパク質溶液の量は実験の目的に依存する。目的が、結晶または沈殿剤の形成を単に検出することである場合には、pLの量が使用され得る。目的が結晶構造を取得することである場合には、10nL以上の量が必要とされ得る。概して、約1nL〜100nL、好適には約10nLのタンパク質溶液が、各プラグに送達される。タンパク質の結晶化に関しては、タンパク質の濃度は、一般的には約0.001mg/mL〜100mg/mL、好適には0.1mg/mL〜50mg/mLである。
【0044】
(収容構成要素)
収容構成要素は、組み合わせ構成要素または他のマイクロチャンネルと流体接続するように構成された少なくとも1つのオープンエンドを有する第1のマイクロチャンネルを備える。収容構成要素は、本出願の別の場所で記述されたようなマイクロフルイディク装置であり得る。収容構成要素は、上記の保持構成要素と同一であるように構成され得る。タンパク質の結晶化実験を行なうために用いられるときには、収容構成要素は、プラグ内で形成される結晶の構成要素上でのx線回折に適した材料、例えばガラスで構成されることが有益であり得る。アッセイのために使用されるときには、収容構成要素は、光学的検出に適した材料、例えばガラスまたはプラスチックで構成され得る。
【0045】
収容構成要素は、プラグ内容の温度を制御する装置を備え得ることにより、例えば反応量を制御する。収容構成要素はまた、プラグ内容を照射または放射する装置を備え、例えば光化学反応を開始する。収容構成要素は、プラグを選別または監視するように設計され得る。収容構成要素は、プラグ内容を検出または分析する装置から分離され得るか、またはそれに統合され得る。
【0046】
収容構成要素は、アクティブな表面を備え得る。このアクティブな表面は、プラグ流体による湿潤を誘発し得る。プラグ流体による湿潤は、例えば、自由界面拡散による高分子の結晶化において、例えば、プラグ流体間の接触を作り出すために使用され得る。このアクティブな表面はまた反応性であり得る。反応は、プラグ流体との接触、および/または搬送流体、スペーサ、または標識を通じて、プラグ流体と表面との間での(いずれかの方向または両方の方向への)試剤の輸送によって生じ得る。
【0047】
(測定構成要素)
測定構成要素は、ユーザが、マイクロチャンネル内のプラグの位置から個々のプラグを識別することを可能にする。線形のアレイ内のプラグの数があまりにも多く、プラグを手動で数えることが可能ではない場合には、測定構成要素は有益であり得る。プラグを自動的に数えることが所望される場合には、測定構成要素はまた有益であり得る。
【0048】
収容構成要素は、マイクロチャンネル内の流体プラグの配置を識別するために、統合測定構成要素(例えば、1つ以上の物理的標識)を備え得る。代替的に、収容構成要素から分離した測定構成要素が使用され得る。分離測定構成要素が使用されるときには、測定装置および収容構成要素を含んでいるキットを提供することが好ましい。特定の実施形態において、キットは、保持構成要素と、保持構成要素の内容が収容構成要素に移動させられた後で、保持構成要素の内容の1つの位置または複数の位置を示すように設計された調和測定構成要素とを備え得る。測定構成要素は、例えば、収容構成要素上に嵌合するように設計されたカードであり得る。
【0049】
測定構成要素はルーラであり得、ルーラにおいて、測定標識は、収容構成要素におけるアレイ内のプラグの位置に相関する。測定標識は、点、線、線分などで形成され得る。標識は、屈折率の違いに基づいて、発光性(蛍光性、燐光性、化学発光性など)、反射性ま
たは吸収性であり得、かつ、他の形式の光学標識であり得る。
【0050】
標識は数字でもあり得る。標識は、人間が判読可能であり得、文字を含み得るか、機械が判読可能であるか、またはその両方であり得る。考えられる機械が判読可能な標識は、例えば上記の方法の任意のものを使用して実装されるバーコードを含み、Nicewarner−Penaら、Science294:137〜141(2001)において記述されたようなナノスケールのバーコードも含む。
【0051】
プラグが視覚的に位置付けすることが困難であるときには、搬送流体およびプラグ流体が調和屈折率を有するときに生じ得るように、測定構成要素が視覚化を助け得る。屈折率調和は、プラグの内容を視覚化することに役立つ。
【0052】
測定構成要素は、あらゆるプラグの位置を標識付ける必要はない。測定構成要素は、例えば、3つのプラグごと、または5つのプラグごとのように複数のプラグを単に標識付け得るか、プラグの線形のアレイに沿って、試剤化合物に関する充分な変化の1つの位置または複数の位置を標識付けし得る。
【0053】
ユーザを助けるために、プラグのアレイは、標識プラグまたはスペーサを備え得る。次に、標識プラグまたはスペーサは、ユーザが測定構成要素をアレイに最初に整列することか、またはユーザが、測定構成要素を使用することなく、収容構成要素内のプラグを識別することに役立つ。いくつかのタイプの標識が使用され得る。例えば、第1のタイプの標識が10個のプラグ毎に、第2のタイプの標識が50個のプラグ毎に、第3のタイプの標識が250個のプラグ毎などに使用される。異なるタイプのプラグは、例えば色が異なり得る。
【0054】
(構成要素の形成)
構成要素は、当該分野において公知の方法を使用して形成され得るマイクロチャンネルを備え得る。例えば、係属中の米国特許出願第10/765,718号は、マイクロチャンネルの製造、ならびに流体プラグを分裂、融合、および操作するためにそれらを使用する方法を記述する。
【0055】
本発明の構成要素は、キャピラリー、(約10mmを下回り、好適には1mmを下回る直径を有する管状にした)エッチングまたはモールドまたはエンボスされたマイクロチャンネルを有する基板、またはそれらの組み合わせから形成され得る。構成要素は、接合されたかまたは分離されたかのいずれかで複数のチャンネルを備え得る。好適には、マイクロチャンネルは、長方形の断面よりも、むしろ円形または丸い断面を有することにより、プラグの輸送を容易にし、プラグの合体を減少させる。しかしながら、任意の形状が使用され得る。
【0056】
円形または概ね円形の断面を有するチャンネルを製作するために、薄片の管またはキャピラリーが、長方形のチャンネルに挿入され得る。この技術は、プラグの形成を容易にし得、チップを他の構成要素に接続する方法も提供し得る。複数の管が複数のチャンネルに挿入され得る。管またはキャピラリーが搬送流体によって優先的に湿潤されるように、管またはキャピラリーは選択され得る。例えば、テフロン(登録商標)は、水溶性流体よりも優先的にフッ化流体によって湿潤される。管またはキャピラリーは、必要に応じて、フレアのついた漏斗状の縁(または狭められた縁)を有し得ることにより、他の構成要素との接続を容易にする。そのような装置を製作するために、層を密閉する(例えば、PDMS層の密閉)前、または長方形のチャンネルが製作された後のいずれかに、管またはキャピラリーはチャンネルの中に挿入され得る。管またはキャピラリーの外表面と長方形のチャンネルとの間の空間を満たすことがまた所望される。この空間は粘着性の液体または重合体で満たされ得る。例えば、PDMSが使用され得る。
【0057】
個々の構成要素は、同じか、または異なる材料から形成され得る。構成要素は、水と接触することに反応する材料から形成され得る。水と接触することに反応する重合体が合成される(Senshuら、Langmuir、15、1754〜1762(1999);Moriら、Macromolecules 27、4093〜4100(1994))。これらのダイブロック重合体は、親水性および疎水性のドメインを含む。空気にさらされたときに、疎水性のブロックは表面に遊走し、表面エネルギーを最小化し、該表面は疎水性となる。水と接触すると、表面の再構成が生じ、水が親水性のブロックのみと接触するまで、親水性のブロックは、重合体と水との界面に遊走する。例示的な重合体は、ポリ(スチレン−b−2,3−デヒドロキシプロピルメタクリル酸塩)およびポリ(4−オクチルスチレン−b−2,3−デヒドロキシプロピルメタクリル酸塩)を含む。
【0058】
不透明な粒子、例えば、カーボンブラック粒子(好適には、約5ミクロンを下回る直径を有するカーボンブラック粒子)が、構成要素を作るために使用される材料に統合され得る。このように、実質的に黒いチャンネルが製作され得ることにより、背景光に関する問題(例えば、蛍光分析の感度を増加させる)を消去する。
【0059】
アダプタが、例えば、キャピラリーまたは複数の管を接続する接続部として使用され得る。アダプタは、中央において狭まるI.D.(内径)を有する小さいガラス管であり得る。異なるI.D.のアダプタが市販されている。ガラスアダプタの内壁の表面の化学的性質は、シラン処理によって疎水性に作られ得る。アダプタは、伸長テフロン(登録商標)パイプからも容易に創作され得る。これを行なうために、1本のテフロン(登録商標)パイプの一部が、ある地点で伸長される。伸長地点のI.D.およびO.D.(外径)の両方は減少し、アダプタとしての使用に適したチューブとなる。
【0060】
(プラグ形成)
本明細書において使用されるように、少なくとも1つのプラグ流体が、プラグ流体が非混和性である搬送流体の流れの中に導入されたときに、「プラグ」は形成される。マイクロフルイディック装置内の流体の流れは、例えば、圧力、放射線、熱、振動、超音波、電場、または磁場の存在または適用から、直接的または間接的に生じる駆動力または刺激によって誘発される。プラグは、サイズが変化し得るが、形成されるときに、それらの断面は、一般的には、プラグが形成されるチャンネルの断面と同じである。円形ではない形状のチャンネルにおいて、プラグは、チャンネルの断面の少なくとも1つの寸法と断面のサイズが同じでなければならない。プラグは搬送流体によって実質的に取り囲まれなければならない。つまり、搬送流体は、プラグ流体がマイクロチャンネルを湿潤するよりも広い範囲を湿潤しなければならない。プラグが、異なる直径の下流のチャンネルを通過する場合、またはプラグが、さらなるプラグと融合するときに、プラグの断面は変化し得る。プラグは形状が変化し得る。用語「プラグ」はまた、プラグ内プラグ、プラグ内ドロップ、およびプラグ内固体(例えばビーズ)を含む。この概略的な定義に対する例外は、スペーサが使用されたときには、プラグがマイクロチャンネルの断面よりも小さくなり得るということである。
【0061】
本明細書において使用されるように、「融合されたプラグ」は、(1)単一のプラグを形成する2つ以上のプラグの組み合わせ、または(2)2つ以上のプラグがときとともに融合するような、マイクロチャンネル内での2つのプラグの並列のいずれかを呼ぶ。
【0062】
分散を最小化して、マイクロチャンネルを通してプラグを形成および移動するために、プラグの内側の流体が、マイクロチャンネルの壁に粘着してはいけない。これを達成するために、プラグ/チャンネルの界面における表面張力は、プラグ/搬送流体の界面における表面張力よりも高くなければならない。プラグが水溶性であり、搬送流体が油であるときには、無数のキャピラリーの数Caは、理想的には、約0.1を下回り:
Ca=Uμ/γ
となり、γ[N m−1]は、油/水の界面における表面張力であり、Uは、m/secでの速度であり、μは粘度(Pa・sec)である。
【0063】
本発明において使用されているマイクロチャンネルは、プラグ流体による湿潤よりも優先的に、搬送流体によってマイクロチャンネルを湿潤可能にするように表面処理され得る。例えば、ガラスキャピラリーが、シラン処理され得ることにより、搬送流体に対する水溶性のプラグの湿潤を減少させる。さらに、マイクロチャンネルは、プラグの導入前に搬送流体を用いて、最初に洗い流され得る。
【0064】
プラグは、実質的に任意の流体、例えば、1つ以上の水溶液、1つ以上の有機溶液、1つ以上の無機溶液、またはそれらの組み合わせから形成され得る。プラグは、水、保存溶液、緩衝液、試剤、溶媒、食塩水、重合体溶液、沈殿剤溶液、金属懸濁液、細胞浮遊液などから形成され得る。
【0065】
プラグのサイズは、本出願を通して記述されているように、例えばプラグ流体および搬送流体のマイクロチャンネルの中への相対流速量によって制御され得る。流速量は好適にはポンプを使用して制御され得る。
【0066】
プラグの形成の間に、様々なプロセスが生じ得る。例えば、脂質(例えばMO、モノオレイン)の流れが、水溶液を有するプラグに組み合わせられ、2つの液体がプラグの内側で活発に混合されるときに、脂質立法相(LCP)の形成が生じ得る。高分子、例えば、タンパク質または膜タンパク質の水溶液が使用され得る。この混合は、(本発明者によって以前に記述されたように)プラグが湾曲するチャンネルにおける複数の屈曲を通って移動するときに誘発される無秩序な移流によって実行され得る。粘着性の搬送流体が使用され得ることにより、プラグの内側でより高いずれを誘発し、さらに効果的な混合を確実にする。この方法は、例えば、LCPに関する結晶化を最小化することに対して魅力がある。
【0067】
マイクロチャンネル内のプラグの間隔は、様々な方法で制御され得る。一実施形態において、試剤溶液の1つの集合体が、非混和性の搬送流体の流れの中に継続的に注入され、プラグを形成し、第2の集合体は、さらに下流に継続的に注入される。安定した界面活性剤を有する搬送流体が使用される場合には、溶液の第2の集合体は、プラグの中に注入されるよりも、既に形成されたプラグに直に隣接して分布されるプラグを形成することが好まれる。試剤溶液と搬送流体との間の界面における界面活性剤集合体、および2つのプラグ流体の間の搬送流体の層によって癒着することを防止される。プラグ流体が異なる特性、例えば異なる粘度を有する場合に、主チャンネルにおいてプラグを対にすることが生じる。この対にすることは、例えば、気相拡散の使用および自由界面拡散方法による高分子の結晶化に対するアプリケーションに対して有益であり得る。
【0068】
互い違いの構造のプラグは、水溶液を正面から搬送流体の中に流すことによって形成され得る。流れている搬送流体はプラグ間にバリアを提供し、該バリアはプラグが癒着することを防止する。互い違いのプラグの形成はキャピラリー数によって制御される。同じ幅のマイクロチャンネルの入口に対して、水溶液の流れの流量の割合が、液滴のサイズの割合を決定する。水溶液の上部の流れの流量が、水溶液の底部の流れの流量よりも2倍速い場合に、その結果生じる液滴のサイズは、約2:1の割合にある。一部の場合において、ほぼ同じサイズのプラグが形成され得るが、速い流れから2つのプラグか、遅い流れの1つのプラグごとに対して形成され得る。マイクロチャンネルの入口の寸法の割合はまた、液滴のサイズの割合に影響するように設計され得る。水溶液の上部の流れに対するマイクロチャンネルが、水溶液の底部の流れに対するマイクロチャンネルに対して2倍以上の幅である場合に、その結果生じる液滴は、約2:1の割合であり得る。プラグ流体が異なる特性、例えば、異なる粘度を有する場合に、主チャンネル内で互い違いのプラグを対にすることが生じる。
【0069】
アレイに沿ったプラグの溶液の濃度は、プラグ流体の流れの構成要素の相対流量を単に変化させることによって急激に変化され得る。この法則は、マイクロチャンネル内のプラグの線形のアレイをセットアップするために使用され得る。例えば、この法則は、様々な濃度のタンパク質および/または水溶性のプラグのアレイ内の様々な濃度の沈殿剤試剤を形成することによって結晶化試験をセットアップするために使用され得る。そのような線形のアレイを含む事前装填されたカートリッジは、結晶化状態を最適化するために使用され得る。
【0070】
一部の実施形態において、アプリケーションに必要とされるプラグよりも大きいプラグを形成することが、より簡単であるか、またはより安価であり得る。例えば、タンパク質結晶化スクリーニングに対して所望されるより小さい10nLのプラグよりも、むしろ約1マイクロリッターの量のより大きいプラグをより確実に作ることが簡単であり得る。装填構成要素が、大量の流体を制御するために利用可能である場合に、複数の保持構成要素を1つの装填構成要素に接続し、複数の保持構成要素をより小さいプラグと並列して製作することが好ましいことがあり得る。例えば、自動的な保持構成要素が、1マイクロリッターの量を吸引することが可能であり、25個のキャピラリーが、この装填構成要素に並列して接続され、その結果、同じ量が各キャピラリーの中に吸引された場合に、1マイクロリッターの量のプラグ流体、搬送流体、およびスペーサを首尾よく吸引することによって、キャピラリーのアレイが約40nLの搬送流体と約40nLのスペーサとによって分離された約40nLのより小さいサイズのプラグを備えるように、キャピラリーのアレイは作成される。例えば、自動的な装填構成要素は、搬送流体、スペーサ(例えば、空気)、搬送流体、第1の試剤混合物、搬送流体、スペーサ、搬送流体、第2の試剤混合物、搬送流体、スペーサ、搬送流体、第3の試剤混合物、搬送流体などを続けて吸引し得る。保持構成要素に入る溶液に対するキャピラリーの圧力は、流れを駆動するために使用される圧力(または圧力差)よりも充分に低いことが好ましい。これは、流体が実質的に同じ量だけ全ての保持構成要素に入ることを確実にする。さらに、プラグ流体が保持構成要素の中に入って進むにつれ、キャピラリーの圧力が増加するように、保持構成要素の入口は設計され得る(一実施形態において、この増加は、入口地点から狭まっていく保持構成要素を使用することによって達成され得る)。そのような入口は、保持構成要素に入る量のより均等な分布を容易にし得る。好適には、保持構成要素は、プラグ流体によって湿潤されないことにより、プラグ流体が保持構成要素に吸着すること、および二次汚染を引き起こすことを防止する。
【0071】
上記のこのアプローチは、複数の保持構成要素の中への吸引に限定されず、他の分布方法にも有益である。
【0072】
プラグは、より大きいプラグをより小さいプラグに分裂させることによっても作られ得る。この実施形態において、マイクロチャンネルは、単一の合流地点において、1つ以上のより小さい収容マイクロチャンネルに分裂される。この合流地点は狭まるように製作され、その結果、キャピラリーの数が増加される。プラグを分割するプロセスは、収容チャンネル内の圧力または圧力降下を調節することによって制御され得る。出口における表面張力による圧力が、収容チャンネル全体の圧力降下よりも充分に低い(例えば、10倍、好適には、100倍または1000倍以上)ように、収容チャンネルが設計されることが好ましい。これは、分裂が出口において分散される流体よりも、むしろチャンネル全体の圧力降下によって制御されることを確実にする。出口におけるキャピラリーの圧力は、保持構成要素を搬送流体で事前に満たし、搬送流体、プラグ流体、およびスペーサを有する低い表面張力を有する流体を用いて、保持構成要素の出口を貯水溝の中に浸すことによって減少され得る。同様に、分裂合流地点におけるキャピラリーの圧力は、収容チャンネル全体の圧力降下よりも充分に低いことが好ましい。同様に、分裂合流地点におけるキャピラリーの数は、分裂が生じることを可能にするように充分に多くなければならない。
【0073】
代替的に、長いプラグが、合流地点において搬送流体の流れの中に流され得る。長いプラグは、搬送流体によって分離された一連の小さいプラグに分かれる。
【0074】
大きいプラグは小さいプラグに分けられ、その結果、小さいプラグは、大きいプラグに最初に含まれた溶液を異なる濃度で含む。タンパク質の結晶化に適用されたときに、この方法は、同じアレイを用いて、スパース行列スクリーンおよび勾配スクリーンを実行することを可能にする。一実施形態において、保持構成要素は、スパース行列スクリーンのために、適切な溶液の大きい(例えば、約100nL)プラグを含む。これらの大きく長いプラグは、搬送流体の流れの中に流され、その結果、プラグは一連の小さく短いプラグに分かれる。搬送流体の流量に対する大きいプラグの流量は、小さいプラグのサイズを制御する。続けて、タンパク質溶液が、下流のチャンネルの末端を通して、より小さいサイズのプラグに組み合わせられ、プラグを含んでいる流れの流量に対するこの末端の流れの流量は、より小さいサイズのプラグ内のタンパク質の濃度を制御する。同様に、緩衝液が小さいプラグに添加され得ることにより、各結晶化アッセイが同じ量で行なわれることを確実にする。スペーサ(例えば、気泡)は、大きいプラグの間の保持構成要素内に含まれ、プラグの操作の間に、さらに導入され得る。
【0075】
代替的に、大きいプラグは水溶性の流れの中に流され得る。この流れは1つ以上の溶液を含み得る。タンパク質の結晶化に適用されたときに、流れは、タンパク質溶液と緩衝液との層流を含み得る。その結果生じる複数の構成要素の流れが、搬送流体の流れの中に流され、搬送流体の流れにおいて、組み合わされた水溶性の流れは、一連のプラグに分かれる。さらに、このアプリケーションにおいて、大きな液滴は、スパース行列スクリーンのために溶液を含み得、水溶性の流れおよび大きいプラグの流量が変化し得ることにより、これらの試剤のうちの任意の試剤に関する濃度の勾配を作成し、ハイブリッドスクリーンをもたらす。スペーサは、大きいプラグの間の保持構成要素において使用され得る。標識もまた、大きいプラグの間で使用され得る。
【0076】
(搬送流体)
搬送流体は、プラグ流体と実質的に非混和性である任意の液体または気体であり得る。好適には、プラグが水溶性であるときに、搬送流体は液体である。搬送流体内のプラグ流体の表面張力は、理論的には約5〜15mN/mの間にあり、好適には約10mN/mである。他のゼロではない表面張力の値が使用され得る。搬送流体は、プラグ流体または試剤に対して透過性があり得る。
【0077】
膜タンパク質の結晶化に関しては、パーフルオロアミンまたはそれらの混合物が理想的な搬送流体である。なぜならば、それらは水溶性のプラグに対して表面(特にテフロン(登録商標)装置におけるフッ化処理された表面)を優先的に湿潤する。
【0078】
一部の実施形態において、キャリア流体に界面活性剤を添加することが所望される。界面活性剤が使用され得ることにより、表面張力および搬送流体の湿潤特性を制御する。フッ化流体が搬送流体として使用されたときに、本発明者らは、1H,1H,2H,2H−パーフルオロクタノールを界面活性剤として使用した。界面活性剤はまた、プラグと搬送流体との間の界面に対するプラグの内容の非特異的吸着を制御するために使用され得る。例えば、可溶性フルオラス(fluorous)界面活性剤は、フッ化搬送流体と水溶液との界面における非特異的タンパク質吸着を制御するために使用され得る。例示的な可溶性フッ化界面活性剤は、オリゴエチレングリコール分子トリエチレングリコールモノ[1H,1H−パーフルオロクチル]エチルCF3(CF2)7CH2O(CH2CH2O)3H)である。この界面活性剤は、プラグ形成の間、フッ化搬送流体と水溶液との界面に自身を配置し、オリゴエチレングリコール基の単分子層に存在する。この界面は、表面に対して素早く強力に吸着することで公知のタンパク質であるフィブリノゲンの濃縮溶液を含む多種多様なタンパク質および酵素の吸着に抵抗した。非特異的吸着に抵抗する同じ能力を有する界面活性剤が、フルオラス水溶液抽出(fluorous−aqueous extraction)を介して、DuPontから市販されているZonyl FSO−100から抽出され得る。可変フッ化アルカン鎖長、可変グリコール長、および様々なスペーサ連結を有する他のオリゴエチレングリコールコンジナーはまた、水溶液とフルオラスとの界面におけるタンパク質の吸着を防止する。逆に、不活性ではない官能基を用いて冠着された界面活性剤は、タンパク質を液体間界面に引き寄せて結合する。
【0079】
(スペーサ)
本発明のアレイは、必要に応じてスペーサを含み得る。適切なスペーサは、少なくとも1つの液体(例えば、イオン性の液体、フルオロシリコーン、炭化水素、フッ化液体)、気体(好適には、不活性の気体、例えば、窒素、アルゴンまたはキセノン)、ゲルまたは固体(例えば、ポリスチレンのような重合体)から成り、それらはプラグ流体と搬送流体との両方に対して非混和性である。本発明のアレイは、複数のタイプのスペーサを含み得る。
【0080】
スペーサはまた標識を含み得、その結果、スペーサは、上記のようにプラグを示すために使用され得る。スペーサはまた、(例えば、光学的伝達を防止すること、または透過を防止することによって)プラグ間の交差連通を減少させるために使用され得る。スペーサはまた、機能特性を有し得る。例えば、キセノンの気泡が、高分子の結晶化においてスペーサとして使用されるとき、特に、実験が圧力を増加された下で行なわれるときに、キセノンが生長している高分子結晶に統合され得、その回折特性を改善する。
【0081】
スペーサは、液体から成るプラグの形成および操作(例えば、分裂)に関して記述された同じ方法を使用して、形成および操作され得る。特に、液体のプラグと気泡との両方から成る流れは、互い違いの液体構成のプラグの流れを形成するために使用される同じ方法を使用して形成され得る。スペーサは、アレイの自動的な製作の間に導入され得る。スペーサによって分離された大きいプラグのアレイが分裂され、小さいプラグのいくつかのアレイを製作する場合に、スペーサもまた分裂されることが好ましい。
【0082】
スペーサはプラグの操作において重要な役割を担い得る。第1に、所望されないプラグの融合が生じる場合に、スペーサはプラグの間に挿入され得ることにより、融合を最小化する。そのようなスペーサは、スペーサを用いないよりも長い距離を通したプラグのアレイの輸送を可能にし得る。そのようなスペーサはまた、装置およびキャピラリーの内外へのプラグの移送(または装置およびキャピラリーの組み合わせで作られた合成装置を通じた移送)を容易にする。
【0083】
スペーサはまた、プラスチックまたはPDMSのチャンネルの内側の自由界面拡散を容易にするために使用され得る。反応構成要素を含んでいるプラグの間の気泡に関しては、両端から圧力を加えることによって、気泡は、プラスチックまたはPDMSの壁を通して取り除かれる。次に、2つのプラグが充分に近付けられることにより、新たに形成されたプラグ間界面全体で拡散を可能にする。そのようなシステムは、タンパク質の結晶化に適用され得、タンパク質の結晶化において、1つのプラグはタンパク質を含み、他のプラグは沈殿剤を含む。圧力が加えられ、気泡が圧縮された場合に、スペーサによって分離されたプラグは接触し得る。
【0084】
(キット)
上記のように、キットの一実施形態は、収容構成要素および測定構成要素を備える。
【0085】
別の実施形態において、本発明のキットは、組み合わせ構成要素、貯水溝およびポンプを備え得る。この実施形態における使用に適したポンプは、充分な圧力を提供し得ることにより、貯水溝から入口を通って、送達チャンネルを通り、組み合わせ構成要素のマイクロチャンネルの中に溶液、例えばタンパク質溶液を駆動する。
【0086】
別の実施形態において、キットは2つ以上の保持構成要素を備える。例えば、キット内の保持構成要素は、ケミカルスペースの一部分をスパンし得る。別の実施形態において、キットは、ゲノムをスパンしている複数の保持構成要素を備え得る。
【0087】
別の実施形態において、キットは、組み合わせ構成要素および1つ以上の収容構成要素を備え、組み合わせ構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。キットはまた、2個、3個、4個、5個、10個、20個、50個またはそれ以上の収容構成要素を含み得る。
【0088】
別の実施形態において、キットは、1つ以上の保持構成要素および組み合わせ構成要素を備え、組み合わせ構成要素および保持構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0089】
別の実施形態において、キットは、1つ以上の保持構成要素、1つ以上の組み合わせ構成要素、および1つ以上の収容構成要素を備え、組み合わせ構成要素、保持構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0090】
別の実施形態において、キットは、1つ以上の装填構成要素、1つ以上の保持構成要素、1つ以上の組み合わせ構成要素、および1つ以上の収容構成要素を備え、装填構成要素、組み合わせ構成要素、保持構成要素および収容構成要素のマイクロチャンネルが互いに流体接続を形成し得るように、該マイクロチャンネルはサイズ付けられ、かつ、形作られる。
【0091】
(様々な構成要素の中へのプラグのアレイの移送)
プラグは、構成要素の一端を他の構成要素の一端に直接的に挿入し、合流地点を密閉し、漏洩を抑制することによって、1つの構成要素から他の構成要素に移送され得る。代替的に、アダプタ(例えば漏斗)が、様々な構成要素を接続するために使用され得る。
【0092】
プラグは、第1の構成要素の出口の反対側の端に圧力を加えることにより、第1の構成要素のマイクロチャンネルから第2の構成要素のマイクロチャンネルの中に押され得るか、または第2の構成要素のチャンネルの内側に減圧を加えることによって、第2の構成要素の中に引き込まれ得る。流体の流れを駆動する他の標準的な方法がまた、上記のように使用され得る。
【0093】
プラグ内の様々な流体の混合率は、同時係属中の米国特許出願第10/765,718号において記述されたように制御され得る。例えば、プラグが湾曲するチャンネルを通って輸送されるときには、急速な混合が誘発され得る。装填構成要素から保持構成要素の中に、もしくは保持構成要素から組み合わせ構成要素の中に、または組み合わせ構成要素から収容構成要素に輸送されるプラグ内の反応時間を増加させるために、プラグは、充分に遅い速度で輸送され得るか、または流れを完全に止めるか、もしくは充分に減少させるかのいずれかであり得る。
【0094】
本発明の一部のアプリケーションにおいて、すぐに続けてまたは組み合わせのイベントの間にある程度の遅延を伴ってのいずれかで、プラグが1つよりも多い次のプラグまたは流れと組み合わされることを可能にすることが所望される。一部の実施形態において、組み合わせ構成要素は、対応する数の貯水溝に接続された1つよりも多い送達チャンネルを含み得、プラグのアレイが送達チャンネルを連続して通過することを可能にする。従って、試剤が各入口を通過するので、各送達チャンネルからの試剤は、各プラグの中に輸送される。そのような実施形態において、試剤の各移送の間の遅延は、送達チャンネル間の距離とプラグのアレイの流量とによって制御され得る。他の実施形態において、組み合わせ構成要素を使用して以前に第1の試剤と組み合わせられたプラグのアレイを含む収容構成要素は、組み合わせ構成要素を使用して第2の試剤と続けて組み合わせられ得る。第1の試剤と組み合わせる際に使用される組み合わせ構成要素は、第2の試剤と組み合わせる際に使用される装置と同じ装置か、または異なる装置かのいずれかであり得る。例えば、酵素の潜在的な防止剤である小分子のライブラリを含むプラグのアレイは、最初に酵素溶液と組み合わせられ、平衡になることを可能にされ得る。続けて、酵素および小分子を含んでいるこのプラグのアレイは、酵素の基質と組み合わされ得、酵素触媒反応がモニタリングされ得ることにより、潜在的な防止剤の有効性が決定する。ほぼ円形の断面を有するパイプの使用は、長い距離にわたるプラグの確かな輸送を達成することに特に有益であり得、該パイプは、反応に対して適切な長さの遅延を達成するためにも使用され得る。
【0095】
構成要素は再利用され得る。例えば、装填構成要素の入口は、第1の保持構成要素(例えばキャピラリー)に接続され得ることにより、プラグのアレイを収集する。アレイの移送の後に、第1の保持構成要素は、装填構成要素から取り外され得、必要である場合には、密閉または冠着される。次に、第2の保持構成要素は、装填構成要素に接続され得、満たされ得る。組み合わせ構成要素は同様な方法で再利用され得る。
【0096】
自動化された装置が、複数の装填構成要素と保持構成要素と収容構成要素とを相互作用するように使用され得る。例えば、1つの装填構成要素は、多数の保持構成要素の中にプラグを装填するために使用され得、該保持構成要素は、自動化された器具によって場所を換えられる。定温放置の間に、保持構成要素または収容構成要素は、プラグ内の反応または結晶化の程度をモニタリングするモニタリングステーションに輸送され得る。保持構成要素または収容構成要素は、モニタリングステーションまたはいくつかのステーションを通過して継続的に輸送され得る。このモニタリングが使用され得ることにより、例えば、結晶化または反応が起こったプラグまたは一連のプラグを検出する。収容構成要素が使用され得ることにより、例えば、所望のプロセスが起こったプラグを検出、選別および/または分離する。
【0097】
図1は、保持構成要素と装填構成要素との間の接続を行なうために使用され得る漏斗状のアダプタ2を図示している。この図示において、保持構成要素はキャピラリー3であり、装填構成要素はマイクロフルイディック装置1である。代替的に、アダプタはマイクロフルイディック装置またはキャピラリーのいずれかに吸着され得る。
【0098】
図2aは、大きいプラグの単一のアレイが、どのように実質的に同一の特性の複数のアレイに分裂され得るかを図示し、各アレイは、より小さいプラグを含む。この分裂は、実質的に同じサイズのより小さくサイズされたチャンネルの対の中に最初の流体の流れを継続的に導くことによって達成される。そのような装置が使用され得ることにより、大きい(例えば、〜800μm)チャンネルを有するマイクロフルイディック装置内のマイクロリッターサイズのプラグのアレイを小さいチャンネル内のnLのプラグに分裂させる。
【0099】
(プラグ内の反応)
本発明は、少ない量の溶液のプラグベースのマイクロフルイディック操作に関するシステムを提供する。該システムは、装填構成要素、着脱式保持構成要素、組み合わせ構成要素および収容構成要素を含む。
【0100】
反応は、これらの構成要素内の任意のものにおけるプラグ内で生じ得る。反応は、これらの構成要素の表面を含んでも起こり得る。構成要素は、所望の反応を最大化する状態(例えば、温度、光の照射、他の形状の放射、様々な場への曝露など)に置かれ得る。例えば、リガンドおよび金属イオンが構成要素のプラグの中に装填された場合に、リガンドと金属との錯体の形成がプラグ内で生じ得る。構成要素は、所望されない反応を最小化する状況の下に置かれ得る。例えば、生体分子および/または有機分子の水溶液がプラグ内にあるときに、所望されない加水分解が生じ得る。この加水分解は、構成要素の温度を制御すること、および構成要素の内側のプラグを凍結することによっても最小化され得る。構成要素の内側のプラグの内側の試剤の光退色は、光に対して実質的に透過性のない構成要素を使用することか、または光に対する構成要素の曝露を最小化することのいずれかによって、光に対するプラグの曝露を最小化することによって最小化され得る。酸素とのプラグの内側の試剤の反応が所望されない場合には、構成要素は、気体に対して透過性のない材料、例えばガラスを用いて製作され得るか、または構成要素は、酸素のない環境の下に維持され得るかである。さらに、搬送流体(例えばフッ化流体)は、(例えば、凍結−ポンプ−解凍のサイクルまたは不活性の気体、例えばアルゴンを用いたバブリングによって)脱気され得ることにより、溶解されたあらゆる酸素を取り除く。
【0101】
プラグ内で行われ得る反応のタイプは限定されない。例としては、限定するわけではないが、タンパク質の結晶化、合成反応、スクリーニングおよび酵素反応、診断用アッセイを含むが、これらに限定されない。本開示全体を通して、本発明の使用はタンパク質の結晶化に対する適用によって例示されている。本発明は他の反応に等しく適用可能であることを理解されたい。
【0102】
溶液のプラグベースのマイクロフルイディック操作は、米国特許出願第10/434,970号および米国特許出願第10/765,718号において、本発明者らによって以前に開示されており、該出願は本明細書においてその全体が参照により援用される。
【0103】
本発明はまた、プラグ内で反応を行うための方法を提供する。該方法は、(a)第1の搬送流体のプラグの線形のアレイおよび/またはスペーサによって互いに分離された第1のプラグ流体は、保持構成要素から組み合わせ構成要素内の第1のマイクロチャンネルの中に第1の流量で導入することと;(b)第2の搬送流体によって互いに分離された(i)第2のプラグ流体の流れまたは(ii)第2のプラグ流体のプラグの流れを、組み合わせ構成要素内の第2のマイクロチャンネルの中に第2の流量で導入することと;(c)第1のプラグ流体のうちの少なくとも1つのプラグを少なくとも一部の第2のプラグ流体に融合し、融合されたプラグを形成することを包含し、該融合は、第1のマイクロチャンネルと第2のマイクロチャンネルとが流体連通している合流地点において生じる。
【0104】
別の実施形態において、試剤プラグの線形のアレイが中に配置されている保持構成要素を吸着することによって、試剤のプラグの線形のアレイはマイクロチャンネルの中に導入される。試剤プラグは、長期間、完全性を失うことなく、保持構成要素の中に格納され得るので、プラグのアレイは、活性核形成粒子(例えば、タンパク質分子または単なるナノ粒子の凝集体)を含み得る。試剤のプラグは、格納および/または輸送され、後に使用され得ることにより、タンパク質または他の分子または材料の結晶化または沈殿のために核形成を誘発する。例えば、研究者は、タンパク質の結晶化スクリーンのために試剤のプラグのアレイを含んでいる保持構成要素を購入し得、それから単純な合流地点および単純な流源(例えば、シリンジまたは圧力)を使用することにより、融合されたプラグのアレイを試剤の流れまたはプラグの流れに融合する。
【0105】
一部のアプリケーションに関しては、複数の異なる保持構成要素が共に使用され得る。例えば、プラグ内に、タンパク質の結晶化のために96個の沈殿剤を含んでいるキャピラリー(第1の保持構成要素)は、装填構成要素を使用して準備され得る。別個に、第2の保持構成要素(例えば、別のキャピラリー)は、結晶化されるタンパク質を含んでいるプラグを用いて準備され得る。この例において、(本出願の別の箇所、または同時係属の米国特許出願第10/434,970号または米国特許出願第10/765,718号において記述されている技術を使用して)タンパク質サンプルのプラグを沈殿剤のプラグに融合することによって、結晶化実験は実行される。例えば、第1の保持構成要素および第2の保持構成要素は、T字型の合流地点によって接続され得、それらの内容は第3の保持構成要素の中に押し流される。
【0106】
融合されたプラグを含んでいる構成要素はまた、光、電場、磁場、熱、放射線などのうちの1つ以上にさらされ得ることにより、融合されたプラグに関する(タンパク質の結晶化を含む)反応および様々な研究を行なう。例えば、タンパク質結晶の核形成は、この方法で誘発され得る。例えば、融合されたプラグを含んでいる構成要素は、温度勾配にさらされ得ることにより、反応に関する温度の影響を理解する。最終的に、反応を追跡することおよび温度を操作することによって、反応のアクティブな制御は達成され得る。
【0107】
プラグは選別され得る。例えば、プラグはまた、それらのサイズに従って選別され得る。代替的に、プラグは、搬送流体の密度に対するプラグの密度によって選別され得る。代替的に、一群のプラグが、磁気のある材料、例えば、鉄もしくはコバルトのナノ粒子または鉄を含む流体を含む場合に、プラグはまた、磁場を適用することによって選別され得る。
【0108】
プラグ内の反応は、マイクロフルイディックシステムの構成要素の任意のものにおいてモニタリングされ得るか、またはマイクロフルイディックシステムの構成要素を出た後にモニタリングされ得る。プラグは、蛍光分極、蛍光摂動、蛍光相関分光分析、質量分析などを含む様々な技術を使用してモニタリングされ得る。例えば、結晶はマイクロフルイディックシステムから取り除かれ、x線の回折を用いて分析され得る。プラグはマイクロフルイディックシステムから取り除かれ、質量分析を用いて分析され得る。
【0109】
(プラグ間の距離の制御)
搬送流体が適切に選ばれた場合に、2つのプラグを分離している距離は、流れを用いて制御され得る。図5cにおいて、流れがチャンネルに適用され、その結果、プラグは分離されたままとなる。図5dにおいて、チャンネルを通して流れは生じない;搬送流体が適切に選ばれた場合に、プラグ間の距離は減少し、最終的に、可能である場合には、プラグは融合する。
【0110】
2つのプラグの距離は、様々な方法で減少され得る。例えば、直径が長手方向に沿って増加するチャンネルが使用され得る。プラグがチャンネルの広がりに向けて移動される場合に、プラグ間の距離は減少する。一部の事例において、融合はまた、マイクロチャンネルの直径を増加させることによって促進され得る。なぜならば、プラグがそのようなチャンネルを通って移動すると、プラグは最終的に融合するからである。一部の事例において、障害物、膨張または収縮が導入され得ることにより、プラグの速度を変化させ、かつ、融合を制御する。
【0111】
2つのプラグの距離を減少させる別の方法は、2つのプラグの間の流体を逐次的に取り除くことである。例えば、気泡によって分離された2つのプラグは、プラグのいずれか側に圧力を加えることによって、より近くに移動され得る。マイクロチャンネルの壁が、気体に対して透過性がある場合に、気体は取り除かれ得る。その結果、2つのプラグは互いに近付き、最終的に融合する。ガラスキャピラリーの事例のように、壁が透過性ではない場合に、気体は圧縮され、量が減少し、その結果、2つのプラグの間の距離はさらに減少するが、融合は妨げられる。
【0112】
図7は、プラグ間の距離を変化させるための手段を示す。マイクロチャンネル内の圧力が、側面分岐チャンネル内の圧力よりも高いときに、搬送流体は取り除かれ、プラグ間の距離は減少する(最終的には融合する)。側面分岐チャンネル内の圧力が、マイクロチャンネル内の圧力よりも高いときに、搬送流体は添加され、プラグ間の距離は増加する。この設計を使用して、一方側に搬送流体を取り除く分岐チャンネルと別側に別の搬送流体を添加する分岐チャンネルとを有することによって、搬送流体は取り替えられ得る。
【0113】
さらなる操作(例えば、さらなる反応、処置、融合、および/または選別)が必要とされる場合に、融合されたプラグは、別の保持構成要素または収容構成要素に輸送され得る。
【0114】
(生物学的高分子の結晶化)
マイクロバッチおよび気相拡散は、プラグベースのマイクロフルイディックシステムに対する2つの基本的な結晶化方法である。係属中の米国特許出願第10/765,718号は、プラグベースのマイクロフルイディックシステムにおけるこれらの技術を記述し、本明細書において参照により援用される。
【0115】
本発明を使用して、結晶化のための溶液を含んでいるプラグは、装填構成要素を使用して、保持構成要素の中に装填され得る。組み合わせ構成要素を使用して、目的の高分子の溶液を添加した後、流れが停止されたときに、結晶化試験は収容構成要素内で行われ得る。本発明は、多種多様な表面張力、粘度および湿潤の性質を有する溶液を処理することが可能である。さらに、本発明は、回折によって、結晶の質に関する最小侵襲性の評価を可能にし、同時に、収容構成要素において、処理によって、壊れやすい結晶の損傷を避けることを可能にする。さらに、結晶は収容構成要素から取り除かれ得る。収容構成要素は、切られ得るか、もしくは解体され得ることにより、結晶の除去を可能にするか、または結晶は未処理の収容構成要素の外に流され得る。結晶の除去は、回折データを取得するために、必要に応じた凍結防止および凍結を可能にし得る。
【0116】
収容構成要素における定温放置の間、(限定するわけではないが、光、磁気、および電気を含む)様々な場が適用され得ることにより、核形成を誘発し、結晶の成長を制御する。保持構成要素の環境がまた制御され得ることにより、核形成および結晶の成長を最適化する。収容構成要素は、プラグ流体、搬送流体、およびスペーサの構成要素に対して、ならびに外部の要素に対しても実質的に透過性がない(例えばガラス)ように設計され得る。代替的に、収容構成要素は、プラグ流体、搬送流体、およびスペーサの構成要素のうちの一部、および/または外部の要素に対する透過性を可能にするように設計され得る。そのような透過性が使用され得ることにより、核形成および結晶の成長を制御および最適化する。例えば、(例えば、PDMSで作られた)保持構成要素の壁を通した水の選択的な除去または添加が使用され得ることにより、核形成および成長の割合を制御する。
【0117】
これらの技術は、例えば、マイクロバッチ、気相拡散、および自由界面拡散の結晶化方法の状況において、例えば、スパース行列スクリーニングの方法、勾配スクリーニングの方法、またはハイブリッドスクリーニングの方法に統合され得る。
【0118】
本開示は多くの場合に高分子の結晶化に関するが、これらの方法は、いくつかの高分子、およびそれらの錯体の結晶化および共結晶化に等しく適用可能であるということを理解されたい。
【0119】
結晶化に関して本明細書において記述された本発明のアプリケーションは、高分子の結晶化を例として使用して説明されているが、該アプリケーションは、高分子の結晶化に限定されない。
【0120】
(膜タンパク質の結晶化)
膜タンパク質の構造的特徴付けは、人間の健康に関する重要な問題であるが、構造決定は困難な問題である。膜タンパク質の利用可能性の低さと、スクリーンされる必要のある状態が非常に多いこととが、この問題に寄与しているが、本発明によって克服される。膜タンパク質は、疎水性の膜貫通部分のために、さらなる難題を引き起こし、該膜貫通部分は、一般的には、膜の抽出および結晶化のために洗浄剤の使用を必要とする。表面張力および湿潤が制御される場合でなければ、洗浄剤の存在が、疎水性のマイクロチャンネルの内側の油ベースの搬送流体内で形成された水溶性のプラグの適切な形成を修正し得る。
【0121】
適切な搬送流体は、上記のものを含み得る。パーフルオロアミンの混合物、例えば、パーフルオロ−トリ−n−ブチルアミンおよびパーフルオロ−トリ−n−ジブチルメチルアミン(FC−40およびFC−70化合物としても公知)は、搬送流体として使用され得る。プラグが洗浄剤溶液を使用して形成されるときに、そのような混合物は、プラグの形成にとって有益であることが発見された。これは、洗浄剤溶液内で可溶性にされた膜タンパク質を含むプラグが、本発明を使用して好都合に処理されることを可能にする。代替的に、適切な湿潤および表面張力の特性を有する他の流体が使用され得る。特性、例えば粘度を調整するために、適切な搬送流体の混合物が準備され得る。
【0122】
(結晶化の状態をスクリーニングするためのアプローチ)
スパース行列スクリーニングは、多くの場合に、最適な結晶化状態を見つけるために使用される第1のステップとなる。スパース行列スクリーンは、可能な構成要素の非常に大きい行列と、結晶化を容易にする溶液を備え得る構成要素の濃度とを希薄にサンプルするように設計されている。スパース行列スクリーニングの方法は、必要に応じてスペーサによって分離される、搬送流体内のプラグのアレイを生成することによって実装され得る。そのようなプラグは多様な結晶化の状態を含み得、該結晶化の状態は、沈殿剤のタイプおよび濃度のバリエーション、pHおよびイオンの強度のバリエーション、および添加剤または凍結防止剤のタイプおよび濃度のバリエーションを含む。そのようなプラグのアレイは、本出願の他の箇所において記述されたように生成され得る。好適には、そのようなアレイは、保持構成要素内で装填構成要素によって生成される。スパース行列のアプローチの不利な点は、各試剤または試剤の組み合わせに対して、2〜3の濃度のみがテストされ、最良の結晶化の状態が見過ごされ得るということである。スパース行列スクリーンは、ケミカルスペースの広い領域をサンプルするが、該スクリーンはケミカルスペースを低い密度でサンプルする。
【0123】
勾配スクリーンは、この不利な点を克服するさらなるアプローチである。勾配スクリーンは、様々な結晶化の状態、例えば、溶液構成要素の濃度または溶液のpHをテストするように設計され得る。これらの勾配は、通常、成功の可能性を高くするために、当該分野において公知である様々な状態をテストするか、または他のスクリーニングのアプローチを使用して成功の兆候を示す状態を取り巻く様々な状態をテストするように設計される。勾配スクリーニングは、本出願の別の箇所において記述されたように、本発明によって好都合に実装され得る。勾配スクリーニングのアプローチの不利な点は、勾配スクリーニングが、可能な状態のうちの1つを完全に調査する間に、非常に多くの関係のない状態はテストされないということである。勾配スクリーンは、ケミカルスペースの狭い領域をサンプルするが、該スクリーンは、ケミカルスペースを高い密度でサンプルする。
【0124】
ハイブリッドスクリーニングのアプローチは、スパース行列スクリーンのアプローチおよび勾配スクリーンのアプローチを組み合わせ得る。このアプローチは、可能な結晶化の状態の広範囲のスクリーニングと、成功すると証明されそうな状態のより完全なサンプリングとの両方を可能にする。ハイブリッドスクリーンは、複数の結晶化混合物を有するプラグを含む保持構成要素を使用して実行され得、該保持構成要素において、各混合物は、いくつかのプラグ内においていくつかの濃度で存在する。本発明において記述されたように、プラグの大きいアレイを生成することは、このハイブリッドスクリーニングのアプローチが効果的に使用され、サンプルの消費を最小化して、理想的またはほぼ理想的な結晶化の状態の迅速な識別を容易にすることを可能にする。
【0125】
全てのスクリーニングのアプローチは余分に実装され得、該スクリーニングのアプローチにおいて、実質的に同じいくつかのプラグが各結晶化の状態に対して使用される。一般的には、いったん、最初の保持構成要素が構成され、タンパク質溶液と組み合わせられ、収容構成要素において定温放置することが可能にされると、プラグは結晶化のサインに関して観察される。本発明を使用した第1の実験、または当該分野において公知の他の技術を使用した別個の実験において、(例えば、構造決定のためにはあまりにも小さい結晶の形成の観察、または規則正しい沈殿剤、球顆などの観察によって)結晶化に対して修正可能な最初の状態が決定される場合に、次の保持構成要素は結晶の成長の状態を最適化するように設計され得る。最適化のために次の保持構成要素内に含まれる溶液は、成功の兆候を示す状態を取り巻く様々な状態、およびプラグの第1のアレイにおいて成功することが見られた特性と同じような特性を有する様々な溶液を含み得る。例えば、最初のスクリーンの間に、結晶針が10%のPEG 5000を含むプラグ内で成長することが見られた場合に、結晶の成長を最適化するように設計された次の保持構成要素は、約1%〜約20%のPEG 5000の濃度勾配、および他のPEG、例えば、PEG 2000、PEG 8000、またはPEG−MME 5000の勾配を生成するように設計され得る。必要に応じて、プラグの第1のアレイに含まれない一連の他の結晶化添加剤は、プラグの次のアレイに含まれ得る。プラグの次のアレイは、プラグの第1のアレイを使用した実験における一定の定義された結果を有するタンパク質を用いて使用されるように事前設計され得るか、または第1のアレイを使用した実験における結果としての一定の高分子に基づいてカスタム設計され得る。
【0126】
そのような実験を容易にするために、スパース行列スクリーン試剤を有する保持構成要素、およびスパース行列スクリーンの保持構成要素内に存在する選択された状態に対する細かなスクリーンを含む保持構成要素を含んで、キットは構成され得る。特定の代替的な実施形態において、保持構成要素は、非常に多数の細かなスクリーンを含み得る。しかしながら、このアプローチは、逐次的に、スパーススクリーン保持構成要素を使用し、次に1つ以上の選択された良好なスクリーンの保持構成要素を使用することよりも多くのタンパク質を消費する。
【0127】
コンピュータソフトウェアは、キットの一部分として提供され得る。このソフトウェアは、実験の第1のセットの結果を分析することに役立ち、次に、ユーザが実験の次のセットを設計することに役立つ。必要に応じて、このソフトウェアは、方法のデータベースを含み得、実験の1つのセットの結果を使用して、実験の次のセットを設計するための規則を含み得る。そのようなソフトウェアがまた使用され得ることにより、結晶化される高分子に関する利用可能な情報(例えば、タンパク質の配列ならびに合成および精製の方法)を処理し、結晶化の状態の最初のセットを提示する。ソフトウェアは、実験の次のセットの設計の間にも、この情報を使用し得る。
【0128】
(マイクロバッチ結晶化)
マイクロバッチスクリーニングを実行するために、組み合わせ構成要素が使用されることにより、結晶化試剤を含む保持構成要素内のプラグのアレイに高分子の溶液を融合する。次に、プラグは、定温放置および結晶成長のために、収容構成要素の中に輸送される。使用される高分子の溶液は、プラグのアレイまたは高分子の溶液の継続的な流れであり得る。高分子の溶液のプラグは、本出願の別の箇所に記述されているように生成され得る。
【0129】
(気相拡散結晶化)
本発明は、気相拡散(VD)結晶化を実行するために使用され得る。VD結晶化に対するこのアプローチにおいて、互い違いに続く一対のプラグに関して考えることは有益であり、その場合に、プラグは搬送流体内にあり、必要に応じて、そのような対の一部の間、および/またはプラグの集団の間にスペーサを含む。一実施形態において、プラグの第1のセットは高分子と沈殿剤との溶液を含み、乾燥溶液を含む「空」のプラグ(つまり、高分子が実質的に存在しない)と互い違いになっている。例えば、乾燥溶液は、高分子と沈殿剤との溶液よりも高い濃度で、高分子と沈殿剤との溶液からの沈殿剤を含み得る。定温放置の間、搬送流体が実質的に透水性であるか、またはプラグが透過性のスペーサ、例えば気泡によって分離されるときに、水の分子は、低い浸透性の圧力を有するプラグの第1のセットから高い浸透圧を有する乾燥剤プラグの第2の「空」のセットへと時と共に拡散する。例えば、水は、濃度の低い高分子と沈殿剤とを含む第1のプラグから濃度の高い食塩水に拡散し、その結果、第1のプラグ内の高分子と沈殿剤との濃度を増加させる。この濃度に関する増加は、高分子の結晶化をもたらし得る。しかしながら、この技術による結晶化は、高分子および沈殿剤を含むプラグの濃度が、濃度に関して増加するシナリオに限定されない。例えば、高分子の溶液のイオン強度を低下することにより、高分子が結晶化するときのように、結晶化はまた、高分子を含むプラグ内の濃度の減少によって生じ得る。この変化は代替的な実施形態において達成され得、該代替的な実施形態において、プラグの第2の「空」のセットが、高分子を含むプラグの第1のセットよりも低いイオン強度を有し、その結果、水の分子がプラグの第1のセットの中に拡散し、イオン強度を低下させる。
【0130】
プラグ流体の濃度を変化させることによって、高分子と沈殿剤との様々な溶液は、様々な浸透圧で、溶液を含む「空」のプラグと対にされ得、単一の装置内での複数の結晶化実験の確立を可能にする。水の移送の割合および程度は、浸透圧および各対におけるプラグ間の間隔に関する差を変化させること、ならびに「空」のプラグと高分子を含むプラグとの相対的なサイズによって制御され得る。高分子の結晶化におけるプラグ流体は、通常、水を含むが、プラグ流体は水に限定されないということに留意されたい。「空」のプラグ内の溶液は、好適には、高分子と沈殿剤との溶液の浸透圧とは異なる浸透圧を有する。「空」のプラグはまた、異なる濃度の構成要素を含み得、該構成要素は、「空」のプラグと結晶化プラグとの間に移送され得る。
【0131】
組み合わせ構成要素において、「空」のプラグの互い違いのセットを作成するために、高分子の溶液の流れは沈殿剤プラグと選択的に融合するが、プラグの第2のセットと融合しないことが好ましい。上記のように、沈殿剤プラグと高分子の流れとの選択的な融合は、相対的な表面張力および/または「空」のプラグおよび沈殿剤プラグの内側の粘度の操作を通じて可能であり、かつ、組み合わせ構成要素の形状に基づいている。このシステムは、本出願の他の箇所で記述したように、二次汚染を伴うことなく確かな融合を提供し得る。沈殿剤プラグと乾燥剤プラグとの対の準備は、装填構成要素によって生成され得、プラグの間隔およびスペーサの存在または不在を制御し、本出願の別の箇所で記述したように保持構成要素の中に装填される。次に、高分子の溶液は、組み合わせ構成要素を使用して沈殿剤構成要素と選択的に融合され、次に、収容構成要素において定温放置され得る。
【0132】
気相拡散結晶化のこの記述は、高分子を有するプラグの1つのセットおよびプラグの第2の「空」のセットを含み、プラグの第2のセットが「空」でなく、代わりにまた高分子を含んだ場合であっても、本方法は動作可能であるであるということに留意されたい。しかしながら、本明細書において記述された選択的融合技術は、より少ない量のタンパク質の使用を可能にする。
【0133】
(自由界面拡散結晶化)
自由界面拡散は、充分に規則正しい結晶を生成する可能性を有する。本発明はまた、自由界面拡散(FID)結晶化を実行するために使用され得る。FID方法によって高分子を結晶化するために、高分子の溶液の貯水溝は、沈殿剤溶液の貯水溝と接触させなければならず、その結果、自立界面が形成される。試剤は、好適には、単純な拡散によって混合され、対流が、好適には、最小化される。界面において、グラスホフ数、つまり、浮力に対する対流の割合を最小化することによって、対流は最小化され得る。さらに、対流は、液体間界面および液体と固体との界面において、表面張力の勾配を減少することによって最小化され得る。
【0134】
本発明は、2つのプラグ間に自由界面を形成するためのマイクロフルイディック方法を包含する。2つのプラグは、マイクロチャンネル装置内に、好適には収容構成要素内に共にもたらされ、その結果、2つのプラグは、非混和性の搬送流体および/またはスペーサによって部分的に分離される。プラグは非混和性の流体が存在しない地点において接触することを可能にされ、それにより自立界面か確立され、流体および試剤がプラグ間で拡散する。一部の実施形態において、プラグ間の接触は親水性のマイクロチャンネルにおいて生じ、該マイクロチャンネルにおいて、プラグ流体は壁を湿潤し、2つのプラグの内容を接触させ、試剤が薄い流体の界面を通じて混合することを可能にする。スペーサまたは多量の搬送流体が使用され得ることにより、この界面を束縛する。他の実施形態において、プラグ流体は薄いフィラメントを湿潤し得、界面を確立する。
【0135】
プラグの間隔を制御する方法およびプラグ流体によるマイクロチャンネルの湿潤の制御が以下に述べられる。
【0136】
(VDおよびFID結晶化におけるプラグ操作)
FIDおよびVDの両方において、プラグ間の間隔および湿潤現象は、プラグが形成されたチャンネルとは別個のチャンネルにおいてプラグを残すことによって同時に制御され得る。一実施形態において、第1に、任意の間隔を有するプラグの任意の配列が、第1のマイクロフルイディック装置において形成され、該マイクロフルイディック装置においては、プラグはチャンネルの壁を湿潤しない。第1の装置の出口は、第1の装置を含むことに充分な大きさの内径を有する第2の装置の中に置かれる。第1および第2のマイクロフルイディック装置は互いに移され(例えば、第1のマイクロフルイディック装置が第2のマイクロフルイディック装置から引き出される)、同時に、プラグが第1のマイクロフルイディック装置の出口の外に移され、プラグは第2のマイクロフルイディック装置の中に続けて残される。第2のマイクロフルイディック装置の表面は処置され、その結果、プラグ流体は、第2の装置を湿潤し、界面を形成することを可能にされる。プラグが残される割合と、2つの装置が互いに移動される割合とは、プラグ間の間隔を決定し、ユーザがこの間隔を任意に制御することを可能にする。
【0137】
さらに、第2のマイクロフルイディック装置は変更され得、その結果、湿潤が正確に制御される。親水性のパッチおよび疎水性のパッチ(または表面エネルギーの変動性を可能にし、プラグ流体および搬送流体の湿潤特性を制御し得るパッチ)は、チャンネルの壁の内側に直接的にパターン付けされ得、その結果、プラグは限られた領域において湿潤するのみである。これらのパッチは、マスクされ得、外部または内部の誘因、例えば、温度変化、または光の照射、またはプラグ流体または搬送流体内の特定の構成要素の存在によって作動され得る。また、フィラメント、ワイヤ、または他の表面が、同様なパターン付けを有するマイクロフルイディック装置の中に挿入され得ることにより、壁の代わりにフィラメントまたはワイヤの長手方向に沿ってのみ湿潤を導く。第2のマイクロフルイディック装置が、ガラスまたは別の流体に対して透過性のない材料から構築された場合に、第2のマイクロフルイディック装置は搬送流体および試剤流体の蒸発を防止する。
【0138】
マイクロチャンネルの表面が準備され、その結果、湿潤が可能でない場合に、プラグは離れた距離を維持する(図5aを参照)。プラグ流体による湿潤が可能である場合に、プラグ流体は接触する(図5bを参照)。マイクロチャンネルの表面は、異なる湿潤特性を有し得る。例えば、マイクロチャンネルの一部分は疎水性であり得る。水溶性のプラグが使用されるときに、この疎水性の表面が湿潤を防止する。マイクロチャンネルの別の部分が、(表面においてか、または疎水性のファイバの存在のために)親水性である場合に、互い違いのプラグのプラグ流体は相互拡散される。なぜならば、親水性の表面は湿潤を促進するからである。代替的に、マイクロフルイディック装置の内面の湿潤は、光スイッチ可能な単分子層を適用することによって制御され得る。最初に、単分子層は湿潤を防止する(図5eを参照)が、光を用いて作動されたときには、湿潤を促進する(図5fを参照)。
【0139】
2つのプラグを1つにして、自立界面を形成するための方法のいくつかのさらなる例が図5に示されている。プラグがチャンネルの壁を湿潤することを防止する状態の下で、試剤溶液のプラグは、最初に、チャンネル内で形成される(図5a)。次に、状態が変化され、その結果、プラグは壁を湿潤する(図5b)。プラグが充分に近くにある場合に、湿潤現象は、プラグ流体が互いに接触することを可能にする。例えば、水溶性のプラグは、親水性のチャンネルの中に輸送され得るが、搬送流体の薄い層は、流れが維持されている間に、そのプラグが湿潤することを防止する(図5c)。流れが止まったときに、搬送流体の薄い層は分散し、プラグ流体が壁を湿潤することを可能にする(図5d)。別の例として、マイクロチャンネルの壁は、光スイッチ可能な単分子層を用いて処置され得、該単分子層は、最初に疎水性の特性を現す(図5e)が、次に、特定の波長の光に曝露すると親水性の特性を現す(図5f)。
【0140】
さらなる例において、マイクロフルイディックシステムは、全体的または部分的に、熱応答性の材料から形成され得る。粗いシリコン基質でコーティングされたポリ(N−イソプロピルアクリルアミド)を有する合成材料は、低い気温においては親水性であり(〜0°の水の接触角度)、高い気温においては疎水性である(〜150°の水の接触角度)。親水性/疎水性の転移温度は29℃〜40℃の間であり、プロセスは数分以内で行なわれる。高分子はこれらの温度において変性するが、熱応答性のファイバを有する疎水性のマイクロチャンネルを40℃を上回る温度に加熱し、それを25℃(または18℃または4℃)まで素早く冷却し、転移が生じる前に、高分子のプラグおよび沈殿剤のプラグをマイクロチャンネルの中に注入することは可能である。数分後、ファイバは親水性になり、液体のブリッジは高分子と沈殿剤との間で形成し、拡散が生じることを可能にする。
【0141】
(X線結晶学)
収容構成要素内のプラグ内で成長した結晶の質は、最初の母溶剤における室温または他の所望の温度(例えば、結晶が成長する温度)での回折によって、直接的に評価され得る(図8)。一部の実施形態において、構造情報は、1つの結晶、または同じプラグ内もしくは異なるプラグ内のいずれかのいくつかの結晶のいずれかから取得され得る。代替的に、キャピラリーの内側のプラグ内で形成する結晶は、容易に抽出、凍結防止、凍結、および回折され得る。結晶は液体間界面において成長され得るので、結晶は固体の表面から擦り取る必要はなく、損傷を最小化する。
【0142】
図3は、マイクロフルイディック装置1を図示し、該装置において、搬送流体6によって分離された様々な沈殿剤プラグ7が、搬送流体によって分離された高分子のプラグ13と融合される。沈殿剤のプラグは、一般的には、様々な濃度の沈殿剤を有する。次に、融合されたプラグ10は下流のチャンネルを通って流れ、該下流のチャンネルにおいて、プラグはさらに操作、モニタリング、制御などをされ得る。沈殿剤のプラグおよび高分子のプラグを分離するために使用される搬送流体6は、同じであり得るかまたは異なり得る。図4cは、タンパク質の流れを一連のプラグに融合する例を図示する。
【0143】
(プラグのアレイを提供する方法)
本発明はまた、保持構成要素内のプラグのアレイ提供する方法を顧客に提供し、該方法は、試剤流体、搬送流体およびプラグ流体の一覧表をオファーするステップと、顧客から所望の試剤のサブセット、所望の搬送流体および所望のプラグ流体を収容するステップと、保持構成要素内でプラグのアレイを形成するステップであって、該保持構成要素において、プラグは搬送流体を用いて互いに分離され、各プラグは所望の試剤のサブセットの要素を含む、ステップと、保持構成要素を顧客に送達するステップとを包含している。該方法は、所望の試剤のサブセットに対する評価を計算することをさらに包含し得る。
【0144】
方法は、所望の構成のプラグのアレイを事前に製作し、これらのアレイを格納し、それらを顧客に提供することを含み得る。
【0145】
顧客はまた、装填構成要素、および一連の保持構成要素、組み合わせ構成要素、および収容構成要素を備えたキットを提供され得る。構成要素は完全な調和流体接続を有し得るか、もしくは分離接続が使用され得ることにより、構成要素を結合するか、またはその両方である。顧客はこれらのキットを利用し得ることにより、所望の構成のプラグのアレイを生成する。顧客専用の試剤と顧客専用ではない試剤との両方が使用され得る。
【0146】
試剤、搬送流体、およびプラグ流体の一覧表は、紙または電子のいずれかの形式において、カタログとしてオファーされ得る(一部の実施形態において、インターネットを介してアクセス可能である)。適切な試剤、搬送流体およびプラグ流体が、本開示の全体を通して記述される。タンパク質の結晶化に関しては、試剤は、結晶の形成のためにスクリーンするために使用される任意の化合物を含み得る。例えば、試剤は、沈殿剤、添加剤、凍結防止剤、緩衝材などを含み得る。
【0147】
例えば、タンパク質の結晶化に対する試剤およびキットに関する会社および製品のリストは、
http://www.structmed.cimr.cam.ac.uk/Course/Crystals/screening.html.に記述されている。
【0148】
この方法において、顧客は、保持構成要素内のプラグのアレイの様々な特徴:例えば、一つ以上の沈殿剤、搬送流体、プラグ流体、プラグ流体のpH、添加剤、凍結防止剤などを選択する。
【0149】
膜タンパク質および他の高分子に関しては、プラグ流体は脂質立法相であり得る(例えば、Landau、E.M.およびRosenbusch、J.P.Lipidic cubic phases:A novel concept for the crystallization of membrane proteins.Proceedings of the National Academy of Sciences
of the United States of America93、14532〜14535(1996)ならびにNollert、Methods.34(3):348〜53(2004年11月)を参照)。
【0150】
沈殿剤として使用され得る塩類の非排他的なリストは以下の通りである:酒石酸塩(Li、Na、K、Na/K、NH4);燐酸塩(Li、Na、K、Na/K、NH4);酢酸塩(Li、Na、K、Na/K、Mg、Ca、Zn、NH4);蟻酸塩(Li、Na、K、Na/K、Mg、NH4);クエン酸塩(Li、Na、K、Na/K、NH4);塩化物(Li、Na、K、Na/K、Mg、Ca、Zn、Mn、Cs、Rb、NH4);硫酸塩(Li、Na、K、Na/K、NH4)、マレイン酸塩(Li、Na、K、Na/K、NH4);グルタミン酸塩(Li、Na、K、Na/K、NH4);テトラアリールホウ酸塩(Li、Na、K、Na/K、NH4)。
【0151】
沈殿剤として使用され得る有機材料の非排他的なリストは以下の通りである:PEG 400;PEG 1000;PEG 1500;PEG 2K;PEG 3350;PEG 4K;PEG 6K;PEG 8K;PEG 10K;PEG 20K;PEG−MME 550;PEG−MME 750;PEG−MME 2K;PEGMME 5K;PEG−DME 2K;ジオキサン;メタノール;エタノール;2−ブタノール;n−ブタノール;t−ブタノール;ジェファミンM−600;イソプロパノール;2−メチル−2、4−ペンタンジオール;1,6−ヘキサンジオール。
【0152】
溶液のpHは緩衝材を含むことによって変化され得る;生物学的材料に対するpHの一般的な範囲は、概ね3〜10.5の間の値であり、緩衝剤の濃度は、概して0.01から0.25Mまでの間の値である。この書類において記述されているマイクロフルイディック装置は、広い範囲のpH値、特に生物学的標的に適した値に容易に適合性がある。
【0153】
本発明に従って使用され得る可能な緩衝剤の非排他的なリストは以下の通りである:酢酸ナトリウム;HEPES;カコジル酸ナトリウム;琥珀酸ナトリウム;燐酸ナトリウムカリウム;TRIS;マレイン酸TRIS;マレイン酸イミダゾール;ビストリスプロパン;CAPSO、CHAPS、MES、およびイミダゾール。
【0154】
添加剤は、標的の溶解性および/または活性行動に影響する小分子である。そのような化合物は、結晶化スクリーニングを加速し得るか、または標的の互い違いの結晶形式または多形体を生成し得る。添加剤は、化学物質の考えられるほぼ全ての形式を取り得るが、一般的には、単一および多価の塩類(無機または有機)、酵素リガンド(基板、生成物、アロステリックなエフェクタ)、化学物質架橋剤、洗浄剤および/または脂質、重金属、有機金属化合物、ごくわずかな量の沈殿剤、および分子量小型有機物。
【0155】
以下は本発明に従って使用され得る添加剤の非排他的なリストである:2−ブタノール、DMSO、ヘキサンジオール、エタノール、メタノール、イソプロピルアルコール、フッ化ナトウム、フッ化カリウム、フッ化アンモニウム、無水塩化リチウム、塩化マグネシウム6水化物、塩化ナトリウム、塩化カルシウム二水和物、塩化カリウム、塩化アンモニウム、ヨウ化ナトリウム、ヨウ化カリウム、ヨウ化アンモニウム、チオシアン酸ナトリウム、チオシアン酸カリウム、リチウム硝酸塩、マグネシウム硝エステル6水化物、硝酸ナトリウム、硝酸カリウム、硝酸アンモニウム、ギ酸マグネシウム、ギ酸ナトリウム、ギ酸カリウム、ギ酸アンモニウム、リチウム酢酸エステル二水和物、マグネシウム酢酸エステル四水和物、酢酸亜鉛二水和物、酢酸ナトリウム三水和物、酢酸カルシウム水和物、酢酸カリウム、酢酸アンモニウム、リチウム硫酸塩一水化物、リチウム硫酸エステル7水化物、硫酸ナトリウム十水塩、硫酸カリウム、硫酸アンモニウム、酒石酸塩二水和物2ナトリウム、酒石酸ナトリウムカリウム四水和物、酒石酸2アンモニウム、リン酸二水素ナトリウム一水化物、水素リン酸エステル2ナトリウム二水和物、カリウム二水素リン酸塩、水素リン酸エステル2カリウム、燐酸二水素アンモニウム、塩基水素リン酸エステル2アンモニウム、クエン酸3リチウム四水和物、クエン酸3ナトリウム二四水和物、クエン酸3カリウム一水化物、クエン酸水素2アンモニウム、塩化バリウム、塩化カドミウム二水和物、塩化カドミウム二水和物、塩化第二銅二水和物、塩化ストロンチウム6水化物、イットリウム塩化物6水化物、エチレングリコール、無水グリセリン、1,6ヘキサンジオール、MPD、ポリエチレングリコール400、トリメチルアミンHCI、グアニジンHCI、尿素、1,2,3−ヘプタントリオール,ベンズアミジンHCI、ジオキサン、エタ
ノール、イソプロパノール、メタノール、ヨウ化ナトリウム、L−システイン、EDTAナトリウム塩、NAD、ATPジナトリウム塩、D(+)−グルコース一水化物、D(+)−スクロース、キシリトール、スペルミジン、スペルミン4HCI、6−アミノカプロン酸、1,5−2アミノペンタン2HCl、1,6−2アミノヘクサン、1,8−アミノオクタン、グリシン、グリシル・グリシル・グリシン、ヘキサミンコバルト三塩化物、タウリン、ベタイン一水化物、ポリビニルピロリドンK15、非洗浄性スルホベタイン195、非洗浄性スルホベタイン201、フェノール、DMSO、硫酸デキストランナトリウム塩、ジェファミンM−600、2、5つのヘキサンジオール、(+/−)−1,3ブタンジオール、ポリプロピレングリコールP400、1,4ブタンジオール、三次ブタノール、1,3プロパンジオール、アセトニトリル、ガンマ・ブチロラクトン、プロパノール、酢酸エチル、アセトン、ジクロロメタン、n−ブタノール、2,2,2トリフルオロエタノール、DTT、TCEP、ノナエチレングリコールモノドデシルエーテル、ノナエチレングリコールモノラウリルエーテル、ポリオキシエチレン(9)エチル、オクタエチレングリコールモノドデシルエーテル(オクタエチレングリコールモノラウリルエーテル)、ポリオキシエチレン(8)ラウリルエーテル、ドデシル−β−Dマルトピラノシド、ラウリン酸スクロースエステル、シクロヘキシルペンチル−β−Dマルトース配糖体、ノナエチレングリコールオクチルフェノールエーテル、N,N−bis(3−D−グルコン酸アミドプロピル−デオキシコール酸アミン、デシル−β−Dマルトピラノシド、ラウリルジメチルアミン酸化物、シクロヘキシルペンチル基−β−Dマルトース配糖体、ra−ドデシルスルホベタイン3−(ドデシルジメチルアンモニア)プロパン−l−スルフォナート)、ノニル−β−D−グルコピラノシド、オクチル−β−D−チオグルコピラノシド,OSG、N,N−ジメチルデシルアミン−β−酸化物、メチl0−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド、スクロースモノカプロイル基、n−オクタノイル−β−D−フルクトフラノシル−α−D−グルコピラノシド、ヘプチル基−β−D−チオグルコピラノシド、オクチル−β−D−グルコピラノシド,OG、シクロヘキシルプロピル
基−β−D−マルトース配糖体、シクロヘキシルブタノイル−N−ヒドロキシエチルグルクアミド、n−デシルスルホベタイン:3−(デシルジメチルアンモニウム)プロパン-1スルフォナート、オクタノイル−N−メチルグルカミン,OMEGA、ヘキシル−β−D
−グルコピラノシド、Brij 35、Brij 58、トリトンX−114、トリトンX−305、トリトンX−405、トゥイーン20、トゥイーン80、ポリオキシエチレン(6)デシルエーテル、ポリオキシエチレン(9)デシルエーテル、ポリオキシエチレン(10)ドデシルエーテル、ポリオキシエチレン(8)トリデシルエーテル、デカノイル−N−ヒドロキシエチルグルカミン、ペンタエチレングリコールモノオクチルエーテル、3−[(3−コールアミドプロピル)−ジメチルアンモニウム]−l−プロパンスルフ
ォナート、3−[(3−コールアミドプロピル)−ジメチルアンモニウム]ヒドロキシ−
1−プロパンスルフォナート、シクロヘキシルペンタノイル−N−ヒドロキシエチルグルクアミド、ノナノイル−N−ヒドロキシエチルグルクアミド、シクロヘキシルプロパノール−N−ヒドロキシエチルグルクアミド、オクタノイル−N−ヒドロキシエチルグルクアミド、シクロヘキシルエタノイル−N−ヒドロキシエチルグルクアミド、ベンジルジメチルドデシル臭化アンモニウム、n−ヘキサデシル−β−Dマルトピラノシド、n−テトラデシル−β−Dマルトピラノシド、n−トリデシル−β−Dマルトピラノシド、ドデシルポリ(エチレングリコエーテル)、n−テトラデシル−N,N−ジメチルアンモニウム−1−プロパンスルフォナート、n−アンデシル−β−Dマルトピラノシド、n−デシルD−チオマルトピラノシド、n−ドデシルホスホコリン、α−D−グルコピラノシド,β−D
−フルクトフラノシルモノデカン酸エステル(スクロースモノカプリン酸塩)、1−s−ノニル−β−D−チオグルコピラノシド、n−ノニル−β−D−チオマルトイラノシド、N−ドデシル−N,N−(ジメチルアンモニオ)−酪酸塩、n−ノニル−β−D−マルトピラノシド、シクロヘキシルブチルD−マルトース配糖体、n−オクチル−β−D−チオマルトピラノシド、n−デシルホスホコリン、n−ノニルホスホコリン、ノナノイルN−メチルグルカミン、1−s−ヘプチル基−β−D−チオグルコピラノシド、n−オクチルホスホコリン、シクロヘキシルエチルDマルトース配糖体、n−オクチル−N,N-ジメ
チルアンモニウム−l−プロパンスルフォナート、シクロヘキシル・メチル−β−D-マ
ルトース配糖体。
【0156】
凍結剤とは、結晶が氷ではなくむしろ硝子体ガラスに埋め込まれるように、液体窒素、液体プロパン、液体エタン、または窒素ガスもしくはヘリウム(全て約100−120°K)などの起寒剤の瞬間冷凍において、標的結晶を安定させる試剤である。いかなる分量の塩類または分子量小型有機化合物は凍結防止剤として使用され得る。一般的には、限定するわけではないが、MPD、PEG−400(および両方のPEG誘導体およびより高
分子量のPEG化合物)、グリセリン、糖(キシリトール、ソルビトール、エリトリトール、スクロース、グルコースなど)、エチレングリコール、アルコール(短鎖と超鎖との両方、揮発性と不揮発性との両方)、LiOAc、LiCl、LiCHO2、LiNO3、Li2SO4、Mg(OAc)2、NaCl、NaCHO2、NaNO3などを含む。また、本発明に従ったマイクロフルイディック装置が製作される材料は、このような一連の化合物と適合性をもち得る。
【0157】
化学物質の変動性に加えて、結晶化スクリーニングの間に、多数の他のパラメータが変化され得る。そのようなパラメータは、限定するわけではないが、(1)結晶化試験回数、(2)標的溶液と結晶化溶液の比率、(3)標的濃度、(4)標的の二次的小型分子または高分子との共結晶化、(5)水和、(6)接触面、(7)分子を標的とする修正などを含む。
【0158】
アプリケーション(4)共結晶化に関しては、アレイは、ケミカルスペースの一部分をスパンする小分子のサブセットを表し得る。代替的に、アレイは、ゲノムまたはゲノムの一部分をスパンしているオリゴヌクレオチドのサブセットを表し得る。
【0159】
(他のアプリケーション)
本発明は任意の実験において使用され、該実験において、多種多様な反応が平行して行われ得る。例えば、96−、384−、または1536−ウェルプレートにおいて、現在、一般的に適用される任意のアプリケーションである。本発明において記述されたような保持構成要素は、これらのアプリケーションの任意のもののために準備され得る。
【0160】
そのようなアプリケーションの1つは、コンビナトリアルケミストリである。構成要素内での組み合わせの後に、第2の試剤または試剤のセットと反応させられる様々な試剤を含む保持構成要素が準備され得る。これらの試剤は溶液の中に存在することに限定されず、ビーズまたは他の形式でも存在し得る。コンビナトリアルケミストリの一般的なアプリケーションは、薬学的または農学的作用のためにテストされる様々な化合物の合成を含む。別のアプリケーションは、様々な無機、有機、または有機金属の触媒の合成である。例えば、保持構成要素は、金属に対する多数の異なる潜在的なリガンドを含み得、組み合わせ構成要素内の金属または様々な金属との組み合わせの後に、リガンドは、金属または複数の金属と反応することを可能にされることにより、潜在的な触媒を含むプラグのアレイを提供する。続いて、プラグは、第2の組み合わせ構成要素内でテスト試剤と組み合わせられ得ることにより、触媒が触媒作用ためにテストされることを可能にする。第2の試剤と組み合わされた後か、または試剤が送られ、反応することを可能にされた後に、最終的な生成物がケミカルスペースの所望の領域をスパンするように、保持構成要素内のコンビナトリアルケミストリ試剤は選択される。さらに、保持構成要素内のプラグは、懸濁液内に試剤を含み得る。これは、安定性を増加させること、または溶解性が制限されるときに有益であり得る。保持構成要素はまた、安定性を増加させるために凍結され得る。
【0161】
別のアプリケーションは、所望の特性に対する化合物の様々なライブラリのスクリーニングであり、多くの場合に「ハイスループットスクリーニング」と呼ばれている。例えば、触媒が特定の反応を実行して物質Aを物質Bに変換することを必要とされる場合に、多数の潜在的な触媒は、保持構成要素の中に装填され、物質Aと組み合わせられ、反応することを可能にし得、その結果、収容構成要素内にその結果として生じるプラグは、物質Bの存在に関してモニタリングされ得る。この例において、触媒は、無機、有機金属、有機、酵素、または核酸で構成されたものであり得る。代替的に、保持構成要素は、潜在的な触媒の作用をテストするために、反応原系の様々なセットを含み得る。組み合わせ構成要素において、反応原系のセットは、潜在的な触媒に組み合わせられ、収容構成要素内で反応することを可能にされる。次に、反応の進行は、例えば、紫外可視分光分析、蛍光分析、または質量分析によってモニタリングされ、触媒の反応性を決定する。
【0162】
同様に、化合物の様々なセットまたは「ライブラリ」は、保持構成要素内にロードされ得ることにより、所望の生物学的作用、例えば、薬学的または農学的化合物の使用に関してテストされる。一般的なライブラリの例は、Sigma−Aldrich and PhytoMyco Research Corporationによってオファーされている10,000を超える植物および微生物抽出物のセットと、Sigma−Aldrichによってオファーされているthe Library of Pharmacologically−Active Compound(Product No.LO1280)と、the Aldrich Library of Rare Chemicalsからの化合物とを含む。他の例は、Nanosyn,Inc.によってオファーされているPharma Library Collectionを含み、該Pharma Library Collectionは、公知の特性およびまたもNanosyn,Inc.からのExplore Library Collectionに基づいて、薬剤となる可能性のあるもののために事前に選択された化合物を含み、該Explore Library Collectionは、より反応性のある化合物を含む。他の例は、Nikem ResearchによるDouble Diversity arraysを含み、該Double Diversity arraysは、単一の反応官能基を含むことにより、顧客専用の化合物およびNickem’s coMerge arraysの吸着を可能にする。
【0163】
化合物ライブラリの他の使用および例は、米国特許第6、740、506号において記述され、該特許は本明細書において参照により援用される。さらに、保持構成要素は、米国特許第6、740、506号において記述されたもののような定方向進化を介して合成されたライブラリを備え得る。
【0164】
同様に、保持構成要素は、様々な生体分子を含み得る。例えば、以下で実施例10において記述されるように、保持構成要素は、単一の基質または1セットの基質に対する結合またはそれらとの反応に関してテストをするために、タンパク質の様々なセットを備え得る。タンパク質ライブラリの例は、Tsujiら、Nucleic Acids Research29(20):e97(2001)において記述されている。保持構成要素はまた、ゲノムによって表わされたタンパク質のライブラリを備え得る。同様に、保持構成要素はまた、オリゴペプチドまたはオリゴ糖もしくは多糖を含み得る。代替的に、保持構成要素は、核酸、例えばDNAまたはRNAを含み得る。
【0165】
実施形態の1つのセットにおいて、保持構成要素は、動物、菌類、古細菌、バクテリア、植物、哺乳類、人間などを含む任意の生物の完全なゲノムに由来する生体分子のセットを含み得、該生体分子のセットは、当該分野において公知の方法によって配列されている。保持構成要素は、生物の全ゲノムまたはゲノムのサブセットを表わす生体分子を含み得る。例えば、保持構成要素は、生物のゲノムを表す核酸を含み得る。核酸は、RNA、DNA、cDNA、またはESTクローンであり得る。1つの例としては、Matrix Technologiesによって販売されているthe ez−raysTMhuman Oligonucleotide Libraryであり、該ライブラリは、15,000を超える人間のmRNA配列を標的とした50−merDNAプローブおよび制御プローブを含む。
【0166】
実施形態の別のセットにおいて、保持構成要素は生きている細胞を含み得る。例えば、細胞の有益なセットは、生物の欠失変異体の多様なセットを含む欠失ライブラリを含む。例えば、Saccharomyces Genome Deletion Project(Giaeverら、Nature.418(6896):387−91(2002))によって生成された欠失ライブラリである。他の有益な細胞収集は、例えば、Invitrogen CorporationによってオファーされているようなESTクローン、BACクローン、ORFクローンおよびPACクローンのセットを含む。別の実施形態において、単一のタイプの細胞が、複数の試剤と組み合わせるために保持構成要素内でオファーされる。例えば、O’Connorら、Cytometry A.63(1):48〜58(2005)において記述されたもののような肝細胞は、保持構成要素内で装填され、次に、組み合わせ構成要素内で、様々な潜在的な薬と組み合され得る。細胞の活性または変動性に対する続けてのモニタリングは、肝臓の毒性に関してテストするために使用され得る。代替的に、O’Connorら、Cytometry A.63(1):48〜58(2005)においてまた記述された特定生物型群を表す様々な細胞系は、保持構成要素の中に装填され得る。
【0167】
ハイスループットスクリーニングまたはコンビナトリアルケミストリのいずれかのアプリケーションに関しては、数千もの化合物の全ライブラリが、単一の保持構成要素内でオファーされ得る。代替的に、タンパク質の結晶化に関して上記されたように、全ライブラリのスパースサブセットが、単一の保持構成要素内でオファーされ得、次に、ケミカルスペースの特定の領域が所望の特性を有することが見つけられた後に、全ライブラリのより細かいサブセットが使用のためにオファーされ得る。
【0168】
実施形態の別のセットにおいて、保持構成要素は、診断および検出のために使用され得る。限定ではない例として、医療的診断、獣医的診断、作物と動物と農産物とのテスト、および水質と大気とのテストを含む環境テストを含む。好適には、保持構成要素は、複数のテスト、および/または同じテストの複数の写しを含む。保持構成要素はまた対照実験を含み得る。
【0169】
本発明の一部の実施形態において、物質のスパースライブラリを含む特定の保持構成要素を使用した最初のテストの後に、第2のカスタムの保持構成要素が準備され得、最初のテストにおいて見つけられた「ヒット」に特性の近い(ケミカルスペースにおいて近くにある)物質を含む。このプロセスは無期限に反復され得る。
【実施例】
【0170】
以下の実施例において、ガラスキャピラリーはシラン処理され、それらは疎水性となった。
【0171】
(実施例1:μLを下回る量の溶液をマイクロフルイディック装置の中への損失を伴わない注入。)
10μLのシリンジおよびテフロン(登録商標)パイプの一部がパーフルオロアミンで満たされ、(1μLを下回る)少量の膜タンパク質溶液の吸引が続いた。パーフルオロアミンの搬送流体はテフロン(登録商標)パイプを優先的に湿潤するので、該搬送流体はタンパク質とテフロン(登録商標)との間で薄い層を形成し、タンパク質溶液のパイプの壁への付着を防止し、マイクロフルイディック装置の中への損失のない完全な分配を可能にした。
【0172】
(実施例2:保持構成要素内で、異なる組成物のプラグのアレイを形成すること。)
この実験において、異なる組成物を含むプラグのアレイが、テフロン(登録商標)パイプまたはガラスキャピラリーにおいて生成された。テフロン(登録商標)パイプの一部(OD:760μm、ID:305μm)が5μLのシリンジ(Hamilton)の針に取り付けられた。より小さい直径(OD:250μm、ID:200μm)を有する別のテフロン(登録商標)パイプが、大きいテフロン(登録商標)パイプに取り付けられ、エポキシ樹脂または蝋のいずれかによって密閉された。油(50:1のFC−3283/PFO)は、パイプおよびシリンジに吸引された。パイプは、組成物Aの水溶液(溶液A)の中に沈められ、プランジャが後ろに引かれて少量(0.1〜0.5μL)の溶液Aを吸引した。次に、パイプが油の中に沈められ、同じ量の油がパイプの中に吸引された。この2つのステップの吸引プロセスが、溶液B、C、…に対して繰り返されることにより、全ての溶液が使用され、組成物A、B、…のプラグのアレイがテフロン(登録商標)パイプの内側で形成された。
【0173】
ガラスキャピラリー内でそのようなプラグのアレイを形成するために、テフロン(登録商標)パイプが、(OD200μm、ID180μm、一端に漏斗状の約2mmの幅の間隔を有する)Hampton Research glass capillaryの幅の広い端の中に挿入された。全システム(シリンジ、テフロン(登録商標)パイプおよびキャピラリー)が油で満たされた後に、等量の溶液A、油、溶液B、油…は、上記のような同じ手順に従ってキャピラリーの中に吸引された。
【0174】
プラグのアレイが、テフロン(登録商標)パイプの内側で形成されたときには、テフロン(登録商標)パイプは切り離され、内側の液体を用いて凍結された。凍結プロセスは、テフロン(登録商標)を通した浸透による液体の損失を防止し、それによりプラグの長期間の格納に役立つ。プラグのアレイが、ガラスキャピラリーの内側で形成されたときには、キャピラリーはテフロン(登録商標)パイプから取り除かれ、蝋を用いて密閉された。この方法で、プラグは長期間(6ヶ月を超えて)格納され得る。
【0175】
(実施例3:プラグのアレイをPDMSマイクロチャンネルの中に輸送すること。)
この実験において、テフロン(登録商標)パイプまたはガラスキャピラリー(保持構成要素)の内側に格納されたプラグのアレイは、PDMSマイクロチャンネル(収容構成要素)の中に輸送された。
【0176】
3つの異なる型が使用された。第1の型において、PDMSマイクロチャンネルの入口は、Hampton researchから取得したガラスキャピラリーに結合された。このキャピラリーはアダプタとして使用され、そのキャピラリーは漏斗の形状を有していた。キャピラリーの小さい端は、PDMSマイクロチャンネルの中に挿入され、キャピラリーとPDMSマイクロチャンネルの壁との間のギャップは、半硬化PDMSで満たされた。110℃で5分間の定温放置の後に、半硬化PDMSは凝固され、合流地点は漏洩耐性となった。内側にプラグのアレイを有するキャピラリーは、アダプタキャピラリーのより大きい端にしっかりと挿入された。接続部はどのような密閉材も用いることなく漏洩耐性となった。セットアップ全体を傾けることによって、重力が、プラグのアレイをPDMSマイクロチャンネルの中に引き込んだ。代替的に、シリンジを使用して、アレイを含んでいるキャピラリーのオープンエンド上に圧力を適用することによって、プラグの輸送は達成され得る。
【0177】
第2の構成において、PDMSマイクロチャンネルの入口は、小さいテフロン(登録商標)パイプ(OD:250μm、ID:200μm)に結合された。合流地点は、第1の型において記述された同じ方法(半硬化PDMSを用いて)で漏洩耐性にされた。次に、テフロン(登録商標)パイプの自由端は、プラグのアレイを保持したガラスキャピラリーの大きい端の中に挿入された。さらに、シリンジによって加えられたガラスキャピラリーの小さい端上の重力または圧力は、PDMSマイクロチャンネルの中にプラグのアレイを移送するように加えられた。
【0178】
第3の型において、最初に、プラグのアレイは、上記のような同じセットアップにおいてシリンジに接続されたテフロン(登録商標)パイプの小さい部分の中に輸送された。次に、内側にプラグのアレイを有する小さいテフロン(登録商標)パイプは、キャピラリー結合器の中に挿入された。シリンジを通じて圧力を加えることによって、プラグのアレイは、PDMSマイクロチャンネルの中に押され得る。
【0179】
プラグの流れは、プラグをマイクロチャンネルの中に押すシリンジによって制御され得る。代替的に、プラグのアレイがPDMSマイクロチャンネルの中に入り、油の入口を通過した後で、入口は蝋によって密閉され得る。次に、プラグの移動は油の流れによって制御され得、該油の流れは、シリンジまたはシリンジポンプによって押される。
【0180】
(実施例4:PDMSマイクロチャンネル(収容構成要素)からガラスキャピラリー(保持構成要素)の中にプラグを輸送すること。)
この実験において、個々にタンパク質溶液に融合されるプラグのアレイは、PDMSマイクロチャンネルの出口に接続されたガラスキャピラリーの中に輸送された。再利用可能な型が、ここで使用され得ることにより、PDMSマイクロフルイディックデバイスを再利用する。これは、薄い壁(OD:250μm、ID:200μm)のテフロン(登録商標)パイプをPDMSマイクロチャンネルの出口に取り付けることによって達成された。Hampton researchからのガラスキャピラリー(OD:200μm、ID:180μm)は、パイプの自由端をガラスキャピラリーの大きい端に挿入することによって、テフロン(登録商標)パイプに結合され得る。結合のために密閉材は必要とされず、漏洩は認められなかった。1つのガラスのキャピラリーが、タンパク質溶液と様々な沈殿剤との混合物を含むプラグの1つのアレイで満たされた後に、該ガラスのキャピラリーはテフロン(登録商標)パイプから取り外され、蝋で密閉された。別のガラスのキャピラリーが、次のプラグのアレイのために、テフロン(登録商標)パイプに結合するように使用され得る。
【0181】
(実施例5:アレイ内の各プラグをPDMSマイクロチャンネル内のタンパク質溶液に融合すること。)
この実験において、融合を実行する2つの型が存在する。第1の型において、プラグのアレイは、融合構成要素内で押され、タンパク質溶液の流れを流されたチャンネルを有する合流地点を通過した。各プラグは少量のタンパク質溶液と融合した。プラグの流量またはタンパク質の流れの流量を変化させることによって、各沈殿剤のタンパク質に対する相対量の割合が制御され得る。
【0182】
第2の型において、まず、タンパク質の流れは、油の流れの中に注入され、その結果、タンパク質溶液のプラグの別のアレイが形成された。沈殿剤を含んだプラグのアレイは、融合構成要素におけるT字型の合流地点において、タンパク質溶液のプラグのアレイに1つずつ融合され得る。
【0183】
(実施例6:PDMSマイクロチャンネル内のタンパク質溶液にプラグを1つおきに融合すること。)
プラグのアレイは多くの群のプラグからなり得る。組み合わせ構成要素が、これらの群内で選択的に溶液を融合することが、時として所望される。例えば、VD結晶化の事例において、第1群のプラグは沈殿剤溶液を含み、第2群のプラグは、乾燥溶液を含む。気相拡散による結晶化を実行するために、タンパク質溶液の流れは、沈殿剤のプラグに融合することを所望されるが、乾燥剤のプラグに融合することは所望されない。試剤溶液を有するプラグのアレイの融合は、キャピラリー数によって記述され得、該キャピラリー数は、表面張力と粘度とに依存する。好適な実施形態において、プラグと搬送流体との間の表面張力が制御され得、選択的な融合の制御を可能にする。表面張力は、プラグ内の界面活性剤の濃度の操作を通じて修正され得る。粘度はまた、例えば、乾燥剤のプラグを粘着性にする構成要素(例えば、ポリエチレングリコール)を追加することによって制御され得る。他の実施形態において、プラグのアレイの流量とタンパク質の流れの流量とがまた使用され得ることにより、選択的な融合を制御する。
【0184】
沈殿剤溶液および洗浄剤溶液を使用した選択的融合を実証する一連の実験が行なわれた。第1の実験において、沈殿剤を含んだプラグは、オクチル−β−D−グルコピラノシド(OG)洗浄剤の1%の溶液の流れと融合した。第1の実験において使用された装置と同一であるが別個の装置上で、同一の流量で行なわれた第2の実験において、ポリエチレングリコール5000モノメチルエチル、ならびに半フッ化界面活性剤および非フッ化界面活性剤の混合物を含んだ乾燥剤のプラグは、1%のOGの流れの付近で、屈曲し、融合しなかった。1%のOGの流れが、乾燥剤のプラグと互い違いにある沈殿剤のプラグのアレイと共に、組み合わせ構成要素において使用された第3の実験において、1%のOGの流れは沈殿剤のプラグのみと融合した。
【0185】
従って、融合されていないプラグ内の塩濃度は、融合されたプラグ内の塩濃度よりも高くなり得る。油が親水性である場合には、濃度差による浸透圧は、融合したプラグから融合していないプラグに水を拡散させ得る。融合したプラグはこの方法で濃縮され、タンパク質の核形成および結晶化は高められ得る。
【0186】
(実施例7:膜タンパク質の結晶化)
脂肪酸アミドヒドロラーゼ(FAAH)は、ニューロン表面において、エンドカンナビノイド信号分子を分解する完全な膜タンパク質である。FAAHの除去は鎮痛効果を増加させることに関連している。つまり、エンドカンナビノイドは、痛みおよびそれに関連する神経障害の緩和を標的とした最高の薬剤と考えられている。アラキドニル阻害剤と錯体化されたラットのFAAHの構造は公知である。その錯体は、どのようにFAAHが細胞膜に統合されるか、およびどのようにFAAHが活性部位から二重層にアクセスを確立するかを示した。
【0187】
FAAHの結晶は、タンパク質結晶化のマイクロバッチ方法を使用して、チップ上で生成された。3つの水溶液の入口および1つの搬送流体の入口を有するPDMSとテフロン(登録商標)との複合キャピラリー装置が構成された。この装置は、出口から搬送流体と水溶液との合流地点に直接的にキャピラリーを挿入され、膜タンパク質界面活性剤を含むプラグの形成を容易にした。使用された搬送流体は、パーフルオロトリペンチルアミン(3MのFC−70)であり、該FC−70は、膜タンパク質界面活性剤と適合性があることを示した。この装置を使用して、〜40cmのパイプは、マイクロバッチの液滴で満たされた。プラグ内の沈殿剤の濃度の勾配は、沈殿剤と緩衝剤との流れの流量を変化させることによって達成された。アラキドニル阻害剤と錯体化されたFAAHに対する沈殿剤溶液は、16%のPEG 6000、200mMのLi2SO4、10%のエチレングリコール、14%の2−メチル−2,4−ペンタンジオールおよび5.6のpHにおいて緩衝剤で処理された200mMのクエン酸塩からなった。非晶質ポリオフィレンの形式におけるFAAHに対する沈殿剤は、24%のPEG 4000、200mMのLi2SO4、10%の2−メチル−2,4−ペンタンジオール、400mMのNaClおよび8.2のpHにおいて緩衝剤で処理された100mMのTrisであった。
【0188】
(実施例8:VD結晶化スクリーン:プラグのアレイの準備および輸送)
第1に、テフロン(登録商標)パイプの小さい部分(外径250μm、内径200μm)が10μLのシリンジ(Hamilton)に接続された。この接続は、「管内管」方法を使用することによって行われた。テフロン(登録商標)パイプのより厚い部分(約30G)がシリンジに接続され、パイプの薄い部分がより暑い部分の中に挿入され、接続は(例えば、蝋を用いて)密閉された。パイプのその部分が伸張され得ることにより、直径を減少させた。シリンジとテフロン(登録商標)パイプとは、フルオロカーボン搬送流体で満たされた。フルオロカーボンは、量的割合が10:1であるパーフルオロパーヒドロフェナントレン(PFP)および1H,1H,2H,2H−パーフルオロオクタノール(PFO)との混合物である。プラグのアレイを準備するために、異なる試剤、フルオロカーボン、および気泡が、小さいテフロン(登録商標)パイプのその部分に連続して吸引された。これは、テフロン(登録商標)パイプに接続されたシリンジのプランジャを引き、テフロン(登録商標)パイプの他の端が対応する溶液の中にあることによって達成された。吸引プロセスの間に、プランジャの移動は、手動のマイクロメータシリンジドライバ(Stoelting Co.)によって制御された。各試剤の吸引の前に、少量のフルオロカーボンは、テフロン(登録商標)パイプの中に吸引されたことにより、プラグを分離した。一部の実験において、フルオロカーボンの吸引の後に、気泡がまたテフロン(登録商標)パイプの中に吸引された。これらの気泡は、対照的な粘度の溶液を含むプラグの偶然的な癒着を防止した。プラグのアレイが、テフロン(登録商標)パイプの内側で準備された後に、フルオロカーボンがさらにパイプの中に吸引された。次に、テフロン(登録商標)パイプは、漏斗状のキャピラリー(Hampton Research)の中に挿入された。テフロン(登録商標)パイプに接続されたシリンジのプランジャを押すことによって、プラグのアレイはキャピラリー(OD 0.20mm、ID 0.18mm)の中に移送された。次に、キャピラリーはパイプから切り離され、長期保存のために蝋によって密閉された。マイクロフルイディックチャンネルにおける実験のためにアレイを利用するために、まず、アレイはキャピラリーからテフロン(登録商標)パイプの中に輸送された。次に、テフロン(登録商標)パイプは漏斗状の結合器の中に挿入され、該結合器はマイクロフルイディックチャンネルの入口に結合された。アレイの輸送はテフロン(登録商標)パイプに接続されたシリンジによって制御された。同時に、標的溶液の流れは、側面のチャンネルの中に注入され、この流れはプラグのアレイに融合し、混合し、反応が生じた。プラグのアレイは、混合の後に、同様の漏斗状の結合器を使用してキャピラリーの中に輸送された。キャピラリーがプラグのアレイで満たされた後に、キャピラリーはマイクロフルイディックチャンネルから取り外され、定温放置または分析のために密閉され得る。
【0189】
(実施例9:1つの基質に対するいくつかの酵素の機能的アッセイ)
プラグのアレイが準備され、該プラグは、アルカリ性のリン酸塩(AP)(0.2Mのジエタノールアミン内に0.02mg/ml、pH10.5)、カタラーゼ(PBS内に0.02mg/ml、pH7.3)、リボヌクレアーゼA(RNase)(0.05MのTris緩衝剤内に0.02mg/ml、pH7.5)、およびリソチーム(0.05MのNaAc緩衝剤内に0.02mg/ml、pH4.5)を含んでいた。アレイは、各酵素のプラグを1つ有し、2つ毎に隣接する酵素のプラグは、PBS緩衝剤の2つのプラグによって分離される。これらのプラグは「洗浄剤のプラグ」として作用し、基質の流れのあらゆる二次汚染を取り除く(酵素が基質の流れの中への拡散または表面張力駆動の流れによって輸送された場合には、この二次汚染は基質の流れに融合する間に生じ得る。)。気泡が2つ毎に隣接する水溶性のプラグの間に挿入された。基質二燐酸フルオレセイン(FDP)(11μM、0.5MのNaClを有する)上の4つの酵素の活性をアッセイするために、プラグのアレイはT字型の合流地点においてFDPの溶液に融合された(図11を参照)。アレイおよびFDPの流れの流量は、それぞれ1.2μL/minおよび0.5μL/minであった。融合されたプラグのアレイは、キャピラリー内に収集され、各プラグの蛍光画像が、デジタルカメラ(Hamamatsu、ORCA−ER)を装備した蛍光顕微鏡(Leica DMIRE2)によって撮影された。画像内の蛍光強度は、Metamorph Imaging System(Universal Imaging)を使用して分析され、アルカリ性の燐酸塩の活性を示した。
【0190】
(実施例10:VD結晶化スクリーン:タウマチンの結晶化状態に関する沈殿剤のスクリーニング)
Crystal Screen Kit(Hampton Research)からの48個の沈殿剤をスクリーンするために、48個の沈殿剤(No.1〜No.48)の48個のプラグのアレイが準備された。沈殿剤の試剤の処方は、Hampton Researchのウェブサイト
(http://www.hamptonresearch.com/support/guides/2110F.pdf)において見つけられ得る。沈殿剤試剤は、様々な塩濃度(例えば、No.44は0.2Mのギ酸アンモニウムおよびNo.33は4.0Mのギ酸ナトリウム)および様々な粘度(例えば、No.30は30%のw/vのPEG8000)を有する。2つ毎に隣接するプラグは気泡によって分離された。搬送流体はPFPとPFOとの混合物(量的割合は10:1)であった。アレイが準備された後に、アレイはスクリーニングのためにマイクロチャンネルの中に輸送された。テフロン(登録商標)パイプの別の部分は10μLのシリンジに接続され、シリンジとパイプとのアセンブリはPFPで満たされた。わずかに1.0μLを下回るタウマチンの溶液(0.1MのN−(2−アセトアミド)イミンアセト酢酸緩衝剤、pH6.5)がパイプの中に吸引された。次に、パイプはT字型の合流地点の側面のマイクロチャンネルの入り口の中に挿入された。タウマチン溶液は、主チャンネルの中に駆動され、沈殿剤のプラグのアレイに融合された。タウマチン溶液およびアレイの流量は、それぞれ0.5μL/minおよび1.2μL/minであった。プラグがタウマチン溶液に融合された後に、プラグはキャピラリー内に収集され、定温放置のために蝋によって密閉された。18℃におけるプラグの定温放置は、沈殿剤No.29およびタウマチンを含むプラグ内でタウマチンの結晶化をもたらした。〜0.1μLを下回るタウマチン溶液がチャンネル内に残った。この方法は、複数の試剤のナノリッターのプラグに対してスクリーンされる多量の溶液を必要とせず、あまり多くの廃棄物を生成せず、マイクロリッターを下回るような少ない量に有益である。
【0191】
Crystal Screen Kitからの5つの沈殿剤をスクリーンするために、プラグのアレイは準備され、該プラグはスクリーニングキットからの5つの異なる沈殿剤:No.13(0.2Mのクエン酸ナトリウム/0.1MのTrisHCl/30%のv/vのPEG 400、pH8.5)、No.24(0.2MのCaCl2/0.1MのNaAc/20%のv/vのイソプロパノール、pH4.6)、No.25(0.1Mのイミダゾール/1.0MのNaAc、pH6.5)、No.29(0.1MのHEPES/0.8Mの酒石酸ナトリウムカリウム、pH7.5)、およびNo.33(4.0Mのギ酸ナトリウム)を含んでいた。アレイは、各試剤のプラグを2つ、合計で10個のプラグを含む。気泡は、2つ毎に隣接するプラグの間に挿入された。PFPとPFOとの混合物(体積割合は10:1)は搬送流体として使用された。タウマチンの水溶性の流れ(0.1MのADA緩衝剤内で〜60mg/ml、pH6.5)は結晶化のためにプラグのアレイの中に注入された。アレイおよびタウマチンの流れの流量は、それぞれ1.2μL/minおよび0.5μL/minであった。18℃におけるプラグの定温放置は、沈殿剤No.29およびタウマチンを含むプラグ内でタウマチンの結晶化をもたらした。
【0192】
(実施例11:自由界面拡散結晶化スクリーン)
自由界面拡散試験は、タンパク質のプラグを沈殿剤のプラグと互い違いにすることによってセットアップされた。密閉されたキャピラリーに輸送される前に、互い違いの対のプラグは、狭いテフロン(登録商標)パイプの部分にポンプ注入された。(密閉されたキャピラリーはシラン処理によって疎水性にされた)。親水性のガラスファイバはキャピラリーの中に挿入された。プラグが残されるにつれ、キャピラリーが一定の割合で移動されることにより、プラグ間の距離を制御した。液滴はガラスファイバを自動的に湿潤し、ドロップ間に小さい相互接続を形成し、拡散が生じることを可能にした。
【0193】
(実施例12:自由界面拡散結晶化スクリーン)
テフロン(登録商標)キャピラリー(ID0.008±0.001内;壁0.001±0.001内)は、3MのFC−3283:1H,1H,2H,2H−パーフルオロ−1−オクタノールの5:1のv/vの混合物で満たされた。ADA緩衝剤内の25mg/mLのタウマチンの〜300nLのプラグはキャピラリーの中に吸引され、次に、フルオロカーボン混合物の〜200nLの小さいプラグ、2Mの酒石酸カルシウムナトリウムの〜300nLのプラグ、およびフルオロカーボンの混合物の別のプラグがこの順序で吸引された。キャピラリーのオープンエンドは、キャピラリー蝋で密閉され、キャピラリーはeppendorf 5415 D遠心分離器内に固定され、その結果、加速力がキャピラリーの長手方向にほぼ垂直に及ぼされた(キャピラリーはロータ上に置かれ、遠心分離器の管の上にテープを用いて固定された)。遠心分離は、30秒間、2000rpmで適用された。遠心分離プロセスは、2つの水溶性のプラグ間からのより密度の高い搬送流体を消散させ、2つの水溶性のプラグが近付き、界面を確立することを可能にした。溶質は界面全体に拡散するように混合し、遠心分離の直後に、沈殿剤が2つの水溶性のプラグ間の界面において観察された。1日後、たんぱく質タウマチンの結晶が形成された。
【特許請求の範囲】
【請求項1】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
水性の流れを、該第1の入口に隣接して該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で、マルチコンポーネントの流れが形成されるように導入することであって、該マルチコンポーネントの流れは、該プラグの第1の線形のアレイと該水性の流れとの層流を含む、ことと、
該マルチコンポーネントの流れに、第2の搬送流体の流れを、該第1の入口および該第2の入口の下流にある第3の入口を通して、第3の流量で導入することであって、該第3の入口は、該マイクロチャンネルと流体連通しており、その結果、該プラグの第1の線形のアレイのそれぞれのプラグまたはその一部が、該水性の流れの一部と組み合わせられて、プラグの第2の線形のアレイを形成する、ことと
を包含し、該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、方法。
【請求項2】
前記プラグの第2の線形のアレイのプラグの体積が、前記プラグの第1の線形のアレイのプラグの体積より小さくなるように、前記第1の流量および第2の流量が調節される、請求項1に記載の方法。
【請求項3】
前記第1の流量と前記第2の流量とが変化させられる、請求項1に記載の方法。
【請求項4】
前記水性の流れが試剤を含む、請求項1に記載の方法。
【請求項5】
前記試剤が、結晶化され得る試剤である、請求項4に記載の方法。
【請求項6】
前記プラグの第1の線形のアレイが、スパース行列スクリーンのための試剤を含む、請求項5に記載の方法。
【請求項7】
前記試剤がタンパク質である、請求項5に記載の方法。
【請求項8】
前記水性の流れが、複数の水溶液の層流を含む、請求項1に記載の方法。
【請求項9】
前記第1の搬送流体および第2の搬送流体のうちのいずれかまたは両方が、フッ化流体を含む、請求項1に記載の方法。
【請求項10】
前記プラグの第1の線形のアレイが、前記マイクロチャンネルに導入される前に、事前形成されたカートリッジ内に配置される、請求項1に記載の方法。
【請求項11】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
第2の搬送流体の流れを、該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で導入することであって、その結果、該プラグの第1の線形のアレイの少なくとも1つのプラグは、該第2の搬送流体の流れによって分離され、プラグの第2の線形のアレイを形成し、該プラグの第2の線形アレイは、該プラグの第1の線形アレイの少なくとも1つのプラグから形成された結果としてのプラグと、該プラグの第1の線形アレイのその他のプラグとを含む、ことと、
を包含し、該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、方法。
【請求項12】
前記プラグの第2の線形のアレイのプラグのサイズが、前記第2の流量に対する前記第1の流量によって調節される、請求項11に記載の方法。
【請求項13】
水性の流れを、前記第1の入口および第2の入口の下流にある第3の入口の中に第3の流量で導入することであって、該第3の入口は、前記マイクロチャンネルと流体連通しており、その結果、前記プラグの第2の線形のアレイにおける少なくとも1つのプラグが、該水性の流れの一部と組み合わせられて、プラグの第3の線形のアレイを形成することをさらに包含し、
該プラグの第3の線形アレイは、該プラグの第2の線形アレイの少なくとも1つのプラグから形成された結果としてのプラグと、該プラグの第2の線形アレイのその他のプラグとを含む、請求項11に記載の方法。
【請求項14】
前記水性の流れが、少なくとも1つの試剤を含み、そして該プラグの第3の線形のアレイのプラグにおける該試剤の濃度が、前記第3の流量に対する前記第2の流量によって調節される、請求項13に記載の方法。
【請求項15】
前記試剤がタンパク質である、請求項14に記載の方法。
【請求項16】
前記プラグの第3の線形のアレイのプラグにおける前記試剤の濃度が変化させられる、請求項14に記載の方法。
【請求項17】
前記第1の搬送流体および前記第2の搬送流体のうちのいずれかまたは両方が、フッ化流体を含む、請求項11に記載の方法。
【請求項18】
前記プラグの第1の線形のアレイが、前記マイクロチャンネルに導入される前に、事前形成されたカートリッジ内に配置される、請求項11に記載の方法。
【請求項19】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該プラグの第1の線形のアレイは、タンパク質を含み、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
第2の搬送流体の流れを、該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で導入することであって、その結果、該プラグの第1の線形のアレイのそれぞれのプラグは、該第2の搬送流体の流れによって分離され、プラグの第2の線形のアレイを形成し、該プラグの第2の線形のアレイのサイズが、該第2の流量に対する該第1の流量を調節することによって変化させられ、そして該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、ことと、
水性の流れを、該第1の入口および第2の入口の下流にある第3の入口の中に第3の流量で導入することであって、該第3の入口は、該マイクロチャンネルと流体連通しており、その結果、該プラグの第2の線形のアレイにおけるそれぞれのプラグが、該水性の流れの一部と組み合わせられて、プラグの第3の線形のアレイを形成し、該プラグの第3の線形のアレイが、該プラグの第1の線形のアレイに元々含まれる濃度とは異なる濃度のタンパク質を含む、ことと、
を包含する、方法。
【請求項20】
少なくとも1つのプラグ内で反応を行う方法であって、
搬送流体をデバイスの第1のマイクロチャンネルに導入することと、
プラグの少なくとも1つの第1のアレイと、1つの水性の流れとを、該第1のマイクロチャンネルと流体連通している第1の入口の中に同時に導入することであって、その結果、該プラグの第1のアレイおよび該水性の流れが該搬送流体と接触した後に、プラグの第2のアレイの少なくとも1つのプラグが該搬送流体内で形成される、ことと、
を包含し、該プラグの第1のアレイが、少なくとも1つの第1の試剤を含み、該水性の流れが、第2の試剤を含み、各プラグ流体が、該搬送流体と非混和性であり、そして該プラグの第2のアレイの少なくとも1つのプラグが、該プラグの第1のアレイの1つのプラグの一部分と該水性の流れの一部分との両方を少なくとも含み、その結果、該試剤の反応が、実質的に、該プラグの第2のアレイにおいて起こり、そして各プラグが、搬送流体によって実質的に囲まれる、方法。
【請求項1】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
水性の流れを、該第1の入口に隣接して該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で、マルチコンポーネントの流れが形成されるように導入することであって、該マルチコンポーネントの流れは、該プラグの第1の線形のアレイと該水性の流れとの層流を含む、ことと、
該マルチコンポーネントの流れに、第2の搬送流体の流れを、該第1の入口および該第2の入口の下流にある第3の入口を通して、第3の流量で導入することであって、該第3の入口は、該マイクロチャンネルと流体連通しており、その結果、該プラグの第1の線形のアレイのそれぞれのプラグまたはその一部が、該水性の流れの一部と組み合わせられて、プラグの第2の線形のアレイを形成する、ことと
を包含し、該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、方法。
【請求項2】
前記プラグの第2の線形のアレイのプラグの体積が、前記プラグの第1の線形のアレイのプラグの体積より小さくなるように、前記第1の流量および第2の流量が調節される、請求項1に記載の方法。
【請求項3】
前記第1の流量と前記第2の流量とが変化させられる、請求項1に記載の方法。
【請求項4】
前記水性の流れが試剤を含む、請求項1に記載の方法。
【請求項5】
前記試剤が、結晶化され得る試剤である、請求項4に記載の方法。
【請求項6】
前記プラグの第1の線形のアレイが、スパース行列スクリーンのための試剤を含む、請求項5に記載の方法。
【請求項7】
前記試剤がタンパク質である、請求項5に記載の方法。
【請求項8】
前記水性の流れが、複数の水溶液の層流を含む、請求項1に記載の方法。
【請求項9】
前記第1の搬送流体および第2の搬送流体のうちのいずれかまたは両方が、フッ化流体を含む、請求項1に記載の方法。
【請求項10】
前記プラグの第1の線形のアレイが、前記マイクロチャンネルに導入される前に、事前形成されたカートリッジ内に配置される、請求項1に記載の方法。
【請求項11】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
第2の搬送流体の流れを、該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で導入することであって、その結果、該プラグの第1の線形のアレイの少なくとも1つのプラグは、該第2の搬送流体の流れによって分離され、プラグの第2の線形のアレイを形成し、該プラグの第2の線形アレイは、該プラグの第1の線形アレイの少なくとも1つのプラグから形成された結果としてのプラグと、該プラグの第1の線形アレイのその他のプラグとを含む、ことと、
を包含し、該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、方法。
【請求項12】
前記プラグの第2の線形のアレイのプラグのサイズが、前記第2の流量に対する前記第1の流量によって調節される、請求項11に記載の方法。
【請求項13】
水性の流れを、前記第1の入口および第2の入口の下流にある第3の入口の中に第3の流量で導入することであって、該第3の入口は、前記マイクロチャンネルと流体連通しており、その結果、前記プラグの第2の線形のアレイにおける少なくとも1つのプラグが、該水性の流れの一部と組み合わせられて、プラグの第3の線形のアレイを形成することをさらに包含し、
該プラグの第3の線形アレイは、該プラグの第2の線形アレイの少なくとも1つのプラグから形成された結果としてのプラグと、該プラグの第2の線形アレイのその他のプラグとを含む、請求項11に記載の方法。
【請求項14】
前記水性の流れが、少なくとも1つの試剤を含み、そして該プラグの第3の線形のアレイのプラグにおける該試剤の濃度が、前記第3の流量に対する前記第2の流量によって調節される、請求項13に記載の方法。
【請求項15】
前記試剤がタンパク質である、請求項14に記載の方法。
【請求項16】
前記プラグの第3の線形のアレイのプラグにおける前記試剤の濃度が変化させられる、請求項14に記載の方法。
【請求項17】
前記第1の搬送流体および前記第2の搬送流体のうちのいずれかまたは両方が、フッ化流体を含む、請求項11に記載の方法。
【請求項18】
前記プラグの第1の線形のアレイが、前記マイクロチャンネルに導入される前に、事前形成されたカートリッジ内に配置される、請求項11に記載の方法。
【請求項19】
複数のプラグを操作するための方法であって、
第1のプラグ流体のプラグの第1の線形のアレイをマイクロフルイディック装置内のマイクロチャンネルの中に第1の入口において第1の流量で導入することであって、該プラグの第1の線形のアレイは、タンパク質を含み、該第1のプラグ流体のプラグは、第1の搬送流体および/またはスペーサのいずれかによって互いから分離され、該第1の搬送流体および該スペーサは、該第1のプラグ流体および互いに実質的に非混和性である、ことと、
第2の搬送流体の流れを、該マイクロチャンネルと流体連通する第2の入口の中に第2の流量で導入することであって、その結果、該プラグの第1の線形のアレイのそれぞれのプラグは、該第2の搬送流体の流れによって分離され、プラグの第2の線形のアレイを形成し、該プラグの第2の線形のアレイのサイズが、該第2の流量に対する該第1の流量を調節することによって変化させられ、そして該第2の搬送流体が、該第1のプラグ流体および該スペーサーと実質的に非混和性である、ことと、
水性の流れを、該第1の入口および第2の入口の下流にある第3の入口の中に第3の流量で導入することであって、該第3の入口は、該マイクロチャンネルと流体連通しており、その結果、該プラグの第2の線形のアレイにおけるそれぞれのプラグが、該水性の流れの一部と組み合わせられて、プラグの第3の線形のアレイを形成し、該プラグの第3の線形のアレイが、該プラグの第1の線形のアレイに元々含まれる濃度とは異なる濃度のタンパク質を含む、ことと、
を包含する、方法。
【請求項20】
少なくとも1つのプラグ内で反応を行う方法であって、
搬送流体をデバイスの第1のマイクロチャンネルに導入することと、
プラグの少なくとも1つの第1のアレイと、1つの水性の流れとを、該第1のマイクロチャンネルと流体連通している第1の入口の中に同時に導入することであって、その結果、該プラグの第1のアレイおよび該水性の流れが該搬送流体と接触した後に、プラグの第2のアレイの少なくとも1つのプラグが該搬送流体内で形成される、ことと、
を包含し、該プラグの第1のアレイが、少なくとも1つの第1の試剤を含み、該水性の流れが、第2の試剤を含み、各プラグ流体が、該搬送流体と非混和性であり、そして該プラグの第2のアレイの少なくとも1つのプラグが、該プラグの第1のアレイの1つのプラグの一部分と該水性の流れの一部分との両方を少なくとも含み、その結果、該試剤の反応が、実質的に、該プラグの第2のアレイにおいて起こり、そして各プラグが、搬送流体によって実質的に囲まれる、方法。
【図2】


【図10】


【図1】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図10】


【図1】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2012−71303(P2012−71303A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−231160(P2011−231160)
【出願日】平成23年10月20日(2011.10.20)
【分割の表示】特願2008−501972(P2008−501972)の分割
【原出願日】平成18年3月15日(2006.3.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(507309046)ユニバーシティ オブ シカゴ (2)
【Fターム(参考)】
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−231160(P2011−231160)
【出願日】平成23年10月20日(2011.10.20)
【分割の表示】特願2008−501972(P2008−501972)の分割
【原出願日】平成18年3月15日(2006.3.15)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(507309046)ユニバーシティ オブ シカゴ (2)
【Fターム(参考)】
[ Back to top ]

