マイクロ化学デバイス
【課題】リンパ球やその他の細胞等からなる多数の被検体を、1個1個独立して容易に保持することができるとともに、保持された各被検体に対して試薬、反応液等の薬液を供給して所望の検査を確実に実施でき、また薬液の交換も容易であるマイクロ化学デバイスを提供する。
【解決手段】合成樹脂製で作成された基板1の表面であって、堰リブ2で周囲を取り囲まれた薬液注入領域3内に被検体Sの保持領域4を設け、該保持領域に複数の独立した突起5を繰返しパターンで一体形成し、接近した複数の突起が連係して被検体を1個のみ保持できる単位保持部Hを形成するとともに、各突起の間を薬液の流路6とし、堰リブの高さを突起の高さ以上に設定してなる。
【解決手段】合成樹脂製で作成された基板1の表面であって、堰リブ2で周囲を取り囲まれた薬液注入領域3内に被検体Sの保持領域4を設け、該保持領域に複数の独立した突起5を繰返しパターンで一体形成し、接近した複数の突起が連係して被検体を1個のみ保持できる単位保持部Hを形成するとともに、各突起の間を薬液の流路6とし、堰リブの高さを突起の高さ以上に設定してなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、複数の被検体を同時に検査することが可能なマイクロ化学デバイスに係り、更に詳しくはリンパ球等の細胞を個々に保持し、各細胞に試薬や反応液等の薬液を作用させることが可能なマイクロ化学デバイスに関する。
【背景技術】
【0002】
特許文献1に示されているように、基板に細胞1個の大きさより少し大きな凹部(ウェル)を多数設けたマイクロ化学デバイスを使用し、細胞1個を1個のウェル内に挿入し、試薬、反応液等の薬液をウェル内に注入して細胞を検査する方法が提案されている。このマイクロ化学デバイスを使用する検査方法は、複雑な装置は必要とせず、細胞の分取の時間は短時間であり、抗原が結合することも確認できる。特に、頻度の低い抗原特異的リンパ球(0.001%以上)も検出でき、抗原が結合したリンパ球が抗原に反応するかを解析することができ、しかも抗原特異的リンパ球を分取できる抗原特異的リンパ球検出法を提供することができる。
【0003】
また、特許文献1には、1個のウェルに1つのリンパ球が格納されるようにするためには、例えば、ウェルの平面形状に内接する最大円の直径が、ウェルに格納しようとするリンパ球の直径の1〜2倍の範囲、より好ましくは1.2〜1.8倍の範囲であることが適当であることが開示されている。そして、ウェルの深さも、該ウェルに格納しようとするリンパ球の直径の1〜2倍の範囲、より好ましくは1.2〜1.8倍の範囲であることが適当であることが開示されている。ウェルの寸法は、ウェルに格納しようとするリンパ球の直径に応じて好適な比を考慮して適宜決定するが、ウェルが円筒形でリンパ球がBリンパ球の場合、直径は5〜15μmであり、深さは5〜40μmである。そして、基板に設けるウェルの数は、特に制限はないが、抗原特異的リンパ球の頻度が105個に1個から多い場合には約500個であるという観点から、1cm2当たり、例えば、2,000〜1,000,000個の範囲である。
【0004】
このような基板に多数のマイクロウェルを形成したマイクロ化学デバイスは、合成樹脂製で射出成形して製造するが、合成樹脂製のマイクロ化学デバイスでは、ガラス製のデバイスと比べて疎水性が高いため、数十μmから数μmの大きさの細胞をウェル内に挿入するのは困難である。そこで、細胞をウェルに挿入する前に、デバイス表面を親水化処理する。親水化処理としてプラズマ処理があるが、親水化はできるものの、所望の親水化状態にさせることが困難であるばかりか、プラズマ処理後から時間が経つにつれて親水化状態が悪くなる。また、溶液に浸漬して親水化、例えばゾルゲル処理する方法もあるが、ウェルが数十μm程度と微細な場合は均一に処理できないばかりか、処理溶液の除去作業が困難となる。
【0005】
従来のマイクロ化学デバイスでは、1ウェル内に1個の細胞を入れる大きさは確保されているものの、ウェルを含むデバイス全体の親水化レベルが一定であるため、ウェル内への細胞の捕集率が悪い。また、試薬、反応液等の薬液をウェル内に入れて、その入れた薬液を他の薬液と置換させる場合もウェルが1個ずつ独立しているので、薬液の交換率が悪い。また、蛍光試薬を用いた解析ではデバイス自体から蛍光が発生したり、蛍光反応を効率良くデバイスが反射しないため、測定感度が悪いといった問題があった。
【特許文献1】特許第3723882号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、本発明が前述の状況に鑑み、解決しようとするところは、リンパ球やその他の細胞等からなる多数の被検体を、1個1個独立して容易に保持することができるとともに、保持された各被検体に対して試薬、反応液等の薬液を供給して所望の検査を確実に実施でき、また薬液の交換も容易であるマイクロ化学デバイスを提供する点にある。
【課題を解決するための手段】
【0007】
前述の課題解決のために、本発明は、合成樹脂製で作成された基板の表面であって、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、該保持領域に複数の独立した突起を繰返しパターンで一体形成し、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成するとともに、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定してなることを特徴とするマイクロ化学デバイスを提供する(請求項1)。
【0008】
ここで、前記単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定した(請求項2)。
【0009】
また、前記単位保持部を構成する突起の数が2〜4個の内の何れかである(請求項3)。
【0010】
そして、前記突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度であることが好ましい(請求項4)。
【0011】
更に、前記堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなることも好ましい(請求項5)。
【0012】
また、前記堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなることも好ましい(請求項6)。
【0013】
そして、前記基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなることも好ましい(請求項7)。更に、前記基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色として発色を利用した解析に供してなることも好ましい(請求項8)。あるいは、前記基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色として発色を利用した解析に供してなることも好ましい(請求項9)。
【発明の効果】
【0014】
以上にしてなる本願請求項1に係る発明のマイクロ化学デバイスによれば、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成したので、リンパ球やその他の細胞等からなる多数の被検体を、1個1個独立して容易に保持することができ、数十μmから数μmの細胞の捕集率が高くなる。また、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定したので、保持された各被検体に対して試薬、反応液等の薬液の供給が容易であるとともに、薬液を被検体に供給して所望の検査を確実に実施でき、また薬液の交換も容易である。
【0015】
請求項2によれば、単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定したので、各単位保持部に被検体を1個1個確実に保持することができる。
【0016】
請求項3によれば、単位保持部を構成する突起の数が2個であると、最小の個数の突起で被検体を保持することができ、また突起の密度が低くなるので、成形金型の製作に対する微細化要求が緩和される。また、単位保持部を構成する突起の数が4個であると、被検体の寸法にバラツキが大きくても確実に1個1個ずつ保持することができるとともに、突起の繰返しパターンが単純化され、成形金型の作成が容易になる。また、単位保持部を構成する突起の数が3個であると、前述の両者の中間的な効果を奏するのである。
【0017】
請求項4によれば、突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度であると、単位保持部に被検体を1個ずつ注入する作業が簡単になるとともに、不要な液体の除去作業が簡単になる。
【0018】
請求項5によれば、堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなるので、薬液注入領域内に常に一定量の薬液を注入することができ、また薬液注入領域内に薬液を注入すると、自動的に単位保持部に保持された被検体に薬液を供給することができる。
【0019】
請求項6によれば、堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなるので、液溜領域から薬液を注入すれば円形領域に設けた保持領域に薬液を緩やかに流動させて供給することができるので、薬液の注入時に単位保持部に保持された被検体が薬液の流れで飛び出すことがないのである。
【0020】
請求項7によれば、基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなることで、成形時の基板の反りを防止でき、基板表面を平らにすることができる。
【0021】
請求項8によれば、基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色とすれば、デバイスの反射率が高くなり、発色を利用した解析に供すると測定感度が高くなる。
【0022】
請求項9によれば、基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色とすれば、デバイス自体からの蛍光の発生が少なくなり、発色を利用した解析に供すると測定感度が高くなる。
【発明を実施するための最良の形態】
【0023】
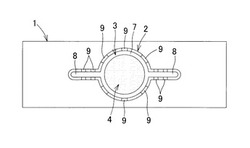
次に、本発明に係るマイクロ化学デバイスの実施形態を図1〜図5に基づいて詳細に説明する。図1は、マイクロ化学デバイスの平面図、図2はその斜視図、図3は部分拡大斜視図、図4及び図5は突起の拡大図であり、図中符号1は基板、2は堰リブ、3は薬液注入領域、4は保持領域、5は突起をそれぞれ示している。
【0024】
本発明に係るマイクロ化学デバイスは、合成樹脂製で作成された基板1の表面であって、堰リブ2で周囲を取り囲まれた薬液注入領域3内に被検体Sの保持領域4を設け、該保持領域4に複数の独立した突起5,…を繰返しパターンで一体形成し、接近した複数の前記突起5,…が連係して被検体Sを1個のみ保持できる単位保持部Hを形成するとともに、各突起5,5の間を薬液の流路6とし、前記堰リブ2の高さを前記突起5の高さ以上に設定したものである。ここで、前記堰リブ2で形成された薬液注入領域3は、保持領域4を取り囲む円形領域7と、該円形領域7から前記基板1の長手方向に膨出した液溜領域8,8とからなっている。
【0025】
そして、前記堰リブ2は、その長手方向に沿って間歇的に高さの低い凹段部9,…を形成し、該凹段部9の高さを前記突起5の高さ以上に設定し、該凹段部9を通して溢れた薬液を薬液注入領域3外に排出するようにしている。また、前記単位保持部Hの平面投影形状の大きさが、前記被検体Sの最大寸法の1.0〜1.5倍であり、隣接する突起5,5間の間隔が前記被検体Sの最小寸法よりも小さく設定している。例えば、前記被検体Sがリンパ球である場合、該リンパ球の図4に示した突起5は、底面の縦横寸法が10μm、高さが13μm、傾斜角(抜き勾配)が6.5°である。また、前記堰リブ2の高さは100μm、凹段部9の高さは50μmである。
【0026】
また、前記単位保持部Hを構成する突起5の数が2〜4個の内の何れかであることが好ましい。図4及び図5で示した本実施形態のものは、正方形の角部に位置する4個の突起5,…で単位保持部Hを構成している。
【0027】
本発明のマイクロ化学デバイスの材料としては、適切な成形性や目的とする用途から基体に対して求められる特性(例えば、透明性や耐熱性など)を満たしていれば、任意の合成樹脂を選択できる。例えば、ポリメチルメタクリレート等のポリメタクリル酸エステル、ポリカーボネート、ポリスチレン、ABS、ポリエチレンテレフタレートやポリブチレンテレフタレート等の芳香族ポリエステル、ポリプロピレンやポリシクロオレフィン等の各種ポリオレフィン、ポリスルホン、ポリエーテルスルホン、ポリフェニレンサルファイド、ポリ乳酸やポリパーフロロアルコキシ樹脂といった熱可塑性合成樹脂のほか、ポリジメチルシロキサン等の熱硬化性の合成樹脂やポリテトラフロロエチレンなども用いることができる。これらの合成樹脂は単独で使用しても良いし、必要に応じて2種以上混合して使用することも可能である。
【0028】
そして、前記突起5の先端面5Aの水滴接触角は、その他の保持領域4表面の水滴接触角より大きく、それらの水滴接触角の差が20〜40度になるようにしている。ここで、水滴接触角を調整するには、表面の親水化度合いを調整するが、プラズマ処理やゾルゲル法等の溶液処理を使用する場合は、部分的に処理するためにマスキングが必要になるので、不可能ではないがコスト高となるため、本実施形態では成形金型の表面粗度を調整して行っている。
【0029】
ここで、成形金型の表面粗度と成形品の水滴接触角との関係を図6に基づき説明する。図6は、射出成形に用いる金型の溶融樹脂が充填される壁面の表面状態を変化させて、ポリスチレンの表面粗度(Ra)を0.01μmから0.2μmの範囲で変化させた場合の水滴接触角(°)の関係を示し、表面粗度が粗くなるほど水滴接触角が大きくなる(疎水化)傾向を示している。一方、図7に示すように、表面粗さ0.2μmのポリスチレン成形品の表面を、サンドブラスト処理によって表面粗度を変化させても、表面粗度によって水滴接触角が異なる結果が得られた。
【0030】
これらの結果は、成形品の表面粗度を変化させると水滴接触角が変化するという一例であり、表面粗度に対して水滴接触角が一義的に決まるものではないが、試行錯誤を繰り返して最適な成形条件を決定する。
【0031】
このように本発明では、成形品の各箇所で表面粗度を変えることで水滴接触角に変化を付けるが、この変化は、大きいほど細胞捕集の効率が良いというものではない。本発明に係るようなマイクロ化学デバイスでは、突起5が数十μmから数μmの微細形状を有し、突起5,5間が流路6で連続し、単位保持部Hの領域の広さが30μmφ以下、好ましいくは5〜15μmφの大きさであり、この単位保持部Hに細胞を保持することを目的とした場合、表面粗度を変えることによる水滴接触角の差は、40度、好ましくは30度、更に好ましくは20度程度が良い。水滴接触角の差が大き過ぎると、即ちデバイス最表面(突起5の先端面5A)が疎水性のため、細胞が保持され難くなる傾向がある。
【0032】
本発明に係るマイクロ化学デバイスを用いて被検体Sの生理学的特性を解析する場合の手法として蛍光反応を用いる場合がある。一般的に500nm前後の励起波長の光を合成樹脂製デバイスに照射すると、デバイスから蛍光を発生する。この蛍光発生のため測定感度が低下する。そこで、前記基板1を成形する合成樹脂材料に、カーボンブラック、グラファイト、等のカーボンあるいは黒鉛の粉末を0.05〜2重量%配合した材料を用いる。射出成形の場合は、射出成形機を用いて金型内に、配合した材料の溶融樹脂を充填させてデバイスを製作することになる。
【0033】
このように、前記基板1を黒色とした場合、デバイス自体から蛍光が発生してもそれを吸収して外部へ出るのを防止するので、発色を利用した解析に供すると、測定感度が高くなる。尚、射出成形の他にホットエンボスによって所望パターンの微細構造を転写することも可能であり、この場合は、一旦配合した材料でシートを製作することになる。ここで、シートを作成する方法は、射出成形、圧縮成形等の成形手法は問わない。
【0034】
また、マイクロ化学デバイスの解析手法によってはデバイスを白色系にした方が、反応後の発色が良く判る場合がある。特に、顕微鏡レベルの光学感度を有する装置やCCDを用いた装置で解析する場合、デバイスを白色化した方が良い場合がある。このような場合は、一般的に用いられる白色系の添加剤、例えば炭酸カルシウム、炭酸マグネシウム、タルク、カオリン、硫酸バリウム、シリカ等を用いる。白色を強調したい場合は酸化チタンを用いる。添加剤の配合量は、多くなるにつれて溶融樹脂の粘度が高くなるため、ベース樹脂に対して、0.001〜2重量%、好ましいくは0.01〜1重量%、更に好ましくは0.05〜0.5重量%の範囲で添加するのが良い。また、添加剤は、チタン系カップリング剤及びシラン系カップリング剤と称される表面処理剤を用いて表面処理をしても良い。
【0035】
このように、前記基板1を白色とした場合、デバイスの反射率が高くなるので、発色を利用した解析に供すると、測定感度が高くなる。
【0036】
また、本発明に係るマイクロ化学デバイスは、前記基板1を合成樹脂で射出成形するとともに、該基板1の裏面に反りを防止するための補強リブ(図示しない)を一体形成することもある。
【0037】
本発明に係るマイクロ化学デバイスを合成樹脂で射出成形して製作する場合、成形したデバイスの反りが問題となる場合がある。そこで、前記基板1の反りを低減させる目的で、該基板1の裏面の長手方向に延びた補強リブ(図示しない)を一体形成することが好ましい。前記補強リブは凸リブや凹リブであっても良く、凸リブと凹リブの両リブを併用しても良いし、どちらか一方のみでも良い。更に、補強リブの形状に関しては、デバイスのパターン面に影響を与えない限り、どのような形状でも構わない。
【0038】
図8及び図9は、前記単位保持部Hを構成する突起5の他の実施形態を示している。図8は、3個の突起5,…で単位保持部Hが構成された実施形態を示し、該突起5,…で囲まれる空間に被検体Sを保持できるようにしたものである。この場合、突起5の中心を結ぶ最小の三角形が繰返しパターンとなる。また、図9は、2個の突起5,5で単位保持部Hが構成された実施形態を示し、該突起5は上下又は左右に被検体Sの一部を受け入れる凹部を形成した形状を有し、該突起5,5の間の空間に被検体Sを保持できるようにしたものである。この場合、2個の突起5,5の中心線を含む最小の四角形が繰返しパターンとなる。何れの場合も、隣接する突起5,5の間は流路6が形成されている。
【0039】
本実施形態の前記突起5は、射出成形時の抜き勾配を考慮して角錐台や円錐台等の縦断面が台形状である先細形状となっている。本実施形態では、前記突起5の側面の傾斜角度角は6.5°としていることは既に述べたが、この傾斜角度は成形性と被検体Sの保持性の両方を考慮して決定される。前記単位保持部Hの大きさについても、前記被検体Sが球形の場合には、前記突起5の中間高さにおける水平切断面において、前記被検体Sの最大寸法の1.0〜1.5倍とし、隣接する突起5,5間の間隔が前記被検体Sの最小寸法よりも小さく設定することがより好ましい。
【0040】
次に、射出成形するための金型製作の手順を以下に簡単に説明する。本発明では、前記保持領域4における突起5,…の微細パターンや堰リブ2を成形するとともに、突起5の先端面5Aの水滴接触角を調整するために金型表面を部分的に粗面化処理を行う必要があるため、シンクロトロン放射光を使った一連のLIGA(Lithographie Galvanoformung Abformung)プロセスで精密成形金型を作製する。それには、先ず、アクリル樹脂基板を用いてLIGAプロセスで雛形基板(前記基板1と同一形状)を作製し、この雛形基板からニッケル電鋳入子を作製し、それからアクリル樹脂等を原料として射出成形にて前記基板1を一体成形する。尚、基板1は、射出成形の他にプレス成形で同一形状品を大量に製造することも可能である。
【0041】
ここで、LIGAプロセスによって前記雛形基板を作製する方法を簡単に説明する。先ず、前記突起と同じパターンのX線透過部以外の部分をX線吸収部としたマスクや、前記堰リブ2のパターンと、前記凹段部9のパターンのX線透過部以外の部分をX線吸収部としたマスクを用意する。ここで、前記X線吸収部は、X線透過板にAuめっきしてパターン形成する。アクリル樹脂基板の表面から垂直にX線を照射して部分的に露光する。露光時間に比例して除去する深さが決定されるので、前述の複数のマスクを組み合わせて多重露光する。アクリル樹脂基板の露光された部分は変質するので、現像処理にて変質部を除去して所望の形状を得るのである。また、マスクを所定の移動量だけ平行移動させて露光することにより、深さ方向で露光時間を調節できるので、前記突起5の側面に傾斜を形成することができる。このように、マスクを移動させて露光する方法をムービングマスク(Moving Mask)法という。
【0042】
最後に、本発明のマイクロ化学デバイスの使用例を簡単に説明する。1つのマイクロ化学デバイスが有する単位保持部Hの数は、特に制限はないが、抗原特異的リンパ球の頻度が105個に1個から多い場合には約500個であるという観点から、1cm2当たり、例えば、2,000〜1,000,000個の範囲であることが好ましい。本発明のマイクロ化学デバイスは、各単位保持部Hに被検体リンパ球を1個のみ保持することで、抗原特異的リンパ球を1個1個の細胞レベルで特定することが可能になる。
【0043】
その結果、検出された抗原特異的リンパ球を取り出して、抗原特異的抗体遺伝子やT細胞受容体遺伝子をクローニングすることが可能になる。例えば、抗原特異的抗体遺伝子がクローニングできると、それを用いて大量にヒト型モノクローナル抗体を生産することができる。この抗体を感染症などの患者へ投与することにより、感染症などの治療、予防に用いることができると考えられる。但し、同一の単位保持部Hには、リンパ球以外の細胞が被検体リンパ球とともに含まれていても良い。リンパ球以外の細胞であれば、抗原に反応せず、検出されることもないからである。
【0044】
抗原特異的リンパ球の検出方法は以下に説明される。本発明のマイクロ化学デバイスの各単位保持部Hにリンパ球を保持した状態で、薬液注入領域3にピペットで抗原液を添加し、薬液注入領域3を抗原液で満たす。この抗原特異的リンパ球の検出方法により検出される抗原には、特に制限はないが、例えば、タンパク質、ペプチド、DNA、RNA、脂質、糖鎖、または有機高分子化合物(例えば、環境ホルモン)等がある。あるいは、細菌、ウィルス、自己抗原、がん抗原またはアレルゲン等もある。
【0045】
抗原に反応する細胞の検出は、例えば、(1)Caイオン依存性蛍光色素を用いて行う、(2)抗原により刺激され活性化した被検体リンパ球細胞の表面に発現する活性化マーカータンパク質を指標として行う、(3)被検体リンパ球細胞内蛍光物質が発する蛍光の偏光度を指標として行う、または(4)被検体リンパ球細胞の増殖または抗体産生を指標として行うことができる。
【0046】
より具体的には、例えば、Bリンパ球の抗原受容体(免疫グロブリン)に抗原が結合するとまず細胞内シグナル伝達が起こり、それに続いて細胞増殖、抗体産生が起こる。従って、細胞内シグナル伝達、細胞増殖、抗体産生を種々の方法により検知することにより、抗原に反応する細胞を検出することができる。あるいは、例えば、Tリンパ球の抗原受容体に抗原が結合するとまず細胞内シグナル伝達が起こり、それに続いて細胞増殖、サイトカイン産生が起こる。従って、細胞内シグナル伝達、細胞増殖、サイトカイン産生を種々の方法により検知することにより、抗原に反応する細胞を検出することができる。
【0047】
細胞内シグナル伝達を検出することによる、抗原に反応する細胞の検出は、例えば、細胞内Caイオンの濃度変化をCaイオン依存性の蛍光色素を用いることにより行うことができる。細胞内Caイオン濃度変化は、蛍光色素としてFura-2、Fluo-3あるいはFluo-4を用い、検出装置として蛍光顕微鏡あるいはマイクロアレイスキャナーを用いる。具体的には、Bリンパ球にCaイオン依存性蛍光色素であるFura-2あるいはFluo-3を導入する。次いで抗原でBリンパ球を刺激すると、Bリンパ球内Caイオン濃度が上昇する。その結果、CaイオンがCaイオン依存性蛍光色素に結合し、蛍光強度が増強される。Caイオン濃度が低いと青っぽい色、高いと赤っぽい色で示されている。この方法では、抗原で刺激されることにより細胞内Caイオンが上昇したBリンパ球(抗原特異的)を、マイクロ化学デバイスを用いて検出できる。
【0048】
以下に、蛍光色素を用いる方法を説明する。末梢血からリンパ球画分を分離後、Bリンパ球画分をさらに分離精製して得られる。次に、Fluo3/AM(2μM)溶液に細胞を懸濁させ、室温に30分置き、さらに緩衝液で細胞を洗浄し、細胞内に負荷されなかった色素を除去する。この細胞をマイクロ化学デバイスの単位保持部Hに1個ずつ入れる。それから、細胞の乾燥を防ぐため、薬液注入領域3を緩衝液で満たす。
【0049】
そして、先ず、未刺激の細胞の蛍光を測定する。その際の蛍光強度(A)を測定する。
次いで抗原溶液を薬液注入領域3に流し入れ緩衝液と交換し、抗原による刺激を受けた細胞の蛍光を測定する。刺激後1〜2分後の蛍光強度(B)を測定する。刺激前後の蛍光強度比(B/A)の高いウェルの細胞を選別する。抗原刺激により反応した細胞を、未刺激の細胞の蛍光強度と抗原による刺激を受けた細胞の蛍光強度の比(B/A)により選別し、取り出すことで、抗原特異的リンパ球を回収することができる。
【図面の簡単な説明】
【0050】
【図1】本発明に係るマイクロ化学デバイスの平面図である。
【図2】同じくマイクロ化学デバイスの斜視図である。
【図3】同じくマイクロ化学デバイスの部分拡大斜視図である。
【図4】多数の突起からなる保持領域の部分拡大平面図である。
【図5】同じく部分拡大斜視図である。
【図6】金型の接触面の表面粗さを変化させた場合におけるポリスチレン成形品表面の水滴接触角の変化を示すグラフである。
【図7】表面粗さが0.2μmの成形品表面をサンドブラスト処理し、ポリスチレン成形品表面の表面粗さを変化させた場合における成形品表面の水滴接触角の変化を示すグラフである。
【図8】3個の突起から構成された単位保持部の実施形態を示す部分拡大平面図である。
【図9】2個の突起から構成された単位保持部の実施形態を示す部分拡大平面図である。
【符号の説明】
【0051】
1 基板
2 堰リブ
3 薬液注入領域
4 保持領域
5 突起
5A 先端面
6 流路
7 円形領域
8 液溜領域
9 凹段部
H 単位保持部
S 被検体
【技術分野】
【0001】
本発明は、複数の被検体を同時に検査することが可能なマイクロ化学デバイスに係り、更に詳しくはリンパ球等の細胞を個々に保持し、各細胞に試薬や反応液等の薬液を作用させることが可能なマイクロ化学デバイスに関する。
【背景技術】
【0002】
特許文献1に示されているように、基板に細胞1個の大きさより少し大きな凹部(ウェル)を多数設けたマイクロ化学デバイスを使用し、細胞1個を1個のウェル内に挿入し、試薬、反応液等の薬液をウェル内に注入して細胞を検査する方法が提案されている。このマイクロ化学デバイスを使用する検査方法は、複雑な装置は必要とせず、細胞の分取の時間は短時間であり、抗原が結合することも確認できる。特に、頻度の低い抗原特異的リンパ球(0.001%以上)も検出でき、抗原が結合したリンパ球が抗原に反応するかを解析することができ、しかも抗原特異的リンパ球を分取できる抗原特異的リンパ球検出法を提供することができる。
【0003】
また、特許文献1には、1個のウェルに1つのリンパ球が格納されるようにするためには、例えば、ウェルの平面形状に内接する最大円の直径が、ウェルに格納しようとするリンパ球の直径の1〜2倍の範囲、より好ましくは1.2〜1.8倍の範囲であることが適当であることが開示されている。そして、ウェルの深さも、該ウェルに格納しようとするリンパ球の直径の1〜2倍の範囲、より好ましくは1.2〜1.8倍の範囲であることが適当であることが開示されている。ウェルの寸法は、ウェルに格納しようとするリンパ球の直径に応じて好適な比を考慮して適宜決定するが、ウェルが円筒形でリンパ球がBリンパ球の場合、直径は5〜15μmであり、深さは5〜40μmである。そして、基板に設けるウェルの数は、特に制限はないが、抗原特異的リンパ球の頻度が105個に1個から多い場合には約500個であるという観点から、1cm2当たり、例えば、2,000〜1,000,000個の範囲である。
【0004】
このような基板に多数のマイクロウェルを形成したマイクロ化学デバイスは、合成樹脂製で射出成形して製造するが、合成樹脂製のマイクロ化学デバイスでは、ガラス製のデバイスと比べて疎水性が高いため、数十μmから数μmの大きさの細胞をウェル内に挿入するのは困難である。そこで、細胞をウェルに挿入する前に、デバイス表面を親水化処理する。親水化処理としてプラズマ処理があるが、親水化はできるものの、所望の親水化状態にさせることが困難であるばかりか、プラズマ処理後から時間が経つにつれて親水化状態が悪くなる。また、溶液に浸漬して親水化、例えばゾルゲル処理する方法もあるが、ウェルが数十μm程度と微細な場合は均一に処理できないばかりか、処理溶液の除去作業が困難となる。
【0005】
従来のマイクロ化学デバイスでは、1ウェル内に1個の細胞を入れる大きさは確保されているものの、ウェルを含むデバイス全体の親水化レベルが一定であるため、ウェル内への細胞の捕集率が悪い。また、試薬、反応液等の薬液をウェル内に入れて、その入れた薬液を他の薬液と置換させる場合もウェルが1個ずつ独立しているので、薬液の交換率が悪い。また、蛍光試薬を用いた解析ではデバイス自体から蛍光が発生したり、蛍光反応を効率良くデバイスが反射しないため、測定感度が悪いといった問題があった。
【特許文献1】特許第3723882号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、本発明が前述の状況に鑑み、解決しようとするところは、リンパ球やその他の細胞等からなる多数の被検体を、1個1個独立して容易に保持することができるとともに、保持された各被検体に対して試薬、反応液等の薬液を供給して所望の検査を確実に実施でき、また薬液の交換も容易であるマイクロ化学デバイスを提供する点にある。
【課題を解決するための手段】
【0007】
前述の課題解決のために、本発明は、合成樹脂製で作成された基板の表面であって、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、該保持領域に複数の独立した突起を繰返しパターンで一体形成し、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成するとともに、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定してなることを特徴とするマイクロ化学デバイスを提供する(請求項1)。
【0008】
ここで、前記単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定した(請求項2)。
【0009】
また、前記単位保持部を構成する突起の数が2〜4個の内の何れかである(請求項3)。
【0010】
そして、前記突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度であることが好ましい(請求項4)。
【0011】
更に、前記堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなることも好ましい(請求項5)。
【0012】
また、前記堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなることも好ましい(請求項6)。
【0013】
そして、前記基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなることも好ましい(請求項7)。更に、前記基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色として発色を利用した解析に供してなることも好ましい(請求項8)。あるいは、前記基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色として発色を利用した解析に供してなることも好ましい(請求項9)。
【発明の効果】
【0014】
以上にしてなる本願請求項1に係る発明のマイクロ化学デバイスによれば、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成したので、リンパ球やその他の細胞等からなる多数の被検体を、1個1個独立して容易に保持することができ、数十μmから数μmの細胞の捕集率が高くなる。また、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定したので、保持された各被検体に対して試薬、反応液等の薬液の供給が容易であるとともに、薬液を被検体に供給して所望の検査を確実に実施でき、また薬液の交換も容易である。
【0015】
請求項2によれば、単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定したので、各単位保持部に被検体を1個1個確実に保持することができる。
【0016】
請求項3によれば、単位保持部を構成する突起の数が2個であると、最小の個数の突起で被検体を保持することができ、また突起の密度が低くなるので、成形金型の製作に対する微細化要求が緩和される。また、単位保持部を構成する突起の数が4個であると、被検体の寸法にバラツキが大きくても確実に1個1個ずつ保持することができるとともに、突起の繰返しパターンが単純化され、成形金型の作成が容易になる。また、単位保持部を構成する突起の数が3個であると、前述の両者の中間的な効果を奏するのである。
【0017】
請求項4によれば、突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度であると、単位保持部に被検体を1個ずつ注入する作業が簡単になるとともに、不要な液体の除去作業が簡単になる。
【0018】
請求項5によれば、堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなるので、薬液注入領域内に常に一定量の薬液を注入することができ、また薬液注入領域内に薬液を注入すると、自動的に単位保持部に保持された被検体に薬液を供給することができる。
【0019】
請求項6によれば、堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなるので、液溜領域から薬液を注入すれば円形領域に設けた保持領域に薬液を緩やかに流動させて供給することができるので、薬液の注入時に単位保持部に保持された被検体が薬液の流れで飛び出すことがないのである。
【0020】
請求項7によれば、基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなることで、成形時の基板の反りを防止でき、基板表面を平らにすることができる。
【0021】
請求項8によれば、基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色とすれば、デバイスの反射率が高くなり、発色を利用した解析に供すると測定感度が高くなる。
【0022】
請求項9によれば、基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色とすれば、デバイス自体からの蛍光の発生が少なくなり、発色を利用した解析に供すると測定感度が高くなる。
【発明を実施するための最良の形態】
【0023】
次に、本発明に係るマイクロ化学デバイスの実施形態を図1〜図5に基づいて詳細に説明する。図1は、マイクロ化学デバイスの平面図、図2はその斜視図、図3は部分拡大斜視図、図4及び図5は突起の拡大図であり、図中符号1は基板、2は堰リブ、3は薬液注入領域、4は保持領域、5は突起をそれぞれ示している。
【0024】
本発明に係るマイクロ化学デバイスは、合成樹脂製で作成された基板1の表面であって、堰リブ2で周囲を取り囲まれた薬液注入領域3内に被検体Sの保持領域4を設け、該保持領域4に複数の独立した突起5,…を繰返しパターンで一体形成し、接近した複数の前記突起5,…が連係して被検体Sを1個のみ保持できる単位保持部Hを形成するとともに、各突起5,5の間を薬液の流路6とし、前記堰リブ2の高さを前記突起5の高さ以上に設定したものである。ここで、前記堰リブ2で形成された薬液注入領域3は、保持領域4を取り囲む円形領域7と、該円形領域7から前記基板1の長手方向に膨出した液溜領域8,8とからなっている。
【0025】
そして、前記堰リブ2は、その長手方向に沿って間歇的に高さの低い凹段部9,…を形成し、該凹段部9の高さを前記突起5の高さ以上に設定し、該凹段部9を通して溢れた薬液を薬液注入領域3外に排出するようにしている。また、前記単位保持部Hの平面投影形状の大きさが、前記被検体Sの最大寸法の1.0〜1.5倍であり、隣接する突起5,5間の間隔が前記被検体Sの最小寸法よりも小さく設定している。例えば、前記被検体Sがリンパ球である場合、該リンパ球の図4に示した突起5は、底面の縦横寸法が10μm、高さが13μm、傾斜角(抜き勾配)が6.5°である。また、前記堰リブ2の高さは100μm、凹段部9の高さは50μmである。
【0026】
また、前記単位保持部Hを構成する突起5の数が2〜4個の内の何れかであることが好ましい。図4及び図5で示した本実施形態のものは、正方形の角部に位置する4個の突起5,…で単位保持部Hを構成している。
【0027】
本発明のマイクロ化学デバイスの材料としては、適切な成形性や目的とする用途から基体に対して求められる特性(例えば、透明性や耐熱性など)を満たしていれば、任意の合成樹脂を選択できる。例えば、ポリメチルメタクリレート等のポリメタクリル酸エステル、ポリカーボネート、ポリスチレン、ABS、ポリエチレンテレフタレートやポリブチレンテレフタレート等の芳香族ポリエステル、ポリプロピレンやポリシクロオレフィン等の各種ポリオレフィン、ポリスルホン、ポリエーテルスルホン、ポリフェニレンサルファイド、ポリ乳酸やポリパーフロロアルコキシ樹脂といった熱可塑性合成樹脂のほか、ポリジメチルシロキサン等の熱硬化性の合成樹脂やポリテトラフロロエチレンなども用いることができる。これらの合成樹脂は単独で使用しても良いし、必要に応じて2種以上混合して使用することも可能である。
【0028】
そして、前記突起5の先端面5Aの水滴接触角は、その他の保持領域4表面の水滴接触角より大きく、それらの水滴接触角の差が20〜40度になるようにしている。ここで、水滴接触角を調整するには、表面の親水化度合いを調整するが、プラズマ処理やゾルゲル法等の溶液処理を使用する場合は、部分的に処理するためにマスキングが必要になるので、不可能ではないがコスト高となるため、本実施形態では成形金型の表面粗度を調整して行っている。
【0029】
ここで、成形金型の表面粗度と成形品の水滴接触角との関係を図6に基づき説明する。図6は、射出成形に用いる金型の溶融樹脂が充填される壁面の表面状態を変化させて、ポリスチレンの表面粗度(Ra)を0.01μmから0.2μmの範囲で変化させた場合の水滴接触角(°)の関係を示し、表面粗度が粗くなるほど水滴接触角が大きくなる(疎水化)傾向を示している。一方、図7に示すように、表面粗さ0.2μmのポリスチレン成形品の表面を、サンドブラスト処理によって表面粗度を変化させても、表面粗度によって水滴接触角が異なる結果が得られた。
【0030】
これらの結果は、成形品の表面粗度を変化させると水滴接触角が変化するという一例であり、表面粗度に対して水滴接触角が一義的に決まるものではないが、試行錯誤を繰り返して最適な成形条件を決定する。
【0031】
このように本発明では、成形品の各箇所で表面粗度を変えることで水滴接触角に変化を付けるが、この変化は、大きいほど細胞捕集の効率が良いというものではない。本発明に係るようなマイクロ化学デバイスでは、突起5が数十μmから数μmの微細形状を有し、突起5,5間が流路6で連続し、単位保持部Hの領域の広さが30μmφ以下、好ましいくは5〜15μmφの大きさであり、この単位保持部Hに細胞を保持することを目的とした場合、表面粗度を変えることによる水滴接触角の差は、40度、好ましくは30度、更に好ましくは20度程度が良い。水滴接触角の差が大き過ぎると、即ちデバイス最表面(突起5の先端面5A)が疎水性のため、細胞が保持され難くなる傾向がある。
【0032】
本発明に係るマイクロ化学デバイスを用いて被検体Sの生理学的特性を解析する場合の手法として蛍光反応を用いる場合がある。一般的に500nm前後の励起波長の光を合成樹脂製デバイスに照射すると、デバイスから蛍光を発生する。この蛍光発生のため測定感度が低下する。そこで、前記基板1を成形する合成樹脂材料に、カーボンブラック、グラファイト、等のカーボンあるいは黒鉛の粉末を0.05〜2重量%配合した材料を用いる。射出成形の場合は、射出成形機を用いて金型内に、配合した材料の溶融樹脂を充填させてデバイスを製作することになる。
【0033】
このように、前記基板1を黒色とした場合、デバイス自体から蛍光が発生してもそれを吸収して外部へ出るのを防止するので、発色を利用した解析に供すると、測定感度が高くなる。尚、射出成形の他にホットエンボスによって所望パターンの微細構造を転写することも可能であり、この場合は、一旦配合した材料でシートを製作することになる。ここで、シートを作成する方法は、射出成形、圧縮成形等の成形手法は問わない。
【0034】
また、マイクロ化学デバイスの解析手法によってはデバイスを白色系にした方が、反応後の発色が良く判る場合がある。特に、顕微鏡レベルの光学感度を有する装置やCCDを用いた装置で解析する場合、デバイスを白色化した方が良い場合がある。このような場合は、一般的に用いられる白色系の添加剤、例えば炭酸カルシウム、炭酸マグネシウム、タルク、カオリン、硫酸バリウム、シリカ等を用いる。白色を強調したい場合は酸化チタンを用いる。添加剤の配合量は、多くなるにつれて溶融樹脂の粘度が高くなるため、ベース樹脂に対して、0.001〜2重量%、好ましいくは0.01〜1重量%、更に好ましくは0.05〜0.5重量%の範囲で添加するのが良い。また、添加剤は、チタン系カップリング剤及びシラン系カップリング剤と称される表面処理剤を用いて表面処理をしても良い。
【0035】
このように、前記基板1を白色とした場合、デバイスの反射率が高くなるので、発色を利用した解析に供すると、測定感度が高くなる。
【0036】
また、本発明に係るマイクロ化学デバイスは、前記基板1を合成樹脂で射出成形するとともに、該基板1の裏面に反りを防止するための補強リブ(図示しない)を一体形成することもある。
【0037】
本発明に係るマイクロ化学デバイスを合成樹脂で射出成形して製作する場合、成形したデバイスの反りが問題となる場合がある。そこで、前記基板1の反りを低減させる目的で、該基板1の裏面の長手方向に延びた補強リブ(図示しない)を一体形成することが好ましい。前記補強リブは凸リブや凹リブであっても良く、凸リブと凹リブの両リブを併用しても良いし、どちらか一方のみでも良い。更に、補強リブの形状に関しては、デバイスのパターン面に影響を与えない限り、どのような形状でも構わない。
【0038】
図8及び図9は、前記単位保持部Hを構成する突起5の他の実施形態を示している。図8は、3個の突起5,…で単位保持部Hが構成された実施形態を示し、該突起5,…で囲まれる空間に被検体Sを保持できるようにしたものである。この場合、突起5の中心を結ぶ最小の三角形が繰返しパターンとなる。また、図9は、2個の突起5,5で単位保持部Hが構成された実施形態を示し、該突起5は上下又は左右に被検体Sの一部を受け入れる凹部を形成した形状を有し、該突起5,5の間の空間に被検体Sを保持できるようにしたものである。この場合、2個の突起5,5の中心線を含む最小の四角形が繰返しパターンとなる。何れの場合も、隣接する突起5,5の間は流路6が形成されている。
【0039】
本実施形態の前記突起5は、射出成形時の抜き勾配を考慮して角錐台や円錐台等の縦断面が台形状である先細形状となっている。本実施形態では、前記突起5の側面の傾斜角度角は6.5°としていることは既に述べたが、この傾斜角度は成形性と被検体Sの保持性の両方を考慮して決定される。前記単位保持部Hの大きさについても、前記被検体Sが球形の場合には、前記突起5の中間高さにおける水平切断面において、前記被検体Sの最大寸法の1.0〜1.5倍とし、隣接する突起5,5間の間隔が前記被検体Sの最小寸法よりも小さく設定することがより好ましい。
【0040】
次に、射出成形するための金型製作の手順を以下に簡単に説明する。本発明では、前記保持領域4における突起5,…の微細パターンや堰リブ2を成形するとともに、突起5の先端面5Aの水滴接触角を調整するために金型表面を部分的に粗面化処理を行う必要があるため、シンクロトロン放射光を使った一連のLIGA(Lithographie Galvanoformung Abformung)プロセスで精密成形金型を作製する。それには、先ず、アクリル樹脂基板を用いてLIGAプロセスで雛形基板(前記基板1と同一形状)を作製し、この雛形基板からニッケル電鋳入子を作製し、それからアクリル樹脂等を原料として射出成形にて前記基板1を一体成形する。尚、基板1は、射出成形の他にプレス成形で同一形状品を大量に製造することも可能である。
【0041】
ここで、LIGAプロセスによって前記雛形基板を作製する方法を簡単に説明する。先ず、前記突起と同じパターンのX線透過部以外の部分をX線吸収部としたマスクや、前記堰リブ2のパターンと、前記凹段部9のパターンのX線透過部以外の部分をX線吸収部としたマスクを用意する。ここで、前記X線吸収部は、X線透過板にAuめっきしてパターン形成する。アクリル樹脂基板の表面から垂直にX線を照射して部分的に露光する。露光時間に比例して除去する深さが決定されるので、前述の複数のマスクを組み合わせて多重露光する。アクリル樹脂基板の露光された部分は変質するので、現像処理にて変質部を除去して所望の形状を得るのである。また、マスクを所定の移動量だけ平行移動させて露光することにより、深さ方向で露光時間を調節できるので、前記突起5の側面に傾斜を形成することができる。このように、マスクを移動させて露光する方法をムービングマスク(Moving Mask)法という。
【0042】
最後に、本発明のマイクロ化学デバイスの使用例を簡単に説明する。1つのマイクロ化学デバイスが有する単位保持部Hの数は、特に制限はないが、抗原特異的リンパ球の頻度が105個に1個から多い場合には約500個であるという観点から、1cm2当たり、例えば、2,000〜1,000,000個の範囲であることが好ましい。本発明のマイクロ化学デバイスは、各単位保持部Hに被検体リンパ球を1個のみ保持することで、抗原特異的リンパ球を1個1個の細胞レベルで特定することが可能になる。
【0043】
その結果、検出された抗原特異的リンパ球を取り出して、抗原特異的抗体遺伝子やT細胞受容体遺伝子をクローニングすることが可能になる。例えば、抗原特異的抗体遺伝子がクローニングできると、それを用いて大量にヒト型モノクローナル抗体を生産することができる。この抗体を感染症などの患者へ投与することにより、感染症などの治療、予防に用いることができると考えられる。但し、同一の単位保持部Hには、リンパ球以外の細胞が被検体リンパ球とともに含まれていても良い。リンパ球以外の細胞であれば、抗原に反応せず、検出されることもないからである。
【0044】
抗原特異的リンパ球の検出方法は以下に説明される。本発明のマイクロ化学デバイスの各単位保持部Hにリンパ球を保持した状態で、薬液注入領域3にピペットで抗原液を添加し、薬液注入領域3を抗原液で満たす。この抗原特異的リンパ球の検出方法により検出される抗原には、特に制限はないが、例えば、タンパク質、ペプチド、DNA、RNA、脂質、糖鎖、または有機高分子化合物(例えば、環境ホルモン)等がある。あるいは、細菌、ウィルス、自己抗原、がん抗原またはアレルゲン等もある。
【0045】
抗原に反応する細胞の検出は、例えば、(1)Caイオン依存性蛍光色素を用いて行う、(2)抗原により刺激され活性化した被検体リンパ球細胞の表面に発現する活性化マーカータンパク質を指標として行う、(3)被検体リンパ球細胞内蛍光物質が発する蛍光の偏光度を指標として行う、または(4)被検体リンパ球細胞の増殖または抗体産生を指標として行うことができる。
【0046】
より具体的には、例えば、Bリンパ球の抗原受容体(免疫グロブリン)に抗原が結合するとまず細胞内シグナル伝達が起こり、それに続いて細胞増殖、抗体産生が起こる。従って、細胞内シグナル伝達、細胞増殖、抗体産生を種々の方法により検知することにより、抗原に反応する細胞を検出することができる。あるいは、例えば、Tリンパ球の抗原受容体に抗原が結合するとまず細胞内シグナル伝達が起こり、それに続いて細胞増殖、サイトカイン産生が起こる。従って、細胞内シグナル伝達、細胞増殖、サイトカイン産生を種々の方法により検知することにより、抗原に反応する細胞を検出することができる。
【0047】
細胞内シグナル伝達を検出することによる、抗原に反応する細胞の検出は、例えば、細胞内Caイオンの濃度変化をCaイオン依存性の蛍光色素を用いることにより行うことができる。細胞内Caイオン濃度変化は、蛍光色素としてFura-2、Fluo-3あるいはFluo-4を用い、検出装置として蛍光顕微鏡あるいはマイクロアレイスキャナーを用いる。具体的には、Bリンパ球にCaイオン依存性蛍光色素であるFura-2あるいはFluo-3を導入する。次いで抗原でBリンパ球を刺激すると、Bリンパ球内Caイオン濃度が上昇する。その結果、CaイオンがCaイオン依存性蛍光色素に結合し、蛍光強度が増強される。Caイオン濃度が低いと青っぽい色、高いと赤っぽい色で示されている。この方法では、抗原で刺激されることにより細胞内Caイオンが上昇したBリンパ球(抗原特異的)を、マイクロ化学デバイスを用いて検出できる。
【0048】
以下に、蛍光色素を用いる方法を説明する。末梢血からリンパ球画分を分離後、Bリンパ球画分をさらに分離精製して得られる。次に、Fluo3/AM(2μM)溶液に細胞を懸濁させ、室温に30分置き、さらに緩衝液で細胞を洗浄し、細胞内に負荷されなかった色素を除去する。この細胞をマイクロ化学デバイスの単位保持部Hに1個ずつ入れる。それから、細胞の乾燥を防ぐため、薬液注入領域3を緩衝液で満たす。
【0049】
そして、先ず、未刺激の細胞の蛍光を測定する。その際の蛍光強度(A)を測定する。
次いで抗原溶液を薬液注入領域3に流し入れ緩衝液と交換し、抗原による刺激を受けた細胞の蛍光を測定する。刺激後1〜2分後の蛍光強度(B)を測定する。刺激前後の蛍光強度比(B/A)の高いウェルの細胞を選別する。抗原刺激により反応した細胞を、未刺激の細胞の蛍光強度と抗原による刺激を受けた細胞の蛍光強度の比(B/A)により選別し、取り出すことで、抗原特異的リンパ球を回収することができる。
【図面の簡単な説明】
【0050】
【図1】本発明に係るマイクロ化学デバイスの平面図である。
【図2】同じくマイクロ化学デバイスの斜視図である。
【図3】同じくマイクロ化学デバイスの部分拡大斜視図である。
【図4】多数の突起からなる保持領域の部分拡大平面図である。
【図5】同じく部分拡大斜視図である。
【図6】金型の接触面の表面粗さを変化させた場合におけるポリスチレン成形品表面の水滴接触角の変化を示すグラフである。
【図7】表面粗さが0.2μmの成形品表面をサンドブラスト処理し、ポリスチレン成形品表面の表面粗さを変化させた場合における成形品表面の水滴接触角の変化を示すグラフである。
【図8】3個の突起から構成された単位保持部の実施形態を示す部分拡大平面図である。
【図9】2個の突起から構成された単位保持部の実施形態を示す部分拡大平面図である。
【符号の説明】
【0051】
1 基板
2 堰リブ
3 薬液注入領域
4 保持領域
5 突起
5A 先端面
6 流路
7 円形領域
8 液溜領域
9 凹段部
H 単位保持部
S 被検体
【特許請求の範囲】
【請求項1】
合成樹脂製で作成された基板の表面であって、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、該保持領域に複数の独立した突起を繰返しパターンで一体形成し、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成するとともに、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定してなることを特徴とするマイクロ化学デバイス。
【請求項2】
前記単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定した請求項1記載のマイクロ化学デバイス。
【請求項3】
前記単位保持部を構成する突起の数が2〜4個の内の何れかである請求項1又は2記載のマイクロ化学デバイス。
【請求項4】
前記突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度である請求項1〜3何れか1項に記載のマイクロ化学デバイス。
【請求項5】
前記堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなる請求項1〜4何れかに記載のマイクロ化学デバイス。
【請求項6】
前記堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなる請求項1〜5何れかに記載のマイクロ化学デバイス。
【請求項7】
前記基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなる請求項1〜6何れかに記載のマイクロ化学デバイス。
【請求項8】
前記基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色として発色を利用した解析に供してなる請求項1〜7何れかに記載のマイクロ化学デバイス。
【請求項9】
前記基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色として発色を利用した解析に供してなる請求項1〜7何れかに記載のマイクロ化学デバイス。
【請求項1】
合成樹脂製で作成された基板の表面であって、堰リブで周囲を取り囲まれた薬液注入領域内に被検体の保持領域を設け、該保持領域に複数の独立した突起を繰返しパターンで一体形成し、接近した複数の前記突起が連係して被検体を1個のみ保持できる単位保持部を形成するとともに、各突起の間を薬液の流路とし、前記堰リブの高さを前記突起の高さ以上に設定してなることを特徴とするマイクロ化学デバイス。
【請求項2】
前記単位保持部の平面投影形状の大きさが、前記被検体の最大寸法の1.0〜1.5倍であり、隣接する突起間の間隔が前記被検体の最小寸法よりも小さく設定した請求項1記載のマイクロ化学デバイス。
【請求項3】
前記単位保持部を構成する突起の数が2〜4個の内の何れかである請求項1又は2記載のマイクロ化学デバイス。
【請求項4】
前記突起の先端面の水滴接触角は、その他の保持領域表面の水滴接触角より大きく、それらの水滴接触角の差は20〜40度である請求項1〜3何れか1項に記載のマイクロ化学デバイス。
【請求項5】
前記堰リブの長手方向に沿って間歇的に高さの低い凹段部を形成し、該凹段部の高さを前記突起の高さ以上に設定し、該凹段部を通して溢れた薬液を薬液注入領域外に排出してなる請求項1〜4何れかに記載のマイクロ化学デバイス。
【請求項6】
前記堰リブで形成された薬液注入領域は、保持領域を取り囲む円形領域と、該円形領域から前記基板の長手方向に膨出した液溜領域とからなる請求項1〜5何れかに記載のマイクロ化学デバイス。
【請求項7】
前記基板を合成樹脂で射出成形するとともに、該基板の裏面に反りを防止するための補強リブを一体形成してなる請求項1〜6何れかに記載のマイクロ化学デバイス。
【請求項8】
前記基板を成形する合成樹脂材料に、白色系の添加剤を配合し、基板を白色として発色を利用した解析に供してなる請求項1〜7何れかに記載のマイクロ化学デバイス。
【請求項9】
前記基板を成形する合成樹脂材料に、カーボンあるいは黒鉛の粉末を配合し、基板を黒色として発色を利用した解析に供してなる請求項1〜7何れかに記載のマイクロ化学デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2007−244319(P2007−244319A)
【公開日】平成19年9月27日(2007.9.27)
【国際特許分類】
【出願番号】特願2006−74322(P2006−74322)
【出願日】平成18年3月17日(2006.3.17)
【出願人】(000107619)スターライト工業株式会社 (62)
【Fターム(参考)】
【公開日】平成19年9月27日(2007.9.27)
【国際特許分類】
【出願日】平成18年3月17日(2006.3.17)
【出願人】(000107619)スターライト工業株式会社 (62)
【Fターム(参考)】
[ Back to top ]

