マイクロ流路チップ
【課題】マイクロ流路内の所定位置に担架した試薬を、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができ、更に、その後の反応処理や分析処理を同一位置で実施可能なため、マイクロ流路上の処理位置の削減により、小型化や、製造コストの低減を図ることができるマイクロ流路チップを提供すること。
【解決手段】マイクロ流路14内に試薬39を配置して被検査液を導入するマイクロ流路チップ1であって、試薬39が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、被検査液の導入時温度からの昇温により熱溶解性結合剤が担架されている所定位置で溶解を開始することで、溶解処理、混合処理を効率よく実施できる。
【解決手段】マイクロ流路14内に試薬39を配置して被検査液を導入するマイクロ流路チップ1であって、試薬39が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、被検査液の導入時温度からの昇温により熱溶解性結合剤が担架されている所定位置で溶解を開始することで、溶解処理、混合処理を効率よく実施できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乾燥試薬を予め流路内に担架して液体試薬を導入することにより溶解させるマイクロ流路チップに関する。
【背景技術】
【0002】
近年、微量の検体の分析や化学反応処理を安価に、且つ迅速に実現するシステムとして、マイクロ流路チップを使用する方法が提案されている。
【0003】
前記マイクロ流路チップはこのチップへ液体を供給して検査を実行する検査装置に適用される物である。この検査装置として例えば特許文献1に開示される生化学処理装置等があり、チャンバ(処理空間)とチャンバ間を連通するマイクロ流路とを有する生化学反応カートリッジ(マイクロ流路チップ)を載置するステージと、流路を介して液体を移動させるための移動手段と、チャンバ内の液体の有無或いは液量を検出する検出手段と、検出手段により検出されたチャンバ内の液体の情報により液体の移動の結果を判定する判定手段とを設けることにより、前記マイクロ流路内で予備処理した検体を前記チャンバ内に誘導して、チャンバ内の検査試薬と検体との化学反応又は生化学反応から、検体の分析を行う。
【0004】
前記マイクロ流路内での検体の予備処理とは、例えば、前記チャンバ内に保持した検査試薬と検体とが効率良く反応するように、検体に反応促進物質(試薬)を混合したり、あるいは検体中の特定成分を単離させたり溶解・増幅させるために検体に所定の反応物質を混合する処理である。
【0005】
そして、このような予備処理や分析用の反応処理を簡単に実施できるように、予め、チップ製造時に、予備処理や分析用の反応処理などに使う試薬を乾燥状態にしてマイクロ流路の内壁面の一部に担架させたマイクロ流路チップが提案されている(例えば、特許文献2,3参照)。このようなマイクロ流路チップにおいて、マイクロ流路の内壁面へ乾燥試薬を担架させる具体的方法としては、例えば、図8(a)に示すように、マイクロ流路51の途中にセル(処理空間)52を設けておき(図では効果的な混合を考えて流路を拡幅している。)、該セル52の内壁面に液状試薬53を点着させた後、該液状試薬53の水分を蒸発させることで、図8(b)に示すようにセルの内壁面に乾燥状態の試薬54が固着した状態を得るものが提案されている。
【0006】
このようなマイクロ流路チップでは、マイクロ流路に検体を流すと、マイクロ流路を流れる検体がマイクロ流路の一部に担架された乾燥試薬に接触して、検体に接触した乾燥試薬が検体中に溶出することで試薬と検体との混合が開始するため、少量の試薬により閉鎖空間で混合が進むので、検体分析作業が手軽に実施できるようになる。
【0007】
【特許文献1】特開2006−170654号公報
【特許文献2】特開2004−194652号公報
【特許文献3】特開2006−133003号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
ところが、上記のようにセル52の内壁面に液状試薬を点着させた後、その液状試薬中の水分を蒸発させて試薬54を担架させた場合は、担架させた試薬54とセル52の内壁面との間の接着強度が低く、検体をマイクロ流路51に流すと、検体がセル52に流入して担架されている試薬54に接触開始した時の衝撃等で、図8(c)に示すように乾燥試薬54が塊状のままセル52の内壁面から剥離し、セル52の外に流されてしまう。
【0009】
特許文献2の場合では、試薬固定位置が拡幅されている訳でもなく、液流が一方向と考えられ、図8(c)に示した場合と同様に、乾燥試薬の常温での溶解が早く、液流が来て直ぐに流れ方向に流れ出してしまう。また、特許文献3の場合では、試薬用のセルが流路に間接的に接続しており、試薬の溶解が遅れたり、あるいは溶解した試薬が検体の全域に均一に混合されずに、その後の反応処理や、分析処理の精度を低下させる虞があった。
【0010】
ここで、検体に溶解・混合させるべき試薬が、セルの内壁面から剥離して流されてしまうと、試薬が実際に液体に溶解・混合される位置が、当初に想定していたセル内の所定位置からずれてしまう。また、分析のために検体と試薬とを化学的又は生化学的に反応させる場合には、反応を促進するために、加熱等を加える必要があるが、試薬が均一に混合された状態になっていないと、反応にばらつきが生じたり、あるいは、反応が遅れるといった問題も生じてしまう。
【0011】
試薬が剥離して流動する場合でも、試薬の溶解・混合が所定の精度で完遂され、試薬が均一に混合された検体に対して化学反応処理又は生化学反応処理を実施できるように、試薬の溶解処理、混合処理、化学・生化学反応処理、検査処理等を、マイクロ流路上の互いに異なる位置で実施するようにする構成が一般である。
ところが、このように処理位置を分けると、チップ上に形成するマイクロ流路の全長が長大化したり、流路が複雑な分岐構造となり、処理手順も複雑となり、マイクロ流路チップの大型化や、製造コストの増大という問題も生じる。
【0012】
そこで、本発明の目的は上記課題を解消することに係り、被検査液に溶解・混合させるべくマイクロ流路内の所定位置に担架した試薬は、当初に想定した担架位置で、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができ、また、当初の担架位置でその後の反応処理や、分析処理を実施することができ、マイクロ流路上の処理位置の削減により、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、小型化や、製造コストの低減を図ることのできるマイクロ流路チップを提供することである。
【課題を解決するための手段】
【0013】
(1)本発明の上記課題の解決は、マイクロ流路内に試薬を担架して被検査液を導入するマイクロ流路チップであって、
前記試薬が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、
前記被検査液の導入時温度からの昇温により前記所定位置での前記試薬の溶解が促進されるマイクロ流路チップにより達成される。
【0014】
上記構成によれば、マイクロ流路内の所定位置に担架された試薬は、混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、流路壁面との間の接着強度を大幅に向上させることができる。そのため、マイクロ流路内に送給される被検査液の接触だけでは担架位置から剥離して流されることがない。
そして、被検査液が試薬の担架位置に導入された後の温度を規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解が促進され、試薬の溶解・混合も促進され、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬の担架位置を挟む一定区間に一定時間被検査液を滞留させたり、あるいは試薬の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0015】
更に、熱溶解性結合剤の溶解促進温度が、試薬と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。即ち、当初の試薬の担架位置またはその周辺だけで、溶解・混合・増幅処理に加えて、その後の反応処理や、分析処理を実施することができる。従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理範囲を削減することができ、これにより、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【0016】
(2)なお、好ましくは、上記(1)に記載のマイクロ流路チップにおいて、前記被検査液の昇温温度が35℃以上60℃以下である構成とすると良い。
このような構成にすると、被検査液の昇温温度設定により熱溶解性結合剤及び試薬の溶解促進開始のタイミングを管理できる同時に、例えば、試薬が血液中の標的核酸の増幅及び検出を目的として使用される乾燥プライマーである場合に、この乾燥プライマーの反応温度を維持して、反応促進を図ることもできる。
【0017】
(3)また、好ましくは、上記(1)又は(2)に記載のマイクロ流路チップにおいて、前記熱溶解性結合剤がゼラチンまたはヒドロキシプロピルセルロースである構成とすると良い。
このような構成にすると、ゼラチンやヒドロキシプロピルセルロースは、上記(2)を満足する熱溶解性を有すると同時に、付着性(接着性)も強いので、マイクロ流路上の所定位置への試薬の担架が容易になり、上記(2)の構成を容易に実現することができる。
【0018】
(4)また、好ましくは、上記(1)乃至(3)のいずれか一つに記載のマイクロ流路チップにおいて、前記熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下含まれている構成とすると良い。
マイクロ流路に担架する試薬に含まれる熱溶解性結合剤は、被検査液に溶解した際に、不純物となってしまう。従って、できるだけ熱溶解性結合剤の含有率を下げることが望ましいが、試薬を被検査液に均一に溶解・混合させるための所要時間や反応速度を最適に調整するためには、熱溶解性結合剤の含有率を高めることで試薬の溶解速度を抑えることが有効な場合が少なくない。このような観点から、上記のように、熱溶解性結合剤の含有率を規制しておけば、被検査液の組成や分析目的等に対応して、試薬の溶解性を柔軟に制御することができる。
【0019】
(5)また、好ましくは、上記(1)乃至(4)のいずれか一つに記載のマイクロ流路チップにおいて、前記試薬が核酸増幅反応を起こすものである構成とすると良い。
このような構成にすると、試薬の担架位置又はその周辺で、核酸増幅反応を効率よく実施できる。
【0020】
(6)また、好ましくは、上記(5)に記載のマイクロ流路チップにおいて、前記核酸増幅反応が等温で行われる構成とすると良い。
このような構成にすると、核酸増幅反応が等温増幅反応となり、使用する酵素の活性が一定に維持できるため核酸増幅反応が安定して進行し、反応処理の信頼性、処理精度を向上させると共に、所要時間を短縮することができる。
【0021】
(7)また、好ましくは、上記(1)又は(2)に記載のマイクロ流路チップにおいて、前記試薬が前記核酸増幅反応の起点となるプライマーである構成とすると良い。
このような構成にすると、試薬の担架位置での試薬の溶解促進開始が、核酸増幅反応の開始となるように制御することが可能となるため、反応時間の管理等が容易になり、核酸増幅反応を上手に制御・進行させることができる。
【発明の効果】
【0022】
本発明に係るマイクロ流路チップでは、マイクロ流路内の所定位置に担架された試薬は、混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、流路壁面との間の接着強度を大幅に向上させることができる。
そのため、マイクロ流路内に送給される被検査液の接触だけで担架位置から剥離して流されることがない。しかも、被検査液の温度が規定温度まで昇温されていないときには、熱溶解性結合剤の溶解が促進されないため、試薬の溶解も開始されない。換言すると、試薬の担架位置に導入される被検査液の温度を規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解促進が始まり、試薬の溶解・混合が始まり、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬の担架位置を挟む一定区間に一定時間被検査液を滞留させたり、あるいは試薬の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0023】
更に、熱溶解性結合剤の溶解促進温度が、試薬と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。即ち、当初の試薬の担架位置またはその周辺だけで、溶解・混合・増幅処理に加えて、その後の反応処理や、分析処理を実施することができる。従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理位置を削減することができ、これにより、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【発明を実施するための最良の形態】
【0024】
以下、本発明に係るマイクロ流路チップの好適な実施の形態について、図面を参照して詳細に説明する。
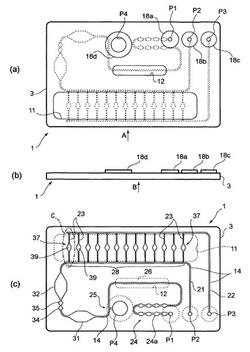
図1は本発明に係るマイクロ流路チップの一実施の形態の分解斜視図、図2は図1に示したマイクロ流路チップを構成する流路基板の構成の説明図で、図2(a)は前記流路基板の平面図、図2(b)は図2(a)のA矢視図、図2(c)は図2(b)のB矢視図、図3(a)は図2(c)に示したマイクロ流路のC部の拡大図、図3(b)は試薬を図3(a)のセルの内壁面に点着した状態の説明図、図3(c)は被検査液がセル内に流入した時の作用説明図である。
【0025】
図1及び図2に示したマイクロ流路チップ(以下、単に「チップ」とも称す。)1は、検査装置(図示せず)にセットされて使用され、一回の使用後に廃棄される。本実施の形態は、検体である血液(全血)がマイクロ流体チップ1に注入される。マイクロ流体チップ1は、検査装置にセットされることで、チップ外部からの物理的作用力によって検体液がハンドリングされ、例えば一塩基多型の複数ターゲット遺伝子が検査されるものであり、特開2005−160387号公報に示されているような、ターゲット配列の核酸を等温で特異的に増幅するための反応とその検出をチップ1上で実現可能とするものである。これにより、例えば、標的核酸を増幅してこれを検出することで、感染症の原因となる病原体に特異的な標的核酸の増幅及び検出が可能となり、検体中の該病原体の存否等が判定可能となる。
【0026】
本実施の形態において、物理的作用力は、液流路の始点と終点に設けたポート部PTからエア供給又はエア吸引することにより発生する空気圧作用力(空圧駆動力)である。したがって、液流路内に供給された液体が、液流路の始点と終点とに作用されるエア供給又はエア吸引により、液流路内の所望位置へ移動制御可能となる。この際、液体は、始点と先端部、後端部と終点との間に介在する気体に挟持された状態で保持され、引っ張り力の作用により途中で分断されることがない。
【0027】
なお、DNA増幅反応は、等温増幅反応により、使用する酵素の活性が一定に維持できる温度に保たれる。ここで、「等温」とは、酵素およびプライマーが実質的に機能し得るような、ほぼ一定の温度をいう。さらに、「ほぼ一定の温度」とは、酵素及びプライマーの実質的な機能を損なわない程度の温度変化であれば許容されることを意味する。
【0028】
また、マイクロ流体チップ1は熱可塑性の高分子ポリマーの射出成形により製作される。使用する高分子ポリマーは、特に限定されないが、光学的に透明であり、耐熱性が高く、化学的に安定であり、射出成形が容易なものが望ましく、COP、COC、PMMA等が好適である。光学的に透明とは、検出に用いる励起光や蛍光の波長において透過性が高く、散乱が小さく、自家蛍光が少ないことである。マイクロ流体チップ1は、蛍光を検出可能とする透光性を有していることで、検出試薬に例えばサイバーグリーンが用いられ、反応によって増幅された2本鎖DNAにインターカレートすることで発する蛍光が測定可能となる。これにより、ターゲットとする遺伝子配列の存在の有無が検出可能となる。
【0029】
図1及び図2(a)において、流路基板3は、その厚さ寸法t、幅寸法W、長さ寸法Lが、省スペースで持ち運び可能な適度の大きさに設定されている。そして、流路基板3の表面には、外部の加熱手段を装備するための凹みである掘り込み11,12と、後述するマイクロ流路14の一端に連通して設けられた検体投入用のポートP1と、マイクロ流路14に連通して設けられてマイクロ流路14内における検体の移動を制御する制御用ポートP2,P3と、マイクロ流路14の途中に連通して設けられてマイクロ流路14内に予備処理用の試薬等の被混合物質を投入する試薬投入用のポートP4とが形成されている。
【0030】
流路基板3の表面に開口する各ポートP1〜P4の周囲は、流路基板3の他の部分より隆起したリング状の隆起部18a,18b,18c,18dとなっており(図2(b)参照)、この隆起部18a,18b,18c,18dには、ポートパッドを介して配管が接続され、各配管にはバルブを介して、検査装置による送液駆動(マイクロ流路14内での検体の移動操作)のためのポンプが接続される。
【0031】
各ポートP1〜P4は、流路基板3を貫通する貫通孔として形成され、流路基板3の裏面に形成されたマイクロ流路14に連通している。マイクロ流路14は、流路基板3に溝として形成され、その開放面が蓋材5によって封止されることで流路となる。このマイクロ流路14は、第1のマイクロ流路用溝21と、この第1のマイクロ流路用溝21に複数の分岐流路23を介して連通した第2のマイクロ流路用溝22とで構成されている。
【0032】
第1のマイクロ流路用溝21は、基端が検体投入用のポートP1に連通し、終端が制御用ポートP2に連通していている。第2のマイクロ流路用溝22は、基端側が複数の分岐流路23を介して第1のマイクロ流路用溝21の途中に接続されており、終端が制御用ポートP3に連通している。
【0033】
第1のマイクロ流路用溝21の基端であるポートP1寄りの位置には、第1の混合部24が設けられ、更に、試薬投入用のポートP4が第1のマイクロ流路用溝21に連通する合流部25と前述の第1の混合部24との間の第1のマイクロ流路用溝21には、加熱部26が設定されている。
【0034】
第1の混合部24は、第1のマイクロ流路用溝21の溝幅を広げた複数個の亀甲型の混合セル24aを流れ方向に沿って所定の間隔で直列に配置したものである。そして、マイクロ流路14の底面を提供する蓋材5の下方には、外部(検査装置)の加熱手段が配置され、マイクロ流路14の底面から加熱可能にされている。
【0035】
加熱部26は、流路基板3の表面側に配置した掘り込み12位置の底面側である蓋材5に装着した加熱手段により、マイクロ流路14内を流れる被混合物質を所定の温度に昇温させる部位である。
【0036】
第1のマイクロ流路用溝21上で、第1のマイクロ流路用溝21に複数本の分岐流路23が接続された分注部28と合流部25との間には、合流部25側から順に、第2の混合部31と、第3の混合部32が装備されている。また、これらの第2の混合部31と第3の混合部32との間には、更に別の予備処理として検体に接触・反応させる乾燥試薬を保持した2つの試薬担架部34,35が設けられている。
【0037】
試薬担架部34,35は、第1の混合部24における混合セル24aと同様に第1のマイクロ流路用溝21の溝幅を広げることで、マイクロ流路14よりも大きな流路断面を持つ流路空間を形成して、その流路空間の上面となる位置に、乾燥試薬が保持される。
そして、本実施の形態のマイクロ流体チップ1では、ポートP1からマイクロ流路14内に導入された液体試薬としての検体を、溶解・混合用のセルである2つの混合部31,32間で往復させることにより試薬担架部34,35に乾燥状態で担架された乾燥試薬を均一に溶解・混合する。
【0038】
そして、本願発明を適用できる最適な部分として、分注部28を構成している複数本の分岐流路23がある。この分岐流路23は、第1のマイクロ流路用溝21と第2のマイクロ流路用溝22に並列に接続されていて、その途中に、亀甲型に流路を拡幅した複数の反応検出セル37を有している。各反応検出セル37は、その内部の重力方向の最上位置となる上面側流路壁面に、検出用の固化試薬39としてのプライマーが担架されており、予備処理を終えた検体が流入すると、検体と試薬の反応により、検体を分析する。
【0039】
各分岐流路23の反応検出セル37には、互いに成分の異なるプライマーである固化試薬39を担架させておくことで、検体に対する多種の分析を一度に実施することができる。
【0040】
分注部28は、流路基板3の表面側に形成された掘り込み11位置の底面側である蓋材5に当接する検査装置の加熱手段によって加熱可能になっていて、反応検出セル37に担架した分析用の固化試薬39の反応促進に適した温度に、加熱される。
【0041】
本実施の形態の場合、各分岐流路23の反応検出セル37における固化試薬39の担架は、次のように行われている。
まず、図3(a)に示すように、反応検出セル37の上面側流路壁面に、熱溶解性結合剤と混合された適量の液状又は半液状(ゲル状)の試薬42を点着させる。そして、試薬42の水分を蒸発させることで、図3(b)に示すようにセルの内壁面に乾燥状態の試薬39が固着した状態を得る。
【0042】
本実施の形態の場合、反応検出セル37に担架させる試薬は、検体である血液に核酸増幅反応を起こす起点となるプライマーである。
【0043】
そして、試薬42に混合される熱溶解性結合剤としては、溶解促進温度が35℃以上60℃以下とされるゼラチンまたはヒドロキシプロピルセルロース(HPC)が選定されている。
また、固化状態の試薬39において、熱溶解性結合剤であるゼラチンまたはヒドロキシプロピルセルロース(HPC)の含有率は、検体となる血液への溶解速度や反応速度を考慮して、重量比で、20%以上98%以下の範囲に設定される。
【0044】
分注部28に装備された加熱手段は、各反応検出セル37内を、固化試薬39の反応が活発になる規定温度に一定に保ち、固化試薬39による等温反応を実現する。
【0045】
以上のマイクロ流路チップ1は、制御用ポートP2,P3に接続された検査装置配管のバルブの開閉、又はバルブに接続されたポンプによる加圧、又は吸引を適宜に制御することで、検体投入用のポートP1からマイクロ流路14に投入された検体の位置を、マイクロ流路14の任意位置に移動させることができ、各混合部24,31,32等での予備処理用の混合処理を済ませた検体を、各反応検出セル37に分注することで、検体に対する多種の分析を行う。
【0046】
以上に説明したマイクロ流体チップ1によれば、マイクロ流路14内の所定位置としての反応検出セル37に担架された試薬39は、予め混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、反応検出セル37内の流路壁面との間の接着強度を大幅に向上させることができる。
そのため、マイクロ流路14内に送給される被検査液(検体)の接触だけで担架位置から剥離して流されることがない。
しかも、被検査液の温度が熱溶解性結合剤の溶解促進温度である規定温度まで昇温されていないときには、熱溶解性結合剤の溶解が促進されず、試薬39の溶解も促進されない。
【0047】
換言すると、試薬39の担架位置に導入される被検査液の温度を分注部28に装備された加熱手段によって規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解が促進され、同時に、図3(c)に示すように試薬39の溶解・混合も促進され、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬39の担架位置を挟む一定区間(例えば、分岐流路23の範囲内)に一定時間被検査液を滞留させたり、あるいは試薬39の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0048】
更に、熱溶解性結合剤の溶解促進温度が、試薬39と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬39を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。
即ち、当初の試薬39の担架位置またはその周辺だけで、溶解・混合処理に加えて、その後の反応処理や、分析処理を実施することができる。
従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理位置を削減することができ、これにより、チップ上に形成するマイクロ流路マイクロ流路14、分岐流路23の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【0049】
また、本実施の形態では、固化試薬39に混合する熱溶解性結合剤は、溶解促進温度が35℃以上60℃以下となるものを選定している。このような構成にすると、固化試薬39の溶解促進温度を常温からずらして溶解開始のタイミングを正確に管理できると同時に、例えば、試薬39が血液中の標的核酸の増幅及び検出を目的として使用される乾燥プライマーである場合に、この乾燥プライマーの反応温度を維持して、反応促進を図ることもできる。
【0050】
また、本実施の形態では、熱溶解性結合剤として、ゼラチンまたはヒドロキシプロピルセルロース(HPC)を採用している。
このような構成にすると、ゼラチンやヒドロキシプロピルセルロース(HPC)は、上記の溶解促進温度が35℃以上60℃以下とする条件を設定できる熱溶解性を有すると同時に、付着性(接着性)も強いので、分岐流路23上の反応検出セル37の所定位置への試薬39の担架が容易になり、前述した溶解温度や反応温度の適正管理によって、均一混合や、反応促進を実現して、効率よく処理を進行させることができる。
【0051】
また、本実施の形態では、熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下の含有率となるように規制している。
流路に担架する試薬39に含まれる熱溶解性結合剤は、被検査液に溶解した際に、不純物となってしまう。従って、できるだけ熱溶解性結合剤の含有率を下げることが望ましいが、試薬39を被検査液に均一に溶解・混合させるための所要時間や反応速度を最適に調整するためには、熱溶解性結合剤の含有率を高めることで試薬39の溶解速度を抑えることが有効な場合が少なくない。このような観点から、上記のように、熱溶解性結合剤の含有率を規制しておけば、被検査液の組成や分析目的等に対応して、試薬39の溶解性を柔軟に制御することができる。
【0052】
また、本実施の形態では、試薬39が核酸増幅反応を起こすものであり、このような構成にすると、試薬39の担架位置又はその周辺で、核酸増幅反応を効率よく実施できる。
【0053】
更に、本実施の形態では、反応検出セル37内は、分注部28に装備された加熱手段によって等温に維持できるため、固化試薬39による被検査液の核酸増幅反応が等温増幅反応となり、使用する酵素の活性が一定に維持できるため核酸増幅反応が安定して進行し、反応処理の信頼性、処理精度を向上させると共に、所要時間を短縮することができる。
【0054】
更に、本実施の形態では、試薬39が被検査液の核酸増幅反応の起点となるプライマーであるため、試薬39の担架位置での試薬39の溶解開始が、核酸増幅反応の開始とするように制御することができ、反応時間の管理等が容易になることにより、核酸増幅反応を上手に制御・進行させることができる。
【0055】
なお,本発明の発明者は熱溶解性結合剤としてゼラチンを使用し、この熱溶解性結合剤を混合した固化試薬39を反応検出セル37に担架させた上記実施の形態における試薬の溶解・混合特性を確認するための実験を行った。
【0056】
図4(a),(b),(c),(d)、図5に実験に用いたマイクロ流路チップ70の構造を示す。実験に用いたマイクロ流路チップ70は図2(c)に示した反応検出セル37を模した構造となっている。図4(a)はマイクロ流路チップ70の全体形状及び反応検出セル内で、水平方向に離間して設定された測定位置を示す図、図4(b)は(a)のY−Y断面を示す断面図、図4(c)は固化試薬が担架されたマイクロ流路チップ70の全体形状を示す図、図4(d)は(c)のY−Y断面を示す断面図である。図5はY−Y断面を拡大した断面図である。
【0057】
マイクロ流路チップ70の中央には反応検出セル72が配置され、両端位置に配置された貫通の送液ポート78が連通されている。マイクロ流路チップ70の側面60の少なくとも反応検出セル72位置は鏡面仕上げとなっており、反応検出セル72内が検出できるようになっている。更に、反応検出セル72の開口側は底面となる蓋76により、閉ざす構造となっている。反応検出セル72の大きさとしては、幅2.0mm,深さ1.0mmに設定されている。この寸法は実際の反応検出セルを模したものであるが、適宜に設計変更可能で、これに限定されるものではない。
【0058】
次に、固化試薬39を反応検出セル72に担架させる手順を示す。
反応検出セル72に担架させる試薬39として液体状の合成プライマー(OPERON社製)を用い、溶解・混合特性を定量化するために蛍光標識されたプライマーであるPanomerTM 9 ランダムオリゴデオキシヌクレオチド、Alexa FluorR 488 Conjugate(インビトロジェン社製)を100μMとなるように滅菌水で溶解したものを体積比で5%混合して、プライマー溶液を作製した。
【0059】
更に前記プライマー溶液とゼラチン溶液[牛骨ゼラチン(新田ゼラチン社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]を体積比で4:1に混合して、熱溶解性結合剤であるゼラチンを含有した液体状プライマー溶液を作製した。なお、前記ゼラチン溶液は常温では固化してしまうため、45℃に加熱してゲル化した後、前記プライマー溶液と混合した。混合後の溶液はゼラチン濃度が0.5%(Weight / Volume)となっているため、常温で固化することはない。
続いて、熱溶解性結合剤であるゼラチンを混合した前記液体状プライマー溶液1.0μLを反応検出セル内壁面74にピペットにて点着させた後、シリカゲル入りデシケータ内で2時間乾燥させることにより、固化試薬39である合成プライマーを反応検出セル72に担架させた。(図4(c),(d)参照)
【0060】
次に、固化試薬の溶解・混合特性を確認するための実験方法を示す。
上記の固化試薬39を担架させたマイクロ流路チップ70に粘着シールであるseal-TSRT2(Excel Scientific社製)を用いて蓋76をした。蓋76側を下にして送液ポート78からピペットで0.2%Tween20水溶液{10%Tween20(和光純薬社製)を滅菌水で50倍希釈}を送液して検出セル72内を満たした後、底面(蓋76側)から不図示のプレートヒーターでプライマーの反応促進温度である60℃に加熱(図5参照)して、水平方向及び重力方向の蛍光輝度分布を測定した。なお、水平方向はLAS−3000(富士フイルム社製)を用いて検出セル72上面側から,重力方向は実体蛍光顕微鏡システムVB−G25(KEYENCE社製)を用いて鏡面加工を施した検出セル側面60側から測定を行った。
【0061】
また、図4(a)には、反応検出セル内において、水平方向に離間して設定された5箇所の輝度測定場所を数字で示している。
図6は、反応検出セルに導入される被検査液の温度を60℃に維持して、反応検出セル内での処理を実施した場合に、図4(a)に示した各測定場所において測定される輝度の変化を示している。
60℃の等温加熱状態を維持すると、水平方向のどの位置でも、略3分位で略同一の蛍光強度に収束した。これにより、流路内の水平方向に略均一に試薬39が溶解・混合されたことが確認できた。
【0062】
そして、図7は、反応検出セル内(セル深さ1.0mm)で底面からの離間距離を変えて、各所の重力方向輝度分布を測定したもので、反応検出セル内の各所の輝度分布のばらつきが、加熱時間の経過と共に低減し、120秒経過後には、輝度のばらつきが±20%以内に収束していて、反応検出セル内の垂直方向の略全域に渡って、固化試薬(プライマー)の成分が略均等に拡散し,固化試薬(プライマー)が被検査液に均一に溶解・混合されていることが確認できた。
【0063】
次に、本発明の発明者は熱溶解性結合剤としてゼラチンおよびヒドロキシプロピルセルロース(HPC)を使用して、この熱溶解性結合剤を混合した固化試薬39を反応検出セル37に担架させた上記実施の形態における試薬の反応性を確認するための実験を行った。
【0064】
熱溶解性結合剤としてゼラチンを乾燥固化させたプライマーを用いた場合の核酸増幅反応を図9で、ゼラチンおよびヒドロキシプロピルセルロース(HPC)を乾燥固化させたプライマーを用いた場合の核酸増幅反応を図10で、ゼラチンおよびヒドロキシプロピルセルロース(HPC)を混合した液体プライマーを用いた場合の核酸増幅反応を図11で、それぞれ示す。なお、反応検出セル72に担架させる試薬39として液体状の合成プライマー(OPERON社製)を用い、ゼラチン溶液[牛骨ゼラチン(新田ゼラチン社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]およびヒドロキシプロピルセルロース溶液[ヒドロキシプロピルセルロース(日本槽達社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]を前記プライマー溶液に体積比で4:1混合して、熱溶解性結合剤であるゼラチンおよびヒドロキシルプロピルセルロース(HPC)を含有した液体状プライマー溶液を作製し、反応検出セル72内壁面74にピペットにて点着させた後、シリカゲル入りデシケータ内で2時間乾燥させることにより、固化試薬39である合成プライマーを反応検出セル72に担架させた。
熱溶解性結合剤としてゼラチンおよびヒドロキシプロピルセルロース(HPC)を用いた場合はいずれも液体プライマーを用いた場合と同様に反応開始から18min程度で蛍光強度の立ち上がりが認められ、核酸増幅反応が液体プライマーと同様に進行することが分かった。
【0065】
なお、ゼラチン又はヒドロキシプロピルセルロース(HPC)等の熱溶解性結合剤を混合させた試薬を担架させておいて、試薬の溶解開始点を、試薬に接触させる被検査液の温度調整により制御可能にする試薬担架構造は、分注部28における反応検出セル37に限らず、第1の混合部24における各混合セル24aや、試薬担架部34,35に適用するようにしても良い。これにより、分注部28の上流側に位置していた2つの混合部31,32や、加熱部26の規模を縮小したり、あるいは一部を削減して、マイクロ流路14の全長を更に短縮したり、チップの小型化を促進することができる。
【0066】
また、ゼラチン又はヒドロキシプロピルセルロース(HPC)等の熱溶解性結合剤を混合させてマイクロ流路チップ上に担架させる手法は、本実施のプライマー以外にも、核酸増幅反応と検出に必要な試薬である酵素、dNTPミックス等の基質及び検査試薬であるサイバーグリーン等に適用しても良い。
【0067】
熱溶解性結合剤の種類としては、上記ゼラチン又はヒドロキシプロピルセルロース(HPC)の他に、コラーゲン、アガロースなどがある。
【図面の簡単な説明】
【0068】
【図1】本発明に係るマイクロ流路チップの一実施の形態の分解斜視図である。
【図2】図1に示したマイクロ流路チップを構成する流路基板の構成の説明図で、(a)は前記流路基板の平面図、(b)は(a)のA矢視図、(c)は(b)のB矢視図である。
【図3】(a)は図2(c)に示したマイクロ流路のC部の拡大図、(b)は試薬を(a)のセルの内壁面に点着した状態の説明図、(c)は被検査液がセル内に流入した時の作用説明図である。
【図4】(a)はマイクロ流路チップ50の全体形状及び反応検出セル内で、水平方向に離間して設定された測定位置を示す図、(b)は(a)のY−Y断面を示す断面図、(c)は固化試薬が担架されたマイクロ流路チップ50の全体形状を示す図、(d)は(c)のY−Y断面を示す断面図である。
【図5】図4のY−Y断面で蓋76側を底面として拡大した断面図である。
【図6】図4に示した測定位置で測定したセル内の試薬拡散状況を示す蛍光強度グラフである。
【図7】図4に示した反応検出セル内で、垂直方向における試薬拡散状況を示す蛍光強度グラフである。
【図8】(a)は従来のマイクロ流路チップにおいて、試薬を担架させたセルの説明図、(b)は試薬を(a)のセルの内壁面に点着した状態の説明図、(c)は被検査液がセル内に流入した時の作用説明図である
【図9】熱溶解性結合剤としてゼラチンを乾燥固化させたプライマーを用いた場合の核酸増幅反応を示す図である。
【図10】ゼラチンおよびヒドロキシプロピルセルロース(HPC)を乾燥固化させたプライマーを用いた場合の核酸増幅反応を示す図である。
【図11】ゼラチンおよびヒドロキシプロピルセルロース(HPC)を混合した液体プライマーを用いた場合の核酸増幅反応を示す図である。
【符号の説明】
【0069】
1 マイクロ流路チップ
3 流路基板
5 蓋材
11,12 掘り込み
14 マイクロ流路
18 隆起部
21 第1のマイクロ流路用溝
22 第2のマイクロ流路用溝
23 分岐流路
24 第1の混合部
24a 混合セル
26 加熱部
31 第2の混合部
32 第3の混合部
34,35 試薬担架部
37 反応検出セル
39 固化試薬
42 試薬
P1〜P4 ポート
【技術分野】
【0001】
本発明は、乾燥試薬を予め流路内に担架して液体試薬を導入することにより溶解させるマイクロ流路チップに関する。
【背景技術】
【0002】
近年、微量の検体の分析や化学反応処理を安価に、且つ迅速に実現するシステムとして、マイクロ流路チップを使用する方法が提案されている。
【0003】
前記マイクロ流路チップはこのチップへ液体を供給して検査を実行する検査装置に適用される物である。この検査装置として例えば特許文献1に開示される生化学処理装置等があり、チャンバ(処理空間)とチャンバ間を連通するマイクロ流路とを有する生化学反応カートリッジ(マイクロ流路チップ)を載置するステージと、流路を介して液体を移動させるための移動手段と、チャンバ内の液体の有無或いは液量を検出する検出手段と、検出手段により検出されたチャンバ内の液体の情報により液体の移動の結果を判定する判定手段とを設けることにより、前記マイクロ流路内で予備処理した検体を前記チャンバ内に誘導して、チャンバ内の検査試薬と検体との化学反応又は生化学反応から、検体の分析を行う。
【0004】
前記マイクロ流路内での検体の予備処理とは、例えば、前記チャンバ内に保持した検査試薬と検体とが効率良く反応するように、検体に反応促進物質(試薬)を混合したり、あるいは検体中の特定成分を単離させたり溶解・増幅させるために検体に所定の反応物質を混合する処理である。
【0005】
そして、このような予備処理や分析用の反応処理を簡単に実施できるように、予め、チップ製造時に、予備処理や分析用の反応処理などに使う試薬を乾燥状態にしてマイクロ流路の内壁面の一部に担架させたマイクロ流路チップが提案されている(例えば、特許文献2,3参照)。このようなマイクロ流路チップにおいて、マイクロ流路の内壁面へ乾燥試薬を担架させる具体的方法としては、例えば、図8(a)に示すように、マイクロ流路51の途中にセル(処理空間)52を設けておき(図では効果的な混合を考えて流路を拡幅している。)、該セル52の内壁面に液状試薬53を点着させた後、該液状試薬53の水分を蒸発させることで、図8(b)に示すようにセルの内壁面に乾燥状態の試薬54が固着した状態を得るものが提案されている。
【0006】
このようなマイクロ流路チップでは、マイクロ流路に検体を流すと、マイクロ流路を流れる検体がマイクロ流路の一部に担架された乾燥試薬に接触して、検体に接触した乾燥試薬が検体中に溶出することで試薬と検体との混合が開始するため、少量の試薬により閉鎖空間で混合が進むので、検体分析作業が手軽に実施できるようになる。
【0007】
【特許文献1】特開2006−170654号公報
【特許文献2】特開2004−194652号公報
【特許文献3】特開2006−133003号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
ところが、上記のようにセル52の内壁面に液状試薬を点着させた後、その液状試薬中の水分を蒸発させて試薬54を担架させた場合は、担架させた試薬54とセル52の内壁面との間の接着強度が低く、検体をマイクロ流路51に流すと、検体がセル52に流入して担架されている試薬54に接触開始した時の衝撃等で、図8(c)に示すように乾燥試薬54が塊状のままセル52の内壁面から剥離し、セル52の外に流されてしまう。
【0009】
特許文献2の場合では、試薬固定位置が拡幅されている訳でもなく、液流が一方向と考えられ、図8(c)に示した場合と同様に、乾燥試薬の常温での溶解が早く、液流が来て直ぐに流れ方向に流れ出してしまう。また、特許文献3の場合では、試薬用のセルが流路に間接的に接続しており、試薬の溶解が遅れたり、あるいは溶解した試薬が検体の全域に均一に混合されずに、その後の反応処理や、分析処理の精度を低下させる虞があった。
【0010】
ここで、検体に溶解・混合させるべき試薬が、セルの内壁面から剥離して流されてしまうと、試薬が実際に液体に溶解・混合される位置が、当初に想定していたセル内の所定位置からずれてしまう。また、分析のために検体と試薬とを化学的又は生化学的に反応させる場合には、反応を促進するために、加熱等を加える必要があるが、試薬が均一に混合された状態になっていないと、反応にばらつきが生じたり、あるいは、反応が遅れるといった問題も生じてしまう。
【0011】
試薬が剥離して流動する場合でも、試薬の溶解・混合が所定の精度で完遂され、試薬が均一に混合された検体に対して化学反応処理又は生化学反応処理を実施できるように、試薬の溶解処理、混合処理、化学・生化学反応処理、検査処理等を、マイクロ流路上の互いに異なる位置で実施するようにする構成が一般である。
ところが、このように処理位置を分けると、チップ上に形成するマイクロ流路の全長が長大化したり、流路が複雑な分岐構造となり、処理手順も複雑となり、マイクロ流路チップの大型化や、製造コストの増大という問題も生じる。
【0012】
そこで、本発明の目的は上記課題を解消することに係り、被検査液に溶解・混合させるべくマイクロ流路内の所定位置に担架した試薬は、当初に想定した担架位置で、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができ、また、当初の担架位置でその後の反応処理や、分析処理を実施することができ、マイクロ流路上の処理位置の削減により、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、小型化や、製造コストの低減を図ることのできるマイクロ流路チップを提供することである。
【課題を解決するための手段】
【0013】
(1)本発明の上記課題の解決は、マイクロ流路内に試薬を担架して被検査液を導入するマイクロ流路チップであって、
前記試薬が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、
前記被検査液の導入時温度からの昇温により前記所定位置での前記試薬の溶解が促進されるマイクロ流路チップにより達成される。
【0014】
上記構成によれば、マイクロ流路内の所定位置に担架された試薬は、混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、流路壁面との間の接着強度を大幅に向上させることができる。そのため、マイクロ流路内に送給される被検査液の接触だけでは担架位置から剥離して流されることがない。
そして、被検査液が試薬の担架位置に導入された後の温度を規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解が促進され、試薬の溶解・混合も促進され、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬の担架位置を挟む一定区間に一定時間被検査液を滞留させたり、あるいは試薬の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0015】
更に、熱溶解性結合剤の溶解促進温度が、試薬と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。即ち、当初の試薬の担架位置またはその周辺だけで、溶解・混合・増幅処理に加えて、その後の反応処理や、分析処理を実施することができる。従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理範囲を削減することができ、これにより、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【0016】
(2)なお、好ましくは、上記(1)に記載のマイクロ流路チップにおいて、前記被検査液の昇温温度が35℃以上60℃以下である構成とすると良い。
このような構成にすると、被検査液の昇温温度設定により熱溶解性結合剤及び試薬の溶解促進開始のタイミングを管理できる同時に、例えば、試薬が血液中の標的核酸の増幅及び検出を目的として使用される乾燥プライマーである場合に、この乾燥プライマーの反応温度を維持して、反応促進を図ることもできる。
【0017】
(3)また、好ましくは、上記(1)又は(2)に記載のマイクロ流路チップにおいて、前記熱溶解性結合剤がゼラチンまたはヒドロキシプロピルセルロースである構成とすると良い。
このような構成にすると、ゼラチンやヒドロキシプロピルセルロースは、上記(2)を満足する熱溶解性を有すると同時に、付着性(接着性)も強いので、マイクロ流路上の所定位置への試薬の担架が容易になり、上記(2)の構成を容易に実現することができる。
【0018】
(4)また、好ましくは、上記(1)乃至(3)のいずれか一つに記載のマイクロ流路チップにおいて、前記熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下含まれている構成とすると良い。
マイクロ流路に担架する試薬に含まれる熱溶解性結合剤は、被検査液に溶解した際に、不純物となってしまう。従って、できるだけ熱溶解性結合剤の含有率を下げることが望ましいが、試薬を被検査液に均一に溶解・混合させるための所要時間や反応速度を最適に調整するためには、熱溶解性結合剤の含有率を高めることで試薬の溶解速度を抑えることが有効な場合が少なくない。このような観点から、上記のように、熱溶解性結合剤の含有率を規制しておけば、被検査液の組成や分析目的等に対応して、試薬の溶解性を柔軟に制御することができる。
【0019】
(5)また、好ましくは、上記(1)乃至(4)のいずれか一つに記載のマイクロ流路チップにおいて、前記試薬が核酸増幅反応を起こすものである構成とすると良い。
このような構成にすると、試薬の担架位置又はその周辺で、核酸増幅反応を効率よく実施できる。
【0020】
(6)また、好ましくは、上記(5)に記載のマイクロ流路チップにおいて、前記核酸増幅反応が等温で行われる構成とすると良い。
このような構成にすると、核酸増幅反応が等温増幅反応となり、使用する酵素の活性が一定に維持できるため核酸増幅反応が安定して進行し、反応処理の信頼性、処理精度を向上させると共に、所要時間を短縮することができる。
【0021】
(7)また、好ましくは、上記(1)又は(2)に記載のマイクロ流路チップにおいて、前記試薬が前記核酸増幅反応の起点となるプライマーである構成とすると良い。
このような構成にすると、試薬の担架位置での試薬の溶解促進開始が、核酸増幅反応の開始となるように制御することが可能となるため、反応時間の管理等が容易になり、核酸増幅反応を上手に制御・進行させることができる。
【発明の効果】
【0022】
本発明に係るマイクロ流路チップでは、マイクロ流路内の所定位置に担架された試薬は、混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、流路壁面との間の接着強度を大幅に向上させることができる。
そのため、マイクロ流路内に送給される被検査液の接触だけで担架位置から剥離して流されることがない。しかも、被検査液の温度が規定温度まで昇温されていないときには、熱溶解性結合剤の溶解が促進されないため、試薬の溶解も開始されない。換言すると、試薬の担架位置に導入される被検査液の温度を規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解促進が始まり、試薬の溶解・混合が始まり、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬の担架位置を挟む一定区間に一定時間被検査液を滞留させたり、あるいは試薬の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0023】
更に、熱溶解性結合剤の溶解促進温度が、試薬と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。即ち、当初の試薬の担架位置またはその周辺だけで、溶解・混合・増幅処理に加えて、その後の反応処理や、分析処理を実施することができる。従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理位置を削減することができ、これにより、チップ上に形成するマイクロ流路の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【発明を実施するための最良の形態】
【0024】
以下、本発明に係るマイクロ流路チップの好適な実施の形態について、図面を参照して詳細に説明する。
図1は本発明に係るマイクロ流路チップの一実施の形態の分解斜視図、図2は図1に示したマイクロ流路チップを構成する流路基板の構成の説明図で、図2(a)は前記流路基板の平面図、図2(b)は図2(a)のA矢視図、図2(c)は図2(b)のB矢視図、図3(a)は図2(c)に示したマイクロ流路のC部の拡大図、図3(b)は試薬を図3(a)のセルの内壁面に点着した状態の説明図、図3(c)は被検査液がセル内に流入した時の作用説明図である。
【0025】
図1及び図2に示したマイクロ流路チップ(以下、単に「チップ」とも称す。)1は、検査装置(図示せず)にセットされて使用され、一回の使用後に廃棄される。本実施の形態は、検体である血液(全血)がマイクロ流体チップ1に注入される。マイクロ流体チップ1は、検査装置にセットされることで、チップ外部からの物理的作用力によって検体液がハンドリングされ、例えば一塩基多型の複数ターゲット遺伝子が検査されるものであり、特開2005−160387号公報に示されているような、ターゲット配列の核酸を等温で特異的に増幅するための反応とその検出をチップ1上で実現可能とするものである。これにより、例えば、標的核酸を増幅してこれを検出することで、感染症の原因となる病原体に特異的な標的核酸の増幅及び検出が可能となり、検体中の該病原体の存否等が判定可能となる。
【0026】
本実施の形態において、物理的作用力は、液流路の始点と終点に設けたポート部PTからエア供給又はエア吸引することにより発生する空気圧作用力(空圧駆動力)である。したがって、液流路内に供給された液体が、液流路の始点と終点とに作用されるエア供給又はエア吸引により、液流路内の所望位置へ移動制御可能となる。この際、液体は、始点と先端部、後端部と終点との間に介在する気体に挟持された状態で保持され、引っ張り力の作用により途中で分断されることがない。
【0027】
なお、DNA増幅反応は、等温増幅反応により、使用する酵素の活性が一定に維持できる温度に保たれる。ここで、「等温」とは、酵素およびプライマーが実質的に機能し得るような、ほぼ一定の温度をいう。さらに、「ほぼ一定の温度」とは、酵素及びプライマーの実質的な機能を損なわない程度の温度変化であれば許容されることを意味する。
【0028】
また、マイクロ流体チップ1は熱可塑性の高分子ポリマーの射出成形により製作される。使用する高分子ポリマーは、特に限定されないが、光学的に透明であり、耐熱性が高く、化学的に安定であり、射出成形が容易なものが望ましく、COP、COC、PMMA等が好適である。光学的に透明とは、検出に用いる励起光や蛍光の波長において透過性が高く、散乱が小さく、自家蛍光が少ないことである。マイクロ流体チップ1は、蛍光を検出可能とする透光性を有していることで、検出試薬に例えばサイバーグリーンが用いられ、反応によって増幅された2本鎖DNAにインターカレートすることで発する蛍光が測定可能となる。これにより、ターゲットとする遺伝子配列の存在の有無が検出可能となる。
【0029】
図1及び図2(a)において、流路基板3は、その厚さ寸法t、幅寸法W、長さ寸法Lが、省スペースで持ち運び可能な適度の大きさに設定されている。そして、流路基板3の表面には、外部の加熱手段を装備するための凹みである掘り込み11,12と、後述するマイクロ流路14の一端に連通して設けられた検体投入用のポートP1と、マイクロ流路14に連通して設けられてマイクロ流路14内における検体の移動を制御する制御用ポートP2,P3と、マイクロ流路14の途中に連通して設けられてマイクロ流路14内に予備処理用の試薬等の被混合物質を投入する試薬投入用のポートP4とが形成されている。
【0030】
流路基板3の表面に開口する各ポートP1〜P4の周囲は、流路基板3の他の部分より隆起したリング状の隆起部18a,18b,18c,18dとなっており(図2(b)参照)、この隆起部18a,18b,18c,18dには、ポートパッドを介して配管が接続され、各配管にはバルブを介して、検査装置による送液駆動(マイクロ流路14内での検体の移動操作)のためのポンプが接続される。
【0031】
各ポートP1〜P4は、流路基板3を貫通する貫通孔として形成され、流路基板3の裏面に形成されたマイクロ流路14に連通している。マイクロ流路14は、流路基板3に溝として形成され、その開放面が蓋材5によって封止されることで流路となる。このマイクロ流路14は、第1のマイクロ流路用溝21と、この第1のマイクロ流路用溝21に複数の分岐流路23を介して連通した第2のマイクロ流路用溝22とで構成されている。
【0032】
第1のマイクロ流路用溝21は、基端が検体投入用のポートP1に連通し、終端が制御用ポートP2に連通していている。第2のマイクロ流路用溝22は、基端側が複数の分岐流路23を介して第1のマイクロ流路用溝21の途中に接続されており、終端が制御用ポートP3に連通している。
【0033】
第1のマイクロ流路用溝21の基端であるポートP1寄りの位置には、第1の混合部24が設けられ、更に、試薬投入用のポートP4が第1のマイクロ流路用溝21に連通する合流部25と前述の第1の混合部24との間の第1のマイクロ流路用溝21には、加熱部26が設定されている。
【0034】
第1の混合部24は、第1のマイクロ流路用溝21の溝幅を広げた複数個の亀甲型の混合セル24aを流れ方向に沿って所定の間隔で直列に配置したものである。そして、マイクロ流路14の底面を提供する蓋材5の下方には、外部(検査装置)の加熱手段が配置され、マイクロ流路14の底面から加熱可能にされている。
【0035】
加熱部26は、流路基板3の表面側に配置した掘り込み12位置の底面側である蓋材5に装着した加熱手段により、マイクロ流路14内を流れる被混合物質を所定の温度に昇温させる部位である。
【0036】
第1のマイクロ流路用溝21上で、第1のマイクロ流路用溝21に複数本の分岐流路23が接続された分注部28と合流部25との間には、合流部25側から順に、第2の混合部31と、第3の混合部32が装備されている。また、これらの第2の混合部31と第3の混合部32との間には、更に別の予備処理として検体に接触・反応させる乾燥試薬を保持した2つの試薬担架部34,35が設けられている。
【0037】
試薬担架部34,35は、第1の混合部24における混合セル24aと同様に第1のマイクロ流路用溝21の溝幅を広げることで、マイクロ流路14よりも大きな流路断面を持つ流路空間を形成して、その流路空間の上面となる位置に、乾燥試薬が保持される。
そして、本実施の形態のマイクロ流体チップ1では、ポートP1からマイクロ流路14内に導入された液体試薬としての検体を、溶解・混合用のセルである2つの混合部31,32間で往復させることにより試薬担架部34,35に乾燥状態で担架された乾燥試薬を均一に溶解・混合する。
【0038】
そして、本願発明を適用できる最適な部分として、分注部28を構成している複数本の分岐流路23がある。この分岐流路23は、第1のマイクロ流路用溝21と第2のマイクロ流路用溝22に並列に接続されていて、その途中に、亀甲型に流路を拡幅した複数の反応検出セル37を有している。各反応検出セル37は、その内部の重力方向の最上位置となる上面側流路壁面に、検出用の固化試薬39としてのプライマーが担架されており、予備処理を終えた検体が流入すると、検体と試薬の反応により、検体を分析する。
【0039】
各分岐流路23の反応検出セル37には、互いに成分の異なるプライマーである固化試薬39を担架させておくことで、検体に対する多種の分析を一度に実施することができる。
【0040】
分注部28は、流路基板3の表面側に形成された掘り込み11位置の底面側である蓋材5に当接する検査装置の加熱手段によって加熱可能になっていて、反応検出セル37に担架した分析用の固化試薬39の反応促進に適した温度に、加熱される。
【0041】
本実施の形態の場合、各分岐流路23の反応検出セル37における固化試薬39の担架は、次のように行われている。
まず、図3(a)に示すように、反応検出セル37の上面側流路壁面に、熱溶解性結合剤と混合された適量の液状又は半液状(ゲル状)の試薬42を点着させる。そして、試薬42の水分を蒸発させることで、図3(b)に示すようにセルの内壁面に乾燥状態の試薬39が固着した状態を得る。
【0042】
本実施の形態の場合、反応検出セル37に担架させる試薬は、検体である血液に核酸増幅反応を起こす起点となるプライマーである。
【0043】
そして、試薬42に混合される熱溶解性結合剤としては、溶解促進温度が35℃以上60℃以下とされるゼラチンまたはヒドロキシプロピルセルロース(HPC)が選定されている。
また、固化状態の試薬39において、熱溶解性結合剤であるゼラチンまたはヒドロキシプロピルセルロース(HPC)の含有率は、検体となる血液への溶解速度や反応速度を考慮して、重量比で、20%以上98%以下の範囲に設定される。
【0044】
分注部28に装備された加熱手段は、各反応検出セル37内を、固化試薬39の反応が活発になる規定温度に一定に保ち、固化試薬39による等温反応を実現する。
【0045】
以上のマイクロ流路チップ1は、制御用ポートP2,P3に接続された検査装置配管のバルブの開閉、又はバルブに接続されたポンプによる加圧、又は吸引を適宜に制御することで、検体投入用のポートP1からマイクロ流路14に投入された検体の位置を、マイクロ流路14の任意位置に移動させることができ、各混合部24,31,32等での予備処理用の混合処理を済ませた検体を、各反応検出セル37に分注することで、検体に対する多種の分析を行う。
【0046】
以上に説明したマイクロ流体チップ1によれば、マイクロ流路14内の所定位置としての反応検出セル37に担架された試薬39は、予め混合される熱溶解性結合剤として、付着性(接着性)を有したものを採用しておくことで、反応検出セル37内の流路壁面との間の接着強度を大幅に向上させることができる。
そのため、マイクロ流路14内に送給される被検査液(検体)の接触だけで担架位置から剥離して流されることがない。
しかも、被検査液の温度が熱溶解性結合剤の溶解促進温度である規定温度まで昇温されていないときには、熱溶解性結合剤の溶解が促進されず、試薬39の溶解も促進されない。
【0047】
換言すると、試薬39の担架位置に導入される被検査液の温度を分注部28に装備された加熱手段によって規定温度に昇温させれば、その被検査液に接触した熱溶解性結合剤の溶解が促進され、同時に、図3(c)に示すように試薬39の溶解・混合も促進され、当初の担架位置で溶解・混合処理が開始・継続されることが担保されるため、例えば、試薬39の担架位置を挟む一定区間(例えば、分岐流路23の範囲内)に一定時間被検査液を滞留させたり、あるいは試薬39の担架位置を挟む一定区間で被検査液を往復させることで、被検査液に確実に溶解・混合させて、溶解・混合処理の精度を向上させることができる。
【0048】
更に、熱溶解性結合剤の溶解促進温度が、試薬39と被検査液との反応促進温度となるように、熱溶解性結合剤の特性を調整しておけば、溶解・混合した試薬39を効率良く被検査液に反応させることができ、当初の担架位置の周辺でその後の反応処理や、分析処理を実施することができる。
即ち、当初の試薬39の担架位置またはその周辺だけで、溶解・混合処理に加えて、その後の反応処理や、分析処理を実施することができる。
従って、これらの溶解・混合処理,反応処理,分析処理をマイクロ流路上の互いに異なる位置で実施するようにしていた従来の場合と比較すると、マイクロ流路上の処理位置を削減することができ、これにより、チップ上に形成するマイクロ流路マイクロ流路14、分岐流路23の単純化や流路長の短縮を実現して、チップの小型化や、製造コストの低減を図ることもできる。
【0049】
また、本実施の形態では、固化試薬39に混合する熱溶解性結合剤は、溶解促進温度が35℃以上60℃以下となるものを選定している。このような構成にすると、固化試薬39の溶解促進温度を常温からずらして溶解開始のタイミングを正確に管理できると同時に、例えば、試薬39が血液中の標的核酸の増幅及び検出を目的として使用される乾燥プライマーである場合に、この乾燥プライマーの反応温度を維持して、反応促進を図ることもできる。
【0050】
また、本実施の形態では、熱溶解性結合剤として、ゼラチンまたはヒドロキシプロピルセルロース(HPC)を採用している。
このような構成にすると、ゼラチンやヒドロキシプロピルセルロース(HPC)は、上記の溶解促進温度が35℃以上60℃以下とする条件を設定できる熱溶解性を有すると同時に、付着性(接着性)も強いので、分岐流路23上の反応検出セル37の所定位置への試薬39の担架が容易になり、前述した溶解温度や反応温度の適正管理によって、均一混合や、反応促進を実現して、効率よく処理を進行させることができる。
【0051】
また、本実施の形態では、熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下の含有率となるように規制している。
流路に担架する試薬39に含まれる熱溶解性結合剤は、被検査液に溶解した際に、不純物となってしまう。従って、できるだけ熱溶解性結合剤の含有率を下げることが望ましいが、試薬39を被検査液に均一に溶解・混合させるための所要時間や反応速度を最適に調整するためには、熱溶解性結合剤の含有率を高めることで試薬39の溶解速度を抑えることが有効な場合が少なくない。このような観点から、上記のように、熱溶解性結合剤の含有率を規制しておけば、被検査液の組成や分析目的等に対応して、試薬39の溶解性を柔軟に制御することができる。
【0052】
また、本実施の形態では、試薬39が核酸増幅反応を起こすものであり、このような構成にすると、試薬39の担架位置又はその周辺で、核酸増幅反応を効率よく実施できる。
【0053】
更に、本実施の形態では、反応検出セル37内は、分注部28に装備された加熱手段によって等温に維持できるため、固化試薬39による被検査液の核酸増幅反応が等温増幅反応となり、使用する酵素の活性が一定に維持できるため核酸増幅反応が安定して進行し、反応処理の信頼性、処理精度を向上させると共に、所要時間を短縮することができる。
【0054】
更に、本実施の形態では、試薬39が被検査液の核酸増幅反応の起点となるプライマーであるため、試薬39の担架位置での試薬39の溶解開始が、核酸増幅反応の開始とするように制御することができ、反応時間の管理等が容易になることにより、核酸増幅反応を上手に制御・進行させることができる。
【0055】
なお,本発明の発明者は熱溶解性結合剤としてゼラチンを使用し、この熱溶解性結合剤を混合した固化試薬39を反応検出セル37に担架させた上記実施の形態における試薬の溶解・混合特性を確認するための実験を行った。
【0056】
図4(a),(b),(c),(d)、図5に実験に用いたマイクロ流路チップ70の構造を示す。実験に用いたマイクロ流路チップ70は図2(c)に示した反応検出セル37を模した構造となっている。図4(a)はマイクロ流路チップ70の全体形状及び反応検出セル内で、水平方向に離間して設定された測定位置を示す図、図4(b)は(a)のY−Y断面を示す断面図、図4(c)は固化試薬が担架されたマイクロ流路チップ70の全体形状を示す図、図4(d)は(c)のY−Y断面を示す断面図である。図5はY−Y断面を拡大した断面図である。
【0057】
マイクロ流路チップ70の中央には反応検出セル72が配置され、両端位置に配置された貫通の送液ポート78が連通されている。マイクロ流路チップ70の側面60の少なくとも反応検出セル72位置は鏡面仕上げとなっており、反応検出セル72内が検出できるようになっている。更に、反応検出セル72の開口側は底面となる蓋76により、閉ざす構造となっている。反応検出セル72の大きさとしては、幅2.0mm,深さ1.0mmに設定されている。この寸法は実際の反応検出セルを模したものであるが、適宜に設計変更可能で、これに限定されるものではない。
【0058】
次に、固化試薬39を反応検出セル72に担架させる手順を示す。
反応検出セル72に担架させる試薬39として液体状の合成プライマー(OPERON社製)を用い、溶解・混合特性を定量化するために蛍光標識されたプライマーであるPanomerTM 9 ランダムオリゴデオキシヌクレオチド、Alexa FluorR 488 Conjugate(インビトロジェン社製)を100μMとなるように滅菌水で溶解したものを体積比で5%混合して、プライマー溶液を作製した。
【0059】
更に前記プライマー溶液とゼラチン溶液[牛骨ゼラチン(新田ゼラチン社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]を体積比で4:1に混合して、熱溶解性結合剤であるゼラチンを含有した液体状プライマー溶液を作製した。なお、前記ゼラチン溶液は常温では固化してしまうため、45℃に加熱してゲル化した後、前記プライマー溶液と混合した。混合後の溶液はゼラチン濃度が0.5%(Weight / Volume)となっているため、常温で固化することはない。
続いて、熱溶解性結合剤であるゼラチンを混合した前記液体状プライマー溶液1.0μLを反応検出セル内壁面74にピペットにて点着させた後、シリカゲル入りデシケータ内で2時間乾燥させることにより、固化試薬39である合成プライマーを反応検出セル72に担架させた。(図4(c),(d)参照)
【0060】
次に、固化試薬の溶解・混合特性を確認するための実験方法を示す。
上記の固化試薬39を担架させたマイクロ流路チップ70に粘着シールであるseal-TSRT2(Excel Scientific社製)を用いて蓋76をした。蓋76側を下にして送液ポート78からピペットで0.2%Tween20水溶液{10%Tween20(和光純薬社製)を滅菌水で50倍希釈}を送液して検出セル72内を満たした後、底面(蓋76側)から不図示のプレートヒーターでプライマーの反応促進温度である60℃に加熱(図5参照)して、水平方向及び重力方向の蛍光輝度分布を測定した。なお、水平方向はLAS−3000(富士フイルム社製)を用いて検出セル72上面側から,重力方向は実体蛍光顕微鏡システムVB−G25(KEYENCE社製)を用いて鏡面加工を施した検出セル側面60側から測定を行った。
【0061】
また、図4(a)には、反応検出セル内において、水平方向に離間して設定された5箇所の輝度測定場所を数字で示している。
図6は、反応検出セルに導入される被検査液の温度を60℃に維持して、反応検出セル内での処理を実施した場合に、図4(a)に示した各測定場所において測定される輝度の変化を示している。
60℃の等温加熱状態を維持すると、水平方向のどの位置でも、略3分位で略同一の蛍光強度に収束した。これにより、流路内の水平方向に略均一に試薬39が溶解・混合されたことが確認できた。
【0062】
そして、図7は、反応検出セル内(セル深さ1.0mm)で底面からの離間距離を変えて、各所の重力方向輝度分布を測定したもので、反応検出セル内の各所の輝度分布のばらつきが、加熱時間の経過と共に低減し、120秒経過後には、輝度のばらつきが±20%以内に収束していて、反応検出セル内の垂直方向の略全域に渡って、固化試薬(プライマー)の成分が略均等に拡散し,固化試薬(プライマー)が被検査液に均一に溶解・混合されていることが確認できた。
【0063】
次に、本発明の発明者は熱溶解性結合剤としてゼラチンおよびヒドロキシプロピルセルロース(HPC)を使用して、この熱溶解性結合剤を混合した固化試薬39を反応検出セル37に担架させた上記実施の形態における試薬の反応性を確認するための実験を行った。
【0064】
熱溶解性結合剤としてゼラチンを乾燥固化させたプライマーを用いた場合の核酸増幅反応を図9で、ゼラチンおよびヒドロキシプロピルセルロース(HPC)を乾燥固化させたプライマーを用いた場合の核酸増幅反応を図10で、ゼラチンおよびヒドロキシプロピルセルロース(HPC)を混合した液体プライマーを用いた場合の核酸増幅反応を図11で、それぞれ示す。なお、反応検出セル72に担架させる試薬39として液体状の合成プライマー(OPERON社製)を用い、ゼラチン溶液[牛骨ゼラチン(新田ゼラチン社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]およびヒドロキシプロピルセルロース溶液[ヒドロキシプロピルセルロース(日本槽達社製)を2.5%(Weight / Volume)となるように10mM Trisバッファー{トリス-塩酸、pH 7.5 (1M)(インビトロジェン社製)を滅菌水で100倍希釈に溶解}で溶解したもの]を前記プライマー溶液に体積比で4:1混合して、熱溶解性結合剤であるゼラチンおよびヒドロキシルプロピルセルロース(HPC)を含有した液体状プライマー溶液を作製し、反応検出セル72内壁面74にピペットにて点着させた後、シリカゲル入りデシケータ内で2時間乾燥させることにより、固化試薬39である合成プライマーを反応検出セル72に担架させた。
熱溶解性結合剤としてゼラチンおよびヒドロキシプロピルセルロース(HPC)を用いた場合はいずれも液体プライマーを用いた場合と同様に反応開始から18min程度で蛍光強度の立ち上がりが認められ、核酸増幅反応が液体プライマーと同様に進行することが分かった。
【0065】
なお、ゼラチン又はヒドロキシプロピルセルロース(HPC)等の熱溶解性結合剤を混合させた試薬を担架させておいて、試薬の溶解開始点を、試薬に接触させる被検査液の温度調整により制御可能にする試薬担架構造は、分注部28における反応検出セル37に限らず、第1の混合部24における各混合セル24aや、試薬担架部34,35に適用するようにしても良い。これにより、分注部28の上流側に位置していた2つの混合部31,32や、加熱部26の規模を縮小したり、あるいは一部を削減して、マイクロ流路14の全長を更に短縮したり、チップの小型化を促進することができる。
【0066】
また、ゼラチン又はヒドロキシプロピルセルロース(HPC)等の熱溶解性結合剤を混合させてマイクロ流路チップ上に担架させる手法は、本実施のプライマー以外にも、核酸増幅反応と検出に必要な試薬である酵素、dNTPミックス等の基質及び検査試薬であるサイバーグリーン等に適用しても良い。
【0067】
熱溶解性結合剤の種類としては、上記ゼラチン又はヒドロキシプロピルセルロース(HPC)の他に、コラーゲン、アガロースなどがある。
【図面の簡単な説明】
【0068】
【図1】本発明に係るマイクロ流路チップの一実施の形態の分解斜視図である。
【図2】図1に示したマイクロ流路チップを構成する流路基板の構成の説明図で、(a)は前記流路基板の平面図、(b)は(a)のA矢視図、(c)は(b)のB矢視図である。
【図3】(a)は図2(c)に示したマイクロ流路のC部の拡大図、(b)は試薬を(a)のセルの内壁面に点着した状態の説明図、(c)は被検査液がセル内に流入した時の作用説明図である。
【図4】(a)はマイクロ流路チップ50の全体形状及び反応検出セル内で、水平方向に離間して設定された測定位置を示す図、(b)は(a)のY−Y断面を示す断面図、(c)は固化試薬が担架されたマイクロ流路チップ50の全体形状を示す図、(d)は(c)のY−Y断面を示す断面図である。
【図5】図4のY−Y断面で蓋76側を底面として拡大した断面図である。
【図6】図4に示した測定位置で測定したセル内の試薬拡散状況を示す蛍光強度グラフである。
【図7】図4に示した反応検出セル内で、垂直方向における試薬拡散状況を示す蛍光強度グラフである。
【図8】(a)は従来のマイクロ流路チップにおいて、試薬を担架させたセルの説明図、(b)は試薬を(a)のセルの内壁面に点着した状態の説明図、(c)は被検査液がセル内に流入した時の作用説明図である
【図9】熱溶解性結合剤としてゼラチンを乾燥固化させたプライマーを用いた場合の核酸増幅反応を示す図である。
【図10】ゼラチンおよびヒドロキシプロピルセルロース(HPC)を乾燥固化させたプライマーを用いた場合の核酸増幅反応を示す図である。
【図11】ゼラチンおよびヒドロキシプロピルセルロース(HPC)を混合した液体プライマーを用いた場合の核酸増幅反応を示す図である。
【符号の説明】
【0069】
1 マイクロ流路チップ
3 流路基板
5 蓋材
11,12 掘り込み
14 マイクロ流路
18 隆起部
21 第1のマイクロ流路用溝
22 第2のマイクロ流路用溝
23 分岐流路
24 第1の混合部
24a 混合セル
26 加熱部
31 第2の混合部
32 第3の混合部
34,35 試薬担架部
37 反応検出セル
39 固化試薬
42 試薬
P1〜P4 ポート
【特許請求の範囲】
【請求項1】
マイクロ流路内に試薬を担架して被検査液を導入するマイクロ流路チップであって、
前記試薬が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、
前記被検査液の導入時温度からの昇温により前記所定位置での前記試薬の溶解が促進されるマイクロ流路チップ。
【請求項2】
前記被検査液の昇温温度が35℃以上60℃以下である請求項1記載のマイクロ流路チップ。
【請求項3】
前記熱溶解性結合剤がゼラチンまたはヒドロキシプロピルセルロースである請求項1または請求項2に記載のマイクロ流路チップ。
【請求項4】
前記熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下含まれている請求項1〜3のいずれか1項に記載のマイクロ流路チップ。
【請求項5】
前記試薬が核酸増幅反応を起こすものである請求項1〜4のいずれか1項に記載のマイクロ流路チップ。
【請求項6】
前記核酸増幅反応が等温で行われる請求項5記載のマイクロ流路チップ。
【請求項7】
前記試薬が前記核酸増幅反応の起点となるプライマーである請求項1または請求項2に記載のマイクロ流路チップ。
【請求項1】
マイクロ流路内に試薬を担架して被検査液を導入するマイクロ流路チップであって、
前記試薬が熱溶解性結合剤と混合されてマイクロ流路内の所定位置に担架され、
前記被検査液の導入時温度からの昇温により前記所定位置での前記試薬の溶解が促進されるマイクロ流路チップ。
【請求項2】
前記被検査液の昇温温度が35℃以上60℃以下である請求項1記載のマイクロ流路チップ。
【請求項3】
前記熱溶解性結合剤がゼラチンまたはヒドロキシプロピルセルロースである請求項1または請求項2に記載のマイクロ流路チップ。
【請求項4】
前記熱溶解性結合剤が固化状態の試薬に対して重量比で20%以上98%以下含まれている請求項1〜3のいずれか1項に記載のマイクロ流路チップ。
【請求項5】
前記試薬が核酸増幅反応を起こすものである請求項1〜4のいずれか1項に記載のマイクロ流路チップ。
【請求項6】
前記核酸増幅反応が等温で行われる請求項5記載のマイクロ流路チップ。
【請求項7】
前記試薬が前記核酸増幅反応の起点となるプライマーである請求項1または請求項2に記載のマイクロ流路チップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2008−151770(P2008−151770A)
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願番号】特願2007−296998(P2007−296998)
【出願日】平成19年11月15日(2007.11.15)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
【公開日】平成20年7月3日(2008.7.3)
【国際特許分類】
【出願日】平成19年11月15日(2007.11.15)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
[ Back to top ]

