マシテンタン含有治療用組成物
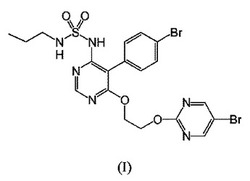
本発明は、プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、下式(I)の化合物、
【化1】

又はこの化合物の薬学的に許容される塩を含む生産品に関する。
【化1】

又はこの化合物の薬学的に許容される塩を含む生産品に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン(macitentan)、すなわち、下式(I)の化合物、
【0002】
【化1】

【0003】
又はこの化合物の薬学的に許容される塩を含む生産品、並びにエンドセリン(endothelin)が関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用する本生産品に関する。
【0004】
PCT公開WO02/053557は、式(I)の化合物を含むエンドセリン受容体拮抗剤、及びエンドセリンが関与する種々の疾患(すなわち、心不全、狭心症、肺及び全身性高血圧症並びに勃起不全)の治療における当該エンドセリン受容体拮抗剤の使用を記載する。
【0005】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、特に、下記の文献に記載されている:
−US4,683,330は、化合物、トレプロスチニル(treprostinil)並びにその塩及び類似体を記載する;
−US4,539,333はエポプロステノールナトリウム(epoprostenol sodium)を記載する;
−US4,692,464は、化合物、イロプロスト(iloprost)並びにその塩及び類似体を記載する;
−US4,474,802は、化合物、ベラプロスト(beraprost)並びにその塩及び類似体を記載する;
−US7,205,302は、他の化合物と共に、プロスタサイクリン受容体(IP)アゴニスト特性を有する5,6−ジフェニルピラジン誘導体並びにその塩及び類似体、特にコードネームMRE−269及びNS−304で知られる化合物(K.Kuwanoら、J.Pharmacol.Exp.Ther.(2007)、322(3)、1181−1188)を記載する。
【0006】
さらに、WO2004/017993は、肺動脈高血圧症の治療のために、エンドセリン受容体拮抗剤、ボセンタン(bosentan)を、プロスタサイクリン受容体アゴニスト、エポプロステノールナトリウムと共に使用することを記載する。
【0007】
本出願人は、マシテンタンの、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物との組み合わせが、エンドセリンが関与する疾患の治療において、強い相乗効果を奏することを見出した。加えて、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物に関連して生じえる副作用(例えば、潮紅又は全身性高血圧症)の軽減が期待される。
【0008】
従って、本発明の第一の主題は、マシテンタン、又はその薬学的に許容される塩、及び、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩を含む生産品に関する。
【0009】
本発明のさらなる主題は、エンドセリンが関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用するための、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はその薬学的に許容される塩を含む生産品に関する。
【0010】
以下の段落では、本特許出願において使用される種々の用語の定義をしており、他の表現によりなされた定義が、より広い又はより狭い定義を与えない限り、当該定義は、本明細書及び請求項を通じて、一律に適用されることを意図している。
【0011】
マシテンタンは、式(I)の化合物の推奨されるINNであり、従って、本特許出願においては、式(I)の化合物を指すために、この名称を使用する。
【0012】
治療用途に関連する場合の、「同時に」又は「同時の」という用語は、本特許出願において、関連する治療における使用が、2又はそれ以上の活性成分の同じ経路による同時投与にあることを意味する。
【0013】
治療用途に関連する場合の、「別々に」または「別々の」という用語は、本特許出願において、関連する治療における使用が、2又はそれ以上の活性成分の、少なくとも2つの異なる経路によるほぼ同時の投与にあることを意味する。
【0014】
「ある期間に渡る」治療上の投与という用語は、本特許出願において、2又はそれ以上の活性成分を異なる時に投与すること、そして特に、一の活性成分の全投与が完結した後に、他方又は他の活性成分の投与を開始する投与法を意味する。このように、活性成分の一方を数カ月間投与した後に、1又は2以上の他方の活性成分を投与することが可能である。この場合には同時投与は生じない。ある期間に渡る治療上の投与の別の態様は、各活性成分について異なる投与頻度を採用する、配合剤の2又はそれ以上の活性成分の期間に渡る投与であり、この場合、ある時点においては、配合剤のすべての活性成分の同時投与が生じる一方、他の時点においては、配合剤の活性成分の一部のみが投与されてもよい(例えば、マシテンタンのNS−304との配合剤の場合、ある期間に渡る治療上の投与は、マシテンタンを1日1回投与する一方、NS−304を一日に2回投与するようなものであり得る。)。
【0015】
「エンドセリンが関与する疾患」は、特に、高血圧症、肺高血圧症(肺動脈高血圧症を含む。)、糖尿病性動脈疾患、心不全、勃起不全、狭心症又は肺線維症である。
【0016】
「プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物」は、本特許出願に記載した「プロスタサイクリン受容体(IP)アゴニストEC50測定試験」に付した場合、500nM又はそれ未満のEC50値を持つ化合物を意味する。
【0017】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の具体的な例は、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸(MRE−269)及びその薬学的に許容される塩を含む。
【0018】
「薬学的に許容される塩」という用語は、無毒性の、無機若しくは有機酸及び/又は塩基付加塩を意味する。「Salt selection for basic drugs」、Int.J.Pharm.(1986)、33、201−217を参照してもよい。
【0019】
さらに、マシテンタン又はプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物に対するいかなる言及も、適切かつふさわしい意味合いになるように、その薬学的に許容される塩にも言及するものと理解されるべきである。
【0020】
好ましくは、本発明の生産品は、マシテンタン及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、同時に、又はある期間に渡って行われる治療上の使用に用いることを意図するような生産品である。
【0021】
本発明の好ましい変形の1つによれば、マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、同時に投与されることが意図される。
【0022】
本発明の別の好ましい変形によれば、マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、ある期間に渡って投与されることが意図される。
【0023】
本発明の生産品の治療上の使用のために意図される期間は、少なくとも1週間、そして好ましくは少なくとも1カ月又はそれ以上(例えば、6カ月)である。この期間はまた、本生産品を受ける患者の全生涯であってもよい。本発明に従う投与の特定の態様によれば、マシテンタンの投与は、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の投与と交互に行ってもよく、そしてそのような投与の間隔は2〜3日を超えない(そしてそしてより好ましくは、1日を超えない。)。本発明に従う投与の別の特定の態様によれば、マシテンタンのNS−304との配合剤の場合には、ある期間に渡る治療上の投与は、マシテンタンを1日1回投与する一方、NS−304を1日2回投与するものであり得る。
【0024】
好ましくは、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸(MRE−269)及びその薬学的に許容される塩から選択される。本発明の特に好ましい変形の1つによれば、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)又はその薬学的に許容される塩である。
【0025】
マシテンタンの投与経路、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の投与経路は、好ましくは同じである。特に、マシテンタン及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の共通の投与経路は経口ルートである。
【0026】
本発明の生産物の正確な投与用量は、治療を行う医師により決定されなければならないが、1日に患者の体重1kg当たり0.05〜2mg(そして好ましくは、0.1〜1mg)のマシテンタンが適切と考えられる。同様に、患者の体重1kg当たり0.5〜30μg(そして好ましくは、1.5〜15μg)の用量のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、1日に2回投与するのが適切と考えられる。
【0027】
好ましくは、本発明の生産物によって治療されることが意図される疾患は、高血圧症、肺高血圧症、糖尿病性動脈疾患、心不全、勃起不全、狭心症及び肺線維症から選択される。より好ましくは、本発明の生産物によって治療されることが意図される疾患は、高血圧症及び肺高血圧症から選択される。特に、本発明の生産物によって治療されることが意図される疾患は、肺高血圧症(そして特に、肺動脈高血圧症)である。
【0028】
本発明はまた、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩と組み合わせて、マシテンタン、又はこの化合物の薬学的に許容される塩を活性成分として、そして少なくとも1種の(そして好ましくは1種の)賦形剤を含む医薬組成物に関する。
【0029】
本発明はさらに、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩との組み合わせにおける、マシテンタン、又はこの化合物の薬学的に許容される塩の、エンドセリンが関与する疾患を治療することを意図する医薬の製造のための使用に関する。
【0030】
さらに、本発明の化合物について示された好適性は、当然のことながら、本発明の医薬組成物及び使用に準用される。
【0031】
本発明の特定の態様を下記の実施例に記載するが、それは、本発明をより詳細に説明するために供されるものであり、その範囲をいかなる意味においても限定するものではない。
【0032】
実施例
本発明の有用性を説明するために、1日当たり10mg/kgの用量で経口投与したマシテンタンの、1日に2回、1mg/kgの用量で経口投与したNS−304との共同作用は、2つの異なる高血圧症モデル、すなわち、肺高血圧症モノクロタリンラットモデル及び自然発症高血圧ラットモデルにおいて試験することができる。当然のことながら、他の共同作用も同様に試験することができる。使用し得るプロトコルは、下記の「本発明化合物の薬理学的特性」と題したパートに詳述する。
【0033】
本発明化合物の薬理学的特性
試験方法:
本発明化合物の薬理学的特性を示すために、下記の試験方法を使用することができる。
【0034】
ラットにおける肺高血圧症のモノクロタリンモデル
雄性Wistar系ラットをHarlan(オランダ)から購入し、そしてローカル・ガイドライン(Basel−Landschaft cantonal veterinary office)に沿った条件下で維持する。すべてのラットを、12:12時間の明:暗サイクルにて環境制御条件で飼育し、そして餌と水を自由に摂取させる。2.5%イソフルラン(70%O2+30%N2O中)の吸引による麻酔下、テレメトリーシステムを埋め込む。無菌条件下、圧無線周波数トランスミッター(pressure radio−frequency transmitter)を腹腔内に埋め込み、そして感知カテーテルを肺動脈に挿入する。トランスミッターを腹筋(abdominal musculature)に縫合し、そして皮膚を閉塞する。受信プラットフォーム(receiver platform)が無線信号をデジタル化された入力に変換し、それが専用パーソナル・コンピュータ(Compaq、Deskpro)に送られる。肺動脈の血圧測定は、参照雰囲気圧(ambient pressure reference)からの入力を用いて修正する。テレメトリー装置はData Sciences(St.Paul、MN、USA)から入手する。モノクロタリン(MCT;Sigma Chemicals、St Louis、MO、USA)は、3ml/kgの体積を単回皮下投与(60mg/kg)し、そして対照同齢ラットには、同体積の生理食塩水を投与する。
【0035】
変形1:慢性効果の評価:
動物を無作為に試験群に分け、そしてMCTの投与後24h以内に、4週間の治療を開始する。マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、経口ルートで投与する。5分間隔でデータを収集することにより、マシテンタン、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物及びそれらの組み合わせの、肺動脈の血圧に対する効果を測定する。肺動脈圧の時間ごとの平均を各ラットについて計算する。記録の最後にラットを殺す。心臓を摘出し、重量を測定し、そして体重(BW)に対する臓器重量の割合を算出する。右心室(RV)と左心室及び隔壁(septum)を分離し、重量を測定する;RV/BW比を、右心室肥大の指標として使用する。RV/BW比が小さいほど、試験した事項の右心室肥大を減少させる効果が強いことになる。
【0036】
変形2:急性効果の評価:
MCTの投与後4週間、ラットは肺高血圧症になり、そしてマシテンタン、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物及びそれらの組み合わせそれぞれの単回経口投与の効果を平均肺動脈圧について評価することができる。
【0037】
自然発症高血圧ラットモデル
モノクロタリン−処置ラットを自然発症高血圧ラット(SHR)で置き換えたことを除いては、ラットにおける肺高血圧症のモノクロタリンモデルについて使用したものと同じプロトコルを用いる。SHRラットはHarlan(オランダ)から購入する。
【0038】
プロスタサイクリン受容体(IP)アゴニストのEC50の測定試験:
ヒトIP受容体を安定に発現するCHO細胞を、10%のウシ胎児血清を含むHam’s F−12培地中で、空気95%、CO25%の加湿雰囲気において37℃にて培養する。細胞を、24−穴プレートに、1x105細胞/ウェルで藩種し、48h培養する。アッセイバッファーを用いた洗浄及び37℃での1hのインキュベーションの後、細胞を、IBMX(500μM)の存在下、種々の濃度の試験化合物に暴露する。上清を除いた後、0.2Mの過塩素酸の添加により反応を停止させる。接着細胞を−80℃にて2h凍結し、そして融解して細胞内cAMPを抽出する。上清を試験管内に集め、2M KHCO3溶液で中和し、次いで4℃、14,000gにて10min遠心して、EIA系によるcAMPレベルの測定用のサンプルを得る。培養プレートに接着した細胞片のタンパク量を、1N NaOH溶液への溶解後に測定する。cAMPレベルをタンパク1mg当たりのcAMP(pmol)で表す。EC50値を、濃度−反応曲線の非線形回帰分析から決定し、そして観察される最大効果の半分の反応を誘発する試験化合物濃度の負対数と定義する。
【0039】
試験結果:
実施例1:マシテンタン、NS−304及びそれらの組み合わせの、モノクロタリン処置ラットの平均肺動脈圧に対する急性効果:
試験は、「試験方法」と題した部分の「ラットにおける肺高血圧症のモノクロタリンモデル」セクションに記載したモノクロタリンモデルに従って、モノクロタリンで処置した肺高血圧症雄性Wistar系ラットにおいて行った。モノクロタリンによる処置の25〜30日後、各群6匹のラットから成る4群を形成し、試験を行った:
−第1群は、マシテンタンでもNS−304でも処置しなかった(対照群);
−第2群は、マシテンタンでのみ処置した(os当たり10mg/kg);
−第3群は、NS−304でのみ処置した(os当たり30mg/kg);
−第4群は、マシテンタン(os当たり10mg/kg)とNS−304(os当たり30mg/kg)の配合剤で処置した;
平均肺動脈圧を試験期間に渡って測定する。平均肺動脈圧と時間の関係をグラフとしてプロットする。異なる処置の経口投与後、曲線下の面積(AUC)をラットの各群について算出する(平均肺動脈血圧が上昇する場合には面積が正であり、平均肺動脈血圧が減少する場合には面積は負である。)。このようにして得られた結果を、下記の表1に要約する。
【0040】
【表1】

【0041】
肺動脈高血圧症のモノクロタリンモデルにおいて得られたこれらのデータにより、前もってモノクロタリン投与を受けたラットの治療における、マシテンタンとNS−304の相乗効果が確認された。
【技術分野】
【0001】
本発明は、プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン(macitentan)、すなわち、下式(I)の化合物、
【0002】
【化1】

【0003】
又はこの化合物の薬学的に許容される塩を含む生産品、並びにエンドセリン(endothelin)が関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用する本生産品に関する。
【0004】
PCT公開WO02/053557は、式(I)の化合物を含むエンドセリン受容体拮抗剤、及びエンドセリンが関与する種々の疾患(すなわち、心不全、狭心症、肺及び全身性高血圧症並びに勃起不全)の治療における当該エンドセリン受容体拮抗剤の使用を記載する。
【0005】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、特に、下記の文献に記載されている:
−US4,683,330は、化合物、トレプロスチニル(treprostinil)並びにその塩及び類似体を記載する;
−US4,539,333はエポプロステノールナトリウム(epoprostenol sodium)を記載する;
−US4,692,464は、化合物、イロプロスト(iloprost)並びにその塩及び類似体を記載する;
−US4,474,802は、化合物、ベラプロスト(beraprost)並びにその塩及び類似体を記載する;
−US7,205,302は、他の化合物と共に、プロスタサイクリン受容体(IP)アゴニスト特性を有する5,6−ジフェニルピラジン誘導体並びにその塩及び類似体、特にコードネームMRE−269及びNS−304で知られる化合物(K.Kuwanoら、J.Pharmacol.Exp.Ther.(2007)、322(3)、1181−1188)を記載する。
【0006】
さらに、WO2004/017993は、肺動脈高血圧症の治療のために、エンドセリン受容体拮抗剤、ボセンタン(bosentan)を、プロスタサイクリン受容体アゴニスト、エポプロステノールナトリウムと共に使用することを記載する。
【0007】
本出願人は、マシテンタンの、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物との組み合わせが、エンドセリンが関与する疾患の治療において、強い相乗効果を奏することを見出した。加えて、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物に関連して生じえる副作用(例えば、潮紅又は全身性高血圧症)の軽減が期待される。
【0008】
従って、本発明の第一の主題は、マシテンタン、又はその薬学的に許容される塩、及び、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩を含む生産品に関する。
【0009】
本発明のさらなる主題は、エンドセリンが関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用するための、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はその薬学的に許容される塩を含む生産品に関する。
【0010】
以下の段落では、本特許出願において使用される種々の用語の定義をしており、他の表現によりなされた定義が、より広い又はより狭い定義を与えない限り、当該定義は、本明細書及び請求項を通じて、一律に適用されることを意図している。
【0011】
マシテンタンは、式(I)の化合物の推奨されるINNであり、従って、本特許出願においては、式(I)の化合物を指すために、この名称を使用する。
【0012】
治療用途に関連する場合の、「同時に」又は「同時の」という用語は、本特許出願において、関連する治療における使用が、2又はそれ以上の活性成分の同じ経路による同時投与にあることを意味する。
【0013】
治療用途に関連する場合の、「別々に」または「別々の」という用語は、本特許出願において、関連する治療における使用が、2又はそれ以上の活性成分の、少なくとも2つの異なる経路によるほぼ同時の投与にあることを意味する。
【0014】
「ある期間に渡る」治療上の投与という用語は、本特許出願において、2又はそれ以上の活性成分を異なる時に投与すること、そして特に、一の活性成分の全投与が完結した後に、他方又は他の活性成分の投与を開始する投与法を意味する。このように、活性成分の一方を数カ月間投与した後に、1又は2以上の他方の活性成分を投与することが可能である。この場合には同時投与は生じない。ある期間に渡る治療上の投与の別の態様は、各活性成分について異なる投与頻度を採用する、配合剤の2又はそれ以上の活性成分の期間に渡る投与であり、この場合、ある時点においては、配合剤のすべての活性成分の同時投与が生じる一方、他の時点においては、配合剤の活性成分の一部のみが投与されてもよい(例えば、マシテンタンのNS−304との配合剤の場合、ある期間に渡る治療上の投与は、マシテンタンを1日1回投与する一方、NS−304を一日に2回投与するようなものであり得る。)。
【0015】
「エンドセリンが関与する疾患」は、特に、高血圧症、肺高血圧症(肺動脈高血圧症を含む。)、糖尿病性動脈疾患、心不全、勃起不全、狭心症又は肺線維症である。
【0016】
「プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物」は、本特許出願に記載した「プロスタサイクリン受容体(IP)アゴニストEC50測定試験」に付した場合、500nM又はそれ未満のEC50値を持つ化合物を意味する。
【0017】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の具体的な例は、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸(MRE−269)及びその薬学的に許容される塩を含む。
【0018】
「薬学的に許容される塩」という用語は、無毒性の、無機若しくは有機酸及び/又は塩基付加塩を意味する。「Salt selection for basic drugs」、Int.J.Pharm.(1986)、33、201−217を参照してもよい。
【0019】
さらに、マシテンタン又はプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物に対するいかなる言及も、適切かつふさわしい意味合いになるように、その薬学的に許容される塩にも言及するものと理解されるべきである。
【0020】
好ましくは、本発明の生産品は、マシテンタン及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、同時に、又はある期間に渡って行われる治療上の使用に用いることを意図するような生産品である。
【0021】
本発明の好ましい変形の1つによれば、マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、同時に投与されることが意図される。
【0022】
本発明の別の好ましい変形によれば、マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、ある期間に渡って投与されることが意図される。
【0023】
本発明の生産品の治療上の使用のために意図される期間は、少なくとも1週間、そして好ましくは少なくとも1カ月又はそれ以上(例えば、6カ月)である。この期間はまた、本生産品を受ける患者の全生涯であってもよい。本発明に従う投与の特定の態様によれば、マシテンタンの投与は、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の投与と交互に行ってもよく、そしてそのような投与の間隔は2〜3日を超えない(そしてそしてより好ましくは、1日を超えない。)。本発明に従う投与の別の特定の態様によれば、マシテンタンのNS−304との配合剤の場合には、ある期間に渡る治療上の投与は、マシテンタンを1日1回投与する一方、NS−304を1日2回投与するものであり得る。
【0024】
好ましくは、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸(MRE−269)及びその薬学的に許容される塩から選択される。本発明の特に好ましい変形の1つによれば、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物は、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド(NS−304)又はその薬学的に許容される塩である。
【0025】
マシテンタンの投与経路、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の投与経路は、好ましくは同じである。特に、マシテンタン及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物の共通の投与経路は経口ルートである。
【0026】
本発明の生産物の正確な投与用量は、治療を行う医師により決定されなければならないが、1日に患者の体重1kg当たり0.05〜2mg(そして好ましくは、0.1〜1mg)のマシテンタンが適切と考えられる。同様に、患者の体重1kg当たり0.5〜30μg(そして好ましくは、1.5〜15μg)の用量のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、1日に2回投与するのが適切と考えられる。
【0027】
好ましくは、本発明の生産物によって治療されることが意図される疾患は、高血圧症、肺高血圧症、糖尿病性動脈疾患、心不全、勃起不全、狭心症及び肺線維症から選択される。より好ましくは、本発明の生産物によって治療されることが意図される疾患は、高血圧症及び肺高血圧症から選択される。特に、本発明の生産物によって治療されることが意図される疾患は、肺高血圧症(そして特に、肺動脈高血圧症)である。
【0028】
本発明はまた、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩と組み合わせて、マシテンタン、又はこの化合物の薬学的に許容される塩を活性成分として、そして少なくとも1種の(そして好ましくは1種の)賦形剤を含む医薬組成物に関する。
【0029】
本発明はさらに、少なくとも1種の(そして好ましくは1種の)プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩との組み合わせにおける、マシテンタン、又はこの化合物の薬学的に許容される塩の、エンドセリンが関与する疾患を治療することを意図する医薬の製造のための使用に関する。
【0030】
さらに、本発明の化合物について示された好適性は、当然のことながら、本発明の医薬組成物及び使用に準用される。
【0031】
本発明の特定の態様を下記の実施例に記載するが、それは、本発明をより詳細に説明するために供されるものであり、その範囲をいかなる意味においても限定するものではない。
【0032】
実施例
本発明の有用性を説明するために、1日当たり10mg/kgの用量で経口投与したマシテンタンの、1日に2回、1mg/kgの用量で経口投与したNS−304との共同作用は、2つの異なる高血圧症モデル、すなわち、肺高血圧症モノクロタリンラットモデル及び自然発症高血圧ラットモデルにおいて試験することができる。当然のことながら、他の共同作用も同様に試験することができる。使用し得るプロトコルは、下記の「本発明化合物の薬理学的特性」と題したパートに詳述する。
【0033】
本発明化合物の薬理学的特性
試験方法:
本発明化合物の薬理学的特性を示すために、下記の試験方法を使用することができる。
【0034】
ラットにおける肺高血圧症のモノクロタリンモデル
雄性Wistar系ラットをHarlan(オランダ)から購入し、そしてローカル・ガイドライン(Basel−Landschaft cantonal veterinary office)に沿った条件下で維持する。すべてのラットを、12:12時間の明:暗サイクルにて環境制御条件で飼育し、そして餌と水を自由に摂取させる。2.5%イソフルラン(70%O2+30%N2O中)の吸引による麻酔下、テレメトリーシステムを埋め込む。無菌条件下、圧無線周波数トランスミッター(pressure radio−frequency transmitter)を腹腔内に埋め込み、そして感知カテーテルを肺動脈に挿入する。トランスミッターを腹筋(abdominal musculature)に縫合し、そして皮膚を閉塞する。受信プラットフォーム(receiver platform)が無線信号をデジタル化された入力に変換し、それが専用パーソナル・コンピュータ(Compaq、Deskpro)に送られる。肺動脈の血圧測定は、参照雰囲気圧(ambient pressure reference)からの入力を用いて修正する。テレメトリー装置はData Sciences(St.Paul、MN、USA)から入手する。モノクロタリン(MCT;Sigma Chemicals、St Louis、MO、USA)は、3ml/kgの体積を単回皮下投与(60mg/kg)し、そして対照同齢ラットには、同体積の生理食塩水を投与する。
【0035】
変形1:慢性効果の評価:
動物を無作為に試験群に分け、そしてMCTの投与後24h以内に、4週間の治療を開始する。マシテンタン、及びプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物を、経口ルートで投与する。5分間隔でデータを収集することにより、マシテンタン、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物及びそれらの組み合わせの、肺動脈の血圧に対する効果を測定する。肺動脈圧の時間ごとの平均を各ラットについて計算する。記録の最後にラットを殺す。心臓を摘出し、重量を測定し、そして体重(BW)に対する臓器重量の割合を算出する。右心室(RV)と左心室及び隔壁(septum)を分離し、重量を測定する;RV/BW比を、右心室肥大の指標として使用する。RV/BW比が小さいほど、試験した事項の右心室肥大を減少させる効果が強いことになる。
【0036】
変形2:急性効果の評価:
MCTの投与後4週間、ラットは肺高血圧症になり、そしてマシテンタン、プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物及びそれらの組み合わせそれぞれの単回経口投与の効果を平均肺動脈圧について評価することができる。
【0037】
自然発症高血圧ラットモデル
モノクロタリン−処置ラットを自然発症高血圧ラット(SHR)で置き換えたことを除いては、ラットにおける肺高血圧症のモノクロタリンモデルについて使用したものと同じプロトコルを用いる。SHRラットはHarlan(オランダ)から購入する。
【0038】
プロスタサイクリン受容体(IP)アゴニストのEC50の測定試験:
ヒトIP受容体を安定に発現するCHO細胞を、10%のウシ胎児血清を含むHam’s F−12培地中で、空気95%、CO25%の加湿雰囲気において37℃にて培養する。細胞を、24−穴プレートに、1x105細胞/ウェルで藩種し、48h培養する。アッセイバッファーを用いた洗浄及び37℃での1hのインキュベーションの後、細胞を、IBMX(500μM)の存在下、種々の濃度の試験化合物に暴露する。上清を除いた後、0.2Mの過塩素酸の添加により反応を停止させる。接着細胞を−80℃にて2h凍結し、そして融解して細胞内cAMPを抽出する。上清を試験管内に集め、2M KHCO3溶液で中和し、次いで4℃、14,000gにて10min遠心して、EIA系によるcAMPレベルの測定用のサンプルを得る。培養プレートに接着した細胞片のタンパク量を、1N NaOH溶液への溶解後に測定する。cAMPレベルをタンパク1mg当たりのcAMP(pmol)で表す。EC50値を、濃度−反応曲線の非線形回帰分析から決定し、そして観察される最大効果の半分の反応を誘発する試験化合物濃度の負対数と定義する。
【0039】
試験結果:
実施例1:マシテンタン、NS−304及びそれらの組み合わせの、モノクロタリン処置ラットの平均肺動脈圧に対する急性効果:
試験は、「試験方法」と題した部分の「ラットにおける肺高血圧症のモノクロタリンモデル」セクションに記載したモノクロタリンモデルに従って、モノクロタリンで処置した肺高血圧症雄性Wistar系ラットにおいて行った。モノクロタリンによる処置の25〜30日後、各群6匹のラットから成る4群を形成し、試験を行った:
−第1群は、マシテンタンでもNS−304でも処置しなかった(対照群);
−第2群は、マシテンタンでのみ処置した(os当たり10mg/kg);
−第3群は、NS−304でのみ処置した(os当たり30mg/kg);
−第4群は、マシテンタン(os当たり10mg/kg)とNS−304(os当たり30mg/kg)の配合剤で処置した;
平均肺動脈圧を試験期間に渡って測定する。平均肺動脈圧と時間の関係をグラフとしてプロットする。異なる処置の経口投与後、曲線下の面積(AUC)をラットの各群について算出する(平均肺動脈血圧が上昇する場合には面積が正であり、平均肺動脈血圧が減少する場合には面積は負である。)。このようにして得られた結果を、下記の表1に要約する。
【0040】
【表1】

【0041】
肺動脈高血圧症のモノクロタリンモデルにおいて得られたこれらのデータにより、前もってモノクロタリン投与を受けたラットの治療における、マシテンタンとNS−304の相乗効果が確認された。
【特許請求の範囲】
【請求項1】
プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はこの化合物の薬学的に許容される塩を含む生産品。
【請求項2】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項1に記載の生産品。
【請求項3】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項2に記載の生産品。
【請求項4】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド又はその薬学的に許容される塩である、請求項3に記載の生産品。
【請求項5】
エンドセリンが関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用するための、プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はこの化合物の薬学的に許容される塩を含む生産品。
【請求項6】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項5に記載の生産品。
【請求項7】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項6に記載の生産品。
【請求項8】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド又はその薬学的に許容される塩である、請求項7に記載の生産品。
【請求項9】
エンドセリンが関与する疾患が、高血圧症、肺高血圧症、糖尿病性動脈疾患、心不全、勃起不全、狭心症及び肺線維症から選択される、請求項5〜8の1項に記載の生産品。
【請求項10】
エンドセリンが関与する疾患が肺高血圧症である、請求項9に記載の生産品。
【請求項11】
少なくとも1種のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩と組み合わせて、マシテンタン、又はその薬学的に許容される塩を活性成分として、そして少なくとも1種の薬学的に許容される賦形剤を含む医薬組成物。
【請求項12】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド、又はその薬学的に許容される塩である、請求項10に記載の医薬組成物。
【請求項13】
少なくとも1種のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩との組み合わせにおける、マシテンタン、又はその薬学的に許容される塩の、エンドセリンが関与する疾患を治療することを意図する医薬の製造のための使用。
【請求項14】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド、又はその薬学的に許容される塩である、請求項13に記載の使用。
【請求項15】
治療されることが意図される疾患が肺高血圧症である、請求項13又は14に記載の使用。
【請求項1】
プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はこの化合物の薬学的に許容される塩を含む生産品。
【請求項2】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項1に記載の生産品。
【請求項3】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項2に記載の生産品。
【請求項4】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド又はその薬学的に許容される塩である、請求項3に記載の生産品。
【請求項5】
エンドセリンが関与する疾患の治療において、同時に、別々に又はある期間に渡って、治療のために使用するための、プロスタサイクリン受容体(IP)アゴニスト特性を有する少なくとも1種の化合物、又はその薬学的に許容される塩を配合した、マシテンタン、又はこの化合物の薬学的に許容される塩を含む生産品。
【請求項6】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、トレプロスチニル及びその薬学的に許容される塩、エポプロステノール及びその薬学的に許容される塩、イロプロスト及びその薬学的に許容される塩、ベラプロスト及びその薬学的に許容される塩、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項5に記載の生産品。
【請求項7】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド及びその薬学的に許容される塩、並びに{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}酢酸及びその薬学的に許容される塩から選択される、請求項6に記載の生産品。
【請求項8】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド又はその薬学的に許容される塩である、請求項7に記載の生産品。
【請求項9】
エンドセリンが関与する疾患が、高血圧症、肺高血圧症、糖尿病性動脈疾患、心不全、勃起不全、狭心症及び肺線維症から選択される、請求項5〜8の1項に記載の生産品。
【請求項10】
エンドセリンが関与する疾患が肺高血圧症である、請求項9に記載の生産品。
【請求項11】
少なくとも1種のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩と組み合わせて、マシテンタン、又はその薬学的に許容される塩を活性成分として、そして少なくとも1種の薬学的に許容される賦形剤を含む医薬組成物。
【請求項12】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド、又はその薬学的に許容される塩である、請求項10に記載の医薬組成物。
【請求項13】
少なくとも1種のプロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩との組み合わせにおける、マシテンタン、又はその薬学的に許容される塩の、エンドセリンが関与する疾患を治療することを意図する医薬の製造のための使用。
【請求項14】
プロスタサイクリン受容体(IP)アゴニスト特性を有する化合物、又はその薬学的に許容される塩が、2−{4−[(5,6−ジフェニルピラジン−2−イル)(イソプロピル)アミノ]ブトキシ}−N−(メチルスルフォニル)アセタミド、又はその薬学的に許容される塩である、請求項13に記載の使用。
【請求項15】
治療されることが意図される疾患が肺高血圧症である、請求項13又は14に記載の使用。
【公表番号】特表2011−530581(P2011−530581A)
【公表日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2011−522608(P2011−522608)
【出願日】平成21年8月12日(2009.8.12)
【国際出願番号】PCT/IB2009/053553
【国際公開番号】WO2010/018549
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
【公表日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成21年8月12日(2009.8.12)
【国際出願番号】PCT/IB2009/053553
【国際公開番号】WO2010/018549
【国際公開日】平成22年2月18日(2010.2.18)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
[ Back to top ]

