ミトコンドリア結合ヘキソキナーゼを選択的に阻害する化合物の同定のためのジャスモン酸エステルに基づくアッセイ
本発明は、ヘキソキナーゼに選択的に結合し、それによってこれらの酵素をミトコンドリアから解離させることを促進する化合物を含む組成物、ならびに、高レベルのミトコンドリア結合ヘキソキナーゼによって特徴づけられる疾病および障害における細胞死を誘導するこのような化合物および組成物の使用方法を提供する。本発明は、さらに、これらの活性を有する分子を検出および同定する方法およびアッセイを開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、候補薬物分子の抗腫瘍効果の判定のためのアッセイに関する。本発明は、具体的には、ヘキソキナーゼに選択的に結合し、それによってこれらの酵素をミトコンドリアから解離させることを促進する化合物の同定方法、このような化合物を含む組成物、ならびに、高レベルのミトコンドリア結合ヘキソキナーゼによって特徴づけられる疾病および障害における細胞死を誘導するためのこのような組成物の使用方法に関する。
【背景技術】
【0002】
(ヘキソキナーゼ)
ヘキソキナーゼは、グルコースを酸化し、続いて、ミトコンドリアによって完全に代謝されて二酸化炭素およびATPを産生する化合物、または、貯蔵脂肪の合成に用いられる化合物を産生する一連の酵素反応に関与する解糖系における初期酵素かつ鍵酵素である。ヘキソキナーゼのアイソザイムI、IIおよびIIIは、電位依存性アニオンチャネルへ特異的に結合することで、ミトコンドリア外膜の外表面に、物理的に結合できる。この結合は、ミトコンドリアを介したアポトーシス細胞死を阻害することが公知である。癌細胞では、ミトコンドリア結合ヘキソキナーゼおよび電位依存性アニオンチャネルに結合したヘキソキナーゼ(主にI型およびII型)が過剰発現している。癌細胞におけるミトコンドリア結合ヘキソキナーゼレベルの上昇は、エネルギー供給の改善およびミトコンドリアを介した細胞死に対する保護によって、癌細胞の増殖率および癌細胞の生存において中心的役割を果たしていることが示唆されている。近年では、II型ヘキソキナーゼが、抗癌治療における有望な標的であることが示唆されている(非特許文献1)。
【0003】
ミトコンドリアは、ATPを産生でき、細胞代謝を制御できることが周知である。さらに、ミトコンドリアは細胞死の制御において重要な役割を果たす。悪条件に曝露した場合、ミトコンドリアの膜透過性遷移が惹起され得る。膜透過性遷移孔複合体(PTPC)は、三つの主要素、すなわち、アデニンヌクレオチドトランスロケーター、シクロフィリンDおよび電位依存性アニオンチャネルに支配される。PTPCの開口が遷延された場合、ミトコンドリア内膜電位の散逸、ミトコンドリアのマトリックスの浸透圧性膨潤、続いて、チトクロムcの遊離、および、ネクローシスまたはアポトーシスによる最終的な細胞死がもたらされる(非特許文献2)。
【0004】
特許文献1および特許文献2は、哺乳類細胞におけるヘキソキナーゼ酵素を阻害する組成物および方法を開示する。これらの参考文献には、トレハロース−6−リン酸の生成を刺激するタンパク質および、それぞれの遺伝子;ヘキソキナーゼ特異的リボザイムおよび、そのコンストラクトをコードする遺伝子;ならびに(例えば、ミトコンドリアからヘキソキナーゼを置換することによる)ヘキソキナーゼ活性を競合的に減少させる薬剤およびそれぞれの遺伝子、について記載されている。後者の薬剤には、不活性なヘキソキナーゼおよびミトコンドリアの結合機能を維持するその断片ならびに、さらにヘキソキナーゼ活性をグルコキナーゼ活性に置換するヘキソキナーゼ−グルコキナーゼキメラが含まれる。2型糖尿病のリスクを判定するための予測法における、変質したミトコンドリアの機能についての指標は、特許文献3に開示されている。
【0005】
(ジャスモン酸エステル)
ジャスモン酸エステルファミリーの植物ストレスホルモンは、抗癌能を備えていることが既に見出されている(非特許文献3;非特許文献4)。ジャスモン酸エステルは、小さな疎水性分子であり、腫瘍を有する動物の生存を延長することができる。ジャスモン酸エステルは、in vitroおよびex vivoの両方で、癌患者由来の細胞の癌細胞株に対する細胞毒性を示した。重要なことに、ジャスモン酸エステルは、正常細胞によりも癌細胞に対して選択的な毒性を有する。白血病細胞株Molt−4では、ジャスモン酸メチル(MJ)の細胞傷害性は、転写非依存性かつ翻訳非依存性であることが示された。さらに、ジャスモン酸エステルは、薬剤耐性の表現型を克服し、抗転移効果を示した(非特許文献5;非特許文献6;非特許文献7;非特許文献8;非特許文献9)。
【0006】
哺乳類の癌治療のためのジャスモン酸エステルの使用は、特許文献4で開示されている。具体的には、ジャスモン酸エステルは、乳癌、前立腺癌、皮膚癌および血液癌由来の種々のヒト癌細胞に対して直接的な細胞毒性を有することが示された。ジャスモン酸エステルは、ヒト白血病Molt−4細胞死を誘発する一方、正常リンパ球を損傷しない。特に、ジャスモン酸メチルは、マウスにおけるリンパ腫細胞の発生を阻害するのに有効であることが示された(非特許文献5)。さらに、特許文献5によれば、ジャスモン酸エステルは、健常赤血球を損傷しない。
【0007】
特許文献6は、新規なハロゲン化ジャスモン酸エステル誘導体、これを含む医薬組成物、ならびに癌細胞増殖の減少および癌治療のための当該医薬組成物の使用を開示する。
【0008】
特許文献7および特許文献8は、ジャスモン酸エステル化合物の化学的誘導体、その調製方法、これを含む医薬組成物、ならびにこれらの化合物および組成物の(特に、哺乳類(とりわけヒト)の癌治療の化学療法薬としての)使用方法を開示する。
【0009】
近年では、ジャスモン酸エステルは、いくつかの異なる癌細胞株の癌細胞におけるミトコンドリアおよび、慢性リンパ性白血病患者のリンパ球の癌細胞におけるミトコンドリアに直接影響することが示されている。ジャスモン酸エステルが作用する提案機構は、PTPCを介し、電位依存性アニオンチャネルを経由するというものであり、当該チャネルの開口がジャスモン酸エステルによるミトコンドリア機能不全を誘導することが見出された(非特許文献10;非特許文献11)。対照的に、ジャスモン酸エステルは、毒性を示さず、正常リンパ球および非形質転換の3T3細胞におけるミトコンドリア機能不全も誘導しない(非特許文献5;非特許文献10)。
【0010】
電位依存性アニオンチャネルおよびその変異体をコードするポリヌクレオチド、ならびに、ペプチド断片、ペプチド誘導体および類似体を含む電位依存性アニオンチャネル組成物が特許文献9に開示されている。特許文献9は、電位依存性アニオンチャネル組成物をアポトーシス制御のために使用する方法を開示している。
【0011】
癌細胞におけるミトコンドリアの成分および機能は、正常細胞と比較して、PTPC構成成分、膜電位およびATP産生を含む多くの面で異なる(非特許文献1)。これらの相違点が、癌細胞に対するジャスモン酸エステルの選択的活性の原因となっているのかもしれない。ジャスモン酸エステルは、癌細胞におけるATP細胞内含有量の著しい低下を引き起こすことも示された。この低下は、正常細胞では検出されない(非特許文献6;非特許文献7;非特許文献12)。さらに、ジャスモン酸メチルの細胞毒性効果に対する特定の細胞型の感受性と、その細胞で誘導されたATP欠乏の度合の間に正の相関が存在することが見出された(非特許文献12)。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,854,067号明細書
【特許文献2】米国特許第5,891,717号明細書
【特許文献3】米国特許第6,140,067号明細書
【特許文献4】米国特許第6,469,061号明細書
【特許文献5】国際公開第02/080890号パンフレット
【特許文献6】国際公開第05/054172号パンフレット
【特許文献7】国際公開第07/066336号パンフレット
【特許文献8】国際公開第07/066337号パンフレット
【特許文献9】国際公開第06/095347号パンフレット
【非特許文献】
【0013】
【非特許文献1】Mathupala S.P.、Ko Y.H.、およびPedersen P.L.(2006)。Hexokinase II:Cancer’s double−edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria。Oncogene 25:4777〜4786。
【非特許文献2】Galuzzi L.、Larochette N.、Zamzami N.、およびKroemer G.(2006)。Mitochondria as therapeutic targets for cancer chemotherapy。Oncogene 25,4812〜4830。
【非特許文献3】Ishii Y.、Kiyota H.、Sakai S.、およびHonma Y.(2004)。Induction of differentiation of human myeloid leukemia cells by jasmonates,plant hormones。Leukemia 18、1413〜1419。
【非特許文献4】Kim J.H.、Lee S.Y.、Oh S.Y.、Han S.I.、Park H.G.、Yoo M.A.、およびKang H.S.(2004)。Methyl jasmonate induces apoptosis through induction of Bax/Bcl−XS and activation of caspase−3 via ROS production in A549 cells。Oncol.Rep.12、1233〜1238。
【非特許文献5】Fingrut O.、およびFlescher E.(2002)。Plant stress hormones suppress the proliferation and induce apoptosis in human cancer cells。Leukemia 16,608〜616。
【非特許文献6】Fingrut O.、Reischer D.、Rotem R.、Goldin N.、Altboum I.、Zan−Bar I.、およびFlescher E.(2005)。Jasmonates induce nonapoptotic death in high−resistance mutant p53−expressing B−lymphoma cells。Br.J.Pharmacol.146,800〜808。
【非特許文献7】Heyfets A.、およびFlescher E.(2007)。Cooperative cytotoxicity of methyl jasmonate with anti−cancer drugs and 2−deoxy−d−glucose。Cancer Lett.50、300〜310。
【非特許文献8】Flescher E.(2005)。Jasmonates−a new family of anti−cancer agents。Anticancer Drugs 16,911〜916。
【非特許文献9】Reischer D.、Heyfets A.、Shimony S.、Nordenberg J.、Kashman Y.、およびFlescher E.、(2007)。Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma。Br.J.Pharmacol.150、738〜749。
【非特許文献10】Rotem R.、Heyfets A.、Fingrut O.、Blickstein D.、Shaklai M.、およびFlescher E.(2005)。Jasmonates:novel anticancer agents acting directly and selectively on human cancer cell mitochondria。Cancer Res.65,1984〜1993。
【非特許文献11】Robey R.B.、およびHay N.(2006)。Mitochondrial hexokinases,novel mediators of the antiapoptotic affects of growth factors and Akt。Oncogene 25、4683〜4696。
【非特許文献12】Goldin N.、Heyfets A.、Reischer D.、およびFlescher E.(2007)。Mitochondria−mediated ATP depletion by anti−cancer agents of the jasmonate family。J. Bioenerg.Biomemb.39,51〜57。
【発明の概要】
【発明が解決しようとする課題】
【0014】
抗腫瘍活性を有する薬物候補の同定のための高信頼性のアッセイに対して、未だ対処されていないニーズが残っている。このようなアッセイは、公知の抗癌療法の有害な副作用をほとんど伴わず、有効な抗癌剤を同定するために使われ得るものである。さらに、成立した腫瘍の進行の予防もしくは退縮の誘導における改善された結果を生じ、または転移を予防する新規な治療剤についての未だ対処されていないニーズがある。
【課題を解決するための手段】
【0015】
本発明は、天然または合成のジャスモン酸エステルと特定の特異的標的分子の相互作用に基づくアッセイを提供する。特に、本発明は、候補薬物分子の活性をヘキソキナーゼをミトコンドリアから解離することが知られる、あるジャスモン酸エステルの活性と比較することによって、候補薬物分子の抗腫瘍効果を判定するためのアッセイを開示する。このアッセイによって同定された抗癌性薬物候補分子、および当該分子を癌細胞の増殖を阻害するために用いる方法も同様に開示される。
【0016】
本発明は、部分的に、ヘキソキナーゼおよびその電位依存性アニオンチャネルとの結合体がジャスモン酸エステルの分子標的を構成するという予期せぬ発見に基づく。本発明において、初めて、ジャスモン酸メチル(MJ)がヘキソキナーゼをミトコンドリアから解離させ、MJが直接的にヘキソキナーゼに結合することで、電位依存性アニオンチャネルへのヘキソキナーゼ結合に干渉することが開示された。さらに、ジャスモン酸メチルはミトコンドリアに結合するヘキソキナーゼのみを撹乱するため、正常細胞の代謝にはほとんど影響しない。
【0017】
第一の態様によれば、本発明は、ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合のうち少なくとも1つにおいて、化合物の活性と抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体の活性を比較することを含む、抗腫瘍効果を有する化合物を同定するためのアッセイであって、当該化合物の活性が、ジャスモン酸エステル誘導体の活性と比較して同等またはジャスモン酸エステル誘導体より高いときは、当該化合物の抗腫瘍効果を示すアッセイを提供する。
【0018】
第二の態様では、本発明は、化合物をミトコンドリアを含む無細胞系に導入し、ヘキソキナーゼのミトコンドリアからの解離を誘導する化合物の能力を測定し、当該化合物の存在下でのヘキソキナーゼの解離を、抗腫瘍活性を有することが知られる、同等の濃度のジャスモン酸エステル誘導体によって達成される解離を比較することを含む、抗腫瘍効果を有する化合物を同定するためのアッセイであって、当該化合物の存在下での解離が同等またはそれより大きいときは、当該化合物の抗腫瘍効果を示すアッセイを提供する。
【0019】
さらに別の態様では、本発明は、少なくとも1つのヘキソキナーゼのサブタイプへの化合物の直接的な結合を測定し、この結合を、同等の濃度の抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される結合を比較することを含み、当該化合物の存在下での結合が同等またはそれより大きいときは当該化合物の抗腫瘍効果を示す、抗腫瘍効果を有する化合物を同定するためのアッセイを提供する。現在の好ましい実施形態では、当該化合物は腫瘍細胞死を選択的に誘導する。
【0020】
ある実施形態によれば、抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体は、当該技術分野で公知のように、ジャスモン酸メチルまたは合成ジャスモン酸エステル誘導体である。
【0021】
他の実施形態では、本発明は、ジャスモン酸メチル以外のジャスモン酸エステル誘導体である、抗腫瘍効果を有する候補薬物分子の同定のためのアッセイを提供する。もう1つの実施形態では、本発明は、非ペプチド有機小分子である抗腫瘍効果を有する候補薬物分子の同定のためのアッセイを提供する。
【0022】
ある実施形態では、本発明は悪性細胞に対する高い特異性を有する小分子(例えば、非ペプチド分子)の同定のための優れたアッセイを提供する。ある実施形態によれば、当該小分子は、分子量が約2,000グラム/mol未満(すなわち、MWが約2000未満)であり、より好ましくは、約1,500グラム/mol未満(すなわち、MWが約1,500未満)であり、最も好ましくは約1,000グラム/mol未満(すなわち、MWが約1,000未満)である。本発明のアッセイで同定された化合物は、天然に存在するものであってもよいし、合成のものでもよく、または天然成分および合成成分の両方を含むことができる。
【0023】
従って、本発明は、候補薬物分子の抗腫瘍効果を判定するためのアッセイを提供する。さらに他の実施形態では、本発明は候補薬物分子の活性を、ジャスモン酸メチルの活性と、下記のうち少なくとも1つの点で比較することを含むアッセイによって同定した抗癌剤の候補分子を提供する:ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合。
【0024】
本発明のアッセイで同定された抗癌剤の候補分子は、その活性および有効性について、当該技術分野において公知のいずれの方法によっても試験できる。ある実施形態によれば、当該候補薬物は、経口投与に適した形態(例えば、液剤、懸濁剤、シロップ、乳剤、分散剤、懸濁剤、錠剤、丸剤、カプセル剤、ペレット、顆粒剤および散剤)、非経口投与に適した形態(例えば、静脈内、筋肉内、動脈内、経皮、皮下または腹腔内)、局所投与に適した形態(例えば、軟膏、ゲル、クリーム)、吸入投与に適した形態または坐薬による投与に適した形態で試験できる。
【0025】
ある実施形態では、本発明は、医薬組成物で投与される候補薬物を提供する。現在の好ましい実施形態では、本発明の候補薬物は、さらに薬理学的に許容できる担体または希釈剤を含む組成物として投与される。
【0026】
ある実施形態では、本発明はさらに、治療上有効な量の本願明細書に記載されるアッセイによって同定された化合物に癌細胞を接触させることを含む、癌細胞の増殖を阻害する方法を提供する。
【0027】
さらに、本発明は、本願明細書に記載されるように、被験者に治療上有効な量の本発明の化合物を投与することによる、被験者における癌治療の方法を提供する。ある実施形態では、当該化合物は医薬組成物として投与される。好ましくは、本発明の化合物は、薬理学的に許容できる担体または希釈剤をさらに含む組成物として投与される。
【0028】
他の実施形態によれば、本発明のアッセイで同定された化合物は、下記を含む(しかしこれらに限定されない)種々の癌に対して有効である:細胞腫、肉腫、腺腫、肝細胞癌、肝芽腫、横紋筋肉腫、食道癌、甲状腺癌、ガングリオン細胞芽腫、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、滑膜腫、ユーイング肉腫、平滑筋肉腫、ラブドセリオサルコーマ(rhabdotheliosarcoma)、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、腎細胞癌、血腫、胆管癌、黒色腫、絨毛癌、精上皮腫、胚性癌腫、ウィルムス腫瘍、子宮頚癌、精巣腫瘍、肺癌、小細胞および非小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、網膜芽細胞腫、多発性骨髄腫、直腸癌、甲状腺癌、頭頚部癌、脳癌、末梢神経腫瘍、中枢神経腫瘍、神経芽細胞腫、子宮内膜癌、リンパ増殖性疾患、全種類の白血病細胞を含む造血器腫瘍およびリンパ腫(急性骨髄性白血病、急性骨髄球性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病、肥満細胞白血病、多発性骨髄腫、骨髄リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫を含む)、ならびに上記全ての転移。
【0029】
もう1つの態様によれば、本発明は、癌細胞の増殖の阻害のための本発明のアッセイによって同定された化合物を含む医薬組成物を提供する。ある実施形態では、当該医薬組成物は、さらに薬理学的に許容できる担体または希釈剤を含む。他の実施形態では、本発明は、癌治療のための本発明のアッセイによって同定された化合物を含む医薬組成物を提供する。
【0030】
さらにもう1つの態様によれば、本発明は、被験者における癌細胞の増殖の阻害のための本発明のアッセイによって同定された化合物の使用に関する。他の実施形態では、癌治療のための本発明のアッセイによって同定された化合物の使用も本発明の範囲内である。1つの実施形態では、当該被験者は哺乳類、好ましくはヒトである。
【0031】
本発明のさらなる実施形態および適用性の全範囲は、下記の詳細な説明から明らかになるであろう。しかし、本発明の精神および範囲中の様々な変更および改変は、当該詳細な説明から当業者に明らかとなるため、詳細な説明および具体的な実施例は、本発明の好ましい実施形態を示してはいるものの、例証する目的のみで示されることは理解されるはずである。
【図面の簡単な説明】
【0032】
【図1A】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。ジャスモン酸メチル(MJ;3mM)は、ヘキソキナーゼを時間依存的様式で解離する。
【図1B】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。ジャスモン酸メチル(MJ)は、用量依存的様式で、30分間のインキュベーションの間、ヘキソキナーゼを解離する。0.5mM G6Pを陽性対照とした。
【図1C】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。同様の実験からミトコンドリア分画の上清を回収し、SDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた。
【図2A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。Molt−4細胞のミトコンドリア分画。
【図2B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。BCL−1のミトコンドリア分画。
【図2C】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。B16腫瘍のミトコンドリア分画。
【図2D】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図2E】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図2F】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図3】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画から単離したチトクロムcの時間依存的な遊離を引き起こす。ミトコンドリア分画を、3mM ジャスモン酸メチル(MJ)で、表示された時間処理し、ペレットにした。遊離したチトクロムcを特異的抗体で調べた。
【図4A】ジャスモン酸メチル(MJ)は、細胞のATPを、60分間の曝露で枯渇させた。CT26細胞(中塗りの四角)、Molt−4細胞(中塗りの菱形)、B16細胞(白抜きの三角)およびBCL1細胞(白抜きの円)を表示されたジャスモン酸メチル(MJ)濃度に曝露し、細胞のATPレベルを測定した。
【図4B】ジャスモン酸メチル(MJ)は、細胞のATPを、60分間の曝露で枯渇させた。CT26細胞(左)およびMolt−4細胞(右)をジャスモン酸メチル(MJ;3mM)に曝露した。トリパンブルー色素排除アッセイ試験の後、細胞数を計測した。白色および青色は、それぞれ生細胞および死細胞を示している。
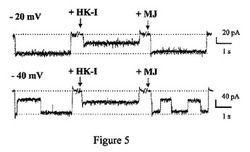
【図5】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ−I−電位依存性アニオンチャネルの相互作用を撹乱する。電位依存性アニオンチャネルは脂質平面二重層に再構成した。0から−20mVまたは−40mVの電圧ステップに対する電流を、ヘキソキナーゼ−I(HK−I;20mU/ml)の添加前および添加10分後に記録した。表示されたように、ジャスモン酸メチル(MJ;3mM)を添加し、電流を10分後に記録した。
【図6A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸メチルは、ヘキソキナーゼに用量依存的様式に結合している。番号1は、6mM MJを示している。番号2は3mM MJを示している。番号3は1.5mM MJを示している。番号4は0.75mM MJを示している。灰色の線は0.375mM MJを示している。
【図6B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸メチルはヘキソキナーゼに結合するが、Rb IgGには結合しない。番号1は6mM MJを示している。番号2は3mM MJを示している。番号3および番号4はRb IgGを示している。
【図6C】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸(JA)はヘキソキナーゼには結合しない。番号3は6nM JAを示している。番号4は3mM JAを示している。6mM MJ(番号1)および3mM MJ(番号2)は、陽性対照として供した。実線および点線の矢印は、それぞれ、分析物の注入の開始点および終点を示している。
【図7A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼをマウスの脳のミトコンドリア分画から解離させる。MJ(3mM)は、時間依存的様式で、ヘキソキナーゼを解離する。
【図7B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼをマウスの脳のミトコンドリア分画から解離させる。MJはヘキソキナーゼを、30分間のインキュベーションで、用量依存的様式で、解離させる。G6Pを陽性対照として供した。
【図8A】ジャスモン酸メチル(MJ)は、マウスの脳のミトコンドリア分画の膨潤を引き起こすが、マウスの肝臓のミトコンドリア分画の膨潤は引き起こさない。マウスの脳のミトコンドリア分画。
【図8B】ジャスモン酸メチル(MJ)は、マウスの脳のミトコンドリア分画の膨潤を引き起こすが、マウスの肝臓のミトコンドリア分画の膨潤は引き起こさない。マウスの肝臓のミトコンドリア分画。ジャスモン酸メチル(MJ;1mM、四角)、ジャスモン酸(JA;1mM、三角)、またはバッファー(円)をミトコンドリアに投与し、光学密度をモニターした。タキソール(70μM、星印)を陽性対照として供した(Varbiro、2001)。
【図9A】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。ATP測定の前の、ジャスモン酸メチル(MJ)曝露。
【図9B】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。細胞傷害測定の前の、ジャスモン酸メチル(MJ)曝露。
【図9C】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。細胞傷害測定の前の、スタウロスポリン曝露。データは、3回反復したうちの代表である。
【図10】ジャスモン酸メチルと比較した場合の新規化合物によるヘキソキナーゼ解離能の比較は、腫瘍細胞死を引き起こす新規化合物の能力を示している。各化合物のヘキソキナーゼ解離活性(縦軸)と、そのMolt−4細胞に対する細胞傷害性についてのIC50(横軸)の間の相関。A〜Fは、6つの異なるジャスモン酸エステル誘導体を示している。MJ=ジャスモン酸メチル。直線的相関性を分析し、R2因子を用いて評価した。
【発明を実施するための形態】
【0033】
本発明は、特異的細胞内標的に基づく新規なアッセイであって、あるジャスモン酸エステルが細胞代謝を妨害し、それによって、正常細胞集団に著しい悪影響を及ぼすことなく特異的に悪性細胞死を引き起こすという発見に基づくアッセイを提供する。本発明は、さらに、これらの新規に同定された細胞内の標的を通じて特異的抗癌活性を発現する新規な小分子を同定し、選択するためのアッセイを提供する。
【0034】
1つの実施形態では、本発明は、重要な新しいクラスの選択的な抗癌剤としてのジャスモン酸エステルに関する。いずれの作用の理論または機構とも結び付けられることなく、ジャスモン酸エステルは、少なくとも部分的には、ミトコンドリアのヘキソキナーゼおよび細胞基質の解糖系を含む他のATP生成経路の撹乱を介して作用すると思われると考えられた。ジャスモン酸メチルの細胞毒性効果に対する所定の細胞型の感受性と、その結果としてその細胞で誘導されたATPの減少の間の正の相関は、ピルビン酸塩およびオリゴマイシン(それぞれ、酸化的リン酸化の基質および阻害剤)に非依存的であることが見出された。このことは、ミトコンドリアのATP生成へのジャスモン酸メチルの効果は強力であり不可逆的であることを示唆している。逆に、解糖基質のグルコースは、ジャスモン酸メチルに誘導されたATPの低下に対する保護作用を示したが、他方で、解糖阻害剤2−デオキシグルコースは、ジャスモン酸メチルと組み合わせた場合、相乗効果を示した(Fingrut、2005;Heyfets、2007)。
【0035】
ジャスモン酸エステルによって誘導された細胞死に関する経路を同定することで、ジャスモン酸エステルが抗癌剤として有効である臨床状況の選択が可能となり、また、臨床医がその潜在的副作用を評価することが可能となる。さらに、これらの抗癌剤が相互作用する標的分子の同定により、より強力なジャスモン酸エステル誘導体の合理的設計、および同一または類似の標的分子と相互作用する他の有機小分子の特徴づけまたは設計が可能となる。
【0036】
1つの態様によれば、本発明は、候補薬物分子の活性をジャスモン酸メチルの活性と、下記のうち少なくとも1つの点で比較することを含む、候補薬物分子の抗腫瘍効果の判定のためのアッセイを提供する;ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合の阻害、およびヘキソキナーゼへの直接的な結合の阻害。さらに、本発明は、非ペプチド有機小分子の有効な抗腫瘍効果についてのアッセイを提供する。
【0037】
もう1つの態様によれば、本発明は、本発明において開示されたいずれか1つのアッセイによって同定された抗癌剤の候補分子を提供する。抗癌剤の候補分子は、続いて、当該技術分野におけるいずれの公知の方法によっても、活性および有効性を試験し得る。
【0038】
他の実施形態によれば、当該候補薬物は、経口投与(例えば、液剤、懸濁剤、シロップ、乳剤、分散剤、懸濁剤、錠剤、丸剤、カプセル剤、ペレット、顆粒剤および散剤)、非経口投与(例えば、静脈内、筋肉内、動脈内、経皮、皮下または腹腔内)、局所投与(例えば、軟膏、ゲル、クリーム)、吸入投与または坐薬による投与に適した形態で試験できる。
【0039】
さらに、当該候補薬物は、さらにいずれの許容できる希釈剤および/または担体を含む医薬組成物として試験できる。担体は、従来用いられてきたいずれのものでもよく、好ましい投与経路に応じて選択し得る。例となる適切な担体には、ラクトース、グルコース、ブドウ糖、スクロース、ソルビトール、マンニトール、澱粉、アカシアゴム、リン酸カルシウム、アルギン酸塩、トラガント、ゼラチン、ケイ酸カルシウム、結晶セルロース、ポリビニルピロリドン、セルロース、水およびメチルセルロースが含まれるが、これらに限定されない。候補薬物には、さらに、滑沢剤(タルク、ステアリン酸マグネシウムおよび鉱油など)、湿潤剤(wetting agents)、界面活性剤、乳化剤および懸濁剤、保存剤(ヒドロキシ安息香酸メチルおよびヒドロキシ安息香酸プロピルなど)、甘味剤、香味剤、着色料、緩衝剤(例えば、酢酸塩、クエン酸塩またはリン酸塩)、崩壊剤、湿潤剤(moistening agents)、抗菌剤、抗酸化剤(例えば、アスコルビン酸または亜硫酸水素ナトリウム)、キレート化剤(例えば、エチレンジアミン四酢酸)および浸透圧の調整のための薬剤(塩化ナトリウムなど)が含まれ得る。他の医薬担体は、滅菌液(水、および石油、動物、植物または合成起源の油(ピーナッツ油、大豆油、鉱油、ゴマ油など)を含む油など)、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の合成溶剤であり得る。水は、医薬組成物が静脈内に投与される場合に、好ましい担体である。生理食塩水およびブドウ糖水溶液およびグリセロール溶液もまた、液体担体として、特に、注射液に利用できる。
【0040】
本発明はさらに、癌細胞を、本願明細書に記載されるアッセイによって同定された、治療上有効な量の化合物に接触させることを含む、癌細胞の増殖を阻害する方法を提供する。「癌細胞の増殖の阻害」という用語は、本発明の構成においては、下記のうち少なくとも1つの減少を意味する:対照と比較した細胞数(壊死性、アポトーシス性または他のいずれの種類の細胞死またはそれらの組み合わせでもよい細胞死による);細胞増殖率の減少、すなわち、細胞数の総数は増加し得るが、対照における増加よりも低いレベルまたは低い割合である;細胞の総数が変化しなくとも、対照と比較した場合の細胞の感染度の減少(例えば、軟寒天アッセイによる判定による);分化の遅れた細胞型から分化の進んだ細胞型への進行;腫瘍化の減速;あるいは、1つの段階から次段階への癌細胞の進行緩徐化。
【0041】
さらに、本発明は、被験者に、本願明細書に記載される本発明のアッセイ系によって同定された化合物を、治療上有効な量投与することによる、被験者における癌治療の方法を提供する。本発明の構成における「癌治療」という用語は、下記のうち少なくとも1つを含む:癌の成長率の減少(すなわち、依然として増殖しているが、より遅い速度である癌);腫瘍増殖の増殖休止、すなわち、腫瘍増殖の停止、および、好ましくは、腫瘍の減少または大きさの縮小。この用語はまた、転移数の減少、形成される新しい転移数の減少、1つの段階から他の段階への癌の進行の緩徐化、および癌によって誘導された血管新生の減少、を含む。最も好ましくは、腫瘍は完全に除去される。さらにこの用語に含まれるのは、治療を受けている被験者の生存期間の延長、疾病進行の時間の延長、腫瘍退縮などである。この用語はまた、予防状態の予防、または腫瘍の収縮に感受性のある個体の予防を含む。
【0042】
本願明細書で用いられる「治療上有効な量」とは、化合物を投与された被験者に対して薬効を呈するのに十分な化合物の量を意味する。本発明の構成における「癌」という用語は、固形腫瘍または非固形腫瘍の形態の全種類の新生物を含み、悪性および前悪性の病態をともに含み、これらの転移を含む。癌は2つの方法で分類され得る。癌が生じた組織の種類(組織型)によるもの、および原発部位または癌が最初に生じた身体における部位によるもの、である。組織学の分類および命名法の国際標準は、国際疾病分類−腫瘍学、第3版である。
【0043】
本発明のアッセイで同定された化合物は、広範囲な癌(細胞腫、肉腫、腺腫、肝細胞癌、肝芽腫、横紋筋肉腫、食道癌、甲状腺癌、ガングリオン細胞芽腫、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、滑膜腫、ユーイング肉腫、平滑筋肉腫、ラブドセリオサルコーマ(rhabdotheliosarcoma)、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、腎細胞癌、血腫、胆管癌、黒色腫、絨毛癌、精上皮腫、胚性癌腫、ウィルムス腫瘍、子宮頚癌、精巣腫瘍、肺癌、小細胞および非小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、網膜芽細胞腫、多発性骨髄腫、直腸癌、甲状腺癌、頭頚部癌、脳癌、末梢神経腫瘍、中枢神経腫瘍、神経芽細胞腫、子宮内膜癌、リンパ増殖性疾患、全種類の白血病細胞を含む造血器腫瘍、および、リンパ腫(急性骨髄性白血病、急性骨髄球性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病、肥満細胞白血病、多発性骨髄腫、骨髄リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫を含む)、ならびに上記全ての転移を含むが、これらに限定されない)に対して有効である。
【0044】
本発明の範囲には、癌細胞の増殖の阻害方法、および哺乳類に本願明細書で開示されたアッセイによって同定された化合物を治療上有効な量投与することによる、哺乳類の癌の治療方法が含まれる。1つの実施形態では、当該哺乳類はヒトである。しかし、本発明はまた、本発明の化合物を非ヒト哺乳類、例えば、動物用医薬品において用いることを意図する。
【0045】
本発明は、悪性細胞に対して高い特異性を有する非ペプチド小分子の同定のための優れたアッセイを提供する。本願明細書において用いる「小分子」は、分子量が約2,000グラム/mol未満(すなわち、MWが約2,000未満)、さらに好ましくは約1,500グラム/mol未満(すなわち、MWが約1,500未満)、最も好ましくは約1,000グラム/mol未満(すなわち、MWが約1,000未満)である組成物または化合物を指すことを意味する。本発明のアッセイで同定された化合物は、天然に存在するものであってもよいし、合成のものでもよく、または天然成分および合成成分の両方(炭水化物、脂質および他の非ペプチド有機分子を含むが、これらに限定されない)を含むことができる。1つの実施形態では、本発明の方法によって同定される新規な小分子は、これらを発見するためのアッセイに用いた基準ジャスモン酸エステル誘導体化合物よりも強力である。従って、これらは、悪性細胞に対して高度の特異性を有する細胞毒性効果を示す。
【0046】
本発明の原理は、下記の非限定的な実施例によって示される。
【実施例】
【0047】
(材料)
全ての試薬は、特に明記しない限り、シグマケミカルズ社(Sigma Chemicals)(米国、ミズーリ州、セントルイス)から購入した。ジャスモン酸メチル(MJ)およびジャスモン酸(JA)を、エタノールに溶解し、500mM ストック溶液を得た。さらに、培養培地またはアッセイバッファーで希釈した。試験におけるエタノールの最終濃度は、0.6%は超えなかった。表面プラズモン共鳴実験のため、ジャスモン酸メチルをDMSOで希釈し、500mM ストック溶液を得た。タキソールを米国ミードジョンソン社(MeadJohnson)から購入した。ヒドロキシアパタイト(Bio−Gel HTP)をバイオラッド ラボラトリーズ社(Bio−Rad Laboratories)(米国、カリフォルニア州、ハーキュリーズ)から購入した。セライトをBDH社(英国、ドーセット州、プール)から購入した。PEGFP プラスミドをクロンテック社(Clontech)(米国、カルフォルニア州)から購入した。PcDNA3.1 プラスミドをインビトロジェン社(米国、カルフォルニア州)から購入した。PcDNA3.1 HKIIは、J.E.Wilson博士(ミシガン大学)のご厚意により提供を受けた。
【0048】
(動物)
メスのウィスターラット、およびオスのICRマウスを脳および肝臓の抽出のために用いた。オスのBALB/cおよびC57BLマウス(7〜8週齢)は、テルアビブ大学(イスラエル)における、繁殖コロニーから得て、BCL1白血病細胞、B16腫瘍およびCT26腫瘍を増殖させるために用いた。動物の飼育および実験は、テルアビブ大学のガイドラインに従って行い、施設内動物実験および飼育委員会の承認を受けた。マウスは、ケージ内で、標準飼料および飼育条件下で飼育した。
【0049】
(癌細胞株および腫瘍)
CT26マウス結腸癌細胞株、B16マウス黒色腫細胞株、BCL1マウスB細胞白血病細胞株およびMolt−4ヒトTリンパ性白血病細胞株は、ATCC(米国、メリーランド州、ロックビル)から購入した。細胞は、加湿した環境下で、37℃、5%CO2で維持した。CT26細胞およびB16細胞を、10% FCS、2mM L−グルタミン、100U ml−1 ペニシリン、100μg ml−1 ストレプトマイシン、1mM ピルビン酸ナトリウムおよび1:100希釈の非必須アミノ酸(全て、バイオロジカル インダストリーズ社(Biological Industries)、イスラエル、から購入した)を添加したダルベッコ変法イーグル培地(バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック(Beit−Haemek))で維持した。Molt−4およびBCL1細胞を、10% FCS、2mM L−グルタミン、100U ml−1 ペニシリンおよび100μgml−1 ストレプトマイシンを添加したRPMI−1640培地(バイオロジカル インダストリーズ社、イスラエル)で維持した。
【0050】
BCL1細胞を、HeyfetsおよびFlescher(2007)が記載したように、BALB/cマウスの体内で増殖させた。BCL1細胞の抽出:100μl PBS中106 BCL1細胞(BCL1白血病を保有するBALB/cマウスから抽出したばかりのもの)を、マウスに対し、腹腔内(i.p.)に接種し、腫瘍を増殖させた。4週後、マウスを麻酔下で屠殺し、脾臓を抽出した。細胞を脾臓分散物によって抽出した。RBCを、RBC溶解バッファー(シグマ社)を用いて破壊した。固形腫瘍の調製:100μl PBS中106 CT26細胞またはB16細胞を両側腹部に皮下注射した。腫瘍を直径10〜12mmに達したところで、壊死の兆候のない状態で切除した。
【0051】
(細胞傷害測定)
細胞死をトリパンブルー色素排除アッセイによって判定した。所定の実験が完了した後、細胞を0.1% トリパンブルーで2〜5分間インキュベーションし、死細胞(染料を排除しない細胞)の割合を、顕微鏡下で測定した(Fingrut、2002)。もう1つの方法として、細胞傷害をヘマカラー染色を用いて判定した。所定の実験の完了後、細胞を染色し、死(解離した)細胞の割合(%)を分光光度的に測定した。
【0052】
(ATPレベルの測定)
CellTiter−Glo(商標)発光細胞生存率(Luminescent Cell Viability)アッセイ(プロメガ社、米国、ウィスコンシン州、マディソン)を用いた(Fingrut、2005)。所定の実験が完了した後、プレートを室温まで平衡化した。ルシフェリンおよびルシフェラーゼを含むCellTiter−Glo(商標)試薬を各ウェルに加え、プレートをオービタルシェーカー上で2分間混合し、細胞溶解を誘導した。ATP、Mg2+および酸素分子の存在下で、ルシフェリンの一酸化(mono−oxidation)がルシフェラーゼによって触媒され、発光シグナルを生じた。次いで、細胞を10分間、室温でインキュベーションし、発光シグナルを安定させた。発光を、コダック デジタルサイエンス イメージステーション 440CDを用いて記録した。発光は、ATP濃度に正比例していた。ATP欠乏(対照に対する%)を次の方法で算出した:{(対照細胞の発光−薬剤で処理した細胞の発光)/対照細胞の発光}×100。
【0053】
(ミトコンドリア分画の抽出)
ミトコンドリア分画を、機械的な溶解および分画遠心法によって調製した。全ての工程は、氷上で行った。細胞または抽出した組織は、PBSで洗浄し、0.1mM EDTAおよびプロテアーゼ阻害剤カクテル(シグマ社)を添加したばかりの抽出バッファー(250mM スクロース、10mM HEPES−NaOH、pH 7.2)中で均一化して破壊した。細胞または組織に、グラムあたり、4倍量の抽出バッファーを入れた。破砕物の量を抽出バッファーで2倍量にし、組織および細胞残渣ならびに核を、遠心分離(1,000g、10分間)でペレットにした。上清を、さらに13,000gで、10分間で2度回転させた。小胞体の層を除去した。ペレット(ミトコンドリア分画と命名)を適切なバッファー(ミトコンドリア分画を調製するアッセイによる)中で懸濁した。ミトコンドリア分画は、速やかに使用するか、または−196℃で保存した。
【0054】
(ヘキソキナーゼ解離アッセイ)
異なる薬剤によってミトコンドリア分画から解離されるヘキソキナーゼの量を測定するため、ミトコンドリアを着目している薬剤とともにインキュベーションし、遠心分離によってペレットにした。上清のヘキソキナーゼ活性(すなわち、解離したヘキソキナーゼの活性)を、340nmで分光光度的に測定した。反応は、ピルビン酸塩キナーゼによってADPがピルビン酸の形成のために消費され、乳酸脱水素酵素によってNADHでピルビン酸が還元され、ヘキソキナーゼによるADP形成に関係がある。簡単に言えば、ミトコンドリアをインキュベーションバッファー(20mM HEPES pH 7.4、0.25M スクロース、10mM グルコース、5mM KCl、10mM MgCl2;0.2mg/試験、100μL/試験)に懸濁し、下記に記載のようにインキュベーションした。ミトコンドリア結合ヘキソキナーゼを遠心分離(20,000g、10分間、4℃)で沈殿させた。上清分画のヘキソキナーゼ活性をピルビン酸キナーゼ(1U/ml)、乳酸脱水素酵素(1U/ml)、ATP(1mM)、ホスホ(エノール)ピルベート(1mM)、NADH(0.18mg/ml)を添加したばかりの反応バッファー(250μL;20mM HEPES pH 7.2、5mM MgCl2、5mM KCl、10mM グルコース)でアッセイした。これらの条件下では、アッセイ混合物に直接的に加えたジャスモン酸メチルもジャスモン酸もヘキソキナーゼ活性に影響しなかった。
【0055】
(ウエスタンブロット)
ヘキソキナーゼレベルの分析のため、上記のヘキソキナーゼ解離アッセイと同様に実験を行い、上清分画中の非結合のヘキソキナーゼをFingrut(2005)が記載したように抽出した。試料をドデシル硫酸ナトリウム・ポリアクリルアミドゲル(7%)電気泳動によって分離し、次いで、免疫ブロットを行った。ブロットは、特異的抗−HKI抗体または抗−HKII抗体(1:300、サンタクルーズバイオテクノロジー社(Santa−Cruz Biotechnology)、 米国、カルフォルニア州)を用いて調べた。ヘキソキナーゼ−抗体複合体をHRP標識抗体(1:10,000、サンタクルーズバイオテクノロジー社、米国、カルフォルニア州)で染色した。高感度化学発光(ECL)試薬(バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック)を加え、ブロットをECLフィルム(イーストマン コダック、米国、ニューヨーク州、ロチェスター)に曝露した。
【0056】
(ミトコンドリア分画から遊離したチトクロムcの測定)
単離したばかりのミトコンドリア分画(100μL中、最終濃度は2mg/ml)を37℃で、試験される薬剤(例えば、ジャスモン酸メチル)とともに、KClベースの呼吸バッファー(respiratory buffer)(150mM KCl、25mM NaHCO3、1mM MgCl2、3mM KH2PO4、20mM ヘペス、pH 7.4;Pastorino、2002)中でインキュベーションした。コハク酸カリウム(5mM)を呼吸基質として加えた(Azoulay−Zohar、2004)。チトクロムc遊離の測定のため、ミトコンドリア分画を20,000×gで10分間、4℃でペレットにした。ペレットを40分間、溶解バッファー(20mM トリス HCl、pH 8、137mM NaCl、2mM EDTA、pH 8、1% トリトンX−100、プロテアーゼ阻害剤カクテル:シグマ社)とともに氷上でインキュベーションした(Fingrut、2005)。ペレットライセートおよび上清を12% SDS−PAGEゲルで分離し、ニトロセルロース膜にエレクトロブロットした。チトクロムcを特異的抗体(1:1000、BDファーミンゲン社(BD PharMingen)、カリフォルニア州、サンディエゴ)で検出した。抗原抗体複合体を西洋わさびペルオキシダーゼ標識抗体(1:10,000、サンタクルーズバイオテクノロジー社、カリフォルニア州)および高感度化学発光(ECL)試薬(EZ−ECL、バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック)で染色し、ECLフィルム(イーストマンコダック社、米国、ニューヨーク州、ロチェスター)に曝露した。
【0057】
(ミトコンドリアの膨潤アッセイ)
単離したばかりのミトコンドリア分画を抽出バッファーで洗浄し、EDTAを除去し、5mM コハク酸カリウム、pH 7.2を添加したばかりの膨潤バッファー(220mM マンニトール、70mM スクロース、150mM トリス、pH 7.2、0.2mM KH2PO4、pH 7.2;100μL中に0.2mg)中で再懸濁した。各成分にはナトリウムは含まれない。試験される試薬(例えば、ジャスモン酸メチル)を加える前に光学密度を540nmの波長で2〜5分間モニターし、その後さらに20分間モニターした。
【0058】
(ヘキソキナーゼ精製)
ラット脳のHK−Iを下記のように精製し、強固に結合したHK−Iを含む粗製脳ミトコンドリアを1.2mM グルコース−6−リン酸および0.5mM K−EDTAとともにインキュベーションし、酵素を可溶性分画に遊離させた。さらに、HK−Iの精製をチバクロンブルーアガロース(ファルマシア社(Pharmacia))のアフィニティークロマトグラフィーで行った。精製した酵素を濃縮し、0.5mM K−EDTA、10mM グルコース、1mM ジチオスレイトールおよび10mM K−ヘペス、pH 7.8で、アミコン社(Amicon)の装置および50,000Da分子量カットオフ膜(スペクトラム社(Spectrum)、タイプC)を用いて洗浄した。濃縮した酵素(最大1mg/ml;30〜60ユニット/mg)を液体窒素中で凍結させ、使用まで−80℃で保存した(Azoulay−Zohar、2004)。
【0059】
(ジャスモン酸エステルとHKの相互作用についての表面プラズモン共鳴分析)
表面プラズモン共鳴(SPR)は金属表面における分子結合の現象を、局所的な屈折率の変化を検出することで測定する光バイオセンサー技術である。SPRは、固定化されたバイオ分子(リガンド)および溶液相の分析物の相互作用の研究に理想的な表面感作技術である。バイオセンサー反応は、結合分析物量に正比例する。小さい分子量の分析物の検討における、従来技術(蛍光または酵素結合免疫吸着アッセイなど)に対しての、SPRの利点は、分析物の標識または多段階の検出手順(サンドウィッチアッセイ)が必要でなく、無標識かつ直接的な分析物を検出することである。また、SPRは、広範囲な結合親和性について分析物を検出できる。
【0060】
ProteOn−EP5(バイオラッド社、米国、カルフォルニア州、ハーキュリーズ)システムを用いたSPRを、ジャスモン酸メチルとヘキソキナーゼの直接的な相互作用を検討するため用いた。このシステムにより、リガンドと分析物の相互作用を、6×6の型式で、リアルタイムで測定できる。精製したラット脳HKIおよびウサギ免疫グロブリンG(Rb IgG;リガンド)を、10mM 酢酸Na(それぞれ、pH 4および4.5)で希釈し、37.5mg/ml N−エチル−N’−(3’ジメチルアミノプロピル)カルボジイミド塩酸塩および7.5mg/ml N−ヒドロキシスクシンイミドで活性化したGLMセンサー表面に結合させた。HKIおよびIgGを、チップを100μg/mlに飽和させるために加えた。次いで、チップ上に残った反応基を1M エタノールアミン(pH 8.5)で不活性化した。飽和状態のヘキソキナーゼの基本的シグナルは、8200と9000相対的単位(RU)の間であり、Rb IgGでは〜10500RUである。ジャスモン酸メチルおよびジャスモン酸(分析物)を、ランニングバッファー(0.005% Tweenおよび5% DMSOを添加したPBS×1)に希釈し、センサーチップに、様々な濃度で注入した。全ての実験は、流量50μl/分、25℃で行った。結果は、少なくとも3実験のセンソグラムの代表である。最大の相対的単位は、約60RUである。シグナルは適切な陰性対照を用いて正規化した。
【0061】
(電位依存性アニオンチャネルの精製)
電位依存性アニオンチャネルを、Azoulay−Zohar(2004)が記載したように精製した。簡単に言えば、ラットの肝臓のミトコンドリア(200mgのタンパク質)を30分間、0℃(5mg/ml)で、10mM トリス、pH 7.0、0.15mM PMSF、0.5μg/ml ロイペプチンおよび0.05% ラウリル(ジメチル)アミンオキシド(LDAO)を含む溶液でインキュベーションした。44,000g、20分の遠心分離の後に、ペレットを2% LDAOを含む上記溶液で、5mg/mlに再懸濁した。44,000g、30分の遠心分離の後に、LDAOで抽出した電位依存性アニオンチャネルを乾燥したヒドロキシアパタイト/セライト(2:1、重量/重量)カラム(0.08g/mgのタンパク質)にアプライし、10mM トリス、pH 7.4、50mM NaCl、20mM リン酸ナトリウムおよび2% LDAOを含むバッファーで溶出した。電位依存性アニオンチャネルを含む分画(クマシーブルー染色によって同定)を回収し、10mM トリス、pH 7.4で5倍に希釈し、10mM トリス、pH 7.4、および0.5% n−オクチル β−D−グルコピラノシド(バヒェムAG社(Bachem AG))で前平衡化したCM−セルロースカラムに充填した。次いで、充填したカラムを同じ平衡化バッファーで洗浄し、電位依存性アニオンチャネルを0.4M NaClを含む同じバッファーで溶出した。
【0062】
(電位依存性アニオンチャネルの記録および分析)
電位依存性アニオンチャネルを脂質平面二重層(PLB)に再構成し、Azoulay−Zohar(2004)が記載したように記録し、分析した。簡単に言えば、PLBは、n−デカンに溶解した大豆アソレクチン(asolectin)(50mg/ml)から調製した。精製した電位依存性アニオンチャネル(約1ng)をシス側と定義した容器に加えた。1またはいくつかのチャネルをPLBに挿入した後、さらなる取り込みを阻害するために、シス側容器(cis chamber)を20容量の溶液で洗浄することで、過剰なタンパク質を除去した。電流を、電位固定下で、二重層電位 BC−525B 増幅器(ワーマー インスツルメンツ社(Wamer Instruments)、米国、コネティカット州、ハムデン)を用いて記録した。電流を膜のトランス側(接地)について測定した。電流を、1kHzで、ベッセルフィルタ(フレクエンシーデバイス社(Frequency Devices)、米国、マサチューセッツ州、ハーバーヒル)を用いて、ローパスフィルターにかけ、デジデータ(Digidata)1200−インターフェースボードおよびPCLAMP6 ソフトウェア(アクソンインスツルメンツ社(Axon Instruments Inc.)、米国、カルフォルニア州、ユニオンシティー)を用いてオンラインでデジタル化した。
【0063】
(形質移入実験)
CT26細胞に、FuGene HD形質移入試薬(ロシュ社(Roche)、スイス、バーゼル)を用いて、製造者の使用説明書に従い、pcDNA3−HKIIまたはpcDNA3を形質移入し、次いで、G418を用いた選択をした。
【0064】
(統計解析)
結果は、少なくとも3つの独立した実験の平均値±標準誤差として示した。統計的有意性は、ANOVA検定を用いて評価した。P<0.05を統計的に有意であるとみなし、それぞれのグラフ中でアスタリスクの印を付けた。
【0065】
(ヘキソキナーゼ−ミトコンドリア結合体は、ジャスモン酸メチルの分子標的である)
(実施例1)
ジャスモン酸メチルはヘキソキナーゼを癌細胞のミトコンドリア分画から解離する。ジャスモン酸メチルは、ミトコンドリアを、PTPC依存様式で直接的に撹乱させる(Rotem、2005)。ジャスモン酸メチルが、CT−26腫瘍から単離したミトコンドリア分画からヘキソキナーゼを解離させることができるかを判定するために、異なる時間で処理したミトコンドリア分画の上清のヘキソキナーゼ活性を測定した。CT−26腫瘍のミトコンドリア分画を、10、30または60分間、種々の試薬とともに、37℃でインキュベーションした。非結合のヘキソキナーゼ活性を測定し、自然に解離したヘキソキナーゼの活性(対照)と比較した。ジャスモン酸メチルは、ヘキソキナーゼを、時間依存的様式で解離した(図1A)。さらに、30分間のインキュベーションの間に行った分析は、ジャスモン酸メチルによるヘキソキナーゼの解離は用量依存的であることを示した(図1B)。逆に、ジャスモン酸メチルのより少ない細胞傷害性誘導体である、ジャスモン酸(Fingrut、2002)は、ミトコンドリア分画からのヘキソキナーゼの解離をそれほど示さなかった。
【0066】
ミトコンドリアのヘキソキナーゼの物理的な解離を確認するため、同様の調製物をSDS−PAGEで分離し、ニトロセルロース膜にエレクトロブロットし、抗−HKI抗体および抗−HKII抗体で調べた。HKIおよびHKIIの両方の遊離が示された(図1C)。
【0067】
ミトコンドリア分画からのヘキソキナーゼの解離は、CT−26結腸癌に限られない。異なる癌細胞から単離したミトコンドリア分画、すなわち、Molt−4細胞、BCL−1白血病細胞およびB16黒色腫を30分間、37℃でインキュベーションし、非結合のヘキソキナーゼの活性を測定し、自然に(対照)解離したヘキソキナーゼの活性と比較した。ジャスモン酸メチルは、ヘキソキナーゼを3つの異なる癌細胞から単離したミトコンドリア分画から解離させた(図2A〜2C)。これらの実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた。ヘキソキナーゼの種々の癌細胞のミトコンドリア分画からの解離を、さらに確認した(図2D〜2F)。
【0068】
(実施例2)
ミトコンドリアの損傷およびATP欠乏は、ミトコンドリア分画からのヘキソキナーゼの遊離と同時に生じた。CT−26腫瘍から単離されたミトコンドリア分画からのチトクロムcの遊離は、ミトコンドリアからヘキソキナーゼを解離するために必要であったのと同じ期間内(15〜60分間)に生じた(図3)。ジャスモン酸メチルは、CT−26腫瘍の単離されたミトコンドリア分画からのチトクロムcの時間依存的な遊離を引き起こした。遊離を特異的抗体を用いて調べた。
【0069】
細胞のATPレベルと、ミトコンドリア分画からのヘキソキナーゼの遊離との間の相関を検討するため、異なる癌細胞、すなわち、Molt−4細胞、BCL−1白血病細胞およびB16黒色腫を種々の濃度のジャスモン酸メチルに曝露した。図4Aは、全ての3種の異なる癌細胞株が、60分間のジャスモン酸メチルへの曝露の間に、有意かつ用量依存的に細胞のATPの減少を呈することを示している。CT26細胞およびMolt−4細胞を、次いで、24穴プレートに播種した。CT26細胞を、一晩接着させた。細胞を、ジャスモン酸メチル(MJ;3mM)に、1時間曝露した。トリパンブルー色素排除アッセイ試験を行い、細胞数を計測した。過度のATP欠乏にも関らず、3mM ジャスモン酸メチルに曝露された細胞は、依然として60分後も生存した(図4B)。Molt−4細胞は、CT26腫瘍細胞に対して感度の上昇を示したが、両方の細胞株で、ATP欠乏が細胞死に先行して現れた。
【0070】
(実施例3)
ジャスモン酸メチルはヘキソキナーゼ−Iによって閉じられた脂質二重層に再構成された電位依存性アニオンチャネルを再開口する。哺乳類のHKIおよびHKIIは、電位依存性アニオンチャネルを通じてミトコンドリアの外膜に結合する(Azoulay−Zohar、2004;Robey、2006)。ジャスモン酸メチルの、脂質平面二重層に再構成された、精製したミトコンドリアの電位依存性アニオンチャネルのチャネル活性に対する効果を、電位固定下で検討した(Azoulay−Zohar、2004)。電位依存性アニオンチャネル活性のモニターは、ヘキソキナーゼおよび他の薬剤との、電位依存性アニオンチャネルの相互作用を試験する定法である(Shoshan−Barmats、2005)。電位依存性アニオンチャネルは、脂質平面二重層に再構成された。0から−20mVまたは−40mVの電圧ステップに対する電流を、0.5M NaClの対称溶液中で、ヘキソキナーゼ−I(HK−I;20mU/ml)の添加前および添加10分後に記録した。表示した時点で、3mM ジャスモン酸メチル(MJ)を加え、電流を10分後に記録した。破線は、零電流および最大電流レベルを示している(図5)。データは、3回反復したうちの代表である。濃度3mMのジャスモン酸メチルは、保持電位0mVから−40mVの電圧ステップに対する電位依存性アニオンチャネルを通る電流について何の効果も示さなかった。相対的に小さい膜電位(−20mV)では、コンダクタンスは、記録のうち120分までは一定のままだった(図5)。しかし、精製HK−Iを添加した場合、開口チャネルは低電導状態で安定した。電位依存性アニオンチャネルに対するHK−Iの上記効果は、ジャスモン酸メチルの添加によって逆転し、ヘキソキナーゼと電位依存性アニオンチャネルとの相互作用を撹乱するジャスモン酸メチルの能力を示している。再構成された電位依存性アニオンチャネルが−40mVに曝露されたとき、同様の結果が得られた。HK−Iは、電位依存性アニオンチャネルの閉鎖を促進させ、低電導状態で安定させた。同様に、ジャスモン酸メチルの添加は、HK−Iによって閉じられたチャネルを再開口させる(図5)。
【0071】
(実施例4)
ジャスモン酸メチルは、ヘキソキナーゼと、特異的かつ用量依存的様式で相互作用する。ジャスモン酸メチルの、ヘキソキナーゼとの可能性のある直接の相互作用を調べるため、リアルタイム表面プラズモン共鳴分析を行った。ジャスモン酸メチルは、精製ラット脳HKIに、用量依存的様式で結合することが見出された(図6A)。しかし、解離定数の決定は、ジャスモン酸メチルのランニングバッファーへの溶解性が制限されていたため、出来なかった。図6Bは、無関係なタンパク質のRb IgG(番号3および番号4)を、ヘキソキナーゼ(番号1および番号2)の代わりに用いることにより、結合の特異性を立証したことを示している。
【0072】
さらに、ジャスモン酸メチルの特異性を示すため、ジャスモン酸メチルよりも低い細胞傷害性を有し(Fingrut、2002;Fingrut、2005;Rotem、2005)、より少ない程度でミトコンドリアを撹乱し、かつ、ジャスモン酸メチルよりも、ヘキソキナーゼをミトコンドリア分画から解離するのには有効でないことが示された(図1C)ジャスモン酸を、同様の条件で試験した。図6Cは、ジャスモン酸は、ヘキソキナーゼに、これらの条件下では全く結合しなかったことを示している(番号3および番号4対番号1および番号2のジャスモン酸メチル)。従って、ジャスモン酸メチルは、ヘキソキナーゼと特異的な様式で相互作用する。
【0073】
(ヘキソキナーゼとミトコンドリアの相互作用の解離は、ジャスモン酸メチルに誘導されたミトコンドリア毒性および細胞傷害性を媒介する)
(実施例5)
ジャスモン酸メチルは、ヘキソキナーゼリッチなミトコンドリア中で膨潤を選択的に誘導する。ジャスモン酸メチルの結合ヘキソキナーゼ解離能と、ミトコンドリアの損傷との間の関係の一貫性を検討するため、ジャスモン酸メチルをマウスの脳内で、マウスの肝臓と比較して試験した。比較は、マウスの脳とマウスの肝臓におけるミトコンドリアのヘキソキナーゼ量の既知の差によって行った。当該技術分野では、脳のミトコンドリア分画は結合ヘキソキナーゼに富み、肝臓のミトコンドリア分画は基本的に結合ヘキソキナーゼを欠くということが実証されている(Wilson、1995)。第一に、ジャスモン酸メチルの、マウスの脳から単離されたミトコンドリア分画からヘキソキナーゼを解離する能力は、時間依存的および用量依存的の両方であることが示された(それぞれ図7Aおよび図7B)。ミトコンドリア分画は、10、30または60分間、37℃でインキュベーションした。非結合ヘキソキナーゼ活性を測定し、自然に(対照)解離されたヘキソキナーゼ活性と比較した。そのため、ジャスモン酸メチルが、マウスの脳および肝臓から単離されたミトコンドリア分画の膨潤を誘導する能力を試験した。上述の関係から予測されるように、ジャスモン酸メチルおよび、わずかな程度だがジャスモン酸は、脳のミトコンドリア分画の膨潤を引き起こすが(図8A)、肝臓のミトコンドリア分画の膨潤は引き起こさなかった(図8B)。
【0074】
(実施例6)
ヘキソキナーゼの過剰発現は、ジャスモン酸メチルで誘導された細胞傷害から保護する。ヘキソキナーゼの過剰発現の、ジャスモン酸メチルの作用に対する効果を検討するため、CT26細胞に、プラスミド、pcDNA3−HKIIまたはpcDNA3(それぞれ、過剰発現したヘキソキナーゼIIおよび対照プラスミドをコードしている)を形質移入した(Zaid、2005)。細胞を96穴プレートに播種し、接着させた。細胞をジャスモン酸メチルにATP測定(図9A)の前に60分間曝露し、ヘマカラー(hemacolor)法による細胞傷害測定の前に24時間曝露した(図9B)。図9Aおよび図9Bに示されるように、60分の細胞ATPレベルの枯渇、および一晩のジャスモン酸メチルによって誘導された細胞傷害はともに、細胞内で減少し、対照(白色)に比べ、ヘキソキナーゼII(灰色)の高発現を伴った。さらに、ヘマカラー法による細胞傷害測定の前に、3.75μM スタウロスポリン(陽性対照;Azoulay−Zohar、2004)に3時間曝露することによって誘導した細胞傷害は、同様に、ヘキソキナーゼIIの過剰発現によって減少した(図9C)。
【0075】
(実施例7)
ジャスモン酸メチルと比較した新規化合物によるヘキソキナーゼ解離は、腫瘍細胞死を引き起こす能力と相関した。ジャスモン酸メチルと比較した、新規化合物がミトコンドリアからヘキソキナーゼを解離させる能力と、ジャスモン酸メチルと比較した、腫瘍細胞死を引き起こす能力との間の相関を検討した。一連の、2000ダルトン未満の分子量を有する6種の有機的に合成された化合物(ジャスモン酸エステル誘導体)(化合物A、B、C、D、E、F)を、腫瘍細胞のミトコンドリアからヘキソキナーゼを解離させる能力について上述のように分析した。次いで、それらの化合物を、ジャスモン酸メチル(MJ)とともに、ヘキソキナーゼ解離を引き起こす能力について順序を付けた。
【0076】
これらの化合物の抗腫瘍活性は、さらに、Molt−4細胞に対する細胞傷害活性を分析することで、評価した。ヘキソキナーゼ解離と、順序付けた化合物A〜Fおよびジャスモン酸メチルの誘導された腫瘍細胞死の間との相関を、Molt−4細胞に対する細胞傷害性の関数としてヘキソキナーゼ解離活性をプロットして評価した。図10は、ジャスモン酸メチルと比較したこれらの化合物のヘキソキナーゼ解離能と、腫瘍細胞死を引き起こす能力との間の強い相関を示している。
【0077】
具体的な実施形態についての上述の記載は、本発明の一般的性質を完全に明らかにしているため、他者は、当業者における知識(本願明細書で引用した参考文献の内容を含む)を用いることで、過度の実験をすることなく、本発明の一般概念から逸脱することなく、このような具体的な実施形態を容易に改変および/または種々の応用例のために適合できる。従って、このような適合および改変は、本願明細書に示された教示および指針に基づき、開示された実施形態の均等物の意義および範囲に含まれることを意図する。本願明細書における表現または用語は、説明を目的とするものであって、限定するものではないため、本願明細書における用語または表現は当業者によって、本願明細書に示された教示および指針を踏まえて、当業者の知識と組み合わせて解釈されることになることが理解されるだろう。
【0078】
(参考文献)
Azoulay−Zohar H.、Israelson A.、Abu−Hamad S.およびShoshan−Barmatz V.(2004)。In self−defence:hexokinase promotes voltage−dependent anion channel closure and prevents mitochondria−mediated apoptotic cell death.Biochem.J.377,347〜355。
Fingrut O.、およびFlescher E.(2002)。Plant stress hormones suppress the proliferation and induce apoptosis in human cancer cells。Leukemia 16,608〜616。
Fingrut O.、Reischer D.、Rotem R.、Goldin N.、Altboum I.、Zan−Bar I.、およびFlescher E.(2005)。Jasmonates induce nonapoptotic death in high−resistance mutant p53−expressing B−lymphoma cells。Br.J.Pharmacol.146,800〜808。
Flescher E.(2005)。Jasmonates−a new family of anti−cancer agents。Anticancer Drugs 16,911〜916。
Galuzzi L.、Larochette N.、Zamzami N.、およびKroemer G.(2006)。Mitochondria as therapeutic targets for cancer chemotherapy。Oncogene 25,4812〜4830。
Goldin N.、Heyfets A.、Reischer D.、およびFlescher E.(2007)。Mitochondria−mediated ATP depletion by anti−cancer agents of the jasmonate family。J. Bioenerg.Biomemb.39,51〜57。
Heyfets A.、およびFlescher E.(2007)。Cooperative cytotoxicity of methyl jasmonate with anti−cancer drugs and 2−deoxy−d−glucose。Cancer Lett.50、300〜310。
Ishii Y.、Kiyota H.、Sakai S.、およびHonma Y.(2004)。Induction of differentiation of human myeloid leukemia cells by jasmonates,plant hormones。Leukemia 18、1413〜1419。
Kim J.H.、Lee S.Y.、Oh S.Y.、Han S.I.、Park H.G.、Yoo M.A.、およびKang H.S.(2004)。Methyl jasmonate induces apoptosis through induction of Bax/Bcl−XS and activation of caspase−3 via ROS production in A549 cells。Oncol.Rep.12、1233〜1238。
Mathupala S.P.、Ko Y.H.、およびPedersen P.L.(2006)。Hexokinase II:Cancer’s double−edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria。Oncogene 25:4777〜4786。
Pastorino J.G.、Shulga N.、およびHoek J.B.(2002)。Mitochondrial binding of hexokinase II inhibits Bax−induced cytochrome c release and apoptosis。J.Biol.Chem.277、7610〜7618。
Reischer D.、Heyfets A.、Shimony S.、Nordenberg J.、Kashman Y.、およびFlescher E.、(2007)。Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma。Br.J.Pharmacol.150、738〜749。
Robey R.B.、およびHay N.(2006)。Mitochondrial hexokinases,novel mediators of the antiapoptotic affects of growth factors and Akt。Oncogene 25、4683〜4696。
Rotem R.、Heyfets A.、Fingrut O.、Blickstein D.、Shaklai M.、およびFlescher E.(2005)。Jasmonates:novel anticancer agents acting directly and selectively on human cancer cell mitochondria。Cancer Res.65,1984〜1993。
Shoshan−Barmatz V.、およびIsraelson A.(2005)。The voltage−dependent anion channel in endoplasmic/sarcoplasmic reticulum:characterization, modulation and possible function。J Membr Biol.204、57〜66。
Varbiro G.、Veres B.、Gallyas F.、およびSumegi B. (2001)。Direct effect of Taxol on free redical formation and mitochondrial permeability transition。Free Radic.Biol.Med.31、548〜558。
Wilson J.E.(1995)。Hexokinases。Rev.Physiol.Biochem.Pharmacol.126、65〜198。
Zaid H.、Abu−Hamad S.、Israelson A.、Nathan I.、およびShoshan−Barmatz V.(2005)。The voltage−dependent anion channel−1 modulates apoptotic cell death。Cell Death Differ.12、751〜760。
【技術分野】
【0001】
本発明は、候補薬物分子の抗腫瘍効果の判定のためのアッセイに関する。本発明は、具体的には、ヘキソキナーゼに選択的に結合し、それによってこれらの酵素をミトコンドリアから解離させることを促進する化合物の同定方法、このような化合物を含む組成物、ならびに、高レベルのミトコンドリア結合ヘキソキナーゼによって特徴づけられる疾病および障害における細胞死を誘導するためのこのような組成物の使用方法に関する。
【背景技術】
【0002】
(ヘキソキナーゼ)
ヘキソキナーゼは、グルコースを酸化し、続いて、ミトコンドリアによって完全に代謝されて二酸化炭素およびATPを産生する化合物、または、貯蔵脂肪の合成に用いられる化合物を産生する一連の酵素反応に関与する解糖系における初期酵素かつ鍵酵素である。ヘキソキナーゼのアイソザイムI、IIおよびIIIは、電位依存性アニオンチャネルへ特異的に結合することで、ミトコンドリア外膜の外表面に、物理的に結合できる。この結合は、ミトコンドリアを介したアポトーシス細胞死を阻害することが公知である。癌細胞では、ミトコンドリア結合ヘキソキナーゼおよび電位依存性アニオンチャネルに結合したヘキソキナーゼ(主にI型およびII型)が過剰発現している。癌細胞におけるミトコンドリア結合ヘキソキナーゼレベルの上昇は、エネルギー供給の改善およびミトコンドリアを介した細胞死に対する保護によって、癌細胞の増殖率および癌細胞の生存において中心的役割を果たしていることが示唆されている。近年では、II型ヘキソキナーゼが、抗癌治療における有望な標的であることが示唆されている(非特許文献1)。
【0003】
ミトコンドリアは、ATPを産生でき、細胞代謝を制御できることが周知である。さらに、ミトコンドリアは細胞死の制御において重要な役割を果たす。悪条件に曝露した場合、ミトコンドリアの膜透過性遷移が惹起され得る。膜透過性遷移孔複合体(PTPC)は、三つの主要素、すなわち、アデニンヌクレオチドトランスロケーター、シクロフィリンDおよび電位依存性アニオンチャネルに支配される。PTPCの開口が遷延された場合、ミトコンドリア内膜電位の散逸、ミトコンドリアのマトリックスの浸透圧性膨潤、続いて、チトクロムcの遊離、および、ネクローシスまたはアポトーシスによる最終的な細胞死がもたらされる(非特許文献2)。
【0004】
特許文献1および特許文献2は、哺乳類細胞におけるヘキソキナーゼ酵素を阻害する組成物および方法を開示する。これらの参考文献には、トレハロース−6−リン酸の生成を刺激するタンパク質および、それぞれの遺伝子;ヘキソキナーゼ特異的リボザイムおよび、そのコンストラクトをコードする遺伝子;ならびに(例えば、ミトコンドリアからヘキソキナーゼを置換することによる)ヘキソキナーゼ活性を競合的に減少させる薬剤およびそれぞれの遺伝子、について記載されている。後者の薬剤には、不活性なヘキソキナーゼおよびミトコンドリアの結合機能を維持するその断片ならびに、さらにヘキソキナーゼ活性をグルコキナーゼ活性に置換するヘキソキナーゼ−グルコキナーゼキメラが含まれる。2型糖尿病のリスクを判定するための予測法における、変質したミトコンドリアの機能についての指標は、特許文献3に開示されている。
【0005】
(ジャスモン酸エステル)
ジャスモン酸エステルファミリーの植物ストレスホルモンは、抗癌能を備えていることが既に見出されている(非特許文献3;非特許文献4)。ジャスモン酸エステルは、小さな疎水性分子であり、腫瘍を有する動物の生存を延長することができる。ジャスモン酸エステルは、in vitroおよびex vivoの両方で、癌患者由来の細胞の癌細胞株に対する細胞毒性を示した。重要なことに、ジャスモン酸エステルは、正常細胞によりも癌細胞に対して選択的な毒性を有する。白血病細胞株Molt−4では、ジャスモン酸メチル(MJ)の細胞傷害性は、転写非依存性かつ翻訳非依存性であることが示された。さらに、ジャスモン酸エステルは、薬剤耐性の表現型を克服し、抗転移効果を示した(非特許文献5;非特許文献6;非特許文献7;非特許文献8;非特許文献9)。
【0006】
哺乳類の癌治療のためのジャスモン酸エステルの使用は、特許文献4で開示されている。具体的には、ジャスモン酸エステルは、乳癌、前立腺癌、皮膚癌および血液癌由来の種々のヒト癌細胞に対して直接的な細胞毒性を有することが示された。ジャスモン酸エステルは、ヒト白血病Molt−4細胞死を誘発する一方、正常リンパ球を損傷しない。特に、ジャスモン酸メチルは、マウスにおけるリンパ腫細胞の発生を阻害するのに有効であることが示された(非特許文献5)。さらに、特許文献5によれば、ジャスモン酸エステルは、健常赤血球を損傷しない。
【0007】
特許文献6は、新規なハロゲン化ジャスモン酸エステル誘導体、これを含む医薬組成物、ならびに癌細胞増殖の減少および癌治療のための当該医薬組成物の使用を開示する。
【0008】
特許文献7および特許文献8は、ジャスモン酸エステル化合物の化学的誘導体、その調製方法、これを含む医薬組成物、ならびにこれらの化合物および組成物の(特に、哺乳類(とりわけヒト)の癌治療の化学療法薬としての)使用方法を開示する。
【0009】
近年では、ジャスモン酸エステルは、いくつかの異なる癌細胞株の癌細胞におけるミトコンドリアおよび、慢性リンパ性白血病患者のリンパ球の癌細胞におけるミトコンドリアに直接影響することが示されている。ジャスモン酸エステルが作用する提案機構は、PTPCを介し、電位依存性アニオンチャネルを経由するというものであり、当該チャネルの開口がジャスモン酸エステルによるミトコンドリア機能不全を誘導することが見出された(非特許文献10;非特許文献11)。対照的に、ジャスモン酸エステルは、毒性を示さず、正常リンパ球および非形質転換の3T3細胞におけるミトコンドリア機能不全も誘導しない(非特許文献5;非特許文献10)。
【0010】
電位依存性アニオンチャネルおよびその変異体をコードするポリヌクレオチド、ならびに、ペプチド断片、ペプチド誘導体および類似体を含む電位依存性アニオンチャネル組成物が特許文献9に開示されている。特許文献9は、電位依存性アニオンチャネル組成物をアポトーシス制御のために使用する方法を開示している。
【0011】
癌細胞におけるミトコンドリアの成分および機能は、正常細胞と比較して、PTPC構成成分、膜電位およびATP産生を含む多くの面で異なる(非特許文献1)。これらの相違点が、癌細胞に対するジャスモン酸エステルの選択的活性の原因となっているのかもしれない。ジャスモン酸エステルは、癌細胞におけるATP細胞内含有量の著しい低下を引き起こすことも示された。この低下は、正常細胞では検出されない(非特許文献6;非特許文献7;非特許文献12)。さらに、ジャスモン酸メチルの細胞毒性効果に対する特定の細胞型の感受性と、その細胞で誘導されたATP欠乏の度合の間に正の相関が存在することが見出された(非特許文献12)。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,854,067号明細書
【特許文献2】米国特許第5,891,717号明細書
【特許文献3】米国特許第6,140,067号明細書
【特許文献4】米国特許第6,469,061号明細書
【特許文献5】国際公開第02/080890号パンフレット
【特許文献6】国際公開第05/054172号パンフレット
【特許文献7】国際公開第07/066336号パンフレット
【特許文献8】国際公開第07/066337号パンフレット
【特許文献9】国際公開第06/095347号パンフレット
【非特許文献】
【0013】
【非特許文献1】Mathupala S.P.、Ko Y.H.、およびPedersen P.L.(2006)。Hexokinase II:Cancer’s double−edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria。Oncogene 25:4777〜4786。
【非特許文献2】Galuzzi L.、Larochette N.、Zamzami N.、およびKroemer G.(2006)。Mitochondria as therapeutic targets for cancer chemotherapy。Oncogene 25,4812〜4830。
【非特許文献3】Ishii Y.、Kiyota H.、Sakai S.、およびHonma Y.(2004)。Induction of differentiation of human myeloid leukemia cells by jasmonates,plant hormones。Leukemia 18、1413〜1419。
【非特許文献4】Kim J.H.、Lee S.Y.、Oh S.Y.、Han S.I.、Park H.G.、Yoo M.A.、およびKang H.S.(2004)。Methyl jasmonate induces apoptosis through induction of Bax/Bcl−XS and activation of caspase−3 via ROS production in A549 cells。Oncol.Rep.12、1233〜1238。
【非特許文献5】Fingrut O.、およびFlescher E.(2002)。Plant stress hormones suppress the proliferation and induce apoptosis in human cancer cells。Leukemia 16,608〜616。
【非特許文献6】Fingrut O.、Reischer D.、Rotem R.、Goldin N.、Altboum I.、Zan−Bar I.、およびFlescher E.(2005)。Jasmonates induce nonapoptotic death in high−resistance mutant p53−expressing B−lymphoma cells。Br.J.Pharmacol.146,800〜808。
【非特許文献7】Heyfets A.、およびFlescher E.(2007)。Cooperative cytotoxicity of methyl jasmonate with anti−cancer drugs and 2−deoxy−d−glucose。Cancer Lett.50、300〜310。
【非特許文献8】Flescher E.(2005)。Jasmonates−a new family of anti−cancer agents。Anticancer Drugs 16,911〜916。
【非特許文献9】Reischer D.、Heyfets A.、Shimony S.、Nordenberg J.、Kashman Y.、およびFlescher E.、(2007)。Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma。Br.J.Pharmacol.150、738〜749。
【非特許文献10】Rotem R.、Heyfets A.、Fingrut O.、Blickstein D.、Shaklai M.、およびFlescher E.(2005)。Jasmonates:novel anticancer agents acting directly and selectively on human cancer cell mitochondria。Cancer Res.65,1984〜1993。
【非特許文献11】Robey R.B.、およびHay N.(2006)。Mitochondrial hexokinases,novel mediators of the antiapoptotic affects of growth factors and Akt。Oncogene 25、4683〜4696。
【非特許文献12】Goldin N.、Heyfets A.、Reischer D.、およびFlescher E.(2007)。Mitochondria−mediated ATP depletion by anti−cancer agents of the jasmonate family。J. Bioenerg.Biomemb.39,51〜57。
【発明の概要】
【発明が解決しようとする課題】
【0014】
抗腫瘍活性を有する薬物候補の同定のための高信頼性のアッセイに対して、未だ対処されていないニーズが残っている。このようなアッセイは、公知の抗癌療法の有害な副作用をほとんど伴わず、有効な抗癌剤を同定するために使われ得るものである。さらに、成立した腫瘍の進行の予防もしくは退縮の誘導における改善された結果を生じ、または転移を予防する新規な治療剤についての未だ対処されていないニーズがある。
【課題を解決するための手段】
【0015】
本発明は、天然または合成のジャスモン酸エステルと特定の特異的標的分子の相互作用に基づくアッセイを提供する。特に、本発明は、候補薬物分子の活性をヘキソキナーゼをミトコンドリアから解離することが知られる、あるジャスモン酸エステルの活性と比較することによって、候補薬物分子の抗腫瘍効果を判定するためのアッセイを開示する。このアッセイによって同定された抗癌性薬物候補分子、および当該分子を癌細胞の増殖を阻害するために用いる方法も同様に開示される。
【0016】
本発明は、部分的に、ヘキソキナーゼおよびその電位依存性アニオンチャネルとの結合体がジャスモン酸エステルの分子標的を構成するという予期せぬ発見に基づく。本発明において、初めて、ジャスモン酸メチル(MJ)がヘキソキナーゼをミトコンドリアから解離させ、MJが直接的にヘキソキナーゼに結合することで、電位依存性アニオンチャネルへのヘキソキナーゼ結合に干渉することが開示された。さらに、ジャスモン酸メチルはミトコンドリアに結合するヘキソキナーゼのみを撹乱するため、正常細胞の代謝にはほとんど影響しない。
【0017】
第一の態様によれば、本発明は、ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合のうち少なくとも1つにおいて、化合物の活性と抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体の活性を比較することを含む、抗腫瘍効果を有する化合物を同定するためのアッセイであって、当該化合物の活性が、ジャスモン酸エステル誘導体の活性と比較して同等またはジャスモン酸エステル誘導体より高いときは、当該化合物の抗腫瘍効果を示すアッセイを提供する。
【0018】
第二の態様では、本発明は、化合物をミトコンドリアを含む無細胞系に導入し、ヘキソキナーゼのミトコンドリアからの解離を誘導する化合物の能力を測定し、当該化合物の存在下でのヘキソキナーゼの解離を、抗腫瘍活性を有することが知られる、同等の濃度のジャスモン酸エステル誘導体によって達成される解離を比較することを含む、抗腫瘍効果を有する化合物を同定するためのアッセイであって、当該化合物の存在下での解離が同等またはそれより大きいときは、当該化合物の抗腫瘍効果を示すアッセイを提供する。
【0019】
さらに別の態様では、本発明は、少なくとも1つのヘキソキナーゼのサブタイプへの化合物の直接的な結合を測定し、この結合を、同等の濃度の抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される結合を比較することを含み、当該化合物の存在下での結合が同等またはそれより大きいときは当該化合物の抗腫瘍効果を示す、抗腫瘍効果を有する化合物を同定するためのアッセイを提供する。現在の好ましい実施形態では、当該化合物は腫瘍細胞死を選択的に誘導する。
【0020】
ある実施形態によれば、抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体は、当該技術分野で公知のように、ジャスモン酸メチルまたは合成ジャスモン酸エステル誘導体である。
【0021】
他の実施形態では、本発明は、ジャスモン酸メチル以外のジャスモン酸エステル誘導体である、抗腫瘍効果を有する候補薬物分子の同定のためのアッセイを提供する。もう1つの実施形態では、本発明は、非ペプチド有機小分子である抗腫瘍効果を有する候補薬物分子の同定のためのアッセイを提供する。
【0022】
ある実施形態では、本発明は悪性細胞に対する高い特異性を有する小分子(例えば、非ペプチド分子)の同定のための優れたアッセイを提供する。ある実施形態によれば、当該小分子は、分子量が約2,000グラム/mol未満(すなわち、MWが約2000未満)であり、より好ましくは、約1,500グラム/mol未満(すなわち、MWが約1,500未満)であり、最も好ましくは約1,000グラム/mol未満(すなわち、MWが約1,000未満)である。本発明のアッセイで同定された化合物は、天然に存在するものであってもよいし、合成のものでもよく、または天然成分および合成成分の両方を含むことができる。
【0023】
従って、本発明は、候補薬物分子の抗腫瘍効果を判定するためのアッセイを提供する。さらに他の実施形態では、本発明は候補薬物分子の活性を、ジャスモン酸メチルの活性と、下記のうち少なくとも1つの点で比較することを含むアッセイによって同定した抗癌剤の候補分子を提供する:ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合。
【0024】
本発明のアッセイで同定された抗癌剤の候補分子は、その活性および有効性について、当該技術分野において公知のいずれの方法によっても試験できる。ある実施形態によれば、当該候補薬物は、経口投与に適した形態(例えば、液剤、懸濁剤、シロップ、乳剤、分散剤、懸濁剤、錠剤、丸剤、カプセル剤、ペレット、顆粒剤および散剤)、非経口投与に適した形態(例えば、静脈内、筋肉内、動脈内、経皮、皮下または腹腔内)、局所投与に適した形態(例えば、軟膏、ゲル、クリーム)、吸入投与に適した形態または坐薬による投与に適した形態で試験できる。
【0025】
ある実施形態では、本発明は、医薬組成物で投与される候補薬物を提供する。現在の好ましい実施形態では、本発明の候補薬物は、さらに薬理学的に許容できる担体または希釈剤を含む組成物として投与される。
【0026】
ある実施形態では、本発明はさらに、治療上有効な量の本願明細書に記載されるアッセイによって同定された化合物に癌細胞を接触させることを含む、癌細胞の増殖を阻害する方法を提供する。
【0027】
さらに、本発明は、本願明細書に記載されるように、被験者に治療上有効な量の本発明の化合物を投与することによる、被験者における癌治療の方法を提供する。ある実施形態では、当該化合物は医薬組成物として投与される。好ましくは、本発明の化合物は、薬理学的に許容できる担体または希釈剤をさらに含む組成物として投与される。
【0028】
他の実施形態によれば、本発明のアッセイで同定された化合物は、下記を含む(しかしこれらに限定されない)種々の癌に対して有効である:細胞腫、肉腫、腺腫、肝細胞癌、肝芽腫、横紋筋肉腫、食道癌、甲状腺癌、ガングリオン細胞芽腫、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、滑膜腫、ユーイング肉腫、平滑筋肉腫、ラブドセリオサルコーマ(rhabdotheliosarcoma)、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、腎細胞癌、血腫、胆管癌、黒色腫、絨毛癌、精上皮腫、胚性癌腫、ウィルムス腫瘍、子宮頚癌、精巣腫瘍、肺癌、小細胞および非小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、網膜芽細胞腫、多発性骨髄腫、直腸癌、甲状腺癌、頭頚部癌、脳癌、末梢神経腫瘍、中枢神経腫瘍、神経芽細胞腫、子宮内膜癌、リンパ増殖性疾患、全種類の白血病細胞を含む造血器腫瘍およびリンパ腫(急性骨髄性白血病、急性骨髄球性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病、肥満細胞白血病、多発性骨髄腫、骨髄リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫を含む)、ならびに上記全ての転移。
【0029】
もう1つの態様によれば、本発明は、癌細胞の増殖の阻害のための本発明のアッセイによって同定された化合物を含む医薬組成物を提供する。ある実施形態では、当該医薬組成物は、さらに薬理学的に許容できる担体または希釈剤を含む。他の実施形態では、本発明は、癌治療のための本発明のアッセイによって同定された化合物を含む医薬組成物を提供する。
【0030】
さらにもう1つの態様によれば、本発明は、被験者における癌細胞の増殖の阻害のための本発明のアッセイによって同定された化合物の使用に関する。他の実施形態では、癌治療のための本発明のアッセイによって同定された化合物の使用も本発明の範囲内である。1つの実施形態では、当該被験者は哺乳類、好ましくはヒトである。
【0031】
本発明のさらなる実施形態および適用性の全範囲は、下記の詳細な説明から明らかになるであろう。しかし、本発明の精神および範囲中の様々な変更および改変は、当該詳細な説明から当業者に明らかとなるため、詳細な説明および具体的な実施例は、本発明の好ましい実施形態を示してはいるものの、例証する目的のみで示されることは理解されるはずである。
【図面の簡単な説明】
【0032】
【図1A】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。ジャスモン酸メチル(MJ;3mM)は、ヘキソキナーゼを時間依存的様式で解離する。
【図1B】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。ジャスモン酸メチル(MJ)は、用量依存的様式で、30分間のインキュベーションの間、ヘキソキナーゼを解離する。0.5mM G6Pを陽性対照とした。
【図1C】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画からヘキソキナーゼ(HK)を解離する。同様の実験からミトコンドリア分画の上清を回収し、SDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた。
【図2A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。Molt−4細胞のミトコンドリア分画。
【図2B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。BCL−1のミトコンドリア分画。
【図2C】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ(HK)を種々の癌細胞から単離したミトコンドリア分画から解離させる。B16腫瘍のミトコンドリア分画。
【図2D】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図2E】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図2F】実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた際の図である。
【図3】ジャスモン酸メチル(MJ)は、CT−26腫瘍のミトコンドリア分画から単離したチトクロムcの時間依存的な遊離を引き起こす。ミトコンドリア分画を、3mM ジャスモン酸メチル(MJ)で、表示された時間処理し、ペレットにした。遊離したチトクロムcを特異的抗体で調べた。
【図4A】ジャスモン酸メチル(MJ)は、細胞のATPを、60分間の曝露で枯渇させた。CT26細胞(中塗りの四角)、Molt−4細胞(中塗りの菱形)、B16細胞(白抜きの三角)およびBCL1細胞(白抜きの円)を表示されたジャスモン酸メチル(MJ)濃度に曝露し、細胞のATPレベルを測定した。
【図4B】ジャスモン酸メチル(MJ)は、細胞のATPを、60分間の曝露で枯渇させた。CT26細胞(左)およびMolt−4細胞(右)をジャスモン酸メチル(MJ;3mM)に曝露した。トリパンブルー色素排除アッセイ試験の後、細胞数を計測した。白色および青色は、それぞれ生細胞および死細胞を示している。
【図5】ジャスモン酸メチル(MJ)は、ヘキソキナーゼ−I−電位依存性アニオンチャネルの相互作用を撹乱する。電位依存性アニオンチャネルは脂質平面二重層に再構成した。0から−20mVまたは−40mVの電圧ステップに対する電流を、ヘキソキナーゼ−I(HK−I;20mU/ml)の添加前および添加10分後に記録した。表示されたように、ジャスモン酸メチル(MJ;3mM)を添加し、電流を10分後に記録した。
【図6A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸メチルは、ヘキソキナーゼに用量依存的様式に結合している。番号1は、6mM MJを示している。番号2は3mM MJを示している。番号3は1.5mM MJを示している。番号4は0.75mM MJを示している。灰色の線は0.375mM MJを示している。
【図6B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸メチルはヘキソキナーゼに結合するが、Rb IgGには結合しない。番号1は6mM MJを示している。番号2は3mM MJを示している。番号3および番号4はRb IgGを示している。
【図6C】ジャスモン酸メチル(MJ)は、ヘキソキナーゼに、特異的かつ用量依存的様式に結合している。ジャスモン酸(JA)はヘキソキナーゼには結合しない。番号3は6nM JAを示している。番号4は3mM JAを示している。6mM MJ(番号1)および3mM MJ(番号2)は、陽性対照として供した。実線および点線の矢印は、それぞれ、分析物の注入の開始点および終点を示している。
【図7A】ジャスモン酸メチル(MJ)は、ヘキソキナーゼをマウスの脳のミトコンドリア分画から解離させる。MJ(3mM)は、時間依存的様式で、ヘキソキナーゼを解離する。
【図7B】ジャスモン酸メチル(MJ)は、ヘキソキナーゼをマウスの脳のミトコンドリア分画から解離させる。MJはヘキソキナーゼを、30分間のインキュベーションで、用量依存的様式で、解離させる。G6Pを陽性対照として供した。
【図8A】ジャスモン酸メチル(MJ)は、マウスの脳のミトコンドリア分画の膨潤を引き起こすが、マウスの肝臓のミトコンドリア分画の膨潤は引き起こさない。マウスの脳のミトコンドリア分画。
【図8B】ジャスモン酸メチル(MJ)は、マウスの脳のミトコンドリア分画の膨潤を引き起こすが、マウスの肝臓のミトコンドリア分画の膨潤は引き起こさない。マウスの肝臓のミトコンドリア分画。ジャスモン酸メチル(MJ;1mM、四角)、ジャスモン酸(JA;1mM、三角)、またはバッファー(円)をミトコンドリアに投与し、光学密度をモニターした。タキソール(70μM、星印)を陽性対照として供した(Varbiro、2001)。
【図9A】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。ATP測定の前の、ジャスモン酸メチル(MJ)曝露。
【図9B】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。細胞傷害測定の前の、ジャスモン酸メチル(MJ)曝露。
【図9C】ヘキソキナーゼの過剰発現は、ジャスモン酸メチルによって誘導されたATP欠乏および細胞傷害から保護する。CT26細胞に、ヘキソキナーゼII発現ベクター(灰色)または対照プラスミド(白色)を形質移入した。細胞傷害測定の前の、スタウロスポリン曝露。データは、3回反復したうちの代表である。
【図10】ジャスモン酸メチルと比較した場合の新規化合物によるヘキソキナーゼ解離能の比較は、腫瘍細胞死を引き起こす新規化合物の能力を示している。各化合物のヘキソキナーゼ解離活性(縦軸)と、そのMolt−4細胞に対する細胞傷害性についてのIC50(横軸)の間の相関。A〜Fは、6つの異なるジャスモン酸エステル誘導体を示している。MJ=ジャスモン酸メチル。直線的相関性を分析し、R2因子を用いて評価した。
【発明を実施するための形態】
【0033】
本発明は、特異的細胞内標的に基づく新規なアッセイであって、あるジャスモン酸エステルが細胞代謝を妨害し、それによって、正常細胞集団に著しい悪影響を及ぼすことなく特異的に悪性細胞死を引き起こすという発見に基づくアッセイを提供する。本発明は、さらに、これらの新規に同定された細胞内の標的を通じて特異的抗癌活性を発現する新規な小分子を同定し、選択するためのアッセイを提供する。
【0034】
1つの実施形態では、本発明は、重要な新しいクラスの選択的な抗癌剤としてのジャスモン酸エステルに関する。いずれの作用の理論または機構とも結び付けられることなく、ジャスモン酸エステルは、少なくとも部分的には、ミトコンドリアのヘキソキナーゼおよび細胞基質の解糖系を含む他のATP生成経路の撹乱を介して作用すると思われると考えられた。ジャスモン酸メチルの細胞毒性効果に対する所定の細胞型の感受性と、その結果としてその細胞で誘導されたATPの減少の間の正の相関は、ピルビン酸塩およびオリゴマイシン(それぞれ、酸化的リン酸化の基質および阻害剤)に非依存的であることが見出された。このことは、ミトコンドリアのATP生成へのジャスモン酸メチルの効果は強力であり不可逆的であることを示唆している。逆に、解糖基質のグルコースは、ジャスモン酸メチルに誘導されたATPの低下に対する保護作用を示したが、他方で、解糖阻害剤2−デオキシグルコースは、ジャスモン酸メチルと組み合わせた場合、相乗効果を示した(Fingrut、2005;Heyfets、2007)。
【0035】
ジャスモン酸エステルによって誘導された細胞死に関する経路を同定することで、ジャスモン酸エステルが抗癌剤として有効である臨床状況の選択が可能となり、また、臨床医がその潜在的副作用を評価することが可能となる。さらに、これらの抗癌剤が相互作用する標的分子の同定により、より強力なジャスモン酸エステル誘導体の合理的設計、および同一または類似の標的分子と相互作用する他の有機小分子の特徴づけまたは設計が可能となる。
【0036】
1つの態様によれば、本発明は、候補薬物分子の活性をジャスモン酸メチルの活性と、下記のうち少なくとも1つの点で比較することを含む、候補薬物分子の抗腫瘍効果の判定のためのアッセイを提供する;ヘキソキナーゼのミトコンドリアからの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合の阻害、およびヘキソキナーゼへの直接的な結合の阻害。さらに、本発明は、非ペプチド有機小分子の有効な抗腫瘍効果についてのアッセイを提供する。
【0037】
もう1つの態様によれば、本発明は、本発明において開示されたいずれか1つのアッセイによって同定された抗癌剤の候補分子を提供する。抗癌剤の候補分子は、続いて、当該技術分野におけるいずれの公知の方法によっても、活性および有効性を試験し得る。
【0038】
他の実施形態によれば、当該候補薬物は、経口投与(例えば、液剤、懸濁剤、シロップ、乳剤、分散剤、懸濁剤、錠剤、丸剤、カプセル剤、ペレット、顆粒剤および散剤)、非経口投与(例えば、静脈内、筋肉内、動脈内、経皮、皮下または腹腔内)、局所投与(例えば、軟膏、ゲル、クリーム)、吸入投与または坐薬による投与に適した形態で試験できる。
【0039】
さらに、当該候補薬物は、さらにいずれの許容できる希釈剤および/または担体を含む医薬組成物として試験できる。担体は、従来用いられてきたいずれのものでもよく、好ましい投与経路に応じて選択し得る。例となる適切な担体には、ラクトース、グルコース、ブドウ糖、スクロース、ソルビトール、マンニトール、澱粉、アカシアゴム、リン酸カルシウム、アルギン酸塩、トラガント、ゼラチン、ケイ酸カルシウム、結晶セルロース、ポリビニルピロリドン、セルロース、水およびメチルセルロースが含まれるが、これらに限定されない。候補薬物には、さらに、滑沢剤(タルク、ステアリン酸マグネシウムおよび鉱油など)、湿潤剤(wetting agents)、界面活性剤、乳化剤および懸濁剤、保存剤(ヒドロキシ安息香酸メチルおよびヒドロキシ安息香酸プロピルなど)、甘味剤、香味剤、着色料、緩衝剤(例えば、酢酸塩、クエン酸塩またはリン酸塩)、崩壊剤、湿潤剤(moistening agents)、抗菌剤、抗酸化剤(例えば、アスコルビン酸または亜硫酸水素ナトリウム)、キレート化剤(例えば、エチレンジアミン四酢酸)および浸透圧の調整のための薬剤(塩化ナトリウムなど)が含まれ得る。他の医薬担体は、滅菌液(水、および石油、動物、植物または合成起源の油(ピーナッツ油、大豆油、鉱油、ゴマ油など)を含む油など)、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の合成溶剤であり得る。水は、医薬組成物が静脈内に投与される場合に、好ましい担体である。生理食塩水およびブドウ糖水溶液およびグリセロール溶液もまた、液体担体として、特に、注射液に利用できる。
【0040】
本発明はさらに、癌細胞を、本願明細書に記載されるアッセイによって同定された、治療上有効な量の化合物に接触させることを含む、癌細胞の増殖を阻害する方法を提供する。「癌細胞の増殖の阻害」という用語は、本発明の構成においては、下記のうち少なくとも1つの減少を意味する:対照と比較した細胞数(壊死性、アポトーシス性または他のいずれの種類の細胞死またはそれらの組み合わせでもよい細胞死による);細胞増殖率の減少、すなわち、細胞数の総数は増加し得るが、対照における増加よりも低いレベルまたは低い割合である;細胞の総数が変化しなくとも、対照と比較した場合の細胞の感染度の減少(例えば、軟寒天アッセイによる判定による);分化の遅れた細胞型から分化の進んだ細胞型への進行;腫瘍化の減速;あるいは、1つの段階から次段階への癌細胞の進行緩徐化。
【0041】
さらに、本発明は、被験者に、本願明細書に記載される本発明のアッセイ系によって同定された化合物を、治療上有効な量投与することによる、被験者における癌治療の方法を提供する。本発明の構成における「癌治療」という用語は、下記のうち少なくとも1つを含む:癌の成長率の減少(すなわち、依然として増殖しているが、より遅い速度である癌);腫瘍増殖の増殖休止、すなわち、腫瘍増殖の停止、および、好ましくは、腫瘍の減少または大きさの縮小。この用語はまた、転移数の減少、形成される新しい転移数の減少、1つの段階から他の段階への癌の進行の緩徐化、および癌によって誘導された血管新生の減少、を含む。最も好ましくは、腫瘍は完全に除去される。さらにこの用語に含まれるのは、治療を受けている被験者の生存期間の延長、疾病進行の時間の延長、腫瘍退縮などである。この用語はまた、予防状態の予防、または腫瘍の収縮に感受性のある個体の予防を含む。
【0042】
本願明細書で用いられる「治療上有効な量」とは、化合物を投与された被験者に対して薬効を呈するのに十分な化合物の量を意味する。本発明の構成における「癌」という用語は、固形腫瘍または非固形腫瘍の形態の全種類の新生物を含み、悪性および前悪性の病態をともに含み、これらの転移を含む。癌は2つの方法で分類され得る。癌が生じた組織の種類(組織型)によるもの、および原発部位または癌が最初に生じた身体における部位によるもの、である。組織学の分類および命名法の国際標準は、国際疾病分類−腫瘍学、第3版である。
【0043】
本発明のアッセイで同定された化合物は、広範囲な癌(細胞腫、肉腫、腺腫、肝細胞癌、肝芽腫、横紋筋肉腫、食道癌、甲状腺癌、ガングリオン細胞芽腫、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、滑膜腫、ユーイング肉腫、平滑筋肉腫、ラブドセリオサルコーマ(rhabdotheliosarcoma)、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、腎細胞癌、血腫、胆管癌、黒色腫、絨毛癌、精上皮腫、胚性癌腫、ウィルムス腫瘍、子宮頚癌、精巣腫瘍、肺癌、小細胞および非小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、網膜芽細胞腫、多発性骨髄腫、直腸癌、甲状腺癌、頭頚部癌、脳癌、末梢神経腫瘍、中枢神経腫瘍、神経芽細胞腫、子宮内膜癌、リンパ増殖性疾患、全種類の白血病細胞を含む造血器腫瘍、および、リンパ腫(急性骨髄性白血病、急性骨髄球性白血病、急性リンパ性白血病、慢性骨髄性白血病、慢性リンパ性白血病、肥満細胞白血病、多発性骨髄腫、骨髄リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫を含む)、ならびに上記全ての転移を含むが、これらに限定されない)に対して有効である。
【0044】
本発明の範囲には、癌細胞の増殖の阻害方法、および哺乳類に本願明細書で開示されたアッセイによって同定された化合物を治療上有効な量投与することによる、哺乳類の癌の治療方法が含まれる。1つの実施形態では、当該哺乳類はヒトである。しかし、本発明はまた、本発明の化合物を非ヒト哺乳類、例えば、動物用医薬品において用いることを意図する。
【0045】
本発明は、悪性細胞に対して高い特異性を有する非ペプチド小分子の同定のための優れたアッセイを提供する。本願明細書において用いる「小分子」は、分子量が約2,000グラム/mol未満(すなわち、MWが約2,000未満)、さらに好ましくは約1,500グラム/mol未満(すなわち、MWが約1,500未満)、最も好ましくは約1,000グラム/mol未満(すなわち、MWが約1,000未満)である組成物または化合物を指すことを意味する。本発明のアッセイで同定された化合物は、天然に存在するものであってもよいし、合成のものでもよく、または天然成分および合成成分の両方(炭水化物、脂質および他の非ペプチド有機分子を含むが、これらに限定されない)を含むことができる。1つの実施形態では、本発明の方法によって同定される新規な小分子は、これらを発見するためのアッセイに用いた基準ジャスモン酸エステル誘導体化合物よりも強力である。従って、これらは、悪性細胞に対して高度の特異性を有する細胞毒性効果を示す。
【0046】
本発明の原理は、下記の非限定的な実施例によって示される。
【実施例】
【0047】
(材料)
全ての試薬は、特に明記しない限り、シグマケミカルズ社(Sigma Chemicals)(米国、ミズーリ州、セントルイス)から購入した。ジャスモン酸メチル(MJ)およびジャスモン酸(JA)を、エタノールに溶解し、500mM ストック溶液を得た。さらに、培養培地またはアッセイバッファーで希釈した。試験におけるエタノールの最終濃度は、0.6%は超えなかった。表面プラズモン共鳴実験のため、ジャスモン酸メチルをDMSOで希釈し、500mM ストック溶液を得た。タキソールを米国ミードジョンソン社(MeadJohnson)から購入した。ヒドロキシアパタイト(Bio−Gel HTP)をバイオラッド ラボラトリーズ社(Bio−Rad Laboratories)(米国、カリフォルニア州、ハーキュリーズ)から購入した。セライトをBDH社(英国、ドーセット州、プール)から購入した。PEGFP プラスミドをクロンテック社(Clontech)(米国、カルフォルニア州)から購入した。PcDNA3.1 プラスミドをインビトロジェン社(米国、カルフォルニア州)から購入した。PcDNA3.1 HKIIは、J.E.Wilson博士(ミシガン大学)のご厚意により提供を受けた。
【0048】
(動物)
メスのウィスターラット、およびオスのICRマウスを脳および肝臓の抽出のために用いた。オスのBALB/cおよびC57BLマウス(7〜8週齢)は、テルアビブ大学(イスラエル)における、繁殖コロニーから得て、BCL1白血病細胞、B16腫瘍およびCT26腫瘍を増殖させるために用いた。動物の飼育および実験は、テルアビブ大学のガイドラインに従って行い、施設内動物実験および飼育委員会の承認を受けた。マウスは、ケージ内で、標準飼料および飼育条件下で飼育した。
【0049】
(癌細胞株および腫瘍)
CT26マウス結腸癌細胞株、B16マウス黒色腫細胞株、BCL1マウスB細胞白血病細胞株およびMolt−4ヒトTリンパ性白血病細胞株は、ATCC(米国、メリーランド州、ロックビル)から購入した。細胞は、加湿した環境下で、37℃、5%CO2で維持した。CT26細胞およびB16細胞を、10% FCS、2mM L−グルタミン、100U ml−1 ペニシリン、100μg ml−1 ストレプトマイシン、1mM ピルビン酸ナトリウムおよび1:100希釈の非必須アミノ酸(全て、バイオロジカル インダストリーズ社(Biological Industries)、イスラエル、から購入した)を添加したダルベッコ変法イーグル培地(バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック(Beit−Haemek))で維持した。Molt−4およびBCL1細胞を、10% FCS、2mM L−グルタミン、100U ml−1 ペニシリンおよび100μgml−1 ストレプトマイシンを添加したRPMI−1640培地(バイオロジカル インダストリーズ社、イスラエル)で維持した。
【0050】
BCL1細胞を、HeyfetsおよびFlescher(2007)が記載したように、BALB/cマウスの体内で増殖させた。BCL1細胞の抽出:100μl PBS中106 BCL1細胞(BCL1白血病を保有するBALB/cマウスから抽出したばかりのもの)を、マウスに対し、腹腔内(i.p.)に接種し、腫瘍を増殖させた。4週後、マウスを麻酔下で屠殺し、脾臓を抽出した。細胞を脾臓分散物によって抽出した。RBCを、RBC溶解バッファー(シグマ社)を用いて破壊した。固形腫瘍の調製:100μl PBS中106 CT26細胞またはB16細胞を両側腹部に皮下注射した。腫瘍を直径10〜12mmに達したところで、壊死の兆候のない状態で切除した。
【0051】
(細胞傷害測定)
細胞死をトリパンブルー色素排除アッセイによって判定した。所定の実験が完了した後、細胞を0.1% トリパンブルーで2〜5分間インキュベーションし、死細胞(染料を排除しない細胞)の割合を、顕微鏡下で測定した(Fingrut、2002)。もう1つの方法として、細胞傷害をヘマカラー染色を用いて判定した。所定の実験の完了後、細胞を染色し、死(解離した)細胞の割合(%)を分光光度的に測定した。
【0052】
(ATPレベルの測定)
CellTiter−Glo(商標)発光細胞生存率(Luminescent Cell Viability)アッセイ(プロメガ社、米国、ウィスコンシン州、マディソン)を用いた(Fingrut、2005)。所定の実験が完了した後、プレートを室温まで平衡化した。ルシフェリンおよびルシフェラーゼを含むCellTiter−Glo(商標)試薬を各ウェルに加え、プレートをオービタルシェーカー上で2分間混合し、細胞溶解を誘導した。ATP、Mg2+および酸素分子の存在下で、ルシフェリンの一酸化(mono−oxidation)がルシフェラーゼによって触媒され、発光シグナルを生じた。次いで、細胞を10分間、室温でインキュベーションし、発光シグナルを安定させた。発光を、コダック デジタルサイエンス イメージステーション 440CDを用いて記録した。発光は、ATP濃度に正比例していた。ATP欠乏(対照に対する%)を次の方法で算出した:{(対照細胞の発光−薬剤で処理した細胞の発光)/対照細胞の発光}×100。
【0053】
(ミトコンドリア分画の抽出)
ミトコンドリア分画を、機械的な溶解および分画遠心法によって調製した。全ての工程は、氷上で行った。細胞または抽出した組織は、PBSで洗浄し、0.1mM EDTAおよびプロテアーゼ阻害剤カクテル(シグマ社)を添加したばかりの抽出バッファー(250mM スクロース、10mM HEPES−NaOH、pH 7.2)中で均一化して破壊した。細胞または組織に、グラムあたり、4倍量の抽出バッファーを入れた。破砕物の量を抽出バッファーで2倍量にし、組織および細胞残渣ならびに核を、遠心分離(1,000g、10分間)でペレットにした。上清を、さらに13,000gで、10分間で2度回転させた。小胞体の層を除去した。ペレット(ミトコンドリア分画と命名)を適切なバッファー(ミトコンドリア分画を調製するアッセイによる)中で懸濁した。ミトコンドリア分画は、速やかに使用するか、または−196℃で保存した。
【0054】
(ヘキソキナーゼ解離アッセイ)
異なる薬剤によってミトコンドリア分画から解離されるヘキソキナーゼの量を測定するため、ミトコンドリアを着目している薬剤とともにインキュベーションし、遠心分離によってペレットにした。上清のヘキソキナーゼ活性(すなわち、解離したヘキソキナーゼの活性)を、340nmで分光光度的に測定した。反応は、ピルビン酸塩キナーゼによってADPがピルビン酸の形成のために消費され、乳酸脱水素酵素によってNADHでピルビン酸が還元され、ヘキソキナーゼによるADP形成に関係がある。簡単に言えば、ミトコンドリアをインキュベーションバッファー(20mM HEPES pH 7.4、0.25M スクロース、10mM グルコース、5mM KCl、10mM MgCl2;0.2mg/試験、100μL/試験)に懸濁し、下記に記載のようにインキュベーションした。ミトコンドリア結合ヘキソキナーゼを遠心分離(20,000g、10分間、4℃)で沈殿させた。上清分画のヘキソキナーゼ活性をピルビン酸キナーゼ(1U/ml)、乳酸脱水素酵素(1U/ml)、ATP(1mM)、ホスホ(エノール)ピルベート(1mM)、NADH(0.18mg/ml)を添加したばかりの反応バッファー(250μL;20mM HEPES pH 7.2、5mM MgCl2、5mM KCl、10mM グルコース)でアッセイした。これらの条件下では、アッセイ混合物に直接的に加えたジャスモン酸メチルもジャスモン酸もヘキソキナーゼ活性に影響しなかった。
【0055】
(ウエスタンブロット)
ヘキソキナーゼレベルの分析のため、上記のヘキソキナーゼ解離アッセイと同様に実験を行い、上清分画中の非結合のヘキソキナーゼをFingrut(2005)が記載したように抽出した。試料をドデシル硫酸ナトリウム・ポリアクリルアミドゲル(7%)電気泳動によって分離し、次いで、免疫ブロットを行った。ブロットは、特異的抗−HKI抗体または抗−HKII抗体(1:300、サンタクルーズバイオテクノロジー社(Santa−Cruz Biotechnology)、 米国、カルフォルニア州)を用いて調べた。ヘキソキナーゼ−抗体複合体をHRP標識抗体(1:10,000、サンタクルーズバイオテクノロジー社、米国、カルフォルニア州)で染色した。高感度化学発光(ECL)試薬(バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック)を加え、ブロットをECLフィルム(イーストマン コダック、米国、ニューヨーク州、ロチェスター)に曝露した。
【0056】
(ミトコンドリア分画から遊離したチトクロムcの測定)
単離したばかりのミトコンドリア分画(100μL中、最終濃度は2mg/ml)を37℃で、試験される薬剤(例えば、ジャスモン酸メチル)とともに、KClベースの呼吸バッファー(respiratory buffer)(150mM KCl、25mM NaHCO3、1mM MgCl2、3mM KH2PO4、20mM ヘペス、pH 7.4;Pastorino、2002)中でインキュベーションした。コハク酸カリウム(5mM)を呼吸基質として加えた(Azoulay−Zohar、2004)。チトクロムc遊離の測定のため、ミトコンドリア分画を20,000×gで10分間、4℃でペレットにした。ペレットを40分間、溶解バッファー(20mM トリス HCl、pH 8、137mM NaCl、2mM EDTA、pH 8、1% トリトンX−100、プロテアーゼ阻害剤カクテル:シグマ社)とともに氷上でインキュベーションした(Fingrut、2005)。ペレットライセートおよび上清を12% SDS−PAGEゲルで分離し、ニトロセルロース膜にエレクトロブロットした。チトクロムcを特異的抗体(1:1000、BDファーミンゲン社(BD PharMingen)、カリフォルニア州、サンディエゴ)で検出した。抗原抗体複合体を西洋わさびペルオキシダーゼ標識抗体(1:10,000、サンタクルーズバイオテクノロジー社、カリフォルニア州)および高感度化学発光(ECL)試薬(EZ−ECL、バイオロジカル インダストリーズ社、イスラエル、ベイトヘメック)で染色し、ECLフィルム(イーストマンコダック社、米国、ニューヨーク州、ロチェスター)に曝露した。
【0057】
(ミトコンドリアの膨潤アッセイ)
単離したばかりのミトコンドリア分画を抽出バッファーで洗浄し、EDTAを除去し、5mM コハク酸カリウム、pH 7.2を添加したばかりの膨潤バッファー(220mM マンニトール、70mM スクロース、150mM トリス、pH 7.2、0.2mM KH2PO4、pH 7.2;100μL中に0.2mg)中で再懸濁した。各成分にはナトリウムは含まれない。試験される試薬(例えば、ジャスモン酸メチル)を加える前に光学密度を540nmの波長で2〜5分間モニターし、その後さらに20分間モニターした。
【0058】
(ヘキソキナーゼ精製)
ラット脳のHK−Iを下記のように精製し、強固に結合したHK−Iを含む粗製脳ミトコンドリアを1.2mM グルコース−6−リン酸および0.5mM K−EDTAとともにインキュベーションし、酵素を可溶性分画に遊離させた。さらに、HK−Iの精製をチバクロンブルーアガロース(ファルマシア社(Pharmacia))のアフィニティークロマトグラフィーで行った。精製した酵素を濃縮し、0.5mM K−EDTA、10mM グルコース、1mM ジチオスレイトールおよび10mM K−ヘペス、pH 7.8で、アミコン社(Amicon)の装置および50,000Da分子量カットオフ膜(スペクトラム社(Spectrum)、タイプC)を用いて洗浄した。濃縮した酵素(最大1mg/ml;30〜60ユニット/mg)を液体窒素中で凍結させ、使用まで−80℃で保存した(Azoulay−Zohar、2004)。
【0059】
(ジャスモン酸エステルとHKの相互作用についての表面プラズモン共鳴分析)
表面プラズモン共鳴(SPR)は金属表面における分子結合の現象を、局所的な屈折率の変化を検出することで測定する光バイオセンサー技術である。SPRは、固定化されたバイオ分子(リガンド)および溶液相の分析物の相互作用の研究に理想的な表面感作技術である。バイオセンサー反応は、結合分析物量に正比例する。小さい分子量の分析物の検討における、従来技術(蛍光または酵素結合免疫吸着アッセイなど)に対しての、SPRの利点は、分析物の標識または多段階の検出手順(サンドウィッチアッセイ)が必要でなく、無標識かつ直接的な分析物を検出することである。また、SPRは、広範囲な結合親和性について分析物を検出できる。
【0060】
ProteOn−EP5(バイオラッド社、米国、カルフォルニア州、ハーキュリーズ)システムを用いたSPRを、ジャスモン酸メチルとヘキソキナーゼの直接的な相互作用を検討するため用いた。このシステムにより、リガンドと分析物の相互作用を、6×6の型式で、リアルタイムで測定できる。精製したラット脳HKIおよびウサギ免疫グロブリンG(Rb IgG;リガンド)を、10mM 酢酸Na(それぞれ、pH 4および4.5)で希釈し、37.5mg/ml N−エチル−N’−(3’ジメチルアミノプロピル)カルボジイミド塩酸塩および7.5mg/ml N−ヒドロキシスクシンイミドで活性化したGLMセンサー表面に結合させた。HKIおよびIgGを、チップを100μg/mlに飽和させるために加えた。次いで、チップ上に残った反応基を1M エタノールアミン(pH 8.5)で不活性化した。飽和状態のヘキソキナーゼの基本的シグナルは、8200と9000相対的単位(RU)の間であり、Rb IgGでは〜10500RUである。ジャスモン酸メチルおよびジャスモン酸(分析物)を、ランニングバッファー(0.005% Tweenおよび5% DMSOを添加したPBS×1)に希釈し、センサーチップに、様々な濃度で注入した。全ての実験は、流量50μl/分、25℃で行った。結果は、少なくとも3実験のセンソグラムの代表である。最大の相対的単位は、約60RUである。シグナルは適切な陰性対照を用いて正規化した。
【0061】
(電位依存性アニオンチャネルの精製)
電位依存性アニオンチャネルを、Azoulay−Zohar(2004)が記載したように精製した。簡単に言えば、ラットの肝臓のミトコンドリア(200mgのタンパク質)を30分間、0℃(5mg/ml)で、10mM トリス、pH 7.0、0.15mM PMSF、0.5μg/ml ロイペプチンおよび0.05% ラウリル(ジメチル)アミンオキシド(LDAO)を含む溶液でインキュベーションした。44,000g、20分の遠心分離の後に、ペレットを2% LDAOを含む上記溶液で、5mg/mlに再懸濁した。44,000g、30分の遠心分離の後に、LDAOで抽出した電位依存性アニオンチャネルを乾燥したヒドロキシアパタイト/セライト(2:1、重量/重量)カラム(0.08g/mgのタンパク質)にアプライし、10mM トリス、pH 7.4、50mM NaCl、20mM リン酸ナトリウムおよび2% LDAOを含むバッファーで溶出した。電位依存性アニオンチャネルを含む分画(クマシーブルー染色によって同定)を回収し、10mM トリス、pH 7.4で5倍に希釈し、10mM トリス、pH 7.4、および0.5% n−オクチル β−D−グルコピラノシド(バヒェムAG社(Bachem AG))で前平衡化したCM−セルロースカラムに充填した。次いで、充填したカラムを同じ平衡化バッファーで洗浄し、電位依存性アニオンチャネルを0.4M NaClを含む同じバッファーで溶出した。
【0062】
(電位依存性アニオンチャネルの記録および分析)
電位依存性アニオンチャネルを脂質平面二重層(PLB)に再構成し、Azoulay−Zohar(2004)が記載したように記録し、分析した。簡単に言えば、PLBは、n−デカンに溶解した大豆アソレクチン(asolectin)(50mg/ml)から調製した。精製した電位依存性アニオンチャネル(約1ng)をシス側と定義した容器に加えた。1またはいくつかのチャネルをPLBに挿入した後、さらなる取り込みを阻害するために、シス側容器(cis chamber)を20容量の溶液で洗浄することで、過剰なタンパク質を除去した。電流を、電位固定下で、二重層電位 BC−525B 増幅器(ワーマー インスツルメンツ社(Wamer Instruments)、米国、コネティカット州、ハムデン)を用いて記録した。電流を膜のトランス側(接地)について測定した。電流を、1kHzで、ベッセルフィルタ(フレクエンシーデバイス社(Frequency Devices)、米国、マサチューセッツ州、ハーバーヒル)を用いて、ローパスフィルターにかけ、デジデータ(Digidata)1200−インターフェースボードおよびPCLAMP6 ソフトウェア(アクソンインスツルメンツ社(Axon Instruments Inc.)、米国、カルフォルニア州、ユニオンシティー)を用いてオンラインでデジタル化した。
【0063】
(形質移入実験)
CT26細胞に、FuGene HD形質移入試薬(ロシュ社(Roche)、スイス、バーゼル)を用いて、製造者の使用説明書に従い、pcDNA3−HKIIまたはpcDNA3を形質移入し、次いで、G418を用いた選択をした。
【0064】
(統計解析)
結果は、少なくとも3つの独立した実験の平均値±標準誤差として示した。統計的有意性は、ANOVA検定を用いて評価した。P<0.05を統計的に有意であるとみなし、それぞれのグラフ中でアスタリスクの印を付けた。
【0065】
(ヘキソキナーゼ−ミトコンドリア結合体は、ジャスモン酸メチルの分子標的である)
(実施例1)
ジャスモン酸メチルはヘキソキナーゼを癌細胞のミトコンドリア分画から解離する。ジャスモン酸メチルは、ミトコンドリアを、PTPC依存様式で直接的に撹乱させる(Rotem、2005)。ジャスモン酸メチルが、CT−26腫瘍から単離したミトコンドリア分画からヘキソキナーゼを解離させることができるかを判定するために、異なる時間で処理したミトコンドリア分画の上清のヘキソキナーゼ活性を測定した。CT−26腫瘍のミトコンドリア分画を、10、30または60分間、種々の試薬とともに、37℃でインキュベーションした。非結合のヘキソキナーゼ活性を測定し、自然に解離したヘキソキナーゼの活性(対照)と比較した。ジャスモン酸メチルは、ヘキソキナーゼを、時間依存的様式で解離した(図1A)。さらに、30分間のインキュベーションの間に行った分析は、ジャスモン酸メチルによるヘキソキナーゼの解離は用量依存的であることを示した(図1B)。逆に、ジャスモン酸メチルのより少ない細胞傷害性誘導体である、ジャスモン酸(Fingrut、2002)は、ミトコンドリア分画からのヘキソキナーゼの解離をそれほど示さなかった。
【0066】
ミトコンドリアのヘキソキナーゼの物理的な解離を確認するため、同様の調製物をSDS−PAGEで分離し、ニトロセルロース膜にエレクトロブロットし、抗−HKI抗体および抗−HKII抗体で調べた。HKIおよびHKIIの両方の遊離が示された(図1C)。
【0067】
ミトコンドリア分画からのヘキソキナーゼの解離は、CT−26結腸癌に限られない。異なる癌細胞から単離したミトコンドリア分画、すなわち、Molt−4細胞、BCL−1白血病細胞およびB16黒色腫を30分間、37℃でインキュベーションし、非結合のヘキソキナーゼの活性を測定し、自然に(対照)解離したヘキソキナーゼの活性と比較した。ジャスモン酸メチルは、ヘキソキナーゼを3つの異なる癌細胞から単離したミトコンドリア分画から解離させた(図2A〜2C)。これらの実験における上清をSDS−PAGEで分離し、抗−HKI抗体および抗−HKII抗体で調べた。ヘキソキナーゼの種々の癌細胞のミトコンドリア分画からの解離を、さらに確認した(図2D〜2F)。
【0068】
(実施例2)
ミトコンドリアの損傷およびATP欠乏は、ミトコンドリア分画からのヘキソキナーゼの遊離と同時に生じた。CT−26腫瘍から単離されたミトコンドリア分画からのチトクロムcの遊離は、ミトコンドリアからヘキソキナーゼを解離するために必要であったのと同じ期間内(15〜60分間)に生じた(図3)。ジャスモン酸メチルは、CT−26腫瘍の単離されたミトコンドリア分画からのチトクロムcの時間依存的な遊離を引き起こした。遊離を特異的抗体を用いて調べた。
【0069】
細胞のATPレベルと、ミトコンドリア分画からのヘキソキナーゼの遊離との間の相関を検討するため、異なる癌細胞、すなわち、Molt−4細胞、BCL−1白血病細胞およびB16黒色腫を種々の濃度のジャスモン酸メチルに曝露した。図4Aは、全ての3種の異なる癌細胞株が、60分間のジャスモン酸メチルへの曝露の間に、有意かつ用量依存的に細胞のATPの減少を呈することを示している。CT26細胞およびMolt−4細胞を、次いで、24穴プレートに播種した。CT26細胞を、一晩接着させた。細胞を、ジャスモン酸メチル(MJ;3mM)に、1時間曝露した。トリパンブルー色素排除アッセイ試験を行い、細胞数を計測した。過度のATP欠乏にも関らず、3mM ジャスモン酸メチルに曝露された細胞は、依然として60分後も生存した(図4B)。Molt−4細胞は、CT26腫瘍細胞に対して感度の上昇を示したが、両方の細胞株で、ATP欠乏が細胞死に先行して現れた。
【0070】
(実施例3)
ジャスモン酸メチルはヘキソキナーゼ−Iによって閉じられた脂質二重層に再構成された電位依存性アニオンチャネルを再開口する。哺乳類のHKIおよびHKIIは、電位依存性アニオンチャネルを通じてミトコンドリアの外膜に結合する(Azoulay−Zohar、2004;Robey、2006)。ジャスモン酸メチルの、脂質平面二重層に再構成された、精製したミトコンドリアの電位依存性アニオンチャネルのチャネル活性に対する効果を、電位固定下で検討した(Azoulay−Zohar、2004)。電位依存性アニオンチャネル活性のモニターは、ヘキソキナーゼおよび他の薬剤との、電位依存性アニオンチャネルの相互作用を試験する定法である(Shoshan−Barmats、2005)。電位依存性アニオンチャネルは、脂質平面二重層に再構成された。0から−20mVまたは−40mVの電圧ステップに対する電流を、0.5M NaClの対称溶液中で、ヘキソキナーゼ−I(HK−I;20mU/ml)の添加前および添加10分後に記録した。表示した時点で、3mM ジャスモン酸メチル(MJ)を加え、電流を10分後に記録した。破線は、零電流および最大電流レベルを示している(図5)。データは、3回反復したうちの代表である。濃度3mMのジャスモン酸メチルは、保持電位0mVから−40mVの電圧ステップに対する電位依存性アニオンチャネルを通る電流について何の効果も示さなかった。相対的に小さい膜電位(−20mV)では、コンダクタンスは、記録のうち120分までは一定のままだった(図5)。しかし、精製HK−Iを添加した場合、開口チャネルは低電導状態で安定した。電位依存性アニオンチャネルに対するHK−Iの上記効果は、ジャスモン酸メチルの添加によって逆転し、ヘキソキナーゼと電位依存性アニオンチャネルとの相互作用を撹乱するジャスモン酸メチルの能力を示している。再構成された電位依存性アニオンチャネルが−40mVに曝露されたとき、同様の結果が得られた。HK−Iは、電位依存性アニオンチャネルの閉鎖を促進させ、低電導状態で安定させた。同様に、ジャスモン酸メチルの添加は、HK−Iによって閉じられたチャネルを再開口させる(図5)。
【0071】
(実施例4)
ジャスモン酸メチルは、ヘキソキナーゼと、特異的かつ用量依存的様式で相互作用する。ジャスモン酸メチルの、ヘキソキナーゼとの可能性のある直接の相互作用を調べるため、リアルタイム表面プラズモン共鳴分析を行った。ジャスモン酸メチルは、精製ラット脳HKIに、用量依存的様式で結合することが見出された(図6A)。しかし、解離定数の決定は、ジャスモン酸メチルのランニングバッファーへの溶解性が制限されていたため、出来なかった。図6Bは、無関係なタンパク質のRb IgG(番号3および番号4)を、ヘキソキナーゼ(番号1および番号2)の代わりに用いることにより、結合の特異性を立証したことを示している。
【0072】
さらに、ジャスモン酸メチルの特異性を示すため、ジャスモン酸メチルよりも低い細胞傷害性を有し(Fingrut、2002;Fingrut、2005;Rotem、2005)、より少ない程度でミトコンドリアを撹乱し、かつ、ジャスモン酸メチルよりも、ヘキソキナーゼをミトコンドリア分画から解離するのには有効でないことが示された(図1C)ジャスモン酸を、同様の条件で試験した。図6Cは、ジャスモン酸は、ヘキソキナーゼに、これらの条件下では全く結合しなかったことを示している(番号3および番号4対番号1および番号2のジャスモン酸メチル)。従って、ジャスモン酸メチルは、ヘキソキナーゼと特異的な様式で相互作用する。
【0073】
(ヘキソキナーゼとミトコンドリアの相互作用の解離は、ジャスモン酸メチルに誘導されたミトコンドリア毒性および細胞傷害性を媒介する)
(実施例5)
ジャスモン酸メチルは、ヘキソキナーゼリッチなミトコンドリア中で膨潤を選択的に誘導する。ジャスモン酸メチルの結合ヘキソキナーゼ解離能と、ミトコンドリアの損傷との間の関係の一貫性を検討するため、ジャスモン酸メチルをマウスの脳内で、マウスの肝臓と比較して試験した。比較は、マウスの脳とマウスの肝臓におけるミトコンドリアのヘキソキナーゼ量の既知の差によって行った。当該技術分野では、脳のミトコンドリア分画は結合ヘキソキナーゼに富み、肝臓のミトコンドリア分画は基本的に結合ヘキソキナーゼを欠くということが実証されている(Wilson、1995)。第一に、ジャスモン酸メチルの、マウスの脳から単離されたミトコンドリア分画からヘキソキナーゼを解離する能力は、時間依存的および用量依存的の両方であることが示された(それぞれ図7Aおよび図7B)。ミトコンドリア分画は、10、30または60分間、37℃でインキュベーションした。非結合ヘキソキナーゼ活性を測定し、自然に(対照)解離されたヘキソキナーゼ活性と比較した。そのため、ジャスモン酸メチルが、マウスの脳および肝臓から単離されたミトコンドリア分画の膨潤を誘導する能力を試験した。上述の関係から予測されるように、ジャスモン酸メチルおよび、わずかな程度だがジャスモン酸は、脳のミトコンドリア分画の膨潤を引き起こすが(図8A)、肝臓のミトコンドリア分画の膨潤は引き起こさなかった(図8B)。
【0074】
(実施例6)
ヘキソキナーゼの過剰発現は、ジャスモン酸メチルで誘導された細胞傷害から保護する。ヘキソキナーゼの過剰発現の、ジャスモン酸メチルの作用に対する効果を検討するため、CT26細胞に、プラスミド、pcDNA3−HKIIまたはpcDNA3(それぞれ、過剰発現したヘキソキナーゼIIおよび対照プラスミドをコードしている)を形質移入した(Zaid、2005)。細胞を96穴プレートに播種し、接着させた。細胞をジャスモン酸メチルにATP測定(図9A)の前に60分間曝露し、ヘマカラー(hemacolor)法による細胞傷害測定の前に24時間曝露した(図9B)。図9Aおよび図9Bに示されるように、60分の細胞ATPレベルの枯渇、および一晩のジャスモン酸メチルによって誘導された細胞傷害はともに、細胞内で減少し、対照(白色)に比べ、ヘキソキナーゼII(灰色)の高発現を伴った。さらに、ヘマカラー法による細胞傷害測定の前に、3.75μM スタウロスポリン(陽性対照;Azoulay−Zohar、2004)に3時間曝露することによって誘導した細胞傷害は、同様に、ヘキソキナーゼIIの過剰発現によって減少した(図9C)。
【0075】
(実施例7)
ジャスモン酸メチルと比較した新規化合物によるヘキソキナーゼ解離は、腫瘍細胞死を引き起こす能力と相関した。ジャスモン酸メチルと比較した、新規化合物がミトコンドリアからヘキソキナーゼを解離させる能力と、ジャスモン酸メチルと比較した、腫瘍細胞死を引き起こす能力との間の相関を検討した。一連の、2000ダルトン未満の分子量を有する6種の有機的に合成された化合物(ジャスモン酸エステル誘導体)(化合物A、B、C、D、E、F)を、腫瘍細胞のミトコンドリアからヘキソキナーゼを解離させる能力について上述のように分析した。次いで、それらの化合物を、ジャスモン酸メチル(MJ)とともに、ヘキソキナーゼ解離を引き起こす能力について順序を付けた。
【0076】
これらの化合物の抗腫瘍活性は、さらに、Molt−4細胞に対する細胞傷害活性を分析することで、評価した。ヘキソキナーゼ解離と、順序付けた化合物A〜Fおよびジャスモン酸メチルの誘導された腫瘍細胞死の間との相関を、Molt−4細胞に対する細胞傷害性の関数としてヘキソキナーゼ解離活性をプロットして評価した。図10は、ジャスモン酸メチルと比較したこれらの化合物のヘキソキナーゼ解離能と、腫瘍細胞死を引き起こす能力との間の強い相関を示している。
【0077】
具体的な実施形態についての上述の記載は、本発明の一般的性質を完全に明らかにしているため、他者は、当業者における知識(本願明細書で引用した参考文献の内容を含む)を用いることで、過度の実験をすることなく、本発明の一般概念から逸脱することなく、このような具体的な実施形態を容易に改変および/または種々の応用例のために適合できる。従って、このような適合および改変は、本願明細書に示された教示および指針に基づき、開示された実施形態の均等物の意義および範囲に含まれることを意図する。本願明細書における表現または用語は、説明を目的とするものであって、限定するものではないため、本願明細書における用語または表現は当業者によって、本願明細書に示された教示および指針を踏まえて、当業者の知識と組み合わせて解釈されることになることが理解されるだろう。
【0078】
(参考文献)
Azoulay−Zohar H.、Israelson A.、Abu−Hamad S.およびShoshan−Barmatz V.(2004)。In self−defence:hexokinase promotes voltage−dependent anion channel closure and prevents mitochondria−mediated apoptotic cell death.Biochem.J.377,347〜355。
Fingrut O.、およびFlescher E.(2002)。Plant stress hormones suppress the proliferation and induce apoptosis in human cancer cells。Leukemia 16,608〜616。
Fingrut O.、Reischer D.、Rotem R.、Goldin N.、Altboum I.、Zan−Bar I.、およびFlescher E.(2005)。Jasmonates induce nonapoptotic death in high−resistance mutant p53−expressing B−lymphoma cells。Br.J.Pharmacol.146,800〜808。
Flescher E.(2005)。Jasmonates−a new family of anti−cancer agents。Anticancer Drugs 16,911〜916。
Galuzzi L.、Larochette N.、Zamzami N.、およびKroemer G.(2006)。Mitochondria as therapeutic targets for cancer chemotherapy。Oncogene 25,4812〜4830。
Goldin N.、Heyfets A.、Reischer D.、およびFlescher E.(2007)。Mitochondria−mediated ATP depletion by anti−cancer agents of the jasmonate family。J. Bioenerg.Biomemb.39,51〜57。
Heyfets A.、およびFlescher E.(2007)。Cooperative cytotoxicity of methyl jasmonate with anti−cancer drugs and 2−deoxy−d−glucose。Cancer Lett.50、300〜310。
Ishii Y.、Kiyota H.、Sakai S.、およびHonma Y.(2004)。Induction of differentiation of human myeloid leukemia cells by jasmonates,plant hormones。Leukemia 18、1413〜1419。
Kim J.H.、Lee S.Y.、Oh S.Y.、Han S.I.、Park H.G.、Yoo M.A.、およびKang H.S.(2004)。Methyl jasmonate induces apoptosis through induction of Bax/Bcl−XS and activation of caspase−3 via ROS production in A549 cells。Oncol.Rep.12、1233〜1238。
Mathupala S.P.、Ko Y.H.、およびPedersen P.L.(2006)。Hexokinase II:Cancer’s double−edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria。Oncogene 25:4777〜4786。
Pastorino J.G.、Shulga N.、およびHoek J.B.(2002)。Mitochondrial binding of hexokinase II inhibits Bax−induced cytochrome c release and apoptosis。J.Biol.Chem.277、7610〜7618。
Reischer D.、Heyfets A.、Shimony S.、Nordenberg J.、Kashman Y.、およびFlescher E.、(2007)。Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma。Br.J.Pharmacol.150、738〜749。
Robey R.B.、およびHay N.(2006)。Mitochondrial hexokinases,novel mediators of the antiapoptotic affects of growth factors and Akt。Oncogene 25、4683〜4696。
Rotem R.、Heyfets A.、Fingrut O.、Blickstein D.、Shaklai M.、およびFlescher E.(2005)。Jasmonates:novel anticancer agents acting directly and selectively on human cancer cell mitochondria。Cancer Res.65,1984〜1993。
Shoshan−Barmatz V.、およびIsraelson A.(2005)。The voltage−dependent anion channel in endoplasmic/sarcoplasmic reticulum:characterization, modulation and possible function。J Membr Biol.204、57〜66。
Varbiro G.、Veres B.、Gallyas F.、およびSumegi B. (2001)。Direct effect of Taxol on free redical formation and mitochondrial permeability transition。Free Radic.Biol.Med.31、548〜558。
Wilson J.E.(1995)。Hexokinases。Rev.Physiol.Biochem.Pharmacol.126、65〜198。
Zaid H.、Abu−Hamad S.、Israelson A.、Nathan I.、およびShoshan−Barmatz V.(2005)。The voltage−dependent anion channel−1 modulates apoptotic cell death。Cell Death Differ.12、751〜760。
【特許請求の範囲】
【請求項1】
抗腫瘍効果を有する化合物を同定するためのアッセイであって、前記化合物の活性と抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体の活性を比較することを含み、
前記抗腫瘍活性は、ミトコンドリアからのヘキソキナーゼの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合のうち少なくとも1つにおけるものであり、
前記化合物の活性が前記ジャスモン酸エステル誘導体の活性と比較して同等またはそれより大きいときは、前記化合物の抗腫瘍効果を示すアッセイ。
【請求項2】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである請求項1記載のアッセイ。
【請求項3】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である請求項1記載のアッセイ。
【請求項4】
抗腫瘍効果を有する化合物を同定するアッセイであって、
前記化合物をミトコンドリアを含む無細胞系に導入する工程と、前記化合物がミトコンドリアからのヘキソキナーゼの解離を誘導する能力を測定する工程と、前記化合物の存在下での前記ヘキソキナーゼの解離を、抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される解離と比較する工程とを含み、
前記化合物の存在下での解離が同等またはそれより大きいときは前記化合物の抗腫瘍効果を示すアッセイ。
【請求項5】
前記化合物が選択的に腫瘍細胞死を誘導する請求項4記載のアッセイ。
【請求項6】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである請求項4記載のアッセイ。
【請求項7】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である請求項4記載のアッセイ。
【請求項8】
抗腫瘍効果を有する化合物を同定するアッセイであって、
少なくとも1つのヘキソキナーゼのサブタイプへの前記化合物の直接的な結合を測定する工程と、当該結合を抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される結合と比較する工程とを含み、
前記化合物の存在下での結合が同等またはそれより大きいときは前記化合物の抗腫瘍効果を示すアッセイ。
【請求項9】
前記化合物が選択的に腫瘍細胞死を誘導する、請求項8記載のアッセイ。
【請求項10】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである、請求項8記載のアッセイ。
【請求項11】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である、請求項8記載のアッセイ。
【請求項12】
請求項1〜11のいずれか1項に記載のアッセイによって同定された抗癌性化合物。
【請求項13】
請求項12記載の抗癌性化合物および薬理学的に許容できる担体または希釈剤を含む医薬組成物。
【請求項14】
癌細胞の増殖を阻害するための請求項13記載の医薬組成物。
【請求項15】
癌治療のための請求項13記載の医薬組成物。
【請求項16】
治療上有効な量の請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物に癌細胞を接触させることを含む、被験者における癌細胞の増殖を阻害する方法。
【請求項17】
前記被験者がヒトである、請求項16記載の方法。
【請求項18】
治療上有効な量の請求項12記載の抗癌性化合物を被験者に投与することによる、被験者における癌治療のための方法。
【請求項19】
前記被験者がヒトである、請求項18記載の方法。
【請求項20】
被験者における癌細胞の増殖を阻害する薬物の調製のための請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物の使用。
【請求項21】
前記被験者がヒトである、請求項20記載の使用。
【請求項22】
癌治療のための薬物の調製のための、請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物の使用。
【請求項1】
抗腫瘍効果を有する化合物を同定するためのアッセイであって、前記化合物の活性と抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体の活性を比較することを含み、
前記抗腫瘍活性は、ミトコンドリアからのヘキソキナーゼの解離、電位依存性アニオンチャネルへのヘキソキナーゼ結合に対する干渉、およびヘキソキナーゼへの直接的な結合のうち少なくとも1つにおけるものであり、
前記化合物の活性が前記ジャスモン酸エステル誘導体の活性と比較して同等またはそれより大きいときは、前記化合物の抗腫瘍効果を示すアッセイ。
【請求項2】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである請求項1記載のアッセイ。
【請求項3】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である請求項1記載のアッセイ。
【請求項4】
抗腫瘍効果を有する化合物を同定するアッセイであって、
前記化合物をミトコンドリアを含む無細胞系に導入する工程と、前記化合物がミトコンドリアからのヘキソキナーゼの解離を誘導する能力を測定する工程と、前記化合物の存在下での前記ヘキソキナーゼの解離を、抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される解離と比較する工程とを含み、
前記化合物の存在下での解離が同等またはそれより大きいときは前記化合物の抗腫瘍効果を示すアッセイ。
【請求項5】
前記化合物が選択的に腫瘍細胞死を誘導する請求項4記載のアッセイ。
【請求項6】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである請求項4記載のアッセイ。
【請求項7】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である請求項4記載のアッセイ。
【請求項8】
抗腫瘍効果を有する化合物を同定するアッセイであって、
少なくとも1つのヘキソキナーゼのサブタイプへの前記化合物の直接的な結合を測定する工程と、当該結合を抗腫瘍活性を有することが知られるジャスモン酸エステル誘導体によって達成される結合と比較する工程とを含み、
前記化合物の存在下での結合が同等またはそれより大きいときは前記化合物の抗腫瘍効果を示すアッセイ。
【請求項9】
前記化合物が選択的に腫瘍細胞死を誘導する、請求項8記載のアッセイ。
【請求項10】
前記ジャスモン酸エステル誘導体がジャスモン酸メチルである、請求項8記載のアッセイ。
【請求項11】
前記化合物がジャスモン酸メチル以外のジャスモン酸エステル誘導体である、請求項8記載のアッセイ。
【請求項12】
請求項1〜11のいずれか1項に記載のアッセイによって同定された抗癌性化合物。
【請求項13】
請求項12記載の抗癌性化合物および薬理学的に許容できる担体または希釈剤を含む医薬組成物。
【請求項14】
癌細胞の増殖を阻害するための請求項13記載の医薬組成物。
【請求項15】
癌治療のための請求項13記載の医薬組成物。
【請求項16】
治療上有効な量の請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物に癌細胞を接触させることを含む、被験者における癌細胞の増殖を阻害する方法。
【請求項17】
前記被験者がヒトである、請求項16記載の方法。
【請求項18】
治療上有効な量の請求項12記載の抗癌性化合物を被験者に投与することによる、被験者における癌治療のための方法。
【請求項19】
前記被験者がヒトである、請求項18記載の方法。
【請求項20】
被験者における癌細胞の増殖を阻害する薬物の調製のための請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物の使用。
【請求項21】
前記被験者がヒトである、請求項20記載の使用。
【請求項22】
癌治療のための薬物の調製のための、請求項1〜11のいずれか1項に記載のアッセイによって同定された化合物の使用。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10】




【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図10】


【公表番号】特表2010−521149(P2010−521149A)
【公表日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願番号】特願2009−553284(P2009−553284)
【出願日】平成20年3月16日(2008.3.16)
【国際出願番号】PCT/IL2008/000366
【国際公開番号】WO2008/111088
【国際公開日】平成20年9月18日(2008.9.18)
【出願人】(505149310)ラモット アット テル−アヴィヴ ユニヴァーシティ リミテッド (2)
【出願人】(509257488)セパル ファーマ エス.エー. (1)
【Fターム(参考)】
【公表日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願日】平成20年3月16日(2008.3.16)
【国際出願番号】PCT/IL2008/000366
【国際公開番号】WO2008/111088
【国際公開日】平成20年9月18日(2008.9.18)
【出願人】(505149310)ラモット アット テル−アヴィヴ ユニヴァーシティ リミテッド (2)
【出願人】(509257488)セパル ファーマ エス.エー. (1)
【Fターム(参考)】
[ Back to top ]

