ミトコンドリア融合タンパク質、ミトジェニンIをコードする遺伝子及びこれ等の用途
【課題】肥満症、脂質代謝異常症、癌等の診断、治療及び予防のための安全かつ有効、そして高信頼度の技術の確立。脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御等。
【解決手段】ミトコンドリア融合タンパク質であるMitogenin I(MG)、MGを有効成分とするミトコンドリア活性化剤、ミトコンドリア融合試薬、抗肥満薬及び脂質代謝異常症治療薬;MG遺伝子に基づき設計・合成されるsiRNA、shRNA、miRNA等のRNAi機能成分を含有する制癌剤;MGに対する抗体を用いるミトコンドリア機能診断剤。
【解決手段】ミトコンドリア融合タンパク質であるMitogenin I(MG)、MGを有効成分とするミトコンドリア活性化剤、ミトコンドリア融合試薬、抗肥満薬及び脂質代謝異常症治療薬;MG遺伝子に基づき設計・合成されるsiRNA、shRNA、miRNA等のRNAi機能成分を含有する制癌剤;MGに対する抗体を用いるミトコンドリア機能診断剤。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、ミトコンドリア融合タンパク質であるミトジェニンI(Mitogenin I)、それをコードする遺伝子、及びこれ等の用途に関する。尚、用途としては、肥満症、癌、脂肪酸代謝異常症等に係る診断剤、治療薬、予防剤、研究用試薬等を上げることができる。
【背景技術】
【0002】
本発明者らは、脂肪酸代謝異常症モデルであるJVSマウス(JVS:juvenile visceral steatosis)において特異的に多量発現する遺伝子をクローニングすると共に、それがコードするタンパク質が新規な機能を発揮することを発見し、「ミトジェニン I(Mitogenin I)」と命名した。併せて、遺伝子解析及びホモロジー検索の結果、ミトジェニン Iが、DNAポリメロラーゼδやPCNA(proliferating cell nuclear antigen)と相互作用することが知られているヒトPDIP38(polymerase delta interacting protein;非特許文献1)のマウスホモログであり、マウスPDIP38と同一であると判定した。尚、マウス及びヒトの各PDIP38遺伝子のNCBIアクセッションは、それぞれNM_026389及びNM_015584である(非特許文献2及び3)。
【非特許文献1】J.Biol.Chem.、第280巻(第23号)、22375−22384、June 10、2005.
【非特許文献2】NCBI(http://www.ncbi.nlm.nih.gov/)、Entrez、nucleotide、NM_026389.
【非特許文献3】同上、NM_015584. しかしながら、詳しくは後述される、本発明に係るミトジェニンIの機能、及びその利用技術は、未だ知られていない。
【発明の開示】
【発明が解決しようとする課題】
【0003】
肥満症、脂肪酸代謝異常症、癌等の診断、治療及び予防のための安全かつ有効、そして高信頼度の技術の確立は、患者とその家族、そして担当臨床医のみならず、全人類にとって、解決されるべき待望の課題である。また、上記疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御等も重要な課題である。
本発明の目的は、上記の課題を解決するための診断剤、治療薬、予防剤、基礎研究用試薬等を提供することにある。
【課題を解決するための手段】
【0004】
(略語の説明)
先ず、この明細書で用いられる略語につき、略語(用語)の形で、以下に列記する:MG[ミトジェニンI(Mitogenin I)]、RNAi(RNA interference)、dsRNA(二本鎖RNA)、shRNA(ショートヘアピンRNA;short hairpin RNA)、siRNA(small intefering RNA)、及びmiRNA(micro−RNA)。
(配列表の説明)
配列番号1:MG遺伝子の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列、及びマウスPIDP38の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列(NCBIアクセッション:NM_0026389)。
配列番号2:MGの完全長アミノ酸配列、及びマウスPIDP38の完全長アミノ酸配列(NCBIアクセッション:NM_0026389)。
配列番号3:ヒトPIDP38の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列(NCBIアクセッション:NM_015584)。
配列番号4:ヒトPIDP38の完全長アミノ酸配列(NCBIアクセッション:NM_015584)。
配列番号5:MG遺伝子mRNA増幅用RT−PCRの上流プライマー。
配列番号6:MG遺伝子mRNA増幅用RT−PCRの下流プライマー。
配列番号7:RNAi用dsRNA(1)(siRNA)のセンス鎖。
配列番号8:RNAi用dsRNA(1)(siRNA)のアンチセンス鎖。
配列番号9:RNAi用dsRNA(2)(siRNA)のセンス鎖。
配列番号10:RNAi用dsRNA(2)(siRNA)のアンチセンス鎖。
配列番号11:RNAi用dsRNA(3)(siRNA)のセンス鎖。
配列番号12:RNAi用dsRNA(3)(siRNA)のアンチセンス鎖。
配列番号13:RNAi用dsRNA(4)(siRNA)のセンス鎖。
配列番号14:RNAi用dsRNA(4)(siRNA)のアンチセンス鎖
配列番号15:RNAi用dsRNA(5)(siRNA)のセンス鎖。
配列番号16:RNAi用dsRNA(5)(siRNA)のアンチセンス鎖
【0005】
本発明者らは、上述の課題と現状に鑑み、長年にわたる深い洞察と試行錯誤の結果、MG遺伝子とMGがもたらす次(1)〜(5)に示す実に驚くべき現象を発見した:
(1)MG遺伝子発現は、健常マウスに比べ、脂肪酸代謝異常症モデルJVSマウスで増強される。
(2)MG遺伝子の過剰発現は、ミトコンドリアを長いチューブ状に形態変化させる。、細胞内脂肪滴の蓄積を抑制する。
(3)RNAiによるMG遺伝子発現のノックダウンは、ミトコンドリアの断片化及び死細胞の増加をもたらす。
(4)MGは、ミトコンドリアタンパク質である。
(5)MGは、ミトコンドリア融合を促進ないしは刺激する。
この発明は、前述課題の解決に寄与するため、上記(1)〜(5)の基礎的知見に基づき着想かつ創作され、絶え間ない創意工夫の投入と勤勉により完成された。
【0006】
この発明によれば、前述の課題を解決するための手段として、次の(1)〜(8)がそれぞれ提供される:
(1)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを有効成分として薬効を奏する量、含有するミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
(2)上記(1)記載の完全長アミノ酸配列又はその部分配列からなるペプチドをコードする遺伝子の発現べクターを含有する、ミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
(3)配列番号1又は3に記載の完全長cDNA塩基配列に基づき設計かつ合成されるsiRNA、shRNA又はmiRNAをRNAi機能成分として薬効を奏する量、含有する制癌剤。
(4)siRNAが、配列番号7と8、9と10、11と12、13と14、及び15と16に記載の各1組のRNAからなる合計5種のdsRNA(1)〜(5)群から選ばれる少なくとも1種のdsRNAである請求項2に記載の制癌剤。
(5)siRNA、shRNA又はmiRNAの発現ベクターをRNAi機能成分として薬効を奏する量、含有する制癌剤。
(6)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドに対する抗体を活性成分として抗原抗体反応を呈する量、含有するミトコンドリア機能の診断剤又は検査薬。
(7)配列番号5及び6に記載のDNAからなるRT−PCR用プライマー。
(8)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを作用成分として融合が生じる量、含有するミトコンドリア融合試薬。
【発明の効果】
【0007】
この発明は、肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防の技術を高め、併せて、上記疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等を可能にする。更に、この発明は、世界の保健と医療行政に寄与するだけではなく、今日の深刻な課題である肥満症、脂肪酸代謝異常症癌の制圧に多大に貢献すると共に、長寿と延命という福音を全ての人類にもたらす。
【発明を実施するための最良の形態】
【0008】
この発明の実施の形態に関し、次の通り詳述する:
(1)MG遺伝子
配列番号1及び3に記載のcDNAの完全長塩基配列及びその部分配列を、前述した肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防、あるいは上記した疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等に用いることができる。尚、部分配列の利用の具体例は、実験例3に記載の通り、MG遺伝子増幅用のPCR用プライマーである配列番号5と6に記載のDNAを上げることができる。
(2)MG遺伝子がコードするアミノ酸配列
配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列を、前述した肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防、あるいは上記した疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等に用いることができる。尚、配列番号2の第1番アミノ酸M〜第30番Lはミトコンドリア移行シグナルの領域、また、第243番V〜第353番Lはタンパク質−タンパク質相互作用に関わるモチーフであり、薬剤や試薬への部分配列の利用や設計において有用かつ活用可能である。
(3)脂肪酸代謝異常症モデル動物
JVSマウスは、未熟内臓脂肪酸代謝異常症あるいは全身性カルニチン欠乏疾患のモデル動物であり、脂肪肝、心肥大、成長障害等の多彩な症状を示す。そのため、JVSマウスは、健常マウスとの比較による遺伝子の異常発現の検出が容易であるので、実験例3において後述される通り、MG遺伝子のクローニングに推奨される。
【0009】
(4)RNAi用薬剤
MG遺伝子DNA塩基配列に基づくRNAi用薬剤としてのsiRNA、shRNA及びmiRNAの合成では、ノックダウン率を考慮し、標的mRNAが高次構造をとらない部分に対するよう事前に設計することが重要である。具体的には実施例1で後述される通り、配列番号7と8に記載の両RNAからなるdsRNAを上げることができる。
(5)発現ベクターを用いた薬剤
配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列からなるペプチドをコードする遺伝子の発現ベクターを、ミトコンドリア活性剤、抗肥満剤又は脂肪酸代謝異常症治療薬等の薬剤として利用することができる。
前記配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列からなるペプチドをコードする遺伝子としては、例えば配列番号1及び3に記載のcDNAの完全長塩基配列或いはその部分配列からなるDNAが上げられる。これらのDNA以外でも、配列番号2及び4に記載のアミノ酸配列において、1個若しくは数個のアミノ酸残基が欠失、置換、或いは付加されたアミノ酸配列であって、ミトジェニンIと同様の機能を有するタンパク質をコードするDNAであってもよい。
発現ベクターは、上記の遺伝子DNAを、原核細胞ベクター、真核細胞ベクター、ウイルスベクター等の公知のベクターに挿入・連携することにより構築できる。その具体的手順については、例えば、常用のテキストMolecular Cloning A LABORATORY MANUAL,3rd ed.,J.Sambrookら著,CSHL Press 2001年発行(http//www.MolecularCloning.com)に記載されている。
発現ベクターは、そのままの形態で、或いは常法に従い、公知の担体を用いて製剤化した後、皮下、皮内、筋肉内等に投与することができる。
【0010】
この発明に係る薬剤、診断剤、試薬等は、アンプルやバイアル瓶等に分注され、液状又は乾燥のかたちで密封された状態で提供かつ使用に供される。
【0011】
以下、実験例及び実施例を上げ、本発明の構成と効果を具体的に説明する。但し、この発明は、これ等の実験例及び実施例だけに限定されるわけではない。
(実験例1)
【0012】
JVSマウスと健常マウスとの間で発現量が違うmRNAの同定
JVSマウスと健常マウスの各心臓細胞から常法によりmRNAを抽出・精製し、得られたmRNAをRT−PCRにより増幅することによりcDNAを調製した。次いで、cDNA解析キットを用い、mRNAの同定を行った。上記の解析キットには、GeneChip[Affymetrix社(米国)製]、蛍光Differential Display[タカラバイオ社(日本)製]及びPCR−Select Subtraction[Clontech社(米国)製]を用いた。その結果、健常マウスに比べJVSマウスでの発現量増加が検出された遺伝子数は、GeneChipでは176、蛍光Differential Displayは9、及びPCR−Select Subtractionは67であった。上記の通り同定された合計250遺伝子cDNAは、機能解析のため、それぞれ−20℃以下に保存した。
(実験例2)
【0013】
JVSマウスにおける特異的に発現が増加するcDNAのクローニングと遺伝子解析
実験例1で得た合計250遺伝子cDNAのうち、前記の3つの方法で共通して発現量増加が認められた合計7遺伝子につき、各発現ベクターを構築の後、これ等の発現ベクターをそれぞれ細胞に移入し得られる形質転換体を検鏡することにより、各遺伝子の機能解析を行った。その結果、ミトコンドリア融合を促進ないしは刺激する遺伝子を検出し、「Mitogenin I遺伝子」と命名した。該MG遺伝子のDNA塩基配列は、DNA解析装置により決定した。DNA塩基配列のホモロジー検索は、NCBIのBLASTを用いて行った。その結果、発見したMG遺伝子は、ヒトPDIP38(NCBIアクセッションNM_015584)のマウスホモログであり、マウスPDIP38(NCBIアクセッションNM_026389)と同一であるが、機能の相違することが確認された。
(実験例3)
【0014】
MGタンパク質の細胞内(ミトコンドリア)局在
JVSマウス心臓から精製したmRNAを使用し、RT−PCR法によりMG遺伝子を増幅の後、これをCT−GFP Fusion TOPOベクター[Invitrogen社[カナダ]製]にサブクローニングした。尚、MG遺伝子の増幅には、次のプライマーを用いた:
上流ブライマー:5‘−TTTTCTGGAATGTGAGGTGTGG−3’
下流プライマー:5‘−CTGGTGGGTAATCCGTGTCTAT−3’
次いで、FuGENE 6 transfection試薬[Roche Diagnostics(米国)製]を用い、MG−GFP融合遺伝子をマウス筋芽細胞にトランスフェクションした。比較対照として、同時に、MitoDsRedIを発現させることにより、ミトコンドリアを赤色標識した。トランスフェクション48時間後、共焦点レーザー顕微鏡を用いて解析した。
その結果を図1に示す。GFP−Mitogenin IとMitoDsRed1の両画像の重ね併せ(merge)による画像一致に基づき、MGはミトコンドリアタンパク質であることが確認された。
(実験例4)
【0015】
MGタンパク質によるミトコンドリア融合の促進
(a)MG遺伝子をpCMS−EGFPベクターにサブクローニングした後、これをマウス筋芽細胞にトランスフェクションした。トランスフェクション48時間後、ミトコンドリアをMitotracker Greenで染色し、蛍光顕微鏡を用いてミトコンドリアの形態を解析した。解析には、約50個の細胞を選択し、ミトコンドリアの形態変化に基づき、断片化された状態(fragment)、チューブ状(tube)、及び断片化とチューブ状の混在状態(mixture)に分類し、各分類形態のミトコンドリアを持つ細胞を数えた。
その結果を図2(B)と(C)に示す。ベクターだけをトランスフェクションした比較対照(mock)に比べ、MGの過剰発現により、ミトコンドリア融合による長いチューブ状のミトコンドリアを持つ細胞の増加が確認された。
(b)また、MGを過剰発現させ、そのミトコンドリアをDASPEI(ミトコンドリアの染色試薬)で染色の後、フローサイトメーターでミトコンドリア量を解析した。
その結果を図2(A)に示す。MGの過剰発現はミトコンドリア量の増加をもたらさないことが確認された。
(c)更に、ベクターだけをトランスフェクションした比較対照(mock)細胞と、MGをトランスフェクションした細胞の両者からRNAを抽出調製の後、RT−PCRで増幅、次いでアガロースゲル電気泳動にかけ、MG発現量を解析した。その結果を図2(A)左上の小枠に示す。MGトランスフェクション細胞ではMGの過剰発現が確認された。
【実施例1】
【0016】
dsRNAによるMG遺伝子発現ノックダウンによるミトコンドリアの形態変化
(a)RNAi法によりMG遺伝子をノックダウンするため、配列表1のDNA塩基配列に基づき、MG遺伝子特異的な次のdsRNAを設計した(上段はセンス鎖、下段はアンチセンス鎖):
5‘−CUAAGGAGGUGAAAGGCAAAACUCAAG−3’
3‘−UAGAUUCCUCCACUUUCCGUUUUGAGU−5’
尚、合成は[北海道システムサイエンス社(日本)]に委託した。上記の塩基配列からなるdsRNAをC2C12細胞にトランスフェクションし、その48時間後にミトコンドリアの形態を解析した。
その結果を図3(B)と(C)に示す。dsRNAをトランスフェクションしない比較対照(mock)に比べ、dsRNAトランスフェクションにより、MG遺伝子発現のノックダウン、及び断片化ミトコンドリアの増加が併せて確認された。
(b)また、dsRNAによりMG発現をノックダウンし、そのミトコンドリアをDASPEI(ミトコンドリアの染色試薬)で染色の後、フローサイトメーターでミトコンドリア量を解析した。
その結果を図3(A)に示す。MG発現のノックダウンはミトコンドリア量の増加を生じないことが確認された。
(c)更に、dsRNAをトランスフェクションしない比較対照(mock)細胞と、dsRNAをトランスフェクションした細胞の両者からRNAを抽出調製の後、RT−PCRで増幅、次いでアガロースゲル電気泳動にかけ、MG発現量を解析した。
その結果を図3(A)左上の小枠に示す。比較対照(mock)に比べ、dsRNAトランスフェクション細胞ではMG遺伝子発現のノックダウンが確認された。
【実施例2】
【0017】
MG遺伝子発現ノックダウンによる細胞の生存率
実施例1の記載と同様にしてdsRNAを用いるRNAi法により、MG遺伝子発現をノックダウンした後、その細胞をトリパンブルー(以下「TB」と略記する)で染色し、細胞の生存率を解析した。即ち、生細胞率(=TB染色陰性・生細胞数/総細胞数)、及び死細胞率(=TB染色陽性・死細胞数/総細胞数)をそれぞれ計数・算出した。
その結果を図4に示す。比較対照(mock)では生細胞率(TB negative)がほぼ100%であるのに対し、MG遺伝子発現ノックダウン(dsRNA)では、死細胞率(TB positive)が約60%に達した。また、死細胞の細胞内にはオートファジー様の小胞の形成が多数、確認された。尚、かかる小胞形成は、アポトーシス以外のメカニズムによる細胞死の誘導を示唆する。
【実施例3】
【0018】
MGタンパク質によるミトコンドリア融合の促進と細胞内脂肪滴の蓄積抑制
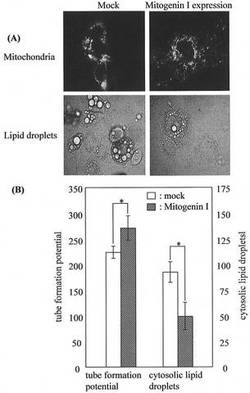
さらにミトコンドリアの形態変化と脂肪滴の蓄積との関係に注目して検討するため、MG遺伝子をFuGENE 6 transfection試薬[Roche Diagnostics(米国)製]を用いて未分化3T3−L1前駆脂肪細胞を分化誘導した脂肪細胞に発現させ、MitoTracker Greenで染色してミトコンドリアの形態を蛍光顕微鏡にて観察した(図5:A)。また、細胞内脂肪滴(図5:B)についても観察し、上述の解析方法に従い、細胞内脂肪滴及びtube formation potentialを算出し、統計学的な解析を行った(図5:B)。
【0019】
[解析方法1:細胞内脂肪滴の細胞内レベルの算出]
脂肪細胞を顕微鏡(オリンパス社製、OLYMPUS IX70)の40倍の対物レンズで観察し、最も細胞内脂肪滴レベルが(トリアシルグリセロールレベル:TGレベル)高くなる10ケ所を写真にとる(10枚の写真の総面積は1540mm2)。油滴が目で確認できるので、そのサイズから以下のように分類した。大:直径3μm以上、中:1−3μm、小:1μm以下。10枚の写真全ての大、中の油滴を数え、大の場合は係数1か2を掛け、中の場合は0.5か1を掛けてTGレベルを算出した。脂肪細胞への誘導率が実験によって異なるため、係数を掛けてコントロールのスコアが55〜65付近になるようにして算出した。
【0020】
[解析方法2:ミトコンドリアチューブのtube formation potentialの算出]
細胞全体のミトコンドリアの形態について、蛍光顕微鏡で観察し(100倍の対物レンズを使用し、油浸で観察する)、表1に示すように場合によって該当する係数を掛け算し、カウントした細胞数に占める割合(%)としてスコアー化した。また、その合計を、tube formation potentialとした。
【0021】
【表1】

【0022】
その結果、MG遺伝子の過剰発現によりミトコンドリアの融合が促進され、細胞内への脂肪滴の蓄積が抑制された。
【産業上の利用可能性】
【0023】
肥満症、脂肪酸代謝異常症、癌等に係る診断剤・臨床検査薬・治療薬・予防剤等、また、上記疾病等の基礎研究用試薬の製造・販売の分野で利用できる。
【図面の簡単な説明】
【0024】
【図1】細胞質(ミトコンドリア)におけるMG遺伝子発現の局在を示す検鏡写真。
【図2】(A)MG遺伝子の過剰発現がミトコンドリア量の増加をもたらさないことを示すフローサイトメーター計測値であり、図中の左上小枠はMG遺伝子の過剰発現を示す電気泳動像。(B)及び(C)は、MG遺伝子の過剰発現による、長いチューブ状のミトコンドリアの増加をそれぞれ示す。
【図3】(A)dsRNAによるMG遺伝子発現ノックダウンがミトコンドリア量の増加をもたらさないことを示すフローサイトメーター計測値であり、図中の左上小枠はMG遺伝子発現のノックダウンを示す電気泳動像。(B)及び(C)は、dsRNAによるMG遺伝子発現ノックダウンによる、断片化ミトコンドリア量の増加をそれぞれ示す。
【図4】dsRNAによるMG遺伝子発現のノックダウンが死細胞数の増加をもたらすことを示す。
【図5】脂肪細胞にMG遺伝子を発現させ、ミトコンドリアの形態及び細胞内脂肪滴を解析した結果を示す図である。(A)は蛍光顕微鏡観察の結果、(B)は統計的に解析した結果を示す。
【技術分野】
【0001】
この発明は、ミトコンドリア融合タンパク質であるミトジェニンI(Mitogenin I)、それをコードする遺伝子、及びこれ等の用途に関する。尚、用途としては、肥満症、癌、脂肪酸代謝異常症等に係る診断剤、治療薬、予防剤、研究用試薬等を上げることができる。
【背景技術】
【0002】
本発明者らは、脂肪酸代謝異常症モデルであるJVSマウス(JVS:juvenile visceral steatosis)において特異的に多量発現する遺伝子をクローニングすると共に、それがコードするタンパク質が新規な機能を発揮することを発見し、「ミトジェニン I(Mitogenin I)」と命名した。併せて、遺伝子解析及びホモロジー検索の結果、ミトジェニン Iが、DNAポリメロラーゼδやPCNA(proliferating cell nuclear antigen)と相互作用することが知られているヒトPDIP38(polymerase delta interacting protein;非特許文献1)のマウスホモログであり、マウスPDIP38と同一であると判定した。尚、マウス及びヒトの各PDIP38遺伝子のNCBIアクセッションは、それぞれNM_026389及びNM_015584である(非特許文献2及び3)。
【非特許文献1】J.Biol.Chem.、第280巻(第23号)、22375−22384、June 10、2005.
【非特許文献2】NCBI(http://www.ncbi.nlm.nih.gov/)、Entrez、nucleotide、NM_026389.
【非特許文献3】同上、NM_015584. しかしながら、詳しくは後述される、本発明に係るミトジェニンIの機能、及びその利用技術は、未だ知られていない。
【発明の開示】
【発明が解決しようとする課題】
【0003】
肥満症、脂肪酸代謝異常症、癌等の診断、治療及び予防のための安全かつ有効、そして高信頼度の技術の確立は、患者とその家族、そして担当臨床医のみならず、全人類にとって、解決されるべき待望の課題である。また、上記疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御等も重要な課題である。
本発明の目的は、上記の課題を解決するための診断剤、治療薬、予防剤、基礎研究用試薬等を提供することにある。
【課題を解決するための手段】
【0004】
(略語の説明)
先ず、この明細書で用いられる略語につき、略語(用語)の形で、以下に列記する:MG[ミトジェニンI(Mitogenin I)]、RNAi(RNA interference)、dsRNA(二本鎖RNA)、shRNA(ショートヘアピンRNA;short hairpin RNA)、siRNA(small intefering RNA)、及びmiRNA(micro−RNA)。
(配列表の説明)
配列番号1:MG遺伝子の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列、及びマウスPIDP38の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列(NCBIアクセッション:NM_0026389)。
配列番号2:MGの完全長アミノ酸配列、及びマウスPIDP38の完全長アミノ酸配列(NCBIアクセッション:NM_0026389)。
配列番号3:ヒトPIDP38の完全長cDNA塩基配列とそれがコードする完全長アミノ酸配列(NCBIアクセッション:NM_015584)。
配列番号4:ヒトPIDP38の完全長アミノ酸配列(NCBIアクセッション:NM_015584)。
配列番号5:MG遺伝子mRNA増幅用RT−PCRの上流プライマー。
配列番号6:MG遺伝子mRNA増幅用RT−PCRの下流プライマー。
配列番号7:RNAi用dsRNA(1)(siRNA)のセンス鎖。
配列番号8:RNAi用dsRNA(1)(siRNA)のアンチセンス鎖。
配列番号9:RNAi用dsRNA(2)(siRNA)のセンス鎖。
配列番号10:RNAi用dsRNA(2)(siRNA)のアンチセンス鎖。
配列番号11:RNAi用dsRNA(3)(siRNA)のセンス鎖。
配列番号12:RNAi用dsRNA(3)(siRNA)のアンチセンス鎖。
配列番号13:RNAi用dsRNA(4)(siRNA)のセンス鎖。
配列番号14:RNAi用dsRNA(4)(siRNA)のアンチセンス鎖
配列番号15:RNAi用dsRNA(5)(siRNA)のセンス鎖。
配列番号16:RNAi用dsRNA(5)(siRNA)のアンチセンス鎖
【0005】
本発明者らは、上述の課題と現状に鑑み、長年にわたる深い洞察と試行錯誤の結果、MG遺伝子とMGがもたらす次(1)〜(5)に示す実に驚くべき現象を発見した:
(1)MG遺伝子発現は、健常マウスに比べ、脂肪酸代謝異常症モデルJVSマウスで増強される。
(2)MG遺伝子の過剰発現は、ミトコンドリアを長いチューブ状に形態変化させる。、細胞内脂肪滴の蓄積を抑制する。
(3)RNAiによるMG遺伝子発現のノックダウンは、ミトコンドリアの断片化及び死細胞の増加をもたらす。
(4)MGは、ミトコンドリアタンパク質である。
(5)MGは、ミトコンドリア融合を促進ないしは刺激する。
この発明は、前述課題の解決に寄与するため、上記(1)〜(5)の基礎的知見に基づき着想かつ創作され、絶え間ない創意工夫の投入と勤勉により完成された。
【0006】
この発明によれば、前述の課題を解決するための手段として、次の(1)〜(8)がそれぞれ提供される:
(1)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを有効成分として薬効を奏する量、含有するミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
(2)上記(1)記載の完全長アミノ酸配列又はその部分配列からなるペプチドをコードする遺伝子の発現べクターを含有する、ミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
(3)配列番号1又は3に記載の完全長cDNA塩基配列に基づき設計かつ合成されるsiRNA、shRNA又はmiRNAをRNAi機能成分として薬効を奏する量、含有する制癌剤。
(4)siRNAが、配列番号7と8、9と10、11と12、13と14、及び15と16に記載の各1組のRNAからなる合計5種のdsRNA(1)〜(5)群から選ばれる少なくとも1種のdsRNAである請求項2に記載の制癌剤。
(5)siRNA、shRNA又はmiRNAの発現ベクターをRNAi機能成分として薬効を奏する量、含有する制癌剤。
(6)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドに対する抗体を活性成分として抗原抗体反応を呈する量、含有するミトコンドリア機能の診断剤又は検査薬。
(7)配列番号5及び6に記載のDNAからなるRT−PCR用プライマー。
(8)配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを作用成分として融合が生じる量、含有するミトコンドリア融合試薬。
【発明の効果】
【0007】
この発明は、肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防の技術を高め、併せて、上記疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等を可能にする。更に、この発明は、世界の保健と医療行政に寄与するだけではなく、今日の深刻な課題である肥満症、脂肪酸代謝異常症癌の制圧に多大に貢献すると共に、長寿と延命という福音を全ての人類にもたらす。
【発明を実施するための最良の形態】
【0008】
この発明の実施の形態に関し、次の通り詳述する:
(1)MG遺伝子
配列番号1及び3に記載のcDNAの完全長塩基配列及びその部分配列を、前述した肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防、あるいは上記した疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等に用いることができる。尚、部分配列の利用の具体例は、実験例3に記載の通り、MG遺伝子増幅用のPCR用プライマーである配列番号5と6に記載のDNAを上げることができる。
(2)MG遺伝子がコードするアミノ酸配列
配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列を、前述した肥満症、脂肪酸代謝異常症、癌等の診断、臨床検査、治療及び予防、あるいは上記した疾病の基礎研究、例えば脂肪細胞・軟骨・神経細胞等の分化機構の解明や制御技術の開発等に用いることができる。尚、配列番号2の第1番アミノ酸M〜第30番Lはミトコンドリア移行シグナルの領域、また、第243番V〜第353番Lはタンパク質−タンパク質相互作用に関わるモチーフであり、薬剤や試薬への部分配列の利用や設計において有用かつ活用可能である。
(3)脂肪酸代謝異常症モデル動物
JVSマウスは、未熟内臓脂肪酸代謝異常症あるいは全身性カルニチン欠乏疾患のモデル動物であり、脂肪肝、心肥大、成長障害等の多彩な症状を示す。そのため、JVSマウスは、健常マウスとの比較による遺伝子の異常発現の検出が容易であるので、実験例3において後述される通り、MG遺伝子のクローニングに推奨される。
【0009】
(4)RNAi用薬剤
MG遺伝子DNA塩基配列に基づくRNAi用薬剤としてのsiRNA、shRNA及びmiRNAの合成では、ノックダウン率を考慮し、標的mRNAが高次構造をとらない部分に対するよう事前に設計することが重要である。具体的には実施例1で後述される通り、配列番号7と8に記載の両RNAからなるdsRNAを上げることができる。
(5)発現ベクターを用いた薬剤
配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列からなるペプチドをコードする遺伝子の発現ベクターを、ミトコンドリア活性剤、抗肥満剤又は脂肪酸代謝異常症治療薬等の薬剤として利用することができる。
前記配列番号2及び4に記載の完全長アミノ酸配列及びその部分配列からなるペプチドをコードする遺伝子としては、例えば配列番号1及び3に記載のcDNAの完全長塩基配列或いはその部分配列からなるDNAが上げられる。これらのDNA以外でも、配列番号2及び4に記載のアミノ酸配列において、1個若しくは数個のアミノ酸残基が欠失、置換、或いは付加されたアミノ酸配列であって、ミトジェニンIと同様の機能を有するタンパク質をコードするDNAであってもよい。
発現ベクターは、上記の遺伝子DNAを、原核細胞ベクター、真核細胞ベクター、ウイルスベクター等の公知のベクターに挿入・連携することにより構築できる。その具体的手順については、例えば、常用のテキストMolecular Cloning A LABORATORY MANUAL,3rd ed.,J.Sambrookら著,CSHL Press 2001年発行(http//www.MolecularCloning.com)に記載されている。
発現ベクターは、そのままの形態で、或いは常法に従い、公知の担体を用いて製剤化した後、皮下、皮内、筋肉内等に投与することができる。
【0010】
この発明に係る薬剤、診断剤、試薬等は、アンプルやバイアル瓶等に分注され、液状又は乾燥のかたちで密封された状態で提供かつ使用に供される。
【0011】
以下、実験例及び実施例を上げ、本発明の構成と効果を具体的に説明する。但し、この発明は、これ等の実験例及び実施例だけに限定されるわけではない。
(実験例1)
【0012】
JVSマウスと健常マウスとの間で発現量が違うmRNAの同定
JVSマウスと健常マウスの各心臓細胞から常法によりmRNAを抽出・精製し、得られたmRNAをRT−PCRにより増幅することによりcDNAを調製した。次いで、cDNA解析キットを用い、mRNAの同定を行った。上記の解析キットには、GeneChip[Affymetrix社(米国)製]、蛍光Differential Display[タカラバイオ社(日本)製]及びPCR−Select Subtraction[Clontech社(米国)製]を用いた。その結果、健常マウスに比べJVSマウスでの発現量増加が検出された遺伝子数は、GeneChipでは176、蛍光Differential Displayは9、及びPCR−Select Subtractionは67であった。上記の通り同定された合計250遺伝子cDNAは、機能解析のため、それぞれ−20℃以下に保存した。
(実験例2)
【0013】
JVSマウスにおける特異的に発現が増加するcDNAのクローニングと遺伝子解析
実験例1で得た合計250遺伝子cDNAのうち、前記の3つの方法で共通して発現量増加が認められた合計7遺伝子につき、各発現ベクターを構築の後、これ等の発現ベクターをそれぞれ細胞に移入し得られる形質転換体を検鏡することにより、各遺伝子の機能解析を行った。その結果、ミトコンドリア融合を促進ないしは刺激する遺伝子を検出し、「Mitogenin I遺伝子」と命名した。該MG遺伝子のDNA塩基配列は、DNA解析装置により決定した。DNA塩基配列のホモロジー検索は、NCBIのBLASTを用いて行った。その結果、発見したMG遺伝子は、ヒトPDIP38(NCBIアクセッションNM_015584)のマウスホモログであり、マウスPDIP38(NCBIアクセッションNM_026389)と同一であるが、機能の相違することが確認された。
(実験例3)
【0014】
MGタンパク質の細胞内(ミトコンドリア)局在
JVSマウス心臓から精製したmRNAを使用し、RT−PCR法によりMG遺伝子を増幅の後、これをCT−GFP Fusion TOPOベクター[Invitrogen社[カナダ]製]にサブクローニングした。尚、MG遺伝子の増幅には、次のプライマーを用いた:
上流ブライマー:5‘−TTTTCTGGAATGTGAGGTGTGG−3’
下流プライマー:5‘−CTGGTGGGTAATCCGTGTCTAT−3’
次いで、FuGENE 6 transfection試薬[Roche Diagnostics(米国)製]を用い、MG−GFP融合遺伝子をマウス筋芽細胞にトランスフェクションした。比較対照として、同時に、MitoDsRedIを発現させることにより、ミトコンドリアを赤色標識した。トランスフェクション48時間後、共焦点レーザー顕微鏡を用いて解析した。
その結果を図1に示す。GFP−Mitogenin IとMitoDsRed1の両画像の重ね併せ(merge)による画像一致に基づき、MGはミトコンドリアタンパク質であることが確認された。
(実験例4)
【0015】
MGタンパク質によるミトコンドリア融合の促進
(a)MG遺伝子をpCMS−EGFPベクターにサブクローニングした後、これをマウス筋芽細胞にトランスフェクションした。トランスフェクション48時間後、ミトコンドリアをMitotracker Greenで染色し、蛍光顕微鏡を用いてミトコンドリアの形態を解析した。解析には、約50個の細胞を選択し、ミトコンドリアの形態変化に基づき、断片化された状態(fragment)、チューブ状(tube)、及び断片化とチューブ状の混在状態(mixture)に分類し、各分類形態のミトコンドリアを持つ細胞を数えた。
その結果を図2(B)と(C)に示す。ベクターだけをトランスフェクションした比較対照(mock)に比べ、MGの過剰発現により、ミトコンドリア融合による長いチューブ状のミトコンドリアを持つ細胞の増加が確認された。
(b)また、MGを過剰発現させ、そのミトコンドリアをDASPEI(ミトコンドリアの染色試薬)で染色の後、フローサイトメーターでミトコンドリア量を解析した。
その結果を図2(A)に示す。MGの過剰発現はミトコンドリア量の増加をもたらさないことが確認された。
(c)更に、ベクターだけをトランスフェクションした比較対照(mock)細胞と、MGをトランスフェクションした細胞の両者からRNAを抽出調製の後、RT−PCRで増幅、次いでアガロースゲル電気泳動にかけ、MG発現量を解析した。その結果を図2(A)左上の小枠に示す。MGトランスフェクション細胞ではMGの過剰発現が確認された。
【実施例1】
【0016】
dsRNAによるMG遺伝子発現ノックダウンによるミトコンドリアの形態変化
(a)RNAi法によりMG遺伝子をノックダウンするため、配列表1のDNA塩基配列に基づき、MG遺伝子特異的な次のdsRNAを設計した(上段はセンス鎖、下段はアンチセンス鎖):
5‘−CUAAGGAGGUGAAAGGCAAAACUCAAG−3’
3‘−UAGAUUCCUCCACUUUCCGUUUUGAGU−5’
尚、合成は[北海道システムサイエンス社(日本)]に委託した。上記の塩基配列からなるdsRNAをC2C12細胞にトランスフェクションし、その48時間後にミトコンドリアの形態を解析した。
その結果を図3(B)と(C)に示す。dsRNAをトランスフェクションしない比較対照(mock)に比べ、dsRNAトランスフェクションにより、MG遺伝子発現のノックダウン、及び断片化ミトコンドリアの増加が併せて確認された。
(b)また、dsRNAによりMG発現をノックダウンし、そのミトコンドリアをDASPEI(ミトコンドリアの染色試薬)で染色の後、フローサイトメーターでミトコンドリア量を解析した。
その結果を図3(A)に示す。MG発現のノックダウンはミトコンドリア量の増加を生じないことが確認された。
(c)更に、dsRNAをトランスフェクションしない比較対照(mock)細胞と、dsRNAをトランスフェクションした細胞の両者からRNAを抽出調製の後、RT−PCRで増幅、次いでアガロースゲル電気泳動にかけ、MG発現量を解析した。
その結果を図3(A)左上の小枠に示す。比較対照(mock)に比べ、dsRNAトランスフェクション細胞ではMG遺伝子発現のノックダウンが確認された。
【実施例2】
【0017】
MG遺伝子発現ノックダウンによる細胞の生存率
実施例1の記載と同様にしてdsRNAを用いるRNAi法により、MG遺伝子発現をノックダウンした後、その細胞をトリパンブルー(以下「TB」と略記する)で染色し、細胞の生存率を解析した。即ち、生細胞率(=TB染色陰性・生細胞数/総細胞数)、及び死細胞率(=TB染色陽性・死細胞数/総細胞数)をそれぞれ計数・算出した。
その結果を図4に示す。比較対照(mock)では生細胞率(TB negative)がほぼ100%であるのに対し、MG遺伝子発現ノックダウン(dsRNA)では、死細胞率(TB positive)が約60%に達した。また、死細胞の細胞内にはオートファジー様の小胞の形成が多数、確認された。尚、かかる小胞形成は、アポトーシス以外のメカニズムによる細胞死の誘導を示唆する。
【実施例3】
【0018】
MGタンパク質によるミトコンドリア融合の促進と細胞内脂肪滴の蓄積抑制
さらにミトコンドリアの形態変化と脂肪滴の蓄積との関係に注目して検討するため、MG遺伝子をFuGENE 6 transfection試薬[Roche Diagnostics(米国)製]を用いて未分化3T3−L1前駆脂肪細胞を分化誘導した脂肪細胞に発現させ、MitoTracker Greenで染色してミトコンドリアの形態を蛍光顕微鏡にて観察した(図5:A)。また、細胞内脂肪滴(図5:B)についても観察し、上述の解析方法に従い、細胞内脂肪滴及びtube formation potentialを算出し、統計学的な解析を行った(図5:B)。
【0019】
[解析方法1:細胞内脂肪滴の細胞内レベルの算出]
脂肪細胞を顕微鏡(オリンパス社製、OLYMPUS IX70)の40倍の対物レンズで観察し、最も細胞内脂肪滴レベルが(トリアシルグリセロールレベル:TGレベル)高くなる10ケ所を写真にとる(10枚の写真の総面積は1540mm2)。油滴が目で確認できるので、そのサイズから以下のように分類した。大:直径3μm以上、中:1−3μm、小:1μm以下。10枚の写真全ての大、中の油滴を数え、大の場合は係数1か2を掛け、中の場合は0.5か1を掛けてTGレベルを算出した。脂肪細胞への誘導率が実験によって異なるため、係数を掛けてコントロールのスコアが55〜65付近になるようにして算出した。
【0020】
[解析方法2:ミトコンドリアチューブのtube formation potentialの算出]
細胞全体のミトコンドリアの形態について、蛍光顕微鏡で観察し(100倍の対物レンズを使用し、油浸で観察する)、表1に示すように場合によって該当する係数を掛け算し、カウントした細胞数に占める割合(%)としてスコアー化した。また、その合計を、tube formation potentialとした。
【0021】
【表1】

【0022】
その結果、MG遺伝子の過剰発現によりミトコンドリアの融合が促進され、細胞内への脂肪滴の蓄積が抑制された。
【産業上の利用可能性】
【0023】
肥満症、脂肪酸代謝異常症、癌等に係る診断剤・臨床検査薬・治療薬・予防剤等、また、上記疾病等の基礎研究用試薬の製造・販売の分野で利用できる。
【図面の簡単な説明】
【0024】
【図1】細胞質(ミトコンドリア)におけるMG遺伝子発現の局在を示す検鏡写真。
【図2】(A)MG遺伝子の過剰発現がミトコンドリア量の増加をもたらさないことを示すフローサイトメーター計測値であり、図中の左上小枠はMG遺伝子の過剰発現を示す電気泳動像。(B)及び(C)は、MG遺伝子の過剰発現による、長いチューブ状のミトコンドリアの増加をそれぞれ示す。
【図3】(A)dsRNAによるMG遺伝子発現ノックダウンがミトコンドリア量の増加をもたらさないことを示すフローサイトメーター計測値であり、図中の左上小枠はMG遺伝子発現のノックダウンを示す電気泳動像。(B)及び(C)は、dsRNAによるMG遺伝子発現ノックダウンによる、断片化ミトコンドリア量の増加をそれぞれ示す。
【図4】dsRNAによるMG遺伝子発現のノックダウンが死細胞数の増加をもたらすことを示す。
【図5】脂肪細胞にMG遺伝子を発現させ、ミトコンドリアの形態及び細胞内脂肪滴を解析した結果を示す図である。(A)は蛍光顕微鏡観察の結果、(B)は統計的に解析した結果を示す。
【特許請求の範囲】
【請求項1】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを有効成分として薬効を奏する量、含有するミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
【請求項2】
請求項1記載の完全長アミノ酸配列又はその部分配列からなるペプチドをコードする遺伝子の発現べクターを含有する、ミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
【請求項3】
配列番号1又は3に記載の完全長cDNA塩基配列に基づき設計かつ合成されるsiRNA、shRNA又はmiRNAをRNAi機能成分として薬効を奏する量、含有する制癌剤。
【請求項4】
siRNAが、配列番号7と8、9と10、11と12、13と14、及び15と16に記載の各1組のRNAからなる合計5種のdsRNA(1)〜(5)群から選ばれる少なくとも1種のdsRNAである請求項2に記載の制癌剤。
【請求項5】
siRNA、shRNA又はmiRNAの発現ベクターをRNAi機能成分として薬効を奏する量、含有する制癌剤。
【請求項6】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドに対する抗体を活性成分として抗原抗体反応を呈する量、含有するミトコンドリア機能の診断剤又は検査薬。
【請求項7】
配列番号5及び6に記載のDNAからなるRT−PCR用プライマー。
【請求項8】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを作用成分として融合が生じる量、含有するミトコンドリア融合試薬。
【請求項1】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを有効成分として薬効を奏する量、含有するミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
【請求項2】
請求項1記載の完全長アミノ酸配列又はその部分配列からなるペプチドをコードする遺伝子の発現べクターを含有する、ミトコンドリア活性化剤、抗肥満薬、又は脂肪酸代謝異常症治療薬。
【請求項3】
配列番号1又は3に記載の完全長cDNA塩基配列に基づき設計かつ合成されるsiRNA、shRNA又はmiRNAをRNAi機能成分として薬効を奏する量、含有する制癌剤。
【請求項4】
siRNAが、配列番号7と8、9と10、11と12、13と14、及び15と16に記載の各1組のRNAからなる合計5種のdsRNA(1)〜(5)群から選ばれる少なくとも1種のdsRNAである請求項2に記載の制癌剤。
【請求項5】
siRNA、shRNA又はmiRNAの発現ベクターをRNAi機能成分として薬効を奏する量、含有する制癌剤。
【請求項6】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドに対する抗体を活性成分として抗原抗体反応を呈する量、含有するミトコンドリア機能の診断剤又は検査薬。
【請求項7】
配列番号5及び6に記載のDNAからなるRT−PCR用プライマー。
【請求項8】
配列番号2又は4に記載の完全長アミノ酸配列又はその部分配列からなるペプチドを作用成分として融合が生じる量、含有するミトコンドリア融合試薬。
【図4】


【図1】


【図2】


【図3】


【図5】




【図1】


【図2】


【図3】


【図5】


【公開番号】特開2007−151541(P2007−151541A)
【公開日】平成19年6月21日(2007.6.21)
【国際特許分類】
【出願番号】特願2006−185938(P2006−185938)
【出願日】平成18年7月5日(2006.7.5)
【出願人】(304020292)国立大学法人徳島大学 (307)
【Fターム(参考)】
【公開日】平成19年6月21日(2007.6.21)
【国際特許分類】
【出願日】平成18年7月5日(2006.7.5)
【出願人】(304020292)国立大学法人徳島大学 (307)
【Fターム(参考)】
[ Back to top ]

