ミネラル成分供給剤及び該供給剤を用いた水の処理方法
【課題】溶存イオン成分を取り除いた超純水に適度な濃度のミネラル成分を溶出付与するのに好適なミネラル成分供給剤及び該供給剤を用いた水の処理方法を提供する。
【解決手段】本発明の水の処理方法は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする。
【解決手段】本発明の水の処理方法は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、溶存イオン成分が取り除かれた超純水を、飲料水や観賞魚用水、養殖魚用水などの用途として用いる際に、ミネラル成分を付与するのに好適な、ミネラル成分供給剤及び該供給剤を用いた水の処理方法に関するものである。
【背景技術】
【0002】
近年、水道水に対する不信感から、国内外の様々な場所で採水されたミネラルウォーターが市販されている。また、水道水中の塩素やトリハロメタンを除去することを目的とした浄水器も多数市販されており、いわゆる「おいしい水」が注目されている。
【0003】
一方、身体に好適な弱アルカリ水を得るために、水を中和してpH値を高める処理方法として、カルシウム濾材を用いたフィルタを用い、水をフィルタに通過させることにより、水と濾材とを接触させて、濾材中を通過する間にカルシウム成分を水に溶出させ、水のpH値を高くして、アルカリ水化する方法が開示されている(例えば、特許文献1参照。)。この特許文献1に開示された方法では、単にすべての水をカルシウム濾材に通過させた場合には、水に対するカルシウム成分の溶出量が多くなりすぎ、ヒトの健康上において良い結果とならない高pHとなってしまうことが課題として挙げられ、これを解決するために、身体に好適な弱アルカリ性にする水処理用フィルタが開示されている。
【0004】
この水処理用フィルタは、フィルタ内に導入した水の一部を分流させて水処理剤層を通過させ、この分流通過水を他の水処理剤層を通過させない水と合流させることで、フィルタに導入した水全体を弱アルカリ水とするものである。水処理剤層は、カルシウム成分を含有するセラミック固形物のようなカルシウム成分含有材で構成され、カルシウム成分を含有する物質としては、珊瑚砂、焼成した珊瑚、焼成した貝化石、焼成した動物骨などが挙げられている。
【特許文献1】特開2004−82081号公報(段落[0002]、[0003]、[0007]、[0008]、[0041])
【発明の開示】
【発明が解決しようとする課題】
【0005】
一方、最近、逆浸透膜(Reverse Osmosis膜)技術の進歩により、水中のイオンや分子を定量的に取り除くことが可能となった。逆浸透膜法により得られる逆浸透水(RO水)は、通常の浄水処理では取り除くことが困難なウイルスや細菌も除去できることから、安全な水の処理方法として注目されている。
【0006】
しかし、逆浸透膜法により得られる水は、逆浸透膜通過直後のpH値は中性であり、また、ミネラル成分も取り除かれてしまうため、いわゆる「味気ない水」となっていた。
【0007】
そこで、カルシウム濃度比の高い弱アルカリ性の軟水が「名水」と称されていることに着目し、溶存イオン成分を取り除いた超純水に適度な濃度のミネラル成分を溶出付与する材料の開発を試みた。
【0008】
本発明の目的は、溶存イオン成分を取り除いた超純水に適度な濃度のミネラル成分を溶出付与するのに好適なミネラル成分供給剤及び該供給剤を用いた水の処理方法を提供することにある。
【0009】
本発明の別の目的は、重金属やアンモニウムを吸着して浄化し得る、ミネラル成分供給剤及び該供給剤を用いた水の処理方法を提供することにある。
【課題を解決するための手段】
【0010】
請求項1に係る発明は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤の改良である。その特徴ある構成は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するところにある。
【0011】
請求項2に係る発明は、請求項1に係る発明であって、混合前の粘土状粉末の平均粒径が0.001〜0.01mmであり、生物由来の炭酸塩粉末がホタテの貝殻の粉砕物であり、混合前のその平均粒径が0.001〜0.01mmであるミネラル成分供給剤である。
【0012】
請求項3に係る発明は、請求項1又は2に係る発明であって、混合物が生物由来の炭酸塩粉末30〜50質量部と粘土状粉末50〜70質量部に、炭酸塩粉末と粘土状粉末の全質量に対し水20〜50質量部の割合となるように混合攪拌して調製されたミネラル成分供給剤である。
【0013】
請求項4に係る発明は、請求項1ないし3いずれか1項に記載のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする水の処理方法である。
【0014】
請求項5に係る発明は、請求項4に係る発明であって、図1に示すように、ミネラル成分供給剤と超純水との接触が、ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、第1容器に超純水を通じることにより行われる水の処理方法である。
【0015】
請求項6に係る発明は、請求項4に係る発明であって、図2に示すように、ミネラル成分供給剤と超純水との接触が、ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、超純水を貯えた第2容器に第1容器を浸漬することにより行われる水の処理方法である。
【0016】
請求項7に係る発明は、請求項4ないし6いずれか1項に係る発明であって、超純水が逆浸透水又は脱イオン水である水の処理方法である。
【発明の効果】
【0017】
本発明のミネラル成分供給剤は、溶存イオン成分を取り除いた飲料用途にはあまり適していない超純水に適度な濃度のミネラル成分を溶出付与するのに適している。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する浄化作用も有する。
【0018】
本発明のミネラル成分供給剤を用いた水の処理方法は、「味気ない水」といわれるような超純水を安全でかつ簡便な方法により美味しい水とすることができる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有するため、身体に優しい水にすることができる。
【発明を実施するための最良の形態】
【0019】
次に本発明を実施するための最良の形態を図面に基づいて説明する。
【0020】
本発明のミネラル成分供給剤は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤の改良である。その特徴ある構成は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するところにある。
【0021】
生物由来の炭酸塩粉末と上記種類の粘土状粉末と水という化学薬品を使用していない自然物を原料とし、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するミネラル成分供給剤は、RO水などといった飲料用途にはあまり適していない超純水に適度な濃度のミネラル成分を溶出付与するのに適している。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有する。
【0022】
上記超純水を本発明のミネラル成分供給剤に接触させることで、カルシウムイオンやマグネシウムイオンといったミネラル成分が適度に付与され、また、pHが身体に適した弱アルカリ性となるため、このミネラル成分供給剤と接触後の処理水は、ヒトが飲んで美味しいと感じる、安全な飲み水となる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有するため、身体に優しい水にすることができる。
【0023】
本発明の処理対象となる超純水は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた水である。このような超純水としては、逆浸透膜法により得られるRO水やイオン交換樹脂法により得られる脱イオン水などが好ましいが、上記方法を用いて得られた水に限定されるものではなく、溶存イオンが取り除かれ、硬度が0ppmでpHが5〜7の範囲の、いわゆる「味気ない水」といわれるような超純水であれば、特に制限されない。
【0024】
ミネラル成分供給剤に配合される生物由来の炭酸塩粉末は主としてカルシウム源の供給に寄与する。この生物由来の炭酸塩粉末としては、ホタテの貝殻の粉砕物(以下、ホタテパウダーという。)が、最も安定にかつ安全にカルシウム成分を供給できることから好ましい。混合前のホタテパウダーの平均粒径は0.001〜0.01mmが、作製後のミネラル成分供給剤からのカルシウム成分を溶出する速度の面、担体成分への担持のし易さなどから好ましい。
【0025】
ミネラル成分供給剤に配合される粘土状粉末は主としてカルシウム以外のミネラル成分源の供給に寄与し、また、供給剤の担体としても機能する。更に、処理対象水に残存するアンモニウムイオンや重金属の吸着作用としても機能する。この粘土状粉末として列挙した、蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の成分は、カルシウム以外のミネラル成分が適度にその組成に含まれ、また、カルシウム源である生物由来の炭酸塩粉末の担持に適している。混合前の粘土状粉末の平均粒径は0.001〜0.01mmが、作製後のミネラル成分供給剤からのカルシウム成分以外の他のミネラル成分を溶出する速度の面や生物由来の炭酸塩粉末の担持の程度などから好ましい。
【0026】
蛙目粘土とは、淡灰ないし青灰色で粗粒の石英を含む、花崗岩が風化し、堆積してできた粘土である。
【0027】
木節粘土とは、暗灰ないし褐色で、炭化した木片など有機物を多く含み、花崗岩が風化し、堆積してできた非常に粒子が細かく、可塑性が高い粘土である。
【0028】
海洋性土とは、花崗岩が風化し海底に堆積した微粒状粘土と、プランクトンや魚類の死骸等が堆積及び混合したものが、数千年かけて地質変動に伴い地上に隆起した粘土であり、その平均粒径は0.002mm以下である。
【0029】
セピオライトは海泡石ともいい、緻密土状の単斜晶系または斜方晶系の鉱物である。
【0030】
次の表1に蛙目粘土及び木節粘土の化学組成の一例を示す。なお、表1中の各化学組成の単位は「質量%」である。
【0031】
【表1】

生物由来の炭酸塩粉末と粘土状粉末と水との混合では、先ず、生物由来の炭酸塩粉末と粘土状粉末を混合して混合粉末とし、次に、この混合粉末に水を添加して混合攪拌することで混合物を調製することが好ましい。このような順で混合物を調製するのは、添加する水によって混合物の硬さなどを調整するためであるが、ある一定の配合割合で、どの程度の硬さとなるかが判っている場合は、炭酸塩粉末と粘土状粉末と水とを一度に混合攪拌して混合物を調製しても良い。
【0032】
生物由来の炭酸塩粉末と粘土状粉末との混合割合は、生物由来の炭酸塩粉末が30〜50質量部、粘土状粉末が50〜70質量部となるように混合することが、溶出させるミネラル成分のバランスや、得られる供給剤の粘土状粉末の担体への炭酸塩粉末の担持の安定性の面などから好ましい。また、水の混合割合は炭酸塩粉末と粘土状粉末の全質量に対し20〜50質量部となるように混合することが、成形物の成形時の取扱い易さ、などから好ましい。
【0033】
次に、本発明のミネラル成分供給剤の作製方法を、生物由来の炭酸塩粉末としてホタテパウダーを、粘土状粉末として蛙目粘土を用いた例で説明する。
【0034】
先ず、平均粒径0.001〜0.100mmのホタテパウダーと、平均粒径0.001〜0.100mmの蛙目粘土とを用意し、ホタテパウダーと蛙目粘土と水とを所定の割合で混合及び攪拌することで混合物を調製する。ここで添加する水の割合が少ないと、攪拌し難くなるため、均一に混合することができず、水の割合が多すぎると、成形時に形状を保つことができないなどの不具合を生じる。
【0035】
次いで、調製した混合物を粒状に成形する。ここでの大きさや形状によって、作製されるミネラル成分供給剤のおおよその粒径や形状が決定する。作製後のミネラル成分供給剤からのミネラル成分の溶出の程度を考慮すると、混合物中に含まれる水の割合によって多少左右されるが、成形物は直径5〜10mm、長さ5〜10mmの粒状となるように成形することが好ましい。
【0036】
次に、成形した成形物を乾燥する。ここでは、成形物を室温で乾燥雰囲気下に5〜10日間、好ましくは5日間静置することで、成形物中の水の大部分を取り除く。
【0037】
最後に、乾燥した成形物を焼成する。乾燥した成形物を酸素含有雰囲気下、850〜1100℃の温度で6〜12時間焼成することで本発明のミネラル成分供給剤が得られる。成形物の焼成温度を上記範囲内としたのは、下限値未満の温度ではミネラル成分供給剤が水に溶解する不具合を生じるためであり、上限値を越える温度で焼成をすると、粘土の融解が進み、得られる供給剤の表面積が減少して、適度なミネラル成分の付与が進まなくなるためである。また、成形物の焼成時間を上記範囲内としたのは、下限値未満では表面がひび割れる不具合を生じるためであり、上限値を越えると供給剤の表面積が減少する不具合を生じるためである。このうち、900〜1150℃の温度で7〜10時間焼成することが特に好ましい。
【0038】
本発明の水の処理方法は、前述した本発明のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする。
【0039】
ミネラル成分供給剤に接触させた超純水(以下、処理水という。)の硬度及びpHが上記範囲内であれば、ヒトが飲むにあたって、美味しいと感じられる程度となり、本発明の処理方法によって、「味気ない水」といわれるような超純水を安全でかつ簡便な方法により美味しい水とすることができる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、ミネラル成分供給剤と超純水との接触によって、超純水に含まれる上記アンモニウムイオンや重金属がミネラル成分供給剤に吸着されるため、本発明の処理方法により得られる処理水を身体に優しい水にすることができる。
【0040】
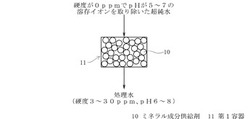
本発明の水の処理方法におけるミネラル成分供給剤と超純水との接触としては、図1に示すような、通水性を有しかつ供給剤の通過しない第1容器11に所定量のミネラル成分供給剤10を入れた後、ミネラル成分供給剤10が入った第1容器11に超純水12を通じることにより行われる。ここで第1容器11内に入れるミネラル成分供給剤10の使用量は、第1容器11への通水量や処理量によって、適宜調整可能である。通じる水の流速は、第1容器の大きさや、第1容器内に入れるミネラル成分供給剤の使用量によって適宜調節可能である。
【0041】
また、図2に示すような、通水性を有しかつ供給剤の通過しない第1容器11に所定量のミネラル成分供給剤10を入れた後、超純水12を貯えた第2容器13にミネラル成分供給剤10が入った第1容器11を一定時間浸漬することで行っても良い。この接触方法での第1容器の浸漬時間は、第1容器に入れたミネラル成分供給剤中の、生物由来の炭酸塩粉末と粘土状粉末の配合割合や供給剤の形状、第1容器内に入れるミネラル成分供給剤の使用量、第2容器に貯えた超純水の量などによって適宜調節する。
【0042】
上記接触方法は、その対象となる超純水の処理形態によってそれぞれ使い分けることができる。
【実施例】
【0043】
次に本発明の実施例を詳しく説明する。
<カルシウム源の検討>
ミネラル成分供給剤のカルシウム源としてホタテパウダーを、担体材料として木節粘土及び蛙目粘土を用意した。ホタテパウダーの組成を表2に、ホタテパウダーの写真図を図3にそれぞれ示す。
【0044】
【表2】

そして、ホタテパウダー0.4gを入れたフィルターにRO水を50ml通水させ、通水後の処理水のpHをpHメーターで、硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィー(IC)によりそれぞれ測定した。木節粘土についても同様の操作を行い、通水後の処理水のpH及び硬度を測定した。
【0045】
また、木節粘土100gにホタテパウダー33gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、900℃で9時間焼成することにより、粒状の担体材料に木節粘土を使用したミネラル成分供給剤を作製した。また、蛙目粘土についても同様の操作を行い、担体材料に蛙目粘土を使用したミネラル成分供給剤を作製した。そして、上記作製したミネラル成分供給剤16gを入れたフィルターにRO水を1L通水させ、通水後の処理水のpHをpHメーターで、硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィーによりそれぞれ測定した。これらの結果を次の表3に示す。
【0046】
【表3】

表3に示す結果から、カルシウム源や担体材料といった原料単体に対する通水では、処理水の硬度及びpHが高い数値となっていたが、上記原料を混合及び焼成を行うことによって得られた供給剤を用いることで、処理水の硬度及びpHの上昇を抑えることができることが確認された。
【0047】
次に、ホタテパウダー16gを入れたフィルターにRO水を1L通水させ、通水後の処理水の硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィーによりそれぞれ適宜測定した。得られた処理水の硬度を図4に示す。
【0048】
図4から明らかなように、処理水の硬度は15ppm前後を保っている結果が得られた。また、他のカルシウム源として安全に供給できると考えられる、炭酸カルシウム、真珠岩、寒水石などについても、上記ホタテパウダーと同様に実験を行ってみたが、実験により得られた処理水ではホタテパウダーを使用したほどの硬度は得られず、ホタテパウダーが通水後の処理水の硬度を高い数値で安定させることができる、カルシウム源の付与に適した原料であることが示唆された。
<ミネラル成分供給剤を作製する際の焼成温度の検討>
次いで、ミネラル成分供給剤を作製するにあたって、成形した成形物の焼成温度について検討した。
【0049】
蛙目粘土100gにホタテパウダー33gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を3つに分け、酸素含有雰囲気下、900℃、1100℃、1200℃でそれぞれ9時間焼成することにより、粒状のミネラル成分供給剤を3種類作製した。
【0050】
図5に示すように、内径が5.6cm、深さが1.2cmの漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水200mlを約20ml/秒の流速で通過させた。通過後の処理水の主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0051】
ミネラル成分供給剤作製時の焼成温度に対する通水後の処理水の硬度を図6に示す。
【0052】
図6から明らかなように、焼成温度が高くなるにつれて通水後の処理水の硬度が減少する傾向が見られた。これは高温での焼成によって、粘土の融解が進みミネラル成分供給剤の表面積が減少したためと考えられる。この結果から、ミネラル成分供給剤を作製する際の焼成温度には適した温度範囲が存在することが確認された。上記結果から950℃程度が最も最適な焼成温度であると推察される。
<ミネラル成分供給剤に配合するホタテパウダーの割合の検討>
次に、ミネラル成分供給剤に混合するホタテパウダーの割合について検討した。
【0053】
蛙目粘土100gにホタテパウダー30gと水40mlを添加し、よく攪拌して混合物を調製した。また、ホタテパウダーの配合量を30gから50gに代えて、別の混合物を調製した。これら混合物をサイズが1cm大の球状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、900℃でそれぞれ9時間焼成することにより、図7に示す、サイズが1cm大の球状のミネラル成分供給剤を2種類作製した。
【0054】
前述した漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水200mlを約20ml/秒の流速で通過させ、通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0055】
ホタテパウダーの配合割合をそれぞれ30質量部及び50質量部としたミネラル成分供給剤を用いた通水結果を次の表4に示す。
【0056】
【表4】

表4に示すように、通水後の処理水の硬度はともに2ppm前後と低い数値となったため、通水に使用するミネラル成分供給剤の量を2倍の32gにして再度検討したが、大きな改善は認められなかった。ここで、ホタテパウダーの割合が少ないミネラル成分供給剤の方が高い硬度を示しているが、この要因としてミネラル成分供給剤の形状が影響しているものと考えられる。
<ミネラル成分供給剤の形状についての検討>
以上の実験では、通水後の処理水で高い硬度が得られなかったため、ここでは、ミネラル成分供給剤の形状について検討した。図7に示す、サイズが1cm大の球状のものから、図8に示す、直径5〜10mm、長さ5〜10mmの粒状にその形状を代えて上記実験を再度行った。その結果を次の表5に示す。
【0057】
【表5】

表5から明らかなように、前述した表4の結果に比べて、通水後の処理水の硬度に明らかな上昇が認められ、硬度10ppm以上の水が得られることが判った。
<ミネラル成分供給剤に配合する担体材料の検討>
上記実験で使用した蛙目粘土以外の担体材料として、木節粘土、海洋性土及びセピオライトの3種類を用意し、これら担体材料100gにホタテパウダー30gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃でそれぞれ9時間焼成することにより、粒状のミネラル成分供給剤を3種類作製した。
【0058】
前述した漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水1000mlを約20ml/秒の流速で通過させ、通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。その結果を次の表6に示す。
【0059】
【表6】

表6より明らかなように、セピオライトを担体材料として用いた場合、他の材料に比べて、美味しい水としてバランスの良い硬度値、pH値となった。これはセピオライトが最もマグネシウムの含有割合が高いためと考えられる。
【0060】
なお、ここでは蛙目粘土を担体材料とした実験を行わなかったが、蛙目粘土は木節粘土とその組成傾向が似ているため、その結果も木節粘土と似通った内容となるものと推察される。
【0061】
以上の結果から、担体材料にセピオライト、カルシウム源にホタテパウダーを用い、ホタテパウダーの割合を30質量部に調整し、焼成温度950℃としたものがミネラル成分を適度に付与することができる最も適した条件と考えられる。
<200Lまでの通水試験>
セピオライト55g、木節粘土5g及び陶石10gにホタテパウダー30gと水27〜40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径3〜6mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃で9時間焼成することにより、粒状のミネラル成分供給剤を作製した。
【0062】
前述した漏斗内に上記作製したミネラル成分供給剤45gを敷き詰め、この漏斗にRO水200Lを約5.6ml/秒の流速で通過させ、一定流量通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0063】
また、ミネラル成分供給剤90gを使用して、上記実験と同様の通水試験を行った。その結果を図9及び図10に示す。
【0064】
図9及び図10から明らかなように、通水後の処理水の硬度は3〜15ppm、pHは弱酸性〜弱アルカリ性の範囲で安定していることが判った。また、使用するミネラル成分供給剤の量を90gとした実験例の方が、硬度、pHとも高い数値となった。
<各イオン濃度とおいしい水指標>
上記200Lの通水試験での、40L通水直後の処理水、200L通水直後の処理水の各イオン濃度を次の表7に示す。
【0065】
【表7】

表7に示す結果から、ミネラル成分供給剤から溶出するイオンはカルシウムの他、カリウム、またわずかにマグネシウムを溶出することが判った。
【0066】
続いて、上記表7に示す各イオン濃度から、次の式(1)に示す「おいしい水指標」を計算すると、40L通水直後の処理水では13.2ppm、200L通水直後の処理水では6.87ppmとなり、おいしい水指標である2ppm以上を十分に満たす結果となった。
【0067】
【数1】

<ミネラル成分供給剤を用いた吸着実験>
先ず、木節粘土70gにホタテパウダー30gと水25mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃で9時間焼成することにより、粒状のミネラル成分供給剤を作製した。
【0068】
次いで、超純水に0.05mmol濃度となるように硫酸アンモニウムを溶解し、この硫酸アンモニウム溶液50mlをビーカーに貯えた。
【0069】
次に、このビーカーにミネラル成分供給剤12gを浸漬して静置状態を保持した。
【0070】
続いて、ミネラル成分供給剤を浸漬して静置状態に保持してから30分経過後、60分経過後、90分経過後及び120分経過後にそれぞれ750μLずつ溶液をサンプリングし、サンプリングした溶液の残存アンモニウムイオン濃度、pH、カルシウムイオン濃度、硫酸イオン濃度、及び硬度をpHメーター及びイオンクロマトグラフィーを用いてそれぞれ測定した。その結果を図11〜図15にそれぞれ示す。
【0071】
図11に示すように、ミネラル成分供給剤浸漬後90分経過後に、残存アンモニウムイオン濃度が急激に低下する結果が得られた。この結果から、本発明のミネラル成分供給剤を水と接触させることで、ミネラル成分供給剤が水中に存在するアンモニウムイオンの吸着作用を示すことが確認された。
【0072】
図12〜図15に示すように、浸漬による水と供給剤との接触でも、通水での接触と同様に、カルシウムイオンや硫酸イオンの溶出が見られたが、その硬度は、通水時よりも高くなることが判った。これは、浸漬による接触の方が、水と供給剤との接触時間が長いことによると推察される。なお、その硬度は浸漬時間が長くなるにつれて上昇傾向を示したが、pH値は浸漬時間にかかわらず10〜11の間を保っている結果となった。
【産業上の利用可能性】
【0073】
本発明のミネラル成分供給剤は、ミネラル成分の適度な付与やpH調整だけでなく、アンモニウムイオンや重金属などを吸着するといった浄化作用も備えることから、飲料用途に限らず、観賞魚用水、養殖魚用水などの用途にも適用できる。
【図面の簡単な説明】
【0074】
【図1】本発明のミネラル成分供給剤と超純水との第1の接触方法を示す図。
【図2】本発明のミネラル成分供給剤と超純水との第2の接触方法を示す図。
【図3】ホタテパウダーの写真図。
【図4】ホタテパウダー単体に通水した処理水の硬度を示す図。
【図5】実験に使用した漏斗を用いた通水を示す図。
【図6】ミネラル成分供給剤作製時の焼成温度に対する通水後の処理水の硬度の関係を示す図。
【図7】実験に用いたサイズが1cm大の球状のミネラル成分供給剤の写真図。
【図8】実験に用いた直径5〜10mm、長さ5〜10mmの粒状のミネラル成分供給剤の写真図。
【図9】200L通水試験における、ミネラル成分供給剤への通水量と処理後の処理水の硬度の関係を示す図。
【図10】200L通水試験における、ミネラル成分供給剤への通水量と処理後の処理水のpHの関係を示す図。
【図11】ミネラル成分供給剤の浸漬時間と処理水の残存アンモニウムイオン濃度の関係を示す図。
【図12】ミネラル成分供給剤の浸漬時間と処理水のpHの関係を示す図。
【図13】ミネラル成分供給剤の浸漬時間と処理水のカルシウムイオン濃度の関係を示す図。
【図14】ミネラル成分供給剤の浸漬時間と処理水の硫酸イオン濃度の関係を示す図。
【図15】ミネラル成分供給剤の浸漬時間と処理水の硬度の関係を示す図。
【符号の説明】
【0075】
10 ミネラル成分供給剤
11 第1容器
12 超純水
13 第2容器
【技術分野】
【0001】
本発明は、溶存イオン成分が取り除かれた超純水を、飲料水や観賞魚用水、養殖魚用水などの用途として用いる際に、ミネラル成分を付与するのに好適な、ミネラル成分供給剤及び該供給剤を用いた水の処理方法に関するものである。
【背景技術】
【0002】
近年、水道水に対する不信感から、国内外の様々な場所で採水されたミネラルウォーターが市販されている。また、水道水中の塩素やトリハロメタンを除去することを目的とした浄水器も多数市販されており、いわゆる「おいしい水」が注目されている。
【0003】
一方、身体に好適な弱アルカリ水を得るために、水を中和してpH値を高める処理方法として、カルシウム濾材を用いたフィルタを用い、水をフィルタに通過させることにより、水と濾材とを接触させて、濾材中を通過する間にカルシウム成分を水に溶出させ、水のpH値を高くして、アルカリ水化する方法が開示されている(例えば、特許文献1参照。)。この特許文献1に開示された方法では、単にすべての水をカルシウム濾材に通過させた場合には、水に対するカルシウム成分の溶出量が多くなりすぎ、ヒトの健康上において良い結果とならない高pHとなってしまうことが課題として挙げられ、これを解決するために、身体に好適な弱アルカリ性にする水処理用フィルタが開示されている。
【0004】
この水処理用フィルタは、フィルタ内に導入した水の一部を分流させて水処理剤層を通過させ、この分流通過水を他の水処理剤層を通過させない水と合流させることで、フィルタに導入した水全体を弱アルカリ水とするものである。水処理剤層は、カルシウム成分を含有するセラミック固形物のようなカルシウム成分含有材で構成され、カルシウム成分を含有する物質としては、珊瑚砂、焼成した珊瑚、焼成した貝化石、焼成した動物骨などが挙げられている。
【特許文献1】特開2004−82081号公報(段落[0002]、[0003]、[0007]、[0008]、[0041])
【発明の開示】
【発明が解決しようとする課題】
【0005】
一方、最近、逆浸透膜(Reverse Osmosis膜)技術の進歩により、水中のイオンや分子を定量的に取り除くことが可能となった。逆浸透膜法により得られる逆浸透水(RO水)は、通常の浄水処理では取り除くことが困難なウイルスや細菌も除去できることから、安全な水の処理方法として注目されている。
【0006】
しかし、逆浸透膜法により得られる水は、逆浸透膜通過直後のpH値は中性であり、また、ミネラル成分も取り除かれてしまうため、いわゆる「味気ない水」となっていた。
【0007】
そこで、カルシウム濃度比の高い弱アルカリ性の軟水が「名水」と称されていることに着目し、溶存イオン成分を取り除いた超純水に適度な濃度のミネラル成分を溶出付与する材料の開発を試みた。
【0008】
本発明の目的は、溶存イオン成分を取り除いた超純水に適度な濃度のミネラル成分を溶出付与するのに好適なミネラル成分供給剤及び該供給剤を用いた水の処理方法を提供することにある。
【0009】
本発明の別の目的は、重金属やアンモニウムを吸着して浄化し得る、ミネラル成分供給剤及び該供給剤を用いた水の処理方法を提供することにある。
【課題を解決するための手段】
【0010】
請求項1に係る発明は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤の改良である。その特徴ある構成は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するところにある。
【0011】
請求項2に係る発明は、請求項1に係る発明であって、混合前の粘土状粉末の平均粒径が0.001〜0.01mmであり、生物由来の炭酸塩粉末がホタテの貝殻の粉砕物であり、混合前のその平均粒径が0.001〜0.01mmであるミネラル成分供給剤である。
【0012】
請求項3に係る発明は、請求項1又は2に係る発明であって、混合物が生物由来の炭酸塩粉末30〜50質量部と粘土状粉末50〜70質量部に、炭酸塩粉末と粘土状粉末の全質量に対し水20〜50質量部の割合となるように混合攪拌して調製されたミネラル成分供給剤である。
【0013】
請求項4に係る発明は、請求項1ないし3いずれか1項に記載のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする水の処理方法である。
【0014】
請求項5に係る発明は、請求項4に係る発明であって、図1に示すように、ミネラル成分供給剤と超純水との接触が、ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、第1容器に超純水を通じることにより行われる水の処理方法である。
【0015】
請求項6に係る発明は、請求項4に係る発明であって、図2に示すように、ミネラル成分供給剤と超純水との接触が、ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、超純水を貯えた第2容器に第1容器を浸漬することにより行われる水の処理方法である。
【0016】
請求項7に係る発明は、請求項4ないし6いずれか1項に係る発明であって、超純水が逆浸透水又は脱イオン水である水の処理方法である。
【発明の効果】
【0017】
本発明のミネラル成分供給剤は、溶存イオン成分を取り除いた飲料用途にはあまり適していない超純水に適度な濃度のミネラル成分を溶出付与するのに適している。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する浄化作用も有する。
【0018】
本発明のミネラル成分供給剤を用いた水の処理方法は、「味気ない水」といわれるような超純水を安全でかつ簡便な方法により美味しい水とすることができる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有するため、身体に優しい水にすることができる。
【発明を実施するための最良の形態】
【0019】
次に本発明を実施するための最良の形態を図面に基づいて説明する。
【0020】
本発明のミネラル成分供給剤は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤の改良である。その特徴ある構成は、生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するところにある。
【0021】
生物由来の炭酸塩粉末と上記種類の粘土状粉末と水という化学薬品を使用していない自然物を原料とし、粘土状粉末の担体に炭酸塩粉末を担持させた粒状の形態を有するミネラル成分供給剤は、RO水などといった飲料用途にはあまり適していない超純水に適度な濃度のミネラル成分を溶出付与するのに適している。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有する。
【0022】
上記超純水を本発明のミネラル成分供給剤に接触させることで、カルシウムイオンやマグネシウムイオンといったミネラル成分が適度に付与され、また、pHが身体に適した弱アルカリ性となるため、このミネラル成分供給剤と接触後の処理水は、ヒトが飲んで美味しいと感じる、安全な飲み水となる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、これらを吸着する作用も有するため、身体に優しい水にすることができる。
【0023】
本発明の処理対象となる超純水は、硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた水である。このような超純水としては、逆浸透膜法により得られるRO水やイオン交換樹脂法により得られる脱イオン水などが好ましいが、上記方法を用いて得られた水に限定されるものではなく、溶存イオンが取り除かれ、硬度が0ppmでpHが5〜7の範囲の、いわゆる「味気ない水」といわれるような超純水であれば、特に制限されない。
【0024】
ミネラル成分供給剤に配合される生物由来の炭酸塩粉末は主としてカルシウム源の供給に寄与する。この生物由来の炭酸塩粉末としては、ホタテの貝殻の粉砕物(以下、ホタテパウダーという。)が、最も安定にかつ安全にカルシウム成分を供給できることから好ましい。混合前のホタテパウダーの平均粒径は0.001〜0.01mmが、作製後のミネラル成分供給剤からのカルシウム成分を溶出する速度の面、担体成分への担持のし易さなどから好ましい。
【0025】
ミネラル成分供給剤に配合される粘土状粉末は主としてカルシウム以外のミネラル成分源の供給に寄与し、また、供給剤の担体としても機能する。更に、処理対象水に残存するアンモニウムイオンや重金属の吸着作用としても機能する。この粘土状粉末として列挙した、蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の成分は、カルシウム以外のミネラル成分が適度にその組成に含まれ、また、カルシウム源である生物由来の炭酸塩粉末の担持に適している。混合前の粘土状粉末の平均粒径は0.001〜0.01mmが、作製後のミネラル成分供給剤からのカルシウム成分以外の他のミネラル成分を溶出する速度の面や生物由来の炭酸塩粉末の担持の程度などから好ましい。
【0026】
蛙目粘土とは、淡灰ないし青灰色で粗粒の石英を含む、花崗岩が風化し、堆積してできた粘土である。
【0027】
木節粘土とは、暗灰ないし褐色で、炭化した木片など有機物を多く含み、花崗岩が風化し、堆積してできた非常に粒子が細かく、可塑性が高い粘土である。
【0028】
海洋性土とは、花崗岩が風化し海底に堆積した微粒状粘土と、プランクトンや魚類の死骸等が堆積及び混合したものが、数千年かけて地質変動に伴い地上に隆起した粘土であり、その平均粒径は0.002mm以下である。
【0029】
セピオライトは海泡石ともいい、緻密土状の単斜晶系または斜方晶系の鉱物である。
【0030】
次の表1に蛙目粘土及び木節粘土の化学組成の一例を示す。なお、表1中の各化学組成の単位は「質量%」である。
【0031】
【表1】

生物由来の炭酸塩粉末と粘土状粉末と水との混合では、先ず、生物由来の炭酸塩粉末と粘土状粉末を混合して混合粉末とし、次に、この混合粉末に水を添加して混合攪拌することで混合物を調製することが好ましい。このような順で混合物を調製するのは、添加する水によって混合物の硬さなどを調整するためであるが、ある一定の配合割合で、どの程度の硬さとなるかが判っている場合は、炭酸塩粉末と粘土状粉末と水とを一度に混合攪拌して混合物を調製しても良い。
【0032】
生物由来の炭酸塩粉末と粘土状粉末との混合割合は、生物由来の炭酸塩粉末が30〜50質量部、粘土状粉末が50〜70質量部となるように混合することが、溶出させるミネラル成分のバランスや、得られる供給剤の粘土状粉末の担体への炭酸塩粉末の担持の安定性の面などから好ましい。また、水の混合割合は炭酸塩粉末と粘土状粉末の全質量に対し20〜50質量部となるように混合することが、成形物の成形時の取扱い易さ、などから好ましい。
【0033】
次に、本発明のミネラル成分供給剤の作製方法を、生物由来の炭酸塩粉末としてホタテパウダーを、粘土状粉末として蛙目粘土を用いた例で説明する。
【0034】
先ず、平均粒径0.001〜0.100mmのホタテパウダーと、平均粒径0.001〜0.100mmの蛙目粘土とを用意し、ホタテパウダーと蛙目粘土と水とを所定の割合で混合及び攪拌することで混合物を調製する。ここで添加する水の割合が少ないと、攪拌し難くなるため、均一に混合することができず、水の割合が多すぎると、成形時に形状を保つことができないなどの不具合を生じる。
【0035】
次いで、調製した混合物を粒状に成形する。ここでの大きさや形状によって、作製されるミネラル成分供給剤のおおよその粒径や形状が決定する。作製後のミネラル成分供給剤からのミネラル成分の溶出の程度を考慮すると、混合物中に含まれる水の割合によって多少左右されるが、成形物は直径5〜10mm、長さ5〜10mmの粒状となるように成形することが好ましい。
【0036】
次に、成形した成形物を乾燥する。ここでは、成形物を室温で乾燥雰囲気下に5〜10日間、好ましくは5日間静置することで、成形物中の水の大部分を取り除く。
【0037】
最後に、乾燥した成形物を焼成する。乾燥した成形物を酸素含有雰囲気下、850〜1100℃の温度で6〜12時間焼成することで本発明のミネラル成分供給剤が得られる。成形物の焼成温度を上記範囲内としたのは、下限値未満の温度ではミネラル成分供給剤が水に溶解する不具合を生じるためであり、上限値を越える温度で焼成をすると、粘土の融解が進み、得られる供給剤の表面積が減少して、適度なミネラル成分の付与が進まなくなるためである。また、成形物の焼成時間を上記範囲内としたのは、下限値未満では表面がひび割れる不具合を生じるためであり、上限値を越えると供給剤の表面積が減少する不具合を生じるためである。このうち、900〜1150℃の温度で7〜10時間焼成することが特に好ましい。
【0038】
本発明の水の処理方法は、前述した本発明のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、ミネラル成分供給剤からミネラル成分を溶出させて超純水にミネラル成分を付与し、接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする。
【0039】
ミネラル成分供給剤に接触させた超純水(以下、処理水という。)の硬度及びpHが上記範囲内であれば、ヒトが飲むにあたって、美味しいと感じられる程度となり、本発明の処理方法によって、「味気ない水」といわれるような超純水を安全でかつ簡便な方法により美味しい水とすることができる。また、処理対象水にアンモニウムイオンや重金属が残存している場合は、ミネラル成分供給剤と超純水との接触によって、超純水に含まれる上記アンモニウムイオンや重金属がミネラル成分供給剤に吸着されるため、本発明の処理方法により得られる処理水を身体に優しい水にすることができる。
【0040】
本発明の水の処理方法におけるミネラル成分供給剤と超純水との接触としては、図1に示すような、通水性を有しかつ供給剤の通過しない第1容器11に所定量のミネラル成分供給剤10を入れた後、ミネラル成分供給剤10が入った第1容器11に超純水12を通じることにより行われる。ここで第1容器11内に入れるミネラル成分供給剤10の使用量は、第1容器11への通水量や処理量によって、適宜調整可能である。通じる水の流速は、第1容器の大きさや、第1容器内に入れるミネラル成分供給剤の使用量によって適宜調節可能である。
【0041】
また、図2に示すような、通水性を有しかつ供給剤の通過しない第1容器11に所定量のミネラル成分供給剤10を入れた後、超純水12を貯えた第2容器13にミネラル成分供給剤10が入った第1容器11を一定時間浸漬することで行っても良い。この接触方法での第1容器の浸漬時間は、第1容器に入れたミネラル成分供給剤中の、生物由来の炭酸塩粉末と粘土状粉末の配合割合や供給剤の形状、第1容器内に入れるミネラル成分供給剤の使用量、第2容器に貯えた超純水の量などによって適宜調節する。
【0042】
上記接触方法は、その対象となる超純水の処理形態によってそれぞれ使い分けることができる。
【実施例】
【0043】
次に本発明の実施例を詳しく説明する。
<カルシウム源の検討>
ミネラル成分供給剤のカルシウム源としてホタテパウダーを、担体材料として木節粘土及び蛙目粘土を用意した。ホタテパウダーの組成を表2に、ホタテパウダーの写真図を図3にそれぞれ示す。
【0044】
【表2】

そして、ホタテパウダー0.4gを入れたフィルターにRO水を50ml通水させ、通水後の処理水のpHをpHメーターで、硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィー(IC)によりそれぞれ測定した。木節粘土についても同様の操作を行い、通水後の処理水のpH及び硬度を測定した。
【0045】
また、木節粘土100gにホタテパウダー33gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、900℃で9時間焼成することにより、粒状の担体材料に木節粘土を使用したミネラル成分供給剤を作製した。また、蛙目粘土についても同様の操作を行い、担体材料に蛙目粘土を使用したミネラル成分供給剤を作製した。そして、上記作製したミネラル成分供給剤16gを入れたフィルターにRO水を1L通水させ、通水後の処理水のpHをpHメーターで、硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィーによりそれぞれ測定した。これらの結果を次の表3に示す。
【0046】
【表3】

表3に示す結果から、カルシウム源や担体材料といった原料単体に対する通水では、処理水の硬度及びpHが高い数値となっていたが、上記原料を混合及び焼成を行うことによって得られた供給剤を用いることで、処理水の硬度及びpHの上昇を抑えることができることが確認された。
【0047】
次に、ホタテパウダー16gを入れたフィルターにRO水を1L通水させ、通水後の処理水の硬度(Ca2+、Mg2+の合量)をイオンクロマトグラフィーによりそれぞれ適宜測定した。得られた処理水の硬度を図4に示す。
【0048】
図4から明らかなように、処理水の硬度は15ppm前後を保っている結果が得られた。また、他のカルシウム源として安全に供給できると考えられる、炭酸カルシウム、真珠岩、寒水石などについても、上記ホタテパウダーと同様に実験を行ってみたが、実験により得られた処理水ではホタテパウダーを使用したほどの硬度は得られず、ホタテパウダーが通水後の処理水の硬度を高い数値で安定させることができる、カルシウム源の付与に適した原料であることが示唆された。
<ミネラル成分供給剤を作製する際の焼成温度の検討>
次いで、ミネラル成分供給剤を作製するにあたって、成形した成形物の焼成温度について検討した。
【0049】
蛙目粘土100gにホタテパウダー33gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を3つに分け、酸素含有雰囲気下、900℃、1100℃、1200℃でそれぞれ9時間焼成することにより、粒状のミネラル成分供給剤を3種類作製した。
【0050】
図5に示すように、内径が5.6cm、深さが1.2cmの漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水200mlを約20ml/秒の流速で通過させた。通過後の処理水の主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0051】
ミネラル成分供給剤作製時の焼成温度に対する通水後の処理水の硬度を図6に示す。
【0052】
図6から明らかなように、焼成温度が高くなるにつれて通水後の処理水の硬度が減少する傾向が見られた。これは高温での焼成によって、粘土の融解が進みミネラル成分供給剤の表面積が減少したためと考えられる。この結果から、ミネラル成分供給剤を作製する際の焼成温度には適した温度範囲が存在することが確認された。上記結果から950℃程度が最も最適な焼成温度であると推察される。
<ミネラル成分供給剤に配合するホタテパウダーの割合の検討>
次に、ミネラル成分供給剤に混合するホタテパウダーの割合について検討した。
【0053】
蛙目粘土100gにホタテパウダー30gと水40mlを添加し、よく攪拌して混合物を調製した。また、ホタテパウダーの配合量を30gから50gに代えて、別の混合物を調製した。これら混合物をサイズが1cm大の球状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、900℃でそれぞれ9時間焼成することにより、図7に示す、サイズが1cm大の球状のミネラル成分供給剤を2種類作製した。
【0054】
前述した漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水200mlを約20ml/秒の流速で通過させ、通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0055】
ホタテパウダーの配合割合をそれぞれ30質量部及び50質量部としたミネラル成分供給剤を用いた通水結果を次の表4に示す。
【0056】
【表4】

表4に示すように、通水後の処理水の硬度はともに2ppm前後と低い数値となったため、通水に使用するミネラル成分供給剤の量を2倍の32gにして再度検討したが、大きな改善は認められなかった。ここで、ホタテパウダーの割合が少ないミネラル成分供給剤の方が高い硬度を示しているが、この要因としてミネラル成分供給剤の形状が影響しているものと考えられる。
<ミネラル成分供給剤の形状についての検討>
以上の実験では、通水後の処理水で高い硬度が得られなかったため、ここでは、ミネラル成分供給剤の形状について検討した。図7に示す、サイズが1cm大の球状のものから、図8に示す、直径5〜10mm、長さ5〜10mmの粒状にその形状を代えて上記実験を再度行った。その結果を次の表5に示す。
【0057】
【表5】

表5から明らかなように、前述した表4の結果に比べて、通水後の処理水の硬度に明らかな上昇が認められ、硬度10ppm以上の水が得られることが判った。
<ミネラル成分供給剤に配合する担体材料の検討>
上記実験で使用した蛙目粘土以外の担体材料として、木節粘土、海洋性土及びセピオライトの3種類を用意し、これら担体材料100gにホタテパウダー30gと水40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃でそれぞれ9時間焼成することにより、粒状のミネラル成分供給剤を3種類作製した。
【0058】
前述した漏斗内に上記作製したミネラル成分供給剤16gを敷き詰め、この漏斗にRO水1000mlを約20ml/秒の流速で通過させ、通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。その結果を次の表6に示す。
【0059】
【表6】

表6より明らかなように、セピオライトを担体材料として用いた場合、他の材料に比べて、美味しい水としてバランスの良い硬度値、pH値となった。これはセピオライトが最もマグネシウムの含有割合が高いためと考えられる。
【0060】
なお、ここでは蛙目粘土を担体材料とした実験を行わなかったが、蛙目粘土は木節粘土とその組成傾向が似ているため、その結果も木節粘土と似通った内容となるものと推察される。
【0061】
以上の結果から、担体材料にセピオライト、カルシウム源にホタテパウダーを用い、ホタテパウダーの割合を30質量部に調整し、焼成温度950℃としたものがミネラル成分を適度に付与することができる最も適した条件と考えられる。
<200Lまでの通水試験>
セピオライト55g、木節粘土5g及び陶石10gにホタテパウダー30gと水27〜40mlを添加し、よく攪拌して混合物を調製した。この混合物を直径3〜6mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃で9時間焼成することにより、粒状のミネラル成分供給剤を作製した。
【0062】
前述した漏斗内に上記作製したミネラル成分供給剤45gを敷き詰め、この漏斗にRO水200Lを約5.6ml/秒の流速で通過させ、一定流量通過後の処理水のpHをpHメーターで、主要イオン濃度をイオンクロマトグラフィーによりそれぞれ測定し、得られた各イオン濃度の数値から、水の硬度を求めた。なお、この通水操作は5回行い、以下に示す結果はその平均値を示したものである。
【0063】
また、ミネラル成分供給剤90gを使用して、上記実験と同様の通水試験を行った。その結果を図9及び図10に示す。
【0064】
図9及び図10から明らかなように、通水後の処理水の硬度は3〜15ppm、pHは弱酸性〜弱アルカリ性の範囲で安定していることが判った。また、使用するミネラル成分供給剤の量を90gとした実験例の方が、硬度、pHとも高い数値となった。
<各イオン濃度とおいしい水指標>
上記200Lの通水試験での、40L通水直後の処理水、200L通水直後の処理水の各イオン濃度を次の表7に示す。
【0065】
【表7】

表7に示す結果から、ミネラル成分供給剤から溶出するイオンはカルシウムの他、カリウム、またわずかにマグネシウムを溶出することが判った。
【0066】
続いて、上記表7に示す各イオン濃度から、次の式(1)に示す「おいしい水指標」を計算すると、40L通水直後の処理水では13.2ppm、200L通水直後の処理水では6.87ppmとなり、おいしい水指標である2ppm以上を十分に満たす結果となった。
【0067】
【数1】

<ミネラル成分供給剤を用いた吸着実験>
先ず、木節粘土70gにホタテパウダー30gと水25mlを添加し、よく攪拌して混合物を調製した。この混合物を直径5〜10mm、長さ5〜10mmの粒状に成形し、成形物を乾燥雰囲気下、室温で5日間静置して乾燥させ、更に乾燥した成形物を、酸素含有雰囲気下、950℃で9時間焼成することにより、粒状のミネラル成分供給剤を作製した。
【0068】
次いで、超純水に0.05mmol濃度となるように硫酸アンモニウムを溶解し、この硫酸アンモニウム溶液50mlをビーカーに貯えた。
【0069】
次に、このビーカーにミネラル成分供給剤12gを浸漬して静置状態を保持した。
【0070】
続いて、ミネラル成分供給剤を浸漬して静置状態に保持してから30分経過後、60分経過後、90分経過後及び120分経過後にそれぞれ750μLずつ溶液をサンプリングし、サンプリングした溶液の残存アンモニウムイオン濃度、pH、カルシウムイオン濃度、硫酸イオン濃度、及び硬度をpHメーター及びイオンクロマトグラフィーを用いてそれぞれ測定した。その結果を図11〜図15にそれぞれ示す。
【0071】
図11に示すように、ミネラル成分供給剤浸漬後90分経過後に、残存アンモニウムイオン濃度が急激に低下する結果が得られた。この結果から、本発明のミネラル成分供給剤を水と接触させることで、ミネラル成分供給剤が水中に存在するアンモニウムイオンの吸着作用を示すことが確認された。
【0072】
図12〜図15に示すように、浸漬による水と供給剤との接触でも、通水での接触と同様に、カルシウムイオンや硫酸イオンの溶出が見られたが、その硬度は、通水時よりも高くなることが判った。これは、浸漬による接触の方が、水と供給剤との接触時間が長いことによると推察される。なお、その硬度は浸漬時間が長くなるにつれて上昇傾向を示したが、pH値は浸漬時間にかかわらず10〜11の間を保っている結果となった。
【産業上の利用可能性】
【0073】
本発明のミネラル成分供給剤は、ミネラル成分の適度な付与やpH調整だけでなく、アンモニウムイオンや重金属などを吸着するといった浄化作用も備えることから、飲料用途に限らず、観賞魚用水、養殖魚用水などの用途にも適用できる。
【図面の簡単な説明】
【0074】
【図1】本発明のミネラル成分供給剤と超純水との第1の接触方法を示す図。
【図2】本発明のミネラル成分供給剤と超純水との第2の接触方法を示す図。
【図3】ホタテパウダーの写真図。
【図4】ホタテパウダー単体に通水した処理水の硬度を示す図。
【図5】実験に使用した漏斗を用いた通水を示す図。
【図6】ミネラル成分供給剤作製時の焼成温度に対する通水後の処理水の硬度の関係を示す図。
【図7】実験に用いたサイズが1cm大の球状のミネラル成分供給剤の写真図。
【図8】実験に用いた直径5〜10mm、長さ5〜10mmの粒状のミネラル成分供給剤の写真図。
【図9】200L通水試験における、ミネラル成分供給剤への通水量と処理後の処理水の硬度の関係を示す図。
【図10】200L通水試験における、ミネラル成分供給剤への通水量と処理後の処理水のpHの関係を示す図。
【図11】ミネラル成分供給剤の浸漬時間と処理水の残存アンモニウムイオン濃度の関係を示す図。
【図12】ミネラル成分供給剤の浸漬時間と処理水のpHの関係を示す図。
【図13】ミネラル成分供給剤の浸漬時間と処理水のカルシウムイオン濃度の関係を示す図。
【図14】ミネラル成分供給剤の浸漬時間と処理水の硫酸イオン濃度の関係を示す図。
【図15】ミネラル成分供給剤の浸漬時間と処理水の硬度の関係を示す図。
【符号の説明】
【0075】
10 ミネラル成分供給剤
11 第1容器
12 超純水
13 第2容器
【特許請求の範囲】
【請求項1】
硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤において、
生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、前記成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、前記粘土状粉末の担体に前記炭酸塩粉末を担持させた粒状の形態を有することを特徴とするミネラル成分供給剤。
【請求項2】
混合前の粘土状粉末の平均粒径が0.001〜0.01mmであり、生物由来の炭酸塩粉末がホタテの貝殻の粉砕物であり、混合前のその平均粒径が0.001〜0.01mmである請求項1記載のミネラル成分供給剤。
【請求項3】
混合物が生物由来の炭酸塩粉末30〜50質量部と粘土状粉末50〜70質量部に、前記炭酸塩粉末と前記粘土状粉末の全質量に対し水20〜50質量部の割合となるように混合攪拌して調製された請求項1又は2記載のミネラル成分供給剤。
【請求項4】
請求項1ないし3いずれか1項に記載のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、前記ミネラル成分供給剤からミネラル成分を溶出させて前記超純水に前記ミネラル成分を付与し、前記接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする水の処理方法。
【請求項5】
ミネラル成分供給剤と超純水との接触が、前記ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、前記第1容器に前記超純水を通じることにより行われる請求項4記載の水の処理方法。
【請求項6】
ミネラル成分供給剤と超純水との接触が、前記ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、前記超純水を貯えた第2容器に前記第1容器を浸漬することにより行われる請求項4記載の水の処理方法。
【請求項7】
超純水が逆浸透水又は脱イオン水である請求項4ないし6いずれか1項に記載の水の処理方法。
【請求項1】
硬度が0ppmでpHが5〜7の溶存イオン成分を取り除いた超純水にミネラル成分を付与するミネラル成分供給剤において、
生物由来の炭酸塩粉末と蛙目粘土、木節粘土、海洋性土及びセピオライトからなる群より選ばれた1種又は2種以上の粘土状粉末と水とを混合攪拌して調製された混合物を粒状に成形し、前記成形物を乾燥し、更に乾燥した成形物を焼成することにより得られ、前記粘土状粉末の担体に前記炭酸塩粉末を担持させた粒状の形態を有することを特徴とするミネラル成分供給剤。
【請求項2】
混合前の粘土状粉末の平均粒径が0.001〜0.01mmであり、生物由来の炭酸塩粉末がホタテの貝殻の粉砕物であり、混合前のその平均粒径が0.001〜0.01mmである請求項1記載のミネラル成分供給剤。
【請求項3】
混合物が生物由来の炭酸塩粉末30〜50質量部と粘土状粉末50〜70質量部に、前記炭酸塩粉末と前記粘土状粉末の全質量に対し水20〜50質量部の割合となるように混合攪拌して調製された請求項1又は2記載のミネラル成分供給剤。
【請求項4】
請求項1ないし3いずれか1項に記載のミネラル成分供給剤と硬度が0ppmでpHが5〜7の溶存イオンを取り除いた超純水とを接触させることにより、前記ミネラル成分供給剤からミネラル成分を溶出させて前記超純水に前記ミネラル成分を付与し、前記接触させた超純水の硬度を3〜30ppmかつpH6〜8にそれぞれ調整することを特徴とする水の処理方法。
【請求項5】
ミネラル成分供給剤と超純水との接触が、前記ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、前記第1容器に前記超純水を通じることにより行われる請求項4記載の水の処理方法。
【請求項6】
ミネラル成分供給剤と超純水との接触が、前記ミネラル成分供給剤を通水性を有しかつ供給剤の通過しない第1容器に入れた後、前記超純水を貯えた第2容器に前記第1容器を浸漬することにより行われる請求項4記載の水の処理方法。
【請求項7】
超純水が逆浸透水又は脱イオン水である請求項4ないし6いずれか1項に記載の水の処理方法。
【図1】


【図2】


【図4】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図3】


【図7】


【図8】




【図2】


【図4】


【図5】


【図6】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図3】


【図7】


【図8】


【公開番号】特開2010−137123(P2010−137123A)
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願番号】特願2008−313189(P2008−313189)
【出願日】平成20年12月9日(2008.12.9)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月4日 社団法人日本化学会関東支部発行の「日本化学会 第2回関東支部大会(2008) 講演予稿集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月28日 社団法人日本分析化学会 フローインジェクション分析研究懇談会発行の「15th ICFIA & 25th Anniversary Meeting of JAFIA−Program & Book of Abstracts−」に発表
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(508363133)株式会社デンショウ (1)
【Fターム(参考)】
【公開日】平成22年6月24日(2010.6.24)
【国際特許分類】
【出願日】平成20年12月9日(2008.12.9)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月4日 社団法人日本化学会関東支部発行の「日本化学会 第2回関東支部大会(2008) 講演予稿集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年9月28日 社団法人日本分析化学会 フローインジェクション分析研究懇談会発行の「15th ICFIA & 25th Anniversary Meeting of JAFIA−Program & Book of Abstracts−」に発表
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(508363133)株式会社デンショウ (1)
【Fターム(参考)】
[ Back to top ]

