メタロセン化合物
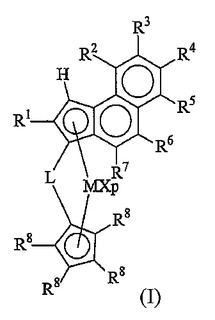
式(I):

[式中、Mは遷移金属の原子であり;Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、RはC1-C40の炭化水素基である)であり;Lは2価の架橋基であり;R1はC1-C40の炭化水素基であり;R3はC1-C40の炭化水素基であり;R2、R4、R5、R6、R7およびR8は、同一または異なって、水素原子またはC1-C40の炭化水素基である]
のメタロセン化合物。

[式中、Mは遷移金属の原子であり;Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、RはC1-C40の炭化水素基である)であり;Lは2価の架橋基であり;R1はC1-C40の炭化水素基であり;R3はC1-C40の炭化水素基であり;R2、R4、R5、R6、R7およびR8は、同一または異なって、水素原子またはC1-C40の炭化水素基である]
のメタロセン化合物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、明確な置換パターンを有するベンゾインデニル部分を含むメタロセン化合物に関する。本発明は、さらに、オレフィン重合用触媒成分としての該メタロセン化合物の使用、およびその重合方法に関する。
【0002】
本発明において、ベンゾインデニルおよびインデニル部分の位置の数え方は、式(a)および(b)の部分において、次に示すとおりである。
【化1】

【背景技術】
【0003】
ベンゾインデニル部分を含むメタロセン化合物は、US 5,830,821により知られている。しかしながら、この文献において、一般式は過度の置換ベンゾインデニル含有メタロセン化合物を包含しているが、例示された化合物はベンゾインデニル環の5位で置換されていない。
【0004】
EP 754 698は、ジメチルシリレン(2,7-ジメチル-4,5-(2-メチル-ベンゾ)-1-インデニル)(2,7-ジ-t-ブチル-9-フルオレニル)ジルコニウム ジクロライドを開示している。表1に示されるように、この化合物は、対応の無置換のベンゾインデニル化合物よりも低い重合活性を有する。
【0005】
US 6,228,795は、化合物の長い一覧表の中で、フェニル(メチル)シランジイルビス(2-メチル-4,5-(メチルベンゾ)-1-インデニル)Zr(CH3)2およびフェニル(メチル)シランジイルビス(2-メチル-4,5-(テトラメチルベンゾ)-1-インデニル)Zr(CH3)2を報告している。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記の最初の化合物において、メチル基の位置についての指摘はない。これに対して、これらのメタロセン化合物が重合反応に用いられるとき、本発明の比較例で示されるように、メチル基の位置はそれらの活性の改善に重要である。
【課題を解決するための手段】
【0007】
本出願人は、4,5-ベンゾインデニル部分を含むメタロセン化合物がオレフィン重合用の触媒成分として用いられるとき、4,5-ベンゾインデニル部分を5位で置換することにより、その化合物の重合活性を増大することができることを見出した。
【0008】
本発明の課題は、式(I):
【化2】

(式中、
Mは元素周期律表の3、4、5、6族またはランタニドもしくはアクチニド族に属するものから選択される遷移金属の原子であり;好ましくは、Mはチタニウム、ジルコニウムまたはハフニウムであり;
pは0〜3の整数で、好ましくは、pは2であり、金属Mの形式上の(formal)酸化状態マイナス2に等しく;
【0009】
Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、Rは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはRは元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基である)であるか;または二つのXは、置換または無置換のブタジエニル基またはOR'O基(ここで、R'はC1-C40アルキリデン、C6-C40アリーリデン、C7-C40アルキルアリーリデンおよびC7-C40アリールアルキリデン基から選択される2価の基である)を任意に形成してもよく;好ましくはXは水素原子、ハロゲン原子またはR基であり;より好ましくはXは塩素またはメチル基であり;
【0010】
Lは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、C1-C20アルキリデン、C3-C20シクロアルキリデン、C6-C20アリーリデン、C7-C20アルキルアリーリデンまたはC7-C20アリールアルキリデン基、およびSiMe2、SiPh2のようなシリコン原子を5つまで含むシリリデン基から選択される2価の架橋基であり;好ましくは、Lは基Z(R'')2(ここで、Zは炭素またはシリコン原子であり、R''は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C10アルキル、C2-C10アルケニル、C2-C10アルキニル、C6-C10アリール、C7-C10アルキルアリールもしくはC7-C10アリールアルキル基である)であり;より好ましくは、基Z(R'')2はSi(CH3)2、SiPh2、SiPhMe、SiMe(SiMe3)、CH2、(CH2)2およびC(CH3)2であり;
【0011】
R1は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR1は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR1は直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキル基であり;さらに好ましくはR1はメチル、エチルまたはイソプロピル基であり;
【0012】
R3は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR3は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR3は直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルまたはC6-C40アリール基であり;さらに好ましくはR3はメチル、エチルまたはフェニル基であり、
【0013】
R2、R4およびR5は、R2、R4およびR5の少なくとも一つが水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR2、R4およびR5は、R2、R4およびR5の少なくとも一つが水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR2、R4およびR5は水素原子であり;
【0014】
R3はR4と共におよび/またはR4はR5と共に結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい、脂肪族または芳香族の3〜7員環を形成していてもよく;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;
【0015】
R6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR6およびR7は水素原子または直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキル基であり;さらに好ましくはR6およびR7は水素原子またはメチル基であり;
【0016】
R8は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C50の炭化水素基であり;R8基は二つ以上一緒になって、元素周期律表の13〜16族に属するヘテロ原子を少なくとも一つ含む一つ以上の3〜7員環を形成することもでき;該環は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C20の炭化水素基でさらに置換され得る)
のメタロセン化合物である。
【0017】
式(I)の化合物のサブクラスは、式(II)
【化3】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は前に記載されており、
R10は、水素原子または元素周期律表13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR10は水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR10はメチル基、エチル基またはイソプロピル基のような直鎖状または分枝鎖状のC1-C20アルキル基であり;好ましくはR1およびR10は同時に分枝鎖状のC1-C40アルキル基ではなく;
【0018】
R11、R12、R13およびR14は互いに同一または異なって、水素原子、または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもC1-C40の炭化水素基であり;好ましくはR11、R12、R13およびR14は互いに同一または異なって、水素原子、または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;隣接する二つのR11、R12、R13およびR14基は結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい3〜7員環を形成することもでき;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;より好ましくはR11はC6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であるか、またはR12と一緒になって、1〜20の炭素原子を有する炭化水素基で置換され得るフェニルを形成し;
より好ましくはR12は水素原子であるか、またはR11と一緒になって上記のような3〜7員環を形成し;
より好ましくはR14およびR13は水素原子またはC1-C20アルキル基である)
の化合物である。
【0019】
式(II)の化合物の好ましいクラスは、式(III)
【化4】

(式中、M、X、p、L、R1、R2、R3、R4、R5、R6、R7、R10、R13およびR14は前に記載されている)
の化合物である。
【0020】
式(I)の化合物のさらなるサブクラスは、式(IV)
【化5】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は前に記載されており;
R15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR15およびR16は、メチル、エチル、イソプロピルまたはトリメチルシリル基のような、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状のC1-C40アルキル基である)
の化合物である。
【0021】
式(I)のメタロセン化合物は、次の工程:
a) 式(Ia)
【化6】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは前記の意味を有する)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム[ここで、Bはアルカリ金属またはアルカリ土類金属であり、jは1または2であり(Bがアルカリ金属、好ましくはリチウムであるときjは1であり、Bがアルカリ土類金属であるときjは2である);Tは、1以上のSiまたはGe原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C20アルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり;好ましくはTはメチルまたはブチル基であり;
【0022】
T1はハロゲン原子または基OR'''(ここで、R'''は、元素周期律表の13〜17族に属するヘテロ原子を1以上任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基である)であり;好ましくはT1はハロゲン原子、より好ましくは臭素である]から選択される塩基と接触させること(ここで、該塩基と式(Ia)のリガンドとのモル比は少なくとも2:1であり;過剰の該塩基を用いることができる);および
b) 工程a)で得られた物質を、式MXp+2(ここで、M、Xおよびpは前記の意味を有する)の化合物と接触させること;
を含む方法で得られる。
【0023】
式(Ia)のリガンドは、次の工程:
a) 式(VI):
【化7】

(式中、R1、R2、R3、R4、R5、R6およびR7は前のとおり定義される)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム(ここで、T、j、BおよびT1は前のとおり定義される)から選択される塩基と接触させること(ここで、該塩基と式(VI)の化合物とのモル比は少なくとも1:1であり;過剰の該塩基を用いることができる);
【0024】
b) 工程a)で得られたアニオン化合物を式(VII):
【化8】

(式中、R8およびLは前のとおり定義され、Yは塩素、臭素およびヨウ素であり、好ましくはYは塩素または臭素である)
の化合物と接触させること;
を含む方法で得られる。
【0025】
式(I)のリガンドを製造するための別の方法は、次の工程:
a) 式(VIIa):
【化9】

(式中、R8は前のとおり定義される)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム(ここで、T、j、BおよびT1は前のとおり定義される)から選択される塩基と接触させること(ここで、該塩基と式(VIIa)の化合物とのモル比は少なくとも1:1であり;過剰の塩基を用いることができる);
【0026】
b) 工程a)で得られたアニオン化合物を、式(VIa):
【化10】

(式中、R1、R2、R3、R4、R5、R6、R7およびLは前のとおり定義され、Yは塩素、臭素およびヨウ素であり、好ましくはYは塩素または臭素である)
の化合物と接触させること;
を含む。
【0027】
上記の方法は、好ましくは極性または無極性どちらかの、非プロトン性溶媒中で行われる。該非プロトン性溶媒は、好ましくは任意にハロゲン化された芳香族もしくは脂肪族の炭化水素、またはエーエルであり;より好ましくはそれはベンゼン、トルエン、ペンタン、ヘキサン、ヘプタン、シクロヘキサン、ジクロロメタン、ジエチルエーエル、テトラヒドロフランおよびそれらの混合物から選択される。上記の方法は、-100℃〜+80℃、より好ましくは-20℃〜+70℃の範囲の温度で行われる。
【0028】
本発明のさらなる課題は、式(Ia)
【化11】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは前記の意味を有する)
のリガンド、および/またはその2重結合異性体である。
【0029】
式(II)、(III)および(IV)のメタロセン化合物は、それぞれ式(IIa)、(IIIa)および(IVa):
【化12】

(式中、L、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15およびR16は前に記載されている)
のリガンド、および/またはそれらの2重結合異性体から出発して、上記の方法を用いて製造される。
【0030】
式(IIa)、(IIIa)および(IVa)のリガンドは、対応する出発化合物を用いて、上記の方法により製造される。
式(VI)および(VIa)の化合物は、US 5,830,821に従って、出発化合物として、適切に置換されたナフタレン部分を用いて製造される。
【0031】
本発明の課題のメタロセン化合物は、オレフィン重合用の触媒系を得るための触媒成分として用いられる。
それゆえ、本発明のさらなる課題は、
a) 少なくとも一つの式(I)のメタロセン化合物;
b) 少なくとも一つのアルモキサン、またはアルキルメタロセンカチオンを形成することができる化合物;および
c) 任意に有機アルミニウム化合物;
を接触させることにより得られる触媒系である。
【0032】
好ましくは、式(II)、(III)および(IV)のメタロセン化合物の少なくとも一つが用いられる。
成分b)として用いられるアルモキサンは、水と式HjAlU3-jまたはHjAl2U6-j(ここで、U置換基は、Uの少なくとも一つはハロゲンでないとの条件で、同一または異なって、水素原子、ハロゲン原子、任意にシリコンまたはゲルマニウム原子を含んでいてもよい、C1-C20アルキル、C3-C20シクロアルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり、jは0〜1の範囲で整数でなくてもよい)の有機アルミニウム化合物とを反応させることにより得られる。この反応において、Al/水のモル比は、好ましくは1:1〜100:1の間に含まれる。
アルミニウムとメタロセンの金属とのモル比は、一般的に、約10:1〜約30000:1の間、好ましくは、約100:1〜約5000:1の間に含まれる。
【0033】
本発明の触媒中に用いられるアルモキサンは、次のタイプ:
【化13】

(式中、n1は0または1〜40の整数であり、置換基Uは、前のとおり定義される)
の少なくとも1つのグループ、および/または環式化合物の場合、次のタイプ:
【化14】

(式中、n2は2〜40の整数であり、U置換基は前のとおり定義される)
を含む、直鎖状、分枝鎖状または環式の化合物であると考えられる。
【0034】
本発明による使用に適したアルモキサンの例は、メチルアルモキサン(MAO)、テトラ-(イソブチル)アルモキサン(TIBAO)、テトラ-(2,4,4-トリメチル-ペンチル)アルモキサン(TIOAO)、テトラ-(2,3-ジメチルブチル)アルモキサン(TDMBAO)およびテトラ-(2,3,3-トリメチルブチル)アルモキサン(TTMBAO)である。
特に興味のある助触媒は、アルキル基およびアリール基が特定の分枝パターンを有する、WO 99/21899およびWO 01/21674に記載されているものである。
【0035】
WO 99/21899およびWO 01/21674に記載されている、水と反応させて適当なアルモキサン(b)を与えることができる非限定的なアルミニウム化合物の例は、トリス(2,3,3-トリメチル-ブチル)アルミニウム、トリス(2,3-ジメチル-ヘキシル)アルミニウム、トリス(2,3-ジメチル-ブチル)アルミニウム、トリス(2,3-ジメチル-ペンチル)アルミニウム、トリス(2,3-ジメチル-ヘプチル)アルミニウム、トリス(2-メチル-3-エチル-ペンチル)アルミニウム、トリス(2-メチル-3-エチル-ヘキシル)アルミニウム、トリス(2-メチル-3-エチル-ヘプチル)アルミニウム、トリス(2-メチル-3-プロピル-ヘキシル)アルミニウム、トリス(2-エチル-3-メチル-ブチル)アルミニウム、トリス(2-エチル-3-メチル-ペンチル)アルミニウム、トリス(2,3-ジエチル-ペンチル)アルミニウム、トリス(2-プロピル-3-メチル-ブチル)アルミニウム、トリス(2-イソプロピル-3-メチル-ブチル)アルミニウム、トリス(2-イソブチル-3-メチル-ペンチル)アルミニウム、トリス(2,3,3-トリメチル-ペンチル)アルミニウム、トリス(2,3,3-トリメチル-ヘキシル)アルミニウム、トリス(2-エチル-3,3-ジメチル-ブチル)アルミニウム、トリス(2-エチル-3,3-ジメチル-ペンチル)アルミニウム、トリス(2-イソプロピル-3,3-ジメチル-ブチル)アルミニウム、トリス(2-トリメチルシリル-プロピル)アルミニウム、トリス(2-メチル-3-フェニル-ブチル)アルミニウム、トリス(2-エチル-3-フェニル-ブチル)アルミニウム、トリス(2,3-ジメチル-3-フェニル-ブチル)アルミニウム、トリス(2-フェニル-プロピル)アルミニウム、トリス[2-(4-フルオロ-フェニル)-プロピル]アルミニウム、トリス[2-(4-クロロ-フェニル)-プロピル]アルミニウム、トリス[2-(3-イソプロピル-フェニル)-プロピル]アルミニウム、トリス(2-フェニル-ブチル)アルミニウム、トリス(3-メチル-2-フェニル-ブチル)アルミニウム、トリス(2-フェニル-ペンチル)アルミニウム、トリス[2-(ペンタフルオロフェニル)-プロピル]アルミニウム、トリス[2,2-ジフェニル-エチル]アルミニウムおよびトリス[2-フェニル-2-メチル-プロピル]アルミニウム、ならびにヒドロカルビル(hydrocarbyl)基の一つが水素原子で置き換えられた対応化合物、およびヒドロカルビル基の一つまたは二つがイソブチル基で置き換えられた対応化合物である。
【0036】
上記のアルミニウム化合物の中で、トリメチルアルミニウム(TMA)、トリイソブチルアルミニウム(TIBA)、トリス(2,4,4-トリメチル-ペンチル)アルミニウム(TIOA)、トリス(2,3-ジメチルブチル)アルミニウム(TDMBA)およびトリス(2,3,3-トリメチルブチル)アルミニウム(TTMBA)が好ましい。
【0037】
アルキルメタロセンカチオンを形成することができる化合物の非限定的な例は、式D+E-(ここで、D+はプロトンを供給することができ、式(I)のメタロセンの置換基Xと不可逆的に反応することができるブレンステッド酸であり、E-は、二つの化合物の反応から生じる活性触媒種を安定化することができ、オレフィン性モノマーにより十分に除去され易い、適当なアニオンである)の化合物である。
【0038】
好ましくは、アニオンE-は一以上のホウ素原子を含む。より好ましくは、アニオンE-は、式BAr4(-)(ここで、同一または異なっていてもよい置換基Arは、フェニル、ペンタフルオロフェニルまたはビス(トリフルオロメチル)フェニルのようなアリール基である)のアニオンである。
WO 91/02012に記載されているように、テトラキス-ペンタフルオロフェニルボレートが特に好ましい化合物である。さらに、式BAr3の化合物が、都合よく用いられる。このタイプの化合物は、例えば国際特許出願WO 92/00333に記載されている。
【0039】
アルキルメタロセンカチオンを形成することができる化合物のその他の例は、式BAr3P(ここで、Pは置換または無置換のピロール基である)の化合物である。これらの化合物は、WO 01/62764に記載されている。ホウ素原子を含む化合物は、DE-A-19962814およびDE-A-19962910の記載により、都合よく支持されている。ホウ素原子を含むこれら全ての化合物は、ホウ素とメタロセンの金属とのモル比が、約1:1〜約10:1、好ましくは1:1〜2:1の間で、より好ましくは約1:1のモル比で用いられ得る。
【0040】
式D+E-の化合物の非限定的な例は、
トリエチルアンモニウムテトラ(フェニル)ボレート、
トリブチルアンモニウムテトラ(フェニル)ボレート、
トリメチルアンモニウムテトラ(トリル)ボレート、
トリブチルアンモニウムテトラ(トリル)ボレート、
トリブチルアンモニウムテトラ(ペンタフルオロフェニル)ボレート、
トリブチルアンモニウムテトラ(ペンタフルオロフェニル)アルミネート、
トリプロピルアンモニウムテトラ(ジメチルフェニル)ボレート、
【0041】
トリブチルアンモニウムテトラ(トリフルオロメチルフェニル)ボレート、
トリブチルアンモニウムテトラ(4-フルオロフェニル)ボレート、
N,N-ジメチルベンジルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルヘキシルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルアニリニウムテトラ(フェニル)ボレート、
N,N-ジエチルアニリニウムテトラ(フェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)アルミネート、
【0042】
N,N-ジメチルベンジルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルヘキシルアンモニウム-テトラキスペンタフルオロフェニルボレート、
ジ(プロピル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
ジ(シクロヘキシル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルホスホニウムテトラキス(フェニル)ボレート、
トリエチルホスホニウムテトラキス(フェニル)ボレート、
ジフェニルホスホニウムテトラキス(フェニル)ボレート、
トリ(メチルフェニル)ホスホニウムテトラキス(フェニル)ボレート、
【0043】
トリ(ジメチルフェニル)ホスホニウムテトラキス(フェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)アルミネート、
トリフェニルカルベニウムテトラキス(フェニル)アルミネート、
フェロセニウムテトラキス(ペンタフルオロフェニル)ボレート、
フェロセニウムテトラキス(ペンタフルオロフェニル)アルミネート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレートおよび
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート
である。
【0044】
化合物c)として用いられる有機アルミニウム化合物は、前記のような式HjAlU3-jまたはHjAl2U6-jのものである。
本発明の課題である触媒系は、一以上のオレフィンの(共)重合のために用いることができる。
それゆえ、本発明のさらなる課題は、上記の触媒系が存在する重合条件下に、一以上のオレフィンを接触させることを含む、2〜20の炭素原子を含有するオレフィンの(共)重合方法である。好ましくは、2〜20の炭素原子を含有するアルファ-オレフィンが用いられる。
【0045】
本発明の方法で用いることができるアルファ-オレフィンの例は、エチレン、プロピレン、1-ブテン、1-ペンテン、4-メチル-1-ペンテン、1-ヘキセン、1-オクテン、4,6-ジメチル-1-ヘプテン、1-デセン、1-ドデセン、1-テトラデセン、1-ヘキサデセン、1-オクタデセンおよび1-エイコセンである。好ましいオレフィンは、プロピレン、エチレンおよび1-ブテンである。
【実施例】
【0046】
以下の実施例は、本発明を説明するためのものであって、本発明を限定するためのものではない。
【0047】
実施例
一般的方法
全ての操作は、通常のシュレンク-ライン(Shlenk-line)手法を用いて、窒素下で行われた。溶媒は窒素で脱気し、活性Al2O3を通して精製され、窒素下で保存された。全ての化合物は、DPX 200 Brukerスペクトロメータでの1H-NMRおよび13C-NMRにより分析された。ジルコノセンの低い溶解性のため、この化合物の13C-NMRスペクトルは、Bruker DPX 400で、120℃、CD2Cl4中で行われた。ポリマーの融点(Tm)は、標準法に従って、Perkin Elmer DSC-7装置での示差走査熱量計(D.S.C.)により測定された。重合により得られた秤量試料(5〜10 mg)をアルミニウムの皿中に密封し、20℃/分に相当する走査速度で200℃に加熱した。全てのクリスタライトを完全に溶融するために、試料を200℃で5分間保持した。続いて、20℃/分に相当する走査速度で0℃に冷却後、試料を0℃で5分間保持した。次いで、試料を10℃/分に相当する走査速度で、2度目の200℃に加熱した。この2回目の加熱運転において、ピーク温度が融点(Tm)として採用された。
【0048】
比較例1
(ジメチル)シランジイルビス(4,5-ベンゾ-インデニル)ジルコニウムジクロライド (C1)
【化15】

は、US 5,830,821に記載の方法により製造された。
【0049】
比較例2
(ジメチル)シランジイルビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2 (C2)の合成
【化16】

a) 2-メチル-2-[(6-メチル-2-ナフチル)メチル]マロン酸
【化17】

【0050】
200 mlのEt2O中の3.6 gのNaH(90 mmol、鉱油中60 %)の撹拌懸濁液に、16.2 ml(94 mmol)の2-メチルマロン酸ジエチルを、冷却下にゆっくりと加えた。20℃で2時間撹拌後、30 mlのTHF中の21.2 g(90 mmol)の2-(ブロモメチル)-6-メチルナフタレン(Buu-Hoi L.; J.Chem.Soc.; 1946; 831により製造)の溶液を加え、得られた混合物を一晩撹拌し、飽和NH4Cl溶液を加えて分解した。有機相を分離し、水相を100 ml部のエーテルで2回抽出した。合わせた抽出液を蒸発させ、残渣を150 mlのメタノールに溶解し、KOH(20 g、360 mmol)の溶液をゆっくり加えた。混合物を5時間還流し、次いで蒸発乾固し、得られた半固体を温水(400 ml)に溶解した。溶液を100 ml部のエーテルで3回抽出し、次いで10 % HClを注意深く添加し酸性とした。上記の酸(2)の沈殿物を集め、乾燥して、白色の粉末20 g (81 %)を得た。
1H NMR (dmso -d6): 12.9 (ブロードs, 2H), 7.72 (m, 2H), 7.62 (d, 2H), 7.33 (m, 2H), 3.3 (s, 2H), 2.4 (s, 3H), 1.25 (s, 3H)
【0051】
b) 2,7-ジメチル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化18】

【0052】
酸(2)(20 g, 73 mmol)を、溶媒を用いないで、気体の発生が止まるまで(10分)180℃に加熱し、次いで反応混合物を冷却し、ベンゼン(50 ml)に溶解し、蒸発させた。油状残渣をベンゼン(100 ml)に再度溶解し、SOCl2(16 ml, 219 mmol)で処理した。得られた溶液を3時間還流し、蒸発乾固し、100 mlの乾燥CH2Cl2に溶解した。この溶液を、50 mlのCH2Cl2中の14.5 g(109 mmol)の無水AlCl3の撹拌懸濁液に、0℃で滴下した。反応混合物を一晩撹拌し、氷-5 % HCl溶液に注ぎ、50 mlのCH2Cl2で2回抽出した。合わせた有機抽出液をKHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させて、褐色の半固体として11.4 g(74 %)の(3)を得た。
1H NMR (CDCl3): 9.05 (d, 1H), 7.95 (d, 1H), 7.68 (s, 1H), 7.52 (d, 1H), 7.45 (d, 2H), 3.45 (カルテット(qwart), 1H), 2.8 (m, 2H), 2.55 (s, 3H), 1.40 (d, 3H)
【0053】
c) 2,7-ジメチル-3H-シクロペンタ[a]ナフタレン
【化19】

【0054】
50 mlのEt2O中の0.54 g(14 mmol)のLiAlH4懸濁液に、0℃で撹拌下に、エーテル中の10g(48 mmol)の(3)の溶液をゆっくりと加えた。反応混合物を室温で4時間撹拌し、次いで飽和NH4Cl溶液を加えて分解した。有機層を分離し、蒸発させ、得られた油状物を250 mlのベンゼンに溶解した。少量(100 mg)のp-TSAを加え、溶液をディーン-スターク水トラップで1時間還流した。反応をTLC(ベンゼン)でモニターした。暗色の溶液を冷却し、飽和KHCO3溶液で洗浄し、MgSO4で乾燥し、Al2O3(Fluka、中性、グレードI)層を通して濾過し、蒸発させた。明るい色の半固体としての(4)(2つの異性体)の収量−8.1 g(87 %)。
1H NMR (CDCl3): 8.05 (d, 1H), 7.85 (d, 1H), 7.74 (m, 3H), 7.64 (m, 2H), 7.55 (d, 1H), 7.4 (m, 2H), 7.15 ("s", 1H), 6.7 ( "s", 1H), 3.65 (s, 2H), 3.55 (s, 2H), 2.63 (d, 6H), 2.33 (d, 6H)
【0055】
d) ビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)(ジメチル)シラン
【化20】

【0056】
(4)のリチウム塩が、75 mlのEt2O中、-30℃で、5 g(25.7 mmol)の(4)と17 ml(27.2 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から、通常の方法で製造された。次いで、反応混合物を20℃に温め、5時間撹拌し、-70℃に再度冷却した。この温度で、130 mg(1.4 mmol, 5モル%)のCuCNを加え、得られた懸濁液を20分間撹拌し、1.55 ml(12.8 mmol)のMe2SiCl2を一度に加えた。一晩撹拌を続け、次いで混合物を冷水に注ぎ、ベンゼン(2×100 ml)で抽出した。ベンゼン溶液をシリカゲル(Merck 60)を通して濾過し、蒸発させて、明るい色の固体(ラセミ-(rac-)およびメソ-(meso-)異性体の混合物)として4.7 g(83%)を得た。
1H NMR (CDCl3): 8.15, 7.75, 7.6, 7.45 (m, Σ 20 H), 7.3 (s, 4H), 4.1 (d, 4H), 2.61 (s, 12H), 2.4 (d, 12H), -0.2 (s, 3H, メソ-), -0.27 ( s, 6H, ラセミ-), -0.29 (s, 3H, メソ-)
【0057】
e) (ジメチル)シランジイルビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2
【化21】

【0058】
(5)のリチウム塩が、40 mlのEt2O中、-30℃で、3 g(6.75mmol)の(5)および8.8 ml(14.4 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から製造された。次いで、反応混合物を20℃に温め、1時間撹拌し、蒸発させた。乾燥した塩を100 mlのペンタンに懸濁し、次いで1.86 g(7.9 mmol)のZrCl4および5 mlのEt2Oを連続して加え、混合物を一晩撹拌した。沈殿を濾別し、ペンタンで洗浄し、乾燥した。得られた化合物をジクロロメタン-エーエルの混液から再結晶して、黄橙色の粉末として(6)を得た。ラセミ-/メソ-=5/1の混合物として、(6)の収量2.5 g。
1H NMR (CD2Cl2): 7.85, 7.6, 7.4, 7.32, 7.35, (m, Σ 20 H), 7.2 (s, 2H), 7.07 (s,2H) 2.53 (s, 12H), 2.40 (s, 6H), 2.34 (s, 6H), 2.35 (s, 6H), 1.43 (s, 3H, メソ-), 1.33 ( s, 6H, ラセミ-), 1.24(s, 3H, メソ-)
【0059】
実施例1
(ジメチル)シランジイルビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2 (A1)の合成
【化22】

a) 2-メチル-2-[(7-メチル-2-ナフチル)メチル]マロン酸
【化23】

【0060】
200 mlのEt2O中の3.6 gのNaH(90 mmol、鉱油中60 %)の撹拌懸濁液に、16.2 ml(94 mmol)の2-メチルマロン酸ジエチルを、冷却下にゆっくりと加えた。20℃で2時間撹拌後、20 mlのTHF中の21.2 g (90 mmol)の2-(ブロモメチル)-7-メチルナフタレン(Gorsane, M.; Martin, R. H.; Bull.Soc.Chim.Belg.; 94; 3; 1985; 205-214により製造)溶液を加え、得られた混合物を一晩撹拌し、飽和NH4Cl溶液を加えて分解した。有機相を分離し、水相を100 ml部のエーテルで2回抽出した。合わせた抽出液を蒸発させ、残渣を150 mlのメタノールに溶解し、KOH(20 g, 360 mmol)の溶液をゆっくりと加えた。混合物を5時間還流し、次いで蒸発乾固し、得られた半固体を温水(300 ml)に溶解した。溶液を100 ml部のエーエルで3回抽出し、次いで10 % HClを加えて注意深く酸性にした。酸(2)の沈殿を集め、乾燥して、黄色がかった粉末を18.8 g (76 %)得た。
1H NMR (CDCl3): 7.77 (カルテット, 2H), 7.62 (s, 2H), 7.33 (m, 2H), 2.9 (s, 2H), 2.56 (s, 3H), 1.26 (s, 3H)
【0061】
b) 2,8-ジメチル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化24】

【0062】
酸(2)(15 g, 55 mmol)を、溶媒を用いないで、気体の発生が止まるまで(10分)180℃に加熱し、次いで反応混合物を冷却し、ベンゼン(50 ml)に溶解し、蒸発させた。油状残渣をベンゼン(100 ml)に再度溶解し、SOCl2(12 ml, 165 mmol)で処理した。得られた溶液を3時間還流し、蒸発乾固し、100 mlの乾燥CH2Cl2に溶解した。この溶液を、50 mlのCH2Cl2中の11.1 g(83mmol)の無水AlCl3の撹拌懸濁液に0℃で滴下した。反応混合物を一晩撹拌し、氷-5 % HCl溶液に注ぎ、50 mlのCH2Cl2で2回抽出した。合わせた有機抽出液をKHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させて、褐色の固体として9.6g(83 %)の(3)を得た。
1H NMR (CDCl3): 9.0 (s, 1H), 8.0 (d, 1H), 7.8 (d, 1H), 7.45 (t, 2H), 3.45 (カルテット(qwar), 1H), 2.8 (m, 2H), 2.6 (s, 3H), 1.4 (d, 3H)
【0063】
c) 2,8-ジメチル-3H-シクロペンタ[a]ナフタレン
【化25】

【0064】
10 mlのEt2O中の0.32 g(8 mmol)のLiAlH4懸濁液に、0℃で撹拌下に、エーテル(50 ml)中の3.5g(17 mmol)の(3)の溶液をゆっくりと加えた。反応混合物を室温で4時間撹拌し、次いで飽和NH4Cl溶液を加えて分解した。有機層を分離し、蒸発させ、得られた油状物を250 mlのベンゼンに溶解した。少量(100 mg)のp-TSAを加え、溶液をディーン-スターク水トラップで1時間還流した。反応をTLC(ベンゼン)でモニターした。暗色の溶液を冷却し、飽和KHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させた。明るい色の半固体としての(4)(2つの異性体)の収量−2.5 g(76 %)。
1H NMR (CDCl3): 7.82 (t, 4H), 7.60 (d, 2H), 7.51 (d, 2H), 7.31 (t, 2H), 7.10 (s, 2H), 3.47 (s, 4H), 2.58 (s, 6H), 2.3(s, 6H)
【0065】
d) ビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)(ジメチル)シラン
【化26】

【0066】
(4)のリチウム塩が、30 mlのEt2O中、-30℃で、2.0 g(10.3mmol)の(4)と6.8 ml(10.8 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から通常の方法で製造された。次いで反応混合物を20℃に温め、2時間撹拌し、-70℃に再度冷却した。この温度で、60 mg(0.6 mmol, 5モル%)のCuCNを加え、得られた懸濁液を20分間撹拌し、0.62 ml(5.13 mmol)のMe2SiCl2を一度に加えた。一晩撹拌を続け、次いで混合物を冷水に注ぎ、ベンゼン(2×100 ml)で抽出した。ベンゼン溶液をシリカゲル(Merck 60)を通して濾過し、蒸発させて、明るい色の固体(ラセミ-およびメソ-異性体の混合物)として1.8 g(79%)を得た。
1H NMR (CDCl3): 7.9, 7.8, 7.75, 7.55, 7.35 (m, Σ 20 H), 7.29 (s, 4H), 4.05 (d, 4H), 2.61 (s, 12H), 2.4 (d, 12H), -0.21 (s, 3H, メソ-), -0.29 ( s, 6H, ラセミ-), -0.30 (s, 3H, メソ-)
【0067】
e) (ジメチル)シランジイルビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2
【化27】

【0068】
(5)のリチウム塩が、40 mlのEt2O中、-30℃で、2.4 g(5.4 mmol)の(5)および7 ml(11.2 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から製造された。次いで反応混合物を20℃に温め、1時間撹拌し、蒸発させた。乾燥した塩を50 mlのペンタンに懸濁し、次いで1.52 gのZrCl4(6.5 mmol)および5 mlのEt2Oを連続して加え、混合物を一晩撹拌した。沈殿を濾別し、ペンタンで洗浄し、乾燥した。得られた化合物をジクロロメタン-エーエルの混液から再結晶して、黄色の粉末として(6)を得た。ラセミ-/メソ-=6/4の混合物として、(6)の収量は1.87 gである。
1H NMR (CD2Cl2): 7.65, 7.55, 7.35, 7.2, 7.35, 7.1 (m, Σ 24 H), 2.53 (s, 6H), 2.50 (s, 6H), 2.44 (s, 6H), 2.35 (s, 6H), 1.4 (s, 3H, メソ-), 1.35 ( s, 6H, ラセミ-), 1.2(s, 3H, メソ-)
【0069】
実施例2
[μ(η5-2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A2)の合成
【化28】

【0070】
a) (2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチル-ジチオフェノシクロペンタジエン-7-イル)ジメチルシラン
【化29】

【0071】
上記のようにして製造された2,8-ジメチル-3H-シクロペンタ[a]ナフタレン(0.43 g, 2.2 mmol)のエーテル(10 ml)中の溶液を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 1.4 ml, 2.2 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、-60℃に冷却し、SiMe2Cl2(0.35 ml, 2.9 mmol)を加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。エーテル(15 ml)中のジメチルジチオフェノシクロペンタジエン(0.45 g, 2.2 mmol)を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 1.4 ml, 2.2 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、10 mlのエーテル中の2,8-ジメチル-3H-シクロペンタ[a]ナフタレンのジメチルクロロシリル誘導体の懸濁液に-60℃で加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。カラムクロマトグラフィー(シリカゲル60、ヘキサン/CHCl3 8:1)により生成物を得た。黄色固体の収量0.82 g(82%)。
【0072】
b) [μ(η5-2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A2)
【化30】

【0073】
工程a)で得られた(2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシラン(0.82 g, 1.8 mmol)をEt2O(20 ml)に溶解し、-40℃に冷却し、n-BuLi(ヘキサン中の1.6Mの2.5 ml、4 mmol)を加えた。反応混合物を室温に温め、2時間撹拌し、-60℃に冷却し、ZrCl4(0.44 g, 1.9 mmol)を加えた。得られた混合物を撹拌して室温に温め、さらに16時間撹拌した。得られた黄色沈殿を濾別し、CH2Cl2から再結晶し、橙黄色の生成物を得た。収量0.82 g(74%)。
1H NMR (CD2Cl2, 20℃) δ: 7.81 (s, 1H); 7.59 (d, 1H); 7.51 (d, 1H); 7.30 (d, 1H); 7.12 (d, 1H) [芳香族C6環]; 6.79 (s, 2H); 6.57 (s, 1H) [C5環]; 2.60 (s, 3H); 2.53 (s, 3H); 2.43 (s, 3H); 2.40 (s, 3H); [C-CH3]; 1.32 (s, 3H); 1.18 (s, 3H) [Si-CH3]
【0074】
実施例3
[μ(η5-2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A3)の合成
【化31】

【0075】
a) 2,7-ジブロモナフタレンは2,7-ナフタレンジオールから出発する既知の方法により得られた[Porzi G., Concilio C., J.Organomet.Chem., 128 (1977), 95-98]。
b) 2-ブロモ-7-メチルナフタレン
【化32】

【0076】
エーテル(400 ml)中の2,7-ジブロモナフタレン(61.4 g, 0.21 mol)懸濁液を-30℃に冷却し、n-BuLi(ヘキサン中1.6M、135 ml、0.21 mol)を加えた。反応混合物を室温に温め、さらに2.5時間撹拌し、-30℃に冷却し、CH3I(13.5 ml, 0.21 mol)を加えた。反応混合物を室温に温め、さらに16時間撹拌し、水(100 ml)で処理した。有機層を分離し、水層をエーテル(6×100 ml)で抽出した。合わせた有機画分を蒸発させ、ほとんど純粋な固形生成物を得た。収量38.1 g(82%)。
1H NMR (CDCl3, 20℃) δ: 7.93 (s, 1H); 7.70 (d, 1H); 7.52 (s, 1H); 7.50 (d, 1H); 7.35 (d, 1H) [芳香族C6環]; 2.54 (s, 3H, -CH3)
【0077】
c) 2-メチル-7-フェニルナフタレン
【化33】

【0078】
エーテル(100 ml)中の2-ブロモ-7-メチルナフタレン(10 g, 45 mmol)溶液を-0℃に冷却し、続いて、Ni(dppp)Cl2および(55 mlのエーテル中1.3 gのMgと5.6 mlのPhBrから得られた)PhLiの溶液を加えた。反応混合物を室温に温め、さらに4時間加熱して撹拌し、室温に冷却し、さらに16時間撹拌し、水(100 ml)で処理した。有機層を分離し、水層をエーテル(3×50 ml)で抽出した。合わせた有機画分を蒸発させ、ほとんど純粋な固形生成物を得た。収量9.23 g(94%)。
1H NMR (CDCl3, 20℃) δ: 8.10 (s, 1H); 7.92 (d, 1H); 7.83-7.71 (mのグループ, 5H); 7.53 (t, 2H); 7.43 (t, 1H); 7.37 (d, 1H) [芳香族C6環]; 2.58 (s, 3H, -CH3)
【0079】
d) 2-(ブロモメチル)-7-フェニルナフタレン
【化34】

【0080】
2-メチル-7-フェニルナフタレン(5.4 g, 25 mmol)およびN-ブロモスクシンイミド(4.4 g, 25 mmol)をCCl4(60 ml)中に懸濁した。過酸化ベンゾイル(0.25 g)およびBr2(20 mkl)を加え、混合物を3時間還流し、濾過し、蒸発させ、乾燥し、ほとんど純粋な生成物を得た。収量7.4 g(〜100%)。
1H NMR (CDCl3, 20℃) δ: 8.40 (s, 1H); 7.94-7.73 (mのグループ, 6H); 7.53 (m, 3H); 7.44 (t, 1H)[芳香族C6環]; 4.71 (s, 2H, -CH2)
【0081】
e) 2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸
【化35】

【0082】
エタノール(80 ml)中のEtONa(1.7 g, 25 mmol)の溶液に、メチルマロン酸ジエチル(4.35 g, 25 mmol)を加えた。得られた混合物を2時間撹拌し、2-(ブロモメチル)-7-フェニルナフタレン(7.4 g, 25 mmol)を加えた。得られた混合物を6時間還流し、冷却し、NaOH(水10 ml中4 g)で処理し、6時間還流した。冷却後、HCl水溶液をpH〜1まで加えた。得られた沈殿を濾別し、純粋な2-メチル-2-[(7-フェニル-2-ナフチル)メチル]マロン酸を得た。収量7.2 g(86%)。
1H NMR (DMSO-d6, 20℃) δ: 12.9 (ブロード, 2H, -COOH); 8.12 (s, 1H); 7.97 (d, 1H); 7.86 (d, 1H); 7.80 (m, 4H); 7.52 (t, 2H); 7.41 (t, 1H); 7.35 (d, 1H) [芳香族C6環]; 3.28 (s, 2H, -CH2); 1.25 (s, 3H, -CH3)
【0083】
ジカルボン酸を加熱(150-160℃、30分)して、2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸(6.25 g)を得た。
1H NMR (CDCl3, 20℃) δ: 11.5-10 (ブロード, 1H, -COOH); 8.15 (s, 1H); 7.92 (d, 1H); 7.83 (d, 1H); 7.76 (m, 4H); 7.52 (t, 2H); 7.42 (t, 1H); 7.36 (d, 1H) [芳香族C6環]; 3.30 (m, 1H); 2.90 (m, 2H) [-CHCH2-]; 1.25 (d, 3H, -CH3)
【0084】
f) 2-メチル-8-フェニル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化36】

【0085】
2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸(6.25 g, 21.5 mmol)をCH2Cl2(20 ml)中に懸濁し、SOCl2(2.9 ml, 40 mmol)および0.05 mlのDMFを加えた。得られた混合物を室温で2時間撹拌し、さらに1時間還流し、蒸発させ、真空下に乾燥した。AlCl3(4.3 g, 33 mmol)をCH2Cl2(40ml)中に懸濁し、得られたクロロアンハイドライドのCH2Cl2(20 ml)溶液を、0℃で0.5時間で加えた。得られた混合物を室温に温め、さらに2時間撹拌し、氷/HCl(〜200 g + 40 ml)中に注いだ。得られた混合物をCH2Cl2(4×50ml)で抽出した。合わせた有機相をKHCO3水溶液で洗浄し、MgSO4で乾燥し、蒸発させ、真空下に乾燥し、ほとんど純粋な固形生成物を得た。収量5.45 g(92%)。
1H NMR (CDCl3, 20℃) δ: 9.48 (s, 1H); 8.07 (d, 1H); 7.70 (d, 1H); 7.85 (m, 3H); 7.53 (m, 3H); 7.43 (t, 1H) [芳香族C6環]; 3.50 (m, 1H); 2.85 (m, 2H) [-CHCH2-]; 1.41 (d, 3H, -CH3)
【0086】
g) 2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレン
【化37】

【0087】
Et2O(50 ml)中のLiAlH4(0.23 g, 6 mmol)の冷却(-40℃)懸濁液に、Et2O(50 ml)中の2-メチル-8-フェニル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン(5.45 g, 20 mmol)を滴下した。得られた混合物を室温に温め、さらに2時間撹拌した。次いで、H2O(10 ml)および10M HCl(5 ml)を加え、得られた混合物をCH2Cl2(300 ml)中に注いだ。有機相を水(50 ml)、5% KHCO3水溶液(50 ml)で洗浄し、MgSO4で乾燥し、蒸発させ、白色結晶性のアルコールを得た。250 mlの丸底フラスコにアルゴンで散布し、ベンゼン(100 ml)およびp-TSA(0.2 g)を加え、得られた溶液を撹拌下に、ディーン-スターク ヘッドで1.5時間(TLC(ベンゼン/EtOAc 4:1)で管理)還流した。次いで、得られた黄色の溶液を水、KHCO3水溶液、水で洗浄し、MgSO4で乾燥し、少量のシリカゲルに通し、蒸発させ、4.8 g (94%)の生成物を得た。
1H NMR (CDCl3, 20℃) δ: 8.30 (s, 1H); 7.98 (d, 1H); 7.82 (dd, 2H); 7.75 (d, 1H); 7.68 (d, 1H); 7.60 (d, 1H); 7.55 (t, 2H); 7.44 (d, 1H); 7.20 (s, 1H) [-CH=]; 3.51 (s, 2H, -CH2-); 2.33 (s, 3H, -CH3)
【0088】
h) (2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチリジチオフェノシクロペンタジエン-7-イル)ジメチルシラン
【化38】

【0089】
エーテル(50 ml)中の2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレン(2.56 g, 10 mmol)の溶液を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 6.3 ml, 10 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、-60℃に冷却し、SiMe2Cl2(1.33 ml, 11 mmol)を加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。エーテル(40 ml)中のジメチルジチオフェノシクロペンタジエン(2.06 g, 10 mmol)を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 6.3 ml, 10 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、エーテル50 ml中の2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレンのジメチルクロロシリル誘導体の懸濁液に、-60℃で加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。ヘキサンからの結晶化により、生成物が単一の異性体として得られた。収量2.28 g(44%)。
1H NMR (CDCl3, 20℃) δ: 8.39 (s, 1H); 7.99 (d, 1H); 7.81 (dd, 2H); 7.78 (d, 1H); 7.63 (m, 2H); 7.56 (t, 2H); 7.44 (t, 1H); 7.36 (s, 1H); 6.94 (s, 1H); 6.90 (s, 1H) [-CH=]; 4.19 (s, 1H); 4.10 (s, 1H) [>CH-]; 2.63 (s, 3H); 2.58 (s, 3H); 2.42 (s, 3H) [C-CH3]; -0.31 (s, 3H); -0.33 (s, 3H) [Si-CH3]
【0090】
i) [μ(η5-2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV)
【化39】

【0091】
(2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチル-ジチオフェノシクロペンタジエン-7-イル)ジメチルシラン(2.28 g, 4.39 mmol)をEt2O(60 ml)中に懸濁し、-40℃に冷却し、n-BuLi(ヘキサン中1.6Mの5.6 ml、9 mmol)を加えた。反応混合物を室温に温め、2時間撹拌し、-60℃に冷却し、ZrCl4(1.05 g, 4.5 mmol)を加えた。得られた混合物を撹拌して室温に温め、さらに16時間撹拌した。得られた黄色の沈殿を濾別し、CH2Cl2での20回の抽出により精製し、続いて溶液を濃縮し、橙黄色の生成物を得た。収量1.97 g(66%)。
【0092】
重合例
一般的な方法
表1に示された量のメタロセンを、適当な量のメチルアルモキサン(MAO)溶液(トルエン中30重量%) (Al/Zrのモル比=500)とともに5 mlのトルエン中に溶解し、オートクレーブに注入する前に、室温で10分間撹拌して溶液を得ることにより、触媒混合物を製造した。前もってヘキサン中のAl(i-Bu)3溶液での洗浄により浄化し、プロピレンのストリーム中50℃で乾燥した、磁気的に作動する撹拌装置および35-mLのステンレス-スチール製バイアルを備え、温度制御のためのサーモスタットが付いた2.4-Lのジャケット付きステンレス-スチール製オートクレーブ中に、2 mmolのAl(i-Bu)3(ヘキサン中の1M溶液として)および700 gのプロピレンを室温で充填した。次いで、オートクレーブを70℃に自動温度調節し、次いで窒素圧力によりステンレス-スチール製バイアルを通して触媒/助触媒混合物を含むトルエン溶液をオートクレーブに注入し、一定の温度で1時間重合を行った。反応器にCOを加圧することにより重合を止めた。未反応のモノマーを排気し、反応器を室温に冷却した後、ポリマーを減圧下に60℃で乾燥した。重合結果を表1に示す。
【0093】
【表1】

*比較
a) ラセミ メソ異性体の混合物(ラセミ:メソ 6:4)
b) ラセミ メソ異性体の混合物(ラセミ:メソ 5:1)
【0094】
表1の結果から、化合物A1は、それがラセミ、メソの混合物で用いられても(メソ体は、ラセミ体に比べてより低い活性を有するか、または不活性である)、化合物C1およびC2より高い重合活性を示すことが明らかである。
【技術分野】
【0001】
本発明は、明確な置換パターンを有するベンゾインデニル部分を含むメタロセン化合物に関する。本発明は、さらに、オレフィン重合用触媒成分としての該メタロセン化合物の使用、およびその重合方法に関する。
【0002】
本発明において、ベンゾインデニルおよびインデニル部分の位置の数え方は、式(a)および(b)の部分において、次に示すとおりである。
【化1】

【背景技術】
【0003】
ベンゾインデニル部分を含むメタロセン化合物は、US 5,830,821により知られている。しかしながら、この文献において、一般式は過度の置換ベンゾインデニル含有メタロセン化合物を包含しているが、例示された化合物はベンゾインデニル環の5位で置換されていない。
【0004】
EP 754 698は、ジメチルシリレン(2,7-ジメチル-4,5-(2-メチル-ベンゾ)-1-インデニル)(2,7-ジ-t-ブチル-9-フルオレニル)ジルコニウム ジクロライドを開示している。表1に示されるように、この化合物は、対応の無置換のベンゾインデニル化合物よりも低い重合活性を有する。
【0005】
US 6,228,795は、化合物の長い一覧表の中で、フェニル(メチル)シランジイルビス(2-メチル-4,5-(メチルベンゾ)-1-インデニル)Zr(CH3)2およびフェニル(メチル)シランジイルビス(2-メチル-4,5-(テトラメチルベンゾ)-1-インデニル)Zr(CH3)2を報告している。
【発明の開示】
【発明が解決しようとする課題】
【0006】
上記の最初の化合物において、メチル基の位置についての指摘はない。これに対して、これらのメタロセン化合物が重合反応に用いられるとき、本発明の比較例で示されるように、メチル基の位置はそれらの活性の改善に重要である。
【課題を解決するための手段】
【0007】
本出願人は、4,5-ベンゾインデニル部分を含むメタロセン化合物がオレフィン重合用の触媒成分として用いられるとき、4,5-ベンゾインデニル部分を5位で置換することにより、その化合物の重合活性を増大することができることを見出した。
【0008】
本発明の課題は、式(I):
【化2】

(式中、
Mは元素周期律表の3、4、5、6族またはランタニドもしくはアクチニド族に属するものから選択される遷移金属の原子であり;好ましくは、Mはチタニウム、ジルコニウムまたはハフニウムであり;
pは0〜3の整数で、好ましくは、pは2であり、金属Mの形式上の(formal)酸化状態マイナス2に等しく;
【0009】
Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、Rは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはRは元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基である)であるか;または二つのXは、置換または無置換のブタジエニル基またはOR'O基(ここで、R'はC1-C40アルキリデン、C6-C40アリーリデン、C7-C40アルキルアリーリデンおよびC7-C40アリールアルキリデン基から選択される2価の基である)を任意に形成してもよく;好ましくはXは水素原子、ハロゲン原子またはR基であり;より好ましくはXは塩素またはメチル基であり;
【0010】
Lは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、C1-C20アルキリデン、C3-C20シクロアルキリデン、C6-C20アリーリデン、C7-C20アルキルアリーリデンまたはC7-C20アリールアルキリデン基、およびSiMe2、SiPh2のようなシリコン原子を5つまで含むシリリデン基から選択される2価の架橋基であり;好ましくは、Lは基Z(R'')2(ここで、Zは炭素またはシリコン原子であり、R''は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C10アルキル、C2-C10アルケニル、C2-C10アルキニル、C6-C10アリール、C7-C10アルキルアリールもしくはC7-C10アリールアルキル基である)であり;より好ましくは、基Z(R'')2はSi(CH3)2、SiPh2、SiPhMe、SiMe(SiMe3)、CH2、(CH2)2およびC(CH3)2であり;
【0011】
R1は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR1は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR1は直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキル基であり;さらに好ましくはR1はメチル、エチルまたはイソプロピル基であり;
【0012】
R3は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR3は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR3は直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルまたはC6-C40アリール基であり;さらに好ましくはR3はメチル、エチルまたはフェニル基であり、
【0013】
R2、R4およびR5は、R2、R4およびR5の少なくとも一つが水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR2、R4およびR5は、R2、R4およびR5の少なくとも一つが水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR2、R4およびR5は水素原子であり;
【0014】
R3はR4と共におよび/またはR4はR5と共に結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい、脂肪族または芳香族の3〜7員環を形成していてもよく;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;
【0015】
R6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR6およびR7は水素原子または直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキル基であり;さらに好ましくはR6およびR7は水素原子またはメチル基であり;
【0016】
R8は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C50の炭化水素基であり;R8基は二つ以上一緒になって、元素周期律表の13〜16族に属するヘテロ原子を少なくとも一つ含む一つ以上の3〜7員環を形成することもでき;該環は元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C20の炭化水素基でさらに置換され得る)
のメタロセン化合物である。
【0017】
式(I)の化合物のサブクラスは、式(II)
【化3】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は前に記載されており、
R10は、水素原子または元素周期律表13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR10は水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR10はメチル基、エチル基またはイソプロピル基のような直鎖状または分枝鎖状のC1-C20アルキル基であり;好ましくはR1およびR10は同時に分枝鎖状のC1-C40アルキル基ではなく;
【0018】
R11、R12、R13およびR14は互いに同一または異なって、水素原子、または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもC1-C40の炭化水素基であり;好ましくはR11、R12、R13およびR14は互いに同一または異なって、水素原子、または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;隣接する二つのR11、R12、R13およびR14基は結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい3〜7員環を形成することもでき;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;より好ましくはR11はC6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であるか、またはR12と一緒になって、1〜20の炭素原子を有する炭化水素基で置換され得るフェニルを形成し;
より好ましくはR12は水素原子であるか、またはR11と一緒になって上記のような3〜7員環を形成し;
より好ましくはR14およびR13は水素原子またはC1-C20アルキル基である)
の化合物である。
【0019】
式(II)の化合物の好ましいクラスは、式(III)
【化4】

(式中、M、X、p、L、R1、R2、R3、R4、R5、R6、R7、R10、R13およびR14は前に記載されている)
の化合物である。
【0020】
式(I)の化合物のさらなるサブクラスは、式(IV)
【化5】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は前に記載されており;
R15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;好ましくはR15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アリールアルキル基であり;より好ましくはR15およびR16は、メチル、エチル、イソプロピルまたはトリメチルシリル基のような、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状のC1-C40アルキル基である)
の化合物である。
【0021】
式(I)のメタロセン化合物は、次の工程:
a) 式(Ia)
【化6】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは前記の意味を有する)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム[ここで、Bはアルカリ金属またはアルカリ土類金属であり、jは1または2であり(Bがアルカリ金属、好ましくはリチウムであるときjは1であり、Bがアルカリ土類金属であるときjは2である);Tは、1以上のSiまたはGe原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C20アルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり;好ましくはTはメチルまたはブチル基であり;
【0022】
T1はハロゲン原子または基OR'''(ここで、R'''は、元素周期律表の13〜17族に属するヘテロ原子を1以上任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基である)であり;好ましくはT1はハロゲン原子、より好ましくは臭素である]から選択される塩基と接触させること(ここで、該塩基と式(Ia)のリガンドとのモル比は少なくとも2:1であり;過剰の該塩基を用いることができる);および
b) 工程a)で得られた物質を、式MXp+2(ここで、M、Xおよびpは前記の意味を有する)の化合物と接触させること;
を含む方法で得られる。
【0023】
式(Ia)のリガンドは、次の工程:
a) 式(VI):
【化7】

(式中、R1、R2、R3、R4、R5、R6およびR7は前のとおり定義される)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム(ここで、T、j、BおよびT1は前のとおり定義される)から選択される塩基と接触させること(ここで、該塩基と式(VI)の化合物とのモル比は少なくとも1:1であり;過剰の該塩基を用いることができる);
【0024】
b) 工程a)で得られたアニオン化合物を式(VII):
【化8】

(式中、R8およびLは前のとおり定義され、Yは塩素、臭素およびヨウ素であり、好ましくはYは塩素または臭素である)
の化合物と接触させること;
を含む方法で得られる。
【0025】
式(I)のリガンドを製造するための別の方法は、次の工程:
a) 式(VIIa):
【化9】

(式中、R8は前のとおり定義される)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム(ここで、T、j、BおよびT1は前のとおり定義される)から選択される塩基と接触させること(ここで、該塩基と式(VIIa)の化合物とのモル比は少なくとも1:1であり;過剰の塩基を用いることができる);
【0026】
b) 工程a)で得られたアニオン化合物を、式(VIa):
【化10】

(式中、R1、R2、R3、R4、R5、R6、R7およびLは前のとおり定義され、Yは塩素、臭素およびヨウ素であり、好ましくはYは塩素または臭素である)
の化合物と接触させること;
を含む。
【0027】
上記の方法は、好ましくは極性または無極性どちらかの、非プロトン性溶媒中で行われる。該非プロトン性溶媒は、好ましくは任意にハロゲン化された芳香族もしくは脂肪族の炭化水素、またはエーエルであり;より好ましくはそれはベンゼン、トルエン、ペンタン、ヘキサン、ヘプタン、シクロヘキサン、ジクロロメタン、ジエチルエーエル、テトラヒドロフランおよびそれらの混合物から選択される。上記の方法は、-100℃〜+80℃、より好ましくは-20℃〜+70℃の範囲の温度で行われる。
【0028】
本発明のさらなる課題は、式(Ia)
【化11】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは前記の意味を有する)
のリガンド、および/またはその2重結合異性体である。
【0029】
式(II)、(III)および(IV)のメタロセン化合物は、それぞれ式(IIa)、(IIIa)および(IVa):
【化12】

(式中、L、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15およびR16は前に記載されている)
のリガンド、および/またはそれらの2重結合異性体から出発して、上記の方法を用いて製造される。
【0030】
式(IIa)、(IIIa)および(IVa)のリガンドは、対応する出発化合物を用いて、上記の方法により製造される。
式(VI)および(VIa)の化合物は、US 5,830,821に従って、出発化合物として、適切に置換されたナフタレン部分を用いて製造される。
【0031】
本発明の課題のメタロセン化合物は、オレフィン重合用の触媒系を得るための触媒成分として用いられる。
それゆえ、本発明のさらなる課題は、
a) 少なくとも一つの式(I)のメタロセン化合物;
b) 少なくとも一つのアルモキサン、またはアルキルメタロセンカチオンを形成することができる化合物;および
c) 任意に有機アルミニウム化合物;
を接触させることにより得られる触媒系である。
【0032】
好ましくは、式(II)、(III)および(IV)のメタロセン化合物の少なくとも一つが用いられる。
成分b)として用いられるアルモキサンは、水と式HjAlU3-jまたはHjAl2U6-j(ここで、U置換基は、Uの少なくとも一つはハロゲンでないとの条件で、同一または異なって、水素原子、ハロゲン原子、任意にシリコンまたはゲルマニウム原子を含んでいてもよい、C1-C20アルキル、C3-C20シクロアルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり、jは0〜1の範囲で整数でなくてもよい)の有機アルミニウム化合物とを反応させることにより得られる。この反応において、Al/水のモル比は、好ましくは1:1〜100:1の間に含まれる。
アルミニウムとメタロセンの金属とのモル比は、一般的に、約10:1〜約30000:1の間、好ましくは、約100:1〜約5000:1の間に含まれる。
【0033】
本発明の触媒中に用いられるアルモキサンは、次のタイプ:
【化13】

(式中、n1は0または1〜40の整数であり、置換基Uは、前のとおり定義される)
の少なくとも1つのグループ、および/または環式化合物の場合、次のタイプ:
【化14】

(式中、n2は2〜40の整数であり、U置換基は前のとおり定義される)
を含む、直鎖状、分枝鎖状または環式の化合物であると考えられる。
【0034】
本発明による使用に適したアルモキサンの例は、メチルアルモキサン(MAO)、テトラ-(イソブチル)アルモキサン(TIBAO)、テトラ-(2,4,4-トリメチル-ペンチル)アルモキサン(TIOAO)、テトラ-(2,3-ジメチルブチル)アルモキサン(TDMBAO)およびテトラ-(2,3,3-トリメチルブチル)アルモキサン(TTMBAO)である。
特に興味のある助触媒は、アルキル基およびアリール基が特定の分枝パターンを有する、WO 99/21899およびWO 01/21674に記載されているものである。
【0035】
WO 99/21899およびWO 01/21674に記載されている、水と反応させて適当なアルモキサン(b)を与えることができる非限定的なアルミニウム化合物の例は、トリス(2,3,3-トリメチル-ブチル)アルミニウム、トリス(2,3-ジメチル-ヘキシル)アルミニウム、トリス(2,3-ジメチル-ブチル)アルミニウム、トリス(2,3-ジメチル-ペンチル)アルミニウム、トリス(2,3-ジメチル-ヘプチル)アルミニウム、トリス(2-メチル-3-エチル-ペンチル)アルミニウム、トリス(2-メチル-3-エチル-ヘキシル)アルミニウム、トリス(2-メチル-3-エチル-ヘプチル)アルミニウム、トリス(2-メチル-3-プロピル-ヘキシル)アルミニウム、トリス(2-エチル-3-メチル-ブチル)アルミニウム、トリス(2-エチル-3-メチル-ペンチル)アルミニウム、トリス(2,3-ジエチル-ペンチル)アルミニウム、トリス(2-プロピル-3-メチル-ブチル)アルミニウム、トリス(2-イソプロピル-3-メチル-ブチル)アルミニウム、トリス(2-イソブチル-3-メチル-ペンチル)アルミニウム、トリス(2,3,3-トリメチル-ペンチル)アルミニウム、トリス(2,3,3-トリメチル-ヘキシル)アルミニウム、トリス(2-エチル-3,3-ジメチル-ブチル)アルミニウム、トリス(2-エチル-3,3-ジメチル-ペンチル)アルミニウム、トリス(2-イソプロピル-3,3-ジメチル-ブチル)アルミニウム、トリス(2-トリメチルシリル-プロピル)アルミニウム、トリス(2-メチル-3-フェニル-ブチル)アルミニウム、トリス(2-エチル-3-フェニル-ブチル)アルミニウム、トリス(2,3-ジメチル-3-フェニル-ブチル)アルミニウム、トリス(2-フェニル-プロピル)アルミニウム、トリス[2-(4-フルオロ-フェニル)-プロピル]アルミニウム、トリス[2-(4-クロロ-フェニル)-プロピル]アルミニウム、トリス[2-(3-イソプロピル-フェニル)-プロピル]アルミニウム、トリス(2-フェニル-ブチル)アルミニウム、トリス(3-メチル-2-フェニル-ブチル)アルミニウム、トリス(2-フェニル-ペンチル)アルミニウム、トリス[2-(ペンタフルオロフェニル)-プロピル]アルミニウム、トリス[2,2-ジフェニル-エチル]アルミニウムおよびトリス[2-フェニル-2-メチル-プロピル]アルミニウム、ならびにヒドロカルビル(hydrocarbyl)基の一つが水素原子で置き換えられた対応化合物、およびヒドロカルビル基の一つまたは二つがイソブチル基で置き換えられた対応化合物である。
【0036】
上記のアルミニウム化合物の中で、トリメチルアルミニウム(TMA)、トリイソブチルアルミニウム(TIBA)、トリス(2,4,4-トリメチル-ペンチル)アルミニウム(TIOA)、トリス(2,3-ジメチルブチル)アルミニウム(TDMBA)およびトリス(2,3,3-トリメチルブチル)アルミニウム(TTMBA)が好ましい。
【0037】
アルキルメタロセンカチオンを形成することができる化合物の非限定的な例は、式D+E-(ここで、D+はプロトンを供給することができ、式(I)のメタロセンの置換基Xと不可逆的に反応することができるブレンステッド酸であり、E-は、二つの化合物の反応から生じる活性触媒種を安定化することができ、オレフィン性モノマーにより十分に除去され易い、適当なアニオンである)の化合物である。
【0038】
好ましくは、アニオンE-は一以上のホウ素原子を含む。より好ましくは、アニオンE-は、式BAr4(-)(ここで、同一または異なっていてもよい置換基Arは、フェニル、ペンタフルオロフェニルまたはビス(トリフルオロメチル)フェニルのようなアリール基である)のアニオンである。
WO 91/02012に記載されているように、テトラキス-ペンタフルオロフェニルボレートが特に好ましい化合物である。さらに、式BAr3の化合物が、都合よく用いられる。このタイプの化合物は、例えば国際特許出願WO 92/00333に記載されている。
【0039】
アルキルメタロセンカチオンを形成することができる化合物のその他の例は、式BAr3P(ここで、Pは置換または無置換のピロール基である)の化合物である。これらの化合物は、WO 01/62764に記載されている。ホウ素原子を含む化合物は、DE-A-19962814およびDE-A-19962910の記載により、都合よく支持されている。ホウ素原子を含むこれら全ての化合物は、ホウ素とメタロセンの金属とのモル比が、約1:1〜約10:1、好ましくは1:1〜2:1の間で、より好ましくは約1:1のモル比で用いられ得る。
【0040】
式D+E-の化合物の非限定的な例は、
トリエチルアンモニウムテトラ(フェニル)ボレート、
トリブチルアンモニウムテトラ(フェニル)ボレート、
トリメチルアンモニウムテトラ(トリル)ボレート、
トリブチルアンモニウムテトラ(トリル)ボレート、
トリブチルアンモニウムテトラ(ペンタフルオロフェニル)ボレート、
トリブチルアンモニウムテトラ(ペンタフルオロフェニル)アルミネート、
トリプロピルアンモニウムテトラ(ジメチルフェニル)ボレート、
【0041】
トリブチルアンモニウムテトラ(トリフルオロメチルフェニル)ボレート、
トリブチルアンモニウムテトラ(4-フルオロフェニル)ボレート、
N,N-ジメチルベンジルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルヘキシルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルアニリニウムテトラ(フェニル)ボレート、
N,N-ジエチルアニリニウムテトラ(フェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)アルミネート、
【0042】
N,N-ジメチルベンジルアンモニウム-テトラキスペンタフルオロフェニルボレート、
N,N-ジメチルヘキシルアンモニウム-テトラキスペンタフルオロフェニルボレート、
ジ(プロピル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
ジ(シクロヘキシル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルホスホニウムテトラキス(フェニル)ボレート、
トリエチルホスホニウムテトラキス(フェニル)ボレート、
ジフェニルホスホニウムテトラキス(フェニル)ボレート、
トリ(メチルフェニル)ホスホニウムテトラキス(フェニル)ボレート、
【0043】
トリ(ジメチルフェニル)ホスホニウムテトラキス(フェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)アルミネート、
トリフェニルカルベニウムテトラキス(フェニル)アルミネート、
フェロセニウムテトラキス(ペンタフルオロフェニル)ボレート、
フェロセニウムテトラキス(ペンタフルオロフェニル)アルミネート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレートおよび
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート
である。
【0044】
化合物c)として用いられる有機アルミニウム化合物は、前記のような式HjAlU3-jまたはHjAl2U6-jのものである。
本発明の課題である触媒系は、一以上のオレフィンの(共)重合のために用いることができる。
それゆえ、本発明のさらなる課題は、上記の触媒系が存在する重合条件下に、一以上のオレフィンを接触させることを含む、2〜20の炭素原子を含有するオレフィンの(共)重合方法である。好ましくは、2〜20の炭素原子を含有するアルファ-オレフィンが用いられる。
【0045】
本発明の方法で用いることができるアルファ-オレフィンの例は、エチレン、プロピレン、1-ブテン、1-ペンテン、4-メチル-1-ペンテン、1-ヘキセン、1-オクテン、4,6-ジメチル-1-ヘプテン、1-デセン、1-ドデセン、1-テトラデセン、1-ヘキサデセン、1-オクタデセンおよび1-エイコセンである。好ましいオレフィンは、プロピレン、エチレンおよび1-ブテンである。
【実施例】
【0046】
以下の実施例は、本発明を説明するためのものであって、本発明を限定するためのものではない。
【0047】
実施例
一般的方法
全ての操作は、通常のシュレンク-ライン(Shlenk-line)手法を用いて、窒素下で行われた。溶媒は窒素で脱気し、活性Al2O3を通して精製され、窒素下で保存された。全ての化合物は、DPX 200 Brukerスペクトロメータでの1H-NMRおよび13C-NMRにより分析された。ジルコノセンの低い溶解性のため、この化合物の13C-NMRスペクトルは、Bruker DPX 400で、120℃、CD2Cl4中で行われた。ポリマーの融点(Tm)は、標準法に従って、Perkin Elmer DSC-7装置での示差走査熱量計(D.S.C.)により測定された。重合により得られた秤量試料(5〜10 mg)をアルミニウムの皿中に密封し、20℃/分に相当する走査速度で200℃に加熱した。全てのクリスタライトを完全に溶融するために、試料を200℃で5分間保持した。続いて、20℃/分に相当する走査速度で0℃に冷却後、試料を0℃で5分間保持した。次いで、試料を10℃/分に相当する走査速度で、2度目の200℃に加熱した。この2回目の加熱運転において、ピーク温度が融点(Tm)として採用された。
【0048】
比較例1
(ジメチル)シランジイルビス(4,5-ベンゾ-インデニル)ジルコニウムジクロライド (C1)
【化15】

は、US 5,830,821に記載の方法により製造された。
【0049】
比較例2
(ジメチル)シランジイルビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2 (C2)の合成
【化16】

a) 2-メチル-2-[(6-メチル-2-ナフチル)メチル]マロン酸
【化17】

【0050】
200 mlのEt2O中の3.6 gのNaH(90 mmol、鉱油中60 %)の撹拌懸濁液に、16.2 ml(94 mmol)の2-メチルマロン酸ジエチルを、冷却下にゆっくりと加えた。20℃で2時間撹拌後、30 mlのTHF中の21.2 g(90 mmol)の2-(ブロモメチル)-6-メチルナフタレン(Buu-Hoi L.; J.Chem.Soc.; 1946; 831により製造)の溶液を加え、得られた混合物を一晩撹拌し、飽和NH4Cl溶液を加えて分解した。有機相を分離し、水相を100 ml部のエーテルで2回抽出した。合わせた抽出液を蒸発させ、残渣を150 mlのメタノールに溶解し、KOH(20 g、360 mmol)の溶液をゆっくり加えた。混合物を5時間還流し、次いで蒸発乾固し、得られた半固体を温水(400 ml)に溶解した。溶液を100 ml部のエーテルで3回抽出し、次いで10 % HClを注意深く添加し酸性とした。上記の酸(2)の沈殿物を集め、乾燥して、白色の粉末20 g (81 %)を得た。
1H NMR (dmso -d6): 12.9 (ブロードs, 2H), 7.72 (m, 2H), 7.62 (d, 2H), 7.33 (m, 2H), 3.3 (s, 2H), 2.4 (s, 3H), 1.25 (s, 3H)
【0051】
b) 2,7-ジメチル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化18】

【0052】
酸(2)(20 g, 73 mmol)を、溶媒を用いないで、気体の発生が止まるまで(10分)180℃に加熱し、次いで反応混合物を冷却し、ベンゼン(50 ml)に溶解し、蒸発させた。油状残渣をベンゼン(100 ml)に再度溶解し、SOCl2(16 ml, 219 mmol)で処理した。得られた溶液を3時間還流し、蒸発乾固し、100 mlの乾燥CH2Cl2に溶解した。この溶液を、50 mlのCH2Cl2中の14.5 g(109 mmol)の無水AlCl3の撹拌懸濁液に、0℃で滴下した。反応混合物を一晩撹拌し、氷-5 % HCl溶液に注ぎ、50 mlのCH2Cl2で2回抽出した。合わせた有機抽出液をKHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させて、褐色の半固体として11.4 g(74 %)の(3)を得た。
1H NMR (CDCl3): 9.05 (d, 1H), 7.95 (d, 1H), 7.68 (s, 1H), 7.52 (d, 1H), 7.45 (d, 2H), 3.45 (カルテット(qwart), 1H), 2.8 (m, 2H), 2.55 (s, 3H), 1.40 (d, 3H)
【0053】
c) 2,7-ジメチル-3H-シクロペンタ[a]ナフタレン
【化19】

【0054】
50 mlのEt2O中の0.54 g(14 mmol)のLiAlH4懸濁液に、0℃で撹拌下に、エーテル中の10g(48 mmol)の(3)の溶液をゆっくりと加えた。反応混合物を室温で4時間撹拌し、次いで飽和NH4Cl溶液を加えて分解した。有機層を分離し、蒸発させ、得られた油状物を250 mlのベンゼンに溶解した。少量(100 mg)のp-TSAを加え、溶液をディーン-スターク水トラップで1時間還流した。反応をTLC(ベンゼン)でモニターした。暗色の溶液を冷却し、飽和KHCO3溶液で洗浄し、MgSO4で乾燥し、Al2O3(Fluka、中性、グレードI)層を通して濾過し、蒸発させた。明るい色の半固体としての(4)(2つの異性体)の収量−8.1 g(87 %)。
1H NMR (CDCl3): 8.05 (d, 1H), 7.85 (d, 1H), 7.74 (m, 3H), 7.64 (m, 2H), 7.55 (d, 1H), 7.4 (m, 2H), 7.15 ("s", 1H), 6.7 ( "s", 1H), 3.65 (s, 2H), 3.55 (s, 2H), 2.63 (d, 6H), 2.33 (d, 6H)
【0055】
d) ビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)(ジメチル)シラン
【化20】

【0056】
(4)のリチウム塩が、75 mlのEt2O中、-30℃で、5 g(25.7 mmol)の(4)と17 ml(27.2 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から、通常の方法で製造された。次いで、反応混合物を20℃に温め、5時間撹拌し、-70℃に再度冷却した。この温度で、130 mg(1.4 mmol, 5モル%)のCuCNを加え、得られた懸濁液を20分間撹拌し、1.55 ml(12.8 mmol)のMe2SiCl2を一度に加えた。一晩撹拌を続け、次いで混合物を冷水に注ぎ、ベンゼン(2×100 ml)で抽出した。ベンゼン溶液をシリカゲル(Merck 60)を通して濾過し、蒸発させて、明るい色の固体(ラセミ-(rac-)およびメソ-(meso-)異性体の混合物)として4.7 g(83%)を得た。
1H NMR (CDCl3): 8.15, 7.75, 7.6, 7.45 (m, Σ 20 H), 7.3 (s, 4H), 4.1 (d, 4H), 2.61 (s, 12H), 2.4 (d, 12H), -0.2 (s, 3H, メソ-), -0.27 ( s, 6H, ラセミ-), -0.29 (s, 3H, メソ-)
【0057】
e) (ジメチル)シランジイルビス(2,7-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2
【化21】

【0058】
(5)のリチウム塩が、40 mlのEt2O中、-30℃で、3 g(6.75mmol)の(5)および8.8 ml(14.4 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から製造された。次いで、反応混合物を20℃に温め、1時間撹拌し、蒸発させた。乾燥した塩を100 mlのペンタンに懸濁し、次いで1.86 g(7.9 mmol)のZrCl4および5 mlのEt2Oを連続して加え、混合物を一晩撹拌した。沈殿を濾別し、ペンタンで洗浄し、乾燥した。得られた化合物をジクロロメタン-エーエルの混液から再結晶して、黄橙色の粉末として(6)を得た。ラセミ-/メソ-=5/1の混合物として、(6)の収量2.5 g。
1H NMR (CD2Cl2): 7.85, 7.6, 7.4, 7.32, 7.35, (m, Σ 20 H), 7.2 (s, 2H), 7.07 (s,2H) 2.53 (s, 12H), 2.40 (s, 6H), 2.34 (s, 6H), 2.35 (s, 6H), 1.43 (s, 3H, メソ-), 1.33 ( s, 6H, ラセミ-), 1.24(s, 3H, メソ-)
【0059】
実施例1
(ジメチル)シランジイルビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2 (A1)の合成
【化22】

a) 2-メチル-2-[(7-メチル-2-ナフチル)メチル]マロン酸
【化23】

【0060】
200 mlのEt2O中の3.6 gのNaH(90 mmol、鉱油中60 %)の撹拌懸濁液に、16.2 ml(94 mmol)の2-メチルマロン酸ジエチルを、冷却下にゆっくりと加えた。20℃で2時間撹拌後、20 mlのTHF中の21.2 g (90 mmol)の2-(ブロモメチル)-7-メチルナフタレン(Gorsane, M.; Martin, R. H.; Bull.Soc.Chim.Belg.; 94; 3; 1985; 205-214により製造)溶液を加え、得られた混合物を一晩撹拌し、飽和NH4Cl溶液を加えて分解した。有機相を分離し、水相を100 ml部のエーテルで2回抽出した。合わせた抽出液を蒸発させ、残渣を150 mlのメタノールに溶解し、KOH(20 g, 360 mmol)の溶液をゆっくりと加えた。混合物を5時間還流し、次いで蒸発乾固し、得られた半固体を温水(300 ml)に溶解した。溶液を100 ml部のエーエルで3回抽出し、次いで10 % HClを加えて注意深く酸性にした。酸(2)の沈殿を集め、乾燥して、黄色がかった粉末を18.8 g (76 %)得た。
1H NMR (CDCl3): 7.77 (カルテット, 2H), 7.62 (s, 2H), 7.33 (m, 2H), 2.9 (s, 2H), 2.56 (s, 3H), 1.26 (s, 3H)
【0061】
b) 2,8-ジメチル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化24】

【0062】
酸(2)(15 g, 55 mmol)を、溶媒を用いないで、気体の発生が止まるまで(10分)180℃に加熱し、次いで反応混合物を冷却し、ベンゼン(50 ml)に溶解し、蒸発させた。油状残渣をベンゼン(100 ml)に再度溶解し、SOCl2(12 ml, 165 mmol)で処理した。得られた溶液を3時間還流し、蒸発乾固し、100 mlの乾燥CH2Cl2に溶解した。この溶液を、50 mlのCH2Cl2中の11.1 g(83mmol)の無水AlCl3の撹拌懸濁液に0℃で滴下した。反応混合物を一晩撹拌し、氷-5 % HCl溶液に注ぎ、50 mlのCH2Cl2で2回抽出した。合わせた有機抽出液をKHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させて、褐色の固体として9.6g(83 %)の(3)を得た。
1H NMR (CDCl3): 9.0 (s, 1H), 8.0 (d, 1H), 7.8 (d, 1H), 7.45 (t, 2H), 3.45 (カルテット(qwar), 1H), 2.8 (m, 2H), 2.6 (s, 3H), 1.4 (d, 3H)
【0063】
c) 2,8-ジメチル-3H-シクロペンタ[a]ナフタレン
【化25】

【0064】
10 mlのEt2O中の0.32 g(8 mmol)のLiAlH4懸濁液に、0℃で撹拌下に、エーテル(50 ml)中の3.5g(17 mmol)の(3)の溶液をゆっくりと加えた。反応混合物を室温で4時間撹拌し、次いで飽和NH4Cl溶液を加えて分解した。有機層を分離し、蒸発させ、得られた油状物を250 mlのベンゼンに溶解した。少量(100 mg)のp-TSAを加え、溶液をディーン-スターク水トラップで1時間還流した。反応をTLC(ベンゼン)でモニターした。暗色の溶液を冷却し、飽和KHCO3溶液で洗浄し、MgSO4で乾燥し、蒸発させた。明るい色の半固体としての(4)(2つの異性体)の収量−2.5 g(76 %)。
1H NMR (CDCl3): 7.82 (t, 4H), 7.60 (d, 2H), 7.51 (d, 2H), 7.31 (t, 2H), 7.10 (s, 2H), 3.47 (s, 4H), 2.58 (s, 6H), 2.3(s, 6H)
【0065】
d) ビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)(ジメチル)シラン
【化26】

【0066】
(4)のリチウム塩が、30 mlのEt2O中、-30℃で、2.0 g(10.3mmol)の(4)と6.8 ml(10.8 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から通常の方法で製造された。次いで反応混合物を20℃に温め、2時間撹拌し、-70℃に再度冷却した。この温度で、60 mg(0.6 mmol, 5モル%)のCuCNを加え、得られた懸濁液を20分間撹拌し、0.62 ml(5.13 mmol)のMe2SiCl2を一度に加えた。一晩撹拌を続け、次いで混合物を冷水に注ぎ、ベンゼン(2×100 ml)で抽出した。ベンゼン溶液をシリカゲル(Merck 60)を通して濾過し、蒸発させて、明るい色の固体(ラセミ-およびメソ-異性体の混合物)として1.8 g(79%)を得た。
1H NMR (CDCl3): 7.9, 7.8, 7.75, 7.55, 7.35 (m, Σ 20 H), 7.29 (s, 4H), 4.05 (d, 4H), 2.61 (s, 12H), 2.4 (d, 12H), -0.21 (s, 3H, メソ-), -0.29 ( s, 6H, ラセミ-), -0.30 (s, 3H, メソ-)
【0067】
e) (ジメチル)シランジイルビス(2,8-ジメチル-3H-シクロペンタ[a]ナフタレン-1-イル)ZrCl2
【化27】

【0068】
(5)のリチウム塩が、40 mlのEt2O中、-30℃で、2.4 g(5.4 mmol)の(5)および7 ml(11.2 mmol)のn-BuLi(Merck、ヘキサン中1.6 N溶液)から製造された。次いで反応混合物を20℃に温め、1時間撹拌し、蒸発させた。乾燥した塩を50 mlのペンタンに懸濁し、次いで1.52 gのZrCl4(6.5 mmol)および5 mlのEt2Oを連続して加え、混合物を一晩撹拌した。沈殿を濾別し、ペンタンで洗浄し、乾燥した。得られた化合物をジクロロメタン-エーエルの混液から再結晶して、黄色の粉末として(6)を得た。ラセミ-/メソ-=6/4の混合物として、(6)の収量は1.87 gである。
1H NMR (CD2Cl2): 7.65, 7.55, 7.35, 7.2, 7.35, 7.1 (m, Σ 24 H), 2.53 (s, 6H), 2.50 (s, 6H), 2.44 (s, 6H), 2.35 (s, 6H), 1.4 (s, 3H, メソ-), 1.35 ( s, 6H, ラセミ-), 1.2(s, 3H, メソ-)
【0069】
実施例2
[μ(η5-2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A2)の合成
【化28】

【0070】
a) (2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチル-ジチオフェノシクロペンタジエン-7-イル)ジメチルシラン
【化29】

【0071】
上記のようにして製造された2,8-ジメチル-3H-シクロペンタ[a]ナフタレン(0.43 g, 2.2 mmol)のエーテル(10 ml)中の溶液を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 1.4 ml, 2.2 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、-60℃に冷却し、SiMe2Cl2(0.35 ml, 2.9 mmol)を加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。エーテル(15 ml)中のジメチルジチオフェノシクロペンタジエン(0.45 g, 2.2 mmol)を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 1.4 ml, 2.2 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、10 mlのエーテル中の2,8-ジメチル-3H-シクロペンタ[a]ナフタレンのジメチルクロロシリル誘導体の懸濁液に-60℃で加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。カラムクロマトグラフィー(シリカゲル60、ヘキサン/CHCl3 8:1)により生成物を得た。黄色固体の収量0.82 g(82%)。
【0072】
b) [μ(η5-2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A2)
【化30】

【0073】
工程a)で得られた(2,8-ジメチル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシラン(0.82 g, 1.8 mmol)をEt2O(20 ml)に溶解し、-40℃に冷却し、n-BuLi(ヘキサン中の1.6Mの2.5 ml、4 mmol)を加えた。反応混合物を室温に温め、2時間撹拌し、-60℃に冷却し、ZrCl4(0.44 g, 1.9 mmol)を加えた。得られた混合物を撹拌して室温に温め、さらに16時間撹拌した。得られた黄色沈殿を濾別し、CH2Cl2から再結晶し、橙黄色の生成物を得た。収量0.82 g(74%)。
1H NMR (CD2Cl2, 20℃) δ: 7.81 (s, 1H); 7.59 (d, 1H); 7.51 (d, 1H); 7.30 (d, 1H); 7.12 (d, 1H) [芳香族C6環]; 6.79 (s, 2H); 6.57 (s, 1H) [C5環]; 2.60 (s, 3H); 2.53 (s, 3H); 2.43 (s, 3H); 2.40 (s, 3H); [C-CH3]; 1.32 (s, 3H); 1.18 (s, 3H) [Si-CH3]
【0074】
実施例3
[μ(η5-2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV) (A3)の合成
【化31】

【0075】
a) 2,7-ジブロモナフタレンは2,7-ナフタレンジオールから出発する既知の方法により得られた[Porzi G., Concilio C., J.Organomet.Chem., 128 (1977), 95-98]。
b) 2-ブロモ-7-メチルナフタレン
【化32】

【0076】
エーテル(400 ml)中の2,7-ジブロモナフタレン(61.4 g, 0.21 mol)懸濁液を-30℃に冷却し、n-BuLi(ヘキサン中1.6M、135 ml、0.21 mol)を加えた。反応混合物を室温に温め、さらに2.5時間撹拌し、-30℃に冷却し、CH3I(13.5 ml, 0.21 mol)を加えた。反応混合物を室温に温め、さらに16時間撹拌し、水(100 ml)で処理した。有機層を分離し、水層をエーテル(6×100 ml)で抽出した。合わせた有機画分を蒸発させ、ほとんど純粋な固形生成物を得た。収量38.1 g(82%)。
1H NMR (CDCl3, 20℃) δ: 7.93 (s, 1H); 7.70 (d, 1H); 7.52 (s, 1H); 7.50 (d, 1H); 7.35 (d, 1H) [芳香族C6環]; 2.54 (s, 3H, -CH3)
【0077】
c) 2-メチル-7-フェニルナフタレン
【化33】

【0078】
エーテル(100 ml)中の2-ブロモ-7-メチルナフタレン(10 g, 45 mmol)溶液を-0℃に冷却し、続いて、Ni(dppp)Cl2および(55 mlのエーテル中1.3 gのMgと5.6 mlのPhBrから得られた)PhLiの溶液を加えた。反応混合物を室温に温め、さらに4時間加熱して撹拌し、室温に冷却し、さらに16時間撹拌し、水(100 ml)で処理した。有機層を分離し、水層をエーテル(3×50 ml)で抽出した。合わせた有機画分を蒸発させ、ほとんど純粋な固形生成物を得た。収量9.23 g(94%)。
1H NMR (CDCl3, 20℃) δ: 8.10 (s, 1H); 7.92 (d, 1H); 7.83-7.71 (mのグループ, 5H); 7.53 (t, 2H); 7.43 (t, 1H); 7.37 (d, 1H) [芳香族C6環]; 2.58 (s, 3H, -CH3)
【0079】
d) 2-(ブロモメチル)-7-フェニルナフタレン
【化34】

【0080】
2-メチル-7-フェニルナフタレン(5.4 g, 25 mmol)およびN-ブロモスクシンイミド(4.4 g, 25 mmol)をCCl4(60 ml)中に懸濁した。過酸化ベンゾイル(0.25 g)およびBr2(20 mkl)を加え、混合物を3時間還流し、濾過し、蒸発させ、乾燥し、ほとんど純粋な生成物を得た。収量7.4 g(〜100%)。
1H NMR (CDCl3, 20℃) δ: 8.40 (s, 1H); 7.94-7.73 (mのグループ, 6H); 7.53 (m, 3H); 7.44 (t, 1H)[芳香族C6環]; 4.71 (s, 2H, -CH2)
【0081】
e) 2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸
【化35】

【0082】
エタノール(80 ml)中のEtONa(1.7 g, 25 mmol)の溶液に、メチルマロン酸ジエチル(4.35 g, 25 mmol)を加えた。得られた混合物を2時間撹拌し、2-(ブロモメチル)-7-フェニルナフタレン(7.4 g, 25 mmol)を加えた。得られた混合物を6時間還流し、冷却し、NaOH(水10 ml中4 g)で処理し、6時間還流した。冷却後、HCl水溶液をpH〜1まで加えた。得られた沈殿を濾別し、純粋な2-メチル-2-[(7-フェニル-2-ナフチル)メチル]マロン酸を得た。収量7.2 g(86%)。
1H NMR (DMSO-d6, 20℃) δ: 12.9 (ブロード, 2H, -COOH); 8.12 (s, 1H); 7.97 (d, 1H); 7.86 (d, 1H); 7.80 (m, 4H); 7.52 (t, 2H); 7.41 (t, 1H); 7.35 (d, 1H) [芳香族C6環]; 3.28 (s, 2H, -CH2); 1.25 (s, 3H, -CH3)
【0083】
ジカルボン酸を加熱(150-160℃、30分)して、2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸(6.25 g)を得た。
1H NMR (CDCl3, 20℃) δ: 11.5-10 (ブロード, 1H, -COOH); 8.15 (s, 1H); 7.92 (d, 1H); 7.83 (d, 1H); 7.76 (m, 4H); 7.52 (t, 2H); 7.42 (t, 1H); 7.36 (d, 1H) [芳香族C6環]; 3.30 (m, 1H); 2.90 (m, 2H) [-CHCH2-]; 1.25 (d, 3H, -CH3)
【0084】
f) 2-メチル-8-フェニル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン
【化36】

【0085】
2-メチル-3-(7-フェニル-2-ナフチル)プロピオン酸(6.25 g, 21.5 mmol)をCH2Cl2(20 ml)中に懸濁し、SOCl2(2.9 ml, 40 mmol)および0.05 mlのDMFを加えた。得られた混合物を室温で2時間撹拌し、さらに1時間還流し、蒸発させ、真空下に乾燥した。AlCl3(4.3 g, 33 mmol)をCH2Cl2(40ml)中に懸濁し、得られたクロロアンハイドライドのCH2Cl2(20 ml)溶液を、0℃で0.5時間で加えた。得られた混合物を室温に温め、さらに2時間撹拌し、氷/HCl(〜200 g + 40 ml)中に注いだ。得られた混合物をCH2Cl2(4×50ml)で抽出した。合わせた有機相をKHCO3水溶液で洗浄し、MgSO4で乾燥し、蒸発させ、真空下に乾燥し、ほとんど純粋な固形生成物を得た。収量5.45 g(92%)。
1H NMR (CDCl3, 20℃) δ: 9.48 (s, 1H); 8.07 (d, 1H); 7.70 (d, 1H); 7.85 (m, 3H); 7.53 (m, 3H); 7.43 (t, 1H) [芳香族C6環]; 3.50 (m, 1H); 2.85 (m, 2H) [-CHCH2-]; 1.41 (d, 3H, -CH3)
【0086】
g) 2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレン
【化37】

【0087】
Et2O(50 ml)中のLiAlH4(0.23 g, 6 mmol)の冷却(-40℃)懸濁液に、Et2O(50 ml)中の2-メチル-8-フェニル-2,3-ジヒドロ-1H-シクロペンタ[a]ナフタレン-1-オン(5.45 g, 20 mmol)を滴下した。得られた混合物を室温に温め、さらに2時間撹拌した。次いで、H2O(10 ml)および10M HCl(5 ml)を加え、得られた混合物をCH2Cl2(300 ml)中に注いだ。有機相を水(50 ml)、5% KHCO3水溶液(50 ml)で洗浄し、MgSO4で乾燥し、蒸発させ、白色結晶性のアルコールを得た。250 mlの丸底フラスコにアルゴンで散布し、ベンゼン(100 ml)およびp-TSA(0.2 g)を加え、得られた溶液を撹拌下に、ディーン-スターク ヘッドで1.5時間(TLC(ベンゼン/EtOAc 4:1)で管理)還流した。次いで、得られた黄色の溶液を水、KHCO3水溶液、水で洗浄し、MgSO4で乾燥し、少量のシリカゲルに通し、蒸発させ、4.8 g (94%)の生成物を得た。
1H NMR (CDCl3, 20℃) δ: 8.30 (s, 1H); 7.98 (d, 1H); 7.82 (dd, 2H); 7.75 (d, 1H); 7.68 (d, 1H); 7.60 (d, 1H); 7.55 (t, 2H); 7.44 (d, 1H); 7.20 (s, 1H) [-CH=]; 3.51 (s, 2H, -CH2-); 2.33 (s, 3H, -CH3)
【0088】
h) (2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチリジチオフェノシクロペンタジエン-7-イル)ジメチルシラン
【化38】

【0089】
エーテル(50 ml)中の2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレン(2.56 g, 10 mmol)の溶液を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 6.3 ml, 10 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、-60℃に冷却し、SiMe2Cl2(1.33 ml, 11 mmol)を加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。エーテル(40 ml)中のジメチルジチオフェノシクロペンタジエン(2.06 g, 10 mmol)を-40℃に冷却し、ヘキサン中のn-BuLi(1.6M, 6.3 ml, 10 mmol)を加えた。得られた混合物を室温に温め、1時間撹拌し、エーテル50 ml中の2-メチル-8-フェニル-3H-シクロペンタ[a]ナフタレンのジメチルクロロシリル誘導体の懸濁液に、-60℃で加えた。得られた混合物を室温に温め、16時間撹拌し、蒸発させ、乾燥した。ヘキサンからの結晶化により、生成物が単一の異性体として得られた。収量2.28 g(44%)。
1H NMR (CDCl3, 20℃) δ: 8.39 (s, 1H); 7.99 (d, 1H); 7.81 (dd, 2H); 7.78 (d, 1H); 7.63 (m, 2H); 7.56 (t, 2H); 7.44 (t, 1H); 7.36 (s, 1H); 6.94 (s, 1H); 6.90 (s, 1H) [-CH=]; 4.19 (s, 1H); 4.10 (s, 1H) [>CH-]; 2.63 (s, 3H); 2.58 (s, 3H); 2.42 (s, 3H) [C-CH3]; -0.31 (s, 3H); -0.33 (s, 3H) [Si-CH3]
【0090】
i) [μ(η5-2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(η5-2,5-ジメチルジチオフェノシクロペンタジエン-7-イル)ジメチルシランジイル] ジクロロジルコニウム (IV)
【化39】

【0091】
(2-メチル-8-フェニル-3H-シクロペンタ[a]ナフチ-3-イル)(2,5-ジメチル-ジチオフェノシクロペンタジエン-7-イル)ジメチルシラン(2.28 g, 4.39 mmol)をEt2O(60 ml)中に懸濁し、-40℃に冷却し、n-BuLi(ヘキサン中1.6Mの5.6 ml、9 mmol)を加えた。反応混合物を室温に温め、2時間撹拌し、-60℃に冷却し、ZrCl4(1.05 g, 4.5 mmol)を加えた。得られた混合物を撹拌して室温に温め、さらに16時間撹拌した。得られた黄色の沈殿を濾別し、CH2Cl2での20回の抽出により精製し、続いて溶液を濃縮し、橙黄色の生成物を得た。収量1.97 g(66%)。
【0092】
重合例
一般的な方法
表1に示された量のメタロセンを、適当な量のメチルアルモキサン(MAO)溶液(トルエン中30重量%) (Al/Zrのモル比=500)とともに5 mlのトルエン中に溶解し、オートクレーブに注入する前に、室温で10分間撹拌して溶液を得ることにより、触媒混合物を製造した。前もってヘキサン中のAl(i-Bu)3溶液での洗浄により浄化し、プロピレンのストリーム中50℃で乾燥した、磁気的に作動する撹拌装置および35-mLのステンレス-スチール製バイアルを備え、温度制御のためのサーモスタットが付いた2.4-Lのジャケット付きステンレス-スチール製オートクレーブ中に、2 mmolのAl(i-Bu)3(ヘキサン中の1M溶液として)および700 gのプロピレンを室温で充填した。次いで、オートクレーブを70℃に自動温度調節し、次いで窒素圧力によりステンレス-スチール製バイアルを通して触媒/助触媒混合物を含むトルエン溶液をオートクレーブに注入し、一定の温度で1時間重合を行った。反応器にCOを加圧することにより重合を止めた。未反応のモノマーを排気し、反応器を室温に冷却した後、ポリマーを減圧下に60℃で乾燥した。重合結果を表1に示す。
【0093】
【表1】

*比較
a) ラセミ メソ異性体の混合物(ラセミ:メソ 6:4)
b) ラセミ メソ異性体の混合物(ラセミ:メソ 5:1)
【0094】
表1の結果から、化合物A1は、それがラセミ、メソの混合物で用いられても(メソ体は、ラセミ体に比べてより低い活性を有するか、または不活性である)、化合物C1およびC2より高い重合活性を示すことが明らかである。
【特許請求の範囲】
【請求項1】
式(I):
【化1】

(式中、
Mは元素周期律表の3、4、5、6族またはランタニドもしくはアクチニド族に属するものから選択される遷移金属の原子であり;
pは0〜3の整数であり、金属Mの形式上の酸化状態マイナス2に等しく;
Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、Rは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基である)であるか;または2つのXは、置換もしくは無置換のブタジエニル基またはOR'O基(ここで、R'はC1-C40アルキリデン、C6-C40アリーリデン、C7-C40アルキルアリーリデンおよびC7-C40アリールアルキリデン基から選択される2価の基である)を任意に形成してもよく;
Lは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、C1-C20アルキリデン、C3-C20シクロアルキリデン、C6-C20アリーリデン、C7-C20アルキルアリーリデンまたはC7-C20アリールアルキリデン基、および5までのシリコン原子を含むシリリデン基から選択される2価の架橋基であり;
R1は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり、
R3は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R2、R4およびR5は、R2、R4およびR5の少なくとも一つは水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R3はR4と共におよび/またはR4はR5と共に結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい、脂肪族または芳香族の3〜7員環を形成していてもよく;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;
R6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R8は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C50の炭化水素基であり;二つ以上のR8基は一緒になって、元素周期律表の13〜16族に属するヘテロ原子を少なくとも一つ含む一つ以上の3〜7員環を形成することもでき;該環は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C20の炭化水素基でさらに置換され得る)
のメタロセン化合物。
【請求項2】
Mがチタニウム、ジルコニウムまたはハフニウムであり;
pが2であり;
Rが、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基であり;
Xが水素原子、ハロゲン原子またはR基であり;
Lが基Z(R'')2(ここで、Zは炭素またはシリコン原子であり、そして
R''は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C10アルキル、C2-C10アルケニル、C2-C10アルキニル、C6-C10アリール、C7-C10アルキルアリールまたはC7-C10アリールアルキル基である)である;
請求項1に記載の式(I)のメタロセン化合物。
【請求項3】
R1が、直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルであり;
R3が、直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルまたはC6-C40アリール基であり;
R2、R4およびR5が水素原子であり;そして
R6およびR7が、水素原子、または直鎖状もしくは分枝鎖状の、飽和もしくは不飽和のC1-C20アルキル基である;
請求項1または2に記載の式(I)のメタロセン化合物。
【請求項4】
式(II)
【化2】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は請求項1〜3に記載の意味を有し;
R10は、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R11、R12、R13およびR14は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもC1-C40の炭化水素基であり;隣接する二つのR11、R12、R13およびR14基は結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい3〜7員環を形成することもでき、該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができる)
を有する、請求項1〜3のいずれか一つに記載のメタロセン化合物。
【請求項5】
R10が直鎖状または分枝鎖状のC1-C20アルキル基であり;
R11がC6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アルールアルキル基であるか、またはR12と一緒になって、1〜20の炭素原子を有する炭化水素基で置換され得るフェニル環を形成し;
R12は水素原子であるか、またはR11と一緒になって前記のような3〜7員環を形成し;
R14およびR13は水素原子、またはC1-C20アルキル基である;
請求項4に記載のメタロセン化合物。
【請求項6】
式(III)
【化3】

(式中、M、X、p、L、R1、R2、R3、R4、R5、R6、R7、R10、R13およびR14は請求項1〜5に記載の意味を有する)
を有する、請求項4または5に記載のメタロセン化合物。
【請求項7】
式(IV)
【化4】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は請求項1〜3に記載の意味を有し、
R15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基である)
を有する、請求項1〜3のいずれか一つに記載のメタロセン化合物。
【請求項8】
R15およびR16が、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状のC1-C40アルキル基である、請求項7に記載のメタロセン化合物。
【請求項9】
次の工程:
a) 式(Ia)
【化5】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは請求項1〜3に記載の意味を有する)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム[ここで、Bはアルカリ金属またはアルカリ土類金属であり;jは1または2であり(Bがアルカリ金属、好ましくはリチウムであるときjは1であり、Bがアルカリ土類金属であるときjは2である);Tは、1以上のSiまたはGe原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C20アルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり;好ましくはTはメチルまたはブチル基であり;T1はハロゲン原子または基OR'''(ここで、R'''は、元素周期律表の13〜17族に属するヘテロ原子を1以上任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基である)である]から選択される塩基と接触させること(ここで、該塩基と式(Ia)のリガンドとのモル比は少なくとも2:1であり;過剰の該塩基を用いることができる);および
b) 工程a)で得られた物質を、式MXp+2(ここで、M、Xおよびpは請求項1〜3に記載の意味を有する)の化合物と接触させること;
を含む、式(I)のメタロセン化合物の製造方法。
【請求項10】
式(Ia)
【化6】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは請求項1〜3に記載の意味を有する)
のリガンド、および/またはその2重結合異性体。
【請求項11】
式(IIa)、(IIIa)および(IVa)
【化7】

(式中、L、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15およびR16は、請求項1〜8に記載されたとおりである)
を有する、請求項12に記載のリガンド、および/またはそれらの2重結合異性体。
【請求項12】
a) 少なくとも一つの式(I)のメタロセン化合物;
b) 少なくとも一つのアルモキサン、またはアルキルメタロセンカチオンを形成することができる化合物;および
c) 任意に有機アルミニウム化合物;
を接触させて得られる触媒系。
【請求項13】
ポイントa)のメタロセン化合物が、式(II)、(III)および(IV)の化合物から選択される、請求項12に記載の触媒系。
【請求項14】
請求項12および13に記載の触媒系の存在下、重合条件下に、2〜20の炭素原子を有する1以上のオレフィンを接触させることを含む、該オレフィンの(共)重合方法。
【請求項15】
オレフィンが2〜20の炭素原子を有するアルファ−オレフィンである、請求項14に記載の方法。
【請求項16】
プロピレン、エチレンまたは1-ブテンが(共)重合させられる、請求項16に記載の方法。
【請求項1】
式(I):
【化1】

(式中、
Mは元素周期律表の3、4、5、6族またはランタニドもしくはアクチニド族に属するものから選択される遷移金属の原子であり;
pは0〜3の整数であり、金属Mの形式上の酸化状態マイナス2に等しく;
Xは同一または異なって、水素原子、ハロゲン原子、またはR、OR、OSO2CF3、OCOR、SR、NR2もしくはPR2基(ここで、Rは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基である)であるか;または2つのXは、置換もしくは無置換のブタジエニル基またはOR'O基(ここで、R'はC1-C40アルキリデン、C6-C40アリーリデン、C7-C40アルキルアリーリデンおよびC7-C40アリールアルキリデン基から選択される2価の基である)を任意に形成してもよく;
Lは、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、C1-C20アルキリデン、C3-C20シクロアルキリデン、C6-C20アリーリデン、C7-C20アルキルアリーリデンまたはC7-C20アリールアルキリデン基、および5までのシリコン原子を含むシリリデン基から選択される2価の架橋基であり;
R1は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり、
R3は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R2、R4およびR5は、R2、R4およびR5の少なくとも一つは水素原子であるとの条件で、互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R3はR4と共におよび/またはR4はR5と共に結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい、脂肪族または芳香族の3〜7員環を形成していてもよく;該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができ;
R6およびR7は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R8は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C50の炭化水素基であり;二つ以上のR8基は一緒になって、元素周期律表の13〜16族に属するヘテロ原子を少なくとも一つ含む一つ以上の3〜7員環を形成することもでき;該環は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C20の炭化水素基でさらに置換され得る)
のメタロセン化合物。
【請求項2】
Mがチタニウム、ジルコニウムまたはハフニウムであり;
pが2であり;
Rが、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C2-C40アルケニル、C2-C40アルキニル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基であり;
Xが水素原子、ハロゲン原子またはR基であり;
Lが基Z(R'')2(ここで、Zは炭素またはシリコン原子であり、そして
R''は、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C10アルキル、C2-C10アルケニル、C2-C10アルキニル、C6-C10アリール、C7-C10アルキルアリールまたはC7-C10アリールアルキル基である)である;
請求項1に記載の式(I)のメタロセン化合物。
【請求項3】
R1が、直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルであり;
R3が、直鎖状または分枝鎖状の、飽和または不飽和のC1-C20アルキルまたはC6-C40アリール基であり;
R2、R4およびR5が水素原子であり;そして
R6およびR7が、水素原子、または直鎖状もしくは分枝鎖状の、飽和もしくは不飽和のC1-C20アルキル基である;
請求項1または2に記載の式(I)のメタロセン化合物。
【請求項4】
式(II)
【化2】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は請求項1〜3に記載の意味を有し;
R10は、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基であり;
R11、R12、R13およびR14は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもC1-C40の炭化水素基であり;隣接する二つのR11、R12、R13およびR14基は結合して、元素周期律表の13〜16族に属するヘテロ原子を任意に含んでいてもよい3〜7員環を形成することもでき、該環は1〜20の炭素原子を有する1以上の炭化水素置換基を有することができる)
を有する、請求項1〜3のいずれか一つに記載のメタロセン化合物。
【請求項5】
R10が直鎖状または分枝鎖状のC1-C20アルキル基であり;
R11がC6-C40アリール、C7-C40アルキルアリールもしくはC7-C40アルールアルキル基であるか、またはR12と一緒になって、1〜20の炭素原子を有する炭化水素基で置換され得るフェニル環を形成し;
R12は水素原子であるか、またはR11と一緒になって前記のような3〜7員環を形成し;
R14およびR13は水素原子、またはC1-C20アルキル基である;
請求項4に記載のメタロセン化合物。
【請求項6】
式(III)
【化3】

(式中、M、X、p、L、R1、R2、R3、R4、R5、R6、R7、R10、R13およびR14は請求項1〜5に記載の意味を有する)
を有する、請求項4または5に記載のメタロセン化合物。
【請求項7】
式(IV)
【化4】

(式中、
M、X、p、L、R1、R2、R3、R4、R5、R6およびR7は請求項1〜3に記載の意味を有し、
R15およびR16は互いに同一または異なって、水素原子または元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよいC1-C40の炭化水素基である)
を有する、請求項1〜3のいずれか一つに記載のメタロセン化合物。
【請求項8】
R15およびR16が、元素周期律表の13〜17族に属するヘテロ原子を任意に含んでいてもよい、直鎖状または分枝鎖状のC1-C40アルキル基である、請求項7に記載のメタロセン化合物。
【請求項9】
次の工程:
a) 式(Ia)
【化5】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは請求項1〜3に記載の意味を有する)
の化合物、および/またはその2重結合異性体を、
TjB、TMgT1、ナトリウムおよびカリウムハイドライド、金属ナトリウムおよびカリウム[ここで、Bはアルカリ金属またはアルカリ土類金属であり;jは1または2であり(Bがアルカリ金属、好ましくはリチウムであるときjは1であり、Bがアルカリ土類金属であるときjは2である);Tは、1以上のSiまたはGe原子を任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C20アルキル、C6-C20アリール、C7-C20アルキルアリールまたはC7-C20アリールアルキル基であり;好ましくはTはメチルまたはブチル基であり;T1はハロゲン原子または基OR'''(ここで、R'''は、元素周期律表の13〜17族に属するヘテロ原子を1以上任意に含んでいてもよい、直鎖状または分枝鎖状の、環式または非環式の、C1-C40アルキル、C6-C40アリール、C7-C40アルキルアリールまたはC7-C40アリールアルキル基である)である]から選択される塩基と接触させること(ここで、該塩基と式(Ia)のリガンドとのモル比は少なくとも2:1であり;過剰の該塩基を用いることができる);および
b) 工程a)で得られた物質を、式MXp+2(ここで、M、Xおよびpは請求項1〜3に記載の意味を有する)の化合物と接触させること;
を含む、式(I)のメタロセン化合物の製造方法。
【請求項10】
式(Ia)
【化6】

(式中、R1、R2、R3、R4、R5、R6、R7、R8およびLは請求項1〜3に記載の意味を有する)
のリガンド、および/またはその2重結合異性体。
【請求項11】
式(IIa)、(IIIa)および(IVa)
【化7】

(式中、L、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15およびR16は、請求項1〜8に記載されたとおりである)
を有する、請求項12に記載のリガンド、および/またはそれらの2重結合異性体。
【請求項12】
a) 少なくとも一つの式(I)のメタロセン化合物;
b) 少なくとも一つのアルモキサン、またはアルキルメタロセンカチオンを形成することができる化合物;および
c) 任意に有機アルミニウム化合物;
を接触させて得られる触媒系。
【請求項13】
ポイントa)のメタロセン化合物が、式(II)、(III)および(IV)の化合物から選択される、請求項12に記載の触媒系。
【請求項14】
請求項12および13に記載の触媒系の存在下、重合条件下に、2〜20の炭素原子を有する1以上のオレフィンを接触させることを含む、該オレフィンの(共)重合方法。
【請求項15】
オレフィンが2〜20の炭素原子を有するアルファ−オレフィンである、請求項14に記載の方法。
【請求項16】
プロピレン、エチレンまたは1-ブテンが(共)重合させられる、請求項16に記載の方法。
【公表番号】特表2007−525489(P2007−525489A)
【公表日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願番号】特願2006−545942(P2006−545942)
【出願日】平成16年11月16日(2004.11.16)
【国際出願番号】PCT/EP2004/012984
【国際公開番号】WO2005/063828
【国際公開日】平成17年7月14日(2005.7.14)
【出願人】(502303902)バセル ポリオレフィン ジーエムビーエイチ (19)
【氏名又は名称原語表記】BASELL POLYOLEFINE GMBH
【住所又は居所原語表記】Bruhler Strasse 60,50389 Wesseling,Germany
【Fターム(参考)】
【公表日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願日】平成16年11月16日(2004.11.16)
【国際出願番号】PCT/EP2004/012984
【国際公開番号】WO2005/063828
【国際公開日】平成17年7月14日(2005.7.14)
【出願人】(502303902)バセル ポリオレフィン ジーエムビーエイチ (19)
【氏名又は名称原語表記】BASELL POLYOLEFINE GMBH
【住所又は居所原語表記】Bruhler Strasse 60,50389 Wesseling,Germany
【Fターム(参考)】
[ Back to top ]

