メチオニン由来グルコシノレート及びメチオニンの蓄積量が制御された植物及びその作出方法
【課題】新たなメチオニン由来グルコシノレート(Met-GSL)生合成の制御因子および生合成酵素などの関連遺伝子を見出し、Met-GSL量又はメチオニン量が調節された植物を提供する。
【解決手段】植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を用いてメチオニン由来グルコシノレート(Met-GSL)量およびメチオニン量が制御された植物を得る方法、及び得られた植物。(a)特定なアミノ酸配列からなるタンパク質、(b)特定なアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質、(c)特定なアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質。
【解決手段】植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を用いてメチオニン由来グルコシノレート(Met-GSL)量およびメチオニン量が制御された植物を得る方法、及び得られた植物。(a)特定なアミノ酸配列からなるタンパク質、(b)特定なアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質、(c)特定なアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、メチオニン由来グルコシノレート及びメチオニンの蓄積量が制御された植物及びその作出方法に関する。
【背景技術】
【0002】
グルコシノレート(GSL)類はアブラナ科植物の生産する含硫二次代謝産物であり、研究用のモデル植物であるシロイヌナズナをはじめ、食用作物であるブロッコリー、キャベツ、ダイコン、ケール、カラシナ、ワサビなどに含まれる。GSL類は、植物内で分解酵素ミロシナーゼとは異なる細胞に蓄積されており、植物組織が破壊されると両者が接触してイソチオシアネート(ITC)に分解される。GSL類は、その分解産物であるイソチオシアネート(ITC)とともに、病害虫に対する忌避物質として知られる。また、ITC類はアブラナ科野菜における辛味成分や香気成分として重要であるほか、ヒトなどの動物に対して分子種によって異なる生理作用がある。
【0003】
GSL類は、その構造によってアリファティック系GSL、インドール系GSL、およびアロマティック系GSLに大別され、これらはそれぞれ、メチオニン、トリプトファン、フェニルアラニンを前駆体として生合成され、その前駆体の種類によって側鎖の化学構造が大きく異なっている(非特許文献1,2)。このうち、メチオニン由来GSL(Met-GSL)及びその分解で生じるイソチオシアネート(ITC)は、発がん抑制効果を示すことが実証され、注目を集めている(非特許文献3)。特にブロッコリースプラウトに含まれるITCであるスルフォラファンはグルコラファニン(4-methylsulfinylbutyl GSL、略称4MSB)より生じ、生体内のNrf2を活性化し、抗酸化や解毒作用によりガン、高血圧、加齢性疾患の予防に有効であることがわかっている(非特許文献4)。一方、分解産物に甲状腺腫をひきおこす作用があるグルコブラッシン(indol-3-ylmethyl GSL、略称I3M)などもアブラナ科野菜に含まれている。
【0004】
このように、野菜作物における豊富なGSL類は、農薬の使用制限のために、またヒトの健康を促進するために重要である。しかしながら、食物および飼料用のアブラナ科油糧作物の価値は、GSL類のような化学物質によって減少する場合もある。一般に、付加価値のある野菜作物の市場性はその植物化学物質(フィトケミカル)のポジティブ面とネガティブ面に密接に関連しているといえる。従って、野菜やそれを利用した食品類の付加価値を高めるためには、グルコラファニンを増やしてグルコブラッシンを減らすなどのように、グルコシノレートの分子種ごとに蓄積量を制御することが望まれる。
【0005】
一方、本発明者らはシロイヌナズナのトランスクリプトミクスおよびメタボロミクスを統合させてGSL生合成と分解に関与する遺伝子群の同定と解析を進めてきた。硫黄栄養欠乏(-S)下のシロイヌナズナのトランスクリプトームおよびメタボロームの経時変化を、それぞれDNAマイクロアレイ及びフーリエ変換イオンサイクロトロン共鳴質量分析を用いて解析し、両データをひとつの行列に統合し、多変量解析のひとつである一括学習自己組織化マッピング法によって解析して共蓄積している代謝物と共発現している遺伝子を調べたところ、グルコシノレート類(3MSP, 4MTB, 7MSH, 8MSO, I3M, 4MI3M)が共蓄積しており、またグルコシノレート生合成酵素遺伝子群(MAM-1, MAM-L, CYP79F1, CYP79F2, CYP79A2, CYP79B2, CYP79B3, CYP83A1, CYP83B1, SUR1, UGT74B1, AtSOT16, AtSOT17, AtSOT18)が共発現していた(非特許文献5)。この結果は、グルコシノレート生合成酵素遺伝子群を同調的に制御する転写調節因子が存在することを示唆した。
【0006】
これまでMet-GSL生合成の制御因子については、生合成を促進する転写因子PMG1およびPMG2(非特許文献6)、硫黄欠乏に応じて生合成を抑制する転写因子SLIM1(非特許文献7)が報告されている。また、グルコシノレートの一種(p-hydroxybenzylglucosinolate)の輸送体に関する報告例として、アブラナ科植物(Brassica napus)のプロトプラストを用いた輸送活性が測定されている(非特許文献8)。しかし、遺伝子の同定に至っておらず、輸送体を用いたグルコシノレート分子種の代謝工学的なアプローチはこれまで報告がない。
【0007】
【非特許文献1】Grubb and Abel, Trends Plant Sci. 11: 89-100 (2006)
【非特許文献2】Halkier and Gershenzon, Annu. Rev. Plant Biol. 57: 303-333 (2006)
【非特許文献3】Talalay and Fahey, J. Nutr. 131: 3027S-3033S (2001)
【非特許文献4】Keum YS et al, Cancer Res. 66: 8804-8813 (2006)
【非特許文献5】Hirai et al., J. Biol. Chem. 280:25590-25595 (2005)
【非特許文献6】Hirai et al. Proc. Natl. Acad. Sci. 104: 6478-6483 (2007)
【非特許文献7】Maruyama-Nakashita, A., et al. Plant Cell 18: 3235-3251 (2006)
【非特許文献8】Chen, S. and Halkier, B.A., J. Biol. Chem. 275:22955-22960 (2000)
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、本発明の課題は、グルコシノレート生合成酵素遺伝子群の共発現関連性に基づいて、新たなメチオニン由来グルコシノレート(Met-GSL)生合成の制御因子および生合成酵素などの関連遺伝子を見出し、当該制御因子又は当該遺伝子を利用してMet-GSL量又はメチオニン量が調節された植物を作出することにある。
【課題を解決するための手段】
【0009】
発明者らは、上記課題を解決すべき鋭意研究を重ねた結果、既に同定されているメチオニン由来グルコシノレート(Met-GSL)生合成の転写促進因子PMG1およびPMG2のダブルノックアウト系統において同調的に発現抑制されている遺伝子群の中に、Met-GSLの生成中間体の輸送体遺伝子 (Met-GSL-related transporter, MGTP)を見出した。このMGTP遺伝子のin vivo機能をT-DNA挿入シロイヌナズナ(MGTP機能喪失シロイヌナズナ)において確認したところ、Met-GSL蓄積のみが特異的に抑制されるともに、メチオニン(Met)が高蓄積することが確認された。これまで、既知のMet-GSL生合成遺伝子および転写調節因子の機能喪失株では出発物質Metの蓄積量増加が見られたものはない。本発明はかかる知見により完成されたものである。
【0010】
即ち、本発明は以下の発明を包含する。
(1) 植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が破壊または発現抑制された変異植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0011】
(2) 植物体に存在する以下の(d)〜(f)のいずれかの遺伝子が破壊または発現抑制された変異植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0012】
(3) 変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、(1)または(2)に記載の変異植物。
(4) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(1)から(3)のいずれかに記載の変異植物。
【0013】
(5) 植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0014】
(6) 植物体に存在する以下の(d)〜(f)のいずれかの遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0015】
(7) 変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、(5)または(6)に記載の変異植物の作出方法。
(8) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(5)から(7)のいずれかに記載の変異植物の作出方法。
【0016】
(9) 以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が導入された形質転換植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0017】
(10) 以下の(d)〜(f)のいずれかの遺伝子が導入された形質転換植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0018】
(11) 形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、(9)または(10)に記載の形質転換植物。
(12) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(9)から(11)のいずれかに記載の形質転換植物。
【0019】
(13) 以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を含む組み換えベクター。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若sしくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0020】
(14) 以下の(d)〜(f)のいずれかの遺伝子を含む組み換えベクター。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0021】
(15) (13)に記載の組換えベクターを植物に導入し、該植物体で以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0022】
(16) (14)に記載の組換えベクターを植物に導入し、該植物体で以下の(d)〜(f)のいずれかの遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1または3に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0023】
(17) 形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、(15)または(16)に記載の形質転換植物の作出方法。
(18) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(15)から(17)のいずれかに記載の形質転換植物の作出方法。
【0024】
(19) 以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン由来グルコシノレート含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0025】
(20) 以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【発明の効果】
【0026】
本発明によれば、シロイヌナズナに含まれる遺伝子の中に、その遺伝子発現レベルの変化により、メチオニン由来グルコシノレート(Met-GSL)の蓄積量のみならず、メチオニン(Met)の蓄積量も変化させることのできる遺伝子が初めて明らかにされた。従って、本遺伝子は他のアブラナ科植物で利用することにより、植物体内のMet-GSL量およびMet量を正逆両方に制御することが可能である。例えば、本遺伝子の欠損変異体を作出することによりMet-GSL量を減少させ、Met量を増加させることができる。Met-GSL量の減少は、毒性が軽減された飼料作物や硫黄発生のないクリーンなバイオ燃料製造のための原料として利用するのに有利であり、Met量の増加は、動物の必須アミノ酸であるメチオニンを含む栄養価の高い飼料作物として利用するのに有利であり、ヒスタミンの血中濃度を低下してアレルギーを起こしにくくする。また、本遺伝子を植物体で高発現させることによりMet-GSL量を増加させることができるので、高い病虫害抵抗性や発がん抑制効果などの付加価値を植物に付与することができる。
【発明を実施するための最良の形態】
【0027】
1.メチオニン由来グルコシノレートの生成中間体の輸送体遺伝子
本発明は、シロイヌナズナに含まれる遺伝子の中で新たに機能同定された植物のメチオニン由来グルコシノレートの生成中間体の輸送体(MET-GSL-related transporter:MGTP)遺伝子の利用に関する。本発明において機能同定したMGTPは、動物の胆汁酸輸送体(bile acid:sodium symporter, BASS)のホモログであるが、植物での機能は未解明であった。本発明は、輸送体を用いた植物における新しい代謝物量の制御方法を提供するものである。
【0028】
上記のMGTP遺伝子としては、MIPSコードが「At4g12030」であるシロイヌナズナ由来の遺伝子が挙げられる。MGTP遺伝子は、配列番号1に示す塩基配列を有し、配列番号2に示すアミノ酸配列からなるタンパク質をコードする。
【0029】
本発明に使用するMGTP遺伝子には、以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子、または(d)〜(f)のいずれかの遺伝子(以下、これらの遺伝子を総称して「MGTP遺伝子」という場合がある。)が含まれる。
【0030】
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0031】
上記の「メチオニン由来グルコシノレートの生成中間体の輸送活性」とは、メチオニン(2C)からヘキサホモメチオニン(8C)に至るメチオニン側鎖伸長(MET-ELONG)反応サイクルによって生産されるメチオニン類縁体の細胞内輸送活性をいう。当該活性に起因して、メチオニン由来グルコシノレート生合成反応におけるGSLコア構造合成への基質供給が促進されて植物体中のメチオニン由来グルコシノレートの蓄積量が増加する。
【0032】
上記の「1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列」について、欠失、置換若しくは付加されてもよいアミノ酸の数としては、部位特異的突然変異誘発法等の公知の変異タンパク質作製法により欠失、置換、若しくは付加できる程度の数をいい、前記した活性を保持する限り、その個数は制限されないが、通常は、たとえば、1〜20個、好ましくは1〜10個、より好ましくは1〜5個をいう。また、ここにいう「変異」は、主には公知の変異タンパク質作製法により人為的に導入された変異を意味するが、天然に存在する同様の変異であってもよい。
【0033】
また、上記の「80%以上の相同性」とは、好ましくは85%以上、より好ましくは90%以上、最も好ましくは95%以上の相同性をいう。配列(アミノ酸配列、塩基配列)の同一性は、FASTA検索やBLAST検索により決定することができる。
【0034】
上記の「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、相同性が高い核酸、すなわち配列番号1に示す塩基配列と80%以上、好ましくは85%以上、より好ましくは90%以上、最も好ましく95%以上の相同性を有する核酸の相補鎖がハイブリダイズし、それより相同性が低い核酸の相補鎖がハイブリダイズしない条件が挙げられる。より具体的には、ナトリウム塩濃度が15〜750mM、好ましくは50〜750mM、より好ましくは300〜750mM、温度が25〜70℃、好ましくは50〜70℃、より好ましくは55〜65℃、ホルムアミド濃度が0〜50%、好ましくは20〜50%、より好ましくは35〜45%での条件をいう。さらに、ストリンジェントな条件では、ハイブリダイゼーション後のフィルターの洗浄条件が、通常はナトリウム塩濃度が15〜600mM、好ましくは50〜600mM、より好ましくは300〜600mM、温度が50〜70℃、好ましくは55〜70℃、より好ましくは60〜65℃である。上記のハイブリダイゼーションは、Sambrookら、Molecular Cloning,A Laboratory Manual,3rd Ed,, Cold Spring Harbor Laboratory(2001)に記載されている方法のような周知の方法で行うことができる。なお、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり、より相同性の高いポリヌクレオチドを単離できる。
【0035】
MGTP遺伝子は、それぞれ配列番号1に基づいて設計したプライマーを用いて、cDNAライブラリーまたはゲノムDNAライブラリー等由来の核酸を鋳型としたPCR増幅を行うことにより、核酸断片として得ることができる。また当該遺伝子は、上記ライブラリー等由来の核酸を鋳型とし、当該遺伝子の一部であるDNA断片をプローブとしてハイブリダイゼーションを行うことにより、核酸断片として得ることができる。あるいは当該遺伝子は、化学合成法等の当技術分野で公知の各種の核酸配列合成法によって、核酸断片として合成してもよい。
【0036】
また、当業者であれば、Molecular Cloning(Sambrook, J. et al., Molecular Cloning :a Laboratory Manual 2nd ed., Cold Spring Harbor Laboratory Press, 10 Skyline Drive Plainview, NY (1989))等を参照することにより、MGTP遺伝子のホモログ遺伝子を容易に取得することができる。
【0037】
たとえば、アミノ酸の欠失、付加、及び置換は、上記タンパク質をコードする遺伝子に、当該技術分野で公知の手法によって変異を導入することによって行うことができる。遺伝子に変異を導入するには、Kunkel法または Gapped duplex法等の公知手法またはこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-K(TAKARA社製)やMutant-G(TAKARA社製))、TAKARA社のLA PCR in vitro Mutagenesis シリーズキットを利用することができる。
【0038】
変異を導入したタンパク質がメチオニン由来グルコシノレートの生成中間体の輸送活性を持つかどうかは、配列番号2に示すアミノ酸配列を有するタンパク質の機能を失わせ、表現型を変化させた植物に、変異を導入したタンパク質をコードする遺伝子を導入し、それにより表現型が回復するかどうかを調べることにより判断できる。
【0039】
2. 組換えベクター
本発明における組換えベクターには、MGTP遺伝子を植物細胞内で発現させるためのベクターとMGTP遺伝子の植物細胞内での発現を抑制させるためのベクターが含まれ、植物体内のメチオニン由来グルコシノレート量またはメチオニン量を調節(増減)する上で、目的に応じて使用すればよい。
【0040】
植物形質転換に用いる本発明の組換えベクターは、上記1.のMGTP遺伝子(以下、「目的遺伝子」ともいう)を適当なベクターに導入することにより構築することができる。本発明の組換えベクターは、目的遺伝子を含むが、必ずしも目的遺伝子の全長を含む必要はなく、目的遺伝子の一部だけを含むものであってもよい。ここで、「目的遺伝子の一部」とは、目的遺伝子のメチオニン由来グルコシノレートの生成中間体の輸送活性を持つDNA断片をいう。
【0041】
上記ベクターとしては、例えば、アグロバクテリウムを介して植物に目的遺伝子を導入することができる、pBI系、pPZP系、pSMA系のベクターなどが好適に用いられる。特にpBI系のバイナリーベクターまたは中間ベクター系が好適に用いられ、例えば、pBI121、pBI101、pBI101.2、pBI101.3等が挙げられる。バイナリーベクターとは大腸菌(Escherichia coli)及びアグロバクテリウムにおいて複製可能なシャトルベクターで、バイナリーベクターを保持するアグロバクテリムを植物に感染させると、ベクター上にあるLB配列とRB配列より成るボーダー配列で囲まれた部分のDNAを植物核DNAに組み込むことが可能である。一方、pUC系のベクターは、植物に遺伝子を直接導入することができ、例えば、pUC18、pUC19、pUC9等が挙げられる。また、カリフラワーモザイクウイルス(CaMV)、インゲンマメモザイクウイルス(BGMV)、タバコモザイクウイルス(TMV)等の植物ウイルスベクターも用いることができる。
【0042】
バイナリーベクター系プラスミドを用いる場合、上記のバイナリーベクターの境界配列(LB,RB)間に、目的遺伝子を挿入し、この組換えベクターを大腸菌中で増幅する。次いで、増幅した組換えベクターをAgrobacterium tumefaciens GV3101、C58、LBA4404、EHA101、EHA105あるいはAgrobacterium rhizogenes LBA1334等に、エレクトロポレーション法等により導入し、該アグロバクテリウムを植物の形質導入に用いる。
【0043】
ベクターに目的遺伝子を挿入するには、まず、精製されたDNAを適当な制限酵素で切断し、適当なベクター DNAの制限酵素部位またはマルチクローニングサイトに挿入してベクターに連結する方法などが採用される。
【0044】
また、本発明の組換えベクターには、目的遺伝子の上流、内部、あるいは下流に、プロモーター、エンハンサー、ターミネーター、バイナリーベクター系を使用するための複製開始点(TiまたはRiプラスミド由来の複製開始点など)、選抜マーカー遺伝子などを含めることができる。
【0045】
「プロモーター」としては、植物細胞において機能し、植物の特定の組織内あるいは特定の発育段階において発現を導くことのできるDNAであれば、植物由来のものでなくてもよい。具体例としては、カリフラワーモザイクウイルス(CaMV)35Sプロモーター、ノパリン合成酵素遺伝子のプロモーター(Pnos)、トウモロコシ由来ユビキチンプロモーター、イネ由来のアクチンプロモーター、タバコ由来PRタンパク質プロモーター、タバコ由来のリブロースビスリン酸カルボキシラーゼ(RuBisCO)プロモーター等が挙げられる。
【0046】
エンハンサーとしては、例えば、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。
【0047】
ターミネーターとしては、プロモーターにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネーター、オクトピン合成酵素(OCS)遺伝子のターミネーター、CaMV 35S RNA遺伝子のターミネーター等が挙げられる。
【0048】
選抜マーカー遺伝子としては、例えば、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ビアラホス耐性遺伝子、クロラムフェニコール耐性遺伝子などが挙げられる。これらの選抜マーカー遺伝子を利用して例えば、アンピシリン、ネオマイシン、ハイグロマイシ、ビアラホス、クロラムフェニコール等の選抜薬剤を含む培地上で目的遺伝子が導入された組換え体を簡単に選抜できるようになる。
【0049】
また、選抜マーカー遺伝子は、上記のように目的遺伝子とともに同一のプラスミドに連結させて組換えベクターを調製してもよいが、あるいは、選抜マーカー遺伝子をプラスミドに連結して得られる組換えベクターと、目的遺伝子をプラスミドに連結して得られる組換えベクターとを別々に調製してもよい。別々に調製した場合は、各ベクターを宿主にコトランスフェクト(共導入)する。
【0050】
また本発明において、MGTP遺伝子の発現を抑制させるためのベクターは、MGTP遺伝子の発現を抑制するDNAを適当なベクターに挿入したものである。「MGTP遺伝子の発現抑制」には、MGTP遺伝子の転写物量の減少およびMGTP遺伝子がコードするタンパク質(翻訳産物)の減少が含まれる。MGTP遺伝子発現抑制用ベクターは、目的遺伝子がMGTP遺伝子の発現抑制を引き起こすDNAである以外、基本的に、プロモーター配列等のその他の要素は上記のMGTP遺伝子発現ベクターと同じである。
【0051】
上記のMGTP遺伝子の発現を抑制するDNAとして、該遺伝子から転写されるmRNAの全部又はその一部に対して相補的な配列を有するRNA(アンチセンスRNA)をコードするアンチセンスDNAを用いることできる。アンチセンスDNAの転写産物であるアンチセンスRNAは、宿主内に存在した場合に、その相補鎖であるMGTP遺伝子のmRNAと結合し、それによってMGTP遺伝子の翻訳を阻害し、発現を抑制できる。アンチセンスRNAをコードするアンチセンスDNAの塩基配列の長さは、対象となるMGTP遺伝子の発現を抑制することのできる長さであれば、必ずしもMGTP遺伝子mRNAの塩基配列の全長である必要はなく、一部であってもよい。一部とは、MGTP遺伝子mRNAの塩基配列全長の30%、好ましくは50%、より好ましくは80%、さらに好ましくは90%に該当する長さである。
【0052】
アンチセンスDNAは、ベクターにおいてアンチセンスの方向に連結する。連結は、直接でも、またはリンカーを介した連結でもよい。アンチセンスDNAは、宿主内で転写されたときに、MGTP遺伝子の転写産物であるmRNAに対してハイブリダイズするアンチセンスRNAが生成するようにベクターに連結し、該ベクターを宿主に導入する。アンチセンスRNAが生成するようにベクターに連結するには、プロモーター配列を有するDNA断片の下流にアンチセンスの方向(逆向き方向)にアンチセンスDNAを連結し、プロモーターの作動によりRNAに転写されるようにする。
【0053】
上記のMGTP遺伝子の発現を抑制するDNAとして、触媒活性を有するRNA分子であるリボザイムをコードするDNAを用いることもできる。標的のMGTP遺伝子mRNAを切断できるよう設計されたリボザイムコードするDNAは、植物細胞中で転写されるように前述の組換えベクター内のプロモーター及び転写終結配列に連結して用いればよい。
【0054】
上記のMGTP遺伝子の発現を抑制するDNAとして、共抑制によりMGTP遺伝子の発現を抑制するRNAをコードするDNA、すなわち、標的遺伝子配列と同一もしくは類似した配列を有するDNAを用いることもできる。共抑制とは、宿主に標的遺伝子と同一もしくは類似した配列を有するDNAを形質転換により導入すると、導入した外来遺伝子及び標的遺伝子の両方の発現が抑制される現象のことをいう。共抑制に用いる遺伝子は、標的遺伝子と完全に同一である必要はないが、少なくとも70%以上、好ましくは80%以上、さらに好ましくは90%以上の配列の同一性を有する。
【0055】
上記のMGTP遺伝子の発現を抑制するDNAとして、RNA干渉(RNAi)によりMGTP遺伝子の発現を抑制するRNAをコードするDNA、すなわち、標的遺伝子配列と同一もしくは類似した配列を逆位反復に配置したDNAを用いることもできる。RNA干渉とは、宿主にMGTP遺伝子と同一もしくは類似した配列を逆位反復に配置したDNAを形質転換により導入すると、導入DNAに由来する二本鎖RNAが発現し、標的遺伝子の発現が抑制される現象のことをいう。RNA干渉は、(1)標的遺伝子のmRNAと導入配列由来の二本鎖RNA(double-strand RNA、dsRNA)がRNA-induced silencing complex(RISC)と呼ばれる複合体を形成し、会合した配列をプライマーとして相補的なRNAが合成されるステップ、(2)内在性RNase によってこの複合体が断片化されるステップ、(3)20〜30塩基対に断片化した二本鎖RNAが二次的なRNA干渉のシグナルとして機能することによって再び標的遺伝子のmRNAを分解するステップによって進行すると考えられている(Curr. Biol., 7:R793, 1997; Curr. Biol., 6:810, 1996)。RNA干渉に用いるDNAの長さとしては、標的遺伝子の全長を使用してもよいが、少なくとも20塩基、好ましくは30塩基以上、より好ましくは50塩基以上であればよい。
【0056】
植物のRNA干渉(RNAi)にはRNAiを引き起こすdsRNAをヘアピン型dsRNAとして発現するベクターが好適に利用される。これは数塩基以上のリンカー(スペーサー)配列の両端にIR(inverted repeat:逆位反復)となるようにdsRNA形成部分に対応したDNA配列を配置し、植物体内で高発現するプロモーターによりヘアピン型dsRNAを転写し、細胞内でsiRNAを産生するシステムである。また、siRNA発現システムには上記のようなヘアピンタイプのほか、タンデムタイプもある。タンデムタイプでは、2つのプロモーターからセンスRNAとアンチセンスRNAが転写され、細胞内でハイブリダイズしてsiRNAを産生する。このようなRNAiベクターは、当該分野で周知の方法に従い、あるいは市販のRNAi用ベクターやシステム(例えば、psiRNA(Invitrogen)、pSUPER RNAi SystemTM(OligoEngine)等)を利用して容易に構築することができる。
【0057】
3.形質転換植物及びその作出方法
本発明の形質転換植物は、上記組換えベクターを対象植物に導入することによって作出することができる。本発明において「遺伝子の導入」とは、例えば公知の遺伝子工学的手法により、目的遺伝子を上記宿主植物の細胞内に発現可能な形で導入することを意味する。ここで導入された遺伝子は、宿主植物のゲノムDNA中に組み込まれてもよいし、外来ベクターに含有されたままで存在していてもよい。
【0058】
上記組換えベクターを植物中に導入する方法としては、既に報告され、確立されている種々の方法を適宜利用することができ、例えば、アグロバクテリウム法、PEG−リン酸カルシウム法、エレクトロポレーション法、リポソーム法、パーティクルガン法、マイクロインジェクション法等が挙げられる。アグロバクテリウム法を用いる場合は、プロトプラストを用いる場合、組織片を用いる場合、及び植物体そのものを用いる場合(in planta法)がある。プロトプラストを用いる場合は、TiプラスミドないしはRiプラスミドをもつアグロバクテリウム(それぞれAgrobacterium tumefaciensまたはAgrobacterium rhizogenes)と共存培養する方法、スフェロプラスト化したアグロバクテリウムと融合する方法(スフェロプラスト法)、組織片を用いる場合は、対象植物の無菌培養葉片(リーフディスク)に感染させる方法やカルス(未分化培養細胞)に感染させる等により行うことができる。また種子あるいは植物体を用いるin planta法を適用する場合、すなわち植物ホルモン添加の組織培養を介さない系では、吸水種子、幼植物(芽生え)、鉢植え植物などへのアグロバクテリウムの直接処理等にて実施可能である。これらの植物形質転換法は、「島本功、岡田清孝 監修、新版 モデル植物の実験プロトコール 遺伝学的手法からゲノム解析まで(2001)、秀潤社」などの一般的な教科書の記載に従って行うことができる。
【0059】
遺伝子が植物体に組み込まれたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ウェスタンブロッティング法等により行うことができる。例えば、形質転換植物からDNAを調製し、MGTP遺伝子特異的プライマーを設計してPCRを行う。PCRを行った後は、増幅産物についてアガロースゲル電気泳動、ポリアクリルアミドゲル電気泳動またはキャピラリー電気泳動等を行い、臭化エチジウム、SYBR Green液等により染色し、そして増幅産物を1本のバンドとして検出することにより、形質転換されたことを確認することができる。また、予め蛍光色素等により標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイクロプレート等の固相に増幅産物を結合させ、蛍光または酵素反応等により増幅産物を確認する方法でもよい。
【0060】
あるいは、種々のレポーター遺伝子、例えばベータグルクロニダーゼ(GUS)、ルシフェラーゼ(LUC)、グリーンフルオレッセントプロテイン(GFP)、クロラムフェニコールアセチルトランスフェラーゼ(CAT)、ベータガラクトシダーゼ(LacZ)等の遺伝子をMGTP遺伝子の下流域に連結したベクターを作製し、該ベクター導入したアグロバクテリムを用いて上記と同様にして植物を形質転換させ、該レポーター遺伝子の発現を測定することによっても確認できる。
【0061】
メチオニン由来グルコシノレート生合成系は、シロイヌナズナだけでなく、広くアブラナ科植物において存在が確認されている。従って、それらの植物においてMGTP遺伝子は、シロイヌナズナの場合と同様に、メチオニン由来グルコシノレート生合成中間体の輸送体として機能すると考えられる。従って、本発明において形質転換に用いられる好適な植物としては、アブラナ科植物、たとえば、シロイヌナズナ、キャベツ、アブラナ、セイヨウアブラナ、ナタネ、カリフラワー、ハボタン、ブロッコリー、ハクサイ、コマツナ、カブ、ミズナ、チンゲンサイ、コールラビ、ハゴロモカンラン(ケール)、ダイコン、ナズナ、ワサビ等が挙げられるが、これらの植物に限定されるものではない。
【0062】
本発明において、形質転換の対象とする植物材料としては、茎、葉、種子、胚、胚珠、子房、茎頂等の植物器官、葯、花粉等の植物組織やその切片、未分化のカルス、それを酵素処置して細胞壁を除いたプロプラスト等の植物培養細胞のいずれであってもよい。またin planta法適用の場合、吸水種子や植物体全体を利用できる。
【0063】
本発明において、形質転換植物とは、植物体全体、植物器官(例えば葉、花弁、茎、根、穀実、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束等)、または植物培養細胞(例えばカルス)のいずれをも意味するものである。
【0064】
植物培養細胞を対象とする場合において、得られた形質転換細胞から形質転換体を再生させるためには既知の組織培養法により器官または個体を再生させればよい。このような操作は、植物細胞から植物体への再生方法として一般的に知られている方法により、当業者であれば容易に行うことができる。植物細胞から植物体への再生については、例えば、以下のように行うことができる。
【0065】
まず、形質転換の対象とする植物材料として植物組織またはプロトプラストを用いた場合、これらを無機要素、ビタミン、炭素源、エネルギー源としての糖類、植物生長調節物質(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノステロイド等の植物ホルモン)等を加えて滅菌したカルス形成用培地中で培養し、不定形に増殖する脱分化したカルスを形成させる(以下「カルス誘導」という)。このように形成されたカルスをオーキシン等の植物生長調節物質を含む新しい培地に移しかえて更に増殖(継代培養)させる。
【0066】
カルス誘導は寒天等の固型培地で行い、継代培養は例えば液体培養で行うと、それぞれの培養を効率良くかつ大量に行うことができる。次に、上記の継代培養により増殖したカルスを適当な条件下で培養することにより器官の再分化を誘導し(以下、「再分化誘導」という)、最終的に完全な植物体を再生させる。再分化誘導は、培地におけるオーキシン等の植物生長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。かかる再分化誘導により、不定胚、不定根、不定芽、不定茎葉等が形成され、更に完全な植物体へと育成させる。あるいは、完全な植物体になる前の状態(例えばカプセル化された人工種子、乾燥胚、凍結乾燥細胞及び組織等)で貯蔵等を行ってもよい。
【0067】
本発明の形質転換植物は、MGTP遺伝子を導入した植物体(形質転換された細胞やカルスから再生された植物体を含む)の有性生殖または無性生殖により得られる子孫の植物体、及びその子孫植物体の組織や器官等の一部(種子、プロトプラストなど)も包含するものとする。
【0068】
上記のようにして得られる形質転換植物は、MGTP遺伝子が過剰発現される結果、野生型の植物よりも植物体中のメチオニン由来グルコシノレート量が増加するので、たとえば、発がん抑制効果のある植物として利用できる。
【0069】
4.変異植物及びその作出方法
本発明の変異植物は、植物中に存在するMGTP遺伝子を破壊または発現抑制することにより作出できる。MGTP遺伝子を破壊する方法としては、例えば、T-DNAの挿入、トランスポゾンの挿入、速中性子線照射、イオンビーム照射、EMSなどの化学変異剤処理などによりによりMGTP遺伝子に変異又は欠失を導入し、ノックアウト変異体を作製する方法が挙げられる。なお、例えばNottingham Arabidopsis Stock Center (http://nasc.nott.ac.uk/)より入手可能なT-DNAが挿入されたシロイヌナズナMGTP遺伝子ノックアウト変異体など、入手可能なMGTP遺伝子ノックアウト変異体を使用してもよい。
【0070】
また、MGTP遺伝子を発現抑制(転写レベル又は翻訳レベルで低下)する方法としては、例えば、アンチセンス法、RNAi (RNA interference)法、共抑制法、リボザイム法等が挙げられる。
【0071】
アンチセンス法、RNAi (RNA interference)法、共抑制法、リボザイム法は、それぞれ前項に記載した組み換えベクターを対象植物細胞に導入することにより行うことができる。対象植物へのベクターの導入は、前述したとおり、アグロバクテリウム法、ポリエチレングリコール法、エレクトロポレーション法等を用いることができ、形質転換された植物は、ベクター内に連結されたレポーター遺伝子や選抜マーカー遺伝子により容易に選抜される。
【0072】
変異植物の作出対象とする植物は、前記形質転換植物の作出対象植物と同様の植物を対象とすることができる。
【0073】
上記のようにして得られる変異植物は、MGTP遺伝子の発現が抑制される結果、野生型の植物よりも植物体中のメチオニン由来グルコシノレート量が減少するので、たとえば、硫黄化合物の発生のないバイオ燃料の採取植物として利用できる。また、当該変異植物は、野生型の植物よりもメチオニン量が増加するので、動物の必須アミノ酸であるメチオニンを含む栄養価の高い飼料作物として利用できる。
【0074】
5.グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体の選抜方法
上記MGTP遺伝子は、植物体におけるグルコシノレート含有量またはメチオニン含有量の指標遺伝子として利用できる。従って、本発明によれば、上記MGTP遺伝子の発現量を測定することを含む、グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体を選抜する方法もまた提供される。
【0075】
遺伝子の発現量は、遺伝子の転写物であるmRNAの量、該mRNAから逆転写したcDNAの量のいずれを測定してもよい。植物組織又は細胞からのRNAの抽出は、当該技術分野において通常用いられる手法、例えば、グリオキザール法、グアニジン チオシアネート-塩化セシウム法、塩化リチウム−尿素法、プロテイナーゼK-デオキシリボヌクレアーゼ法、AGPC法(アシッドグアニジウム−フェノール−クロロホルム法)などにより、粗RNA 画分を抽出調製する。RNA の抽出は、市販のキット(Total RNAExtraction Kit;Amersham製)を用い、当該キットに添付される抽出プロトコルを改良した独自のプロトコルに従って行ってもよい。次いで、この粗RNA 画分から、オリゴdT-セルロースやセファロース2Bを担体とするポリ U-セファロースなどを用いたアフィニティーカラム法、あるいはバッチ法によりポリ(A)+RNA (mRNA )を得ることができる。さらに、ショ糖密度勾配遠心法などによりmRNA をさらに分画してもよい。このようにして得られたmRNA を鋳型として、市販のキット(例えば、ZAP-cDNASynthesis Kit(STRATAGENE社製))を用い、オリゴdT20及び逆転写酵素によって一本鎖cDNAを合成した後、該一本鎖cDNAからDNA合成酵素I、DNAリガーゼ及びRnaseH等を用いて二本鎖cDNAを合成する。
【0076】
本発明において、遺伝子の発現量の測定は、公知の遺伝子発現解析方法に従って行うこができる。例えば、上記の指標遺伝子にハイブリダイズするオリゴ(ポリ)ヌクレオチドをプローブとしたハイブリダイゼーション法、又は指標遺伝子にハイブリダイズするオリゴヌクレオチドをプライマーとした遺伝子増幅法等を利用することができる。具体的には、ドットブロット法、ノーザンブロット法、RNアーゼプロテクションアッセイ法、RT-PCR法、DNAマイクロアレイ法などが挙げられる。
【0077】
上記測定に用いられるプライマー(セット)は、指標遺伝子であるMGTP遺伝子の各塩基配列に基づき設計し、合成・精製の各工程を経て調製することができる。プライマーのサイズ(塩基数)は、鋳型DNAとの間の特異的なアニーリングが可能とするために、15〜40塩基、好ましくは20〜30塩基である。プライマーの設計は、センス鎖(5'末端側)とアンチセンス鎖(3'末端側)からなる1組あるいは1対(2本)のプライマーが互いにアニールしないよう、両プライマー間の相補的配列を避けると共に、プライマー内のヘアピン構造の形成を防止するため自己相補配列をも避けるようにする。さらに、鋳型DNAとの安定な結合を確保するため、GC含量を約50%にし、プライマー内においてGC-richあるいはAT-richが偏在しないようにする。アニーリング温度はTm(melting temperature)に依存するので、特異性の高いPCR産物を得るため、Tm値が55〜65℃で互いに近似したプライマーを選定する。また、PCRにおけるプライマー使用の最終濃度が約0.1〜1μMになるよう調整する等を留意することも必要である。また、プライマー設計用の市販のソフトウェア、例えばOligoTM[National Bioscience Inc.(米国)製]、GENETYX[ソフトウェア開発(株)(日本)製]等を用いることもできる。また、プローブとしては、指標遺伝子の塩基配列の連続する部分配列からなるポリ(オリゴ)ヌクレオチド、あるいは、指標遺伝子の塩基配列に対する相補配列の連続する部分配列からなるポリ(オリゴ)ヌクレオチド断片が用いられる。プローブの長さは特に限定されないが、例えば15塩基以上、好ましくは20塩基以上であれば目的とする遺伝子の間で特異的なハイブリッドを形成できる。上記ヌクレオチド断片は、例えば、各塩基配列を有するポリヌクレオチド(cDNA)を適当な制限酵素で切断するか、あるいは、周知の化学合成技術により、in vitroにおいて合成することができる。
【0078】
上記ヌクレオチド断片をプローブとして使用する場合、標識物質により標識化する。標識物質は、特に限定はされないが、例えば、蛍光物質、放射性同位体、酵素、アビジン若しくはビオチンなどを用いることができる。蛍光物質としては、フルオレッセンスイソチオシアネート(FITC)、テトラメチルローダミンイソチオシアネート(TRIC)、シアニン色素(例えば、Cy DyeTMシリーズのCy3、Cy5等)などが挙げられ、酵素としては、ペルオキシダーゼ、β−ガラクトシダーゼ、アルカリホスファターゼなどが挙げられ、放射性同位体としては、125Iや3Hなどが挙げられる。
【0079】
また本発明スクリーニング方法の別の態様として、指標遺伝子によりコードされるタンパク質(指標タンパク質)の発現量を測定することにより行うこともできる。
【0080】
本発明において、指標タンパク質の発現量の測定は、公知のタンパク質発現解析方法に従って行うことができる。例えば、SDSポリアクリルアミド電気泳動法、2次元電気泳動法、ウェスタンブロッティング法、ドットブロッティング法、免疫沈降法、酵素免疫測定法 (ELISA; enzyme-linked immunosorbent assay)、蛍光抗体法等が挙げられる。
【実施例】
【0081】
以下、実施例によって本発明を更に具体的に説明するが、これらの実施例は本発明を限定するものでない。
〔材料及び方法〕
後記各実施例において用いた材料及び方法は以下のとおりである。
(1) 植物の育成
野生型シロイヌナズナ(コロンビア株)及び変異体(T-DNA 挿入系統)をプレハブ型チャンバー内で22℃、16時間の明周期の条件下、種子採取用は土壌(PRO-MIX BX, Premier Horticulture)で、トランスクリプトミクス及びメタボロミクス用は1%ショ糖含有寒天固化1/2MS(ムラシゲ−スクーグ)上でそれぞれ生育させた。
【0082】
(2) マイクロアレイを用いたトランスクリプトーム解析
全RNAをRNeasy Plant mini kit (Qiagen)を用いて抽出した。Hirai et al, 2007(参考文献1)に記載のとおり、ATH1 microarray (Affymetrix)を用いたハイブリダイゼーションを行い、分析した。このマイクロアレイ(Affymetrix)解析は4回行った。マイクロアレイデータはArrayExpress database (accession番号. E-MEXP-1578)に寄託した。
【0083】
(3) 共発現解析
共発現解析はPRIMe (Platform for RIKEN Metabolomics) (http://prime.psc.riken.jp/)上のCorrelated Gene Searchツールを用い、Methodにinterconnetion of setsを選択して行った。上記によりクエリ遺伝子(全640遺伝子)の中で相関性のある遺伝子ペアとして同定された遺伝子セット(278遺伝子)をCytoscape 2.5.1 (http://www.cytoscape.org/)(Cline et al, 2007(参考文献2)上での共発現ネットワークグラフの構築に用いた。機能的に関連のある遺伝子セットとして特徴づけられるモジュールはArabidopsis Keyword Search (http://kanaya.naist.jp/arabidopsis/top.jsp)を用いて評価した。
【0084】
(4) T-DNA 挿入変異体のゲノタイプ
T-DNA 挿入系統からのゲノムDNA抽出とPCR反応はAmpdirect Plus (Shimazu)を用いて行い、T-DNA 挿入部位をヌクレオチドシーケンスによって確認した。
【0085】
(5) 統計学的分析
有意差は、代謝物データにはExcel 2003 (Microsoft)またはDNA アレイデータにはGeneSpringGX7.3 (Agilent)を用いてStudent’s t-testによって決定した。
【0086】
(6) 逆転写ポリメラーゼ鎖反応(RT-PCR)解析
RT-PCRは、全RNAからSuperScript III First-Strand Synthesis System (Invitrogen)を用いて合成したcDNAについて行った(図3B)。プライマー配列は次のとおりである。
UBC9 (At4g27960)用:
5'-CCATGGGCTGACACAAATACT-3' (配列番号3)
3'-CCAAATAATATGAGCCTTGATAAAC-5' (配列番号4)
MGTP (At4g12030)用:
5'-CACTGGTTTCTTCTTCAGCAAGGCACC-3' (配列番号5)
3'-GCCGACCATAAACAACAGCAAATTCCG-5' (配列番号6)
MAM-IL1 (At4g13430)用:
5'-CTTGGTGGCCCAGCAGACACCTACG-3' (配列番号7)
3'-CACACGAAGCCATTACATTAGC-5' (配列番号8)
MAM-D1 (At5g14200)用
5'-GTATGGACTTGGAGAAGAAAAGGC-3' (配列番号9)
3'-GTGACCGTAAAACCAAGTGCTACAC-5' (配列番号10)
【0087】
(7)グルコシノレートおよび遊離アミノ酸分析
野生型およびMGTP遺伝子過剰発現株のロゼット葉を1mgあたり10μlの抽出液(メタノール:水=4:1、内部標準として0.02mMシニグリン(3-propenylGSL)を含む)を加え、ミキサーミルMM200 (Retsch GmbH, Germany)を用いて4℃で破砕した。20,000gで10分間遠心した上清400μlを蒸発乾固したのち、80μlの水に溶解し、NANOSEP MF GHP0.45μm (PALL Life Science)で濾過したものをグルコシノレート分析に供した。グルコシノレート分析は、Keurentjes et al.(Nature Genetics, 38:842-849)に従ってLC-MSを用いて行った。装置はWaters Acquity UPLCTMsystem (Waters Corporation, USA)にZQMS (Micromass)を接続したものを用いた。UPLC部でのグルコシノレートおよび遊離アミノ酸分離はACQUITY UPLC HSS T3 カラム(φ2.1mm×50mm, Waters)上で30℃、流速0.38 ml/minにて行った。グルコシノレート分析は移動相にsolvent A(0.1% ギ酸/水)とsolvent B(0.1% ギ酸/アセトニトリル)を用いてグラジエント溶出(0-0.1分:100% solvent A、2分:8% solvent B、3分:20% solvent B、5.5分:100% solvent B、6.5分:100% solvent B)を行った。遊離アミノ酸分析は移動相にsolvent A(0.1% heptafluorobutyric acid/水)とsolvent B(0.1% heptafluorobutyric acid/アセトニトリル)を用いてグラジエント溶出(0-0.1分:100% solvent A、1.5分:20% solvent B、2分:25% solvent B、2.6分:90% solvent B、2.9分:90% solvent B)を行った。質量分析部の分析条件は、ESIイオン化、キャピラリースプレー3.0kV、コーン電圧40V、ソース温度150℃、脱溶媒温度300℃、脱溶媒ガス(窒素ガス)流量600 L/hとし、グルコシノレートに特異的な[M-H]-イオンおよび遊離アミノ酸に特異的な[M+H]+のピークをQ mass spectrometerで検出した。4MSBは、質量分析による質量/電荷比を標準化合物と比較して同定した。他のグルコシノレート分子種については、溶出時間、質量/電荷比、ミロシナーゼ酵素(Sigma-Aldrich、USA)による特異的な分解から推定した。グルコシノレート含量をシニグリン当量に換算して計算した。遊離アミノ酸は、標準品で濃度あたりの検出ピークの面積から検量線を作成し、定量した。
【0088】
〔実験結果〕
(実施例1)メチオニン由来グルコシノレート(Met-GSL)生合成酵素遺伝子群を制御する遺伝子の予測
グルコシノレート生合成酵素遺伝子群と共発現し、当該酵素遺伝子群を同調的に発現制御する転写調節因子としてPMG1遺伝子(At5g61420:配列番号11)とPMG2遺伝子(At5g07690:配列番号12)が既に同定されている[Hirai et al. Proc. Natl. Acad. Sci. 104: 6478-6483 (2007)]。
【0089】
(1) PMGの相乗効果
Met-GSL生合成関連遺伝子の転写制御及び代謝をより理解するために、ダブルノックアウトPMG系統をT-DNA 挿入シングルノックアウト系統(pmg1, pmg2, pmg3)から構築した。Gigolashvili et al, 2008(参考文献3)、Hirai et al, 2007(参考文献1)、Sonderby et al, 2007(参考文献4)に記載されているように破壊遺伝子の発現は顕著に抑制された。ノックアウト系統の中で、MET-GSL含量における最も大きな変化がpmg1pmg2において葉及び種子の両方に観察され、各メチオニン-GSL(MET-GSL)類 (メチルチオ-GSL, メチルスルフィニル-GSL, ヒドロキシ-GSL、及びベンゾイロキシ-GSL)が完全にまたはほとんど完全になくなっていた(図1)。一方、インドールGSL(Indol-GSL)類 (インドール-3-イルメチル-GSL及びメトキシインドール-3-イルメチル-GSL)は大きな影響は受けなかった。
【0090】
全MET-GSL含量はシングルノックアウト系統pmg3において影響はなかったが(図1)、ダブルノックアウトpmg1pmg3の葉はpmg1系統のMET-GSL量の半分以下、野生型のそれの4分の1となった。PMG2とPMG3は、それらのシングルノックアウト系統においてPMG1よりもMET-GSL蓄積に与える影響が弱かった。しかしながら、pmg1pmg2 及び pmg1pmg3 ダブルノックアウト系統においては、PMG間の明確な相乗効果があった(図1)。
【0091】
以上の結果より、pmg1pmg2ダブルノックアウト系統はMET-GSLを有さないことからPMGの主要機能であるMET-GSL生合成の正の制御を喪失してMet-GSL生合成遺伝子群の転写が抑制されていると考えられる。そのため、pmg1pmg2ダブルノックアウト系統は発現量の抑制を指標に新規のMet-GSL生合成遺伝子を探索・同定する材料として有効であると考えられた。
【0092】
(2) pmg1pmg2 ダブルノックアウト系統におけるトランスクリプトーム
pmg1pmg2 ダブルノックアウト系統のトランスクリプトームを、DNAマイクロアレイを用いて解析した。マイクロアレイ解析は2つのサンプル(野生型、pmg1pmg2 ダブルノックアウト系統)を用いて4回繰り返し行った。
【0093】
pmg1pmg2 ダブルノックアウト系統は、公知のMET-GSL生合成遺伝子のほかに、未同定のMET-GSL生合成候補遺伝子及び公知の硫黄同化遺伝子が強く抑制された(下記表1参照)。
【0094】
【表1】

【0095】
(3) MET-GSL生合成ステップ
MET-GSL生合成の最初の段階であるメチオニン側鎖伸長(MET-ELONG)反応は、ロイシン生合成と類似した4ステップの反応で進行する(Hirai et al, 2005(参考文献5); Hirai et al, 2007(参考文献1))。メチルチオアルキルマレートシンターゼ(MAM)、メチルチオアルキルマレートイソメラーゼ(MAM-I)、メチルチオアルキルマレートデヒドロゲナーゼ(MAM-D)、及びメチオニン-アナログアミノトランスフェラーゼ(MAAT)をコードするMET-ELONG 遺伝子の中で(図2)、MAM-I及びMAM-Dが同定されていない。
【0096】
(4) PMG1遺伝子とPMG2遺伝子との共発現解析
Affymetrix社のシロイヌナズナDNAマイクロアレイATH1によるトランスクリプトームデータが登録されているAtGenExpress(http://web.uni-frankfurt.de/fb15/botanik/mcb/AFGN/atgenex.htm)のデータを利用したシロイヌナズナ共発現遺伝子探索ツールATTED-II(http://www.atted.bio.titech.ac.jp/)を用いてPMG1遺伝子とPMG2遺伝子との共発現解析を行った。その解析結果から、Met-GSL生合成遺伝子の候補遺伝子として、MAM-I 大サブユニット(At4g13430)、 MAM-I 小サブユニット(At3g58990 及び At2g43100)、MAM-D (At5g14200)を予測した。さらに、動物における胆汁酸:ナトリウム共輸送体(BASS, At4g12030)のホモログである輸送体遺伝子がMet-GSL生合成に関与することを予測し、それをメチオニン由来グルコシノレート関連輸送体(methionine-derived glucosinolate related transporter:MGTP)と命名した。
【0097】
(実施例2)候補遺伝子の機能解析
pmg1pmg2ダブルノックアウト系統において顕著に発現が抑制されているMET-ELONG遺伝子とMGTP遺伝子(表1)間の機能的関連があるかどうかを決定するために、これらの遺伝子のin vivo 機能をT-DNA 挿入シロイヌナズナ系統(図3A)で確認した。
【0098】
(1) MGTP遺伝子
シロイヌナズナMGTP遺伝子(At4g12030)の5’UTRまたはイントロンにT-DNAが挿入されたMGTPノックアウト変異体mgtp1-1, SALK_041259; mgtp1-2, SALK_126525(図3A)をArabidopsis Biological Resource Center(オハイオ州立大学)から購入した。挿入されたT-DNAがhomozygousになったラインを単離し、MGTP転写産物の減少をRT-PCRにより確認した(図3B)。この植物と、対照となる野生型シロイヌナズナ(エコタイプColumbia)を1/2MS培地に植えて、22℃、16時間明期/8時間暗期の光条件で約3週間栽培した。40〜100mgのロゼット分を6連で採取して直ちに液体窒素で凍結し、−80℃で使用まで保存した。
【0099】
MGTPノックアウト系統 (mgtp1-1, SALK_041259; mgtp1-2, SALK_126525)の葉では、MGTP遺伝子の発現が抑制され(図3B)、メチルチオ-GSL (3C-8C)、及びメチルスルフィニル-GSL (3C-8C)が野生型の半分以下の量まで減少した(図4A)。また、MGTPノックアウト系統では可溶性メチオニンの最大蓄積が約7倍となり(図4B)、その主要基質である可溶性メチオニンの蓄積はMET-GSLの蓄積と負に相関していた(図4A及び図4B)。MGTPはMET-ELONGと共制御されているので、この輸送体タンパク質は、メチオニン(2C)からヘキサホモメチオニン(8C)に至るMET-ELONG サイクルによって生産されるメチオニン−アナログの細胞内輸送に関与していると推定した(図1参照)。公開データベース(Winter et al, 2007(参考文献6))では、MGTPは葉緑体/ミトコンドリアタンパク質としてアノテートされている。膜を介したグルコシノレートの輸送に関しては、プロトン−共役輸送体によって仲介されるアブラナ科植物の葉プロトプラストへの取り込み(Grubb & Abel, 2006(参考文献7); Halkier & Gershenzon, 2006(参考文献8))など、ごく限られた報告しかない。この報告から予想される輸送機構は、MGTPが属するナトリウム依存性BASS ファミリータンパク質のそれと異なっている。従って、MGTP は原形質膜を介したGSLのプロトプラスト細胞への取り込みを担ってはいないと考えられる。
【0100】
(2) MET-ELONG遺伝子
MAM-I 大サブユニット遺伝子 (MAM-IL)または MAM-Dのノックアウトシロイヌナズナ系統の葉における長鎖 MET-GSL(7C及び8Cの側鎖を有する)のレベルは、当該ノックアウト系統におけるT-DNA-タグ化遺伝子(mam-iL1-1, SALK_029510; mam-iL1-2, SALK_065789; mam-d1-1, SALK_063423; mam-d1-2 SALK_069991)の抑制(図3B)と同時に顕著に減少した(図5A及び5B)。短鎖MET-GSL(3C)の蓄積はもっとも高い増加を示し、約5倍に達した(図5A及び5B)。MAM-ILと共制御されている、MAM-I 小サブユニット(MAM-IS)候補遺伝子(At3g58990 及び At2g43100)は、これらの遺伝子のノックアウト系統において何ら変化が観察されないことから判断して重複した機能を有するかもしれない。これらの結果は、新たに同定されたMET-ELONG遺伝子(MAM-I 及び MAM-D)は、シロイヌナズナエコタイプ及びアブラナ科植物においてMET-GSLの側鎖長の多様性を調節しているMAM遺伝子(Field et al, 2004(参考文献9); Textor et al, 2004(参考文献10); Textor et al, 2007(参考文献11))と同様に、シロイヌナズナにおいてMET-GSLの側鎖長多様性を調節していることを示唆している。
【0101】
アブラナ科植物もまたMET-ELONG 遺伝子(MAM-I 及び MAM-D)を有すること、そして、4つのステップのそれぞれにおける MET-ELONG 遺伝子の重複がMET-GSL 組成の多様性を生みだしているかもしれないことが推定された。MET-ELONG 反応は葉緑体で起こると考えられ(Grubb & Abel, 2006 (参考文献7); Halkier & Gershenzon, 2006 (参考文献8))、その後、側鎖伸長されたメチオニン−アナログはMET-GSLのコア構造合成が起こる細胞質ゾルに輸送されると推定される。
【0102】
参考文献1:Hirai MY, Sugiyama K, Sawada Y, Tohge T, Obayashi T, Suzuki A, Araki R, Sakurai N, Suzuki H, Aoki K et al (2007) Omics-based identification of Arabidopsis Myb transcription factors regulating aliphatic glucosinolate biosynthesis. Proc Natl Acad Sci USA 104(15): 6478-6483
参考文献2:Cline MS, Smoot M, Cerami E, Kuchinsky A, Landys N, Workman C, Christmas R, Avila-Campilo I, Creech M, Gross B et al (2007) Integration of biological networks and gene expression data using Cytoscape. Nat Protoc 2(10): 2366-2382
参考文献3:Gigolashvili T, Engqvist M, Yatusevich R, Muller C, Flugge UI (2008) HAG2/MYB76 and HAG3/MYB29 exert a specific and coordinated control on the regulation of aliphatic glucosinolate biosynthesis in Arabidopsis thaliana. New Phytol 177(3): 627-642
参考文献4:Sonderby IE, Hansen BG, Bjarnholt N, Ticconi C, Halkier BA, Kliebenstein DJ (2007) A Systems Biology Approach Identifies a R2R3 MYB Gene Subfamily with Distinct and Overlapping Functions in Regulation of Aliphatic Glucosinolates. PLoS ONE 2(12): e1322
参考文献5:Hirai MY, Klein M, Fujikawa Y, Yano M, Goodenowe DB, Yamazaki Y, Kanaya S, Nakamura Y, Kitayama M, Suzuki H et al (2005) Elucidation of gene-to-gene and metabolite-to-gene networks in Arabidopsis by integration of metabolomics and transcriptomics. J Biol Chem 280(27): 25590-25595
参考文献6:Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ (2007) An "electronic fluorescent pictograph" browser for exploring and analyzing large-scale biological data sets. PLoS ONE 2(1): e718
参考文献7:Grubb CD, Abel S (2006) Glucosinolate metabolism and its control. Trends in Plant Sci 11(2): 89-100
参考文献8:Halkier BA, Gershenzon J (2006) Biology and biochemistry of glucosinolates. Annu Rev Plant Biol 57: 303-333
参考文献9:Field B, Cardon G, Traka M, Botterman J, Vancanneyt G, Mithen R (2004) Glucosinolate and amino acid biosynthesis in Arabidopsis. Plant Physiol 135(2): 828-839
参考文献10:Textor S, Bartram S, Kroymann J, Falk KL, Hick A, Pickett JA, Gershenzon J (2004) Biosynthesis of methionine-derived glucosinolates in Arabidopsis thaliana: recombinant expression and characterization of methylthioalkylmalate synthase, the condensing enzyme of the chain-elongation cycle. Planta 218(6): 1026-1035
参考文献11:Textor S, de Kraker JW, Hause B, Gershenzon J, Tokuhisa JG (2007) MAM3 catalyzes the formation of all aliphatic glucosinolate chain lengths in arabidopsis. Plant Physiol 144(1): 60-71
【図面の簡単な説明】
【0103】
【図1】PMG ノックアウトシロイヌナズナ系統の葉におけるMET-GSL濃度およびIndol-GSL濃度(means ± S.D.; n = 6) を示す。
【図2】MET-GSLの3つの主要生合成ステップを示す。
【図3】図3Aは、MET-ELONG 及び MGTP T-DNA 挿入シロイヌナズナ系統を示す。MAM-IL(メチルチオアルキルマレートイソメラーゼ大サブユニット)、MAM-D(メチルアルキルマレートデヒドロゲナーゼ)、及びMGTP(メチオニン由来グルコシノレート−関連輸送体)のエキソンをグレーボックスで、5’-UTR、3’-UTR、及びイントロンを黒ラインで示す。矢印はT-DNA 挿入部位を示す。図3Bは、MET-ELONG 及び MGTP T-DNA 挿入シロイヌナズナ系統(3週齢)におけるRT-PCR(逆転写-PCR)分析結果を示す。ユビキチン(UBC9)をPCRコントロールとして用いた。MAM:メチルチオアルキルマレートシンターゼ、MAM-D:メチルチオアルキルマレートデヒドロゲナーゼ、MAM-I:メチルチオアルキルマレートイソメラーゼ、MAAT:メチオニン−アナログアミノトランスフェラーゼ、CYP:チトクロームP450、GST:グルタチオンS-トランスフェーゼ、SUR:superroot、UGT:ウリジンジホスフェート−グリコシルトランスフェラーゼ、AtSOT:スルホトランスフェラーゼ、FMO:フラビンモノオキシダーゼ、GS-OX:グルコシノレートオキシゲナーゼ、AOP:アルケニルヒドロキシプロピルグルコシノレートシンターゼ
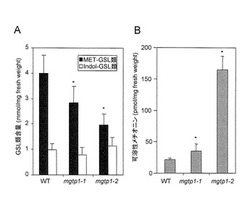
【図4】図4AはMGTPノックアウト系統の葉におけるMET-GSLおよびIndol-GSLの総レベル、図4BはMGTPノックアウト系統の葉における可溶性メチオニンを示す(means ± S.D; n = 6)。Student’s t-testを用いて野生型(WT)と統計学的有意に異なる数値をアスタリスクで示す(*:p < 0.05)。
【図5】図5AはMET-ELONG 変異体mam-iLにおけるMET-GSLの長鎖及び短鎖の濃度の違いを示す。図5BはMET-ELONG 変異体mam-dにおけるMET-GSLの長鎖及び短鎖の濃度の違いを示す。Student’s t-testを用いて野生型(WT)と統計学的有意に異なる数値をアスタリスクで示す(*:p<0.05)。
【技術分野】
【0001】
本発明は、メチオニン由来グルコシノレート及びメチオニンの蓄積量が制御された植物及びその作出方法に関する。
【背景技術】
【0002】
グルコシノレート(GSL)類はアブラナ科植物の生産する含硫二次代謝産物であり、研究用のモデル植物であるシロイヌナズナをはじめ、食用作物であるブロッコリー、キャベツ、ダイコン、ケール、カラシナ、ワサビなどに含まれる。GSL類は、植物内で分解酵素ミロシナーゼとは異なる細胞に蓄積されており、植物組織が破壊されると両者が接触してイソチオシアネート(ITC)に分解される。GSL類は、その分解産物であるイソチオシアネート(ITC)とともに、病害虫に対する忌避物質として知られる。また、ITC類はアブラナ科野菜における辛味成分や香気成分として重要であるほか、ヒトなどの動物に対して分子種によって異なる生理作用がある。
【0003】
GSL類は、その構造によってアリファティック系GSL、インドール系GSL、およびアロマティック系GSLに大別され、これらはそれぞれ、メチオニン、トリプトファン、フェニルアラニンを前駆体として生合成され、その前駆体の種類によって側鎖の化学構造が大きく異なっている(非特許文献1,2)。このうち、メチオニン由来GSL(Met-GSL)及びその分解で生じるイソチオシアネート(ITC)は、発がん抑制効果を示すことが実証され、注目を集めている(非特許文献3)。特にブロッコリースプラウトに含まれるITCであるスルフォラファンはグルコラファニン(4-methylsulfinylbutyl GSL、略称4MSB)より生じ、生体内のNrf2を活性化し、抗酸化や解毒作用によりガン、高血圧、加齢性疾患の予防に有効であることがわかっている(非特許文献4)。一方、分解産物に甲状腺腫をひきおこす作用があるグルコブラッシン(indol-3-ylmethyl GSL、略称I3M)などもアブラナ科野菜に含まれている。
【0004】
このように、野菜作物における豊富なGSL類は、農薬の使用制限のために、またヒトの健康を促進するために重要である。しかしながら、食物および飼料用のアブラナ科油糧作物の価値は、GSL類のような化学物質によって減少する場合もある。一般に、付加価値のある野菜作物の市場性はその植物化学物質(フィトケミカル)のポジティブ面とネガティブ面に密接に関連しているといえる。従って、野菜やそれを利用した食品類の付加価値を高めるためには、グルコラファニンを増やしてグルコブラッシンを減らすなどのように、グルコシノレートの分子種ごとに蓄積量を制御することが望まれる。
【0005】
一方、本発明者らはシロイヌナズナのトランスクリプトミクスおよびメタボロミクスを統合させてGSL生合成と分解に関与する遺伝子群の同定と解析を進めてきた。硫黄栄養欠乏(-S)下のシロイヌナズナのトランスクリプトームおよびメタボロームの経時変化を、それぞれDNAマイクロアレイ及びフーリエ変換イオンサイクロトロン共鳴質量分析を用いて解析し、両データをひとつの行列に統合し、多変量解析のひとつである一括学習自己組織化マッピング法によって解析して共蓄積している代謝物と共発現している遺伝子を調べたところ、グルコシノレート類(3MSP, 4MTB, 7MSH, 8MSO, I3M, 4MI3M)が共蓄積しており、またグルコシノレート生合成酵素遺伝子群(MAM-1, MAM-L, CYP79F1, CYP79F2, CYP79A2, CYP79B2, CYP79B3, CYP83A1, CYP83B1, SUR1, UGT74B1, AtSOT16, AtSOT17, AtSOT18)が共発現していた(非特許文献5)。この結果は、グルコシノレート生合成酵素遺伝子群を同調的に制御する転写調節因子が存在することを示唆した。
【0006】
これまでMet-GSL生合成の制御因子については、生合成を促進する転写因子PMG1およびPMG2(非特許文献6)、硫黄欠乏に応じて生合成を抑制する転写因子SLIM1(非特許文献7)が報告されている。また、グルコシノレートの一種(p-hydroxybenzylglucosinolate)の輸送体に関する報告例として、アブラナ科植物(Brassica napus)のプロトプラストを用いた輸送活性が測定されている(非特許文献8)。しかし、遺伝子の同定に至っておらず、輸送体を用いたグルコシノレート分子種の代謝工学的なアプローチはこれまで報告がない。
【0007】
【非特許文献1】Grubb and Abel, Trends Plant Sci. 11: 89-100 (2006)
【非特許文献2】Halkier and Gershenzon, Annu. Rev. Plant Biol. 57: 303-333 (2006)
【非特許文献3】Talalay and Fahey, J. Nutr. 131: 3027S-3033S (2001)
【非特許文献4】Keum YS et al, Cancer Res. 66: 8804-8813 (2006)
【非特許文献5】Hirai et al., J. Biol. Chem. 280:25590-25595 (2005)
【非特許文献6】Hirai et al. Proc. Natl. Acad. Sci. 104: 6478-6483 (2007)
【非特許文献7】Maruyama-Nakashita, A., et al. Plant Cell 18: 3235-3251 (2006)
【非特許文献8】Chen, S. and Halkier, B.A., J. Biol. Chem. 275:22955-22960 (2000)
【発明の開示】
【発明が解決しようとする課題】
【0008】
従って、本発明の課題は、グルコシノレート生合成酵素遺伝子群の共発現関連性に基づいて、新たなメチオニン由来グルコシノレート(Met-GSL)生合成の制御因子および生合成酵素などの関連遺伝子を見出し、当該制御因子又は当該遺伝子を利用してMet-GSL量又はメチオニン量が調節された植物を作出することにある。
【課題を解決するための手段】
【0009】
発明者らは、上記課題を解決すべき鋭意研究を重ねた結果、既に同定されているメチオニン由来グルコシノレート(Met-GSL)生合成の転写促進因子PMG1およびPMG2のダブルノックアウト系統において同調的に発現抑制されている遺伝子群の中に、Met-GSLの生成中間体の輸送体遺伝子 (Met-GSL-related transporter, MGTP)を見出した。このMGTP遺伝子のin vivo機能をT-DNA挿入シロイヌナズナ(MGTP機能喪失シロイヌナズナ)において確認したところ、Met-GSL蓄積のみが特異的に抑制されるともに、メチオニン(Met)が高蓄積することが確認された。これまで、既知のMet-GSL生合成遺伝子および転写調節因子の機能喪失株では出発物質Metの蓄積量増加が見られたものはない。本発明はかかる知見により完成されたものである。
【0010】
即ち、本発明は以下の発明を包含する。
(1) 植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が破壊または発現抑制された変異植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0011】
(2) 植物体に存在する以下の(d)〜(f)のいずれかの遺伝子が破壊または発現抑制された変異植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0012】
(3) 変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、(1)または(2)に記載の変異植物。
(4) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(1)から(3)のいずれかに記載の変異植物。
【0013】
(5) 植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0014】
(6) 植物体に存在する以下の(d)〜(f)のいずれかの遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0015】
(7) 変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、(5)または(6)に記載の変異植物の作出方法。
(8) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(5)から(7)のいずれかに記載の変異植物の作出方法。
【0016】
(9) 以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が導入された形質転換植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0017】
(10) 以下の(d)〜(f)のいずれかの遺伝子が導入された形質転換植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0018】
(11) 形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、(9)または(10)に記載の形質転換植物。
(12) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(9)から(11)のいずれかに記載の形質転換植物。
【0019】
(13) 以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を含む組み換えベクター。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若sしくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0020】
(14) 以下の(d)〜(f)のいずれかの遺伝子を含む組み換えベクター。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0021】
(15) (13)に記載の組換えベクターを植物に導入し、該植物体で以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【0022】
(16) (14)に記載の組換えベクターを植物に導入し、該植物体で以下の(d)〜(f)のいずれかの遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1または3に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0023】
(17) 形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、(15)または(16)に記載の形質転換植物の作出方法。
(18) 植物が、植物体、植物器官、植物組織、または植物培養細胞である(15)から(17)のいずれかに記載の形質転換植物の作出方法。
【0024】
(19) 以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン由来グルコシノレート含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0025】
(20) 以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【発明の効果】
【0026】
本発明によれば、シロイヌナズナに含まれる遺伝子の中に、その遺伝子発現レベルの変化により、メチオニン由来グルコシノレート(Met-GSL)の蓄積量のみならず、メチオニン(Met)の蓄積量も変化させることのできる遺伝子が初めて明らかにされた。従って、本遺伝子は他のアブラナ科植物で利用することにより、植物体内のMet-GSL量およびMet量を正逆両方に制御することが可能である。例えば、本遺伝子の欠損変異体を作出することによりMet-GSL量を減少させ、Met量を増加させることができる。Met-GSL量の減少は、毒性が軽減された飼料作物や硫黄発生のないクリーンなバイオ燃料製造のための原料として利用するのに有利であり、Met量の増加は、動物の必須アミノ酸であるメチオニンを含む栄養価の高い飼料作物として利用するのに有利であり、ヒスタミンの血中濃度を低下してアレルギーを起こしにくくする。また、本遺伝子を植物体で高発現させることによりMet-GSL量を増加させることができるので、高い病虫害抵抗性や発がん抑制効果などの付加価値を植物に付与することができる。
【発明を実施するための最良の形態】
【0027】
1.メチオニン由来グルコシノレートの生成中間体の輸送体遺伝子
本発明は、シロイヌナズナに含まれる遺伝子の中で新たに機能同定された植物のメチオニン由来グルコシノレートの生成中間体の輸送体(MET-GSL-related transporter:MGTP)遺伝子の利用に関する。本発明において機能同定したMGTPは、動物の胆汁酸輸送体(bile acid:sodium symporter, BASS)のホモログであるが、植物での機能は未解明であった。本発明は、輸送体を用いた植物における新しい代謝物量の制御方法を提供するものである。
【0028】
上記のMGTP遺伝子としては、MIPSコードが「At4g12030」であるシロイヌナズナ由来の遺伝子が挙げられる。MGTP遺伝子は、配列番号1に示す塩基配列を有し、配列番号2に示すアミノ酸配列からなるタンパク質をコードする。
【0029】
本発明に使用するMGTP遺伝子には、以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子、または(d)〜(f)のいずれかの遺伝子(以下、これらの遺伝子を総称して「MGTP遺伝子」という場合がある。)が含まれる。
【0030】
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【0031】
上記の「メチオニン由来グルコシノレートの生成中間体の輸送活性」とは、メチオニン(2C)からヘキサホモメチオニン(8C)に至るメチオニン側鎖伸長(MET-ELONG)反応サイクルによって生産されるメチオニン類縁体の細胞内輸送活性をいう。当該活性に起因して、メチオニン由来グルコシノレート生合成反応におけるGSLコア構造合成への基質供給が促進されて植物体中のメチオニン由来グルコシノレートの蓄積量が増加する。
【0032】
上記の「1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列」について、欠失、置換若しくは付加されてもよいアミノ酸の数としては、部位特異的突然変異誘発法等の公知の変異タンパク質作製法により欠失、置換、若しくは付加できる程度の数をいい、前記した活性を保持する限り、その個数は制限されないが、通常は、たとえば、1〜20個、好ましくは1〜10個、より好ましくは1〜5個をいう。また、ここにいう「変異」は、主には公知の変異タンパク質作製法により人為的に導入された変異を意味するが、天然に存在する同様の変異であってもよい。
【0033】
また、上記の「80%以上の相同性」とは、好ましくは85%以上、より好ましくは90%以上、最も好ましくは95%以上の相同性をいう。配列(アミノ酸配列、塩基配列)の同一性は、FASTA検索やBLAST検索により決定することができる。
【0034】
上記の「ストリンジェントな条件」とは、いわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件をいう。例えば、相同性が高い核酸、すなわち配列番号1に示す塩基配列と80%以上、好ましくは85%以上、より好ましくは90%以上、最も好ましく95%以上の相同性を有する核酸の相補鎖がハイブリダイズし、それより相同性が低い核酸の相補鎖がハイブリダイズしない条件が挙げられる。より具体的には、ナトリウム塩濃度が15〜750mM、好ましくは50〜750mM、より好ましくは300〜750mM、温度が25〜70℃、好ましくは50〜70℃、より好ましくは55〜65℃、ホルムアミド濃度が0〜50%、好ましくは20〜50%、より好ましくは35〜45%での条件をいう。さらに、ストリンジェントな条件では、ハイブリダイゼーション後のフィルターの洗浄条件が、通常はナトリウム塩濃度が15〜600mM、好ましくは50〜600mM、より好ましくは300〜600mM、温度が50〜70℃、好ましくは55〜70℃、より好ましくは60〜65℃である。上記のハイブリダイゼーションは、Sambrookら、Molecular Cloning,A Laboratory Manual,3rd Ed,, Cold Spring Harbor Laboratory(2001)に記載されている方法のような周知の方法で行うことができる。なお、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり、より相同性の高いポリヌクレオチドを単離できる。
【0035】
MGTP遺伝子は、それぞれ配列番号1に基づいて設計したプライマーを用いて、cDNAライブラリーまたはゲノムDNAライブラリー等由来の核酸を鋳型としたPCR増幅を行うことにより、核酸断片として得ることができる。また当該遺伝子は、上記ライブラリー等由来の核酸を鋳型とし、当該遺伝子の一部であるDNA断片をプローブとしてハイブリダイゼーションを行うことにより、核酸断片として得ることができる。あるいは当該遺伝子は、化学合成法等の当技術分野で公知の各種の核酸配列合成法によって、核酸断片として合成してもよい。
【0036】
また、当業者であれば、Molecular Cloning(Sambrook, J. et al., Molecular Cloning :a Laboratory Manual 2nd ed., Cold Spring Harbor Laboratory Press, 10 Skyline Drive Plainview, NY (1989))等を参照することにより、MGTP遺伝子のホモログ遺伝子を容易に取得することができる。
【0037】
たとえば、アミノ酸の欠失、付加、及び置換は、上記タンパク質をコードする遺伝子に、当該技術分野で公知の手法によって変異を導入することによって行うことができる。遺伝子に変異を導入するには、Kunkel法または Gapped duplex法等の公知手法またはこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-K(TAKARA社製)やMutant-G(TAKARA社製))、TAKARA社のLA PCR in vitro Mutagenesis シリーズキットを利用することができる。
【0038】
変異を導入したタンパク質がメチオニン由来グルコシノレートの生成中間体の輸送活性を持つかどうかは、配列番号2に示すアミノ酸配列を有するタンパク質の機能を失わせ、表現型を変化させた植物に、変異を導入したタンパク質をコードする遺伝子を導入し、それにより表現型が回復するかどうかを調べることにより判断できる。
【0039】
2. 組換えベクター
本発明における組換えベクターには、MGTP遺伝子を植物細胞内で発現させるためのベクターとMGTP遺伝子の植物細胞内での発現を抑制させるためのベクターが含まれ、植物体内のメチオニン由来グルコシノレート量またはメチオニン量を調節(増減)する上で、目的に応じて使用すればよい。
【0040】
植物形質転換に用いる本発明の組換えベクターは、上記1.のMGTP遺伝子(以下、「目的遺伝子」ともいう)を適当なベクターに導入することにより構築することができる。本発明の組換えベクターは、目的遺伝子を含むが、必ずしも目的遺伝子の全長を含む必要はなく、目的遺伝子の一部だけを含むものであってもよい。ここで、「目的遺伝子の一部」とは、目的遺伝子のメチオニン由来グルコシノレートの生成中間体の輸送活性を持つDNA断片をいう。
【0041】
上記ベクターとしては、例えば、アグロバクテリウムを介して植物に目的遺伝子を導入することができる、pBI系、pPZP系、pSMA系のベクターなどが好適に用いられる。特にpBI系のバイナリーベクターまたは中間ベクター系が好適に用いられ、例えば、pBI121、pBI101、pBI101.2、pBI101.3等が挙げられる。バイナリーベクターとは大腸菌(Escherichia coli)及びアグロバクテリウムにおいて複製可能なシャトルベクターで、バイナリーベクターを保持するアグロバクテリムを植物に感染させると、ベクター上にあるLB配列とRB配列より成るボーダー配列で囲まれた部分のDNAを植物核DNAに組み込むことが可能である。一方、pUC系のベクターは、植物に遺伝子を直接導入することができ、例えば、pUC18、pUC19、pUC9等が挙げられる。また、カリフラワーモザイクウイルス(CaMV)、インゲンマメモザイクウイルス(BGMV)、タバコモザイクウイルス(TMV)等の植物ウイルスベクターも用いることができる。
【0042】
バイナリーベクター系プラスミドを用いる場合、上記のバイナリーベクターの境界配列(LB,RB)間に、目的遺伝子を挿入し、この組換えベクターを大腸菌中で増幅する。次いで、増幅した組換えベクターをAgrobacterium tumefaciens GV3101、C58、LBA4404、EHA101、EHA105あるいはAgrobacterium rhizogenes LBA1334等に、エレクトロポレーション法等により導入し、該アグロバクテリウムを植物の形質導入に用いる。
【0043】
ベクターに目的遺伝子を挿入するには、まず、精製されたDNAを適当な制限酵素で切断し、適当なベクター DNAの制限酵素部位またはマルチクローニングサイトに挿入してベクターに連結する方法などが採用される。
【0044】
また、本発明の組換えベクターには、目的遺伝子の上流、内部、あるいは下流に、プロモーター、エンハンサー、ターミネーター、バイナリーベクター系を使用するための複製開始点(TiまたはRiプラスミド由来の複製開始点など)、選抜マーカー遺伝子などを含めることができる。
【0045】
「プロモーター」としては、植物細胞において機能し、植物の特定の組織内あるいは特定の発育段階において発現を導くことのできるDNAであれば、植物由来のものでなくてもよい。具体例としては、カリフラワーモザイクウイルス(CaMV)35Sプロモーター、ノパリン合成酵素遺伝子のプロモーター(Pnos)、トウモロコシ由来ユビキチンプロモーター、イネ由来のアクチンプロモーター、タバコ由来PRタンパク質プロモーター、タバコ由来のリブロースビスリン酸カルボキシラーゼ(RuBisCO)プロモーター等が挙げられる。
【0046】
エンハンサーとしては、例えば、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。
【0047】
ターミネーターとしては、プロモーターにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネーター、オクトピン合成酵素(OCS)遺伝子のターミネーター、CaMV 35S RNA遺伝子のターミネーター等が挙げられる。
【0048】
選抜マーカー遺伝子としては、例えば、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ビアラホス耐性遺伝子、クロラムフェニコール耐性遺伝子などが挙げられる。これらの選抜マーカー遺伝子を利用して例えば、アンピシリン、ネオマイシン、ハイグロマイシ、ビアラホス、クロラムフェニコール等の選抜薬剤を含む培地上で目的遺伝子が導入された組換え体を簡単に選抜できるようになる。
【0049】
また、選抜マーカー遺伝子は、上記のように目的遺伝子とともに同一のプラスミドに連結させて組換えベクターを調製してもよいが、あるいは、選抜マーカー遺伝子をプラスミドに連結して得られる組換えベクターと、目的遺伝子をプラスミドに連結して得られる組換えベクターとを別々に調製してもよい。別々に調製した場合は、各ベクターを宿主にコトランスフェクト(共導入)する。
【0050】
また本発明において、MGTP遺伝子の発現を抑制させるためのベクターは、MGTP遺伝子の発現を抑制するDNAを適当なベクターに挿入したものである。「MGTP遺伝子の発現抑制」には、MGTP遺伝子の転写物量の減少およびMGTP遺伝子がコードするタンパク質(翻訳産物)の減少が含まれる。MGTP遺伝子発現抑制用ベクターは、目的遺伝子がMGTP遺伝子の発現抑制を引き起こすDNAである以外、基本的に、プロモーター配列等のその他の要素は上記のMGTP遺伝子発現ベクターと同じである。
【0051】
上記のMGTP遺伝子の発現を抑制するDNAとして、該遺伝子から転写されるmRNAの全部又はその一部に対して相補的な配列を有するRNA(アンチセンスRNA)をコードするアンチセンスDNAを用いることできる。アンチセンスDNAの転写産物であるアンチセンスRNAは、宿主内に存在した場合に、その相補鎖であるMGTP遺伝子のmRNAと結合し、それによってMGTP遺伝子の翻訳を阻害し、発現を抑制できる。アンチセンスRNAをコードするアンチセンスDNAの塩基配列の長さは、対象となるMGTP遺伝子の発現を抑制することのできる長さであれば、必ずしもMGTP遺伝子mRNAの塩基配列の全長である必要はなく、一部であってもよい。一部とは、MGTP遺伝子mRNAの塩基配列全長の30%、好ましくは50%、より好ましくは80%、さらに好ましくは90%に該当する長さである。
【0052】
アンチセンスDNAは、ベクターにおいてアンチセンスの方向に連結する。連結は、直接でも、またはリンカーを介した連結でもよい。アンチセンスDNAは、宿主内で転写されたときに、MGTP遺伝子の転写産物であるmRNAに対してハイブリダイズするアンチセンスRNAが生成するようにベクターに連結し、該ベクターを宿主に導入する。アンチセンスRNAが生成するようにベクターに連結するには、プロモーター配列を有するDNA断片の下流にアンチセンスの方向(逆向き方向)にアンチセンスDNAを連結し、プロモーターの作動によりRNAに転写されるようにする。
【0053】
上記のMGTP遺伝子の発現を抑制するDNAとして、触媒活性を有するRNA分子であるリボザイムをコードするDNAを用いることもできる。標的のMGTP遺伝子mRNAを切断できるよう設計されたリボザイムコードするDNAは、植物細胞中で転写されるように前述の組換えベクター内のプロモーター及び転写終結配列に連結して用いればよい。
【0054】
上記のMGTP遺伝子の発現を抑制するDNAとして、共抑制によりMGTP遺伝子の発現を抑制するRNAをコードするDNA、すなわち、標的遺伝子配列と同一もしくは類似した配列を有するDNAを用いることもできる。共抑制とは、宿主に標的遺伝子と同一もしくは類似した配列を有するDNAを形質転換により導入すると、導入した外来遺伝子及び標的遺伝子の両方の発現が抑制される現象のことをいう。共抑制に用いる遺伝子は、標的遺伝子と完全に同一である必要はないが、少なくとも70%以上、好ましくは80%以上、さらに好ましくは90%以上の配列の同一性を有する。
【0055】
上記のMGTP遺伝子の発現を抑制するDNAとして、RNA干渉(RNAi)によりMGTP遺伝子の発現を抑制するRNAをコードするDNA、すなわち、標的遺伝子配列と同一もしくは類似した配列を逆位反復に配置したDNAを用いることもできる。RNA干渉とは、宿主にMGTP遺伝子と同一もしくは類似した配列を逆位反復に配置したDNAを形質転換により導入すると、導入DNAに由来する二本鎖RNAが発現し、標的遺伝子の発現が抑制される現象のことをいう。RNA干渉は、(1)標的遺伝子のmRNAと導入配列由来の二本鎖RNA(double-strand RNA、dsRNA)がRNA-induced silencing complex(RISC)と呼ばれる複合体を形成し、会合した配列をプライマーとして相補的なRNAが合成されるステップ、(2)内在性RNase によってこの複合体が断片化されるステップ、(3)20〜30塩基対に断片化した二本鎖RNAが二次的なRNA干渉のシグナルとして機能することによって再び標的遺伝子のmRNAを分解するステップによって進行すると考えられている(Curr. Biol., 7:R793, 1997; Curr. Biol., 6:810, 1996)。RNA干渉に用いるDNAの長さとしては、標的遺伝子の全長を使用してもよいが、少なくとも20塩基、好ましくは30塩基以上、より好ましくは50塩基以上であればよい。
【0056】
植物のRNA干渉(RNAi)にはRNAiを引き起こすdsRNAをヘアピン型dsRNAとして発現するベクターが好適に利用される。これは数塩基以上のリンカー(スペーサー)配列の両端にIR(inverted repeat:逆位反復)となるようにdsRNA形成部分に対応したDNA配列を配置し、植物体内で高発現するプロモーターによりヘアピン型dsRNAを転写し、細胞内でsiRNAを産生するシステムである。また、siRNA発現システムには上記のようなヘアピンタイプのほか、タンデムタイプもある。タンデムタイプでは、2つのプロモーターからセンスRNAとアンチセンスRNAが転写され、細胞内でハイブリダイズしてsiRNAを産生する。このようなRNAiベクターは、当該分野で周知の方法に従い、あるいは市販のRNAi用ベクターやシステム(例えば、psiRNA(Invitrogen)、pSUPER RNAi SystemTM(OligoEngine)等)を利用して容易に構築することができる。
【0057】
3.形質転換植物及びその作出方法
本発明の形質転換植物は、上記組換えベクターを対象植物に導入することによって作出することができる。本発明において「遺伝子の導入」とは、例えば公知の遺伝子工学的手法により、目的遺伝子を上記宿主植物の細胞内に発現可能な形で導入することを意味する。ここで導入された遺伝子は、宿主植物のゲノムDNA中に組み込まれてもよいし、外来ベクターに含有されたままで存在していてもよい。
【0058】
上記組換えベクターを植物中に導入する方法としては、既に報告され、確立されている種々の方法を適宜利用することができ、例えば、アグロバクテリウム法、PEG−リン酸カルシウム法、エレクトロポレーション法、リポソーム法、パーティクルガン法、マイクロインジェクション法等が挙げられる。アグロバクテリウム法を用いる場合は、プロトプラストを用いる場合、組織片を用いる場合、及び植物体そのものを用いる場合(in planta法)がある。プロトプラストを用いる場合は、TiプラスミドないしはRiプラスミドをもつアグロバクテリウム(それぞれAgrobacterium tumefaciensまたはAgrobacterium rhizogenes)と共存培養する方法、スフェロプラスト化したアグロバクテリウムと融合する方法(スフェロプラスト法)、組織片を用いる場合は、対象植物の無菌培養葉片(リーフディスク)に感染させる方法やカルス(未分化培養細胞)に感染させる等により行うことができる。また種子あるいは植物体を用いるin planta法を適用する場合、すなわち植物ホルモン添加の組織培養を介さない系では、吸水種子、幼植物(芽生え)、鉢植え植物などへのアグロバクテリウムの直接処理等にて実施可能である。これらの植物形質転換法は、「島本功、岡田清孝 監修、新版 モデル植物の実験プロトコール 遺伝学的手法からゲノム解析まで(2001)、秀潤社」などの一般的な教科書の記載に従って行うことができる。
【0059】
遺伝子が植物体に組み込まれたか否かの確認は、PCR法、サザンハイブリダイゼーション法、ノーザンハイブリダイゼーション法、ウェスタンブロッティング法等により行うことができる。例えば、形質転換植物からDNAを調製し、MGTP遺伝子特異的プライマーを設計してPCRを行う。PCRを行った後は、増幅産物についてアガロースゲル電気泳動、ポリアクリルアミドゲル電気泳動またはキャピラリー電気泳動等を行い、臭化エチジウム、SYBR Green液等により染色し、そして増幅産物を1本のバンドとして検出することにより、形質転換されたことを確認することができる。また、予め蛍光色素等により標識したプライマーを用いてPCRを行い、増幅産物を検出することもできる。さらに、マイクロプレート等の固相に増幅産物を結合させ、蛍光または酵素反応等により増幅産物を確認する方法でもよい。
【0060】
あるいは、種々のレポーター遺伝子、例えばベータグルクロニダーゼ(GUS)、ルシフェラーゼ(LUC)、グリーンフルオレッセントプロテイン(GFP)、クロラムフェニコールアセチルトランスフェラーゼ(CAT)、ベータガラクトシダーゼ(LacZ)等の遺伝子をMGTP遺伝子の下流域に連結したベクターを作製し、該ベクター導入したアグロバクテリムを用いて上記と同様にして植物を形質転換させ、該レポーター遺伝子の発現を測定することによっても確認できる。
【0061】
メチオニン由来グルコシノレート生合成系は、シロイヌナズナだけでなく、広くアブラナ科植物において存在が確認されている。従って、それらの植物においてMGTP遺伝子は、シロイヌナズナの場合と同様に、メチオニン由来グルコシノレート生合成中間体の輸送体として機能すると考えられる。従って、本発明において形質転換に用いられる好適な植物としては、アブラナ科植物、たとえば、シロイヌナズナ、キャベツ、アブラナ、セイヨウアブラナ、ナタネ、カリフラワー、ハボタン、ブロッコリー、ハクサイ、コマツナ、カブ、ミズナ、チンゲンサイ、コールラビ、ハゴロモカンラン(ケール)、ダイコン、ナズナ、ワサビ等が挙げられるが、これらの植物に限定されるものではない。
【0062】
本発明において、形質転換の対象とする植物材料としては、茎、葉、種子、胚、胚珠、子房、茎頂等の植物器官、葯、花粉等の植物組織やその切片、未分化のカルス、それを酵素処置して細胞壁を除いたプロプラスト等の植物培養細胞のいずれであってもよい。またin planta法適用の場合、吸水種子や植物体全体を利用できる。
【0063】
本発明において、形質転換植物とは、植物体全体、植物器官(例えば葉、花弁、茎、根、穀実、種子等)、植物組織(例えば表皮、師部、柔組織、木部、維管束等)、または植物培養細胞(例えばカルス)のいずれをも意味するものである。
【0064】
植物培養細胞を対象とする場合において、得られた形質転換細胞から形質転換体を再生させるためには既知の組織培養法により器官または個体を再生させればよい。このような操作は、植物細胞から植物体への再生方法として一般的に知られている方法により、当業者であれば容易に行うことができる。植物細胞から植物体への再生については、例えば、以下のように行うことができる。
【0065】
まず、形質転換の対象とする植物材料として植物組織またはプロトプラストを用いた場合、これらを無機要素、ビタミン、炭素源、エネルギー源としての糖類、植物生長調節物質(オーキシン、サイトカイニン、ジベレリン、アブシジン酸、エチレン、ブラシノステロイド等の植物ホルモン)等を加えて滅菌したカルス形成用培地中で培養し、不定形に増殖する脱分化したカルスを形成させる(以下「カルス誘導」という)。このように形成されたカルスをオーキシン等の植物生長調節物質を含む新しい培地に移しかえて更に増殖(継代培養)させる。
【0066】
カルス誘導は寒天等の固型培地で行い、継代培養は例えば液体培養で行うと、それぞれの培養を効率良くかつ大量に行うことができる。次に、上記の継代培養により増殖したカルスを適当な条件下で培養することにより器官の再分化を誘導し(以下、「再分化誘導」という)、最終的に完全な植物体を再生させる。再分化誘導は、培地におけるオーキシン等の植物生長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。かかる再分化誘導により、不定胚、不定根、不定芽、不定茎葉等が形成され、更に完全な植物体へと育成させる。あるいは、完全な植物体になる前の状態(例えばカプセル化された人工種子、乾燥胚、凍結乾燥細胞及び組織等)で貯蔵等を行ってもよい。
【0067】
本発明の形質転換植物は、MGTP遺伝子を導入した植物体(形質転換された細胞やカルスから再生された植物体を含む)の有性生殖または無性生殖により得られる子孫の植物体、及びその子孫植物体の組織や器官等の一部(種子、プロトプラストなど)も包含するものとする。
【0068】
上記のようにして得られる形質転換植物は、MGTP遺伝子が過剰発現される結果、野生型の植物よりも植物体中のメチオニン由来グルコシノレート量が増加するので、たとえば、発がん抑制効果のある植物として利用できる。
【0069】
4.変異植物及びその作出方法
本発明の変異植物は、植物中に存在するMGTP遺伝子を破壊または発現抑制することにより作出できる。MGTP遺伝子を破壊する方法としては、例えば、T-DNAの挿入、トランスポゾンの挿入、速中性子線照射、イオンビーム照射、EMSなどの化学変異剤処理などによりによりMGTP遺伝子に変異又は欠失を導入し、ノックアウト変異体を作製する方法が挙げられる。なお、例えばNottingham Arabidopsis Stock Center (http://nasc.nott.ac.uk/)より入手可能なT-DNAが挿入されたシロイヌナズナMGTP遺伝子ノックアウト変異体など、入手可能なMGTP遺伝子ノックアウト変異体を使用してもよい。
【0070】
また、MGTP遺伝子を発現抑制(転写レベル又は翻訳レベルで低下)する方法としては、例えば、アンチセンス法、RNAi (RNA interference)法、共抑制法、リボザイム法等が挙げられる。
【0071】
アンチセンス法、RNAi (RNA interference)法、共抑制法、リボザイム法は、それぞれ前項に記載した組み換えベクターを対象植物細胞に導入することにより行うことができる。対象植物へのベクターの導入は、前述したとおり、アグロバクテリウム法、ポリエチレングリコール法、エレクトロポレーション法等を用いることができ、形質転換された植物は、ベクター内に連結されたレポーター遺伝子や選抜マーカー遺伝子により容易に選抜される。
【0072】
変異植物の作出対象とする植物は、前記形質転換植物の作出対象植物と同様の植物を対象とすることができる。
【0073】
上記のようにして得られる変異植物は、MGTP遺伝子の発現が抑制される結果、野生型の植物よりも植物体中のメチオニン由来グルコシノレート量が減少するので、たとえば、硫黄化合物の発生のないバイオ燃料の採取植物として利用できる。また、当該変異植物は、野生型の植物よりもメチオニン量が増加するので、動物の必須アミノ酸であるメチオニンを含む栄養価の高い飼料作物として利用できる。
【0074】
5.グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体の選抜方法
上記MGTP遺伝子は、植物体におけるグルコシノレート含有量またはメチオニン含有量の指標遺伝子として利用できる。従って、本発明によれば、上記MGTP遺伝子の発現量を測定することを含む、グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体を選抜する方法もまた提供される。
【0075】
遺伝子の発現量は、遺伝子の転写物であるmRNAの量、該mRNAから逆転写したcDNAの量のいずれを測定してもよい。植物組織又は細胞からのRNAの抽出は、当該技術分野において通常用いられる手法、例えば、グリオキザール法、グアニジン チオシアネート-塩化セシウム法、塩化リチウム−尿素法、プロテイナーゼK-デオキシリボヌクレアーゼ法、AGPC法(アシッドグアニジウム−フェノール−クロロホルム法)などにより、粗RNA 画分を抽出調製する。RNA の抽出は、市販のキット(Total RNAExtraction Kit;Amersham製)を用い、当該キットに添付される抽出プロトコルを改良した独自のプロトコルに従って行ってもよい。次いで、この粗RNA 画分から、オリゴdT-セルロースやセファロース2Bを担体とするポリ U-セファロースなどを用いたアフィニティーカラム法、あるいはバッチ法によりポリ(A)+RNA (mRNA )を得ることができる。さらに、ショ糖密度勾配遠心法などによりmRNA をさらに分画してもよい。このようにして得られたmRNA を鋳型として、市販のキット(例えば、ZAP-cDNASynthesis Kit(STRATAGENE社製))を用い、オリゴdT20及び逆転写酵素によって一本鎖cDNAを合成した後、該一本鎖cDNAからDNA合成酵素I、DNAリガーゼ及びRnaseH等を用いて二本鎖cDNAを合成する。
【0076】
本発明において、遺伝子の発現量の測定は、公知の遺伝子発現解析方法に従って行うこができる。例えば、上記の指標遺伝子にハイブリダイズするオリゴ(ポリ)ヌクレオチドをプローブとしたハイブリダイゼーション法、又は指標遺伝子にハイブリダイズするオリゴヌクレオチドをプライマーとした遺伝子増幅法等を利用することができる。具体的には、ドットブロット法、ノーザンブロット法、RNアーゼプロテクションアッセイ法、RT-PCR法、DNAマイクロアレイ法などが挙げられる。
【0077】
上記測定に用いられるプライマー(セット)は、指標遺伝子であるMGTP遺伝子の各塩基配列に基づき設計し、合成・精製の各工程を経て調製することができる。プライマーのサイズ(塩基数)は、鋳型DNAとの間の特異的なアニーリングが可能とするために、15〜40塩基、好ましくは20〜30塩基である。プライマーの設計は、センス鎖(5'末端側)とアンチセンス鎖(3'末端側)からなる1組あるいは1対(2本)のプライマーが互いにアニールしないよう、両プライマー間の相補的配列を避けると共に、プライマー内のヘアピン構造の形成を防止するため自己相補配列をも避けるようにする。さらに、鋳型DNAとの安定な結合を確保するため、GC含量を約50%にし、プライマー内においてGC-richあるいはAT-richが偏在しないようにする。アニーリング温度はTm(melting temperature)に依存するので、特異性の高いPCR産物を得るため、Tm値が55〜65℃で互いに近似したプライマーを選定する。また、PCRにおけるプライマー使用の最終濃度が約0.1〜1μMになるよう調整する等を留意することも必要である。また、プライマー設計用の市販のソフトウェア、例えばOligoTM[National Bioscience Inc.(米国)製]、GENETYX[ソフトウェア開発(株)(日本)製]等を用いることもできる。また、プローブとしては、指標遺伝子の塩基配列の連続する部分配列からなるポリ(オリゴ)ヌクレオチド、あるいは、指標遺伝子の塩基配列に対する相補配列の連続する部分配列からなるポリ(オリゴ)ヌクレオチド断片が用いられる。プローブの長さは特に限定されないが、例えば15塩基以上、好ましくは20塩基以上であれば目的とする遺伝子の間で特異的なハイブリッドを形成できる。上記ヌクレオチド断片は、例えば、各塩基配列を有するポリヌクレオチド(cDNA)を適当な制限酵素で切断するか、あるいは、周知の化学合成技術により、in vitroにおいて合成することができる。
【0078】
上記ヌクレオチド断片をプローブとして使用する場合、標識物質により標識化する。標識物質は、特に限定はされないが、例えば、蛍光物質、放射性同位体、酵素、アビジン若しくはビオチンなどを用いることができる。蛍光物質としては、フルオレッセンスイソチオシアネート(FITC)、テトラメチルローダミンイソチオシアネート(TRIC)、シアニン色素(例えば、Cy DyeTMシリーズのCy3、Cy5等)などが挙げられ、酵素としては、ペルオキシダーゼ、β−ガラクトシダーゼ、アルカリホスファターゼなどが挙げられ、放射性同位体としては、125Iや3Hなどが挙げられる。
【0079】
また本発明スクリーニング方法の別の態様として、指標遺伝子によりコードされるタンパク質(指標タンパク質)の発現量を測定することにより行うこともできる。
【0080】
本発明において、指標タンパク質の発現量の測定は、公知のタンパク質発現解析方法に従って行うことができる。例えば、SDSポリアクリルアミド電気泳動法、2次元電気泳動法、ウェスタンブロッティング法、ドットブロッティング法、免疫沈降法、酵素免疫測定法 (ELISA; enzyme-linked immunosorbent assay)、蛍光抗体法等が挙げられる。
【実施例】
【0081】
以下、実施例によって本発明を更に具体的に説明するが、これらの実施例は本発明を限定するものでない。
〔材料及び方法〕
後記各実施例において用いた材料及び方法は以下のとおりである。
(1) 植物の育成
野生型シロイヌナズナ(コロンビア株)及び変異体(T-DNA 挿入系統)をプレハブ型チャンバー内で22℃、16時間の明周期の条件下、種子採取用は土壌(PRO-MIX BX, Premier Horticulture)で、トランスクリプトミクス及びメタボロミクス用は1%ショ糖含有寒天固化1/2MS(ムラシゲ−スクーグ)上でそれぞれ生育させた。
【0082】
(2) マイクロアレイを用いたトランスクリプトーム解析
全RNAをRNeasy Plant mini kit (Qiagen)を用いて抽出した。Hirai et al, 2007(参考文献1)に記載のとおり、ATH1 microarray (Affymetrix)を用いたハイブリダイゼーションを行い、分析した。このマイクロアレイ(Affymetrix)解析は4回行った。マイクロアレイデータはArrayExpress database (accession番号. E-MEXP-1578)に寄託した。
【0083】
(3) 共発現解析
共発現解析はPRIMe (Platform for RIKEN Metabolomics) (http://prime.psc.riken.jp/)上のCorrelated Gene Searchツールを用い、Methodにinterconnetion of setsを選択して行った。上記によりクエリ遺伝子(全640遺伝子)の中で相関性のある遺伝子ペアとして同定された遺伝子セット(278遺伝子)をCytoscape 2.5.1 (http://www.cytoscape.org/)(Cline et al, 2007(参考文献2)上での共発現ネットワークグラフの構築に用いた。機能的に関連のある遺伝子セットとして特徴づけられるモジュールはArabidopsis Keyword Search (http://kanaya.naist.jp/arabidopsis/top.jsp)を用いて評価した。
【0084】
(4) T-DNA 挿入変異体のゲノタイプ
T-DNA 挿入系統からのゲノムDNA抽出とPCR反応はAmpdirect Plus (Shimazu)を用いて行い、T-DNA 挿入部位をヌクレオチドシーケンスによって確認した。
【0085】
(5) 統計学的分析
有意差は、代謝物データにはExcel 2003 (Microsoft)またはDNA アレイデータにはGeneSpringGX7.3 (Agilent)を用いてStudent’s t-testによって決定した。
【0086】
(6) 逆転写ポリメラーゼ鎖反応(RT-PCR)解析
RT-PCRは、全RNAからSuperScript III First-Strand Synthesis System (Invitrogen)を用いて合成したcDNAについて行った(図3B)。プライマー配列は次のとおりである。
UBC9 (At4g27960)用:
5'-CCATGGGCTGACACAAATACT-3' (配列番号3)
3'-CCAAATAATATGAGCCTTGATAAAC-5' (配列番号4)
MGTP (At4g12030)用:
5'-CACTGGTTTCTTCTTCAGCAAGGCACC-3' (配列番号5)
3'-GCCGACCATAAACAACAGCAAATTCCG-5' (配列番号6)
MAM-IL1 (At4g13430)用:
5'-CTTGGTGGCCCAGCAGACACCTACG-3' (配列番号7)
3'-CACACGAAGCCATTACATTAGC-5' (配列番号8)
MAM-D1 (At5g14200)用
5'-GTATGGACTTGGAGAAGAAAAGGC-3' (配列番号9)
3'-GTGACCGTAAAACCAAGTGCTACAC-5' (配列番号10)
【0087】
(7)グルコシノレートおよび遊離アミノ酸分析
野生型およびMGTP遺伝子過剰発現株のロゼット葉を1mgあたり10μlの抽出液(メタノール:水=4:1、内部標準として0.02mMシニグリン(3-propenylGSL)を含む)を加え、ミキサーミルMM200 (Retsch GmbH, Germany)を用いて4℃で破砕した。20,000gで10分間遠心した上清400μlを蒸発乾固したのち、80μlの水に溶解し、NANOSEP MF GHP0.45μm (PALL Life Science)で濾過したものをグルコシノレート分析に供した。グルコシノレート分析は、Keurentjes et al.(Nature Genetics, 38:842-849)に従ってLC-MSを用いて行った。装置はWaters Acquity UPLCTMsystem (Waters Corporation, USA)にZQMS (Micromass)を接続したものを用いた。UPLC部でのグルコシノレートおよび遊離アミノ酸分離はACQUITY UPLC HSS T3 カラム(φ2.1mm×50mm, Waters)上で30℃、流速0.38 ml/minにて行った。グルコシノレート分析は移動相にsolvent A(0.1% ギ酸/水)とsolvent B(0.1% ギ酸/アセトニトリル)を用いてグラジエント溶出(0-0.1分:100% solvent A、2分:8% solvent B、3分:20% solvent B、5.5分:100% solvent B、6.5分:100% solvent B)を行った。遊離アミノ酸分析は移動相にsolvent A(0.1% heptafluorobutyric acid/水)とsolvent B(0.1% heptafluorobutyric acid/アセトニトリル)を用いてグラジエント溶出(0-0.1分:100% solvent A、1.5分:20% solvent B、2分:25% solvent B、2.6分:90% solvent B、2.9分:90% solvent B)を行った。質量分析部の分析条件は、ESIイオン化、キャピラリースプレー3.0kV、コーン電圧40V、ソース温度150℃、脱溶媒温度300℃、脱溶媒ガス(窒素ガス)流量600 L/hとし、グルコシノレートに特異的な[M-H]-イオンおよび遊離アミノ酸に特異的な[M+H]+のピークをQ mass spectrometerで検出した。4MSBは、質量分析による質量/電荷比を標準化合物と比較して同定した。他のグルコシノレート分子種については、溶出時間、質量/電荷比、ミロシナーゼ酵素(Sigma-Aldrich、USA)による特異的な分解から推定した。グルコシノレート含量をシニグリン当量に換算して計算した。遊離アミノ酸は、標準品で濃度あたりの検出ピークの面積から検量線を作成し、定量した。
【0088】
〔実験結果〕
(実施例1)メチオニン由来グルコシノレート(Met-GSL)生合成酵素遺伝子群を制御する遺伝子の予測
グルコシノレート生合成酵素遺伝子群と共発現し、当該酵素遺伝子群を同調的に発現制御する転写調節因子としてPMG1遺伝子(At5g61420:配列番号11)とPMG2遺伝子(At5g07690:配列番号12)が既に同定されている[Hirai et al. Proc. Natl. Acad. Sci. 104: 6478-6483 (2007)]。
【0089】
(1) PMGの相乗効果
Met-GSL生合成関連遺伝子の転写制御及び代謝をより理解するために、ダブルノックアウトPMG系統をT-DNA 挿入シングルノックアウト系統(pmg1, pmg2, pmg3)から構築した。Gigolashvili et al, 2008(参考文献3)、Hirai et al, 2007(参考文献1)、Sonderby et al, 2007(参考文献4)に記載されているように破壊遺伝子の発現は顕著に抑制された。ノックアウト系統の中で、MET-GSL含量における最も大きな変化がpmg1pmg2において葉及び種子の両方に観察され、各メチオニン-GSL(MET-GSL)類 (メチルチオ-GSL, メチルスルフィニル-GSL, ヒドロキシ-GSL、及びベンゾイロキシ-GSL)が完全にまたはほとんど完全になくなっていた(図1)。一方、インドールGSL(Indol-GSL)類 (インドール-3-イルメチル-GSL及びメトキシインドール-3-イルメチル-GSL)は大きな影響は受けなかった。
【0090】
全MET-GSL含量はシングルノックアウト系統pmg3において影響はなかったが(図1)、ダブルノックアウトpmg1pmg3の葉はpmg1系統のMET-GSL量の半分以下、野生型のそれの4分の1となった。PMG2とPMG3は、それらのシングルノックアウト系統においてPMG1よりもMET-GSL蓄積に与える影響が弱かった。しかしながら、pmg1pmg2 及び pmg1pmg3 ダブルノックアウト系統においては、PMG間の明確な相乗効果があった(図1)。
【0091】
以上の結果より、pmg1pmg2ダブルノックアウト系統はMET-GSLを有さないことからPMGの主要機能であるMET-GSL生合成の正の制御を喪失してMet-GSL生合成遺伝子群の転写が抑制されていると考えられる。そのため、pmg1pmg2ダブルノックアウト系統は発現量の抑制を指標に新規のMet-GSL生合成遺伝子を探索・同定する材料として有効であると考えられた。
【0092】
(2) pmg1pmg2 ダブルノックアウト系統におけるトランスクリプトーム
pmg1pmg2 ダブルノックアウト系統のトランスクリプトームを、DNAマイクロアレイを用いて解析した。マイクロアレイ解析は2つのサンプル(野生型、pmg1pmg2 ダブルノックアウト系統)を用いて4回繰り返し行った。
【0093】
pmg1pmg2 ダブルノックアウト系統は、公知のMET-GSL生合成遺伝子のほかに、未同定のMET-GSL生合成候補遺伝子及び公知の硫黄同化遺伝子が強く抑制された(下記表1参照)。
【0094】
【表1】

【0095】
(3) MET-GSL生合成ステップ
MET-GSL生合成の最初の段階であるメチオニン側鎖伸長(MET-ELONG)反応は、ロイシン生合成と類似した4ステップの反応で進行する(Hirai et al, 2005(参考文献5); Hirai et al, 2007(参考文献1))。メチルチオアルキルマレートシンターゼ(MAM)、メチルチオアルキルマレートイソメラーゼ(MAM-I)、メチルチオアルキルマレートデヒドロゲナーゼ(MAM-D)、及びメチオニン-アナログアミノトランスフェラーゼ(MAAT)をコードするMET-ELONG 遺伝子の中で(図2)、MAM-I及びMAM-Dが同定されていない。
【0096】
(4) PMG1遺伝子とPMG2遺伝子との共発現解析
Affymetrix社のシロイヌナズナDNAマイクロアレイATH1によるトランスクリプトームデータが登録されているAtGenExpress(http://web.uni-frankfurt.de/fb15/botanik/mcb/AFGN/atgenex.htm)のデータを利用したシロイヌナズナ共発現遺伝子探索ツールATTED-II(http://www.atted.bio.titech.ac.jp/)を用いてPMG1遺伝子とPMG2遺伝子との共発現解析を行った。その解析結果から、Met-GSL生合成遺伝子の候補遺伝子として、MAM-I 大サブユニット(At4g13430)、 MAM-I 小サブユニット(At3g58990 及び At2g43100)、MAM-D (At5g14200)を予測した。さらに、動物における胆汁酸:ナトリウム共輸送体(BASS, At4g12030)のホモログである輸送体遺伝子がMet-GSL生合成に関与することを予測し、それをメチオニン由来グルコシノレート関連輸送体(methionine-derived glucosinolate related transporter:MGTP)と命名した。
【0097】
(実施例2)候補遺伝子の機能解析
pmg1pmg2ダブルノックアウト系統において顕著に発現が抑制されているMET-ELONG遺伝子とMGTP遺伝子(表1)間の機能的関連があるかどうかを決定するために、これらの遺伝子のin vivo 機能をT-DNA 挿入シロイヌナズナ系統(図3A)で確認した。
【0098】
(1) MGTP遺伝子
シロイヌナズナMGTP遺伝子(At4g12030)の5’UTRまたはイントロンにT-DNAが挿入されたMGTPノックアウト変異体mgtp1-1, SALK_041259; mgtp1-2, SALK_126525(図3A)をArabidopsis Biological Resource Center(オハイオ州立大学)から購入した。挿入されたT-DNAがhomozygousになったラインを単離し、MGTP転写産物の減少をRT-PCRにより確認した(図3B)。この植物と、対照となる野生型シロイヌナズナ(エコタイプColumbia)を1/2MS培地に植えて、22℃、16時間明期/8時間暗期の光条件で約3週間栽培した。40〜100mgのロゼット分を6連で採取して直ちに液体窒素で凍結し、−80℃で使用まで保存した。
【0099】
MGTPノックアウト系統 (mgtp1-1, SALK_041259; mgtp1-2, SALK_126525)の葉では、MGTP遺伝子の発現が抑制され(図3B)、メチルチオ-GSL (3C-8C)、及びメチルスルフィニル-GSL (3C-8C)が野生型の半分以下の量まで減少した(図4A)。また、MGTPノックアウト系統では可溶性メチオニンの最大蓄積が約7倍となり(図4B)、その主要基質である可溶性メチオニンの蓄積はMET-GSLの蓄積と負に相関していた(図4A及び図4B)。MGTPはMET-ELONGと共制御されているので、この輸送体タンパク質は、メチオニン(2C)からヘキサホモメチオニン(8C)に至るMET-ELONG サイクルによって生産されるメチオニン−アナログの細胞内輸送に関与していると推定した(図1参照)。公開データベース(Winter et al, 2007(参考文献6))では、MGTPは葉緑体/ミトコンドリアタンパク質としてアノテートされている。膜を介したグルコシノレートの輸送に関しては、プロトン−共役輸送体によって仲介されるアブラナ科植物の葉プロトプラストへの取り込み(Grubb & Abel, 2006(参考文献7); Halkier & Gershenzon, 2006(参考文献8))など、ごく限られた報告しかない。この報告から予想される輸送機構は、MGTPが属するナトリウム依存性BASS ファミリータンパク質のそれと異なっている。従って、MGTP は原形質膜を介したGSLのプロトプラスト細胞への取り込みを担ってはいないと考えられる。
【0100】
(2) MET-ELONG遺伝子
MAM-I 大サブユニット遺伝子 (MAM-IL)または MAM-Dのノックアウトシロイヌナズナ系統の葉における長鎖 MET-GSL(7C及び8Cの側鎖を有する)のレベルは、当該ノックアウト系統におけるT-DNA-タグ化遺伝子(mam-iL1-1, SALK_029510; mam-iL1-2, SALK_065789; mam-d1-1, SALK_063423; mam-d1-2 SALK_069991)の抑制(図3B)と同時に顕著に減少した(図5A及び5B)。短鎖MET-GSL(3C)の蓄積はもっとも高い増加を示し、約5倍に達した(図5A及び5B)。MAM-ILと共制御されている、MAM-I 小サブユニット(MAM-IS)候補遺伝子(At3g58990 及び At2g43100)は、これらの遺伝子のノックアウト系統において何ら変化が観察されないことから判断して重複した機能を有するかもしれない。これらの結果は、新たに同定されたMET-ELONG遺伝子(MAM-I 及び MAM-D)は、シロイヌナズナエコタイプ及びアブラナ科植物においてMET-GSLの側鎖長の多様性を調節しているMAM遺伝子(Field et al, 2004(参考文献9); Textor et al, 2004(参考文献10); Textor et al, 2007(参考文献11))と同様に、シロイヌナズナにおいてMET-GSLの側鎖長多様性を調節していることを示唆している。
【0101】
アブラナ科植物もまたMET-ELONG 遺伝子(MAM-I 及び MAM-D)を有すること、そして、4つのステップのそれぞれにおける MET-ELONG 遺伝子の重複がMET-GSL 組成の多様性を生みだしているかもしれないことが推定された。MET-ELONG 反応は葉緑体で起こると考えられ(Grubb & Abel, 2006 (参考文献7); Halkier & Gershenzon, 2006 (参考文献8))、その後、側鎖伸長されたメチオニン−アナログはMET-GSLのコア構造合成が起こる細胞質ゾルに輸送されると推定される。
【0102】
参考文献1:Hirai MY, Sugiyama K, Sawada Y, Tohge T, Obayashi T, Suzuki A, Araki R, Sakurai N, Suzuki H, Aoki K et al (2007) Omics-based identification of Arabidopsis Myb transcription factors regulating aliphatic glucosinolate biosynthesis. Proc Natl Acad Sci USA 104(15): 6478-6483
参考文献2:Cline MS, Smoot M, Cerami E, Kuchinsky A, Landys N, Workman C, Christmas R, Avila-Campilo I, Creech M, Gross B et al (2007) Integration of biological networks and gene expression data using Cytoscape. Nat Protoc 2(10): 2366-2382
参考文献3:Gigolashvili T, Engqvist M, Yatusevich R, Muller C, Flugge UI (2008) HAG2/MYB76 and HAG3/MYB29 exert a specific and coordinated control on the regulation of aliphatic glucosinolate biosynthesis in Arabidopsis thaliana. New Phytol 177(3): 627-642
参考文献4:Sonderby IE, Hansen BG, Bjarnholt N, Ticconi C, Halkier BA, Kliebenstein DJ (2007) A Systems Biology Approach Identifies a R2R3 MYB Gene Subfamily with Distinct and Overlapping Functions in Regulation of Aliphatic Glucosinolates. PLoS ONE 2(12): e1322
参考文献5:Hirai MY, Klein M, Fujikawa Y, Yano M, Goodenowe DB, Yamazaki Y, Kanaya S, Nakamura Y, Kitayama M, Suzuki H et al (2005) Elucidation of gene-to-gene and metabolite-to-gene networks in Arabidopsis by integration of metabolomics and transcriptomics. J Biol Chem 280(27): 25590-25595
参考文献6:Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ (2007) An "electronic fluorescent pictograph" browser for exploring and analyzing large-scale biological data sets. PLoS ONE 2(1): e718
参考文献7:Grubb CD, Abel S (2006) Glucosinolate metabolism and its control. Trends in Plant Sci 11(2): 89-100
参考文献8:Halkier BA, Gershenzon J (2006) Biology and biochemistry of glucosinolates. Annu Rev Plant Biol 57: 303-333
参考文献9:Field B, Cardon G, Traka M, Botterman J, Vancanneyt G, Mithen R (2004) Glucosinolate and amino acid biosynthesis in Arabidopsis. Plant Physiol 135(2): 828-839
参考文献10:Textor S, Bartram S, Kroymann J, Falk KL, Hick A, Pickett JA, Gershenzon J (2004) Biosynthesis of methionine-derived glucosinolates in Arabidopsis thaliana: recombinant expression and characterization of methylthioalkylmalate synthase, the condensing enzyme of the chain-elongation cycle. Planta 218(6): 1026-1035
参考文献11:Textor S, de Kraker JW, Hause B, Gershenzon J, Tokuhisa JG (2007) MAM3 catalyzes the formation of all aliphatic glucosinolate chain lengths in arabidopsis. Plant Physiol 144(1): 60-71
【図面の簡単な説明】
【0103】
【図1】PMG ノックアウトシロイヌナズナ系統の葉におけるMET-GSL濃度およびIndol-GSL濃度(means ± S.D.; n = 6) を示す。
【図2】MET-GSLの3つの主要生合成ステップを示す。
【図3】図3Aは、MET-ELONG 及び MGTP T-DNA 挿入シロイヌナズナ系統を示す。MAM-IL(メチルチオアルキルマレートイソメラーゼ大サブユニット)、MAM-D(メチルアルキルマレートデヒドロゲナーゼ)、及びMGTP(メチオニン由来グルコシノレート−関連輸送体)のエキソンをグレーボックスで、5’-UTR、3’-UTR、及びイントロンを黒ラインで示す。矢印はT-DNA 挿入部位を示す。図3Bは、MET-ELONG 及び MGTP T-DNA 挿入シロイヌナズナ系統(3週齢)におけるRT-PCR(逆転写-PCR)分析結果を示す。ユビキチン(UBC9)をPCRコントロールとして用いた。MAM:メチルチオアルキルマレートシンターゼ、MAM-D:メチルチオアルキルマレートデヒドロゲナーゼ、MAM-I:メチルチオアルキルマレートイソメラーゼ、MAAT:メチオニン−アナログアミノトランスフェラーゼ、CYP:チトクロームP450、GST:グルタチオンS-トランスフェーゼ、SUR:superroot、UGT:ウリジンジホスフェート−グリコシルトランスフェラーゼ、AtSOT:スルホトランスフェラーゼ、FMO:フラビンモノオキシダーゼ、GS-OX:グルコシノレートオキシゲナーゼ、AOP:アルケニルヒドロキシプロピルグルコシノレートシンターゼ
【図4】図4AはMGTPノックアウト系統の葉におけるMET-GSLおよびIndol-GSLの総レベル、図4BはMGTPノックアウト系統の葉における可溶性メチオニンを示す(means ± S.D; n = 6)。Student’s t-testを用いて野生型(WT)と統計学的有意に異なる数値をアスタリスクで示す(*:p < 0.05)。
【図5】図5AはMET-ELONG 変異体mam-iLにおけるMET-GSLの長鎖及び短鎖の濃度の違いを示す。図5BはMET-ELONG 変異体mam-dにおけるMET-GSLの長鎖及び短鎖の濃度の違いを示す。Student’s t-testを用いて野生型(WT)と統計学的有意に異なる数値をアスタリスクで示す(*:p<0.05)。
【特許請求の範囲】
【請求項1】
植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が破壊または発現抑制された変異植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項2】
植物体に存在する以下の(d)〜(f)のいずれかの遺伝子が破壊または発現抑制された変異植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項3】
変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、請求項1または2に記載の変異植物。
【請求項4】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項1から3のいずれかに記載の変異植物。
【請求項5】
植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項6】
植物体に存在する以下の(d)〜(f)のいずれかの遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項7】
変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、請求項5または6に記載の変異植物の作出方法。
【請求項8】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項5から7のいずれかに記載の変異植物の作出方法。
【請求項9】
以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が導入された形質転換植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項10】
以下の(d)〜(f)のいずれかの遺伝子が導入された形質転換植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項11】
形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、請求項9または10に記載の形質転換植物。
【請求項12】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項9から11のいずれかに記載の形質転換植物。
【請求項13】
以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を含む組み換えベクター。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項14】
以下の(d)〜(f)のいずれかの遺伝子を含む組み換えベクター。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項15】
請求項13に記載の組換えベクターを植物に導入し、該植物体で以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項16】
請求項14に記載の組換えベクターを植物に導入し、該植物体で以下の(d)〜(f)のいずれかの遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1または3に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項17】
形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、請求項15または16に記載の形質転換植物の作出方法。
【請求項18】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項15から17のいずれかに記載の形質転換植物の作出方法。
【請求項19】
以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン由来グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項1】
植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が破壊または発現抑制された変異植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項2】
植物体に存在する以下の(d)〜(f)のいずれかの遺伝子が破壊または発現抑制された変異植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項3】
変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、請求項1または2に記載の変異植物。
【請求項4】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項1から3のいずれかに記載の変異植物。
【請求項5】
植物体に存在する以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項6】
植物体に存在する以下の(d)〜(f)のいずれかの遺伝子を破壊または発現抑制させることを特徴とする、変異植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項7】
変異植物がメチオニン由来グルコシノレート蓄積量が減少し、メチオニン蓄積量が増加した植物である、請求項5または6に記載の変異植物の作出方法。
【請求項8】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項5から7のいずれかに記載の変異植物の作出方法。
【請求項9】
以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子が導入された形質転換植物。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項10】
以下の(d)〜(f)のいずれかの遺伝子が導入された形質転換植物。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項11】
形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、請求項9または10に記載の形質転換植物。
【請求項12】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項9から11のいずれかに記載の形質転換植物。
【請求項13】
以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を含む組み換えベクター。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項14】
以下の(d)〜(f)のいずれかの遺伝子を含む組み換えベクター。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項15】
請求項13に記載の組換えベクターを植物に導入し、該植物体で以下の(a)〜(c)のいずれかのタンパク質をコードする遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
【請求項16】
請求項14に記載の組換えベクターを植物に導入し、該植物体で以下の(d)〜(f)のいずれかの遺伝子を過剰発現させることを特徴とする、形質転換植物の作出方法。
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1または3に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【請求項17】
形質転換植物がメチオニン由来グルコシノレート蓄積量が増加した植物である、請求項15または16に記載の形質転換植物の作出方法。
【請求項18】
植物が、植物体、植物器官、植物組織、または植物培養細胞である請求項15から17のいずれかに記載の形質転換植物の作出方法。
【請求項19】
以下の(a)〜(c)のいずれかのタンパク質、または以下の(d)〜(f)のいずれかの遺伝子の発現量を測定することを含む、メチオニン由来グルコシノレート含有量またはメチオニン含有量が増加または減少した植物体を選抜する方法。
(a) 配列番号2に示すアミノ酸配列からなるタンパク質
(b) 配列番号2に示すアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(c) 配列番号2に示すアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質
(d) 配列番号1に示す塩基配列からなるDNAを含む遺伝子
(e) 配列番号1に示す塩基配列からなるDNAと相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
(f) 配列番号1に示す塩基配列に対して80%以上の相同性を有する塩基配列からなり、かつメチオニン由来グルコシノレートの生成中間体の輸送活性を有するタンパク質をコードするDNAを含む遺伝子
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−22210(P2010−22210A)
【公開日】平成22年2月4日(2010.2.4)
【国際特許分類】
【出願番号】特願2008−183655(P2008−183655)
【出願日】平成20年7月15日(2008.7.15)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【Fターム(参考)】
【公開日】平成22年2月4日(2010.2.4)
【国際特許分類】
【出願日】平成20年7月15日(2008.7.15)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【Fターム(参考)】
[ Back to top ]

