メチル化DNAを検出する手段、及び方法
【課題】本発明は、CpGメチル化を分析するための検出方法を提供することに関している。
【解決手段】メチル−CpG結合タンパク質(MBD)のファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する核酸分子を提供することによる。さらに、上記核酸分子、及び当該核酸分子によりコードされるポリペプチドを含むベクター、及び宿主細胞、並びに当該ポリペプチド製造するための方法を開示する。
【解決手段】メチル−CpG結合タンパク質(MBD)のファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する核酸分子を提供することによる。さらに、上記核酸分子、及び当該核酸分子によりコードされるポリペプチドを含むベクター、及び宿主細胞、並びに当該ポリペプチド製造するための方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、メチル−CpG結合タンパク質(MBD)のファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する核酸分子に関する。さらに、上記核酸分子、及び当該核酸分子によりコードされるポリペプチドを含むベクター、及び宿主細胞、並びに当該ポリペプチド製造するための方法を開示する。さらに、本出願は、上記ポリペプチド及び組成物、特に上記核酸分子、ベクター、宿主細胞、ポリペプチド又は抗体を含む診断用組成物を特異的に結合する抗体を提供する。さらに、特に腫瘍組織又は腫瘍細胞において、メチル化DNAを検出するための本発明のポリペプチドを使用する方法、及び使用を提供する。
【背景技術】
【0002】
全生体の細胞を形成するための情報は、それらのDNA中に含まれる。DNAは、G、A、T、及びCとして省略された4塩基からなり、はしごの「横木」の各々を形成するこれらの文字と対を有する非常に長い当該はしごのように形成される。当該文字Gは、Cと対になり、AはTと対になる。これらの対の文字列は、遺伝子と呼ばれる領域に分類された特定の細胞を形成するための情報と共に、コードされたメッセージのような情報を保存する。2倍体動物の全細胞は、全遺伝子の2つのコピーを含む。一方は、母親由来のものであり、もう一方は父親由来のものである(このルールの唯一の例外は、生物が「雄」か「雌」のいずれかとして発達することを決定する染色体上の遺伝子である。)。
【0003】
DNAのメチル化、及び遺伝子調節
私たちのゲノムを「つづる」4つの塩基−アデニン、グアニン、シトシン、及びチミンは別として、複製後のDNAの一時的変異により産生される5番目の塩基もある。DNAメチルトランスフェラーゼ(DNMT)は、メチル供与体S−アデノシルメチオニンからシトシン環へのメチル基の移転を触媒し得る、そしてその結果、5−メチルシトシン塩基を形成する。特定のシトシン残基が哺乳類において修飾され、それは、DNA配列のグアノシン残基の前にある(CpGジヌクレオチド)(Singal,Blood93(1999),4059-4070);Robertson,Nat.Rev.Genet.1(2000),11−19;Ng,Curr.Opin.Genet.Dev.(2000),158−163;Razin,EMBO J.17(1998),4905−4908)。当該CpGジヌクレオチドのメチル化は、一般的に、安定した転写抑制と関連し、おそらく、非コードゲノムの大部分、及びトランスポゾン、繰り返し体、ウイルス性挿入部分の如き潜在的に有害な配列は転写されないといった事実を導く。CpGジヌクレオチドが、ゲノム中において、非常に遍在していることは興味深い(Singal(1999),loc.cit,Robertson(2000),loc.cit.,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。
【0004】
ゲノムの大部分は、統計的に予期されるよりも非常に少ないCpGを含む。このことは、おそらく、5−メチルシトシンは比較的容易にアミノ基を取り去りチミジンとなり、進化の過程で、当該CpGジヌクレオチドの数の低減を導くという事実に起因する。しかしながら、ゲノム中に区分される何度も繰り返される多くのCpG、いわゆるCpGアイランドがある。これらの領域は、しばしば、転写開始点、及び遺伝子プロモーターを含み、そして一般的に、CpGアイランドに関連しないCpGとは対照的にメチル化されない。正常細胞において、当該CpGアイランドのメチル化は、雌性細胞中のX染色体、及び親の刷り込みゲノムの第2転写の不活性化の如き例外的ケースの場合のみ観察される(Singal(1999),loc.cit.,Robertson(2000),loc.cit.,Ng(2000),loc.cit,Razin(1998),loc.cit)。
【0005】
DNAメチル化の調節
DNAメチル化パターンが胚形成の過程中でどのように確立されるのか、及びCpGメチル化がどのようにゲノム中に維持され、調節されるのかは、一部しかわかっていない(Singal(1999),loc.cit,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。哺乳類において、DNAメチル化過程を触媒する既知の3つのDNAメチルトランスフェラーゼ(DNMT1、3a、及び3b)がある。各DNMTがCpGメチル化の維持、及び調節に寄与する対応分担は、明らかとされなければならないが、いまだ明らかではない。しかし、全3つの酵素は、明らかに胚形に必要不可欠であり、対応するノックアウトマウスは、生まれる前に、又は生後間もなく死に至る(Bestor,Hum.MoI.Genet.9(2000),2395−2402;El Osta,Bioessays 25(2003),1071−1084)。その間、DNAメチル化、クロマチン構造の一時的変異と、特定のヒストン一時的変異との関連は、数回見られる。DNAのメチル化は、ヒストン脱アセチル化、及びヒストンH3でのリジン9残基のメチル化と大部分関係がある(Sims,Trends Genet.19(2003),629−639,Fahrner,Cancer Res.62(2002),7213−7218)。従って、DNMTは、ヒストンアセチラーゼ(HDAC)又はコリプレッサー複合体と関連する。メチル基がどのようにCpG残基から除かれるのかもほとんどわかっていない。増殖細胞において、DNAメチル化は、おそらく複製の間にも受動的に生じ得るだろう。しかしながら、活性のある未知のデメチラーゼの存在により説明され得る有糸分裂細胞におけるDNA脱メチル化の例もある(Wolffe,Proc.Natl.Acad.Sd.96(1999),5894−5896)。
【0006】
CpGメチル化、及び遺伝子抑制
プロモーターのメチル化(しかし、非調節配列のものではない)は、安定、転写抑制と相互に関連する(Singal(1999),loc.cit.,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。5−メチルシトシンの抑制特性は、2つの機構により影響され得る。第1に、DNAメチル化は、転写因子の結合を直接的に損なわせ得るというもの。第2に、抑制の最大部分に関与しそうな可能性は、メチル−CpG−結合タンパク質(MBP)の増大であるというものである(Ballestar,Eur.J.Biochem.268(2001),1−6)。MECP2又はMBD2(MeCP1複合体の構成要素)の如きMBPは、コリプレッサー複合体、及び抑制作用を有するHDACを伴い、そして転写因子に利用できない高密度クロマチン構造(ヘテロクロマチン)の形成に関与する(Ballestar(2001),loc.cit)。
【0007】
腫瘍形成における後成的変化
腫瘍の形成が、遺伝子病変(例えば、突然変異又は転座)だけでなく、後成的変化によっても支持されることが明らかとなっている。異常なクロマチン構造又はDNAメチル化は、腫瘍遺伝子又は腫瘍抑制遺伝子の転写状態に影響を与え得、及び腫瘍の成長を促進し得る。当該DNAメチル化における変化は、正常なメチル化配列におけるメチル化の損失(低メチル化)、あるいは正常な非メチル化配列におけるメチル化(高メチル化)のいずれかを含む(Roberston(2000),Ioc.cit.,Herman,N.Engl.J.Med.349(2003),2042−2054;Momparler,Oncogene22(2003),6479−6483;Esteller,Science297(2002),1807−1808;Plass,Hum.Mol.Genet11(2002),2479− 488)。
【0008】
低メチル化
広範囲のDNA低メチル化は、ほぼ全ての種類の腫瘍について記載される。腫瘍組織において、5−メチルシトシン含有量は、反復サテライト配列又は染色体のセントロメア領域に見られる脱メチル化事象の大部分を有する正常な組織と比較して、低減される。しかしながら、個々の場合、bcl-2又はc-mycの如き原がん遺伝子の脱メチル化、及び活性化もまた記載される(Costello,J.Med.Genet.38(2001),285−303)。
【0009】
CpGアイランドの高メチル化
CpGアイランドは、通常、遺伝子調節機能に影響を及ぼす。これは、メチル化状態における変化が、関連する遺伝子座の転写活性における変化と主に直接的に関与することによる(Robertson(1999);Herman(2003);Esteller(2002);Momparler(2003);Plass(2002),all Ioc.cit。)。大抵のCpGアイランドは、正常細胞における非メチル化形態中に存在する。しかしながら、ある態様において、CpGアイランドは、遺伝子調節事象においてもメチル化され得る。例えば雌性細胞の非活性化X染色体のCpGアイランドの大部分は、メチル化される(Goto,Microbiol.Mol.Biol.Rev.62(1998),362−378)。CpGアイランドは、正常な老化作用の過程においてもメチル化され得る(Issa,Clin.Immunol.109(2003),103−108)。
【0010】
特定の腫瘍において、通常メチル化されないCpGアイランドが高メチル化形態に存在し得る。多くの場合において、高メチル化により影響を受ける遺伝子は、腫瘍抑制遺伝子の如き腫瘍の成長に対抗するタンパク質をコードする。以下の表は、高メチル化の後成的機構を通じて腫瘍中で非活性化され得ることが明らかである遺伝子の例を挙げるものである。
【0011】
【表1】

【0012】
腫瘍特異的高メチル化の理由は、ほとんどわかっていない。興味深いことに、ある種の腫瘍は、それら自身の高メチル化プロフィールを有しているようである。高メチル化が均一に分布されず、腫瘍に依存して生ずることが、より多くの比較研究において示され得た。白血病の場合、例えば結腸がん又は神経こう腫と比較して、ほとんど他の遺伝子が高メチル化される。それ故、高メチル化は、腫瘍を分類するために有用となり得た(Esteller,CancerRes.61(2001),3225−3229;Costello,Nat.Genet.24(2000),132−138)。
【0013】
多くの場合において、高メチル化は、HDACの増大活性も混合される。脱メチル化物質(例えば、5−アザシチジン)での処理の後、メチル化遺伝子は、HDAC阻害剤(例えば、トリコスタチン(TSA))も使用した後にのみ、再活性化され得た(Suzuki,Nat.Genet.31(2002),141−149;Ghoshal,Mol.Cell.Biol.22(2002),8302−8319;Kalebic,Ann.N.Y.Acad.Sci983(2003),278−285)。
【0014】
大抵の分析は、DNAのメチル化は優位に抑制されること、及びTSAの如きHDAC阻害剤での処理により逆転され得ないことを示す(Suzuki(2002);Ghoshal(2002),loc.cit)。しかしながら、既に臨床に使用されるHDAC阻害剤、バルプロエートは、DNAの脱メチル化を導きうることもさらに最近示された(Detich,J.Biol.Chem.278(2003),27586−27592)。しかしながら、この観点において実施される系統的分析は、今のところない。
【0015】
後成的変化を逆転するための臨床的研究
がん(例えば突然変異)の遺伝的原因は不可逆的なものであるが、腫瘍形成に対する役割に寄与する後成的変化は可逆的となり得る。それ故、後成的変化の可能な処置は、新組織形成の治療のための新たな可能性を提示する(Herman(2003);Momparler(2003);Plass(2002),allloc.cit.;Leone,Clin.Immunol.109(2003),89−102;Claus,Oncogene 22 (2003), 6489−6496)。
【0016】
20年以上前、5−アザシチジンは、抗腫瘍薬として既に開発されており、及び知られた基質の分子効果なしに使用されていた。現在、さらに発達した形態(デオキシ−5−アザシチジン,デシタビン)において、骨髄異形成症候群、及び二次性白血病の治療のために、すでに首尾よく使用されている(Leone(2003),loc.cit.;Lyons,Curr.Opin.Investig.Drugs 4(2003),1442−1450;Issa,Curr.Opin.Oncol.15(2003),446−451)。
【0017】
HDAC阻害剤がメチル化プロモーターの再活性化を支持し得、及び脱メチル化基質と相乗的に作用し得るといった生体外の観察に起因して、現在、基質双方の種類の使用を含む、試験的研究が世界中で実施される(Kalebic(2003);Claus(2003),loc.cit.;Gagnon,Anticancer Drugs 14(2003),193−202;Shaker,Leuk.Res.27(2003),437−444)。
【0018】
CpGメチル化の分析のための検出方法
ゲノムのCpGメチル化分析のための検出方法の開発は、CpGメチル化パターンにおける変化ががんの如き疾患に関連し得ることが見出される事実に起因する重要性を主に有している。現在のところ、主に、既知の遺伝子座のCpGメチル化の検出のために使用されることが知られている技術がある(Dahl,Biogerontology4(2003),233−250)。ゲノムを通じてCpGメチル化の分析を可能とする方法は、ほとんど確立されていない。以下に、適用の主要分野と共にCpGメチル化の分析のための最も一般的な方法を要約する。
【0019】
CpGメチル化の検出のためのメチル化感受性制限酵素の使用
特異的CpGジヌクレオチドのメチル化状態が、5−メチルシトシンに対する異なる感受性により特徴づけられる細菌の制限エンドヌクレアーゼのイソシゾマーを使用して、検出され得る。それらの例は、双方ともCCGG配列を切断する酵素HpaII、及びMspIであって、しかしながら、HpaIIは、内部シトシンがメチル化されない場合に限られる。いくつかのアッセイは、メチル化感受性制限酵素の使用に基づき、上記アッセイは、個々の遺伝子の分析、及び当該ゲノムを通じたCpGメチル化の分析の双方のために使用され得る。メチル化感受性制限消化の断片は、サザンブロット又は制限部位の側面に接する領域のゲノムPCRにより、主に検出される(Dahl(2003),loc.cit.)。現在までに刊行されている、ゲノムを通じたCpGメチル化の全分析法は、当該方法の構成成分として、メチル化感受性制限酵素を使用する。制限ランドマークゲノムスキャニング法(Restriction Landmark genomic Scanning、RLGS)(Costello,Methods27(2002),144−149)は、例えば、全次元が異なるメチル化感受性制限酵素で消化され2つのDNA母集団のCpGメチル化における相違を特定する、一種の2次元アガロースゲル電気泳動を使用する。メチル化CpGアイランド増幅法(Methylated CpG Island Amplification、MCA)は、メチル化SmaI制限部位を有する断片を充実させ、そして当該断片を増やすためにLM−PCRを使用する。かかる増幅産生物は、表示差異分析(Representational Difference Analyzis、RDA)(Smith,Genome Res.13(2003),558−569)又はCpGアイランドマイクロアレイ(Yan,Cancer Res.6(2001),8375−8380)を用いて、すでに成功裏に分析されている。
【0020】
ゲノムを介したCpGメチル化の分析に関して、メチル化感受性制限酵素に基づいた全アッセイは、不都合を有する。最善の方法で実施するために、とりわけ、全ての制限消化が完了することが保証される必要がある。最も著しい不都合は、当該分析が与える情報が、単に、使用されるメチル化感受性制限酵素により認識されるシトシン残基のメチル化状態に関する情報だけであることである。当該制限酵素の選択は、検出可能な配列の数を自動的に制限する。それ故、当該CpGメチル化の中立分析は、可能性のないものである。
【0021】
CpGメチル化の分析のための重硫酸塩処理
硫酸水素ナトリウムでの二本鎖ゲノムDNAの処理は、非メチル化シトシン残基の脱アミノ化を導きウラシル残基とし、及びもはや相補的ではない2つの一本鎖の形成を導く。この処理の間、5−メチルシトシンが維持される。このようにして形成された配列間の相違は、メチル化DNAと非メチル化DNAとの相違の根拠を作り出す(Frommer,Proc.Natl.Acad.Sci.889(1992),1827−1831)。亜硫酸水素塩で処理されたDNAは、ウラシル残基(以前は非メチル化シトシンであったもの)とチミジン残基がチミジンとして増幅され、5−メチルシトシン残基のみがシトシン残基として増幅されるPCRにおいて直接的に使用され得る。増幅に依存して、PDRに使用されるプライマーは、メチル化配列と非メチル化配列とを区別し、又はメチル化状態とは無関係に、断片を増幅する。例えば、非特徴的なプライマーを使用して増幅されるPCR断片は、直接的にシークエンスされ、メチル化、及び非メチル化CpGの占有率を決定し得る。
【0022】
さらなる方法は、メチル化の程度を決定するために、かかるPCR断片の物理的な相違(融解挙動、一本鎖構造、制限酵素のための制限部位など)を活用する(Dahl(2003),Ioc.cit.)。他の系統的アプローチは、特徴的なプライマー又はプローブによるメチル化、及び非メチル化配列の特異的増幅(メチル化特異的PCR、MethylightPCR)のための配列内の相違を活用する(Dahl(2003),Ioc.cit.)。PCR産物の配列における亜硫酸水素塩−誘導の相違は、メチル化特異的オリゴヌクレオチド(MSO)マイクロアレイを用いても見出され得る(Shi,J.Cell.Biochem.88(2003),138−143;Adorjan,Nucleic Acid Res.30(2002),e21;Gitan,Genome Res.12(2002),158−164)。
【0023】
当該メチル化感受性制限酵素と対照的に、亜硫酸水素塩で処理されたDNAは、増幅されたゲノム断片におけるいくつかのCpG残基のメチル化状態に関する情報を提供し得る。おそらく、その低減された複雑さ、及びその高程度の変性に起因して、当該処理されたDNAは、当該ゲノムを介する分析に適してはいない。
【0024】
CpGメチル化の検出のためのさらなる方法
変性された一本鎖DNA内のCpGメチル化を認識する5-メチルシトシンに対する抗体は、主に個々の固定細胞の染色体上のCpGメチル化の免疫組織化学的染色のために使用される。しかし、これらの抗体は、豊富にメチル化された配列に適してはいない。
【0025】
1994年に既に、A.Bird研究所は、親和性クロマトグラフィーを用いてメチル化DNA断片を濃縮するための方法を開発した(Gross,Nat.Genet.6(1994),236−244)。マトリクスに結合する組み換えMECP2が、メチル化DNAを結合するために使用された。それ以来、この技術は、使用され、改良され、そして他の作業グループによるさらなる技術と組み合わされた(Shiraishi,Proc.Natl.Acad.Sci.96(1999),2913−2918;Brock,Nucleic Acid.Res.29(2001),E123)。親和性マトリクスに対する強力な又はより劣る強力なメチル化ゲノム配列の結合は、濃密なメチル化を伴うCpGアイランドをより低いメチル化密度を伴う他の配列から分離することを可能とする塩濃度に、依存する。この親和性クロマトグラフィーの不都合な点は、大量のゲノムDNA(50〜100μg)を必要とすること、及び比較的時間のかかる手順である。
【0026】
以上の観点から、CpGジヌクレオチドのメチル化が、細胞の転写活性を制御するための重要な後成的機構であることが明らかである。一般的に、CpGジヌクレオチドのメチル化は、転写不活性と関連がある。しかし、正常な又は変性した分化過程の間、遺伝子座のメチル化パターンは変化し得る。従って、腫瘍形成の間、正常なメチル化パターンの逆転は、各々、腫瘍抑制遺伝子又は原がん遺伝子の如き、遺伝子の異常な抑制(又は活性化)を導き得、それ故、腫瘍形成を導く。それ故、CpGメチル化DNAの検出、及びそれ故、調節されない腫瘍抑制遺伝子、及び/又は原がん遺伝子の同定は、最も外部の臨床的興味である。上記のように、先行技術は、メチル化DNAの検出のために異なるアプローチを記載するが、欠陥に悩まされている。例えば、先行技術の方法は、CpGメチル化DNAの中立、ゲノムレベル解析を可能とはせず、又はハイスループット適用に適しておらず、又はCpGメチル化DNAの検出において、特に検出対象として少量のDNAしかないとき、信頼性がない。それ故、先行技術の欠陥、及び欠点を克服し得るメチル化DNAを検出するさらなる手段、及び方法の必要性の余地がある。従って、本発明の根底にある技術的問題は、上記必要性に応じる。
【0027】
この技術的問題に対する解決法は、本願請求項において特徴付けられる態様を提供することにより達せられる。
【発明の概要】
【0028】
よって、本発明の第1の態様は、メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメインと抗体のFc部分とを含む二機能性ポリペプチドをコードするヌクレオチド配列を有するポリヌクレオチドである。該DNA結合ドメインは本明細書で後述される。
【0029】
本発明の別の実施形態では、該断片がメチル化DNA、好ましくはCpGメチル化DNAと結合し得る限り、その断片であってもよい。
【図面の簡単な説明】
【0030】
【図1−1】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。MBD2−Fc二機能性タンパク質のアミノ酸配列は次のような特徴を有する。
【表2】

【図1−2】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。
【図1−3】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。
【図2】Drosophila Schneider細胞におけるMBD2−FCの発現。安定トランスフェクトされたS2細胞を、w/o 500μM CuSO4を含む培地w/o FCSに播種した。4日後、上清を回収し、セファロースビーズを用い、4℃でo/n、予備洗浄した。予備洗浄された上清1mlを、Aタンパク質セファロースを用いて沈降させ、洗浄し、SDSローディング色素に再懸濁させ、SDS−PAGEを行った。このゲルをクマシー染色して沈降したタンパク質を検出した。
【図3】逆サウス−ウエスタンブロット。ヒトICSBP−プロモーター(A)の650bpのPCR断片、または種々のCpG密度のメチル化プロモーター断片(50ng)(CpG−ジヌクレオチドの数/100bp:ICSBP:10,6;CHI3L1:2,9;TLR2:6,2;TLR3:2,1)を、SssIを用いてメチル化し、アガロースゲル電気泳動(対照として臭化エチジウム染色が示されている)を行い、ナイロン膜に直接ブロットした。膜を、実施例3に記載するように、MBD2−Fc、HRPコンジュゲート(konjugated)抗ヒトFcおよびECLを用いて染色した。
【図4】MBD−Fcビーズに対するCpGメチル化物の塩濃度依存性結合。(A)ヒトプロモーター断片の模式図。丸はCpG−ジヌクレオチドの位置を示す(白丸:非メチル化CPM;黒丸:SssIメチル化CCL13、TLR2、CHI3L1)。(B,C)メチル化および非メチル化断片の混合物をMBD2−Fc−セファロース(Aタンパク質−セファロース50μl当たりのMBD2−Fcの量が示されている)に結合させ、塩濃度を引き上げて溶出させ、アガロースゲル電気泳動を用いて精製および分離した(投入混合物の1/5と共に)。バンドを臭化エチジウムで可視化し、Typhoon Imager(Pharmacia−Amersham)を用いて走査した。
【図5】MCIpによるCpGアイランドの富化。示された細胞種のゲノムDNA(300ng)に対してMCIpを行った。3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を、LightCyclerリアルタイムPCRを用いて定量した。MCIp溶出物から増幅させた特定のプロモーター断片の量が、非処理のゲノムDNA対照と比較して示されている。THP−1細胞にはp15プロモーターが検出できなかったが、このことはこの遺伝子の突然変異または欠失を示す。
【図6】MCIpによるメチル化CpGアイランド検出の感度。制限ゲノムU937DNAの量を引き下げてMCIpを行った。2つのCpGアイランドプロモーター(TLR2、p15)の富化を、LightCyclerリアルタイムPCRを用いて定量した。MCIp溶出物から増幅させた特定のプロモーター断片の量が、非処理のゲノムDNA対照と比較して示されている。
【図7】MB−PCRの原理。この図はMB−PCRの模式図を示す。
【図8】正常DNAサンプルおよび4つの白血病DNAサンプルにおけるTLR2、ESR1およびp15プロモーターのMB−PCR。示された細胞種のゲノムDNA(10ng)に対してMB−PCRを行った。3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を標準的なゲノムPCRにより検出した。THP−1細胞にはp15プロモーターが検出できなかったが、このことはこの遺伝子の突然変異または欠失を示す。
【図9】リアルタイムPCRを用いた特定のCpGアイランドプロモーターにおけるCpGメチル化のMCIp検出。(A〜C)分画メチル−CpG免疫沈降(MCIp)をリアルタイムLightCycler PCRと併用し、非処理(グレーのバー)並びにSssIメチル化およびMseI制限ゲノムDNA断片(黒いバー)由来の示された遺伝子のメチル化状態を検出した。MCIp溶出物から回収された遺伝子断片(上の四角にはNaCl濃度(mM)を示す)および同量の投入DNAをLightCycler−PCRにより増幅させた。個々の画分の値(平均値±SD,n=4)は回収率%を表し、個々の投入DNAから生成したPCR産物の量(100%)に対して算出する。各図の上に相当するCpGアイランドの3kB領域を模式的に示している。各CpGジヌクレオチドは垂直線により示されている。エキソンの位置はグレーの四角として示され、転写開始部位は矢印で示されている。白四角は100bp断片を表す。黒四角は検出されるMseI断片の位置を示す。(D〜G)3つのヒト骨髄性白血病細胞系統(KG−1、U937およびTHP−1)並びに正常ヒト血液単球(N)の高塩(1000mM)MCIp画分におけるSNRPN、TLR2、ESR1およびCDKN2Bを、上記のようにリアルタイムPCRにより分析した。
【図10】MCIpアプローチの感度および直線性。(A)MseI処理されたU937DNAの量を引き下げて、MCIpを行った。CDKN2BおよびTLR2遺伝子断片を上記のように定量した。(B)正常ヒト血液単球(N)とKG−1細胞のMseI処理DNAを示された比率で混合し、その混合物に対してMCIpを行い、TLR2遺伝子断片を上記のようにLightCycler−PCRを用いて定量した。
【発明を実施するための形態】
【0031】
本発明好ましい一実施形態では、本発明の二機能性ポリペプチドをコードするヌクレオチド配列を含む核酸分子は、リンカーポリペプチドをコードするヌクレオチド配列 をさらに含む。好ましくは、該リンカーポリペプチドをコードするヌクレオチド配列は、本発明の二機能性ポリペプチドをコードするポリヌクレオチドにおいて、MBDをコードするヌクレオチド配列とFc部分の間に、該MBDとリンカーポリペプチドとFc部分の間で融合が起こるように配置される。「融合」とは、タンパク質をコードする核酸分子の遺伝子発現により個々のペプチド主鎖を介して複数のタンパク質またはその断片が共に線状結合することを指す。よって、好ましい融合タンパク質としては、MBDのDNA結合ドメインまたはその断片が含まれ、この断片は好ましくは、本明細書に記載されるような抗体のFc部分とそれ自体共有結合しているリンカーポリペプチドと共有結合している、メチル化DNA、好ましくは、CpGメチル化DNAとの結合活性を有する。
【0032】
該ポリペプチドリンカーは好ましくは、フレキシブルリンカーである。好ましくは、該リンカーは複数の、親水性の、ペプチド結合アミノ酸を含み、MBDのDNA結合ドメインのC末端とFc部分のN末端を接続している。場合により、本発明のポリペプチドは、所望により該Fc部分の切断を可能とするプロテアーゼ切断部位をFc部分の前に含む。プロテアーゼ切断部位は例えば、トロンビン切断部位である。
【0033】
好ましくは、該ポリペプチドリンカーは、複数のグリシン、アラニン、アスパラギン酸塩、グルタミン酸塩、プロリン、イソロイシンおよび/またはアルギニン残基を含む。該ポリペプチドリンカーは複数の、アミノ酸配列の連続コピーを含むのがさらに好ましい。通常、ポリペプチドリンカーは、1〜20、好ましくは、1〜19、1〜18、1〜17、1〜16または1〜15のアミノ酸を含むが、20を超えるアミノ酸のポリペプチドリンカーも同様に機能し得る。本発明の好ましい一実施形態では、該ポリペプチドリンカーは、1〜14のアミノ酸残基を含む。本発明の特に好ましい一実施形態では、本発明のポリペプチドにおける該ポリペプチドリンカーは14のアミノ酸を含む。添付の実施例に示すように、該ポリペプチドリンカーは有利には、配列番号2(図1)の116〜129番でも示されるアミノ酸配列「AAADPIEGRGGGGG」を含む。
【0034】
本発明のポリペプチドは場合により、そのN末端および/またはC末端にタグを含む。「タグ」は、そのタグが融合するアミノ酸配列と同種または異種のアミノ酸配列である。該タグはとりわけ、それが融合するタンパク質の精製を容易にする、または該タンパク質の検出を容易にすることができる。好ましくは、該タグは、HAタグ、myc6タグ、flagタグ、strepタグ、strepllタグ、TAPタグ、HATタグ、キチン結合ドメイン(CBD)、マルトース結合タンパク質、免疫グロブリンA(IgA)、His−6タグ、グルタチオン−S−トランスフェラーゼ(GST)タグ、インテインおよびストレプトアビジン(streptavidie)結合タンパク質(SBP)タグからなる群から選択される。
【0035】
CpGアイランドは多くの場合、遺伝子プロモーターと転写開始部位を含み、通常、正常細胞ではメチル化されていない。CpGアイランドのメチル化は、転写抑制と関連している。がんでは、CpGアイランドプロモーターのメチル化は腫瘍抑制遺伝子の異常なサイレンシングをもたらし、疾病の病因に関与している。これまでに、ヒトのがんにおけるCpGアイランドの異常なメチル化の研究は主として候補遺伝子アプローチを採ってきたが、これにはいくつかの欠点がある。これらは例えば、高メチル化であれ低メチル化であれ、メチル化の対象となり得る腫瘍形成に関与する遺伝子座のカバーが不完全なこと、または例えば、Restriction Landmark Genomic Scanning(RLGS)を用いる場合、手段および方法の限定により遺伝子座の解析が不完全なことである。偏りのない、CpGメチル化DNAのゲノム全域検出を可能とするため、本発明は、例えば、メチル化感受性制限エンドヌクレアーゼまたは重亜硫酸塩処理を適用せずに、CpGメチル化の分離および検出を可能とする手段および方法を提供する。これらの手段および方法はとりわけ、CpGメチル化DNAと効率的に結合する、メチル−CpG結合性抗体様タンパク質に基づく。本明細書に記載されるように、このメチル−CpG結合性抗体様タンパク質は、メチル−CpG結合タンパク質(MBD)ファミリーに属すタンパク質のDNA結合ドメインと抗体の定常部分とを含む。
【0036】
驚くことに、組み換えメチル−CpG結合性抗体様タンパク質は、抗体のような様式でCpGメチル化DNAに、好ましくは結合することができることが判明した。これは、本発明のメチル−CpG結合性抗体様タンパク質が、CpGジヌクレオチドにおいて、好ましくは、メチル化されるDNAであることが好ましいその「抗原」に対して、高い親和性と高い結合力を有することを意味する。特定の理論に拘束されるものではないが、本発明のポリペプチドの、その「抗原」に対する高い親和性と結合力は、該メチル−CpG結合性抗体様タンパク質の独特の構造により生じるものである。本発明のポリペプチドのユニークな構造は、抗体の定常領域の存在により達成されるものと推測され、従って、当該ポリペプチドは好ましくは二機能性分子となる。これらの定常領域は、本発明の2つのポリペプチドの分子の各定常領域の免疫グロブリン重鎖の間でジスルフィド結合を形成すると考えられている。よって、抗体様構造は、抗体の構造を密接に類似して形成されることが好ましい。
【0037】
ここでも特定の理論に拘束されるものではないが、この構造は例えば、本発明のポリペプチドに安定性をもたらすものと思われる。これは、当技術分野において、抗体の定常領域と融合されたタンパク質は、該タンパク質により高い安定性とより長い半減期を与え得るとされているためである。さらに、これらの定常領域の分子間相互作用によって生じた抗体様構造は、本発明のあるポリペプチドのメチル−DNA結合ドメインを、本発明の別のポリペプチドのメチル−DNA結合ドメインの近接近に持ってくると考えられている。これにより、メチル−DNA結合タンパク質とメチル化DNAの間で二価の相互作用が可能となる。よって、本発明のポリペプチドは、本発明のポリペプチドの一部である2つのメチルDNA結合ドメインを介してその抗原に好ましく結合することができる。
【0038】
本発明のポリペプチドの高親和性結合はまた、とりわけ、好ましくは、本明細書に記載されているような独特の適用性を妨害または干渉し得る他のタンパク質との相互作用のためのドメインを含む全長メチル−DNA結合タンパク質の代わりに、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと特異的に結合することが知られているタンパク質のメチル−DNA結合ドメインを使用することによっても達成される。このメチル−DNA結合ドメインの使用はさらに、この検出は直接的なものであって間接的なものないことから、実際にメチル化DNAが結合していることが保証される。ほとんどの先行技術の方法は、PCRによりメチル化DNAを間接的に検出できるにすぎない。
【0039】
これらの特性は本発明のポリペプチドを、たとえ該DNAが、本明細書に記載されるように、例えば、約10ngを超える量、10ng未満、7.5ng未満、5ng未満、2.5ng未満、または約1ngといった極めて少量でしか存在しない場合であっても、とりわけ、メチル化DNAを単離、精製富化および/または検出するための信頼性があり、かつ、容易に適用できる診断ツールとする。よって、本発明のポリペプチドは、その抗体様構造のために、例えば、単一試験管アッセイにおいて多段階手順を含む様々な適用にそれを適用可能とする強力な分子である。例えば、CpGメチル化DNAの特異的分離および検出は、逆サウスウエスタンブロット解析およびメチル−CpG免疫沈降法(MCIp)を用いて実証された。この技術は、リアルタイムPCR、例えば、LightCycler PCRと組み合わせると、例えば、全ゲノムDNAが1ngといった少量からの、候補CpGアイランドプロモーターのCpGアイランドメチル化の高感度検出を可能とする。MCIpにより生成されたゲノムDNA断片は、容易に増幅、標識およびCpGアイランド・マイクロアレイ・ハイブリダイゼーションに使用することができる。本明細書に記載の技術を使用すれば、ヒトがんにおけるCpGアイランドの異常なメチル化のゲノム域プロフィールの作製、および例えば、腫瘍抑制遺伝子またはさらなる抑制遺伝子活性の同定が可能となる。
【0040】
本発明を詳しく記載する前に、本明細書に記載される特定の方法論、プロトコール、細菌、ベクターおよび試薬は変更可能であるので、本発明はこれらに限定されないことを理解すべきである。また、本明細書で用いられる用語は単に特定の実施形態を記載するためのものであって、本発明の範囲を限定するものではなく、本発明の範囲は添付の特許請求の範囲によってのみ限定されることを理解すべきである。特に断りのない限り、本明細書で用いられる技術用語および科学用語は全て、当業者が一般に理解しているものと同じ意味を有する。
【0041】
好ましくは、本明細書で用いられる用語は、“A multilingual glossary of biotechnological terms:(IUPAC Recommendations)”,Leuenberger,H.G.W,Nagel,B.and KoIbI,H.eds.(1995),Helvetica Chimica Acta,CH−4010 Basel,Switzerland)の記載と同様に定義される。本明細書および特許請求の範囲を通じ、特に断りのない限り、「含む」およびその活用形は、示されている数字若しくはステップまたは一連の数字若しくはステップを包含することを意味するが、他のいずれの数字若しくはステップまたは一連の数字若しくはステップを排除するものではないと理解される。本明細書および添付の特許請求の範囲において、単数形「a」、「an」、および「the」は、特に断りのない限り、複数の指示対象も含むということに留意しなければならない。よって、例えば、「ある試薬(a reagent)」と記載する場合には、そのような種々の試薬の1又は複数を含み、また、「その方法(the method)」と記載する場合には、本明細書に記載の方法に対して改変または置換可能な当業者に知られている等価なステップおよび方法に対する言及も含む。
【0042】
本明細書において「核酸分子」とは、当該核酸分子により含まれるプリン塩基およびピリミジン塩基を含む塩基のヌクレオチド配列を有する任意の核酸分子を包含し、これにより該塩基は核酸分子の主要構造を呈する。核酸配列は、センス鎖であれアンチ鎖であれ、DNA、cDNA、ゲノムDNA、RNA、合成形態(例えば、PNA)、および混合ポリマーを含むか、或いは当業者ならば容易に認識できるように、非天然若しくは誘導体化ヌクレオチド塩基も含み得る。本発明のポリヌクレオチドは、好ましくは、ポリリボヌクレオチドまたはポリデオキシリボヌクレオチドからなり、非修飾RNA若しくはDNA、または修飾RNA若しくはDNAであってもよい。例えば、ポリヌクレオチドは一本鎖および二本鎖DNA、一本鎖領域と二本鎖領域の混合物であるDNA、一本鎖および二本鎖RNA、並びに一本鎖領域と二本鎖領域の混合物であるRNA、一本鎖またはより典型的には二本鎖、または一本鎖領域と二本鎖領域の混合物であり得るDNAとRNAを含むハイブリッド分子であってもよい。さらに、このポリヌクレオチドは、RNAまたはDNA、またはRNAとDNAの双方を含む三本鎖領域からなってもよい。また、このポリヌクレオチドは、1又は複数の修飾塩基、または安定性若しくはその他の理由で修飾されたDNA若しくはRNA主鎖を含んでもよい。「修飾」塩基としては、例えば、トリチル化塩基、およびイノシンなどの非必須塩基が挙げられる。DNAおよびRNAには様々な修飾を行うことができ、従って、「核酸分子」には、化学的、酵素的、または代謝的修飾形態が含まれる。
【0043】
本発明において「ポリペプチド」とは、互換的に用いられ、所与の長さのアミノ酸を包含するペプチド、タンパク質またはポリペプチドを意味し、ここでアミノ酸残基が共有ペプチド結合により連結されている。しかしながら、アミノ酸結合および/またはペプチド結合が機能的類似体により置換される、かかるタンパク質/ポリペプチドのペプチド模倣薬も本発明に包含され、並びにセレノシステインなどの遺伝子にコードされている20種のアミノ酸以外のものも本発明に包含される。ペプチド、オリゴペプチドおよびタンパク質は、ポリペプチドと呼ぶこともできる。記載のように、ポリペプチドおよびタンパク質という用語は本明細書では互換的に用いる場合が多い。ポリペプチドという用語はまた、ポリペプチドの修飾物も指し、それを排除しない。修飾としては、グリコシル化、アセチル化、アシル化、リン酸化、ADP−リボシル化、アミド化、フラビンの共有結合、ヘム部分の共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、脂質または脂質誘導体の共有結合、ホスホチジルイノシトール(phosphotidylinositol)の共有結合、架橋、環化、ジスルフィド結合の形成、脱メチル化、共有結合性架橋の形成、システインの形成、ピログルタミン酸塩の形成、フォーミュレーション(formulation)、γ−カルボキシル化、グリコシル化、GPIアンカーの形成、水酸化、ヨウ化、メチル化、ミリストイル化、酸化、ペグ化、タンパク質分解性プロセシング、リン酸化、プレニル化、ラセミ化、セレノイル化、硫酸化、トランスファーRNAにより媒介されるタンパク質へのアミノ酸付加(アルギニン化など)、およびユビキチン化が挙げられる(例えば、PROTEINS−STRUCTURE AND MOLECULAR PROPERTIES,2nd Ed.,T.E.Creighton,W.H.Freeman and Company,New York(1993);POST−TRANSLATIONAL COVALENT MODIFICATION OF PROTEINS,B.C.Johnson,Ed.,Academic Press,New York(1983),pgs.1−12;Seifter,Meth.Enzymol.182(1990);626−646,Rattan,Ann.NY Acad.Sci.663(1992);48−62参照)。
【0044】
本発明のポリペプチドは好ましくは、本明細書に記載されるように、本発明の核酸分子によりコードされるアミノ酸配列を有するか、或いは該ポリペプチドの産生方法により、または本明細書に記載の該ポリペプチドを発現し得る細胞の作出方法によって得られる。
【0045】
好ましくは、本発明に関して、該ポリペプチドは二機能性ポリペプチドである。「二機能性ポリペプチド」とは、本発明のポリペプチドが、メチル化DNA、好ましくはCpGメチル化DNAと結合することに加え、本発明のポリペプチドの一部である抗体のFc部分によってさらなる能力を有することを意味する。例えば、該Fc部分は好ましくは、化合物または部分を当該Fc部分と接合、連結、または共有結合的にカップリングさせる能力を与える。本明細書において、「共有結合的にカップリングされる」とは、特定の化合物または部分が、互いに直接共有結合されているか、或いはまた、ブリッジ、スペーサー、または1つの連結部分若しくは複数の連結部分などの、1つの介在部分または複数の介在部分によって互いに間接的に共有結合的に連結されていることを意味する。
【0046】
このような化合物は検出可能な物質であり得る。検出可能な物質の例としては、様々な酵素、補欠分子族、蛍光物質、発光物質、生物発光物質、放射性物質、様々な陽電子放射断層撮影法を用いる陽電子放射金属、および非放射性常磁性金属イオンが挙げられる。この検出可能な物質は、当技術分野で公知の技術を用い、抗体(またはそのフラグメント)のFc部分の直接、または中間体(例えば、当技術分野で公知のリンカーなど)を介して間接的にカップリングまたは接合させることができる。本発明に従い診断薬として用いるために抗体のFc部分に接合し得る金属イオンについては、例えば、米国特許第4,741,900号を参照のこと。
【0047】
好適な酵素の例としては、セイヨウワサビペルオキシダーゼ、アルカリ性ホスファターゼ、β−ガラクトシダーゼ、またはアセチルコリンエステラーゼが挙げられ;好適な補欠分子族複合体の例としては、ストレプトアビジン/ビオチンおよびアビジン/ビオチンが挙げられ;好適な蛍光材料の例としては、ウンベリフェロン、フルオレセイン、フルオレセインイソチオシアネート、ローダミン、ジクロロトリアジニルアミンフルオレセイン、塩化ダンシルまたはフィコエリトリンが挙げられ;発光物質の例としては、ルミノールが挙げられ;生物発光物質の例としては、ルシフェラーゼ、ルシフェリン、およびエクオリンが挙げられ;好適な放射性物質の例としては、125I、131I、または99Tcが挙げられる。
【0048】
さらに、該Fc部分は、細胞毒素(例えば、細胞増殖抑制剤または細胞破壊剤)などの治療用成分、治療薬または放射性金属イオン(例えば213Biなどのα放射体と接合させてもよい。細胞毒素または細胞傷害性薬剤としては、細胞に有害ないずれの薬剤も含む。例としては、パクリタキソール、サイトカラシンB、グラミシジンD、臭化エチジウム、エメチン、マイトマイシン、エトポシド、テノポシド、ビンクリスチン、ビンブラスチン、コルヒチン、ドキソルビシン、ダウノルビシン、ジヒドロキシアントラシンジオン、ミトキサントロン、ミトラマイシン、アクチノマイシンD、1−デヒドロテストステロン、グルココルチコイド、プロカイン、テトラカイン、リドカイン、プロプラノロール、およびピューロマイシン、並びにそれらの類似体または同族体が挙げられる。
【0049】
治療薬としては、限定されるものではないが、代謝拮抗物質(例えば、メトトレキサート、6−メルカプトプリン、6−チオグアニン、シタラビン、5−フルオロウラシルデカルバジン)、アルキル化剤(例えば、メクロレタミン、チオテパ(thioepa)、クロルムブシル(chlormbucil)、メルファラン、カルムスチン(BSNU)およびロムスチン(CCNU)、シクロトスファミド(cyclothosphamide)、ブスルファン、ジブロモマンニトール、ストレプトゾトシン、マイトマイシンC、およびシス−ジクロロジアミン白金(11)(DDP)シスプラチン、アントラサイクリン(例えば、ダウノルビシン(以前のダウノマイシン)およびドキソルビシン)、抗生物質(例えば、ダクチノマイシン(以前のアクチノマイシン)、ブレオマイシン、ミトラマイシン、およびアントラマイシン(AMC))、並びに細胞分裂阻害剤(例えば、ビンクリスチンおよびビンブラスチン)が挙げられる。
【0050】
さらに、本発明のポリペプチドのFc部分は、所望の生物活性を有するタンパク質またはポリペプチドとカップリングまたは接合させることもできる。かかるタンパク質として、例えば、アブリン、リシンA、シュードモナス外毒素、またはジフテリア毒などの毒素;腫瘍壊死因子、α−インターフェロン、β−インターフェロン、神経成長因子、血小板由来増殖因子、組織プラスミノーゲン活性化因子、アポトーシス薬などのタンパク質が挙げられる。
【0051】
該Fc部分はまた、本発明のポリペプチドと、本明細書に記載されるような、標的抗原のイムノアッセイまたは精製に特に有用な固相支持体との結合を可能とする。かかる固相支持体としては、限定されるものではないが、ガラス、セルロース、ポリアクリルアミド、ナイロン、ポリカーボネート、ポリスチレン、ポリ塩化ビニルまたはポリプロピレンなどが挙げられる。
【0052】
化合物をFc部分と接合、カップリングまたは連結する技術は周知である。例えば、Arnon et al.,“Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy”,Monoclonal Antibodies And Cancer Therapy, Reisfeld et al.(eds.),pp.243−56(Alan R.Liss,Inc.1985);Hellstrom et al.,“Antibodies For Drug Delivery”,Controlled Drug Delivery(2nd Ed.),Robinson et al.(eds.),pp.623−53(Marcel Dekker,Inc.1987);Thorpe,“Antibody Carriers Of Cycotoxic Agents In Cancer Therapy:A Review”, Monoclonal Antibodies’84:Biological And Clinical Applications,Pinchera et al.(eds.),pp.475−506(1985);“Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy”,Monoelonal Antibodies For Cancer Detection And Therapy,Baldwin et al.(eds.),pp.303−16(Academic Press 1985),およびThorpe,Immunol.Rev.,119−158参照。
【0053】
「メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメイン」とは、タンパク質MeCP2、MBD1、MBD2、MBD3およびMBD4を含むMBDファミリーのタンパク質のメチル−DNA結合ドメインの構造的および/または機能的特徴を好ましく有するポリペプチドを包含する。このメチル−DNA結合活性は、当技術分野で公知の方法によって試験することができる。好ましくは、「メチル化DNA」とは、ヘミメチル化、または両鎖でメチル化されたDNA、または一本鎖メチル化DNAを含む、メチル化DNA、より好ましくは、CpGメチル化DNAを包含する。これまでで最も重要な例は、ほとんどの場合はジヌクレオチドCpGに関して、また、CpNpG配列およびCpNpN配列に関して生じたメチル化シトシンである。基本的に、他の天然ヌクレオチドもメチル化され得る。
【0054】
本発明のポリペプチドは、本明細書に記載されるように、モノマーまたはダイマーまたは多価分子のいずれかとしてメチル化DNAと結合することが好ましい。本発明のポリペプチドは、高メチル化DNAまたは低メチル化DNAと結合し得るのが好ましい。本発明のポリペプチドは、単一のメチル化CpG対と結合することができるのが好ましい。MeCP2、MBD1、MBD2、MBD3およびMBD4は、メチル−CpG結合ドメインを共有する脊椎動物タンパク質の一ファミリーを構成している。該MBDタンパク質ファミリーは既知のMBDの配列に基づく2つのサブグループを含む。
【0055】
MBD4のメチル−DNA結合ドメインは、一次配列においてはとほとんど同じであるが、MBD1、MBD2およびMBD3のメチル−DNA結合ドメインは、MBD4またはMeCP2のいずれかよりも互いにより類似している。しかしながら、各タンパク質内のメチル−DNA結合ドメインは、MeCP2、MBD1、MBD2、MBD3およびMBD4の5つ全ての遺伝子内の保存された位置にあるイントロンの存在に基づけば、進化的に近縁であると思われる。やはり、MBDファミリーのメンバー間の配列類似性は、それらのメチル−DNA結合ドメインに主として限定されるが、MBD2およびMBD3は類似しており、それらの長さの大部分にわたって全体として約70%の同一性を有する。最大の違いはC末端にあり、そこでMBD3は12の連続するグルタミン酸残基を有する。
【0056】
本発明において有用なMBDまたはその断片、好ましくは、メチル−DNA結合ドメインまたはその断片は、例えば、当技術分野で公知の、好ましくは本明細書に記載の手段および方法を使用し、既知のMBDとMBDであると思われる配列とを比較し、および/または整列することによる、配列比較および/または整列を用いることで同定することができる。
【0057】
例えば、比較される2つの配列の双方の位置が、同じ塩基またはアミノ酸モノマーサブユニットにより占められている場合(例えば、2つのDNA分子の各々のある位置がアラニンにより示されているか、または2つのポリペプチドの各々のある位置がリシンにより占められている場合)、それら個々の分子はその位置において同一である。2つの配列間の同一性%は、その2配列間で共通の一致するまたは同一の位置の数を、比較される位置の数で割ったものに100を掛けたものの関数である。例えば、2配列中の位置10のうち6が一致する、または同一であれば、その2配列は60%同一である。例を示せば、DNA配列CTGACTとCAGGTTは50%の相同性を有する(全ての位置6のうち3が一致する)。
【0058】
一般に、比較は、2配列を、最大の相同性および/または同一性が得られるように整列させて実施される。かかる整列は、例えば、便宜には整列プログラム(DNAstar,Inc.)などのコンピュータープログラムもより実行される、Needlemanの方法(J.Mol Biol.48(1970):443−453を用いて提供することができる。相同配列は同一または類似のアミノ酸残基を共有し、ここで、類似の残基は、整列させられた対照配列における対応するアミノ酸残基との保存的置換であるか、または「許容される点突然変異」である。これに関して、参照配列の残基の「保存的置換」は、対応する参照残基と物理的または機能的に類似の、例えば、類似の大きさ、形状、電荷、共有結合または水素結合の形成力などを含む化学的特性を有する置換である。特に好ましい保存的置換は、Dayhoff et al.,5:Atlas of Protein Sequence and Structure,5:Suppl.3,chapter 22:354−352,Nat.Biomed.Res.Foundation,Washington,D.C.(1978)に「許容される突然変異」として定義されている基準を満たすものである。
【0059】
好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、本明細書に記載されるような構造的特徴および/または機能的特徴を有する。好ましくは、本明細書に記載のメチル−DNA結合タンパク質の断片は、メチル化DNA、好ましくは、CpGメチル化DNAと結合することができる。
【0060】
本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、好ましくは、昆虫起源、線虫起源、魚類起源、両生類起源、より好ましくは、脊椎動物起源、いっそうより好ましくは、哺乳類起源、最も好ましくは、マウス、特に好ましくはヒト起源のものである。
【0061】
好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe,Eur.J.Biochem.268(2001),1−6の図1に示され、メチル化DNAと結合することができる、特徴的なループを有する固有のα−ヘリックス/β−鎖サンドイッチを有する。
【0062】
より好ましくは、本発明のポリペプチドのMBDまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示され、メチル化DNAと結合することができ、MBDの少なくとも50、より好ましくは少なくとも60、いっそうより好ましくは少なくとも70または少なくとも80のアミノ酸残基を含む。
【0063】
いっそうより好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示され、メチル化DNAと結合することができ、MBDと、アミノ酸レベルで、好ましくは50%、60%、70%、80%または90%、より好ましくは95%または97%、いっそうより好ましくは98%、最も好ましくは99%の同一性を有する。配列、例えば、アミノ酸配列の同一性を決定するための手段および方法は、本明細書の他所に記載されている。
【0064】
最も好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示されているMBDタンパク質のメチル−DNA結合ドメイン、またはHendrich and Tweedy,Trends Genet.19(2003),269−77に記載されるMBDタンパク質のメチル−DNA結合ドメインを含み、かつ、メチル化DNAと結合することができる。
【0065】
もちろん、本発明によれば、本発明のポリペプチドは好ましくは二機能性であり、好ましくは、上記のような2つのメチル−DNA結合ドメインを担持し、好ましくは両メチル−DNA結合ドメインとも単一のメチル化CpG対と結合することができる。
【0066】
本発明の特定の好ましい実施形態では、本発明のポリペプチドのメチル−DNA結合ドメインは、ヒトMBD2のものである。より特に好ましい実施形態では、メチル−DNA結合ドメインは、Genbank受託番号NM003927のアミノ酸配列の144〜230番のアミノ酸を含むヒトMBD2のものである。最も特に好ましい実施形態では、本発明のポリペプチドのメチル−DNA結合ドメインは、配列番号2(図1)に示されるアミノ酸配列の29〜115番のアミノ酸配列を含む。
【0067】
本発明のポリペプチドの成分である、抗体の「Fc部分」は、好ましくは、少なくとも、免疫グロブリン重鎖分子の定常領域の部分を含む。このFc領域は、好ましくは、定常ドメインヒンジ領域とCH2およびCH3ドメインに限定される。本発明のポリペプチドのFc領域はまた、ヒンジ領域の部分、分子間ジスルフィド橋を形成し得る部分、並びにCH2およびCH3ドメイン、またはそれらの機能的等価物に限定され得る。
【0068】
或いは、Fc部分は、本発明のポリペプチドが上記のポリペプチドの特性、特に、添付の実施例で用いられるポリペプチドの特性をなお有するのに必要な多くのCH領域を少なくとも含むことも好ましい。
【0069】
別の例では、該定常領域が、当技術分野で公知の定常領域と比較した場合に1又は複数のアミノ酸置換を含み得ることも好ましい。好ましくは、定常領域は、1〜100、1〜90、1〜80、1〜70、1〜60、1〜50、1〜40、1〜30または1〜20、より好ましくは、1〜10、いっそうより好ましくは、1〜9、1〜8、1〜7または1〜6、最も好ましくは、1〜5、1〜4、1〜3または2または1の置換を含む。比較は好ましくは、当技術分野で公知のように、またはより好ましくは、本明細書の他所に記載されているように行う。
【0070】
あるいは、該定常領域は好ましくは、少なくともCH1領域、より好ましくは、CH1およびCH2領域、最も好ましくは、CH1、CH2およびCH3領域を含む。当技術分野で公知のように、抗体の定常領域は、約110のアミノ酸からなる3つの特徴的な免疫グロブリンドメインを担持する2つの免疫グロブリン重鎖を含み、ここで、この2つの免疫グロブリン重鎖は、ジスルフィド結合により共有結合的に連結されている。特定の理論に拘束されるものではないが、メチル−DNA結合ドメインと抗体のFc部分を含む本発明の未完成ポリペプチドは、好ましくは2つのポリペプチドがそれらのFc部分において、抗体の定常領域と類似または好ましくは同一の様式で連結されて、本明細書に記載されるような二機能性ポリペプチドとなるように、宿主細胞内で折り畳まれる。
【0071】
また、この定常領域は好ましくは、ニワトリまたはカモ起源のものであり得ることが企図される。いっそう好ましくは、該定常領域は、IgM、IgA、IgDまたはIgEイソ型のものであり、より好ましくは、IgGイソ型のものであり、最も好ましくは、IgGIイソ型のものである。好ましくは、上述のイソ型は脊椎動物起源、より好ましくは、哺乳類のものであり、いっそうより好ましくは、マウス、ラット、ヤギ、ウマ、ロバ、ラクダまたはチンパンジー起源のものであり、最も好ましくは、ヒト起源のものである。好ましくは、該IgGイソ型はクラスIgG1、IgG2、IgG3、IgG4のものであり、該IgAイソ型はクラスIgA1、IgA2のものである。
【0072】
本明細書に記載されるように、本発明は好ましくは、二機能性ポリペプチドを提供する。さらにまた、本発明の1又は複数の二機能性ポリペプチドを含む多量体二機能性ポリペプチドが企図される。かかる多量体は、IgMペンタマーおよびIgAダイマーなど、通常多価であるIg分子のFc領域またはその一部を使用することによって製造することができる。J鎖ポリペプチドは、IgMペンタマーおよびIgAダイマーを形成および安定化させるのに必要であり得ると理解される。
【0073】
より好ましい実施形態では、上述の本発明のヌクレオチド配列を含む核酸分子は、
(a)配列番号1(図1)に示されるヌクレオチド配列を有する核酸配列;
(b)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸配列;
(c)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドの断片をコードするヌクレオチド配列を有する核酸配列であって、ここで、該断片が該ポリペプチドの少なくともアミノ酸130〜361番を含み、メチル化DNAと結合し得る、前記核酸配列;
(d)(a)〜(c)のいずれか1つのポリヌクレオチドによりコードされるポリペプチドの変異体をコードするヌクレオチド配列を有する核酸配列であって、該変異体において1又は複数のアミノ酸残基が該ポリペプチドに比べて置換されており、該変異体がメチル化DNAと結合し得る、前記核酸配列;
(e)(a)〜(d)のいずれか1つの核酸配列とハイブリダイズし、かつ、(a)の核酸分子のヌクレオチド配列と少なくとも65%同一であって、メチル化DNAと結合し得るポリペプチドをコードするヌクレオチド配列を有する、核酸配列;
(f)メチル化DNAと結合し得る(b)の核酸分子によりコードされるポリペプチドと少なくとも65%同一であり、かつ、メチル化DNAと結合し得るポリペプチドをコードする、ヌクレオチド配列を有する核酸配列;および
(g)(a)〜(f)のいずれか1つのポリヌクレオチドのヌクレオチド配列と縮重しているヌクレオチド配列を有する核酸分子
またはかかるポリヌクレオチドの相補鎖からなる群から選択される、ヌクレオチド配列を含む。
【0074】
上記のように、配列番号2(図1)に示されるアミノ酸配列を有する本発明のポリペプチドの断片は、配列番号2(図1)に示されるアミノ酸配列の少なくともアミノ酸130〜361番を含む。これは、該断片が、Fc部分に相当するアミノ酸130〜361の他に、該断片が非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るように1又は複数のアミノ酸を含み得ることを意味する。よって、該断片は、より好ましくは、配列番号2(図1)に示されるアミノ酸配列の少なくとも116〜361番のアミノ酸を含むと考えられる。いっそうより好ましくは、該断片は、配列番号2(図1)に示されるアミノ酸配列の少なくとも29〜115番および130〜361番のアミノ酸を含み得る。最も好ましい実施形態では、該断片は、少なくとも29〜361番のアミノ酸を含み得る。一般に、本発明のポリペプチドの断片は、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得ることが好ましい。この能力は、当技術分野で公知の方法により、または好ましくは、添付の実施例に記載されている方法によって試験することができる。
【0075】
本発明のポリペプチドの「変異体」は、該ポリペプチドと比較して1又は複数のアミノ酸残基が置換されている、好ましくは、保存的に置換されており、かつ、該変異体が好ましくは、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドを包含する。かかる変異体としては、本発明のポリペプチドの活性に全く作用がないように、当技術分野で公知の一般ルールに従って選択された欠失体、挿入体、逆位体、反復体および置換体が挙げられる。例えば、いかにして表現型的にサイレントなアミノ酸置換を作出するかに関する指針は、Bowie,Science 247:(1990)1306−1310に示されており、その中で、筆者は、アミノ酸配列の変異許容性を調べるには2つの主要な方法論があることを示している。
【0076】
第1の方法論は、進化過程での自然選択によるアミノ酸置換の許容性を利用する。異種のアミノ酸配列を比較することにより、保存されているアミノ酸を同定することができる。これらの保存されているアミノ酸はおそらくタンパク質機能に重要である。これに対し、置換が自然選択に許容されたアミノ酸位は、これらの位置がタンパク質機能には重要でないことを示す。よって、アミノ酸置換を許容する位置は、そのタンパク質の生物活性をなお維持しつつ修飾可能である。
【0077】
第2の方法論は、タンパク質機能に重要な領域を同定するために、クローニングされた遺伝子の特定の位置にアミノ酸変異を導入するような遺伝子操作を用いる。例えば、部位指定突然変異誘発またはアラニンスキャニング突然変異誘発(分子内の各残基ごとに単一のアラニン突然変異を導入する)が使用可能である(Cunningham and Wells,Science 244:(1989)1081−1085)。結果として得られた突然変異分子を次に、生物活性に関して試験することができる。
【0078】
これらの筆者らが述べているように、これら2つの方法論により、タンパク質はアミノ酸置換に驚くべき許容性を示すことが明らかになった。これらの筆者らはさらに、そのタンパク質内の特定のアミノ酸位においてどのアミノ酸変化が許容され得るかを示している。例えば、最も埋め込まれている(タンパク質の三次構造中に)アミノ酸残基は非極性側鎖を必要とするが、表面側鎖の特徴で保存されているものは一般に少ない。
【0079】
本発明は、同一性程度は低いが、本発明のポリペプチドによって遂行される1又は複数の機能を遂行するのに十分な類似性を有するポリペプチドを包含する。類似性は、保存的アミノ酸置換により決定される。かかる置換は、ポリペプチドにおけるあるアミノ酸を特徴的(例えば、化学特性)別のアミノ酸で置換するものである。Cunningham et al.(前記)によれば、かかる保存的置換は表現型的にサイレントであり得る。どのアミノ酸変化が表現型的にサイレントであり得るかに関するさらなる指針は、Bowie,Science 247:(1990)1306−1310に示されている。
【0080】
本発明の許容される保存的アミノ酸置換は、脂肪族または疎水性アミノ酸Ala、Val、LeuおよびIleの置換;ヒドロキシル残基SerおよびThrの置換;酸性残基AspおよびGluの置換;アミド残基AsnおよびGlnの置換、塩基性残基Lys、ArgおよびHisの置換;芳香族残基Phe、TyrおよびTrpの置換、並びに小型アミノ酸Ala、Ser、Thr、MetおよびGlyの置換を含む。
【0081】
さらに、本発明はまた、下表に示される保存的置換も包含する。
【0082】
【表3】

【0083】
上記の使用の他、かかるアミノ酸置換はまた、タンパク質またはペプチドの安定性も高め得る。本発明は、例えば、そのタンパク質またはペプチド配列内に1又は複数の非ペプチド結合を(ペプチド結合に取って代わる)を含むアミノ酸置換を包含する。また、天然のL−アミノ酸以外のアミノ酸残基、例えば、D−アミノ酸または非天然若しくは合成アミノ酸、例えば、βまたはγアミノ酸を含む置換も含まれる。
【0084】
同一性および類似性とも、次の刊行物:Computational Molecular Biology,Lesk,A.M.,ed.,Oxford University Press,New York,1988;Biocomputing:Infoliuaties and Genome Projects,Smith,DM.,ed.,Academic Press,New York,1993;Informafies Computer Analysis of Sequence Data,Part 1,Griffin,A.M.,and Griffin,H.G.,eds.,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academie Press,1987;およびSequence Analysis Primer,Gribskov,M.and Devereux,eds.,M Stockton Press,New York,1991を参照すれば、容易に算出することができる。
【0085】
上記のように、本発明は好ましくはまた、配列番号1に示される核酸配列、本明細書に記載されるようなその断片または変異体(図1)とハイブリダイズし、かつ、配列番号1に示される核酸配列(図1)と少なくとも65%同一であり、かつ、好ましくは、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドをコードする核酸配列に関する。
【0086】
また、記載されるように、本発明は、好ましくは、配列番号2に示されるポリペプチドと少なくとも65%、より好ましくは、70%、75%、80%、85%、90%、より好ましくは、99%同一であるポリペプチドをコードする核酸配列に関する。
【0087】
本発明に従って用いる場合「ハイブリダイズする」とは、好ましくは、ストリンジェント条件下でのハイブリダイゼーションに関する。「ハイブリダイズする配列」とは、好ましくは、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドをコードする、上記のような核酸配列と少なくとも65%、いっそうより好ましくは、少なくとも70%、特に好ましくは、少なくとも80%、より特に好ましくは、少なくとも90%、いっそうより特に好ましくは、少なくとも95%、最も好ましくは、少なくとも97、98%または99%の配列同一性を示す配列を指す。
【0088】
該ハイブリダイゼーション条件は、例えば、Sambrook,Russell “Molecular Cloning,A Laboratory Manual”,Cold Spring Harbor Laboratory,N.Y.(2001); Ausubel,“Current Protocols in Molecular Biology”,Green Publishing Associates and Wiley Interscience,N.Y.(1989)、またはHiggins and Hames(Eds.)“Nucleic acid hybridization,a practical approach”IRL Press Oxford,Washington DC,(1985)に記載されている従来のプロトコールに従って確立することができる。
【0089】
条件の設定は十分当業者の技術の範囲内であり、当技術分野に記載のプロトコールに従って決定することができる。よって、特異的にハイブリダイズする配列だけの検出は、通常、0.1×SSC、0.1%SDS、65℃などのストリンジェントなハイブリダイゼーションおよび洗浄条件を必要とする。相同な、または厳密にではないが相補的な配列の検出のための非ストリンジェントハイブリダイゼーション条件は、6×SSC、1%SDS、65℃に設定することができる。
【0090】
周知のように、プローブの長さ、および判定される核酸の組成も、ハイブリダイゼーション条件のさらなるパラメーターとなる。上記の条件の変更は、ハイブリダイゼーション試験においてバックグラウンドを抑えるために用いられる択一的遮断試薬の包含および/または置換によって行い得ることに留意する。
【0091】
典型的な遮断試薬としては、デンハートの試薬、BLOTTO、ヘパリン、変性サケ精子DNA、および市販の専売製剤が挙げられる。特定の遮断試薬を含めると、適合性の問題から上記のハイブリダイゼーション条件の変更が必要となる場合がある。ハイブリッドする核酸分子はまた、上記の分子の断片を含む。このような断片は本明細書に記載されるような核酸配列を表し得る。さらに、上述の核酸分子のいずれかとハイブリダイズする核酸分子はまた、これらの分子の相補的断片、誘導体および対立遺伝子変異体を含む。さらにまた、ハイブリダイゼーション複合体は、相補的なG塩基とC塩基の間、また、相補的なA塩基とT塩基の間の水素結合の形成による、2つの核酸配列間の複合体を指し、これらの水素結合は塩基スタッキング相互作用によりさらに安定化され得る。
【0092】
この2つの相補的核酸配列において、水素結合は逆平行の形である。ハイブリダイゼーション複合体は液相中(例えば、CotまたはRot分析)、または液相に存在するある核酸配列と固相支持体(例えば、細胞が固定化されている膜、フィルター、チップ、ピンまたはスライドガラス)上に固定化された別の核酸配列との間で形成され得る。相補的または相補性とは、許容される塩および温度条件下での、塩基対合によるポリヌクレオチドの自然結合を指す。例えば、配列「A−G−T」は、相補的配列「T−C−A」と結合する。2つの一本鎖分子間の相補性は、いくつかの核酸だけが結合する「部分的」なものであってもよいし、或いは一本鎖分子間に全体的な相補性が存在する場合には完全なものであり得る。核酸鎖間の相補性の程度は、核酸鎖間のハイブリダイゼーション効率および強度に有意な影響を及ぼす。これは、核酸鎖間の結合に依存する増幅反応において特に重要である。
【0093】
本発明によれば、2以上の核酸配列またはアミノ酸配列に関して「同一」または「同一性%」とは、当技術分野で公知の配列比較アルゴリズムを用いて、または手動の整列と目視検査により、ある比較枠にわたって、または所定の領域にわたって最大一致が得られるように比較および整列した場合に、同じであるか、または同じであるアミノ酸残基またはヌクレオチドの特定のパーセンテージを有する(例えば、少なくとも65%同一、好ましくは、少なくとも70〜95%同一、より好ましくは、少なくとも95%、96%、97%、98%または99%同一の)複数の配列または部分配列を指す。例えば、65%〜95%またはそれを超える配列同一性を有する配列は、実質的に同一であるとみなされる。かかる定義はまた、試験配列の相補物に対しても当てはまる。好ましくは、記載されている同一性は、少なくとも約232アミノ酸長または696ヌクレオチド長の領域にわたって存在する。当業者ならば、当技術分野で公知のように、例えば、CLUSTALWコンピュータープログラム(Thompson Nucl.Acids Res.2(1994),4673−4680)またはFASTDB(Brutlag Comp.App.Biosci.6(1990),237−245)に基づくものなどのアルゴリズムを用い、配列間の同一性%をどのようして決定すればよいかが分かるであろう。
【0094】
FASTDBアルゴリズムは一般に、配列中の内部の不一致欠失または付加、すなわち、ギャップを計算に入れないが、これは手作業で補正を行い、同一性%の過剰見積を避けることができる。しかしながら、CLUSTALWでは、その同一性計算において配列ギャップを考慮に入れる。また、BLASTおよびBLAST2.0アルゴリズム(Altschul Nucl.Acids Res.25(1977),3389−3402)の当業者に利用可能である。核酸配列用のBLASTNプログラムはデフォルトとして、ワードレングス(W)11、期待値(E)10、M=5、N=4、および両鎖比較を用いる。アミノ酸配列に関して、BLASTPプログラムは、デフォルトとして、ワードレングス(W)3、および期待値(E)10を用いる。BLOSUM62スコアリングマトリクス(Henikoff Proc.Natl.Acad.Sci.,USA,89,(1989),10915)では、整列値(B)50、期待値(E)10、M=5、N=4、および両鎖比較を用いる。
【0095】
例えば、基本的局所配列ツールを表すBLAST2.0(Altschul,Nucl.Acids Res.25(1997),3389−3402;Altschul,J.Mol.Evol.36(1993),290−300;Altschul,J.Mol.Biol.215(1990),403−410)は、局所配列の整列に関して検索するために使用することができる。BLASTは、配列の類似性を判定するためにヌクレオチド配列とアミノ酸配列の双方の整列を行う。整列の局所性のため、BLASTは正確な一致の判定または類似配列の同定に特に有用である。BLASTアルゴリズム出力の基本単位は、高スコア断片対(HSP)である。HSPは、その整列が局所的に最大になり、その整列スコアがユーザーにより設定された閾値スコアまたはカットオフスコアに一致するか、またはそれを超える、任意の、しかし、同じ長さの2つの配列断片からなる。BLASTアプローチは、問い合わせ配列とデータベース配列の間でHSPを探し、見出された一致の統計学的有意性を評価し、さらにユーザーが選択した有意な閾値を満たす一致だけを報告する。パラメーターEは、データベース配列の一致を報告するための統計学的に有意な閾値を設定するものである。Eは、全データベース検索の範囲内で、HSP(またはHSPセット)の機会の期待頻度の上限として説明される。その一致がEを満たすデータベース配列が、このプログラムの出力として報告される。
【0096】
BLAST(Altschul(1997),前掲;Altschul(1993),前掲;Altschul(1990),前掲)を用いる類似のコンピューター技術が、GenBankまたはEMBLなどのヌクレオチドデータベースにおいて同一または関連の分子を検索するために用いられる。この分析は、膜に基づくハイブリダイゼーションを何回も行うより、はるかに迅速である。さらに、このコンピューター検索の感度を改良すれば、特定の一致が正確なものとして分類されるか、類似のものとして分類されるかを判定することができる。
【0097】
この検索の基本は、
【化1】

として定義される解であり、2配列間の類似性の程度および配列一致の長さの双方も考慮に入れる。
【0098】
例えば、解が40であれば、その一致は1〜2%の誤差内で正確であり、70であれば、その一致は正確である。類似分子は通常、15〜40の間の解を示すものを選択することにより同定され、それより低いスコアは関連分子を識別し得る。
【0099】
さらに、本発明はまた、その配列が上記の核酸分子の配列と比較して縮重している核酸分子に関する。本発明に従って用いる場合、「遺伝コードの結果として縮重している」とは、遺伝コードの重複により、異なるヌクレオチド配列が同じアミノ酸をコードすることを意味する。
【0100】
もちろん、本発明はまた、上述および後述の核酸分子が一本鎖型であり得る場合は、それらに対する相補鎖も考慮する。
【0101】
好ましくは、本発明の核酸分子はいずれの種類の核酸であってもよく、例えば、DNA、ゲノムcDNA、cDNA、RNAまたはPNA(ペプチド核酸)である。
【0102】
本発明の目的では、ペプチド核酸(PNA)はポリアミド型のDNA類似体であり、アデニン、グアニン、チミンおよびシトシンのモノマー単位は市販されている(Perceptive Biosystems)。リン、酸化リン、またはデオキシリボース誘導体などのDNAの特定の成分がPNAには存在しない。Nielsen et al.,Science 254:1497(1991);およびEgholm et al.,Nature 365:666(1993)により開示されているように、PNAは相補的DNA鎖と特異的かつ強固に結合し、ヌクレアーゼにより分解されない。実際、PNAは、DNAそれ自体よりもDNAと強く結合する。これはおそらくは、これら2鎖間に静電気的な反発がなく、また、そのポリアミド主鎖がより柔軟であるためである。このため、PNA/DNA二重らせんは、DNA/DNA二重らせんよりも広範なストリンジェンシー条件下で結合し、複合体のハイブリダイゼーションの遂行をより容易にする。強い結合のため、DNAの場合よりも短いプローブが使用できる。さらに、PNA/DNAハイブリダイゼーションを用いれば、単一塩基の不一致が判定できる可能性が高いが、これは、PNA/DNA15マーの単一の不一致が融点(Tm)を8℃〜20℃引き下げるためである(これに対し、DNA/DNA15マー二重らせんの場合は4℃〜16℃)。また、PNAに荷電基が存在しないことは、低イオン強度でハイブリダイゼーションを行うことができ、分析中、塩による干渉の可能性が小さくなることを意味する。
【0103】
このDNAは例えば、ゲノムDNAまたはcDNAであってもよい。RNAは例えば、mRNAであってもよい。核酸分子は天然、合成または半合成であってもよいし、或いはペプチド核酸(Nielsen,Science 254(1991),1497−1500)またはホスホロチオエートなどの誘導体であってもよい。さらに、この核酸分子は、上述の核酸分子のいずれかを単独または組み合わせて含む、組み換え産生されたキメラ核酸分子であってもよい。
【0104】
好ましくは、本発明の核酸分子はベクターの一部である。よって、本発明は、もう1つの実施形態において、本発明の核酸分子を含むベクターに関する。このようなベクターは、例えば、プラスミド、コスミド、ウイルス、バクテリオファージ、または遺伝子工学において通常用いられているその他のベクターであってよく、好適な宿主細胞において、好適な条件下で該ベクターの選択および/または複製を可能とするマーカー遺伝子などのさらなる遺伝子を含んでもよい。好ましい実施形態では、該ベクターは、本発明の核酸分子が、本明細書に記載されるような原核生物または真核生物宿主細胞において発現を可能とする発現制御配列に作動可能なように連結されている、発現ベクターである。本明細書において「作動可能なように連結される」とは、1又は複数の発現制御配列と発現させるポリヌクレオチドのコード領域の間における、その発現制御配列と適合する条件下で発現が遂行されるような連結を指す。
【0105】
よって、本発明の核酸分子は、いくつかの市販のベクター中に挿入することができる。非限定的な例としては、pUC、pBluescript(Stratagene)、pET(Novagen)、pREP(Invitrogen)、pCRTopo(Invitrogen)、pcDNA3(Invitrogen)、pCEP4(Invitrogen)、pMC1 neo(Stratagene)、pXT1(Stratagene)、pSG5(Stratagene)、EBO−pSV2neo、pBPV−1、pdBPVMMTneo、pRSVgpt、pRSVneo、pSV2−dhfr、pUCTag、plZD35、pLXINおよびpSIR(Clontech)並びにplRES−EGFP(Clontech)などの、哺乳類細胞に適合するプラスミドベクターが挙げられる。好ましくは、本発明の核酸分子は、ベクターSignal plG plus(Ingenius,R&D Systems)に挿入される。pBlueBac、BacPaczバキュロウイルス発現系(CLONTECH)、およびMaxBacTMバキュロウイルス発現系,昆虫細胞およびプロトコール(Invitrogen)などのバキュロウイルスベクターが市販されており、生物学的に活性なタンパク質を高収率で産生するために用い得る(また、Miller(1993),Curr.Op.Genet.Dev.,3,9;O’Reilly,Baculovirus Expression Vectors:A Laboratory Manual,p.127も参照)。さらに、pcDNA2などの原核生物ベクター、およびpYes2などの酵母ベクターが、本発明と共に用いるのに好適な他のベクターの限定されない例である。
【0106】
本願の他の好ましい発現ベクターは、InvitrogenのDES(登録商標)シリーズなど、当技術分野で周知のショウジョウバエ細胞でタンパク質を発現させるためのものがある。好ましくは、該ショウジョウバエ細胞発現ベクターはpMTBiP/V5−His B(Invitrogen)である。このpMT/BiP/V5−Hisベクターは、次のような付加的な特徴を提供する。このベクターは、DNA収率を向上させ、サブクローニング効率を高めるために小型(3.6kb)であり、抗V5抗体を用いた迅速検出のためのC末端V5エピトープタグを有し、ニッケルキレート樹脂を用いた組み換え融合タンパク質の簡単な精製のためのC末端6xHisタグを有する。
【0107】
ベクター修飾技術に関しては、Sambrook and Russel(2001),前掲を参照すること。ベクターはクローニングまたは発現のための1又は複数の複製および遺伝系、宿主における選択のための1又は複数のマーカー(例えば、抗生物質耐性)、および1又は複数の発現カセットを含む。
【0108】
該ベクターに挿入されるコード配列は、標準的な方法により合成するか、天然源から単離するか、またはハイブリッドとして調製することができる。これらのコード配列と転写調節エレメント(例えば、プロモーター、エンハンサーおよび/またはインスレーター)との、および/または他のアミノ酸コード配列との連結は、確立された方法を用いて行うことができる。
【0109】
さらに、これらのベクターは、本発明の核酸配列の他、好適な宿主内でコード領域の適切な発現を可能とする発現制御エレメントを含む。かかる制御エレメントは当業者には既知であり、プロモーター、翻訳開始コドン、翻訳および挿入部位、挿入部をベクターに導入するための内部リボソームエントリー部位(IRES)(Owens,Proc.Natl.Acad.Sci.USA 98(2001),1471−1476)を含み得る。好ましくは、本発明の核酸分子は、真核細胞または原核細胞での発現を可能とする当該発現制御配列と作動可能なように連結されている。
【0110】
真核細胞および原核細胞での発現を保証する制御エレメントは当業者には周知である。上述のように、これらの制御エレメントは通常、転写の開始を保証する調節配列、並びに任意選択の、転写の終結と転写物の安定化を保証するポリ−Aシグナルを含む。さらなる調節エレメントとしては、転写エンハンサー並びに翻訳エンハンサー、および/または自然状態で会合している、または異種のプロモーター領域を含み得る。例えば哺乳類宿主細胞での発現を可能とする、あり得る調節エレメントとしては、CMV−HSVチミジンキナーゼプロモーター、SV40、RSV−プロモーター(ラウス肉腫ウイルス)、ヒト延長因子1α−プロモーター、CMVエンハンサー、CaM−キナーゼプロモーターまたはSV40−エンハンサーを含む。
【0111】
原核細胞での発現に関しては、例えば、tac−lac−プロモーター、lacUV5またはtrpプロモーターをはじめとする多数のプロモーターが記載されている。このような調節エレメントは、転写の開始を担うエレメントの他、当該ポリヌクレオチドの下流に、SV40−ポリ−A部位またはtk−ポリ−A部位などの転写終結シグナルも含み得る。これに関しては、Okayama−Berg cDNA発現ベクターpcDV1(Pharmacia)、pRc/CMV、pcDNA1、pcDNA3(In−Vitrogene,とりわけ、添付の実施例において用いられる)、pSPORT1(GIBCO BRL)またはpGEMHE(Promega)、またはラムダgt11などの原核生物発現ベクターといった好適な発現ベクターは当技術分野で公知である。
【0112】
本発明の発現ベクターは、本発明の核酸のおよびタンパク質の、少なくとも複製、および好ましくは発現を命令することができる。好適な複製起点としては、例えば、Col E1、SV40ウイルスおよびM13複製起源が挙げられる。好適なプロモーターとしては、例えば、サイトメガロウイルス(CMV)プロモーター、lacZプロモーター、gal 10プロモーターおよびオートグラファ・カリフォルニカ(Autographa californica)核多角体ウイルス(AcMNPV)多角体プロモーターが挙げられる。好適な終結配列としては、例えば、ウシ成長ホルモン、SV40、lacZおよびAcMNPV多角体ポリアデニル化シグナルが挙げられる。選択マーカーの例としては、ネオマイシン、アンピシリン、およびハイグロマイシン耐性などが挙げられる。特殊設計ベクターは、細菌−酵母、または細菌−動物細胞、または細菌−真菌細胞、または細菌−無脊椎動物細胞など、異なる宿主細胞間のDNAのシャッフルを可能とする。
【0113】
該ベクターは、本発明の核酸分子の他、分泌シグナルをコードする核酸配列をさらに含み得る。本発明のポリペプチドがショウジョウバエ細胞、好ましくは、ショウジョウバエS2細胞で発現される場合、本発明に従って好ましい使用される本発明の分泌シグナルは、当技術分野で周知のDrosophila BiP分泌シグナルである。本発明において使用される好ましいBiP分泌シグナルは、配列番号2の1〜28番のアミノ酸配列で示される。他の分泌シグナル配列も当業者に周知である。
【0114】
さらに、使用する発現系に応じ、発現したポリペプチドをある細胞コンパートメントに向けることができるリーダー配列を、本発明の核酸分子のコード配列に付加してもよく、これも当技術分野で周知である。当該リーダー配列は、翻訳開始および終結配列、並びに好ましくは、翻訳されたタンパク質またはその一部の、とりわけ細胞外の膜への分泌を命令し得るリーダー配列と適当な位相で組み立てる。所望により、異種配列は、所望の特徴、例えば、発現した組み換え産物の安定化または簡単な精製を付与するCまたはN末端識別ペプチドを含む融合タンパク質をコードすることができる。ひと度ベクターが適当な宿主に組み込まれると、宿主は当該ヌクレオチド配列の高レベル発現に好適な条件下で維持され、所望により、その後、本発明のタンパク質、抗原性断片または融合タンパク質の回収および精製を行うことができる。もちろん、当該ベクターはまた、病原生物由来の調節領域も含むことができる。
【0115】
さらに、当該ベクターは、発現ベクターの他、遺伝子導入および/または遺伝子標的化ベクターであってもよい。治療遺伝子(例えば、ワクチン用)をex vivoまたはin vivo技術により細胞へ導入することに基づく遺伝子療法は、遺伝子導入の最も重要な適用の1つである。in vitroまたはin vivo遺伝子療法のための好適なベクター、ベクター系および方法は文献に記載されており、当業者に公知である;例えば、Giordano,Nature Medicine 2(1996),534−539;Schaper,Circ.Res.79(1996),911−919;Anderson,Science 256(1992),808−813,Isner,Lancet 348(1996),370−374;Muhlhauser,Circ.Res.77(1995),1077−1086;Wang,Nature Medicine 2(1996),714−716;WO94/29469;WO97/00957;Schaper,Current Opinion in Biotechnology 7(1996),635−640またはVerma,Nature 389(1997),239−242およびその中に引用されている参照文献を参照すること。
【0116】
本発明の核酸分子および本明細書で上記されたベクターは、細胞へ直接導入するよう、またはリポソーム若しくはウイルスベクター(例えば、アデノウイルス、レトロウイルス)を介して導入するように設計することができる。さらに、バキュロウイルス系、またはワクシニアウイルス若しくはセムリキ森林ウイルスに基づく系を、本発明の核酸分子のための真核生物発現系として使用することもできる。組み換え産生の他、本発明のタンパク質断片、融合タンパク質、または抗原性断片を、固相技術を用いた直接的ペプチド合成によって産生させてもよい(Stewart et al.(1969)Solod Phase Peptide Synthesis;Freeman Co,San Francisco;Merrifield,J.Am.Chem.Soc.85(1963),2149−2154参照)。in vitroタンパク質合成は、手動法を用いて、または自動法により行うことができる。自動合成は、例えば、Applied Biosystems 431A Peptide Synthesizer(Perkin Elmer,Foster City CA)を、製造業者が提供している説明書に従って用いて行うことができる。様々な断片を別個に化学合成し、化学法を用いて化合し、全長分子を作製することができる。
【0117】
本発明はさらに、本発明の核酸分子または本発明のベクターで遺伝的に操作された宿主細胞に関する。当該宿主は、該ベクターまたはヌクレオチド配列を宿主細胞に導入することにより作出され、その際、その細胞におけるその存在が、本発明のヌクレオチド配列によりコードされるか、または本発明のヌクレオチド配列若しくはベクター(なお、このヌクレオチド配列および/またはコードされるポリペプチドは宿主細胞に対して外来である)を含むタンパク質の発現を媒介する。
【0118】
「外来」とは、そのヌクレオチド配列および/またはコードされるポリペプチドが宿主に対して異種である(これは、異なるゲノムバックグラウンドを有する細胞または生物に由来することを意味する)か、または宿主と同種であるが、該ヌクレオチド配列の天然に存在する対象物とは異なるゲノム環境にあることを意味する。これは、当該ヌクレオチド配列が宿主と同種である場合に、当該宿主のゲノムにおける本来の位置にはないこと、特に、異なる遺伝子に囲まれていることを意味する。この場合、該ヌクレオチド配列はその固有のプロモーターの制御下にあっても異種プロモーターの制御下にあってもいずれでもよい。導入された核酸分子またはベクターの位置は、当業者ならば、当業者に周知の方法、例えばサザンブロット法を用いることで決定することができる。 宿主中に存在する本発明のベクターまたはヌクレオチド配列は宿主のゲノムに組み込まれても何らかの形で染色体外で維持されてもいずれでもよい。これに関し、本発明のヌクレオチド配列は、相同組換えにより突然変異遺伝子を復帰または作出するために使用することができる。
【0119】
該宿主はいずれの原核細胞または真核細胞であってもよい。好適な原核細胞/細菌細胞は一般に、大腸菌(E.coli)、ネズミチフス菌(Salmonella typhimurium)、レイ菌(Serratia marcescens)または枯草菌(Bacillus subtilis)のようなクローニングに使用されているものである。該真核生物宿主は哺乳類細胞、両生類細胞、魚類細胞、昆虫細胞、真菌細胞、植物細胞または細菌細胞(例えば、大腸菌株HB101、DH5a、XL1 Blue、Y1090およびJM101)であり得る。真核組み換え宿主細胞が好ましい。真核宿主細胞の例としては、限定されるものではないが、酵母、例えば、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポムベ(Schizosaccharomyces pombe)、クルイベロミセス・ラクチス(Kluyveromyces lactis)またはピキア・パストリス(Pichia pastoris)細胞、ヒト、ウシ、ブタ、サルおよび齧歯類起源の細胞系統、並びに限定されるものではないが、ヨトウガ(Spodoptera frugiperda)昆虫細胞をはじめとする昆虫細胞、およびゼブラフィッシュ細胞が挙げられる。
【0120】
しかしながら、ショウジョウバエ細胞が好ましい。より好ましくは、該ショウジョウバエ細胞は、好ましくはショウジョウバエ発現系、例えば、Drosophila Expression System(DES(登録商標))において異種タンパク質発現に使用されるドロソフィラS2(ATCC CRL−1963)である。該S2細胞系統は、後期(20〜24時間齢)のキイロショウジョウバエ(Drosophila melanogaster)胚の一次培養物に由来するものであった。この可変細胞系統はCO2を含まない室温で急速に増殖し、容易に懸濁培養に適合する。一般に、本発明のポリペプチドを発現させる際には昆虫細胞が好ましいが、これはそれらがメチル化DNAを少ししか含まない、または好ましくは全く含まないという利点を有するからである。よって、本発明のポリペプチドを発現および単離、および好ましくは精製する場合、当該ポリペプチドは好ましくは、当該ポリペプチドが優先的に結合することができるメチル化DNAを混入していない。昆虫細胞を使用することのもう1つの利点は、昆虫細胞がタンパク質フリー培地で好ましく増殖し、よって、当該ポリペプチドが該培養培地に好ましく分泌される場合、好ましくは培養培地から本発明のポリペプチドを単離、回収および/または精製する際に、本発明のポリペプチドのさらなる混入が最小となるということである。
【0121】
使用に好適な、かつ、市販されている哺乳類種由来細胞系統としては、限定されるものではないが、L細胞、CV−1細胞、COS−1細胞(ATCC CRL 1650)、COS−7細胞(ATCC CRL 1651)、HeLa細胞(ATCC CCL 2)、C1271(ATCC CRL 1616)、BS−C−1(ATCC CCL 26)およびMRC−5(ATCC CCL 171)が挙げられる。
【0122】
もう1つの実施形態では、本発明は、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドを産生する方法であって、本発明の宿主細胞を培養すること、および産生されたポリペプチドを回収することを含む方法に関する。当該ポリペプチドは好ましくは、本発明の核酸分子によりコードされる。本発明のポリペプチドを産生するための好ましい方法は実施例2に記載されている。
【0123】
本発明はまた、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得る本発明のポリペプチドを発現し得る細胞を作出する方法であって、当技術分野で公知の方法により、または本明細書に記載されている方法により、in vitroで細胞を遺伝的に操作することを含む方法も提供する。当該ポリペプチドは好ましくは、本発明の核酸分子によりコードされる。当技術分野では、適当な宿主内でポリペプチドを産生するための多くの好適な方法が存在する。宿主が単細胞生物または哺乳類若しくは昆虫細胞である場合、当業者ならば、様々な培養条件に目を向けることができ、これらの培養条件は、余計な検討を行わずとも、さらに至適化することができる。便宜には、産生されたタンパク質を培養培地から、または単離した(生物学的)膜から、確立された技術によって採取する。さらに、産生されたポリペプチドは直接宿主細胞から単離してもよい。
【0124】
本発明のポリペプチドは、微生物学的方法またはトランスジェニック哺乳類により産生させてもよい。また、本発明のポリペプチドはトランスジェニック植物から回収することも企図される。或いは、本発明のポリペプチドは合成または半合性的に産生させることもできる。
【0125】
例えば、Houghton Proc.Natl.Acad.Sci.USA(82)(1985),5131−5135により記載されている固相法などの化学的合成を使用することができる。もう1つの方法は、mRNAのin vitro翻訳である。好ましい方法は、上記のような宿主細胞内でのタンパク質の組み換え産生を含む。例えば、本発明のヌクレオチド配列のいずれか1つの全体または一部を含む核酸配列をPCRにより合成し、発現ベクターに挿入し、宿主細胞を当該発現ベクターで形質転換させることができる。その後、当該宿主細胞を培養して所望のポリペプチドを産生させ、単離および精製する。
【0126】
タンパク質の単離および精製は、例えば、限定されるものではないが、イオン交換クロマトグラフィー、ゲル濾過クロマトグラフィーおよびアフィニティークロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相HPLC、分取ディスクゲル電気泳動など、いくつかの既知の技術のいずれか1つにより達成することができる。さらに、無細胞翻訳系を用いて本発明のポリペプチドを産生させることもできる。本発明において使用するのに好適な無細胞発現系としては、ウサギ網赤血球溶解物。麦芽抽出物、イヌ膵臓ミクロソーム膜、大腸菌S30抽出物、およびTNT系(Promega)などの転写/翻訳複合系が挙げられる。
【0127】
これらの系は、コード領域と適当なプロモーターエレメントを含むクローニングベクター、DNA断片、またはRNA配列を付加した際に、組み換えポリペプチドまたはペプチドの発現を可能とする。上述のように、タンパク質の単離/精製技術は、常法を用いた本発明のタンパク質の修飾を必要とすることがある。例えば、ニッケルカラムでの精製が可能となるように、当該タンパク質にヒスチジンタグを付加することができる。他の修飾はより高い若しくはより低い活性を生じたり、より高いレベルのタンパク質産生を可能としたり、またはタンパク質の精製を簡単にしたりすることができる。本発明のポリペプチドが産生された後、ペグ化、誘導体化などにより修飾することもできる。
【0128】
もう1つの実施形態では、本発明は、本発明のポリペプチドと特異的に結合する抗体に関する。好ましくは、当該ポリペプチドは、メチル化DNAと結合する能力を有し、本明細書に記載されるような二機能性タンパク質である。本明細書において「特異的に」とは、当該抗体は本発明のポリペプチドと反応するが、当該ポリペプチドの一部だけ、例えば、メチル−DNA結合ドメイン、Fc部分またはリーダー若しくは分泌配列とは反応しないことを意味する。しかしながら、当該抗体は、本発明のポリペプチドのポリペプチドリンカー(そのようなポリペプチドリンカーが存在すれば)と特異的に結合することができる。
【0129】
よって、当該抗体は、例えば、本発明のポリペプチドのメチル−DNA結合ドメインおよびFc部分、またはメチル−DNA結合ドメインおよびリンカーポリペプチドの部分、またはリンカーポリペプチドの部分およびFc部分と、または上述のように、リンカーポリペプチドとのみ特異的に結合する。当該抗体が本発明の上記で定義されたように特異的に反応するかどうかは、とりわけ、当該抗体の結合反応を上述のような部分と、また、本発明のポリペプチドの個々の部分のみと比較することにより、容易に調べることができる。
【0130】
本発明の抗体は、例えば、ポリクローナルまたはモノクローナルであり得る。「抗体」とはまた、結合特異性をなお保持しているその誘導体または断片も含む。抗体産生のための技術は当技術分野で周知であり、例えば、Harlow and Lane“Antibodies,A Laboratory Manual”,CSH Press,Cold Spring Harbor,1988に記載されている。これらの抗体は、例えば、本発明のポリペプチドの免疫沈降法および免疫学的局在決定法に、また、例えば、組み換え生物における、または診断法におけるこのようなポリペプチドの存在のモニタリングに使用することができる。これらの抗体はまた、本発明のタンパク質と相互作用する化合物を同定するために使用することもできる(本明細書に後述する)。例えば、BIAcore系に用いられるような表面プラズモン共鳴を使用すれば、本発明のポリペプチドのエピトープと結合するファージ抗体の効率を高めることができる(Schier,Human Antibodies Hybridomas 7(1996),97−105;Malmborg,J.Immunol.Methods 183(1995),7−13)。
【0131】
本発明はさらに、キメラ抗体、単鎖抗体およびヒト化抗体、並びにとりわけFab断片のような抗体断片を含む。抗体断片または誘導体はさらに、F(ab’)2、FvまたはscFv断片を含む;例えば、Harlow and Lane前掲参照のこと。様々な手法が当技術分野で知られており、このような抗体および/または断片の作成に使用することができる。よって、当該(抗体)誘導体は、ペプチドミメティクスにより産生させることができる。さらに、単鎖抗体の産生に関して記載されている技術(とりわけ、米国特許第4,946,778号参照)を、本発明のポリペプチドに対する単鎖抗体を作出するために適合させることもできる。また、トランスジェニック動物を用いて、本発明のポリペプチドに対するヒト化抗体を発現させることもできる。最も好ましくは、本発明の抗体はモノクローナル抗体である。モノクローナル抗体の作製のためには、連続細胞培養系により産生される抗体を提供するいずれの技術を用いてもよい。このような技術の例としては、ハイブリドーマ技術(Kohler and Milstein Nature 256(1975),495−497)、トリオーマ技術、ヒトB細胞ハイブリドーマ技術(Kozbor,Immunology Today 4(1983),72)およびヒトモノクローナル抗体を産生するためのEBV−ハイブリドーマ技術(Cole et al.,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,Inc.(1985),77−96)が挙げられる。
【0132】
単鎖抗体(例えば、米国特許第4,946,778号)の産生を記載している技術は、上記のような免疫原性ポリペプチドに対する単鎖抗体を産生するために適合させることができる。さらに、トランスジェニックマウスを用いて、該免疫原性ポリペプチドに対するヒト化抗体を発現させてもよい。本発明に従って使用される、または細胞内で発現させることができる、抗体/抗体構築物並びに抗体断片または誘導体が特に好ましい。これは、とりわけ、対応するタンパク質分子の直接注入、または対応するタンパク質分子をコードする核酸分子の注入によって達成され得る。さらに、遺伝子療法アプローチも企図される。よって、本発明において、「抗体分子」とは、完全な免疫グロブリン分子並びにこのような免疫グロブリン分子の一部に関する用語である。
【0133】
さらに、この用語は、上述のように、キメラ抗体およびヒト化抗体のような修飾および/または変更された抗体分子に関する。この用語はまた、モノクローナルまたはポリクローナル抗体並びに組み換え若しくは合成によって生成/合成された抗体に関する。この用語はまた、無傷な抗体、並びに分離された軽鎖および重鎖、Fab、Fab/c、Fv、Fab’、F(ab’)2のようなその抗体断片に関する。「抗体分子」という用語はまた、単鎖Fvs(scFv)または抗体−融合タンパク質のような二機能性抗体および抗体構築物も含む。本発明では、「抗体」という用語が、細胞内で発現され得る抗体構築物、例えば、とりわけウイルスまたはベクターを介してトランスフェクトおよび/または形質導入され得る抗体構築物を含むことが企図される。もちろん、本発明の抗体は、本発明のポリペプチドのFc部分との関連で本発明で上記したように、検出可能な物質とカップリング、連結または接合させることができる。
【0134】
本発明はまた、本発明の核酸分子、ベクター、宿主細胞、ポリペプチドまたは抗体を含む組成物も提供する。
【0135】
本発明において「組成物」とは、上述の化合物の少なくとも1つを含む組成物に関する用語である。本発明で後述される本発明の組成物は、上述の化合物をいずれかの組合せで含むと考えられる。所望により、該組成物は、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得る分子をさらに含んでもよい。該組成物は固体、液体、または気体であってもよく、とりわけ、粉末、錠剤、溶液、エアゾール、顆粒剤、丸剤、懸濁液、エマルション、カプセル剤、シロップ剤、液剤、エリキシル剤、抽出物、チンキ状若しくは液状抽出物、または経口若しくは非経口若しくは局所投与に特に好適な形態であってもよい。
【0136】
さらに、本発明は、本発明の核酸分子、ベクター、宿主、ポリペプチドまたは抗体を含むキットに関する。有利には、本発明のキットはさらに、所望により、反応バッファー、保存溶液および/または科学的アッセイ若しくは診断アッセイなどの実施に必要な残りの試薬または材料を含む。さらにまた、本発明のキットの部分は、バイアルまたは瓶に個々にパッケージングすることもできるし、或いは容器または複数容器単位に組み合わせてパッケージングすることもできる。
【0137】
本発明のキットは、とりわけ、本明細書に記載されるようにメチル化DNAを単離、富化、精製および/または検出する方法を実施するために有利に使用することができ、かつ/または本明細書において、例えば、診断キット、研究ツールまたは治療ツールと呼ばれる様々な適用に使用することができる。さらに、本発明のキットは、科学目的、医学目的および/または診断目的に好適な検出のための手段を含み得る。当該キットの製造は、好ましくは、当業者に公知の標準的な手順に従う。
【0138】
上記のように、本発明は、メチル−DNA結合ドメインと抗体のFc部分を含む二機能性抗体様分子が、メチル化DNA、好ましくは、CpGメチル化DNAと、高親和性および高結合力で特異的に結合することができ、これにより、サンプル中に10ngを超える量、10ng未満、7.5ng未満、5ng未満、2.5ng未満、または約1ngからメチル化DNAを単離、富化および/または検出するための好適な診断ツールとなるという、驚くべき発見に基づくものである。
【0139】
よって、好ましい実施形態では、本発明の組成物は、所望により検出に好適な手段をさらに含む診断用組成物である。本発明のさらなる実施形態は、メチル化DNAの検出のための本発明のポリペプチドの使用である。
【0140】
さらに、本発明の核酸分子、ポリペプチド、ベクター、宿主細胞または抗体は、メチル化DNAを検出することを目的とした診断用組成物の製造のために使用される。
【0141】
さらに、本発明の核酸分子、ポリペプチド、ベクター、宿主細胞または抗体は、腫瘍組織または腫瘍細胞の検出を目的とした診断用組成物の製造のために使用される。
【0142】
本明細書に記載されるように、本発明のポリペプチドは、特に、メチル化DNA、好ましくは、CpGメチル化DNAを単離、富化、精製および/または検出するための、予期できない優れた特性を有する。よって、本発明は、本発明のポリペプチドを使用する様々な診断的使用および方法を提供する。メチル化DNA、好ましくは、CpGメチル化DNAの好ましい小規模富化手順が実施例3に記載されている。要するに、本発明のポリペプチドを、例えば、Aタンパク質セファロースに結合させ、結合していない(inbound)タンパク質を洗浄除去する。次に、対象DNAを好ましくは消化し、結合している本発明のポリペプチドに加える。さらに、該消化DNAを結合している本発明のポリペプチドと共にインキュベートし、洗浄し、その後、本発明のポリペプチドが結合したものを溶出させる。
【0143】
よって、本発明はまた、in vitroでメチル化DNAを検出する方法であって、
(a)メチル化および/または非メチル化DNAを含むサンプルを本発明のポリペプチドと接触させること;および
(b)該ポリペプチドとメチル化DNAとの結合を検出すること
を含む方法に関する。
【0144】
好ましくは、該in vitro法は、実施例3に例示されるような逆サザン−ウエスタンブロット法、免疫沈降法、メチル化DNAのアフィニティー精製、または実施例4および5に例示されるようなメチル−CpG免疫沈降法(MCIp)である。しかしながら、該in vitro法はそれに限定されないが、本発明の診断用組成物に関しても記載したように、基本的に、本発明のポリペプチドが固相マトリクス、例えば、セファロース、アガロース、キャピラリー、容器壁などのマトリクスに結合されているいずれかの手順であり得る。
【0145】
より好ましくは、上述のin vitro法は、ステップ(c)として、例えば、シークエンシング、サザンブロット法、制限酵素消化、重亜硫酸塩シークエンシング、ピロシークエンシングまたはPCR法によりメチル化DNAを分析することをさらに含む。なお、本発明のポリペプチドを用いることにより単離、富化、精製および/または検出されたメチル化DNAの分析は、上述の方法に限定されず、例えば、RDA法、マイクロアレイ法など、メチル化DNAを分析するために当技術分野で公知の全ての方法を包含する。
【0146】
本発明のポリペプチドの好ましい診断適用は、図7に示される、いわゆるMB−PCRである。要するに、第1のステップにおいて、本発明のポリペプチドをコアテーブルPCR容器、例えば、Nunc製のTopYield Stripsに加える。このようにすれば、当該ポリペプチドは当技術分野で公知の技術により、該容器の内面に好ましくコーティングされる。次のステップで、このコーティングPCR容器に遮断試薬、例えば、4.5%粉乳を加える。さらなるステップで、好ましくは対象DNA断片(例えば、メチル化および/または非メチル化DNA断片)を、このコーティングおよび遮断済みのPCR容器に加える。本発明のポリペプチドは、存在すれば、メチル化DNAと特異的に結合すると考えられる。その後のステップで、好ましくはDNA断片を含むコーティングおよび遮断済みPCR容器をインキュベートし、その後、結合していないDNA断片を洗浄除去する。
【0147】
その後、例えば、メチル化または非メチル化であると思われる対象の遺伝子または遺伝子座または複数の遺伝子座に関する多重PCRのための、好ましくは遺伝子特異的プライマー、または、これもまた好ましいが、少なくとも2つ、3つ、4つ、5つ、6つ、7つなどのプライマー対を含むPCR混合物を加え、好ましくは、リアルタイムPCRまたは通常のPCRを実施した後、ゲル電気泳動により増幅産物を分離する。
【0148】
MB−PCRは好ましくは次のように行う。好ましくは、PCR試験管は熱安定性TopYield(商標)ストリップ(Nuncカタログ番号248909)を用いて調製する。好ましくは、好ましくは組み換え型の本発明のポリペプチド50μl(10mMのTris/HCL pH7.5中、15μg/mlに希釈)を各ウェルに加え、4℃で一晩インキュベートする。好ましくは、ウェルを200μlのTBS(150mMのNaCLを含有する20mMのTris,pH7.4)で3回洗浄し、4℃にて一晩、100μl遮断溶液(150mMのNaCL、4.5%スキムミルク粉末、5mMのEDTAおよび各0.8μg/mlのポリd(I/C)、ポリd(A/T)およびポリd(CG)を含有する10mMのTris,pH7.5)で遮断する。好ましくは、その後、これらの管を200μlのTBST(0.1%Tween−20を含有するTBS)で3回洗浄する。
【0149】
好ましくは、50μlの結合バッファー(400mMのNaCl、2mMのMgCl2、0.5mMのEDTA、および0.1%Tween−20を含有する20mMのTris,pH7.5)を各ウェルに加え、好ましくは、1μlの消化DNA、好ましくは、Mselで消化したゲノムDNAを、好ましくは10ng/μlの量で各第2のウェルに加える(M−反応)。
【0150】
ゲノムDNAを、好ましくは、例えば、Blood and Cell Culture Midi Kit(Qiagen)を用いるなど、当技術分野で公知のキットを用いることにより調製する。このゲノムDNA調製物の質は、好ましくは、アガロースゲル電気泳動により制御し、DNA濃度は好ましくは、UV分光光度法により測定した。DNAの定量は好ましくは、PicoGreen dsDNA定量試薬(Molecular Probes)を用いることにより行う。
【0151】
本発明のポリペプチドとDNA、好ましくは、DNA(酵素消化または機械的断片化により生成)を含有するウェルを、好ましくは4℃にて、好ましくは3時間、シェーカー上でインキュベートする。好ましくは、これらの管を200μlの結合バッファーで3回、10mMのTris/HCl、pH7.5で1回洗浄した。
【0152】
次に、PCRを好ましくは、直接TopYield(商標)ストリップで行った。好ましくは、PCR混合物(50μl/ウェル)は、標準的なPCRバッファー(Roche)、好ましくは、2.5U FastStart Taq DNAポリメラーゼ(Roche)、好ましくは、各10pmolの遺伝子特異的プライマー(Qiagenにより合成)、dNTP(好ましくは、各200mM,Amersham/Pharmacia)、好ましくは、1Mベタイン(Sigma)、プライマー配列を含み、特定の対象遺伝子のサイクリングパラメーターは実施例6の表2および3に示されている。当然のことながら、当業者ならば、他の好適な遺伝子特異的または遺伝子座特異的または複数の遺伝子座特異的プライマーを設計することができる。
【0153】
さらに、当業者ならば、対象とするプライマーおよび遺伝子、遺伝子座医/複数の遺伝子座に最も好適なPCRパラメーターを容易に決定および/または試験することができる。PCR混合物を加えた後、好ましくは、1μlのMseI消化DNA(好ましくは、10ng/μl量)を、事前にDNA断片と共にインキュベートしなかった各第2のウェルに加える(P−反応)。好ましくは、PCR産物を、アガロースゲル電気泳動を用いて分析し、臭化エチジウムで染色したゲルを、例えば、Typhoon9200Imager(Amersham/Pharmacia)を用いて走査した。
【0154】
よって、本発明のポリペプチドは、単一細胞を含み得る、本明細書に後述されるようなサンプル中におけるメチル化DNA、好ましくは、CpGメチル化DNAの検出に有用であると考えられる。また、本発明のポリペプチドは完全細胞にも有用であると考えられる。「完全細胞」とは、ゲノムという点から完全な単一の細胞を意味する。よって、完全細胞は、メチル化DNAのゲノム分析に有用である。
【0155】
かかる方法は、好ましくは、本発明のポリペプチドを用いたメチル化DNAの富化/精製ステップと、例えば、ゲノムDNAマイクロアレイ、ティリングアレイ、低密度アレイのハイブリダイゼーション、またはlab−on−a−chip−アプローチなどの検出ステップを含む。当業者ならば、当技術分野で公知の検出方法を容易に行うことができる。それらのいくつかが添付の実施例に示されているが、ここでは、メチル化DNAを富化、精製および/または単離するために本発明のポリペプチドが使用される。1つの実施例は、ハイスループット・ロバスト・ワンチューブ・アッセイに好適であり得る、いわゆるMB−PCRを示す。さらに、本発明のポリペプチドは、単一遺伝子レベルでCpGメチル化の検出に特に有用であり得る。このような方法は好ましくは、単一遺伝子のメチル化DNA、好ましくは、CpGメチル化DNAを富化および/または精製するステップと、該メチル化DNAを、PCR、リアルタイムPCRなどを用いて検出するステップを含む。
【0156】
本発明のポリペプチドのもう1つの可能性のある診断適用として、免疫組織化学がある。よって、本発明のポリペプチドは、メチル化DNA、好ましくは、CpGメチル化DNAを「染色する」ために使用することができる。本発明のポリペプチドは、本明細書に記載されるような好適な検出可能物質に、そのFc部分を介してカップリング、連結または接合されるか、または例えば、メチル化DNAに結合されている場合の本発明のポリペプチドを検出するには、第2の抗Fc部分抗体が用いられる。
【0157】
数種の悪性疾患は、本発明の方法により、それらのメチル化パターン/プロフィールによって検出することができ、従って、予後的および/または属性的に有用であり得ると思われる。これは、このメチル化パターンが患者の薬理学的プロフィールを設定するために使用可能であることを意味する。例えば、抗がん薬に対する感受性および/または感度は、あるがん遺伝子および/または腫瘍抑制遺伝子が高メチル化であるか、低メチル化であるかが検出されれば、判定することができる。よって、当業者は、例えば、がん遺伝子がすでに高メチル化され、従って、不活性であると思われるが、ある薬剤ががん遺伝子を阻害し得る場合に、負の作用および/または有害作用を回避するのに最も適当な薬剤を選択する。
【0158】
本明細書に記載の方法は、第1に、がんまたは腫瘍性疾患などの悪性疾患において高メチル化または低メチル化(hypomethylated)されている遺伝子座および/または遺伝子を同定するため、また、第2に、単一遺伝子レベルでこのような遺伝子座および/または遺伝子のメチル化状態をアッセイするための基礎を提供するのに有用であり得る。該悪性疾患は好ましくは腫瘍である。腫瘍はあり得るいずれの腫瘍種であってもよい。例としては、皮膚がん、乳がん、脳がん、子宮頸がん、精巣がん、頭頸部がん、肺がん、縦隔がん、消化管がん、尿生殖器系がん、婦人科系がん、乳がん、内分泌系がん、皮膚がん、小児がん、原発部位不明のがんまたは転移がん、軟組織および骨の肉腫、中皮腫、黒色腫、中枢神経系の新生物、リンパ腫、白血病、腫瘍随伴症候群、腹膜がん腫症(peritoneal carcinomastosis)、免疫抑制関連の悪性および/または転移がんなどがある。
【0159】
これらの腫瘍細胞は、例えば、鼻腔、副鼻洞、鼻咽頭、口腔、中咽頭、喉頭、下咽頭、唾液腺のがんおよび傍神経節腫を含む頭頸部;非小細胞肺がん、小細胞肺がんを含む肺のがん;縦隔のがん;食道、胃、膵臓、肝臓、胆管、小腸、結腸、直腸および肛門領域のがんを含む消化管のがん;腎臓、尿道、膀胱、前立腺、尿道、陰茎および精巣のがんを含む尿生殖器系のがん;子宮頸がん、膣がん、外陰がん、子宮胎がん、妊娠性栄養膜疾患、卵巣がん、卵管がん、腹膜がん、乳がんを含む婦人科がん;甲状腺、副甲状腺、副腎皮質の腫瘍、膵内分泌腫瘍を含む内分泌系のがん;カルチノイド腫およびカルチノイド症候群;多発性内分泌腺腫症;軟組織および骨の肉腫;中皮腫;皮膚がん;皮膚黒色腫および眼内黒色腫を含む黒色腫;中枢神経系の新生物;網膜芽腫、ビルムス腫瘍、神経繊維腫瘍、神経芽腫、ユーイング肉腫系の腫瘍、横紋筋肉腫を含む小児がん;非ホジキンリンパ腫、皮膚T細胞リンパ腫、原発性中枢神経系リンパ腫、およびホジキン病を含むリンパ腫;急性白血病、慢性骨髄性白血病およびリンパ性白血病、血漿細胞新生物、および骨髄異形成症候群を含む白血病;腫瘍随伴症候群;原発部位不明のがん;腹膜がん腫症;カポジ肉腫、エイズ関連リンパ腫、エイズ関連原発性中枢神経系リンパ腫、エイズ関連ホジキン病およびエイズ関連肛門性器などのエイズ関連悪性疾患を含む免疫抑制関連悪性疾患、および移植関連悪性疾患、肝臓への転移がん、骨への転移がん、悪性胸腔および心膜滲出および悪性腹水に由来し得る。
【0160】
多くの場合、該がんまたは腫瘍性疾患は、頭頸部がん、肺がん、縦隔がん、消化管がん、尿生殖器系がん、婦人科系がん、乳がん、内分泌系がん、皮膚がん、小児がん、原発部位不明のがんまたは転移がん、軟組織および骨の肉腫、中皮腫、黒色腫、中枢神経系の新生物、リンパ腫、白血病、腫瘍随伴症候群、腹膜がん腫症、免疫抑制関連の悪性および/または転移がんであることが好ましい。好ましい腫瘍はAML、形質細胞腫またはCLLである。
【0161】
本発明の診断用組成物は、本明細書に記載の本発明の少なくとも1つを含む。当該診断用組成物は、とりわけ、例えば、上記のような個体からのサンプルにおいて、メチル化DNA、好ましくは、CpGメチル化DNAの存在を単離、富化および/または測定するための方法に使用することができる。
【0162】
本発明において「サンプル」とは、ポリヌクレオチドまたはポリペプチドまたはその一部を含有する個体、細胞系統、組織培養またはその他の供給源から得られるいずれの生体サンプルも企図する。示されているように、生体サンプルとしては、本発明のポリヌクレオチドを発現することが見出された体液(血液、血清、血漿、尿、滑液および脊髄液など)および組織源が挙げられる。哺乳類から組織生検および体液を得る方法は本技術分野で周知である。ゲノムDNA、mRNAまたはタンパク質を含む生体サンプルが供給源として好ましい。
【0163】
診断用組成物のさらなる適用は本明細書に記載されており、添付の実施例に示されている。
【0164】
当該診断用組成物は、所望により、検出に好適な手段を含む。上記の核酸分子、ベクター、宿主、抗体、およびポリペプチドはイムノアッセイにおける使用に好適であり、それらは例えば、液相において、または固相担体に結合させて使用することができる。周知の担体の例としては、ガラス、ポリスチレン、ポリビニルイオン、ポリプロピレン、ポリエチレン、ポリカーボネート、デキストラン、ナイロン、アミロース、天然および修飾セルロース、ポリアクリルアミド、アガロース、および磁鉄鉱が挙げられる。本発明において、当該担体の性質は可溶性であっても不溶性であってもよい。
【0165】
固相担体は当業者に公知であり、ポリスチレンビーズ、ラテックスビーズ、磁性ビーズ、金属コロイド粒子、ガラスおよび/またはシリコーンチップおよび表面、ニトロセルロースストリップ、膜、シート、デュラサイト(duracytes)、および反応トレーのウェル、プラスチックチューブまたは他の試験管の壁面を含み得る。固相支持体に核酸分子、ベクター、宿主、抗体、アプタマー、ポリペプチドなどを固定化する好適な方法は、限定されるものではないが、イオン的、疎水性、共有結合的相互作用または(化学的)架橋などがある。
【0166】
本発明の当該化合物を使用することができるイムノアッセイの例としては、直接的または間接的な形式の、競合的および非競合的イムノアッセイがある。一般に使用される検出アッセイは、放射性同位元素的または非放射性同位元素的方法を含み得る。かかるイムノアッセイの例としては、ラジオイムノアッセイ(RIA)、サンドイッチ(免疫測定アッセイ)およびノーザンまたはサザンブロットアッセイがある。さらに、これらの検出法は、とりわけ、IRMA(免疫放射定量測定法)、EIA(酵素免疫測定法)、ELISA(酵素結合免疫測定法)、FIA(蛍光免疫測定法)、およびCLIA(化学発光免疫測定法)がある。さらに、本発明の診断用化合物は、FRET(蛍光共鳴エネルギー移動)アッセイのような技術に使用することもできる。
【0167】
標識のための適当な標識および方法は当業者に公知である。本発明において使用可能な標識種の例としては、とりわけ、蛍光色素(フルオレセイン、ローダミン、テキサスレッドなど)、酵素(セイヨウワサビペルオキシダーゼ、β−ガラクトシダーゼ、アルカリ性ホスファターゼなど)、放射性同位元素(32P、33P、35Sまたは125Iなど)、ビオチン、ジゴキシゲニン、金属コロイド、化学発光化合物および生物発光化合物(ジオキセタン、ルミノールまたはアクリジニウムなど)が挙げられる。
【0168】
様々な技術が生体分子を標識するために利用でき、当業者に周知であり、本発明の範囲内であり、とりわけ、酵素またはビオチニル基の共有結合的カップリング、リン酸化、ビオチン化、ランダムプライミング、ニックトランスレーション、テーリング(ターミナルトランスフェラーゼを用いる)を含む。このような技術は、例えば、Tijssen,“Practice and theory of enzyme immunoassays”,Burden and von Knippenburg(Eds),Volume 15(1985);“Basic methods in molecular biology”,Davis LG,Dibmer MD,Battey Elsevier(1990);Mayer,(Eds)“Immunochemical methods in cell and molecular biology”Academic Press,London(1987);またはシリーズ“Methods in Enzymology”,Academic Press,Inc.に記載されている。検出方法は、限定されるものではないが、オートラジオグラフィー、蛍光顕微鏡法、直接的および間接的酵素反応などを含む。
【0169】
本発明のもう1つの好ましい組成物は、所望により、製薬上許容される担体をさらに含む医薬組成物である。当該医薬組成物は、とりわけ、例えばヒストンデアセチラーゼ、ヒストンアセチラーゼ、DNA−メチラーゼおよび/またはDNA−デメチラーゼなどのさらなるタンパク質とカップリングさせ得る本発明のポリペプチドを含む。当該医薬組成物はまた、制限酵素またはリボザイムとカップリングさせることもできる。上記のように1又は複数のさらなるタンパク質(proteian)とカップリングさせた本発明のポリペプチドがメチル化DNAと結合すれば、上記そのさらなるタンパク質をDNAへターゲッティングし得ると考えられる。よって、DNA−メチラーゼは低メチル化DNA、例えば、低メチル化発癌遺伝子座またはがん遺伝子またはDNAを高メチル化することができる。このようにして、遺伝子の不活化が達成できる。
【0170】
或いは、DNA−デメチラーゼは、高メチル化遺伝子または遺伝子座、例えば、腫瘍抑制遺伝子または遺伝子座を脱メチル化し得る。このようにして、遺伝子の活性化が達成できる。
【0171】
ヒストンデアセチラーゼは、ヒストンのアセチル化リシン残基を脱アセチル化し、それにより、DNAのヒストンへのより強固なパッケージングと遺伝子抑制をもたらすことによって活性遺伝子の転写抑制に関与する。当技術分野で公知のように、ヒストンアセチラーゼは反対の作用を示し得る。
【0172】
制限酵素またはリボザイムは、切断されるべきDNAにターゲッティングされる場合にその作用を発揮し得る。適当な制限酵素は当技術分野で公知である。標的DNA配列に特異的なリボザイムは、当技術分野で公知のように調製することができる。
【0173】
よって、当該医薬組成物は、がんおよび/または腫瘍性疾患を治療するのに有用であり得る。その双方が非制御の遺伝子発現、活性化および/または抑制により引き起こされることが知られており、これはとりわけ、ヒストンアセチル化/脱アセチル化および/またはDNAメチル化/脱メチル化により調節される。
【0174】
当該医薬組成物は、本明細書に記載されるように、生理学上許容される担体と共に患者に投与することができる。特定の実施形態では、「製薬上許容される」とは、動物、より詳しくは、ヒトでの使用が、規制機関または他の一般に認知されている薬局方により認可されていることを意味する。「担体」とは、それと共に治療薬が投与される希釈剤、アジュバント、賦形剤または媒体を指す。かかる医薬担体は、ラッカセイ油、ダイズ油、鉱油、ゴマ油など、石油、動物、植物または合成起源のものを含む、水および油といった無菌の液体であり得る。
【0175】
当該医薬組成物が静脈投与される場合、水が好ましい担体である。特に注射可能な溶液に関しては、液体担体として、生理食塩水並びにデキストロースおよびグリセロール水溶液を使用することもできる。好適な医薬賦形剤としては、グルコース、ラクトース、スクロース、ゼラチン、麦芽、コメ、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセロール、タルク、ナトリウムイオン、乾燥スキムミルク、グリセロール、プロピレン、グリコール、水、エタノールなどが挙げられる。
【0176】
当該組成物はまた、所望により、微量の湿潤剤若しくは乳化剤、またはpH緩衝剤を含むことができる。これらの組成物は溶液、懸濁液、エマルション、錠剤、丸剤、カプセル剤、粉末、徐放性処方物などの形態を採ることができる。当該組成物は、通常の結合剤およびトリグリセリドなどの担体と共に坐剤として処方することもできる。経口処方物は、医薬級のマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの標準的な担体を含むことができる。
【0177】
好適な医薬担体の例は、E.W.Martinにより“Remington’s Pharmaceutical Sciences”に記載されている。このような組成物は、治療有効量の上述の化合物を、好ましくは精製形態で、患者への適切な投与のための形態を提供するよう、好適な量の担体と共に含む。当該処方物は投与様式に適したものとすべきである。
【0178】
もう1つの好ましい実施形態では、当該組成物は、ヒトへの静脈投与に適合した医薬組成物としてありふれた手段に従って処方される。典型的には、静脈投与用組成物は、無菌等張水性バッファー中の溶液である。必要であれば、当該組成物はまた、可溶化剤、および注射部位の痛みを和らげるためのリドカインなどの局所麻酔薬を含んでもよい。一般に、これらの成分は個別に、または例えば、凍結乾燥粉末または無水濃縮物として単位投与形中に共に混合して、有効剤の量を示す、アンプルまたサシェなどの湿気遮断容器にて提供される。当該組成物が注入により投与される場合、無菌医薬級の水または生理食塩水を含む注入瓶を用いて調剤することができる。当該組成物が注射により投与される場合、投与前に成分を混合し得るように無菌注射水または生理食塩水のアンプルを提供することができる。
【0179】
本発明の医薬組成物は、中性または塩の形態で処方することができる。医薬上許容される塩としては、塩酸、リン酸、酢酸、シュウ酸、酒石酸などから得られるものなど、陰イオンを伴って形成されるもの、およびナトリウム、カリウム、アンモニウム、カルシウム、水酸化鉄(III)、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどから得られるものなど、陽イオンを伴って形成されるものが挙げられる。
【0180】
所望により、in vitroアッセイを用いて、至適用量範囲を特定する補助としてもよい。処方物に用いる厳密な用量はまた、投与経路、および疾病または疾患の重篤度によっても異なり、医師の判断および各患者の状況に従って決定されなければならない。有効量はin vitroまたは動物モデル試験系から得られる用量反応曲線から推定することができる。好ましくは、当該医薬組成物はそのまま投与するか、またはアジュバントと組み合わせて投与する。
【0181】
当該医薬組成物は好ましくは、遺伝子療法に適用するために設計される。遺伝子療法の技術は、本発明の核酸分子に関して既に上記されており、そこで述べたことは全て、当該医薬組成物についても当てはまる。例えば、当該医薬組成物中の核酸分子は、好ましくは、治療される個体の細胞へのその導入、発現および/または安定な組み込みを可能とする形態である。
【0182】
遺伝子療法のために使用可能なウイルスベクターとしては、例えば、アデノウイルス、ヘルペスウイルス、ワクシニア、または好ましくは、レトロウイルスなどのRNAウイルスが挙げられる。単一の外来遺伝子を挿入することができるレトロウイルスベクターの例としては、限定されるものではないが、モロニーネズミ白血病ウイルス(MoMuLV)、ハーヴェーネズミ肉腫ウイルス(HaMuSV)、ネズミ乳房腫瘍ウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)が挙げられる。その他のレトロウイルスベクターの多くは、複数の遺伝子を組み込むこともできる。
【0183】
これらのベクターは全て、形質導入された細胞を識別および生成可能なように、選択マーカーの遺伝子を導入または組み込むことができる。レトロウイルスベクターは、例えば、糖、糖脂質またはタンパク質をコードするポリヌクレオチドを挿入することにより、標的特異的とすることができる。当業者ならば、挿入ポリヌクレオチド配列を含むレトロウイルスベクターの標的特異的送達を可能とするためにレトロウイルスゲノムに挿入可能な特定のポリヌクレオチド配列を知っているか、または余計な実験を行わずに容易に確認することができる。
【0184】
組み換えレトロウイルスは欠陥型のものが好ましいので、感染性のベクター粒子を産生するためには補助を必要とする。この補助は、例えば、LTR内の調節配列の制御下に、レトロウイルスの全構造遺伝子をコードするプラスミドを含むヘルパー細胞系統を用いることにより、提供することができる。
【0185】
これらのプラスミドは、パッケージング機構にキャプシド形成に関するRNA転写物を認識させ得るヌクレオチド配列を欠いている。パッケージングシグナルの欠失したヘルパー細胞系統としては、限定されるものではないが、例えば、w2、PA317およびPA12が挙げられる。これらの細胞系統は、ゲノムがパッケージングされていないので、空のビリオンを産生する。パッケージングシグナルが無傷な細胞にレトロウイルスベクターが導入されるが、それらの構造遺伝子が対象とする他の遺伝子で置換されている場合、このベクターはパッケージング可能で、ベクタービリオンも産生可能である。或いは、NIH3T3または他の組織培養細胞を、従来のリン酸カルシウムトランスフェクションにより、レトロウイルス構造遺伝子gag、polおよびenvをコードするプラスミドで直接トランスフェクトすることができる。
【0186】
次に、これらの細胞を、対象遺伝子を含むベクタープラスミドでトランスフェクトする。得られた細胞は培養培地中にレトロウイルスベクターを放出する。本発明の核酸分子のための別の標的送達系として、コロイド分散系がある。コロイド分散系としては、高分子複合体、ナノカプセル、マイクロスフェア、ビーズ、並びに水中油エマルション、ミセル、混合ミセルおよびリポソームを含む脂質に基づく系が挙げられる。本発明の好ましいコロイド系はリポソームである。リポソームは、in vitroおよびin vivoにおいて送達媒体として有用な人工膜小胞である。0.2〜4.0pmの範囲の大きさの大型単層小胞(LUV)は、大きな高分子を含む、実質的パーセンテージの水性バッファーを封入し得ることが示されている。RNA、DNAおよび無傷なビリオンは水性の内部に封入することができ、生物学的に活性な形態で細胞に送達され得る(Fraley,et al.,Trends Biochem.Sci.,6:77,1981)。
【0187】
哺乳類細胞の他、リポソームは植物、酵母および細菌細胞においてポリヌクレオチドの送達に使用されている。リポソームを効率的な遺伝子導入媒体とするためには、次の特徴が存在しなければならない:(1)それらの生物活性を損なわずに高効率で対象遺伝子を封入すること;(2)非標的細胞に比べて標的細胞と優先的かつ実質的に結合すること;(3)その小胞の水性内容物を高効率で標的細胞細胞質に送達すること;および(4)遺伝情報の正確および有効な発現(Mannino,et al.,Biotechniques,6:682,1988)。当該リポソーム組成物は通常、リン脂質、特に、高相転移温度リン脂質の組合せ、通常はステロイド、特にコレステロールと組み合わせたものである。他のリン脂質または他の脂質も使用可能である。リポソームの物理的特徴は、pH、イオン強度および二価陽イオンの存在によって異なる。
【0188】
リポソームの産生に有用な脂質の例としては、ホスファチジルグリセロール、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルエタノールアミン、スフィンゴ脂質、セレブロシド、およびガングリオシドなどのホスファチジル化合物が挙げられる。脂質部分が14〜18個の炭素原子、特に16〜18個の炭素原子を含み、飽和している、ジアシルホスファチジルグリセロールが特に好ましい。例示的リン脂質としては、卵ホスファチジルコリン、ジパルミトイルホスファチジルコリンおよびジステアロイルホスファチジルコリンが挙げられる。リポソームの標的化は、解剖学的因子および機会的因子に基づいて分類することができる。解剖学的分類は選択性、例えば、器官特異性、細胞特異性およびオルガネラ特異性のレベルに基づく。機械的標的化は、受動的であるか能動的であるかに基づいて識別することができる。受動的標的化は、洞様毛細管を含む器官における細網内皮系(RES)の細胞に分布するリポソームの自然の傾向を利用する。
【0189】
好ましい実施形態では、本発明の組成物は、メチル化DNA、好ましくは、CpGメチル化DNAをin vivoで画像化するのに有用であり得る。よって、当該組成物は、それを必要とする被験体に投与することができる。本発明において「被験体」とは、情動障害の治療を必要とする個体を意味する。好ましくは、該被験体は脊椎動物、いっそうより好ましくは哺乳類であり、特に好ましくはヒトである。
【0190】
「投与される」とは、本発明のポリペプチドをコードする上述の核酸分子の、治療上または診断上有効量を投与することを意味する。「治療上または診断上有効量」とは、それが投与される目的の作用をもたらす用量を意味する。厳密な用量は治療または診断の目的によって異なり、当業者ならば既知の技術を用いて確認することができる。
【0191】
当業者で公知のように、また、上記のように、全身投与か局所投与、齢、体重、健康状態、性、食餌、投与時間、薬剤の相互作用、および症状の重篤度に関する判断が必要である場合があり、当業者ならば通常の検討で確認することができる。
【0192】
これらの方法は、ヒト療法および獣医学的適用の双方に適用可能である。所望の治療活性を有する本明細書に記載の化合物は、本明細書に記載されるように、生理学上許容される担体中にて患者に投与することができる。導入の方法に応じ、当該化合物は後述するような様々な方法で処方することができる。処方物中の治療上有効な化合物の濃度は、約0.1〜100重量%で様々であってよい。これらの薬剤は単独または他の治療と組み合わせて投与することができる。
【0193】
当該医薬組成物の投与は、限定されるものではないが、経口、皮下、静脈内、動脈内、節内、髄内、くも膜下腔内、脳室内、鼻腔内、気管支内、経皮、節内、直腸内、腹膜内、筋肉内、肺内、膣、直腸、または眼内を含む上述のような様々な方法で行うことができる。場合によっては、例えば、創傷および炎症の治療において、これらの候補薬剤は溶液ドライスプレーとして直接適用することもできる。
【0194】
主治医および臨床因子が投与計画を決定する。医療分野で周知のように、ある患者の用量は、患者の大きさ、体表面積、齢、投与される特定の化合物、性、投与時間および投与経路、健康状態、および同時に投与される他の薬剤を含む多くの因子によって異なる。典型的な用量は例えば、0.001〜1000μgの範囲であり得るが、上述の因子を考慮して、この例示的範囲よりも低いまたは高い用量も考えられる。
【0195】
これらの用量は好ましくは、1週間に1回与えられるが、これらの用量は治療の進行過程で、ずっと長い時間間隔で与えることもでき、必要があれば、例えば毎日など、ずっと短い時間間隔で与えることもできる。好ましい場合では、免疫応答は本明細書に記載の方法、および当業者に公知のさらなる方法を用いてモニタリングされ、用量は、例えば、時間、量および/または組成において至適化することができる。
【0196】
用量は様々であるが、DNAの静脈投与に好ましい用量は、DNA分子およそ106〜1012コピーである。投与計画が持続的注入である場合、用量はまた、それぞれ、1μg〜10mg単位/体重キログラム/分の範囲でなければならない。進行は定期的評価によりモニタリングすることができる。本発明の医薬組成物は局所投与または全身投与可能である。
【0197】
好ましくは、投与は非経口、例えば、静脈投与である。非経口投与用の剤形としては、無菌水溶液または非水溶液、懸濁液、およびエマルションが挙げられる。非水性溶媒の例としては、プロピレングリコール、ポリエチレングリコール、オリーブ油などんの植物油、およびオレイン酸エチルなどの注射可能な有機エステルが挙げられる。水性担体としては、生理食塩水および緩衝媒体を含む、水、アルコール/水溶液、エマルションまたは懸濁液が挙げられる。非経口媒体としては、ナトリウムイオン溶液、リンゲルのデキストロース、デキストロースおよびナトリウムイオン、乳酸リンゲル液、または硬化油が挙げられる。静脈用媒体としては、流体および栄養補液、電解質補液(リンゲルのデキストロースに基づくものなど)などが挙げられる。また、保存剤および他の添加剤、例えば、抗菌剤、抗酸化剤、キレート剤、および不活性ガスなどが存在してもよい。
【0198】
また、当該医薬組成物は、例えば、メチル化DNAの検出に有用な、従って例えば、典型的なメチル化パターンを示し得る悪性疾患の診断に有用な他の薬剤との同時治療アプローチに用いられると考えられる。
【0199】
本発明およびその多くの利点のより良い理解は以下の実施例から得られるが、これらの実施例は単に例示のために示されるものであり、本発明の範囲を何ら限定するものではない。
【実施例】
【0200】
実施例1:pMTBip/MBD2−Fcのクローニング
ヒトMBD2(Genbank受託番号NM003927;AA144〜230)のメチル−CpG結合ドメイン(MBD)に相当するcDNAを、プライマーMBD2−Nhe S(5’−AGA TGC TAG CAC GGA GAG CGG GAA GAG G−3’)(配列番号4)およびMBD2−Not AS(5’−ATC ACG CGG CCG CCA GAG GAT CGT TTC GCA GTC TC−3’)(配列番号5)並びにHerculaseDNAポリメラーゼ(Stratagene)を用い、逆転写ヒト一次マクロファージ全RNAからPCR増幅させた。サイクリングパラメーターは、95℃3分変性;95℃20秒、65℃20秒、72℃80秒の増幅34サイクル;72℃5分の最終伸張であった。このPCR産物を沈殿させ、NotI/NheIで消化し、Signal plg plusベクター(Ingenius,R&D Systems)のNotI/NheI部位にクローニングし、配列を確認し、plg/MBD2−Fc(真核細胞発現ベクター)を得た。ショウジョウバエS2細胞における組み換え発現のためのpMTBip/MBD2−Fcをクローニングするため、ヒトIgG1のFcテールと融合されたヒトMBD2のMBDを含むplg/MBD2−FcのApaI/NheI断片を、pMTBiP/V5−HisB(Invitrogen)のApaI/SpeI部位にサブクローニングした。
【0201】
実施例2:抗体様メチル−CpG−DNA結合タンパク質の組み換え発現
一本鎖のメチル化シトシンは、5−mC抗体を用いて効率的に検出され得るが、二本鎖DNA分子は検出されない。二本鎖CpGメチル化DNAの抗体様検出を可能にするため、上記実施例1に記載のベクターを、ヒトメチル−CpG結合ドメイン2(MBD2)のメチル−CpG結合ドメイン(MBD)、フレキシブルリンカーポリペプチドおよびヒトIgG1のFc部分を含む融合タンパク質をコードするように構築した。このタンパク質をショウジョウバエS2 Schneider細胞において金属誘導プロモーターの制御下で発現させ、Aタンパク質アフィニティークロマトグラフィーにより上清から回収した。この精製タンパク質は多量に発現され(4〜5mg/L細胞培養上清)、推定分子量は約40kDaであった(図2参照)。
【0202】
よって、詳しくは、MBD2−Fcタンパク質の組み換え発現用として、いくつかの理由で昆虫細胞系が選択された。主な理由は、CpGメチル化が存在しないか、低量であることである。哺乳類(特にヒト)細胞でのこのタンパク質の産生ではDNA混入(細胞培養上清におけるMBD2−Fcタンパク質への結合)が起こるおそれがあり、これがその後のCpGメチル化DNAの分析を煩雑にすることがある。他の理由としては、培養条件が簡単なこと、およびタンパク質収量が潜在的に高いことである。
【0203】
ショウジョウバエS2細胞はATTCから入手し、25℃のインキュベーター内で、10%FCS(PAA)を含有するInsect−Xpress培地(Bio Whittaker)で培養した。4×106個のショウジョウバエS2細胞/60mm細胞培養ディッシュを、Effecteneトランスフェクション試薬(Qiagen)を製造業者のプロトコールに従って用い、1.5μg pMTBip/MBD2−Fcと0.3μg pCoHygro(Invitrogen)の混合物でトランスフェクトした。
【0204】
3日目にトランスフェクト細胞を採取し、洗浄し、10%FCSおよび300μg/mlハイグロマイシン(BD Biosciences)を含有する選択培地(Insect−Xpress)に再プレーティングした。5週間、4〜5日おきに選択培地を交換した。安定トランスフェクトされたショウジョウバエS2細胞のプールを拡張し、いくつかのアリコートにして液体窒素中で保存した。
【0205】
大規模生産では、1〜5×108細胞を、2000ml容の回転瓶にて、FCSを含まない100〜200mlのInsect−Xpress中で(任意選択で300μg/mlハイグロマイシン)2日間培養した後、0.5mM CuSO4を加えた。培地を4〜7日おきに採取し、さらなるタンパク質産生のため、細胞を培地+CuSO4に再プレーティングした。細胞培養上清を合わせ、TBS(pH7.4)に対して透析し、Aタンパク質カラムを用いて精製した。MBD−Fcを含有する画分を合わせ、TBS(pH7.4)に対して透析した。安定トランスフェクトされたショウジョウバエS2細胞は、細胞培養上清1リットル当たり3〜5mgの組み換えMBD2−Fcタンパク質を産生した。
【0206】
実施例3:メンブラン上でのCpGメチル化DNAの検出(逆サウス−ウエスタンブロット法)
ウエスタンブロット様の手順にて、MBD2−Fcが膜上でCpGメチル化DNAを検出できるかどうかを調べるため、本発明者らは、従来のサザンブロット法と同等であるが、ブロット前にDNAを変性させないキャピラリートランスファー系を用い、in vitroにてナイロン膜上に、種々のCpG濃度のメチル化または非メチル化PCR断片をブロットした。図3に示すように、標準的な免疫ブロット条件と一次抗体と等価なものとしてMBD−Fcを用い、メチル化DNAをナイロン膜上、一列に(図3A)、また、CpG含量に依存して(図3B)検出することができる。これらの結果は、MBD−Fc融合タンパク質が固相支持体に結合したCpGメチル化DNAを検出することができることを示す。
【0207】
実施例4:メチル−CpG免疫沈降法(MCIp)を用いたCpGメチル化DNAの小規模富化
次のプロトコールは、スピンカラムを用いたCpGメチル化DNA断片の迅速富化を可能とする。このDNAは、Aタンパク質を介してセファロースビーズにカップリングされたMBD2−Fcタンパク質と結合している。メチル化DNAに対する親和性はメチル化CpG−ジヌクレオチドの密度と共に高くなり、洗浄するバッファーのイオン強度と共に低くなる。
【0208】
4.1 Aタンパク質セファロースに対するMBD2−Fcタンパク質の結合
1mlのTBS中、50μlのAタンパク質セファロース4ファーストフロービーズ(Amersham)に、8〜10μgの精製MBD2−Fcタンパク質を加え、4℃で一晩、回転装置上で回転させた。翌日、MBD2−Fc−ビーズをバッファーA(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、150mMのNaCl、0.1%NP−40)で2回洗浄した。
【0209】
4.2 DNAの制限消化および定量
少なくとも1μgのゲノムDNA(Qiagenカラムを用いて調製)をMseIで消化した。アガロースゲル電気泳動を用いて完全消化物を制御し、消化したDNAを、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0210】
4.3 高メチル化CpG−DNAの精製
消化したDNA(300ng)を1mlのバッファーA中の洗浄MBD2−Fc−ビーズに加え、4℃、回転装置上で3時間回転させた。ビーズをSpinXカラムに移し、およそ1mlのバッファーAで回転洗浄した。ビーズを400μlのバッファーB(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、450mMのNaCl、0.1%NP−40)で2回、バッファーC(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、650mMのNaCl、0.1%NP−40)で2回洗浄した。各洗浄ステップの流出液は廃棄するか、またはさらなる分析のために回収した。CpGメチル化DNAを、250μlバッファーD(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、1000mMのNaCl、0.1%NP−40)で、新しい試験管中へ溶出した。溶出したDNAをQiaquickスピンカラム(溶出)で脱塩した。並行して、300ngの消化DNA(投入)を250μlのバッファーDに再懸濁させ、QIAquick PCR精製キット(Qiagen)を用いて脱塩した。溶出DNAおよび投入DNAの双方を、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0211】
4.4. 別法
DNAは種々の制限エンドヌクレアーゼを用いて、または音波処理によって制限処理してもよい。
【0212】
実施例5:MCIpにより作出されたメチル化CpG−DNA断片の検出および定量
MBD−Fc融合タンパク質が免疫沈降様のアプローチでCpGメチル化DNA断片と結合し得るかどうかを調べるため、本発明者らは、まず、in vitroで生成され、種々のメチル化を受けたDNA断片の結合特性を調べた。種々のCpG密度を有するヒトプロモーターのPCR断片を、PCRを用いて作製し(図4参照)、SssI(CCL13、TLR2、CHI3L1)を用いてCpGのメチル化を行うか、またはメチル化せずにおいた(CPM)。DNAを、150mMのNaCl中で、MBD−Fc−Aタンパク質セファロースビーズに結合させ(実施例4参照)、NaCl濃度を引き上げて溶出させた。画分を回収し、スピン精製し、アガロースゲル電気泳動を行った。
【0213】
図4Bに示されるように、メチル化断片の親和性はメチル化CpG−ジヌクレオチドの密度と共に上昇し、非メチル化DNA(CPMプロモーター断片)は比較的低い塩濃度で溶出し、高メチル化DNA(TLR2プロモーター断片)は高い塩濃度で溶出する。投入DNAの量を変えても溶出プロフィールは有意には変化しなかった。しかしながら、このDNAの塩依存的な親和性は、Aタンパク質セファロースビーズ上のMBD−Fc融合タンパク質の密度に依存的であった。これらの結果は、このMBD−Fc融合タンパク質が、塩濃度およびCpGメチル化濃度依存的に、溶液中のCpGメチル化DNAを補足し、それと結合し得ることを示唆した。
【0214】
5.1 遺伝子特異的リアルタイムPCRを用いた単一遺伝子レベルの定量
5.1.1
組み換えMBD−Fcタンパク質が、複合ゲノムDNA混合物中のCpGアイランドプロモーターのメチル化密度を検出できるかどうかを調べるため、3つの白血病細胞系統、正常ドナー単球、並びにAML患者の芽細胞由来のゲノムDNAをMseIで制限処理し、MCIpを行った。1000mMのNaCl MCIp画分中、3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を、LightCycler−PCRを用いて検出した。p15とESR1は白血病においてメチル化の既知の標的であり、また、TLR2はこれまでにU937細胞でメチル化され、THP−1細胞ではメチル化されないことが示されていることから、この3つの遺伝子座を選択した。
【0215】
図5に示されるように、この3つの遺伝子座の中に、正常ドナーDNA(MO)からのDNA調製物において有意に検出可能なものはなく、これは正常細胞のCpGアイランドプロモーターの通常の非メチル化状態と一致している。U937ではTLR2は富化されるが、THP−1では富化されないことは、両細胞においてこれまでに観察されているメチル化パターンと一致している。Hahnel,J.Immunol.168(2002),5629−37に記載されているようなTLR2プロモーターの重亜硫酸塩シークエンシングは、KG1細胞におけるTLR2プロモーターのほぼ完全なメチル化を示し(データは示されていない)、これは図5に示されている強力なMCIp富化と一致している。KG1およびU937におけるp15に関する結果は公開されているデータと一致している。これらのデータは、MCIpを用い、ゲノムDNAにおける単一遺伝子断片のメチル化DNA断片を検出することができることを示す。
【0216】
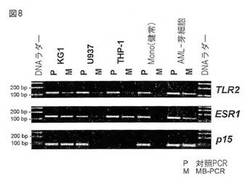
よって、MCIp溶出物における特定のMseI断片の富化は、リアルタイムLightcycler−PCRにより、ゲノム投入に対して検出および定量された(図5参照)。この富化はまた、溶出DNAおよび投入DNAの双方の非特異的DNA増幅後に定量してもよい(下記実施例5.2.1のアンプリコン精製参照、データは示されていない)。
【0217】
【表4】

【0218】
MCIpを用い、ゲノムDNAからメチル化および非メチル化DNA断片を識別し得るかどうかを調べるため、健康なドナーの単球由来の、in vitro SssIメチル化された、および非処理の正常DNAのMseI制限ゲノムDNAを富化するためにMCIpを用いた。MseIは低CpG含量の領域で優先的に切断し、多くのCpGアイランドは切断せずに残すことが知られていることから、DNAの断片化のために選択した(Cross,Nat.Genet.6(1994),236−244)。
【0219】
4つの異なるCpGアイランドプロモーターと、低CpG密度の1つのプロモーターの塩濃度依存性の富化は、LightCyclerリアルタイムPCRを用い、投入DNAに対するSssIメチル化および非処理DNAで判定した。DNAメチル化の陽性対照として、正常細胞においてもメチル化されるその2コピーのうち1つで母性刷り込みを受けるSNRPN遺伝子プロモーター(Zeschnigk,Hum.Mol.Genet.6(1997),387−395)を使用した。正常なDNAにおいて、SNRPNの2つの異なるメチル化を受けた対立遺伝子断片が、2つの別の画分で富化された(図9A参照)。SssIメチル化DNAでは、富化された画分は1つだけ見られた。白血病細胞において頻繁にメチル化されていることが知られている(Chim,Ann.Hematol.82(2003),738−742;Dodge,Int.J.Cancer 78(1998),561−567;Dodge,Leuk.Res.25(2001),917−925)CDKN2B遺伝子(p15INK4bとしても知られる)の場合(図9B)、断片は主として、正常DNA由来の低塩画分と、SssIメチル化DNA由来の高塩画分で検出された。
【0220】
同様の結果がヒトエストロゲン受容体1(ESR1)遺伝子(Issa,Cancer Res.56(1996),973−977)およびヒトToll様受容体2遺伝子(TLR2)(データは示されていない)でも得られた。図9Cに示されるように、CHI3L1遺伝子座におけるメチル化および非メチル化DNAのプロフィールは上記供試のCpGアイランドプロモーターのプロフィールとは有意に異なっていた。ほとんどの非処理CHI3L1断片は低NaCl濃度において回収され、そのDNAがSssIメチル化された場合に、より高いNaCl濃度への若干のシフトが見られた。
【0221】
上記の溶出プロフィールの解析から次のことが示唆される。
a.)低または高塩画分のいずれかで、低メチル化ゲノム断片より200〜300倍強い富化が見られる。
b.)低CpG密度の断片は高塩画分から主として排除される。
c.)分画MCIpアプローチはCpGメチル化密度における小さな違いを分解することができる{SssI処理単球DNAと非処理単球DNAの間の平均的な違いはメチル化CpG残基12のうちおよそ6個である(データは示されていない)}。
【0222】
MCIpが腫瘍サンプルにおける異常な高メチル化を検出できるかどうかを調べるため、3つの白血病細胞系統(KG1、U937、THP−1)並びに健康なドナーの単球からのDNAを、高塩画分におけるSNRNP、CDKN2B、ESR1およびTLR2プロモーター富化に関して分析した(図9D〜G参照)。TLR2遺伝子プロモーターは、KG−1およびU937細胞においては富化されたが、THP−1または正常細胞においては富化されなかった。TLR2のメチル化パターンを重亜硫酸塩シークエンシングにより確認した(Haehnel,J.Immunol.168(2002),5629−5637)(データは示されていない)。CDKN2B(KG−1とU937)およびESR1(KG−1)の結果もこれまでに公開されている研究に一致していた(Chim(2003);Dodge(2001);Issa(1996),全て前掲)。上記3つのMseI断片で、正常細胞由来のDNAにおいて富化されたものはなかった。その刷り込み関連のメチル化状態に従い、SNRPN遺伝子プロモーターは全ての白血病細胞系統並びに正常細胞で有意に富化された。これらの実験により、高塩MCIp画分は高い程度のCpGメチル化を有するゲノムDNA断片を特異的に富化することが確認された。
【0223】
【表5】

【0224】
5.1.2
ゲノムDNAの複雑な混合物における単一遺伝子断片の検出に必要はDNAの量を決定するため、DNA断片の量を引き下げてMCIpおよびその後のLightCyclerリアルタイムPCRを行った。図6に示されるように、メチル化TLR2プロモーターはU937細胞由来のゲノムDNA 1ngといった少量から、富化および検出が可能である。非メチル化p15−プロモーターは、U937細胞においては有意には富化されなかった(20ng、MCIp溶出物)、または検出できなかった(4ngまたは1ng、MCIp溶出物)(図6)。これらの結果は、MCIpが、複雑なゲノム混合物においてメチル化DNA断片を検出するための高感度の方法であることを示す。
【0225】
このアプローチの感度を調べるため、MCIpアプローチを用い、U937DNAの量を引き下げて分析した。TLR2(強いメチル化)およびCDKN2B遺伝子断片(メチル化無し)の富化を、LightCyclerリアルタイムPCRにより測定した。図10Aに示されるように、MCIp手順に対してゲノムDNA断片1ngといった少量(およそ150腫瘍細胞に相当)を用いて、TLR2断片の有意な富化が達成された。腫瘍由来のサンプルは有意な数の正常細胞を含む場合があり、それはほとんどのCpGアイランドにおいてメチル化されていないと予想される。
【0226】
CpGメチル化の検出が細胞純度に関してどのような直線性があるかを調べるため、正常血液細胞および白血病細胞系統KG−1由来のDNAの混合物を用いてMCIpを行ったところ、いくつかのプロモーターでCpGアイランドの高レベルのメチル化が示された。図10Bに示されるように、KG−1 DNAを含有するサンプルでのみTLR2プロモーター断片が検出され、そのシグナルは、サンプル中のメチル化DNAの割合と共に緩やかに増強された。ESR1遺伝子座についても同様の結果が得られた(データは示されていない)。一般に、標的遺伝子断片がCpGアイランド内に近位プロモーターのみを含んでいた場合に、最も有益(転写に対する効果に関して)かつ最も明瞭な結果(ノイズおよびバックグラウンドの点で)が得られた。また、酵素の制限作用の他、機械的手段、例えば、音波処理によってもDNAの断片化が達成され得る(データは示されていない)。
【0227】
5.2 マイクロアレイ技術を用いたゲノムレベルでの定量
5.2.1
ライゲーション媒介(LM)−PCRを用いたゲノムMseI−断片由来のDNAアンプリコンの生成
MseI適合性LMPCR−リンカーを生成するため、オリゴヌクレオチドLMPCR S−L(5’−GCG GTG ACC CGG GAG ATC TCT TAA G−3’)(配列番号22)およびLMPCR AS−L(5’−TAC TTA AGA GAT C−3’)(配列番号23)を次のようにアニーリングした。両オリゴをヌクレアーゼフリーH2O(USB)中20μMの濃度で混合し、80℃で10分間インキュベートし、室温までゆっくり冷却した。アニーリングしたリンカーを50μlのアリコートとして−20℃で保存した。
【0228】
LMPCR−リンカー(0.5μl/ng溶出DNAまたは投入DNA)を、60μlの反応液中、1μlのT4−リガーゼ(1200u/μl,NEB)を16℃ o/nで用い、溶出DNAと連結し、さらに別の反応で同量の投入DNAと連結した。リンカー連結DNAをQIAquickPCR精製キット(Qiagen)を用いて脱塩し、55μlのTris−HCl pH8.0(5mM)で溶出させた。
【0229】
リンカー連結DNA(溶出および投入それぞれ)を、LMPCR−プライマー(5’−GTG ACC CGG GAG ATC TCT TAA G−3’)(配列番号24)およびTaqDNAポリメラーゼ(Roche)を用いてPCR増幅させた。このPCR混合物は、総量250μl中、25μlの10×PCRバッファー(Roche)、15μlのMgCl2(25mM,Roche)、10μlのdNTP(各10mM)、65μlベタイン(5M,Sigma)、2.5μlのLMPCR−プライマー、45μlのリンカー連結DNA、2.5μlのTaqDNAポリメラーゼ(5U/μl)を含み、これを5本のPCRチューブに分注した。サイクリングパラメーターを58℃2分(LMPCR AS−L融解)、72℃5分(オーバーハングの充填);95℃30秒、58℃30秒、72℃3分の増幅15サイクル;72℃10分の最終伸張とした。
【0230】
PCR反応液を混合し、QIAquickPCR精製キット(Qiagen)を用いて精製した。溶出アンプリコンおよび投入アンプリコンの双方を、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0231】
5.2.2 CpGアイランドマイクロアレイを用いたMCIpアンプリコンの分析
単一遺伝子断片の富化を検出するため、MCIpアンプリコンを、PCR(LightCycler,標準的PCR)を用いて分析した。多重遺伝子断片を検出するため、アレイ技術を用い得る。例えばCpGアイランドマイクロアレイを用いたMCIpアンプリコンの分析は、MCIp−DNA断片の蛍光標識と、その後の標準的プロトコールを用いたマイクロアレイとのハイブリダイゼーションを含む。
【0232】
実施例6:メチル結合ポリメラーゼ連鎖反応(MB−PCR)を用いたCpGメチル化DNA断片の検出のための一試験管アッセイ
この方法はELISAと類似のアプローチを用いる。CpGメチル化DNAに対して高親和性を有するタンパク質を、PCRサイクラー適合性反応容器の壁面にコーティングし、ゲノムDNA混合物から高メチル化DNA断片を選択的に捕捉するために使用する。特定のDNA断片(例えば、特定の遺伝子のCpGアイランドプロモーター)の保持は、同じ試験管でPCR(標準的PCRまたはリアルタイムPCR、単一または多重)を用いて検出することができる。メチル化の程度は、ゲノム投入DNAのPCR反応に対して評価することができる。図7は、MB−PCRの模式図を示す。
【0233】
6.1 DNAの調製および断片化
3つの細胞系統(KG1、U937、およびTHP−1)、正常ヒト単球(健康なドナー)およびAML患者の冷凍芽細胞からのゲノムDNAを、Blood and Cell Culture Midi Kit(Qiagen)を用いて調製した。このゲノムDNA調製物の質はアガロースゲル電気泳動により制御し、DNA濃度をUV分光光度法により測定した。ゲノムDNAをMse I(NEB)で消化し、最後に、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて定量した。
【0234】
6.2 PCR試験管の調製
MBD−FcコーティングPCR試験管を、熱安定性TopYield(商標)ストリップ(Nuncカタログ番号248909)を用いて調製した。50μlの組み換えMBD−Fcタンパク質(10mMのTris/HCl pH7.5中、15μg/mlに希釈)を各ウェルに加え、4℃で一晩インキュベートした。ウェルを200μlのTBS(150mMのNaClを含有する20mMのTris,pH7.4)で3回洗浄し、4℃で一晩、100μl遮断溶液(150mMのNaCl、4.5%スキムミルク粉末、5mMのEDTAおよび各0.8μg/mlのポリd(l/C)、ポリd(A/Tおよびポリd(CG)を含有する10mMのTris,pH7.5)で遮断した。試験管を200μlのTBST(0.1%Tween−20を含有するTBS)で3回洗浄した。
【0235】
6.3 メチル化DNAの結合
50μlの結合バッファー(400mMのNaCl、2mMのMgCI2、0.5mMのEDTA、および0.1%Tween−20を含有する20mMのTris,pH7.5)を各ウェルに加え、1μlのMseI消化DNA(10ng/μl)を各第2のウェルに加えた(M−反応)。ウェルを4℃で3時間、シェーカー上でインキュベートした。試験管を200μlの結合バッファーで3回、10mMのTris/HCl pH7.5で1回洗浄した。
【0236】
6.4 メチル化DNA断片の検出
TopYield(商標)ストリップで直接PCRを行った。PCR混合物(50μl/ウェルl)は、標準的なPCRバッファー(Roche)、2.5U FastStart TaqDNAポリメラーゼ(Roche)、各10pmolの遺伝子特異的プライマー(Qiagenにより合成)、dNTP(各200mM,Amersham/Pharmacia)、1Mベタイン(Sigma)を含み、プライマー配列およびサイクリングパラメーターはそれぞれ表2および3に示される。このPCR混合物を加えた後、1μlのMseI消化DNA(10ng/μl)を、事前にDNA断片と共にインキュベートしなかった各第2のウェルに加えた(P−反応)。PCR産物を、アガロースゲル電気泳動を用いて分析し、臭化エチジウムで染色したゲルを、Typhoon9200Imager(Amersham/Pharmacia)を用いて走査した。
【0237】
【表6】

【0238】
【表7】

【0239】
図8は、5つの細胞種における、3つの異なるCpGアイランドプロモーターのメチル化プロフィールを分析するMB−PCR実験の結果を示す。Pと表示したレーンは、ゲノム投入DNAの増幅を示す。THP−1細胞のp15遺伝子を除き(おそらく欠失または突然変異)、全てのプロモーターが増幅された。注目すべきは、正常DNA対照からのMB−PCR反応において検出されたプロモーターは無かったことであり、これは、正常個体においてこれらのプロモーターがメチル化されていないという事実と一致する。これらの細胞系統並びに患者サンプルにおいては、プロモーターは大部分メチル化されていた。これらの結果は、独立した実験のMCIpで得られたデータと一致する。
【技術分野】
【0001】
本発明は、メチル−CpG結合タンパク質(MBD)のファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する核酸分子に関する。さらに、上記核酸分子、及び当該核酸分子によりコードされるポリペプチドを含むベクター、及び宿主細胞、並びに当該ポリペプチド製造するための方法を開示する。さらに、本出願は、上記ポリペプチド及び組成物、特に上記核酸分子、ベクター、宿主細胞、ポリペプチド又は抗体を含む診断用組成物を特異的に結合する抗体を提供する。さらに、特に腫瘍組織又は腫瘍細胞において、メチル化DNAを検出するための本発明のポリペプチドを使用する方法、及び使用を提供する。
【背景技術】
【0002】
全生体の細胞を形成するための情報は、それらのDNA中に含まれる。DNAは、G、A、T、及びCとして省略された4塩基からなり、はしごの「横木」の各々を形成するこれらの文字と対を有する非常に長い当該はしごのように形成される。当該文字Gは、Cと対になり、AはTと対になる。これらの対の文字列は、遺伝子と呼ばれる領域に分類された特定の細胞を形成するための情報と共に、コードされたメッセージのような情報を保存する。2倍体動物の全細胞は、全遺伝子の2つのコピーを含む。一方は、母親由来のものであり、もう一方は父親由来のものである(このルールの唯一の例外は、生物が「雄」か「雌」のいずれかとして発達することを決定する染色体上の遺伝子である。)。
【0003】
DNAのメチル化、及び遺伝子調節
私たちのゲノムを「つづる」4つの塩基−アデニン、グアニン、シトシン、及びチミンは別として、複製後のDNAの一時的変異により産生される5番目の塩基もある。DNAメチルトランスフェラーゼ(DNMT)は、メチル供与体S−アデノシルメチオニンからシトシン環へのメチル基の移転を触媒し得る、そしてその結果、5−メチルシトシン塩基を形成する。特定のシトシン残基が哺乳類において修飾され、それは、DNA配列のグアノシン残基の前にある(CpGジヌクレオチド)(Singal,Blood93(1999),4059-4070);Robertson,Nat.Rev.Genet.1(2000),11−19;Ng,Curr.Opin.Genet.Dev.(2000),158−163;Razin,EMBO J.17(1998),4905−4908)。当該CpGジヌクレオチドのメチル化は、一般的に、安定した転写抑制と関連し、おそらく、非コードゲノムの大部分、及びトランスポゾン、繰り返し体、ウイルス性挿入部分の如き潜在的に有害な配列は転写されないといった事実を導く。CpGジヌクレオチドが、ゲノム中において、非常に遍在していることは興味深い(Singal(1999),loc.cit,Robertson(2000),loc.cit.,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。
【0004】
ゲノムの大部分は、統計的に予期されるよりも非常に少ないCpGを含む。このことは、おそらく、5−メチルシトシンは比較的容易にアミノ基を取り去りチミジンとなり、進化の過程で、当該CpGジヌクレオチドの数の低減を導くという事実に起因する。しかしながら、ゲノム中に区分される何度も繰り返される多くのCpG、いわゆるCpGアイランドがある。これらの領域は、しばしば、転写開始点、及び遺伝子プロモーターを含み、そして一般的に、CpGアイランドに関連しないCpGとは対照的にメチル化されない。正常細胞において、当該CpGアイランドのメチル化は、雌性細胞中のX染色体、及び親の刷り込みゲノムの第2転写の不活性化の如き例外的ケースの場合のみ観察される(Singal(1999),loc.cit.,Robertson(2000),loc.cit.,Ng(2000),loc.cit,Razin(1998),loc.cit)。
【0005】
DNAメチル化の調節
DNAメチル化パターンが胚形成の過程中でどのように確立されるのか、及びCpGメチル化がどのようにゲノム中に維持され、調節されるのかは、一部しかわかっていない(Singal(1999),loc.cit,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。哺乳類において、DNAメチル化過程を触媒する既知の3つのDNAメチルトランスフェラーゼ(DNMT1、3a、及び3b)がある。各DNMTがCpGメチル化の維持、及び調節に寄与する対応分担は、明らかとされなければならないが、いまだ明らかではない。しかし、全3つの酵素は、明らかに胚形に必要不可欠であり、対応するノックアウトマウスは、生まれる前に、又は生後間もなく死に至る(Bestor,Hum.MoI.Genet.9(2000),2395−2402;El Osta,Bioessays 25(2003),1071−1084)。その間、DNAメチル化、クロマチン構造の一時的変異と、特定のヒストン一時的変異との関連は、数回見られる。DNAのメチル化は、ヒストン脱アセチル化、及びヒストンH3でのリジン9残基のメチル化と大部分関係がある(Sims,Trends Genet.19(2003),629−639,Fahrner,Cancer Res.62(2002),7213−7218)。従って、DNMTは、ヒストンアセチラーゼ(HDAC)又はコリプレッサー複合体と関連する。メチル基がどのようにCpG残基から除かれるのかもほとんどわかっていない。増殖細胞において、DNAメチル化は、おそらく複製の間にも受動的に生じ得るだろう。しかしながら、活性のある未知のデメチラーゼの存在により説明され得る有糸分裂細胞におけるDNA脱メチル化の例もある(Wolffe,Proc.Natl.Acad.Sd.96(1999),5894−5896)。
【0006】
CpGメチル化、及び遺伝子抑制
プロモーターのメチル化(しかし、非調節配列のものではない)は、安定、転写抑制と相互に関連する(Singal(1999),loc.cit.,Ng(2000),loc.cit.,Razin(1998),loc.cit.)。5−メチルシトシンの抑制特性は、2つの機構により影響され得る。第1に、DNAメチル化は、転写因子の結合を直接的に損なわせ得るというもの。第2に、抑制の最大部分に関与しそうな可能性は、メチル−CpG−結合タンパク質(MBP)の増大であるというものである(Ballestar,Eur.J.Biochem.268(2001),1−6)。MECP2又はMBD2(MeCP1複合体の構成要素)の如きMBPは、コリプレッサー複合体、及び抑制作用を有するHDACを伴い、そして転写因子に利用できない高密度クロマチン構造(ヘテロクロマチン)の形成に関与する(Ballestar(2001),loc.cit)。
【0007】
腫瘍形成における後成的変化
腫瘍の形成が、遺伝子病変(例えば、突然変異又は転座)だけでなく、後成的変化によっても支持されることが明らかとなっている。異常なクロマチン構造又はDNAメチル化は、腫瘍遺伝子又は腫瘍抑制遺伝子の転写状態に影響を与え得、及び腫瘍の成長を促進し得る。当該DNAメチル化における変化は、正常なメチル化配列におけるメチル化の損失(低メチル化)、あるいは正常な非メチル化配列におけるメチル化(高メチル化)のいずれかを含む(Roberston(2000),Ioc.cit.,Herman,N.Engl.J.Med.349(2003),2042−2054;Momparler,Oncogene22(2003),6479−6483;Esteller,Science297(2002),1807−1808;Plass,Hum.Mol.Genet11(2002),2479− 488)。
【0008】
低メチル化
広範囲のDNA低メチル化は、ほぼ全ての種類の腫瘍について記載される。腫瘍組織において、5−メチルシトシン含有量は、反復サテライト配列又は染色体のセントロメア領域に見られる脱メチル化事象の大部分を有する正常な組織と比較して、低減される。しかしながら、個々の場合、bcl-2又はc-mycの如き原がん遺伝子の脱メチル化、及び活性化もまた記載される(Costello,J.Med.Genet.38(2001),285−303)。
【0009】
CpGアイランドの高メチル化
CpGアイランドは、通常、遺伝子調節機能に影響を及ぼす。これは、メチル化状態における変化が、関連する遺伝子座の転写活性における変化と主に直接的に関与することによる(Robertson(1999);Herman(2003);Esteller(2002);Momparler(2003);Plass(2002),all Ioc.cit。)。大抵のCpGアイランドは、正常細胞における非メチル化形態中に存在する。しかしながら、ある態様において、CpGアイランドは、遺伝子調節事象においてもメチル化され得る。例えば雌性細胞の非活性化X染色体のCpGアイランドの大部分は、メチル化される(Goto,Microbiol.Mol.Biol.Rev.62(1998),362−378)。CpGアイランドは、正常な老化作用の過程においてもメチル化され得る(Issa,Clin.Immunol.109(2003),103−108)。
【0010】
特定の腫瘍において、通常メチル化されないCpGアイランドが高メチル化形態に存在し得る。多くの場合において、高メチル化により影響を受ける遺伝子は、腫瘍抑制遺伝子の如き腫瘍の成長に対抗するタンパク質をコードする。以下の表は、高メチル化の後成的機構を通じて腫瘍中で非活性化され得ることが明らかである遺伝子の例を挙げるものである。
【0011】
【表1】

【0012】
腫瘍特異的高メチル化の理由は、ほとんどわかっていない。興味深いことに、ある種の腫瘍は、それら自身の高メチル化プロフィールを有しているようである。高メチル化が均一に分布されず、腫瘍に依存して生ずることが、より多くの比較研究において示され得た。白血病の場合、例えば結腸がん又は神経こう腫と比較して、ほとんど他の遺伝子が高メチル化される。それ故、高メチル化は、腫瘍を分類するために有用となり得た(Esteller,CancerRes.61(2001),3225−3229;Costello,Nat.Genet.24(2000),132−138)。
【0013】
多くの場合において、高メチル化は、HDACの増大活性も混合される。脱メチル化物質(例えば、5−アザシチジン)での処理の後、メチル化遺伝子は、HDAC阻害剤(例えば、トリコスタチン(TSA))も使用した後にのみ、再活性化され得た(Suzuki,Nat.Genet.31(2002),141−149;Ghoshal,Mol.Cell.Biol.22(2002),8302−8319;Kalebic,Ann.N.Y.Acad.Sci983(2003),278−285)。
【0014】
大抵の分析は、DNAのメチル化は優位に抑制されること、及びTSAの如きHDAC阻害剤での処理により逆転され得ないことを示す(Suzuki(2002);Ghoshal(2002),loc.cit)。しかしながら、既に臨床に使用されるHDAC阻害剤、バルプロエートは、DNAの脱メチル化を導きうることもさらに最近示された(Detich,J.Biol.Chem.278(2003),27586−27592)。しかしながら、この観点において実施される系統的分析は、今のところない。
【0015】
後成的変化を逆転するための臨床的研究
がん(例えば突然変異)の遺伝的原因は不可逆的なものであるが、腫瘍形成に対する役割に寄与する後成的変化は可逆的となり得る。それ故、後成的変化の可能な処置は、新組織形成の治療のための新たな可能性を提示する(Herman(2003);Momparler(2003);Plass(2002),allloc.cit.;Leone,Clin.Immunol.109(2003),89−102;Claus,Oncogene 22 (2003), 6489−6496)。
【0016】
20年以上前、5−アザシチジンは、抗腫瘍薬として既に開発されており、及び知られた基質の分子効果なしに使用されていた。現在、さらに発達した形態(デオキシ−5−アザシチジン,デシタビン)において、骨髄異形成症候群、及び二次性白血病の治療のために、すでに首尾よく使用されている(Leone(2003),loc.cit.;Lyons,Curr.Opin.Investig.Drugs 4(2003),1442−1450;Issa,Curr.Opin.Oncol.15(2003),446−451)。
【0017】
HDAC阻害剤がメチル化プロモーターの再活性化を支持し得、及び脱メチル化基質と相乗的に作用し得るといった生体外の観察に起因して、現在、基質双方の種類の使用を含む、試験的研究が世界中で実施される(Kalebic(2003);Claus(2003),loc.cit.;Gagnon,Anticancer Drugs 14(2003),193−202;Shaker,Leuk.Res.27(2003),437−444)。
【0018】
CpGメチル化の分析のための検出方法
ゲノムのCpGメチル化分析のための検出方法の開発は、CpGメチル化パターンにおける変化ががんの如き疾患に関連し得ることが見出される事実に起因する重要性を主に有している。現在のところ、主に、既知の遺伝子座のCpGメチル化の検出のために使用されることが知られている技術がある(Dahl,Biogerontology4(2003),233−250)。ゲノムを通じてCpGメチル化の分析を可能とする方法は、ほとんど確立されていない。以下に、適用の主要分野と共にCpGメチル化の分析のための最も一般的な方法を要約する。
【0019】
CpGメチル化の検出のためのメチル化感受性制限酵素の使用
特異的CpGジヌクレオチドのメチル化状態が、5−メチルシトシンに対する異なる感受性により特徴づけられる細菌の制限エンドヌクレアーゼのイソシゾマーを使用して、検出され得る。それらの例は、双方ともCCGG配列を切断する酵素HpaII、及びMspIであって、しかしながら、HpaIIは、内部シトシンがメチル化されない場合に限られる。いくつかのアッセイは、メチル化感受性制限酵素の使用に基づき、上記アッセイは、個々の遺伝子の分析、及び当該ゲノムを通じたCpGメチル化の分析の双方のために使用され得る。メチル化感受性制限消化の断片は、サザンブロット又は制限部位の側面に接する領域のゲノムPCRにより、主に検出される(Dahl(2003),loc.cit.)。現在までに刊行されている、ゲノムを通じたCpGメチル化の全分析法は、当該方法の構成成分として、メチル化感受性制限酵素を使用する。制限ランドマークゲノムスキャニング法(Restriction Landmark genomic Scanning、RLGS)(Costello,Methods27(2002),144−149)は、例えば、全次元が異なるメチル化感受性制限酵素で消化され2つのDNA母集団のCpGメチル化における相違を特定する、一種の2次元アガロースゲル電気泳動を使用する。メチル化CpGアイランド増幅法(Methylated CpG Island Amplification、MCA)は、メチル化SmaI制限部位を有する断片を充実させ、そして当該断片を増やすためにLM−PCRを使用する。かかる増幅産生物は、表示差異分析(Representational Difference Analyzis、RDA)(Smith,Genome Res.13(2003),558−569)又はCpGアイランドマイクロアレイ(Yan,Cancer Res.6(2001),8375−8380)を用いて、すでに成功裏に分析されている。
【0020】
ゲノムを介したCpGメチル化の分析に関して、メチル化感受性制限酵素に基づいた全アッセイは、不都合を有する。最善の方法で実施するために、とりわけ、全ての制限消化が完了することが保証される必要がある。最も著しい不都合は、当該分析が与える情報が、単に、使用されるメチル化感受性制限酵素により認識されるシトシン残基のメチル化状態に関する情報だけであることである。当該制限酵素の選択は、検出可能な配列の数を自動的に制限する。それ故、当該CpGメチル化の中立分析は、可能性のないものである。
【0021】
CpGメチル化の分析のための重硫酸塩処理
硫酸水素ナトリウムでの二本鎖ゲノムDNAの処理は、非メチル化シトシン残基の脱アミノ化を導きウラシル残基とし、及びもはや相補的ではない2つの一本鎖の形成を導く。この処理の間、5−メチルシトシンが維持される。このようにして形成された配列間の相違は、メチル化DNAと非メチル化DNAとの相違の根拠を作り出す(Frommer,Proc.Natl.Acad.Sci.889(1992),1827−1831)。亜硫酸水素塩で処理されたDNAは、ウラシル残基(以前は非メチル化シトシンであったもの)とチミジン残基がチミジンとして増幅され、5−メチルシトシン残基のみがシトシン残基として増幅されるPCRにおいて直接的に使用され得る。増幅に依存して、PDRに使用されるプライマーは、メチル化配列と非メチル化配列とを区別し、又はメチル化状態とは無関係に、断片を増幅する。例えば、非特徴的なプライマーを使用して増幅されるPCR断片は、直接的にシークエンスされ、メチル化、及び非メチル化CpGの占有率を決定し得る。
【0022】
さらなる方法は、メチル化の程度を決定するために、かかるPCR断片の物理的な相違(融解挙動、一本鎖構造、制限酵素のための制限部位など)を活用する(Dahl(2003),Ioc.cit.)。他の系統的アプローチは、特徴的なプライマー又はプローブによるメチル化、及び非メチル化配列の特異的増幅(メチル化特異的PCR、MethylightPCR)のための配列内の相違を活用する(Dahl(2003),Ioc.cit.)。PCR産物の配列における亜硫酸水素塩−誘導の相違は、メチル化特異的オリゴヌクレオチド(MSO)マイクロアレイを用いても見出され得る(Shi,J.Cell.Biochem.88(2003),138−143;Adorjan,Nucleic Acid Res.30(2002),e21;Gitan,Genome Res.12(2002),158−164)。
【0023】
当該メチル化感受性制限酵素と対照的に、亜硫酸水素塩で処理されたDNAは、増幅されたゲノム断片におけるいくつかのCpG残基のメチル化状態に関する情報を提供し得る。おそらく、その低減された複雑さ、及びその高程度の変性に起因して、当該処理されたDNAは、当該ゲノムを介する分析に適してはいない。
【0024】
CpGメチル化の検出のためのさらなる方法
変性された一本鎖DNA内のCpGメチル化を認識する5-メチルシトシンに対する抗体は、主に個々の固定細胞の染色体上のCpGメチル化の免疫組織化学的染色のために使用される。しかし、これらの抗体は、豊富にメチル化された配列に適してはいない。
【0025】
1994年に既に、A.Bird研究所は、親和性クロマトグラフィーを用いてメチル化DNA断片を濃縮するための方法を開発した(Gross,Nat.Genet.6(1994),236−244)。マトリクスに結合する組み換えMECP2が、メチル化DNAを結合するために使用された。それ以来、この技術は、使用され、改良され、そして他の作業グループによるさらなる技術と組み合わされた(Shiraishi,Proc.Natl.Acad.Sci.96(1999),2913−2918;Brock,Nucleic Acid.Res.29(2001),E123)。親和性マトリクスに対する強力な又はより劣る強力なメチル化ゲノム配列の結合は、濃密なメチル化を伴うCpGアイランドをより低いメチル化密度を伴う他の配列から分離することを可能とする塩濃度に、依存する。この親和性クロマトグラフィーの不都合な点は、大量のゲノムDNA(50〜100μg)を必要とすること、及び比較的時間のかかる手順である。
【0026】
以上の観点から、CpGジヌクレオチドのメチル化が、細胞の転写活性を制御するための重要な後成的機構であることが明らかである。一般的に、CpGジヌクレオチドのメチル化は、転写不活性と関連がある。しかし、正常な又は変性した分化過程の間、遺伝子座のメチル化パターンは変化し得る。従って、腫瘍形成の間、正常なメチル化パターンの逆転は、各々、腫瘍抑制遺伝子又は原がん遺伝子の如き、遺伝子の異常な抑制(又は活性化)を導き得、それ故、腫瘍形成を導く。それ故、CpGメチル化DNAの検出、及びそれ故、調節されない腫瘍抑制遺伝子、及び/又は原がん遺伝子の同定は、最も外部の臨床的興味である。上記のように、先行技術は、メチル化DNAの検出のために異なるアプローチを記載するが、欠陥に悩まされている。例えば、先行技術の方法は、CpGメチル化DNAの中立、ゲノムレベル解析を可能とはせず、又はハイスループット適用に適しておらず、又はCpGメチル化DNAの検出において、特に検出対象として少量のDNAしかないとき、信頼性がない。それ故、先行技術の欠陥、及び欠点を克服し得るメチル化DNAを検出するさらなる手段、及び方法の必要性の余地がある。従って、本発明の根底にある技術的問題は、上記必要性に応じる。
【0027】
この技術的問題に対する解決法は、本願請求項において特徴付けられる態様を提供することにより達せられる。
【発明の概要】
【0028】
よって、本発明の第1の態様は、メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメインと抗体のFc部分とを含む二機能性ポリペプチドをコードするヌクレオチド配列を有するポリヌクレオチドである。該DNA結合ドメインは本明細書で後述される。
【0029】
本発明の別の実施形態では、該断片がメチル化DNA、好ましくはCpGメチル化DNAと結合し得る限り、その断片であってもよい。
【図面の簡単な説明】
【0030】
【図1−1】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。MBD2−Fc二機能性タンパク質のアミノ酸配列は次のような特徴を有する。
【表2】

【図1−2】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。
【図1−3】図1は、プラスミドpMTBip/MBD2−Fcのヌクレオチド配列と、プラスミドpMTBip/MBD2−FによりコードされるMBD2−Fc二機能性タンパク質のタンパク質配列(太字)を示す。
【図2】Drosophila Schneider細胞におけるMBD2−FCの発現。安定トランスフェクトされたS2細胞を、w/o 500μM CuSO4を含む培地w/o FCSに播種した。4日後、上清を回収し、セファロースビーズを用い、4℃でo/n、予備洗浄した。予備洗浄された上清1mlを、Aタンパク質セファロースを用いて沈降させ、洗浄し、SDSローディング色素に再懸濁させ、SDS−PAGEを行った。このゲルをクマシー染色して沈降したタンパク質を検出した。
【図3】逆サウス−ウエスタンブロット。ヒトICSBP−プロモーター(A)の650bpのPCR断片、または種々のCpG密度のメチル化プロモーター断片(50ng)(CpG−ジヌクレオチドの数/100bp:ICSBP:10,6;CHI3L1:2,9;TLR2:6,2;TLR3:2,1)を、SssIを用いてメチル化し、アガロースゲル電気泳動(対照として臭化エチジウム染色が示されている)を行い、ナイロン膜に直接ブロットした。膜を、実施例3に記載するように、MBD2−Fc、HRPコンジュゲート(konjugated)抗ヒトFcおよびECLを用いて染色した。
【図4】MBD−Fcビーズに対するCpGメチル化物の塩濃度依存性結合。(A)ヒトプロモーター断片の模式図。丸はCpG−ジヌクレオチドの位置を示す(白丸:非メチル化CPM;黒丸:SssIメチル化CCL13、TLR2、CHI3L1)。(B,C)メチル化および非メチル化断片の混合物をMBD2−Fc−セファロース(Aタンパク質−セファロース50μl当たりのMBD2−Fcの量が示されている)に結合させ、塩濃度を引き上げて溶出させ、アガロースゲル電気泳動を用いて精製および分離した(投入混合物の1/5と共に)。バンドを臭化エチジウムで可視化し、Typhoon Imager(Pharmacia−Amersham)を用いて走査した。
【図5】MCIpによるCpGアイランドの富化。示された細胞種のゲノムDNA(300ng)に対してMCIpを行った。3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を、LightCyclerリアルタイムPCRを用いて定量した。MCIp溶出物から増幅させた特定のプロモーター断片の量が、非処理のゲノムDNA対照と比較して示されている。THP−1細胞にはp15プロモーターが検出できなかったが、このことはこの遺伝子の突然変異または欠失を示す。
【図6】MCIpによるメチル化CpGアイランド検出の感度。制限ゲノムU937DNAの量を引き下げてMCIpを行った。2つのCpGアイランドプロモーター(TLR2、p15)の富化を、LightCyclerリアルタイムPCRを用いて定量した。MCIp溶出物から増幅させた特定のプロモーター断片の量が、非処理のゲノムDNA対照と比較して示されている。
【図7】MB−PCRの原理。この図はMB−PCRの模式図を示す。
【図8】正常DNAサンプルおよび4つの白血病DNAサンプルにおけるTLR2、ESR1およびp15プロモーターのMB−PCR。示された細胞種のゲノムDNA(10ng)に対してMB−PCRを行った。3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を標準的なゲノムPCRにより検出した。THP−1細胞にはp15プロモーターが検出できなかったが、このことはこの遺伝子の突然変異または欠失を示す。
【図9】リアルタイムPCRを用いた特定のCpGアイランドプロモーターにおけるCpGメチル化のMCIp検出。(A〜C)分画メチル−CpG免疫沈降(MCIp)をリアルタイムLightCycler PCRと併用し、非処理(グレーのバー)並びにSssIメチル化およびMseI制限ゲノムDNA断片(黒いバー)由来の示された遺伝子のメチル化状態を検出した。MCIp溶出物から回収された遺伝子断片(上の四角にはNaCl濃度(mM)を示す)および同量の投入DNAをLightCycler−PCRにより増幅させた。個々の画分の値(平均値±SD,n=4)は回収率%を表し、個々の投入DNAから生成したPCR産物の量(100%)に対して算出する。各図の上に相当するCpGアイランドの3kB領域を模式的に示している。各CpGジヌクレオチドは垂直線により示されている。エキソンの位置はグレーの四角として示され、転写開始部位は矢印で示されている。白四角は100bp断片を表す。黒四角は検出されるMseI断片の位置を示す。(D〜G)3つのヒト骨髄性白血病細胞系統(KG−1、U937およびTHP−1)並びに正常ヒト血液単球(N)の高塩(1000mM)MCIp画分におけるSNRPN、TLR2、ESR1およびCDKN2Bを、上記のようにリアルタイムPCRにより分析した。
【図10】MCIpアプローチの感度および直線性。(A)MseI処理されたU937DNAの量を引き下げて、MCIpを行った。CDKN2BおよびTLR2遺伝子断片を上記のように定量した。(B)正常ヒト血液単球(N)とKG−1細胞のMseI処理DNAを示された比率で混合し、その混合物に対してMCIpを行い、TLR2遺伝子断片を上記のようにLightCycler−PCRを用いて定量した。
【発明を実施するための形態】
【0031】
本発明好ましい一実施形態では、本発明の二機能性ポリペプチドをコードするヌクレオチド配列を含む核酸分子は、リンカーポリペプチドをコードするヌクレオチド配列 をさらに含む。好ましくは、該リンカーポリペプチドをコードするヌクレオチド配列は、本発明の二機能性ポリペプチドをコードするポリヌクレオチドにおいて、MBDをコードするヌクレオチド配列とFc部分の間に、該MBDとリンカーポリペプチドとFc部分の間で融合が起こるように配置される。「融合」とは、タンパク質をコードする核酸分子の遺伝子発現により個々のペプチド主鎖を介して複数のタンパク質またはその断片が共に線状結合することを指す。よって、好ましい融合タンパク質としては、MBDのDNA結合ドメインまたはその断片が含まれ、この断片は好ましくは、本明細書に記載されるような抗体のFc部分とそれ自体共有結合しているリンカーポリペプチドと共有結合している、メチル化DNA、好ましくは、CpGメチル化DNAとの結合活性を有する。
【0032】
該ポリペプチドリンカーは好ましくは、フレキシブルリンカーである。好ましくは、該リンカーは複数の、親水性の、ペプチド結合アミノ酸を含み、MBDのDNA結合ドメインのC末端とFc部分のN末端を接続している。場合により、本発明のポリペプチドは、所望により該Fc部分の切断を可能とするプロテアーゼ切断部位をFc部分の前に含む。プロテアーゼ切断部位は例えば、トロンビン切断部位である。
【0033】
好ましくは、該ポリペプチドリンカーは、複数のグリシン、アラニン、アスパラギン酸塩、グルタミン酸塩、プロリン、イソロイシンおよび/またはアルギニン残基を含む。該ポリペプチドリンカーは複数の、アミノ酸配列の連続コピーを含むのがさらに好ましい。通常、ポリペプチドリンカーは、1〜20、好ましくは、1〜19、1〜18、1〜17、1〜16または1〜15のアミノ酸を含むが、20を超えるアミノ酸のポリペプチドリンカーも同様に機能し得る。本発明の好ましい一実施形態では、該ポリペプチドリンカーは、1〜14のアミノ酸残基を含む。本発明の特に好ましい一実施形態では、本発明のポリペプチドにおける該ポリペプチドリンカーは14のアミノ酸を含む。添付の実施例に示すように、該ポリペプチドリンカーは有利には、配列番号2(図1)の116〜129番でも示されるアミノ酸配列「AAADPIEGRGGGGG」を含む。
【0034】
本発明のポリペプチドは場合により、そのN末端および/またはC末端にタグを含む。「タグ」は、そのタグが融合するアミノ酸配列と同種または異種のアミノ酸配列である。該タグはとりわけ、それが融合するタンパク質の精製を容易にする、または該タンパク質の検出を容易にすることができる。好ましくは、該タグは、HAタグ、myc6タグ、flagタグ、strepタグ、strepllタグ、TAPタグ、HATタグ、キチン結合ドメイン(CBD)、マルトース結合タンパク質、免疫グロブリンA(IgA)、His−6タグ、グルタチオン−S−トランスフェラーゼ(GST)タグ、インテインおよびストレプトアビジン(streptavidie)結合タンパク質(SBP)タグからなる群から選択される。
【0035】
CpGアイランドは多くの場合、遺伝子プロモーターと転写開始部位を含み、通常、正常細胞ではメチル化されていない。CpGアイランドのメチル化は、転写抑制と関連している。がんでは、CpGアイランドプロモーターのメチル化は腫瘍抑制遺伝子の異常なサイレンシングをもたらし、疾病の病因に関与している。これまでに、ヒトのがんにおけるCpGアイランドの異常なメチル化の研究は主として候補遺伝子アプローチを採ってきたが、これにはいくつかの欠点がある。これらは例えば、高メチル化であれ低メチル化であれ、メチル化の対象となり得る腫瘍形成に関与する遺伝子座のカバーが不完全なこと、または例えば、Restriction Landmark Genomic Scanning(RLGS)を用いる場合、手段および方法の限定により遺伝子座の解析が不完全なことである。偏りのない、CpGメチル化DNAのゲノム全域検出を可能とするため、本発明は、例えば、メチル化感受性制限エンドヌクレアーゼまたは重亜硫酸塩処理を適用せずに、CpGメチル化の分離および検出を可能とする手段および方法を提供する。これらの手段および方法はとりわけ、CpGメチル化DNAと効率的に結合する、メチル−CpG結合性抗体様タンパク質に基づく。本明細書に記載されるように、このメチル−CpG結合性抗体様タンパク質は、メチル−CpG結合タンパク質(MBD)ファミリーに属すタンパク質のDNA結合ドメインと抗体の定常部分とを含む。
【0036】
驚くことに、組み換えメチル−CpG結合性抗体様タンパク質は、抗体のような様式でCpGメチル化DNAに、好ましくは結合することができることが判明した。これは、本発明のメチル−CpG結合性抗体様タンパク質が、CpGジヌクレオチドにおいて、好ましくは、メチル化されるDNAであることが好ましいその「抗原」に対して、高い親和性と高い結合力を有することを意味する。特定の理論に拘束されるものではないが、本発明のポリペプチドの、その「抗原」に対する高い親和性と結合力は、該メチル−CpG結合性抗体様タンパク質の独特の構造により生じるものである。本発明のポリペプチドのユニークな構造は、抗体の定常領域の存在により達成されるものと推測され、従って、当該ポリペプチドは好ましくは二機能性分子となる。これらの定常領域は、本発明の2つのポリペプチドの分子の各定常領域の免疫グロブリン重鎖の間でジスルフィド結合を形成すると考えられている。よって、抗体様構造は、抗体の構造を密接に類似して形成されることが好ましい。
【0037】
ここでも特定の理論に拘束されるものではないが、この構造は例えば、本発明のポリペプチドに安定性をもたらすものと思われる。これは、当技術分野において、抗体の定常領域と融合されたタンパク質は、該タンパク質により高い安定性とより長い半減期を与え得るとされているためである。さらに、これらの定常領域の分子間相互作用によって生じた抗体様構造は、本発明のあるポリペプチドのメチル−DNA結合ドメインを、本発明の別のポリペプチドのメチル−DNA結合ドメインの近接近に持ってくると考えられている。これにより、メチル−DNA結合タンパク質とメチル化DNAの間で二価の相互作用が可能となる。よって、本発明のポリペプチドは、本発明のポリペプチドの一部である2つのメチルDNA結合ドメインを介してその抗原に好ましく結合することができる。
【0038】
本発明のポリペプチドの高親和性結合はまた、とりわけ、好ましくは、本明細書に記載されているような独特の適用性を妨害または干渉し得る他のタンパク質との相互作用のためのドメインを含む全長メチル−DNA結合タンパク質の代わりに、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと特異的に結合することが知られているタンパク質のメチル−DNA結合ドメインを使用することによっても達成される。このメチル−DNA結合ドメインの使用はさらに、この検出は直接的なものであって間接的なものないことから、実際にメチル化DNAが結合していることが保証される。ほとんどの先行技術の方法は、PCRによりメチル化DNAを間接的に検出できるにすぎない。
【0039】
これらの特性は本発明のポリペプチドを、たとえ該DNAが、本明細書に記載されるように、例えば、約10ngを超える量、10ng未満、7.5ng未満、5ng未満、2.5ng未満、または約1ngといった極めて少量でしか存在しない場合であっても、とりわけ、メチル化DNAを単離、精製富化および/または検出するための信頼性があり、かつ、容易に適用できる診断ツールとする。よって、本発明のポリペプチドは、その抗体様構造のために、例えば、単一試験管アッセイにおいて多段階手順を含む様々な適用にそれを適用可能とする強力な分子である。例えば、CpGメチル化DNAの特異的分離および検出は、逆サウスウエスタンブロット解析およびメチル−CpG免疫沈降法(MCIp)を用いて実証された。この技術は、リアルタイムPCR、例えば、LightCycler PCRと組み合わせると、例えば、全ゲノムDNAが1ngといった少量からの、候補CpGアイランドプロモーターのCpGアイランドメチル化の高感度検出を可能とする。MCIpにより生成されたゲノムDNA断片は、容易に増幅、標識およびCpGアイランド・マイクロアレイ・ハイブリダイゼーションに使用することができる。本明細書に記載の技術を使用すれば、ヒトがんにおけるCpGアイランドの異常なメチル化のゲノム域プロフィールの作製、および例えば、腫瘍抑制遺伝子またはさらなる抑制遺伝子活性の同定が可能となる。
【0040】
本発明を詳しく記載する前に、本明細書に記載される特定の方法論、プロトコール、細菌、ベクターおよび試薬は変更可能であるので、本発明はこれらに限定されないことを理解すべきである。また、本明細書で用いられる用語は単に特定の実施形態を記載するためのものであって、本発明の範囲を限定するものではなく、本発明の範囲は添付の特許請求の範囲によってのみ限定されることを理解すべきである。特に断りのない限り、本明細書で用いられる技術用語および科学用語は全て、当業者が一般に理解しているものと同じ意味を有する。
【0041】
好ましくは、本明細書で用いられる用語は、“A multilingual glossary of biotechnological terms:(IUPAC Recommendations)”,Leuenberger,H.G.W,Nagel,B.and KoIbI,H.eds.(1995),Helvetica Chimica Acta,CH−4010 Basel,Switzerland)の記載と同様に定義される。本明細書および特許請求の範囲を通じ、特に断りのない限り、「含む」およびその活用形は、示されている数字若しくはステップまたは一連の数字若しくはステップを包含することを意味するが、他のいずれの数字若しくはステップまたは一連の数字若しくはステップを排除するものではないと理解される。本明細書および添付の特許請求の範囲において、単数形「a」、「an」、および「the」は、特に断りのない限り、複数の指示対象も含むということに留意しなければならない。よって、例えば、「ある試薬(a reagent)」と記載する場合には、そのような種々の試薬の1又は複数を含み、また、「その方法(the method)」と記載する場合には、本明細書に記載の方法に対して改変または置換可能な当業者に知られている等価なステップおよび方法に対する言及も含む。
【0042】
本明細書において「核酸分子」とは、当該核酸分子により含まれるプリン塩基およびピリミジン塩基を含む塩基のヌクレオチド配列を有する任意の核酸分子を包含し、これにより該塩基は核酸分子の主要構造を呈する。核酸配列は、センス鎖であれアンチ鎖であれ、DNA、cDNA、ゲノムDNA、RNA、合成形態(例えば、PNA)、および混合ポリマーを含むか、或いは当業者ならば容易に認識できるように、非天然若しくは誘導体化ヌクレオチド塩基も含み得る。本発明のポリヌクレオチドは、好ましくは、ポリリボヌクレオチドまたはポリデオキシリボヌクレオチドからなり、非修飾RNA若しくはDNA、または修飾RNA若しくはDNAであってもよい。例えば、ポリヌクレオチドは一本鎖および二本鎖DNA、一本鎖領域と二本鎖領域の混合物であるDNA、一本鎖および二本鎖RNA、並びに一本鎖領域と二本鎖領域の混合物であるRNA、一本鎖またはより典型的には二本鎖、または一本鎖領域と二本鎖領域の混合物であり得るDNAとRNAを含むハイブリッド分子であってもよい。さらに、このポリヌクレオチドは、RNAまたはDNA、またはRNAとDNAの双方を含む三本鎖領域からなってもよい。また、このポリヌクレオチドは、1又は複数の修飾塩基、または安定性若しくはその他の理由で修飾されたDNA若しくはRNA主鎖を含んでもよい。「修飾」塩基としては、例えば、トリチル化塩基、およびイノシンなどの非必須塩基が挙げられる。DNAおよびRNAには様々な修飾を行うことができ、従って、「核酸分子」には、化学的、酵素的、または代謝的修飾形態が含まれる。
【0043】
本発明において「ポリペプチド」とは、互換的に用いられ、所与の長さのアミノ酸を包含するペプチド、タンパク質またはポリペプチドを意味し、ここでアミノ酸残基が共有ペプチド結合により連結されている。しかしながら、アミノ酸結合および/またはペプチド結合が機能的類似体により置換される、かかるタンパク質/ポリペプチドのペプチド模倣薬も本発明に包含され、並びにセレノシステインなどの遺伝子にコードされている20種のアミノ酸以外のものも本発明に包含される。ペプチド、オリゴペプチドおよびタンパク質は、ポリペプチドと呼ぶこともできる。記載のように、ポリペプチドおよびタンパク質という用語は本明細書では互換的に用いる場合が多い。ポリペプチドという用語はまた、ポリペプチドの修飾物も指し、それを排除しない。修飾としては、グリコシル化、アセチル化、アシル化、リン酸化、ADP−リボシル化、アミド化、フラビンの共有結合、ヘム部分の共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、脂質または脂質誘導体の共有結合、ホスホチジルイノシトール(phosphotidylinositol)の共有結合、架橋、環化、ジスルフィド結合の形成、脱メチル化、共有結合性架橋の形成、システインの形成、ピログルタミン酸塩の形成、フォーミュレーション(formulation)、γ−カルボキシル化、グリコシル化、GPIアンカーの形成、水酸化、ヨウ化、メチル化、ミリストイル化、酸化、ペグ化、タンパク質分解性プロセシング、リン酸化、プレニル化、ラセミ化、セレノイル化、硫酸化、トランスファーRNAにより媒介されるタンパク質へのアミノ酸付加(アルギニン化など)、およびユビキチン化が挙げられる(例えば、PROTEINS−STRUCTURE AND MOLECULAR PROPERTIES,2nd Ed.,T.E.Creighton,W.H.Freeman and Company,New York(1993);POST−TRANSLATIONAL COVALENT MODIFICATION OF PROTEINS,B.C.Johnson,Ed.,Academic Press,New York(1983),pgs.1−12;Seifter,Meth.Enzymol.182(1990);626−646,Rattan,Ann.NY Acad.Sci.663(1992);48−62参照)。
【0044】
本発明のポリペプチドは好ましくは、本明細書に記載されるように、本発明の核酸分子によりコードされるアミノ酸配列を有するか、或いは該ポリペプチドの産生方法により、または本明細書に記載の該ポリペプチドを発現し得る細胞の作出方法によって得られる。
【0045】
好ましくは、本発明に関して、該ポリペプチドは二機能性ポリペプチドである。「二機能性ポリペプチド」とは、本発明のポリペプチドが、メチル化DNA、好ましくはCpGメチル化DNAと結合することに加え、本発明のポリペプチドの一部である抗体のFc部分によってさらなる能力を有することを意味する。例えば、該Fc部分は好ましくは、化合物または部分を当該Fc部分と接合、連結、または共有結合的にカップリングさせる能力を与える。本明細書において、「共有結合的にカップリングされる」とは、特定の化合物または部分が、互いに直接共有結合されているか、或いはまた、ブリッジ、スペーサー、または1つの連結部分若しくは複数の連結部分などの、1つの介在部分または複数の介在部分によって互いに間接的に共有結合的に連結されていることを意味する。
【0046】
このような化合物は検出可能な物質であり得る。検出可能な物質の例としては、様々な酵素、補欠分子族、蛍光物質、発光物質、生物発光物質、放射性物質、様々な陽電子放射断層撮影法を用いる陽電子放射金属、および非放射性常磁性金属イオンが挙げられる。この検出可能な物質は、当技術分野で公知の技術を用い、抗体(またはそのフラグメント)のFc部分の直接、または中間体(例えば、当技術分野で公知のリンカーなど)を介して間接的にカップリングまたは接合させることができる。本発明に従い診断薬として用いるために抗体のFc部分に接合し得る金属イオンについては、例えば、米国特許第4,741,900号を参照のこと。
【0047】
好適な酵素の例としては、セイヨウワサビペルオキシダーゼ、アルカリ性ホスファターゼ、β−ガラクトシダーゼ、またはアセチルコリンエステラーゼが挙げられ;好適な補欠分子族複合体の例としては、ストレプトアビジン/ビオチンおよびアビジン/ビオチンが挙げられ;好適な蛍光材料の例としては、ウンベリフェロン、フルオレセイン、フルオレセインイソチオシアネート、ローダミン、ジクロロトリアジニルアミンフルオレセイン、塩化ダンシルまたはフィコエリトリンが挙げられ;発光物質の例としては、ルミノールが挙げられ;生物発光物質の例としては、ルシフェラーゼ、ルシフェリン、およびエクオリンが挙げられ;好適な放射性物質の例としては、125I、131I、または99Tcが挙げられる。
【0048】
さらに、該Fc部分は、細胞毒素(例えば、細胞増殖抑制剤または細胞破壊剤)などの治療用成分、治療薬または放射性金属イオン(例えば213Biなどのα放射体と接合させてもよい。細胞毒素または細胞傷害性薬剤としては、細胞に有害ないずれの薬剤も含む。例としては、パクリタキソール、サイトカラシンB、グラミシジンD、臭化エチジウム、エメチン、マイトマイシン、エトポシド、テノポシド、ビンクリスチン、ビンブラスチン、コルヒチン、ドキソルビシン、ダウノルビシン、ジヒドロキシアントラシンジオン、ミトキサントロン、ミトラマイシン、アクチノマイシンD、1−デヒドロテストステロン、グルココルチコイド、プロカイン、テトラカイン、リドカイン、プロプラノロール、およびピューロマイシン、並びにそれらの類似体または同族体が挙げられる。
【0049】
治療薬としては、限定されるものではないが、代謝拮抗物質(例えば、メトトレキサート、6−メルカプトプリン、6−チオグアニン、シタラビン、5−フルオロウラシルデカルバジン)、アルキル化剤(例えば、メクロレタミン、チオテパ(thioepa)、クロルムブシル(chlormbucil)、メルファラン、カルムスチン(BSNU)およびロムスチン(CCNU)、シクロトスファミド(cyclothosphamide)、ブスルファン、ジブロモマンニトール、ストレプトゾトシン、マイトマイシンC、およびシス−ジクロロジアミン白金(11)(DDP)シスプラチン、アントラサイクリン(例えば、ダウノルビシン(以前のダウノマイシン)およびドキソルビシン)、抗生物質(例えば、ダクチノマイシン(以前のアクチノマイシン)、ブレオマイシン、ミトラマイシン、およびアントラマイシン(AMC))、並びに細胞分裂阻害剤(例えば、ビンクリスチンおよびビンブラスチン)が挙げられる。
【0050】
さらに、本発明のポリペプチドのFc部分は、所望の生物活性を有するタンパク質またはポリペプチドとカップリングまたは接合させることもできる。かかるタンパク質として、例えば、アブリン、リシンA、シュードモナス外毒素、またはジフテリア毒などの毒素;腫瘍壊死因子、α−インターフェロン、β−インターフェロン、神経成長因子、血小板由来増殖因子、組織プラスミノーゲン活性化因子、アポトーシス薬などのタンパク質が挙げられる。
【0051】
該Fc部分はまた、本発明のポリペプチドと、本明細書に記載されるような、標的抗原のイムノアッセイまたは精製に特に有用な固相支持体との結合を可能とする。かかる固相支持体としては、限定されるものではないが、ガラス、セルロース、ポリアクリルアミド、ナイロン、ポリカーボネート、ポリスチレン、ポリ塩化ビニルまたはポリプロピレンなどが挙げられる。
【0052】
化合物をFc部分と接合、カップリングまたは連結する技術は周知である。例えば、Arnon et al.,“Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy”,Monoclonal Antibodies And Cancer Therapy, Reisfeld et al.(eds.),pp.243−56(Alan R.Liss,Inc.1985);Hellstrom et al.,“Antibodies For Drug Delivery”,Controlled Drug Delivery(2nd Ed.),Robinson et al.(eds.),pp.623−53(Marcel Dekker,Inc.1987);Thorpe,“Antibody Carriers Of Cycotoxic Agents In Cancer Therapy:A Review”, Monoclonal Antibodies’84:Biological And Clinical Applications,Pinchera et al.(eds.),pp.475−506(1985);“Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy”,Monoelonal Antibodies For Cancer Detection And Therapy,Baldwin et al.(eds.),pp.303−16(Academic Press 1985),およびThorpe,Immunol.Rev.,119−158参照。
【0053】
「メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメイン」とは、タンパク質MeCP2、MBD1、MBD2、MBD3およびMBD4を含むMBDファミリーのタンパク質のメチル−DNA結合ドメインの構造的および/または機能的特徴を好ましく有するポリペプチドを包含する。このメチル−DNA結合活性は、当技術分野で公知の方法によって試験することができる。好ましくは、「メチル化DNA」とは、ヘミメチル化、または両鎖でメチル化されたDNA、または一本鎖メチル化DNAを含む、メチル化DNA、より好ましくは、CpGメチル化DNAを包含する。これまでで最も重要な例は、ほとんどの場合はジヌクレオチドCpGに関して、また、CpNpG配列およびCpNpN配列に関して生じたメチル化シトシンである。基本的に、他の天然ヌクレオチドもメチル化され得る。
【0054】
本発明のポリペプチドは、本明細書に記載されるように、モノマーまたはダイマーまたは多価分子のいずれかとしてメチル化DNAと結合することが好ましい。本発明のポリペプチドは、高メチル化DNAまたは低メチル化DNAと結合し得るのが好ましい。本発明のポリペプチドは、単一のメチル化CpG対と結合することができるのが好ましい。MeCP2、MBD1、MBD2、MBD3およびMBD4は、メチル−CpG結合ドメインを共有する脊椎動物タンパク質の一ファミリーを構成している。該MBDタンパク質ファミリーは既知のMBDの配列に基づく2つのサブグループを含む。
【0055】
MBD4のメチル−DNA結合ドメインは、一次配列においてはとほとんど同じであるが、MBD1、MBD2およびMBD3のメチル−DNA結合ドメインは、MBD4またはMeCP2のいずれかよりも互いにより類似している。しかしながら、各タンパク質内のメチル−DNA結合ドメインは、MeCP2、MBD1、MBD2、MBD3およびMBD4の5つ全ての遺伝子内の保存された位置にあるイントロンの存在に基づけば、進化的に近縁であると思われる。やはり、MBDファミリーのメンバー間の配列類似性は、それらのメチル−DNA結合ドメインに主として限定されるが、MBD2およびMBD3は類似しており、それらの長さの大部分にわたって全体として約70%の同一性を有する。最大の違いはC末端にあり、そこでMBD3は12の連続するグルタミン酸残基を有する。
【0056】
本発明において有用なMBDまたはその断片、好ましくは、メチル−DNA結合ドメインまたはその断片は、例えば、当技術分野で公知の、好ましくは本明細書に記載の手段および方法を使用し、既知のMBDとMBDであると思われる配列とを比較し、および/または整列することによる、配列比較および/または整列を用いることで同定することができる。
【0057】
例えば、比較される2つの配列の双方の位置が、同じ塩基またはアミノ酸モノマーサブユニットにより占められている場合(例えば、2つのDNA分子の各々のある位置がアラニンにより示されているか、または2つのポリペプチドの各々のある位置がリシンにより占められている場合)、それら個々の分子はその位置において同一である。2つの配列間の同一性%は、その2配列間で共通の一致するまたは同一の位置の数を、比較される位置の数で割ったものに100を掛けたものの関数である。例えば、2配列中の位置10のうち6が一致する、または同一であれば、その2配列は60%同一である。例を示せば、DNA配列CTGACTとCAGGTTは50%の相同性を有する(全ての位置6のうち3が一致する)。
【0058】
一般に、比較は、2配列を、最大の相同性および/または同一性が得られるように整列させて実施される。かかる整列は、例えば、便宜には整列プログラム(DNAstar,Inc.)などのコンピュータープログラムもより実行される、Needlemanの方法(J.Mol Biol.48(1970):443−453を用いて提供することができる。相同配列は同一または類似のアミノ酸残基を共有し、ここで、類似の残基は、整列させられた対照配列における対応するアミノ酸残基との保存的置換であるか、または「許容される点突然変異」である。これに関して、参照配列の残基の「保存的置換」は、対応する参照残基と物理的または機能的に類似の、例えば、類似の大きさ、形状、電荷、共有結合または水素結合の形成力などを含む化学的特性を有する置換である。特に好ましい保存的置換は、Dayhoff et al.,5:Atlas of Protein Sequence and Structure,5:Suppl.3,chapter 22:354−352,Nat.Biomed.Res.Foundation,Washington,D.C.(1978)に「許容される突然変異」として定義されている基準を満たすものである。
【0059】
好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、本明細書に記載されるような構造的特徴および/または機能的特徴を有する。好ましくは、本明細書に記載のメチル−DNA結合タンパク質の断片は、メチル化DNA、好ましくは、CpGメチル化DNAと結合することができる。
【0060】
本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、好ましくは、昆虫起源、線虫起源、魚類起源、両生類起源、より好ましくは、脊椎動物起源、いっそうより好ましくは、哺乳類起源、最も好ましくは、マウス、特に好ましくはヒト起源のものである。
【0061】
好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe,Eur.J.Biochem.268(2001),1−6の図1に示され、メチル化DNAと結合することができる、特徴的なループを有する固有のα−ヘリックス/β−鎖サンドイッチを有する。
【0062】
より好ましくは、本発明のポリペプチドのMBDまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示され、メチル化DNAと結合することができ、MBDの少なくとも50、より好ましくは少なくとも60、いっそうより好ましくは少なくとも70または少なくとも80のアミノ酸残基を含む。
【0063】
いっそうより好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示され、メチル化DNAと結合することができ、MBDと、アミノ酸レベルで、好ましくは50%、60%、70%、80%または90%、より好ましくは95%または97%、いっそうより好ましくは98%、最も好ましくは99%の同一性を有する。配列、例えば、アミノ酸配列の同一性を決定するための手段および方法は、本明細書の他所に記載されている。
【0064】
最も好ましくは、本発明のポリペプチドのメチル−DNA結合ドメインまたはその断片は、Ballester and Wolffe(2001)前掲の図1に示されているMBDタンパク質のメチル−DNA結合ドメイン、またはHendrich and Tweedy,Trends Genet.19(2003),269−77に記載されるMBDタンパク質のメチル−DNA結合ドメインを含み、かつ、メチル化DNAと結合することができる。
【0065】
もちろん、本発明によれば、本発明のポリペプチドは好ましくは二機能性であり、好ましくは、上記のような2つのメチル−DNA結合ドメインを担持し、好ましくは両メチル−DNA結合ドメインとも単一のメチル化CpG対と結合することができる。
【0066】
本発明の特定の好ましい実施形態では、本発明のポリペプチドのメチル−DNA結合ドメインは、ヒトMBD2のものである。より特に好ましい実施形態では、メチル−DNA結合ドメインは、Genbank受託番号NM003927のアミノ酸配列の144〜230番のアミノ酸を含むヒトMBD2のものである。最も特に好ましい実施形態では、本発明のポリペプチドのメチル−DNA結合ドメインは、配列番号2(図1)に示されるアミノ酸配列の29〜115番のアミノ酸配列を含む。
【0067】
本発明のポリペプチドの成分である、抗体の「Fc部分」は、好ましくは、少なくとも、免疫グロブリン重鎖分子の定常領域の部分を含む。このFc領域は、好ましくは、定常ドメインヒンジ領域とCH2およびCH3ドメインに限定される。本発明のポリペプチドのFc領域はまた、ヒンジ領域の部分、分子間ジスルフィド橋を形成し得る部分、並びにCH2およびCH3ドメイン、またはそれらの機能的等価物に限定され得る。
【0068】
或いは、Fc部分は、本発明のポリペプチドが上記のポリペプチドの特性、特に、添付の実施例で用いられるポリペプチドの特性をなお有するのに必要な多くのCH領域を少なくとも含むことも好ましい。
【0069】
別の例では、該定常領域が、当技術分野で公知の定常領域と比較した場合に1又は複数のアミノ酸置換を含み得ることも好ましい。好ましくは、定常領域は、1〜100、1〜90、1〜80、1〜70、1〜60、1〜50、1〜40、1〜30または1〜20、より好ましくは、1〜10、いっそうより好ましくは、1〜9、1〜8、1〜7または1〜6、最も好ましくは、1〜5、1〜4、1〜3または2または1の置換を含む。比較は好ましくは、当技術分野で公知のように、またはより好ましくは、本明細書の他所に記載されているように行う。
【0070】
あるいは、該定常領域は好ましくは、少なくともCH1領域、より好ましくは、CH1およびCH2領域、最も好ましくは、CH1、CH2およびCH3領域を含む。当技術分野で公知のように、抗体の定常領域は、約110のアミノ酸からなる3つの特徴的な免疫グロブリンドメインを担持する2つの免疫グロブリン重鎖を含み、ここで、この2つの免疫グロブリン重鎖は、ジスルフィド結合により共有結合的に連結されている。特定の理論に拘束されるものではないが、メチル−DNA結合ドメインと抗体のFc部分を含む本発明の未完成ポリペプチドは、好ましくは2つのポリペプチドがそれらのFc部分において、抗体の定常領域と類似または好ましくは同一の様式で連結されて、本明細書に記載されるような二機能性ポリペプチドとなるように、宿主細胞内で折り畳まれる。
【0071】
また、この定常領域は好ましくは、ニワトリまたはカモ起源のものであり得ることが企図される。いっそう好ましくは、該定常領域は、IgM、IgA、IgDまたはIgEイソ型のものであり、より好ましくは、IgGイソ型のものであり、最も好ましくは、IgGIイソ型のものである。好ましくは、上述のイソ型は脊椎動物起源、より好ましくは、哺乳類のものであり、いっそうより好ましくは、マウス、ラット、ヤギ、ウマ、ロバ、ラクダまたはチンパンジー起源のものであり、最も好ましくは、ヒト起源のものである。好ましくは、該IgGイソ型はクラスIgG1、IgG2、IgG3、IgG4のものであり、該IgAイソ型はクラスIgA1、IgA2のものである。
【0072】
本明細書に記載されるように、本発明は好ましくは、二機能性ポリペプチドを提供する。さらにまた、本発明の1又は複数の二機能性ポリペプチドを含む多量体二機能性ポリペプチドが企図される。かかる多量体は、IgMペンタマーおよびIgAダイマーなど、通常多価であるIg分子のFc領域またはその一部を使用することによって製造することができる。J鎖ポリペプチドは、IgMペンタマーおよびIgAダイマーを形成および安定化させるのに必要であり得ると理解される。
【0073】
より好ましい実施形態では、上述の本発明のヌクレオチド配列を含む核酸分子は、
(a)配列番号1(図1)に示されるヌクレオチド配列を有する核酸配列;
(b)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸配列;
(c)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドの断片をコードするヌクレオチド配列を有する核酸配列であって、ここで、該断片が該ポリペプチドの少なくともアミノ酸130〜361番を含み、メチル化DNAと結合し得る、前記核酸配列;
(d)(a)〜(c)のいずれか1つのポリヌクレオチドによりコードされるポリペプチドの変異体をコードするヌクレオチド配列を有する核酸配列であって、該変異体において1又は複数のアミノ酸残基が該ポリペプチドに比べて置換されており、該変異体がメチル化DNAと結合し得る、前記核酸配列;
(e)(a)〜(d)のいずれか1つの核酸配列とハイブリダイズし、かつ、(a)の核酸分子のヌクレオチド配列と少なくとも65%同一であって、メチル化DNAと結合し得るポリペプチドをコードするヌクレオチド配列を有する、核酸配列;
(f)メチル化DNAと結合し得る(b)の核酸分子によりコードされるポリペプチドと少なくとも65%同一であり、かつ、メチル化DNAと結合し得るポリペプチドをコードする、ヌクレオチド配列を有する核酸配列;および
(g)(a)〜(f)のいずれか1つのポリヌクレオチドのヌクレオチド配列と縮重しているヌクレオチド配列を有する核酸分子
またはかかるポリヌクレオチドの相補鎖からなる群から選択される、ヌクレオチド配列を含む。
【0074】
上記のように、配列番号2(図1)に示されるアミノ酸配列を有する本発明のポリペプチドの断片は、配列番号2(図1)に示されるアミノ酸配列の少なくともアミノ酸130〜361番を含む。これは、該断片が、Fc部分に相当するアミノ酸130〜361の他に、該断片が非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るように1又は複数のアミノ酸を含み得ることを意味する。よって、該断片は、より好ましくは、配列番号2(図1)に示されるアミノ酸配列の少なくとも116〜361番のアミノ酸を含むと考えられる。いっそうより好ましくは、該断片は、配列番号2(図1)に示されるアミノ酸配列の少なくとも29〜115番および130〜361番のアミノ酸を含み得る。最も好ましい実施形態では、該断片は、少なくとも29〜361番のアミノ酸を含み得る。一般に、本発明のポリペプチドの断片は、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得ることが好ましい。この能力は、当技術分野で公知の方法により、または好ましくは、添付の実施例に記載されている方法によって試験することができる。
【0075】
本発明のポリペプチドの「変異体」は、該ポリペプチドと比較して1又は複数のアミノ酸残基が置換されている、好ましくは、保存的に置換されており、かつ、該変異体が好ましくは、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドを包含する。かかる変異体としては、本発明のポリペプチドの活性に全く作用がないように、当技術分野で公知の一般ルールに従って選択された欠失体、挿入体、逆位体、反復体および置換体が挙げられる。例えば、いかにして表現型的にサイレントなアミノ酸置換を作出するかに関する指針は、Bowie,Science 247:(1990)1306−1310に示されており、その中で、筆者は、アミノ酸配列の変異許容性を調べるには2つの主要な方法論があることを示している。
【0076】
第1の方法論は、進化過程での自然選択によるアミノ酸置換の許容性を利用する。異種のアミノ酸配列を比較することにより、保存されているアミノ酸を同定することができる。これらの保存されているアミノ酸はおそらくタンパク質機能に重要である。これに対し、置換が自然選択に許容されたアミノ酸位は、これらの位置がタンパク質機能には重要でないことを示す。よって、アミノ酸置換を許容する位置は、そのタンパク質の生物活性をなお維持しつつ修飾可能である。
【0077】
第2の方法論は、タンパク質機能に重要な領域を同定するために、クローニングされた遺伝子の特定の位置にアミノ酸変異を導入するような遺伝子操作を用いる。例えば、部位指定突然変異誘発またはアラニンスキャニング突然変異誘発(分子内の各残基ごとに単一のアラニン突然変異を導入する)が使用可能である(Cunningham and Wells,Science 244:(1989)1081−1085)。結果として得られた突然変異分子を次に、生物活性に関して試験することができる。
【0078】
これらの筆者らが述べているように、これら2つの方法論により、タンパク質はアミノ酸置換に驚くべき許容性を示すことが明らかになった。これらの筆者らはさらに、そのタンパク質内の特定のアミノ酸位においてどのアミノ酸変化が許容され得るかを示している。例えば、最も埋め込まれている(タンパク質の三次構造中に)アミノ酸残基は非極性側鎖を必要とするが、表面側鎖の特徴で保存されているものは一般に少ない。
【0079】
本発明は、同一性程度は低いが、本発明のポリペプチドによって遂行される1又は複数の機能を遂行するのに十分な類似性を有するポリペプチドを包含する。類似性は、保存的アミノ酸置換により決定される。かかる置換は、ポリペプチドにおけるあるアミノ酸を特徴的(例えば、化学特性)別のアミノ酸で置換するものである。Cunningham et al.(前記)によれば、かかる保存的置換は表現型的にサイレントであり得る。どのアミノ酸変化が表現型的にサイレントであり得るかに関するさらなる指針は、Bowie,Science 247:(1990)1306−1310に示されている。
【0080】
本発明の許容される保存的アミノ酸置換は、脂肪族または疎水性アミノ酸Ala、Val、LeuおよびIleの置換;ヒドロキシル残基SerおよびThrの置換;酸性残基AspおよびGluの置換;アミド残基AsnおよびGlnの置換、塩基性残基Lys、ArgおよびHisの置換;芳香族残基Phe、TyrおよびTrpの置換、並びに小型アミノ酸Ala、Ser、Thr、MetおよびGlyの置換を含む。
【0081】
さらに、本発明はまた、下表に示される保存的置換も包含する。
【0082】
【表3】

【0083】
上記の使用の他、かかるアミノ酸置換はまた、タンパク質またはペプチドの安定性も高め得る。本発明は、例えば、そのタンパク質またはペプチド配列内に1又は複数の非ペプチド結合を(ペプチド結合に取って代わる)を含むアミノ酸置換を包含する。また、天然のL−アミノ酸以外のアミノ酸残基、例えば、D−アミノ酸または非天然若しくは合成アミノ酸、例えば、βまたはγアミノ酸を含む置換も含まれる。
【0084】
同一性および類似性とも、次の刊行物:Computational Molecular Biology,Lesk,A.M.,ed.,Oxford University Press,New York,1988;Biocomputing:Infoliuaties and Genome Projects,Smith,DM.,ed.,Academic Press,New York,1993;Informafies Computer Analysis of Sequence Data,Part 1,Griffin,A.M.,and Griffin,H.G.,eds.,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academie Press,1987;およびSequence Analysis Primer,Gribskov,M.and Devereux,eds.,M Stockton Press,New York,1991を参照すれば、容易に算出することができる。
【0085】
上記のように、本発明は好ましくはまた、配列番号1に示される核酸配列、本明細書に記載されるようなその断片または変異体(図1)とハイブリダイズし、かつ、配列番号1に示される核酸配列(図1)と少なくとも65%同一であり、かつ、好ましくは、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドをコードする核酸配列に関する。
【0086】
また、記載されるように、本発明は、好ましくは、配列番号2に示されるポリペプチドと少なくとも65%、より好ましくは、70%、75%、80%、85%、90%、より好ましくは、99%同一であるポリペプチドをコードする核酸配列に関する。
【0087】
本発明に従って用いる場合「ハイブリダイズする」とは、好ましくは、ストリンジェント条件下でのハイブリダイゼーションに関する。「ハイブリダイズする配列」とは、好ましくは、非メチル化DNAよりも、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドをコードする、上記のような核酸配列と少なくとも65%、いっそうより好ましくは、少なくとも70%、特に好ましくは、少なくとも80%、より特に好ましくは、少なくとも90%、いっそうより特に好ましくは、少なくとも95%、最も好ましくは、少なくとも97、98%または99%の配列同一性を示す配列を指す。
【0088】
該ハイブリダイゼーション条件は、例えば、Sambrook,Russell “Molecular Cloning,A Laboratory Manual”,Cold Spring Harbor Laboratory,N.Y.(2001); Ausubel,“Current Protocols in Molecular Biology”,Green Publishing Associates and Wiley Interscience,N.Y.(1989)、またはHiggins and Hames(Eds.)“Nucleic acid hybridization,a practical approach”IRL Press Oxford,Washington DC,(1985)に記載されている従来のプロトコールに従って確立することができる。
【0089】
条件の設定は十分当業者の技術の範囲内であり、当技術分野に記載のプロトコールに従って決定することができる。よって、特異的にハイブリダイズする配列だけの検出は、通常、0.1×SSC、0.1%SDS、65℃などのストリンジェントなハイブリダイゼーションおよび洗浄条件を必要とする。相同な、または厳密にではないが相補的な配列の検出のための非ストリンジェントハイブリダイゼーション条件は、6×SSC、1%SDS、65℃に設定することができる。
【0090】
周知のように、プローブの長さ、および判定される核酸の組成も、ハイブリダイゼーション条件のさらなるパラメーターとなる。上記の条件の変更は、ハイブリダイゼーション試験においてバックグラウンドを抑えるために用いられる択一的遮断試薬の包含および/または置換によって行い得ることに留意する。
【0091】
典型的な遮断試薬としては、デンハートの試薬、BLOTTO、ヘパリン、変性サケ精子DNA、および市販の専売製剤が挙げられる。特定の遮断試薬を含めると、適合性の問題から上記のハイブリダイゼーション条件の変更が必要となる場合がある。ハイブリッドする核酸分子はまた、上記の分子の断片を含む。このような断片は本明細書に記載されるような核酸配列を表し得る。さらに、上述の核酸分子のいずれかとハイブリダイズする核酸分子はまた、これらの分子の相補的断片、誘導体および対立遺伝子変異体を含む。さらにまた、ハイブリダイゼーション複合体は、相補的なG塩基とC塩基の間、また、相補的なA塩基とT塩基の間の水素結合の形成による、2つの核酸配列間の複合体を指し、これらの水素結合は塩基スタッキング相互作用によりさらに安定化され得る。
【0092】
この2つの相補的核酸配列において、水素結合は逆平行の形である。ハイブリダイゼーション複合体は液相中(例えば、CotまたはRot分析)、または液相に存在するある核酸配列と固相支持体(例えば、細胞が固定化されている膜、フィルター、チップ、ピンまたはスライドガラス)上に固定化された別の核酸配列との間で形成され得る。相補的または相補性とは、許容される塩および温度条件下での、塩基対合によるポリヌクレオチドの自然結合を指す。例えば、配列「A−G−T」は、相補的配列「T−C−A」と結合する。2つの一本鎖分子間の相補性は、いくつかの核酸だけが結合する「部分的」なものであってもよいし、或いは一本鎖分子間に全体的な相補性が存在する場合には完全なものであり得る。核酸鎖間の相補性の程度は、核酸鎖間のハイブリダイゼーション効率および強度に有意な影響を及ぼす。これは、核酸鎖間の結合に依存する増幅反応において特に重要である。
【0093】
本発明によれば、2以上の核酸配列またはアミノ酸配列に関して「同一」または「同一性%」とは、当技術分野で公知の配列比較アルゴリズムを用いて、または手動の整列と目視検査により、ある比較枠にわたって、または所定の領域にわたって最大一致が得られるように比較および整列した場合に、同じであるか、または同じであるアミノ酸残基またはヌクレオチドの特定のパーセンテージを有する(例えば、少なくとも65%同一、好ましくは、少なくとも70〜95%同一、より好ましくは、少なくとも95%、96%、97%、98%または99%同一の)複数の配列または部分配列を指す。例えば、65%〜95%またはそれを超える配列同一性を有する配列は、実質的に同一であるとみなされる。かかる定義はまた、試験配列の相補物に対しても当てはまる。好ましくは、記載されている同一性は、少なくとも約232アミノ酸長または696ヌクレオチド長の領域にわたって存在する。当業者ならば、当技術分野で公知のように、例えば、CLUSTALWコンピュータープログラム(Thompson Nucl.Acids Res.2(1994),4673−4680)またはFASTDB(Brutlag Comp.App.Biosci.6(1990),237−245)に基づくものなどのアルゴリズムを用い、配列間の同一性%をどのようして決定すればよいかが分かるであろう。
【0094】
FASTDBアルゴリズムは一般に、配列中の内部の不一致欠失または付加、すなわち、ギャップを計算に入れないが、これは手作業で補正を行い、同一性%の過剰見積を避けることができる。しかしながら、CLUSTALWでは、その同一性計算において配列ギャップを考慮に入れる。また、BLASTおよびBLAST2.0アルゴリズム(Altschul Nucl.Acids Res.25(1977),3389−3402)の当業者に利用可能である。核酸配列用のBLASTNプログラムはデフォルトとして、ワードレングス(W)11、期待値(E)10、M=5、N=4、および両鎖比較を用いる。アミノ酸配列に関して、BLASTPプログラムは、デフォルトとして、ワードレングス(W)3、および期待値(E)10を用いる。BLOSUM62スコアリングマトリクス(Henikoff Proc.Natl.Acad.Sci.,USA,89,(1989),10915)では、整列値(B)50、期待値(E)10、M=5、N=4、および両鎖比較を用いる。
【0095】
例えば、基本的局所配列ツールを表すBLAST2.0(Altschul,Nucl.Acids Res.25(1997),3389−3402;Altschul,J.Mol.Evol.36(1993),290−300;Altschul,J.Mol.Biol.215(1990),403−410)は、局所配列の整列に関して検索するために使用することができる。BLASTは、配列の類似性を判定するためにヌクレオチド配列とアミノ酸配列の双方の整列を行う。整列の局所性のため、BLASTは正確な一致の判定または類似配列の同定に特に有用である。BLASTアルゴリズム出力の基本単位は、高スコア断片対(HSP)である。HSPは、その整列が局所的に最大になり、その整列スコアがユーザーにより設定された閾値スコアまたはカットオフスコアに一致するか、またはそれを超える、任意の、しかし、同じ長さの2つの配列断片からなる。BLASTアプローチは、問い合わせ配列とデータベース配列の間でHSPを探し、見出された一致の統計学的有意性を評価し、さらにユーザーが選択した有意な閾値を満たす一致だけを報告する。パラメーターEは、データベース配列の一致を報告するための統計学的に有意な閾値を設定するものである。Eは、全データベース検索の範囲内で、HSP(またはHSPセット)の機会の期待頻度の上限として説明される。その一致がEを満たすデータベース配列が、このプログラムの出力として報告される。
【0096】
BLAST(Altschul(1997),前掲;Altschul(1993),前掲;Altschul(1990),前掲)を用いる類似のコンピューター技術が、GenBankまたはEMBLなどのヌクレオチドデータベースにおいて同一または関連の分子を検索するために用いられる。この分析は、膜に基づくハイブリダイゼーションを何回も行うより、はるかに迅速である。さらに、このコンピューター検索の感度を改良すれば、特定の一致が正確なものとして分類されるか、類似のものとして分類されるかを判定することができる。
【0097】
この検索の基本は、
【化1】

として定義される解であり、2配列間の類似性の程度および配列一致の長さの双方も考慮に入れる。
【0098】
例えば、解が40であれば、その一致は1〜2%の誤差内で正確であり、70であれば、その一致は正確である。類似分子は通常、15〜40の間の解を示すものを選択することにより同定され、それより低いスコアは関連分子を識別し得る。
【0099】
さらに、本発明はまた、その配列が上記の核酸分子の配列と比較して縮重している核酸分子に関する。本発明に従って用いる場合、「遺伝コードの結果として縮重している」とは、遺伝コードの重複により、異なるヌクレオチド配列が同じアミノ酸をコードすることを意味する。
【0100】
もちろん、本発明はまた、上述および後述の核酸分子が一本鎖型であり得る場合は、それらに対する相補鎖も考慮する。
【0101】
好ましくは、本発明の核酸分子はいずれの種類の核酸であってもよく、例えば、DNA、ゲノムcDNA、cDNA、RNAまたはPNA(ペプチド核酸)である。
【0102】
本発明の目的では、ペプチド核酸(PNA)はポリアミド型のDNA類似体であり、アデニン、グアニン、チミンおよびシトシンのモノマー単位は市販されている(Perceptive Biosystems)。リン、酸化リン、またはデオキシリボース誘導体などのDNAの特定の成分がPNAには存在しない。Nielsen et al.,Science 254:1497(1991);およびEgholm et al.,Nature 365:666(1993)により開示されているように、PNAは相補的DNA鎖と特異的かつ強固に結合し、ヌクレアーゼにより分解されない。実際、PNAは、DNAそれ自体よりもDNAと強く結合する。これはおそらくは、これら2鎖間に静電気的な反発がなく、また、そのポリアミド主鎖がより柔軟であるためである。このため、PNA/DNA二重らせんは、DNA/DNA二重らせんよりも広範なストリンジェンシー条件下で結合し、複合体のハイブリダイゼーションの遂行をより容易にする。強い結合のため、DNAの場合よりも短いプローブが使用できる。さらに、PNA/DNAハイブリダイゼーションを用いれば、単一塩基の不一致が判定できる可能性が高いが、これは、PNA/DNA15マーの単一の不一致が融点(Tm)を8℃〜20℃引き下げるためである(これに対し、DNA/DNA15マー二重らせんの場合は4℃〜16℃)。また、PNAに荷電基が存在しないことは、低イオン強度でハイブリダイゼーションを行うことができ、分析中、塩による干渉の可能性が小さくなることを意味する。
【0103】
このDNAは例えば、ゲノムDNAまたはcDNAであってもよい。RNAは例えば、mRNAであってもよい。核酸分子は天然、合成または半合成であってもよいし、或いはペプチド核酸(Nielsen,Science 254(1991),1497−1500)またはホスホロチオエートなどの誘導体であってもよい。さらに、この核酸分子は、上述の核酸分子のいずれかを単独または組み合わせて含む、組み換え産生されたキメラ核酸分子であってもよい。
【0104】
好ましくは、本発明の核酸分子はベクターの一部である。よって、本発明は、もう1つの実施形態において、本発明の核酸分子を含むベクターに関する。このようなベクターは、例えば、プラスミド、コスミド、ウイルス、バクテリオファージ、または遺伝子工学において通常用いられているその他のベクターであってよく、好適な宿主細胞において、好適な条件下で該ベクターの選択および/または複製を可能とするマーカー遺伝子などのさらなる遺伝子を含んでもよい。好ましい実施形態では、該ベクターは、本発明の核酸分子が、本明細書に記載されるような原核生物または真核生物宿主細胞において発現を可能とする発現制御配列に作動可能なように連結されている、発現ベクターである。本明細書において「作動可能なように連結される」とは、1又は複数の発現制御配列と発現させるポリヌクレオチドのコード領域の間における、その発現制御配列と適合する条件下で発現が遂行されるような連結を指す。
【0105】
よって、本発明の核酸分子は、いくつかの市販のベクター中に挿入することができる。非限定的な例としては、pUC、pBluescript(Stratagene)、pET(Novagen)、pREP(Invitrogen)、pCRTopo(Invitrogen)、pcDNA3(Invitrogen)、pCEP4(Invitrogen)、pMC1 neo(Stratagene)、pXT1(Stratagene)、pSG5(Stratagene)、EBO−pSV2neo、pBPV−1、pdBPVMMTneo、pRSVgpt、pRSVneo、pSV2−dhfr、pUCTag、plZD35、pLXINおよびpSIR(Clontech)並びにplRES−EGFP(Clontech)などの、哺乳類細胞に適合するプラスミドベクターが挙げられる。好ましくは、本発明の核酸分子は、ベクターSignal plG plus(Ingenius,R&D Systems)に挿入される。pBlueBac、BacPaczバキュロウイルス発現系(CLONTECH)、およびMaxBacTMバキュロウイルス発現系,昆虫細胞およびプロトコール(Invitrogen)などのバキュロウイルスベクターが市販されており、生物学的に活性なタンパク質を高収率で産生するために用い得る(また、Miller(1993),Curr.Op.Genet.Dev.,3,9;O’Reilly,Baculovirus Expression Vectors:A Laboratory Manual,p.127も参照)。さらに、pcDNA2などの原核生物ベクター、およびpYes2などの酵母ベクターが、本発明と共に用いるのに好適な他のベクターの限定されない例である。
【0106】
本願の他の好ましい発現ベクターは、InvitrogenのDES(登録商標)シリーズなど、当技術分野で周知のショウジョウバエ細胞でタンパク質を発現させるためのものがある。好ましくは、該ショウジョウバエ細胞発現ベクターはpMTBiP/V5−His B(Invitrogen)である。このpMT/BiP/V5−Hisベクターは、次のような付加的な特徴を提供する。このベクターは、DNA収率を向上させ、サブクローニング効率を高めるために小型(3.6kb)であり、抗V5抗体を用いた迅速検出のためのC末端V5エピトープタグを有し、ニッケルキレート樹脂を用いた組み換え融合タンパク質の簡単な精製のためのC末端6xHisタグを有する。
【0107】
ベクター修飾技術に関しては、Sambrook and Russel(2001),前掲を参照すること。ベクターはクローニングまたは発現のための1又は複数の複製および遺伝系、宿主における選択のための1又は複数のマーカー(例えば、抗生物質耐性)、および1又は複数の発現カセットを含む。
【0108】
該ベクターに挿入されるコード配列は、標準的な方法により合成するか、天然源から単離するか、またはハイブリッドとして調製することができる。これらのコード配列と転写調節エレメント(例えば、プロモーター、エンハンサーおよび/またはインスレーター)との、および/または他のアミノ酸コード配列との連結は、確立された方法を用いて行うことができる。
【0109】
さらに、これらのベクターは、本発明の核酸配列の他、好適な宿主内でコード領域の適切な発現を可能とする発現制御エレメントを含む。かかる制御エレメントは当業者には既知であり、プロモーター、翻訳開始コドン、翻訳および挿入部位、挿入部をベクターに導入するための内部リボソームエントリー部位(IRES)(Owens,Proc.Natl.Acad.Sci.USA 98(2001),1471−1476)を含み得る。好ましくは、本発明の核酸分子は、真核細胞または原核細胞での発現を可能とする当該発現制御配列と作動可能なように連結されている。
【0110】
真核細胞および原核細胞での発現を保証する制御エレメントは当業者には周知である。上述のように、これらの制御エレメントは通常、転写の開始を保証する調節配列、並びに任意選択の、転写の終結と転写物の安定化を保証するポリ−Aシグナルを含む。さらなる調節エレメントとしては、転写エンハンサー並びに翻訳エンハンサー、および/または自然状態で会合している、または異種のプロモーター領域を含み得る。例えば哺乳類宿主細胞での発現を可能とする、あり得る調節エレメントとしては、CMV−HSVチミジンキナーゼプロモーター、SV40、RSV−プロモーター(ラウス肉腫ウイルス)、ヒト延長因子1α−プロモーター、CMVエンハンサー、CaM−キナーゼプロモーターまたはSV40−エンハンサーを含む。
【0111】
原核細胞での発現に関しては、例えば、tac−lac−プロモーター、lacUV5またはtrpプロモーターをはじめとする多数のプロモーターが記載されている。このような調節エレメントは、転写の開始を担うエレメントの他、当該ポリヌクレオチドの下流に、SV40−ポリ−A部位またはtk−ポリ−A部位などの転写終結シグナルも含み得る。これに関しては、Okayama−Berg cDNA発現ベクターpcDV1(Pharmacia)、pRc/CMV、pcDNA1、pcDNA3(In−Vitrogene,とりわけ、添付の実施例において用いられる)、pSPORT1(GIBCO BRL)またはpGEMHE(Promega)、またはラムダgt11などの原核生物発現ベクターといった好適な発現ベクターは当技術分野で公知である。
【0112】
本発明の発現ベクターは、本発明の核酸のおよびタンパク質の、少なくとも複製、および好ましくは発現を命令することができる。好適な複製起点としては、例えば、Col E1、SV40ウイルスおよびM13複製起源が挙げられる。好適なプロモーターとしては、例えば、サイトメガロウイルス(CMV)プロモーター、lacZプロモーター、gal 10プロモーターおよびオートグラファ・カリフォルニカ(Autographa californica)核多角体ウイルス(AcMNPV)多角体プロモーターが挙げられる。好適な終結配列としては、例えば、ウシ成長ホルモン、SV40、lacZおよびAcMNPV多角体ポリアデニル化シグナルが挙げられる。選択マーカーの例としては、ネオマイシン、アンピシリン、およびハイグロマイシン耐性などが挙げられる。特殊設計ベクターは、細菌−酵母、または細菌−動物細胞、または細菌−真菌細胞、または細菌−無脊椎動物細胞など、異なる宿主細胞間のDNAのシャッフルを可能とする。
【0113】
該ベクターは、本発明の核酸分子の他、分泌シグナルをコードする核酸配列をさらに含み得る。本発明のポリペプチドがショウジョウバエ細胞、好ましくは、ショウジョウバエS2細胞で発現される場合、本発明に従って好ましい使用される本発明の分泌シグナルは、当技術分野で周知のDrosophila BiP分泌シグナルである。本発明において使用される好ましいBiP分泌シグナルは、配列番号2の1〜28番のアミノ酸配列で示される。他の分泌シグナル配列も当業者に周知である。
【0114】
さらに、使用する発現系に応じ、発現したポリペプチドをある細胞コンパートメントに向けることができるリーダー配列を、本発明の核酸分子のコード配列に付加してもよく、これも当技術分野で周知である。当該リーダー配列は、翻訳開始および終結配列、並びに好ましくは、翻訳されたタンパク質またはその一部の、とりわけ細胞外の膜への分泌を命令し得るリーダー配列と適当な位相で組み立てる。所望により、異種配列は、所望の特徴、例えば、発現した組み換え産物の安定化または簡単な精製を付与するCまたはN末端識別ペプチドを含む融合タンパク質をコードすることができる。ひと度ベクターが適当な宿主に組み込まれると、宿主は当該ヌクレオチド配列の高レベル発現に好適な条件下で維持され、所望により、その後、本発明のタンパク質、抗原性断片または融合タンパク質の回収および精製を行うことができる。もちろん、当該ベクターはまた、病原生物由来の調節領域も含むことができる。
【0115】
さらに、当該ベクターは、発現ベクターの他、遺伝子導入および/または遺伝子標的化ベクターであってもよい。治療遺伝子(例えば、ワクチン用)をex vivoまたはin vivo技術により細胞へ導入することに基づく遺伝子療法は、遺伝子導入の最も重要な適用の1つである。in vitroまたはin vivo遺伝子療法のための好適なベクター、ベクター系および方法は文献に記載されており、当業者に公知である;例えば、Giordano,Nature Medicine 2(1996),534−539;Schaper,Circ.Res.79(1996),911−919;Anderson,Science 256(1992),808−813,Isner,Lancet 348(1996),370−374;Muhlhauser,Circ.Res.77(1995),1077−1086;Wang,Nature Medicine 2(1996),714−716;WO94/29469;WO97/00957;Schaper,Current Opinion in Biotechnology 7(1996),635−640またはVerma,Nature 389(1997),239−242およびその中に引用されている参照文献を参照すること。
【0116】
本発明の核酸分子および本明細書で上記されたベクターは、細胞へ直接導入するよう、またはリポソーム若しくはウイルスベクター(例えば、アデノウイルス、レトロウイルス)を介して導入するように設計することができる。さらに、バキュロウイルス系、またはワクシニアウイルス若しくはセムリキ森林ウイルスに基づく系を、本発明の核酸分子のための真核生物発現系として使用することもできる。組み換え産生の他、本発明のタンパク質断片、融合タンパク質、または抗原性断片を、固相技術を用いた直接的ペプチド合成によって産生させてもよい(Stewart et al.(1969)Solod Phase Peptide Synthesis;Freeman Co,San Francisco;Merrifield,J.Am.Chem.Soc.85(1963),2149−2154参照)。in vitroタンパク質合成は、手動法を用いて、または自動法により行うことができる。自動合成は、例えば、Applied Biosystems 431A Peptide Synthesizer(Perkin Elmer,Foster City CA)を、製造業者が提供している説明書に従って用いて行うことができる。様々な断片を別個に化学合成し、化学法を用いて化合し、全長分子を作製することができる。
【0117】
本発明はさらに、本発明の核酸分子または本発明のベクターで遺伝的に操作された宿主細胞に関する。当該宿主は、該ベクターまたはヌクレオチド配列を宿主細胞に導入することにより作出され、その際、その細胞におけるその存在が、本発明のヌクレオチド配列によりコードされるか、または本発明のヌクレオチド配列若しくはベクター(なお、このヌクレオチド配列および/またはコードされるポリペプチドは宿主細胞に対して外来である)を含むタンパク質の発現を媒介する。
【0118】
「外来」とは、そのヌクレオチド配列および/またはコードされるポリペプチドが宿主に対して異種である(これは、異なるゲノムバックグラウンドを有する細胞または生物に由来することを意味する)か、または宿主と同種であるが、該ヌクレオチド配列の天然に存在する対象物とは異なるゲノム環境にあることを意味する。これは、当該ヌクレオチド配列が宿主と同種である場合に、当該宿主のゲノムにおける本来の位置にはないこと、特に、異なる遺伝子に囲まれていることを意味する。この場合、該ヌクレオチド配列はその固有のプロモーターの制御下にあっても異種プロモーターの制御下にあってもいずれでもよい。導入された核酸分子またはベクターの位置は、当業者ならば、当業者に周知の方法、例えばサザンブロット法を用いることで決定することができる。 宿主中に存在する本発明のベクターまたはヌクレオチド配列は宿主のゲノムに組み込まれても何らかの形で染色体外で維持されてもいずれでもよい。これに関し、本発明のヌクレオチド配列は、相同組換えにより突然変異遺伝子を復帰または作出するために使用することができる。
【0119】
該宿主はいずれの原核細胞または真核細胞であってもよい。好適な原核細胞/細菌細胞は一般に、大腸菌(E.coli)、ネズミチフス菌(Salmonella typhimurium)、レイ菌(Serratia marcescens)または枯草菌(Bacillus subtilis)のようなクローニングに使用されているものである。該真核生物宿主は哺乳類細胞、両生類細胞、魚類細胞、昆虫細胞、真菌細胞、植物細胞または細菌細胞(例えば、大腸菌株HB101、DH5a、XL1 Blue、Y1090およびJM101)であり得る。真核組み換え宿主細胞が好ましい。真核宿主細胞の例としては、限定されるものではないが、酵母、例えば、サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、シゾサッカロミセス・ポムベ(Schizosaccharomyces pombe)、クルイベロミセス・ラクチス(Kluyveromyces lactis)またはピキア・パストリス(Pichia pastoris)細胞、ヒト、ウシ、ブタ、サルおよび齧歯類起源の細胞系統、並びに限定されるものではないが、ヨトウガ(Spodoptera frugiperda)昆虫細胞をはじめとする昆虫細胞、およびゼブラフィッシュ細胞が挙げられる。
【0120】
しかしながら、ショウジョウバエ細胞が好ましい。より好ましくは、該ショウジョウバエ細胞は、好ましくはショウジョウバエ発現系、例えば、Drosophila Expression System(DES(登録商標))において異種タンパク質発現に使用されるドロソフィラS2(ATCC CRL−1963)である。該S2細胞系統は、後期(20〜24時間齢)のキイロショウジョウバエ(Drosophila melanogaster)胚の一次培養物に由来するものであった。この可変細胞系統はCO2を含まない室温で急速に増殖し、容易に懸濁培養に適合する。一般に、本発明のポリペプチドを発現させる際には昆虫細胞が好ましいが、これはそれらがメチル化DNAを少ししか含まない、または好ましくは全く含まないという利点を有するからである。よって、本発明のポリペプチドを発現および単離、および好ましくは精製する場合、当該ポリペプチドは好ましくは、当該ポリペプチドが優先的に結合することができるメチル化DNAを混入していない。昆虫細胞を使用することのもう1つの利点は、昆虫細胞がタンパク質フリー培地で好ましく増殖し、よって、当該ポリペプチドが該培養培地に好ましく分泌される場合、好ましくは培養培地から本発明のポリペプチドを単離、回収および/または精製する際に、本発明のポリペプチドのさらなる混入が最小となるということである。
【0121】
使用に好適な、かつ、市販されている哺乳類種由来細胞系統としては、限定されるものではないが、L細胞、CV−1細胞、COS−1細胞(ATCC CRL 1650)、COS−7細胞(ATCC CRL 1651)、HeLa細胞(ATCC CCL 2)、C1271(ATCC CRL 1616)、BS−C−1(ATCC CCL 26)およびMRC−5(ATCC CCL 171)が挙げられる。
【0122】
もう1つの実施形態では、本発明は、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得るポリペプチドを産生する方法であって、本発明の宿主細胞を培養すること、および産生されたポリペプチドを回収することを含む方法に関する。当該ポリペプチドは好ましくは、本発明の核酸分子によりコードされる。本発明のポリペプチドを産生するための好ましい方法は実施例2に記載されている。
【0123】
本発明はまた、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得る本発明のポリペプチドを発現し得る細胞を作出する方法であって、当技術分野で公知の方法により、または本明細書に記載されている方法により、in vitroで細胞を遺伝的に操作することを含む方法も提供する。当該ポリペプチドは好ましくは、本発明の核酸分子によりコードされる。当技術分野では、適当な宿主内でポリペプチドを産生するための多くの好適な方法が存在する。宿主が単細胞生物または哺乳類若しくは昆虫細胞である場合、当業者ならば、様々な培養条件に目を向けることができ、これらの培養条件は、余計な検討を行わずとも、さらに至適化することができる。便宜には、産生されたタンパク質を培養培地から、または単離した(生物学的)膜から、確立された技術によって採取する。さらに、産生されたポリペプチドは直接宿主細胞から単離してもよい。
【0124】
本発明のポリペプチドは、微生物学的方法またはトランスジェニック哺乳類により産生させてもよい。また、本発明のポリペプチドはトランスジェニック植物から回収することも企図される。或いは、本発明のポリペプチドは合成または半合性的に産生させることもできる。
【0125】
例えば、Houghton Proc.Natl.Acad.Sci.USA(82)(1985),5131−5135により記載されている固相法などの化学的合成を使用することができる。もう1つの方法は、mRNAのin vitro翻訳である。好ましい方法は、上記のような宿主細胞内でのタンパク質の組み換え産生を含む。例えば、本発明のヌクレオチド配列のいずれか1つの全体または一部を含む核酸配列をPCRにより合成し、発現ベクターに挿入し、宿主細胞を当該発現ベクターで形質転換させることができる。その後、当該宿主細胞を培養して所望のポリペプチドを産生させ、単離および精製する。
【0126】
タンパク質の単離および精製は、例えば、限定されるものではないが、イオン交換クロマトグラフィー、ゲル濾過クロマトグラフィーおよびアフィニティークロマトグラフィー、高速液体クロマトグラフィー(HPLC)、逆相HPLC、分取ディスクゲル電気泳動など、いくつかの既知の技術のいずれか1つにより達成することができる。さらに、無細胞翻訳系を用いて本発明のポリペプチドを産生させることもできる。本発明において使用するのに好適な無細胞発現系としては、ウサギ網赤血球溶解物。麦芽抽出物、イヌ膵臓ミクロソーム膜、大腸菌S30抽出物、およびTNT系(Promega)などの転写/翻訳複合系が挙げられる。
【0127】
これらの系は、コード領域と適当なプロモーターエレメントを含むクローニングベクター、DNA断片、またはRNA配列を付加した際に、組み換えポリペプチドまたはペプチドの発現を可能とする。上述のように、タンパク質の単離/精製技術は、常法を用いた本発明のタンパク質の修飾を必要とすることがある。例えば、ニッケルカラムでの精製が可能となるように、当該タンパク質にヒスチジンタグを付加することができる。他の修飾はより高い若しくはより低い活性を生じたり、より高いレベルのタンパク質産生を可能としたり、またはタンパク質の精製を簡単にしたりすることができる。本発明のポリペプチドが産生された後、ペグ化、誘導体化などにより修飾することもできる。
【0128】
もう1つの実施形態では、本発明は、本発明のポリペプチドと特異的に結合する抗体に関する。好ましくは、当該ポリペプチドは、メチル化DNAと結合する能力を有し、本明細書に記載されるような二機能性タンパク質である。本明細書において「特異的に」とは、当該抗体は本発明のポリペプチドと反応するが、当該ポリペプチドの一部だけ、例えば、メチル−DNA結合ドメイン、Fc部分またはリーダー若しくは分泌配列とは反応しないことを意味する。しかしながら、当該抗体は、本発明のポリペプチドのポリペプチドリンカー(そのようなポリペプチドリンカーが存在すれば)と特異的に結合することができる。
【0129】
よって、当該抗体は、例えば、本発明のポリペプチドのメチル−DNA結合ドメインおよびFc部分、またはメチル−DNA結合ドメインおよびリンカーポリペプチドの部分、またはリンカーポリペプチドの部分およびFc部分と、または上述のように、リンカーポリペプチドとのみ特異的に結合する。当該抗体が本発明の上記で定義されたように特異的に反応するかどうかは、とりわけ、当該抗体の結合反応を上述のような部分と、また、本発明のポリペプチドの個々の部分のみと比較することにより、容易に調べることができる。
【0130】
本発明の抗体は、例えば、ポリクローナルまたはモノクローナルであり得る。「抗体」とはまた、結合特異性をなお保持しているその誘導体または断片も含む。抗体産生のための技術は当技術分野で周知であり、例えば、Harlow and Lane“Antibodies,A Laboratory Manual”,CSH Press,Cold Spring Harbor,1988に記載されている。これらの抗体は、例えば、本発明のポリペプチドの免疫沈降法および免疫学的局在決定法に、また、例えば、組み換え生物における、または診断法におけるこのようなポリペプチドの存在のモニタリングに使用することができる。これらの抗体はまた、本発明のタンパク質と相互作用する化合物を同定するために使用することもできる(本明細書に後述する)。例えば、BIAcore系に用いられるような表面プラズモン共鳴を使用すれば、本発明のポリペプチドのエピトープと結合するファージ抗体の効率を高めることができる(Schier,Human Antibodies Hybridomas 7(1996),97−105;Malmborg,J.Immunol.Methods 183(1995),7−13)。
【0131】
本発明はさらに、キメラ抗体、単鎖抗体およびヒト化抗体、並びにとりわけFab断片のような抗体断片を含む。抗体断片または誘導体はさらに、F(ab’)2、FvまたはscFv断片を含む;例えば、Harlow and Lane前掲参照のこと。様々な手法が当技術分野で知られており、このような抗体および/または断片の作成に使用することができる。よって、当該(抗体)誘導体は、ペプチドミメティクスにより産生させることができる。さらに、単鎖抗体の産生に関して記載されている技術(とりわけ、米国特許第4,946,778号参照)を、本発明のポリペプチドに対する単鎖抗体を作出するために適合させることもできる。また、トランスジェニック動物を用いて、本発明のポリペプチドに対するヒト化抗体を発現させることもできる。最も好ましくは、本発明の抗体はモノクローナル抗体である。モノクローナル抗体の作製のためには、連続細胞培養系により産生される抗体を提供するいずれの技術を用いてもよい。このような技術の例としては、ハイブリドーマ技術(Kohler and Milstein Nature 256(1975),495−497)、トリオーマ技術、ヒトB細胞ハイブリドーマ技術(Kozbor,Immunology Today 4(1983),72)およびヒトモノクローナル抗体を産生するためのEBV−ハイブリドーマ技術(Cole et al.,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,Inc.(1985),77−96)が挙げられる。
【0132】
単鎖抗体(例えば、米国特許第4,946,778号)の産生を記載している技術は、上記のような免疫原性ポリペプチドに対する単鎖抗体を産生するために適合させることができる。さらに、トランスジェニックマウスを用いて、該免疫原性ポリペプチドに対するヒト化抗体を発現させてもよい。本発明に従って使用される、または細胞内で発現させることができる、抗体/抗体構築物並びに抗体断片または誘導体が特に好ましい。これは、とりわけ、対応するタンパク質分子の直接注入、または対応するタンパク質分子をコードする核酸分子の注入によって達成され得る。さらに、遺伝子療法アプローチも企図される。よって、本発明において、「抗体分子」とは、完全な免疫グロブリン分子並びにこのような免疫グロブリン分子の一部に関する用語である。
【0133】
さらに、この用語は、上述のように、キメラ抗体およびヒト化抗体のような修飾および/または変更された抗体分子に関する。この用語はまた、モノクローナルまたはポリクローナル抗体並びに組み換え若しくは合成によって生成/合成された抗体に関する。この用語はまた、無傷な抗体、並びに分離された軽鎖および重鎖、Fab、Fab/c、Fv、Fab’、F(ab’)2のようなその抗体断片に関する。「抗体分子」という用語はまた、単鎖Fvs(scFv)または抗体−融合タンパク質のような二機能性抗体および抗体構築物も含む。本発明では、「抗体」という用語が、細胞内で発現され得る抗体構築物、例えば、とりわけウイルスまたはベクターを介してトランスフェクトおよび/または形質導入され得る抗体構築物を含むことが企図される。もちろん、本発明の抗体は、本発明のポリペプチドのFc部分との関連で本発明で上記したように、検出可能な物質とカップリング、連結または接合させることができる。
【0134】
本発明はまた、本発明の核酸分子、ベクター、宿主細胞、ポリペプチドまたは抗体を含む組成物も提供する。
【0135】
本発明において「組成物」とは、上述の化合物の少なくとも1つを含む組成物に関する用語である。本発明で後述される本発明の組成物は、上述の化合物をいずれかの組合せで含むと考えられる。所望により、該組成物は、メチル化DNA、好ましくは、CpGメチル化DNAと結合し得る分子をさらに含んでもよい。該組成物は固体、液体、または気体であってもよく、とりわけ、粉末、錠剤、溶液、エアゾール、顆粒剤、丸剤、懸濁液、エマルション、カプセル剤、シロップ剤、液剤、エリキシル剤、抽出物、チンキ状若しくは液状抽出物、または経口若しくは非経口若しくは局所投与に特に好適な形態であってもよい。
【0136】
さらに、本発明は、本発明の核酸分子、ベクター、宿主、ポリペプチドまたは抗体を含むキットに関する。有利には、本発明のキットはさらに、所望により、反応バッファー、保存溶液および/または科学的アッセイ若しくは診断アッセイなどの実施に必要な残りの試薬または材料を含む。さらにまた、本発明のキットの部分は、バイアルまたは瓶に個々にパッケージングすることもできるし、或いは容器または複数容器単位に組み合わせてパッケージングすることもできる。
【0137】
本発明のキットは、とりわけ、本明細書に記載されるようにメチル化DNAを単離、富化、精製および/または検出する方法を実施するために有利に使用することができ、かつ/または本明細書において、例えば、診断キット、研究ツールまたは治療ツールと呼ばれる様々な適用に使用することができる。さらに、本発明のキットは、科学目的、医学目的および/または診断目的に好適な検出のための手段を含み得る。当該キットの製造は、好ましくは、当業者に公知の標準的な手順に従う。
【0138】
上記のように、本発明は、メチル−DNA結合ドメインと抗体のFc部分を含む二機能性抗体様分子が、メチル化DNA、好ましくは、CpGメチル化DNAと、高親和性および高結合力で特異的に結合することができ、これにより、サンプル中に10ngを超える量、10ng未満、7.5ng未満、5ng未満、2.5ng未満、または約1ngからメチル化DNAを単離、富化および/または検出するための好適な診断ツールとなるという、驚くべき発見に基づくものである。
【0139】
よって、好ましい実施形態では、本発明の組成物は、所望により検出に好適な手段をさらに含む診断用組成物である。本発明のさらなる実施形態は、メチル化DNAの検出のための本発明のポリペプチドの使用である。
【0140】
さらに、本発明の核酸分子、ポリペプチド、ベクター、宿主細胞または抗体は、メチル化DNAを検出することを目的とした診断用組成物の製造のために使用される。
【0141】
さらに、本発明の核酸分子、ポリペプチド、ベクター、宿主細胞または抗体は、腫瘍組織または腫瘍細胞の検出を目的とした診断用組成物の製造のために使用される。
【0142】
本明細書に記載されるように、本発明のポリペプチドは、特に、メチル化DNA、好ましくは、CpGメチル化DNAを単離、富化、精製および/または検出するための、予期できない優れた特性を有する。よって、本発明は、本発明のポリペプチドを使用する様々な診断的使用および方法を提供する。メチル化DNA、好ましくは、CpGメチル化DNAの好ましい小規模富化手順が実施例3に記載されている。要するに、本発明のポリペプチドを、例えば、Aタンパク質セファロースに結合させ、結合していない(inbound)タンパク質を洗浄除去する。次に、対象DNAを好ましくは消化し、結合している本発明のポリペプチドに加える。さらに、該消化DNAを結合している本発明のポリペプチドと共にインキュベートし、洗浄し、その後、本発明のポリペプチドが結合したものを溶出させる。
【0143】
よって、本発明はまた、in vitroでメチル化DNAを検出する方法であって、
(a)メチル化および/または非メチル化DNAを含むサンプルを本発明のポリペプチドと接触させること;および
(b)該ポリペプチドとメチル化DNAとの結合を検出すること
を含む方法に関する。
【0144】
好ましくは、該in vitro法は、実施例3に例示されるような逆サザン−ウエスタンブロット法、免疫沈降法、メチル化DNAのアフィニティー精製、または実施例4および5に例示されるようなメチル−CpG免疫沈降法(MCIp)である。しかしながら、該in vitro法はそれに限定されないが、本発明の診断用組成物に関しても記載したように、基本的に、本発明のポリペプチドが固相マトリクス、例えば、セファロース、アガロース、キャピラリー、容器壁などのマトリクスに結合されているいずれかの手順であり得る。
【0145】
より好ましくは、上述のin vitro法は、ステップ(c)として、例えば、シークエンシング、サザンブロット法、制限酵素消化、重亜硫酸塩シークエンシング、ピロシークエンシングまたはPCR法によりメチル化DNAを分析することをさらに含む。なお、本発明のポリペプチドを用いることにより単離、富化、精製および/または検出されたメチル化DNAの分析は、上述の方法に限定されず、例えば、RDA法、マイクロアレイ法など、メチル化DNAを分析するために当技術分野で公知の全ての方法を包含する。
【0146】
本発明のポリペプチドの好ましい診断適用は、図7に示される、いわゆるMB−PCRである。要するに、第1のステップにおいて、本発明のポリペプチドをコアテーブルPCR容器、例えば、Nunc製のTopYield Stripsに加える。このようにすれば、当該ポリペプチドは当技術分野で公知の技術により、該容器の内面に好ましくコーティングされる。次のステップで、このコーティングPCR容器に遮断試薬、例えば、4.5%粉乳を加える。さらなるステップで、好ましくは対象DNA断片(例えば、メチル化および/または非メチル化DNA断片)を、このコーティングおよび遮断済みのPCR容器に加える。本発明のポリペプチドは、存在すれば、メチル化DNAと特異的に結合すると考えられる。その後のステップで、好ましくはDNA断片を含むコーティングおよび遮断済みPCR容器をインキュベートし、その後、結合していないDNA断片を洗浄除去する。
【0147】
その後、例えば、メチル化または非メチル化であると思われる対象の遺伝子または遺伝子座または複数の遺伝子座に関する多重PCRのための、好ましくは遺伝子特異的プライマー、または、これもまた好ましいが、少なくとも2つ、3つ、4つ、5つ、6つ、7つなどのプライマー対を含むPCR混合物を加え、好ましくは、リアルタイムPCRまたは通常のPCRを実施した後、ゲル電気泳動により増幅産物を分離する。
【0148】
MB−PCRは好ましくは次のように行う。好ましくは、PCR試験管は熱安定性TopYield(商標)ストリップ(Nuncカタログ番号248909)を用いて調製する。好ましくは、好ましくは組み換え型の本発明のポリペプチド50μl(10mMのTris/HCL pH7.5中、15μg/mlに希釈)を各ウェルに加え、4℃で一晩インキュベートする。好ましくは、ウェルを200μlのTBS(150mMのNaCLを含有する20mMのTris,pH7.4)で3回洗浄し、4℃にて一晩、100μl遮断溶液(150mMのNaCL、4.5%スキムミルク粉末、5mMのEDTAおよび各0.8μg/mlのポリd(I/C)、ポリd(A/T)およびポリd(CG)を含有する10mMのTris,pH7.5)で遮断する。好ましくは、その後、これらの管を200μlのTBST(0.1%Tween−20を含有するTBS)で3回洗浄する。
【0149】
好ましくは、50μlの結合バッファー(400mMのNaCl、2mMのMgCl2、0.5mMのEDTA、および0.1%Tween−20を含有する20mMのTris,pH7.5)を各ウェルに加え、好ましくは、1μlの消化DNA、好ましくは、Mselで消化したゲノムDNAを、好ましくは10ng/μlの量で各第2のウェルに加える(M−反応)。
【0150】
ゲノムDNAを、好ましくは、例えば、Blood and Cell Culture Midi Kit(Qiagen)を用いるなど、当技術分野で公知のキットを用いることにより調製する。このゲノムDNA調製物の質は、好ましくは、アガロースゲル電気泳動により制御し、DNA濃度は好ましくは、UV分光光度法により測定した。DNAの定量は好ましくは、PicoGreen dsDNA定量試薬(Molecular Probes)を用いることにより行う。
【0151】
本発明のポリペプチドとDNA、好ましくは、DNA(酵素消化または機械的断片化により生成)を含有するウェルを、好ましくは4℃にて、好ましくは3時間、シェーカー上でインキュベートする。好ましくは、これらの管を200μlの結合バッファーで3回、10mMのTris/HCl、pH7.5で1回洗浄した。
【0152】
次に、PCRを好ましくは、直接TopYield(商標)ストリップで行った。好ましくは、PCR混合物(50μl/ウェル)は、標準的なPCRバッファー(Roche)、好ましくは、2.5U FastStart Taq DNAポリメラーゼ(Roche)、好ましくは、各10pmolの遺伝子特異的プライマー(Qiagenにより合成)、dNTP(好ましくは、各200mM,Amersham/Pharmacia)、好ましくは、1Mベタイン(Sigma)、プライマー配列を含み、特定の対象遺伝子のサイクリングパラメーターは実施例6の表2および3に示されている。当然のことながら、当業者ならば、他の好適な遺伝子特異的または遺伝子座特異的または複数の遺伝子座特異的プライマーを設計することができる。
【0153】
さらに、当業者ならば、対象とするプライマーおよび遺伝子、遺伝子座医/複数の遺伝子座に最も好適なPCRパラメーターを容易に決定および/または試験することができる。PCR混合物を加えた後、好ましくは、1μlのMseI消化DNA(好ましくは、10ng/μl量)を、事前にDNA断片と共にインキュベートしなかった各第2のウェルに加える(P−反応)。好ましくは、PCR産物を、アガロースゲル電気泳動を用いて分析し、臭化エチジウムで染色したゲルを、例えば、Typhoon9200Imager(Amersham/Pharmacia)を用いて走査した。
【0154】
よって、本発明のポリペプチドは、単一細胞を含み得る、本明細書に後述されるようなサンプル中におけるメチル化DNA、好ましくは、CpGメチル化DNAの検出に有用であると考えられる。また、本発明のポリペプチドは完全細胞にも有用であると考えられる。「完全細胞」とは、ゲノムという点から完全な単一の細胞を意味する。よって、完全細胞は、メチル化DNAのゲノム分析に有用である。
【0155】
かかる方法は、好ましくは、本発明のポリペプチドを用いたメチル化DNAの富化/精製ステップと、例えば、ゲノムDNAマイクロアレイ、ティリングアレイ、低密度アレイのハイブリダイゼーション、またはlab−on−a−chip−アプローチなどの検出ステップを含む。当業者ならば、当技術分野で公知の検出方法を容易に行うことができる。それらのいくつかが添付の実施例に示されているが、ここでは、メチル化DNAを富化、精製および/または単離するために本発明のポリペプチドが使用される。1つの実施例は、ハイスループット・ロバスト・ワンチューブ・アッセイに好適であり得る、いわゆるMB−PCRを示す。さらに、本発明のポリペプチドは、単一遺伝子レベルでCpGメチル化の検出に特に有用であり得る。このような方法は好ましくは、単一遺伝子のメチル化DNA、好ましくは、CpGメチル化DNAを富化および/または精製するステップと、該メチル化DNAを、PCR、リアルタイムPCRなどを用いて検出するステップを含む。
【0156】
本発明のポリペプチドのもう1つの可能性のある診断適用として、免疫組織化学がある。よって、本発明のポリペプチドは、メチル化DNA、好ましくは、CpGメチル化DNAを「染色する」ために使用することができる。本発明のポリペプチドは、本明細書に記載されるような好適な検出可能物質に、そのFc部分を介してカップリング、連結または接合されるか、または例えば、メチル化DNAに結合されている場合の本発明のポリペプチドを検出するには、第2の抗Fc部分抗体が用いられる。
【0157】
数種の悪性疾患は、本発明の方法により、それらのメチル化パターン/プロフィールによって検出することができ、従って、予後的および/または属性的に有用であり得ると思われる。これは、このメチル化パターンが患者の薬理学的プロフィールを設定するために使用可能であることを意味する。例えば、抗がん薬に対する感受性および/または感度は、あるがん遺伝子および/または腫瘍抑制遺伝子が高メチル化であるか、低メチル化であるかが検出されれば、判定することができる。よって、当業者は、例えば、がん遺伝子がすでに高メチル化され、従って、不活性であると思われるが、ある薬剤ががん遺伝子を阻害し得る場合に、負の作用および/または有害作用を回避するのに最も適当な薬剤を選択する。
【0158】
本明細書に記載の方法は、第1に、がんまたは腫瘍性疾患などの悪性疾患において高メチル化または低メチル化(hypomethylated)されている遺伝子座および/または遺伝子を同定するため、また、第2に、単一遺伝子レベルでこのような遺伝子座および/または遺伝子のメチル化状態をアッセイするための基礎を提供するのに有用であり得る。該悪性疾患は好ましくは腫瘍である。腫瘍はあり得るいずれの腫瘍種であってもよい。例としては、皮膚がん、乳がん、脳がん、子宮頸がん、精巣がん、頭頸部がん、肺がん、縦隔がん、消化管がん、尿生殖器系がん、婦人科系がん、乳がん、内分泌系がん、皮膚がん、小児がん、原発部位不明のがんまたは転移がん、軟組織および骨の肉腫、中皮腫、黒色腫、中枢神経系の新生物、リンパ腫、白血病、腫瘍随伴症候群、腹膜がん腫症(peritoneal carcinomastosis)、免疫抑制関連の悪性および/または転移がんなどがある。
【0159】
これらの腫瘍細胞は、例えば、鼻腔、副鼻洞、鼻咽頭、口腔、中咽頭、喉頭、下咽頭、唾液腺のがんおよび傍神経節腫を含む頭頸部;非小細胞肺がん、小細胞肺がんを含む肺のがん;縦隔のがん;食道、胃、膵臓、肝臓、胆管、小腸、結腸、直腸および肛門領域のがんを含む消化管のがん;腎臓、尿道、膀胱、前立腺、尿道、陰茎および精巣のがんを含む尿生殖器系のがん;子宮頸がん、膣がん、外陰がん、子宮胎がん、妊娠性栄養膜疾患、卵巣がん、卵管がん、腹膜がん、乳がんを含む婦人科がん;甲状腺、副甲状腺、副腎皮質の腫瘍、膵内分泌腫瘍を含む内分泌系のがん;カルチノイド腫およびカルチノイド症候群;多発性内分泌腺腫症;軟組織および骨の肉腫;中皮腫;皮膚がん;皮膚黒色腫および眼内黒色腫を含む黒色腫;中枢神経系の新生物;網膜芽腫、ビルムス腫瘍、神経繊維腫瘍、神経芽腫、ユーイング肉腫系の腫瘍、横紋筋肉腫を含む小児がん;非ホジキンリンパ腫、皮膚T細胞リンパ腫、原発性中枢神経系リンパ腫、およびホジキン病を含むリンパ腫;急性白血病、慢性骨髄性白血病およびリンパ性白血病、血漿細胞新生物、および骨髄異形成症候群を含む白血病;腫瘍随伴症候群;原発部位不明のがん;腹膜がん腫症;カポジ肉腫、エイズ関連リンパ腫、エイズ関連原発性中枢神経系リンパ腫、エイズ関連ホジキン病およびエイズ関連肛門性器などのエイズ関連悪性疾患を含む免疫抑制関連悪性疾患、および移植関連悪性疾患、肝臓への転移がん、骨への転移がん、悪性胸腔および心膜滲出および悪性腹水に由来し得る。
【0160】
多くの場合、該がんまたは腫瘍性疾患は、頭頸部がん、肺がん、縦隔がん、消化管がん、尿生殖器系がん、婦人科系がん、乳がん、内分泌系がん、皮膚がん、小児がん、原発部位不明のがんまたは転移がん、軟組織および骨の肉腫、中皮腫、黒色腫、中枢神経系の新生物、リンパ腫、白血病、腫瘍随伴症候群、腹膜がん腫症、免疫抑制関連の悪性および/または転移がんであることが好ましい。好ましい腫瘍はAML、形質細胞腫またはCLLである。
【0161】
本発明の診断用組成物は、本明細書に記載の本発明の少なくとも1つを含む。当該診断用組成物は、とりわけ、例えば、上記のような個体からのサンプルにおいて、メチル化DNA、好ましくは、CpGメチル化DNAの存在を単離、富化および/または測定するための方法に使用することができる。
【0162】
本発明において「サンプル」とは、ポリヌクレオチドまたはポリペプチドまたはその一部を含有する個体、細胞系統、組織培養またはその他の供給源から得られるいずれの生体サンプルも企図する。示されているように、生体サンプルとしては、本発明のポリヌクレオチドを発現することが見出された体液(血液、血清、血漿、尿、滑液および脊髄液など)および組織源が挙げられる。哺乳類から組織生検および体液を得る方法は本技術分野で周知である。ゲノムDNA、mRNAまたはタンパク質を含む生体サンプルが供給源として好ましい。
【0163】
診断用組成物のさらなる適用は本明細書に記載されており、添付の実施例に示されている。
【0164】
当該診断用組成物は、所望により、検出に好適な手段を含む。上記の核酸分子、ベクター、宿主、抗体、およびポリペプチドはイムノアッセイにおける使用に好適であり、それらは例えば、液相において、または固相担体に結合させて使用することができる。周知の担体の例としては、ガラス、ポリスチレン、ポリビニルイオン、ポリプロピレン、ポリエチレン、ポリカーボネート、デキストラン、ナイロン、アミロース、天然および修飾セルロース、ポリアクリルアミド、アガロース、および磁鉄鉱が挙げられる。本発明において、当該担体の性質は可溶性であっても不溶性であってもよい。
【0165】
固相担体は当業者に公知であり、ポリスチレンビーズ、ラテックスビーズ、磁性ビーズ、金属コロイド粒子、ガラスおよび/またはシリコーンチップおよび表面、ニトロセルロースストリップ、膜、シート、デュラサイト(duracytes)、および反応トレーのウェル、プラスチックチューブまたは他の試験管の壁面を含み得る。固相支持体に核酸分子、ベクター、宿主、抗体、アプタマー、ポリペプチドなどを固定化する好適な方法は、限定されるものではないが、イオン的、疎水性、共有結合的相互作用または(化学的)架橋などがある。
【0166】
本発明の当該化合物を使用することができるイムノアッセイの例としては、直接的または間接的な形式の、競合的および非競合的イムノアッセイがある。一般に使用される検出アッセイは、放射性同位元素的または非放射性同位元素的方法を含み得る。かかるイムノアッセイの例としては、ラジオイムノアッセイ(RIA)、サンドイッチ(免疫測定アッセイ)およびノーザンまたはサザンブロットアッセイがある。さらに、これらの検出法は、とりわけ、IRMA(免疫放射定量測定法)、EIA(酵素免疫測定法)、ELISA(酵素結合免疫測定法)、FIA(蛍光免疫測定法)、およびCLIA(化学発光免疫測定法)がある。さらに、本発明の診断用化合物は、FRET(蛍光共鳴エネルギー移動)アッセイのような技術に使用することもできる。
【0167】
標識のための適当な標識および方法は当業者に公知である。本発明において使用可能な標識種の例としては、とりわけ、蛍光色素(フルオレセイン、ローダミン、テキサスレッドなど)、酵素(セイヨウワサビペルオキシダーゼ、β−ガラクトシダーゼ、アルカリ性ホスファターゼなど)、放射性同位元素(32P、33P、35Sまたは125Iなど)、ビオチン、ジゴキシゲニン、金属コロイド、化学発光化合物および生物発光化合物(ジオキセタン、ルミノールまたはアクリジニウムなど)が挙げられる。
【0168】
様々な技術が生体分子を標識するために利用でき、当業者に周知であり、本発明の範囲内であり、とりわけ、酵素またはビオチニル基の共有結合的カップリング、リン酸化、ビオチン化、ランダムプライミング、ニックトランスレーション、テーリング(ターミナルトランスフェラーゼを用いる)を含む。このような技術は、例えば、Tijssen,“Practice and theory of enzyme immunoassays”,Burden and von Knippenburg(Eds),Volume 15(1985);“Basic methods in molecular biology”,Davis LG,Dibmer MD,Battey Elsevier(1990);Mayer,(Eds)“Immunochemical methods in cell and molecular biology”Academic Press,London(1987);またはシリーズ“Methods in Enzymology”,Academic Press,Inc.に記載されている。検出方法は、限定されるものではないが、オートラジオグラフィー、蛍光顕微鏡法、直接的および間接的酵素反応などを含む。
【0169】
本発明のもう1つの好ましい組成物は、所望により、製薬上許容される担体をさらに含む医薬組成物である。当該医薬組成物は、とりわけ、例えばヒストンデアセチラーゼ、ヒストンアセチラーゼ、DNA−メチラーゼおよび/またはDNA−デメチラーゼなどのさらなるタンパク質とカップリングさせ得る本発明のポリペプチドを含む。当該医薬組成物はまた、制限酵素またはリボザイムとカップリングさせることもできる。上記のように1又は複数のさらなるタンパク質(proteian)とカップリングさせた本発明のポリペプチドがメチル化DNAと結合すれば、上記そのさらなるタンパク質をDNAへターゲッティングし得ると考えられる。よって、DNA−メチラーゼは低メチル化DNA、例えば、低メチル化発癌遺伝子座またはがん遺伝子またはDNAを高メチル化することができる。このようにして、遺伝子の不活化が達成できる。
【0170】
或いは、DNA−デメチラーゼは、高メチル化遺伝子または遺伝子座、例えば、腫瘍抑制遺伝子または遺伝子座を脱メチル化し得る。このようにして、遺伝子の活性化が達成できる。
【0171】
ヒストンデアセチラーゼは、ヒストンのアセチル化リシン残基を脱アセチル化し、それにより、DNAのヒストンへのより強固なパッケージングと遺伝子抑制をもたらすことによって活性遺伝子の転写抑制に関与する。当技術分野で公知のように、ヒストンアセチラーゼは反対の作用を示し得る。
【0172】
制限酵素またはリボザイムは、切断されるべきDNAにターゲッティングされる場合にその作用を発揮し得る。適当な制限酵素は当技術分野で公知である。標的DNA配列に特異的なリボザイムは、当技術分野で公知のように調製することができる。
【0173】
よって、当該医薬組成物は、がんおよび/または腫瘍性疾患を治療するのに有用であり得る。その双方が非制御の遺伝子発現、活性化および/または抑制により引き起こされることが知られており、これはとりわけ、ヒストンアセチル化/脱アセチル化および/またはDNAメチル化/脱メチル化により調節される。
【0174】
当該医薬組成物は、本明細書に記載されるように、生理学上許容される担体と共に患者に投与することができる。特定の実施形態では、「製薬上許容される」とは、動物、より詳しくは、ヒトでの使用が、規制機関または他の一般に認知されている薬局方により認可されていることを意味する。「担体」とは、それと共に治療薬が投与される希釈剤、アジュバント、賦形剤または媒体を指す。かかる医薬担体は、ラッカセイ油、ダイズ油、鉱油、ゴマ油など、石油、動物、植物または合成起源のものを含む、水および油といった無菌の液体であり得る。
【0175】
当該医薬組成物が静脈投与される場合、水が好ましい担体である。特に注射可能な溶液に関しては、液体担体として、生理食塩水並びにデキストロースおよびグリセロール水溶液を使用することもできる。好適な医薬賦形剤としては、グルコース、ラクトース、スクロース、ゼラチン、麦芽、コメ、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセロール、タルク、ナトリウムイオン、乾燥スキムミルク、グリセロール、プロピレン、グリコール、水、エタノールなどが挙げられる。
【0176】
当該組成物はまた、所望により、微量の湿潤剤若しくは乳化剤、またはpH緩衝剤を含むことができる。これらの組成物は溶液、懸濁液、エマルション、錠剤、丸剤、カプセル剤、粉末、徐放性処方物などの形態を採ることができる。当該組成物は、通常の結合剤およびトリグリセリドなどの担体と共に坐剤として処方することもできる。経口処方物は、医薬級のマンニトール、ラクトース、デンプン、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの標準的な担体を含むことができる。
【0177】
好適な医薬担体の例は、E.W.Martinにより“Remington’s Pharmaceutical Sciences”に記載されている。このような組成物は、治療有効量の上述の化合物を、好ましくは精製形態で、患者への適切な投与のための形態を提供するよう、好適な量の担体と共に含む。当該処方物は投与様式に適したものとすべきである。
【0178】
もう1つの好ましい実施形態では、当該組成物は、ヒトへの静脈投与に適合した医薬組成物としてありふれた手段に従って処方される。典型的には、静脈投与用組成物は、無菌等張水性バッファー中の溶液である。必要であれば、当該組成物はまた、可溶化剤、および注射部位の痛みを和らげるためのリドカインなどの局所麻酔薬を含んでもよい。一般に、これらの成分は個別に、または例えば、凍結乾燥粉末または無水濃縮物として単位投与形中に共に混合して、有効剤の量を示す、アンプルまたサシェなどの湿気遮断容器にて提供される。当該組成物が注入により投与される場合、無菌医薬級の水または生理食塩水を含む注入瓶を用いて調剤することができる。当該組成物が注射により投与される場合、投与前に成分を混合し得るように無菌注射水または生理食塩水のアンプルを提供することができる。
【0179】
本発明の医薬組成物は、中性または塩の形態で処方することができる。医薬上許容される塩としては、塩酸、リン酸、酢酸、シュウ酸、酒石酸などから得られるものなど、陰イオンを伴って形成されるもの、およびナトリウム、カリウム、アンモニウム、カルシウム、水酸化鉄(III)、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどから得られるものなど、陽イオンを伴って形成されるものが挙げられる。
【0180】
所望により、in vitroアッセイを用いて、至適用量範囲を特定する補助としてもよい。処方物に用いる厳密な用量はまた、投与経路、および疾病または疾患の重篤度によっても異なり、医師の判断および各患者の状況に従って決定されなければならない。有効量はin vitroまたは動物モデル試験系から得られる用量反応曲線から推定することができる。好ましくは、当該医薬組成物はそのまま投与するか、またはアジュバントと組み合わせて投与する。
【0181】
当該医薬組成物は好ましくは、遺伝子療法に適用するために設計される。遺伝子療法の技術は、本発明の核酸分子に関して既に上記されており、そこで述べたことは全て、当該医薬組成物についても当てはまる。例えば、当該医薬組成物中の核酸分子は、好ましくは、治療される個体の細胞へのその導入、発現および/または安定な組み込みを可能とする形態である。
【0182】
遺伝子療法のために使用可能なウイルスベクターとしては、例えば、アデノウイルス、ヘルペスウイルス、ワクシニア、または好ましくは、レトロウイルスなどのRNAウイルスが挙げられる。単一の外来遺伝子を挿入することができるレトロウイルスベクターの例としては、限定されるものではないが、モロニーネズミ白血病ウイルス(MoMuLV)、ハーヴェーネズミ肉腫ウイルス(HaMuSV)、ネズミ乳房腫瘍ウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)が挙げられる。その他のレトロウイルスベクターの多くは、複数の遺伝子を組み込むこともできる。
【0183】
これらのベクターは全て、形質導入された細胞を識別および生成可能なように、選択マーカーの遺伝子を導入または組み込むことができる。レトロウイルスベクターは、例えば、糖、糖脂質またはタンパク質をコードするポリヌクレオチドを挿入することにより、標的特異的とすることができる。当業者ならば、挿入ポリヌクレオチド配列を含むレトロウイルスベクターの標的特異的送達を可能とするためにレトロウイルスゲノムに挿入可能な特定のポリヌクレオチド配列を知っているか、または余計な実験を行わずに容易に確認することができる。
【0184】
組み換えレトロウイルスは欠陥型のものが好ましいので、感染性のベクター粒子を産生するためには補助を必要とする。この補助は、例えば、LTR内の調節配列の制御下に、レトロウイルスの全構造遺伝子をコードするプラスミドを含むヘルパー細胞系統を用いることにより、提供することができる。
【0185】
これらのプラスミドは、パッケージング機構にキャプシド形成に関するRNA転写物を認識させ得るヌクレオチド配列を欠いている。パッケージングシグナルの欠失したヘルパー細胞系統としては、限定されるものではないが、例えば、w2、PA317およびPA12が挙げられる。これらの細胞系統は、ゲノムがパッケージングされていないので、空のビリオンを産生する。パッケージングシグナルが無傷な細胞にレトロウイルスベクターが導入されるが、それらの構造遺伝子が対象とする他の遺伝子で置換されている場合、このベクターはパッケージング可能で、ベクタービリオンも産生可能である。或いは、NIH3T3または他の組織培養細胞を、従来のリン酸カルシウムトランスフェクションにより、レトロウイルス構造遺伝子gag、polおよびenvをコードするプラスミドで直接トランスフェクトすることができる。
【0186】
次に、これらの細胞を、対象遺伝子を含むベクタープラスミドでトランスフェクトする。得られた細胞は培養培地中にレトロウイルスベクターを放出する。本発明の核酸分子のための別の標的送達系として、コロイド分散系がある。コロイド分散系としては、高分子複合体、ナノカプセル、マイクロスフェア、ビーズ、並びに水中油エマルション、ミセル、混合ミセルおよびリポソームを含む脂質に基づく系が挙げられる。本発明の好ましいコロイド系はリポソームである。リポソームは、in vitroおよびin vivoにおいて送達媒体として有用な人工膜小胞である。0.2〜4.0pmの範囲の大きさの大型単層小胞(LUV)は、大きな高分子を含む、実質的パーセンテージの水性バッファーを封入し得ることが示されている。RNA、DNAおよび無傷なビリオンは水性の内部に封入することができ、生物学的に活性な形態で細胞に送達され得る(Fraley,et al.,Trends Biochem.Sci.,6:77,1981)。
【0187】
哺乳類細胞の他、リポソームは植物、酵母および細菌細胞においてポリヌクレオチドの送達に使用されている。リポソームを効率的な遺伝子導入媒体とするためには、次の特徴が存在しなければならない:(1)それらの生物活性を損なわずに高効率で対象遺伝子を封入すること;(2)非標的細胞に比べて標的細胞と優先的かつ実質的に結合すること;(3)その小胞の水性内容物を高効率で標的細胞細胞質に送達すること;および(4)遺伝情報の正確および有効な発現(Mannino,et al.,Biotechniques,6:682,1988)。当該リポソーム組成物は通常、リン脂質、特に、高相転移温度リン脂質の組合せ、通常はステロイド、特にコレステロールと組み合わせたものである。他のリン脂質または他の脂質も使用可能である。リポソームの物理的特徴は、pH、イオン強度および二価陽イオンの存在によって異なる。
【0188】
リポソームの産生に有用な脂質の例としては、ホスファチジルグリセロール、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルエタノールアミン、スフィンゴ脂質、セレブロシド、およびガングリオシドなどのホスファチジル化合物が挙げられる。脂質部分が14〜18個の炭素原子、特に16〜18個の炭素原子を含み、飽和している、ジアシルホスファチジルグリセロールが特に好ましい。例示的リン脂質としては、卵ホスファチジルコリン、ジパルミトイルホスファチジルコリンおよびジステアロイルホスファチジルコリンが挙げられる。リポソームの標的化は、解剖学的因子および機会的因子に基づいて分類することができる。解剖学的分類は選択性、例えば、器官特異性、細胞特異性およびオルガネラ特異性のレベルに基づく。機械的標的化は、受動的であるか能動的であるかに基づいて識別することができる。受動的標的化は、洞様毛細管を含む器官における細網内皮系(RES)の細胞に分布するリポソームの自然の傾向を利用する。
【0189】
好ましい実施形態では、本発明の組成物は、メチル化DNA、好ましくは、CpGメチル化DNAをin vivoで画像化するのに有用であり得る。よって、当該組成物は、それを必要とする被験体に投与することができる。本発明において「被験体」とは、情動障害の治療を必要とする個体を意味する。好ましくは、該被験体は脊椎動物、いっそうより好ましくは哺乳類であり、特に好ましくはヒトである。
【0190】
「投与される」とは、本発明のポリペプチドをコードする上述の核酸分子の、治療上または診断上有効量を投与することを意味する。「治療上または診断上有効量」とは、それが投与される目的の作用をもたらす用量を意味する。厳密な用量は治療または診断の目的によって異なり、当業者ならば既知の技術を用いて確認することができる。
【0191】
当業者で公知のように、また、上記のように、全身投与か局所投与、齢、体重、健康状態、性、食餌、投与時間、薬剤の相互作用、および症状の重篤度に関する判断が必要である場合があり、当業者ならば通常の検討で確認することができる。
【0192】
これらの方法は、ヒト療法および獣医学的適用の双方に適用可能である。所望の治療活性を有する本明細書に記載の化合物は、本明細書に記載されるように、生理学上許容される担体中にて患者に投与することができる。導入の方法に応じ、当該化合物は後述するような様々な方法で処方することができる。処方物中の治療上有効な化合物の濃度は、約0.1〜100重量%で様々であってよい。これらの薬剤は単独または他の治療と組み合わせて投与することができる。
【0193】
当該医薬組成物の投与は、限定されるものではないが、経口、皮下、静脈内、動脈内、節内、髄内、くも膜下腔内、脳室内、鼻腔内、気管支内、経皮、節内、直腸内、腹膜内、筋肉内、肺内、膣、直腸、または眼内を含む上述のような様々な方法で行うことができる。場合によっては、例えば、創傷および炎症の治療において、これらの候補薬剤は溶液ドライスプレーとして直接適用することもできる。
【0194】
主治医および臨床因子が投与計画を決定する。医療分野で周知のように、ある患者の用量は、患者の大きさ、体表面積、齢、投与される特定の化合物、性、投与時間および投与経路、健康状態、および同時に投与される他の薬剤を含む多くの因子によって異なる。典型的な用量は例えば、0.001〜1000μgの範囲であり得るが、上述の因子を考慮して、この例示的範囲よりも低いまたは高い用量も考えられる。
【0195】
これらの用量は好ましくは、1週間に1回与えられるが、これらの用量は治療の進行過程で、ずっと長い時間間隔で与えることもでき、必要があれば、例えば毎日など、ずっと短い時間間隔で与えることもできる。好ましい場合では、免疫応答は本明細書に記載の方法、および当業者に公知のさらなる方法を用いてモニタリングされ、用量は、例えば、時間、量および/または組成において至適化することができる。
【0196】
用量は様々であるが、DNAの静脈投与に好ましい用量は、DNA分子およそ106〜1012コピーである。投与計画が持続的注入である場合、用量はまた、それぞれ、1μg〜10mg単位/体重キログラム/分の範囲でなければならない。進行は定期的評価によりモニタリングすることができる。本発明の医薬組成物は局所投与または全身投与可能である。
【0197】
好ましくは、投与は非経口、例えば、静脈投与である。非経口投与用の剤形としては、無菌水溶液または非水溶液、懸濁液、およびエマルションが挙げられる。非水性溶媒の例としては、プロピレングリコール、ポリエチレングリコール、オリーブ油などんの植物油、およびオレイン酸エチルなどの注射可能な有機エステルが挙げられる。水性担体としては、生理食塩水および緩衝媒体を含む、水、アルコール/水溶液、エマルションまたは懸濁液が挙げられる。非経口媒体としては、ナトリウムイオン溶液、リンゲルのデキストロース、デキストロースおよびナトリウムイオン、乳酸リンゲル液、または硬化油が挙げられる。静脈用媒体としては、流体および栄養補液、電解質補液(リンゲルのデキストロースに基づくものなど)などが挙げられる。また、保存剤および他の添加剤、例えば、抗菌剤、抗酸化剤、キレート剤、および不活性ガスなどが存在してもよい。
【0198】
また、当該医薬組成物は、例えば、メチル化DNAの検出に有用な、従って例えば、典型的なメチル化パターンを示し得る悪性疾患の診断に有用な他の薬剤との同時治療アプローチに用いられると考えられる。
【0199】
本発明およびその多くの利点のより良い理解は以下の実施例から得られるが、これらの実施例は単に例示のために示されるものであり、本発明の範囲を何ら限定するものではない。
【実施例】
【0200】
実施例1:pMTBip/MBD2−Fcのクローニング
ヒトMBD2(Genbank受託番号NM003927;AA144〜230)のメチル−CpG結合ドメイン(MBD)に相当するcDNAを、プライマーMBD2−Nhe S(5’−AGA TGC TAG CAC GGA GAG CGG GAA GAG G−3’)(配列番号4)およびMBD2−Not AS(5’−ATC ACG CGG CCG CCA GAG GAT CGT TTC GCA GTC TC−3’)(配列番号5)並びにHerculaseDNAポリメラーゼ(Stratagene)を用い、逆転写ヒト一次マクロファージ全RNAからPCR増幅させた。サイクリングパラメーターは、95℃3分変性;95℃20秒、65℃20秒、72℃80秒の増幅34サイクル;72℃5分の最終伸張であった。このPCR産物を沈殿させ、NotI/NheIで消化し、Signal plg plusベクター(Ingenius,R&D Systems)のNotI/NheI部位にクローニングし、配列を確認し、plg/MBD2−Fc(真核細胞発現ベクター)を得た。ショウジョウバエS2細胞における組み換え発現のためのpMTBip/MBD2−Fcをクローニングするため、ヒトIgG1のFcテールと融合されたヒトMBD2のMBDを含むplg/MBD2−FcのApaI/NheI断片を、pMTBiP/V5−HisB(Invitrogen)のApaI/SpeI部位にサブクローニングした。
【0201】
実施例2:抗体様メチル−CpG−DNA結合タンパク質の組み換え発現
一本鎖のメチル化シトシンは、5−mC抗体を用いて効率的に検出され得るが、二本鎖DNA分子は検出されない。二本鎖CpGメチル化DNAの抗体様検出を可能にするため、上記実施例1に記載のベクターを、ヒトメチル−CpG結合ドメイン2(MBD2)のメチル−CpG結合ドメイン(MBD)、フレキシブルリンカーポリペプチドおよびヒトIgG1のFc部分を含む融合タンパク質をコードするように構築した。このタンパク質をショウジョウバエS2 Schneider細胞において金属誘導プロモーターの制御下で発現させ、Aタンパク質アフィニティークロマトグラフィーにより上清から回収した。この精製タンパク質は多量に発現され(4〜5mg/L細胞培養上清)、推定分子量は約40kDaであった(図2参照)。
【0202】
よって、詳しくは、MBD2−Fcタンパク質の組み換え発現用として、いくつかの理由で昆虫細胞系が選択された。主な理由は、CpGメチル化が存在しないか、低量であることである。哺乳類(特にヒト)細胞でのこのタンパク質の産生ではDNA混入(細胞培養上清におけるMBD2−Fcタンパク質への結合)が起こるおそれがあり、これがその後のCpGメチル化DNAの分析を煩雑にすることがある。他の理由としては、培養条件が簡単なこと、およびタンパク質収量が潜在的に高いことである。
【0203】
ショウジョウバエS2細胞はATTCから入手し、25℃のインキュベーター内で、10%FCS(PAA)を含有するInsect−Xpress培地(Bio Whittaker)で培養した。4×106個のショウジョウバエS2細胞/60mm細胞培養ディッシュを、Effecteneトランスフェクション試薬(Qiagen)を製造業者のプロトコールに従って用い、1.5μg pMTBip/MBD2−Fcと0.3μg pCoHygro(Invitrogen)の混合物でトランスフェクトした。
【0204】
3日目にトランスフェクト細胞を採取し、洗浄し、10%FCSおよび300μg/mlハイグロマイシン(BD Biosciences)を含有する選択培地(Insect−Xpress)に再プレーティングした。5週間、4〜5日おきに選択培地を交換した。安定トランスフェクトされたショウジョウバエS2細胞のプールを拡張し、いくつかのアリコートにして液体窒素中で保存した。
【0205】
大規模生産では、1〜5×108細胞を、2000ml容の回転瓶にて、FCSを含まない100〜200mlのInsect−Xpress中で(任意選択で300μg/mlハイグロマイシン)2日間培養した後、0.5mM CuSO4を加えた。培地を4〜7日おきに採取し、さらなるタンパク質産生のため、細胞を培地+CuSO4に再プレーティングした。細胞培養上清を合わせ、TBS(pH7.4)に対して透析し、Aタンパク質カラムを用いて精製した。MBD−Fcを含有する画分を合わせ、TBS(pH7.4)に対して透析した。安定トランスフェクトされたショウジョウバエS2細胞は、細胞培養上清1リットル当たり3〜5mgの組み換えMBD2−Fcタンパク質を産生した。
【0206】
実施例3:メンブラン上でのCpGメチル化DNAの検出(逆サウス−ウエスタンブロット法)
ウエスタンブロット様の手順にて、MBD2−Fcが膜上でCpGメチル化DNAを検出できるかどうかを調べるため、本発明者らは、従来のサザンブロット法と同等であるが、ブロット前にDNAを変性させないキャピラリートランスファー系を用い、in vitroにてナイロン膜上に、種々のCpG濃度のメチル化または非メチル化PCR断片をブロットした。図3に示すように、標準的な免疫ブロット条件と一次抗体と等価なものとしてMBD−Fcを用い、メチル化DNAをナイロン膜上、一列に(図3A)、また、CpG含量に依存して(図3B)検出することができる。これらの結果は、MBD−Fc融合タンパク質が固相支持体に結合したCpGメチル化DNAを検出することができることを示す。
【0207】
実施例4:メチル−CpG免疫沈降法(MCIp)を用いたCpGメチル化DNAの小規模富化
次のプロトコールは、スピンカラムを用いたCpGメチル化DNA断片の迅速富化を可能とする。このDNAは、Aタンパク質を介してセファロースビーズにカップリングされたMBD2−Fcタンパク質と結合している。メチル化DNAに対する親和性はメチル化CpG−ジヌクレオチドの密度と共に高くなり、洗浄するバッファーのイオン強度と共に低くなる。
【0208】
4.1 Aタンパク質セファロースに対するMBD2−Fcタンパク質の結合
1mlのTBS中、50μlのAタンパク質セファロース4ファーストフロービーズ(Amersham)に、8〜10μgの精製MBD2−Fcタンパク質を加え、4℃で一晩、回転装置上で回転させた。翌日、MBD2−Fc−ビーズをバッファーA(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、150mMのNaCl、0.1%NP−40)で2回洗浄した。
【0209】
4.2 DNAの制限消化および定量
少なくとも1μgのゲノムDNA(Qiagenカラムを用いて調製)をMseIで消化した。アガロースゲル電気泳動を用いて完全消化物を制御し、消化したDNAを、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0210】
4.3 高メチル化CpG−DNAの精製
消化したDNA(300ng)を1mlのバッファーA中の洗浄MBD2−Fc−ビーズに加え、4℃、回転装置上で3時間回転させた。ビーズをSpinXカラムに移し、およそ1mlのバッファーAで回転洗浄した。ビーズを400μlのバッファーB(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、450mMのNaCl、0.1%NP−40)で2回、バッファーC(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、650mMのNaCl、0.1%NP−40)で2回洗浄した。各洗浄ステップの流出液は廃棄するか、またはさらなる分析のために回収した。CpGメチル化DNAを、250μlバッファーD(20mMのTris−HCl pH8.0、2mMのMgCl2、0.5mMのEDTA、1000mMのNaCl、0.1%NP−40)で、新しい試験管中へ溶出した。溶出したDNAをQiaquickスピンカラム(溶出)で脱塩した。並行して、300ngの消化DNA(投入)を250μlのバッファーDに再懸濁させ、QIAquick PCR精製キット(Qiagen)を用いて脱塩した。溶出DNAおよび投入DNAの双方を、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0211】
4.4. 別法
DNAは種々の制限エンドヌクレアーゼを用いて、または音波処理によって制限処理してもよい。
【0212】
実施例5:MCIpにより作出されたメチル化CpG−DNA断片の検出および定量
MBD−Fc融合タンパク質が免疫沈降様のアプローチでCpGメチル化DNA断片と結合し得るかどうかを調べるため、本発明者らは、まず、in vitroで生成され、種々のメチル化を受けたDNA断片の結合特性を調べた。種々のCpG密度を有するヒトプロモーターのPCR断片を、PCRを用いて作製し(図4参照)、SssI(CCL13、TLR2、CHI3L1)を用いてCpGのメチル化を行うか、またはメチル化せずにおいた(CPM)。DNAを、150mMのNaCl中で、MBD−Fc−Aタンパク質セファロースビーズに結合させ(実施例4参照)、NaCl濃度を引き上げて溶出させた。画分を回収し、スピン精製し、アガロースゲル電気泳動を行った。
【0213】
図4Bに示されるように、メチル化断片の親和性はメチル化CpG−ジヌクレオチドの密度と共に上昇し、非メチル化DNA(CPMプロモーター断片)は比較的低い塩濃度で溶出し、高メチル化DNA(TLR2プロモーター断片)は高い塩濃度で溶出する。投入DNAの量を変えても溶出プロフィールは有意には変化しなかった。しかしながら、このDNAの塩依存的な親和性は、Aタンパク質セファロースビーズ上のMBD−Fc融合タンパク質の密度に依存的であった。これらの結果は、このMBD−Fc融合タンパク質が、塩濃度およびCpGメチル化濃度依存的に、溶液中のCpGメチル化DNAを補足し、それと結合し得ることを示唆した。
【0214】
5.1 遺伝子特異的リアルタイムPCRを用いた単一遺伝子レベルの定量
5.1.1
組み換えMBD−Fcタンパク質が、複合ゲノムDNA混合物中のCpGアイランドプロモーターのメチル化密度を検出できるかどうかを調べるため、3つの白血病細胞系統、正常ドナー単球、並びにAML患者の芽細胞由来のゲノムDNAをMseIで制限処理し、MCIpを行った。1000mMのNaCl MCIp画分中、3つのCpGアイランドプロモーター(TLR2、p15およびESR1)の富化を、LightCycler−PCRを用いて検出した。p15とESR1は白血病においてメチル化の既知の標的であり、また、TLR2はこれまでにU937細胞でメチル化され、THP−1細胞ではメチル化されないことが示されていることから、この3つの遺伝子座を選択した。
【0215】
図5に示されるように、この3つの遺伝子座の中に、正常ドナーDNA(MO)からのDNA調製物において有意に検出可能なものはなく、これは正常細胞のCpGアイランドプロモーターの通常の非メチル化状態と一致している。U937ではTLR2は富化されるが、THP−1では富化されないことは、両細胞においてこれまでに観察されているメチル化パターンと一致している。Hahnel,J.Immunol.168(2002),5629−37に記載されているようなTLR2プロモーターの重亜硫酸塩シークエンシングは、KG1細胞におけるTLR2プロモーターのほぼ完全なメチル化を示し(データは示されていない)、これは図5に示されている強力なMCIp富化と一致している。KG1およびU937におけるp15に関する結果は公開されているデータと一致している。これらのデータは、MCIpを用い、ゲノムDNAにおける単一遺伝子断片のメチル化DNA断片を検出することができることを示す。
【0216】
よって、MCIp溶出物における特定のMseI断片の富化は、リアルタイムLightcycler−PCRにより、ゲノム投入に対して検出および定量された(図5参照)。この富化はまた、溶出DNAおよび投入DNAの双方の非特異的DNA増幅後に定量してもよい(下記実施例5.2.1のアンプリコン精製参照、データは示されていない)。
【0217】
【表4】

【0218】
MCIpを用い、ゲノムDNAからメチル化および非メチル化DNA断片を識別し得るかどうかを調べるため、健康なドナーの単球由来の、in vitro SssIメチル化された、および非処理の正常DNAのMseI制限ゲノムDNAを富化するためにMCIpを用いた。MseIは低CpG含量の領域で優先的に切断し、多くのCpGアイランドは切断せずに残すことが知られていることから、DNAの断片化のために選択した(Cross,Nat.Genet.6(1994),236−244)。
【0219】
4つの異なるCpGアイランドプロモーターと、低CpG密度の1つのプロモーターの塩濃度依存性の富化は、LightCyclerリアルタイムPCRを用い、投入DNAに対するSssIメチル化および非処理DNAで判定した。DNAメチル化の陽性対照として、正常細胞においてもメチル化されるその2コピーのうち1つで母性刷り込みを受けるSNRPN遺伝子プロモーター(Zeschnigk,Hum.Mol.Genet.6(1997),387−395)を使用した。正常なDNAにおいて、SNRPNの2つの異なるメチル化を受けた対立遺伝子断片が、2つの別の画分で富化された(図9A参照)。SssIメチル化DNAでは、富化された画分は1つだけ見られた。白血病細胞において頻繁にメチル化されていることが知られている(Chim,Ann.Hematol.82(2003),738−742;Dodge,Int.J.Cancer 78(1998),561−567;Dodge,Leuk.Res.25(2001),917−925)CDKN2B遺伝子(p15INK4bとしても知られる)の場合(図9B)、断片は主として、正常DNA由来の低塩画分と、SssIメチル化DNA由来の高塩画分で検出された。
【0220】
同様の結果がヒトエストロゲン受容体1(ESR1)遺伝子(Issa,Cancer Res.56(1996),973−977)およびヒトToll様受容体2遺伝子(TLR2)(データは示されていない)でも得られた。図9Cに示されるように、CHI3L1遺伝子座におけるメチル化および非メチル化DNAのプロフィールは上記供試のCpGアイランドプロモーターのプロフィールとは有意に異なっていた。ほとんどの非処理CHI3L1断片は低NaCl濃度において回収され、そのDNAがSssIメチル化された場合に、より高いNaCl濃度への若干のシフトが見られた。
【0221】
上記の溶出プロフィールの解析から次のことが示唆される。
a.)低または高塩画分のいずれかで、低メチル化ゲノム断片より200〜300倍強い富化が見られる。
b.)低CpG密度の断片は高塩画分から主として排除される。
c.)分画MCIpアプローチはCpGメチル化密度における小さな違いを分解することができる{SssI処理単球DNAと非処理単球DNAの間の平均的な違いはメチル化CpG残基12のうちおよそ6個である(データは示されていない)}。
【0222】
MCIpが腫瘍サンプルにおける異常な高メチル化を検出できるかどうかを調べるため、3つの白血病細胞系統(KG1、U937、THP−1)並びに健康なドナーの単球からのDNAを、高塩画分におけるSNRNP、CDKN2B、ESR1およびTLR2プロモーター富化に関して分析した(図9D〜G参照)。TLR2遺伝子プロモーターは、KG−1およびU937細胞においては富化されたが、THP−1または正常細胞においては富化されなかった。TLR2のメチル化パターンを重亜硫酸塩シークエンシングにより確認した(Haehnel,J.Immunol.168(2002),5629−5637)(データは示されていない)。CDKN2B(KG−1とU937)およびESR1(KG−1)の結果もこれまでに公開されている研究に一致していた(Chim(2003);Dodge(2001);Issa(1996),全て前掲)。上記3つのMseI断片で、正常細胞由来のDNAにおいて富化されたものはなかった。その刷り込み関連のメチル化状態に従い、SNRPN遺伝子プロモーターは全ての白血病細胞系統並びに正常細胞で有意に富化された。これらの実験により、高塩MCIp画分は高い程度のCpGメチル化を有するゲノムDNA断片を特異的に富化することが確認された。
【0223】
【表5】

【0224】
5.1.2
ゲノムDNAの複雑な混合物における単一遺伝子断片の検出に必要はDNAの量を決定するため、DNA断片の量を引き下げてMCIpおよびその後のLightCyclerリアルタイムPCRを行った。図6に示されるように、メチル化TLR2プロモーターはU937細胞由来のゲノムDNA 1ngといった少量から、富化および検出が可能である。非メチル化p15−プロモーターは、U937細胞においては有意には富化されなかった(20ng、MCIp溶出物)、または検出できなかった(4ngまたは1ng、MCIp溶出物)(図6)。これらの結果は、MCIpが、複雑なゲノム混合物においてメチル化DNA断片を検出するための高感度の方法であることを示す。
【0225】
このアプローチの感度を調べるため、MCIpアプローチを用い、U937DNAの量を引き下げて分析した。TLR2(強いメチル化)およびCDKN2B遺伝子断片(メチル化無し)の富化を、LightCyclerリアルタイムPCRにより測定した。図10Aに示されるように、MCIp手順に対してゲノムDNA断片1ngといった少量(およそ150腫瘍細胞に相当)を用いて、TLR2断片の有意な富化が達成された。腫瘍由来のサンプルは有意な数の正常細胞を含む場合があり、それはほとんどのCpGアイランドにおいてメチル化されていないと予想される。
【0226】
CpGメチル化の検出が細胞純度に関してどのような直線性があるかを調べるため、正常血液細胞および白血病細胞系統KG−1由来のDNAの混合物を用いてMCIpを行ったところ、いくつかのプロモーターでCpGアイランドの高レベルのメチル化が示された。図10Bに示されるように、KG−1 DNAを含有するサンプルでのみTLR2プロモーター断片が検出され、そのシグナルは、サンプル中のメチル化DNAの割合と共に緩やかに増強された。ESR1遺伝子座についても同様の結果が得られた(データは示されていない)。一般に、標的遺伝子断片がCpGアイランド内に近位プロモーターのみを含んでいた場合に、最も有益(転写に対する効果に関して)かつ最も明瞭な結果(ノイズおよびバックグラウンドの点で)が得られた。また、酵素の制限作用の他、機械的手段、例えば、音波処理によってもDNAの断片化が達成され得る(データは示されていない)。
【0227】
5.2 マイクロアレイ技術を用いたゲノムレベルでの定量
5.2.1
ライゲーション媒介(LM)−PCRを用いたゲノムMseI−断片由来のDNAアンプリコンの生成
MseI適合性LMPCR−リンカーを生成するため、オリゴヌクレオチドLMPCR S−L(5’−GCG GTG ACC CGG GAG ATC TCT TAA G−3’)(配列番号22)およびLMPCR AS−L(5’−TAC TTA AGA GAT C−3’)(配列番号23)を次のようにアニーリングした。両オリゴをヌクレアーゼフリーH2O(USB)中20μMの濃度で混合し、80℃で10分間インキュベートし、室温までゆっくり冷却した。アニーリングしたリンカーを50μlのアリコートとして−20℃で保存した。
【0228】
LMPCR−リンカー(0.5μl/ng溶出DNAまたは投入DNA)を、60μlの反応液中、1μlのT4−リガーゼ(1200u/μl,NEB)を16℃ o/nで用い、溶出DNAと連結し、さらに別の反応で同量の投入DNAと連結した。リンカー連結DNAをQIAquickPCR精製キット(Qiagen)を用いて脱塩し、55μlのTris−HCl pH8.0(5mM)で溶出させた。
【0229】
リンカー連結DNA(溶出および投入それぞれ)を、LMPCR−プライマー(5’−GTG ACC CGG GAG ATC TCT TAA G−3’)(配列番号24)およびTaqDNAポリメラーゼ(Roche)を用いてPCR増幅させた。このPCR混合物は、総量250μl中、25μlの10×PCRバッファー(Roche)、15μlのMgCl2(25mM,Roche)、10μlのdNTP(各10mM)、65μlベタイン(5M,Sigma)、2.5μlのLMPCR−プライマー、45μlのリンカー連結DNA、2.5μlのTaqDNAポリメラーゼ(5U/μl)を含み、これを5本のPCRチューブに分注した。サイクリングパラメーターを58℃2分(LMPCR AS−L融解)、72℃5分(オーバーハングの充填);95℃30秒、58℃30秒、72℃3分の増幅15サイクル;72℃10分の最終伸張とした。
【0230】
PCR反応液を混合し、QIAquickPCR精製キット(Qiagen)を用いて精製した。溶出アンプリコンおよび投入アンプリコンの双方を、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて正確に定量した。
【0231】
5.2.2 CpGアイランドマイクロアレイを用いたMCIpアンプリコンの分析
単一遺伝子断片の富化を検出するため、MCIpアンプリコンを、PCR(LightCycler,標準的PCR)を用いて分析した。多重遺伝子断片を検出するため、アレイ技術を用い得る。例えばCpGアイランドマイクロアレイを用いたMCIpアンプリコンの分析は、MCIp−DNA断片の蛍光標識と、その後の標準的プロトコールを用いたマイクロアレイとのハイブリダイゼーションを含む。
【0232】
実施例6:メチル結合ポリメラーゼ連鎖反応(MB−PCR)を用いたCpGメチル化DNA断片の検出のための一試験管アッセイ
この方法はELISAと類似のアプローチを用いる。CpGメチル化DNAに対して高親和性を有するタンパク質を、PCRサイクラー適合性反応容器の壁面にコーティングし、ゲノムDNA混合物から高メチル化DNA断片を選択的に捕捉するために使用する。特定のDNA断片(例えば、特定の遺伝子のCpGアイランドプロモーター)の保持は、同じ試験管でPCR(標準的PCRまたはリアルタイムPCR、単一または多重)を用いて検出することができる。メチル化の程度は、ゲノム投入DNAのPCR反応に対して評価することができる。図7は、MB−PCRの模式図を示す。
【0233】
6.1 DNAの調製および断片化
3つの細胞系統(KG1、U937、およびTHP−1)、正常ヒト単球(健康なドナー)およびAML患者の冷凍芽細胞からのゲノムDNAを、Blood and Cell Culture Midi Kit(Qiagen)を用いて調製した。このゲノムDNA調製物の質はアガロースゲル電気泳動により制御し、DNA濃度をUV分光光度法により測定した。ゲノムDNAをMse I(NEB)で消化し、最後に、PicoGreen dsDNA定量試薬(Molecular Probes)を用いて定量した。
【0234】
6.2 PCR試験管の調製
MBD−FcコーティングPCR試験管を、熱安定性TopYield(商標)ストリップ(Nuncカタログ番号248909)を用いて調製した。50μlの組み換えMBD−Fcタンパク質(10mMのTris/HCl pH7.5中、15μg/mlに希釈)を各ウェルに加え、4℃で一晩インキュベートした。ウェルを200μlのTBS(150mMのNaClを含有する20mMのTris,pH7.4)で3回洗浄し、4℃で一晩、100μl遮断溶液(150mMのNaCl、4.5%スキムミルク粉末、5mMのEDTAおよび各0.8μg/mlのポリd(l/C)、ポリd(A/Tおよびポリd(CG)を含有する10mMのTris,pH7.5)で遮断した。試験管を200μlのTBST(0.1%Tween−20を含有するTBS)で3回洗浄した。
【0235】
6.3 メチル化DNAの結合
50μlの結合バッファー(400mMのNaCl、2mMのMgCI2、0.5mMのEDTA、および0.1%Tween−20を含有する20mMのTris,pH7.5)を各ウェルに加え、1μlのMseI消化DNA(10ng/μl)を各第2のウェルに加えた(M−反応)。ウェルを4℃で3時間、シェーカー上でインキュベートした。試験管を200μlの結合バッファーで3回、10mMのTris/HCl pH7.5で1回洗浄した。
【0236】
6.4 メチル化DNA断片の検出
TopYield(商標)ストリップで直接PCRを行った。PCR混合物(50μl/ウェルl)は、標準的なPCRバッファー(Roche)、2.5U FastStart TaqDNAポリメラーゼ(Roche)、各10pmolの遺伝子特異的プライマー(Qiagenにより合成)、dNTP(各200mM,Amersham/Pharmacia)、1Mベタイン(Sigma)を含み、プライマー配列およびサイクリングパラメーターはそれぞれ表2および3に示される。このPCR混合物を加えた後、1μlのMseI消化DNA(10ng/μl)を、事前にDNA断片と共にインキュベートしなかった各第2のウェルに加えた(P−反応)。PCR産物を、アガロースゲル電気泳動を用いて分析し、臭化エチジウムで染色したゲルを、Typhoon9200Imager(Amersham/Pharmacia)を用いて走査した。
【0237】
【表6】

【0238】
【表7】

【0239】
図8は、5つの細胞種における、3つの異なるCpGアイランドプロモーターのメチル化プロフィールを分析するMB−PCR実験の結果を示す。Pと表示したレーンは、ゲノム投入DNAの増幅を示す。THP−1細胞のp15遺伝子を除き(おそらく欠失または突然変異)、全てのプロモーターが増幅された。注目すべきは、正常DNA対照からのMB−PCR反応において検出されたプロモーターは無かったことであり、これは、正常個体においてこれらのプロモーターがメチル化されていないという事実と一致する。これらの細胞系統並びに患者サンプルにおいては、プロモーターは大部分メチル化されていた。これらの結果は、独立した実験のMCIpで得られたデータと一致する。
【特許請求の範囲】
【請求項1】
メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する、核酸分子。
【請求項2】
リンカーポリペプチドをコードするヌクレオチド配列をさらに含む、請求項1に記載の核酸分子。
【請求項3】
前記メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメインが、MBD2タンパク質のDNA結合ドメインである、請求項1または2に記載の核酸分子。
【請求項4】
以下の:
(a)配列番号1(図1)に示されるヌクレオチド配列を有する核酸分子;
(b)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸分子;
(c)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドの断片をコードするヌクレオチド配列を有する核酸分子、ここで、該断片は、該ポリペプチドの少なくともアミノ酸130〜361番を含み、メチル化DNAと結合し得る;
(d)(a)〜(c)のいずれか1つのポリヌクレオチドによりコードされるポリペプチドの変異体をコードするヌクレオチド配列を有する核酸分子、ここで、該変異体において、1又は複数のアミノ酸残基は該ポリペプチドに比べて置換されており、該変異体はメチル化DNAと結合し得る;
(e)(a)〜(d)のいずれか1つの核酸分子とハイブリダイズし、かつ、(a)の核酸分子のヌクレオチド配列と少なくとも65%同一であって、メチル化DNAと結合し得るポリペプチドをコードするヌクレオチド配列を有する、核酸分子;
(f)メチル化DNAと結合し得る(b)の核酸分子によりコードされるポリペプチドと少なくとも65%同一であるポリペプチドをコードする、ヌクレオチド配列を有する核酸配列;および
(g)(a)〜(f)のいずれか1つのポリヌクレオチドのヌクレオチド配列と縮重しているヌクレオチド配列を有する核酸分子、
またはかかるポリヌクレオチドの相補鎖からなる群から選択されるヌクレオチド配列を含む、請求項1〜3のいずれか一項に記載の核酸分子。
【請求項5】
DNA、cDNA、ゲノムDNA、RNAまたはPNAである、請求項1〜4のいずれか一項に記載の核酸分子。
【請求項6】
請求項1〜5のいずれか一項に記載の核酸分子を含む、ベクター。
【請求項7】
前記核酸分子が、原核生物または真核生物宿主細胞における発現を可能とする発現制御配列と作動可能なように連結されている、請求項6に記載のベクター。
【請求項8】
請求項1〜5のいずれか一項に記載の核酸分子、または請求項6若しくは7に記載のベクターで遺伝的に操作された、宿主細胞。
【請求項9】
メチル化DNAと結合し得るポリペプチドを産生する方法であって、請求項8に記載の宿主細胞を培養すること、および該ポリペプチドを回収することを含む、前記方法。
【請求項10】
メチル化DNAと結合し得るポリペプチドを発現し得る細胞を製造する方法であって、請求項6または7に記載のベクターで細胞をin vitroにおいて遺伝的に操作することを含む、前記方法。
【請求項11】
請求項1〜5のいずれか一項に記載の核酸分子によりコードされるアミノ酸配列を有する、または請求項10の方法により得られる、ポリペプチド。
【請求項12】
請求項11に記載のポリペプチドと特異的に結合する抗体。
【請求項13】
請求項1〜5のいずれか一項に記載の核酸分子、請求項6または7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体を含む、組成物。
【請求項14】
場合により好適な診断手段をさらに含む診断用組成物である、請求項13に記載の組成物。
【請求項15】
場合により製薬上許容される担体をさらに含む医薬組成物である、請求項13に記載の組成物。
【請求項16】
in vitroでメチル化DNAを検出する方法であって、
(a)メチル化および/または非メチル化DNAを含むサンプルを請求項11に記載のポリペプチドと接触させること;および
(b)請求項11に記載のポリペプチドとメチル化DNAとの結合を検出すること
を含む方法。
【請求項17】
逆サウスウエスタンブロット法、免疫沈降法、アフィニティー精製、メチル−CpG免疫沈降法(MCiP)またはメチル結合(MB−)PCR法である、請求項16に記載の方法。
【請求項18】
メチル化DNAを制限酵素消化、重亜硫酸塩シークエンシング、ピロシークエンシング、サザンブロット法またはPCRにより分析するステップ(c)をさらに含む、請求項16または17に記載の方法。
【請求項19】
メチル化DNAを検出するための、請求項11に記載のポリペプチド。
【請求項20】
メチル化DNAの検出を目的とした診断用組成物の製造のための、請求項1〜5のいずれか一項に記載の核酸分子、請求項6若しくは7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体の使用。
【請求項21】
腫瘍組織または腫瘍細胞の検出を目的とした診断用組成物の製造のための、請求項1〜5のいずれか一項に記載の核酸分子、請求項6若しくは7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体の使用。
【請求項1】
メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメイン、及び抗体のFc部分を含む二機能性ポリペプチドをコードするヌクレオチド配列を有する、核酸分子。
【請求項2】
リンカーポリペプチドをコードするヌクレオチド配列をさらに含む、請求項1に記載の核酸分子。
【請求項3】
前記メチル−CpG結合タンパク質(MBD)ファミリーに属するタンパク質のDNA結合ドメインが、MBD2タンパク質のDNA結合ドメインである、請求項1または2に記載の核酸分子。
【請求項4】
以下の:
(a)配列番号1(図1)に示されるヌクレオチド配列を有する核酸分子;
(b)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドをコードするヌクレオチド配列を有する核酸分子;
(c)配列番号2(図1)に示されるアミノ酸配列を有するポリペプチドの断片をコードするヌクレオチド配列を有する核酸分子、ここで、該断片は、該ポリペプチドの少なくともアミノ酸130〜361番を含み、メチル化DNAと結合し得る;
(d)(a)〜(c)のいずれか1つのポリヌクレオチドによりコードされるポリペプチドの変異体をコードするヌクレオチド配列を有する核酸分子、ここで、該変異体において、1又は複数のアミノ酸残基は該ポリペプチドに比べて置換されており、該変異体はメチル化DNAと結合し得る;
(e)(a)〜(d)のいずれか1つの核酸分子とハイブリダイズし、かつ、(a)の核酸分子のヌクレオチド配列と少なくとも65%同一であって、メチル化DNAと結合し得るポリペプチドをコードするヌクレオチド配列を有する、核酸分子;
(f)メチル化DNAと結合し得る(b)の核酸分子によりコードされるポリペプチドと少なくとも65%同一であるポリペプチドをコードする、ヌクレオチド配列を有する核酸配列;および
(g)(a)〜(f)のいずれか1つのポリヌクレオチドのヌクレオチド配列と縮重しているヌクレオチド配列を有する核酸分子、
またはかかるポリヌクレオチドの相補鎖からなる群から選択されるヌクレオチド配列を含む、請求項1〜3のいずれか一項に記載の核酸分子。
【請求項5】
DNA、cDNA、ゲノムDNA、RNAまたはPNAである、請求項1〜4のいずれか一項に記載の核酸分子。
【請求項6】
請求項1〜5のいずれか一項に記載の核酸分子を含む、ベクター。
【請求項7】
前記核酸分子が、原核生物または真核生物宿主細胞における発現を可能とする発現制御配列と作動可能なように連結されている、請求項6に記載のベクター。
【請求項8】
請求項1〜5のいずれか一項に記載の核酸分子、または請求項6若しくは7に記載のベクターで遺伝的に操作された、宿主細胞。
【請求項9】
メチル化DNAと結合し得るポリペプチドを産生する方法であって、請求項8に記載の宿主細胞を培養すること、および該ポリペプチドを回収することを含む、前記方法。
【請求項10】
メチル化DNAと結合し得るポリペプチドを発現し得る細胞を製造する方法であって、請求項6または7に記載のベクターで細胞をin vitroにおいて遺伝的に操作することを含む、前記方法。
【請求項11】
請求項1〜5のいずれか一項に記載の核酸分子によりコードされるアミノ酸配列を有する、または請求項10の方法により得られる、ポリペプチド。
【請求項12】
請求項11に記載のポリペプチドと特異的に結合する抗体。
【請求項13】
請求項1〜5のいずれか一項に記載の核酸分子、請求項6または7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体を含む、組成物。
【請求項14】
場合により好適な診断手段をさらに含む診断用組成物である、請求項13に記載の組成物。
【請求項15】
場合により製薬上許容される担体をさらに含む医薬組成物である、請求項13に記載の組成物。
【請求項16】
in vitroでメチル化DNAを検出する方法であって、
(a)メチル化および/または非メチル化DNAを含むサンプルを請求項11に記載のポリペプチドと接触させること;および
(b)請求項11に記載のポリペプチドとメチル化DNAとの結合を検出すること
を含む方法。
【請求項17】
逆サウスウエスタンブロット法、免疫沈降法、アフィニティー精製、メチル−CpG免疫沈降法(MCiP)またはメチル結合(MB−)PCR法である、請求項16に記載の方法。
【請求項18】
メチル化DNAを制限酵素消化、重亜硫酸塩シークエンシング、ピロシークエンシング、サザンブロット法またはPCRにより分析するステップ(c)をさらに含む、請求項16または17に記載の方法。
【請求項19】
メチル化DNAを検出するための、請求項11に記載のポリペプチド。
【請求項20】
メチル化DNAの検出を目的とした診断用組成物の製造のための、請求項1〜5のいずれか一項に記載の核酸分子、請求項6若しくは7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体の使用。
【請求項21】
腫瘍組織または腫瘍細胞の検出を目的とした診断用組成物の製造のための、請求項1〜5のいずれか一項に記載の核酸分子、請求項6若しくは7に記載のベクター、請求項8に記載の宿主細胞、請求項11に記載のポリペプチド、または請求項12に記載の抗体の使用。
【図1−1】


【図1−2】


【図1−3】


【図5】


【図6】


【図7】


【図9】


【図10】


【図2】


【図3】


【図4】


【図8】




【図1−2】


【図1−3】


【図5】


【図6】


【図7】


【図9】


【図10】


【図2】


【図3】


【図4】


【図8】


【公開番号】特開2013−27399(P2013−27399A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−209790(P2012−209790)
【出願日】平成24年9月24日(2012.9.24)
【分割の表示】特願2007−541869(P2007−541869)の分割
【原出願日】平成17年11月28日(2005.11.28)
【出願人】(505198950)セクエノム,インコーポレイティド (6)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2012−209790(P2012−209790)
【出願日】平成24年9月24日(2012.9.24)
【分割の表示】特願2007−541869(P2007−541869)の分割
【原出願日】平成17年11月28日(2005.11.28)
【出願人】(505198950)セクエノム,インコーポレイティド (6)
【Fターム(参考)】
[ Back to top ]

