モダフィニルの異性体の調製方法及び結晶形
【課題】モダフィニルの光学異性体の結晶形等を調製する方法の提供
【解決手段】本発明は、モダフィニルの光学異性体の結晶形を調製する方法に関し、各段階が:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の1種を溶解させること、
ii)モダフィニルの異性体を晶出させること、
iii)そのようにして得られるモダフィニルの異性体の結晶形を回収すること、
を含む。
本発明は、モダフィニルの光学異性体を調製する方法にも関する。
【解決手段】本発明は、モダフィニルの光学異性体の結晶形を調製する方法に関し、各段階が:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の1種を溶解させること、
ii)モダフィニルの異性体を晶出させること、
iii)そのようにして得られるモダフィニルの異性体の結晶形を回収すること、
を含む。
本発明は、モダフィニルの光学異性体を調製する方法にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、モダフィニルの異性体の結晶形を得るための方法、および本方法に従って得ることができる結晶形に関する。
本発明はまた、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する、新しい方法に関する。
【背景技術】
【0002】
米国特許第4,177,290号明細書には、中枢神経系を刺激する特性を有する化合物として、(±)−2−(ベンズヒドリルスルフィニル)アセトアミド又は(±)−2−[(ジ−フェニルメチル)スルフィニル]アセトアミドとしても知られる、ラセミ体のモダフィニルが記述されている。
【0003】
米国特許第4,927,855号明細書には、モダフィニルの光学異性体の2つが記述されている。詳細には、当該明細書には、左旋性異性体、並びにアルツハイマー病に関する疾患及び睡眠過剰の治療における、興奮剤又は抗うつ薬としての当該異性体の用途について記述されている。この文書に記述されている(±)モダフィニル酸又は(±)−ベンズヒドリルスルフィニル酢酸から、2つのモダフィニルの光学異性体を調製するプロセスを次の合成図に具体的に示す:
【化1】

【0004】
このプロセスには、光学活性剤であるα−メチルベンジルアミンを用い、ジアステレオマーの形成を介して、第1段階において(±)−モダフィニル酸の光学異性体の分割を実施することが含まれる。
次いで、この(−)−α−メチルベンジルアミン−(−)−ベンズヒドリルスルフィニルアセテートを、酸加水分解により、(−)−ベンズヒドリルスルフィニル酢酸に転換する。ジメチルスルフェートの存在下で、(−)−ベンズヒドリルスルフィニル酢酸をエステル化し、次いでアンモニア(気体)の存在下で、アミドに転換する。それぞれの段階に対応する収率を基礎として計算すると、このプロセスを介して、(±)−モダフィニル酸に関し5.7%の総合的な収率で、モダフィニルの(−)又はl−(左旋性)の異性体を得ることができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
用語「異性体」は、お互いの鏡像を重ね合わせることができない立体異性体分子について言及するものとする。典型的には、(+)及び(−)、又は(d)及び(l)のいずれかを用いて異性体を表し、この異性体はキラル中心において旋光能を示す。
(D)及び(L)、又は(R)及び(S)のいずれかによっても、立体異性を表すことができ、これらは絶対配置を記述するものである。
以下において、モダフィニルの左旋性異性体をl−又は(−)異性体と、右旋性異性体をd−又は(+)異性体として、区別なく称するつもりである。
【0006】
モダフィニルの光学異性体の異なる結晶形を得ることができる方法を見出した。さらに具体的には、本発明者達は、得られる結晶形が、主に用いる晶出溶媒の性質によって決まることを示した。
本明細書の目的において、用語「結晶形」は、多形体又は溶媒和物のいずれかを区別なく言及するものとする。
「多形体」は、溶質分子のみを含み、そして特有の結晶特性を有する、系統立った構造体を表すものとする。
【0007】
用語「溶媒和物」は、溶質分子及び溶媒分子の両方を含み、特有の結晶特性を有する有機構造体に関するものである。溶媒1分子に対して溶質1分子を有する溶媒和物類を、真の溶媒和物と称する。
さらに、本発明者達は、米国特許第4,177,290号明細書に記述されている条件に従って調製されたl−モダフィニル及びd−モダフィニルが、形態Iとして記述する多形体の一種の形で得られ、その形態が、通常の温度及び圧力状態下で熱力学的に最も安定な多形体に対応することを示した。
形態Iは、下記のX線回折スペクトルを有し、ここでdは格子間間隔を表し、比I/I0は相対強度を表す。
【0008】
【表1】

【0009】
所与の化合物の各結晶形は、一般的に、お互い非常に明確に異なる、物理学的、製薬学的、生理学的、及び生物学的特性を有する。
この関係において、光学活性なモダフィニルの各結晶形(特にこれらの各多形体)が、形態Iと比較して、有利でかつ異なる各特性を有することに関心がある。
他の観点に従い、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する新しいプロセスを見出した。この方法を用いて、米国特許第4,927,855号明細書に記述される収率及び光学純度よりも、明らかに優れた収率及び光学純度で、それぞれの異性体を分割することができる。
特に有利な様式では、優先晶出(製品規模で適用可能である点で有利である)によって(±)−モダフィニル酸の光学活性体の2つを分割するプロセスを作り上げた。
【0010】
(±)−モダフィニル酸を分割する方法には、多くの優位性がある:
− 本方法は、高価なキラル中間体の使用を回避すること(De Min.,M.,Levy,G.and Michwater J.−C.,1988,J.Chem.Phys.85,603−19)、本方法の追加の調製では、10%よりも大幅に少ない損失しか発生しない、
− ジアステレオマー塩の形成を経由する一般的な分割を利用する方法に対し、本方法は異性体2つを直接得ることができること、
− 連続的に母液をリサイクルする結果、収率が理論的に定量的であること、
− 粗異性体結晶の精製が容易であること。
【0011】
従って、本発明は、モダフィニル異性体の結晶形を調製する方法を提供することを目指す。
本発明は、モダフィニルの光学異性体(特にモダフィニルの左旋性異性体)を調製する新しい方法を提供することも目指している。
【課題を解決するための手段】
【0012】
l−モダフィニルの多形体を調製する方法
本発明は、これらの目的及び他の目的を達成する。詳細には、第一の観点において、本発明は、モダフィニルの光学異性体の結晶形を調製する方法に関し、次の各段階:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の1つを溶解させること、
ii)モダフィニルの前記異性体を晶出させること、そして
iii)そのようにして得られたモダフィニルの前記異性体の結晶形を回収すること、
を含む。
【0013】
本発明の目的において、本方法の段階i)で用いる溶媒は(「再晶出溶媒」とも呼ばれる)、モダフィニルの前記光学異性体の晶出をもたらすことができる溶媒であり、大気圧下で晶出をもたらすことができる溶媒であることが好ましい。すなわち、上記溶媒には、少なくとも一つの異性体を伴って所与の圧力において、次のもの:
− 第一温度及び濃度領域において、単相系が、溶媒A中の希釈溶液中に少なくとも一つの異性体を含むこと、
− 第一領域とは同じではない第二温度及び濃度領域において、第二の2相系が、飽和溶液の存在下、前記異性体の結晶を含むこと、
この2領域が、検討圧力において、前記異性体の溶解度曲線T(℃)=f(異性体濃度)によってお互いに分離されていること、
を、形成することができる任意の溶媒Aが含まれる。
【0014】
一般的に、段階ii)内の晶出には、温度及び濃度を変化させることによって、単相系から2相系へ転換させることが含まれる。
本発明に従う再晶出法に好適であることができる溶媒類として非限定的に具体的に説明する目的で、アルコール性溶媒類、カルボン酸エステル溶媒類、エーテル溶媒類、塩素化溶媒類、芳香族溶媒類、及び低級脂肪族ケトン溶媒類に、特に言及することができる。他の溶媒類は、カルボン酸溶媒類、非プロトン性極性溶媒類、脂環式炭化水素類、脂肪族炭化水素類、カーボネート類、ヘテロ芳香族類及び水等である。
【0015】
アルコール溶媒類の中で、メタノール、エタノール、プロパノール、イソプロパノール、ブタノール、イソブタノール、2−メチル−2−ペンタノール、1,2−プロパンジオール、及びt−アミルアルコール等の低級アルキルアルコール類に特に言及することができ、そしてメタノール、プロパノール、及びイソプロパノールが特に好ましい。
カルボン酸エステル型の溶媒類の中で、メチルアセテート、エチルアセテート、n−プロピルアセテート、イソプロピルアセテート、n−ブチルアセテート、及び蟻酸エチルエステル等の蟻酸アルキルエステル類に特に言及することができ、そしてエチルアセテートが特に好ましい。
【0016】
有用なエーテル再晶出溶媒類は、ジエチルエーテル、テトラヒドロフラン(THF)、ジオキサン、ジブチルエーテル、イソプロピルエーテル、t−ブチルメチルエーテル、及びテトラヒドロピランであり、そしてテトラヒドロフランが特に好ましい。
塩素化溶媒類の中で、塩素化炭化水素類、特にクロロホルム、1,2−ジクロロエタン、ジクロロメタン、塩素化芳香族類(クロロベンゼン等)に言及することができる。
芳香族溶媒類の例として、オルト,メタ及びパラキシレン又はオルト,メタ及びパラキシレンの混合物、メトキシベンゼン、ニトロベンゼン、トリフルオロトルエン、及びトルエンに言及することができ、そしてオルト,メタ及びパラキシレンが特に好ましい。
【0017】
有用なケトン溶媒類は、アセトン、メチルエチルケトン、メチルイソブチルケトン、ブタン−2−オン、シクロペンタノン、イソブチルメチルケトン、2−ペンタノン、3−ペンタノン等の溶媒類である。
カルボン酸溶媒の例として、特に酢酸に言及することができる。
ヘテロ芳香族溶媒の例の目的で、特にピリジンに言及することができる。
【0018】
芳香族極性溶媒類の例は、特に、アセトニトリル、プロピオニトリル、4−メチルモルホリン、N、N−ジメチルアセトアミド、ニトロメタン、トリエチルアミン、N−メチル−ピロリドン(NMP)である。
脂肪族炭化水素類の例は、特にヘプタン、2,2,4−トリメチルペンタンである。
脂環式炭化水素類の例は、特にシクロペンタン、シクロヘキサンである。
カーボネート類の例は、特にジメチルカーボネート等のアルキルカーボネート類である。
【0019】
本発明に従う方法の好ましい態様に従い、晶出溶媒類を、アセトン、メタノール、1,4−ジオキサン、エチルアセテート、オルト,メタ,パラキシレンの混合物、イソプロパノール、n−プロパノール、ジメチルカーボネート、テトラヒドロフラン、クロロホルム、及びメチルエチルケトン、水及びアルコール/H2O混合物から選択する。
このように、特定の溶媒中で異性体の再晶出によって、モダフィニルの光学異性体の結晶形を得ることができ、性質そして場合によっては晶出条件によって、主に得ることができる結晶形の種類が決まる。
【0020】
官能基及び電子吸引性置換基又は電子供与性置換基との相互作用を介して、この再晶出溶媒は、所与の晶出条件下で特定の結晶形を生じさせる、一定の分子配列を実際に促進することができる。
一般的に、段階i)で用いられる再晶出溶媒を、モダフィニルの光学異性体が溶媒に完全に溶解するまで、(特に還流下で)加熱する。段階i)におけるモダフィニルの光学異性体の濃度は、晶出には重要な要素ではないが、当該再晶出溶媒中においてモダフィニルの光学異性体の飽和濃度に近い濃度の存在下で、作用させることが好ましい。
【0021】
態様の一つに従って、還流下で溶媒を加熱することで、モダフィニルの光学異性体を溶解させ、次いで飽和に達するように、前記光学異性体の追加量を分画中に添加する。さらに溶媒を添加し、完全な溶解を確保することもできる。
他の態様に従って、モダフィニルの光学異性体を、還流下で加熱する溶媒中で懸濁させ、次いで均一溶液を得るように追加量の溶媒を分画中に添加し、このようにして飽和を達成する。
【0022】
当業者に公知の技法(すなわち、溶液の冷却、一部の溶媒の蒸発、貧溶媒(antisolvent)の添加、又は所望の形態として同一の結晶形を有する光学活性なモダフィニル結晶を用いる溶液のシーディング)を用いて、段階ii)におけるモダフィニルの光学異性体の晶出プロセスを促進させることができる。最も一般的には、均一な懸濁液を得てかつそれぞれの微結晶の周りの母液が速やかに一新するように、この晶出プロセスの全てにおいて、この混合物を連続的に撹拌する。
【0023】
本発明に従うプロセスにおける晶出プロセスを、熱力学的又は動力学的条件の下で実施することができる。
本明細書の目的では、「熱力学条件下での晶出」は、l−又はd−モダフィニルの結晶の存在下で、均一溶液及び飽和溶液間の平衡が維持されている状態の下で実施する晶出を表す。
【0024】
例の目的で、段階i)中で得られる溶液を徐冷することによって(典型的には、溶液を室温まで冷却させるか、又は好ましくは0.75℃/分以下、さらに好ましくは0.6℃/分以下、そしてさらに好ましくは0.5℃/分以下の冷却勾配若しくは冷却速度を適用する)、熱力学的晶出を実施することができる。
本明細書の目的では、「動力学的条件下で実施する晶出」は、d−又はl−モダフィニル結晶の存在下、均一溶液及び飽和溶液間の平衡を、突然、飽和溶液の2相領域の方向(すなわち結晶形成の方向)に移動させる晶出を表す。
【0025】
具体的な説明を目的として、動力学的と称する晶出を、特に急冷(例えば300℃/分の冷却勾配を実施するか、又は段階i)で得られた溶液に貧溶媒を添加することを通して析出させること)によって実施することができる。
具体的かつ非制限的な例の目的として、本明細書中において、徐冷又は急冷によって、これら2種類の熱力学的晶出又は動力学的晶出を実施する。
【0026】
もちろん、動力学的及び/若しくは熱力学的条件を得ることが可能な、溶媒の蒸発又は析出等の任意の他の晶出技法もまた、本発明に従う方法の範囲内に入る。
このように、特定態様に従って、場合によっては所望の結晶形態の種結晶の存在下で、析出によって段階ii)の晶出を実施することができる。
【0027】
本発明者達は、動力学的条件下か又は熱力学的条件下で晶出を実施するのに従って、一部の溶媒が、異なる結晶形類(さらに具体的には、多形体)を生じさせることができることも開示した。
態様によっては、晶出に、段階i)で得られる溶液を冷却することが含まれる場合が、特に有利である。
実用的には、最初の様式において、冷却が急冷であり、一般的に溶液を完全に晶出させるのに充分な時間、氷水浴等の0℃以下の温度の浴中に段階i)で得られた溶液を浸すことで急冷するか、又は−1℃/分〜−5℃/分等の温度勾配で冷却することに該当する。
【0028】
第二態様に従って、徐冷する。このような関係において、一般に、この溶液を、溶液の還流温度から室温まで冷却させるか、又は好ましくは−0.1℃/分〜−0.8℃/分の温度勾配、さらに好ましくは−0.5℃/分に近い温度勾配で、一般的に15℃〜20℃の温度までこの溶液を冷却する。
本発明に従う溶媒/貧溶媒の好ましい組み合わせの中で、特に水/アセトン、アセトニトリル/水、エタノール/水、メタノール/水、酢酸/水の組み合わせに言及する。
【0029】
最後に、ろ過及び遠心分離等の通常の方法を用いて、モダフィニルの光学異性体の結晶形を分離することができる。
非限定的な具体的説明の目的で、モダフィニルの左旋性異性体を用いて、本発明に従う調製プロセスを詳細に実施する。
特定態様に従って、この方法に従って得られる結晶形は、多形体である。
【0030】
この点において、所与化合物の(l)及び(d)のそれぞれの異性体は、一般的に、同一実験条件下で再晶出させる場合に、同一の粉末X線回折スペクトルを有する結晶形(特に多形体)を生ずることに留意することができる。
この点において、J.Bernstein<<Polymorphism in molecular crystals>>2002,University Press,Oxford,UKの著作、及びG.Coquerel,Enantiomer,2000;5(5):481−498、Gordon and Breach Science Publishersの出版物によって、特に参照される。
【0031】
この点において、右旋性形態(結晶形に関するX線回折スペクトルが以下に記述される左旋性形態のスペクトルと同一であり、逆の関係も成立する)は、本発明の一部を形成する。
以下において、形態I,II,III,IV及びVと称する多形体もまた、左旋性異性体から得られるCRL40982の形態I,II,III,IV及びV、並びに右旋性異性体から得られるCRL40983の形態I,II,III,IV及びVに及ぶ。
【0032】
形態I
このような関係において、アセトン、エタノール、1,4−ジオキサン、エチルアセテート、及びオルト,メタ及びパラキシレンの混合物から選択する溶媒と、徐冷による晶出段階とを用いるプロセスとによって、形態IまたはCRL40982の形態Iがもたらされる。
メタノール、水、又はアルコール/水混合物(特に、メタノール/水及びエタノール/水)から選択する溶媒を用いるプロセスと、急冷による晶出の段階とによって、形態I又はCRL40982の形態Iがもたらされる。
本発明の他の同様に好ましい別形に従って、メタノールを用いるプロセスと、メタノールの貧溶媒として冷水の添加を介する析出による晶出の段階とによって、形態Iがもたらされる。
【0033】
形態II
本発明の他の態様に従って、イソプロパノール、エチルアセテート、n−プロパノール,又はトルエン変性エタノールから選択される段階i)の溶媒を用いるプロセスと、急冷による晶出段階とによって、形態II又はCRL40982の形態IIとして記述する多形体がもたらされる。
本方法の別形に従って、イソプロパノールからの急冷によっても、形態IIを得ることができる。
イソプロパノールからの形態IIの生成物が、晶出条件(熱力学的又は動力学的)によって決まらないことも、注釈することができる。
【0034】
形態III
本発明に従うプロセスの他の別形に従って、段階i)で用いる溶媒がアセトンであり、そして晶出段階ii)が急冷を含む場合、形態III又はCRL40982の形態IIIとして記述する結晶形がもたらされることは明らかである。
【0035】
形態IV
本発明に従うプロセスの別形として、段階i)で用いられる溶媒を、テトラヒドロフラン、クロロホルム及びメチルエチルケトンから選択し、そして晶出段階ii)が溶液の徐冷を含む場合、形態IV又はCRL40982の形態IVとして記述する結晶形が、結果的に得られる。
モダフィニルの光学異性体の再晶出プロセスによって、溶媒和物の生成物を生じさせることができ、溶媒和物は用いる溶媒の性質によって決まる。
【0036】
形態V
本発明に従うプロセスの別形として、段階i)で用いられる溶媒を、2−ペンタノン及びテトラヒドロフランから選択し、そして晶出段階ii)が、2−ペンタノン中における徐冷及びTHF中における急冷を含む場合、形態Vとして記述する多形体が、結果的に得られる。
【0037】
ジメチルカーボネート溶媒和物
このように、本発明の特定態様に従って、段階i)の溶媒がジメチルカーボネートであり、そして晶出が徐冷からなる場合、(−)−モダフィニルのジメチルカーボネート溶媒和物が得られる。
【0038】
酢酸溶媒和物
本発明の特定態様に従い、段階i)中の溶媒が酢酸であり、そして晶出が急冷又は徐冷からなる場合、(−)−モダフィニルの酢酸溶媒和物が得られる。
【0039】
(−)−モダフィニルの多形体
本発明は、CRL40982の形態IIとして記述する、モダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔:11.33、8.54、7.57、7.44、4.56、3.78、3.71Åに強度ピークを含むX線回折スペクトルを作り出すことを特徴とし、この強度ピークは8.54、7.57、7.44、4.56、3.78、3.71Åに特に特徴を有する格子間間隔に該当する。
さらに具体的に、以下のX線回折スペクトルを示し、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0040】
【表2】

【0041】
本発明は、CRL40982の形態IIIとして記述するモダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔d:13.40、12.28、8.54、7.32、6.17、5.01、4.10、3.97、3.42、3.20Åに強度ピークを組込むX線回折スペクトルを特徴とし、そして格子間間隔:12.28、8.54、5.01、4.10、3.97、3.42、3.20Åが、もっとも特徴的な強度ピークに該当する。
このような関係において、さらに具体的には、本発明は、(−)−モダフィニルの形態IIIにするものであり、この形態は次のX線回折スペクトルを作り出し、そこでdは格子間間隔を表し、I/I0は相対強度を表す:
【0042】
【表3】

【0043】
本発明は、CRL40982の形態IVとして記述する、モダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔:12.38、8.58、7.34、6.16、5.00、4.48、4.09、3.66Åに強度ピークを含むX線回折スペクトルを作り出すことを特徴とし、もっとも特徴的なピークは、12.38、8.58、7.34、5.00、4.09Åの格子間間隔に該当する。
さらに具体的には、(−)−モダフィニルの形態IVは、次のX線回折スペクトルを作り出すことを特徴とし、ここでdは格子間間隔を表し、I/I0は格子間間隔における強度ピークを含む相対強度を表す:
【0044】
【表4】

【0045】
本発明は、CRL40983の形態Vと称する、モダフィニルの右旋性異性体の多形体にも関するものであり、格子間間隔:9.63、5.23、5.03、4.74、4.66、4.22、4.10、3.77(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする。
【0046】
【表5】

【0047】
本発明は(−)−モダフィニルのジメチルカーボネート溶媒和物にも関するものであり、次の回折スペクトルを特徴とし、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0048】
【表6】

【0049】
本発明は、本発明に従う再晶出プロセスによって得ることができるモダフィニルの左旋性異性体及び右旋性異性体の酢酸溶媒和物にも関するものであり、格子間間隔:9.45、7.15、5.13、4.15、3.67(Å)における強度ピークを含むX線回折スペクトルを作り出すことを特徴とする。
【0050】
【表7】

【0051】
他の態様に従い、本発明は、モダフィニルの異性体の1つの第一結晶形から、第一結晶形とは異なる第二結晶形へ転化する方法にも関するものであり、前記方法は次の各段階:
i)モダフィニルの前記異性体の結晶形を溶媒中に懸濁すること;
ii)得られた結晶形を回収すること;
を含む。
本方法に好適であることができる溶媒類の目的で、特にアセトニトリルに言及することができる。
【0052】
一般的に、均一化温度より低温において、初期形態の全ての転化をさせるのに充分な時間、初期結晶形を懸濁液中に保持する。特に、溶媒の性質、初期結晶形、及び媒体温度に従ってこの段階を変化させることができる。大気圧下で室温において24時間以上(さらに一般的には約72時間)、結晶形を懸濁液中に保持するのが一般的である。
具体的な説明を目的として、(−)−モダフィニルを用いて本方法を実施する。
【0053】
このような関係において、本発明の特定態様に従い、このプロセスは、段階i)のアセトニトリル中で形態Iを用い、その結果(−)−モダフィニルのアセトニトリル溶媒和物が得られる。
目安の目的で、数日間(好ましくは3日間)、室温で大気圧下、形態Iを懸濁液中で保持する。
本発明は、本発明に従う再晶出プロセスにより得ることができる(−)−モダフィニルのアセトニトリル溶媒和物にも関する。この溶媒和物を、次の回折スペクトルによって特徴付け、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0054】
【表8】

【0055】
【表9】

【0056】
(−)−モダフィニル及び(+)−モダフィニルの、それぞれの多形体II,III,IV及びVを含む医薬組成物
本発明はまた、それぞれ、(−)−モダフィニルの多形体であるCRL40982の形態II、CRL40982の形態III、CRL40982の形態IV又はCRL40982の形態V、並びにCRL40983の形態II、CRL40983の形態III、CRL40983の形態IV及びCRL40983の形態Vを含む医薬組成物に関し、あるいは医薬的に許容されるビヒクルに関連する。
これらの組成物を、粘膜(目、鼻、肺、胃、腸、直腸、膣、若しくは尿器官の粘膜等)を介して経口的に投与するか、又は非経口的(皮下、皮内、筋肉内、静脈内、若しくは腹膜内等)に投与することができる。
【0057】
好ましい態様に従い、錠剤、ピル、ゼラチン状カプセル、若しくは即時放出若しくは制御放出の粒剤の形状で、散剤、カプセル剤、溶液の若しくはゲル中の若しくはエマルション中の懸濁剤の形状で、又は冷凍乾燥物として好ましくは錠剤、カプセル剤、溶液中又はゲル中の懸濁剤形状で)、本発明に従う医薬組成物を経口的に投与する。投与するビヒクルは、多形体(油中の多形体の懸濁液等)の安定性を確保する医学的に許容できる一以上の賦形剤を含むことができる。
【0058】
本発明に従う医薬組成物には、それぞれ(−)−モダフィニル及び(+)−モダフィニルの、II,III,IV又はVの多形体が含まれ、場合によってはそれぞれの混合物及び/又は一以上の医薬的に許容できる賦形剤と多形体との混合物として含まれることもある。
経口投与用の固体組成物を、有効成分に一以上の賦形剤を加える(特に充填剤、そして適切な場合には、結合剤、剥離剤(exfoliating agent)、潤滑剤、界面活性剤及び乳化剤、可溶化剤、着色剤、糖代用物又は味覚調整剤、及び錠剤又はカプセル剤等の形にした混合物)ことによって、調製する。
【0059】
充填剤の例には、ラクトース、スクロース、マンニトール又はソルビトール;トウモロコシでんぷん、米でんぷん、ジャガイモでんぷん等のセルロースに基づく調製品が含まれる。
結合剤の例には、ゼラチン、ガム、トラガカントガム、メチルセルロース、ヒドロキシプロピルセルロース、ソジウムカルボキシメチルセルロース、及び/又はポリビニルピロリドン(PVP)、ポビドン、コポビドン、デキストラン、デキストリン、シクロデキストリン及びヒドロキシプロピル−β−シクロデキストリン等のその誘導体が含まれる。
【0060】
糖代替物の例には、アスパルテーム、サッカリン及びソジウムシクラメートが含まれる。
味覚調整剤の例には、ココア粉末、植物形態中のミント、芳香性粉末、油形態中のミント、ボルネオール、及びシナモン粉末が含まれる。
表面調整剤及び乳化剤の例には、特にポリソルベート20,60,80、sucroester(7−11−15)、poloxamer188,407、PEF300,400、及びソルビタンステアレートが含まれる。
【0061】
可溶化剤の例には、miglyol810,812、グリセリド類及びそれらの誘導体、並びにプロピレングリコールが含まれる。
剥離剤の例には、ポリビニルピロリドン、ソジウムカルメロース、又はアルギン酸若しくはアルギン酸ナトリウム等の塩が含まれる。
潤滑剤の例には、ステアリン酸マグネシウム、ステアリルマグネシウムフマレート、ベヘン酸及びその誘導体類が含まれる。
【0062】
本発明に従う医療組成物は、(−)−モダフィニル又は(+)−モダフィニルのそれぞれの他の結晶形(特に、形態III、形態II、形態IV及び形態V等の一つ以上のモダフィニルの多形体との混合物等の他の有効成分若しくは非有効成分並びに/又は形態I)を含むことができる。
本発明の目的において、用語「医学的に許容できるビヒクル」は、溶媒、分散媒、抗真菌剤及び抗菌剤、等張剤及び吸収遅延剤に及ぶ。医薬的な有効物質に関して、そのような媒体及び薬剤の使用は、当業者に公知である。
【0063】
本発明はまた、睡眠過剰(特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰);睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作;傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害(特にシュタイネルト病に関連する覚醒障害)、多動性障害(ADHD)等に関連する注意障害;疲労状態(特に多発性障害及び他の変性疾患に関する疲労状態);日光暴露の少なさ、統合失調症、交代性労働、タイム・シフトに関連するうつ状態、うつ病;摂食障害から選択する状態の、予防及び/又は治療を目的とする薬物(ここで、モダフィニルは食欲刺激剤、低用量の認知機能刺激剤として作用する)を製造するため、それぞれ、(−)−モダフィニルのCRL40982の形態II、CRL40982の形態III、CRL40982の形態IV又はCRL40982の形態Vの各形態、及び(+)−モダフィニルのCRL40983の形態II、CRL40983の形態III、CRL40983の形態IV又はCRL40983の形態Vの各形態の使用に関する。
【0064】
光学活性モダフィニルを調製する方法
他の観点に従って、本発明は、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する方法に関し、前記方法は次の各段階を含む:
i)(±)−モダフィニル酸の2つの光学異性体を分割し、そして少なくとも
1つの異性体を回収すること、
ii)塩基の存在下で、得られた2つの異性体のうち1つを低級アルキルハロホルメート及びアルコールと接触させて置くこと、
iii)得られた生成物を回収すること、
iv)段階iii)で得られたエステルをアミドに転換すること、
v)段階iv)で得られた生成物を回収すること。
【0065】
好ましくは、この低級アルキルハロホルメートは低級アルキルクロロホルメートであり、そしてさらに好ましくは、低級アルキルハロホルメートにメチルクロロホルメートが含まれる。
モダフィニル酸のエステル化をもたらすこのプロセス中で用いる低級アルキルハロホルメート(中でも、特にメチルクロロホルメート)は、従来技術である米国特許第4,927,855号明細書に記載されているジメチルスルフェートより毒性が少ない点が有利であり、同等以上の収率が与えられる。従って、この方法は、簡潔に用いられ、工業用途においてさらに好適である。
【0066】
光学活性モダフィニル酸に関して、段階ii)中の低級アルキルホルメート及び塩基の等モル量の存在下で、この操作を実施することが好ましい。
有機塩基の使用が、特に好ましく、窒素含有塩基類の使用がさらに好ましい。
【0067】
特に好ましい塩基として、トリエチルアミン、ジイソプロピルアミン、ジエチルメチルアミン、ジイソプロピルエチルアミン、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(DBU)に、特に言及することができる。
段階ii)中で用いる溶媒は、メタノール、エタノール又はプロパノール等の低級脂肪族アルコールであることが好ましく、メタノールが特に好ましい。
特別な態様に従い、段階ii)から得られるエステルを、氷水の添加によって晶出させる。
【0068】
段階iv)中のエステルからアミドへの転化は、アンモノリシス(すなわちアンモニア処理)からなることが好ましい。
このような関係では、一般的に、過剰のアンモニアを用いて処理することが好ましい。
本発明の特に有利な別形に従い、気体状でアンモニアを用いる。
【0069】
態様によっては、極性溶媒中、低級脂肪族アルコール類のようなプロトン性溶媒(メタノール又はエタノール等)中で、このアンモノリシス反応を実施することが好ましく、メタノールが特に好ましい。
段階iii)中の(+)又は(−)モダフィニル酸エステル、及び段階iv)中の(+)又は(−)モダフィニルを、それぞれ当業者に公知の通常の方法を用いて回収する。
【0070】
他の観点に従って、本発明は、以下の各段階:
a.優先晶出法に従い、(±)−モダフィニル酸又はその塩類の光学異性体の2つを分割すること、
b.前記分割された異性体をアミドに転換すること、
c.得られたモダフィニル異性体を回収すること、
を含む、モダフィニルの光学異性体を調製する方法に関する。
好ましい態様に従って、段階b)を次の2段階:
b1)前記異性体を低級アルキルエステルに転換すること、
b2)段階b1)で得られた生成物をアミドに転換すること、
で実施する。
【0071】
態様に従って、上述の条件の下、段階b1)を、低級アルキルハロホルメート、アルコールおよび塩基の存在下で実施することが特に好ましい。
特に有利な態様に従って、クロロ蟻酸メチルエステル、塩基及びアルコールの存在下でb1)を実施し、そしてc1)が上述のようなアンモノリシスを含む場合、この方法((±)−モダフィニル酸を、優先晶出によって分割する)によって、一般的に25%オーダーの総合的な収率が生じる。このように、特にこの方法によって得られる(−)−モダフィニルの異性体の収率は、米国特許第4,927,855号明細書中で得られる収率よりも顕著に高い。
【0072】
好ましい晶出技法は、実験室及び当産業で広く用いられる技法である。
この方法は、R及びSと称する2つのキラル化合物の交互の晶出に基づき、溶媒A中で、そして所与の温度範囲DTにわたり、ラセミ混合物を形成する。これは、この温度範囲内で、溶液と熱力学的平衡にある2つの鏡像体の任意の混合物が、2つの結晶(それぞれの結晶が同一の配置を有する分子のみを含み、この配置は溶媒分子を含んでも(溶媒和物)、含まなくてもよい)を含むことを意味する。以下において、少なくとも温度範囲DTの間でかつ溶媒Aの場合、固体状態内の混和性がないようなラセミ混合物の存在が、確実に認められる。
【0073】
2種のファクターが、光学的鏡像体の晶出に影響を及ぼし、一方は3成分の異種平衡に関連するパラメーターであり、そして他方は晶出の動力学に影響を与えるファクターである。
3成分の異種平衡に関連するパラメーターは:
− それぞれの温度で沈殿する固体種に関する晶出曲面のポジション、並びに具体的には温度に関連するラセミ体s(±)及びその鏡像体s(+)=s(−)の安定相及び準安定相の溶解性、並びに溶解度比α=s(±)/s(+)、
− 固溶体、ラセミ化合物、ラセミ体の溶媒和物、活性な溶媒和物、及び晶出した固体の多形体の種類に関する安定領域及び準安定領域の範囲、
を含む。
【0074】
晶出の動力学に影響を与えるファクターは:
− 実験者によって修正変更することはできない、分子相互間の結合に関連する結晶内部のファクター類、
− 実験者によって修正変更できる外部ファクター類;これらは、溶媒の性質、不純物の性質及び濃度、時間に関連して得る過飽和、温度範囲DT、撹拌の速度及び様式、結晶核の質量及び粒径、壁の効果等である、
を含む。
【0075】
これら2種のファクターは、得られる相の純度、収率、及び分割操作の処理に直接影響を与える。ろ過の成否はまた、粒径スペクトル及び晶癖、懸濁液の粘度、溶媒の蒸気圧、それぞれの鏡像体の過飽和並びに準安定性の真のラセミ化合物の存在可能性によって決まる。これらの選択によって、鏡像体のラセミ化又は分子の分解の動力学にも影響が与えられる。
一対の鏡像体(R及びS)及び溶媒(A)を含むそれぞれの配合物において、動力学に影響を与えるファクターは特定の種類である。
【0076】
2種の好ましい晶出法を:
− 「シード化等温優先晶出法(Seeded Isothermal Preferential Crystallization)」に対しSIPCとして記述される一般的な方法、及びそれらの多温の別形、そして
− 「自動シード化多温プログラム化優先晶出法(Auto−Seeded Polythermic Programmed Preferential Crystallization)」に対しAS3PCと称する方法、
に主に分類する。
【0077】
AS3PC優先晶出法(自動シード化と称する)では、所望の異性体を生成するように、系そのものが系そのものの種結晶を生成するような条件下にこの系を置く。一方、SIPC法では、シーディングによってこれらの種結晶を導入する。この2種の方法を、以下でさらに詳述する。
AS3PC法を用いる優先晶出による分割法に関連するさらなる情報では、特に、G.Coquerel,M.−N.Petit及びR.Bouazizが著者の、ヨーロッパ特許明細書第0720595B1号明細書(1996年)、E.Ndzie,P.Cardinael,A.−R.Schoofs及びG.Coquerelが著者の、テトラヒドロンアシンメトリー、1997年、第8巻、第17号、2913〜2920ページ(Tetrahedron Asymmetry, 1997,8(17),2913−2920)、L.Courvoisier,E.Ndzie,M.−N.Petit,U.Hedtmann,U.Sprengard及びG.Coquerelが著者の、ケミストリーレターズ、2001年、第4巻、364〜365ページ(Chemistry Letters,2001,4,364−365)に、特に言及することができる。
【0078】
特定の態様に従って、(±)−モダフィニル酸又はそれらの塩類の光学異性体を分割する方法は、シード化SIPC又はS3PC法であり、前記方法は次の各段階を含む:
a)温度TDにおいて、モダフィニル酸の第一異性体のラセミ混合物の形のラセミ体の結晶を含む配合物を均一化すること、ここで規定ポイントE(濃度及び温度TDの変数によって規定する)は希釈溶液の単相領域内に存在する、
b)段階a)において調製された溶液を、初めの温度TDから温度TFまで急冷させること、
c)冷却の間(例えば、TL〜TF)又は冷却が完了するときに(例えば、TF)、第一異性体の純粋な種結晶を用いて、段階b)で得られる溶液をシーディングさせること、
d)第一異性体の結晶を集めること、
e)段階d)内で実施する収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして温度TDまで加熱することによって新配合物を均一化すること、それにより、規定ポイントE’は溶媒、鏡像体(−)、鏡像体(+)系のラセミ体の平面に関してEと対称になり、前記ポイントE’は希釈溶液の単相領域内に存在する、
f)段階e)において調製された溶液を、初めの温度TDから温度TFまで急冷させること、
g)第二異性体の純粋な種結晶を用いて、段階f)で得られた溶液をシーディングすること、
h)第二異性体の結晶を集めること、
i)段階h)内で作成された結晶収集に由来する結晶の母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして初期規定ポイントEを有する配合物の組成と同一の組成を得るため、温度TDまで加熱することによって新配合物を均一化すること、
j)次いで、第一及び第二の2つの異性体を得るために、各段階a),b),c),d),e),f),h)及びj)を繰り返すこと。
【0079】
それぞれ、「SIPC」及び「S3PC」と記述することによって、これら2種の方法にしばしば言及する。そしてS3PC法は、明細書中でさらに詳細に記述するように、SIPCの別形である。
以下では、本発明の目的において、
− TFは、晶出の終わり及びろ過における温度を表し、3相領域にあり、
− TLは、ラセミ体の均一化温度を表し、
− TDは、始動混合物が均一溶液である始動温度を表し、
− 鏡像体は、異性体を表す。
【0080】
優先晶出によって、(±)−モダフィニル酸又はこれらの塩の、これら2つの光学異性体を分割する方法は、AS3PC自己シード化法が好ましく、前記方法は次の各段階を含む:
a)モダフィニル酸の第一異性体のラセミ混合物の形のラセミ体結晶及び溶媒を含む配合物を作り出すこと、ここで規定ポイントE(濃度及び温度TBの変数によって規定する)は、過剰の異性体の2相領域内に存在し、かつ飽和溶液と平衡にある、
b)段階a)で調製する2相混合物に、温度冷却プログラミング関数を適用すること、このプログラミング関数は、溶液中に存在する第二異性体の自発的な核形成を防止しながら、母液がわずかに過飽和のままであり、結晶の形で存在する異性体の成長を促進する、
c)段階b)の結晶成長時間中の全ての時間にわたって、時間に関してわずかに増していく撹拌速度を採用すること、ここで、全ての時間において、その撹拌速度が、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、第一異性体の成長を促進するためには充分に遅いが、均一な懸濁液を得て、そして第一異性体のそれぞれの微結晶周りの母液の一新をはかるためには充分に速い、
d)第一異性体の結晶を集めること
e)段階d)で実施された収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして規定ポイントE’が、溶媒、鏡像体(−)、鏡像体(+)系に関するラセミ体の平面に関してEと対称であり、前記ポイントE’が、第二異性体(過剰で、かつ飽和溶液と平衡に有る)の2相領域内に存在するように、熱力学的平衡を達成するのに必要な時間、新配合物を温度しきい値TBまで導くこと、
f)溶液内に存在する第一異性体の自発的な結晶核形成を防止しながら、結晶の形で存在する異性体の成長を促進するため、晶出中に母液がわずかに過飽和のままであるように、第二異性体を含む段階e)で調製された2相混合物に、段階b)と同じ冷却プログラミング関数を適用すること、
g)段階f)の結晶成長の全時間に渡って、時間に関してわずかに増加する撹拌速度を採用すること、ここで、全ての時間において、制御されない結晶核形成を生じさせる過度に大きな剪断力の生成を回避しながら、第二異性体の成長を促進するためには充分遅く、しかし均一な懸濁液を得て、そして第二異性体のそれぞれの微結晶周りの母液の一新をはかるのには充分速くなる、
h)第二異性体の結晶を集めること、
i)組成が初期配合物Eの組成と同じである配合物を得るため、段階g)で実施した結晶の収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、
j)2つの異性体の第一体、次いで第二体を連続的に得るため、a),b),c),d),e),f),g),h)及びi)の各段階を繰り返すこと。
【0081】
以下では、本発明の目的において、THOMOは、ラセミ体、第一異性体及び溶媒を含む配合物の均一化温度を表す。
【0082】
このように、本発明に従うプロセスの段階a)において、1種以上の溶媒及び作用温度範囲の選択を、下記要件:
− ラセミ混合物を形成し、かつ任意のラセミ化合物が作用温度範囲で準安定である鏡像体であること、
− 充分に濃縮されるが、低粘度及び低蒸気圧である溶液であること、
− 加溶媒分解及びラセミ化がないこと、
− 溶媒和物が平衡状態で存在し、かつ分割可能な異性体の種類である場合に、溶媒和物に安定性があること、
を同時に満たすような様式で規定する。
【0083】
本発明に従うプロセスの段階a)及び段階b)において、初期懸濁液中に存在する多量のラセミ体の均一化に関して、温度TBが温度TLより高く、過剰の異性体に関するTHOMOの変化と、ラセミ体XLの一定濃度とに関する曲線から前記温度TBを規定し、ここで、段階a)及び段階i)に由来する第一異性体並びに段階e)に由来する第二異性体の純粋結晶の質量が(それらの飽和溶液との平衡内において)、期待される収集物の、多くても50%、好ましくは25〜40%で存在する。
【0084】
本発明に従う方法の段階b)及び段階f)において、温度TB〜TFに冷却するプログラミング関数(実験用アセンブリに適している)を、下記の通りに規定する:
− それぞれのサイクルのはじめにおいて、結晶の形で存在する異性体の晶出時間の全てにおいて、わずかな過飽和を達成し、このわずかな過飽和によって、穏やかな成長及び第二核形成を起こさせること、
− 最初に核を形成することなく、TFにおいて他の異性体の過飽和の上限を達成させること、
− ラセミ体の添加の後に、段階d)及び段階h)において結晶収集物を得ること、そして段階e)及び段階i)において再補給することによって、サイクル操作の実施を可能とすること。
【0085】
実は、全ての実験用アセンブリは、用いる混合物の過飽和キャパシティー及び撹拌効率に影響力を有するので、冷却プログラミング関数を、この方法を実施する状況に適合させなければならない。しかし、温度TB、温度に関連するラセミ体の溶解性、及びラセミ体XLの一定濃度に関する過剰の異性体に関連するTHOMO曲線は、それら自体、実験用アセンブリとは完全に無関係である。
【0086】
初期の過剰の異性体の2倍の収集を可能にしながら、最初に核を形成することなく安定な飽和溶液を得るために、この冷却プログラミング関数(温度と時間を関連付ける関数)は、TL〜TFの部分を濃度XLの溶液をTL+1℃からTFへ冷却すること(TFはTL−(THOMO−TL)より低い)によって定められ、そして前記冷却プログラミング関数は、TB〜TLの部分をTL+1℃〜TFで設定するように同一関数を外挿することによって定められている。
【0087】
(±)−モダフィニル酸又はその塩類の好ましい晶出プロセスは、次の有利な特徴:
− 段階a)及び段階i)において、飽和溶液と平衡にある第一異性体の純粋結晶の質量が、期待される収集量の約25%〜40%になり、50%が上限になること、
− 段階e)において、飽和溶液と平衡にある第二異性体の純粋結晶の質量が、期待される収集量の約25%〜40%になり、50%が上限になること、
− 段階b)及び段階f)において、第一異性体及び第二異性体の析出に付随する熱放出を、温度プログラミング関数に組込むこと、
− 段階e)及び段階i)において、補助的な溶媒を添加すること、
− 段階a),段階e)及び段階i)において、添加する前に、添加されるラセミ混合物の形のラセミ体の純粋な結晶を、溶解段階を促進する前処理(粉砕及び分級、超音波処理、又は部分的な凍結乾燥等)にかけ;これらの処理はまた、結晶生成のため大きな表面積を生成することができる微細結晶を用意するためである、
− 分割を含む段階a),段階e)及び段階i)において、段階c)及び段階g)と比較して、撹拌速度が速いこと、
を、単独又は組み合わせで有する。
【0088】
AS3PC法を実施するために必要な異種平衡データに加え、これらの各操作はまた、可調の動力学的制約(特に、冷却関数)に従い、そしてこれらの制約類はそれぞれの溶媒/異性体の組み合わせに特有なものである。
一態様に従い、SIPC法、S3PC法又はAS3PC法の、段階a)中で用いる溶媒は、無水又は変性エタノール、場合によっては有機若しくは無機塩基との混合物中のエタノール、又はエタノール中のラセミ体の溶解性を向上することができる1種以上の溶媒との混合物中のエタノールである。
【0089】
別形として、SIPC法、S3PC法又はAS3PC法の段階a)中で用いる溶媒は、2−メトキシエタノール又はメタノール、場合によっては有機若しくは無機塩基と混合物中の2−メトキシエタノール又はメタノール、及び/又はエタノール中のラセミ体の溶解性を向上することができる1種以上の溶媒と混合した2−メトキシエタノール又はメタノールである。
特に有利な態様において、SIPC法、S3PC法又はAS3PC法の段階a)中で用いる溶媒は、エタノール、2−メトキシエタノール又はメタノールである。(±)−モダフィニル酸において、ろ過温度TFは、好ましくは0℃〜40℃に存在する。
【0090】
エタノールの場合において、温度TFは、好ましくは0℃〜25℃に存在し、18℃又は17℃に近いことがさらに良い。
2−メトキシエタノール又はメタノールの場合では、温度TFは、好ましくは20℃〜35℃で存在し、そして特に30℃に近い。
好ましくは、段階a)中のラセミ混合物の濃度は、2〜50質量%、さらに好ましくは2〜30質量%、そしていっそう好ましくは、エタノールの場合、5.96質量%、2−メトキシエタノールの場合、15.99質量%、メタノールの場合、25.70質量%に近い。
【0091】
このような関係において、段階a)中の異性体は、1〜50質量%、さらに好ましくは1〜20質量%、そしていっそう好ましくは、エタノールでは11質量%、2−メトキシエタノールでは8質量%、メタノールでは10%に近いことがもっとも好ましい。
SIPC及びS3PCにおいて、温度TD(始動混合物が均一溶液である温度)は、濃度によって決まり、そして溶媒が還流下にある場合には、一般的に35°〜50℃に存在する。温度TD〜TFへの冷却は、単相領域内のままでいるように非常に早く、そして好ましくは20分以内に、例えば急冷によって実施される。
【0092】
AS3PC法の好ましい態様に従い、温度TBは、温度TL〜温度THOMOに存在する。温度TBは、特に25℃〜50℃に存在することができる。
例の目的であるが、エタノールの場合、過剰の異性体が11質量%に近いとき、TBは好ましくは25℃〜40℃、特に30.1℃〜36.2℃、そしてさらに好ましくは33.5℃又は31.5℃の近くに存在する。
【0093】
2−メトキシエタノールの場合、過剰の異性体が8質量%に近いとき、TBは好ましくは35℃〜50℃、特に39.1℃〜47.9℃、そしてさらに好ましくは41℃の近くに存在する。
メタノールの場合、過剰の異性体が10質量%に近いとき、TBは好ましくは40℃〜55℃、特に45.1℃〜53.9℃、そしてさらに好ましくは46.5℃の近くに存在する。
【0094】
大きくするために集めた所望の異性体結晶の平均質量に対して充分に長いが、他の異性体が晶出することを防ぐためには充分に短い時間内で、段階b)内のTB〜TFへの冷却を実施することがもっとも好ましく、このようにして高い光学純度(特に85%より大きい純度)を得る。ろ過の正確な時機を決定するため、一般に偏光計を用いて、冷却を監視する。冷却を50〜70分間行うことが好ましく、エタノール溶媒を用いる場合には60分間かけることがさらに好ましい。
【0095】
同様に、SIPC法、AS3PC法及びS3PC法に関する温度TFにおける平坦域の長さは、集められる所望の異性体結晶の大きな質量を可能にするのに充分に長いが、所望の異性体のように、他の異性体が同時に晶出することを防ぐようにあまり長すぎないことが好ましく、そのようにして高い光学純度を得る。
好ましい態様に従って、TFの温度平坦域長は、15〜60分間存在し、約60分間存在することが好ましい。
【0096】
当業者は、SIPC法、AS3PC法及びS3PC法で用いる反応容器のタイプに撹拌速度を調節することができるであろう。表示の目的ではあるが、2リットル又は10リットルの反応容器において、媒体を撹拌する速度を150〜250rpmに保つことができる。
特に有用な様式において、これらの優先晶出法によって、光学分割剤を用いて得られる収率より非常に高い収率で、モダフィニルの光学異性体(特に、左旋性異性体)を分割することが可能である。得られる収率は、(+)若しくは(−)の光学異性体に対し、一般的に90%以上のオーダーであるか、又はラセミ体に対し、45%以上のオーダーである。
【0097】
AS3PC法、SIPC法、又はS3PC法
上述のAS3PC法及びSIPC法を、下記に記述する。
3成分の異種平衡:R鏡像体及びS鏡像体、並びに溶媒A
例えば、J.E.Ricciによる著作(Ed.Dover Publication Inc.New York,1966,The Phase Rule and Heterogeneous Equilibrium)によって、3成分系の異種平衡の一般的なケースが論じられている。以下の記述を、3成分系、A(キラル溶媒)、R及びS(用いる温度領域内で、ラセミ化できない異性体)の特定観点に限定する。これらの観点は、様々な優先晶出法の理解に必要となる。
【0098】
溶媒の特別な役割を示すため、濃度平面に対して軸垂線上に温度をプロットした直角二等辺三角形の断面を有する直角柱によって、この3成分系を表すことができる。
【0099】
2つの異性体に関する熱力学変数:非キラル溶媒中の溶解性、Tf、ΔHf等が同一であるという事実は、領域表示が、図1中でA−TS−Tの垂直面(光学不活性な混合物を含む)に関して対称であるという結論を有することとなる。この系の初期の記述を支援するために、次の簡略化を行う:
− 所与の配合中で、晶出物が純粋成分である唯一の相であること(鏡像体の場合、ラセミ化合物、溶媒和物、及び多形体がないこと)、
− 固体状態において、独立成分相互間の混和性がゼロであること、
− この溶媒が、鏡像体の融点よりもかなり低い融点を有すること、
− 用いる温度範囲において、鏡像体の溶解性が、溶液中の他の存在によって影響を受けず(Meyerhofferの法則を守る)、溶解性は、α=2の値を有する比で表せること。
【0100】
温度の関数としての3成分平衡の表示
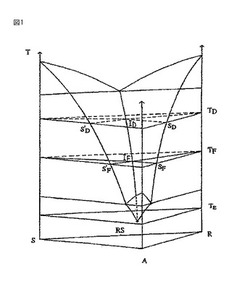
図1は、次の相の領域を示す:
− 希釈溶液(φ=1)における単相領域、
− 2相領域(φ=2)の境界を示す成分における2つの晶出曲面。
溶媒の析出に関する曲面をA付近に制限する。というのは上述の条件に従って、溶媒成分の融点は、他の成分の融点よりもかなり低いからである。
− 2成分の共晶点から生ずる、3種の単変式曲線(φ=3)又は共晶谷形状、
− 3成分が晶出する、Tε(φ=4)における3成分共晶不変点。
【0101】
図2は、TD及びTFにおける図1中に表示する3成分の2種の等温断面を、重ね合わせ様式で示す。それぞれの温度において、この断面は、以下の表に詳述するような4つの領域からなる。
【0102】
【表10】

【0103】
等値断面RYT
図3は、熱力学的にある程度の平衡にある3成分溶液の冷却によって、晶出の理解に対する基本となる等温断面R−Y−Tを示し、この断面は、SIPC、別形及びAS3PCの次の非平衡法にも必要である。この平面は、以下の関係を満たす点の幾何学的な軌跡である:
XA/XS=(1−Y)/Y=一定、そしてXA及びXSには、溶媒及び鏡像体Sの質量による比率をあてる。
【0104】
図3において、以下の点が分かる:
− 3成分溶液の単相領域、
− 鏡像体Rに関する溶液線、この曲線は、図2中でR−Y平面と、鏡像体Rの組成に関する晶出曲面との交差を表している。この安定平衡曲線は、鏡像体Rの融点(示されていない)で生じ、そしてポイントL(ラセミ混合物に関する3成分共晶谷形状の一部を形成する)によって低温面との境界が示されている。この後者の曲線及びTLにおける円錐に似た形の線(TLにおける水平線分)が、R体結晶を加えた飽和溶液の2相領域の境界である。曲線は、準安定性である同じ鏡像体Rに対する溶解性曲線を通って、下にある3相領域へと伸びる(破線)。
− 3相領域:飽和溶液を加えたR体結晶及びS体結晶。この領域は、頂部がRに関する円錐に似た形の水平線によって、そして底部が3成分共晶不変平面によって、左側が鏡像体Sに関連する円錐に似た形状の一本の線Lmによって境界を示されている。
− 頂部において2相領域(飽和溶液+S体鏡像体)との境界を示す、鏡像体Sに関する晶出曲面の線KL。この領域は、Sに関する2つの円錐に似た形の線:gm及びLmによって低い部分との境界を示している。R2に対する準安定溶解性曲線に関するSに対する円錐に似た形の第2線Lm(ELの延長)の位置を、溶解度比αに関するF1及びFの近い位置に関して、以下で論じるつもりである、
− 3種の晶出された成分A,R及びSが存在する、温度Tεにおける3成分不変点。
【0105】
冷却及びわずかに過剰の異性体を有する3成分溶液の熱力学的なある程度の平衡を伴った変化
以下において、この系に関する全体的なポイント(すなわち、混合物の全体的な組成を表すポイント)は、図2及び図3中のポイントEを通る垂直線上に存在することを要し、その正確なポイントは温度(又は水準)によって規定される。次の温度範囲のみを考慮に入れる:
− TD:初期混合物が均一溶液である温度、そして
− TF:晶出の終わり及びろ過における温度、ここで、この温度は3相領域内に存在する。
【0106】
この全体的な組成物Eは、総質量Mtを形成する鏡像体Rの質量Mによって、わずかに濃厚にされているラセミ体溶液に対応する(過剰の異性体R−S/R+Sは、一般的に4%〜9%で存在する)。混合物を規定する全体的なポイントEが、一又は複数の相が平衡で存在する領域に到達すると、非常にゆっくりとした冷却及び一又は複数の固相のシーディングによって、平衡状態を得る。
【0107】
初期温度TDにおいて溶液は均一である。連続冷却時に、次のものを得る:
− THOMO〜TLにおける鏡像体R単体の晶出、同時に溶液ポイントが、鏡像体Rに関する溶解度曲線上を移動(等値断面R−Y内のTHOMO水準のポイントEからポイントLへ)する。ポイントLにおいて、飽和溶液と平衡にある鏡像体Rの質量Mは、Mt(XE−XL/1−XL)=Mによって与えられ、初期溶液(図3)中に存在する過剰の異性体に該当し、ポイントL,E,及びRの横軸は、組成,及び1に該当する(図3)。
− TLから、この溶液ポイントは、図2に示されるラセミ体組成溶液を含む一定勾配の線に沿って、LからIFへ移動し、そして図3中の等値断面R−Yを通り過ぎ、次いでR体結晶及びS体結晶を、同時にかつ等量析出する。
平衡状態下において、TL未満の温度で分割を実施することはできない。
【0108】
SIPCプロセスに従う一般的な制御により分割する場合の溶液の変化
過剰の第一鏡像体の晶出
前述の溶液Eを、温度TDで均一化する(図4及び図5)。溶液Eを過飽和にするため、晶出を一切生じさせずに温度TFまで急冷させる。次いで、熱力学的平衡にないこの溶液を、過剰の鏡像体と同一のキラリティーを有する非常に純粋な鏡像体Rの種結晶を用いてシード化する。鏡像体Rの等温晶出を設定し、そして溶液を表示するポイントが断面R−Y−T内を、Eから水準TF(ろ過を早急に実施するFと、第一の同一延長上にある)まで移動する。回収する鏡像体Rの質量は、2M又はさらにMt(XE−XF/1−XF)に等しい。
【0109】
第二鏡像体の晶出、操作のサイクル
このように、上記基本操作により、鏡像体Sに富む溶液Fが生じる。質量2Mのラセミ体(回収した鏡像体質量に等しい)を添加すること、及びこの混合物を温度TDまで加熱することによって、垂直面A−(RS)−Tに関してEに対称な、均一溶液E’を得る。質量2Mの鏡像体Sを得ることができるこのプロセスを、それ自体、この中央平面に関連する上記の対称移動によって表すこともできる。そして、次の操作:
− 温度TDで均一な溶液E’を、第一にTFまで冷却すること、そして、
− 鏡像体Sの非常に純粋な種結晶を用いてシード化し、この鏡像体の成長によって、水平線分E’F’(水準TFにおいて)上の溶液を表すポイントを移動させること、
− 溶液ポイントがF’と同一である場合、この溶液をろ過し、そして質量2Mの鏡像体Sを与えること、
− 質量2Mのラセミ体をさらに添加し、さらにTDまで加熱した後、均一溶液を再度得ること、そしてその表示ポイントは、水準TDにおける初期ポイントEと同一であること、
− このプロセスの残部として、この操作サイクルを単に繰り返すこと、
を順に実施する。
【0110】
SIPC法の別形
各文献(Amiard,G.,1956,Bull.Soc.Chim.Fr.447,Collet,A.,Brienne,M.J.,Jacques,J.,1980,Chemical reviews 80,3,215−30,Noguchi Institute,1968,patent GB 1 197 809)は、上記の一般的なスキームに基づく;この文献中に明白である主な変形点を以下のように分類する:
a)過剰の鏡像体の最初の自発的な核形成、
(±)−トレオニンを分割する場合(Amiard,G.,1956,Bull.Soc.Chim.Fr.447)、過剰の鏡像体の最初の核形成が、過飽和の均一溶液中で自発的に起きる。全体の組成を表すポイントEが3相領域内に存在し、かつこの溶液を撹拌しない場合に、最初の核形成が起きる(Collet,A.,Brienne,M.J.,Jacques,J.,1980,Chemical reviews 80,3,215−30)。
b)冷却中のシーディング(S3PC)、
このプロトコルは、このプロセスがSIPCとは異なる場合に、文献(Noguchi Institute,1968,patent GB 1 197 809)中に最もよく見出されるプロセスの1種である。引用する手順相互間に違いがあるものの、それでも次の一般的なブロードラインを認識することができる:
− TDから、TL未満だがTFより高い温度まで均一溶液を冷却すること、
− 過剰の鏡像体と同一のキラリティーの種結晶を用いて3相領域に存在する過飽和均一溶液をシーディングすること、
− TFまで冷却すること。一部の場合では、正確な温度プログラミングにより、後者の段階を制御する(Noguchi Institute、1968、patent GB 1 197 809)。
【0111】
これらのプロトコルを、合わせて「シード化多温プログラム化優先晶出法(Seeded polythermic programmed preferential crystallization)」に対する「S3PC」と同一用語の下に分類することができる。しかし、温度プログラミングは存在しないか、又は冷却の第2段階に限定される。
【0112】
本発明に従うAS3PC法に関連する、プログラム制御及び自己シード化により分割する場合の溶液ポイントの変化
一般的な方法及びAS3PC法間のより良い比較を達成するために、前記の場合と同一になるように、図6及び図7内で、初期ポイントEを任意に選択する;しかし、次の例で明らかにするAS3PC法によって、平面A−(RS)−Tからさらに離れ、そして大過剰の異性体を伴うポイントEを選択することと、このように、それぞれの操作において結晶収集量を向上させることとが可能となる。
【0113】
過剰の第一鏡像体の晶出
このプロセスの最初において、そして一般的なプロトコルに反して、全体(溶液を加えた結晶)を、均一ではないが温度TBまで昇温させる。次いで、この初期溶液は、過剰の異性体結晶と平衡状態になる(例えば、図7中のR)。それゆえ、溶液(SE)及び全体(E)を表す各ポイントは、本プロセスの最初から同一ではない。この2相混合物は、種結晶の添加なしで温度低下関数のプログラムに従う。溶液を表すポイントによって、冷却の動力学によって決定する曲線SEF(平面R−Y−T内に含まれる)が記述される(図7)。正確に調節した動力学を用いると、過剰の異性体結晶の成長が最初に生じ、その後、晶出は、第二核形成を加えた成長の同時支配の方向に進んでいく。溶液を表すポイントがポイントFに到達した場合、ろ過を実施し、2Mの質量の鏡像体Rの結晶を回収する。
【0114】
第二鏡像体の晶出、操作のサイクル性
質量2Mのラセミ体を添加することと、温度TBまで加熱することとによって、ポイントF(上記母液に対応する)からポイントE’(垂直面A−(RS)−Tに関して、Eに対称である)まで移動する。次いで、過剰の異性体は、過剰の鏡像体結晶及び飽和溶液を含む2相領域に位置することで恩恵を受ける。はじめに、F〜E(F’からEとして)の推移の間に添加されるラセミ体を、2つの鏡像体(さらに具体的には少ない方の鏡像体)の溶解段階を促進するように、かつこのように過剰の方の鏡像体の多数の結晶(一般的方法中で、添加する種結晶の役割を有する)の形成を可能とするように、粉砕及び分級することができる。
【0115】
飽和溶液S’E(平面A−(RS)−Tに関して、SEに対称である)は、同一の冷却関数に従う。冷却の最初から存在する結晶が成長して、次いで成長+第二核形成の二つの機構に参加することになる。それゆえ、最初の晶出の場合のように、シーディングは必要ない。
この間、溶液を表すポイントは、2等分平面A−(RS)−Tに関して対称である等値断面S−Y’−Tの平面内に含まれる曲線SE’F’に沿って、移動する。
【0116】
この溶液がF’に置かれる表示ポイントに到達した場合、ろ過を行い、粉砕及び分級したラセミ体の2Mの質量を集め、次いで温度をTBまで上げ、次いで開始平衡における2相混合物がもたらされる。
このプロセスの継続は、鏡像体R及び鏡像体Sの結晶を交互にもたらす操作のこのサイクルを繰り返すことから成る。
【0117】
AS3PCプロセスを実施するのに必要な条件
a)各光学異性体の等モル混合物は、温度範囲TB〜TF内で用いる溶媒中でラセミ混合物(純粋な鏡像体又は溶媒和物)を生成する;しかし、準安定なラセミ化合物の存在は不利な条件とはならない。
b)分割される分子は、この溶媒中及びTB〜TFで用いる温度範囲内で安定である。
c)3成分平衡温度TL及びTHOMOを決定する必要がある。温度TLは、ラセミ体が溶液中で任意の過剰の異性体なく溶解する温度である。一度、TLを決定すると、温度THOMOは、溶液の均一化温度に該当することとなる。それは、当初の過剰の異性体、並びにTLにおけるラセミ体及び鏡像体の溶解度比αによって決まる。TL〜TFの溶液の過飽和キャパシティーの知見も必要であり、冷却の動力学、撹拌の形態、容器の性質、及び過剰の鏡像体結晶の粒径によって決まる。第一次近似に対し、同様の動力学を用いてTLよりわずかに高い温度から冷却された均一ラセミ化合物の溶液L中において、最初の結晶核形成によって結晶が出現する時間が、これらの実験条件下でラセミ混合物によって許容される過飽和キャパシティーの兆候をもたらすこととなる。この操作方法を、例として考慮に入れる。
d)温度TBにおいて溶液中に分散された(所与の粒径の)ラセミ体の既知質量の溶解の動力学の知見。この時間を見出すのに、何点かの試験で充分であろう。
以下において、本発明の非限定的な具体的な説明の目的で、各例及び各図を提供する。
【図面の簡単な説明】
【0118】
【図1】図1は、温度及びそれぞれの成分に対する晶出曲面、並びに二重に飽和した溶液(単変式曲線)の組成物に関連し、溶媒A−鏡像体R−鏡像体Sの3成分系の透視図であり;この図は、温度TD及びTFにおける等温曲線と、4相を含む温度Tεにおける3成分共晶平面を示している。
【0119】
【図2】図2は、TD及びTFにおける平衡濃度の平面上の、並びに等値断面RYの線表示の投影図であり、ここで、ポイントEは、鏡像体R(同一の鏡像体を沈殿させる)をわずかに過剰にした初期混合物の組成物を表している。
【0120】
【図3】図3は、過剰の鏡像体に関する組成物ポイント及び初期溶液ポイントEを含む、図2中の等値垂直断面RYであり、ここで、平衡時及び冷却中の組成XEの混合物に対する溶液ポイントの経路(太線として)を示す。T<TLの場合、この溶液ポイントはこの断面内に入ってこない。
【0121】
【図4】図4は、温度TFにおける等温制御と、SIPC法に従うシード化とによる交互の分割の間の、溶液ポイントの経路(太線として)の濃度平面上の投影図である。
【0122】
【図5】図5は、等温制御(TFに関する)及びSIPC法に従うシード化の間のE〜Fへの溶液ポイントの経路(太線として)を具体的に説明し、かつ図4中の直線RYを含む垂直等値断面である。
【0123】
【図6】図6は、自己シード化多温プログラム化プロセス(AS3PC)を用いて分割する場合の、溶液ポイントの経路(太線として)の濃度平面上の投影図である。
【0124】
【図7】図7は、本発明に従う自己シード化多温プログラム化プロセス(AS3PC)によって分割する間、SEからFへの溶液ポイントの経路(太線として)を具体的に説明し、かつ図6中の直線RYを含む、垂直等値断面である。
【0125】
【図8】図8は、自己シード化多温プログラム化プロセス(AS3PC)による分割の間、溶液ポイントの経路(太線として)の濃度平面上の投影図であり、そして関係式s(±)<2−αを証明するものである。 これらの図中に具体的に説明する、等値及び全ての等温断面は、質量率として表す組成物の変数を有する。
【0126】
【図9】図9は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IIに対応して得られる粉末X線回折スペクトルを示している(回折計:Miniflex Rigaku(Elexience))。
【0127】
【図10】図10は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IIIに対応して得られる粉末X線回折スペクトルを示している(回折計:Miniflex Rigaku(Elexience))。
【0128】
【図11】図11は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IVに対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0129】
【図12】図12は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれのジメチルカーボネート溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0130】
【図13】図13は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれのアセトニトリル溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0131】
【図14】図14は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態Vに対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【0132】
【図15】図15は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの酢酸溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【0133】
【図16】図16は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの非晶形に対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【実施例】
【0134】
(−)−モダフィニル異性体及び(+)−モダフィニル異性体のそれぞれの結晶形態の調製
一般
モダフィニルの各異性体の新しい結晶形態を、粉末X線回折スペクトロスコピーによって特徴づけ、このスペクトロスコピーによって、試験される結晶形態特有のデジタル識別特性が付与され、そしてこのスペクトロスコピーを、モダフィニルの非晶質異性体及びモダフィニル異性体の他の任意の結晶形態から識別するために使用ができる。
【0135】
X線回折データを測定した:
− ニッケルでフィルターしたλ=1.540ÅのCu線(40KVの加速速度、管電流40mA)と、及び測定中の試料の回転(角度:速度0.04°[2θ]・s−1において3〜40°[2θ]、刻み幅を0.04°とし、優先のオリエンテーションを用いた試料の調製)とを用いる、X線粉体回折計としてのD5005システム(Siemens AG,Karlsruhe,Germany,Eva5.0データ解析法)。
− Cr線、30KVの加速速度、15mAの管電流、及び測定中の試料の回転(角度:速度0.05°[2θ]・s−1において3〜80°[2θ]、刻み幅を0.1°とし、優先のオリエンテーションを用いた試料の調製)を用いる粉末X線回折計としてのMiniflex Rigaku(Elexience)システム。
− 「ハイスターエリア」検出器を備え、そしてプレート分析のため96ウェルを備える、粉末X線回折計(Bruker,the Netherlands)としてGADDSシステムの使用。3〜42°の2θ角の範囲内で、室温において、CuKalphaCu線を用いた分析を実施した。50〜250秒の露光時間を用いて、2θ角の値の2つの領域間(3°≦2θ≦21°及び19°≦2θ≦42°)で、それぞれのウェルの回折スペクトルを収集する。
【0136】
もちろん、強度値は、サンプル調製、アセンブリ、及び測定機器に関連して変化することがある。2θの測定は、測定機器に関連する変動によっても影響を受けることがあり、対応するピークは、装置に従って±0.4°〜±0.2°ので変化することがある。また、当業者は、回折スペクトルに関する本質的なデータを構成する利用可能な面格子間隔を有することを評価するであろう。ブラッグの関係式を満たす場合、ブラッグの関係式(2dsinθ=nλ、ここでd=格子間間隔(Å)、λ=Cu線の波長、θ=結晶の回転角(度))を用いて、格子間間隔を計算する。
【0137】
◆例1〜10:(−)−モダフィニル及び(+)−モダフィニルの形態Iの調製
・例1
a)還流下及び表1に詳述する実験条件下で、モダフィニルのl−異性体を、極性溶媒:メタノール、無水エタノール、3%の水を含む無水エタノール、トルエン(2.5%)で変性しそして3%の水を含むエタノール、及び水に溶解した。
【0138】
【表11】

【0139】
30分間、氷水浴中に浸すこと(quenching)によって急冷させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥させた。晶出生成物を、モダフィニルのl−異性体の形態Iの多形体として、その粉末X線回折スペクトルによって同定した。
b)モダフィニルのd−異性体(555g)を、トルエン(2L)で変性したエタノール及び水(0.1L)の混合物中で、例1aと同一の実験条件下で処理し、その粉末X線回折スペクトルによって同定されるような多形体Iに晶出させ、収率は91%であった。
【0140】
・例2:アセトンからの再晶出
a)2gの(−)−モダフィニルを、コンデンサー、温度計及びスターラーを備える三口フラスコ中で、アセトン中(20mL)で懸濁させた。この混合物を還流下で加熱した。(−)−モダフィニルが完全に溶解するまで、約56℃において30分間、反応混合物を撹拌した。次いで、この溶液を撹拌しながら、−0.5℃/分の速度で10℃まで徐冷した。反応混合物をろ過し、そして得られた固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は62%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0141】
・例3:メタノールからの再晶出
a)1gの(−)−モダフィニルを、メタノール中(7mL)に添加し、(−)−モダフィニルが完全に溶解するまで、還流下で加熱した。1℃において水を6mL添加することによって、この反応混合物を沈殿させた。この懸濁液を連続して1分間撹拌し、次いで、ガラスろ過器(No.3)上でろ過した。分割した固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は55%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0142】
・例4:メタノールからの再晶出(第二例)
a)2.5gの(−)−モダフィニルを、90mLのメタノール中に添加し、(−)−モダフィニルが完全に溶解するまで、還流下で加熱した。透明な溶液に、1℃において水を200mL添加し、そして10分間撹拌を続けた。この反応混合物をろ過し、そして回収した固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は78%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0143】
・例5:1,4−ジオキサンからの再晶出
a)20mLの1,4−ジオキサンを50mLのフラスコに入れ、そして還流下に置いた。飽和に達するように2gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、20℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は51%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0144】
・例6:オルト,パラ及びメタ−キシレンからの再晶出
a)180mLのオルト,メタ及びパラキシレンを250mLのフラスコに入れ、そして還流下に置いた。飽和に達するように0.5gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、15℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は26%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0145】
・例7:エチルアセテートからの再晶出
a)100mLのエチルアセテートを250mLのフラスコに入れ、そして還流下に置いた;飽和に達するように2gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、20℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は66%であった。
b)還流下で、(+)−モダフィニル(3g)を、エチルアセテート中(100mL)に溶解した。30分間、氷水浴中に浸すことによって冷却させた後、この媒体をろ過し、次いで減圧下で、50℃において乾燥炉中で乾燥した。晶出生成物を、(+)−モダフィニルのl−異性体の形態Iの多形体として、その粉末X線回折スペクトルによって同定した。
【0146】
・例8:他の多形体から
a)CRL40982の形態IV(0.5g)及びCRL40982の形態II(0.5g)を100℃まで加熱することによって、形態Iがもたらされた。
さらに、転換を完全に達成するのに充分な時間(3日間)、(−)−モダフィニルの形態I(0.5g)及び形態II(0.5g)及び形態III(0.5g)の混合物をアセトン中(20mL)に溶解させることによって、(−)−モダフィニルの純粋な形態Iを調製することができる。
二つの手順において、その粉末X線回折スペクトルで、形態Iと同定した。
b)同じ条件下で(+)−モダフィニル(CRL40983)の使用によって、同じ結果がもたらされた。
【0147】
・例9:アセトニトリル溶媒和物から
a)1gの(−)−モダフィニルのアセトニトリル溶媒和物を、100℃まで8時間加熱し、その粉末X線回折スペクトルによって(−)−モダフィニルの形態Iであるとして同定される白い固体に転換した。
b)同一条件下で(+)−モダフィニルの使用によって、同一結果がもたらされた。
【0148】
・例10:モノジメチルカーボネート溶媒和物から
a)1gの(−)−モダフィニルのモノジメチルカーボネート溶媒和物を、110℃まで16時間加熱し、その粉末X線回折スペクトルによって(−)−モダフィニルの形態Iであるとして同定される白い固体に転換した。
b)同じ条件下で(+)−モダフィニルの使用によって、同じ結果がもたらされた。
◆例11〜12:(−)−モダフィニルの形態II(CRL40982の形態II)及び(+)−モダフィニルの形態II(CRL40983の形態II)のそれぞれの調製
・例11:急冷による
【0149】
a)表2に記述する実験条件に従い、モダフィニルのl−異性体を、還流下で溶媒中:エチルアセテート,イソプロパノール,n−プロパノール,及びトルエン(2.5%)で変性したエタノール中に溶解した。
【0150】
【表12】

【0151】
30分間、氷水浴中に浸すことによって冷却させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥した。それぞれの実験手順において、その粉末X線回折スペクトルによって、晶出させた生成物を、モダフィニルのl−異性体の形態IIの多形体(CRL40982の形態II)として同定した。
b)モダフィニルのd−異性体(3.02g)を、還流下で100mLのイソプロパノール中で溶解し、次いで30分間、氷水浴中に浸すことによって急冷させ、ろ過しそして50℃の乾燥炉中で、減圧下で乾燥した。これらの実験条件の下、その粉末X線回折スペクトルによって同定される多形体II(CRL40983の形態II)に、(+)−モダフィニルを晶出させた。
【0152】
・例12:イソプロパノールからの冷却による
a)100mLのイソプロパノールを250mLのフラスコに入れ、還流下に置き、そして飽和に達するように3gの(−)−モダフィニルを添加し、棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過した。晶出生成物を、そのX線回折スペクトルによって、モダフィニルのl−異性体の形態IIの多形体(CRL40982の形態II)として同定した。収率は42%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0153】
◆例13:(−)−モダフィニルの形態III(CRL40982の形態III)及び(+)−モダフィニルの形態III(CRL40983の形態III)のそれぞれの調製
・例13:アセトンからの徐冷による
a)モダフィニルのl−異性体(5g)を、90mLのアセトンの還流下で溶解させた。30分間、氷水浴中に浸すことによって急冷させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥した。その粉末X線回折スペクトルによって、晶出させた生成物を、モダフィニルのl−異性体の形態IIIの多形体として同定した。収率は61%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0154】
◆例14〜16:(−)−モダフィニルの形態IV(CRL40982の形態IV)及び(+)−モダフィニルの形態IV(CRL40983の形態IV)のそれぞれの調製
・例14:クロロホルムからの再晶出
a)20mLのクロロホルムを50mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように1.5gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0155】
・例15:メチルエチルケトンからの再晶出
a)100mLのメチルエチルケトンを250mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように、2gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0156】
・例16:テトラヒドロフランからの再晶出
a)20mLのテトラヒドロフランを50mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように、1gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、10℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
例17〜17B:(+)−モダフィニルの形態V(CRL40982の形態V)及び(+)−モダフィニルの形態V(CRL40983の形態V)のそれぞれの調製
【0157】
・例17及び例17bの操作手順
モダフィニルのd−異性体のメタノール溶液(150mg/mL)を96ウェルのプレートに分配し、そして様々な溶媒を25μL(濃度=3.75mg/溶媒25μL)添加する前に、次いで室温においてわずかに減圧して、メタノールを蒸発させた。このマルチウェルプレートは、ステンレス鋼(316L)及び総体積50μLが含まれるそれぞれの密封ウェルからできていた。このプレートを4.8°C/分の温度勾配を用いて、60℃の初期温度まで加熱した。30分後、3℃の最終温度に達するまで、このプレートを徐冷(−0.6°C/分)又は急冷(−300°C/分)し、次いで、最小で1時間、最大で48時間、最終温度を保持した。この溶液を、減圧下(窒素雰囲気)で蒸発させ、そしてこの晶出させた生成物を分析した。
【0158】
・例17:2−プロパノンからの再晶出
徐冷(−0.6°C/分)の適用と、1時間、3℃の温度の保持することとによって、上記操作条件に従って、2−プロパノンからd−モダフィニルを晶出させた。この結晶をその粉末X線回折スペクトルによって、(+)−モダフィニルの形態V(CRL40983の形態V)であるとして同定された。
【0159】
・例17b:テトラヒドロフラン(THF)からの再晶出
急冷(−300°C/分)の適用と、1時間、3℃の温度の保持することとによって、上記操作条件に従って、THFからd−モダフィニルを晶出させた。この結晶をその粉末X線回折スペクトルによって、(+)−モダフィニルの形態V(CRL40983の形態V)であるとして同定した。
【0160】
◆例18〜19:(−)−モダフィニルの溶媒和物及び(+)−モダフィニルの溶媒和物の調製
・例18:(−)−モダフィニルのジメチルカーボネート溶媒和物の調製
a)20mLのジメチルカーボネートを、2gの(−)−モダフィニルに添加し、還流させた。(−)−モダフィニルが完全に溶解するまで、この溶液を10分間撹拌させた。この溶液を、撹拌しながら10℃まで徐冷(−0.5°C/分)させた。この反応混合物を、ガラスろ過器(No.3)上でろ過した。モダフィニルのジメチルカーボネート溶媒和物の分析によって、約24%の質量がもたらされた(約50℃から開始し、110℃まで下げた)。従って、ジメチルカーボネート溶媒和物の化学量論性は、1:1である。それゆえ、これは真の溶媒和物であり、その粉末X線回折スペクトルにより、(−)−モダフィニルのジメチルカーボネート溶媒和物として同定された。収率は88%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0161】
・例19:(−)−モダフィニルのアセトニトリル溶媒和物の調製
a)(−)−モダフィニルの多形体Iの結晶をアセトニトリル中で3日間、20℃において懸濁させた。回収した固体は、X線回折により、アセトニトリル溶媒和物として同定された。この溶媒和物は、1:1の化学両論性を有する真の溶媒和物に該当し、その粉末X線回折スペクトルにより、(−)−モダフィニルのアセトニトリル溶媒和物として同定された。収率は92%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0162】
・例20:酢酸溶媒和物の調製
a)15%の濃度(重量/体積)に達するように、75mgのd−又はl−モダフィニルを、ミニマックス反応器中で、酢酸中に懸濁させた。晶出媒体(絶えず撹拌した)を、3°C/分の温度勾配を用いて、60℃又は80℃の初期温度まで昇温した。30分後、3℃の最終温度まで、この媒体を徐冷(−0.6°C/分)又は急冷(−300°C/分)し、次いで、最小で1時間又は最大で48時間、最終温度を保持した。これらの実験条件の下、酢酸溶媒和物を得て、そしてその粉末X線回折スペクトルによって同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0163】
・例21:(−)及び(+)−モダフィニルの非晶質形態の調製
例20で得られた(−)又は(+)−モダフィニルの溶媒和物を120℃で3時間加熱することによって、非晶質形態に転換した。得られた粉末X線回折スペクトルを図16に示す。
【0164】
◆例22〜29:優先晶出による(±)−モダフィニル酸の分割
エタノール中でAS3PC法の使用
・平衡に関連する状態
− エタノール中のラセミ体の溶解度:
【表13】

− 純粋な(+)鏡像体の溶解度=1.99%(20℃);比α=2.06
− ポイントLの座標=濃度:5.96%、温度:30℃
【0165】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=5.96%=一定)を伴うTHOMOの変化
【表14】

【0166】
・動力学に関連する状態
このように、TBをTLにより近くなるように調整することで、実験のはじめに純粋結晶の形の最終収集物の約40%を得ることができ、次いで、期待される最終質量のたった60%が、生成されればよいことになる。この操作は、比Zが充分に大きい場合(過剰の異性体%につき0.8以上)、簡単に実施することができる。
【0167】
モダフィニル酸の場合にあっては、晶出を正確に行う。
【数1】

温度TB1=33.5℃、そしてTB2=31.5℃。
温度TF=17℃。
冷却関数=T=f(t)。
【表15】

【0168】
ポイント中の二つの場合において、TB1又はTB2からの冷却関数は1次線分である:
T1=33.5−0.275t(タイプ1)
T2=31.5−0.24167t(タイプ2)
17℃における平坦域が続く。
【0169】
・例22:エタノール中の35ccスケールにおけるAS3PC法による(±)−モダフィニル酸の分割
・初期状態
過剰の異性体=11%
【表16】

【0170】
TB1及びTB2における平坦域の持続時間=30分
撹拌速度=200rpm
・結果
【表17】

− 純粋な鏡像体結晶の平均質量=0.66g
− 平均光学純度=90.6%
【0171】
・例23:エタノール中の400ccスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11%
【表18】

撹拌速度=200rpm
【0172】
・結果
【表19】

− 純粋な鏡像体結晶の平均質量=8.55g
− 平均光学純度=89.63%
【0173】
・例24:エタノール中の2リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.1%
【表20】

【0174】
・結果
【表21】

− 純粋な鏡像体結晶の平均質量=32.6g
− 平均光学純度=90.3%
【0175】
・例25:エタノール中の10リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.7%
【表22】

撹拌速度=200rpm(lmpeller(商標)ムービングスターラーを用いる手順の間)
【0176】
・結果
【表23】

− 純粋な鏡像体結晶の平均質量=130.8g
− 平均光学純度=89.9%
【0177】
2−メトキシエタノール中でAS3PC法の使用
・平衡に関連する状態
− 2−メトキシエタノール中のラセミ体の溶解度:
【表24】

− 純粋な(+)鏡像体の溶解度=4%(20℃)、比α=2.53
− ポイントLの座標=濃度:16%、温度:39.4℃
【0178】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=16%=一定)を伴うTHOMOの変化
【表25】

【0179】
・例26:10リットルスケール上のAS3PC法による2−メトキシエタノール中の(±)−モダフィニル酸の分割
・初期状態
過剰の異性体=10%
初期温度TB:41℃
ろ過温度TF:30℃
1時間内の41℃〜30℃への直線温度勾配
【表26】

撹拌速度=200rpm
【0180】
・結果
【表27】

− 純粋な鏡像体結晶の平均質量=422.4g
− 平均光学純度=98.2%
【0181】
メタノール中でのAS3PC法の使用
・平衡に関連する状態
− メタノール中のラセミ体の溶解度:
【表28】

− 純粋な(+)鏡像体の溶解度=4.9%(20℃)、比α=2.53
− ポイントLの座標=濃度:25.6%、温度:46.5℃
【0182】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=25.7%=一定)を伴うTHOMOの変化
【表29】

【0183】
・例27:メタノール中の1リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・実験条件
過剰の異性体=10%
初期温度TB:46.5℃
ろ過温度TF:30℃
温度勾配:1時間の39.4℃〜18℃への1次勾配
【表30】

撹拌速度=230rpm
【0184】
・結果
【表31】

− 純粋な鏡像体結晶の平均質量=108g
− 平均光学純度=87.5%
【0185】
エタノール中でSIPC法の使用
・平衡に関連する状態(AS3PC法を参照)
・例28:メタノール中、冷却の終わりにシーディングを伴う、2リットルスケール上のSIPC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.8%
初期混合物が均一溶液である温度、TD=40℃
【表32】

− 種結晶を添加する前のTFにおける時間(平坦域)=0分
− 種結晶質量=1%
− 晶出時間=クエンチングによる最速の冷却
撹拌速度=200rpm(lmpelier(商標)モバイルスターラーを用いる手順の間)
【0186】
・結果
【表33】

− 純粋な鏡像体結晶の平均質量=31.28g
− 平均光学純度=91%
【0187】
・例29:メタノール中、冷却の間にシーディングを伴う、2リットルスケール上のS3PC法による(±)−モダフィニル酸の分割
− 初期の過剰の異性体=11.14%
【表34】

− シーディング温度=29℃
− 種結晶質量=1%
− 晶出時間=クエンチングによる最速の冷却
撹拌速度=200rpm(lmpelier(商標)モバイルスターラーを用いる手順の間)
【0188】
・結果
【表35】

− 純粋な鏡像体結晶の平均質量=25.2g
− 平均光学純度=85.2%
【0189】
◆例30〜32:モダフィニルの光学異性体のアルキルエステルへの転換
(−)−モダフィニル酸を使用して、この段階を具体的に説明する。
・例30:ジメチルスルフェートの存在下
3.3リットルのアセトン、0.6リットルの水、349gのNa2CO3(3.29モル)、451gの(−)−モダフィニル酸(1.64モル)を10リットルフラスコ内に入れ、そして還流に達するように加熱する。330mLのジメチルスルフェート(3.29モル)を30分にわたり流し込む。還流を1時間続け、次いで20時間内で室温まで冷却させた。
【0190】
次いで、この媒体を6.6kgの氷の上に注いだ。即時に晶出し、そして3時間後、さらに撹拌ろ過によって白い析出物をもたらし、6リットルの水で洗った。
この生成物を再度6リットルの水中に取り上げ、そして再度ろ過した。この析出物を減圧下、35℃において乾燥し、そしてこのようにして436.3gのメチルエステルを得た(収率=92.3%)。
【0191】
・例31:クロロ蟻酸メチルエステルの存在下
100gの(−)−モダフィニル酸(0.36モル)、21.6mLのトリエチルアミン(0.36モル)を450mLのメタノールに添加した。30mLのクロロ蟻酸メチルエステル(0.36モル)を、塩を溶解させた後に、得られた溶液上に連続的に注いだ。
15分にわたり注ぎ、28℃〜35℃まで昇温した(CO2の放出)。この溶液を2時間撹拌し、そして積み重ねた「氷+水(500g/500mL)」上に注いだ。
このエステルが晶出し;ろ過及び乾燥の後、94.5gのエステルを得た(収率=90.1%)。
【0192】
・例32:光学活性モダフィニル酸のアルキルエステルのアンモノリシス
1.63リットルのトルエン変性メタノール、0.1リットルの水、及び425.1gのメチルエステル(1.474モル)を4リットルのダブルジャケット反応器内に入れた。
温度を30℃まで上げ、そしてこの温度を維持しながら、アンモニアのバブリングを開始した。この操作を1時間45分続け、そして導入したアンモニアの質量は200gであった。撹拌を21時間30分維持し、次いで、0℃に調節された温度で冷却した。
次いで、この媒体をNo.3のガラスろ過器上でろ過し、ろ液(乾燥するまで蒸発させる)と共に57.2gをすぐに得た。この残留物を1.2リットルのトルエン変性エタノール中に取り上げ、そしてろ過後に308.6gの第二の量を得た。
【0193】
第一の晶出:
1.83リットルのトルエン変性エタノール中にこの二つの量をため、そして再晶出させた。熱ろ過によって、冷却すると生成物を生ずるろ液(ろ過し、かつ30℃における減圧下で乾燥する)がもたらされた。162.2gの白い析出物を得た。
【0194】
第二の晶出:
これらの162.2gを、810mLのトルエン変性エタノールと混合し、そして完全な溶解に達するように、還流下で加熱した。次いで、この溶液を氷で冷却することによって晶出させ、そしてNo.4のガラスろ過器を通してろ過し、そして減圧下で、30℃において乾燥した。147.3gの(−)−モダフィニル(CRL40982)を得た。
収率は36.6%であった。
特性:
回転力=−18.6(メタノール中の4.9%溶液)
融点=163℃
【0195】
◆例33〜34:結晶体構造
・例33:モダフィニル酸の構造
アセトンから、モダフィニルの結晶を得た。
この相は、次の特性を有する:
− 異性体に依存する六方晶系のP31又はP32、したがってこのモダフィニルはラセミ混合物であり、
− a=9.55、b=9.55、c=13.14Å
− α=90.000、β=90.000、γ=120.000°
20℃において、自動SMART APEX(Brucker)回折計を用いて、この回折強度を測定した。
【0196】
Saintplus、Sadabs、Shelxsのソフトウェアのパッケージセットを用いて、この構造を決定した。
キラル有機分子の場合において、この空間群の特異的な性質を強調しなければならない。
結晶格子中で、このパターンが3回繰り返しており、従って再度Z=1であった。これらの分子は、酸やスルホキシド基を介して、水素結合によって共に結びつけられている。最も強い相互作用(水素結合)が、結晶方向Zに沿って3つのらせん軸に回り込むものであると論ずることができる。
【0197】
・例34:(−)及び(+)−モダフィニルの形態Iの構造
(+)−モダフィニルの形態Iの結晶構造((−)−モダフィニルの形態Iの結晶構造と同一であるとして同定される)を決定した。その結晶構造は、次の特性を有する:
− 結晶系=単斜晶系、
− 空間群=P21
− a=5.6938、b=26.5024、c=9.3346Å
− β=105.970°
20℃において、自動SMART APEX(Brucker)回折計を用いて、この回折強度を測定した。
【技術分野】
【0001】
本発明は、モダフィニルの異性体の結晶形を得るための方法、および本方法に従って得ることができる結晶形に関する。
本発明はまた、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する、新しい方法に関する。
【背景技術】
【0002】
米国特許第4,177,290号明細書には、中枢神経系を刺激する特性を有する化合物として、(±)−2−(ベンズヒドリルスルフィニル)アセトアミド又は(±)−2−[(ジ−フェニルメチル)スルフィニル]アセトアミドとしても知られる、ラセミ体のモダフィニルが記述されている。
【0003】
米国特許第4,927,855号明細書には、モダフィニルの光学異性体の2つが記述されている。詳細には、当該明細書には、左旋性異性体、並びにアルツハイマー病に関する疾患及び睡眠過剰の治療における、興奮剤又は抗うつ薬としての当該異性体の用途について記述されている。この文書に記述されている(±)モダフィニル酸又は(±)−ベンズヒドリルスルフィニル酢酸から、2つのモダフィニルの光学異性体を調製するプロセスを次の合成図に具体的に示す:
【化1】

【0004】
このプロセスには、光学活性剤であるα−メチルベンジルアミンを用い、ジアステレオマーの形成を介して、第1段階において(±)−モダフィニル酸の光学異性体の分割を実施することが含まれる。
次いで、この(−)−α−メチルベンジルアミン−(−)−ベンズヒドリルスルフィニルアセテートを、酸加水分解により、(−)−ベンズヒドリルスルフィニル酢酸に転換する。ジメチルスルフェートの存在下で、(−)−ベンズヒドリルスルフィニル酢酸をエステル化し、次いでアンモニア(気体)の存在下で、アミドに転換する。それぞれの段階に対応する収率を基礎として計算すると、このプロセスを介して、(±)−モダフィニル酸に関し5.7%の総合的な収率で、モダフィニルの(−)又はl−(左旋性)の異性体を得ることができる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
用語「異性体」は、お互いの鏡像を重ね合わせることができない立体異性体分子について言及するものとする。典型的には、(+)及び(−)、又は(d)及び(l)のいずれかを用いて異性体を表し、この異性体はキラル中心において旋光能を示す。
(D)及び(L)、又は(R)及び(S)のいずれかによっても、立体異性を表すことができ、これらは絶対配置を記述するものである。
以下において、モダフィニルの左旋性異性体をl−又は(−)異性体と、右旋性異性体をd−又は(+)異性体として、区別なく称するつもりである。
【0006】
モダフィニルの光学異性体の異なる結晶形を得ることができる方法を見出した。さらに具体的には、本発明者達は、得られる結晶形が、主に用いる晶出溶媒の性質によって決まることを示した。
本明細書の目的において、用語「結晶形」は、多形体又は溶媒和物のいずれかを区別なく言及するものとする。
「多形体」は、溶質分子のみを含み、そして特有の結晶特性を有する、系統立った構造体を表すものとする。
【0007】
用語「溶媒和物」は、溶質分子及び溶媒分子の両方を含み、特有の結晶特性を有する有機構造体に関するものである。溶媒1分子に対して溶質1分子を有する溶媒和物類を、真の溶媒和物と称する。
さらに、本発明者達は、米国特許第4,177,290号明細書に記述されている条件に従って調製されたl−モダフィニル及びd−モダフィニルが、形態Iとして記述する多形体の一種の形で得られ、その形態が、通常の温度及び圧力状態下で熱力学的に最も安定な多形体に対応することを示した。
形態Iは、下記のX線回折スペクトルを有し、ここでdは格子間間隔を表し、比I/I0は相対強度を表す。
【0008】
【表1】

【0009】
所与の化合物の各結晶形は、一般的に、お互い非常に明確に異なる、物理学的、製薬学的、生理学的、及び生物学的特性を有する。
この関係において、光学活性なモダフィニルの各結晶形(特にこれらの各多形体)が、形態Iと比較して、有利でかつ異なる各特性を有することに関心がある。
他の観点に従い、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する新しいプロセスを見出した。この方法を用いて、米国特許第4,927,855号明細書に記述される収率及び光学純度よりも、明らかに優れた収率及び光学純度で、それぞれの異性体を分割することができる。
特に有利な様式では、優先晶出(製品規模で適用可能である点で有利である)によって(±)−モダフィニル酸の光学活性体の2つを分割するプロセスを作り上げた。
【0010】
(±)−モダフィニル酸を分割する方法には、多くの優位性がある:
− 本方法は、高価なキラル中間体の使用を回避すること(De Min.,M.,Levy,G.and Michwater J.−C.,1988,J.Chem.Phys.85,603−19)、本方法の追加の調製では、10%よりも大幅に少ない損失しか発生しない、
− ジアステレオマー塩の形成を経由する一般的な分割を利用する方法に対し、本方法は異性体2つを直接得ることができること、
− 連続的に母液をリサイクルする結果、収率が理論的に定量的であること、
− 粗異性体結晶の精製が容易であること。
【0011】
従って、本発明は、モダフィニル異性体の結晶形を調製する方法を提供することを目指す。
本発明は、モダフィニルの光学異性体(特にモダフィニルの左旋性異性体)を調製する新しい方法を提供することも目指している。
【課題を解決するための手段】
【0012】
l−モダフィニルの多形体を調製する方法
本発明は、これらの目的及び他の目的を達成する。詳細には、第一の観点において、本発明は、モダフィニルの光学異性体の結晶形を調製する方法に関し、次の各段階:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の1つを溶解させること、
ii)モダフィニルの前記異性体を晶出させること、そして
iii)そのようにして得られたモダフィニルの前記異性体の結晶形を回収すること、
を含む。
【0013】
本発明の目的において、本方法の段階i)で用いる溶媒は(「再晶出溶媒」とも呼ばれる)、モダフィニルの前記光学異性体の晶出をもたらすことができる溶媒であり、大気圧下で晶出をもたらすことができる溶媒であることが好ましい。すなわち、上記溶媒には、少なくとも一つの異性体を伴って所与の圧力において、次のもの:
− 第一温度及び濃度領域において、単相系が、溶媒A中の希釈溶液中に少なくとも一つの異性体を含むこと、
− 第一領域とは同じではない第二温度及び濃度領域において、第二の2相系が、飽和溶液の存在下、前記異性体の結晶を含むこと、
この2領域が、検討圧力において、前記異性体の溶解度曲線T(℃)=f(異性体濃度)によってお互いに分離されていること、
を、形成することができる任意の溶媒Aが含まれる。
【0014】
一般的に、段階ii)内の晶出には、温度及び濃度を変化させることによって、単相系から2相系へ転換させることが含まれる。
本発明に従う再晶出法に好適であることができる溶媒類として非限定的に具体的に説明する目的で、アルコール性溶媒類、カルボン酸エステル溶媒類、エーテル溶媒類、塩素化溶媒類、芳香族溶媒類、及び低級脂肪族ケトン溶媒類に、特に言及することができる。他の溶媒類は、カルボン酸溶媒類、非プロトン性極性溶媒類、脂環式炭化水素類、脂肪族炭化水素類、カーボネート類、ヘテロ芳香族類及び水等である。
【0015】
アルコール溶媒類の中で、メタノール、エタノール、プロパノール、イソプロパノール、ブタノール、イソブタノール、2−メチル−2−ペンタノール、1,2−プロパンジオール、及びt−アミルアルコール等の低級アルキルアルコール類に特に言及することができ、そしてメタノール、プロパノール、及びイソプロパノールが特に好ましい。
カルボン酸エステル型の溶媒類の中で、メチルアセテート、エチルアセテート、n−プロピルアセテート、イソプロピルアセテート、n−ブチルアセテート、及び蟻酸エチルエステル等の蟻酸アルキルエステル類に特に言及することができ、そしてエチルアセテートが特に好ましい。
【0016】
有用なエーテル再晶出溶媒類は、ジエチルエーテル、テトラヒドロフラン(THF)、ジオキサン、ジブチルエーテル、イソプロピルエーテル、t−ブチルメチルエーテル、及びテトラヒドロピランであり、そしてテトラヒドロフランが特に好ましい。
塩素化溶媒類の中で、塩素化炭化水素類、特にクロロホルム、1,2−ジクロロエタン、ジクロロメタン、塩素化芳香族類(クロロベンゼン等)に言及することができる。
芳香族溶媒類の例として、オルト,メタ及びパラキシレン又はオルト,メタ及びパラキシレンの混合物、メトキシベンゼン、ニトロベンゼン、トリフルオロトルエン、及びトルエンに言及することができ、そしてオルト,メタ及びパラキシレンが特に好ましい。
【0017】
有用なケトン溶媒類は、アセトン、メチルエチルケトン、メチルイソブチルケトン、ブタン−2−オン、シクロペンタノン、イソブチルメチルケトン、2−ペンタノン、3−ペンタノン等の溶媒類である。
カルボン酸溶媒の例として、特に酢酸に言及することができる。
ヘテロ芳香族溶媒の例の目的で、特にピリジンに言及することができる。
【0018】
芳香族極性溶媒類の例は、特に、アセトニトリル、プロピオニトリル、4−メチルモルホリン、N、N−ジメチルアセトアミド、ニトロメタン、トリエチルアミン、N−メチル−ピロリドン(NMP)である。
脂肪族炭化水素類の例は、特にヘプタン、2,2,4−トリメチルペンタンである。
脂環式炭化水素類の例は、特にシクロペンタン、シクロヘキサンである。
カーボネート類の例は、特にジメチルカーボネート等のアルキルカーボネート類である。
【0019】
本発明に従う方法の好ましい態様に従い、晶出溶媒類を、アセトン、メタノール、1,4−ジオキサン、エチルアセテート、オルト,メタ,パラキシレンの混合物、イソプロパノール、n−プロパノール、ジメチルカーボネート、テトラヒドロフラン、クロロホルム、及びメチルエチルケトン、水及びアルコール/H2O混合物から選択する。
このように、特定の溶媒中で異性体の再晶出によって、モダフィニルの光学異性体の結晶形を得ることができ、性質そして場合によっては晶出条件によって、主に得ることができる結晶形の種類が決まる。
【0020】
官能基及び電子吸引性置換基又は電子供与性置換基との相互作用を介して、この再晶出溶媒は、所与の晶出条件下で特定の結晶形を生じさせる、一定の分子配列を実際に促進することができる。
一般的に、段階i)で用いられる再晶出溶媒を、モダフィニルの光学異性体が溶媒に完全に溶解するまで、(特に還流下で)加熱する。段階i)におけるモダフィニルの光学異性体の濃度は、晶出には重要な要素ではないが、当該再晶出溶媒中においてモダフィニルの光学異性体の飽和濃度に近い濃度の存在下で、作用させることが好ましい。
【0021】
態様の一つに従って、還流下で溶媒を加熱することで、モダフィニルの光学異性体を溶解させ、次いで飽和に達するように、前記光学異性体の追加量を分画中に添加する。さらに溶媒を添加し、完全な溶解を確保することもできる。
他の態様に従って、モダフィニルの光学異性体を、還流下で加熱する溶媒中で懸濁させ、次いで均一溶液を得るように追加量の溶媒を分画中に添加し、このようにして飽和を達成する。
【0022】
当業者に公知の技法(すなわち、溶液の冷却、一部の溶媒の蒸発、貧溶媒(antisolvent)の添加、又は所望の形態として同一の結晶形を有する光学活性なモダフィニル結晶を用いる溶液のシーディング)を用いて、段階ii)におけるモダフィニルの光学異性体の晶出プロセスを促進させることができる。最も一般的には、均一な懸濁液を得てかつそれぞれの微結晶の周りの母液が速やかに一新するように、この晶出プロセスの全てにおいて、この混合物を連続的に撹拌する。
【0023】
本発明に従うプロセスにおける晶出プロセスを、熱力学的又は動力学的条件の下で実施することができる。
本明細書の目的では、「熱力学条件下での晶出」は、l−又はd−モダフィニルの結晶の存在下で、均一溶液及び飽和溶液間の平衡が維持されている状態の下で実施する晶出を表す。
【0024】
例の目的で、段階i)中で得られる溶液を徐冷することによって(典型的には、溶液を室温まで冷却させるか、又は好ましくは0.75℃/分以下、さらに好ましくは0.6℃/分以下、そしてさらに好ましくは0.5℃/分以下の冷却勾配若しくは冷却速度を適用する)、熱力学的晶出を実施することができる。
本明細書の目的では、「動力学的条件下で実施する晶出」は、d−又はl−モダフィニル結晶の存在下、均一溶液及び飽和溶液間の平衡を、突然、飽和溶液の2相領域の方向(すなわち結晶形成の方向)に移動させる晶出を表す。
【0025】
具体的な説明を目的として、動力学的と称する晶出を、特に急冷(例えば300℃/分の冷却勾配を実施するか、又は段階i)で得られた溶液に貧溶媒を添加することを通して析出させること)によって実施することができる。
具体的かつ非制限的な例の目的として、本明細書中において、徐冷又は急冷によって、これら2種類の熱力学的晶出又は動力学的晶出を実施する。
【0026】
もちろん、動力学的及び/若しくは熱力学的条件を得ることが可能な、溶媒の蒸発又は析出等の任意の他の晶出技法もまた、本発明に従う方法の範囲内に入る。
このように、特定態様に従って、場合によっては所望の結晶形態の種結晶の存在下で、析出によって段階ii)の晶出を実施することができる。
【0027】
本発明者達は、動力学的条件下か又は熱力学的条件下で晶出を実施するのに従って、一部の溶媒が、異なる結晶形類(さらに具体的には、多形体)を生じさせることができることも開示した。
態様によっては、晶出に、段階i)で得られる溶液を冷却することが含まれる場合が、特に有利である。
実用的には、最初の様式において、冷却が急冷であり、一般的に溶液を完全に晶出させるのに充分な時間、氷水浴等の0℃以下の温度の浴中に段階i)で得られた溶液を浸すことで急冷するか、又は−1℃/分〜−5℃/分等の温度勾配で冷却することに該当する。
【0028】
第二態様に従って、徐冷する。このような関係において、一般に、この溶液を、溶液の還流温度から室温まで冷却させるか、又は好ましくは−0.1℃/分〜−0.8℃/分の温度勾配、さらに好ましくは−0.5℃/分に近い温度勾配で、一般的に15℃〜20℃の温度までこの溶液を冷却する。
本発明に従う溶媒/貧溶媒の好ましい組み合わせの中で、特に水/アセトン、アセトニトリル/水、エタノール/水、メタノール/水、酢酸/水の組み合わせに言及する。
【0029】
最後に、ろ過及び遠心分離等の通常の方法を用いて、モダフィニルの光学異性体の結晶形を分離することができる。
非限定的な具体的説明の目的で、モダフィニルの左旋性異性体を用いて、本発明に従う調製プロセスを詳細に実施する。
特定態様に従って、この方法に従って得られる結晶形は、多形体である。
【0030】
この点において、所与化合物の(l)及び(d)のそれぞれの異性体は、一般的に、同一実験条件下で再晶出させる場合に、同一の粉末X線回折スペクトルを有する結晶形(特に多形体)を生ずることに留意することができる。
この点において、J.Bernstein<<Polymorphism in molecular crystals>>2002,University Press,Oxford,UKの著作、及びG.Coquerel,Enantiomer,2000;5(5):481−498、Gordon and Breach Science Publishersの出版物によって、特に参照される。
【0031】
この点において、右旋性形態(結晶形に関するX線回折スペクトルが以下に記述される左旋性形態のスペクトルと同一であり、逆の関係も成立する)は、本発明の一部を形成する。
以下において、形態I,II,III,IV及びVと称する多形体もまた、左旋性異性体から得られるCRL40982の形態I,II,III,IV及びV、並びに右旋性異性体から得られるCRL40983の形態I,II,III,IV及びVに及ぶ。
【0032】
形態I
このような関係において、アセトン、エタノール、1,4−ジオキサン、エチルアセテート、及びオルト,メタ及びパラキシレンの混合物から選択する溶媒と、徐冷による晶出段階とを用いるプロセスとによって、形態IまたはCRL40982の形態Iがもたらされる。
メタノール、水、又はアルコール/水混合物(特に、メタノール/水及びエタノール/水)から選択する溶媒を用いるプロセスと、急冷による晶出の段階とによって、形態I又はCRL40982の形態Iがもたらされる。
本発明の他の同様に好ましい別形に従って、メタノールを用いるプロセスと、メタノールの貧溶媒として冷水の添加を介する析出による晶出の段階とによって、形態Iがもたらされる。
【0033】
形態II
本発明の他の態様に従って、イソプロパノール、エチルアセテート、n−プロパノール,又はトルエン変性エタノールから選択される段階i)の溶媒を用いるプロセスと、急冷による晶出段階とによって、形態II又はCRL40982の形態IIとして記述する多形体がもたらされる。
本方法の別形に従って、イソプロパノールからの急冷によっても、形態IIを得ることができる。
イソプロパノールからの形態IIの生成物が、晶出条件(熱力学的又は動力学的)によって決まらないことも、注釈することができる。
【0034】
形態III
本発明に従うプロセスの他の別形に従って、段階i)で用いる溶媒がアセトンであり、そして晶出段階ii)が急冷を含む場合、形態III又はCRL40982の形態IIIとして記述する結晶形がもたらされることは明らかである。
【0035】
形態IV
本発明に従うプロセスの別形として、段階i)で用いられる溶媒を、テトラヒドロフラン、クロロホルム及びメチルエチルケトンから選択し、そして晶出段階ii)が溶液の徐冷を含む場合、形態IV又はCRL40982の形態IVとして記述する結晶形が、結果的に得られる。
モダフィニルの光学異性体の再晶出プロセスによって、溶媒和物の生成物を生じさせることができ、溶媒和物は用いる溶媒の性質によって決まる。
【0036】
形態V
本発明に従うプロセスの別形として、段階i)で用いられる溶媒を、2−ペンタノン及びテトラヒドロフランから選択し、そして晶出段階ii)が、2−ペンタノン中における徐冷及びTHF中における急冷を含む場合、形態Vとして記述する多形体が、結果的に得られる。
【0037】
ジメチルカーボネート溶媒和物
このように、本発明の特定態様に従って、段階i)の溶媒がジメチルカーボネートであり、そして晶出が徐冷からなる場合、(−)−モダフィニルのジメチルカーボネート溶媒和物が得られる。
【0038】
酢酸溶媒和物
本発明の特定態様に従い、段階i)中の溶媒が酢酸であり、そして晶出が急冷又は徐冷からなる場合、(−)−モダフィニルの酢酸溶媒和物が得られる。
【0039】
(−)−モダフィニルの多形体
本発明は、CRL40982の形態IIとして記述する、モダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔:11.33、8.54、7.57、7.44、4.56、3.78、3.71Åに強度ピークを含むX線回折スペクトルを作り出すことを特徴とし、この強度ピークは8.54、7.57、7.44、4.56、3.78、3.71Åに特に特徴を有する格子間間隔に該当する。
さらに具体的に、以下のX線回折スペクトルを示し、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0040】
【表2】

【0041】
本発明は、CRL40982の形態IIIとして記述するモダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔d:13.40、12.28、8.54、7.32、6.17、5.01、4.10、3.97、3.42、3.20Åに強度ピークを組込むX線回折スペクトルを特徴とし、そして格子間間隔:12.28、8.54、5.01、4.10、3.97、3.42、3.20Åが、もっとも特徴的な強度ピークに該当する。
このような関係において、さらに具体的には、本発明は、(−)−モダフィニルの形態IIIにするものであり、この形態は次のX線回折スペクトルを作り出し、そこでdは格子間間隔を表し、I/I0は相対強度を表す:
【0042】
【表3】

【0043】
本発明は、CRL40982の形態IVとして記述する、モダフィニルの左旋性異性体の多形体にも関するものであり、格子間間隔:12.38、8.58、7.34、6.16、5.00、4.48、4.09、3.66Åに強度ピークを含むX線回折スペクトルを作り出すことを特徴とし、もっとも特徴的なピークは、12.38、8.58、7.34、5.00、4.09Åの格子間間隔に該当する。
さらに具体的には、(−)−モダフィニルの形態IVは、次のX線回折スペクトルを作り出すことを特徴とし、ここでdは格子間間隔を表し、I/I0は格子間間隔における強度ピークを含む相対強度を表す:
【0044】
【表4】

【0045】
本発明は、CRL40983の形態Vと称する、モダフィニルの右旋性異性体の多形体にも関するものであり、格子間間隔:9.63、5.23、5.03、4.74、4.66、4.22、4.10、3.77(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする。
【0046】
【表5】

【0047】
本発明は(−)−モダフィニルのジメチルカーボネート溶媒和物にも関するものであり、次の回折スペクトルを特徴とし、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0048】
【表6】

【0049】
本発明は、本発明に従う再晶出プロセスによって得ることができるモダフィニルの左旋性異性体及び右旋性異性体の酢酸溶媒和物にも関するものであり、格子間間隔:9.45、7.15、5.13、4.15、3.67(Å)における強度ピークを含むX線回折スペクトルを作り出すことを特徴とする。
【0050】
【表7】

【0051】
他の態様に従い、本発明は、モダフィニルの異性体の1つの第一結晶形から、第一結晶形とは異なる第二結晶形へ転化する方法にも関するものであり、前記方法は次の各段階:
i)モダフィニルの前記異性体の結晶形を溶媒中に懸濁すること;
ii)得られた結晶形を回収すること;
を含む。
本方法に好適であることができる溶媒類の目的で、特にアセトニトリルに言及することができる。
【0052】
一般的に、均一化温度より低温において、初期形態の全ての転化をさせるのに充分な時間、初期結晶形を懸濁液中に保持する。特に、溶媒の性質、初期結晶形、及び媒体温度に従ってこの段階を変化させることができる。大気圧下で室温において24時間以上(さらに一般的には約72時間)、結晶形を懸濁液中に保持するのが一般的である。
具体的な説明を目的として、(−)−モダフィニルを用いて本方法を実施する。
【0053】
このような関係において、本発明の特定態様に従い、このプロセスは、段階i)のアセトニトリル中で形態Iを用い、その結果(−)−モダフィニルのアセトニトリル溶媒和物が得られる。
目安の目的で、数日間(好ましくは3日間)、室温で大気圧下、形態Iを懸濁液中で保持する。
本発明は、本発明に従う再晶出プロセスにより得ることができる(−)−モダフィニルのアセトニトリル溶媒和物にも関する。この溶媒和物を、次の回折スペクトルによって特徴付け、ここでdは格子間間隔を表し、I/I0は相対強度を表す:
【0054】
【表8】

【0055】
【表9】

【0056】
(−)−モダフィニル及び(+)−モダフィニルの、それぞれの多形体II,III,IV及びVを含む医薬組成物
本発明はまた、それぞれ、(−)−モダフィニルの多形体であるCRL40982の形態II、CRL40982の形態III、CRL40982の形態IV又はCRL40982の形態V、並びにCRL40983の形態II、CRL40983の形態III、CRL40983の形態IV及びCRL40983の形態Vを含む医薬組成物に関し、あるいは医薬的に許容されるビヒクルに関連する。
これらの組成物を、粘膜(目、鼻、肺、胃、腸、直腸、膣、若しくは尿器官の粘膜等)を介して経口的に投与するか、又は非経口的(皮下、皮内、筋肉内、静脈内、若しくは腹膜内等)に投与することができる。
【0057】
好ましい態様に従い、錠剤、ピル、ゼラチン状カプセル、若しくは即時放出若しくは制御放出の粒剤の形状で、散剤、カプセル剤、溶液の若しくはゲル中の若しくはエマルション中の懸濁剤の形状で、又は冷凍乾燥物として好ましくは錠剤、カプセル剤、溶液中又はゲル中の懸濁剤形状で)、本発明に従う医薬組成物を経口的に投与する。投与するビヒクルは、多形体(油中の多形体の懸濁液等)の安定性を確保する医学的に許容できる一以上の賦形剤を含むことができる。
【0058】
本発明に従う医薬組成物には、それぞれ(−)−モダフィニル及び(+)−モダフィニルの、II,III,IV又はVの多形体が含まれ、場合によってはそれぞれの混合物及び/又は一以上の医薬的に許容できる賦形剤と多形体との混合物として含まれることもある。
経口投与用の固体組成物を、有効成分に一以上の賦形剤を加える(特に充填剤、そして適切な場合には、結合剤、剥離剤(exfoliating agent)、潤滑剤、界面活性剤及び乳化剤、可溶化剤、着色剤、糖代用物又は味覚調整剤、及び錠剤又はカプセル剤等の形にした混合物)ことによって、調製する。
【0059】
充填剤の例には、ラクトース、スクロース、マンニトール又はソルビトール;トウモロコシでんぷん、米でんぷん、ジャガイモでんぷん等のセルロースに基づく調製品が含まれる。
結合剤の例には、ゼラチン、ガム、トラガカントガム、メチルセルロース、ヒドロキシプロピルセルロース、ソジウムカルボキシメチルセルロース、及び/又はポリビニルピロリドン(PVP)、ポビドン、コポビドン、デキストラン、デキストリン、シクロデキストリン及びヒドロキシプロピル−β−シクロデキストリン等のその誘導体が含まれる。
【0060】
糖代替物の例には、アスパルテーム、サッカリン及びソジウムシクラメートが含まれる。
味覚調整剤の例には、ココア粉末、植物形態中のミント、芳香性粉末、油形態中のミント、ボルネオール、及びシナモン粉末が含まれる。
表面調整剤及び乳化剤の例には、特にポリソルベート20,60,80、sucroester(7−11−15)、poloxamer188,407、PEF300,400、及びソルビタンステアレートが含まれる。
【0061】
可溶化剤の例には、miglyol810,812、グリセリド類及びそれらの誘導体、並びにプロピレングリコールが含まれる。
剥離剤の例には、ポリビニルピロリドン、ソジウムカルメロース、又はアルギン酸若しくはアルギン酸ナトリウム等の塩が含まれる。
潤滑剤の例には、ステアリン酸マグネシウム、ステアリルマグネシウムフマレート、ベヘン酸及びその誘導体類が含まれる。
【0062】
本発明に従う医療組成物は、(−)−モダフィニル又は(+)−モダフィニルのそれぞれの他の結晶形(特に、形態III、形態II、形態IV及び形態V等の一つ以上のモダフィニルの多形体との混合物等の他の有効成分若しくは非有効成分並びに/又は形態I)を含むことができる。
本発明の目的において、用語「医学的に許容できるビヒクル」は、溶媒、分散媒、抗真菌剤及び抗菌剤、等張剤及び吸収遅延剤に及ぶ。医薬的な有効物質に関して、そのような媒体及び薬剤の使用は、当業者に公知である。
【0063】
本発明はまた、睡眠過剰(特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰);睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作;傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害(特にシュタイネルト病に関連する覚醒障害)、多動性障害(ADHD)等に関連する注意障害;疲労状態(特に多発性障害及び他の変性疾患に関する疲労状態);日光暴露の少なさ、統合失調症、交代性労働、タイム・シフトに関連するうつ状態、うつ病;摂食障害から選択する状態の、予防及び/又は治療を目的とする薬物(ここで、モダフィニルは食欲刺激剤、低用量の認知機能刺激剤として作用する)を製造するため、それぞれ、(−)−モダフィニルのCRL40982の形態II、CRL40982の形態III、CRL40982の形態IV又はCRL40982の形態Vの各形態、及び(+)−モダフィニルのCRL40983の形態II、CRL40983の形態III、CRL40983の形態IV又はCRL40983の形態Vの各形態の使用に関する。
【0064】
光学活性モダフィニルを調製する方法
他の観点に従って、本発明は、(±)−モダフィニル酸からモダフィニルの光学異性体を調製する方法に関し、前記方法は次の各段階を含む:
i)(±)−モダフィニル酸の2つの光学異性体を分割し、そして少なくとも
1つの異性体を回収すること、
ii)塩基の存在下で、得られた2つの異性体のうち1つを低級アルキルハロホルメート及びアルコールと接触させて置くこと、
iii)得られた生成物を回収すること、
iv)段階iii)で得られたエステルをアミドに転換すること、
v)段階iv)で得られた生成物を回収すること。
【0065】
好ましくは、この低級アルキルハロホルメートは低級アルキルクロロホルメートであり、そしてさらに好ましくは、低級アルキルハロホルメートにメチルクロロホルメートが含まれる。
モダフィニル酸のエステル化をもたらすこのプロセス中で用いる低級アルキルハロホルメート(中でも、特にメチルクロロホルメート)は、従来技術である米国特許第4,927,855号明細書に記載されているジメチルスルフェートより毒性が少ない点が有利であり、同等以上の収率が与えられる。従って、この方法は、簡潔に用いられ、工業用途においてさらに好適である。
【0066】
光学活性モダフィニル酸に関して、段階ii)中の低級アルキルホルメート及び塩基の等モル量の存在下で、この操作を実施することが好ましい。
有機塩基の使用が、特に好ましく、窒素含有塩基類の使用がさらに好ましい。
【0067】
特に好ましい塩基として、トリエチルアミン、ジイソプロピルアミン、ジエチルメチルアミン、ジイソプロピルエチルアミン、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(DBU)に、特に言及することができる。
段階ii)中で用いる溶媒は、メタノール、エタノール又はプロパノール等の低級脂肪族アルコールであることが好ましく、メタノールが特に好ましい。
特別な態様に従い、段階ii)から得られるエステルを、氷水の添加によって晶出させる。
【0068】
段階iv)中のエステルからアミドへの転化は、アンモノリシス(すなわちアンモニア処理)からなることが好ましい。
このような関係では、一般的に、過剰のアンモニアを用いて処理することが好ましい。
本発明の特に有利な別形に従い、気体状でアンモニアを用いる。
【0069】
態様によっては、極性溶媒中、低級脂肪族アルコール類のようなプロトン性溶媒(メタノール又はエタノール等)中で、このアンモノリシス反応を実施することが好ましく、メタノールが特に好ましい。
段階iii)中の(+)又は(−)モダフィニル酸エステル、及び段階iv)中の(+)又は(−)モダフィニルを、それぞれ当業者に公知の通常の方法を用いて回収する。
【0070】
他の観点に従って、本発明は、以下の各段階:
a.優先晶出法に従い、(±)−モダフィニル酸又はその塩類の光学異性体の2つを分割すること、
b.前記分割された異性体をアミドに転換すること、
c.得られたモダフィニル異性体を回収すること、
を含む、モダフィニルの光学異性体を調製する方法に関する。
好ましい態様に従って、段階b)を次の2段階:
b1)前記異性体を低級アルキルエステルに転換すること、
b2)段階b1)で得られた生成物をアミドに転換すること、
で実施する。
【0071】
態様に従って、上述の条件の下、段階b1)を、低級アルキルハロホルメート、アルコールおよび塩基の存在下で実施することが特に好ましい。
特に有利な態様に従って、クロロ蟻酸メチルエステル、塩基及びアルコールの存在下でb1)を実施し、そしてc1)が上述のようなアンモノリシスを含む場合、この方法((±)−モダフィニル酸を、優先晶出によって分割する)によって、一般的に25%オーダーの総合的な収率が生じる。このように、特にこの方法によって得られる(−)−モダフィニルの異性体の収率は、米国特許第4,927,855号明細書中で得られる収率よりも顕著に高い。
【0072】
好ましい晶出技法は、実験室及び当産業で広く用いられる技法である。
この方法は、R及びSと称する2つのキラル化合物の交互の晶出に基づき、溶媒A中で、そして所与の温度範囲DTにわたり、ラセミ混合物を形成する。これは、この温度範囲内で、溶液と熱力学的平衡にある2つの鏡像体の任意の混合物が、2つの結晶(それぞれの結晶が同一の配置を有する分子のみを含み、この配置は溶媒分子を含んでも(溶媒和物)、含まなくてもよい)を含むことを意味する。以下において、少なくとも温度範囲DTの間でかつ溶媒Aの場合、固体状態内の混和性がないようなラセミ混合物の存在が、確実に認められる。
【0073】
2種のファクターが、光学的鏡像体の晶出に影響を及ぼし、一方は3成分の異種平衡に関連するパラメーターであり、そして他方は晶出の動力学に影響を与えるファクターである。
3成分の異種平衡に関連するパラメーターは:
− それぞれの温度で沈殿する固体種に関する晶出曲面のポジション、並びに具体的には温度に関連するラセミ体s(±)及びその鏡像体s(+)=s(−)の安定相及び準安定相の溶解性、並びに溶解度比α=s(±)/s(+)、
− 固溶体、ラセミ化合物、ラセミ体の溶媒和物、活性な溶媒和物、及び晶出した固体の多形体の種類に関する安定領域及び準安定領域の範囲、
を含む。
【0074】
晶出の動力学に影響を与えるファクターは:
− 実験者によって修正変更することはできない、分子相互間の結合に関連する結晶内部のファクター類、
− 実験者によって修正変更できる外部ファクター類;これらは、溶媒の性質、不純物の性質及び濃度、時間に関連して得る過飽和、温度範囲DT、撹拌の速度及び様式、結晶核の質量及び粒径、壁の効果等である、
を含む。
【0075】
これら2種のファクターは、得られる相の純度、収率、及び分割操作の処理に直接影響を与える。ろ過の成否はまた、粒径スペクトル及び晶癖、懸濁液の粘度、溶媒の蒸気圧、それぞれの鏡像体の過飽和並びに準安定性の真のラセミ化合物の存在可能性によって決まる。これらの選択によって、鏡像体のラセミ化又は分子の分解の動力学にも影響が与えられる。
一対の鏡像体(R及びS)及び溶媒(A)を含むそれぞれの配合物において、動力学に影響を与えるファクターは特定の種類である。
【0076】
2種の好ましい晶出法を:
− 「シード化等温優先晶出法(Seeded Isothermal Preferential Crystallization)」に対しSIPCとして記述される一般的な方法、及びそれらの多温の別形、そして
− 「自動シード化多温プログラム化優先晶出法(Auto−Seeded Polythermic Programmed Preferential Crystallization)」に対しAS3PCと称する方法、
に主に分類する。
【0077】
AS3PC優先晶出法(自動シード化と称する)では、所望の異性体を生成するように、系そのものが系そのものの種結晶を生成するような条件下にこの系を置く。一方、SIPC法では、シーディングによってこれらの種結晶を導入する。この2種の方法を、以下でさらに詳述する。
AS3PC法を用いる優先晶出による分割法に関連するさらなる情報では、特に、G.Coquerel,M.−N.Petit及びR.Bouazizが著者の、ヨーロッパ特許明細書第0720595B1号明細書(1996年)、E.Ndzie,P.Cardinael,A.−R.Schoofs及びG.Coquerelが著者の、テトラヒドロンアシンメトリー、1997年、第8巻、第17号、2913〜2920ページ(Tetrahedron Asymmetry, 1997,8(17),2913−2920)、L.Courvoisier,E.Ndzie,M.−N.Petit,U.Hedtmann,U.Sprengard及びG.Coquerelが著者の、ケミストリーレターズ、2001年、第4巻、364〜365ページ(Chemistry Letters,2001,4,364−365)に、特に言及することができる。
【0078】
特定の態様に従って、(±)−モダフィニル酸又はそれらの塩類の光学異性体を分割する方法は、シード化SIPC又はS3PC法であり、前記方法は次の各段階を含む:
a)温度TDにおいて、モダフィニル酸の第一異性体のラセミ混合物の形のラセミ体の結晶を含む配合物を均一化すること、ここで規定ポイントE(濃度及び温度TDの変数によって規定する)は希釈溶液の単相領域内に存在する、
b)段階a)において調製された溶液を、初めの温度TDから温度TFまで急冷させること、
c)冷却の間(例えば、TL〜TF)又は冷却が完了するときに(例えば、TF)、第一異性体の純粋な種結晶を用いて、段階b)で得られる溶液をシーディングさせること、
d)第一異性体の結晶を集めること、
e)段階d)内で実施する収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして温度TDまで加熱することによって新配合物を均一化すること、それにより、規定ポイントE’は溶媒、鏡像体(−)、鏡像体(+)系のラセミ体の平面に関してEと対称になり、前記ポイントE’は希釈溶液の単相領域内に存在する、
f)段階e)において調製された溶液を、初めの温度TDから温度TFまで急冷させること、
g)第二異性体の純粋な種結晶を用いて、段階f)で得られた溶液をシーディングすること、
h)第二異性体の結晶を集めること、
i)段階h)内で作成された結晶収集に由来する結晶の母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして初期規定ポイントEを有する配合物の組成と同一の組成を得るため、温度TDまで加熱することによって新配合物を均一化すること、
j)次いで、第一及び第二の2つの異性体を得るために、各段階a),b),c),d),e),f),h)及びj)を繰り返すこと。
【0079】
それぞれ、「SIPC」及び「S3PC」と記述することによって、これら2種の方法にしばしば言及する。そしてS3PC法は、明細書中でさらに詳細に記述するように、SIPCの別形である。
以下では、本発明の目的において、
− TFは、晶出の終わり及びろ過における温度を表し、3相領域にあり、
− TLは、ラセミ体の均一化温度を表し、
− TDは、始動混合物が均一溶液である始動温度を表し、
− 鏡像体は、異性体を表す。
【0080】
優先晶出によって、(±)−モダフィニル酸又はこれらの塩の、これら2つの光学異性体を分割する方法は、AS3PC自己シード化法が好ましく、前記方法は次の各段階を含む:
a)モダフィニル酸の第一異性体のラセミ混合物の形のラセミ体結晶及び溶媒を含む配合物を作り出すこと、ここで規定ポイントE(濃度及び温度TBの変数によって規定する)は、過剰の異性体の2相領域内に存在し、かつ飽和溶液と平衡にある、
b)段階a)で調製する2相混合物に、温度冷却プログラミング関数を適用すること、このプログラミング関数は、溶液中に存在する第二異性体の自発的な核形成を防止しながら、母液がわずかに過飽和のままであり、結晶の形で存在する異性体の成長を促進する、
c)段階b)の結晶成長時間中の全ての時間にわたって、時間に関してわずかに増していく撹拌速度を採用すること、ここで、全ての時間において、その撹拌速度が、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、第一異性体の成長を促進するためには充分に遅いが、均一な懸濁液を得て、そして第一異性体のそれぞれの微結晶周りの母液の一新をはかるためには充分に速い、
d)第一異性体の結晶を集めること
e)段階d)で実施された収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、そして規定ポイントE’が、溶媒、鏡像体(−)、鏡像体(+)系に関するラセミ体の平面に関してEと対称であり、前記ポイントE’が、第二異性体(過剰で、かつ飽和溶液と平衡に有る)の2相領域内に存在するように、熱力学的平衡を達成するのに必要な時間、新配合物を温度しきい値TBまで導くこと、
f)溶液内に存在する第一異性体の自発的な結晶核形成を防止しながら、結晶の形で存在する異性体の成長を促進するため、晶出中に母液がわずかに過飽和のままであるように、第二異性体を含む段階e)で調製された2相混合物に、段階b)と同じ冷却プログラミング関数を適用すること、
g)段階f)の結晶成長の全時間に渡って、時間に関してわずかに増加する撹拌速度を採用すること、ここで、全ての時間において、制御されない結晶核形成を生じさせる過度に大きな剪断力の生成を回避しながら、第二異性体の成長を促進するためには充分遅く、しかし均一な懸濁液を得て、そして第二異性体のそれぞれの微結晶周りの母液の一新をはかるのには充分速くなる、
h)第二異性体の結晶を集めること、
i)組成が初期配合物Eの組成と同じである配合物を得るため、段階g)で実施した結晶の収集に由来する母液に、ラセミ混合物の形のラセミ体の結晶を添加すること、
j)2つの異性体の第一体、次いで第二体を連続的に得るため、a),b),c),d),e),f),g),h)及びi)の各段階を繰り返すこと。
【0081】
以下では、本発明の目的において、THOMOは、ラセミ体、第一異性体及び溶媒を含む配合物の均一化温度を表す。
【0082】
このように、本発明に従うプロセスの段階a)において、1種以上の溶媒及び作用温度範囲の選択を、下記要件:
− ラセミ混合物を形成し、かつ任意のラセミ化合物が作用温度範囲で準安定である鏡像体であること、
− 充分に濃縮されるが、低粘度及び低蒸気圧である溶液であること、
− 加溶媒分解及びラセミ化がないこと、
− 溶媒和物が平衡状態で存在し、かつ分割可能な異性体の種類である場合に、溶媒和物に安定性があること、
を同時に満たすような様式で規定する。
【0083】
本発明に従うプロセスの段階a)及び段階b)において、初期懸濁液中に存在する多量のラセミ体の均一化に関して、温度TBが温度TLより高く、過剰の異性体に関するTHOMOの変化と、ラセミ体XLの一定濃度とに関する曲線から前記温度TBを規定し、ここで、段階a)及び段階i)に由来する第一異性体並びに段階e)に由来する第二異性体の純粋結晶の質量が(それらの飽和溶液との平衡内において)、期待される収集物の、多くても50%、好ましくは25〜40%で存在する。
【0084】
本発明に従う方法の段階b)及び段階f)において、温度TB〜TFに冷却するプログラミング関数(実験用アセンブリに適している)を、下記の通りに規定する:
− それぞれのサイクルのはじめにおいて、結晶の形で存在する異性体の晶出時間の全てにおいて、わずかな過飽和を達成し、このわずかな過飽和によって、穏やかな成長及び第二核形成を起こさせること、
− 最初に核を形成することなく、TFにおいて他の異性体の過飽和の上限を達成させること、
− ラセミ体の添加の後に、段階d)及び段階h)において結晶収集物を得ること、そして段階e)及び段階i)において再補給することによって、サイクル操作の実施を可能とすること。
【0085】
実は、全ての実験用アセンブリは、用いる混合物の過飽和キャパシティー及び撹拌効率に影響力を有するので、冷却プログラミング関数を、この方法を実施する状況に適合させなければならない。しかし、温度TB、温度に関連するラセミ体の溶解性、及びラセミ体XLの一定濃度に関する過剰の異性体に関連するTHOMO曲線は、それら自体、実験用アセンブリとは完全に無関係である。
【0086】
初期の過剰の異性体の2倍の収集を可能にしながら、最初に核を形成することなく安定な飽和溶液を得るために、この冷却プログラミング関数(温度と時間を関連付ける関数)は、TL〜TFの部分を濃度XLの溶液をTL+1℃からTFへ冷却すること(TFはTL−(THOMO−TL)より低い)によって定められ、そして前記冷却プログラミング関数は、TB〜TLの部分をTL+1℃〜TFで設定するように同一関数を外挿することによって定められている。
【0087】
(±)−モダフィニル酸又はその塩類の好ましい晶出プロセスは、次の有利な特徴:
− 段階a)及び段階i)において、飽和溶液と平衡にある第一異性体の純粋結晶の質量が、期待される収集量の約25%〜40%になり、50%が上限になること、
− 段階e)において、飽和溶液と平衡にある第二異性体の純粋結晶の質量が、期待される収集量の約25%〜40%になり、50%が上限になること、
− 段階b)及び段階f)において、第一異性体及び第二異性体の析出に付随する熱放出を、温度プログラミング関数に組込むこと、
− 段階e)及び段階i)において、補助的な溶媒を添加すること、
− 段階a),段階e)及び段階i)において、添加する前に、添加されるラセミ混合物の形のラセミ体の純粋な結晶を、溶解段階を促進する前処理(粉砕及び分級、超音波処理、又は部分的な凍結乾燥等)にかけ;これらの処理はまた、結晶生成のため大きな表面積を生成することができる微細結晶を用意するためである、
− 分割を含む段階a),段階e)及び段階i)において、段階c)及び段階g)と比較して、撹拌速度が速いこと、
を、単独又は組み合わせで有する。
【0088】
AS3PC法を実施するために必要な異種平衡データに加え、これらの各操作はまた、可調の動力学的制約(特に、冷却関数)に従い、そしてこれらの制約類はそれぞれの溶媒/異性体の組み合わせに特有なものである。
一態様に従い、SIPC法、S3PC法又はAS3PC法の、段階a)中で用いる溶媒は、無水又は変性エタノール、場合によっては有機若しくは無機塩基との混合物中のエタノール、又はエタノール中のラセミ体の溶解性を向上することができる1種以上の溶媒との混合物中のエタノールである。
【0089】
別形として、SIPC法、S3PC法又はAS3PC法の段階a)中で用いる溶媒は、2−メトキシエタノール又はメタノール、場合によっては有機若しくは無機塩基と混合物中の2−メトキシエタノール又はメタノール、及び/又はエタノール中のラセミ体の溶解性を向上することができる1種以上の溶媒と混合した2−メトキシエタノール又はメタノールである。
特に有利な態様において、SIPC法、S3PC法又はAS3PC法の段階a)中で用いる溶媒は、エタノール、2−メトキシエタノール又はメタノールである。(±)−モダフィニル酸において、ろ過温度TFは、好ましくは0℃〜40℃に存在する。
【0090】
エタノールの場合において、温度TFは、好ましくは0℃〜25℃に存在し、18℃又は17℃に近いことがさらに良い。
2−メトキシエタノール又はメタノールの場合では、温度TFは、好ましくは20℃〜35℃で存在し、そして特に30℃に近い。
好ましくは、段階a)中のラセミ混合物の濃度は、2〜50質量%、さらに好ましくは2〜30質量%、そしていっそう好ましくは、エタノールの場合、5.96質量%、2−メトキシエタノールの場合、15.99質量%、メタノールの場合、25.70質量%に近い。
【0091】
このような関係において、段階a)中の異性体は、1〜50質量%、さらに好ましくは1〜20質量%、そしていっそう好ましくは、エタノールでは11質量%、2−メトキシエタノールでは8質量%、メタノールでは10%に近いことがもっとも好ましい。
SIPC及びS3PCにおいて、温度TD(始動混合物が均一溶液である温度)は、濃度によって決まり、そして溶媒が還流下にある場合には、一般的に35°〜50℃に存在する。温度TD〜TFへの冷却は、単相領域内のままでいるように非常に早く、そして好ましくは20分以内に、例えば急冷によって実施される。
【0092】
AS3PC法の好ましい態様に従い、温度TBは、温度TL〜温度THOMOに存在する。温度TBは、特に25℃〜50℃に存在することができる。
例の目的であるが、エタノールの場合、過剰の異性体が11質量%に近いとき、TBは好ましくは25℃〜40℃、特に30.1℃〜36.2℃、そしてさらに好ましくは33.5℃又は31.5℃の近くに存在する。
【0093】
2−メトキシエタノールの場合、過剰の異性体が8質量%に近いとき、TBは好ましくは35℃〜50℃、特に39.1℃〜47.9℃、そしてさらに好ましくは41℃の近くに存在する。
メタノールの場合、過剰の異性体が10質量%に近いとき、TBは好ましくは40℃〜55℃、特に45.1℃〜53.9℃、そしてさらに好ましくは46.5℃の近くに存在する。
【0094】
大きくするために集めた所望の異性体結晶の平均質量に対して充分に長いが、他の異性体が晶出することを防ぐためには充分に短い時間内で、段階b)内のTB〜TFへの冷却を実施することがもっとも好ましく、このようにして高い光学純度(特に85%より大きい純度)を得る。ろ過の正確な時機を決定するため、一般に偏光計を用いて、冷却を監視する。冷却を50〜70分間行うことが好ましく、エタノール溶媒を用いる場合には60分間かけることがさらに好ましい。
【0095】
同様に、SIPC法、AS3PC法及びS3PC法に関する温度TFにおける平坦域の長さは、集められる所望の異性体結晶の大きな質量を可能にするのに充分に長いが、所望の異性体のように、他の異性体が同時に晶出することを防ぐようにあまり長すぎないことが好ましく、そのようにして高い光学純度を得る。
好ましい態様に従って、TFの温度平坦域長は、15〜60分間存在し、約60分間存在することが好ましい。
【0096】
当業者は、SIPC法、AS3PC法及びS3PC法で用いる反応容器のタイプに撹拌速度を調節することができるであろう。表示の目的ではあるが、2リットル又は10リットルの反応容器において、媒体を撹拌する速度を150〜250rpmに保つことができる。
特に有用な様式において、これらの優先晶出法によって、光学分割剤を用いて得られる収率より非常に高い収率で、モダフィニルの光学異性体(特に、左旋性異性体)を分割することが可能である。得られる収率は、(+)若しくは(−)の光学異性体に対し、一般的に90%以上のオーダーであるか、又はラセミ体に対し、45%以上のオーダーである。
【0097】
AS3PC法、SIPC法、又はS3PC法
上述のAS3PC法及びSIPC法を、下記に記述する。
3成分の異種平衡:R鏡像体及びS鏡像体、並びに溶媒A
例えば、J.E.Ricciによる著作(Ed.Dover Publication Inc.New York,1966,The Phase Rule and Heterogeneous Equilibrium)によって、3成分系の異種平衡の一般的なケースが論じられている。以下の記述を、3成分系、A(キラル溶媒)、R及びS(用いる温度領域内で、ラセミ化できない異性体)の特定観点に限定する。これらの観点は、様々な優先晶出法の理解に必要となる。
【0098】
溶媒の特別な役割を示すため、濃度平面に対して軸垂線上に温度をプロットした直角二等辺三角形の断面を有する直角柱によって、この3成分系を表すことができる。
【0099】
2つの異性体に関する熱力学変数:非キラル溶媒中の溶解性、Tf、ΔHf等が同一であるという事実は、領域表示が、図1中でA−TS−Tの垂直面(光学不活性な混合物を含む)に関して対称であるという結論を有することとなる。この系の初期の記述を支援するために、次の簡略化を行う:
− 所与の配合中で、晶出物が純粋成分である唯一の相であること(鏡像体の場合、ラセミ化合物、溶媒和物、及び多形体がないこと)、
− 固体状態において、独立成分相互間の混和性がゼロであること、
− この溶媒が、鏡像体の融点よりもかなり低い融点を有すること、
− 用いる温度範囲において、鏡像体の溶解性が、溶液中の他の存在によって影響を受けず(Meyerhofferの法則を守る)、溶解性は、α=2の値を有する比で表せること。
【0100】
温度の関数としての3成分平衡の表示
図1は、次の相の領域を示す:
− 希釈溶液(φ=1)における単相領域、
− 2相領域(φ=2)の境界を示す成分における2つの晶出曲面。
溶媒の析出に関する曲面をA付近に制限する。というのは上述の条件に従って、溶媒成分の融点は、他の成分の融点よりもかなり低いからである。
− 2成分の共晶点から生ずる、3種の単変式曲線(φ=3)又は共晶谷形状、
− 3成分が晶出する、Tε(φ=4)における3成分共晶不変点。
【0101】
図2は、TD及びTFにおける図1中に表示する3成分の2種の等温断面を、重ね合わせ様式で示す。それぞれの温度において、この断面は、以下の表に詳述するような4つの領域からなる。
【0102】
【表10】

【0103】
等値断面RYT
図3は、熱力学的にある程度の平衡にある3成分溶液の冷却によって、晶出の理解に対する基本となる等温断面R−Y−Tを示し、この断面は、SIPC、別形及びAS3PCの次の非平衡法にも必要である。この平面は、以下の関係を満たす点の幾何学的な軌跡である:
XA/XS=(1−Y)/Y=一定、そしてXA及びXSには、溶媒及び鏡像体Sの質量による比率をあてる。
【0104】
図3において、以下の点が分かる:
− 3成分溶液の単相領域、
− 鏡像体Rに関する溶液線、この曲線は、図2中でR−Y平面と、鏡像体Rの組成に関する晶出曲面との交差を表している。この安定平衡曲線は、鏡像体Rの融点(示されていない)で生じ、そしてポイントL(ラセミ混合物に関する3成分共晶谷形状の一部を形成する)によって低温面との境界が示されている。この後者の曲線及びTLにおける円錐に似た形の線(TLにおける水平線分)が、R体結晶を加えた飽和溶液の2相領域の境界である。曲線は、準安定性である同じ鏡像体Rに対する溶解性曲線を通って、下にある3相領域へと伸びる(破線)。
− 3相領域:飽和溶液を加えたR体結晶及びS体結晶。この領域は、頂部がRに関する円錐に似た形の水平線によって、そして底部が3成分共晶不変平面によって、左側が鏡像体Sに関連する円錐に似た形状の一本の線Lmによって境界を示されている。
− 頂部において2相領域(飽和溶液+S体鏡像体)との境界を示す、鏡像体Sに関する晶出曲面の線KL。この領域は、Sに関する2つの円錐に似た形の線:gm及びLmによって低い部分との境界を示している。R2に対する準安定溶解性曲線に関するSに対する円錐に似た形の第2線Lm(ELの延長)の位置を、溶解度比αに関するF1及びFの近い位置に関して、以下で論じるつもりである、
− 3種の晶出された成分A,R及びSが存在する、温度Tεにおける3成分不変点。
【0105】
冷却及びわずかに過剰の異性体を有する3成分溶液の熱力学的なある程度の平衡を伴った変化
以下において、この系に関する全体的なポイント(すなわち、混合物の全体的な組成を表すポイント)は、図2及び図3中のポイントEを通る垂直線上に存在することを要し、その正確なポイントは温度(又は水準)によって規定される。次の温度範囲のみを考慮に入れる:
− TD:初期混合物が均一溶液である温度、そして
− TF:晶出の終わり及びろ過における温度、ここで、この温度は3相領域内に存在する。
【0106】
この全体的な組成物Eは、総質量Mtを形成する鏡像体Rの質量Mによって、わずかに濃厚にされているラセミ体溶液に対応する(過剰の異性体R−S/R+Sは、一般的に4%〜9%で存在する)。混合物を規定する全体的なポイントEが、一又は複数の相が平衡で存在する領域に到達すると、非常にゆっくりとした冷却及び一又は複数の固相のシーディングによって、平衡状態を得る。
【0107】
初期温度TDにおいて溶液は均一である。連続冷却時に、次のものを得る:
− THOMO〜TLにおける鏡像体R単体の晶出、同時に溶液ポイントが、鏡像体Rに関する溶解度曲線上を移動(等値断面R−Y内のTHOMO水準のポイントEからポイントLへ)する。ポイントLにおいて、飽和溶液と平衡にある鏡像体Rの質量Mは、Mt(XE−XL/1−XL)=Mによって与えられ、初期溶液(図3)中に存在する過剰の異性体に該当し、ポイントL,E,及びRの横軸は、組成,及び1に該当する(図3)。
− TLから、この溶液ポイントは、図2に示されるラセミ体組成溶液を含む一定勾配の線に沿って、LからIFへ移動し、そして図3中の等値断面R−Yを通り過ぎ、次いでR体結晶及びS体結晶を、同時にかつ等量析出する。
平衡状態下において、TL未満の温度で分割を実施することはできない。
【0108】
SIPCプロセスに従う一般的な制御により分割する場合の溶液の変化
過剰の第一鏡像体の晶出
前述の溶液Eを、温度TDで均一化する(図4及び図5)。溶液Eを過飽和にするため、晶出を一切生じさせずに温度TFまで急冷させる。次いで、熱力学的平衡にないこの溶液を、過剰の鏡像体と同一のキラリティーを有する非常に純粋な鏡像体Rの種結晶を用いてシード化する。鏡像体Rの等温晶出を設定し、そして溶液を表示するポイントが断面R−Y−T内を、Eから水準TF(ろ過を早急に実施するFと、第一の同一延長上にある)まで移動する。回収する鏡像体Rの質量は、2M又はさらにMt(XE−XF/1−XF)に等しい。
【0109】
第二鏡像体の晶出、操作のサイクル
このように、上記基本操作により、鏡像体Sに富む溶液Fが生じる。質量2Mのラセミ体(回収した鏡像体質量に等しい)を添加すること、及びこの混合物を温度TDまで加熱することによって、垂直面A−(RS)−Tに関してEに対称な、均一溶液E’を得る。質量2Mの鏡像体Sを得ることができるこのプロセスを、それ自体、この中央平面に関連する上記の対称移動によって表すこともできる。そして、次の操作:
− 温度TDで均一な溶液E’を、第一にTFまで冷却すること、そして、
− 鏡像体Sの非常に純粋な種結晶を用いてシード化し、この鏡像体の成長によって、水平線分E’F’(水準TFにおいて)上の溶液を表すポイントを移動させること、
− 溶液ポイントがF’と同一である場合、この溶液をろ過し、そして質量2Mの鏡像体Sを与えること、
− 質量2Mのラセミ体をさらに添加し、さらにTDまで加熱した後、均一溶液を再度得ること、そしてその表示ポイントは、水準TDにおける初期ポイントEと同一であること、
− このプロセスの残部として、この操作サイクルを単に繰り返すこと、
を順に実施する。
【0110】
SIPC法の別形
各文献(Amiard,G.,1956,Bull.Soc.Chim.Fr.447,Collet,A.,Brienne,M.J.,Jacques,J.,1980,Chemical reviews 80,3,215−30,Noguchi Institute,1968,patent GB 1 197 809)は、上記の一般的なスキームに基づく;この文献中に明白である主な変形点を以下のように分類する:
a)過剰の鏡像体の最初の自発的な核形成、
(±)−トレオニンを分割する場合(Amiard,G.,1956,Bull.Soc.Chim.Fr.447)、過剰の鏡像体の最初の核形成が、過飽和の均一溶液中で自発的に起きる。全体の組成を表すポイントEが3相領域内に存在し、かつこの溶液を撹拌しない場合に、最初の核形成が起きる(Collet,A.,Brienne,M.J.,Jacques,J.,1980,Chemical reviews 80,3,215−30)。
b)冷却中のシーディング(S3PC)、
このプロトコルは、このプロセスがSIPCとは異なる場合に、文献(Noguchi Institute,1968,patent GB 1 197 809)中に最もよく見出されるプロセスの1種である。引用する手順相互間に違いがあるものの、それでも次の一般的なブロードラインを認識することができる:
− TDから、TL未満だがTFより高い温度まで均一溶液を冷却すること、
− 過剰の鏡像体と同一のキラリティーの種結晶を用いて3相領域に存在する過飽和均一溶液をシーディングすること、
− TFまで冷却すること。一部の場合では、正確な温度プログラミングにより、後者の段階を制御する(Noguchi Institute、1968、patent GB 1 197 809)。
【0111】
これらのプロトコルを、合わせて「シード化多温プログラム化優先晶出法(Seeded polythermic programmed preferential crystallization)」に対する「S3PC」と同一用語の下に分類することができる。しかし、温度プログラミングは存在しないか、又は冷却の第2段階に限定される。
【0112】
本発明に従うAS3PC法に関連する、プログラム制御及び自己シード化により分割する場合の溶液ポイントの変化
一般的な方法及びAS3PC法間のより良い比較を達成するために、前記の場合と同一になるように、図6及び図7内で、初期ポイントEを任意に選択する;しかし、次の例で明らかにするAS3PC法によって、平面A−(RS)−Tからさらに離れ、そして大過剰の異性体を伴うポイントEを選択することと、このように、それぞれの操作において結晶収集量を向上させることとが可能となる。
【0113】
過剰の第一鏡像体の晶出
このプロセスの最初において、そして一般的なプロトコルに反して、全体(溶液を加えた結晶)を、均一ではないが温度TBまで昇温させる。次いで、この初期溶液は、過剰の異性体結晶と平衡状態になる(例えば、図7中のR)。それゆえ、溶液(SE)及び全体(E)を表す各ポイントは、本プロセスの最初から同一ではない。この2相混合物は、種結晶の添加なしで温度低下関数のプログラムに従う。溶液を表すポイントによって、冷却の動力学によって決定する曲線SEF(平面R−Y−T内に含まれる)が記述される(図7)。正確に調節した動力学を用いると、過剰の異性体結晶の成長が最初に生じ、その後、晶出は、第二核形成を加えた成長の同時支配の方向に進んでいく。溶液を表すポイントがポイントFに到達した場合、ろ過を実施し、2Mの質量の鏡像体Rの結晶を回収する。
【0114】
第二鏡像体の晶出、操作のサイクル性
質量2Mのラセミ体を添加することと、温度TBまで加熱することとによって、ポイントF(上記母液に対応する)からポイントE’(垂直面A−(RS)−Tに関して、Eに対称である)まで移動する。次いで、過剰の異性体は、過剰の鏡像体結晶及び飽和溶液を含む2相領域に位置することで恩恵を受ける。はじめに、F〜E(F’からEとして)の推移の間に添加されるラセミ体を、2つの鏡像体(さらに具体的には少ない方の鏡像体)の溶解段階を促進するように、かつこのように過剰の方の鏡像体の多数の結晶(一般的方法中で、添加する種結晶の役割を有する)の形成を可能とするように、粉砕及び分級することができる。
【0115】
飽和溶液S’E(平面A−(RS)−Tに関して、SEに対称である)は、同一の冷却関数に従う。冷却の最初から存在する結晶が成長して、次いで成長+第二核形成の二つの機構に参加することになる。それゆえ、最初の晶出の場合のように、シーディングは必要ない。
この間、溶液を表すポイントは、2等分平面A−(RS)−Tに関して対称である等値断面S−Y’−Tの平面内に含まれる曲線SE’F’に沿って、移動する。
【0116】
この溶液がF’に置かれる表示ポイントに到達した場合、ろ過を行い、粉砕及び分級したラセミ体の2Mの質量を集め、次いで温度をTBまで上げ、次いで開始平衡における2相混合物がもたらされる。
このプロセスの継続は、鏡像体R及び鏡像体Sの結晶を交互にもたらす操作のこのサイクルを繰り返すことから成る。
【0117】
AS3PCプロセスを実施するのに必要な条件
a)各光学異性体の等モル混合物は、温度範囲TB〜TF内で用いる溶媒中でラセミ混合物(純粋な鏡像体又は溶媒和物)を生成する;しかし、準安定なラセミ化合物の存在は不利な条件とはならない。
b)分割される分子は、この溶媒中及びTB〜TFで用いる温度範囲内で安定である。
c)3成分平衡温度TL及びTHOMOを決定する必要がある。温度TLは、ラセミ体が溶液中で任意の過剰の異性体なく溶解する温度である。一度、TLを決定すると、温度THOMOは、溶液の均一化温度に該当することとなる。それは、当初の過剰の異性体、並びにTLにおけるラセミ体及び鏡像体の溶解度比αによって決まる。TL〜TFの溶液の過飽和キャパシティーの知見も必要であり、冷却の動力学、撹拌の形態、容器の性質、及び過剰の鏡像体結晶の粒径によって決まる。第一次近似に対し、同様の動力学を用いてTLよりわずかに高い温度から冷却された均一ラセミ化合物の溶液L中において、最初の結晶核形成によって結晶が出現する時間が、これらの実験条件下でラセミ混合物によって許容される過飽和キャパシティーの兆候をもたらすこととなる。この操作方法を、例として考慮に入れる。
d)温度TBにおいて溶液中に分散された(所与の粒径の)ラセミ体の既知質量の溶解の動力学の知見。この時間を見出すのに、何点かの試験で充分であろう。
以下において、本発明の非限定的な具体的な説明の目的で、各例及び各図を提供する。
【図面の簡単な説明】
【0118】
【図1】図1は、温度及びそれぞれの成分に対する晶出曲面、並びに二重に飽和した溶液(単変式曲線)の組成物に関連し、溶媒A−鏡像体R−鏡像体Sの3成分系の透視図であり;この図は、温度TD及びTFにおける等温曲線と、4相を含む温度Tεにおける3成分共晶平面を示している。
【0119】
【図2】図2は、TD及びTFにおける平衡濃度の平面上の、並びに等値断面RYの線表示の投影図であり、ここで、ポイントEは、鏡像体R(同一の鏡像体を沈殿させる)をわずかに過剰にした初期混合物の組成物を表している。
【0120】
【図3】図3は、過剰の鏡像体に関する組成物ポイント及び初期溶液ポイントEを含む、図2中の等値垂直断面RYであり、ここで、平衡時及び冷却中の組成XEの混合物に対する溶液ポイントの経路(太線として)を示す。T<TLの場合、この溶液ポイントはこの断面内に入ってこない。
【0121】
【図4】図4は、温度TFにおける等温制御と、SIPC法に従うシード化とによる交互の分割の間の、溶液ポイントの経路(太線として)の濃度平面上の投影図である。
【0122】
【図5】図5は、等温制御(TFに関する)及びSIPC法に従うシード化の間のE〜Fへの溶液ポイントの経路(太線として)を具体的に説明し、かつ図4中の直線RYを含む垂直等値断面である。
【0123】
【図6】図6は、自己シード化多温プログラム化プロセス(AS3PC)を用いて分割する場合の、溶液ポイントの経路(太線として)の濃度平面上の投影図である。
【0124】
【図7】図7は、本発明に従う自己シード化多温プログラム化プロセス(AS3PC)によって分割する間、SEからFへの溶液ポイントの経路(太線として)を具体的に説明し、かつ図6中の直線RYを含む、垂直等値断面である。
【0125】
【図8】図8は、自己シード化多温プログラム化プロセス(AS3PC)による分割の間、溶液ポイントの経路(太線として)の濃度平面上の投影図であり、そして関係式s(±)<2−αを証明するものである。 これらの図中に具体的に説明する、等値及び全ての等温断面は、質量率として表す組成物の変数を有する。
【0126】
【図9】図9は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IIに対応して得られる粉末X線回折スペクトルを示している(回折計:Miniflex Rigaku(Elexience))。
【0127】
【図10】図10は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IIIに対応して得られる粉末X線回折スペクトルを示している(回折計:Miniflex Rigaku(Elexience))。
【0128】
【図11】図11は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態IVに対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0129】
【図12】図12は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれのジメチルカーボネート溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0130】
【図13】図13は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれのアセトニトリル溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Siemens AG)。
【0131】
【図14】図14は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの形態Vに対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【0132】
【図15】図15は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの酢酸溶媒和物に対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【0133】
【図16】図16は、モダフィニルの左旋性異性体及び右旋性異性体のそれぞれの非晶形に対応して得られる粉末X線回折スペクトルを示している(回折計:Bruker GADDS)。
【実施例】
【0134】
(−)−モダフィニル異性体及び(+)−モダフィニル異性体のそれぞれの結晶形態の調製
一般
モダフィニルの各異性体の新しい結晶形態を、粉末X線回折スペクトロスコピーによって特徴づけ、このスペクトロスコピーによって、試験される結晶形態特有のデジタル識別特性が付与され、そしてこのスペクトロスコピーを、モダフィニルの非晶質異性体及びモダフィニル異性体の他の任意の結晶形態から識別するために使用ができる。
【0135】
X線回折データを測定した:
− ニッケルでフィルターしたλ=1.540ÅのCu線(40KVの加速速度、管電流40mA)と、及び測定中の試料の回転(角度:速度0.04°[2θ]・s−1において3〜40°[2θ]、刻み幅を0.04°とし、優先のオリエンテーションを用いた試料の調製)とを用いる、X線粉体回折計としてのD5005システム(Siemens AG,Karlsruhe,Germany,Eva5.0データ解析法)。
− Cr線、30KVの加速速度、15mAの管電流、及び測定中の試料の回転(角度:速度0.05°[2θ]・s−1において3〜80°[2θ]、刻み幅を0.1°とし、優先のオリエンテーションを用いた試料の調製)を用いる粉末X線回折計としてのMiniflex Rigaku(Elexience)システム。
− 「ハイスターエリア」検出器を備え、そしてプレート分析のため96ウェルを備える、粉末X線回折計(Bruker,the Netherlands)としてGADDSシステムの使用。3〜42°の2θ角の範囲内で、室温において、CuKalphaCu線を用いた分析を実施した。50〜250秒の露光時間を用いて、2θ角の値の2つの領域間(3°≦2θ≦21°及び19°≦2θ≦42°)で、それぞれのウェルの回折スペクトルを収集する。
【0136】
もちろん、強度値は、サンプル調製、アセンブリ、及び測定機器に関連して変化することがある。2θの測定は、測定機器に関連する変動によっても影響を受けることがあり、対応するピークは、装置に従って±0.4°〜±0.2°ので変化することがある。また、当業者は、回折スペクトルに関する本質的なデータを構成する利用可能な面格子間隔を有することを評価するであろう。ブラッグの関係式を満たす場合、ブラッグの関係式(2dsinθ=nλ、ここでd=格子間間隔(Å)、λ=Cu線の波長、θ=結晶の回転角(度))を用いて、格子間間隔を計算する。
【0137】
◆例1〜10:(−)−モダフィニル及び(+)−モダフィニルの形態Iの調製
・例1
a)還流下及び表1に詳述する実験条件下で、モダフィニルのl−異性体を、極性溶媒:メタノール、無水エタノール、3%の水を含む無水エタノール、トルエン(2.5%)で変性しそして3%の水を含むエタノール、及び水に溶解した。
【0138】
【表11】

【0139】
30分間、氷水浴中に浸すこと(quenching)によって急冷させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥させた。晶出生成物を、モダフィニルのl−異性体の形態Iの多形体として、その粉末X線回折スペクトルによって同定した。
b)モダフィニルのd−異性体(555g)を、トルエン(2L)で変性したエタノール及び水(0.1L)の混合物中で、例1aと同一の実験条件下で処理し、その粉末X線回折スペクトルによって同定されるような多形体Iに晶出させ、収率は91%であった。
【0140】
・例2:アセトンからの再晶出
a)2gの(−)−モダフィニルを、コンデンサー、温度計及びスターラーを備える三口フラスコ中で、アセトン中(20mL)で懸濁させた。この混合物を還流下で加熱した。(−)−モダフィニルが完全に溶解するまで、約56℃において30分間、反応混合物を撹拌した。次いで、この溶液を撹拌しながら、−0.5℃/分の速度で10℃まで徐冷した。反応混合物をろ過し、そして得られた固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は62%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0141】
・例3:メタノールからの再晶出
a)1gの(−)−モダフィニルを、メタノール中(7mL)に添加し、(−)−モダフィニルが完全に溶解するまで、還流下で加熱した。1℃において水を6mL添加することによって、この反応混合物を沈殿させた。この懸濁液を連続して1分間撹拌し、次いで、ガラスろ過器(No.3)上でろ過した。分割した固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は55%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0142】
・例4:メタノールからの再晶出(第二例)
a)2.5gの(−)−モダフィニルを、90mLのメタノール中に添加し、(−)−モダフィニルが完全に溶解するまで、還流下で加熱した。透明な溶液に、1℃において水を200mL添加し、そして10分間撹拌を続けた。この反応混合物をろ過し、そして回収した固体を乾燥し、そのX線回折スペクトルによって同定される(−)−モダフィニルの形態Iがもたらされた。収率は78%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0143】
・例5:1,4−ジオキサンからの再晶出
a)20mLの1,4−ジオキサンを50mLのフラスコに入れ、そして還流下に置いた。飽和に達するように2gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、20℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は51%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0144】
・例6:オルト,パラ及びメタ−キシレンからの再晶出
a)180mLのオルト,メタ及びパラキシレンを250mLのフラスコに入れ、そして還流下に置いた。飽和に達するように0.5gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、15℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は26%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0145】
・例7:エチルアセテートからの再晶出
a)100mLのエチルアセテートを250mLのフラスコに入れ、そして還流下に置いた;飽和に達するように2gの(−)−モダフィニルを添加した;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、20℃まで、−0.5℃/分の冷却勾配を用い、全体を冷却させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって形態Iとして同定した。収率は66%であった。
b)還流下で、(+)−モダフィニル(3g)を、エチルアセテート中(100mL)に溶解した。30分間、氷水浴中に浸すことによって冷却させた後、この媒体をろ過し、次いで減圧下で、50℃において乾燥炉中で乾燥した。晶出生成物を、(+)−モダフィニルのl−異性体の形態Iの多形体として、その粉末X線回折スペクトルによって同定した。
【0146】
・例8:他の多形体から
a)CRL40982の形態IV(0.5g)及びCRL40982の形態II(0.5g)を100℃まで加熱することによって、形態Iがもたらされた。
さらに、転換を完全に達成するのに充分な時間(3日間)、(−)−モダフィニルの形態I(0.5g)及び形態II(0.5g)及び形態III(0.5g)の混合物をアセトン中(20mL)に溶解させることによって、(−)−モダフィニルの純粋な形態Iを調製することができる。
二つの手順において、その粉末X線回折スペクトルで、形態Iと同定した。
b)同じ条件下で(+)−モダフィニル(CRL40983)の使用によって、同じ結果がもたらされた。
【0147】
・例9:アセトニトリル溶媒和物から
a)1gの(−)−モダフィニルのアセトニトリル溶媒和物を、100℃まで8時間加熱し、その粉末X線回折スペクトルによって(−)−モダフィニルの形態Iであるとして同定される白い固体に転換した。
b)同一条件下で(+)−モダフィニルの使用によって、同一結果がもたらされた。
【0148】
・例10:モノジメチルカーボネート溶媒和物から
a)1gの(−)−モダフィニルのモノジメチルカーボネート溶媒和物を、110℃まで16時間加熱し、その粉末X線回折スペクトルによって(−)−モダフィニルの形態Iであるとして同定される白い固体に転換した。
b)同じ条件下で(+)−モダフィニルの使用によって、同じ結果がもたらされた。
◆例11〜12:(−)−モダフィニルの形態II(CRL40982の形態II)及び(+)−モダフィニルの形態II(CRL40983の形態II)のそれぞれの調製
・例11:急冷による
【0149】
a)表2に記述する実験条件に従い、モダフィニルのl−異性体を、還流下で溶媒中:エチルアセテート,イソプロパノール,n−プロパノール,及びトルエン(2.5%)で変性したエタノール中に溶解した。
【0150】
【表12】

【0151】
30分間、氷水浴中に浸すことによって冷却させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥した。それぞれの実験手順において、その粉末X線回折スペクトルによって、晶出させた生成物を、モダフィニルのl−異性体の形態IIの多形体(CRL40982の形態II)として同定した。
b)モダフィニルのd−異性体(3.02g)を、還流下で100mLのイソプロパノール中で溶解し、次いで30分間、氷水浴中に浸すことによって急冷させ、ろ過しそして50℃の乾燥炉中で、減圧下で乾燥した。これらの実験条件の下、その粉末X線回折スペクトルによって同定される多形体II(CRL40983の形態II)に、(+)−モダフィニルを晶出させた。
【0152】
・例12:イソプロパノールからの冷却による
a)100mLのイソプロパノールを250mLのフラスコに入れ、還流下に置き、そして飽和に達するように3gの(−)−モダフィニルを添加し、棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過した。晶出生成物を、そのX線回折スペクトルによって、モダフィニルのl−異性体の形態IIの多形体(CRL40982の形態II)として同定した。収率は42%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0153】
◆例13:(−)−モダフィニルの形態III(CRL40982の形態III)及び(+)−モダフィニルの形態III(CRL40983の形態III)のそれぞれの調製
・例13:アセトンからの徐冷による
a)モダフィニルのl−異性体(5g)を、90mLのアセトンの還流下で溶解させた。30分間、氷水浴中に浸すことによって急冷させた後、この媒体をろ過し、次いで35℃において乾燥炉中で乾燥した。その粉末X線回折スペクトルによって、晶出させた生成物を、モダフィニルのl−異性体の形態IIIの多形体として同定した。収率は61%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0154】
◆例14〜16:(−)−モダフィニルの形態IV(CRL40982の形態IV)及び(+)−モダフィニルの形態IV(CRL40983の形態IV)のそれぞれの調製
・例14:クロロホルムからの再晶出
a)20mLのクロロホルムを50mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように1.5gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0155】
・例15:メチルエチルケトンからの再晶出
a)100mLのメチルエチルケトンを250mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように、2gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、20℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0156】
・例16:テトラヒドロフランからの再晶出
a)20mLのテトラヒドロフランを50mLのフラスコに入れ、そして還流下で加熱した。そして飽和に達するように、1gの(−)−モダフィニルを添加し;棒磁石によって撹拌した(300rpm)。(−)−モダフィニルの全体の溶解の後、−0.5℃/分の冷却勾配で、10℃まで全体を徐冷させた。得られた結晶をガラスろ過器上でろ過し、そのX線回折スペクトルによって(−)−モダフィニルの形態IVとして同定した。
例17〜17B:(+)−モダフィニルの形態V(CRL40982の形態V)及び(+)−モダフィニルの形態V(CRL40983の形態V)のそれぞれの調製
【0157】
・例17及び例17bの操作手順
モダフィニルのd−異性体のメタノール溶液(150mg/mL)を96ウェルのプレートに分配し、そして様々な溶媒を25μL(濃度=3.75mg/溶媒25μL)添加する前に、次いで室温においてわずかに減圧して、メタノールを蒸発させた。このマルチウェルプレートは、ステンレス鋼(316L)及び総体積50μLが含まれるそれぞれの密封ウェルからできていた。このプレートを4.8°C/分の温度勾配を用いて、60℃の初期温度まで加熱した。30分後、3℃の最終温度に達するまで、このプレートを徐冷(−0.6°C/分)又は急冷(−300°C/分)し、次いで、最小で1時間、最大で48時間、最終温度を保持した。この溶液を、減圧下(窒素雰囲気)で蒸発させ、そしてこの晶出させた生成物を分析した。
【0158】
・例17:2−プロパノンからの再晶出
徐冷(−0.6°C/分)の適用と、1時間、3℃の温度の保持することとによって、上記操作条件に従って、2−プロパノンからd−モダフィニルを晶出させた。この結晶をその粉末X線回折スペクトルによって、(+)−モダフィニルの形態V(CRL40983の形態V)であるとして同定された。
【0159】
・例17b:テトラヒドロフラン(THF)からの再晶出
急冷(−300°C/分)の適用と、1時間、3℃の温度の保持することとによって、上記操作条件に従って、THFからd−モダフィニルを晶出させた。この結晶をその粉末X線回折スペクトルによって、(+)−モダフィニルの形態V(CRL40983の形態V)であるとして同定した。
【0160】
◆例18〜19:(−)−モダフィニルの溶媒和物及び(+)−モダフィニルの溶媒和物の調製
・例18:(−)−モダフィニルのジメチルカーボネート溶媒和物の調製
a)20mLのジメチルカーボネートを、2gの(−)−モダフィニルに添加し、還流させた。(−)−モダフィニルが完全に溶解するまで、この溶液を10分間撹拌させた。この溶液を、撹拌しながら10℃まで徐冷(−0.5°C/分)させた。この反応混合物を、ガラスろ過器(No.3)上でろ過した。モダフィニルのジメチルカーボネート溶媒和物の分析によって、約24%の質量がもたらされた(約50℃から開始し、110℃まで下げた)。従って、ジメチルカーボネート溶媒和物の化学量論性は、1:1である。それゆえ、これは真の溶媒和物であり、その粉末X線回折スペクトルにより、(−)−モダフィニルのジメチルカーボネート溶媒和物として同定された。収率は88%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0161】
・例19:(−)−モダフィニルのアセトニトリル溶媒和物の調製
a)(−)−モダフィニルの多形体Iの結晶をアセトニトリル中で3日間、20℃において懸濁させた。回収した固体は、X線回折により、アセトニトリル溶媒和物として同定された。この溶媒和物は、1:1の化学両論性を有する真の溶媒和物に該当し、その粉末X線回折スペクトルにより、(−)−モダフィニルのアセトニトリル溶媒和物として同定された。収率は92%であった。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0162】
・例20:酢酸溶媒和物の調製
a)15%の濃度(重量/体積)に達するように、75mgのd−又はl−モダフィニルを、ミニマックス反応器中で、酢酸中に懸濁させた。晶出媒体(絶えず撹拌した)を、3°C/分の温度勾配を用いて、60℃又は80℃の初期温度まで昇温した。30分後、3℃の最終温度まで、この媒体を徐冷(−0.6°C/分)又は急冷(−300°C/分)し、次いで、最小で1時間又は最大で48時間、最終温度を保持した。これらの実験条件の下、酢酸溶媒和物を得て、そしてその粉末X線回折スペクトルによって同定した。
b)(+)−モダフィニルに同一の実験条件を適用し、同一のX線回折スペクトルを取得した。
【0163】
・例21:(−)及び(+)−モダフィニルの非晶質形態の調製
例20で得られた(−)又は(+)−モダフィニルの溶媒和物を120℃で3時間加熱することによって、非晶質形態に転換した。得られた粉末X線回折スペクトルを図16に示す。
【0164】
◆例22〜29:優先晶出による(±)−モダフィニル酸の分割
エタノール中でAS3PC法の使用
・平衡に関連する状態
− エタノール中のラセミ体の溶解度:
【表13】

− 純粋な(+)鏡像体の溶解度=1.99%(20℃);比α=2.06
− ポイントLの座標=濃度:5.96%、温度:30℃
【0165】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=5.96%=一定)を伴うTHOMOの変化
【表14】

【0166】
・動力学に関連する状態
このように、TBをTLにより近くなるように調整することで、実験のはじめに純粋結晶の形の最終収集物の約40%を得ることができ、次いで、期待される最終質量のたった60%が、生成されればよいことになる。この操作は、比Zが充分に大きい場合(過剰の異性体%につき0.8以上)、簡単に実施することができる。
【0167】
モダフィニル酸の場合にあっては、晶出を正確に行う。
【数1】

温度TB1=33.5℃、そしてTB2=31.5℃。
温度TF=17℃。
冷却関数=T=f(t)。
【表15】

【0168】
ポイント中の二つの場合において、TB1又はTB2からの冷却関数は1次線分である:
T1=33.5−0.275t(タイプ1)
T2=31.5−0.24167t(タイプ2)
17℃における平坦域が続く。
【0169】
・例22:エタノール中の35ccスケールにおけるAS3PC法による(±)−モダフィニル酸の分割
・初期状態
過剰の異性体=11%
【表16】

【0170】
TB1及びTB2における平坦域の持続時間=30分
撹拌速度=200rpm
・結果
【表17】

− 純粋な鏡像体結晶の平均質量=0.66g
− 平均光学純度=90.6%
【0171】
・例23:エタノール中の400ccスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11%
【表18】

撹拌速度=200rpm
【0172】
・結果
【表19】

− 純粋な鏡像体結晶の平均質量=8.55g
− 平均光学純度=89.63%
【0173】
・例24:エタノール中の2リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.1%
【表20】

【0174】
・結果
【表21】

− 純粋な鏡像体結晶の平均質量=32.6g
− 平均光学純度=90.3%
【0175】
・例25:エタノール中の10リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.7%
【表22】

撹拌速度=200rpm(lmpeller(商標)ムービングスターラーを用いる手順の間)
【0176】
・結果
【表23】

− 純粋な鏡像体結晶の平均質量=130.8g
− 平均光学純度=89.9%
【0177】
2−メトキシエタノール中でAS3PC法の使用
・平衡に関連する状態
− 2−メトキシエタノール中のラセミ体の溶解度:
【表24】

− 純粋な(+)鏡像体の溶解度=4%(20℃)、比α=2.53
− ポイントLの座標=濃度:16%、温度:39.4℃
【0178】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=16%=一定)を伴うTHOMOの変化
【表25】

【0179】
・例26:10リットルスケール上のAS3PC法による2−メトキシエタノール中の(±)−モダフィニル酸の分割
・初期状態
過剰の異性体=10%
初期温度TB:41℃
ろ過温度TF:30℃
1時間内の41℃〜30℃への直線温度勾配
【表26】

撹拌速度=200rpm
【0180】
・結果
【表27】

− 純粋な鏡像体結晶の平均質量=422.4g
− 平均光学純度=98.2%
【0181】
メタノール中でのAS3PC法の使用
・平衡に関連する状態
− メタノール中のラセミ体の溶解度:
【表28】

− 純粋な(+)鏡像体の溶解度=4.9%(20℃)、比α=2.53
− ポイントLの座標=濃度:25.6%、温度:46.5℃
【0182】
・過剰の異性体(=(ラセミ体/(溶媒+ラセミ体))=25.7%=一定)を伴うTHOMOの変化
【表29】

【0183】
・例27:メタノール中の1リットルスケール上のAS3PC法による(±)−モダフィニル酸の分割
・実験条件
過剰の異性体=10%
初期温度TB:46.5℃
ろ過温度TF:30℃
温度勾配:1時間の39.4℃〜18℃への1次勾配
【表30】

撹拌速度=230rpm
【0184】
・結果
【表31】

− 純粋な鏡像体結晶の平均質量=108g
− 平均光学純度=87.5%
【0185】
エタノール中でSIPC法の使用
・平衡に関連する状態(AS3PC法を参照)
・例28:メタノール中、冷却の終わりにシーディングを伴う、2リットルスケール上のSIPC法による(±)−モダフィニル酸の分割
・初期状態
初期の過剰の異性体=11.8%
初期混合物が均一溶液である温度、TD=40℃
【表32】

− 種結晶を添加する前のTFにおける時間(平坦域)=0分
− 種結晶質量=1%
− 晶出時間=クエンチングによる最速の冷却
撹拌速度=200rpm(lmpelier(商標)モバイルスターラーを用いる手順の間)
【0186】
・結果
【表33】

− 純粋な鏡像体結晶の平均質量=31.28g
− 平均光学純度=91%
【0187】
・例29:メタノール中、冷却の間にシーディングを伴う、2リットルスケール上のS3PC法による(±)−モダフィニル酸の分割
− 初期の過剰の異性体=11.14%
【表34】

− シーディング温度=29℃
− 種結晶質量=1%
− 晶出時間=クエンチングによる最速の冷却
撹拌速度=200rpm(lmpelier(商標)モバイルスターラーを用いる手順の間)
【0188】
・結果
【表35】

− 純粋な鏡像体結晶の平均質量=25.2g
− 平均光学純度=85.2%
【0189】
◆例30〜32:モダフィニルの光学異性体のアルキルエステルへの転換
(−)−モダフィニル酸を使用して、この段階を具体的に説明する。
・例30:ジメチルスルフェートの存在下
3.3リットルのアセトン、0.6リットルの水、349gのNa2CO3(3.29モル)、451gの(−)−モダフィニル酸(1.64モル)を10リットルフラスコ内に入れ、そして還流に達するように加熱する。330mLのジメチルスルフェート(3.29モル)を30分にわたり流し込む。還流を1時間続け、次いで20時間内で室温まで冷却させた。
【0190】
次いで、この媒体を6.6kgの氷の上に注いだ。即時に晶出し、そして3時間後、さらに撹拌ろ過によって白い析出物をもたらし、6リットルの水で洗った。
この生成物を再度6リットルの水中に取り上げ、そして再度ろ過した。この析出物を減圧下、35℃において乾燥し、そしてこのようにして436.3gのメチルエステルを得た(収率=92.3%)。
【0191】
・例31:クロロ蟻酸メチルエステルの存在下
100gの(−)−モダフィニル酸(0.36モル)、21.6mLのトリエチルアミン(0.36モル)を450mLのメタノールに添加した。30mLのクロロ蟻酸メチルエステル(0.36モル)を、塩を溶解させた後に、得られた溶液上に連続的に注いだ。
15分にわたり注ぎ、28℃〜35℃まで昇温した(CO2の放出)。この溶液を2時間撹拌し、そして積み重ねた「氷+水(500g/500mL)」上に注いだ。
このエステルが晶出し;ろ過及び乾燥の後、94.5gのエステルを得た(収率=90.1%)。
【0192】
・例32:光学活性モダフィニル酸のアルキルエステルのアンモノリシス
1.63リットルのトルエン変性メタノール、0.1リットルの水、及び425.1gのメチルエステル(1.474モル)を4リットルのダブルジャケット反応器内に入れた。
温度を30℃まで上げ、そしてこの温度を維持しながら、アンモニアのバブリングを開始した。この操作を1時間45分続け、そして導入したアンモニアの質量は200gであった。撹拌を21時間30分維持し、次いで、0℃に調節された温度で冷却した。
次いで、この媒体をNo.3のガラスろ過器上でろ過し、ろ液(乾燥するまで蒸発させる)と共に57.2gをすぐに得た。この残留物を1.2リットルのトルエン変性エタノール中に取り上げ、そしてろ過後に308.6gの第二の量を得た。
【0193】
第一の晶出:
1.83リットルのトルエン変性エタノール中にこの二つの量をため、そして再晶出させた。熱ろ過によって、冷却すると生成物を生ずるろ液(ろ過し、かつ30℃における減圧下で乾燥する)がもたらされた。162.2gの白い析出物を得た。
【0194】
第二の晶出:
これらの162.2gを、810mLのトルエン変性エタノールと混合し、そして完全な溶解に達するように、還流下で加熱した。次いで、この溶液を氷で冷却することによって晶出させ、そしてNo.4のガラスろ過器を通してろ過し、そして減圧下で、30℃において乾燥した。147.3gの(−)−モダフィニル(CRL40982)を得た。
収率は36.6%であった。
特性:
回転力=−18.6(メタノール中の4.9%溶液)
融点=163℃
【0195】
◆例33〜34:結晶体構造
・例33:モダフィニル酸の構造
アセトンから、モダフィニルの結晶を得た。
この相は、次の特性を有する:
− 異性体に依存する六方晶系のP31又はP32、したがってこのモダフィニルはラセミ混合物であり、
− a=9.55、b=9.55、c=13.14Å
− α=90.000、β=90.000、γ=120.000°
20℃において、自動SMART APEX(Brucker)回折計を用いて、この回折強度を測定した。
【0196】
Saintplus、Sadabs、Shelxsのソフトウェアのパッケージセットを用いて、この構造を決定した。
キラル有機分子の場合において、この空間群の特異的な性質を強調しなければならない。
結晶格子中で、このパターンが3回繰り返しており、従って再度Z=1であった。これらの分子は、酸やスルホキシド基を介して、水素結合によって共に結びつけられている。最も強い相互作用(水素結合)が、結晶方向Zに沿って3つのらせん軸に回り込むものであると論ずることができる。
【0197】
・例34:(−)及び(+)−モダフィニルの形態Iの構造
(+)−モダフィニルの形態Iの結晶構造((−)−モダフィニルの形態Iの結晶構造と同一であるとして同定される)を決定した。その結晶構造は、次の特性を有する:
− 結晶系=単斜晶系、
− 空間群=P21
− a=5.6938、b=26.5024、c=9.3346Å
− β=105.970°
20℃において、自動SMART APEX(Brucker)回折計を用いて、この回折強度を測定した。
【特許請求の範囲】
【請求項1】
次の各段階:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の一つを溶解する段階、
ii)モダフィニルの前記異性体を結晶化させる段階、そして
iii)そのようにして得られたモダフィニルの前記異性体の前記結晶形を回収する段階、
を含む、モダフィニルの前記光学異性体の結晶形を調製する方法。
【請求項2】
前記モダフィニルの異性体が、左旋性の異性体である、請求項1に記載の方法。
【請求項3】
前記モダフィニルの異性体が、右旋性の異性体である、請求項1に記載の方法。
【請求項4】
得られた前記結晶形が、多形体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
動力学的又は熱力学的条件下で晶出を行う、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
場合により所望の結晶形の種結晶の存在下で、析出により晶出を行う、請求項5に記載の調製方法。
【請求項7】
晶出が、段階i)で得られた前記溶液を冷却することからなる、請求項5に記載の調製方法。
【請求項8】
冷却が徐冷である、請求項7に記載の方法。
【請求項9】
冷却が急冷である、請求項7に記載の方法。
【請求項10】
段階i)で用いる前記溶媒を、アセトン、1,4−ジオキサン、エチルアセテート、オルト,メタ若しくはパラキシレン、又はオルト,メタ又は/若しくはパラキシレンの混合物から選択する、請求項4及び8に記載の方法(そのようにして得られた前記多形体を、以下形態Iとして記述する)。
【請求項11】
段階i)で用いる前記溶媒を、メタノール、水、又はアルコール/水の混合物から選択する、請求項4及び9に記載の方法(得られた前記結晶形を、以下形態Iとして記述する)。
【請求項12】
段階i)で用いる前記溶媒が、イソプロパノール、n−プロパノール、エチルアセテート又はトルエン変性エタノールである、請求項4及び9に記載の方法(そのようにして得られた前記多形体を、以下形態IIとして記述する)。
【請求項13】
段階i)で用いる前記溶媒がイソプロパノールである、請求項4及び8に記載の方法(そのようにして得られた前記多形体を、以下形態IIとして記述する)。
【請求項14】
段階i)で用いる前記溶媒がアセトンである、請求項4及び9に記載の方法(そのようにして得られた前記多形体を、以下形態IIIとして記述する)。
【請求項15】
段階i)で用いる前記溶媒を、テトラヒドロフラン、クロロホルム、メチルエチルケトンから選択する、請求項4及び8の方法(そのようにして得られた前記多形体を、以下形態IVとして記述する)。
【請求項16】
得られた前記結晶形が前記モダフィニルの光学異性体の溶媒和物である、請求項1〜3のいずれか一項に記載の方法。
【請求項17】
段階i)で用いる前記溶媒がジメチルカーボネートである、請求項8及び16に記載の方法(そのようにして得られた溶媒和物を前記モダフィニルの光学異性体のジメチルカーボネート溶媒和物として記述する)。
【請求項18】
格子間間隔:8.54、7.57、7.44、4.56、3.78、3.71(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IIとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項19】
格子間間隔:11.33、8.54、7.57、7.44、5.67、5.33、4.83、4.59、4.56、4.45、4.05、3.88、3.78、3.71、3.34、2.83、2.53(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項18に記載の多形体。
【請求項20】
格子間間隔:12.28、8.54、5.01、4.10、3.97、3.20(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IIIとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項21】
格子間間隔:13.40、12.28、8.54、7.32、6.17、5.11、5.01、4.65、4.60、4.48、4.44、4.27、4.19、4.10、4.02、3.97、3.83、3.66、3.54、3.42、3.20、2.91、2.58(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項20に記載の多形体。
【請求項22】
格子間間隔:12.38、8.58、7.34、5.00、4.09(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IVとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項23】
格子間間隔:13.88、12.38、10.27、8.58、7.34、6.16、5.660、5.120、5.00、4.64、4.48、4.26、4.18、4.09、3.82、3.66、3.53、3.42、3.28、3.20(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項22に記載の多形体。
【請求項24】
格子間間隔:9.63、5.23、5.03、4.74、4.66、4.22、4.10、3.77(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項25】
格子間間隔:12.31、9.69、9.09、8.54、7.27、6.21、5.45、5.10、5.00、4.83、4.63、4.46、4.22、4.13、4.09、3.78、3.62、3.53、3.42、3.32、3.24、3.21、3.10(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、モダフィニルの左旋性又は右旋性異性体のジメチルカーボネート溶媒和物。
【請求項26】
モダフィニルの異性体の一つの第一結晶形を、当該第一結晶形とは異なる異性体の第二結晶形へ転化する方法であって、次の各段階:
i)前記モダフィニル異性体の前記第一結晶形を、適切な溶媒中に懸濁させる段階、そして
ii)得られた前記第二結晶形を回収する段階、
を含む方法。
【請求項27】
用いる前記異性体が、(−)−モダフィニルである、請求項26に記載の方法。
【請求項28】
前記第一結晶形が形態Iである、請求項27に記載の方法。
【請求項29】
段階ii)で用いる溶媒がアセトニトリルであり、その結果、アセトニトリル溶媒和物が得られる、請求項28に記載の方法。
【請求項30】
格子間間隔:16.17、14.14、12.32、10.66、9.79、9.29、8.54、8.15、7.80、7.09、6.31、5.83、5.62、5.41、5.10、4.90、4.66、4.58、4.46、4.33、4.20、4.02、3.92、3.835、3.72、3.60、3.57、3.45、3.33、3.24、3.19、3.09、3.03(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、(−)−モダフィニル又は(+)−モダフィニル異性体のアセトニトリル溶媒和物。
【請求項31】
モダフィニル酸から光学活性モダフィニルを調製する方法であって、次の各段階:
i)(±)−モダフィニル酸の2つの光学異性体を分割し、そして少なくとも一方の前記異性体を回収する段階、
ii)アルコール又は有機塩基の存在下で、得られた異性体のうち一つを低級アルキルハロホルメートと接触させて置く段階、
iii)得られた生成物を回収する段階、
iv)得られたエステルをアミドに転換する段階、
v)段階iv)で得られた生成物を回収する段階、
を含む方法。
【請求項32】
前記ハロホルメートが低級アルキルクロロホルメートである、請求項31に記載の方法。
【請求項33】
前記低級アルキルクロロホルメートがメチルクロロホルメートである、請求項32に記載の方法。
【請求項34】
段階ii)で用いる前記塩基を、トリエチルアミン、ジイソプロピルアミン、ジエチルメチルアミン、DBUから選択する、請求項31〜33のいずれか一項に記載の方法。
【請求項35】
段階ii)で用いる溶媒が、低級脂肪族アルコール、好ましくはメタノールである、請求項31〜34のいずれか一項に記載の方法。
【請求項36】
段階iv)で用いる溶媒が、低級脂肪族アルコール、好ましくはメタノールである、請求項31〜35のいずれか一項に記載の方法。
【請求項37】
段階i)において(±)−モダフィニル酸の前記光学異性体の分割を、優先晶出法により行う、請求項31〜36のいずれか一項に記載の方法。
【請求項38】
(±)−モダフィニル酸又はその塩類の2つの光学異性体を分割する方法がシード化法であり、前記方法が次の各段階:
a)ラセミ混合物の形の、モダフィニル酸の第一異性体結晶のラセミ体及び溶媒を含む配合物を、温度TDにおいて均一化する段階、
ここで濃度及び温度TDの変数によって規定される規定ポイントEは、希釈溶液の単相領域内に存在する、
b)段階a)において調製された前記溶液を、初期温度TDから温度TFまで急冷させる段階、
c)冷却(TF)の最中か又は終わりに、前記第一異性体の純粋な種結晶を用いて、段階b)の溶液をシーディングさせる段階、
d)前記第一異性体の結晶を集める段階
e)ラセミ混合物の形の前記ラセミ体の結晶を、段階d)内で実施した前記収集に由来する母液に添加し、そして温度TDまで加熱することで前記新配合物を均一化する段階、
ここで規定ポイントE’は、溶媒、鏡像体(−)、鏡像体(+)系のラセミ混合物の平面に関してEに対称であり、前記ポイントE’は希釈溶液の単相領域内に存在する、
f)段階e)において調製された前記溶液を、初期前記温度TDから前記温度TFまで急冷させる段階、
g)第二異性体の純粋な種結晶を用いて、段階f)で得た前記溶液をシーディングさせる段階、
h)前記第二異性体の結晶を集める段階、
i)ラセミ混合物の形の前記ラセミ体の結晶を、段階h)内で実施した前記結晶収集に由来する前記母液に添加し、そして前記初期規定ポイントEを有する配合物の組成と同一の組成を得るため、温度TDまで加熱することで新配合物を均一化させる段階、
j)前記第一体、次いで前記第二体の2つの異性体を連続して得るために、a),b),c),d),e),f),h)及びj)の各段階を繰り返す段階、
を含む、請求項37に記載の方法。
【請求項39】
優先晶出によって、(±)−モダフィニル酸又は(±)−モダフィニル酸塩を前記2つの光学異性体に分割する前記方法が、自己シード化AS3PC法であり、前記方法が、次の各段階:
a)ラセミ混合物の形の、モダフィニル酸の第一異性体のラセミ体の結晶及び溶媒を含む配合物を作る段階、
ここで、濃度及び温度変数TBによって規定される規定ポイントEは、過剰の異性体の2相領域内にあり、かつその飽和溶液と平衡にある、
b)段階a)で調製した前記2相混合物の温度から、冷却プログラミング関数を適用する段階、
前記プログラミング関数は、前記溶液中に存在する第二異性体の自発的な核形成を防止しながら、母液をわずかに過飽和にしたままで、結晶の形で存在する前記異性体の成長を促進する、
c)段階b)の結晶成長段階中の全ての時間にわたって、わずかに増していく撹拌速度を採用する段階、
ここで、全ての時間において、前記撹拌速度は、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、前記第一異性体の成長を促進するのには充分に遅く、そして均一な懸濁液と前記第一異性体のそれぞれの微結晶周りの前記母液の一新とをもたらすのには充分に速い様式である、
d)前記第一異性体の結晶を集める段階、
e)段階d)で実施された前記収集に由来する前記母液に、ラセミ混合物の形の前記ラセミ体の結晶を添加し、そして規定ポイントE’が、前記溶媒、鏡像体(−)、鏡像体(+)系の前記ラセミ体の平面に関してEと対称であり、前記ポイントE’が、過剰でかつ それらの飽和溶液と平衡にある前記第二異性体の前記2相領域内に位置するように、熱力学的平衡を達成するのに必要な時間、前記新配合物を温度平坦域TBまで導く段階、
f)前記溶液内に存在する前記第一異性体の自発的な核形成を防止しながら、前記第二異性体を含む段階e)で調製された前記2相混合物に、段階b)と同じ冷却プログラミング関数を適用する段階、
ここで、結晶の形で存在する前記異性体の成長を促進するため、晶出の間、前記母液をわずかに過飽和にしたままとする、
g)段階f)の結晶成長段階中の全ての時間にわたって、わずかに増していく撹拌速度を採用する段階、
ここで、全ての時間において、前記撹拌速度は、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、前記第二異性体の成長を促進するのには充分に遅く、そして均一な懸濁液と前記第二異性体のそれぞれの微結晶周りの前記母液の一新とを達成するのには充分に速い様式である、
h)前記第二異性体の結晶を集める段階、
i)前記初期配合物Eの組成と同一の組成の配合物を得るため、段階g)で実施した前記結晶の収集に由来する前記母液に、ラセミ混合物の形の前記ラセミ体の結晶を添加する段階、
j)前記第一体、次いで前記第二体の2つの異性体を連続して得るために、a),b),c),d),e),f),g),h)及びi)の各段階を繰り返す段階、
を含む、請求項37に記載の方法。
【請求項40】
段階a)において、一種又は複数種の前記溶媒及び作用温度範囲の選択を、下記記載:− ラセミ混合物を形成し、そして任意のラセミ化合物が前記作用温度範囲内において準安定である鏡像体であること、
− 充分に濃縮されるが、低粘度及び低蒸気圧である溶液であること、− 加溶媒分解及びラセミ化がないこと、
− 溶媒和物が平衡状態で存在し、かつ分割可能な異性体の状態である場合に、溶媒和物に安定性があること、
を同時に満たす様式で規定することを特徴とする、請求項39に記載の方法。
【請求項41】
段階a)及び段階e)において、初期懸濁液中に存在する多量のラセミ体の均一化に関して、温度TBが温度TLより高いこと、そして過剰の異性体に関するTHOMOの変化と、ラセミ体XLの一定濃度とに関する曲線から、前記温度TBを規定することを特徴とし、
ここで段階a)及びi)の第一異性体並びに段階e)内の第二異性体の純粋結晶の質量が、それらの飽和溶液との平衡内において、期待される収集物の多くても50%で、好ましくは約25〜40%で存在する、請求項39又は40に記載の方法。
【請求項42】
段階b)及び段階f)において、実験用アセンブリに適している温度TB〜温度TFへ冷却するためのプログラミング関数を、下記の様式:
− それぞれのサイクルのはじめに、結晶の形で存在する異性体の晶出のための段階中の全てにおいてわずかな過飽和を達成すること、このわずかな過飽和によって、穏やかな成長及び第二核形成が生じる、
− 最初に核を形成することなく、TFにおいて他の異性体の過飽和の上限を達成すること、
− 段階d)及び段階h)において結晶の収集物を得ること、その後、段階e)及び段階i)において前記ラセミ体を添加及び補充することによって、サイクル操作の実施が可能になる、
によって規定する、請求項39〜41のいずれか一項に記載の方法。
【請求項43】
初期の過剰の異性体の2倍の収集を可能としながら、最初に核を形成することなく安定な飽和溶液を得るため、前記冷却プログラミング関数が、濃度XLの溶液をTL+1℃〜TFに冷却させることによってTL〜TFの部分を定めること、
ここで、TFはTL−(THOMO−TL)より低く、そして前記冷却プログラミング関数が、TL+1℃〜TFで決定される同一の関数を外挿することによってTB〜TLの部分を定める、
を特徴とする請求項42に記載の方法。
【請求項44】
前記b)及びf)の2段階において、前記第一異性体及び前記第二異性体の析出に付随する熱放出を、前記冷却プログラミング関数に組込むことを特徴とする、請求項39〜43のいずれか一項に記載の方法。
【請求項45】
段階e)及び段階i)において、溶媒の不足分を補充することを特徴とする、請求項39〜44のいずれか一項に記載の方法。
【請求項46】
段階a),段階e)及び段階i)において、添加されるラセミ混合物の形のラセミ体の微細結晶を、導入前に、前記溶解段階を促進する前処理(粉砕及び分級、超音波処理、又は部分的な凍結乾燥等)にかけることを特徴とする、請求項39〜45のいずれか一項に記載の方法。
【請求項47】
段階a)、段階e)及び段階i)において、前記撹拌速度を上げることを特徴とする、請求項39〜46のいずれか一項に記載の方法。
【請求項48】
段階a)で用いる前記溶媒が、エタノール、2−メトキシエタノール又はメタノールである、請求項38又は39〜47のいずれか一項に記載の方法。
【請求項49】
前記温度TFが0〜40℃に存在する、請求項48に記載の方法。
【請求項50】
段階a)において、前記ラセミ体が2〜50質量%で存在する、請求項48又は49のいずれかに記載の方法。
【請求項51】
段階a)において、前記過剰の異性体が1〜50質量%で存在する、請求項48〜50のいずれか一項に記載の方法。
【請求項52】
前記温度TBが25℃〜50℃の間に存在する、請求項51に記載の方法。
【請求項53】
温度平坦域TBの持続時間が、15〜60分の間に存在する、請求項48〜52のいずれか一項に記載の方法。
【請求項54】
次の各段階:
a)請求項35〜53のいずれか一項に規定する優先晶出法により、(±)−モダフィニル酸又は(±)−モダフィニル酸塩の前記2つの光学異性体を分割する段階、
b)前記異性体をアミドに転換する段階、
c)得られた前記モダフィニル異性体を回収する段階、
を含む、モダフィニルの前記異性体のうちの一つを調製する方法。
【請求項55】
段階b)を、次の2段階:
b1)前記異性体を低級アルキルエステルに転換する段階、
b2)段階b1)で得られた生成物をアミドに転換する段階、
で実施する、請求項54に記載の方法。
【請求項56】
適切な場合には医学的に許容されるビヒクルと共に、形態(II)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項57】
適切な場合には医学的に許容されるビヒクルと共に、形態(III)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項58】
適切な場合には医学的に許容されるビヒクルと共に、形態(IV)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項59】
適切な場合には医学的に許容されるビヒクルと共に、形態(V)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項60】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するために、形態IIとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項61】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態IIIとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項62】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態IVとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項63】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態Vとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項1】
次の各段階:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の一つを溶解する段階、
ii)モダフィニルの前記異性体を結晶化させる段階、そして
iii)そのようにして得られたモダフィニルの前記異性体の前記結晶形を回収する段階、
を含む、モダフィニルの前記光学異性体の結晶形を調製する方法。
【請求項2】
前記モダフィニルの異性体が、左旋性の異性体である、請求項1に記載の方法。
【請求項3】
前記モダフィニルの異性体が、右旋性の異性体である、請求項1に記載の方法。
【請求項4】
得られた前記結晶形が、多形体である、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
動力学的又は熱力学的条件下で晶出を行う、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
場合により所望の結晶形の種結晶の存在下で、析出により晶出を行う、請求項5に記載の調製方法。
【請求項7】
晶出が、段階i)で得られた前記溶液を冷却することからなる、請求項5に記載の調製方法。
【請求項8】
冷却が徐冷である、請求項7に記載の方法。
【請求項9】
冷却が急冷である、請求項7に記載の方法。
【請求項10】
段階i)で用いる前記溶媒を、アセトン、1,4−ジオキサン、エチルアセテート、オルト,メタ若しくはパラキシレン、又はオルト,メタ又は/若しくはパラキシレンの混合物から選択する、請求項4及び8に記載の方法(そのようにして得られた前記多形体を、以下形態Iとして記述する)。
【請求項11】
段階i)で用いる前記溶媒を、メタノール、水、又はアルコール/水の混合物から選択する、請求項4及び9に記載の方法(得られた前記結晶形を、以下形態Iとして記述する)。
【請求項12】
段階i)で用いる前記溶媒が、イソプロパノール、n−プロパノール、エチルアセテート又はトルエン変性エタノールである、請求項4及び9に記載の方法(そのようにして得られた前記多形体を、以下形態IIとして記述する)。
【請求項13】
段階i)で用いる前記溶媒がイソプロパノールである、請求項4及び8に記載の方法(そのようにして得られた前記多形体を、以下形態IIとして記述する)。
【請求項14】
段階i)で用いる前記溶媒がアセトンである、請求項4及び9に記載の方法(そのようにして得られた前記多形体を、以下形態IIIとして記述する)。
【請求項15】
段階i)で用いる前記溶媒を、テトラヒドロフラン、クロロホルム、メチルエチルケトンから選択する、請求項4及び8の方法(そのようにして得られた前記多形体を、以下形態IVとして記述する)。
【請求項16】
得られた前記結晶形が前記モダフィニルの光学異性体の溶媒和物である、請求項1〜3のいずれか一項に記載の方法。
【請求項17】
段階i)で用いる前記溶媒がジメチルカーボネートである、請求項8及び16に記載の方法(そのようにして得られた溶媒和物を前記モダフィニルの光学異性体のジメチルカーボネート溶媒和物として記述する)。
【請求項18】
格子間間隔:8.54、7.57、7.44、4.56、3.78、3.71(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IIとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項19】
格子間間隔:11.33、8.54、7.57、7.44、5.67、5.33、4.83、4.59、4.56、4.45、4.05、3.88、3.78、3.71、3.34、2.83、2.53(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項18に記載の多形体。
【請求項20】
格子間間隔:12.28、8.54、5.01、4.10、3.97、3.20(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IIIとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項21】
格子間間隔:13.40、12.28、8.54、7.32、6.17、5.11、5.01、4.65、4.60、4.48、4.44、4.27、4.19、4.10、4.02、3.97、3.83、3.66、3.54、3.42、3.20、2.91、2.58(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項20に記載の多形体。
【請求項22】
格子間間隔:12.38、8.58、7.34、5.00、4.09(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、形態IVとして記述される、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項23】
格子間間隔:13.88、12.38、10.27、8.58、7.34、6.16、5.660、5.120、5.00、4.64、4.48、4.26、4.18、4.09、3.82、3.66、3.53、3.42、3.28、3.20(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、請求項22に記載の多形体。
【請求項24】
格子間間隔:9.63、5.23、5.03、4.74、4.66、4.22、4.10、3.77(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、モダフィニルの左旋性又は右旋性異性体の多形体。
【請求項25】
格子間間隔:12.31、9.69、9.09、8.54、7.27、6.21、5.45、5.10、5.00、4.83、4.63、4.46、4.22、4.13、4.09、3.78、3.62、3.53、3.42、3.32、3.24、3.21、3.10(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、モダフィニルの左旋性又は右旋性異性体のジメチルカーボネート溶媒和物。
【請求項26】
モダフィニルの異性体の一つの第一結晶形を、当該第一結晶形とは異なる異性体の第二結晶形へ転化する方法であって、次の各段階:
i)前記モダフィニル異性体の前記第一結晶形を、適切な溶媒中に懸濁させる段階、そして
ii)得られた前記第二結晶形を回収する段階、
を含む方法。
【請求項27】
用いる前記異性体が、(−)−モダフィニルである、請求項26に記載の方法。
【請求項28】
前記第一結晶形が形態Iである、請求項27に記載の方法。
【請求項29】
段階ii)で用いる溶媒がアセトニトリルであり、その結果、アセトニトリル溶媒和物が得られる、請求項28に記載の方法。
【請求項30】
格子間間隔:16.17、14.14、12.32、10.66、9.79、9.29、8.54、8.15、7.80、7.09、6.31、5.83、5.62、5.41、5.10、4.90、4.66、4.58、4.46、4.33、4.20、4.02、3.92、3.835、3.72、3.60、3.57、3.45、3.33、3.24、3.19、3.09、3.03(Å)に強度ピークを含むX線回折スペクトルを作り出すことを特徴とする、(−)−モダフィニル又は(+)−モダフィニル異性体のアセトニトリル溶媒和物。
【請求項31】
モダフィニル酸から光学活性モダフィニルを調製する方法であって、次の各段階:
i)(±)−モダフィニル酸の2つの光学異性体を分割し、そして少なくとも一方の前記異性体を回収する段階、
ii)アルコール又は有機塩基の存在下で、得られた異性体のうち一つを低級アルキルハロホルメートと接触させて置く段階、
iii)得られた生成物を回収する段階、
iv)得られたエステルをアミドに転換する段階、
v)段階iv)で得られた生成物を回収する段階、
を含む方法。
【請求項32】
前記ハロホルメートが低級アルキルクロロホルメートである、請求項31に記載の方法。
【請求項33】
前記低級アルキルクロロホルメートがメチルクロロホルメートである、請求項32に記載の方法。
【請求項34】
段階ii)で用いる前記塩基を、トリエチルアミン、ジイソプロピルアミン、ジエチルメチルアミン、DBUから選択する、請求項31〜33のいずれか一項に記載の方法。
【請求項35】
段階ii)で用いる溶媒が、低級脂肪族アルコール、好ましくはメタノールである、請求項31〜34のいずれか一項に記載の方法。
【請求項36】
段階iv)で用いる溶媒が、低級脂肪族アルコール、好ましくはメタノールである、請求項31〜35のいずれか一項に記載の方法。
【請求項37】
段階i)において(±)−モダフィニル酸の前記光学異性体の分割を、優先晶出法により行う、請求項31〜36のいずれか一項に記載の方法。
【請求項38】
(±)−モダフィニル酸又はその塩類の2つの光学異性体を分割する方法がシード化法であり、前記方法が次の各段階:
a)ラセミ混合物の形の、モダフィニル酸の第一異性体結晶のラセミ体及び溶媒を含む配合物を、温度TDにおいて均一化する段階、
ここで濃度及び温度TDの変数によって規定される規定ポイントEは、希釈溶液の単相領域内に存在する、
b)段階a)において調製された前記溶液を、初期温度TDから温度TFまで急冷させる段階、
c)冷却(TF)の最中か又は終わりに、前記第一異性体の純粋な種結晶を用いて、段階b)の溶液をシーディングさせる段階、
d)前記第一異性体の結晶を集める段階
e)ラセミ混合物の形の前記ラセミ体の結晶を、段階d)内で実施した前記収集に由来する母液に添加し、そして温度TDまで加熱することで前記新配合物を均一化する段階、
ここで規定ポイントE’は、溶媒、鏡像体(−)、鏡像体(+)系のラセミ混合物の平面に関してEに対称であり、前記ポイントE’は希釈溶液の単相領域内に存在する、
f)段階e)において調製された前記溶液を、初期前記温度TDから前記温度TFまで急冷させる段階、
g)第二異性体の純粋な種結晶を用いて、段階f)で得た前記溶液をシーディングさせる段階、
h)前記第二異性体の結晶を集める段階、
i)ラセミ混合物の形の前記ラセミ体の結晶を、段階h)内で実施した前記結晶収集に由来する前記母液に添加し、そして前記初期規定ポイントEを有する配合物の組成と同一の組成を得るため、温度TDまで加熱することで新配合物を均一化させる段階、
j)前記第一体、次いで前記第二体の2つの異性体を連続して得るために、a),b),c),d),e),f),h)及びj)の各段階を繰り返す段階、
を含む、請求項37に記載の方法。
【請求項39】
優先晶出によって、(±)−モダフィニル酸又は(±)−モダフィニル酸塩を前記2つの光学異性体に分割する前記方法が、自己シード化AS3PC法であり、前記方法が、次の各段階:
a)ラセミ混合物の形の、モダフィニル酸の第一異性体のラセミ体の結晶及び溶媒を含む配合物を作る段階、
ここで、濃度及び温度変数TBによって規定される規定ポイントEは、過剰の異性体の2相領域内にあり、かつその飽和溶液と平衡にある、
b)段階a)で調製した前記2相混合物の温度から、冷却プログラミング関数を適用する段階、
前記プログラミング関数は、前記溶液中に存在する第二異性体の自発的な核形成を防止しながら、母液をわずかに過飽和にしたままで、結晶の形で存在する前記異性体の成長を促進する、
c)段階b)の結晶成長段階中の全ての時間にわたって、わずかに増していく撹拌速度を採用する段階、
ここで、全ての時間において、前記撹拌速度は、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、前記第一異性体の成長を促進するのには充分に遅く、そして均一な懸濁液と前記第一異性体のそれぞれの微結晶周りの前記母液の一新とをもたらすのには充分に速い様式である、
d)前記第一異性体の結晶を集める段階、
e)段階d)で実施された前記収集に由来する前記母液に、ラセミ混合物の形の前記ラセミ体の結晶を添加し、そして規定ポイントE’が、前記溶媒、鏡像体(−)、鏡像体(+)系の前記ラセミ体の平面に関してEと対称であり、前記ポイントE’が、過剰でかつ それらの飽和溶液と平衡にある前記第二異性体の前記2相領域内に位置するように、熱力学的平衡を達成するのに必要な時間、前記新配合物を温度平坦域TBまで導く段階、
f)前記溶液内に存在する前記第一異性体の自発的な核形成を防止しながら、前記第二異性体を含む段階e)で調製された前記2相混合物に、段階b)と同じ冷却プログラミング関数を適用する段階、
ここで、結晶の形で存在する前記異性体の成長を促進するため、晶出の間、前記母液をわずかに過飽和にしたままとする、
g)段階f)の結晶成長段階中の全ての時間にわたって、わずかに増していく撹拌速度を採用する段階、
ここで、全ての時間において、前記撹拌速度は、制御されていない核形成をもたらす過度に大きな剪断力の発生を防止しながら、前記第二異性体の成長を促進するのには充分に遅く、そして均一な懸濁液と前記第二異性体のそれぞれの微結晶周りの前記母液の一新とを達成するのには充分に速い様式である、
h)前記第二異性体の結晶を集める段階、
i)前記初期配合物Eの組成と同一の組成の配合物を得るため、段階g)で実施した前記結晶の収集に由来する前記母液に、ラセミ混合物の形の前記ラセミ体の結晶を添加する段階、
j)前記第一体、次いで前記第二体の2つの異性体を連続して得るために、a),b),c),d),e),f),g),h)及びi)の各段階を繰り返す段階、
を含む、請求項37に記載の方法。
【請求項40】
段階a)において、一種又は複数種の前記溶媒及び作用温度範囲の選択を、下記記載:− ラセミ混合物を形成し、そして任意のラセミ化合物が前記作用温度範囲内において準安定である鏡像体であること、
− 充分に濃縮されるが、低粘度及び低蒸気圧である溶液であること、− 加溶媒分解及びラセミ化がないこと、
− 溶媒和物が平衡状態で存在し、かつ分割可能な異性体の状態である場合に、溶媒和物に安定性があること、
を同時に満たす様式で規定することを特徴とする、請求項39に記載の方法。
【請求項41】
段階a)及び段階e)において、初期懸濁液中に存在する多量のラセミ体の均一化に関して、温度TBが温度TLより高いこと、そして過剰の異性体に関するTHOMOの変化と、ラセミ体XLの一定濃度とに関する曲線から、前記温度TBを規定することを特徴とし、
ここで段階a)及びi)の第一異性体並びに段階e)内の第二異性体の純粋結晶の質量が、それらの飽和溶液との平衡内において、期待される収集物の多くても50%で、好ましくは約25〜40%で存在する、請求項39又は40に記載の方法。
【請求項42】
段階b)及び段階f)において、実験用アセンブリに適している温度TB〜温度TFへ冷却するためのプログラミング関数を、下記の様式:
− それぞれのサイクルのはじめに、結晶の形で存在する異性体の晶出のための段階中の全てにおいてわずかな過飽和を達成すること、このわずかな過飽和によって、穏やかな成長及び第二核形成が生じる、
− 最初に核を形成することなく、TFにおいて他の異性体の過飽和の上限を達成すること、
− 段階d)及び段階h)において結晶の収集物を得ること、その後、段階e)及び段階i)において前記ラセミ体を添加及び補充することによって、サイクル操作の実施が可能になる、
によって規定する、請求項39〜41のいずれか一項に記載の方法。
【請求項43】
初期の過剰の異性体の2倍の収集を可能としながら、最初に核を形成することなく安定な飽和溶液を得るため、前記冷却プログラミング関数が、濃度XLの溶液をTL+1℃〜TFに冷却させることによってTL〜TFの部分を定めること、
ここで、TFはTL−(THOMO−TL)より低く、そして前記冷却プログラミング関数が、TL+1℃〜TFで決定される同一の関数を外挿することによってTB〜TLの部分を定める、
を特徴とする請求項42に記載の方法。
【請求項44】
前記b)及びf)の2段階において、前記第一異性体及び前記第二異性体の析出に付随する熱放出を、前記冷却プログラミング関数に組込むことを特徴とする、請求項39〜43のいずれか一項に記載の方法。
【請求項45】
段階e)及び段階i)において、溶媒の不足分を補充することを特徴とする、請求項39〜44のいずれか一項に記載の方法。
【請求項46】
段階a),段階e)及び段階i)において、添加されるラセミ混合物の形のラセミ体の微細結晶を、導入前に、前記溶解段階を促進する前処理(粉砕及び分級、超音波処理、又は部分的な凍結乾燥等)にかけることを特徴とする、請求項39〜45のいずれか一項に記載の方法。
【請求項47】
段階a)、段階e)及び段階i)において、前記撹拌速度を上げることを特徴とする、請求項39〜46のいずれか一項に記載の方法。
【請求項48】
段階a)で用いる前記溶媒が、エタノール、2−メトキシエタノール又はメタノールである、請求項38又は39〜47のいずれか一項に記載の方法。
【請求項49】
前記温度TFが0〜40℃に存在する、請求項48に記載の方法。
【請求項50】
段階a)において、前記ラセミ体が2〜50質量%で存在する、請求項48又は49のいずれかに記載の方法。
【請求項51】
段階a)において、前記過剰の異性体が1〜50質量%で存在する、請求項48〜50のいずれか一項に記載の方法。
【請求項52】
前記温度TBが25℃〜50℃の間に存在する、請求項51に記載の方法。
【請求項53】
温度平坦域TBの持続時間が、15〜60分の間に存在する、請求項48〜52のいずれか一項に記載の方法。
【請求項54】
次の各段階:
a)請求項35〜53のいずれか一項に規定する優先晶出法により、(±)−モダフィニル酸又は(±)−モダフィニル酸塩の前記2つの光学異性体を分割する段階、
b)前記異性体をアミドに転換する段階、
c)得られた前記モダフィニル異性体を回収する段階、
を含む、モダフィニルの前記異性体のうちの一つを調製する方法。
【請求項55】
段階b)を、次の2段階:
b1)前記異性体を低級アルキルエステルに転換する段階、
b2)段階b1)で得られた生成物をアミドに転換する段階、
で実施する、請求項54に記載の方法。
【請求項56】
適切な場合には医学的に許容されるビヒクルと共に、形態(II)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項57】
適切な場合には医学的に許容されるビヒクルと共に、形態(III)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項58】
適切な場合には医学的に許容されるビヒクルと共に、形態(IV)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項59】
適切な場合には医学的に許容されるビヒクルと共に、形態(V)として記述される(−)−モダフィニル又は(+)−モダフィニルの多形体を含む医薬組成物。
【請求項60】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するために、形態IIとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項61】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態IIIとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項62】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態IVとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【請求項63】
睡眠過剰、特に、痛みを和らげるためモルヒネ鎮痛薬を用いるがんの治療によって影響を受けた患者の睡眠過剰及び特発性睡眠過剰;睡眠時無呼吸、疾患に関連する過度の傾眠、閉塞性睡眠時無呼吸、睡眠発作、傾眠、過度の傾眠、睡眠発作に関連する過度の傾眠;パーキンソン病等の中枢神経系の障害;虚血に対する脳組織の保護、覚醒障害、特にシュタイネルト病に関連する覚醒障害、多動性障害(ADHD)に関連する等の注意障害、疲労状態、特に多発性障害及び他の変性疾患に関する疲労状態;うつ病、低日光暴露、統合失調症、交代性労働、タイム・シフトに関連するうつ状態;摂食障害から選択する疾患の予防又は治療を目的とする医薬を製造するため、形態Vとして記述され、モダフィニルが食欲刺激剤、低用量の認知機能刺激剤として作用する、(−)−モダフィニル又は(+)−モダフィニル多形体の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−102330(P2011−102330A)
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2011−32155(P2011−32155)
【出願日】平成23年2月17日(2011.2.17)
【分割の表示】特願2004−564285(P2004−564285)の分割
【原出願日】平成15年12月18日(2003.12.18)
【出願人】(505048921)セファロン フランス (9)
【Fターム(参考)】
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成23年2月17日(2011.2.17)
【分割の表示】特願2004−564285(P2004−564285)の分割
【原出願日】平成15年12月18日(2003.12.18)
【出願人】(505048921)セファロン フランス (9)
【Fターム(参考)】
[ Back to top ]

