モノクローナル抗体、それを用いる検査装置
【課題】迅速かつ簡便にIMP型MBLを検出するためのモノクローナル抗体を提供する。
【解決手段】IMPのアミノ酸配列AにおいてN末端側103番目から108番目の6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応するモノクローナル抗体D。あるいは、IMPのアミノ酸配列AにおいてN末端側113番目から121番目の9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応するモノクローナル抗体D。
【解決手段】IMPのアミノ酸配列AにおいてN末端側103番目から108番目の6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応するモノクローナル抗体D。あるいは、IMPのアミノ酸配列AにおいてN末端側113番目から121番目の9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応するモノクローナル抗体D。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、モノクローナル抗体、それを用いる検査装置に係り、特に、β−ラクタム系薬剤に対する細菌の耐性因子であるIMP型メタロ−β−ラクタマーゼの検出に関するものである。
【背景技術】
【0002】
病原性微生物により惹き起される感染症の問題は、人類にとってたいへん重大であり、時として重篤な病状を伴う大流行を発生させ、多数の感染患者、更には死者を出してきた。そして病原性微生物の増殖を抑制できる抗生物質ペニシリンの発見により、細菌性感染症の治療は急速な進展を遂げ、それ以降も様々な抗生物質の開発が行われてきた。しかしながら、これらの抗生物質を使用していく中で、抗生物質を分解または無毒化する能力を獲得した細菌(耐性菌)が現れ、新たな問題となっている。
【0003】
医療現場において、特に高齢者や乳幼児、長期の入院患者などで免疫力が低下している場合や怪我や手術後の治療患者、各種カテーテル使用患者などで病原菌と直接接触する可能性が考えられる場合に、耐性菌による感染拡大、端的には院内感染が、大きな社会問題となっている。
【0004】
医療現場では感染対策のため、耐性菌のモニタリングを行い、万が一耐性菌を発見した場合には、適正な薬剤の選択、治療とともに、感染の蔓延を防止するための患者の隔離、消毒の徹底などが求められている。また、医療従事者を介しての感染拡大も考えられるため、徹底した感染経路の遮断や消毒、環境対策などが必要となる。この様な理由から、耐性菌の早期検出は、医療現場において抗生物質が効かない危険な耐性菌の感染蔓延を防止する目的でたいへん重要である。
【0005】
細菌の薬剤耐性には、いくつかの系統があることが分かっており、菌種により抗菌剤の有効性も当然異なっている。その抗菌剤の中でも人体への毒性が低く、広範囲の細菌種に対して有効な抗菌剤であるβ−ラクタム系薬剤が開発され広く使用されてきた。
【0006】
1990年代になると完全合成β−ラクタムのカルバペネム系薬剤が開発され、殆どの種類の細菌に効果を示すことで大いに期待された。β−ラクタム系薬剤は、分子構造中にβ−ラクタム環を有する抗菌薬の総称である。このβ−ラクタム系薬剤は、広域スペクトラムを示し、ペプチドグリカンを主成分とする細菌の細胞壁の合成を阻害することで、細菌に細胞分裂をできなくさせる効果や、細胞壁が浸透圧に耐えられず細菌を破裂して死菌させる効果がある。
【0007】
しかし、細菌の中でも特にグラム陰性菌において、このβ−ラクタム系薬剤の分解酵素であるβ−ラクタマーゼを産生し、β−ラクタム系薬剤を加水分解し失活させることで、強い耐性を持つものが出現した。
【0008】
この中でも、活性中心に亜鉛をもつメタロ−β−ラクタマーゼ(MBL)は、ほとんど全てのβ−ラクタム系薬剤に耐性を示すため、最後の砦とされているカルバペネム系薬剤を含め薬剤投与の選択肢がなくなってしまう、最も危険なβ−ラクタマーゼ耐性因子と考えられている。
【0009】
また、MBL産生菌の耐性因子は、その伝播しやすさについても問題視されている。菌自体の遺伝子DNAとは別に存在する独立したDNA分子であるプラスミドや可動性エレメントであるインテグロン上に耐性遺伝子を持つため、プラスミドを有する細菌同士の接触のみでこの因子の伝搬が容易に行われるのである。
【0010】
これは他の耐性菌であるメチシリン耐性黄色ブドウ球菌(MRSA)などが、多量の薬剤投与によって突然変異を起こし菌自体のDNAにメチシリン耐性を獲得して細胞分裂により増殖するのとは異なり、菌種をも超えて伝達されるため耐性菌が広範囲に劇的に増殖しやすいことを意味する。
【0011】
MBLは、Bacteroides fragilis、Serratia marcescens、Klebsiella pneumoniae、Escherichia coli等複数のグラム陰性菌で確認されており、特に緑膿菌(Pseudomonas aeruginosa)においては、多剤耐性緑膿菌(MDRP)における耐性因子の一つとしても注目され社会的にも大きな問題となっている。
【0012】
緑膿菌は常在菌であり、それ自体の病原性は低く健常者に対して感染症を引き起こすことはまれである。しかしながら、免疫力が低下している人などに日和見感染して感染症を引き起こす。特に、緑膿菌敗血症のような重篤な疾患を引き起こした場合の致死率は80%以上にもなる。
【0013】
これらの理由から、薬剤耐性菌、特に多剤耐性緑膿菌に代表されるMBL産生グラム陰性菌は、最も危険で重要な感染病原菌として認識されている。臨床の現場でこれらの産生株が広く蔓延をすることで、将来的に世界規模の深刻な問題を引き起こす可能性も指摘されており、MBL産生のグラム陰性菌の早期発見と伝播を止める対策は重要である。
【0014】
MBLとしては、IMP型、VIM型、SPM型が世界的によく知られている。その中でもIMP型が代表的なMBLであり、さらに、近年問題視されている多剤耐性緑膿菌も、主としてIMP型のMBLを産生していることが分かっている。そのため、IMP型のMBLを迅速に検出し、隔離や適切な治療を施すことで、これらの耐性菌を封じ込めることが可能となる。
【0015】
IMP型のMBLには亜型(subtype)が存在し、現在まででIMP−1からIMP−29までの29種の亜型が知られており、その中でIMP−17,IMP−23,IMP−27,IMP−28,IMP−29を除くIMP−1,IMP−2,IMP−3,IMP−4,IMP−5,IMP−6,IMP−7,IMP−8,IMP−9,IMP−10,IMP−11,IMP−12,IMP−13,IMP−14,IMP−15,IMP−16,IMP−18,IMP−19,IMP−20,IMP−21,IMP−22,IMP−24,IMP−25,およびIMP−26のアミノ酸配列が分かっている。
【0016】
これらIMP型のMBLを簡便・容易に検出することは、これまでに不可能であった。
【0017】
現在、MBLを検出する技術としては、2価イオンキレート剤のジピコリン酸を使用したディスク拡散法、特許文献1(特開2001−299388号公報)記載のMBL阻害剤のチオグリコール酸(メルカプト酢酸)を使用した方法がある。
【0018】
MBLは活性中心に亜鉛を持っているため、亜鉛とキレートすることで活性を不活化することができ、ジピコリン酸、チオグリコール酸や2−メルカプトプロピオン酸もMBLの阻害剤として用いることができる。この方法を用いた製品としてはドライプレート'栄研'DPD1(栄研化学株式会社、商標)やメタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社、商標)がある。
【0019】
具体的には、検体に分離培養した菌のコロニーを用い、検査する培地上の一方に抗菌薬のみをもう一方には抗菌薬とMBL阻害剤を近接して置いた状態で、培地に菌体を播いて培養する。培地上に設置した抗菌剤や阻害剤の周辺に、発育の阻害を受けて作る阻止帯の有無や大きさを比較することで、MBL産生株かどうかを検出することができる。
【0020】
しかしながら、検査をするためには16時間以上培養しなければならず長時間を要してしまう。また阻止帯の大きさによっては判定不能となること、菌体数を濁度法などで正確に定量する必要があることから、簡便・迅速な測定方法とは言い切れない。また、ハイリスクであるプラスミド伝搬性のIMP型のMBL産生株のみを検出することはできない。
【0021】
また、別の方法としては、特許文献2(WO 02/24707号公報)記載のMBLに分解され発色するセファロスポリン化合物の基質とMBL阻害剤を併用する試薬がある。この方法ではMBLおよび基質特異性拡張型β−ラクタマーゼ(ESBL)によって分解される発色基質をテストストリップに塗布してあり、そこに分離培養コロニーから採取した菌体をこすりつけ、菌の産生するMBLもしくはESBLにより発色基質が分解されることでテストストリップが変色して判定できる仕組みである。
【0022】
さらにESBLかMBLかを特定するには、発色基質のみのものと、発色基質と共にMBL阻害剤を塗ったものとを用意し、同一検体で同時に測定して結果を比較する必要がある。この方法を用いた製品としては、シカベータテストI/MBL(関東化学株式会社、商標)という検出試薬が市販されている。
【0023】
ここでMBL過剰産生菌の場合は、阻害剤の阻害能を超えてしまうことで基質が変色し、判定を誤る可能性もある。検査に使用する菌体を過剰にテストストリップに塗布すると偽陽性、少量であると偽陰性が生じる可能性もあり、適量を塗布するのに技量が必要となる。
【0024】
さらに、2〜8℃で保存する必要があり貯法にも注意を要する。従ってこの方法は15分と短時間での測定が可能ではあるが、簡便性には欠けているといわざるを得ない。また、この方法でも、ハイリスクであるプラスミド伝搬性のIMP型のMBL産生株のみを検出することはできない。
【0025】
更に、別の方法としては、プライマーを使って特定のMBL遺伝子を検出するPCR法や特許文献3(特開2007−195421号公報)記載のLAMP法などがある。
【0026】
遺伝子検査であるため検出感度が高く、各種のプライマーを用意することで遺伝子型まで特定できるが、全ての亜型を検出するプライマーはないため、必要な遺伝子型のプライマーをそれぞれに用意する必要がある。さらに高価な機械や、高度な手技、抽出作業といった手間が必要となり、測定可能な施設や人が限られてしまう問題がある。
【0027】
検体は、一度分離培養したものを用いるが、従来法ではMBL検出のためには、さらに検査時にもう一度培養する必要があるため、より多くの時間を要してしまい迅速に結果がわからないことや、無菌操作の手技、培養状況の判定などが必要であり誰でも容易にはできないことがあった。また、IMP型のMBLを捕捉しようとするとPCRのような遺伝子検査でしか実現可能でなく、遺伝子検査においては、変異型毎にプライマーを用意する必要があった。
【特許文献1】特開2001−299388号公報
【特許文献2】WO 02/24707号公報
【特許文献3】特開2007−195421号公報
【発明の開示】
【発明が解決しようとする課題】
【0028】
そこで本発明は、迅速かつ簡便にIMP型MBLを検出するためのモノクローナル抗体及びその関連技術を提供することを目的とする。
【課題を解決するための手段】
【0029】
第1の発明に係るモノクローナル抗体は、IMP−1及びその亜型に対して特異的に反応する。
【0030】
第2の発明に係るモノクローナル抗体は、第1の発明に加え、IMPのアミノ酸配列においてN末端側103番目から108番目の6残基に対し特異的に反応する。
【0031】
第3の発明に係るモノクローナル抗体は、第2の発明に加え、6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応する。
【0032】
第4の発明に係るモノクローナル抗体は、第1の発明に加え、IMPのアミノ酸配列においてN末端側113番目から121番目の9残基に対し特異的に反応する。
【0033】
第5の発明に係るモノクローナル抗体は、第4の発明に加え、9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応する。
【0034】
第9の発明に係る検査装置は、ストリップと、ストリップの上流側に配置される滴下部と、ストリップの下流側に配置される吸水ろ紙と、滴下部より吸水ろ紙に至る流れ方向下流側に配置され第1の抗体を標識したものを流動可能に保持する塗布部と、塗布部と吸水ろ紙との間に配置され第2の抗体が固相される検査部とを備える検査装置であって、第1の抗体と第2の抗体の一方は、第1の発明に係るモノクローナル抗体であり、第1の抗体と第2の抗体の他方は、第2の発明又は第4の発明に係るモノクローナル抗体である。
【発明の効果】
【0035】
本発明によれば、IMP型MBLを特異的、迅速かつ簡便に検出することができる。
【発明を実施するための最良の形態】
【0036】
(開発の経緯)
まず本発明者らが本願発明の完成に達するまでの経緯を述べる。本発明者らは、薬剤耐性細菌が持っているβ−ラクタム系薬剤に対する耐性因子IMPを免疫学的に簡便に測定しうる装置を開発するために、その代表的な酵素タンパク質であるIMP−1を用いてモノクローナル抗体の作製を行った。
【0037】
モノクローナル抗体の作製は、免疫源にIMP−1発現タンパク質を使用して行った。すなわち、IMP−1蛋白質発現プラスミドpET28−blaIMPで形質転換した大腸菌株BL21(DE3)を、50μg/ml カナマイシンを含むLB培地中、37℃で培養した。
【0038】
600nmでの吸光度が0.8を示した対数増殖期にIPTGを最終濃度が1mMになるように加え、組換えIMP−1タンパク質の発現を誘導した。誘導後、2時間培養し菌体を回集した。これを6Mグアニジン塩酸塩、0.1Mリン酸水素二ナトリウム、10mMトリス、5mMイミダゾール、(pH8.0)に溶解して、Ni−NTAアガロースカラムに発現IMP−1タンパク質を結合させた。8M尿素、0.1Mリン酸水素二ナトリウム、10mMトリス、10mMイミダゾール(pH8.0)で洗浄した後、更にイミダゾールを最終濃度250mMになるように加えて組換えIMP−1をカラムから溶出した。以下に、IMP−1発現タンパク質の246個のアミノ酸配列を示す。
【0039】
MSKLSVFFIFLFCSIATAAESLPDLKIEKLDEGVYVHTSFEEVNGWGVVPKHGLVVLVNAEAYLIDTPFTAKDTEKLVTWFVERGYKIKGSISSHFHSDSTGGIEWLNSRSIPTYASELTNELLKKDGKVQATNSFSGVNYWLVKNKIEVFYPGPGHTPDNVVVWLPERKILFGGCFIKPYGLGNLGDANIEAWPKSAKLLKSKYGKAKLVVPSHSEVGDASLLKLTLEQAVKGLNESKKPSKPSN
【0040】
免疫法は、文献;生化学[69:128−131(1997).佐渡義一,香川恵:ラットリンパ節を用いる,効率的で,しかも,抗原量,労力,時間を節約できるモノクローナル抗体作製法]の方法に従い実施した。
【0041】
100μgの免疫源を含む溶液に等量のフロインド完全アジュバント(DIFCO社製)を加え完全に混合した後、WKYラットのフットパッドに投与した。その2週間後に同量の抗原をフロインド不完全アジュバントと混合し、ラット尾根部に投与し、さらに2週間後に同様の追加免疫を実施した。最終免疫後、3〜4日でPEGを用いてラット腸骨リンパ節細胞とミエローマ細胞(SP2/0)とを融合した。培養液にはHAT選択培地を使用し、約1週間後に培養上清を採取しスクリーニングに供した。
【0042】
モノクローナル抗体のスクリーニングには、IMP産生緑膿菌のNCGM2.S1株の溶菌物とIMP−1発現タンパク質を抗原とし、1次抗体に各抗IMP−1ラットモノクローナル抗体の培養上清を使用したウエスタンブロッティング法を使用した。
【0043】
その結果、緑膿菌の溶菌物とIMP−1発現タンパク質に強い反応性を示す2種のクローン(クローン4C9−C/F6とクローン4E7−C/F6)を得た。
【0044】
これら2種のモノクローナル抗体が認識する反応部位を分析するため、IMP−1のアミノ酸配列中の各種断片化ペプチドを合成して、全長IMP−1を固相化したマイクロプレートと各モノクローナル抗体の免疫反応における競合ELISA法で測定を行った結果、4C9−C/F6はN末端から103−108番目のGIEWLNを含むアミノ酸配列に、4E7−C/F6はN末端から113−121番目のPTYASELTNを含むアミノ酸配列にエピトープがあることが確認された。
【0045】
IMP−1の亜型は29種報告されているが、そのうちアミノ酸配列が分かっているものはIMP−1,IMP−2,IMP−3,IMP−4,IMP−5,IMP−6,IMP−7,IMP−8,IMP−9,IMP−10,IMP−11,IMP−12,IMP−13,IMP−14,IMP−15,IMP−16,IMP−18,IMP−19,IMP−20,IMP−21,IMP−22,IMP−24,IMP−25ならびにIMP−26の24種類である。
【0046】
これらの亜型について本発明の2つのモノクローナル抗体のエピトープを含むN末端から101〜125番目の配列のアミノ酸配列について詳細に調べたところ、各変異株についてのアミノ酸配列が異なる部分が確認された。これを次表に示す。
【0047】
【表1】

これらの各亜型について本発明のモノクローナル抗体が反応するかどうかを確認するために、免疫源の組み換え体IMP−1の作製法と同様の方法を用いて変異に対応する各アミノ酸を置換した組み換え亜型Type2〜8を次表に従って作製した。
【0048】
【表2】

【0049】
固相化メンブレンにIMP−1亜型組み換えタンパク質を、金コロイド標識に4C9−C/F6または4E7−C/F6の各モノクローナル抗体を用いたイムノクロマト装置にて、各組み換え体タンパク質Type1〜8を添加し反応に阻害がかかるかどうかを調べた。
【0050】
その結果、4C9−C/F6、4E7−C/F6ともに全ての組み換え体タンパク質にて反応に阻害がかかり、本発明のモノクローナル抗体はいずれもこれらの亜型について反応することが確認された。
【0051】
従って本発明のモノクローナル抗体4C9−C/F6はN末端から103−108番目のGIEWLNを含むアミノ酸配列のみならず105番目のアミノ酸E(グルタミン酸)をG(グリシン)に置換したGIGWLNにも反応性を有することが分かった。
【0052】
一方、4E7−C/F6はN末端から113−121番目のPTYASELTNを含むアミノ酸配列のみならず、113番目のP(プロリン)をS(セリン)に置換したSTYASELTN、118番目のE(グルタミン酸)をV(バリン)に置換したPTYASVLTNにも反応性を有することが分かった。
【0053】
この様に本発明のモノクローナル抗体は、免疫源であるIMP−1発現タンパク質に反応するのみならず、亜型のIMPも広く認識することが出来ることが確認された。
【0054】
本モノクローナル抗体がIMPのいずれの亜型にも反応性を有することは、IMPを広くかつ特異的に検出するために非常に有用である。このようにIMPを広く、特異的に検出するためのアミノ酸配列の条件としてIMPの立体構造において表面にあるアミノ酸配列であり、かつ、どの亜型にもある程度の共通したアミノ酸配列を有しているという条件を満たしていることが必要と考えられる。
【0055】
本発明のモノクローナル抗体である4C9−C/F6の認識部位は103−108であり、4E7−C/F6の認識部位は113−121であるが、それ以外の領域では22−30のLPDLKIEKLなどもエピトープの候補として考えられよう。そして、これらを認識部位として作製された抗体も、4C9−C/F6や4E7−C/F6と同様に、または本抗体と組み合わせることによってIMPの検出に利用できる。
【0056】
こうして得られたモノクローナル抗体はIMP−1のみならず、複数の亜型IMPに対しても反応性を有するため、これらを用いて作製される測定装置は、IMPを広範囲に、しかしながら特異的に検出可能であり大変有用性の高いものと考えられる。
【0057】
<原理>
(競合法を用いた免疫測定法)
本発明の実施の一形態として、固相化抗原および標識抗体からなる競合法を用いた免疫学的測定装置があげられる。
【0058】
IMP−1の全長またはモノクローナル抗体の認識部位を含むIMPの合成ペプチド(IMPの部分ペプチド)を固相に用い、本発明のモノクローナル抗体を直接的または間接的に標識して標識抗体として用いる。本発明のモノクローナル抗体に対して、検査対象物中のIMPと固相化されたIMPまたはIMPの部分ペプチドとを競合的に反応させ、検査対象物中のIMPの存在の有無を検出する。
【0059】
ここで用いる固相用の担体としては、ポリスチレン製のプレートやビーズ、ニトロセルロース性のメンブレンフィルターなど、免疫学的測定装置で一般的に用いられるものが利用できる。また標識抗体用の標識としては、酵素、金属やラテックスからなる有色粒子、蛍光物質など、免疫学的測定装置で一般的に用いられるものが利用できる。
【0060】
(サンドイッチ法を用いた免疫測定法)
また、別の本発明における実施の一形態として、固相側、および標識抗体側にそれぞれ異なる本発明のモノクローナル抗体を用いた免疫学的測定装置があげられる。
【0061】
本発明のモノクローナル抗体の一方を固相に用い、他方のモノクローナル抗体を直接的または間接的に標識して標識抗体として用いる。検査対象物中にIMPが存在すると、固相化されたモノクローナル抗体と標識抗体により抗原がサンドイッチ結合し、検査対象物中のIMPの存在の有無を検出する。
【0062】
(イムノクロマトの作製法)
また、更に好ましい本発明における実施の一形態として、イムノクロマト法を用いた免疫学的測定装置があげられる。
【0063】
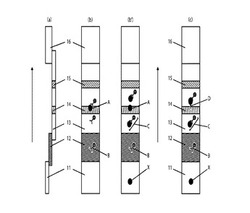
ここで、イムノクロマト装置の原理を、図1を参照しながら説明すると、イムノクロマト装置は、短冊形状の多孔質坦体13(例えば、ニトロセルロース膜からなる)を主として構成される。検体を抽出するための液、すなわち検体抽出液のクロマト的な流動方向に沿って、上流側から順に、滴下部11と標識区域12と検出区域14と対照区域15と吸液部16とが、連設される。
【0064】
多孔質坦体13あるいはその他の要素は、更に、プラスチック等よりなる基体に固定されて強度が付与されていてもよく、また、保護のために表面に透明なフィルム等が貼られていてもよい。
【0065】
標識区域12は、保水性担体を含み、保水性担体は、本発明のモノクローナル抗体(B)を有色粒子により標識したものを乾燥状態で保持し、試料滴下後に湿潤された状態において流動可能にこれを保持する。
【0066】
保水性担体としては、例えば、ポリエステル、レーヨン、ポリプロピレン等からなる不織布、あるいはセルロース、パルプ、ガラス繊維等からなる濾紙を挙げることができる。
【0067】
有色粒子としては、例えば、金、セレンからなる金属コロイド、あるいは、スチレン、塩化ビニル、アクリロニトリル、酢酸ビニル、アクリル酸エステル、メタクリル酸エステル等のビニル系モノマーの単一重合体や共重合体、スチレン−ブタジエン共重合体、メチルメタクリレート−ブタジエン共重合体等のブタジエン系共重合体等に着色してなるラテックス微粒子を挙げることができる。
【0068】
これらのうち、抗体又は抗原の吸着性が優れ、かつ、生物学的活性を長期間安定に保持できる等の理由から、金コロイド、またはポリスチレン系の着色ラテックス粒子が有色粒子として好適に用いられる。
【0069】
抗体を有色粒子に結合するには、例えば、物理的又は化学的な吸着法等によることができる。
【0070】
さらに、対照区域15には、標識抗体成分に対して特異的に結合する物質が固相化される。検出対象物の有無にかかわらず、対照区域15にライン状のサインが現れることでイムノクロマトグラフィー試験が正常に行われたかどうかを判定できる。
【0071】
(イムノクロマトにおける競合法)
検出区域14は、IMP−1または、IMPの部分ペプチド(A)が多孔質坦体13上に固相されている。標識区域12の本発明のモノクローナル抗体標識物(B)は、固相化されたIMP−1またはIMPの部分ペプチド(A)を認識する。
【0072】
図1(b)のように検査対象物中にIMPが存在しないとき、本発明のモノクローナル抗体(B)は検出区域14において固相化されているIMP−1または、IMPの部分ペプチド(A)との抗原抗体反応によって複合体を形成する。複合体を形成することで、検出区域14が有色粒子により色づけされ、ライン状のサインが現れることになる。
【0073】
一方、図1(b')のように検査対象物中にIMPが存在し、それが滴下部11に滴下されたとき、この検査対象物中のIMP(X)は、クロマト的な流動により、まず、標識区域12の本発明のモノクローナル抗体標識物(B)と抗原抗体反応して、複合体(C)を形成する。
【0074】
複合体(C)が形成され、本発明のモノクローナル抗体標識物(B)は検出区域に固相化されているIMP−1または、IMPの部分ペプチド(A)と抗原抗体反応することができず流れていくため、検出区域14において線状のサインが現れない。従ってライン状のサインが出現しないことにより検査対象物中のIMPの存在を検出することができる。
【0075】
(イムノクロマトにおけるサンドイッチ法)
図1(c)において、検出区域14は、本発明のモノクローナル抗体(D)が多孔質坦体13上に固相化されている。
【0076】
検査対象物中にIMPが存在し、それが滴下部11に滴下されたとき、この検査対象物中のIMP(X)は、クロマト的な流動により、まず、標識区域12の本発明のモノクローナル抗体標識物(B)との抗原抗体反応によって、複合体(C)を形成する。
【0077】
検出区域14の本発明のモノクローナル抗体(D)はIMP(X)を認識するため、この複合体(C)は検出区域14に捕捉される。例えば、図1(c)の形態のように、モノクローナル抗体(D)が検出区域14に線状に固相化されていれば、検出区域14が有色粒子により色づけされ、ライン状のサインが現れることになる。
【0078】
以下に緑膿菌を用いたIMPの検出について実例をあげて、本発明をより詳細に説明するが、本発明は、この実施例に限定されるものでない。
【0079】
<実施例1>
[ELISA競合法による測定]
検体としてIMP−1発現タンパク質を用い、免疫源のIMP−1発現タンパク質を固相に使用したELISA競合法による測定を行った。
【0080】
(検体試料液の調製)
pH7.4に調整した0.5%のカゼインを含む30mM PBSでIMP−1発現タンパクを0.1μg/mL、1.0μg/mL、10μg/mLとなるように調整し、検体試料液として用いた。対照として、0.5%のカゼインを含むPBSのみを用いた。
【0081】
(検出装置の作製と反応性試験)
IMP−1発現タンパク質をPBSで1μg/mLとなるように希釈し、nuncマキスソープイムノプレート(サーモフィッシャーサイエンティフィック株式会社、商標)の各ウエルに100μgずつ加え、4℃で15時間インキュベートし固相化した。
【0082】
その後、固相化用の溶液を除き、pH8.5に調整した0.5%カゼインを含むホウ酸緩衝液を300μg加えた後、4℃で15時間静置し、ブロッキングを行った。ブロッキング液を除き、0.05%のTween20を含むPBS(PBS−T)で各ウエルを洗浄した。
【0083】
Alkaline Phosphatase Labeling Kit−NH2(株式会社同仁化学研究所、商標)を用い、本発明のモノクローナル抗体4C9−C/F6をアルカリフォスファターゼ(ALP)標識し、0.5%のカゼインを含むPBSでALP標識4C9−C/F6を1μg/mLに希釈した後、ウエルに50μgずつ希釈した。そこに、調整した検体試験薬をそれぞれ50μgずつウエルに添加した。
【0084】
これらを37℃で1時間反応させた後、PBS−Tで洗浄し、Pierce 1−Step PNPP(サーモフィッシャーサイエンティフィック株式会社、商標)を100μg添加し、室温で120分反応後、405nmの吸光度を測定した。4E7−C/F6も以上と同様に測定した。
【0085】
(結果の検討)
【0086】
【表3】

【0087】
結果は表3のとおりとなり、添加したIMP−1発現タンパク質濃度が上がるにつれ、吸光度が下がっており、競合的に反応することが確認できた。ELISA競合法を利用した検出装置によって、検体試料液中のIMP−1を検出することができた。また、同様の手法により検体に菌体の培養物を用いることにより、検体中のIMPを検出することも可能である。
【0088】
<実施例2>
[イムノクロマト競合法による測定]
【0089】
検体としてIMP−1発現タンパク質を用い、免疫源のIMP−1発現タンパク質を固相に用いたイムノクロマト競合法による測定を行った。以下、図1(b)の形態に沿って検出装置の作製方法を示す。
【0090】
(標識成分の調製)
G.Frens(Nature,241,20−22,1973)の方法に従い金コロイド粒子を作製した。この金コロイド10mLに対し、抗IMPモノクローナル抗体4C9−C/F6を40μg室温にて混合し、金コロイド標識抗IMPモノクローナル抗体4C9−C/F6を調製した。同様に金コロイド標識抗IMPモノクローナル抗体4E7−C/F6も調製した。
【0091】
(標識区域12の調製)
金コロイド標識抗IMPモノクローナル抗体4C9−C/F6をOD520nm=1.0となるように調製し、反応確認のために対照として金コロイド標識ウサギγグロブリンをOD520nm=0.2となるように調製したものを混合し調製液を作製した。
【0092】
この調製液をガラス繊維パッドにテスト当たり36μLずつそれぞれ塗布した後、凍結乾燥させ、標識区域12である金コロイド標識抗IMPモノクローナル抗体4C9−C/F6塗布パッドを調製した。4E7−C/F6についても同様に金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドを調製した。
【0093】
(検出区域14の調製)
IMP−1発現タンパク質を10μg/mLとなるようにPBS緩衝液で調製し、多孔質坦体13であるニトロセルロースメンブレン(ミリポア社)の所定位置に、テスト当たり0.73μLでライン状に塗布し検出区域14を形成した。
【0094】
また、検出区域14の下流側に、抗ウサギ抗体を同様にテスト当たり0.73μLで塗布し、反応確認のための対照区域15を形成した。乾燥作業を経て、IMP−1発現タンパク質抗原固相化メンブレン(検出区域14の配置された多孔質担体13)を調製した。
【0095】
(検出装置の作製)
滴下部11としてのADVANTEC Grade60(商標)濾紙を用い、金コロイド標識抗IMPモノクローナル抗体4C9−C/F6塗布パッド、IMP−1発現タンパク質抗原固相化メンブレン、吸液部16としての濾紙とをそれぞれ重ね合わせ、粘着剤付きの台紙に貼付してイムノクロマト競合法を利用したIMP検出装置を作製した。同様に4C9−C/F6の代わりに4E7−C/F6を用いたIMP検出装置も作製した。
【0096】
(検体試料液の調製)
抽出液としてTris−HCl緩衝液を用い、この緩衝液でIMP−1発現タンパクを10μg/mLとなるように調製し、検体試料液として用いた。対照として、抽出液のみを用いた。
【0097】
(反応性試験)
作製した2種の検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。
【0098】
(結果の検討)
【0099】
【表4】

【0100】
4C9−C/F6を用いた検出装置は、検体試料液が抽出液のみの時、検出区域14に明確なライン発色が現れた。これは、金コロイド標識された4C9−C/F6が、ニトロセルロースメンブレン上に固相化されたIMP−1発現タンパク質と特異的に反応したため、そこで結合がおき、検出区域14で発色したことによる。
【0101】
一方、検体試料液にIMP−1発現タンパク質が存在する場合、検出区域14にてライン発色は認められなかった。これは、検体試料液中のIMP−1発現タンパク質が、クロマト的な流動により金コロイド標識された4C9−C/F6と先に特異的に反応したため、ニトロセルロースメンブレン上に固相化されたIMP−1発現タンパク質とは反応ができず、検出区域14で発色ができないことによる。
【0102】
金コロイド標識に4E7−C/F6を用いた検出装置も同様の結果であった。反応系の確認のための対照区域15はいずれも明確な発色を示した。
【0103】
このように、イムノクロマト競合法を利用した検出装置によって、ニトロセルロース上に固相化されたIMP−1発現タンパク質と検体試料液中のIMP−1発現タンパク質を競合的に反応させることで、検体試料液中のIMP−1発現タンパク質を検出することができた。
【0104】
検体と抽出液を混合させるだけで検体試料液は容易に作製でき、さらに滴下後、15分以内で反応性が確認できるため、非常に簡便かつ迅速に検出することができる。また、同様の手法で検体に菌体の培養物を用いることにより、検体中のIMPを検出することも可能である。
【0105】
<実施例3>
[イムノクロマトサンドイッチ法による測定]
実施例2の(標識成分の調製)と(標識区域12の調製)と同じ方法で金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドを調製した。
【0106】
(検出区域14の調製)
本発明のモノクローナル抗体4C9−C/F6を1.0mg/mLとなるようにPBS緩衝液で調製し、多孔質坦体13であるニトロセルロースメンブレン(ミリポア社)の所定位置に、テスト当たり0.73μLでライン状に塗布し検出区域14を形成した。
【0107】
また、検出区域14の下流側に、抗ウサギ抗体を同様にテスト当たり0.73μLで塗布し、反応確認のための対照区域15を形成した。乾燥作業を経て、抗IMPモノクローナル抗体4C9−C/F6固相化メンブレン(検出区域14の配置された多孔質担体13)を調製した。
【0108】
(検出装置の作製)
滴下部11としてのADVANTEC Grade60(商標)濾紙を用い、金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドと、抗IMPモノクローナル抗体4C9−C/F6固相化メンブレンと、吸液部16としての濾紙とをそれぞれ重ね合わせ、粘着剤付きの台紙に貼付してイムノクロマトサンドイッチ法を利用したIMP検出装置を作製した。
【0109】
(検体試料液の調製)
緑膿菌のIMP産生株はNCGM2.S1株を使用した。これをMH寒天培地上にて37℃の条件下で静置培養した。菌株のコロニーを滅菌された綿棒で1コロニーかきとり、0.7mLの抽出液中で菌体を破砕し、これを検体試料液として用いた。抽出液にはTris−HCl緩衝液を使用している。対照として、緑膿菌のIMP非産生株であるATCC27853株を用いた検体試料液も調製した。
【0110】
(反応性試験)
作製した検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。
【0111】
(結果の検討)
【0112】
【表5】

【0113】
結果は、表5、図2のとおりである。IMP非産生緑膿菌検体では、図2(a)に示すように、検出区域14にライン発色が認められなかった。これはIMPが検体試料液に含まれず、本発明のモノクローナル抗体と反応しないためである。
【0114】
一方、IMP産生緑膿菌検体では、図2(b)に示すように、検出区域14に明確なライン発色が認められた。これはIMPが検体試料液に含まれているため、金コロイド標識した4E7−C/F6とニトロセルロースメンブレンに固相化された4C9−C/F6がそれぞれIMPと特異的に反応し、検出区域14でこれらがサンドイッチ的に結合したため発色したことによる。
【0115】
イムノクロマトサンドイッチ法を利用した検出装置によって、検体試料液中のIMPを検出することができた。実際の菌株を用いても菌株と抽出液を混合させるのみで、検体試料液は調製することができ、さらに、滴下後15分以内で反応性が確認できるため、非常に簡便かつ迅速に検出することが実証された。
【0116】
<実施例4>
[イムノクロマトサンドイッチ法とPCRまたはSMA法による測定の比較]
緑膿菌248株を検体として用いた。
【0117】
(イムノクロマトサンドイッチ法を利用したIMP検出装置での測定)
実施例3の(標識成分の調製)から(検出装置の作製)までと同様の方法でイムノクロマトサンドイッチ法を利用したIMP検出装置を作製した。
【0118】
(検出装置の検体試料液の調製)
緑膿菌248株をミューラーヒントン(MH)寒天培地上にて37℃の条件下でそれぞれ静置培養した。菌株のコロニーを滅菌された綿棒で1コロニーかきとり、0.7mLの抽出液中で菌体を破砕し、これを検体試料液として用いた。抽出液にはTris−HCl緩衝液を使用している。
【0119】
(反応性試験)
作製した検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。ライン発色が認められたものを陽性とした。
【0120】
(SMA法での測定)
メタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社,商標)の説明書に基づき検体の248株の緑膿菌株を測定した。すなわち、抗菌薬としてイミペネム(IPM)含有のKBディスク(栄研化学株式会社,商標)を用いた。SMAディスクはメタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社,商標)を用いた。SMAディスクに隣接しているIPMの阻止帯の直径がIPM単独の阻止帯の直径よりも5mm以上の拡大を認めたとき、陽性とした。
【0121】
(PCR法での測定)
PCRに用いる鋳型DNAは、菌体ボイル法により抽出した。
【0122】
PCRは以下の2種類のプライマーセットを使用して行った。プライマーセット1を用いることにより、IMP−1、IMP−3、IMP−4、IMP−6、IMP−7、IMP−10、IMP−25及びIMP−26を、プライマーセット2を用いることによりIMP−4、IMP−5、IMP−7、IMP−9、IMP−11、IMP−15、IMP−21及びIMP−26の亜型を検出した。詳細な亜型は、PCR検出により得られた増幅断片のダイレクトシークエンスを実施することで決定した。
【0123】
[プライマーセット1]
blaIMP-F1:GAAGTTAACGGGTGGGGCG
blaIMP-R1:CTTTAACCGCCTGCTCTAAT
【0124】
[プライマーセット2]
blaIMP-F2:GTATTCTTTATGTTTTTGTTTTGTAGCATT
blaIMP-R2:AAGCTTCTAAATTTGCGTCACCCAAATTAC
【0125】
(結果の検討)
結果をまとめると次表の通りである。
【0126】
【表6】

【0127】
【表7】

【0128】
表6において、イムノクロマトサンドイッチ法(本法)の結果とSMA法との結果を比較すると、本法が陽性でSMA方が陰性となった25検体にはIMP遺伝子があり、本法が陰性で、SMA方が陽性となった1検体にはIMP遺伝子がなかった。そのため、本法が、感度・特異度ともにSMA法より優れている結果となった。
【0129】
表7において、本法とPCR法との結果を比較すると、陽性191株、陰性57株と、全て一致した。このことにより、本法は感度・特異度よくIMPを検出することが確認できた。さらに陽性191株についてはダイレクトシークエンスでの分析の結果、IMP−1が144株、IMP−6が6株、IMP−7が25株、IMP−10が14株およびIMP−11が2株となり、IMP−1,IMP−6,IMP−7,IMP−10およびIMP−11が検体中に含まれていることが分かった。同一検体を本法でも検出できているため、実際の緑膿菌体の産生するIMP亜型にも反応することが認められた。
【0130】
ここで、判定するまでの手間や時間を考えると、SMA法では培地にまく菌体の量を一定にするため濁度法により調製する必要があり、検体の調製に時間と手間がかかった。さらに、判定のために再度培養に16時間以上時間を要するため、簡便さや迅速さに欠けてしまう。
【0131】
また、PCR法では、菌体からDNAの抽出作業を行う必要があり、IMPの亜型を網羅的に検出しようとすると複数のプライマーを用意する必要がある。さらに、測定の為に、高価な機器や設置場所を必要とするため、こちらも簡便さや迅速さに欠けてしまう。
【0132】
しかし、本法は菌体と抽出液を混合させるだけで検体試料液を調製でき、さらに判定は15分以内と短時間であり、判定もライン発色の有無を目視にて確認できるためより容易に測定することができる。
【図面の簡単な説明】
【0133】
【図1】(a)本発明の一実施の形態における検出装置の側面図、(b)〜(c)本発明の一実施の形態における検出装置の正面図
【図2】(a)〜(b)本発明の一実施の形態における検出区域の拡大図
【符号の説明】
【0134】
11 滴下部
12 標識区域
13 多孔質担体
14 検出区域
15 対象区域
16 吸液部
A IMP−1またはIMPの部分ペプチド
B モノクローナル抗体標識物
C 複合体
D モノクローナル抗体
X IMP
【技術分野】
【0001】
本発明は、モノクローナル抗体、それを用いる検査装置に係り、特に、β−ラクタム系薬剤に対する細菌の耐性因子であるIMP型メタロ−β−ラクタマーゼの検出に関するものである。
【背景技術】
【0002】
病原性微生物により惹き起される感染症の問題は、人類にとってたいへん重大であり、時として重篤な病状を伴う大流行を発生させ、多数の感染患者、更には死者を出してきた。そして病原性微生物の増殖を抑制できる抗生物質ペニシリンの発見により、細菌性感染症の治療は急速な進展を遂げ、それ以降も様々な抗生物質の開発が行われてきた。しかしながら、これらの抗生物質を使用していく中で、抗生物質を分解または無毒化する能力を獲得した細菌(耐性菌)が現れ、新たな問題となっている。
【0003】
医療現場において、特に高齢者や乳幼児、長期の入院患者などで免疫力が低下している場合や怪我や手術後の治療患者、各種カテーテル使用患者などで病原菌と直接接触する可能性が考えられる場合に、耐性菌による感染拡大、端的には院内感染が、大きな社会問題となっている。
【0004】
医療現場では感染対策のため、耐性菌のモニタリングを行い、万が一耐性菌を発見した場合には、適正な薬剤の選択、治療とともに、感染の蔓延を防止するための患者の隔離、消毒の徹底などが求められている。また、医療従事者を介しての感染拡大も考えられるため、徹底した感染経路の遮断や消毒、環境対策などが必要となる。この様な理由から、耐性菌の早期検出は、医療現場において抗生物質が効かない危険な耐性菌の感染蔓延を防止する目的でたいへん重要である。
【0005】
細菌の薬剤耐性には、いくつかの系統があることが分かっており、菌種により抗菌剤の有効性も当然異なっている。その抗菌剤の中でも人体への毒性が低く、広範囲の細菌種に対して有効な抗菌剤であるβ−ラクタム系薬剤が開発され広く使用されてきた。
【0006】
1990年代になると完全合成β−ラクタムのカルバペネム系薬剤が開発され、殆どの種類の細菌に効果を示すことで大いに期待された。β−ラクタム系薬剤は、分子構造中にβ−ラクタム環を有する抗菌薬の総称である。このβ−ラクタム系薬剤は、広域スペクトラムを示し、ペプチドグリカンを主成分とする細菌の細胞壁の合成を阻害することで、細菌に細胞分裂をできなくさせる効果や、細胞壁が浸透圧に耐えられず細菌を破裂して死菌させる効果がある。
【0007】
しかし、細菌の中でも特にグラム陰性菌において、このβ−ラクタム系薬剤の分解酵素であるβ−ラクタマーゼを産生し、β−ラクタム系薬剤を加水分解し失活させることで、強い耐性を持つものが出現した。
【0008】
この中でも、活性中心に亜鉛をもつメタロ−β−ラクタマーゼ(MBL)は、ほとんど全てのβ−ラクタム系薬剤に耐性を示すため、最後の砦とされているカルバペネム系薬剤を含め薬剤投与の選択肢がなくなってしまう、最も危険なβ−ラクタマーゼ耐性因子と考えられている。
【0009】
また、MBL産生菌の耐性因子は、その伝播しやすさについても問題視されている。菌自体の遺伝子DNAとは別に存在する独立したDNA分子であるプラスミドや可動性エレメントであるインテグロン上に耐性遺伝子を持つため、プラスミドを有する細菌同士の接触のみでこの因子の伝搬が容易に行われるのである。
【0010】
これは他の耐性菌であるメチシリン耐性黄色ブドウ球菌(MRSA)などが、多量の薬剤投与によって突然変異を起こし菌自体のDNAにメチシリン耐性を獲得して細胞分裂により増殖するのとは異なり、菌種をも超えて伝達されるため耐性菌が広範囲に劇的に増殖しやすいことを意味する。
【0011】
MBLは、Bacteroides fragilis、Serratia marcescens、Klebsiella pneumoniae、Escherichia coli等複数のグラム陰性菌で確認されており、特に緑膿菌(Pseudomonas aeruginosa)においては、多剤耐性緑膿菌(MDRP)における耐性因子の一つとしても注目され社会的にも大きな問題となっている。
【0012】
緑膿菌は常在菌であり、それ自体の病原性は低く健常者に対して感染症を引き起こすことはまれである。しかしながら、免疫力が低下している人などに日和見感染して感染症を引き起こす。特に、緑膿菌敗血症のような重篤な疾患を引き起こした場合の致死率は80%以上にもなる。
【0013】
これらの理由から、薬剤耐性菌、特に多剤耐性緑膿菌に代表されるMBL産生グラム陰性菌は、最も危険で重要な感染病原菌として認識されている。臨床の現場でこれらの産生株が広く蔓延をすることで、将来的に世界規模の深刻な問題を引き起こす可能性も指摘されており、MBL産生のグラム陰性菌の早期発見と伝播を止める対策は重要である。
【0014】
MBLとしては、IMP型、VIM型、SPM型が世界的によく知られている。その中でもIMP型が代表的なMBLであり、さらに、近年問題視されている多剤耐性緑膿菌も、主としてIMP型のMBLを産生していることが分かっている。そのため、IMP型のMBLを迅速に検出し、隔離や適切な治療を施すことで、これらの耐性菌を封じ込めることが可能となる。
【0015】
IMP型のMBLには亜型(subtype)が存在し、現在まででIMP−1からIMP−29までの29種の亜型が知られており、その中でIMP−17,IMP−23,IMP−27,IMP−28,IMP−29を除くIMP−1,IMP−2,IMP−3,IMP−4,IMP−5,IMP−6,IMP−7,IMP−8,IMP−9,IMP−10,IMP−11,IMP−12,IMP−13,IMP−14,IMP−15,IMP−16,IMP−18,IMP−19,IMP−20,IMP−21,IMP−22,IMP−24,IMP−25,およびIMP−26のアミノ酸配列が分かっている。
【0016】
これらIMP型のMBLを簡便・容易に検出することは、これまでに不可能であった。
【0017】
現在、MBLを検出する技術としては、2価イオンキレート剤のジピコリン酸を使用したディスク拡散法、特許文献1(特開2001−299388号公報)記載のMBL阻害剤のチオグリコール酸(メルカプト酢酸)を使用した方法がある。
【0018】
MBLは活性中心に亜鉛を持っているため、亜鉛とキレートすることで活性を不活化することができ、ジピコリン酸、チオグリコール酸や2−メルカプトプロピオン酸もMBLの阻害剤として用いることができる。この方法を用いた製品としてはドライプレート'栄研'DPD1(栄研化学株式会社、商標)やメタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社、商標)がある。
【0019】
具体的には、検体に分離培養した菌のコロニーを用い、検査する培地上の一方に抗菌薬のみをもう一方には抗菌薬とMBL阻害剤を近接して置いた状態で、培地に菌体を播いて培養する。培地上に設置した抗菌剤や阻害剤の周辺に、発育の阻害を受けて作る阻止帯の有無や大きさを比較することで、MBL産生株かどうかを検出することができる。
【0020】
しかしながら、検査をするためには16時間以上培養しなければならず長時間を要してしまう。また阻止帯の大きさによっては判定不能となること、菌体数を濁度法などで正確に定量する必要があることから、簡便・迅速な測定方法とは言い切れない。また、ハイリスクであるプラスミド伝搬性のIMP型のMBL産生株のみを検出することはできない。
【0021】
また、別の方法としては、特許文献2(WO 02/24707号公報)記載のMBLに分解され発色するセファロスポリン化合物の基質とMBL阻害剤を併用する試薬がある。この方法ではMBLおよび基質特異性拡張型β−ラクタマーゼ(ESBL)によって分解される発色基質をテストストリップに塗布してあり、そこに分離培養コロニーから採取した菌体をこすりつけ、菌の産生するMBLもしくはESBLにより発色基質が分解されることでテストストリップが変色して判定できる仕組みである。
【0022】
さらにESBLかMBLかを特定するには、発色基質のみのものと、発色基質と共にMBL阻害剤を塗ったものとを用意し、同一検体で同時に測定して結果を比較する必要がある。この方法を用いた製品としては、シカベータテストI/MBL(関東化学株式会社、商標)という検出試薬が市販されている。
【0023】
ここでMBL過剰産生菌の場合は、阻害剤の阻害能を超えてしまうことで基質が変色し、判定を誤る可能性もある。検査に使用する菌体を過剰にテストストリップに塗布すると偽陽性、少量であると偽陰性が生じる可能性もあり、適量を塗布するのに技量が必要となる。
【0024】
さらに、2〜8℃で保存する必要があり貯法にも注意を要する。従ってこの方法は15分と短時間での測定が可能ではあるが、簡便性には欠けているといわざるを得ない。また、この方法でも、ハイリスクであるプラスミド伝搬性のIMP型のMBL産生株のみを検出することはできない。
【0025】
更に、別の方法としては、プライマーを使って特定のMBL遺伝子を検出するPCR法や特許文献3(特開2007−195421号公報)記載のLAMP法などがある。
【0026】
遺伝子検査であるため検出感度が高く、各種のプライマーを用意することで遺伝子型まで特定できるが、全ての亜型を検出するプライマーはないため、必要な遺伝子型のプライマーをそれぞれに用意する必要がある。さらに高価な機械や、高度な手技、抽出作業といった手間が必要となり、測定可能な施設や人が限られてしまう問題がある。
【0027】
検体は、一度分離培養したものを用いるが、従来法ではMBL検出のためには、さらに検査時にもう一度培養する必要があるため、より多くの時間を要してしまい迅速に結果がわからないことや、無菌操作の手技、培養状況の判定などが必要であり誰でも容易にはできないことがあった。また、IMP型のMBLを捕捉しようとするとPCRのような遺伝子検査でしか実現可能でなく、遺伝子検査においては、変異型毎にプライマーを用意する必要があった。
【特許文献1】特開2001−299388号公報
【特許文献2】WO 02/24707号公報
【特許文献3】特開2007−195421号公報
【発明の開示】
【発明が解決しようとする課題】
【0028】
そこで本発明は、迅速かつ簡便にIMP型MBLを検出するためのモノクローナル抗体及びその関連技術を提供することを目的とする。
【課題を解決するための手段】
【0029】
第1の発明に係るモノクローナル抗体は、IMP−1及びその亜型に対して特異的に反応する。
【0030】
第2の発明に係るモノクローナル抗体は、第1の発明に加え、IMPのアミノ酸配列においてN末端側103番目から108番目の6残基に対し特異的に反応する。
【0031】
第3の発明に係るモノクローナル抗体は、第2の発明に加え、6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応する。
【0032】
第4の発明に係るモノクローナル抗体は、第1の発明に加え、IMPのアミノ酸配列においてN末端側113番目から121番目の9残基に対し特異的に反応する。
【0033】
第5の発明に係るモノクローナル抗体は、第4の発明に加え、9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応する。
【0034】
第9の発明に係る検査装置は、ストリップと、ストリップの上流側に配置される滴下部と、ストリップの下流側に配置される吸水ろ紙と、滴下部より吸水ろ紙に至る流れ方向下流側に配置され第1の抗体を標識したものを流動可能に保持する塗布部と、塗布部と吸水ろ紙との間に配置され第2の抗体が固相される検査部とを備える検査装置であって、第1の抗体と第2の抗体の一方は、第1の発明に係るモノクローナル抗体であり、第1の抗体と第2の抗体の他方は、第2の発明又は第4の発明に係るモノクローナル抗体である。
【発明の効果】
【0035】
本発明によれば、IMP型MBLを特異的、迅速かつ簡便に検出することができる。
【発明を実施するための最良の形態】
【0036】
(開発の経緯)
まず本発明者らが本願発明の完成に達するまでの経緯を述べる。本発明者らは、薬剤耐性細菌が持っているβ−ラクタム系薬剤に対する耐性因子IMPを免疫学的に簡便に測定しうる装置を開発するために、その代表的な酵素タンパク質であるIMP−1を用いてモノクローナル抗体の作製を行った。
【0037】
モノクローナル抗体の作製は、免疫源にIMP−1発現タンパク質を使用して行った。すなわち、IMP−1蛋白質発現プラスミドpET28−blaIMPで形質転換した大腸菌株BL21(DE3)を、50μg/ml カナマイシンを含むLB培地中、37℃で培養した。
【0038】
600nmでの吸光度が0.8を示した対数増殖期にIPTGを最終濃度が1mMになるように加え、組換えIMP−1タンパク質の発現を誘導した。誘導後、2時間培養し菌体を回集した。これを6Mグアニジン塩酸塩、0.1Mリン酸水素二ナトリウム、10mMトリス、5mMイミダゾール、(pH8.0)に溶解して、Ni−NTAアガロースカラムに発現IMP−1タンパク質を結合させた。8M尿素、0.1Mリン酸水素二ナトリウム、10mMトリス、10mMイミダゾール(pH8.0)で洗浄した後、更にイミダゾールを最終濃度250mMになるように加えて組換えIMP−1をカラムから溶出した。以下に、IMP−1発現タンパク質の246個のアミノ酸配列を示す。
【0039】
MSKLSVFFIFLFCSIATAAESLPDLKIEKLDEGVYVHTSFEEVNGWGVVPKHGLVVLVNAEAYLIDTPFTAKDTEKLVTWFVERGYKIKGSISSHFHSDSTGGIEWLNSRSIPTYASELTNELLKKDGKVQATNSFSGVNYWLVKNKIEVFYPGPGHTPDNVVVWLPERKILFGGCFIKPYGLGNLGDANIEAWPKSAKLLKSKYGKAKLVVPSHSEVGDASLLKLTLEQAVKGLNESKKPSKPSN
【0040】
免疫法は、文献;生化学[69:128−131(1997).佐渡義一,香川恵:ラットリンパ節を用いる,効率的で,しかも,抗原量,労力,時間を節約できるモノクローナル抗体作製法]の方法に従い実施した。
【0041】
100μgの免疫源を含む溶液に等量のフロインド完全アジュバント(DIFCO社製)を加え完全に混合した後、WKYラットのフットパッドに投与した。その2週間後に同量の抗原をフロインド不完全アジュバントと混合し、ラット尾根部に投与し、さらに2週間後に同様の追加免疫を実施した。最終免疫後、3〜4日でPEGを用いてラット腸骨リンパ節細胞とミエローマ細胞(SP2/0)とを融合した。培養液にはHAT選択培地を使用し、約1週間後に培養上清を採取しスクリーニングに供した。
【0042】
モノクローナル抗体のスクリーニングには、IMP産生緑膿菌のNCGM2.S1株の溶菌物とIMP−1発現タンパク質を抗原とし、1次抗体に各抗IMP−1ラットモノクローナル抗体の培養上清を使用したウエスタンブロッティング法を使用した。
【0043】
その結果、緑膿菌の溶菌物とIMP−1発現タンパク質に強い反応性を示す2種のクローン(クローン4C9−C/F6とクローン4E7−C/F6)を得た。
【0044】
これら2種のモノクローナル抗体が認識する反応部位を分析するため、IMP−1のアミノ酸配列中の各種断片化ペプチドを合成して、全長IMP−1を固相化したマイクロプレートと各モノクローナル抗体の免疫反応における競合ELISA法で測定を行った結果、4C9−C/F6はN末端から103−108番目のGIEWLNを含むアミノ酸配列に、4E7−C/F6はN末端から113−121番目のPTYASELTNを含むアミノ酸配列にエピトープがあることが確認された。
【0045】
IMP−1の亜型は29種報告されているが、そのうちアミノ酸配列が分かっているものはIMP−1,IMP−2,IMP−3,IMP−4,IMP−5,IMP−6,IMP−7,IMP−8,IMP−9,IMP−10,IMP−11,IMP−12,IMP−13,IMP−14,IMP−15,IMP−16,IMP−18,IMP−19,IMP−20,IMP−21,IMP−22,IMP−24,IMP−25ならびにIMP−26の24種類である。
【0046】
これらの亜型について本発明の2つのモノクローナル抗体のエピトープを含むN末端から101〜125番目の配列のアミノ酸配列について詳細に調べたところ、各変異株についてのアミノ酸配列が異なる部分が確認された。これを次表に示す。
【0047】
【表1】

これらの各亜型について本発明のモノクローナル抗体が反応するかどうかを確認するために、免疫源の組み換え体IMP−1の作製法と同様の方法を用いて変異に対応する各アミノ酸を置換した組み換え亜型Type2〜8を次表に従って作製した。
【0048】
【表2】

【0049】
固相化メンブレンにIMP−1亜型組み換えタンパク質を、金コロイド標識に4C9−C/F6または4E7−C/F6の各モノクローナル抗体を用いたイムノクロマト装置にて、各組み換え体タンパク質Type1〜8を添加し反応に阻害がかかるかどうかを調べた。
【0050】
その結果、4C9−C/F6、4E7−C/F6ともに全ての組み換え体タンパク質にて反応に阻害がかかり、本発明のモノクローナル抗体はいずれもこれらの亜型について反応することが確認された。
【0051】
従って本発明のモノクローナル抗体4C9−C/F6はN末端から103−108番目のGIEWLNを含むアミノ酸配列のみならず105番目のアミノ酸E(グルタミン酸)をG(グリシン)に置換したGIGWLNにも反応性を有することが分かった。
【0052】
一方、4E7−C/F6はN末端から113−121番目のPTYASELTNを含むアミノ酸配列のみならず、113番目のP(プロリン)をS(セリン)に置換したSTYASELTN、118番目のE(グルタミン酸)をV(バリン)に置換したPTYASVLTNにも反応性を有することが分かった。
【0053】
この様に本発明のモノクローナル抗体は、免疫源であるIMP−1発現タンパク質に反応するのみならず、亜型のIMPも広く認識することが出来ることが確認された。
【0054】
本モノクローナル抗体がIMPのいずれの亜型にも反応性を有することは、IMPを広くかつ特異的に検出するために非常に有用である。このようにIMPを広く、特異的に検出するためのアミノ酸配列の条件としてIMPの立体構造において表面にあるアミノ酸配列であり、かつ、どの亜型にもある程度の共通したアミノ酸配列を有しているという条件を満たしていることが必要と考えられる。
【0055】
本発明のモノクローナル抗体である4C9−C/F6の認識部位は103−108であり、4E7−C/F6の認識部位は113−121であるが、それ以外の領域では22−30のLPDLKIEKLなどもエピトープの候補として考えられよう。そして、これらを認識部位として作製された抗体も、4C9−C/F6や4E7−C/F6と同様に、または本抗体と組み合わせることによってIMPの検出に利用できる。
【0056】
こうして得られたモノクローナル抗体はIMP−1のみならず、複数の亜型IMPに対しても反応性を有するため、これらを用いて作製される測定装置は、IMPを広範囲に、しかしながら特異的に検出可能であり大変有用性の高いものと考えられる。
【0057】
<原理>
(競合法を用いた免疫測定法)
本発明の実施の一形態として、固相化抗原および標識抗体からなる競合法を用いた免疫学的測定装置があげられる。
【0058】
IMP−1の全長またはモノクローナル抗体の認識部位を含むIMPの合成ペプチド(IMPの部分ペプチド)を固相に用い、本発明のモノクローナル抗体を直接的または間接的に標識して標識抗体として用いる。本発明のモノクローナル抗体に対して、検査対象物中のIMPと固相化されたIMPまたはIMPの部分ペプチドとを競合的に反応させ、検査対象物中のIMPの存在の有無を検出する。
【0059】
ここで用いる固相用の担体としては、ポリスチレン製のプレートやビーズ、ニトロセルロース性のメンブレンフィルターなど、免疫学的測定装置で一般的に用いられるものが利用できる。また標識抗体用の標識としては、酵素、金属やラテックスからなる有色粒子、蛍光物質など、免疫学的測定装置で一般的に用いられるものが利用できる。
【0060】
(サンドイッチ法を用いた免疫測定法)
また、別の本発明における実施の一形態として、固相側、および標識抗体側にそれぞれ異なる本発明のモノクローナル抗体を用いた免疫学的測定装置があげられる。
【0061】
本発明のモノクローナル抗体の一方を固相に用い、他方のモノクローナル抗体を直接的または間接的に標識して標識抗体として用いる。検査対象物中にIMPが存在すると、固相化されたモノクローナル抗体と標識抗体により抗原がサンドイッチ結合し、検査対象物中のIMPの存在の有無を検出する。
【0062】
(イムノクロマトの作製法)
また、更に好ましい本発明における実施の一形態として、イムノクロマト法を用いた免疫学的測定装置があげられる。
【0063】
ここで、イムノクロマト装置の原理を、図1を参照しながら説明すると、イムノクロマト装置は、短冊形状の多孔質坦体13(例えば、ニトロセルロース膜からなる)を主として構成される。検体を抽出するための液、すなわち検体抽出液のクロマト的な流動方向に沿って、上流側から順に、滴下部11と標識区域12と検出区域14と対照区域15と吸液部16とが、連設される。
【0064】
多孔質坦体13あるいはその他の要素は、更に、プラスチック等よりなる基体に固定されて強度が付与されていてもよく、また、保護のために表面に透明なフィルム等が貼られていてもよい。
【0065】
標識区域12は、保水性担体を含み、保水性担体は、本発明のモノクローナル抗体(B)を有色粒子により標識したものを乾燥状態で保持し、試料滴下後に湿潤された状態において流動可能にこれを保持する。
【0066】
保水性担体としては、例えば、ポリエステル、レーヨン、ポリプロピレン等からなる不織布、あるいはセルロース、パルプ、ガラス繊維等からなる濾紙を挙げることができる。
【0067】
有色粒子としては、例えば、金、セレンからなる金属コロイド、あるいは、スチレン、塩化ビニル、アクリロニトリル、酢酸ビニル、アクリル酸エステル、メタクリル酸エステル等のビニル系モノマーの単一重合体や共重合体、スチレン−ブタジエン共重合体、メチルメタクリレート−ブタジエン共重合体等のブタジエン系共重合体等に着色してなるラテックス微粒子を挙げることができる。
【0068】
これらのうち、抗体又は抗原の吸着性が優れ、かつ、生物学的活性を長期間安定に保持できる等の理由から、金コロイド、またはポリスチレン系の着色ラテックス粒子が有色粒子として好適に用いられる。
【0069】
抗体を有色粒子に結合するには、例えば、物理的又は化学的な吸着法等によることができる。
【0070】
さらに、対照区域15には、標識抗体成分に対して特異的に結合する物質が固相化される。検出対象物の有無にかかわらず、対照区域15にライン状のサインが現れることでイムノクロマトグラフィー試験が正常に行われたかどうかを判定できる。
【0071】
(イムノクロマトにおける競合法)
検出区域14は、IMP−1または、IMPの部分ペプチド(A)が多孔質坦体13上に固相されている。標識区域12の本発明のモノクローナル抗体標識物(B)は、固相化されたIMP−1またはIMPの部分ペプチド(A)を認識する。
【0072】
図1(b)のように検査対象物中にIMPが存在しないとき、本発明のモノクローナル抗体(B)は検出区域14において固相化されているIMP−1または、IMPの部分ペプチド(A)との抗原抗体反応によって複合体を形成する。複合体を形成することで、検出区域14が有色粒子により色づけされ、ライン状のサインが現れることになる。
【0073】
一方、図1(b')のように検査対象物中にIMPが存在し、それが滴下部11に滴下されたとき、この検査対象物中のIMP(X)は、クロマト的な流動により、まず、標識区域12の本発明のモノクローナル抗体標識物(B)と抗原抗体反応して、複合体(C)を形成する。
【0074】
複合体(C)が形成され、本発明のモノクローナル抗体標識物(B)は検出区域に固相化されているIMP−1または、IMPの部分ペプチド(A)と抗原抗体反応することができず流れていくため、検出区域14において線状のサインが現れない。従ってライン状のサインが出現しないことにより検査対象物中のIMPの存在を検出することができる。
【0075】
(イムノクロマトにおけるサンドイッチ法)
図1(c)において、検出区域14は、本発明のモノクローナル抗体(D)が多孔質坦体13上に固相化されている。
【0076】
検査対象物中にIMPが存在し、それが滴下部11に滴下されたとき、この検査対象物中のIMP(X)は、クロマト的な流動により、まず、標識区域12の本発明のモノクローナル抗体標識物(B)との抗原抗体反応によって、複合体(C)を形成する。
【0077】
検出区域14の本発明のモノクローナル抗体(D)はIMP(X)を認識するため、この複合体(C)は検出区域14に捕捉される。例えば、図1(c)の形態のように、モノクローナル抗体(D)が検出区域14に線状に固相化されていれば、検出区域14が有色粒子により色づけされ、ライン状のサインが現れることになる。
【0078】
以下に緑膿菌を用いたIMPの検出について実例をあげて、本発明をより詳細に説明するが、本発明は、この実施例に限定されるものでない。
【0079】
<実施例1>
[ELISA競合法による測定]
検体としてIMP−1発現タンパク質を用い、免疫源のIMP−1発現タンパク質を固相に使用したELISA競合法による測定を行った。
【0080】
(検体試料液の調製)
pH7.4に調整した0.5%のカゼインを含む30mM PBSでIMP−1発現タンパクを0.1μg/mL、1.0μg/mL、10μg/mLとなるように調整し、検体試料液として用いた。対照として、0.5%のカゼインを含むPBSのみを用いた。
【0081】
(検出装置の作製と反応性試験)
IMP−1発現タンパク質をPBSで1μg/mLとなるように希釈し、nuncマキスソープイムノプレート(サーモフィッシャーサイエンティフィック株式会社、商標)の各ウエルに100μgずつ加え、4℃で15時間インキュベートし固相化した。
【0082】
その後、固相化用の溶液を除き、pH8.5に調整した0.5%カゼインを含むホウ酸緩衝液を300μg加えた後、4℃で15時間静置し、ブロッキングを行った。ブロッキング液を除き、0.05%のTween20を含むPBS(PBS−T)で各ウエルを洗浄した。
【0083】
Alkaline Phosphatase Labeling Kit−NH2(株式会社同仁化学研究所、商標)を用い、本発明のモノクローナル抗体4C9−C/F6をアルカリフォスファターゼ(ALP)標識し、0.5%のカゼインを含むPBSでALP標識4C9−C/F6を1μg/mLに希釈した後、ウエルに50μgずつ希釈した。そこに、調整した検体試験薬をそれぞれ50μgずつウエルに添加した。
【0084】
これらを37℃で1時間反応させた後、PBS−Tで洗浄し、Pierce 1−Step PNPP(サーモフィッシャーサイエンティフィック株式会社、商標)を100μg添加し、室温で120分反応後、405nmの吸光度を測定した。4E7−C/F6も以上と同様に測定した。
【0085】
(結果の検討)
【0086】
【表3】

【0087】
結果は表3のとおりとなり、添加したIMP−1発現タンパク質濃度が上がるにつれ、吸光度が下がっており、競合的に反応することが確認できた。ELISA競合法を利用した検出装置によって、検体試料液中のIMP−1を検出することができた。また、同様の手法により検体に菌体の培養物を用いることにより、検体中のIMPを検出することも可能である。
【0088】
<実施例2>
[イムノクロマト競合法による測定]
【0089】
検体としてIMP−1発現タンパク質を用い、免疫源のIMP−1発現タンパク質を固相に用いたイムノクロマト競合法による測定を行った。以下、図1(b)の形態に沿って検出装置の作製方法を示す。
【0090】
(標識成分の調製)
G.Frens(Nature,241,20−22,1973)の方法に従い金コロイド粒子を作製した。この金コロイド10mLに対し、抗IMPモノクローナル抗体4C9−C/F6を40μg室温にて混合し、金コロイド標識抗IMPモノクローナル抗体4C9−C/F6を調製した。同様に金コロイド標識抗IMPモノクローナル抗体4E7−C/F6も調製した。
【0091】
(標識区域12の調製)
金コロイド標識抗IMPモノクローナル抗体4C9−C/F6をOD520nm=1.0となるように調製し、反応確認のために対照として金コロイド標識ウサギγグロブリンをOD520nm=0.2となるように調製したものを混合し調製液を作製した。
【0092】
この調製液をガラス繊維パッドにテスト当たり36μLずつそれぞれ塗布した後、凍結乾燥させ、標識区域12である金コロイド標識抗IMPモノクローナル抗体4C9−C/F6塗布パッドを調製した。4E7−C/F6についても同様に金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドを調製した。
【0093】
(検出区域14の調製)
IMP−1発現タンパク質を10μg/mLとなるようにPBS緩衝液で調製し、多孔質坦体13であるニトロセルロースメンブレン(ミリポア社)の所定位置に、テスト当たり0.73μLでライン状に塗布し検出区域14を形成した。
【0094】
また、検出区域14の下流側に、抗ウサギ抗体を同様にテスト当たり0.73μLで塗布し、反応確認のための対照区域15を形成した。乾燥作業を経て、IMP−1発現タンパク質抗原固相化メンブレン(検出区域14の配置された多孔質担体13)を調製した。
【0095】
(検出装置の作製)
滴下部11としてのADVANTEC Grade60(商標)濾紙を用い、金コロイド標識抗IMPモノクローナル抗体4C9−C/F6塗布パッド、IMP−1発現タンパク質抗原固相化メンブレン、吸液部16としての濾紙とをそれぞれ重ね合わせ、粘着剤付きの台紙に貼付してイムノクロマト競合法を利用したIMP検出装置を作製した。同様に4C9−C/F6の代わりに4E7−C/F6を用いたIMP検出装置も作製した。
【0096】
(検体試料液の調製)
抽出液としてTris−HCl緩衝液を用い、この緩衝液でIMP−1発現タンパクを10μg/mLとなるように調製し、検体試料液として用いた。対照として、抽出液のみを用いた。
【0097】
(反応性試験)
作製した2種の検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。
【0098】
(結果の検討)
【0099】
【表4】

【0100】
4C9−C/F6を用いた検出装置は、検体試料液が抽出液のみの時、検出区域14に明確なライン発色が現れた。これは、金コロイド標識された4C9−C/F6が、ニトロセルロースメンブレン上に固相化されたIMP−1発現タンパク質と特異的に反応したため、そこで結合がおき、検出区域14で発色したことによる。
【0101】
一方、検体試料液にIMP−1発現タンパク質が存在する場合、検出区域14にてライン発色は認められなかった。これは、検体試料液中のIMP−1発現タンパク質が、クロマト的な流動により金コロイド標識された4C9−C/F6と先に特異的に反応したため、ニトロセルロースメンブレン上に固相化されたIMP−1発現タンパク質とは反応ができず、検出区域14で発色ができないことによる。
【0102】
金コロイド標識に4E7−C/F6を用いた検出装置も同様の結果であった。反応系の確認のための対照区域15はいずれも明確な発色を示した。
【0103】
このように、イムノクロマト競合法を利用した検出装置によって、ニトロセルロース上に固相化されたIMP−1発現タンパク質と検体試料液中のIMP−1発現タンパク質を競合的に反応させることで、検体試料液中のIMP−1発現タンパク質を検出することができた。
【0104】
検体と抽出液を混合させるだけで検体試料液は容易に作製でき、さらに滴下後、15分以内で反応性が確認できるため、非常に簡便かつ迅速に検出することができる。また、同様の手法で検体に菌体の培養物を用いることにより、検体中のIMPを検出することも可能である。
【0105】
<実施例3>
[イムノクロマトサンドイッチ法による測定]
実施例2の(標識成分の調製)と(標識区域12の調製)と同じ方法で金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドを調製した。
【0106】
(検出区域14の調製)
本発明のモノクローナル抗体4C9−C/F6を1.0mg/mLとなるようにPBS緩衝液で調製し、多孔質坦体13であるニトロセルロースメンブレン(ミリポア社)の所定位置に、テスト当たり0.73μLでライン状に塗布し検出区域14を形成した。
【0107】
また、検出区域14の下流側に、抗ウサギ抗体を同様にテスト当たり0.73μLで塗布し、反応確認のための対照区域15を形成した。乾燥作業を経て、抗IMPモノクローナル抗体4C9−C/F6固相化メンブレン(検出区域14の配置された多孔質担体13)を調製した。
【0108】
(検出装置の作製)
滴下部11としてのADVANTEC Grade60(商標)濾紙を用い、金コロイド標識抗IMPモノクローナル抗体4E7−C/F6塗布パッドと、抗IMPモノクローナル抗体4C9−C/F6固相化メンブレンと、吸液部16としての濾紙とをそれぞれ重ね合わせ、粘着剤付きの台紙に貼付してイムノクロマトサンドイッチ法を利用したIMP検出装置を作製した。
【0109】
(検体試料液の調製)
緑膿菌のIMP産生株はNCGM2.S1株を使用した。これをMH寒天培地上にて37℃の条件下で静置培養した。菌株のコロニーを滅菌された綿棒で1コロニーかきとり、0.7mLの抽出液中で菌体を破砕し、これを検体試料液として用いた。抽出液にはTris−HCl緩衝液を使用している。対照として、緑膿菌のIMP非産生株であるATCC27853株を用いた検体試料液も調製した。
【0110】
(反応性試験)
作製した検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。
【0111】
(結果の検討)
【0112】
【表5】

【0113】
結果は、表5、図2のとおりである。IMP非産生緑膿菌検体では、図2(a)に示すように、検出区域14にライン発色が認められなかった。これはIMPが検体試料液に含まれず、本発明のモノクローナル抗体と反応しないためである。
【0114】
一方、IMP産生緑膿菌検体では、図2(b)に示すように、検出区域14に明確なライン発色が認められた。これはIMPが検体試料液に含まれているため、金コロイド標識した4E7−C/F6とニトロセルロースメンブレンに固相化された4C9−C/F6がそれぞれIMPと特異的に反応し、検出区域14でこれらがサンドイッチ的に結合したため発色したことによる。
【0115】
イムノクロマトサンドイッチ法を利用した検出装置によって、検体試料液中のIMPを検出することができた。実際の菌株を用いても菌株と抽出液を混合させるのみで、検体試料液は調製することができ、さらに、滴下後15分以内で反応性が確認できるため、非常に簡便かつ迅速に検出することが実証された。
【0116】
<実施例4>
[イムノクロマトサンドイッチ法とPCRまたはSMA法による測定の比較]
緑膿菌248株を検体として用いた。
【0117】
(イムノクロマトサンドイッチ法を利用したIMP検出装置での測定)
実施例3の(標識成分の調製)から(検出装置の作製)までと同様の方法でイムノクロマトサンドイッチ法を利用したIMP検出装置を作製した。
【0118】
(検出装置の検体試料液の調製)
緑膿菌248株をミューラーヒントン(MH)寒天培地上にて37℃の条件下でそれぞれ静置培養した。菌株のコロニーを滅菌された綿棒で1コロニーかきとり、0.7mLの抽出液中で菌体を破砕し、これを検体試料液として用いた。抽出液にはTris−HCl緩衝液を使用している。
【0119】
(反応性試験)
作製した検出装置に検体試料液をピペットで100μL滴下した後、15分後の検出区域14のライン発色を確認した。ライン発色が認められたものを陽性とした。
【0120】
(SMA法での測定)
メタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社,商標)の説明書に基づき検体の248株の緑膿菌株を測定した。すなわち、抗菌薬としてイミペネム(IPM)含有のKBディスク(栄研化学株式会社,商標)を用いた。SMAディスクはメタロ−β−ラクタマーゼSMA'栄研'(栄研化学株式会社,商標)を用いた。SMAディスクに隣接しているIPMの阻止帯の直径がIPM単独の阻止帯の直径よりも5mm以上の拡大を認めたとき、陽性とした。
【0121】
(PCR法での測定)
PCRに用いる鋳型DNAは、菌体ボイル法により抽出した。
【0122】
PCRは以下の2種類のプライマーセットを使用して行った。プライマーセット1を用いることにより、IMP−1、IMP−3、IMP−4、IMP−6、IMP−7、IMP−10、IMP−25及びIMP−26を、プライマーセット2を用いることによりIMP−4、IMP−5、IMP−7、IMP−9、IMP−11、IMP−15、IMP−21及びIMP−26の亜型を検出した。詳細な亜型は、PCR検出により得られた増幅断片のダイレクトシークエンスを実施することで決定した。
【0123】
[プライマーセット1]
blaIMP-F1:GAAGTTAACGGGTGGGGCG
blaIMP-R1:CTTTAACCGCCTGCTCTAAT
【0124】
[プライマーセット2]
blaIMP-F2:GTATTCTTTATGTTTTTGTTTTGTAGCATT
blaIMP-R2:AAGCTTCTAAATTTGCGTCACCCAAATTAC
【0125】
(結果の検討)
結果をまとめると次表の通りである。
【0126】
【表6】

【0127】
【表7】

【0128】
表6において、イムノクロマトサンドイッチ法(本法)の結果とSMA法との結果を比較すると、本法が陽性でSMA方が陰性となった25検体にはIMP遺伝子があり、本法が陰性で、SMA方が陽性となった1検体にはIMP遺伝子がなかった。そのため、本法が、感度・特異度ともにSMA法より優れている結果となった。
【0129】
表7において、本法とPCR法との結果を比較すると、陽性191株、陰性57株と、全て一致した。このことにより、本法は感度・特異度よくIMPを検出することが確認できた。さらに陽性191株についてはダイレクトシークエンスでの分析の結果、IMP−1が144株、IMP−6が6株、IMP−7が25株、IMP−10が14株およびIMP−11が2株となり、IMP−1,IMP−6,IMP−7,IMP−10およびIMP−11が検体中に含まれていることが分かった。同一検体を本法でも検出できているため、実際の緑膿菌体の産生するIMP亜型にも反応することが認められた。
【0130】
ここで、判定するまでの手間や時間を考えると、SMA法では培地にまく菌体の量を一定にするため濁度法により調製する必要があり、検体の調製に時間と手間がかかった。さらに、判定のために再度培養に16時間以上時間を要するため、簡便さや迅速さに欠けてしまう。
【0131】
また、PCR法では、菌体からDNAの抽出作業を行う必要があり、IMPの亜型を網羅的に検出しようとすると複数のプライマーを用意する必要がある。さらに、測定の為に、高価な機器や設置場所を必要とするため、こちらも簡便さや迅速さに欠けてしまう。
【0132】
しかし、本法は菌体と抽出液を混合させるだけで検体試料液を調製でき、さらに判定は15分以内と短時間であり、判定もライン発色の有無を目視にて確認できるためより容易に測定することができる。
【図面の簡単な説明】
【0133】
【図1】(a)本発明の一実施の形態における検出装置の側面図、(b)〜(c)本発明の一実施の形態における検出装置の正面図
【図2】(a)〜(b)本発明の一実施の形態における検出区域の拡大図
【符号の説明】
【0134】
11 滴下部
12 標識区域
13 多孔質担体
14 検出区域
15 対象区域
16 吸液部
A IMP−1またはIMPの部分ペプチド
B モノクローナル抗体標識物
C 複合体
D モノクローナル抗体
X IMP
【特許請求の範囲】
【請求項1】
IMP−1及びその亜型に対して特異的に反応するモノクローナル抗体。
【請求項2】
IMPのアミノ酸配列においてN末端側103番目から108番目の6残基に対し特異的に反応する請求項1記載のモノクローナル抗体。
【請求項3】
前記6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応する請求項2記載のモノクローナル抗体。
【請求項4】
IMPのアミノ酸配列においてN末端側113番目から121番目の9残基に対し特異的に反応する請求項1記載のモノクローナル抗体。
【請求項5】
前記9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応する請求項4記載のモノクローナル抗体。
【請求項6】
ストリップと、
前記ストリップの上流側に配置される滴下部と、
前記ストリップの下流側に配置される吸水ろ紙と、
前記滴下部より前記吸水ろ紙に至る流れ方向下流側に配置され第1の抗体を標識したものを流動可能に保持する塗布部と、
前記塗布部と前記吸水ろ紙との間に配置され第2の抗体が固相される検査部とを備える検査装置であって、
前記第1の抗体と前記第2の抗体の一方は、請求項1記載のモノクローナル抗体であり、前記第1の抗体と前記第2の抗体の他方は、請求項2又は4記載のモノクローナル抗体である検査装置。
【請求項1】
IMP−1及びその亜型に対して特異的に反応するモノクローナル抗体。
【請求項2】
IMPのアミノ酸配列においてN末端側103番目から108番目の6残基に対し特異的に反応する請求項1記載のモノクローナル抗体。
【請求項3】
前記6残基がGIEWLN及びGIGWLNであるIMPの両方に対して特異的に反応する請求項2記載のモノクローナル抗体。
【請求項4】
IMPのアミノ酸配列においてN末端側113番目から121番目の9残基に対し特異的に反応する請求項1記載のモノクローナル抗体。
【請求項5】
前記9残基がPTYASELTN、STYASELTN及びPTYASVLTNであるIMPのいずれに対しても特異的に反応する請求項4記載のモノクローナル抗体。
【請求項6】
ストリップと、
前記ストリップの上流側に配置される滴下部と、
前記ストリップの下流側に配置される吸水ろ紙と、
前記滴下部より前記吸水ろ紙に至る流れ方向下流側に配置され第1の抗体を標識したものを流動可能に保持する塗布部と、
前記塗布部と前記吸水ろ紙との間に配置され第2の抗体が固相される検査部とを備える検査装置であって、
前記第1の抗体と前記第2の抗体の一方は、請求項1記載のモノクローナル抗体であり、前記第1の抗体と前記第2の抗体の他方は、請求項2又は4記載のモノクローナル抗体である検査装置。
【図1】


【図2】




【図2】


【公開番号】特開2012−240923(P2012−240923A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−109456(P2011−109456)
【出願日】平成23年5月16日(2011.5.16)
【出願人】(510192802)独立行政法人国立国際医療研究センター (8)
【出願人】(598034720)株式会社ミズホメディー (17)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月16日(2011.5.16)
【出願人】(510192802)独立行政法人国立国際医療研究センター (8)
【出願人】(598034720)株式会社ミズホメディー (17)
【Fターム(参考)】
[ Back to top ]

