ヤトロファ由来のNF−YBをコードするポリヌクレオチド及びその利用
【課題】乾燥ストレス耐性を付与した形質転換ヤトロファを作出する手法として、ヤトロファのNF-YBコード遺伝子を同定し、当該遺伝子を用いて形質転換体を作成する方法の提供。
【解決手段】ヤトロファ由来のNF-YB転写因子をコードする特定の塩基配列で示される単離されたDNA。該DNAが組み入れられた、ヤトロファ植物体形質転換用ベクター。当該ベクターを含む形質転換体。当該ベクターを用いて形質転換された、ヤトロファ植物体野生型と比べて、NF-YBを過剰発現できる、乾燥ストレス耐性形質転換ヤトロファ。
【解決手段】ヤトロファ由来のNF-YB転写因子をコードする特定の塩基配列で示される単離されたDNA。該DNAが組み入れられた、ヤトロファ植物体形質転換用ベクター。当該ベクターを含む形質転換体。当該ベクターを用いて形質転換された、ヤトロファ植物体野生型と比べて、NF-YBを過剰発現できる、乾燥ストレス耐性形質転換ヤトロファ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヤトロファ(Jatropha)属の新規な遺伝子としてNF-YB転写因子をコードするポリヌクレオチド及びその利用に関し、特に乾燥ストレス耐性ヤトロファ作出のための利用に関する。
【背景技術】
【0002】
ヤトロファ・クルカス(Jatropha curcas)から非食用ヤトロファ油を製造することができるため、バイオディーゼル燃料生産のための生物資源として注目を集めている。また、ヤトロファは、水分や無機栄養について、他の作物の生育不適地でも栽培できる植物として知られており、半乾燥地の有効利用と緑化のために非常に有益であると考えられている。一方、ヤトロファ属植物は、荒地で育つものの、結実回数も年1回、実のサイズもパームよりかなり小さいため、自然栽培による油脂の生産効率は高くない。このような理由から、生産性の高いヤトロファの開発が求められている。
【0003】
ヤトロファ油の生産性効率の改善方法の1つとしては、例えば特開2009−536029号公報(特許文献1)に開示されているように、種子の油含有量を増大させるべく、アセチルCoAカルボキシラーゼ(ACCアーゼ)を過剰発現可能に形質転換する方法がある。
【0004】
一方、ヤトロファ自体の生産性を上げる観点から、水不足条件下でも高い成長性を確保できるような乾燥耐性の付与が考えられる。
一般に、植物は、乾燥、塩、低温などの環境要因によって、生育が大きく左右されることから、環境ストレス耐性を付与した農作物の開発が期待されている。
乾燥ストレス耐性遺伝子組換え植物としては、乾燥ストレスに対して適応又は応答できるように、ストレス応答シグナル伝達強度、機構を改変したもの、耐性に関与するタンパク質分子(環境ストレスに応答するタンパク質)を過剰生産するように改良する方法などが考えられる。
【0005】
植物の環境ストレスに応答したシグナル伝達経路は、植物ホルモンのアブシジン酸(ABA)を介した経路とABAを介さない経路に大別され、さらに関与する転写制御因子のタイプによっても細分化される。また、応答にかかわるタンパク質についても、転写制御因子、プロテアーゼ、プロテインキナーゼ等の応答にかかわる制御タンパク質、シャペロンなどの耐性にかかる機能タンパク質などがあり、さまざまな生理応答を行っていると考えられている(篠崎一雄ら、朝倉植物生理学講座5環境応答、pp106-1145)。
【0006】
アブシジン酸(ABA)は、種子休眠、気孔の開閉、浸透圧ストレス耐性にかかわる植物ホルモンであり、ストレス応答性遺伝子群の発現にはABAが深く関与することが知られている。
例えば、非特許文献1(Wen-Xue Li et al., "The Arabidopsis NFYA5 Transcription Factor Is Regulated Transcriptionally and Posttranscriptionally to Promote Drought Resistance", The Plant Cell, Vol.20:2238-2251(2008))は、シロイヌナズナにおける乾燥ストレス耐性の制御機構に、NF−YA5転写因子が、ABA依存性で、乾燥ストレスにより強く誘導されること、NF−YA5を過剰発現させた形質転換シロイヌナズナが、野生型シロイヌナズナよりも乾燥ストレスに対する耐性に優れていたことを報告している。
【0007】
また、環境ストレス耐性シロイヌナズナを作製する方法としては、特開2005−253395号公報(特許文献2)に、環境ストレスにより発現されるストレス応答性タンパク質をコードする遺伝子の上流に存在するシスエレメントに結合して転写を活性化する転写因子(ストレス応答性転写因子)の制御下にある遺伝子群の活性化作用を利用する方法が提案されている。具体的には、ストレス応答性転写因子であるDREB/CBFの発現を誘導するシグナル伝達因子をコードする新規な遺伝子として、SRK2C遺伝子を開示するとともに、このSRK2C遺伝子を過剰発現するように形質転換したシロイヌナズナが、給水停止後も、コントロールに対して優位に高い生存率を示したことを開示している。
【0008】
さらに、非特許文献2(Donald E. Nelson et al., "Plant nuclear factor Y (NF-Y)B subunits confer drought tolerance and lead to improved corn yields on wate-limited acres" , PNAS, vol.104, No.42, 16450-16455(2007))には、トウモロコシNF-YB因子を同定し、これを用いて形質転換したトウモロコシが、野生型と比べて、水不足条件下での生産性が高かったことが報告されている。
【0009】
またさらに、特表2009−540830(特許文献3)には、イネ、トウモロコシ、ダイズ、ワタの水不足ストレス耐性植物として、シロイヌナズナ、トウモロコシ、ダイズのNF-YBタンパク質をコードするDNAに作動可能に連結されたプロモータを含む転写ユニットを導入した植物が開示されている。プロモータ等を工夫することで、NF-YBを過剰発現できるようにした形質転換植物は、水不足条件下でも、野生型コントロールと比べて、収量が改善されると報告されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−536029号公報
【特許文献2】特開2005−253395号公報
【特許文献3】特表2009−540830号公報
【非特許文献】
【0011】
【非特許文献1】Wen-Xue Li et al., "The Arabidopsis NFYA5 Transcription Factor Is Regulated Transcriptionally and Posttranscriptionally to Promote Drought Resistance", The Plant Cell, Vol.20:2238-2251(2008)
【非特許文献2】Donald E. Nelson et al., "Plant nuclear factor Y (NF-Y)B subunits confer drought tolerance and lead to improved corn yields on water-limited acres" , PNAS, vol.104, No.42, 16450-16455(2007)
【発明の開示】
【発明が解決しようとする課題】
【0012】
環境ストレスに対するシグナル伝達経路のメカニズムは複雑であり、乾燥ストレス耐性植物の作出についても、上記のように、種々の形質転換方法が提案されている。しかしながら、ヤトロファに関しては、乾燥ストレスにかかわる制御タンパク質、耐性にかかわる機能タンパク質などは明らかにされていないのが現状である。
【0013】
本発明の目的は、乾燥ストレス耐性ヤトロファを作出することにあり、その手法として、ヤトロファのNF-YBコード遺伝子を同定し、当該遺伝子を用いて、乾燥ストレス耐性を付与した形質転換ヤトロファを作出することにある。
【課題を解決するための手段】
【0014】
本発明者らは、ヤトロファのゲノム配列を明らかにし、さらにNF-YBコード遺伝子を単離、同定することに成功し、本発明を完成した。
すなわち、本発明の新規なDNAは、配列番号1〜13で示される、ヤトロファ由来のNF-YB転写因子をコードする、単離された13個のDNAのファミリーである。本発明は、さらに、配列番号14〜24で示される各アミノ酸配列からなる、ヤトロファ由来の単離されたNF-YBポリペプチド、及び配列番号25、26で示されるアミノ酸配列を有するヤトロファ由来の単離されたNF-YBポリペプチド断片も含み、これらのアミノ酸配列をコードするポリヌクレオチドも含む。
【0015】
本発明は、さらに、上記本発明のDNAが組み入れられた、ヤトロファ植物体形質転換用ベクター、当該ベクターを含む形質転換体、当該ベクターを用いて形質転換されたヤトロファ植物体であって、野生型と比べてNF-YB転写因子を過剰発現できる乾燥ストレス耐性形質転換ヤトロファも対象とする。
【発明の効果】
【0016】
本発明に係るポリヌクレオチドは、ヤトロファ由来のDNAであるから、形質転換体されたヤトロファにおいて天然のヤトロファが発現するNF-YBと同等の転写因子を過剰発現させることができ、ひいてはNF-YBが関与するタンパク合成の生産性、例えば乾燥ストレス耐性を向上させることができる。
【図面の簡単な説明】
【0017】
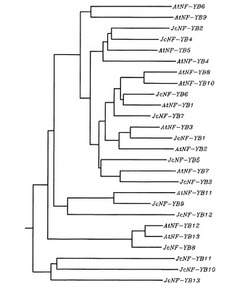
【図1】シロイロナズナとヤトロファのNF-YBの分子系統樹を示す図である。
【図2】NF-YB1〜NF-YB5のアガロース電気泳動の結果を示す写真である。
【図3】pGWB11プラスミドの遺伝子マップ(Nakagawa et al., “Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation”, Journal of Bioscience and Bioengineering Vol. 104 (2007), No. 1 p.38を参照)である。
【発明を実施するための形態】
【0018】
〔JcNF-YB遺伝子〕
本発明に係る単離された新規なヤトロファ遺伝子は、ヤトロファの野生型転写因子NF-YBをコードするDNAであり、ヤトロファゲノム中に個別に存在する13個の遺伝子ファミリーである。具体的には、配列番号1〜13に示すもの(これを各順に「JcNF-YB1遺伝子」−「JcNF-YB13遺伝子」と命名する)である。ただし、配列番号12、13は、ヤトロファの野生型転写因子NF-YBをコードするDNA断片である。
【0019】
上記本発明の各遺伝子を発現させて得られるポリペプチド、すなわちヤトロファの野生型転写因子NF-YB1〜NF-YB13(但し、NF-YB12,13は転写因子断片である)のアミノ酸配列を配列番号14〜26に各順に示す。本発明の遺伝子の塩基配列は、配列番号14−26に示すポリペプチドをコードする限り、塩基の一部が置換されていてもよい。例えば、配列番号1に示すJcNF-YB1 DNAにおいて、6番目の塩基Gを塩基Tに置換(配列番号39)することで、翻訳効率を野生型よりも高くすることができる。
以下、「JcNF-YB遺伝子」という場合は、ヤトロファ転写因子NF-YBをコードするポリヌクレオチドを総称する。
【0020】
本発明のJcNF-YB遺伝子の調製方法は特に限定しない。例えば、ヤトロファゲノムを鋳型とし、各NF-YB遺伝子に応じたプライマーを設計して、PCR反応を行うことにより、直接、目的とする遺伝子のPCR産物を得ることもできるし、乾燥ストレスを与えたヤトロファ植物の一部、好ましくは葉を摩砕して得られたmRNAから、下記プライマーセットを用いて、RT−PCR法により、目的とするポリヌクレオチドのPCR産物を得てもよい。
【0021】
好ましくは、Sudheerらの方法(Indian Journal of Biotechnology Vol. 8 (2009) p 187-192)に基づいて抽出したヤトロファゲノムを用いて、直接、目的とする遺伝子のPCR産物を得る方法である。Sudheerらの方法とは、使用する抽出バッファーからDNA沈殿化までに用いる溶液のNaCl濃度を調節している点、精製工程をTris飽和フェノール、続いてクロロホルムとイソアミルアルコールの混合液で処理する点、沈殿化工程で80%エタノールを用いる点に特徴がある。
【0022】
mRNAの調製は、通常行われる手法により行うことができる。例えば、凍結した植物体を乳鉢などで摩砕後、得られた摩砕物から、グリオキザール法、グアニジンチオシアネート−塩化セシウム法、塩化リチウム−尿素法、プロテイナーゼK−デオキシリボヌクレアーゼ法などにより、粗RNA画分を抽出調製すればよい。また、市販のキットを用いてもよい。
【0023】
得られたPCR産物の塩基配列の決定、確認は、従来より公知の手法、例えば、マキサム−ギルバートの化学修飾法、又はM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行えばよい。
【0024】
〔乾燥ストレス耐性形質転換ヤトロファの作出〕
本発明の乾燥ストレス耐性形質転換ヤトロファは、NF-YB遺伝子を発現又は発現調節のためのプロモータと作動可能に連結した発現カセットを、野生型ヤトロファに遺伝子導入することにより作製される。
【0025】
本発明が対象とするヤトロファの種類は特に限定せず、ヤトロファ・クルカス(Jatropha curcus)、ヤトロファ・ポタグリカ(Jatropha potagurica)、ヤトロファ・ムルチフィダ(Jatropha、multifida)、ヤトロファ・ベルランディエリ(Jatropha berlandieri)、ヤトロファ・インテゲリマ(Jatropha integerrima)などを用いることができる。これらのうち、油脂含有量が多いという点から、ヤトロファ・クルカスが好ましく用いられる
【0026】
遺伝子導入方法は、プロトプラスト同士を融合させる方法、電気穿孔法、遺伝子ショットガン法等の細胞に直接的にDNAを導入する方法;アグロバクテリウム(Agrobacterium tumefaciens)やR.rhizogenesを利用して間接的に導入する方法のいずれの方法により行ってもよいが、好ましくはアグロバクテリウムを用いる方法である。以下、アグロバクテリウムを用いる形質転換方法について説明する。
【0027】
アグロバクテリウムは植物病細菌で、LB(レフトボーダー)とRB(ライトボーダー)に挟まれた領域(T−DNA(Transferred DNA)領域)を切り出して宿主ゲノムに挿入することができるTiプラスミドをもっている。このT−DNA領域内に、導入しようとする遺伝子、すなわちJcNF-YB遺伝子を組み込んだプラスミドを有するアグロバクテリウムを、宿主植物へ感染させると、T−DNA領域が切り出されて、vir領域にコードされているタンパク質群と複合体を形成して植物細胞内に侵入し、さらに宿主ゲノムに挿入することができる。
【0028】
アグロバクテリウムを用いる形質転換方法としては、バイナリーベクター法が好ましい。バイナリーベクター法とは、TiプラスミドのT−DNAを欠落させたプラスミド(pAL4404など)とは別に、T−DNA領域のボーダー(LB及びRB)を有するプラスミドのT−DNA領域に目的の外来遺伝子を組み込んだプラスミドをアグロバクテリウムに導入して植物に感染させることにより、目的遺伝子を植物ゲノムに挿入する方法である。
【0029】
バイナリーベクター法を利用した、形質転換ヤトロファの作出に用いられる発現カセットは、T−DNA領域に、上記本発明に係るNF-YB遺伝子、及び当該ヌクレオチド発現のためのプロモータ、マーカー遺伝子、レポータ遺伝子を含んでいる。
【0030】
プロモータとしては、35Sカリフラワーモザイクウィルスプロモータ、ノパリンシンターゼ(NOS)プロモータ、並びにβファゼオリン、ナピン、ユビキチンなどの他の胚乳特異的プロモータが挙げられる。
【0031】
選択マーカー遺伝子としては、抗生物質または除草剤のような選択剤に対する抵抗性を付与する遺伝子が用いられる。具体的には、カナマイシン耐性遺伝子、パロモマイシンB耐性遺伝子、またはグルフォシネート及びグリフォセートのような除草剤に対する抵抗性遺伝子などが挙げられる。形質転換体を視覚的に同定できる選択マーカー、例えば、ルシフェラーゼ、または緑色蛍光タンパク質(GFP)のような発色または蛍光タンパク質を発現する遺伝子又は種々の発色体基質が知られているβグルクロニダーゼまたはGUSを発現する遺伝子も利用することができる。このような選択マーカーは、レポータ遺伝子としても利用できる。
【0032】
必要に応じて、さらにエンハンサー、ターミネータ、タグなどを含んでもよい。エンハンサーは、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。ターミネータとしては、プロモータにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネータ、オクトビン合成酵素(OCS)、CaMV35S RNA遺伝子のターミネータが挙げられる。
【0033】
バイナリーベクター法によるヤトロファの形質転換に用いるバイナリーベクターとしては、上記発現カセットをT−DNA領域に含むもので、具体的には、pBI系、pPZP系、pSMA系、pGWB系などの市販ベクターに上記発現カセットを組み入れたものを用いることができる。特に、Gateway(登録商標)のクローニングシステムが適用可能な植物形質転換用バイナリーベクターが好ましく、このようなベクターとしては、pGWB系ベクターが挙げられる。このpGWB系ベクターは、プロモータとしてカリフラワーモザイクウィルス(CaMV)35Sプロモータ;選択マーカー遺伝子としては、ハイグロマイシン耐性遺伝子、カナマイシン耐性遺伝子;レポータとしてβ−グルクロニダーゼ(GUS)、緑色蛍光タンパク質(GFP)、ルシフェラーゼ(LUC)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP);タグとして、6xHis、FLAG、3xHA、4xMyc、GST、T7−エピトープを用いて、目的遺伝子及びレポータが作動可能に連結されている。さらにN末端、C末端の双方に融合できるように、レポータ、タグをコードする配列がある。
【0034】
Gatewayクローニングシステムとは、Gatewayシグナル(att)を用いることによって、発現ベクターの構築を容易にしたものである。attP1、attP2配列を有するドナーベクターと目的遺伝子の両端にattB1、attB2配列を付加したものとの間で反応(BP反応)させることにより、目的遺伝子が組み込まれたエントリーベクター(両端にattL1、attL2配列を有する)を作製し、次いで、このエントリーベクターと発現に必要なプロモータが組み込まれたデスティネーションベクター(attR1、attR2配列を付加)と組みかえ反応(LR反応)することにより、目的遺伝子が挿入されたベクター(発現ベクター)を作製する方法である。
【0035】
従って、まず、クローニングしたJcNF-YB遺伝子を、ドナーベクターとの間でBP反応させることによりドナーベクターに組み入れたエントリーベクターを調製し、次いでこのエントリーベクターとデスティネーションベクター(pGWB)とをLR反応させることにより、目的とする遺伝子(JcNF-YB)が組み入れられた発現ベクターを作製することができる。
【0036】
Gatewayバイナリーベクター(pGWB)を用いた植物形質転換用発現カセットの構築については、Nakagawa et al., “Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation”, Journal of Bioscience and Bioengineering Vol. 104, No.1.34-41(2007)に詳述されている。
【0037】
以上のようにして作成した発現ベクター(植物形質転換用ベクター)は、大腸菌中で増幅させることができる。増幅した形質転換用ベクターは、エレクトロポレーション法等により、アグロバクテリウムに導入すればよい。このようにして発現ベクターを導入したアグロバクテリウムを、ヤトロファの形質転換に用いる。
【0038】
植物形質転換用ベクターを搭載したアグロバクテリウムの感染によるヤトロファへの目的遺伝子(NF-YB遺伝子)の導入は、リーフディスク法などの公知の方法を用いて行うことができる。
【0039】
具体的には、アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に宿主となるヤトロファの一部(好ましくは子葉のカット片、以下「ヤトロファ葉片」という)とを3日間程度共培養する。共培養に先立って、ヤトロファの葉片を、MS培地に2日間程度浸漬し、さらにはソニケーションしておくことが好ましい。これにより導入効率を高くすることができる。さらにまた、アグロバクテリウム菌の懸濁液に砂を加えた状態で振動を与えるSandvortex法は、アグロバクテリウムの感染力が高まり、好ましい。
共培養培地としては、MS培地などに、IBA、BAなどの植物ホルモンを添加した培地が用いられる。
【0040】
共培養後、ヤトロファ葉片を洗浄し、選択培地(形質転換用ベクターの発現カセットで用いられた選択マーカー遺伝子に対応する抗生物質を含有)に移して、インキュベートした後、葉片に形成されたカルスを切り取り、選択培地に移して、さらに、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。
【0041】
選択培地としては、選択用物質となる抗生物質(カナマイシン、ハイグロマイシン)を、前培養に用いた培地(MS培地など)に添加し、さらに植物ホルモンとして、IBA、BA、TDZなどを含有したものが好ましく用いられる。
【0042】
次に、選抜したカルスをRI培地、MS培地などの培地に移して、発根させ、植物体へ再分化させる。再分化誘導は、培地におけるオーキシンやサイトカイニン等の植物成長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。
【0043】
〔形質転換ヤトロファ〕
本発明の形質転換ヤトロファでは、乾燥ストレスに対する抵抗遺伝子の転写に関与する転写因子NF-YBをコードする遺伝子を野生型と比べてNF-YB遺伝子の転写産物を過剰発現することができる。従って、乾燥ストレス抵抗遺伝子の転写、発現を活性化できる。その結果、乾燥条件であっても、野生型と比べて、高い植物成長を達成できる。
【0044】
本発明の形質転換植物体は、形質転換処理を施した「T1世代」のほか、その植物の種子から得られた後代である「T2世代」、薬剤選抜あるいはサザン法等による解析により形質転換であることが判明した「T2世代」植物の花を自家受粉して得られる次世代(T3世代)などの後代植物もふくまれる。
【実施例】
【0045】
本発明を実施するための形態を実施例により説明する。下記実施例は、本発明の範囲を限定するものではない。
【0046】
〔ヤトロファにおけるNF-YBコードDNAの単離および形質転換用プラスミドの構築〕
(1)ヤトロファゲノムDNAの調製
鳥取大学農学部より分与されたタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉から、Sudheerらの方法(Indian Journal of Biotechnology Vol. 8 (2009) p 187-192)に基づき、ゲノムDNAを調製した。
【0047】
ヤトロファの葉を蒸留水で水洗し、ティッシュペーパーで水分を吸い取った後、1gを乳鉢で粉砕し、粉末化した。この粉末を、65℃の10mlの抽出バッファー(2%CTAB,100mM Tris−HCl,3.5M NaCl,20mM EDTA,1% β-メルカプトエタノール)とともに十分混合した。混合液を水浴中で、65℃、90分間インキュベートした後、5分間冷却した。クロロホルムとイソアミルアルコールの混合物(24:1)を等量加え、ゆっくり混和して、均一なエマルジョンとした。このエマルジョンを、10,000xgで15分間、遠心分離した後、水相を分取した。分取した水相に、再度、クロロホルムとイソアミルアルコールの混合物(24:1)を等量加え、ゆっくり混和して、均一なエマルジョンとした。このエマルジョンを10,000 x gで15分間、4℃で遠心分離した後、水相を分取した。分取した水相に、等量のイソプロピルアルコールを添加し、−20℃で30分間冷却した後、10,000 x gで30分間、4℃で遠心分離して、DNAペレットを得た。このDNAペレットを70%エタノールで洗浄した後、TE緩衝液で再懸濁した。得られたDNAペレットを、20mg/mLのRNaseを含むTEバッファー(10mM Tris-HCl, 1mM EDTA, pH 8.0)に溶解して、ゲノムDNAサンプルとした。
【0048】
得られた抽出ゲノムDNAを、EcoRI、HindIII、SauIIIとともに培養することにより断片化し、シークエンサーにより配列決定した。
【0049】
(2)NF-YBコード遺伝子のクローニング及び増幅
(1)より得られたヤトロファのゲノム情報(コンティング地図)に基づき、シロイヌナズナNF-YBと相同性を示す遺伝子をTBLASTN検索した。なお、シロイヌナズナのNF-YBの遺伝子情報は、NCBIの遺伝子登録情報(http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=Retrieve&dopt=full_report&list_uids=818472&itool=HomoloGeneMainReport)を参照した。
【0050】
検索の結果、NF-YBをコードするとアノテーションされるものは、下記の通りであった。
Contig1977.1.1
Contig21632.1.1
Contig30054.1.1
Contig31310.1.2
Contig31788.1.2
Contig3182.1.1
Contig8131.1.1
F4IDXKH14IHOZQ.1
HYB_Contig17630.1.2
HYB_Contig31673.1.1
HYB_Contig46618.1.1
HYB_Contig46864.1.1
HYB_Contig61720.1.1.1
jatropha454_3Run_c74008.1
【0051】
上記配列のうち、HYB_Contig46618.1.1とHYB_Contig61720.1.1.1のDNA塩基配列は末端部を除き、完全に一致することが判明したので、NF-YB遺伝子の予測にはHYB_Contig46618.1.1を用いることとした。従って、ヤトロファには、13種類のNF-YB遺伝子が存在すると考えられる(これらの遺伝子をNF-YB1〜NF-YB13と命名した。)。相同性検索の結果、上記各ゲノム断片に含まれるヤトロファDNAとシロイヌナズナNF-YB遺伝子との関係は表1に示す通りとなった。JcNF-YB遺伝子のヌクレオチド配列を、配列リストの配列番号1−13に示す。また、これらのポリヌクレオチドを翻訳して得られるポリペプチドのアミノ酸配列を、各順に配列番号14−26に示す。さらに、JcNF-YB1〜JcNF-YB13と、シロイロナズナのNF-YBファミリー(AtNF-YB1〜AtNF-YB13)についてCLASTALW解析を行い、分子系樹を作成した。作成結果を図1に示す。
【0052】
【表1】

【0053】
次に、ヤトロファ(タイ系統品種)ゲノムDNAを鋳型として、それぞれ表2に示すプライマーセット(配列番号27−36)を用いて、PCR反応を行うことにより、JcNF-YB1〜JcNF-YB5遺伝子を増幅した。
【0054】
【表2】

【0055】
PCRに用いた反応液は、下記の通りである。
1.25 Unit Ex taq (タカラバイオ)
1x Ex taq buffer (タカラバイオ)
0.2 mM dNTPs(タカラバイオ)
1 μM フォワードプライマー
1 μM リバースプライマー
上記で調製した反応液に、100倍希釈したヤトロファゲノムDNA溶液1μlを加えて全量50μlとして、以下の条件でPCR反応を行った。
96℃、5分間保持した後、[96℃, 30秒 → 60℃, 30秒 → 72℃, 1分]を30回繰り返し、次いで、72℃, 5分間保持した後、4℃まで冷却した。
反応終了後、増幅により得られたDNAをアガロース電気泳動で確認した。JcNF-YB1〜JcNF-YB5の電気泳動の結果を図2に示す。また、得られたPCR産物の配列をDNAシークエンサーで配列決定した。JcNF-YB1〜JcNF-YB5ポリヌクレオチドの各塩基配列は、配列リストの配列番号1〜5に示すとおりであった。
【0056】
配列番号1で示すDNA(JcNF-YB1)について、Gatewayクローニングシステムを適用するにあたり、下記に示すアダプター配列attB1(配列番号37),attB2(配列番号38)を付加するためのPCR反応を行った。
【0057】
【化1】

【0058】
尚、PCR反応は、下記に示す反応液に、各DNA溶液1μlを加えて全量50μlとした。
1.25 Unit Ex taq (タカラバイオ)
1x Ex taq buffer (タカラバイオ)
0.2 mM dNTPs(タカラバイオ)
1 μM attB1_adapter
1 μM attB2_adapter
【0059】
PCR反応は、下記温度サイクルにて行った。すなわち、94℃, 1分間保持した後、[94℃, 15秒 → 45℃, 30秒 → 68℃, 1分] を5回繰り返し、さらに[94℃, 15秒 → 55℃, 30秒 → 68℃, 1分]を20回繰り返した後、4℃まで冷却した。反応終了後、増幅DNAをアガロース電気泳動で確認した。
【0060】
(3)形質転換用プラスミドの構築
JcNF-YB1遺伝子を、インビトロジェン社のゲートウェイシステム(登録商標)のドナーべクター(pDONR221)を用いて、クローニングした。具体的には、PCRにより上記で増幅したJcNF-YB1遺伝子(attB1、attB2を両端に有している)とドナーベクターpDONR221を混合後、BP clonase (Invitrogen) を用いて組み替え反応(BP反応)を行うことにより、エントリーベクターとなるpENTRJcNF-YB1を得、これを大腸菌DH5α株に導入した。pDONR221は、カナマイシン耐性遺伝子をマーカー遺伝子として導入されたものである。
【0061】
植物形質転換用プラスミドの構築にあたり、pENTRJcNF-YB1プラスミドを大腸菌から抽出し、制限酵素XhoI(タカラバイオ)により直鎖化したプラスミドベクター(デスティネーションベクター)pGWB11と混合後、LR clonase (Invitrogen)を用いて組み替え反応を行った。
pGWB11は、図3に示すように、プロモータとして35Sプロモータを有し、C末端にFLAGタグが付加されている。また、HindIII−SacI間に、35Sプロモータ−R1−Cmr−ccdB−R2−FLAGが入っている。R1−Cmr−ccdB−R2の部分が、エントリーベクターとのLR反応によりattB1−(NF-YB1)−attB2に入れ替わることができる。このようにして、植物組み換え用ベクターとなるpGWB11JcNF-YB1を得た。
【0062】
〔形質転換体の作製〕
(1)形質転換用アグロバクテリウムの調製
上記組換え用ベクターをエレクトロポレーション法によりアグロバクテリウムに導入し、形質転換した。この形質転換アグロバクテリウムを、YEB液体培地(50mg/lカナマイシン、50mg/lハイグロマイシン添加)で、30℃、2日間振とう培養した後、遠心分離により集菌した。集菌した菌をYEB培地に再懸濁して、感染用菌液を調製した。
【0063】
(2)ヤトロファの形質転換
宿主となるヤトロファ細胞には、ゲノム抽出に用いたヤトロファと同種のタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉を用いて、リーフディスク法により形質転換を行った。具体的には、まず、宿主となるヤトロファの成葉のカット片((約25mm2)、以下「ヤトロファ葉片」という)を、家庭用漂白剤を希釈した液で滅菌し、MS基本培地に植物ホルモン(TDZ, IBA, BA)を添加したPre-conditioning寒天培地上に2日間25℃で静置する。アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に先のヤトロファ葉片を浸漬し、10分間振とうする。その後、3日間、25℃で遮光環境下で寒天培地上で共培養する。共培養培地としては、Pre-conditioning培地に、Acetosyringoneを添加したCo-cultivation培地を用いる。
【0064】
(3)形質転換ヤトロファのスクリーニング
上記で作製した発現カセットが、ヤトロファの染色体ゲノムに安定して挿入された形質転換体をスクリーニングする。
具体的には、共培養後のヤトロファ葉片をセフォタキシムナトリウム水溶液(200 mg / l)で洗浄し、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。スクリーニング用抗生物質としてはカナマイシン(20 mg / l)を用いる。まず、Shoot regeneration I寒天培地(SR-I)に移して、25℃で培養した際にカルスの形成が見られた葉片を、Shoot regeneration II(SR-II)寒天培地に移す。
次に、選抜したカルスをShoot elongation I寒天培地(SE-I)、Shoot elongation II寒天培地(SE-II)に移して、不定胚を分化させ、Root induction寒天培地(RI)において発根を誘導し、再分化したヤトロファ植物(T1)を得る。
【0065】
使用した培地組成を以下に示す。
<MS基本培地>
MS 1x, (pH5.8)
スクロース 3%
Myo-inositol 100 mg / l
Thiamine-HCl(pH5.8) 10 mg / l
Agar 0.8 %
【0066】
<Pre-conditioning培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
【0067】
<Co-cultivation培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
AS (Acetosyringone) 20 mg /l
【0068】
<SR-I培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0069】
<SR-II培地>
MS基本培地
BA (6-benzylaminopurine) 3 mg / l
IBA (indole-3-butyric acid) 0.5 mg /l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0070】
<SE-I培地>
MS基本培地
BA (6-benzylaminopurine) 2 mg / l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0071】
<SE-II培地>
MS基本培地
BA (6-benzylaminopurine) 2 mg / l
カナマイシン 20 mg /l
【0072】
<RI培地>
MS基本培地(1/2濃度のMS)
IBA (indole-3-butyric acid) 0.2 mg /l
【0073】
(4)NF-YB遺伝子発現の確認
スクリーニングにより選択された形質転換体において、NF-YB1転写因子が過剰発現することを確認する。
形質転換細胞(NF-YBポリペプチドをプロモータによって発現する形質転換双子葉細胞)及び、コントロール(野生型ヤトロファの双子葉細胞)を、それぞれ培養し、mRNAを抽出する。形質転換細胞のNF-YB1転写因子のmRNA量を、コントロールにおけるそれと比較する。
【0074】
(5)形質転換ヤトロファの耐乾燥ストレス性の確認
再分化させて得られた形質転換植物体を砂耕栽培し、任意の時点における灌水を中断した後の水不足条件で栽培した際の光合成速度およびクロロフィル蛍光、蒸散速度および、成葉の黄変、巻き上がり、落葉を野生株と比較し、乾燥ストレス耐性を評価する。
【産業上の利用可能性】
【0075】
本発明の新規な遺伝子、すなわち単離された、野生型ヤトロファのNF-YB転写因子をコードする遺伝子は、乾燥ストレス耐性ヤトロファの作出に利用でき、ひいては乾燥地でも生育できるヤトロファを提供できる。
【技術分野】
【0001】
本発明は、ヤトロファ(Jatropha)属の新規な遺伝子としてNF-YB転写因子をコードするポリヌクレオチド及びその利用に関し、特に乾燥ストレス耐性ヤトロファ作出のための利用に関する。
【背景技術】
【0002】
ヤトロファ・クルカス(Jatropha curcas)から非食用ヤトロファ油を製造することができるため、バイオディーゼル燃料生産のための生物資源として注目を集めている。また、ヤトロファは、水分や無機栄養について、他の作物の生育不適地でも栽培できる植物として知られており、半乾燥地の有効利用と緑化のために非常に有益であると考えられている。一方、ヤトロファ属植物は、荒地で育つものの、結実回数も年1回、実のサイズもパームよりかなり小さいため、自然栽培による油脂の生産効率は高くない。このような理由から、生産性の高いヤトロファの開発が求められている。
【0003】
ヤトロファ油の生産性効率の改善方法の1つとしては、例えば特開2009−536029号公報(特許文献1)に開示されているように、種子の油含有量を増大させるべく、アセチルCoAカルボキシラーゼ(ACCアーゼ)を過剰発現可能に形質転換する方法がある。
【0004】
一方、ヤトロファ自体の生産性を上げる観点から、水不足条件下でも高い成長性を確保できるような乾燥耐性の付与が考えられる。
一般に、植物は、乾燥、塩、低温などの環境要因によって、生育が大きく左右されることから、環境ストレス耐性を付与した農作物の開発が期待されている。
乾燥ストレス耐性遺伝子組換え植物としては、乾燥ストレスに対して適応又は応答できるように、ストレス応答シグナル伝達強度、機構を改変したもの、耐性に関与するタンパク質分子(環境ストレスに応答するタンパク質)を過剰生産するように改良する方法などが考えられる。
【0005】
植物の環境ストレスに応答したシグナル伝達経路は、植物ホルモンのアブシジン酸(ABA)を介した経路とABAを介さない経路に大別され、さらに関与する転写制御因子のタイプによっても細分化される。また、応答にかかわるタンパク質についても、転写制御因子、プロテアーゼ、プロテインキナーゼ等の応答にかかわる制御タンパク質、シャペロンなどの耐性にかかる機能タンパク質などがあり、さまざまな生理応答を行っていると考えられている(篠崎一雄ら、朝倉植物生理学講座5環境応答、pp106-1145)。
【0006】
アブシジン酸(ABA)は、種子休眠、気孔の開閉、浸透圧ストレス耐性にかかわる植物ホルモンであり、ストレス応答性遺伝子群の発現にはABAが深く関与することが知られている。
例えば、非特許文献1(Wen-Xue Li et al., "The Arabidopsis NFYA5 Transcription Factor Is Regulated Transcriptionally and Posttranscriptionally to Promote Drought Resistance", The Plant Cell, Vol.20:2238-2251(2008))は、シロイヌナズナにおける乾燥ストレス耐性の制御機構に、NF−YA5転写因子が、ABA依存性で、乾燥ストレスにより強く誘導されること、NF−YA5を過剰発現させた形質転換シロイヌナズナが、野生型シロイヌナズナよりも乾燥ストレスに対する耐性に優れていたことを報告している。
【0007】
また、環境ストレス耐性シロイヌナズナを作製する方法としては、特開2005−253395号公報(特許文献2)に、環境ストレスにより発現されるストレス応答性タンパク質をコードする遺伝子の上流に存在するシスエレメントに結合して転写を活性化する転写因子(ストレス応答性転写因子)の制御下にある遺伝子群の活性化作用を利用する方法が提案されている。具体的には、ストレス応答性転写因子であるDREB/CBFの発現を誘導するシグナル伝達因子をコードする新規な遺伝子として、SRK2C遺伝子を開示するとともに、このSRK2C遺伝子を過剰発現するように形質転換したシロイヌナズナが、給水停止後も、コントロールに対して優位に高い生存率を示したことを開示している。
【0008】
さらに、非特許文献2(Donald E. Nelson et al., "Plant nuclear factor Y (NF-Y)B subunits confer drought tolerance and lead to improved corn yields on wate-limited acres" , PNAS, vol.104, No.42, 16450-16455(2007))には、トウモロコシNF-YB因子を同定し、これを用いて形質転換したトウモロコシが、野生型と比べて、水不足条件下での生産性が高かったことが報告されている。
【0009】
またさらに、特表2009−540830(特許文献3)には、イネ、トウモロコシ、ダイズ、ワタの水不足ストレス耐性植物として、シロイヌナズナ、トウモロコシ、ダイズのNF-YBタンパク質をコードするDNAに作動可能に連結されたプロモータを含む転写ユニットを導入した植物が開示されている。プロモータ等を工夫することで、NF-YBを過剰発現できるようにした形質転換植物は、水不足条件下でも、野生型コントロールと比べて、収量が改善されると報告されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−536029号公報
【特許文献2】特開2005−253395号公報
【特許文献3】特表2009−540830号公報
【非特許文献】
【0011】
【非特許文献1】Wen-Xue Li et al., "The Arabidopsis NFYA5 Transcription Factor Is Regulated Transcriptionally and Posttranscriptionally to Promote Drought Resistance", The Plant Cell, Vol.20:2238-2251(2008)
【非特許文献2】Donald E. Nelson et al., "Plant nuclear factor Y (NF-Y)B subunits confer drought tolerance and lead to improved corn yields on water-limited acres" , PNAS, vol.104, No.42, 16450-16455(2007)
【発明の開示】
【発明が解決しようとする課題】
【0012】
環境ストレスに対するシグナル伝達経路のメカニズムは複雑であり、乾燥ストレス耐性植物の作出についても、上記のように、種々の形質転換方法が提案されている。しかしながら、ヤトロファに関しては、乾燥ストレスにかかわる制御タンパク質、耐性にかかわる機能タンパク質などは明らかにされていないのが現状である。
【0013】
本発明の目的は、乾燥ストレス耐性ヤトロファを作出することにあり、その手法として、ヤトロファのNF-YBコード遺伝子を同定し、当該遺伝子を用いて、乾燥ストレス耐性を付与した形質転換ヤトロファを作出することにある。
【課題を解決するための手段】
【0014】
本発明者らは、ヤトロファのゲノム配列を明らかにし、さらにNF-YBコード遺伝子を単離、同定することに成功し、本発明を完成した。
すなわち、本発明の新規なDNAは、配列番号1〜13で示される、ヤトロファ由来のNF-YB転写因子をコードする、単離された13個のDNAのファミリーである。本発明は、さらに、配列番号14〜24で示される各アミノ酸配列からなる、ヤトロファ由来の単離されたNF-YBポリペプチド、及び配列番号25、26で示されるアミノ酸配列を有するヤトロファ由来の単離されたNF-YBポリペプチド断片も含み、これらのアミノ酸配列をコードするポリヌクレオチドも含む。
【0015】
本発明は、さらに、上記本発明のDNAが組み入れられた、ヤトロファ植物体形質転換用ベクター、当該ベクターを含む形質転換体、当該ベクターを用いて形質転換されたヤトロファ植物体であって、野生型と比べてNF-YB転写因子を過剰発現できる乾燥ストレス耐性形質転換ヤトロファも対象とする。
【発明の効果】
【0016】
本発明に係るポリヌクレオチドは、ヤトロファ由来のDNAであるから、形質転換体されたヤトロファにおいて天然のヤトロファが発現するNF-YBと同等の転写因子を過剰発現させることができ、ひいてはNF-YBが関与するタンパク合成の生産性、例えば乾燥ストレス耐性を向上させることができる。
【図面の簡単な説明】
【0017】
【図1】シロイロナズナとヤトロファのNF-YBの分子系統樹を示す図である。
【図2】NF-YB1〜NF-YB5のアガロース電気泳動の結果を示す写真である。
【図3】pGWB11プラスミドの遺伝子マップ(Nakagawa et al., “Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation”, Journal of Bioscience and Bioengineering Vol. 104 (2007), No. 1 p.38を参照)である。
【発明を実施するための形態】
【0018】
〔JcNF-YB遺伝子〕
本発明に係る単離された新規なヤトロファ遺伝子は、ヤトロファの野生型転写因子NF-YBをコードするDNAであり、ヤトロファゲノム中に個別に存在する13個の遺伝子ファミリーである。具体的には、配列番号1〜13に示すもの(これを各順に「JcNF-YB1遺伝子」−「JcNF-YB13遺伝子」と命名する)である。ただし、配列番号12、13は、ヤトロファの野生型転写因子NF-YBをコードするDNA断片である。
【0019】
上記本発明の各遺伝子を発現させて得られるポリペプチド、すなわちヤトロファの野生型転写因子NF-YB1〜NF-YB13(但し、NF-YB12,13は転写因子断片である)のアミノ酸配列を配列番号14〜26に各順に示す。本発明の遺伝子の塩基配列は、配列番号14−26に示すポリペプチドをコードする限り、塩基の一部が置換されていてもよい。例えば、配列番号1に示すJcNF-YB1 DNAにおいて、6番目の塩基Gを塩基Tに置換(配列番号39)することで、翻訳効率を野生型よりも高くすることができる。
以下、「JcNF-YB遺伝子」という場合は、ヤトロファ転写因子NF-YBをコードするポリヌクレオチドを総称する。
【0020】
本発明のJcNF-YB遺伝子の調製方法は特に限定しない。例えば、ヤトロファゲノムを鋳型とし、各NF-YB遺伝子に応じたプライマーを設計して、PCR反応を行うことにより、直接、目的とする遺伝子のPCR産物を得ることもできるし、乾燥ストレスを与えたヤトロファ植物の一部、好ましくは葉を摩砕して得られたmRNAから、下記プライマーセットを用いて、RT−PCR法により、目的とするポリヌクレオチドのPCR産物を得てもよい。
【0021】
好ましくは、Sudheerらの方法(Indian Journal of Biotechnology Vol. 8 (2009) p 187-192)に基づいて抽出したヤトロファゲノムを用いて、直接、目的とする遺伝子のPCR産物を得る方法である。Sudheerらの方法とは、使用する抽出バッファーからDNA沈殿化までに用いる溶液のNaCl濃度を調節している点、精製工程をTris飽和フェノール、続いてクロロホルムとイソアミルアルコールの混合液で処理する点、沈殿化工程で80%エタノールを用いる点に特徴がある。
【0022】
mRNAの調製は、通常行われる手法により行うことができる。例えば、凍結した植物体を乳鉢などで摩砕後、得られた摩砕物から、グリオキザール法、グアニジンチオシアネート−塩化セシウム法、塩化リチウム−尿素法、プロテイナーゼK−デオキシリボヌクレアーゼ法などにより、粗RNA画分を抽出調製すればよい。また、市販のキットを用いてもよい。
【0023】
得られたPCR産物の塩基配列の決定、確認は、従来より公知の手法、例えば、マキサム−ギルバートの化学修飾法、又はM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行えばよい。
【0024】
〔乾燥ストレス耐性形質転換ヤトロファの作出〕
本発明の乾燥ストレス耐性形質転換ヤトロファは、NF-YB遺伝子を発現又は発現調節のためのプロモータと作動可能に連結した発現カセットを、野生型ヤトロファに遺伝子導入することにより作製される。
【0025】
本発明が対象とするヤトロファの種類は特に限定せず、ヤトロファ・クルカス(Jatropha curcus)、ヤトロファ・ポタグリカ(Jatropha potagurica)、ヤトロファ・ムルチフィダ(Jatropha、multifida)、ヤトロファ・ベルランディエリ(Jatropha berlandieri)、ヤトロファ・インテゲリマ(Jatropha integerrima)などを用いることができる。これらのうち、油脂含有量が多いという点から、ヤトロファ・クルカスが好ましく用いられる
【0026】
遺伝子導入方法は、プロトプラスト同士を融合させる方法、電気穿孔法、遺伝子ショットガン法等の細胞に直接的にDNAを導入する方法;アグロバクテリウム(Agrobacterium tumefaciens)やR.rhizogenesを利用して間接的に導入する方法のいずれの方法により行ってもよいが、好ましくはアグロバクテリウムを用いる方法である。以下、アグロバクテリウムを用いる形質転換方法について説明する。
【0027】
アグロバクテリウムは植物病細菌で、LB(レフトボーダー)とRB(ライトボーダー)に挟まれた領域(T−DNA(Transferred DNA)領域)を切り出して宿主ゲノムに挿入することができるTiプラスミドをもっている。このT−DNA領域内に、導入しようとする遺伝子、すなわちJcNF-YB遺伝子を組み込んだプラスミドを有するアグロバクテリウムを、宿主植物へ感染させると、T−DNA領域が切り出されて、vir領域にコードされているタンパク質群と複合体を形成して植物細胞内に侵入し、さらに宿主ゲノムに挿入することができる。
【0028】
アグロバクテリウムを用いる形質転換方法としては、バイナリーベクター法が好ましい。バイナリーベクター法とは、TiプラスミドのT−DNAを欠落させたプラスミド(pAL4404など)とは別に、T−DNA領域のボーダー(LB及びRB)を有するプラスミドのT−DNA領域に目的の外来遺伝子を組み込んだプラスミドをアグロバクテリウムに導入して植物に感染させることにより、目的遺伝子を植物ゲノムに挿入する方法である。
【0029】
バイナリーベクター法を利用した、形質転換ヤトロファの作出に用いられる発現カセットは、T−DNA領域に、上記本発明に係るNF-YB遺伝子、及び当該ヌクレオチド発現のためのプロモータ、マーカー遺伝子、レポータ遺伝子を含んでいる。
【0030】
プロモータとしては、35Sカリフラワーモザイクウィルスプロモータ、ノパリンシンターゼ(NOS)プロモータ、並びにβファゼオリン、ナピン、ユビキチンなどの他の胚乳特異的プロモータが挙げられる。
【0031】
選択マーカー遺伝子としては、抗生物質または除草剤のような選択剤に対する抵抗性を付与する遺伝子が用いられる。具体的には、カナマイシン耐性遺伝子、パロモマイシンB耐性遺伝子、またはグルフォシネート及びグリフォセートのような除草剤に対する抵抗性遺伝子などが挙げられる。形質転換体を視覚的に同定できる選択マーカー、例えば、ルシフェラーゼ、または緑色蛍光タンパク質(GFP)のような発色または蛍光タンパク質を発現する遺伝子又は種々の発色体基質が知られているβグルクロニダーゼまたはGUSを発現する遺伝子も利用することができる。このような選択マーカーは、レポータ遺伝子としても利用できる。
【0032】
必要に応じて、さらにエンハンサー、ターミネータ、タグなどを含んでもよい。エンハンサーは、目的遺伝子の発現効率を高めるために用いられ、CaMV35Sプロモーター内の上流側の配列を含むエンハンサー領域などが挙げられる。ターミネータとしては、プロモータにより転写された遺伝子の転写を終結できる配列であればよく、例えば、ノパリン合成酵素(NOS)遺伝子のターミネータ、オクトビン合成酵素(OCS)、CaMV35S RNA遺伝子のターミネータが挙げられる。
【0033】
バイナリーベクター法によるヤトロファの形質転換に用いるバイナリーベクターとしては、上記発現カセットをT−DNA領域に含むもので、具体的には、pBI系、pPZP系、pSMA系、pGWB系などの市販ベクターに上記発現カセットを組み入れたものを用いることができる。特に、Gateway(登録商標)のクローニングシステムが適用可能な植物形質転換用バイナリーベクターが好ましく、このようなベクターとしては、pGWB系ベクターが挙げられる。このpGWB系ベクターは、プロモータとしてカリフラワーモザイクウィルス(CaMV)35Sプロモータ;選択マーカー遺伝子としては、ハイグロマイシン耐性遺伝子、カナマイシン耐性遺伝子;レポータとしてβ−グルクロニダーゼ(GUS)、緑色蛍光タンパク質(GFP)、ルシフェラーゼ(LUC)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP);タグとして、6xHis、FLAG、3xHA、4xMyc、GST、T7−エピトープを用いて、目的遺伝子及びレポータが作動可能に連結されている。さらにN末端、C末端の双方に融合できるように、レポータ、タグをコードする配列がある。
【0034】
Gatewayクローニングシステムとは、Gatewayシグナル(att)を用いることによって、発現ベクターの構築を容易にしたものである。attP1、attP2配列を有するドナーベクターと目的遺伝子の両端にattB1、attB2配列を付加したものとの間で反応(BP反応)させることにより、目的遺伝子が組み込まれたエントリーベクター(両端にattL1、attL2配列を有する)を作製し、次いで、このエントリーベクターと発現に必要なプロモータが組み込まれたデスティネーションベクター(attR1、attR2配列を付加)と組みかえ反応(LR反応)することにより、目的遺伝子が挿入されたベクター(発現ベクター)を作製する方法である。
【0035】
従って、まず、クローニングしたJcNF-YB遺伝子を、ドナーベクターとの間でBP反応させることによりドナーベクターに組み入れたエントリーベクターを調製し、次いでこのエントリーベクターとデスティネーションベクター(pGWB)とをLR反応させることにより、目的とする遺伝子(JcNF-YB)が組み入れられた発現ベクターを作製することができる。
【0036】
Gatewayバイナリーベクター(pGWB)を用いた植物形質転換用発現カセットの構築については、Nakagawa et al., “Development of Series of Gateway Binary Vectors, pGWBs, for Realizing Efficient Construction of Fusion Genes for Plant Transformation”, Journal of Bioscience and Bioengineering Vol. 104, No.1.34-41(2007)に詳述されている。
【0037】
以上のようにして作成した発現ベクター(植物形質転換用ベクター)は、大腸菌中で増幅させることができる。増幅した形質転換用ベクターは、エレクトロポレーション法等により、アグロバクテリウムに導入すればよい。このようにして発現ベクターを導入したアグロバクテリウムを、ヤトロファの形質転換に用いる。
【0038】
植物形質転換用ベクターを搭載したアグロバクテリウムの感染によるヤトロファへの目的遺伝子(NF-YB遺伝子)の導入は、リーフディスク法などの公知の方法を用いて行うことができる。
【0039】
具体的には、アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に宿主となるヤトロファの一部(好ましくは子葉のカット片、以下「ヤトロファ葉片」という)とを3日間程度共培養する。共培養に先立って、ヤトロファの葉片を、MS培地に2日間程度浸漬し、さらにはソニケーションしておくことが好ましい。これにより導入効率を高くすることができる。さらにまた、アグロバクテリウム菌の懸濁液に砂を加えた状態で振動を与えるSandvortex法は、アグロバクテリウムの感染力が高まり、好ましい。
共培養培地としては、MS培地などに、IBA、BAなどの植物ホルモンを添加した培地が用いられる。
【0040】
共培養後、ヤトロファ葉片を洗浄し、選択培地(形質転換用ベクターの発現カセットで用いられた選択マーカー遺伝子に対応する抗生物質を含有)に移して、インキュベートした後、葉片に形成されたカルスを切り取り、選択培地に移して、さらに、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。
【0041】
選択培地としては、選択用物質となる抗生物質(カナマイシン、ハイグロマイシン)を、前培養に用いた培地(MS培地など)に添加し、さらに植物ホルモンとして、IBA、BA、TDZなどを含有したものが好ましく用いられる。
【0042】
次に、選抜したカルスをRI培地、MS培地などの培地に移して、発根させ、植物体へ再分化させる。再分化誘導は、培地におけるオーキシンやサイトカイニン等の植物成長調節物質、炭素源等の各種成分の種類や量、光、温度等を適切に設定することにより行うことができる。
【0043】
〔形質転換ヤトロファ〕
本発明の形質転換ヤトロファでは、乾燥ストレスに対する抵抗遺伝子の転写に関与する転写因子NF-YBをコードする遺伝子を野生型と比べてNF-YB遺伝子の転写産物を過剰発現することができる。従って、乾燥ストレス抵抗遺伝子の転写、発現を活性化できる。その結果、乾燥条件であっても、野生型と比べて、高い植物成長を達成できる。
【0044】
本発明の形質転換植物体は、形質転換処理を施した「T1世代」のほか、その植物の種子から得られた後代である「T2世代」、薬剤選抜あるいはサザン法等による解析により形質転換であることが判明した「T2世代」植物の花を自家受粉して得られる次世代(T3世代)などの後代植物もふくまれる。
【実施例】
【0045】
本発明を実施するための形態を実施例により説明する。下記実施例は、本発明の範囲を限定するものではない。
【0046】
〔ヤトロファにおけるNF-YBコードDNAの単離および形質転換用プラスミドの構築〕
(1)ヤトロファゲノムDNAの調製
鳥取大学農学部より分与されたタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉から、Sudheerらの方法(Indian Journal of Biotechnology Vol. 8 (2009) p 187-192)に基づき、ゲノムDNAを調製した。
【0047】
ヤトロファの葉を蒸留水で水洗し、ティッシュペーパーで水分を吸い取った後、1gを乳鉢で粉砕し、粉末化した。この粉末を、65℃の10mlの抽出バッファー(2%CTAB,100mM Tris−HCl,3.5M NaCl,20mM EDTA,1% β-メルカプトエタノール)とともに十分混合した。混合液を水浴中で、65℃、90分間インキュベートした後、5分間冷却した。クロロホルムとイソアミルアルコールの混合物(24:1)を等量加え、ゆっくり混和して、均一なエマルジョンとした。このエマルジョンを、10,000xgで15分間、遠心分離した後、水相を分取した。分取した水相に、再度、クロロホルムとイソアミルアルコールの混合物(24:1)を等量加え、ゆっくり混和して、均一なエマルジョンとした。このエマルジョンを10,000 x gで15分間、4℃で遠心分離した後、水相を分取した。分取した水相に、等量のイソプロピルアルコールを添加し、−20℃で30分間冷却した後、10,000 x gで30分間、4℃で遠心分離して、DNAペレットを得た。このDNAペレットを70%エタノールで洗浄した後、TE緩衝液で再懸濁した。得られたDNAペレットを、20mg/mLのRNaseを含むTEバッファー(10mM Tris-HCl, 1mM EDTA, pH 8.0)に溶解して、ゲノムDNAサンプルとした。
【0048】
得られた抽出ゲノムDNAを、EcoRI、HindIII、SauIIIとともに培養することにより断片化し、シークエンサーにより配列決定した。
【0049】
(2)NF-YBコード遺伝子のクローニング及び増幅
(1)より得られたヤトロファのゲノム情報(コンティング地図)に基づき、シロイヌナズナNF-YBと相同性を示す遺伝子をTBLASTN検索した。なお、シロイヌナズナのNF-YBの遺伝子情報は、NCBIの遺伝子登録情報(http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene&cmd=Retrieve&dopt=full_report&list_uids=818472&itool=HomoloGeneMainReport)を参照した。
【0050】
検索の結果、NF-YBをコードするとアノテーションされるものは、下記の通りであった。
Contig1977.1.1
Contig21632.1.1
Contig30054.1.1
Contig31310.1.2
Contig31788.1.2
Contig3182.1.1
Contig8131.1.1
F4IDXKH14IHOZQ.1
HYB_Contig17630.1.2
HYB_Contig31673.1.1
HYB_Contig46618.1.1
HYB_Contig46864.1.1
HYB_Contig61720.1.1.1
jatropha454_3Run_c74008.1
【0051】
上記配列のうち、HYB_Contig46618.1.1とHYB_Contig61720.1.1.1のDNA塩基配列は末端部を除き、完全に一致することが判明したので、NF-YB遺伝子の予測にはHYB_Contig46618.1.1を用いることとした。従って、ヤトロファには、13種類のNF-YB遺伝子が存在すると考えられる(これらの遺伝子をNF-YB1〜NF-YB13と命名した。)。相同性検索の結果、上記各ゲノム断片に含まれるヤトロファDNAとシロイヌナズナNF-YB遺伝子との関係は表1に示す通りとなった。JcNF-YB遺伝子のヌクレオチド配列を、配列リストの配列番号1−13に示す。また、これらのポリヌクレオチドを翻訳して得られるポリペプチドのアミノ酸配列を、各順に配列番号14−26に示す。さらに、JcNF-YB1〜JcNF-YB13と、シロイロナズナのNF-YBファミリー(AtNF-YB1〜AtNF-YB13)についてCLASTALW解析を行い、分子系樹を作成した。作成結果を図1に示す。
【0052】
【表1】

【0053】
次に、ヤトロファ(タイ系統品種)ゲノムDNAを鋳型として、それぞれ表2に示すプライマーセット(配列番号27−36)を用いて、PCR反応を行うことにより、JcNF-YB1〜JcNF-YB5遺伝子を増幅した。
【0054】
【表2】

【0055】
PCRに用いた反応液は、下記の通りである。
1.25 Unit Ex taq (タカラバイオ)
1x Ex taq buffer (タカラバイオ)
0.2 mM dNTPs(タカラバイオ)
1 μM フォワードプライマー
1 μM リバースプライマー
上記で調製した反応液に、100倍希釈したヤトロファゲノムDNA溶液1μlを加えて全量50μlとして、以下の条件でPCR反応を行った。
96℃、5分間保持した後、[96℃, 30秒 → 60℃, 30秒 → 72℃, 1分]を30回繰り返し、次いで、72℃, 5分間保持した後、4℃まで冷却した。
反応終了後、増幅により得られたDNAをアガロース電気泳動で確認した。JcNF-YB1〜JcNF-YB5の電気泳動の結果を図2に示す。また、得られたPCR産物の配列をDNAシークエンサーで配列決定した。JcNF-YB1〜JcNF-YB5ポリヌクレオチドの各塩基配列は、配列リストの配列番号1〜5に示すとおりであった。
【0056】
配列番号1で示すDNA(JcNF-YB1)について、Gatewayクローニングシステムを適用するにあたり、下記に示すアダプター配列attB1(配列番号37),attB2(配列番号38)を付加するためのPCR反応を行った。
【0057】
【化1】

【0058】
尚、PCR反応は、下記に示す反応液に、各DNA溶液1μlを加えて全量50μlとした。
1.25 Unit Ex taq (タカラバイオ)
1x Ex taq buffer (タカラバイオ)
0.2 mM dNTPs(タカラバイオ)
1 μM attB1_adapter
1 μM attB2_adapter
【0059】
PCR反応は、下記温度サイクルにて行った。すなわち、94℃, 1分間保持した後、[94℃, 15秒 → 45℃, 30秒 → 68℃, 1分] を5回繰り返し、さらに[94℃, 15秒 → 55℃, 30秒 → 68℃, 1分]を20回繰り返した後、4℃まで冷却した。反応終了後、増幅DNAをアガロース電気泳動で確認した。
【0060】
(3)形質転換用プラスミドの構築
JcNF-YB1遺伝子を、インビトロジェン社のゲートウェイシステム(登録商標)のドナーべクター(pDONR221)を用いて、クローニングした。具体的には、PCRにより上記で増幅したJcNF-YB1遺伝子(attB1、attB2を両端に有している)とドナーベクターpDONR221を混合後、BP clonase (Invitrogen) を用いて組み替え反応(BP反応)を行うことにより、エントリーベクターとなるpENTRJcNF-YB1を得、これを大腸菌DH5α株に導入した。pDONR221は、カナマイシン耐性遺伝子をマーカー遺伝子として導入されたものである。
【0061】
植物形質転換用プラスミドの構築にあたり、pENTRJcNF-YB1プラスミドを大腸菌から抽出し、制限酵素XhoI(タカラバイオ)により直鎖化したプラスミドベクター(デスティネーションベクター)pGWB11と混合後、LR clonase (Invitrogen)を用いて組み替え反応を行った。
pGWB11は、図3に示すように、プロモータとして35Sプロモータを有し、C末端にFLAGタグが付加されている。また、HindIII−SacI間に、35Sプロモータ−R1−Cmr−ccdB−R2−FLAGが入っている。R1−Cmr−ccdB−R2の部分が、エントリーベクターとのLR反応によりattB1−(NF-YB1)−attB2に入れ替わることができる。このようにして、植物組み換え用ベクターとなるpGWB11JcNF-YB1を得た。
【0062】
〔形質転換体の作製〕
(1)形質転換用アグロバクテリウムの調製
上記組換え用ベクターをエレクトロポレーション法によりアグロバクテリウムに導入し、形質転換した。この形質転換アグロバクテリウムを、YEB液体培地(50mg/lカナマイシン、50mg/lハイグロマイシン添加)で、30℃、2日間振とう培養した後、遠心分離により集菌した。集菌した菌をYEB培地に再懸濁して、感染用菌液を調製した。
【0063】
(2)ヤトロファの形質転換
宿主となるヤトロファ細胞には、ゲノム抽出に用いたヤトロファと同種のタイ系統ヤトロファ(Jatropha curcas)を用いた。このヤトロファの成葉を用いて、リーフディスク法により形質転換を行った。具体的には、まず、宿主となるヤトロファの成葉のカット片((約25mm2)、以下「ヤトロファ葉片」という)を、家庭用漂白剤を希釈した液で滅菌し、MS基本培地に植物ホルモン(TDZ, IBA, BA)を添加したPre-conditioning寒天培地上に2日間25℃で静置する。アグロバクテリウムをMS培地に懸濁した感染用菌液を調製し、この菌液に先のヤトロファ葉片を浸漬し、10分間振とうする。その後、3日間、25℃で遮光環境下で寒天培地上で共培養する。共培養培地としては、Pre-conditioning培地に、Acetosyringoneを添加したCo-cultivation培地を用いる。
【0064】
(3)形質転換ヤトロファのスクリーニング
上記で作製した発現カセットが、ヤトロファの染色体ゲノムに安定して挿入された形質転換体をスクリーニングする。
具体的には、共培養後のヤトロファ葉片をセフォタキシムナトリウム水溶液(200 mg / l)で洗浄し、形質転換されたヤトロファ(組換え細胞)のスクリーニングを行う。スクリーニング用抗生物質としてはカナマイシン(20 mg / l)を用いる。まず、Shoot regeneration I寒天培地(SR-I)に移して、25℃で培養した際にカルスの形成が見られた葉片を、Shoot regeneration II(SR-II)寒天培地に移す。
次に、選抜したカルスをShoot elongation I寒天培地(SE-I)、Shoot elongation II寒天培地(SE-II)に移して、不定胚を分化させ、Root induction寒天培地(RI)において発根を誘導し、再分化したヤトロファ植物(T1)を得る。
【0065】
使用した培地組成を以下に示す。
<MS基本培地>
MS 1x, (pH5.8)
スクロース 3%
Myo-inositol 100 mg / l
Thiamine-HCl(pH5.8) 10 mg / l
Agar 0.8 %
【0066】
<Pre-conditioning培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
【0067】
<Co-cultivation培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
AS (Acetosyringone) 20 mg /l
【0068】
<SR-I培地>
MS基本培地
TDZ (thidiazuron) 0.5 mg / l
BA (6-benzylaminopurine) 1 mg / l
IBA (indole-3-butyric acid) 0.075 mg /l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0069】
<SR-II培地>
MS基本培地
BA (6-benzylaminopurine) 3 mg / l
IBA (indole-3-butyric acid) 0.5 mg /l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0070】
<SE-I培地>
MS基本培地
BA (6-benzylaminopurine) 2 mg / l
Cefotaxim-Na 200 mg /l
カナマイシン 20 mg /l
【0071】
<SE-II培地>
MS基本培地
BA (6-benzylaminopurine) 2 mg / l
カナマイシン 20 mg /l
【0072】
<RI培地>
MS基本培地(1/2濃度のMS)
IBA (indole-3-butyric acid) 0.2 mg /l
【0073】
(4)NF-YB遺伝子発現の確認
スクリーニングにより選択された形質転換体において、NF-YB1転写因子が過剰発現することを確認する。
形質転換細胞(NF-YBポリペプチドをプロモータによって発現する形質転換双子葉細胞)及び、コントロール(野生型ヤトロファの双子葉細胞)を、それぞれ培養し、mRNAを抽出する。形質転換細胞のNF-YB1転写因子のmRNA量を、コントロールにおけるそれと比較する。
【0074】
(5)形質転換ヤトロファの耐乾燥ストレス性の確認
再分化させて得られた形質転換植物体を砂耕栽培し、任意の時点における灌水を中断した後の水不足条件で栽培した際の光合成速度およびクロロフィル蛍光、蒸散速度および、成葉の黄変、巻き上がり、落葉を野生株と比較し、乾燥ストレス耐性を評価する。
【産業上の利用可能性】
【0075】
本発明の新規な遺伝子、すなわち単離された、野生型ヤトロファのNF-YB転写因子をコードする遺伝子は、乾燥ストレス耐性ヤトロファの作出に利用でき、ひいては乾燥地でも生育できるヤトロファを提供できる。
【特許請求の範囲】
【請求項1】
配列番号1〜配列番号11で示される、ヤトロファ由来のNF-YBポリペプチドをコードする、単離されたDNA。
【請求項2】
配列番号12又は配列番号13で示されるDNA断片を含む、ヤトロファ由来のNF-YBポリペプチドをコードする、単離されたDNA。
【請求項3】
配列番号14〜26のいずれか1つで示されるアミノ酸配列をコードするポリヌクレオチド。
【請求項4】
配列番号14〜24のいずれか1つで示されるアミノ酸配列からなる、ヤトロファ由来の単離されたNF-YBポリペプチド。
【請求項5】
配列番号25又は26で示されるアミノ酸配列のポリペプチドを含む、ヤトロファ由来の単離されたNF-YBポリペプチド。
【請求項6】
請求項1〜3のいずれかに記載のDNAが組み入れられた、ヤトロファ植物体形質転換用ベクター。
【請求項7】
請求項6に記載のベクターを含む形質転換体。
【請求項8】
請求項6に記載のベクターを用いて形質転換されたヤトロファ植物体であって、野生型と比べて、NF-YBポリペプチドを過剰発現できる乾燥ストレス耐性形質転換ヤトロファ。
【請求項1】
配列番号1〜配列番号11で示される、ヤトロファ由来のNF-YBポリペプチドをコードする、単離されたDNA。
【請求項2】
配列番号12又は配列番号13で示されるDNA断片を含む、ヤトロファ由来のNF-YBポリペプチドをコードする、単離されたDNA。
【請求項3】
配列番号14〜26のいずれか1つで示されるアミノ酸配列をコードするポリヌクレオチド。
【請求項4】
配列番号14〜24のいずれか1つで示されるアミノ酸配列からなる、ヤトロファ由来の単離されたNF-YBポリペプチド。
【請求項5】
配列番号25又は26で示されるアミノ酸配列のポリペプチドを含む、ヤトロファ由来の単離されたNF-YBポリペプチド。
【請求項6】
請求項1〜3のいずれかに記載のDNAが組み入れられた、ヤトロファ植物体形質転換用ベクター。
【請求項7】
請求項6に記載のベクターを含む形質転換体。
【請求項8】
請求項6に記載のベクターを用いて形質転換されたヤトロファ植物体であって、野生型と比べて、NF-YBポリペプチドを過剰発現できる乾燥ストレス耐性形質転換ヤトロファ。
【図1】


【図3】


【図2】




【図3】


【図2】


【公開番号】特開2011−229521(P2011−229521A)
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願番号】特願2010−273463(P2010−273463)
【出願日】平成22年12月8日(2010.12.8)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発/バイオマスエネルギー等高効率転換技術開発(先導技術開発)/乾燥ストレス耐性改良型ヤトロファの創出とその機能評価に関する研究開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願日】平成22年12月8日(2010.12.8)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人新エネルギー・産業技術総合開発機構、「新エネルギー技術研究開発/バイオマスエネルギー等高効率転換技術開発(先導技術開発)/乾燥ストレス耐性改良型ヤトロファの創出とその機能評価に関する研究開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

