ヤヌスキナーゼ3のピペリジンインヒビター
本発明は、ヤヌスキナーゼ3活性の新しいピペリジンインヒビター、その医薬組成物、およびその使用の方法に関連する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2009年4月20日に出願の、米国仮特許出願第61/170,858号、および2010年2月3日出願の第61/300,887号の優先権の利益を主張するものであり、これらの開示は、本明細書の全体に記載されるかのように、引用によって本明細書に組み込まれる。
【0002】
本明細書には、新しいピペリジン化合物、それらから作られた医薬品組成物が記載され、および腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、移植拒絶反応、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病による合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、および白血病などの障害の処置のために、被験体においてヤヌスキナーゼ3活性を阻害する方法もまた提供される。
【背景技術】
【0003】
CP-690550(CAS # 477600-75-2,タソシチニブ)、4-メチル-3-(メチル-7H-ピロロ[2,3-d]ピリミジン-4-イルアミノ)-ベータ-オキソ-(3R,4R)-l-ピペリジンプロパンニトリルは、ヤヌスキナーゼ3インヒビターである。CP-690550は、腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、および移植拒絶反応の処置のために研究中である(Jiang et al.,J.Med.Chem.2008,51,8012-8018;米国特許第6,627,754号;およびWO 2003/048162)。CP-690550はまた、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病による合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、および白血病の処置における有望性を示した(米国特許第6,627,754号;およびWO 2003/048162)。
【0004】
【化1】

【0005】
6人のヒト男性ボランティアにおける14Cの標識が付けられたCP-690550でのインビトロの研究は、ヒトにおいてCP-690550の急速な取り込みを実証し、総放射能が、経口投与後、1時間までにピークに達した(Prakash et al.,AAPS Journal 2008,10(S2))。未変化のCP-690550および総放射能に対する平均の終末過程の半減期は、両方とも約3.2時間であり、合計の循環する放射能の65%以上は、未変化のCP-690550によって占められていた(Prakash et al.,AAPS Journal 2008,10(S2))。血漿における残りの放射能は、各々が総放射能の<5%を占める8つの代謝物質に起因した(Prakash et al.,AAPS Journal 2008,10(S2))。主要な一次代謝経路は、ピロロピリミジン環の酸化、ピペリジン環の酸化、およびピペリジン環側鎖の酸化を含むことが発見された(Prakash et al.,AAPS Journal 2008,10(S2))。主要ではない代謝経路は、N-脱メチル化およびグルクロン酸との結合によるものであった(Prakash et al.,AAPS Journal 2008,10(S2))。CP-690550のクリアランス経路は、未変化の薬物の(CYP3A4/5およびCYP2C19による肝臓代謝を介した)約70%の非腎排泄および30%の腎排泄であった(Krishnaswami et al.,AAPS Journal 2009,11(S2))。
【0006】
重水素速度論的同位体効果
治療薬などの異物を除去するために、動物体は、シトクロムP450酵素(CYP)、エステラーゼ、プロテアーゼ、還元酵素、脱水素酵素、およびモノアミンオキシダーゼなどの様々な酵素を発現し、これらの異物と反応し、これらの異物を、腎排泄のためのより極性のある中間物質または代謝物質に変換させる。このような代謝反応は、炭素−酸素(C-O)または炭素−炭素(C-C)のπ結合のいずれかへの炭素−水素(C-H)結合の酸化をしばしば含んでいる。結果として生じる代謝物質は、生理学的条件下で安定または不安定であり得、親化合物に比べて、実質的に異なる薬物動態学的特性、薬力学的特性、および急性および長期毒性の特性を有し得る。ほとんどの薬物に関して、このような酸化は、一般に急速であり、最終的に、複数回のまたは高い一日用量の投与につながる。
【0007】
活性化エネルギーと反応速度の間の関係は、アレニウスの式、k=Ae-Eact/RTによって数量化され得る。アレニウスの式は、所与の温度で、化学反応の速度が活性化エネルギー(Eact)に指数関数的に依存することを示している。
【0008】
反応における遷移状態は、反応経路に沿った一時的な状態であり、その反応経路の間に、最初の結合は限界に達する。定義によると、反応のための活性化エネルギーEactは、その反応の遷移状態に達するために必要なエネルギーである。一旦遷移状態が達せられると、分子は、最初の反応物に戻ることができるか、または反応生成物を生じさせる新しい結合を形成することができるかのいずれかである。触媒は、遷移状態につながる活性化エネルギーを低下させることにより、反応工程を促進する。酵素は生物学的触媒の例である。
【0009】
炭素-水素結合の強度は、結合の基底状態の振動エネルギーの絶対値に正比例する。この振動エネルギーは、結合を形成する原子の質量に依存し、原子の1つまたは両方の質量が結合を増加させるにつれ増加する。重水素(D)がプロチウム(1H)の2倍の質量を有するため、C-D結合は、対応するC-1H結合より強固である。C-1H結合が、化学反応において律速段階(すなわち最も高い遷移状態のエネルギーを備えた段階)の間に壊されたならば、その後、重水素をそのプロチウムと置換することは、反応速度の減少を引き起こす。この現象は、重水素速度論的同位体効果(DKIE)として知られている。DKIEの重要性は、C-1H結合が壊された所与の反応の速度と、重水素がプロチウムと置換される場合の同様の反応の速度の間の比率として表現され得る。DKIEは、約1(同位体効果はない)から、50以上などの極めて大きい数までの範囲になり得る。トリチウムに対する水素の置換は、結果的に重水素よりもなお強固な結合をもたらし、数的により大きな同位体効果を与える。
【0010】
重水素(2HまたはD)は安定しており、水素の最も一般的な同位体、プロチウム(1H)の約2倍の質量を有する水素の非放射性の同位体である。酸化重水素(D2Oまたは「重水」)は、H2Oのような見た目および味がするが、異なる物理的性質を有する。
【0011】
純粋なD2Oが齧歯類に与えられるとき、それは容易に吸収される。毒性を誘発するのに必要な重水素の量は極端に高い。体内水分の約0〜15%がD2Oと置換されたとき、動物は健康であるが、対照(無処置)群ほど速く体重を増加させることはできない。体内水分の約15〜20%がD2Oと置換されたとき、動物は興奮しやすくなる。体内水分の約20〜25%がD2Oと置換されたとき、動物は非常に興奮しやすくなるため、刺激されたとき頻繁に痙攣する。皮膚病変、足および鼻鏡上の潰瘍、および尾の壊死が現われる。動物はまた、非常に攻撃的になる。体内水分の約30%がD2Oと置換されたとき、動物は拒食し、昏睡状態になる。動物の体重は急激に落ち、動物の代謝率は、標準よりかなり下がり、D2Oとの約30〜約35%の置換で死に至る。以前の体重の30パーセント以上がD2Oにより失われない限り、効果は可逆的である。研究はまた、D2Oの使用が癌細胞の成長を遅らせることができ、一定の抗腫瘍薬の細胞毒性を増強することができることを示した。
【0012】
薬物動態学(PK)、薬力学(PD)、および毒性の特性を改善するための医薬品の重水素化は、いくつかの種類の薬物によって以前に実証された。例えば、DKIEは、塩化トリフルオロアセチルなどの反応種の産生をおそらく制限することにより、ハロタンの肝毒性を減少させるために使用された。しかしながら、この方法はすべての薬物の種類に適用可能ではないかもしれない。例えば、重水素の取り込みは、代謝交換(metabolic switching)につながり得る。第I相(Phase I)酵素によって捕捉された異物(xenogens)が一時的に結合し、化学反応(例えば、酸化)前に様々な構造で再び結合するときに、代謝交換は生じる。多くの第I相酵素中の結合ポケットの比較的巨大なサイズおよび多くの代謝反応の乱雑な性質によって、代謝交換は可能になる。代謝交換は、全く新しい代謝物質と同様に既知の代謝物質の異なる比率につながり得る。この新しい代謝特性は、多かれ少なかれ毒性を与え得る。このような落とし穴は明白ではなく、任意の薬物の種類に関してアプリオリに予測可能ではない。
【0013】
CP-690550は、ヤヌスキナーゼ3インヒビターである。CP-690550の炭素-水素結合は、水素同位体の自然発生の分布、すなわち、1Hまたはプロチウム(約99.9844%)、2Hまたは重水素(約0.0156%)、3Hまたはトリチウム(1018のプロチウム原子当たり約0.5〜67の間のトリチウム原子の範囲内)を含んでいる。重水素の取り込みの増加したレベルは、重水素の自然発生のレベルを有するCP-690550と比較したCP-690550の薬物動態学、薬理学、及び/又は毒物学の特性に影響を与え得る、検出可能な重水素速度論的同位体効果(DKIE)を生み得る。
【0014】
文献を考慮することに加え、我々の研究室でなされた発見に基づくと、CP-690550は、ヒトでは、N-メチル基、ピペリジンメチル基、ピペリジン環、およびアルファ−カルボニルメチル基において代謝される。現在の手法は、これらの部位で代謝を妨げる見込みを有する。分子上の他の部位はまた、まだ知られていない薬物学/毒物学を有する代謝物質につながる形質転換を受け得る。これらの代謝物質の産生を制限することで、このような薬物の投与の危険を減少させ、増加した用量及び/又は増加した有効性さえ与える潜在性が備えられる。これらの形質転換のすべてが、多形的に発現された酵素を介して起こり、患者間のばらつきを激化させる。さらに、被験体が一日中または長時間の間、薬で治療されるとき、いくつかの障害は最も治りやすい。すべての前述の理由のために、より長い半減期を有する薬は、結果的に、より大きな有効性および経費節約につながり得る。様々な重水素化のパターンは、(a)不要な代謝物質を低減するまたは除去する、(b)親薬物の半減期を増加させる、(c)所望の効果を達成するために必要とされる投与数を減少させる、(d)所望の効果を達成するために必要とされる投与量を減少させる、(e)活性代謝物の形成を、もし形成されれば、増加させる、(f)特定の組織において有害代謝物の産生を減少させる、及び/又は(g)多薬療法が意図的であろうと、そうでないにしても、多薬療法のためのより有効な薬物及び/又はより安全な薬物を作り出すために使用され得る。重水素化の手法は、CP-690550の代謝を遅らせ、患者間のばらつきを軽減するという、大きな見込みを有する。
【発明の概要】
【課題を解決するための手段】
【0015】
ヤヌスキナーゼ3活性を阻害することが分かったいくつかの新しい化合物および医薬組成物は、化合物を合成する方法および使用する方法と一緒に発見され、その方法は、本明細書に開示されるような化合物を投与することによる患者におけるヤヌスキナーゼ3媒介の障害の処置のための方法を含む。
【発明を実施するための形態】
【0016】
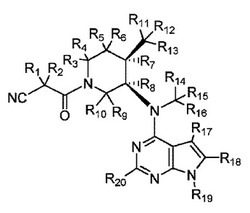
本発明の特定の実施形態において、化合物は、構造式I、
【0017】
【化2】

【0018】
またはその薬学的に許容可能な塩を有し、ここで、
R1-R20は、水素および重水素からなる群から独立して選択され、および、
R1-R20の少なくとも1つは、重水素である。
【0019】
さらなる実施形態において、R1-R2の少なくとも1つは、重水素である。
【0020】
さらなる実施形態において、R1-R2は、重水素である。
【0021】
さらなる実施形態において、R11-R13の少なくとも1つは、重水素である。
【0022】
さらなる実施形態において、R11-R13は、重水素である。
【0023】
さらなる実施形態において、R20は、重水素である。
【0024】
さらなる実施形態において、R3-R10の少なくとも6つは、重水素である。
【0025】
さらなる実施形態において、R3-R10の少なくとも7つは、重水素である。
【0026】
さらなる実施形態において、R3-R10は、重水素である。
【0027】
さらなる実施形態において、R1-R2およびR11-R13は、重水素である。
【0028】
さらなる実施形態において、R1-R2およびR20は、重水素である。
【0029】
さらなる実施形態において、R1-R2、およびR3-R10の少なくとも6つは、重水素である。
【0030】
さらなる実施形態において、R1-R2およびR3-R10は、重水素である。
【0031】
さらなる実施形態において、R11-R13およびR20は、重水素である。
【0032】
さらなる実施形態において、R11-R13、およびR3-R10の少なくとも6つは、重水素である。
【0033】
さらなる実施形態において、R11-R13およびR3-R10は、重水素である。
【0034】
さらなる実施形態において、R20、およびR3-R10の少なくとも6つは、重水素である。
【0035】
さらなる実施形態において、R20およびR3-R10は、重水素である。
【0036】
さらなる実施形態において、R1-R2、R20、およびR3-R10の少なくとも6つは、重水素である。
【0037】
さらなる実施形態において、R1-R2、R20、およびR3-R10は、重水素である。
【0038】
さらなる実施形態において、R1-R2、R11-R13、およびR3-R10の少なくとも6つは、重水素である。
【0039】
さらなる実施形態において、R1-R2、R11-R13、およびR3-R10は、重水素である。
【0040】
さらなる実施形態において、R1-R2、R11-R13、およびR20は、重水素である。
【0041】
さらなる実施形態において、R1-R2、R11-R13、R20、およびR3-R10の少なくとも6つは、重水素である。
【0042】
さらなる実施形態において、R1-R2、R11-R13、R20、およびR3-R10は、重水素である。
【0043】
本明細書に開示される特定の化合物は、有用なヤヌスキナーゼ3阻害活性を有し得、ヤヌスキナーゼ3が活発な役割を果たす障害の処置または予防において使用され得る。したがって、特定の実施形態はまた、化合物および組成物を作り使用する方法に加え、薬学的に許容可能な担体と一緒に、本明細書に開示される1つ以上の化合物を含む医薬組成物も提供する。特定の実施形態は、ヤヌスキナーゼ3活性を阻害するための方法を提供する。
他の実施形態は、本発明に従って、患者に治療上有効な量の化合物または組成物を投与する工程を含む、そのような処置を必要とする前記患者においてヤヌスキナーゼ3媒介の障害を処置するための方法を提供する。また、ヤヌスキナーゼ3活性を阻害することにより改善された障害の予防または処置のための薬剤の製造において使用するための、本明細書に開示される特定の化合物の使用が提供される。
【0044】
本明細書に開示される化合物はまた、限定されないが、炭素に対する13Cまたは14C、硫黄に対する33S、34S、または36S、窒素に対する15N、および酸素に対する17Oまたは18Oを含む、より一般的でない他の元素に対する同位体を含み得る。
【0045】
特定の実施形態において、本明細書に開示される化合物におけるすべてのC-D結合が、代謝され、D2OまたはDHOとして放出されると仮定すれば、本明細書に開示される化合物は、最大約0.000005%のD2Oまたは約0.00001%のDHOに患者を曝し得る。特定の実施形態において、動物において毒性を引き起こすことが示されたD2Oのレベルは、本明細書に開示されるような重水素が濃縮された化合物の投与によって引き起こされた曝露の最大限度よりもはるかに大きい。したがって特定の実施形態において、本明細書に開示される重水素が濃縮された化合物は、薬物代謝上のD2OまたはDHOの形成により何らかのさらなる毒性を引き起こすはずはない。
【0046】
特定の実施形態において、本明細書に開示される重水素化の化合物は、対応する非同位体的に濃縮された分子の有益な面を維持する一方で、最大耐用量を実質的に増加させ、毒性を減少させ、半減期(T1/2)を増加させ、最小有効量(MED)の最大血漿濃度(Cmax)を低下させ、有効量を低下させ、それによって、機序に関連しない(non-mechanism-related)毒性を減少させ、及び/又は薬物と薬物の相互作用の可能性を低下させる。
【0047】
特定の実施形態において、化合物は、構造式II、
【0048】
【化3】

【0049】
またはその塩を有し、
式中、
Z1はアミノ保護基であり、
R3−R16は、水素および重水素からなる群から独立して選択され、および、
R3−R16の少なくとも1つは、重水素である。
【0050】
さらなる実施形態において、Z1は、ベンジルである。
【0051】
さらなる実施形態において、構造式IIの化合物は、
【0052】
【化4】

【0053】
からなる群から選択された構造を有する。
【0054】
特定の実施形態において、本明細書には、構造式IIの化合物:
【0055】
【化5】

【0056】
式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3−R16は、水素および重水素からなる群から独立して選択され、
R3−R16の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は、以下の工程を含む:
Z2がカルボキシル保護基である、構造式IIIの化合物を、テトラヒドロフランなどの適切な溶剤中で、水素化ナトリウムなどの適切な塩基の存在下において、構造式IVの化合物と反応させ、構造式Vの化合物を得る工程;
【0057】
【化6】

【0058】
構造式Vの化合物を、水または酸化重水素などの適切な溶剤中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIの化合物を得る工程;
【0059】
【化7】

【0060】
および構造式VIの化合物を、テトラヒドロフランなどの適切な溶剤中で、トリアセトキシ水素化ホウ素ナトリウム(sodium triacetoxyborohydride)またはトリアセトキシ重水素化ホウ素ナトリウム(sodium triacetoxyborodeuteride)などの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式VIIの化合物を得る工程。
【0061】
【化8】

【0062】
特定の実施形態において、本明細書には、構造式IIの化合物:
【0063】
【化9】

【0064】
式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は、以下の工程を含む:
構造式VIIIの化合物を、メタノールなどの適切な溶剤中で、トルエンスルフォン酸などの適切な酸の存在下、オルソギ酸メチルエステルなどの随意の脱水剤の存在下において、構造式Xの化合物(Z3がC1-C2アルキルである)と反応させ、構造式IXの化合物を得る工程;
【0065】
【化10】

【0066】
構造式IXの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶剤中で、水酸化ナトリウムまたはd1-水酸化ナトリウム、または塩化重水素などの適切な塩基と反応させ、構造式IXの化合物を得る工程;
構造式IXの化合物を、水または酸化重水素などの適切な溶剤中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIIIの化合物を得る工程;
【0067】
【化11】

【0068】
構造式VIIIの化合物を、テトラヒドロフランなどの適切な溶剤中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式Xの化合物を得る工程;
【0069】
【化12】

【0070】
および構造式Xの化合物を、テトラヒドロフランなどの適切な溶剤中で、水素化アルミニウムリチウムまたは重水素化リチウムアルミニウムなどの適切な還元剤と反応させ、構造式Xの化合物を得る工程。
【0071】
【化13】

【0072】
特定の実施形態において、本明細書には構造式XIIIの化合物:
【0073】
【化14】

【0074】
式中、
Z1およびZ4は、水素およびアミノ保護基からなる群から独立して選択され、
R3-R18およびR20は、水素および重水素からなる群から独立して選択され、
R3-R18およびR20の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は以下の工程を含む:
構造式XIの化合物を、水およびテトラヒドロフランの組み合わせなどの適切な溶剤中で、炭酸カリウムなどの適切な塩基の存在下において、構造式IIの化合物と反応させ、構造式XIIの化合物を得る工程;
【0075】
【化15】

【0076】
および構造式XIIの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶剤中で、水素または重水素ガスなどの適切な還元剤および炭素上のパラジウムまたは炭素上の水酸化パラジウムなどの適切な触媒と反応させ、構造式XIIIの化合物を得る工程。
【0077】
【化16】

【0078】
本明細書に言及されるすべての公報および引用は、それらの全体の引用によって明白に本明細書に組み込まれる。しかしながら、組み込まれた両方の公報または引用において見出され、本明細書に明確に提示されたまたは定義されたあらゆる同様のまたは同一の用語に関して、言うならば、本明細書に明確に提示されたそれらの用語、定義または意味は、すべての点において優先するものとする。
【0079】
本明細書に使用されるように、下記の用語は、示された意味を有する。
【0080】
単数形「a」、「an」、および「the」は、特に別記のない限り複数の冠詞を指し得る。
【0081】
用語「約(about)」は、本明細書に使用されるように、修正する数値を修飾するように意図され、そのような値を許容誤差内の変数として示す。データの図または表に与えられた平均値に対する標準偏差などの特定の許容誤差が詳述されないとき、用語「約」は、詳述された値を包含するその範囲およびその数字を四捨五入することによって含まれる範囲も同様に意味し、有効数字を考慮に入れることは理解されたい。
【0082】
値域が開示され、表記法「n1から... n2まで」または「n1-n2」(n1およびn2が数字である)が使用されるとき、そのときは、他に指定のない限り、この表記法は、それらの間の数字自体およびそれらの間の範囲を含むことが意図される。この範囲はそれらの間で整数または連続的であり得、終値を含み得る。
【0083】
用語「重水素濃縮(deuterium enrichment)」は、水素に代わる、分子における所与の位置での重水素の取り込みのパーセンテージを指す。例えば、所与の位置での1%の重水素濃縮は、所与のサンプル内の分子の1%が、所定位置で重水素を含むことを意味する。重水素の自然発生の分布が約0.0156%であるため、濃縮していない出発物質を使用して合成された化合物における任意の位置での重水素濃縮は、約0.0156%である。重水素濃縮は、質量分析法および核磁気共鳴法を含む、当業者に公知の従来の分析法を使用して、測定され得る。
【0084】
R1-R20または記号「D」などの分子における所与の位置を記載するために使用されるとき、分子構造の図面における所与の位置を表わすために使用されるときの、用語「重水素である(is/are deuterium)」は、所定位置が重水素の自然発生の分布上で重水素で濃縮されることを意味する。1つの実施形態において、重水素濃縮は、所定位置での重水素の約1%以上であり、別の実施形態において、約5%以上であり、別の実施形態において、約10%以上であり、別の実施形態において、約20%以上であり、別の実施形態において、約50%以上であり、別の実施形態において、約70%以上であり、別の実施形態において、約80%以上であり、別の実施形態において、約90%以上であり、または別の実施形態において、約98%以上である。
【0085】
用語「同位体濃縮(isotopic enrichment)」は、元素のより一般的な同位体に代わって、分子における所与の位置での、元素のより一般的でない同位体の取り込みのパーセンテージを指す。
【0086】
用語「非同位体的に濃縮された(non-isotopically enriched)」は、様々な同位体のパーセンテージが自然発生のパーセンテージと実質的に同様である分子を指す。
【0087】
不斉中心は、本明細書に開示される化合物中に存在する。これらの中心は、キラル炭素原子のまわりの置換基の配置に依存する、記号「R」または「S」で示される。本発明が、D-異性体およびL-異性体、およびそれらの混合物のみだけでなく、ジアステレオマー、エナンチオマー、およびエピマーの形態を含む、すべての立体化学の異性体の形態を包含することは理解されたい。化合物の個々の立体異性体は、キラル中心を含む市販の出発物質から、または分離または再結晶、クロマトグラフ法、キラルクロマトグラフィーカラム上のエナンチオマーの直接分離、または当該技術分野に公知の任意の他の適切な方法に続く、ジアステレオマーの混合物への転換などの分離の後のエナンチオマー生成物の混合物の調製によって合成的に調製され得る。特定の立体化学の出発化合物は、市販であるか、当該技術分野に公知の技術によって作られ分解され得るかのいずれかである。さらに、本明細書に開示される化合物は、幾何異性体として存在し得る。本発明は、すべてのシス(cis)、トランス(trans)、合成(syn)、抗(anti)、エントゲーゲン(E)(entgegen)、およびツザメン(Z)(zusammen)の異性体に加え、それらの適切な混合物を含む。さらに、化合物は、互変異性体として存在し得る。すべての互変体の異性体は、本発明によって提供される。さらに、本明細書に開示される化合物は、非溶媒和の形態に加え、水、エタノールなどの薬学的に許容可能な溶剤との溶媒和の形態で存在し得る。一般に、溶媒和の形態は、非溶媒和の形態と等価であると考えられる。
【0088】
「カルボキシル保護基」の定義は、限定されないが、2-N-(モルホリノ)エチル、コリン、メチル、メトキシエチル、9-フルオレニルメチル、メトキシメチル、メチルチオメチル、テトラヒドロピラニル、テトラヒドロフラニル、メトキシエトキシメチル、2-(トリメチルシリル)エトキシメチル、ベンジルオキシメチル、ピバロイルオキシメチル、フェニルアセトキシメチル、トリイソプロピルシリルメチル、シアノメチル、アセトール、p-ブロモフェナシル,α-メチルフェナシル、p-メトキシフェナシル、デシール、カルボキサミドメチル、p-アゾベンゼンカルボキサミド-メチル、N-フタルイミドメチル 、(メトキシエトキシ)エチル、2,2,2-トリクロロエチル 、2-フルオロエチル、2-クロロエチル、2-ブロモエチル、2-ヨードエチル、4-クロロブチル、5-クロロペンチル、2-(トリメチルシリル)エチル、2-メチルチオエチル、1,3-ジチアニル-2-メチル、2-(p-ニトロフェニルスルフェニル)エチル、 2-(p-トルエンスルホニル)エチル、2-(2'-ピリジル )エチル、2-(p-メトキシフェニル)エチル、2-(ジフェニルホスフィノ)エチル、1-メチル-1-フェニルエチル、2-(4-アセチル-2-ニトロフェニル)エチル、2-シアノエチル、ヘプチル、tert-ブチル、3-メチル-3-ペンチル、ジシクロプロピルメチル、2,4-ジメチル-3-ペンチル、シクロペンチル、シクロヘキシル、アリル、メタリル、2-メチルブタ-3-エン-2-イル、3-メチルブタ-2-(プレニル)、3-ブテン-1-イル、4-(トリメチルシリル)-2-ブテン-1-イル、シンナミル、α-メチルシンナミル、プロパルギル、フェニル、2,6-ジメチルフェニル、2,6-ジイソプロピルフェニル、2,6-ジ-tert-ブチル-4-メチルフェニル、2,6-ジ-tert-ブチル-4-メトキシフェニル、p-(メチルチオ)フェニル、ペンタフルオロフェニル、ベンジル、トリフェニルメチル、ジフェニルメチル、ビス(o-ニトロフェニル)メチル、9-アントリルメチル、2-(9,10-ジオキソ)アントリルメチル,5-ジベンゾスベリル、1-ピレニルメチル、2-(トリフルオロメチル)-6-クロモニルメチル、2,4,6-トリメチルベンジル、p-ブロモベンジル、o-ニトロベンジル、p-ニトロベンジル、p-メトキシベンジル、2,6-ジメトキシベンジル、4-(メチルスルフィニル)ベンジル、4-スルホベンジル、4-アジドメトキシベンジル、4-{N-[1-(4,4-ジメチル-2,6-ジオキソシクロヘキシリデン)-3-メチルブチル]アミノ}ベンジル、ピペロニル、4-ピコリル、トリメチルシリル、トリエチルシリル、tert-ブチルジメチルシリル、イソプロピルジメチルシリル、フェニルジメチルシリル、ジ-tert-ブチルメチルシリル、トリイソプロピルシリルなどを含む。
【0089】
「アミノ保護基」の定義は、限定されないが、
2-メチルチオエチル、2-メチルスルホニルエチル、2-(p-トルエンスルホニル)エチル、[2-(1,3-ジチアニル)]メチル、4-メチルチオフェニル、2,4-ジメチルチオフェニル、2-ホスホニオエチル、1-メチル-1-(トリフェニルホスホニオ)エチル、1,1-ジメチル-2-シアノエチル、2-ダンシルエチル、2-(4-ニトロフェニル)エチル、4-フェニルアセトキシベンジル、4-アジドベンジル、4-アジドメトキシベンジル、m-クロロ-p-アシルオキシベンジル、p-(ジヒドロキシボリル)ベンジル、5-ベンズイソオキサゾリルメチル、2-(トリフルオロメチル)-6-クロモニルメチル(chromonytmethyl)、m-ニトロフェニル、3.5-ジメトキシベンジル、1-メチル-1-(3,5-ジメトキシフェニル)エチル、o-ニトロベンジル、α-メチルニトロピペロニル、3,4-ジメトキシ-6-ニトロベンジル、N-ベンゼンスルフェニル、N-o-ニトロベンゼンスルフェニル、N-2,4-ジニトロベンゼンスルフェニル、N-ペンタクロロベンゼンスルフェニル,N-2-ニトロ-4-メトキシベンゼンスルフェニル、N-トリフェニルメチルスルフェニル、N-1-(2,2,2-トリフルオロ-1,1-ジフェニル)エチルスルフェニル、N-3-ニトロ-2-ピリジンスルフェニル、N-p-トルエンスルホニル、N-ベンゼンスルホニル、N-2,3,6-トリメチル-4-メトキシベンゼンスルホニル、N-2,4,6-トリメトキシベンゼン-スルフォニル、N-2,6-ジメチル-4-メトキシベンゼンスルホニル、N-ペンタメチルベンゼンスルホニル(N-2,3,5,6-テトラメチル-4-メトキシベンゼンスルホニルなど、
R80が、アルキル、置換されたアルキル、アリールからなる基から選択され、より具体的には、R80=メチル、エチル、9-フルオレニルメチル、9-(2-スルフォ)フルオレニルメチル,9-(2,7-ジブロモ)フルオレニルメチル)、17-テトラベンゾ[a,c,g,i]フルオレニルメチル,2-クロロ-3-インデニルメチル、ベンズ[f]インデン-3-イルメチル、2,7-ジ-t-ブチル-[9-(10,10-ジオキソ-10,10,10,10-テトラヒドロチオキサンチル(tetrahydrothloxanthyl)]メチル、1,1-ジオキソベンゾ[b]チオフェン-2-イルメチル、2,2,2-トリクロロエチル、2-トリメチルシリルエチル、2-フェニルエチル、1-(1-アダマンチル)-1-メチルエチル、2-クロロエチル、1,1-ジメチル-2-ハロエチル、1,1-ジメチル-2,2-ジブロモエチル、1,1-ジメチル-2,2,2-トリクロロエチル、1-メチル-1-(4-ビフェニルイル)エチル、1-(3,5-ジ-tert-ブチルフェニル)-1-メチルエチル、2-(2'-ピリジン)エチル、2-(4'-ピリジン)エチル、2,2-ビス(4'-ニトロフェニル)エチル、N-(2-ピバロイルアミノ)-1,1-ジメチルエチル、2-[(2-ニトロフェニル)ジチオ]-1-フェニルエチル、tert-ブチル、1-アダマンチル、2-アダマンチル、ビニル、アリル、1-イソプロピルアリル、シンナミル,4-ニトロシンナミル、3-(3-ピリジン)プロプ-2-エニル、8-キノリル、N-ヒドロキシピペリジニル、アルキルジチオ、ベンジル、p-メトキシベンジル、p-ニトロベンジル、p-ブロモベンジル,p-クロロベンジル、2,4-ジクロロベンジル、4-メチルスルフィニルベンジル、9-アントリルメチル、ジフェニルメチル、tert-アミル、S-ベンジルチオカルバマート、ブチニル、p-シアノベンジル、シクロブチル、シクロヘキシル、シクロペンチル、シクロプロピルメチル、p-デシルオキシベンジル、ジイソプロピルメチル、2,2-ジメトキシカルボニルビニル、o-(N,N'-ジメチルカルボキサミド)ベンジル、1,1-ジメチル-3-(N,N'-ジメチルカルボキサミド)プロピル、1,1-ジメチルプロピニル、ジ(2-ピリジン)メチル、2-フラニルメチル、2-イオドエチル(lodoethyl)、イソボルニル、イソブチル、イソニコチニル、p-(p'-メトキシフェニルアゾ)ベンジル、1-メチルシクロブチル、1-メチルシクロヘキシル、1-メチル-1-シクロプロピルメチル、1-メチル-1-(p-フェニルアゾフェニル)エチル、1-メチル-1-フェニルエチル、1-メチル-1-4'-ピリジリエチル、フェニル、p-(フェニルアゾ)ベンジル、2,4,6-トリメチルフェニル、4-(トリメチルアンモニウム)ベンジル、2,4,6-トリメチルベンジルなどである、-C(O)OR80を含む。
【0090】
用語「結合(bond)」は、2つの原子の間、または結合によって連結された原子がより大きな下部構造の一部であると考えられるときの2つの部分の間の共有結合を指す。結合は、特に指定のない限り、単一、二重または三重であり得る。分子の図面における2つの原子の間の破線は、さらなる結合がその位置で存在し得るまたは存在し得ないことを示す。
【0091】
本明細書に使用されるような用語「障害(disorder)」は、用語「疾患」、「症候群」、および(内科疾患におけるような)「疾病」と一般に同意語になるように意図され、交換可能に使用され、それらすべては、正常な機能を害する、ヒトまたは動物の体の、またはその部分の一つの異常状態を表し、兆候および症状を見分けることによって、典型的に明らかとなる。
【0092】
用語「処置する(treat)」、「処置すること(treating)」、および「処置(treatment)」は、障害または障害に関係する1以上の症状を緩和または抑制すること、または障害自体の原因を緩和または根絶することを含むように意図されている。本明細書で使用されるように、障害の「処置」への言及は、予防を含むように意図されている。用語「予防する(prevent)」、「予防すること(preventing)」、および「予防(prevention)」は、障害の発症、及び/又はその伴う症状を遅らせるまたは排除する、被験体が障害にかかることを防ぐ、または障害にかかる被験体のリスクを減らす方法を指す。
【0093】
用語「治療上有効な量(therapeutically effective amount)」は、処置されている障害の1以上の症状の進行を防ぐ、またはある程度まで緩和するのに十分な、投与されたときの化合物の量を指す。用語「治療上有効な量」はまた、研究者、獣医、医師、または臨床医によって求められている、細胞、組織、器官系、動物、またはヒトの生物学的または医学的反応を引き出すのに十分な化合物の量を指す。
【0094】
用語「被験体(subject)」は、限定されないが、霊長類(例えば、ヒト、猿、チンパンジー、ゴリラなど)、齧歯類(例えば、ラット、マウス、アレチネズミ、ハムスター、フェレットなど)、ウサギ、豚類(例えば、豚、ミニチュアピッグ)、ウマ、イヌ、ネコなどを含む動物を指す。用語「被験体」および「患者(patient)」は、本明細書の引用において、例えば、ヒト患者などの哺乳類の被験体に交換可能に使用される。
【0095】
用語「併用療法(combination therapy)」は、本開示に記載される治療上の障害を治療するための2つ以上の治療薬の投与を意味する。このような投与は、固定比率の活性成分を有する単一のカプセル、または各活性成分のための多数の、別々のカプセルなどのように、実質的に同時の方法で、これらの治療薬の同時投与を包含する。さらに、このような投与はまた、連続する方法で、各タイプの治療薬の使用を包含する。いずれの場合においても、処置レジメンは、本明細書に記載される障害を治療する際に、複合薬の有益な効果を提供する。
【0096】
用語「ヤヌスキナーゼ3(Janus kinase 3)」は、プロテインキナーゼのヤヌスファミリーのメンバーを指す。このファミリーの他のメンバーは、本質的にすべての組織によって発現されるが、ヤヌスキナーゼ3の発現は造血細胞に限定される。これは、これらの多連鎖の受容体に共通のγ鎖との、ヤヌスキナーゼ3の非共有結合の会合によって、IL-2、IL-4、IL-7、IL-9、およびIL-15に対する受容体を介してシグナル伝達する際のその不可欠な役割と一致している。XSCID患者集団は、ヤヌスキナーゼ3タンパク質の激しく減少したレベルまたは共通のγ鎖に対する遺伝子欠損と同定され、免疫抑制が、ヤヌスキナーゼ3経路を介してシグナル伝達を遮断することから生じるはずであることを示唆している。動物研究は、ヤヌスキナーゼ3がBおよびTリンパ球の成熟に重大な役割を果たすだけでなく、ヤヌスキナーゼ3がT細胞機能を維持するのに構成的に必要とされることを示唆した。この新しい機構を介する免疫力の調節は、移植拒絶反応および自己免疫性疾患などのT細胞の増殖障害の処置に有用であることが分かり得る。
【0097】
用語「ヤヌスキナーゼ3媒介の障害(Janus kinase 3-mediated disorder)」は、異常なヤヌスキナーゼ3活性、または調節されたときに、他の異常な生化学的プロセスを改善する、正常なヤヌスキナーゼ3活性によって特徴付けられる障害を指す。ヤヌスキナーゼ3媒介の障害は、ヤヌスキナーゼ3活性を調節することによって、完全にまたは部分的に媒介され得る。特に、ヤヌスキナーゼ3媒介の障害は、ヤヌスキナーゼ3活性を阻害することによって、結果的に根本的な障害へある程度の効果を与える、例えば、ヤヌスキナーゼ3インヒビターの投与が、結果的に少なくとも何人かの処置されている患者においてある程度の改善をもたらす。
【0098】
用語「ヤヌスキナーゼ3インヒビター(Janus kinase 3 inhibitor)」は、ヤヌスキナーゼ3の機能を変える、本明細書に開示される化合物の能力を指す。インヒビターは、インヒビターとヤヌスキナーゼ3の間の、可逆的または不可逆的な共有結合の形成により、または非共有結合の複合体の形成を介して、ヤヌスキナーゼ3活性を遮断または低減し得る。このような阻害は、特定の細胞タイプにおいてのみ明らかにされ得る、または特定の生物学的事象に左右され得る。用語「ヤヌスキナーゼ3インヒビター」はまた、複合体がヤヌスキナーゼ3と天然の基質の間で生じる可能性を減らすことによって、ヤヌスキナーゼ3の機能を変えることを指す。幾つかの実施形態において、ヤヌスキナーゼ3活性の阻害は、Jiang et al., J. Med. Chem. 2008, 51,8012-8018;米国特許第6,627,754号およびWO 2003/048162に記載される方法を使用して評価され得る。
【0099】
用語「ヤヌスキナーゼ3活性を阻害すること(inhibiting Janus kinase 3 activity)」または「ヤヌスキナーゼ3活性の阻害(inhibition of Janus kinase 3 activity)」は、ヤヌスキナーゼ3インヒビターを投与することによってヤヌスキナーゼ3の機能を変えることを指す。
【0100】
用語「治療上許容可能な(therapeutically acceptable)」は、過度の毒性、刺激、アレルギー反応、免疫原性のない患者の組織に接触する使用に適し、合理的なリスク・ベネフィット比と比例し、それらの意図された使用に有効である化合物(あるいは塩、プロドラッグ、互変異性体、両性イオンの形態など)を指す。
【0101】
用語「薬学的に許容可能な担体(pharmaceutically acceptable carrier)」、「薬学的に許容可能な賦形剤(pharmaceutically acceptable excipient)」、「生理学的に許容可能な担体(physiologically acceptable carrier)」、または「生理学的に許容可能な賦形剤(physiologically acceptable excipient)」は、液体または固形の充填剤、希釈剤、賦形剤、溶剤、または封入材料などの薬学的に許容可能な材料、組成物、またはビヒクルを指す。各構成要素は、医薬製剤の他の成分と適合している意味で、「薬学的に許容可能」でなければならない。また、合理的なリスク・ベネフィット比と比例して、過度の毒性、刺激、アレルギー反応、免疫原性、または他の問題または合併症のない、ヒトおよび動物の組織または器官に接触する使用に適していなければならない。Remington:The Science and Practice of Pharmacy, 21st Edition; Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition; Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; および Handbook of Pharmaceutical Additives, 3rd Edition; Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004)を参照。
【0102】
用語「活性成分(active ingredient)」、「活性化合物(active compound)」、および「活性物質(active substance)」は、1つ以上の障害の症状を処置、予防、または改善するために、被験体に単独でまたは1つ以上の薬学的に許容可能な賦形剤または担体と組み合わせて投与される化合物を指す。
【0103】
用語「薬物(drug)」、「治療薬(therapeutic agent)」、および「化学療法薬(chemotherapeutic agent)」は、1つ以上の障害の症状を処置、予防、または改善するために、被験体に投与される、化合物、またはその医薬組成物を指す。
【0104】
用語「放出制御賦形剤(release controlling excipient)」は、その主要な機能が、従来の即時放出剤形と比較して、剤形から活性物質を放出する期間または場所を修正することである賦形剤を指す。
【0105】
用語「非放出制御賦形剤(nonrelease controlling excipient)」は、その主要な機能が、従来の即時放出剤形と比較して、剤形から活性物質を放出する期間または場所を修正することを含まない賦形剤を指す。
【0106】
用語「プロドラッグ(prodrug)」は、本明細書に開示されるような化合物の複合機能的誘導体を指し、インビボで親化合物に容易に変換可能である。プロドラッグは、幾つかの状況において、親化合物よりも投与しやすいという理由から、しばしば有用である。プロドラッグは、例えば、経口投与により生物学的に利用可能であり得る一方で、親化合物はそうではない。プロドラッグはまた、親化合物を超える医薬組成物において高溶解度を有し得る。プロドラッグは、酵素法および代謝の加水分解を含む、様々なメカニズムによって親薬物に変換され得る。Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. in "Design of Biopharmaceutical Properties through Prodrugs and Analogs," Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application," Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs," Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265-287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech.1998, 11, 345-365; Gaignault et al., Pract.Med. Chem. 1996, 671- 696; Asgharnejad in "Transport Processes in Pharmaceutical Systems," Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. Drug Metab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev.1992, 8, 1-38; Fleisher et al., Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher et al., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc, Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 49-59; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148-155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507を参照。
【0107】
本明細書に開示される化合物は、治療上許容可能な塩として存在し得る。本明細書に使用されるように、用語「薬学的に許容可能な塩(pharmaceutically acceptable salt)」は、本明細書に定義されるように治療上許容可能である本明細書に開示される化合物の塩または両性イオンの形態を表わす。塩は、化合物の最終的な分離および精製の間に、または適切な化合物を適切な酸または塩基と反応させることにより別々に調製され得る。
治療上許容可能な塩は、酸および塩基付加塩を含む。塩の調製および選択のより十分な議論については、"Handbook of Pharmaceutical Salts, Properties, and Use," Stah and Wermuth, Ed., (Wiley- VCH and VHCA, Zurich, 2002) および Berge et al., J. Pharm. Sci. 1977, 66, 1-19を参照。
【0108】
薬学的に許容可能な塩の調製で使用するための適切な酸は、限定されないが、酢酸、2,2-ジクロロ酢酸、アシル化されたアミノ酸、アジピン酸、アルギン酸、アスコルビン酸、L-アスパラギン酸、ベンゼンスルホン酸、安息香酸、4-アセトアミド安息香酸、ホウ酸、(+)-樟脳酸、カンファースルホン酸、(+)-(1S)-カンファー-10-スルホン酸、カプリン酸、カプロン酸、カプリル酸、珪皮酸、クエン酸、シクラミン酸、シクロヘキサンスルファミン酸、ドデシル硫酸、エタン-1,2-ジスルホン酸、エタンスルホン酸、2-ヒドロキシ-エタンスルホン酸、ギ酸、フマル酸、ガラクタル酸、ゲンチシン酸、グルコペプトン酸、D-グルコン酸、D-グルクロン酸、L-グルタミン酸、α-オキソ-グルタル酸、グリコール酸、馬尿酸、臭化水素酸、塩化水素酸、ヨウ化水素酸、(+)-L-乳酸、(±)-DL -乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、(-)-L-リンゴ酸、マロン酸、(±)-DL-マンデル酸、メタンスルホン酸、ナフタリン-2-スルホン酸、ナフタレン-1,5-ジスルホン酸、1-ヒドロキシ-2-ナフトエ酸、ニコチン酸、硝酸、オレイン酸、オロト酸、シュウ酸、パルミチン酸、パモン酸、過塩素酸、リン酸、L-ピログルタミン酸、糖酸、サリチル酸、4-アミノ-サリチル酸、セバシン酸、ステアリン酸、コハク酸、硫酸、タンニン酸、(+)-L-酒石酸、チオシアン酸、p-トルエンスルホン酸、ウンデシレン酸、および吉草酸を含む。
【0109】
薬学的に許容可能な塩の調製で使用するための適切な塩基は、限定されないが、水酸化マグネシウム、水酸化カルシウム、水酸化カリウム、水酸化亜鉛、または水酸化ナトリウムなどの無機塩基、およびL-アルギニン、ベネタミン、ベンザチン、コリン、デアノール、ジエタノールアミン、ジエチルアミン、ジメチルアミン、ジプロピルアミン、ジイソプロピルアミン、2-(ジエチルアミノ)-エタノール、エタノールアミン、エチルアミン、エチレンジアミン、イソプロピルアミン、N-メチル-グルカミン、ヒドラバミン、1H-イミダゾール、L-リジン、モルホリン、4-(2-ヒドロキシエチル)-モルホリン、メチルアミン、ピペリジン、ピペラジン、プロピルアミン、ピロリジン、1-(2-ヒドロキシエチル)-ピロリジン、ピリジン、キヌクリジン、キノリン、イソキノリン、第二級アミン、トリエタノールアミン、トリメチルアミン、トリエチルアミン、N-メチル-D-グルカミン、2-アミノ-2-(ヒドロキシメチル) - 1,3-プロパンジオール、およびトロメタミンを含む、第1級、第2級、第3級、および第4級、脂肪族および芳香族のアミンなどの有機塩基を含む。
【0110】
対象の発明の化合物が、未加工の化学物質として投与されることは可能であり得る一方で、それらを医薬組成物として提示することも可能である。従って、本明細書には、本明細書に開示される1以上の特定の化合物、またはその1以上の薬学的に許容可能な塩、プロドラッグ、または溶媒和物を、それらの薬学的に許容可能な担体および随意に1以上の他の治療成分と一緒に含む、医薬組成物が提供される。適切な製剤は、選択される投与の経路に依存する。周知の技術、担体、および賦形剤はいずれも、当該技術分野において、適切なものとして、かつ理解されるものとして使用され得る(例えば、Remington's Pharmaceutical Sciencesにおいて)。本明細書に開示される医薬組成物は、当該技術分野に公知の任意の方法で、例えば、従来の、混合、溶解、造粒、ドラゼー製法、微粒子化、乳化、カプセル化、封入、又は圧縮のプロセスの手段によって製造され得る。医薬組成物はまた、遅延放出、徐放、持効性放出、持続性放出、パルス放出、制御放出、促進放出、および即時放出、標的放出、プログラム放出を含む、修正された放出剤形、および胃貯留の剤形として製剤され得る。これらの剤形は、当業者に公知の従来の方法と技術に従って調製され得る(Remington: The Science and Practice of Pharmacy, 上記; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc., New York, NY, 2002, Vol. 126を参照)。
【0111】
最も適切な経路は、例えば、レシピエントの疾病および障害に依存し得るが、組成物は、経口、非経口(皮下、皮内、筋肉内、静脈内、関節内、および髄内を含む)、腹腔内、口腔粘膜、経皮、直腸および局所(真皮、バッカル、舌下および眼内)の投与に適している組成物を含む。組成物は、ユニット剤形で好都合に提示され得、薬学の技術分野で周知の方法のいずれかによって調製され得る。典型的に、これらの方法は、対象の発明の化合物またはその薬学的な塩、プロドラッグ、または溶媒和物(「活性成分」)を、1以上の副成分を構成する担体と関連させる工程を含む。一般に、組成物は、活性成分を、液体担体または微粉固体担体またはその両方を一律にかつ密接に関連させ、その後、必要であれば、生成物を所望の製剤に形作ることによって調製される。
【0112】
経口投与に適した本明細書に開示される化合物の製剤は、各々が活性成分の所定量を含んでいる、カプセル剤、カシェ剤または錠剤などの別々のユニットとして、パウダーまたは果粒剤として、水性液または非水性液体中の溶液または懸濁液として、または水中油型の乳濁液または油中水型の乳濁液として存在し得る。活性成分も、ボーラス、舐剤またはペーストとして存在し得る。
【0113】
経口に利用可能な医薬製剤は、錠剤、ゼラチンで作られた押し込み型カプセル剤に加え、グリセロールまたはソルビトールなどの、ゼラチンおよび可塑剤で作られた軟質密閉カプセル剤を含む。錠剤は、随意に1つ以上の副成分とともに、圧縮または成形によって作られ得る。圧縮錠剤は、結合剤、不活性希釈剤、または平滑剤、界面活性剤または分散剤と随意に混合され、パウダーまたは果粒剤などの自由流動形態で、活性成分を適切な機械において圧縮することによって調製され得る。成形錠剤は、不活性液体希釈剤で湿らされた粉末化合物の混合物を適切な機械において成形することにより作られ得る。錠剤は、随意にコーティングされ得、または印を付けられ得、錠剤中に活性成分の遅効性放出または制御放出を提供するように製剤され得る。経口投与のためのすべての製剤は、そのような投与に適した用量であるべきである。押し込み型カプセル剤は、ラクトースなどの充填剤、デンプンなどの結合剤、及び/又はタルクまたはステアリン酸マグネシウムなどの潤滑剤、および随意に安定剤との混合において、活性成分を含み得る。軟カプセル剤において、活性化合物は、脂肪油、液動パラフィン、または液体ポリエチレングリコールなどの適切な液体中で溶解または懸濁され得る。さらに、安定剤が加えられ得る。ドラゼーコアは、適切なコーティングとともに提供される。この目的のために、濃縮された糖溶液は使用され得、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、及び/又は二酸化チタン、ラッカー溶液、および適切な有機溶剤または溶媒混合液を随意に含み得る。色素またはピグメントは、同定のために、または活性化合物用量の異なる組み合わせを特徴付けるために、錠剤またはドラゼーのコーティングに加えられ得る。
【0114】
化合物は、注射、例えば、ボーラス注射または持続注入によって非経口投与のために製剤され得る。注射のための製剤は、ユニット剤形、例えば、アンプルまたは複数用量容器において、加えられた防腐剤と一緒に存在し得る。組成物は、油性または水溶性のビヒクル内で、懸濁液、溶液または乳濁液のような形態をとり得、懸濁剤、安定剤及び/又は分散剤などの製剤化剤を含み得る。製剤は、単一用量または複数用量の容器、例えば密閉されたアンプルおよびバイアルにおいて存在し得、使用の直前に、無菌の液体担体、例えば、食塩水または無菌の発熱性物質が入っていない水の付加のみを必要とする、粉末形態または冷凍乾燥(凍結乾燥)された状態で貯蔵され得る。即席の注射液および懸濁液は、以前に記載された種類の無菌の粉末剤、果粒剤および錠剤から調製され得る。
【0115】
非経口投与のための製剤は、指定されたレシピエントの血液と等張な製剤にする、酸化防止剤、緩衝液、静菌剤および溶質を含み得る活性化合物の水性および非水性(油性)の無菌の注射溶液、および懸濁剤および増粘剤を含み得る、水性および非水性の無菌の懸濁液を含む。適切な親油性溶媒またはビヒクルは、胡麻油などの脂肪油、オレイン酸エチルまたはトリグリセリドなどの合成脂肪酸エステル、またはリポソームを含む。水溶性の注射懸濁液は、例えば、ナトリウムカルボキシメチルセルロース、ソルビトール、またはデキストランなどの、懸濁液の粘性を増加させる物質を含み得る。随意に、懸濁液はまた、化合物の溶解度を増加させることで高濃縮溶液の調製を可能にする、適切な安定剤または薬剤を含み得る。
【0116】
以前に記載された製剤に加えて、化合物もデポ製剤として製剤され得る。このような長時間作用する製剤は、(例えば皮下または筋肉内の)注入または筋肉内注射によって投与され得る。したがって、例えば、化合物は、適切なポリマーまたは(例えば許容可能な油内での乳濁液のような)疎水性材料またはイオン交換樹脂とともに、またはやや難溶性の誘導体、例えば、やや難溶性の塩として製剤され得る。
【0117】
口腔内または舌下投与のために、組成物は、従来の方法で製剤された、錠剤、ロゼンジ、香錠、またはゲルの形態をとり得る。このような組成物は、蔗糖およびアラビアゴムまたはトラガカントゴムなどの香料ベースの活性成分を含み得る。
【0118】
化合物はまた、例えば、ココアバター、ポリエチレングリコール、または他のグリセリドなどの従来の坐剤基剤を含む、坐剤または停留浣腸剤などの直腸の組成物において製剤され得る。
【0119】
本明細書に開示される特定の化合物は、局所的に、すなわち非全身性の投与によって投与され得る。これは、化合物が著しく血流に入らないように、表皮または口腔への外側からの本明細書に開示される化合物の適用、および耳、目および鼻へのそのような化合物の注入を含む。対照的に、全身投与は、経口、静脈内、腹腔内および筋肉内の投与を指す。
【0120】
局所投与に適した製剤は、ゲル剤、リニメント剤、ローション剤、クリーム剤、軟膏剤またはペースト剤などの、皮膚を通って炎症の部位に浸透させることに適した液体または半液体の製剤、および目、耳または鼻への投与に適した滴下剤を含む。
【0121】
吸入による投与のために、化合物は、注入器、噴霧器で加圧されたパック、またはエアロゾルスプレー送達するという他の簡便な手段から送達され得る。加圧されたパックは、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適切なガスなどの適切な噴霧剤を含み得る。加圧されたエアロゾルの場合、投与ユニットは、測定された量を送達するための弁を提供することによって決定され得る。代わりに、吸入またはガス注入による投与のために、本発明による化合物は、乾燥粉末組成物、例えば化合物の粉末混合の形態、およびラクトースまたはデンプンなどの適切な粉末基剤の形態をとり得る。粉末組成物は、ユニット剤形で、例えば、カプセル剤、カートリッジ、ゼラチンまたはブリスターパックにおいて存在し得、それらから粉末剤は、吸入器または注入器を用いて投与され得る。
【0122】
好ましいユニット投与の製剤は、本明細書の下記に詳述されるような活性成分の有効量、または活性成分のその適切な分画(fraction)を含んでいる製剤である。
【0123】
化合物は、1日当たり0.1〜500mg/kgの用量で経口にまたは注射によって投与され得る。成人のヒトのための用量範囲は、一般に、5mg〜2g/日までである。別々のユニットで提供される錠剤または他の提示の形態は、そのような投与で有効であるか、または複数回の同じもの、例えば、5mg〜500mgまで、通常約10mg〜200mgまでを含んでいるユニットとして有効である、1以上の化合物の量を、適宜に含み得る。
【0124】
単一の剤形をもたらすために担体物質と組み合わせられ得る活性成分の量は、処置される宿主および投与の特定の形式に依存して変化する。
【0125】
化合物は、様々な形式で、例えば、経口、局所、または注射によって投与され得る。患者に投与される化合物の正確な量は、担当する医師の責任となる。任意の特定の患者のための特定の用量レベルは、使用される特定の化合物の活性、年齢、体重、健康状態、性別、食事、投与の時間、投与の経路、分泌の速度、複合薬、処置されている正確な障害、および処置されている障害の重症度を含む、様々な要因に依存する。また、投与の経路は、障害およびその重症度に依存して変化し得る。
【0126】
患者の症状が改善しない場合、医者の判断に基づき、化合物の投与は、長期にわたって、すなわち、患者の障害の症状を回復させる、またはそうでなくとも抑制または制限するために、患者の生涯を通した期間を含む、長期間の間投与され得る。
【0127】
患者の状態が改善する場合において、医者の判断に基づいて、化合物の投与は、継続的に与えられ得る、または一定時間の間一時的に停止され得る(即ち、「休薬期間」)。
【0128】
一旦患者の症状が改善すると、必要ならば維持量が投与される。続いて、投与の量または頻度、またはその両方は、改善された障害が持続されるレベルまで、症状の作用として減らされる。しかしながら、患者は、症状が再発すると、長期的に間欠処置が必要となり得る。
【0129】
本明細書には、治療上有効な量の本明細書に開示されるような化合物またはその薬学的に許容可能な塩、溶媒和物、またはプロドラッグを、そのような障害を有するまたは有する疑いのある被験体に投与する工程を含む、ヤヌスキナーゼ3媒介の障害を処置する方法が開示される。
【0130】
ヤヌスキナーゼ3媒介の障害は、限定されないが、腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、移植拒絶反応、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病からの合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、白血病、及び/又は、ヤヌスキナーゼ3インヒビターを投与することによって減少され、緩和され、または予防され得るあらゆる障害を含む。
【0131】
特定の実施形態において、ヤヌスキナーゼ3媒介の障害を処置する方法は、治療上有効な量の本明細書に開示されるような化合物、またはその薬学的に許容可能な塩、溶媒和物、またはそのプロドラッグを、被験体に投与する工程を含み、(1)化合物またはその代謝物質の血漿レベルの減少した個対間変動、(2)化合物の増加した平均血漿レベル、投与ユニットごとの化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、(3)被験体における、少なくとも1つのシトクロムP450またはモノアミンオキシダーゼアイソフォームの減少した阻害、及び/又はそれによる減少した代謝、(4)被験体における、少なくとも1つの多形的に発現されたシトクロムP450アイソフォームを介した減少した代謝、(5)少なくとも1つの統計的に有意に改善された障害抑制及び/又は障害根絶のエンドポイント、(6)障害の処置の間の改善された臨床効果、(7)主要な臨床的有用性としての異常な消化管または肝臓のパラメーターの再発の予防、またはその衰弱また出現の遅延、(8)対応する非同位体的に濃縮された化合物に比べて、任意の診断上の肝胆道機能エンドポイントの悪化の低減または除去、に影響を与える。
【0132】
特定の実施形態において、本明細書に開示されるような化合物、またはその代謝物質の血漿レベル中の個対間変動は減少され、本明細書に開示されるような化合物の平均血漿レベルは増加され、本明細書に開示されるような化合物の代謝物質の平均血漿レベルは減少され、本明細書に開示されるような化合物によるシトクロムP450またはモノアミンオキシダーゼアイソフォームの阻害は減少され、または、少なくとも1つの多形的に発現されたシトクロムP450アイソフォームによる本明細書に開示されるような化合物の代謝は、対応する非同位体的に濃縮された化合物に比べて、約5%以上、約10%以上、約20%以上、約30%以上、約40%以上、または約50%以上減少される。
【0133】
本明細書に開示されるような化合物、またはその代謝物質の血漿レベルは、Li et al. Rapid Communications in Mass Spectrometry 2005, 19, 1943-1950;Paniagua et al., Therapeutic Drug Monitoring 2005, 27(5), 608-616;Lawendy et al., J Clin Pharmacol 2009, 49, 423-429;およびその中で言及される任意の引用およびそれで作られたその中のなされた任意の修正に記載される方法を使用して測定され得る。
【0134】
哺乳類の被験体におけるシトクロムP450アイソフォームの例は、限定されないが、CYP1A1、CYP1A2、CYP1B1、CYP2A6、CYP2A13、CYP2B6、CYP2C8、CYP2C9、CYP2C18、CYP2C19、CYP2D6、CYP2E1、CYP2G1、CYP2J2、CYP2R1、CYP2S1、CYP3A4、CYP3A5、CYP3A5P1、CYP3A5P2、CYP3A7、CYP4A11、CYP4B1、CYP4F2、CYP4F3、CYP4F8、CYP4F11、CYP4F12、CYP4X1、CYP4Z1、CYP5A1、CYP7A1、CYP7B1、CYP8A1、CYP8B1、CYP11A1、CYP11B1、CYP11B2、CYP17、CYP19、CYP21、CYP24、CYP26A1、CYP26B1、CYP27A1、CYP27B1、CYP39、CYP46、およびCYP51を含む。
【0135】
哺乳類の被験体におけるモノアミンオキシダーゼアイソフォームの例は、限定されないが、MAOA、およびMAOBを含む。
【0136】
シトクロムP450アイソフォームの阻害は、Ko et al., British Journal of Clinical Pharmacology 2000, 49, 343-351の方法によって測定される。MAOAアイソフォームの阻害は、Weyler et al., J.Biol Chem. 1985, 260, 13199-13207の方法によって測定される。MAOBアイソフォームの阻害は、Uebelhack et al., Pharmacopsychiatry, 1998, 31, 187-192の方法によって測定される。
【0137】
哺乳類の被験体における多形的に発現されたシトクロムP450アイソフォームの例は、限定されないが、CYP2C8、CYP2C9、CYP2C19、およびCYP2D6を含む。
【0138】
肝ミクロソーム、シトクロムP450アイソフォーム、およびモノアミンオキシダーゼアイソフォームの代謝活性は、本明細書に記載される方法によって測定される。
【0139】
診断上の肝胆道機能エンドポイントの例は、限定されないが、アラニンアミノトランスフェラーゼ(「ALT」)、血清グルタミン酸ピルビン酸トランスアミナーゼ(「SGPT」)、アスパラギン酸アミノトランスフェラーゼ(「AST」または「SGOT」)、ALT/AST比、血清アルドラーゼ、アルカリフォスファターゼ(「ALP」)、アンモニアレベル、ビリルビン、ガンマグルタミントランスペプチターゼ(「GGTP」、「γ-GTP」、または「GGT」)、ロイシンアミノペプチダーゼ(「LAP」)、肝生検、肝臓超音波検査、肝臓核スキャン、5'-ヌクレオチダーゼ、および血液タンパク質を含む。肝胆道エンドポイントは、「Diagnostic and Laboratory Test Reference」、4th edition, Mosby, 1999で与えられるような定められた正常レベルと比較される。これらのアッセイは、標準プロトコルに従って公認の研究所によって実行される。
【0140】
ヒトの処置のために有用であることに加えて、本明細書に開示される特定の化合物および製剤は、哺乳動物、齧歯類などを含む、コンパニオンアニマル、エキゾチックアニマルおよび家畜の獣医学的処置にも有用であり得る。より好ましい動物は、馬、犬、および猫を含む。
【0141】
併用療法
本明細書に開示される化合物はまた、ヤヌスキナーゼ3媒介の障害の処置に有用な他の薬剤と組み合わされ得る、または組み合わせて使用され得る。または、ほんの一例として、本明細書に記載される化合物の1つの治療効果は、アジュバントの投与によって高められ得る(すなわち、アジュバント自体は最小の治療的有用性を有し得るだけであるが、別の治療剤と併用することで、患者に対する全体的な治療的有用性が高められる)。
【0142】
そのような他の薬剤、アジュバント、または薬物は、経路によって、およびそのために一般に使用される量で、本明細書に開示されるような化合物と同時にまたは連続して投与され得る。本明細書に開示されるような化合物が1つ以上の他の薬物と同時に使用されるとき、本明細書に開示される化合物に加えてこのような他の薬物を含んでいる医薬組成物は、利用され得るが、必要ではない。
【0143】
特定の実施形態において、本明細書に開示される化合物は、1つ以上のH+,K+ATPアーゼインヒビター、消化管運動性(alimentary motility)モジュレーター、非ステロイド性の抗炎症剤、アニリド鎮痛剤、抗リウマチ剤、グルココルチコイド、および免疫抑制剤と組み合わされ得る。
【0144】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、エソメプラゾール 、ランソプラゾール、オメプラゾール、パントプラゾール 、ラベプラゾール、およびテナトプラゾールを含む、1つ以上のH+,K+ATPアーゼインヒビターと組み合わされ得る。
【0145】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、ソラベグロン、テガセロッド、アロセトロン、シランセトロン、ドンペリドン、メトクロプラミド、イトプリド、シサプリド、レンザプリド、ザコプリド、オクトレオチド、ナロキソン、エリスロマイシン、およびベタネコールを含む、1つ以上の消化管運動性モジュレーターと組み合わされ得る。
【0146】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アセクロフェナク、アセメタシン、アモキシプリン、アスピリン、アザプロパゾン、ベノリラート、ブロムフェナク、カルプロフェン、セレコキシブ、コリンサリチル酸マグネシウム、ジクロフェナク、ジフルニサル、エトドラク、エトリコキシブ(etoracoxib)、ファイスラミン、フェンブフェン(fenbuten)、フェノプロフェン、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、ロルノキシカム、ロキソプロフェン、ルミラコキシブ、メロキシカム、メクロフェナム酸、メフェナム酸、メロキシカム、メタミゾール、サリチル酸メチル、サリチル酸マグネシウム、ナブメトン、ナプロキセン、ニメスリド、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピロキシカム、サリチルサリチル酸塩、スリンダク、スルフィンピラゾン(sulfinprazone)、スプロフェン、テノキシカム、チアプロフェン酸、およびトルメチンを含む、1つ以上の非ステロイド性の抗炎症剤と組み合わされ得る。
【0147】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アセトアミノフェンおよびフェナセチンを含む、1つ以上のアニリド鎮痛剤と組み合わされ得る。
【0148】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アザチオプリン、シクロスポリン A、D-ペニシラミン、金塩、水酸化クロロキン、レフルノミド、メトトレキサート、ミノサイクリン、スルファサラジン、シクロホスファミド、エタネルセプト、インフリキシマブ、アダリムマブ、アナキンラ、リツキシマブ、およびアバタセプトを含む、1つ以上の寛解導入抗リウマチ剤と組み合わされ得る。
【0149】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、ベクロメタゾン、ブデソニド、フルニソリド、ベータメタゾン、フルチカゾン、トリアムシノロン、モメタゾン、シクレソニド、ヒドロコルチゾン、酢酸コルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニソロン、およびデキサメタゾンを含む、1つ以上のグルココルチコイドと組み合わされ得る。
【0150】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、フィンゴリモド、シクロスポリン A、アザチオプリン、デキサメタゾン、タクロリムス、シロリムス、ピメクロリムス、ミコフェノール酸塩、エベロリムス、バシリキシマブ、ダクリズマブ、抗胸腺細胞グロブリン、抗リンパ球グロブリン、およびCTLA4IgGを含む、1つ以上の免疫抑制剤と組み合わされ得る。
【0151】
本明細書に開示される化合物はまた、限定されないが、アトモキセチンなどのノルエピネフリン再取込みインヒビター(NRI)、メチルフェニデートなどのドーパミン再取込みインヒビター(DARI)、ミルナシプランなどのセロトニンノルエピネフリン再取込みインヒビター(SNRI)、ジアゼパム(diazepham)などの鎮静剤、ブプロピオンなどのノルエピネフリンドーパミン再取込みインヒビター(NDRI)、ベンラファキシンなどの、セロトニンノルエピネフリンドーパミン再取込みインヒビター(SNDRI)、セレギリンなどのモノアミンオキシダーゼインヒビター、視床下部のリン脂質、フォスフォラミドンなどのエンドセリン変換酵素(ECE)インヒビター、トラマドールなどのオピオイド、イフェトロバンなどのトロンボキサン受容体アンタゴニスト、カリウムチャネル開口薬、ヒルジンなどのトロンビンインヒビター、視床下部のリン脂質、PDGF活性モジュレーターなどの成長因子インヒビター、血小板活性化因子(PAF)アンタゴニスト、GPIIb/IIIa遮断薬(例えば、アブシキシマブ(abdximab)、エプチフィバチドおよびチロフィバン)、P2Y(AC)アンタゴニスト(例えば、クロピドグレル、チクロピジンおよびCS-747)、およびアスピリンなどの抗血小板剤、ワルファリンなどの抗凝血剤、エノキサパリンなどの低分子ヘパリン、Factor VIIa InhibitorsおよびFactor Xa Inhibitors、レニンインヒビター、中性エンドペプチダーゼ(NEP)インヒビター、オマパトリラトおよびゲモパトリアトなどのバソペプチダーゼ(vasopepsidase)インヒビター(2重NEP-ACEインヒビター)、プラバスタチン、ロバスタチン、アトルバスタチン、シンバスタチン、NK-104(別名、イタバスタチン、ニスバスタチン(nisvastatin)、またはニスバスタチン(nisbastatin))、および(ロスバスタチン、またはアトルバスタチン(atavastatin)またはビサスタチンとしても知られる)ZD-4522などのHMG CoAリダクターゼインヒビター、スクアレン合成酵素インヒビター、フィブラート、クエストランなどの胆汁酸捕捉剤(bile acid sequestrants)、ナイアシン、ACATインヒビターなどの抗アテローム性動脈硬化剤、MTPインヒビター、ベシル酸アムロジピンなどのカルシウム拮抗薬、カリウムチャンネル活性化因子、アルファムスカリン性薬物、カルベジロールおよびメトプロロールなどのベータムスカリン性薬物、抗不整脈薬、クロロサイアザイド、ヒドロクロロチアジド(hydrochiorothiazide)、フルメサイアザイド、ヒドロフルメチアジド、ベンドロフルメサイアザイド、メチルクロロチアジド、トリクロロメチアジド(trichioromethiazide)、ポリチアジド、ベンゾチアジド(benzothlazide)、エタクリン酸、チクリナフェン(tricrynafen)、クロルサリドン、フロセミド(furosenilde)、ムゾリミン(musolimine)、ブメタニド、トリアムテレン、アミロライド、およびスピロノラクトンなどの利尿剤、組織プラスミノーゲン活性化因子(tPA)、組み換え型tPA、ストレプトキナーゼ、ウロキナーゼ、プロウロキナーゼ、およびアニソイル化プラスミノゲンストレプトキナーゼ活性化因子複合体(APSAC)などの血栓溶解剤、ビグアニド(例えばメトホルミン)、グルコシダーゼインヒビター(例えば、アカルボース)、インシュリン、メグリチニド(例えば、レパグリニド)、スルホニル尿素誘導体(例えば、グリメピリド、グリブライド、およびグリピジド)、チアゾリジンジオン(thiozolidinediones)(例えばトログリタゾン、ロシグリタゾンおよびピオグリタゾン)、およびPPARガンマアゴニストなどの抗糖尿病薬、スピロノラクトンおよびエプレレノンなどの無機質コルチコイド受容体アンタゴニスト、成長ホルモン分泌促進因子、aP2インヒビター、PDE IIIインヒビター(例えば、シロスタゾール)およびPDE Vインヒビター(例えば、シルデナフィル、タダラフィル、バルデナフィル)などのホスホジエステラーゼインヒビター、タンパク質チロシンキナーゼインヒビター、抗炎症薬、メトトレキサート、FK506(タクロリムス、プログラフ)、ミコフェノール酸モフェチルなどの細胞増殖阻害剤、化学療法剤、抗癌剤および細胞毒性薬剤(例えば、ナイトロジェンマスタード、スルホン酸アルキル、ニトロソウレア、エチレンイミン、およびトリアゼンなどのアルキル化剤)、葉酸アンタゴニスト、プリンアナログ、およびピリジンアナログなどの代謝拮抗剤、アントラサイクリン、ブレオマイシン、マイトマイシン、ダクチノマイシン、およびプリカマイシンなどの抗生物質、L-アスパラギナーゼなどの酵素、ファルネシルタンパク質トランスフェラーゼインヒビター、エストロゲン/抗エストロゲン、アントロゲン/抗アンドロゲン、プロゲスチン、および黄体形成ホルモン放出ホルモンアンタゴニスト、および酢酸オクトレオチドなどのホルモン剤、エクテイナシジンなどの微小管破壊剤(microtubule-disruptor agents)、パシタキセル、ドセタキセル、およびエポチロン A-Fなどの微小管安定剤、ビンカアルカロイド、エピポドフィロトキシン、およびタキサンなどの植物由来産物、トポイソメラーゼインヒビター、プレニルタンパク質トランスフェラーゼインヒビター、シクロスポリン、プレドニゾンおよびデキサメタゾンなどのステロイド、アザチオプリン(azathiprine)およびシクロホスファミドなどの細胞毒、テニダップなどのTNFアルファインヒビター、エタネルセプト、ラパマイシン、およびレフルノミド(leflunimide)などの抗TNF抗体または可溶性のTNF受容体、およびセレコキシブおよびロフェコキシブなどのシクロオキシゲナーゼ-2(COX-2)インヒビター、およびヒドロキシ尿素、プロカルバジン、ミトタン、ヘキサメチルメラミン、金化合物、シスプラチン、サトラプラチン、およびカルボプラチンなどのプラチナ配位化合物などの種々の薬剤を含む、他の種類の化合物と組み合わせて投与され得る。
【0152】
したがって、別の態様において、特定の実施形態は、処置を必要とするヒトまたは動物の被験体においてヤヌスキナーゼ3媒介の障害を処置するための方法を提供し、当該処置は、当該技術分野に公知の前記障害の処置のための少なくとも1つの追加の薬剤と組み合わせて、被験体において前記障害を低減または予防するために、有効な本明細書に開示される化合物の量を前記被験体に投与する工程を含む。関連する態様において、特定の実施形態は、ヤヌスキナーゼ3媒介の障害の処置のために少なくとも1以上の追加の薬剤と組み合わせた、本明細書に開示される少なくとも1つの化合物を含む、治療上の組成物を提供する。
【0153】
化合物を調製するための一般的な合成方法
同位体水素は、重水素化の試薬を使用する合成技術によって、本明細書に開示されるような化合物へ導入され得、それによって、取り込み速度は予め決定され、及び/又は交換技術によって、取り込み速度は平衡状態によって決定され、反応条件に依存して非常に変化しやすくなり得る。トリチウムまたは重水素が、公知の同位体含有量のトリチウム化または重水素化の試薬によって直接および特に導入される場合の合成技術は、高いトリチウムまたは重水素存在比をもたらし得るが、必要とされる化学によって制限され得る。一方で、交換技術は、しばしば分子上の多くの部位に分散されている同位体による、より少ないトリチウムまたは重水素の取り込みをもたらし得る。
【0154】
本明細書に開示されるような化合物は、当業者に公知の方法およびその日常的な変更、及び/又は本明細書の実施例のセクションに記載される手順と同様の次の手順およびその日常的な変更、及び/又はそれらの全体において本明細書に組み込まれる、Jiang et al., J. Med. Chem. 2008, 51, 8012-8018;米国特許第6,627,754号;WO 2003/048162;WO 2007/012953に見られる手順、およびそれらに言及される引用およびそれらの日常的な変更によって調製され得る。本明細書に開示されるような化合物はまた、任意の次の模式図およびその日常的な変更において示されるように調製され得る。
【0155】
次の模式図は、本発明を実行するために使用され得る。
水素として示される任意の位置は、重水素と随意に置換され得る。
【0156】
【化17】

【0157】
化合物1は、トルエンなどの適切な溶媒中で、塩化ベンジルと反応され、化合物2を与える。化合物2は、エタノールなどの適切な溶媒中で、水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物3を与える。化合物3は、エタノールなどの適切な溶媒中で、ビス(1,5-シクロオクタジエン)ロジウム(I)トリフルオロメタンスルフォナートと(R)-(-)-1-[(S)-2-(ジフェニルホスフィノ)フェロセニル]エチル-ジ-t-ブチルホスフィンの組み合わせなどの、適切なキラルのロジウム触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物4を与える。化合物4は、増加したエナンチオマーの純度を与えるためにL-ジ-p-トルオイル酒石酸などの適切なキラル酸とともに随意に結晶化され得る。化合物4は、水などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物5と反応され、化合物6を与える。化合物6は、水などの適切な溶媒中で、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、ジクロロメタンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物8と反応され、式Iの化合物9を与える。
【0158】
重水素は、適切な重水素化の中間物質を使用することによって、模式図Iに示されるような合成手順に従って、人工的に異なる位置に組み込まれ得る。例えば、R3、R5、R9およびR11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物1が使用され得る。R4、R6、およびR10で重水素を導入するために、重水素化ホウ素ナトリウムおよびd5エタノールが使用され得る。R7-R8およびR14-R16の1つ以上の位置で重水素を導入するために、重水素ガスが使用され得る。R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R1-R2の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物8が使用され得る。
【0159】
重水素は、プロトン-重水素平衡交換を介して、ヘテロ環式 N-Hなどの交換性プロトンを有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0160】
【化18】

【0161】
化合物10は、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、化合物11と反応され、化合物12を与える。化合物12は、L-ジ-p-トルオイル酒石酸などの適切なキラル酸とともに結晶化され、化合物4を与える。化合物4は、水などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物5と反応され、化合物6を与える。化合物6は、水などの適切な溶媒中で、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、ジクロロメタンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物8と反応され、式Iの化合物9を与える。
【0162】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R7およびR9-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物10が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R1-R2の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物8が使用され得る。
【0163】
重水素は、プロトン-重水素平衡交換(proton-deuterium equilibrium exchange)を介して、ヘテロ環式 N-Hなどの交換性プロトン(an exchangeable proton)を有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0164】
【化19】

【0165】
化合物13は、テトラヒドロフランなどの適切な溶媒中で、ナトリウムヘキサメチルジシラジドなどの適切な塩基の存在下において、炭酸ジメチルなどの適切なアミン保護試薬と反応され、化合物1を与える。化合物1は、高温度で、トルエンなどの適切な溶媒中で、臭化ベンジルと反応され、化合物14を与える。化合物14は、エタノールなどの適切な溶媒中で、水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物3を与える。化合物3は、メタノールなどの適切な溶媒中で、酸化白金などの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物15を与える。化合物15は、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムなどの適切な還元剤と反応され、化合物12を与える。
【0166】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3、R6、R9、およびR11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物13が使用され得る。R4-R5およびR10で重水素を導入するために、重水素化ホウ素ナトリウムが使用され得る。R7-R8の1つ以上の位置で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。
【0167】
【化20】

【0168】
化合物16は、高温度で、トルエンなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下において、ベンジルアルコールと反応され、化合物17を与える。化合物17は、高温度で、トルエンなどの適切な溶媒中で、カリウム tert-ブトキシドなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物19を与える。化合物19は、メタノールなどの適切な溶媒中で、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物10を与える。化合物10は、ナトリウムメトキシドなどの適切な塩基の存在下において、化合物11と反応され、イミン中間物質を与え、その後、テトラヒドロフランなどの適切な溶媒中で、酢酸などの適切な酸の存在下において、トリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物12を与える。
【0169】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IVに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R6およびR9-R10の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物16が使用され得る。R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。R7で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。R14-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物11が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。
【0170】
【化21】

【0171】
化合物20は、アセトンと水の適切な混合物などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基の存在下において、塩化トルエンスルホニルと反応され、化合物21を与える。化合物21は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物4と反応され、化合物22を与える。化合物22は、水などの適切な溶媒中で、酸化マグネシウムなどの適切な塩基の存在下、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物23を与える。
【0172】
重水素は、適切な重水素化の中間物質を使用することにより、模式図Vに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えばR17-R18の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物20が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物4が使用され得る。R20で重水素を導入するために、重水素ガス及び/又は酸化重水素が使用され得る。
【0173】
【化22】

【0174】
化合物24は、約120℃で、約16時間、d4-メタノールおよびd3-ナトリウムメトキシドと反応され、化合物25を与える。化合物24は、約160℃で、約16時間、d4-メタノールおよびd3-ナトリウムメトキシドと反応され、化合物26を与える。
【0175】
【化23】

【0176】
化合物5は、アセトンと水の適切な混合物などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基の存在下において、塩化トルエンスルホニルと反応され、化合物27を与える。化合物27は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物12と反応され、化合物23を与える。
化合物23は、水などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物28を与える。化合物28は、ヘキサン(0.1%のトリエチルアミンを含む)/イソプロパノールなどの適切な溶離剤を使用して、Chiralpak IAなどの適切なカラムで、キラルクロマトグラフィーを使用して分離され、化合物6を与える。化合物6は、イソプロパノールと水の組み合わせなどの適切な溶媒中で、酢酸などの適切な酸の存在下、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、トルエンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物29と反応され、化合物9を与える。
【0177】
重水素は、適切な重水素化の中間物質を使用することにより、模式図VIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物12が使用され得る。R1-R2で重水素を導入するために、対応する重水素置換を有する化合物29が使用され得る。
【0178】
重水素は、プロトン-重水素平衡交換を介して、ヘテロ環式 N-Hなどの交換性プロトンを有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0179】
【化24】

【0180】
化合物21は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物12と反応され、化合物30を与える。化合物30は、メタノールと水の組み合わせなどの適切な溶媒中で、ジ-tert-ブチル重炭酸塩などの適切な保護剤の存在下、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物31を与える。化合物31は、水などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物32を与える。化合物32は、ヘキサン(0.1%のトリエチルアミンを含む)/イソプロパノールなどの適切な溶離剤を使用して、Chiralpak IAなどの適切なカラムで、キラルクロマトグラフィーを使用して分離され、化合物33を与える。化合物33は、1,4-ジオキサンなどの適切な溶媒中で、塩化水素などの適切な酸と反応され、化合物7を与える。
【0181】
重水素は、適切な重水素化の中間物質を使用することにより、模式図VIIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R17-R18の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物21が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物12が使用され得る。R20で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。
【0182】
【化25】

【0183】
化合物16は、メタノールなどの適切な溶媒中で、酢酸などの適切な酸の存在下において、水素ガスなどの適切な還元剤、および炭素上のパラジウムなどの適切な触媒と反応され、化合物34を与える。化合物34は、テトラヒドロフランなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、ジ-tert-ブチル重炭酸塩などの適切な保護剤と反応され、化合物35を与える。化合物35は、高温度で、テトラヒドロフランなどの適切な溶媒中で、水素化ナトリウムなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物36を与える。化合物36は、水などの適切な溶媒中で、塩化水素酸などの適切な酸と反応され、化合物37を与える。化合物37は、トリエチルアミンなどの適切な塩基の存在下において、臭化ベンジルなどの適切な保護剤と反応され、化合物10を与える。
【0184】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IXに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R6およびR9-R10の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物16が使用され得る。R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。R7で重水素を導入するために、塩化重水素及び/又は酸化重水素が使用され得る。
【0185】
【化26】

【0186】
化合物38は、ジイソプロピルエチルアミンなどの適切な塩基の存在下において、化合物39と反応され、化合物40を与える。化合物40は、水とテトラヒドロフランの組み合わせなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物41と反応され、化合物42を与える。化合物42は、エタノールと1,4-ジオキサンの組み合わせなどの適切な溶媒中で、ナトリウムエトキシドなどの適切な塩基と反応され、化合物43を与える。化合物43は、高温度で、ベンジルアルコールと反応され、化合物44を与える。化合物44は、高温度で、アセトンなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物45を与える。化合物45は、酢酸エチルなどの適切な溶媒中で、水素などの適切な還元剤、および炭素上のパラジウムなどの適切な触媒と反応され、化合物46を与える。化合物46は、メタノールなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下において、オルソギ酸メチルエステルなどの適切な脱水剤の薬剤と反応され、化合物47を与える。化合物47は、水とメタノールの組み合わせなどの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物48を与える。化合物48は、水などの適切な溶媒中で、塩化水素酸などの適切な酸と反応され、化合物49を与える。化合物49は、テトラヒドロフランなどの適切な溶媒中で、酢酸などの適切な酸、およびトリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、化合物11と反応され、化合物50を与える。化合物50は、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムなどの適切な還元剤と反応され、化合物12を与える。
【0187】
重水素は、適切な重水素化の中間物質を使用することにより、模式図Xに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。
R5-R7で重水素を導入するために、d1-水酸化ナトリウム、酸化重水素、及び/又はd4-メタノールが使用され得る。R9-R10で重水素を導入するために、塩化重水素及び/又は酸化重水素が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。R3-R4で重水素を導入するために、重水素化リチウムアルミニウムが使用され得る。R14-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。
【0188】
本発明は、以下の実施例によってさらに示される。すべてのIUPAC名は、CambridgeSoft's ChemDraw 10.0を使用して作り出された。
【0189】
<実施例1>
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550クエン酸塩)
【0190】
【化27】

【0191】
<工程1>
【0192】
【化28】

【0193】
4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン:約0℃で、水酸化ナトリウム(水中2mol/L、8mL、1.20等量)を、アセトン(20mL)中の4-メチルベンゼン-1-塩化スルホニル(2.7g、13.9mmol、1.10等量)および4-クロロ-7H-ピロロ[2,3-d]ピリミジン(2g、12.8mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約6時間、約20℃で撹拌した。固体をろ過によって集め、アセトン/水で洗浄し、白色固体として表題生成物を得た(4.0g;収量=97%)。1H NMR (300 MHz, CDCl3) δ: 8.78 (s, 1H), 8.11 (d, J = 8.4 Hz, 2H), 7.80 (d, J = 4.2 Hz, 1H), 7.34 (d, J = 8.4 Hz, 2H), 7.73 (d, J = 4.2 Hz, 1H), 2.42 (s, 3H)。LC-MS: m/z = 308/310 (M+H)+。
【0194】
<工程2>
【0195】
【化29】

【0196】
メチル4-メチルピリジン-3-イルカルバマート:約0℃で、カリウム tert-ブトキシド(47g、420mmol、3.00等量)をいくつかのバッチで、テトラヒドロフラン(400mL)中の4-メチルピリジン-3-アミン(15g、139mmol、1.00等量)の溶液に加えた。約30分間溶液を撹拌した後、その後、炭酸ジメチル(18.8g、209mmol、1.50等量)を加えた。溶液を約16時間、周囲温度で撹拌し、その後、水(100mL)を加えた。酢酸エチル(3×200mL)での標準の抽出後処理(extractive workup)の後で、粗製生成物を酢酸エチル/石油エーテル(1:1)からの再結晶化によって精製し、淡黄色固体として表題生成物を得た(17g;収量=74%)。LC-MS: m/z = 167(M+H)+。
【0197】
<工程3>
【0198】
【化30】

【0199】
1-ベンジル-3-メトキシカルボニルアミノ-4-メチル-臭化ピリジニウム(pyridinum bromide):1-(ブロモメチル)ベンゼン(19g、111mmol、1.10等量)を、トルエン(500mL)中のメチル4-メチルピリジン-3-イルカルバマート(17g、102mmol、1.00等量)の溶液に加えた。溶液を約16時間、約110℃で撹拌した。周囲温度にまで冷却した後、固体をろ過によって集め、トルエンで洗浄し、淡褐色固体として表題生成物を得た(35g;収量=97%)。
【0200】
<工程4>
【0201】
【化31】

【0202】
メチル1-ベンジル-4-メチル-1,2,5,6-テトラヒドロピリジン-3-イルカルバマート:水素化ホウ素ナトリウム(4.4g、116mmol、1.20等量)をいくつかのバッチで、メタノール(300mL)中の1-ベンジル-3-メトキシカルボニルアミノ-4-メチル-臭化ピリジニウム(35g、104mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、周囲温度で撹拌し、その後水(200mL)を加えた。真空内で混合物を濃縮した後に、エーテル(3×200mL)での標準の抽出後処理により粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(20:1))によって精製し、黄色固体として表題生成物を得た(18g;収量=66%)。LC-MS: m/z = 261 (M+H)+。
【0203】
<工程5>
【0204】
【化32】

【0205】
メチル1-ベンジル-4-メチルピペリジン-3-イル-カルバマート:酸化白金(1.0g、4.41mmol、0.11等量)を、メタノール(200mL)中のメチル1-ベンジル-4-メチル-1,2,5,6-テトラヒドロピリジン-3-イルカルバマート(10g、38.46mmol、1.00等量)の溶液に加えた。水素ガスを導入した後に、混合物を約16時間、約60℃で撹拌し、その後ろ過した。結果として生じる濾液を濃縮して粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(酢酸エチル/石油(1:2))によって精製し、黄色固体(7g;収量=66%)として表題生成物を得た。LC-MS: m/z = 263 (M+H)+。
【0206】
<工程6>
【0207】
【化33】

【0208】
(1-ベンジル-4-メチル-ピペリジン-3-イル)-メチル-アミン:約0℃で、水素化アルミニウムリチウム(3.6g、92.8mmol、5.00等量)をいくつかのバッチで、テトラヒドロフラン(100mL)中のメチル1-ベンジル-4-メチルピペリジン-3-イル-カルバマート(5.0g、18.1mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、還流にて加熱し、その後水(10mL)を加えた。混合物をろ過し、結果として生じる濾液を真空内で濃縮し、粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(20;1))によって精製して、黄色の油として表題生成物を得た(3.0g;収量=72%)。1H NMR (300 MHz, CDCl3) δ: 7.20-7.38 (m, 5H), 3.58 (d, J = 13.2 Hz, 1H), 3.48 (d, J = 13.2 Hz, 1H), 2.60-2.82 (m, 2H), 2.46 (br s, 1H), 2.34 (s, 3H), 2.02-2.22 (m, 2H), 2.64-2.84 (m, 2H), 1.45-1.58 (m, 2H), 0.97 (d, J = 6.9 Hz, 3H)。LC-MS: m/z = 219 (M+H)+。
【0209】
<工程7>
【0210】
【化34】

【0211】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン(2g、6.37mmol、2.00等量)および炭酸カリウム(2.7g、19.4mmol、6.00等量)を、水(30mL)中の(1-ベンジル-4-メチル-ピペリジン-3-イル)-メチル-アミン(700mg、2.89mmol、1.00等量)の溶液に加えた。溶液を約16時間、約100℃で撹拌し、その後周囲温度にまで冷却した。酢酸エチル(3×100mL)での標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/鉱油(1:1))によって精製し、淡黄色固体として表題生成物を得た(1.5g;収量=96%)。1H NMR (300 MHz, CDCl3) δ: 8.36 (s, 1H), 8.08 (d, J = 8.4 Hz, 2H), 7.45 (d, J = 4.2 Hz, 1H), 7.20-7.42 (m, 7H), 6.75 (d, J = 4.2 Hz, 1H), 5.05-5.20 (m, 1H), 3.40-3.65 (m, 5H), 2.70-2.92 (m, 2H), 2.50-2.70 (m, 1H), 2.42 (s, 3H), 2.23-2.42 (m, 1H), 2.10-2.23 (m, 1H), 1.55-1.75 (m, 2H), 0.92 (d, J = 6.9 Hz, 3H)。LC-MS: m/z = 490 (M+H)+。
【0212】
<工程8>
【0213】
【化35】

【0214】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:50%の水酸化ナトリウム(10mL)とN-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(400mg、0.80mmol、1.00等量)の混合物を約16時間、約60℃で撹拌し、その後周囲温度にまで冷却した。酢酸エチル(4×10mL)での標準の抽出後処理の後に、粗製の残留物をその後シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(10:1))によって精製し、黄色固体として表題生成物を得た(0.25g;収量=88%)。1H NMR (300 MHz, CDCl3) δ: 11.35 (br s, 1H), 8.30 (s, 1H), 7.20-7.40 (m, 5H), 7.06 (d, J = 3.6 Hz, 1H), 6.60 (d, J = 3.6 Hz, 1H), 5.20-5.30 (m, 1H), 3.66 (s, 3H), 3.48-3.65 (m, 2H), 2.85-2.98 (m, 1H), 2.60-2.85 (m, 2H), 2.30-2.45 (m, 1H), 2.12-2.30 (m, 1H), 1.60-1.92 (m, 2H), 0.98 (d, J = 6.0 Hz, 3H)。LC-MS: m/z = 336 (M+H)+。
【0215】
<工程9>
【0216】
【化36】

【0217】
N-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:エナンチオマーN-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(4.5g)を、以下の条件でのキラル-Prep-HPLCを使用したキラル分離により分離した:カラム:キラルパックIA、0.46×25cm;移動相:ヘキサン(0.1%のトリエチルアミン中):イソプロパノール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:11.72分、所望されないエナンチオマーの保持時間:7.88分。ee%>99.8%。表題生成物を黄色固体として分離した(1.8g;収量=40%)。1H NMR (300 MHz, CDCl3) δ: 11.35 (br s, 1H), 8.30 (s, 1H), 7.20-7.40 (m, 5H), 7.06 (d, J = 3.6 Hz, 1H), 6.60 (d, J = 3.6 Hz, 1H), 5.20-5.30 (m, 1H), 3.66 (s, 3H), 3.48-3.65 (m, 2H), 2.85-2.98 (m, 1H), 2.60-2.85 (m, 2H), 2.30-2.45 (m, 1H), 2.12-2.30 (m, 1H), 1.60-1.92 (m, 2H), 0.98 (d, J = 6.0 Hz, 3H)。LC-MS: m/z = 336 (M+H)+。
【0218】
<工程10>
【0219】
【化37】

【0220】
N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミン:炭素上の水酸化パラジウム(50mg)および酢酸(44mg、0.72mmol、1.00等量)を、イソプロパノール/水(10mL/2mL)中のN-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(250mg、0.67mmol、1.00等量)の溶液に加えた。水素ガスを導入した後に、結果として生じる混合物を約16時間、約50℃で撹拌した。混合物をろ過した後に、濾液のpH値を、水酸化ナトリウムを加えることにより8に調節した。ジクロロメタン(3×20mL)での標準の抽出後処理により、灰白色固体として表題生成物を得た(140mg;収量=81%)。1H NMR (300 MHz, CDCl3) δ: 10.60 (br s, 1H), 8.35 (s, 1H), 7.07 (d, J = 3.6 Hz, 1H), 6.60
(d, J = 3.6 Hz, 1H), 4.88-4.98 (m, 1H), 3.45 (s, 3H), 3.25-3.37 (m, 1H), 2.80-3.10 (m, 3H), 2.45-2.58 (m, 1H), 1.82-2.00 (m, 1H), 1.60-1.80 (m, 2H), 1.11 (d, J = 7.2 Hz, 3H)。LC-MS: m/z = 246 (M+H)+。
【0221】
<工程11>
【0222】
【化38】

【0223】
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550):エチル2-シアノ酢酸(140mg、1.23mmol、6.00等量)およびトリエチルアミン(40mg、0.39mmol、2.00等量)を、トルエン(10mL)中のN-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミン12(50mg、0.19mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、約110℃で撹拌し、その後真空内で濃縮した。結果として生じる残留物を、シリカゲルカラムクロマトグラフィー(酢酸エチル/メタノール(50:1))によって精製し、淡黄色固体として表題生成物を得た(33mg;収量=52%)。1H NMR (300 MHz, CD3OD) δ: 8.10 (s, 1H), 7.10 (d, J = 4.0 Hz, 1H), 6.65 (d, J = 4.0 Hz, 1H), 5.00-5.10 (m, 1H), 3.80- 4.00 (m, 2H), 3.55-3.75 (m, 1H), 3.40-3.55 (m, 1H), 3.30-3.40 (m, 5H), 2.40-2.55 (m, 1H), 1.82-2.00 (m, 1H), 1.60-1.80 (m, 1H), 1.05-1.20 (m, 3H)。LC-MS: m/z = 313 (M+H)+。
【0224】
<工程12>
【0225】
【化39】

【0226】
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550クエン酸塩):クエン酸(20mg、0.10mmol、1.00等量)を、水/メタノール(5/0.5mL)中の3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(33mg、0.10mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約10分、約40℃で撹拌し、その後周囲温度にまで冷却した。溶剤をその後、クライオフリーズドライヤー(cryofreeze-dryer)を使用することにより取り除き、灰白色固体として表題化合物を得た(40mg;収量=76%)。1H NMR (300 MHz, CD3OD) δ: 8.15 (s, 1H), 7.15 (d, J = 3.6 Hz, 1H), 6.70 (d, J = 3.6 Hz, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.58-3.80 (m, 1H), 3.40-3.60 (m, 4H), 2.92 (Abq, J = 15.6 Hz, 2H), 2.80 (Abq, J = 15.6 Hz, 2H), 2.40-2.60 (m, 1H), 1.85-2.05 (m, 1H), 1.68-1.85 (m, 1H), 1.05-1.20 (m, 3H)。LC- MS: m/z = 313 (MH-C6H8O7)+。
【0227】
<実施例2>
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d4クエン酸塩)
【0228】
【化40】

【0229】
<工程1>
【0230】
【化41】

【0231】
4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン:4-メチルベンゼン-1-塩化スルホニル(3.7g、19.32mmol、1.20等量)を、アセトン(20mL)中の2,4-ジクロロ-7H-ピロロ[2,3-d]ピリミジン1(3g、16.1mmol、1.00等量)の溶液に加えた。約0℃で、水性の水酸化ナトリウム溶液(2mol/L、12mL)を溶液に滴下で加えた。その後、溶液を約3時間、周囲温度で撹拌した。固体をろ過によって集め、アセトン/水で洗浄し、白色固体として表題生成物を得た(5.2g;収量=95%)。LC-MS: m/z = 342 (M+H)+。
【0232】
<工程2>
【0233】
【化42】

【0234】
(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミン:実施例1、工程6の手順に従ったが、水素化アルミニウムリチウムに対して重水素化リチウムアルミニウムを置換した。表題生成物を黄色の油として分離した(3.0g;収量=72%)。LC-MS: m/z = 222 (M+H)+。
【0235】
<工程3>
【0236】
【化43】

【0237】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:テトラヒドロフラン/水(1:1)(60mL)中の(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミン(700mg、2.89mmol、1.00等量)、2,4-ジクロロ-7H-ピロロ[2,3-d]ピリミジン(2g、5.78mmol、2.00等量)および炭酸カリウム(2.7g、19.4mmol、6.00等量)の混合物を、約16時間、約60℃で加熱し、その後溶剤を真空内で取り除いた。酢酸エチル(3×200mL)での標準の抽出後処理の後に、粗製の残留物をカラムクロマトグラフイーによって精製し、淡黄色固体として表題生成物を得た(1.5g;収量=96%)。LC-MS: m/z = 527 (M+H)+。
【0238】
<工程4>
【0239】
【化44】

【0240】
tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート:重水素ガスの雰囲気下で、d4-メタノール/酸化重水素(1:3)(30mL)中のN-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(400mg、0.80mmol、1.00等量)、ジ-tert-ブチル重炭酸塩(348mg、1.6mmol)および炭素上の水酸化パラジウム(1.00等量;3サイクル間の酸化重水素により予め処理した)を、約16時間、約70℃で加熱した。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、固体として表題生成物を得た(300mg;収量=78.5%)。LC-MS: m/z = 504 (M+H)+。
【0241】
<工程5>
【0242】
【化45】

【0243】
4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン-1-カルボン酸 tert-ブチルエステル:30%のd1-水酸化ナトリウム(60mL)中のtert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート(300mg)の溶液を、約2時間、約100℃で加熱した。酢酸エチル(3×200mL)での標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、泡沫状固体として表題生成物を得た(190mg;収量=90%)。LC-MS: m/z = 350 (M+H)+。
【0244】
<工程6>
【0245】
【化46】

【0246】
3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステル:エナンチオマー3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルを、以下の条件を伴うキラル-Prep-HPLCを使用するキラル分離により、4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン-1-カルボン酸 tert-ブチルエステル(4.5g)から分離した:カラム:キラルパックIA、0.46×15cm;移動相:(ヘキサン:イソプロピルアルコール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:7.19分、所望されないエナンチオマーの保持時間:9.11分。ee%>99.8%。表題生成物を黄色固体として分離した(1.5g;収量=35%)。LC- MS: m/z = 527 (M+H)+。
【0247】
<工程7>
【0248】
【化47】

【0249】
N-d3-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩(amine deuterochloride):5Nの塩化重水素/ジオキサン(0.5mL/3 mL)中の3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルの溶液(190mg)を、約16時間、25℃で撹拌した。溶液を真空内で濃縮し、結果として生じる残留物を任意の更なる精製無しで、次の工程で使用した。LC-MS: m/z = 250 (M+H)+。
【0250】
<工程8>
【0251】
【化48】

【0252】
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(33mg;収量=52%)。LC-MS: m/z = 317 (M+H)+。
【0253】
<工程9>
【0254】
【化49】

【0255】
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d4クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を白色固体として分離した(40mg;収量=76%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.9 Hz, 2H), 2.81 (Abq, J = 15.6 Hz, 2H), 2.48-2.61 (m, 1H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H), 1.14 (d, J = 6.6 Hz, 3H)。LC-MS: m/z = 317 (MH-C6H8O7)+。
【0256】
<実施例3>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d7クエン酸塩)
【0257】
【化50】

【0258】
<工程1>
【0259】
【化51】

【0260】
エチル3-オキソピペリジン-4-カルボキシラート酢酸塩:水素の雰囲気下で、エチル1-ベンジル-3-オキソピペリジン-4-カルボキシラート(20g、16.1mmol、1.00等量)、炭素上の10%のパラジウム、酢酸(10mL)およびメタノール(100mL)の混合物を、約4時間、約50℃で加熱した。混合物をろ過し、濾液を蒸発させ、酢酸塩として表題生成物を得た(16g:収量=85%)。LC-MS: m/z = 172 (M+H)+。
【0261】
<工程2>
【0262】
【化52】

【0263】
メチル4-メチルピリジン-3-イルカルバマート:ジ-tert-ブチル重炭酸塩(5.66g、26mmol)、炭酸カリウム(12g、86.4mmol)および水(100mL)の溶液を、テトラヒドロフラン(400mL)中のエチル3-オキソピペリジン-4-カルボキシラート酢酸塩(15g、21.6mmol)の溶液に加えた。結果として生じる混合物を約2時間、周囲温度で撹拌した。真空内で溶剤を取り除いた後に、酢酸エチル(3×200mL)での標準の抽出後処理により、淡白色固体(14g;収量=80%)として表題生成物を得た。LC-MS: m/z = 172/272 (M+H)+。
【0264】
<工程3>
【0265】
【化53】

【0266】
1-tert-ブチル-4-エチル4-d3-メチル-3-オキソピペリジン-1,4-ジカルボキシラート:70%の水素化ナトリウム(3.54g、103mmol)を、テトラヒドロフラン(300mL)中の1-tert-ブチル4-エチル3-オキソピペリジン-1,4-ジカルボン酸(14g、51.6mmol、1.00等量)の溶液にいくつかの部分で(in several portions)加えた。結果として生じる混合物を約2時間、約50℃で加熱し、その後周囲温度にまで冷却した。ヨードメタン(15g、103mmol)を加えた後に、結果として生じる懸濁液を約3時間、周囲温度で撹拌し、その後氷中へ注いだ。酢酸エチル(3×100mL)での標準の抽出後処理により粗製の残留物を得て、それをその後、カラムクロマトグラフイーによって精製し、固体として表題生成物を得た(7.4g;収量=50%)。LC-MS: m/z = 289 (M+H)+。
【0267】
<工程4>
【0268】
【化54】

【0269】
4-d3-メチルピペリジン-3-オン塩酸塩:37%の塩化水素(30mL)を、1-tert-ブチル4-エチル4-d3-メチル-3-オキソピペリジン-1,4-ジカルボン酸(7g、25.6mmol)に加えた。結果として生じる混合物を約3時間、還流にて加熱し、その後溶剤を真空内での蒸発によって取り除いた。結果として生じる残留物を、更なる精製無しで次の工程に使用した。LC-MS: m/z = 117/125 (M+H)+。
【0270】
<工程5>
【0271】
【化55】

【0272】
1-ベンジル-4-d3-メチルピペリジン-3-オン:(ブロモメチル)ベンゼン(2.23g、10.5mmol)を、テトラヒドロフラン(30mL)中の4-d3-メチルピペリジン-3-オン塩酸塩(1.2g、10.3mmol、1.00等量)およびトリエチルアミン(2.1g、20.6mmol)の溶液に滴下で加えた。結果として生じる混合物を約16時間、周囲温度で撹拌し、その後溶剤を真空内で蒸発させた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、固体として表題生成物を得た(1.7g;収量=80%)。1H NMR (300 MHz, CD3OD) δ: 7.21-7.39 (m, 5H), 3.5 (s,2H), 3.23 (d, J= 13.8Hz, 1H), 2.94 (d, J = 9.6 Hz, 1H), 2.79 (d, J = 13.8 Hz, 1H), 2.45 (t, J = 11.4Hz, 1H), 2.29-2.39 (m, 1H), 1.98-2.01 (m, 1H), 1.59-1.71 (m, 341H)。LC-MS: m/z = 207/225 (M+H)+。
【0273】
<工程6>
【0274】
【化56】

【0275】
(1-ベンジル-4-d3-メチル-ピペリジン-3-イル)-d3-メチル-アミン:約0℃で、ナトリウムメトキシド(3.2g、38.2mmol)を、d3-メチルアミン塩酸塩(1.4g、19.4mmol)、1-ベンジル-4-d3-メチルピペリジン-3-オン(2g、9.7mmol)およびテトラヒドロフラン(60mL)の懸濁液に加えた。混合物を約16時間、周囲温度で撹拌し、その後トリアセトキシ水素化ホウ素ナトリウム(8.5g、40mmol)を加えた。混合物を約5時間、周囲温度で撹拌し、その後5%の水酸化ナトリウム(50mL)を加えた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール)によって精製し、表題生成物を得た(2.2g;収量=50%)。LC-MS: m/z = 225 (M+H)+。
【0276】
<工程7>
【0277】
【化57】

【0278】
N-(1-ベンジル-4-d3-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-(7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンのため、(1-ベンジル-4-d3-メチル-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を淡黄色固体として分離した(1.4g;収量=90%)。LC-MS: m/z = 530 (M+H)+。
【0279】
<工程8>
【0280】
【化58】

【0281】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した(270mg;収量=70%)。LC-MS: m/z = 507 (M+H)+。
【0282】
<工程9>
【0283】
【化59】

【0284】
tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)-d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート:tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート(200mg、0.4mmol)および30%のd1-水酸化ナトリウム(60mL)の混合物を約16時間、約100℃で加熱した。周囲温度にまで混合物を冷却した後に、ジ-tert-ブチル重炭酸塩(170mg、0.8mmol)およびテトラヒドロフラン(20ml)を加えた。混合物を約16時間、周囲温度で撹拌し、その後溶剤を真空内で取り除いた。酢酸エチルでの標準の抽出後処理の後に、結果として生じる粗製の残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/鉱油(1:5))によって精製し、白色固体として表題生成物を得た。LC-MS: m/z = 453 (M+H)+。
【0285】
<工程10>
【0286】
【化60】

【0287】
(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート:エナンチオマー(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラートを、以下の条件を伴うキラル-Prep-HPLCを使用するキラル分離によって、tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d3-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート)(300mg)から分離した:カラム:キラルパックIA(Waters 2767-1)、0.46×25cm;移動相:ヘキサン/イソプロピルアルコール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:6.08分、所望されないエナンチオマーの保持時間:10.16分。ee%>99.8%。表題生成物を白色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 353(M+H)+。
【0288】
<工程11>
【0289】
【化61】

【0290】
N-d3-メチル-N-((3R,4R)-4-d3-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチル-エステルに対して、(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート)を置換した。表題生成物を粗製の残留物として分離し、任意の更なる精製無しで次の工程で使用した。LC-MS: m/z = 253 (M+H)+。
【0291】
<工程12>
【0292】
【化62】

【0293】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550-d7):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(40mg;収量=56%)。LC-MS: m/z = 320 (M+H)+。
【0294】
<工程13>
【0295】
【化63】

【0296】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d7クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を灰白色固体として分離した(23mg;収量=41%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H), 2.48-2.61 (m, 1H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H)。LC-MS: m/z = 320 (MH-C6H8O7)+。
【0297】
<実施例4>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-イル)-3-オキソ-プロパンニトリルモノクエン酸塩(CP-690550-d11クエン酸塩)
【0298】
【化64】

【0299】
<工程1>
【0300】
【化65】

【0301】
1-ベンジル-4-d3-メチル-(2,2',4-d3)-ピペリジン-3-オン:酸化重水素(60mL)中の2Nの塩化重水素中の1-ベンジル-4-d3-メチルピペリジン-3-オン6の混合物(2.5g、12.1mmol)を約16時間、約80℃で加熱した。周囲温度にまで混合物を冷却した後に、酸化重水素(80mL)中の2Nのd1-水酸化ナトリウムを加えた。酢酸エチルでの標準の抽出後処理により、粗製の残留物を得て、それを更なる精製無しで次の工程で使用した。LC-MS: m/z = 210/228 (M+H)+。
【0302】
<工程2>
【0303】
【化66】

【0304】
(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-d3-メチル-アミン:
実施例3、工程6の手順に従ったが、1-ベンジル-4-d3-メチル-ピペリジン-3-オンに対して、1-ベンジル-4-d3-メチル-(2,2',4-d3)-ピペリジン-3-オンを置換した。表題生成物を固体として分離した(3.9g;収量=90%)。LC-MS: m/z = 229 (M+H)+。
【0305】
<工程3>
【0306】
【化67】

【0307】
N-(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-クロロ-N-d3-(メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンに対して、(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を淡黄色固体として分離した(1.4g;収量=90%)。LC-MS: m/z = 534 (M+H)+。
【0308】
<工程4>
【0309】
【化68】

【0310】
Tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した(270mg;収量=70%)。LC-MS: m/z = 411/511 (M+H)+。
【0311】
<工程5>
【0312】
【化69】

【0313】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラート:実施例2、工程5の手順に従ったが、tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラートに対して、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラートを置換した。表題生成物を泡沫状固体として分離した(130mg;収量=90%)。1H NMR (300 MHz, CD3OD) δ: 10.41-10.73 (br s, 1H), 7.07 (d, J = 3.6 Hz, 1H), 6.57 (d, J = 2.4 Hz, 1H), 3.38- 3.71 (brs, 2H), 1.76-1.91 (m, 1H), 1.58-1.65 (m, 1H), 1.47 (s, 9H)。LC-MS: m/z = 257/357 (M+H)+。
【0314】
<工程6>
【0315】
【化70】

【0316】
(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラート:エナンチオマー(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラートを、以下の条件を有するキラル-Prep-HPLCを使用したキラル分離によって、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラートから分離した: カラム:キラルパックIC2×25cm(Waters 2767-1)、5umキラル-P(IC)001IC00CJ-LD016;移動相:ヘキサン/イソプロピルアルコール(85:15);検出器:UV254nm。所望のエナンチオマーの保持時間:12.01分、所望されないエナンチオマーの保持時間:15.10分。ee%>99.8%。表題生成物を黄色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 490 (M+H)+。
【0317】
<工程7>
【0318】
【化71】

【0319】
N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-d7-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルに対して、(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラートを置換した。表題生成物を分離し、更なる精製無しで次の工程に使用した。LC-MS: m/z = 257 (M+H)+。
【0320】
<工程8>
【0321】
【化72】

【0322】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリル(CP-690550-d11):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(50mg;収量=63%)。LC-MS: m/z = 324 (M+H)+。
【0323】
<工程9>
【0324】
【化73】

【0325】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ))-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリルモノクエン酸塩((CP-690550-d11クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリルを置換した。表題生成物を灰白色固体として分離した(50mg;収量=80%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 3.91-4.08 (m, 2H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H)。LC-MS: m/z = 324 (MH-C6H8O7)+。
【0326】
<実施例5>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロ-パンニトリルモノクエン酸塩(CP-690550-d15クエン酸塩)
【0327】
【化74】

【0328】
<工程1>
【0329】
【化75】

【0330】
エチル2-(ベンジルアミノ)酢酸塩:ジイソプロピルエチルアミン(155g、1.2mol)とベンジルアミン(96g、0.9mol)の溶液を、ジオキサン(1000mL)中の臭化酢酸エチル(100g、0.6mol)の溶液に滴下で加えた。結果として生じる懸濁液を約5時間、約90℃で加熱し、その後周囲温度にまで冷却した。酢酸エチルでの標準の抽出後処理により、黄色の油として表題生成物を得た(90g;収量=80%)。LC-MS: m/z = 194 (M+H)+。
【0331】
<工程2>
【0332】
【化76】

【0333】
エチル4-(ベンジル(2-エトキシ-2-オキソエチル)アミノ)-4-オキソブタノアート:炭酸カリウム(110.4g、0.97mol)を、テトラヒドロフラン(500mL)および水(200mL)中のエチル2-(ベンジルアミノ)酢酸塩(78g、0.4mol)の溶液に1つの部分で加えた。その後、無水のテトラヒドロフラン(200mL)中のエチル4-クロロ-4-オキソブタノアート(72.7g、0.485mol)を、1時間にわたって滴下で混合物に加えた。混合物をろ過し、濾液を酢酸エチルで洗浄した。溶剤を蒸発により取り除いた後、酢酸エチル(100mL)での標準の抽出後処理により黄色の油として表題生成物を得た(110g;収量=80%)。LC-MS: m/z = 322 (M+H)+。
【0334】
<工程3>
【0335】
【化77】

【0336】
エチル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート:エタノール(37g、0.8mol)およびジオキサン(200ml)中のエチル4-(ベンジル(2-エトキシ-2-オキソエチル)アミノ)-4-オキソブタノアート(123.2g、0.4mol)を、ジオキサン(500mL)中のナトリウム(18.4g、0.8mol)の懸濁液に滴下で加えた。ナトリウム金属がもはや見えなくなるまで、結果として生じる混合物を還流にて加熱した。周囲温度にまで混合物を冷却した後に、酢酸(48g、0.8mol)を加えた。酢酸エチルでの標準の抽出後処理により粗製生成物を得て、それをエーテル/アセトンからの再結晶化によって精製し、 黄色固体として表題生成物を得た(40g;収量=40%)。1H NMR (300 MHz, CD3OD) δ: 11.81 (s, 1H), 7.19-7.41 (m, 5H), 4.65 (s, 2H), 4.25 (q, J = 7.2 Hz, 2H), 3.91(t, J = 3Hz, 2H), 3.27 (t, J = 3Hz, 2H), 1.32 (t, J = 7.2Hz, 3H)。LC-MS: m/z = 276 (M+H)+。
【0337】
<工程4>
【0338】
【化78】

【0339】
ベンジル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート:ベンジルアルコール(27.5g、255mmol)中の1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート4(14g、50.9mmol)の溶液を、約16時間、約170℃で加熱した。溶剤を真空内で取り除き、結果として生じる残留物をエーテルから再結晶化し、黄色固体として表題生成物を得た(14g;収量=85%)。LC-MS: m/z = 338 (M+H)+。
【0340】
<工程5>
【0341】
【化79】

【0342】
ベンジル1-ベンジル-4-トリジューテロメチル(trideuteromethyl)-2,5-ジオキソピペリジン-4-カルボキシラート:ベンジル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート5(13.5g、40mmol)、d3-ヨードメタン(8.7g、60mmol)、炭酸カリウム(16.6g、120mmol)およびアセトン(60mL)の混合物を、約3時間、還流にて加熱した。混合物をろ過し、結果として生じる濾液を真空内で濃縮した。酢酸エチルでの標準の抽出後処理により粗製の残留物を得て、それをその後エーテル/アセトンからの再結晶化によって精製し、淡黄色固体として表題生成物を得た(11.3g;収量=80%)。LC-MS: m/z = 355 (M+H)+。
【0343】
<工程6>
【0344】
【化80】

【0345】
1-ベンジル-4-d3-メチルピペリジン-2,5-ジオン:水素ガスを、1-ベンジル-4-d3メチル-2,5-ジオキソピペリジン-4-カルボキシラート(12.5g、35.3mmol)、炭素(2g)上の10%のパラジウムおよび酢酸エチル(100mL)の懸濁液に導入した。混合物を約16時間、約50℃で加熱した。その後混合物を、セライトパッドを通してろ過し、濾液を酢酸エチルで洗浄した。濾液を約3時間、還流にて加熱し、その後溶剤を真空内での蒸発によって取り除いた。結果として生じる残留物をシリカゲルカラム(石油エーテル/酢酸エチル)によって精製し、表題生成物を得た(7g;収量=90%)。LC-MS: m/z = 221 (M+H)+。
【0346】
<工程7>
【0347】
【化81】

【0348】
1-ベンジル-5,5-ジメトキシ-4-d3-メチルピペリジン-2-オン:メタノール(20mL)中のオルトギ酸メチル(10mL)および4-メチルベンゼンスルホン酸(0.5g)の溶液を、メタノール(50mL)中の1-ベンジル-4-トリジューテロメチルピペリジン(trideuteromethylpiperidine)-2,5-ジオン(7g、31.8mmol)の溶液に滴下で加えた。結果として生じる混合物を約16時間、還流にて加熱し、その後周囲温度にまで冷却した。トリエチルアミン(2ml)を加えた後に、酢酸エチルでの標準の抽出後処理により粗製の残留物を得て、それをその後シリカゲルカラムクロマトグラフィーによって精製し、黄色の油として表題生成物を得た(7.8g;収量=90%)。LC-MS: m/z = 267 (M+H)+。
【0349】
<工程8>
【0350】
【化82】

【0351】
1-ベンジル-5,5-ジメトキシ-4-d3-メチル-3,3-d2-ピペリジン-オン:1-ベンジル-5,5-ジメトキシ-4-d3-メチルピペリジン-2-オン(4g、15mmol)、d4-メタノール(10mL)および30%のd1-水酸化ナトリウム(50mL)の混合物を、LC-MSによって測定されるように、反応が完了するまで約50℃で加熱した。混合物を周囲温度にまで冷却し、その後酸化重水素(25mL)を加えた。酢酸エチルでの標準の抽出後処理により、黄色の油として表題生成物を得た(3.3g;収量=80%)。LC-MS: m/z = 269 (M+H)+。
【0352】
<工程9>
【0353】
【化83】

【0354】
1-ベンジル-4-d3-メチル-3,3',4,6,6',-d5-ピペリジン-2,5-ジオン:(酸化重水素中の)1Nの重水素塩酸(deuterochloric acid)(200mL)中の1-ベンジル-5,5-ジメトキシ-4-d3-メチル-3,3-d2-ピペリジン-2-オン(8g、29.8mmol)の混合物を約16時間、約80℃で加熱した。混合物を周囲温度にまで冷却し、その後(酸化重水素中の)2Nのd1-水酸化ナトリウム(110mL)を加えた。混合物を酢酸エチルで抽出し、乾燥し、真空内で蒸発させた。結果として生じる残留物をシリカゲルカラムクロマトグラフィーによって精製し、表題生成物を得た(4.7g;収量=60%)。LC-MS: m/z = 226/244 (M+H)+。
【0355】
<工程10>
【0356】
【化84】

【0357】
1-ベンジル-4-d3-メチル-5-(d3-メチルアミノ)-3,3',4,5,6,6'-d6-ピペリジン-2-オン:
約0℃で、ナトリウムd3-メトキシド(0.9g、16mmol)を、テトラヒドロフラン(10mL)中のd5-メチルアミン塩化重水素(methylamine deuterium chloride)(1.2g、16mmol)の懸濁液に加えた。30分後、d4-酢酸(1.1g、16mmol)を、注射器を使用して混合物に注入した。結果として生じる混合物をその後約30分間、周囲温度で撹拌した。大気を窒素に置換した後、テトラヒドロフラン(20mL)中の1-ベンジル-4-d3-メチル-3,3',4,6,6',-d5-ピペリジン-2,5-ジオン(3g、13.3mmol)を、その後滴下で加えた。混合物を約16時間撹拌し、その後トリアセトキシ重水素化ホウ素ナトリウム(7.4g、32mmol)を加えた。混合物を約5時間、周囲温度で撹拌し、その後5%のd1-水酸化ナトリウム(50mL)を加えた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、表題生成物を得た(1.2g;収量=37%)。LC-MS: m/z = 245 (M+H)+。
【0358】
<工程11>
【0359】
【化85】

【0360】
(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-d3-メチル-アミン:テトラヒドロフラン(5mL)中の1-ベンジル-4-d3-メチル-5-(d3-メチルアミノ)-3,3',4,5,6,6'-d6-ピペリジン-2-オン(1.0g、4.1mmol)を、テトラヒドロフラン(20mL)中の重水素化リチウムアルミニウム(860mg、20.5mmol)の懸濁液に滴下で加えた。混合物を約1時間、周囲温度で撹拌した。約-10℃にまで混合物を冷却した後に、混合物を、氷を含んでいる10%の水酸化ナトリウム(5mL)へ注いだ。濾過の後、濾液を真空内で濃縮し、酢酸エチルで抽出した。有機相を組み合わせ、ブラインで洗浄し、乾燥し、真空内で蒸発させ、黄色の固体として表題生成物を得た(1.0g;収量=85%)。LC-MS: m/z = 233 (M+H)+。
【0361】
<工程12>
【0362】
【化86】

【0363】
N-(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンに対して、(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を、淡黄色固体として分離した(1.4g,収量=90%)。LC-MS: m/z = 538 (M+H)+。
【0364】
<工程13>
【0365】
【化87】

【0366】
tert-ブチル3-((2-d1-7-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した。LC-MS: m/z = 515 (M+H)+。
【0367】
<工程14>
【0368】
【化88】

【0369】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:実施例2、工程5の手順に従ったが、tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラートに対して、tert-ブチル3-(2-d1-7-トシル7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートを置換した。表題生成物を泡沫状固体として分離した(130mg;収量=90%)。LC-MS: m/z = 361 (M+H)+。
【0370】
<工程15>
【0371】
【化89】

【0372】
(3R,4R)-tert-ブチル3-((2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:エナンチオマーを、以下の条件を有するキラル-Prep-HPLCを使用したキラル分割により、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートから分離した:カラム:キラルパックIC2×25cm(Waters 2767-1)、5umキラル-P(IC)001IC00CJ-LD016;移動相:ヘキサン/イソプロピルアルコール(85:15);検出器:UV254nm。所望のエナンチオマーの保持時間:12.13分、所望されないエナンチオマーの保持時間:15.15分。ee%>99.8%。表題生成物を黄色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 361 (M+H)+。
【0373】
<工程16>
【0374】
【化90】

【0375】
N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸-tert-ブチルエステルに対して、(3R,4R)-tert-ブチル3-((2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートを置換した。表題生成物を粗製の残留物として分離し、それを任意の更なる精製無しで次の工程で使用した。LC-MS: m/z = 261 (M+H)+。
【0376】
<工程17>
【0377】
【化91】

【0378】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ-2,2',3,4,5,5',6,6'-d8-ピペリジン-l-イル)-3-オキソプロパンニトリル(CP-690550-d15):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(50mg;収量=63%)。LC-MS: m/z = 328 (M+H)+。
【0379】
<工程18>
【0380】
【化92】

【0381】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ [2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸(CP-690550-d15-クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ [2,3-d]ピリミジン-4-イル)アミノ)- 2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を白色固体として分離した(54mg;収量=90%)。1H NMR (300 MHz, CD3OD) δ: 7.35 (s, 1H), 6.89 (d, J = 2.7Hz, 1H), 3.91-4.08 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H)。LC-MS: m/z = 328 (MH-C6H8O7)+。
【0382】
以下の化合物は一般的に、上述された方法を使用して作ることができる。作られた時のこれらの化合物は、上記の実施例に記載されているものに類似する活性を有することが期待される。
【0383】
【化93】

【0384】
【化94】

【0385】
【化95】

【0386】
【化96】

【0387】
【化97】

【0388】
【化98】

【0389】
【化99】

【0390】
【化100】

【0391】
【化101】

【0392】
【化102】

【0393】
【化103】

【0394】
【化104】

【0395】
【化105】

【0396】
【化106】

【0397】
【化107】

【0398】
【化108】

【0399】
【化109】

【0400】
【化110】

【0401】
【化111】

【0402】
それらの非同位体的に濃縮されたアナログと比較して、本明細書に開示の化合物の代謝特性の変化は、以下のアッセイを使用して示すことができる。まだ作られていない及び/又は試験されていない、上記にリストされた化合物は、これらの1つ以上のアッセイによって示されるのと同様に、代謝特性を変更するものと予想される。
【0403】
<生物活性アッセイ>
<インビトロのヒト肝臓ミクロソーム安定性(HLM)アッセイ>
肝臓ミクロソーム安定性アッセイを、2%の重炭酸ナトリウム中のNADPH-ジェネレーションシステム(8.8mMのNADPH、102.4mMのグルコース6-リン酸塩、24単位/mLのグルコース6-リン酸デヒドロゲナーゼおよび13.2mMの塩化マグネシウム)を用いて肝臓ミクロソームタンパク質4mg/mLで行った。試験化合物を、20%のアセトニトリル-水中の溶液として調製し、アッセイ混合物(最終アッセイ濃度5マイクログラム/mL)に加え、37℃で培養した。アッセイ中のアセトニトリルの終末濃度は<1%であるべきである。アリコート(50μL)を、0、30、60、90および120分で取り出し、氷冷のアセトニトリル(200μL)で希釈し、反応を停止させた。サンプルを10分間、12,000RPMで遠心分離機にかけ、タンパク質を促進させた。上清を微量遠心管に移し、試験化合物の分解半減期(degradation half-life)のLC/MS/MS分析のために貯蔵した。従って、このアッセイにおいて試験された、本明細書開示の特定の同位体的に濃縮した化合物が、非同位体的に濃縮された薬物と比較して分解半減期の増加を示したことが分かった。HLMのための実施例1-5(CP-690550および同位体的に濃縮されたCP-690550アナログ)の分解半減期を、表1に示す。
【0404】
【表1】

【0405】
<ヒトシトクロームP450酵素を使用するインビトロでの代謝>
シトクロームP450酵素を、バキュロウィルス発現システム(BD Biosciences, San Jose, CA)を使用して、対応するヒトcDNAから発現させた。0.8ミリグラム/ミリリットルのタンパク質、1.3ミリモーラーのNADP+、3.3ミリモーラーのグルコース-6-フォスフェート、0.4U/mLのグルコース-6-リン酸デヒドロゲナーゼ、3.3ミリモーラーの塩化マグネシウムおよび0.2ミリモーラーの本明細書開示のような化合物、100ミリモーラーのリン酸カリウム(pH7.4)中の対応する非同位体的に濃縮された化合物又は標準又はコントロールを含む、0.25ミリリットルの反応混合物を20分間、37℃で培養する。培養した後、反応を適切な溶剤(例えばアセトニトリル、20%のトリクロロ酢酸、94%のアセトニトリル/6%の氷酢酸、70%の過塩素酸、94%のアセトニトリル/6%氷酢酸)の添加によって止め、3分間遠心分離機にかけた(10,000g)。上清をHPLC/MS/MSによって分析する。
【0406】
【表2】

【0407】
<モノアミンオキシダーゼAの阻害及び酸化代謝ターンオーバー(turnover)>
この手順を、Weyler et al., Journal of Biological Chemistry 1985, 260, 13199-13207により記載された方法を使用して行い、それは全体における参照により本明細書に組み込まれる。モノアミンオキシダーゼA活性を、4-ヒドロキシキノリンの形成を有するキヌラミンの酸化上で314nmでの吸光度の増加を監視することにより、分光測定で測定する。測定を、0.2%のトリトンX-100(モノアミンオキシダーゼアッセイ緩衝液)を含む、1mMのキヌラミンを加えた50mMのリン酸ナトリウム緩衝液、pH7.2、及び酵素の所望量中1mLの全容量で、30℃で行う。
【0408】
<モノアミンオキシダーゼBの阻害及び酸化代謝ターンオーバー>
この手順を、Uebelhack, Pharmacopsychiatry 1998, 31(5), 187-192に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0409】
<LC-MSによるCP-690550及びその代謝物の検出>
この手順を、Lawendy et al., J Clin Pharmacol 2009, 49, 423-429に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0410】
<LC-MSによる全血中のCP-690550の定量化>
この手順を、Paniagua et al., Therapeutic Drug Monitoring 2005, 27(5), 608-616に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0411】
<ヤヌスキナーゼ3酵素分析法>
この手順を、米国特許第6,627,754号に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0412】
<ヤヌスキナーゼ3酵素学的アッセイ>
この手順を、WO2003/048162に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0413】
<ヒトIL−2依存性T細胞ブラスト増殖の阻害>
この手順を、WO2003/048162に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0414】
前述の記載から、当業者は本発明の本質的な特徴を確認することができ、その精神および範囲から逸脱することなく、様々な使用法および状況に適応させるために本発明の様々な変更および修正を行うことができる。
【技術分野】
【0001】
本出願は、2009年4月20日に出願の、米国仮特許出願第61/170,858号、および2010年2月3日出願の第61/300,887号の優先権の利益を主張するものであり、これらの開示は、本明細書の全体に記載されるかのように、引用によって本明細書に組み込まれる。
【0002】
本明細書には、新しいピペリジン化合物、それらから作られた医薬品組成物が記載され、および腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、移植拒絶反応、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病による合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、および白血病などの障害の処置のために、被験体においてヤヌスキナーゼ3活性を阻害する方法もまた提供される。
【背景技術】
【0003】
CP-690550(CAS # 477600-75-2,タソシチニブ)、4-メチル-3-(メチル-7H-ピロロ[2,3-d]ピリミジン-4-イルアミノ)-ベータ-オキソ-(3R,4R)-l-ピペリジンプロパンニトリルは、ヤヌスキナーゼ3インヒビターである。CP-690550は、腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、および移植拒絶反応の処置のために研究中である(Jiang et al.,J.Med.Chem.2008,51,8012-8018;米国特許第6,627,754号;およびWO 2003/048162)。CP-690550はまた、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病による合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、および白血病の処置における有望性を示した(米国特許第6,627,754号;およびWO 2003/048162)。
【0004】
【化1】

【0005】
6人のヒト男性ボランティアにおける14Cの標識が付けられたCP-690550でのインビトロの研究は、ヒトにおいてCP-690550の急速な取り込みを実証し、総放射能が、経口投与後、1時間までにピークに達した(Prakash et al.,AAPS Journal 2008,10(S2))。未変化のCP-690550および総放射能に対する平均の終末過程の半減期は、両方とも約3.2時間であり、合計の循環する放射能の65%以上は、未変化のCP-690550によって占められていた(Prakash et al.,AAPS Journal 2008,10(S2))。血漿における残りの放射能は、各々が総放射能の<5%を占める8つの代謝物質に起因した(Prakash et al.,AAPS Journal 2008,10(S2))。主要な一次代謝経路は、ピロロピリミジン環の酸化、ピペリジン環の酸化、およびピペリジン環側鎖の酸化を含むことが発見された(Prakash et al.,AAPS Journal 2008,10(S2))。主要ではない代謝経路は、N-脱メチル化およびグルクロン酸との結合によるものであった(Prakash et al.,AAPS Journal 2008,10(S2))。CP-690550のクリアランス経路は、未変化の薬物の(CYP3A4/5およびCYP2C19による肝臓代謝を介した)約70%の非腎排泄および30%の腎排泄であった(Krishnaswami et al.,AAPS Journal 2009,11(S2))。
【0006】
重水素速度論的同位体効果
治療薬などの異物を除去するために、動物体は、シトクロムP450酵素(CYP)、エステラーゼ、プロテアーゼ、還元酵素、脱水素酵素、およびモノアミンオキシダーゼなどの様々な酵素を発現し、これらの異物と反応し、これらの異物を、腎排泄のためのより極性のある中間物質または代謝物質に変換させる。このような代謝反応は、炭素−酸素(C-O)または炭素−炭素(C-C)のπ結合のいずれかへの炭素−水素(C-H)結合の酸化をしばしば含んでいる。結果として生じる代謝物質は、生理学的条件下で安定または不安定であり得、親化合物に比べて、実質的に異なる薬物動態学的特性、薬力学的特性、および急性および長期毒性の特性を有し得る。ほとんどの薬物に関して、このような酸化は、一般に急速であり、最終的に、複数回のまたは高い一日用量の投与につながる。
【0007】
活性化エネルギーと反応速度の間の関係は、アレニウスの式、k=Ae-Eact/RTによって数量化され得る。アレニウスの式は、所与の温度で、化学反応の速度が活性化エネルギー(Eact)に指数関数的に依存することを示している。
【0008】
反応における遷移状態は、反応経路に沿った一時的な状態であり、その反応経路の間に、最初の結合は限界に達する。定義によると、反応のための活性化エネルギーEactは、その反応の遷移状態に達するために必要なエネルギーである。一旦遷移状態が達せられると、分子は、最初の反応物に戻ることができるか、または反応生成物を生じさせる新しい結合を形成することができるかのいずれかである。触媒は、遷移状態につながる活性化エネルギーを低下させることにより、反応工程を促進する。酵素は生物学的触媒の例である。
【0009】
炭素-水素結合の強度は、結合の基底状態の振動エネルギーの絶対値に正比例する。この振動エネルギーは、結合を形成する原子の質量に依存し、原子の1つまたは両方の質量が結合を増加させるにつれ増加する。重水素(D)がプロチウム(1H)の2倍の質量を有するため、C-D結合は、対応するC-1H結合より強固である。C-1H結合が、化学反応において律速段階(すなわち最も高い遷移状態のエネルギーを備えた段階)の間に壊されたならば、その後、重水素をそのプロチウムと置換することは、反応速度の減少を引き起こす。この現象は、重水素速度論的同位体効果(DKIE)として知られている。DKIEの重要性は、C-1H結合が壊された所与の反応の速度と、重水素がプロチウムと置換される場合の同様の反応の速度の間の比率として表現され得る。DKIEは、約1(同位体効果はない)から、50以上などの極めて大きい数までの範囲になり得る。トリチウムに対する水素の置換は、結果的に重水素よりもなお強固な結合をもたらし、数的により大きな同位体効果を与える。
【0010】
重水素(2HまたはD)は安定しており、水素の最も一般的な同位体、プロチウム(1H)の約2倍の質量を有する水素の非放射性の同位体である。酸化重水素(D2Oまたは「重水」)は、H2Oのような見た目および味がするが、異なる物理的性質を有する。
【0011】
純粋なD2Oが齧歯類に与えられるとき、それは容易に吸収される。毒性を誘発するのに必要な重水素の量は極端に高い。体内水分の約0〜15%がD2Oと置換されたとき、動物は健康であるが、対照(無処置)群ほど速く体重を増加させることはできない。体内水分の約15〜20%がD2Oと置換されたとき、動物は興奮しやすくなる。体内水分の約20〜25%がD2Oと置換されたとき、動物は非常に興奮しやすくなるため、刺激されたとき頻繁に痙攣する。皮膚病変、足および鼻鏡上の潰瘍、および尾の壊死が現われる。動物はまた、非常に攻撃的になる。体内水分の約30%がD2Oと置換されたとき、動物は拒食し、昏睡状態になる。動物の体重は急激に落ち、動物の代謝率は、標準よりかなり下がり、D2Oとの約30〜約35%の置換で死に至る。以前の体重の30パーセント以上がD2Oにより失われない限り、効果は可逆的である。研究はまた、D2Oの使用が癌細胞の成長を遅らせることができ、一定の抗腫瘍薬の細胞毒性を増強することができることを示した。
【0012】
薬物動態学(PK)、薬力学(PD)、および毒性の特性を改善するための医薬品の重水素化は、いくつかの種類の薬物によって以前に実証された。例えば、DKIEは、塩化トリフルオロアセチルなどの反応種の産生をおそらく制限することにより、ハロタンの肝毒性を減少させるために使用された。しかしながら、この方法はすべての薬物の種類に適用可能ではないかもしれない。例えば、重水素の取り込みは、代謝交換(metabolic switching)につながり得る。第I相(Phase I)酵素によって捕捉された異物(xenogens)が一時的に結合し、化学反応(例えば、酸化)前に様々な構造で再び結合するときに、代謝交換は生じる。多くの第I相酵素中の結合ポケットの比較的巨大なサイズおよび多くの代謝反応の乱雑な性質によって、代謝交換は可能になる。代謝交換は、全く新しい代謝物質と同様に既知の代謝物質の異なる比率につながり得る。この新しい代謝特性は、多かれ少なかれ毒性を与え得る。このような落とし穴は明白ではなく、任意の薬物の種類に関してアプリオリに予測可能ではない。
【0013】
CP-690550は、ヤヌスキナーゼ3インヒビターである。CP-690550の炭素-水素結合は、水素同位体の自然発生の分布、すなわち、1Hまたはプロチウム(約99.9844%)、2Hまたは重水素(約0.0156%)、3Hまたはトリチウム(1018のプロチウム原子当たり約0.5〜67の間のトリチウム原子の範囲内)を含んでいる。重水素の取り込みの増加したレベルは、重水素の自然発生のレベルを有するCP-690550と比較したCP-690550の薬物動態学、薬理学、及び/又は毒物学の特性に影響を与え得る、検出可能な重水素速度論的同位体効果(DKIE)を生み得る。
【0014】
文献を考慮することに加え、我々の研究室でなされた発見に基づくと、CP-690550は、ヒトでは、N-メチル基、ピペリジンメチル基、ピペリジン環、およびアルファ−カルボニルメチル基において代謝される。現在の手法は、これらの部位で代謝を妨げる見込みを有する。分子上の他の部位はまた、まだ知られていない薬物学/毒物学を有する代謝物質につながる形質転換を受け得る。これらの代謝物質の産生を制限することで、このような薬物の投与の危険を減少させ、増加した用量及び/又は増加した有効性さえ与える潜在性が備えられる。これらの形質転換のすべてが、多形的に発現された酵素を介して起こり、患者間のばらつきを激化させる。さらに、被験体が一日中または長時間の間、薬で治療されるとき、いくつかの障害は最も治りやすい。すべての前述の理由のために、より長い半減期を有する薬は、結果的に、より大きな有効性および経費節約につながり得る。様々な重水素化のパターンは、(a)不要な代謝物質を低減するまたは除去する、(b)親薬物の半減期を増加させる、(c)所望の効果を達成するために必要とされる投与数を減少させる、(d)所望の効果を達成するために必要とされる投与量を減少させる、(e)活性代謝物の形成を、もし形成されれば、増加させる、(f)特定の組織において有害代謝物の産生を減少させる、及び/又は(g)多薬療法が意図的であろうと、そうでないにしても、多薬療法のためのより有効な薬物及び/又はより安全な薬物を作り出すために使用され得る。重水素化の手法は、CP-690550の代謝を遅らせ、患者間のばらつきを軽減するという、大きな見込みを有する。
【発明の概要】
【課題を解決するための手段】
【0015】
ヤヌスキナーゼ3活性を阻害することが分かったいくつかの新しい化合物および医薬組成物は、化合物を合成する方法および使用する方法と一緒に発見され、その方法は、本明細書に開示されるような化合物を投与することによる患者におけるヤヌスキナーゼ3媒介の障害の処置のための方法を含む。
【発明を実施するための形態】
【0016】
本発明の特定の実施形態において、化合物は、構造式I、
【0017】
【化2】

【0018】
またはその薬学的に許容可能な塩を有し、ここで、
R1-R20は、水素および重水素からなる群から独立して選択され、および、
R1-R20の少なくとも1つは、重水素である。
【0019】
さらなる実施形態において、R1-R2の少なくとも1つは、重水素である。
【0020】
さらなる実施形態において、R1-R2は、重水素である。
【0021】
さらなる実施形態において、R11-R13の少なくとも1つは、重水素である。
【0022】
さらなる実施形態において、R11-R13は、重水素である。
【0023】
さらなる実施形態において、R20は、重水素である。
【0024】
さらなる実施形態において、R3-R10の少なくとも6つは、重水素である。
【0025】
さらなる実施形態において、R3-R10の少なくとも7つは、重水素である。
【0026】
さらなる実施形態において、R3-R10は、重水素である。
【0027】
さらなる実施形態において、R1-R2およびR11-R13は、重水素である。
【0028】
さらなる実施形態において、R1-R2およびR20は、重水素である。
【0029】
さらなる実施形態において、R1-R2、およびR3-R10の少なくとも6つは、重水素である。
【0030】
さらなる実施形態において、R1-R2およびR3-R10は、重水素である。
【0031】
さらなる実施形態において、R11-R13およびR20は、重水素である。
【0032】
さらなる実施形態において、R11-R13、およびR3-R10の少なくとも6つは、重水素である。
【0033】
さらなる実施形態において、R11-R13およびR3-R10は、重水素である。
【0034】
さらなる実施形態において、R20、およびR3-R10の少なくとも6つは、重水素である。
【0035】
さらなる実施形態において、R20およびR3-R10は、重水素である。
【0036】
さらなる実施形態において、R1-R2、R20、およびR3-R10の少なくとも6つは、重水素である。
【0037】
さらなる実施形態において、R1-R2、R20、およびR3-R10は、重水素である。
【0038】
さらなる実施形態において、R1-R2、R11-R13、およびR3-R10の少なくとも6つは、重水素である。
【0039】
さらなる実施形態において、R1-R2、R11-R13、およびR3-R10は、重水素である。
【0040】
さらなる実施形態において、R1-R2、R11-R13、およびR20は、重水素である。
【0041】
さらなる実施形態において、R1-R2、R11-R13、R20、およびR3-R10の少なくとも6つは、重水素である。
【0042】
さらなる実施形態において、R1-R2、R11-R13、R20、およびR3-R10は、重水素である。
【0043】
本明細書に開示される特定の化合物は、有用なヤヌスキナーゼ3阻害活性を有し得、ヤヌスキナーゼ3が活発な役割を果たす障害の処置または予防において使用され得る。したがって、特定の実施形態はまた、化合物および組成物を作り使用する方法に加え、薬学的に許容可能な担体と一緒に、本明細書に開示される1つ以上の化合物を含む医薬組成物も提供する。特定の実施形態は、ヤヌスキナーゼ3活性を阻害するための方法を提供する。
他の実施形態は、本発明に従って、患者に治療上有効な量の化合物または組成物を投与する工程を含む、そのような処置を必要とする前記患者においてヤヌスキナーゼ3媒介の障害を処置するための方法を提供する。また、ヤヌスキナーゼ3活性を阻害することにより改善された障害の予防または処置のための薬剤の製造において使用するための、本明細書に開示される特定の化合物の使用が提供される。
【0044】
本明細書に開示される化合物はまた、限定されないが、炭素に対する13Cまたは14C、硫黄に対する33S、34S、または36S、窒素に対する15N、および酸素に対する17Oまたは18Oを含む、より一般的でない他の元素に対する同位体を含み得る。
【0045】
特定の実施形態において、本明細書に開示される化合物におけるすべてのC-D結合が、代謝され、D2OまたはDHOとして放出されると仮定すれば、本明細書に開示される化合物は、最大約0.000005%のD2Oまたは約0.00001%のDHOに患者を曝し得る。特定の実施形態において、動物において毒性を引き起こすことが示されたD2Oのレベルは、本明細書に開示されるような重水素が濃縮された化合物の投与によって引き起こされた曝露の最大限度よりもはるかに大きい。したがって特定の実施形態において、本明細書に開示される重水素が濃縮された化合物は、薬物代謝上のD2OまたはDHOの形成により何らかのさらなる毒性を引き起こすはずはない。
【0046】
特定の実施形態において、本明細書に開示される重水素化の化合物は、対応する非同位体的に濃縮された分子の有益な面を維持する一方で、最大耐用量を実質的に増加させ、毒性を減少させ、半減期(T1/2)を増加させ、最小有効量(MED)の最大血漿濃度(Cmax)を低下させ、有効量を低下させ、それによって、機序に関連しない(non-mechanism-related)毒性を減少させ、及び/又は薬物と薬物の相互作用の可能性を低下させる。
【0047】
特定の実施形態において、化合物は、構造式II、
【0048】
【化3】

【0049】
またはその塩を有し、
式中、
Z1はアミノ保護基であり、
R3−R16は、水素および重水素からなる群から独立して選択され、および、
R3−R16の少なくとも1つは、重水素である。
【0050】
さらなる実施形態において、Z1は、ベンジルである。
【0051】
さらなる実施形態において、構造式IIの化合物は、
【0052】
【化4】

【0053】
からなる群から選択された構造を有する。
【0054】
特定の実施形態において、本明細書には、構造式IIの化合物:
【0055】
【化5】

【0056】
式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3−R16は、水素および重水素からなる群から独立して選択され、
R3−R16の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は、以下の工程を含む:
Z2がカルボキシル保護基である、構造式IIIの化合物を、テトラヒドロフランなどの適切な溶剤中で、水素化ナトリウムなどの適切な塩基の存在下において、構造式IVの化合物と反応させ、構造式Vの化合物を得る工程;
【0057】
【化6】

【0058】
構造式Vの化合物を、水または酸化重水素などの適切な溶剤中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIの化合物を得る工程;
【0059】
【化7】

【0060】
および構造式VIの化合物を、テトラヒドロフランなどの適切な溶剤中で、トリアセトキシ水素化ホウ素ナトリウム(sodium triacetoxyborohydride)またはトリアセトキシ重水素化ホウ素ナトリウム(sodium triacetoxyborodeuteride)などの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式VIIの化合物を得る工程。
【0061】
【化8】

【0062】
特定の実施形態において、本明細書には、構造式IIの化合物:
【0063】
【化9】

【0064】
式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は、以下の工程を含む:
構造式VIIIの化合物を、メタノールなどの適切な溶剤中で、トルエンスルフォン酸などの適切な酸の存在下、オルソギ酸メチルエステルなどの随意の脱水剤の存在下において、構造式Xの化合物(Z3がC1-C2アルキルである)と反応させ、構造式IXの化合物を得る工程;
【0065】
【化10】

【0066】
構造式IXの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶剤中で、水酸化ナトリウムまたはd1-水酸化ナトリウム、または塩化重水素などの適切な塩基と反応させ、構造式IXの化合物を得る工程;
構造式IXの化合物を、水または酸化重水素などの適切な溶剤中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIIIの化合物を得る工程;
【0067】
【化11】

【0068】
構造式VIIIの化合物を、テトラヒドロフランなどの適切な溶剤中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式Xの化合物を得る工程;
【0069】
【化12】

【0070】
および構造式Xの化合物を、テトラヒドロフランなどの適切な溶剤中で、水素化アルミニウムリチウムまたは重水素化リチウムアルミニウムなどの適切な還元剤と反応させ、構造式Xの化合物を得る工程。
【0071】
【化13】

【0072】
特定の実施形態において、本明細書には構造式XIIIの化合物:
【0073】
【化14】

【0074】
式中、
Z1およびZ4は、水素およびアミノ保護基からなる群から独立して選択され、
R3-R18およびR20は、水素および重水素からなる群から独立して選択され、
R3-R18およびR20の少なくとも1つは、重水素である、を調製する方法が開示され、
前記方法は以下の工程を含む:
構造式XIの化合物を、水およびテトラヒドロフランの組み合わせなどの適切な溶剤中で、炭酸カリウムなどの適切な塩基の存在下において、構造式IIの化合物と反応させ、構造式XIIの化合物を得る工程;
【0075】
【化15】

【0076】
および構造式XIIの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶剤中で、水素または重水素ガスなどの適切な還元剤および炭素上のパラジウムまたは炭素上の水酸化パラジウムなどの適切な触媒と反応させ、構造式XIIIの化合物を得る工程。
【0077】
【化16】

【0078】
本明細書に言及されるすべての公報および引用は、それらの全体の引用によって明白に本明細書に組み込まれる。しかしながら、組み込まれた両方の公報または引用において見出され、本明細書に明確に提示されたまたは定義されたあらゆる同様のまたは同一の用語に関して、言うならば、本明細書に明確に提示されたそれらの用語、定義または意味は、すべての点において優先するものとする。
【0079】
本明細書に使用されるように、下記の用語は、示された意味を有する。
【0080】
単数形「a」、「an」、および「the」は、特に別記のない限り複数の冠詞を指し得る。
【0081】
用語「約(about)」は、本明細書に使用されるように、修正する数値を修飾するように意図され、そのような値を許容誤差内の変数として示す。データの図または表に与えられた平均値に対する標準偏差などの特定の許容誤差が詳述されないとき、用語「約」は、詳述された値を包含するその範囲およびその数字を四捨五入することによって含まれる範囲も同様に意味し、有効数字を考慮に入れることは理解されたい。
【0082】
値域が開示され、表記法「n1から... n2まで」または「n1-n2」(n1およびn2が数字である)が使用されるとき、そのときは、他に指定のない限り、この表記法は、それらの間の数字自体およびそれらの間の範囲を含むことが意図される。この範囲はそれらの間で整数または連続的であり得、終値を含み得る。
【0083】
用語「重水素濃縮(deuterium enrichment)」は、水素に代わる、分子における所与の位置での重水素の取り込みのパーセンテージを指す。例えば、所与の位置での1%の重水素濃縮は、所与のサンプル内の分子の1%が、所定位置で重水素を含むことを意味する。重水素の自然発生の分布が約0.0156%であるため、濃縮していない出発物質を使用して合成された化合物における任意の位置での重水素濃縮は、約0.0156%である。重水素濃縮は、質量分析法および核磁気共鳴法を含む、当業者に公知の従来の分析法を使用して、測定され得る。
【0084】
R1-R20または記号「D」などの分子における所与の位置を記載するために使用されるとき、分子構造の図面における所与の位置を表わすために使用されるときの、用語「重水素である(is/are deuterium)」は、所定位置が重水素の自然発生の分布上で重水素で濃縮されることを意味する。1つの実施形態において、重水素濃縮は、所定位置での重水素の約1%以上であり、別の実施形態において、約5%以上であり、別の実施形態において、約10%以上であり、別の実施形態において、約20%以上であり、別の実施形態において、約50%以上であり、別の実施形態において、約70%以上であり、別の実施形態において、約80%以上であり、別の実施形態において、約90%以上であり、または別の実施形態において、約98%以上である。
【0085】
用語「同位体濃縮(isotopic enrichment)」は、元素のより一般的な同位体に代わって、分子における所与の位置での、元素のより一般的でない同位体の取り込みのパーセンテージを指す。
【0086】
用語「非同位体的に濃縮された(non-isotopically enriched)」は、様々な同位体のパーセンテージが自然発生のパーセンテージと実質的に同様である分子を指す。
【0087】
不斉中心は、本明細書に開示される化合物中に存在する。これらの中心は、キラル炭素原子のまわりの置換基の配置に依存する、記号「R」または「S」で示される。本発明が、D-異性体およびL-異性体、およびそれらの混合物のみだけでなく、ジアステレオマー、エナンチオマー、およびエピマーの形態を含む、すべての立体化学の異性体の形態を包含することは理解されたい。化合物の個々の立体異性体は、キラル中心を含む市販の出発物質から、または分離または再結晶、クロマトグラフ法、キラルクロマトグラフィーカラム上のエナンチオマーの直接分離、または当該技術分野に公知の任意の他の適切な方法に続く、ジアステレオマーの混合物への転換などの分離の後のエナンチオマー生成物の混合物の調製によって合成的に調製され得る。特定の立体化学の出発化合物は、市販であるか、当該技術分野に公知の技術によって作られ分解され得るかのいずれかである。さらに、本明細書に開示される化合物は、幾何異性体として存在し得る。本発明は、すべてのシス(cis)、トランス(trans)、合成(syn)、抗(anti)、エントゲーゲン(E)(entgegen)、およびツザメン(Z)(zusammen)の異性体に加え、それらの適切な混合物を含む。さらに、化合物は、互変異性体として存在し得る。すべての互変体の異性体は、本発明によって提供される。さらに、本明細書に開示される化合物は、非溶媒和の形態に加え、水、エタノールなどの薬学的に許容可能な溶剤との溶媒和の形態で存在し得る。一般に、溶媒和の形態は、非溶媒和の形態と等価であると考えられる。
【0088】
「カルボキシル保護基」の定義は、限定されないが、2-N-(モルホリノ)エチル、コリン、メチル、メトキシエチル、9-フルオレニルメチル、メトキシメチル、メチルチオメチル、テトラヒドロピラニル、テトラヒドロフラニル、メトキシエトキシメチル、2-(トリメチルシリル)エトキシメチル、ベンジルオキシメチル、ピバロイルオキシメチル、フェニルアセトキシメチル、トリイソプロピルシリルメチル、シアノメチル、アセトール、p-ブロモフェナシル,α-メチルフェナシル、p-メトキシフェナシル、デシール、カルボキサミドメチル、p-アゾベンゼンカルボキサミド-メチル、N-フタルイミドメチル 、(メトキシエトキシ)エチル、2,2,2-トリクロロエチル 、2-フルオロエチル、2-クロロエチル、2-ブロモエチル、2-ヨードエチル、4-クロロブチル、5-クロロペンチル、2-(トリメチルシリル)エチル、2-メチルチオエチル、1,3-ジチアニル-2-メチル、2-(p-ニトロフェニルスルフェニル)エチル、 2-(p-トルエンスルホニル)エチル、2-(2'-ピリジル )エチル、2-(p-メトキシフェニル)エチル、2-(ジフェニルホスフィノ)エチル、1-メチル-1-フェニルエチル、2-(4-アセチル-2-ニトロフェニル)エチル、2-シアノエチル、ヘプチル、tert-ブチル、3-メチル-3-ペンチル、ジシクロプロピルメチル、2,4-ジメチル-3-ペンチル、シクロペンチル、シクロヘキシル、アリル、メタリル、2-メチルブタ-3-エン-2-イル、3-メチルブタ-2-(プレニル)、3-ブテン-1-イル、4-(トリメチルシリル)-2-ブテン-1-イル、シンナミル、α-メチルシンナミル、プロパルギル、フェニル、2,6-ジメチルフェニル、2,6-ジイソプロピルフェニル、2,6-ジ-tert-ブチル-4-メチルフェニル、2,6-ジ-tert-ブチル-4-メトキシフェニル、p-(メチルチオ)フェニル、ペンタフルオロフェニル、ベンジル、トリフェニルメチル、ジフェニルメチル、ビス(o-ニトロフェニル)メチル、9-アントリルメチル、2-(9,10-ジオキソ)アントリルメチル,5-ジベンゾスベリル、1-ピレニルメチル、2-(トリフルオロメチル)-6-クロモニルメチル、2,4,6-トリメチルベンジル、p-ブロモベンジル、o-ニトロベンジル、p-ニトロベンジル、p-メトキシベンジル、2,6-ジメトキシベンジル、4-(メチルスルフィニル)ベンジル、4-スルホベンジル、4-アジドメトキシベンジル、4-{N-[1-(4,4-ジメチル-2,6-ジオキソシクロヘキシリデン)-3-メチルブチル]アミノ}ベンジル、ピペロニル、4-ピコリル、トリメチルシリル、トリエチルシリル、tert-ブチルジメチルシリル、イソプロピルジメチルシリル、フェニルジメチルシリル、ジ-tert-ブチルメチルシリル、トリイソプロピルシリルなどを含む。
【0089】
「アミノ保護基」の定義は、限定されないが、
2-メチルチオエチル、2-メチルスルホニルエチル、2-(p-トルエンスルホニル)エチル、[2-(1,3-ジチアニル)]メチル、4-メチルチオフェニル、2,4-ジメチルチオフェニル、2-ホスホニオエチル、1-メチル-1-(トリフェニルホスホニオ)エチル、1,1-ジメチル-2-シアノエチル、2-ダンシルエチル、2-(4-ニトロフェニル)エチル、4-フェニルアセトキシベンジル、4-アジドベンジル、4-アジドメトキシベンジル、m-クロロ-p-アシルオキシベンジル、p-(ジヒドロキシボリル)ベンジル、5-ベンズイソオキサゾリルメチル、2-(トリフルオロメチル)-6-クロモニルメチル(chromonytmethyl)、m-ニトロフェニル、3.5-ジメトキシベンジル、1-メチル-1-(3,5-ジメトキシフェニル)エチル、o-ニトロベンジル、α-メチルニトロピペロニル、3,4-ジメトキシ-6-ニトロベンジル、N-ベンゼンスルフェニル、N-o-ニトロベンゼンスルフェニル、N-2,4-ジニトロベンゼンスルフェニル、N-ペンタクロロベンゼンスルフェニル,N-2-ニトロ-4-メトキシベンゼンスルフェニル、N-トリフェニルメチルスルフェニル、N-1-(2,2,2-トリフルオロ-1,1-ジフェニル)エチルスルフェニル、N-3-ニトロ-2-ピリジンスルフェニル、N-p-トルエンスルホニル、N-ベンゼンスルホニル、N-2,3,6-トリメチル-4-メトキシベンゼンスルホニル、N-2,4,6-トリメトキシベンゼン-スルフォニル、N-2,6-ジメチル-4-メトキシベンゼンスルホニル、N-ペンタメチルベンゼンスルホニル(N-2,3,5,6-テトラメチル-4-メトキシベンゼンスルホニルなど、
R80が、アルキル、置換されたアルキル、アリールからなる基から選択され、より具体的には、R80=メチル、エチル、9-フルオレニルメチル、9-(2-スルフォ)フルオレニルメチル,9-(2,7-ジブロモ)フルオレニルメチル)、17-テトラベンゾ[a,c,g,i]フルオレニルメチル,2-クロロ-3-インデニルメチル、ベンズ[f]インデン-3-イルメチル、2,7-ジ-t-ブチル-[9-(10,10-ジオキソ-10,10,10,10-テトラヒドロチオキサンチル(tetrahydrothloxanthyl)]メチル、1,1-ジオキソベンゾ[b]チオフェン-2-イルメチル、2,2,2-トリクロロエチル、2-トリメチルシリルエチル、2-フェニルエチル、1-(1-アダマンチル)-1-メチルエチル、2-クロロエチル、1,1-ジメチル-2-ハロエチル、1,1-ジメチル-2,2-ジブロモエチル、1,1-ジメチル-2,2,2-トリクロロエチル、1-メチル-1-(4-ビフェニルイル)エチル、1-(3,5-ジ-tert-ブチルフェニル)-1-メチルエチル、2-(2'-ピリジン)エチル、2-(4'-ピリジン)エチル、2,2-ビス(4'-ニトロフェニル)エチル、N-(2-ピバロイルアミノ)-1,1-ジメチルエチル、2-[(2-ニトロフェニル)ジチオ]-1-フェニルエチル、tert-ブチル、1-アダマンチル、2-アダマンチル、ビニル、アリル、1-イソプロピルアリル、シンナミル,4-ニトロシンナミル、3-(3-ピリジン)プロプ-2-エニル、8-キノリル、N-ヒドロキシピペリジニル、アルキルジチオ、ベンジル、p-メトキシベンジル、p-ニトロベンジル、p-ブロモベンジル,p-クロロベンジル、2,4-ジクロロベンジル、4-メチルスルフィニルベンジル、9-アントリルメチル、ジフェニルメチル、tert-アミル、S-ベンジルチオカルバマート、ブチニル、p-シアノベンジル、シクロブチル、シクロヘキシル、シクロペンチル、シクロプロピルメチル、p-デシルオキシベンジル、ジイソプロピルメチル、2,2-ジメトキシカルボニルビニル、o-(N,N'-ジメチルカルボキサミド)ベンジル、1,1-ジメチル-3-(N,N'-ジメチルカルボキサミド)プロピル、1,1-ジメチルプロピニル、ジ(2-ピリジン)メチル、2-フラニルメチル、2-イオドエチル(lodoethyl)、イソボルニル、イソブチル、イソニコチニル、p-(p'-メトキシフェニルアゾ)ベンジル、1-メチルシクロブチル、1-メチルシクロヘキシル、1-メチル-1-シクロプロピルメチル、1-メチル-1-(p-フェニルアゾフェニル)エチル、1-メチル-1-フェニルエチル、1-メチル-1-4'-ピリジリエチル、フェニル、p-(フェニルアゾ)ベンジル、2,4,6-トリメチルフェニル、4-(トリメチルアンモニウム)ベンジル、2,4,6-トリメチルベンジルなどである、-C(O)OR80を含む。
【0090】
用語「結合(bond)」は、2つの原子の間、または結合によって連結された原子がより大きな下部構造の一部であると考えられるときの2つの部分の間の共有結合を指す。結合は、特に指定のない限り、単一、二重または三重であり得る。分子の図面における2つの原子の間の破線は、さらなる結合がその位置で存在し得るまたは存在し得ないことを示す。
【0091】
本明細書に使用されるような用語「障害(disorder)」は、用語「疾患」、「症候群」、および(内科疾患におけるような)「疾病」と一般に同意語になるように意図され、交換可能に使用され、それらすべては、正常な機能を害する、ヒトまたは動物の体の、またはその部分の一つの異常状態を表し、兆候および症状を見分けることによって、典型的に明らかとなる。
【0092】
用語「処置する(treat)」、「処置すること(treating)」、および「処置(treatment)」は、障害または障害に関係する1以上の症状を緩和または抑制すること、または障害自体の原因を緩和または根絶することを含むように意図されている。本明細書で使用されるように、障害の「処置」への言及は、予防を含むように意図されている。用語「予防する(prevent)」、「予防すること(preventing)」、および「予防(prevention)」は、障害の発症、及び/又はその伴う症状を遅らせるまたは排除する、被験体が障害にかかることを防ぐ、または障害にかかる被験体のリスクを減らす方法を指す。
【0093】
用語「治療上有効な量(therapeutically effective amount)」は、処置されている障害の1以上の症状の進行を防ぐ、またはある程度まで緩和するのに十分な、投与されたときの化合物の量を指す。用語「治療上有効な量」はまた、研究者、獣医、医師、または臨床医によって求められている、細胞、組織、器官系、動物、またはヒトの生物学的または医学的反応を引き出すのに十分な化合物の量を指す。
【0094】
用語「被験体(subject)」は、限定されないが、霊長類(例えば、ヒト、猿、チンパンジー、ゴリラなど)、齧歯類(例えば、ラット、マウス、アレチネズミ、ハムスター、フェレットなど)、ウサギ、豚類(例えば、豚、ミニチュアピッグ)、ウマ、イヌ、ネコなどを含む動物を指す。用語「被験体」および「患者(patient)」は、本明細書の引用において、例えば、ヒト患者などの哺乳類の被験体に交換可能に使用される。
【0095】
用語「併用療法(combination therapy)」は、本開示に記載される治療上の障害を治療するための2つ以上の治療薬の投与を意味する。このような投与は、固定比率の活性成分を有する単一のカプセル、または各活性成分のための多数の、別々のカプセルなどのように、実質的に同時の方法で、これらの治療薬の同時投与を包含する。さらに、このような投与はまた、連続する方法で、各タイプの治療薬の使用を包含する。いずれの場合においても、処置レジメンは、本明細書に記載される障害を治療する際に、複合薬の有益な効果を提供する。
【0096】
用語「ヤヌスキナーゼ3(Janus kinase 3)」は、プロテインキナーゼのヤヌスファミリーのメンバーを指す。このファミリーの他のメンバーは、本質的にすべての組織によって発現されるが、ヤヌスキナーゼ3の発現は造血細胞に限定される。これは、これらの多連鎖の受容体に共通のγ鎖との、ヤヌスキナーゼ3の非共有結合の会合によって、IL-2、IL-4、IL-7、IL-9、およびIL-15に対する受容体を介してシグナル伝達する際のその不可欠な役割と一致している。XSCID患者集団は、ヤヌスキナーゼ3タンパク質の激しく減少したレベルまたは共通のγ鎖に対する遺伝子欠損と同定され、免疫抑制が、ヤヌスキナーゼ3経路を介してシグナル伝達を遮断することから生じるはずであることを示唆している。動物研究は、ヤヌスキナーゼ3がBおよびTリンパ球の成熟に重大な役割を果たすだけでなく、ヤヌスキナーゼ3がT細胞機能を維持するのに構成的に必要とされることを示唆した。この新しい機構を介する免疫力の調節は、移植拒絶反応および自己免疫性疾患などのT細胞の増殖障害の処置に有用であることが分かり得る。
【0097】
用語「ヤヌスキナーゼ3媒介の障害(Janus kinase 3-mediated disorder)」は、異常なヤヌスキナーゼ3活性、または調節されたときに、他の異常な生化学的プロセスを改善する、正常なヤヌスキナーゼ3活性によって特徴付けられる障害を指す。ヤヌスキナーゼ3媒介の障害は、ヤヌスキナーゼ3活性を調節することによって、完全にまたは部分的に媒介され得る。特に、ヤヌスキナーゼ3媒介の障害は、ヤヌスキナーゼ3活性を阻害することによって、結果的に根本的な障害へある程度の効果を与える、例えば、ヤヌスキナーゼ3インヒビターの投与が、結果的に少なくとも何人かの処置されている患者においてある程度の改善をもたらす。
【0098】
用語「ヤヌスキナーゼ3インヒビター(Janus kinase 3 inhibitor)」は、ヤヌスキナーゼ3の機能を変える、本明細書に開示される化合物の能力を指す。インヒビターは、インヒビターとヤヌスキナーゼ3の間の、可逆的または不可逆的な共有結合の形成により、または非共有結合の複合体の形成を介して、ヤヌスキナーゼ3活性を遮断または低減し得る。このような阻害は、特定の細胞タイプにおいてのみ明らかにされ得る、または特定の生物学的事象に左右され得る。用語「ヤヌスキナーゼ3インヒビター」はまた、複合体がヤヌスキナーゼ3と天然の基質の間で生じる可能性を減らすことによって、ヤヌスキナーゼ3の機能を変えることを指す。幾つかの実施形態において、ヤヌスキナーゼ3活性の阻害は、Jiang et al., J. Med. Chem. 2008, 51,8012-8018;米国特許第6,627,754号およびWO 2003/048162に記載される方法を使用して評価され得る。
【0099】
用語「ヤヌスキナーゼ3活性を阻害すること(inhibiting Janus kinase 3 activity)」または「ヤヌスキナーゼ3活性の阻害(inhibition of Janus kinase 3 activity)」は、ヤヌスキナーゼ3インヒビターを投与することによってヤヌスキナーゼ3の機能を変えることを指す。
【0100】
用語「治療上許容可能な(therapeutically acceptable)」は、過度の毒性、刺激、アレルギー反応、免疫原性のない患者の組織に接触する使用に適し、合理的なリスク・ベネフィット比と比例し、それらの意図された使用に有効である化合物(あるいは塩、プロドラッグ、互変異性体、両性イオンの形態など)を指す。
【0101】
用語「薬学的に許容可能な担体(pharmaceutically acceptable carrier)」、「薬学的に許容可能な賦形剤(pharmaceutically acceptable excipient)」、「生理学的に許容可能な担体(physiologically acceptable carrier)」、または「生理学的に許容可能な賦形剤(physiologically acceptable excipient)」は、液体または固形の充填剤、希釈剤、賦形剤、溶剤、または封入材料などの薬学的に許容可能な材料、組成物、またはビヒクルを指す。各構成要素は、医薬製剤の他の成分と適合している意味で、「薬学的に許容可能」でなければならない。また、合理的なリスク・ベネフィット比と比例して、過度の毒性、刺激、アレルギー反応、免疫原性、または他の問題または合併症のない、ヒトおよび動物の組織または器官に接触する使用に適していなければならない。Remington:The Science and Practice of Pharmacy, 21st Edition; Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition; Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; および Handbook of Pharmaceutical Additives, 3rd Edition; Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004)を参照。
【0102】
用語「活性成分(active ingredient)」、「活性化合物(active compound)」、および「活性物質(active substance)」は、1つ以上の障害の症状を処置、予防、または改善するために、被験体に単独でまたは1つ以上の薬学的に許容可能な賦形剤または担体と組み合わせて投与される化合物を指す。
【0103】
用語「薬物(drug)」、「治療薬(therapeutic agent)」、および「化学療法薬(chemotherapeutic agent)」は、1つ以上の障害の症状を処置、予防、または改善するために、被験体に投与される、化合物、またはその医薬組成物を指す。
【0104】
用語「放出制御賦形剤(release controlling excipient)」は、その主要な機能が、従来の即時放出剤形と比較して、剤形から活性物質を放出する期間または場所を修正することである賦形剤を指す。
【0105】
用語「非放出制御賦形剤(nonrelease controlling excipient)」は、その主要な機能が、従来の即時放出剤形と比較して、剤形から活性物質を放出する期間または場所を修正することを含まない賦形剤を指す。
【0106】
用語「プロドラッグ(prodrug)」は、本明細書に開示されるような化合物の複合機能的誘導体を指し、インビボで親化合物に容易に変換可能である。プロドラッグは、幾つかの状況において、親化合物よりも投与しやすいという理由から、しばしば有用である。プロドラッグは、例えば、経口投与により生物学的に利用可能であり得る一方で、親化合物はそうではない。プロドラッグはまた、親化合物を超える医薬組成物において高溶解度を有し得る。プロドラッグは、酵素法および代謝の加水分解を含む、様々なメカニズムによって親薬物に変換され得る。Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. in "Design of Biopharmaceutical Properties through Prodrugs and Analogs," Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application," Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs," Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265-287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech.1998, 11, 345-365; Gaignault et al., Pract.Med. Chem. 1996, 671- 696; Asgharnejad in "Transport Processes in Pharmaceutical Systems," Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. Drug Metab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev.1992, 8, 1-38; Fleisher et al., Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher et al., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc, Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 49-59; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148-155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507を参照。
【0107】
本明細書に開示される化合物は、治療上許容可能な塩として存在し得る。本明細書に使用されるように、用語「薬学的に許容可能な塩(pharmaceutically acceptable salt)」は、本明細書に定義されるように治療上許容可能である本明細書に開示される化合物の塩または両性イオンの形態を表わす。塩は、化合物の最終的な分離および精製の間に、または適切な化合物を適切な酸または塩基と反応させることにより別々に調製され得る。
治療上許容可能な塩は、酸および塩基付加塩を含む。塩の調製および選択のより十分な議論については、"Handbook of Pharmaceutical Salts, Properties, and Use," Stah and Wermuth, Ed., (Wiley- VCH and VHCA, Zurich, 2002) および Berge et al., J. Pharm. Sci. 1977, 66, 1-19を参照。
【0108】
薬学的に許容可能な塩の調製で使用するための適切な酸は、限定されないが、酢酸、2,2-ジクロロ酢酸、アシル化されたアミノ酸、アジピン酸、アルギン酸、アスコルビン酸、L-アスパラギン酸、ベンゼンスルホン酸、安息香酸、4-アセトアミド安息香酸、ホウ酸、(+)-樟脳酸、カンファースルホン酸、(+)-(1S)-カンファー-10-スルホン酸、カプリン酸、カプロン酸、カプリル酸、珪皮酸、クエン酸、シクラミン酸、シクロヘキサンスルファミン酸、ドデシル硫酸、エタン-1,2-ジスルホン酸、エタンスルホン酸、2-ヒドロキシ-エタンスルホン酸、ギ酸、フマル酸、ガラクタル酸、ゲンチシン酸、グルコペプトン酸、D-グルコン酸、D-グルクロン酸、L-グルタミン酸、α-オキソ-グルタル酸、グリコール酸、馬尿酸、臭化水素酸、塩化水素酸、ヨウ化水素酸、(+)-L-乳酸、(±)-DL -乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、(-)-L-リンゴ酸、マロン酸、(±)-DL-マンデル酸、メタンスルホン酸、ナフタリン-2-スルホン酸、ナフタレン-1,5-ジスルホン酸、1-ヒドロキシ-2-ナフトエ酸、ニコチン酸、硝酸、オレイン酸、オロト酸、シュウ酸、パルミチン酸、パモン酸、過塩素酸、リン酸、L-ピログルタミン酸、糖酸、サリチル酸、4-アミノ-サリチル酸、セバシン酸、ステアリン酸、コハク酸、硫酸、タンニン酸、(+)-L-酒石酸、チオシアン酸、p-トルエンスルホン酸、ウンデシレン酸、および吉草酸を含む。
【0109】
薬学的に許容可能な塩の調製で使用するための適切な塩基は、限定されないが、水酸化マグネシウム、水酸化カルシウム、水酸化カリウム、水酸化亜鉛、または水酸化ナトリウムなどの無機塩基、およびL-アルギニン、ベネタミン、ベンザチン、コリン、デアノール、ジエタノールアミン、ジエチルアミン、ジメチルアミン、ジプロピルアミン、ジイソプロピルアミン、2-(ジエチルアミノ)-エタノール、エタノールアミン、エチルアミン、エチレンジアミン、イソプロピルアミン、N-メチル-グルカミン、ヒドラバミン、1H-イミダゾール、L-リジン、モルホリン、4-(2-ヒドロキシエチル)-モルホリン、メチルアミン、ピペリジン、ピペラジン、プロピルアミン、ピロリジン、1-(2-ヒドロキシエチル)-ピロリジン、ピリジン、キヌクリジン、キノリン、イソキノリン、第二級アミン、トリエタノールアミン、トリメチルアミン、トリエチルアミン、N-メチル-D-グルカミン、2-アミノ-2-(ヒドロキシメチル) - 1,3-プロパンジオール、およびトロメタミンを含む、第1級、第2級、第3級、および第4級、脂肪族および芳香族のアミンなどの有機塩基を含む。
【0110】
対象の発明の化合物が、未加工の化学物質として投与されることは可能であり得る一方で、それらを医薬組成物として提示することも可能である。従って、本明細書には、本明細書に開示される1以上の特定の化合物、またはその1以上の薬学的に許容可能な塩、プロドラッグ、または溶媒和物を、それらの薬学的に許容可能な担体および随意に1以上の他の治療成分と一緒に含む、医薬組成物が提供される。適切な製剤は、選択される投与の経路に依存する。周知の技術、担体、および賦形剤はいずれも、当該技術分野において、適切なものとして、かつ理解されるものとして使用され得る(例えば、Remington's Pharmaceutical Sciencesにおいて)。本明細書に開示される医薬組成物は、当該技術分野に公知の任意の方法で、例えば、従来の、混合、溶解、造粒、ドラゼー製法、微粒子化、乳化、カプセル化、封入、又は圧縮のプロセスの手段によって製造され得る。医薬組成物はまた、遅延放出、徐放、持効性放出、持続性放出、パルス放出、制御放出、促進放出、および即時放出、標的放出、プログラム放出を含む、修正された放出剤形、および胃貯留の剤形として製剤され得る。これらの剤形は、当業者に公知の従来の方法と技術に従って調製され得る(Remington: The Science and Practice of Pharmacy, 上記; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc., New York, NY, 2002, Vol. 126を参照)。
【0111】
最も適切な経路は、例えば、レシピエントの疾病および障害に依存し得るが、組成物は、経口、非経口(皮下、皮内、筋肉内、静脈内、関節内、および髄内を含む)、腹腔内、口腔粘膜、経皮、直腸および局所(真皮、バッカル、舌下および眼内)の投与に適している組成物を含む。組成物は、ユニット剤形で好都合に提示され得、薬学の技術分野で周知の方法のいずれかによって調製され得る。典型的に、これらの方法は、対象の発明の化合物またはその薬学的な塩、プロドラッグ、または溶媒和物(「活性成分」)を、1以上の副成分を構成する担体と関連させる工程を含む。一般に、組成物は、活性成分を、液体担体または微粉固体担体またはその両方を一律にかつ密接に関連させ、その後、必要であれば、生成物を所望の製剤に形作ることによって調製される。
【0112】
経口投与に適した本明細書に開示される化合物の製剤は、各々が活性成分の所定量を含んでいる、カプセル剤、カシェ剤または錠剤などの別々のユニットとして、パウダーまたは果粒剤として、水性液または非水性液体中の溶液または懸濁液として、または水中油型の乳濁液または油中水型の乳濁液として存在し得る。活性成分も、ボーラス、舐剤またはペーストとして存在し得る。
【0113】
経口に利用可能な医薬製剤は、錠剤、ゼラチンで作られた押し込み型カプセル剤に加え、グリセロールまたはソルビトールなどの、ゼラチンおよび可塑剤で作られた軟質密閉カプセル剤を含む。錠剤は、随意に1つ以上の副成分とともに、圧縮または成形によって作られ得る。圧縮錠剤は、結合剤、不活性希釈剤、または平滑剤、界面活性剤または分散剤と随意に混合され、パウダーまたは果粒剤などの自由流動形態で、活性成分を適切な機械において圧縮することによって調製され得る。成形錠剤は、不活性液体希釈剤で湿らされた粉末化合物の混合物を適切な機械において成形することにより作られ得る。錠剤は、随意にコーティングされ得、または印を付けられ得、錠剤中に活性成分の遅効性放出または制御放出を提供するように製剤され得る。経口投与のためのすべての製剤は、そのような投与に適した用量であるべきである。押し込み型カプセル剤は、ラクトースなどの充填剤、デンプンなどの結合剤、及び/又はタルクまたはステアリン酸マグネシウムなどの潤滑剤、および随意に安定剤との混合において、活性成分を含み得る。軟カプセル剤において、活性化合物は、脂肪油、液動パラフィン、または液体ポリエチレングリコールなどの適切な液体中で溶解または懸濁され得る。さらに、安定剤が加えられ得る。ドラゼーコアは、適切なコーティングとともに提供される。この目的のために、濃縮された糖溶液は使用され得、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、及び/又は二酸化チタン、ラッカー溶液、および適切な有機溶剤または溶媒混合液を随意に含み得る。色素またはピグメントは、同定のために、または活性化合物用量の異なる組み合わせを特徴付けるために、錠剤またはドラゼーのコーティングに加えられ得る。
【0114】
化合物は、注射、例えば、ボーラス注射または持続注入によって非経口投与のために製剤され得る。注射のための製剤は、ユニット剤形、例えば、アンプルまたは複数用量容器において、加えられた防腐剤と一緒に存在し得る。組成物は、油性または水溶性のビヒクル内で、懸濁液、溶液または乳濁液のような形態をとり得、懸濁剤、安定剤及び/又は分散剤などの製剤化剤を含み得る。製剤は、単一用量または複数用量の容器、例えば密閉されたアンプルおよびバイアルにおいて存在し得、使用の直前に、無菌の液体担体、例えば、食塩水または無菌の発熱性物質が入っていない水の付加のみを必要とする、粉末形態または冷凍乾燥(凍結乾燥)された状態で貯蔵され得る。即席の注射液および懸濁液は、以前に記載された種類の無菌の粉末剤、果粒剤および錠剤から調製され得る。
【0115】
非経口投与のための製剤は、指定されたレシピエントの血液と等張な製剤にする、酸化防止剤、緩衝液、静菌剤および溶質を含み得る活性化合物の水性および非水性(油性)の無菌の注射溶液、および懸濁剤および増粘剤を含み得る、水性および非水性の無菌の懸濁液を含む。適切な親油性溶媒またはビヒクルは、胡麻油などの脂肪油、オレイン酸エチルまたはトリグリセリドなどの合成脂肪酸エステル、またはリポソームを含む。水溶性の注射懸濁液は、例えば、ナトリウムカルボキシメチルセルロース、ソルビトール、またはデキストランなどの、懸濁液の粘性を増加させる物質を含み得る。随意に、懸濁液はまた、化合物の溶解度を増加させることで高濃縮溶液の調製を可能にする、適切な安定剤または薬剤を含み得る。
【0116】
以前に記載された製剤に加えて、化合物もデポ製剤として製剤され得る。このような長時間作用する製剤は、(例えば皮下または筋肉内の)注入または筋肉内注射によって投与され得る。したがって、例えば、化合物は、適切なポリマーまたは(例えば許容可能な油内での乳濁液のような)疎水性材料またはイオン交換樹脂とともに、またはやや難溶性の誘導体、例えば、やや難溶性の塩として製剤され得る。
【0117】
口腔内または舌下投与のために、組成物は、従来の方法で製剤された、錠剤、ロゼンジ、香錠、またはゲルの形態をとり得る。このような組成物は、蔗糖およびアラビアゴムまたはトラガカントゴムなどの香料ベースの活性成分を含み得る。
【0118】
化合物はまた、例えば、ココアバター、ポリエチレングリコール、または他のグリセリドなどの従来の坐剤基剤を含む、坐剤または停留浣腸剤などの直腸の組成物において製剤され得る。
【0119】
本明細書に開示される特定の化合物は、局所的に、すなわち非全身性の投与によって投与され得る。これは、化合物が著しく血流に入らないように、表皮または口腔への外側からの本明細書に開示される化合物の適用、および耳、目および鼻へのそのような化合物の注入を含む。対照的に、全身投与は、経口、静脈内、腹腔内および筋肉内の投与を指す。
【0120】
局所投与に適した製剤は、ゲル剤、リニメント剤、ローション剤、クリーム剤、軟膏剤またはペースト剤などの、皮膚を通って炎症の部位に浸透させることに適した液体または半液体の製剤、および目、耳または鼻への投与に適した滴下剤を含む。
【0121】
吸入による投与のために、化合物は、注入器、噴霧器で加圧されたパック、またはエアロゾルスプレー送達するという他の簡便な手段から送達され得る。加圧されたパックは、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適切なガスなどの適切な噴霧剤を含み得る。加圧されたエアロゾルの場合、投与ユニットは、測定された量を送達するための弁を提供することによって決定され得る。代わりに、吸入またはガス注入による投与のために、本発明による化合物は、乾燥粉末組成物、例えば化合物の粉末混合の形態、およびラクトースまたはデンプンなどの適切な粉末基剤の形態をとり得る。粉末組成物は、ユニット剤形で、例えば、カプセル剤、カートリッジ、ゼラチンまたはブリスターパックにおいて存在し得、それらから粉末剤は、吸入器または注入器を用いて投与され得る。
【0122】
好ましいユニット投与の製剤は、本明細書の下記に詳述されるような活性成分の有効量、または活性成分のその適切な分画(fraction)を含んでいる製剤である。
【0123】
化合物は、1日当たり0.1〜500mg/kgの用量で経口にまたは注射によって投与され得る。成人のヒトのための用量範囲は、一般に、5mg〜2g/日までである。別々のユニットで提供される錠剤または他の提示の形態は、そのような投与で有効であるか、または複数回の同じもの、例えば、5mg〜500mgまで、通常約10mg〜200mgまでを含んでいるユニットとして有効である、1以上の化合物の量を、適宜に含み得る。
【0124】
単一の剤形をもたらすために担体物質と組み合わせられ得る活性成分の量は、処置される宿主および投与の特定の形式に依存して変化する。
【0125】
化合物は、様々な形式で、例えば、経口、局所、または注射によって投与され得る。患者に投与される化合物の正確な量は、担当する医師の責任となる。任意の特定の患者のための特定の用量レベルは、使用される特定の化合物の活性、年齢、体重、健康状態、性別、食事、投与の時間、投与の経路、分泌の速度、複合薬、処置されている正確な障害、および処置されている障害の重症度を含む、様々な要因に依存する。また、投与の経路は、障害およびその重症度に依存して変化し得る。
【0126】
患者の症状が改善しない場合、医者の判断に基づき、化合物の投与は、長期にわたって、すなわち、患者の障害の症状を回復させる、またはそうでなくとも抑制または制限するために、患者の生涯を通した期間を含む、長期間の間投与され得る。
【0127】
患者の状態が改善する場合において、医者の判断に基づいて、化合物の投与は、継続的に与えられ得る、または一定時間の間一時的に停止され得る(即ち、「休薬期間」)。
【0128】
一旦患者の症状が改善すると、必要ならば維持量が投与される。続いて、投与の量または頻度、またはその両方は、改善された障害が持続されるレベルまで、症状の作用として減らされる。しかしながら、患者は、症状が再発すると、長期的に間欠処置が必要となり得る。
【0129】
本明細書には、治療上有効な量の本明細書に開示されるような化合物またはその薬学的に許容可能な塩、溶媒和物、またはプロドラッグを、そのような障害を有するまたは有する疑いのある被験体に投与する工程を含む、ヤヌスキナーゼ3媒介の障害を処置する方法が開示される。
【0130】
ヤヌスキナーゼ3媒介の障害は、限定されないが、腎移植拒絶反応、関節リウマチ、乾癬、炎症性腸疾患、ドライアイ症候群、喘息、移植拒絶反応、臓器移植、異種移植、狼瘡、多発性硬化症、I型糖尿病、糖尿病からの合併症、癌、アトピー性皮膚炎、自己免疫性甲状腺障害、潰瘍性大腸炎、クローン病、アルツハイマー病、白血病、及び/又は、ヤヌスキナーゼ3インヒビターを投与することによって減少され、緩和され、または予防され得るあらゆる障害を含む。
【0131】
特定の実施形態において、ヤヌスキナーゼ3媒介の障害を処置する方法は、治療上有効な量の本明細書に開示されるような化合物、またはその薬学的に許容可能な塩、溶媒和物、またはそのプロドラッグを、被験体に投与する工程を含み、(1)化合物またはその代謝物質の血漿レベルの減少した個対間変動、(2)化合物の増加した平均血漿レベル、投与ユニットごとの化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、(3)被験体における、少なくとも1つのシトクロムP450またはモノアミンオキシダーゼアイソフォームの減少した阻害、及び/又はそれによる減少した代謝、(4)被験体における、少なくとも1つの多形的に発現されたシトクロムP450アイソフォームを介した減少した代謝、(5)少なくとも1つの統計的に有意に改善された障害抑制及び/又は障害根絶のエンドポイント、(6)障害の処置の間の改善された臨床効果、(7)主要な臨床的有用性としての異常な消化管または肝臓のパラメーターの再発の予防、またはその衰弱また出現の遅延、(8)対応する非同位体的に濃縮された化合物に比べて、任意の診断上の肝胆道機能エンドポイントの悪化の低減または除去、に影響を与える。
【0132】
特定の実施形態において、本明細書に開示されるような化合物、またはその代謝物質の血漿レベル中の個対間変動は減少され、本明細書に開示されるような化合物の平均血漿レベルは増加され、本明細書に開示されるような化合物の代謝物質の平均血漿レベルは減少され、本明細書に開示されるような化合物によるシトクロムP450またはモノアミンオキシダーゼアイソフォームの阻害は減少され、または、少なくとも1つの多形的に発現されたシトクロムP450アイソフォームによる本明細書に開示されるような化合物の代謝は、対応する非同位体的に濃縮された化合物に比べて、約5%以上、約10%以上、約20%以上、約30%以上、約40%以上、または約50%以上減少される。
【0133】
本明細書に開示されるような化合物、またはその代謝物質の血漿レベルは、Li et al. Rapid Communications in Mass Spectrometry 2005, 19, 1943-1950;Paniagua et al., Therapeutic Drug Monitoring 2005, 27(5), 608-616;Lawendy et al., J Clin Pharmacol 2009, 49, 423-429;およびその中で言及される任意の引用およびそれで作られたその中のなされた任意の修正に記載される方法を使用して測定され得る。
【0134】
哺乳類の被験体におけるシトクロムP450アイソフォームの例は、限定されないが、CYP1A1、CYP1A2、CYP1B1、CYP2A6、CYP2A13、CYP2B6、CYP2C8、CYP2C9、CYP2C18、CYP2C19、CYP2D6、CYP2E1、CYP2G1、CYP2J2、CYP2R1、CYP2S1、CYP3A4、CYP3A5、CYP3A5P1、CYP3A5P2、CYP3A7、CYP4A11、CYP4B1、CYP4F2、CYP4F3、CYP4F8、CYP4F11、CYP4F12、CYP4X1、CYP4Z1、CYP5A1、CYP7A1、CYP7B1、CYP8A1、CYP8B1、CYP11A1、CYP11B1、CYP11B2、CYP17、CYP19、CYP21、CYP24、CYP26A1、CYP26B1、CYP27A1、CYP27B1、CYP39、CYP46、およびCYP51を含む。
【0135】
哺乳類の被験体におけるモノアミンオキシダーゼアイソフォームの例は、限定されないが、MAOA、およびMAOBを含む。
【0136】
シトクロムP450アイソフォームの阻害は、Ko et al., British Journal of Clinical Pharmacology 2000, 49, 343-351の方法によって測定される。MAOAアイソフォームの阻害は、Weyler et al., J.Biol Chem. 1985, 260, 13199-13207の方法によって測定される。MAOBアイソフォームの阻害は、Uebelhack et al., Pharmacopsychiatry, 1998, 31, 187-192の方法によって測定される。
【0137】
哺乳類の被験体における多形的に発現されたシトクロムP450アイソフォームの例は、限定されないが、CYP2C8、CYP2C9、CYP2C19、およびCYP2D6を含む。
【0138】
肝ミクロソーム、シトクロムP450アイソフォーム、およびモノアミンオキシダーゼアイソフォームの代謝活性は、本明細書に記載される方法によって測定される。
【0139】
診断上の肝胆道機能エンドポイントの例は、限定されないが、アラニンアミノトランスフェラーゼ(「ALT」)、血清グルタミン酸ピルビン酸トランスアミナーゼ(「SGPT」)、アスパラギン酸アミノトランスフェラーゼ(「AST」または「SGOT」)、ALT/AST比、血清アルドラーゼ、アルカリフォスファターゼ(「ALP」)、アンモニアレベル、ビリルビン、ガンマグルタミントランスペプチターゼ(「GGTP」、「γ-GTP」、または「GGT」)、ロイシンアミノペプチダーゼ(「LAP」)、肝生検、肝臓超音波検査、肝臓核スキャン、5'-ヌクレオチダーゼ、および血液タンパク質を含む。肝胆道エンドポイントは、「Diagnostic and Laboratory Test Reference」、4th edition, Mosby, 1999で与えられるような定められた正常レベルと比較される。これらのアッセイは、標準プロトコルに従って公認の研究所によって実行される。
【0140】
ヒトの処置のために有用であることに加えて、本明細書に開示される特定の化合物および製剤は、哺乳動物、齧歯類などを含む、コンパニオンアニマル、エキゾチックアニマルおよび家畜の獣医学的処置にも有用であり得る。より好ましい動物は、馬、犬、および猫を含む。
【0141】
併用療法
本明細書に開示される化合物はまた、ヤヌスキナーゼ3媒介の障害の処置に有用な他の薬剤と組み合わされ得る、または組み合わせて使用され得る。または、ほんの一例として、本明細書に記載される化合物の1つの治療効果は、アジュバントの投与によって高められ得る(すなわち、アジュバント自体は最小の治療的有用性を有し得るだけであるが、別の治療剤と併用することで、患者に対する全体的な治療的有用性が高められる)。
【0142】
そのような他の薬剤、アジュバント、または薬物は、経路によって、およびそのために一般に使用される量で、本明細書に開示されるような化合物と同時にまたは連続して投与され得る。本明細書に開示されるような化合物が1つ以上の他の薬物と同時に使用されるとき、本明細書に開示される化合物に加えてこのような他の薬物を含んでいる医薬組成物は、利用され得るが、必要ではない。
【0143】
特定の実施形態において、本明細書に開示される化合物は、1つ以上のH+,K+ATPアーゼインヒビター、消化管運動性(alimentary motility)モジュレーター、非ステロイド性の抗炎症剤、アニリド鎮痛剤、抗リウマチ剤、グルココルチコイド、および免疫抑制剤と組み合わされ得る。
【0144】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、エソメプラゾール 、ランソプラゾール、オメプラゾール、パントプラゾール 、ラベプラゾール、およびテナトプラゾールを含む、1つ以上のH+,K+ATPアーゼインヒビターと組み合わされ得る。
【0145】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、ソラベグロン、テガセロッド、アロセトロン、シランセトロン、ドンペリドン、メトクロプラミド、イトプリド、シサプリド、レンザプリド、ザコプリド、オクトレオチド、ナロキソン、エリスロマイシン、およびベタネコールを含む、1つ以上の消化管運動性モジュレーターと組み合わされ得る。
【0146】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アセクロフェナク、アセメタシン、アモキシプリン、アスピリン、アザプロパゾン、ベノリラート、ブロムフェナク、カルプロフェン、セレコキシブ、コリンサリチル酸マグネシウム、ジクロフェナク、ジフルニサル、エトドラク、エトリコキシブ(etoracoxib)、ファイスラミン、フェンブフェン(fenbuten)、フェノプロフェン、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、ロルノキシカム、ロキソプロフェン、ルミラコキシブ、メロキシカム、メクロフェナム酸、メフェナム酸、メロキシカム、メタミゾール、サリチル酸メチル、サリチル酸マグネシウム、ナブメトン、ナプロキセン、ニメスリド、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピロキシカム、サリチルサリチル酸塩、スリンダク、スルフィンピラゾン(sulfinprazone)、スプロフェン、テノキシカム、チアプロフェン酸、およびトルメチンを含む、1つ以上の非ステロイド性の抗炎症剤と組み合わされ得る。
【0147】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アセトアミノフェンおよびフェナセチンを含む、1つ以上のアニリド鎮痛剤と組み合わされ得る。
【0148】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、アザチオプリン、シクロスポリン A、D-ペニシラミン、金塩、水酸化クロロキン、レフルノミド、メトトレキサート、ミノサイクリン、スルファサラジン、シクロホスファミド、エタネルセプト、インフリキシマブ、アダリムマブ、アナキンラ、リツキシマブ、およびアバタセプトを含む、1つ以上の寛解導入抗リウマチ剤と組み合わされ得る。
【0149】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、ベクロメタゾン、ブデソニド、フルニソリド、ベータメタゾン、フルチカゾン、トリアムシノロン、モメタゾン、シクレソニド、ヒドロコルチゾン、酢酸コルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニソロン、およびデキサメタゾンを含む、1つ以上のグルココルチコイドと組み合わされ得る。
【0150】
特定の実施形態において、本明細書に開示される化合物は、限定されないが、フィンゴリモド、シクロスポリン A、アザチオプリン、デキサメタゾン、タクロリムス、シロリムス、ピメクロリムス、ミコフェノール酸塩、エベロリムス、バシリキシマブ、ダクリズマブ、抗胸腺細胞グロブリン、抗リンパ球グロブリン、およびCTLA4IgGを含む、1つ以上の免疫抑制剤と組み合わされ得る。
【0151】
本明細書に開示される化合物はまた、限定されないが、アトモキセチンなどのノルエピネフリン再取込みインヒビター(NRI)、メチルフェニデートなどのドーパミン再取込みインヒビター(DARI)、ミルナシプランなどのセロトニンノルエピネフリン再取込みインヒビター(SNRI)、ジアゼパム(diazepham)などの鎮静剤、ブプロピオンなどのノルエピネフリンドーパミン再取込みインヒビター(NDRI)、ベンラファキシンなどの、セロトニンノルエピネフリンドーパミン再取込みインヒビター(SNDRI)、セレギリンなどのモノアミンオキシダーゼインヒビター、視床下部のリン脂質、フォスフォラミドンなどのエンドセリン変換酵素(ECE)インヒビター、トラマドールなどのオピオイド、イフェトロバンなどのトロンボキサン受容体アンタゴニスト、カリウムチャネル開口薬、ヒルジンなどのトロンビンインヒビター、視床下部のリン脂質、PDGF活性モジュレーターなどの成長因子インヒビター、血小板活性化因子(PAF)アンタゴニスト、GPIIb/IIIa遮断薬(例えば、アブシキシマブ(abdximab)、エプチフィバチドおよびチロフィバン)、P2Y(AC)アンタゴニスト(例えば、クロピドグレル、チクロピジンおよびCS-747)、およびアスピリンなどの抗血小板剤、ワルファリンなどの抗凝血剤、エノキサパリンなどの低分子ヘパリン、Factor VIIa InhibitorsおよびFactor Xa Inhibitors、レニンインヒビター、中性エンドペプチダーゼ(NEP)インヒビター、オマパトリラトおよびゲモパトリアトなどのバソペプチダーゼ(vasopepsidase)インヒビター(2重NEP-ACEインヒビター)、プラバスタチン、ロバスタチン、アトルバスタチン、シンバスタチン、NK-104(別名、イタバスタチン、ニスバスタチン(nisvastatin)、またはニスバスタチン(nisbastatin))、および(ロスバスタチン、またはアトルバスタチン(atavastatin)またはビサスタチンとしても知られる)ZD-4522などのHMG CoAリダクターゼインヒビター、スクアレン合成酵素インヒビター、フィブラート、クエストランなどの胆汁酸捕捉剤(bile acid sequestrants)、ナイアシン、ACATインヒビターなどの抗アテローム性動脈硬化剤、MTPインヒビター、ベシル酸アムロジピンなどのカルシウム拮抗薬、カリウムチャンネル活性化因子、アルファムスカリン性薬物、カルベジロールおよびメトプロロールなどのベータムスカリン性薬物、抗不整脈薬、クロロサイアザイド、ヒドロクロロチアジド(hydrochiorothiazide)、フルメサイアザイド、ヒドロフルメチアジド、ベンドロフルメサイアザイド、メチルクロロチアジド、トリクロロメチアジド(trichioromethiazide)、ポリチアジド、ベンゾチアジド(benzothlazide)、エタクリン酸、チクリナフェン(tricrynafen)、クロルサリドン、フロセミド(furosenilde)、ムゾリミン(musolimine)、ブメタニド、トリアムテレン、アミロライド、およびスピロノラクトンなどの利尿剤、組織プラスミノーゲン活性化因子(tPA)、組み換え型tPA、ストレプトキナーゼ、ウロキナーゼ、プロウロキナーゼ、およびアニソイル化プラスミノゲンストレプトキナーゼ活性化因子複合体(APSAC)などの血栓溶解剤、ビグアニド(例えばメトホルミン)、グルコシダーゼインヒビター(例えば、アカルボース)、インシュリン、メグリチニド(例えば、レパグリニド)、スルホニル尿素誘導体(例えば、グリメピリド、グリブライド、およびグリピジド)、チアゾリジンジオン(thiozolidinediones)(例えばトログリタゾン、ロシグリタゾンおよびピオグリタゾン)、およびPPARガンマアゴニストなどの抗糖尿病薬、スピロノラクトンおよびエプレレノンなどの無機質コルチコイド受容体アンタゴニスト、成長ホルモン分泌促進因子、aP2インヒビター、PDE IIIインヒビター(例えば、シロスタゾール)およびPDE Vインヒビター(例えば、シルデナフィル、タダラフィル、バルデナフィル)などのホスホジエステラーゼインヒビター、タンパク質チロシンキナーゼインヒビター、抗炎症薬、メトトレキサート、FK506(タクロリムス、プログラフ)、ミコフェノール酸モフェチルなどの細胞増殖阻害剤、化学療法剤、抗癌剤および細胞毒性薬剤(例えば、ナイトロジェンマスタード、スルホン酸アルキル、ニトロソウレア、エチレンイミン、およびトリアゼンなどのアルキル化剤)、葉酸アンタゴニスト、プリンアナログ、およびピリジンアナログなどの代謝拮抗剤、アントラサイクリン、ブレオマイシン、マイトマイシン、ダクチノマイシン、およびプリカマイシンなどの抗生物質、L-アスパラギナーゼなどの酵素、ファルネシルタンパク質トランスフェラーゼインヒビター、エストロゲン/抗エストロゲン、アントロゲン/抗アンドロゲン、プロゲスチン、および黄体形成ホルモン放出ホルモンアンタゴニスト、および酢酸オクトレオチドなどのホルモン剤、エクテイナシジンなどの微小管破壊剤(microtubule-disruptor agents)、パシタキセル、ドセタキセル、およびエポチロン A-Fなどの微小管安定剤、ビンカアルカロイド、エピポドフィロトキシン、およびタキサンなどの植物由来産物、トポイソメラーゼインヒビター、プレニルタンパク質トランスフェラーゼインヒビター、シクロスポリン、プレドニゾンおよびデキサメタゾンなどのステロイド、アザチオプリン(azathiprine)およびシクロホスファミドなどの細胞毒、テニダップなどのTNFアルファインヒビター、エタネルセプト、ラパマイシン、およびレフルノミド(leflunimide)などの抗TNF抗体または可溶性のTNF受容体、およびセレコキシブおよびロフェコキシブなどのシクロオキシゲナーゼ-2(COX-2)インヒビター、およびヒドロキシ尿素、プロカルバジン、ミトタン、ヘキサメチルメラミン、金化合物、シスプラチン、サトラプラチン、およびカルボプラチンなどのプラチナ配位化合物などの種々の薬剤を含む、他の種類の化合物と組み合わせて投与され得る。
【0152】
したがって、別の態様において、特定の実施形態は、処置を必要とするヒトまたは動物の被験体においてヤヌスキナーゼ3媒介の障害を処置するための方法を提供し、当該処置は、当該技術分野に公知の前記障害の処置のための少なくとも1つの追加の薬剤と組み合わせて、被験体において前記障害を低減または予防するために、有効な本明細書に開示される化合物の量を前記被験体に投与する工程を含む。関連する態様において、特定の実施形態は、ヤヌスキナーゼ3媒介の障害の処置のために少なくとも1以上の追加の薬剤と組み合わせた、本明細書に開示される少なくとも1つの化合物を含む、治療上の組成物を提供する。
【0153】
化合物を調製するための一般的な合成方法
同位体水素は、重水素化の試薬を使用する合成技術によって、本明細書に開示されるような化合物へ導入され得、それによって、取り込み速度は予め決定され、及び/又は交換技術によって、取り込み速度は平衡状態によって決定され、反応条件に依存して非常に変化しやすくなり得る。トリチウムまたは重水素が、公知の同位体含有量のトリチウム化または重水素化の試薬によって直接および特に導入される場合の合成技術は、高いトリチウムまたは重水素存在比をもたらし得るが、必要とされる化学によって制限され得る。一方で、交換技術は、しばしば分子上の多くの部位に分散されている同位体による、より少ないトリチウムまたは重水素の取り込みをもたらし得る。
【0154】
本明細書に開示されるような化合物は、当業者に公知の方法およびその日常的な変更、及び/又は本明細書の実施例のセクションに記載される手順と同様の次の手順およびその日常的な変更、及び/又はそれらの全体において本明細書に組み込まれる、Jiang et al., J. Med. Chem. 2008, 51, 8012-8018;米国特許第6,627,754号;WO 2003/048162;WO 2007/012953に見られる手順、およびそれらに言及される引用およびそれらの日常的な変更によって調製され得る。本明細書に開示されるような化合物はまた、任意の次の模式図およびその日常的な変更において示されるように調製され得る。
【0155】
次の模式図は、本発明を実行するために使用され得る。
水素として示される任意の位置は、重水素と随意に置換され得る。
【0156】
【化17】

【0157】
化合物1は、トルエンなどの適切な溶媒中で、塩化ベンジルと反応され、化合物2を与える。化合物2は、エタノールなどの適切な溶媒中で、水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物3を与える。化合物3は、エタノールなどの適切な溶媒中で、ビス(1,5-シクロオクタジエン)ロジウム(I)トリフルオロメタンスルフォナートと(R)-(-)-1-[(S)-2-(ジフェニルホスフィノ)フェロセニル]エチル-ジ-t-ブチルホスフィンの組み合わせなどの、適切なキラルのロジウム触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物4を与える。化合物4は、増加したエナンチオマーの純度を与えるためにL-ジ-p-トルオイル酒石酸などの適切なキラル酸とともに随意に結晶化され得る。化合物4は、水などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物5と反応され、化合物6を与える。化合物6は、水などの適切な溶媒中で、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、ジクロロメタンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物8と反応され、式Iの化合物9を与える。
【0158】
重水素は、適切な重水素化の中間物質を使用することによって、模式図Iに示されるような合成手順に従って、人工的に異なる位置に組み込まれ得る。例えば、R3、R5、R9およびR11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物1が使用され得る。R4、R6、およびR10で重水素を導入するために、重水素化ホウ素ナトリウムおよびd5エタノールが使用され得る。R7-R8およびR14-R16の1つ以上の位置で重水素を導入するために、重水素ガスが使用され得る。R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R1-R2の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物8が使用され得る。
【0159】
重水素は、プロトン-重水素平衡交換を介して、ヘテロ環式 N-Hなどの交換性プロトンを有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0160】
【化18】

【0161】
化合物10は、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、化合物11と反応され、化合物12を与える。化合物12は、L-ジ-p-トルオイル酒石酸などの適切なキラル酸とともに結晶化され、化合物4を与える。化合物4は、水などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物5と反応され、化合物6を与える。化合物6は、水などの適切な溶媒中で、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、ジクロロメタンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物8と反応され、式Iの化合物9を与える。
【0162】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R7およびR9-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物10が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R1-R2の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物8が使用され得る。
【0163】
重水素は、プロトン-重水素平衡交換(proton-deuterium equilibrium exchange)を介して、ヘテロ環式 N-Hなどの交換性プロトン(an exchangeable proton)を有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0164】
【化19】

【0165】
化合物13は、テトラヒドロフランなどの適切な溶媒中で、ナトリウムヘキサメチルジシラジドなどの適切な塩基の存在下において、炭酸ジメチルなどの適切なアミン保護試薬と反応され、化合物1を与える。化合物1は、高温度で、トルエンなどの適切な溶媒中で、臭化ベンジルと反応され、化合物14を与える。化合物14は、エタノールなどの適切な溶媒中で、水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物3を与える。化合物3は、メタノールなどの適切な溶媒中で、酸化白金などの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物15を与える。化合物15は、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムなどの適切な還元剤と反応され、化合物12を与える。
【0166】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3、R6、R9、およびR11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物13が使用され得る。R4-R5およびR10で重水素を導入するために、重水素化ホウ素ナトリウムが使用され得る。R7-R8の1つ以上の位置で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。
【0167】
【化20】

【0168】
化合物16は、高温度で、トルエンなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下において、ベンジルアルコールと反応され、化合物17を与える。化合物17は、高温度で、トルエンなどの適切な溶媒中で、カリウム tert-ブトキシドなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物19を与える。化合物19は、メタノールなどの適切な溶媒中で、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物10を与える。化合物10は、ナトリウムメトキシドなどの適切な塩基の存在下において、化合物11と反応され、イミン中間物質を与え、その後、テトラヒドロフランなどの適切な溶媒中で、酢酸などの適切な酸の存在下において、トリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤と反応され、化合物12を与える。
【0169】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IVに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R6およびR9-R10の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物16が使用され得る。R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。R7で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。R14-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物11が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。
【0170】
【化21】

【0171】
化合物20は、アセトンと水の適切な混合物などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基の存在下において、塩化トルエンスルホニルと反応され、化合物21を与える。化合物21は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物4と反応され、化合物22を与える。化合物22は、水などの適切な溶媒中で、酸化マグネシウムなどの適切な塩基の存在下、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物23を与える。
【0172】
重水素は、適切な重水素化の中間物質を使用することにより、模式図Vに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えばR17-R18の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物20が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物4が使用され得る。R20で重水素を導入するために、重水素ガス及び/又は酸化重水素が使用され得る。
【0173】
【化22】

【0174】
化合物24は、約120℃で、約16時間、d4-メタノールおよびd3-ナトリウムメトキシドと反応され、化合物25を与える。化合物24は、約160℃で、約16時間、d4-メタノールおよびd3-ナトリウムメトキシドと反応され、化合物26を与える。
【0175】
【化23】

【0176】
化合物5は、アセトンと水の適切な混合物などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基の存在下において、塩化トルエンスルホニルと反応され、化合物27を与える。化合物27は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物12と反応され、化合物23を与える。
化合物23は、水などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物28を与える。化合物28は、ヘキサン(0.1%のトリエチルアミンを含む)/イソプロパノールなどの適切な溶離剤を使用して、Chiralpak IAなどの適切なカラムで、キラルクロマトグラフィーを使用して分離され、化合物6を与える。化合物6は、イソプロパノールと水の組み合わせなどの適切な溶媒中で、酢酸などの適切な酸の存在下、炭素上のパラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物7を与える。化合物7は、トルエンなどの適切な溶媒中で、トリエチルアミンなどの適切な塩基の存在下において、化合物29と反応され、化合物9を与える。
【0177】
重水素は、適切な重水素化の中間物質を使用することにより、模式図VIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R17-R18およびR20の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物5が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物12が使用され得る。R1-R2で重水素を導入するために、対応する重水素置換を有する化合物29が使用され得る。
【0178】
重水素は、プロトン-重水素平衡交換を介して、ヘテロ環式 N-Hなどの交換性プロトンを有する様々な位置へ組み込まれ得る。例えば、R19で重水素を導入するために、このプロトンは、当該技術分野に公知のプロトン-重水素の交換方法を介して、選択的にまたは非選択的に重水素と置換され得る。
【0179】
【化24】

【0180】
化合物21は、テトラヒドロフランと水の適切な混合物などの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物12と反応され、化合物30を与える。化合物30は、メタノールと水の組み合わせなどの適切な溶媒中で、ジ-tert-ブチル重炭酸塩などの適切な保護剤の存在下、炭素上の水酸化パラジウムなどの適切な触媒の存在下において、水素ガスなどの適切な還元剤と反応され、化合物31を与える。化合物31は、水などの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物32を与える。化合物32は、ヘキサン(0.1%のトリエチルアミンを含む)/イソプロパノールなどの適切な溶離剤を使用して、Chiralpak IAなどの適切なカラムで、キラルクロマトグラフィーを使用して分離され、化合物33を与える。化合物33は、1,4-ジオキサンなどの適切な溶媒中で、塩化水素などの適切な酸と反応され、化合物7を与える。
【0181】
重水素は、適切な重水素化の中間物質を使用することにより、模式図VIIIに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R17-R18の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物21が使用され得る。R3-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物12が使用され得る。R20で重水素を導入するために、重水素ガス及び/又はd4-メタノールが使用され得る。
【0182】
【化25】

【0183】
化合物16は、メタノールなどの適切な溶媒中で、酢酸などの適切な酸の存在下において、水素ガスなどの適切な還元剤、および炭素上のパラジウムなどの適切な触媒と反応され、化合物34を与える。化合物34は、テトラヒドロフランなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、ジ-tert-ブチル重炭酸塩などの適切な保護剤と反応され、化合物35を与える。化合物35は、高温度で、テトラヒドロフランなどの適切な溶媒中で、水素化ナトリウムなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物36を与える。化合物36は、水などの適切な溶媒中で、塩化水素酸などの適切な酸と反応され、化合物37を与える。化合物37は、トリエチルアミンなどの適切な塩基の存在下において、臭化ベンジルなどの適切な保護剤と反応され、化合物10を与える。
【0184】
重水素は、適切な重水素化の中間物質を使用することにより、模式図IXに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R3-R6およびR9-R10の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物16が使用され得る。R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。R7で重水素を導入するために、塩化重水素及び/又は酸化重水素が使用され得る。
【0185】
【化26】

【0186】
化合物38は、ジイソプロピルエチルアミンなどの適切な塩基の存在下において、化合物39と反応され、化合物40を与える。化合物40は、水とテトラヒドロフランの組み合わせなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物41と反応され、化合物42を与える。化合物42は、エタノールと1,4-ジオキサンの組み合わせなどの適切な溶媒中で、ナトリウムエトキシドなどの適切な塩基と反応され、化合物43を与える。化合物43は、高温度で、ベンジルアルコールと反応され、化合物44を与える。化合物44は、高温度で、アセトンなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、化合物18(ここでXは、ヨウ素などの適切な脱離基である)と反応され、化合物45を与える。化合物45は、酢酸エチルなどの適切な溶媒中で、水素などの適切な還元剤、および炭素上のパラジウムなどの適切な触媒と反応され、化合物46を与える。化合物46は、メタノールなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下において、オルソギ酸メチルエステルなどの適切な脱水剤の薬剤と反応され、化合物47を与える。化合物47は、水とメタノールの組み合わせなどの適切な溶媒中で、水酸化ナトリウムなどの適切な塩基と反応され、化合物48を与える。化合物48は、水などの適切な溶媒中で、塩化水素酸などの適切な酸と反応され、化合物49を与える。化合物49は、テトラヒドロフランなどの適切な溶媒中で、酢酸などの適切な酸、およびトリアセトキシ水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、化合物11と反応され、化合物50を与える。化合物50は、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムなどの適切な還元剤と反応され、化合物12を与える。
【0187】
重水素は、適切な重水素化の中間物質を使用することにより、模式図Xに示されるような合成手順に従って、人工的に異なる位置へ組み込まれ得る。例えば、R11-R13の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。
R5-R7で重水素を導入するために、d1-水酸化ナトリウム、酸化重水素、及び/又はd4-メタノールが使用され得る。R9-R10で重水素を導入するために、塩化重水素及び/又は酸化重水素が使用され得る。R8で重水素を導入するために、トリアセトキシ重水素化ホウ素ナトリウムが使用され得る。R3-R4で重水素を導入するために、重水素化リチウムアルミニウムが使用され得る。R14-R16の1つ以上の位置で重水素を導入するために、対応する重水素置換を有する化合物18が使用され得る。
【0188】
本発明は、以下の実施例によってさらに示される。すべてのIUPAC名は、CambridgeSoft's ChemDraw 10.0を使用して作り出された。
【0189】
<実施例1>
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550クエン酸塩)
【0190】
【化27】

【0191】
<工程1>
【0192】
【化28】

【0193】
4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン:約0℃で、水酸化ナトリウム(水中2mol/L、8mL、1.20等量)を、アセトン(20mL)中の4-メチルベンゼン-1-塩化スルホニル(2.7g、13.9mmol、1.10等量)および4-クロロ-7H-ピロロ[2,3-d]ピリミジン(2g、12.8mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約6時間、約20℃で撹拌した。固体をろ過によって集め、アセトン/水で洗浄し、白色固体として表題生成物を得た(4.0g;収量=97%)。1H NMR (300 MHz, CDCl3) δ: 8.78 (s, 1H), 8.11 (d, J = 8.4 Hz, 2H), 7.80 (d, J = 4.2 Hz, 1H), 7.34 (d, J = 8.4 Hz, 2H), 7.73 (d, J = 4.2 Hz, 1H), 2.42 (s, 3H)。LC-MS: m/z = 308/310 (M+H)+。
【0194】
<工程2>
【0195】
【化29】

【0196】
メチル4-メチルピリジン-3-イルカルバマート:約0℃で、カリウム tert-ブトキシド(47g、420mmol、3.00等量)をいくつかのバッチで、テトラヒドロフラン(400mL)中の4-メチルピリジン-3-アミン(15g、139mmol、1.00等量)の溶液に加えた。約30分間溶液を撹拌した後、その後、炭酸ジメチル(18.8g、209mmol、1.50等量)を加えた。溶液を約16時間、周囲温度で撹拌し、その後、水(100mL)を加えた。酢酸エチル(3×200mL)での標準の抽出後処理(extractive workup)の後で、粗製生成物を酢酸エチル/石油エーテル(1:1)からの再結晶化によって精製し、淡黄色固体として表題生成物を得た(17g;収量=74%)。LC-MS: m/z = 167(M+H)+。
【0197】
<工程3>
【0198】
【化30】

【0199】
1-ベンジル-3-メトキシカルボニルアミノ-4-メチル-臭化ピリジニウム(pyridinum bromide):1-(ブロモメチル)ベンゼン(19g、111mmol、1.10等量)を、トルエン(500mL)中のメチル4-メチルピリジン-3-イルカルバマート(17g、102mmol、1.00等量)の溶液に加えた。溶液を約16時間、約110℃で撹拌した。周囲温度にまで冷却した後、固体をろ過によって集め、トルエンで洗浄し、淡褐色固体として表題生成物を得た(35g;収量=97%)。
【0200】
<工程4>
【0201】
【化31】

【0202】
メチル1-ベンジル-4-メチル-1,2,5,6-テトラヒドロピリジン-3-イルカルバマート:水素化ホウ素ナトリウム(4.4g、116mmol、1.20等量)をいくつかのバッチで、メタノール(300mL)中の1-ベンジル-3-メトキシカルボニルアミノ-4-メチル-臭化ピリジニウム(35g、104mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、周囲温度で撹拌し、その後水(200mL)を加えた。真空内で混合物を濃縮した後に、エーテル(3×200mL)での標準の抽出後処理により粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(20:1))によって精製し、黄色固体として表題生成物を得た(18g;収量=66%)。LC-MS: m/z = 261 (M+H)+。
【0203】
<工程5>
【0204】
【化32】

【0205】
メチル1-ベンジル-4-メチルピペリジン-3-イル-カルバマート:酸化白金(1.0g、4.41mmol、0.11等量)を、メタノール(200mL)中のメチル1-ベンジル-4-メチル-1,2,5,6-テトラヒドロピリジン-3-イルカルバマート(10g、38.46mmol、1.00等量)の溶液に加えた。水素ガスを導入した後に、混合物を約16時間、約60℃で撹拌し、その後ろ過した。結果として生じる濾液を濃縮して粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(酢酸エチル/石油(1:2))によって精製し、黄色固体(7g;収量=66%)として表題生成物を得た。LC-MS: m/z = 263 (M+H)+。
【0206】
<工程6>
【0207】
【化33】

【0208】
(1-ベンジル-4-メチル-ピペリジン-3-イル)-メチル-アミン:約0℃で、水素化アルミニウムリチウム(3.6g、92.8mmol、5.00等量)をいくつかのバッチで、テトラヒドロフラン(100mL)中のメチル1-ベンジル-4-メチルピペリジン-3-イル-カルバマート(5.0g、18.1mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、還流にて加熱し、その後水(10mL)を加えた。混合物をろ過し、結果として生じる濾液を真空内で濃縮し、粗製の残留物を得て、それをその後、シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(20;1))によって精製して、黄色の油として表題生成物を得た(3.0g;収量=72%)。1H NMR (300 MHz, CDCl3) δ: 7.20-7.38 (m, 5H), 3.58 (d, J = 13.2 Hz, 1H), 3.48 (d, J = 13.2 Hz, 1H), 2.60-2.82 (m, 2H), 2.46 (br s, 1H), 2.34 (s, 3H), 2.02-2.22 (m, 2H), 2.64-2.84 (m, 2H), 1.45-1.58 (m, 2H), 0.97 (d, J = 6.9 Hz, 3H)。LC-MS: m/z = 219 (M+H)+。
【0209】
<工程7>
【0210】
【化34】

【0211】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン(2g、6.37mmol、2.00等量)および炭酸カリウム(2.7g、19.4mmol、6.00等量)を、水(30mL)中の(1-ベンジル-4-メチル-ピペリジン-3-イル)-メチル-アミン(700mg、2.89mmol、1.00等量)の溶液に加えた。溶液を約16時間、約100℃で撹拌し、その後周囲温度にまで冷却した。酢酸エチル(3×100mL)での標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/鉱油(1:1))によって精製し、淡黄色固体として表題生成物を得た(1.5g;収量=96%)。1H NMR (300 MHz, CDCl3) δ: 8.36 (s, 1H), 8.08 (d, J = 8.4 Hz, 2H), 7.45 (d, J = 4.2 Hz, 1H), 7.20-7.42 (m, 7H), 6.75 (d, J = 4.2 Hz, 1H), 5.05-5.20 (m, 1H), 3.40-3.65 (m, 5H), 2.70-2.92 (m, 2H), 2.50-2.70 (m, 1H), 2.42 (s, 3H), 2.23-2.42 (m, 1H), 2.10-2.23 (m, 1H), 1.55-1.75 (m, 2H), 0.92 (d, J = 6.9 Hz, 3H)。LC-MS: m/z = 490 (M+H)+。
【0212】
<工程8>
【0213】
【化35】

【0214】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:50%の水酸化ナトリウム(10mL)とN-(1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(400mg、0.80mmol、1.00等量)の混合物を約16時間、約60℃で撹拌し、その後周囲温度にまで冷却した。酢酸エチル(4×10mL)での標準の抽出後処理の後に、粗製の残留物をその後シリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール(10:1))によって精製し、黄色固体として表題生成物を得た(0.25g;収量=88%)。1H NMR (300 MHz, CDCl3) δ: 11.35 (br s, 1H), 8.30 (s, 1H), 7.20-7.40 (m, 5H), 7.06 (d, J = 3.6 Hz, 1H), 6.60 (d, J = 3.6 Hz, 1H), 5.20-5.30 (m, 1H), 3.66 (s, 3H), 3.48-3.65 (m, 2H), 2.85-2.98 (m, 1H), 2.60-2.85 (m, 2H), 2.30-2.45 (m, 1H), 2.12-2.30 (m, 1H), 1.60-1.92 (m, 2H), 0.98 (d, J = 6.0 Hz, 3H)。LC-MS: m/z = 336 (M+H)+。
【0215】
<工程9>
【0216】
【化36】

【0217】
N-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:エナンチオマーN-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(4.5g)を、以下の条件でのキラル-Prep-HPLCを使用したキラル分離により分離した:カラム:キラルパックIA、0.46×25cm;移動相:ヘキサン(0.1%のトリエチルアミン中):イソプロパノール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:11.72分、所望されないエナンチオマーの保持時間:7.88分。ee%>99.8%。表題生成物を黄色固体として分離した(1.8g;収量=40%)。1H NMR (300 MHz, CDCl3) δ: 11.35 (br s, 1H), 8.30 (s, 1H), 7.20-7.40 (m, 5H), 7.06 (d, J = 3.6 Hz, 1H), 6.60 (d, J = 3.6 Hz, 1H), 5.20-5.30 (m, 1H), 3.66 (s, 3H), 3.48-3.65 (m, 2H), 2.85-2.98 (m, 1H), 2.60-2.85 (m, 2H), 2.30-2.45 (m, 1H), 2.12-2.30 (m, 1H), 1.60-1.92 (m, 2H), 0.98 (d, J = 6.0 Hz, 3H)。LC-MS: m/z = 336 (M+H)+。
【0218】
<工程10>
【0219】
【化37】

【0220】
N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミン:炭素上の水酸化パラジウム(50mg)および酢酸(44mg、0.72mmol、1.00等量)を、イソプロパノール/水(10mL/2mL)中のN-((3R,4R)-1-ベンジル-4-メチルピペリジン-3-イル)-N-メチル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(250mg、0.67mmol、1.00等量)の溶液に加えた。水素ガスを導入した後に、結果として生じる混合物を約16時間、約50℃で撹拌した。混合物をろ過した後に、濾液のpH値を、水酸化ナトリウムを加えることにより8に調節した。ジクロロメタン(3×20mL)での標準の抽出後処理により、灰白色固体として表題生成物を得た(140mg;収量=81%)。1H NMR (300 MHz, CDCl3) δ: 10.60 (br s, 1H), 8.35 (s, 1H), 7.07 (d, J = 3.6 Hz, 1H), 6.60
(d, J = 3.6 Hz, 1H), 4.88-4.98 (m, 1H), 3.45 (s, 3H), 3.25-3.37 (m, 1H), 2.80-3.10 (m, 3H), 2.45-2.58 (m, 1H), 1.82-2.00 (m, 1H), 1.60-1.80 (m, 2H), 1.11 (d, J = 7.2 Hz, 3H)。LC-MS: m/z = 246 (M+H)+。
【0221】
<工程11>
【0222】
【化38】

【0223】
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550):エチル2-シアノ酢酸(140mg、1.23mmol、6.00等量)およびトリエチルアミン(40mg、0.39mmol、2.00等量)を、トルエン(10mL)中のN-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミン12(50mg、0.19mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約16時間、約110℃で撹拌し、その後真空内で濃縮した。結果として生じる残留物を、シリカゲルカラムクロマトグラフィー(酢酸エチル/メタノール(50:1))によって精製し、淡黄色固体として表題生成物を得た(33mg;収量=52%)。1H NMR (300 MHz, CD3OD) δ: 8.10 (s, 1H), 7.10 (d, J = 4.0 Hz, 1H), 6.65 (d, J = 4.0 Hz, 1H), 5.00-5.10 (m, 1H), 3.80- 4.00 (m, 2H), 3.55-3.75 (m, 1H), 3.40-3.55 (m, 1H), 3.30-3.40 (m, 5H), 2.40-2.55 (m, 1H), 1.82-2.00 (m, 1H), 1.60-1.80 (m, 1H), 1.05-1.20 (m, 3H)。LC-MS: m/z = 313 (M+H)+。
【0224】
<工程12>
【0225】
【化39】

【0226】
3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550クエン酸塩):クエン酸(20mg、0.10mmol、1.00等量)を、水/メタノール(5/0.5mL)中の3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(33mg、0.10mmol、1.00等量)の溶液に加えた。結果として生じる溶液を約10分、約40℃で撹拌し、その後周囲温度にまで冷却した。溶剤をその後、クライオフリーズドライヤー(cryofreeze-dryer)を使用することにより取り除き、灰白色固体として表題化合物を得た(40mg;収量=76%)。1H NMR (300 MHz, CD3OD) δ: 8.15 (s, 1H), 7.15 (d, J = 3.6 Hz, 1H), 6.70 (d, J = 3.6 Hz, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.58-3.80 (m, 1H), 3.40-3.60 (m, 4H), 2.92 (Abq, J = 15.6 Hz, 2H), 2.80 (Abq, J = 15.6 Hz, 2H), 2.40-2.60 (m, 1H), 1.85-2.05 (m, 1H), 1.68-1.85 (m, 1H), 1.05-1.20 (m, 3H)。LC- MS: m/z = 313 (MH-C6H8O7)+。
【0227】
<実施例2>
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d4クエン酸塩)
【0228】
【化40】

【0229】
<工程1>
【0230】
【化41】

【0231】
4-クロロ-7-トシル-7H-ピロロ[2,3-d]ピリミジン:4-メチルベンゼン-1-塩化スルホニル(3.7g、19.32mmol、1.20等量)を、アセトン(20mL)中の2,4-ジクロロ-7H-ピロロ[2,3-d]ピリミジン1(3g、16.1mmol、1.00等量)の溶液に加えた。約0℃で、水性の水酸化ナトリウム溶液(2mol/L、12mL)を溶液に滴下で加えた。その後、溶液を約3時間、周囲温度で撹拌した。固体をろ過によって集め、アセトン/水で洗浄し、白色固体として表題生成物を得た(5.2g;収量=95%)。LC-MS: m/z = 342 (M+H)+。
【0232】
<工程2>
【0233】
【化42】

【0234】
(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミン:実施例1、工程6の手順に従ったが、水素化アルミニウムリチウムに対して重水素化リチウムアルミニウムを置換した。表題生成物を黄色の油として分離した(3.0g;収量=72%)。LC-MS: m/z = 222 (M+H)+。
【0235】
<工程3>
【0236】
【化43】

【0237】
N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:テトラヒドロフラン/水(1:1)(60mL)中の(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミン(700mg、2.89mmol、1.00等量)、2,4-ジクロロ-7H-ピロロ[2,3-d]ピリミジン(2g、5.78mmol、2.00等量)および炭酸カリウム(2.7g、19.4mmol、6.00等量)の混合物を、約16時間、約60℃で加熱し、その後溶剤を真空内で取り除いた。酢酸エチル(3×200mL)での標準の抽出後処理の後に、粗製の残留物をカラムクロマトグラフイーによって精製し、淡黄色固体として表題生成物を得た(1.5g;収量=96%)。LC-MS: m/z = 527 (M+H)+。
【0238】
<工程4>
【0239】
【化44】

【0240】
tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート:重水素ガスの雰囲気下で、d4-メタノール/酸化重水素(1:3)(30mL)中のN-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン(400mg、0.80mmol、1.00等量)、ジ-tert-ブチル重炭酸塩(348mg、1.6mmol)および炭素上の水酸化パラジウム(1.00等量;3サイクル間の酸化重水素により予め処理した)を、約16時間、約70℃で加熱した。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、固体として表題生成物を得た(300mg;収量=78.5%)。LC-MS: m/z = 504 (M+H)+。
【0241】
<工程5>
【0242】
【化45】

【0243】
4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン-1-カルボン酸 tert-ブチルエステル:30%のd1-水酸化ナトリウム(60mL)中のtert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート(300mg)の溶液を、約2時間、約100℃で加熱した。酢酸エチル(3×200mL)での標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、泡沫状固体として表題生成物を得た(190mg;収量=90%)。LC-MS: m/z = 350 (M+H)+。
【0244】
<工程6>
【0245】
【化46】

【0246】
3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステル:エナンチオマー3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルを、以下の条件を伴うキラル-Prep-HPLCを使用するキラル分離により、4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン-1-カルボン酸 tert-ブチルエステル(4.5g)から分離した:カラム:キラルパックIA、0.46×15cm;移動相:(ヘキサン:イソプロピルアルコール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:7.19分、所望されないエナンチオマーの保持時間:9.11分。ee%>99.8%。表題生成物を黄色固体として分離した(1.5g;収量=35%)。LC- MS: m/z = 527 (M+H)+。
【0247】
<工程7>
【0248】
【化47】

【0249】
N-d3-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩(amine deuterochloride):5Nの塩化重水素/ジオキサン(0.5mL/3 mL)中の3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルの溶液(190mg)を、約16時間、25℃で撹拌した。溶液を真空内で濃縮し、結果として生じる残留物を任意の更なる精製無しで、次の工程で使用した。LC-MS: m/z = 250 (M+H)+。
【0250】
<工程8>
【0251】
【化48】

【0252】
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(33mg;収量=52%)。LC-MS: m/z = 317 (M+H)+。
【0253】
<工程9>
【0254】
【化49】

【0255】
3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d4クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を白色固体として分離した(40mg;収量=76%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.9 Hz, 2H), 2.81 (Abq, J = 15.6 Hz, 2H), 2.48-2.61 (m, 1H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H), 1.14 (d, J = 6.6 Hz, 3H)。LC-MS: m/z = 317 (MH-C6H8O7)+。
【0256】
<実施例3>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d7クエン酸塩)
【0257】
【化50】

【0258】
<工程1>
【0259】
【化51】

【0260】
エチル3-オキソピペリジン-4-カルボキシラート酢酸塩:水素の雰囲気下で、エチル1-ベンジル-3-オキソピペリジン-4-カルボキシラート(20g、16.1mmol、1.00等量)、炭素上の10%のパラジウム、酢酸(10mL)およびメタノール(100mL)の混合物を、約4時間、約50℃で加熱した。混合物をろ過し、濾液を蒸発させ、酢酸塩として表題生成物を得た(16g:収量=85%)。LC-MS: m/z = 172 (M+H)+。
【0261】
<工程2>
【0262】
【化52】

【0263】
メチル4-メチルピリジン-3-イルカルバマート:ジ-tert-ブチル重炭酸塩(5.66g、26mmol)、炭酸カリウム(12g、86.4mmol)および水(100mL)の溶液を、テトラヒドロフラン(400mL)中のエチル3-オキソピペリジン-4-カルボキシラート酢酸塩(15g、21.6mmol)の溶液に加えた。結果として生じる混合物を約2時間、周囲温度で撹拌した。真空内で溶剤を取り除いた後に、酢酸エチル(3×200mL)での標準の抽出後処理により、淡白色固体(14g;収量=80%)として表題生成物を得た。LC-MS: m/z = 172/272 (M+H)+。
【0264】
<工程3>
【0265】
【化53】

【0266】
1-tert-ブチル-4-エチル4-d3-メチル-3-オキソピペリジン-1,4-ジカルボキシラート:70%の水素化ナトリウム(3.54g、103mmol)を、テトラヒドロフラン(300mL)中の1-tert-ブチル4-エチル3-オキソピペリジン-1,4-ジカルボン酸(14g、51.6mmol、1.00等量)の溶液にいくつかの部分で(in several portions)加えた。結果として生じる混合物を約2時間、約50℃で加熱し、その後周囲温度にまで冷却した。ヨードメタン(15g、103mmol)を加えた後に、結果として生じる懸濁液を約3時間、周囲温度で撹拌し、その後氷中へ注いだ。酢酸エチル(3×100mL)での標準の抽出後処理により粗製の残留物を得て、それをその後、カラムクロマトグラフイーによって精製し、固体として表題生成物を得た(7.4g;収量=50%)。LC-MS: m/z = 289 (M+H)+。
【0267】
<工程4>
【0268】
【化54】

【0269】
4-d3-メチルピペリジン-3-オン塩酸塩:37%の塩化水素(30mL)を、1-tert-ブチル4-エチル4-d3-メチル-3-オキソピペリジン-1,4-ジカルボン酸(7g、25.6mmol)に加えた。結果として生じる混合物を約3時間、還流にて加熱し、その後溶剤を真空内での蒸発によって取り除いた。結果として生じる残留物を、更なる精製無しで次の工程に使用した。LC-MS: m/z = 117/125 (M+H)+。
【0270】
<工程5>
【0271】
【化55】

【0272】
1-ベンジル-4-d3-メチルピペリジン-3-オン:(ブロモメチル)ベンゼン(2.23g、10.5mmol)を、テトラヒドロフラン(30mL)中の4-d3-メチルピペリジン-3-オン塩酸塩(1.2g、10.3mmol、1.00等量)およびトリエチルアミン(2.1g、20.6mmol)の溶液に滴下で加えた。結果として生じる混合物を約16時間、周囲温度で撹拌し、その後溶剤を真空内で蒸発させた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、固体として表題生成物を得た(1.7g;収量=80%)。1H NMR (300 MHz, CD3OD) δ: 7.21-7.39 (m, 5H), 3.5 (s,2H), 3.23 (d, J= 13.8Hz, 1H), 2.94 (d, J = 9.6 Hz, 1H), 2.79 (d, J = 13.8 Hz, 1H), 2.45 (t, J = 11.4Hz, 1H), 2.29-2.39 (m, 1H), 1.98-2.01 (m, 1H), 1.59-1.71 (m, 341H)。LC-MS: m/z = 207/225 (M+H)+。
【0273】
<工程6>
【0274】
【化56】

【0275】
(1-ベンジル-4-d3-メチル-ピペリジン-3-イル)-d3-メチル-アミン:約0℃で、ナトリウムメトキシド(3.2g、38.2mmol)を、d3-メチルアミン塩酸塩(1.4g、19.4mmol)、1-ベンジル-4-d3-メチルピペリジン-3-オン(2g、9.7mmol)およびテトラヒドロフラン(60mL)の懸濁液に加えた。混合物を約16時間、周囲温度で撹拌し、その後トリアセトキシ水素化ホウ素ナトリウム(8.5g、40mmol)を加えた。混合物を約5時間、周囲温度で撹拌し、その後5%の水酸化ナトリウム(50mL)を加えた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィー(ジクロロメタン/メタノール)によって精製し、表題生成物を得た(2.2g;収量=50%)。LC-MS: m/z = 225 (M+H)+。
【0276】
<工程7>
【0277】
【化57】

【0278】
N-(1-ベンジル-4-d3-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-(7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンのため、(1-ベンジル-4-d3-メチル-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を淡黄色固体として分離した(1.4g;収量=90%)。LC-MS: m/z = 530 (M+H)+。
【0279】
<工程8>
【0280】
【化58】

【0281】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した(270mg;収量=70%)。LC-MS: m/z = 507 (M+H)+。
【0282】
<工程9>
【0283】
【化59】

【0284】
tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)-d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート:tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラート(200mg、0.4mmol)および30%のd1-水酸化ナトリウム(60mL)の混合物を約16時間、約100℃で加熱した。周囲温度にまで混合物を冷却した後に、ジ-tert-ブチル重炭酸塩(170mg、0.8mmol)およびテトラヒドロフラン(20ml)を加えた。混合物を約16時間、周囲温度で撹拌し、その後溶剤を真空内で取り除いた。酢酸エチルでの標準の抽出後処理の後に、結果として生じる粗製の残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/鉱油(1:5))によって精製し、白色固体として表題生成物を得た。LC-MS: m/z = 453 (M+H)+。
【0285】
<工程10>
【0286】
【化60】

【0287】
(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート:エナンチオマー(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラートを、以下の条件を伴うキラル-Prep-HPLCを使用するキラル分離によって、tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d3-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート)(300mg)から分離した:カラム:キラルパックIA(Waters 2767-1)、0.46×25cm;移動相:ヘキサン/イソプロピルアルコール(90:10);検出器:UV254nm。所望のエナンチオマーの保持時間:6.08分、所望されないエナンチオマーの保持時間:10.16分。ee%>99.8%。表題生成物を白色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 353(M+H)+。
【0288】
<工程11>
【0289】
【化61】

【0290】
N-d3-メチル-N-((3R,4R)-4-d3-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチル-エステルに対して、(3R,4R)-tert-ブチル4-((1-(tert-ブトキシカルボニル)-4-d3-メチルピペリジン-3-イル)(d3-メチル)アミノ)-2-d1-7H-ピロロ[2,3-d]ピリミジン-7-カルボキシラート)を置換した。表題生成物を粗製の残留物として分離し、任意の更なる精製無しで次の工程で使用した。LC-MS: m/z = 253 (M+H)+。
【0291】
<工程12>
【0292】
【化62】

【0293】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリル(CP-690550-d7):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチルピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(40mg;収量=56%)。LC-MS: m/z = 320 (M+H)+。
【0294】
<工程13>
【0295】
【化63】

【0296】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸塩(CP-690550-d7クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を灰白色固体として分離した(23mg;収量=41%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 4.95-5.15 (m, 1H), 3.85-4.08 (m, 4H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H), 2.48-2.61 (m, 1H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H)。LC-MS: m/z = 320 (MH-C6H8O7)+。
【0297】
<実施例4>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-イル)-3-オキソ-プロパンニトリルモノクエン酸塩(CP-690550-d11クエン酸塩)
【0298】
【化64】

【0299】
<工程1>
【0300】
【化65】

【0301】
1-ベンジル-4-d3-メチル-(2,2',4-d3)-ピペリジン-3-オン:酸化重水素(60mL)中の2Nの塩化重水素中の1-ベンジル-4-d3-メチルピペリジン-3-オン6の混合物(2.5g、12.1mmol)を約16時間、約80℃で加熱した。周囲温度にまで混合物を冷却した後に、酸化重水素(80mL)中の2Nのd1-水酸化ナトリウムを加えた。酢酸エチルでの標準の抽出後処理により、粗製の残留物を得て、それを更なる精製無しで次の工程で使用した。LC-MS: m/z = 210/228 (M+H)+。
【0302】
<工程2>
【0303】
【化66】

【0304】
(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-d3-メチル-アミン:
実施例3、工程6の手順に従ったが、1-ベンジル-4-d3-メチル-ピペリジン-3-オンに対して、1-ベンジル-4-d3-メチル-(2,2',4-d3)-ピペリジン-3-オンを置換した。表題生成物を固体として分離した(3.9g;収量=90%)。LC-MS: m/z = 229 (M+H)+。
【0305】
<工程3>
【0306】
【化67】

【0307】
N-(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-クロロ-N-d3-(メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンに対して、(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を淡黄色固体として分離した(1.4g;収量=90%)。LC-MS: m/z = 534 (M+H)+。
【0308】
<工程4>
【0309】
【化68】

【0310】
Tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した(270mg;収量=70%)。LC-MS: m/z = 411/511 (M+H)+。
【0311】
<工程5>
【0312】
【化69】

【0313】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラート:実施例2、工程5の手順に従ったが、tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラートに対して、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラートを置換した。表題生成物を泡沫状固体として分離した(130mg;収量=90%)。1H NMR (300 MHz, CD3OD) δ: 10.41-10.73 (br s, 1H), 7.07 (d, J = 3.6 Hz, 1H), 6.57 (d, J = 2.4 Hz, 1H), 3.38- 3.71 (brs, 2H), 1.76-1.91 (m, 1H), 1.58-1.65 (m, 1H), 1.47 (s, 9H)。LC-MS: m/z = 257/357 (M+H)+。
【0314】
<工程6>
【0315】
【化70】

【0316】
(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラート:エナンチオマー(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラートを、以下の条件を有するキラル-Prep-HPLCを使用したキラル分離によって、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4-d4-ピペリジン-1-カルボキシラートから分離した: カラム:キラルパックIC2×25cm(Waters 2767-1)、5umキラル-P(IC)001IC00CJ-LD016;移動相:ヘキサン/イソプロピルアルコール(85:15);検出器:UV254nm。所望のエナンチオマーの保持時間:12.01分、所望されないエナンチオマーの保持時間:15.10分。ee%>99.8%。表題生成物を黄色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 490 (M+H)+。
【0317】
<工程7>
【0318】
【化71】

【0319】
N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-d7-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸 tert-ブチルエステルに対して、(3R,4R)-tert-ブチル-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-カルボキシラートを置換した。表題生成物を分離し、更なる精製無しで次の工程に使用した。LC-MS: m/z = 257 (M+H)+。
【0320】
<工程8>
【0321】
【化72】

【0322】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリル(CP-690550-d11):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4-d4-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(50mg;収量=63%)。LC-MS: m/z = 324 (M+H)+。
【0323】
<工程9>
【0324】
【化73】

【0325】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ))-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリルモノクエン酸塩((CP-690550-d11クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2,3,4-d4-ピペリジン-1-イル)-3-オキソプロパン-ニトリルを置換した。表題生成物を灰白色固体として分離した(50mg;収量=80%)。1H NMR (300 MHz, CD3OD) δ: 7.36 (s, 1H), 6.89 (s, 1H), 3.91-4.08 (m, 2H), 3.48-3.75 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H), 1.89-2.05 (m, 1H), 1.69-1.88 (m, 1H)。LC-MS: m/z = 324 (MH-C6H8O7)+。
【0326】
<実施例5>
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロ-パンニトリルモノクエン酸塩(CP-690550-d15クエン酸塩)
【0327】
【化74】

【0328】
<工程1>
【0329】
【化75】

【0330】
エチル2-(ベンジルアミノ)酢酸塩:ジイソプロピルエチルアミン(155g、1.2mol)とベンジルアミン(96g、0.9mol)の溶液を、ジオキサン(1000mL)中の臭化酢酸エチル(100g、0.6mol)の溶液に滴下で加えた。結果として生じる懸濁液を約5時間、約90℃で加熱し、その後周囲温度にまで冷却した。酢酸エチルでの標準の抽出後処理により、黄色の油として表題生成物を得た(90g;収量=80%)。LC-MS: m/z = 194 (M+H)+。
【0331】
<工程2>
【0332】
【化76】

【0333】
エチル4-(ベンジル(2-エトキシ-2-オキソエチル)アミノ)-4-オキソブタノアート:炭酸カリウム(110.4g、0.97mol)を、テトラヒドロフラン(500mL)および水(200mL)中のエチル2-(ベンジルアミノ)酢酸塩(78g、0.4mol)の溶液に1つの部分で加えた。その後、無水のテトラヒドロフラン(200mL)中のエチル4-クロロ-4-オキソブタノアート(72.7g、0.485mol)を、1時間にわたって滴下で混合物に加えた。混合物をろ過し、濾液を酢酸エチルで洗浄した。溶剤を蒸発により取り除いた後、酢酸エチル(100mL)での標準の抽出後処理により黄色の油として表題生成物を得た(110g;収量=80%)。LC-MS: m/z = 322 (M+H)+。
【0334】
<工程3>
【0335】
【化77】

【0336】
エチル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート:エタノール(37g、0.8mol)およびジオキサン(200ml)中のエチル4-(ベンジル(2-エトキシ-2-オキソエチル)アミノ)-4-オキソブタノアート(123.2g、0.4mol)を、ジオキサン(500mL)中のナトリウム(18.4g、0.8mol)の懸濁液に滴下で加えた。ナトリウム金属がもはや見えなくなるまで、結果として生じる混合物を還流にて加熱した。周囲温度にまで混合物を冷却した後に、酢酸(48g、0.8mol)を加えた。酢酸エチルでの標準の抽出後処理により粗製生成物を得て、それをエーテル/アセトンからの再結晶化によって精製し、 黄色固体として表題生成物を得た(40g;収量=40%)。1H NMR (300 MHz, CD3OD) δ: 11.81 (s, 1H), 7.19-7.41 (m, 5H), 4.65 (s, 2H), 4.25 (q, J = 7.2 Hz, 2H), 3.91(t, J = 3Hz, 2H), 3.27 (t, J = 3Hz, 2H), 1.32 (t, J = 7.2Hz, 3H)。LC-MS: m/z = 276 (M+H)+。
【0337】
<工程4>
【0338】
【化78】

【0339】
ベンジル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート:ベンジルアルコール(27.5g、255mmol)中の1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート4(14g、50.9mmol)の溶液を、約16時間、約170℃で加熱した。溶剤を真空内で取り除き、結果として生じる残留物をエーテルから再結晶化し、黄色固体として表題生成物を得た(14g;収量=85%)。LC-MS: m/z = 338 (M+H)+。
【0340】
<工程5>
【0341】
【化79】

【0342】
ベンジル1-ベンジル-4-トリジューテロメチル(trideuteromethyl)-2,5-ジオキソピペリジン-4-カルボキシラート:ベンジル1-ベンジル-5-ヒドロキシ-2-オキソ-1,2,3,6-テトラヒドロピリジン-4-カルボキシラート5(13.5g、40mmol)、d3-ヨードメタン(8.7g、60mmol)、炭酸カリウム(16.6g、120mmol)およびアセトン(60mL)の混合物を、約3時間、還流にて加熱した。混合物をろ過し、結果として生じる濾液を真空内で濃縮した。酢酸エチルでの標準の抽出後処理により粗製の残留物を得て、それをその後エーテル/アセトンからの再結晶化によって精製し、淡黄色固体として表題生成物を得た(11.3g;収量=80%)。LC-MS: m/z = 355 (M+H)+。
【0343】
<工程6>
【0344】
【化80】

【0345】
1-ベンジル-4-d3-メチルピペリジン-2,5-ジオン:水素ガスを、1-ベンジル-4-d3メチル-2,5-ジオキソピペリジン-4-カルボキシラート(12.5g、35.3mmol)、炭素(2g)上の10%のパラジウムおよび酢酸エチル(100mL)の懸濁液に導入した。混合物を約16時間、約50℃で加熱した。その後混合物を、セライトパッドを通してろ過し、濾液を酢酸エチルで洗浄した。濾液を約3時間、還流にて加熱し、その後溶剤を真空内での蒸発によって取り除いた。結果として生じる残留物をシリカゲルカラム(石油エーテル/酢酸エチル)によって精製し、表題生成物を得た(7g;収量=90%)。LC-MS: m/z = 221 (M+H)+。
【0346】
<工程7>
【0347】
【化81】

【0348】
1-ベンジル-5,5-ジメトキシ-4-d3-メチルピペリジン-2-オン:メタノール(20mL)中のオルトギ酸メチル(10mL)および4-メチルベンゼンスルホン酸(0.5g)の溶液を、メタノール(50mL)中の1-ベンジル-4-トリジューテロメチルピペリジン(trideuteromethylpiperidine)-2,5-ジオン(7g、31.8mmol)の溶液に滴下で加えた。結果として生じる混合物を約16時間、還流にて加熱し、その後周囲温度にまで冷却した。トリエチルアミン(2ml)を加えた後に、酢酸エチルでの標準の抽出後処理により粗製の残留物を得て、それをその後シリカゲルカラムクロマトグラフィーによって精製し、黄色の油として表題生成物を得た(7.8g;収量=90%)。LC-MS: m/z = 267 (M+H)+。
【0349】
<工程8>
【0350】
【化82】

【0351】
1-ベンジル-5,5-ジメトキシ-4-d3-メチル-3,3-d2-ピペリジン-オン:1-ベンジル-5,5-ジメトキシ-4-d3-メチルピペリジン-2-オン(4g、15mmol)、d4-メタノール(10mL)および30%のd1-水酸化ナトリウム(50mL)の混合物を、LC-MSによって測定されるように、反応が完了するまで約50℃で加熱した。混合物を周囲温度にまで冷却し、その後酸化重水素(25mL)を加えた。酢酸エチルでの標準の抽出後処理により、黄色の油として表題生成物を得た(3.3g;収量=80%)。LC-MS: m/z = 269 (M+H)+。
【0352】
<工程9>
【0353】
【化83】

【0354】
1-ベンジル-4-d3-メチル-3,3',4,6,6',-d5-ピペリジン-2,5-ジオン:(酸化重水素中の)1Nの重水素塩酸(deuterochloric acid)(200mL)中の1-ベンジル-5,5-ジメトキシ-4-d3-メチル-3,3-d2-ピペリジン-2-オン(8g、29.8mmol)の混合物を約16時間、約80℃で加熱した。混合物を周囲温度にまで冷却し、その後(酸化重水素中の)2Nのd1-水酸化ナトリウム(110mL)を加えた。混合物を酢酸エチルで抽出し、乾燥し、真空内で蒸発させた。結果として生じる残留物をシリカゲルカラムクロマトグラフィーによって精製し、表題生成物を得た(4.7g;収量=60%)。LC-MS: m/z = 226/244 (M+H)+。
【0355】
<工程10>
【0356】
【化84】

【0357】
1-ベンジル-4-d3-メチル-5-(d3-メチルアミノ)-3,3',4,5,6,6'-d6-ピペリジン-2-オン:
約0℃で、ナトリウムd3-メトキシド(0.9g、16mmol)を、テトラヒドロフラン(10mL)中のd5-メチルアミン塩化重水素(methylamine deuterium chloride)(1.2g、16mmol)の懸濁液に加えた。30分後、d4-酢酸(1.1g、16mmol)を、注射器を使用して混合物に注入した。結果として生じる混合物をその後約30分間、周囲温度で撹拌した。大気を窒素に置換した後、テトラヒドロフラン(20mL)中の1-ベンジル-4-d3-メチル-3,3',4,6,6',-d5-ピペリジン-2,5-ジオン(3g、13.3mmol)を、その後滴下で加えた。混合物を約16時間撹拌し、その後トリアセトキシ重水素化ホウ素ナトリウム(7.4g、32mmol)を加えた。混合物を約5時間、周囲温度で撹拌し、その後5%のd1-水酸化ナトリウム(50mL)を加えた。酢酸エチルでの標準の抽出後処理の後に、粗製の残留物をシリカゲルカラムクロマトグラフィーによって精製し、表題生成物を得た(1.2g;収量=37%)。LC-MS: m/z = 245 (M+H)+。
【0358】
<工程11>
【0359】
【化85】

【0360】
(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-d3-メチル-アミン:テトラヒドロフラン(5mL)中の1-ベンジル-4-d3-メチル-5-(d3-メチルアミノ)-3,3',4,5,6,6'-d6-ピペリジン-2-オン(1.0g、4.1mmol)を、テトラヒドロフラン(20mL)中の重水素化リチウムアルミニウム(860mg、20.5mmol)の懸濁液に滴下で加えた。混合物を約1時間、周囲温度で撹拌した。約-10℃にまで混合物を冷却した後に、混合物を、氷を含んでいる10%の水酸化ナトリウム(5mL)へ注いだ。濾過の後、濾液を真空内で濃縮し、酢酸エチルで抽出した。有機相を組み合わせ、ブラインで洗浄し、乾燥し、真空内で蒸発させ、黄色の固体として表題生成物を得た(1.0g;収量=85%)。LC-MS: m/z = 233 (M+H)+。
【0361】
<工程12>
【0362】
【化86】

【0363】
N-(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミン:実施例2、工程3の手順に従ったが、(1-ベンジル-4-メチル-ピペリジン-3-イル)-d3-メチル-アミンに対して、(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-d3-メチル-アミンを置換した。表題生成物を、淡黄色固体として分離した(1.4g,収量=90%)。LC-MS: m/z = 538 (M+H)+。
【0364】
<工程13>
【0365】
【化87】

【0366】
tert-ブチル3-((2-d1-7-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:実施例2、工程4の手順に従ったが、N-(1-ベンジル-4-メチルピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-(1-ベンジル-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-クロロ-N-d3-メチル-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-アミンを置換した。表題生成物を固体として分離した。LC-MS: m/z = 515 (M+H)+。
【0367】
<工程14>
【0368】
【化88】

【0369】
tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:実施例2、工程5の手順に従ったが、tert-ブチル4-メチル-3-(d3-メチル(2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-カルボキシラートに対して、tert-ブチル3-(2-d1-7-トシル7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートを置換した。表題生成物を泡沫状固体として分離した(130mg;収量=90%)。LC-MS: m/z = 361 (M+H)+。
【0370】
<工程15>
【0371】
【化89】

【0372】
(3R,4R)-tert-ブチル3-((2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラート:エナンチオマーを、以下の条件を有するキラル-Prep-HPLCを使用したキラル分割により、tert-ブチル4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートから分離した:カラム:キラルパックIC2×25cm(Waters 2767-1)、5umキラル-P(IC)001IC00CJ-LD016;移動相:ヘキサン/イソプロピルアルコール(85:15);検出器:UV254nm。所望のエナンチオマーの保持時間:12.13分、所望されないエナンチオマーの保持時間:15.15分。ee%>99.8%。表題生成物を黄色固体として分離した(0.1g;収量=35%)。LC-MS: m/z = 361 (M+H)+。
【0373】
<工程16>
【0374】
【化90】

【0375】
N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩:実施例2、工程7の手順に従ったが、3-((3R,4R)-4-メチル-3-[d3-メチル-(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)-アミノ]-ピペリジン)-1-カルボン酸-tert-ブチルエステルに対して、(3R,4R)-tert-ブチル3-((2-d1-7-トシル-7H-ピロロ[2,3-d]ピリミジン-4-イル)(d3-メチル)アミノ)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-カルボキシラートを置換した。表題生成物を粗製の残留物として分離し、それを任意の更なる精製無しで次の工程で使用した。LC-MS: m/z = 261 (M+H)+。
【0376】
<工程17>
【0377】
【化91】

【0378】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ-2,2',3,4,5,5',6,6'-d8-ピペリジン-l-イル)-3-オキソプロパンニトリル(CP-690550-d15):実施例1、工程11の手順に従ったが、N-メチル-N-((3R,4R)-4-メチルピペリジン-3-イル)-7H-ピロロ[2,3-d]ピリミジン-4-アミンに対して、N-d3-メチル-N-((3R,4R)-4-d3-メチル-2,2',3,4,5,5',6,6'-d8-ピペリジン-3-イル)-2-d1-7H-ピロロ[2,3-d]ピリミジン-4-アミン重塩酸塩を置換した。表題生成物を淡黄色固体として分離した(50mg;収量=63%)。LC-MS: m/z = 328 (M+H)+。
【0379】
<工程18>
【0380】
【化92】

【0381】
3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ [2,3-d]ピリミジン-4-イル)アミノ)-2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロパンニトリルモノクエン酸(CP-690550-d15-クエン酸塩):実施例1、工程12の手順に従ったが、3-((3R,4R)-4-メチル-3-(メチル(7H-ピロロ[2,3-d]ピリミジン-4-イル)アミノ)ピペリジン-1-イル)-3-オキソプロパンニトリルに対して、3-((3R,4R)-4-d3-メチル-3-(d3-メチル(2-d1-7H-ピロロ [2,3-d]ピリミジン-4-イル)アミノ)- 2,2',3,4,5,5',6,6'-d8-ピペリジン-1-イル)-3-オキソプロパンニトリルを置換した。表題生成物を白色固体として分離した(54mg;収量=90%)。1H NMR (300 MHz, CD3OD) δ: 7.35 (s, 1H), 6.89 (d, J = 2.7Hz, 1H), 3.91-4.08 (m, 2H), 2.94(Abq, J = 15.6 Hz, 2H), 2.81 (Abq, J = 15.9 Hz, 2H)。LC-MS: m/z = 328 (MH-C6H8O7)+。
【0382】
以下の化合物は一般的に、上述された方法を使用して作ることができる。作られた時のこれらの化合物は、上記の実施例に記載されているものに類似する活性を有することが期待される。
【0383】
【化93】

【0384】
【化94】

【0385】
【化95】

【0386】
【化96】

【0387】
【化97】

【0388】
【化98】

【0389】
【化99】

【0390】
【化100】

【0391】
【化101】

【0392】
【化102】

【0393】
【化103】

【0394】
【化104】

【0395】
【化105】

【0396】
【化106】

【0397】
【化107】

【0398】
【化108】

【0399】
【化109】

【0400】
【化110】

【0401】
【化111】

【0402】
それらの非同位体的に濃縮されたアナログと比較して、本明細書に開示の化合物の代謝特性の変化は、以下のアッセイを使用して示すことができる。まだ作られていない及び/又は試験されていない、上記にリストされた化合物は、これらの1つ以上のアッセイによって示されるのと同様に、代謝特性を変更するものと予想される。
【0403】
<生物活性アッセイ>
<インビトロのヒト肝臓ミクロソーム安定性(HLM)アッセイ>
肝臓ミクロソーム安定性アッセイを、2%の重炭酸ナトリウム中のNADPH-ジェネレーションシステム(8.8mMのNADPH、102.4mMのグルコース6-リン酸塩、24単位/mLのグルコース6-リン酸デヒドロゲナーゼおよび13.2mMの塩化マグネシウム)を用いて肝臓ミクロソームタンパク質4mg/mLで行った。試験化合物を、20%のアセトニトリル-水中の溶液として調製し、アッセイ混合物(最終アッセイ濃度5マイクログラム/mL)に加え、37℃で培養した。アッセイ中のアセトニトリルの終末濃度は<1%であるべきである。アリコート(50μL)を、0、30、60、90および120分で取り出し、氷冷のアセトニトリル(200μL)で希釈し、反応を停止させた。サンプルを10分間、12,000RPMで遠心分離機にかけ、タンパク質を促進させた。上清を微量遠心管に移し、試験化合物の分解半減期(degradation half-life)のLC/MS/MS分析のために貯蔵した。従って、このアッセイにおいて試験された、本明細書開示の特定の同位体的に濃縮した化合物が、非同位体的に濃縮された薬物と比較して分解半減期の増加を示したことが分かった。HLMのための実施例1-5(CP-690550および同位体的に濃縮されたCP-690550アナログ)の分解半減期を、表1に示す。
【0404】
【表1】

【0405】
<ヒトシトクロームP450酵素を使用するインビトロでの代謝>
シトクロームP450酵素を、バキュロウィルス発現システム(BD Biosciences, San Jose, CA)を使用して、対応するヒトcDNAから発現させた。0.8ミリグラム/ミリリットルのタンパク質、1.3ミリモーラーのNADP+、3.3ミリモーラーのグルコース-6-フォスフェート、0.4U/mLのグルコース-6-リン酸デヒドロゲナーゼ、3.3ミリモーラーの塩化マグネシウムおよび0.2ミリモーラーの本明細書開示のような化合物、100ミリモーラーのリン酸カリウム(pH7.4)中の対応する非同位体的に濃縮された化合物又は標準又はコントロールを含む、0.25ミリリットルの反応混合物を20分間、37℃で培養する。培養した後、反応を適切な溶剤(例えばアセトニトリル、20%のトリクロロ酢酸、94%のアセトニトリル/6%の氷酢酸、70%の過塩素酸、94%のアセトニトリル/6%氷酢酸)の添加によって止め、3分間遠心分離機にかけた(10,000g)。上清をHPLC/MS/MSによって分析する。
【0406】
【表2】

【0407】
<モノアミンオキシダーゼAの阻害及び酸化代謝ターンオーバー(turnover)>
この手順を、Weyler et al., Journal of Biological Chemistry 1985, 260, 13199-13207により記載された方法を使用して行い、それは全体における参照により本明細書に組み込まれる。モノアミンオキシダーゼA活性を、4-ヒドロキシキノリンの形成を有するキヌラミンの酸化上で314nmでの吸光度の増加を監視することにより、分光測定で測定する。測定を、0.2%のトリトンX-100(モノアミンオキシダーゼアッセイ緩衝液)を含む、1mMのキヌラミンを加えた50mMのリン酸ナトリウム緩衝液、pH7.2、及び酵素の所望量中1mLの全容量で、30℃で行う。
【0408】
<モノアミンオキシダーゼBの阻害及び酸化代謝ターンオーバー>
この手順を、Uebelhack, Pharmacopsychiatry 1998, 31(5), 187-192に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0409】
<LC-MSによるCP-690550及びその代謝物の検出>
この手順を、Lawendy et al., J Clin Pharmacol 2009, 49, 423-429に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0410】
<LC-MSによる全血中のCP-690550の定量化>
この手順を、Paniagua et al., Therapeutic Drug Monitoring 2005, 27(5), 608-616に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0411】
<ヤヌスキナーゼ3酵素分析法>
この手順を、米国特許第6,627,754号に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0412】
<ヤヌスキナーゼ3酵素学的アッセイ>
この手順を、WO2003/048162に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0413】
<ヒトIL−2依存性T細胞ブラスト増殖の阻害>
この手順を、WO2003/048162に記載の通りに行ない、それは全体における参照により本明細書に組み込まれる。
【0414】
前述の記載から、当業者は本発明の本質的な特徴を確認することができ、その精神および範囲から逸脱することなく、様々な使用法および状況に適応させるために本発明の様々な変更および修正を行うことができる。
【特許請求の範囲】
【請求項1】
構造式I
【化1】

の化合物またはその薬学的に許容可能な塩であって、
式中、
R1-R2、R11-R13、またはR20の少なくとも1つは、重水素であり、
または、R3-R10の少なくとも6つは、重水素である場合、
R1-R20は、水素および重水素からなる群から独立して選択されることを特徴とする化合物。
【請求項2】
R1-R20の少なくとも1つは、独立して、約10%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項3】
R1-R20の少なくとも1つは、独立して、約50%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項4】
R1-R20の少なくとも1つは、独立して、約90%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項5】
R1-R20の少なくとも1つは、独立して、約98%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項6】
前記化合物は、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

からなる群から選択される構造式を有することを特徴とする、請求項1に記載の化合物。
【請求項7】
Dとして表わされる各位置は、約10%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項8】
Dとして表わされる各位置は、約50%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項9】
Dとして表わされる各位置は、約90%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項10】
Dとして表わされる各位置は、約98%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項11】
前記化合物は、
【化21】

【化22】

【化23】

【化24】

【化25】

【化26】

【化27】

【化28】

からなる群から選択される構造式を有することを特徴とする、請求項6に記載の化合物。
【請求項12】
前記化合物は、構造式、
【化29】

を有することを特徴とする、請求項11に記載の化合物。
【請求項13】
前記化合物は、構造式、
【化30】

を有することを特徴とする、請求項11に記載の化合物。
【請求項14】
前記化合物は、構造式、
【化31】

を有することを特徴とする、請求項11に記載の化合物。
【請求項15】
前記化合物は、構造式、
【化32】

を有することを特徴とする、請求項11に記載の化合物。
【請求項16】
前記化合物は、構造式、
【化33】

を有することを特徴とする、請求項11に記載の化合物。
【請求項17】
前記化合物は、構造式、
【化34】

を有することを特徴とする、請求項11に記載の化合物。
【請求項18】
前記化合物は、構造式、
【化35】

を有することを特徴とする、請求項11に記載の化合物。
【請求項19】
薬学的に許容可能な担体とともに請求項1に記載の化合物を含むことを特徴とする医薬組成物。
【請求項20】
請求項1に記載の治療上有効な量の化合物を、それを必要とする患者に投与する工程を含むことを特徴とする、ヤヌスキナーゼ3媒介の障害の処置の方法。
【請求項21】
前記障害は、腎移植拒絶反応、関節リウマチ、乾癬、炎症性大腸疾患、ドライアイ症候群、喘息、および移植拒絶反応からなる群から選択されることを特徴とする、請求項20に記載の方法。
【請求項22】
追加の治療薬を投与する工程をさらに含むことを特徴とする、請求項20に記載の方法。
【請求項23】
前記追加の治療薬は、H+,K+ATPアーゼインヒビター、消化管運動性モジュレーター、非ステロイド性抗炎症剤、アニリド鎮痛剤、抗リウマチ剤、グルココルチコイド、および免疫抑制剤からなる群から選択されることを特徴とする、請求項22に記載の方法。
【請求項24】
前記H+,K+ATPアーゼインヒビターは、エソメプラゾール、ランソプラゾール、オメプラゾール、パントプラゾール、ラベプラゾール、およびテナトプラゾールからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項25】
前記消化管運動性モジュレーターは、ソラベグロン、テガセロッド、アロセトロン、シランセトロン、ドンペリドン、メトクロプラミド、イトプリド、シサプリド、レンザプリド、ザコプリド、オクトレオチド、ナロキソン、エリスロマイシン、およびベタネコールからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項26】
前記非ステロイド性抗炎症剤は、アセクロフェナク、アセメタシン、アモキシプリン、アスピリン、アザプロパゾン、ベノリラート、ブロムフェナク、カルプロフェン、セレコキシブ、コリンサリチル酸マグネシウム、ジクロフェナク、ジフルニサル、エトドラク、エトリコキシブ、ファイスラミン、フェンブフェン、フェノプロフェン、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、ロルノキシカム、ロキソプロフェン、ルミラコキシブ、メロキシカム、メクロフェナム酸、メフェナム酸、メロキシカム、メタミゾール、サリチル酸メチル、サリチル酸マグネシウム、ナブメトン、ナプロキセン、ニメスリド、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピロキシカム、サリチルサリチル酸塩、スリンダク、スルフィンピラゾン、スプロフェン、テノキシカム、チアプロフェン酸、およびトルメチンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項27】
前記アニリド鎮痛剤は、アセトアミノフェンおよびフェナセチンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項28】
前記寛解導入抗リウマチ剤は、アザチオプリン、シクロスポリン A、D-ペニシラミン、金塩、水酸化クロロキン、レフルノミド、メトトレキサート、ミノサイクリン、スルファサラジン、シクロホスファミド、エタネルセプト、インフリキシマブ、アダリムマブ、アナキンラ、リツキシマブ、およびアバタセプトからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項29】
前記グルココルチコイドは、ベクロメタゾン、ブデソニド、フルニソリド、ベタメタゾン、フルチカゾン、トリアムシノロン、モメタゾン、シクレソニド、ヒドロコルチゾン、酢酸コルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニソロン、およびデキサメタゾンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項30】
前記免疫抑制剤は、フィンゴリモド、シクロスポリン A、アザチオプリン、デキサメタゾン、タクロリムス、シロリムス、ピメクロリムス、ミコフェノール酸塩、エベロリムス、バシリキシマブ、ダクリズマブ、抗胸腺細胞グロブリン、抗リンパ球グロブリン、およびCTLA4IgGからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項31】
a. 非同位体的に濃縮された化合物に比べて、前記化合物またはその代謝物質の血漿レベルの減少した個対間変動、
b. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の増加した平均血漿レベル、
c. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、
d. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の増加した平均血漿レベル、および、
e. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における処置の間の改善された臨床効果、
からなる群から選択される、少なくとも1つの効果を結果的にさらにもたらすことを特徴とする、請求項20に記載の方法。
【請求項32】
a. 非同位体的に濃縮された化合物に比べて、前記化合物またはその代謝物質の血漿レベルの減少した個対間変動、
b. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の増加した平均血漿レベル、
c. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、
d. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の増加した平均血漿レベル、および、
e. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における処置の間の改善された臨床効果、
からなる群から選択される、少なくとも2つの効果を結果的にさらにもたらすことを特徴とする、請求項20に記載の方法。
【請求項33】
前記方法は、対応する非同位体的に濃縮された化合物に比べて、被験体における少なくとも1つの多形的に発現されたシトクロムP450アイソフォームによる、その投与ユニットごとの化合物の減少した代謝をもたらすことを特徴とする、請求項20に記載の方法。
【請求項34】
シトクロムP450アイソフォームは、CYP2C8、CYP2C9、CYP2C19、およびCYP2D6からなる群から選択されることを特徴とする、請求項33に記載の方法。
【請求項35】
前記化合物は、非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における少なくとも1つのシトクロムP450またはモノアミンオキシダーゼアイソフォームの減少した阻害によって特徴付けられることを特徴とする、請求項20に記載の方法。
【請求項36】
前記シトクロムP450またはモノアミンオキシダーゼアイソフォームは、CYP1A1、CYP1A2、CYP1B1、CYP2A6、CYP2A13、CYP2B6、CYP2C8、CYP2C9、CYP2C18、CYP2C19、CYP2D6、CYP2E1、CYP2G1、CYP2J2、CYP2R1、CYP2S1、CYP3A4、CYP3A5、CYP3A5P1、CYP3A5P2、CYP3A7、CYP4A11、CYP4B1、CYP4F2、CYP4F3、CYP4F8、CYP4F11、CYP4F12、CYP4X1、CYP4Z1、CYP5A1、CYP7A1、CYP7B1、CYP8A1、CYP8B1、CYP11A1、CYP11B1、CYP11B2、CYP17、CYP19、CYP21、CYP24、CYP26A1、CYP26B1、CYP27A1、CYP27B1、CYP39、CYP46、CYP51、MAOA、およびMAOBからなる群から選択されることを特徴とする、請求項35に記載の方法。
【請求項37】
前記方法は、対応する非同位体的に濃縮された化合物に比べて、診断上の肝胆道機能エンドポイントの悪化を低減することを特徴とする、請求項20に記載の方法。
【請求項38】
前記診断上の肝胆道機能エンドポイントは、アラニンアミノトランスフェラーゼ(「ALT」)、血清グルタミン酸ピルビン酸トランスアミナーゼ(「SGPT」)、アスパラギン酸アミノトランスフェラーゼ(「AST」、「SGOT」)、ALT/AST比、血清アルドラーゼ、アルカリフォスファターゼ(「ALP」)、アンモニアレベル、ビリルビン、ガンマグルタミントランスペプチダーゼ(「GGTP」、「γ-GTP」、「GGT」)、ロイシンアミノペプチダーゼ(「LAP」)、肝生検、肝臓超音波検査、肝臓核スキャン、5'-ヌクレオチダーゼ、および血液タンパク質からなる群から選択されることを特徴とする、請求項37に記載の方法。
【請求項39】
薬剤として使用されるための、請求項1に記載の化合物。
【請求項40】
ヤヌスキナーゼ3活性を阻害することによって改善された、障害の予防または処置のための薬剤の製造において使用されるための、請求項1に記載の化合物。
【請求項41】
構造式II、
【化36】

を有する化合物、またはその塩であって、
式中、
Z1は、アミノ保護基であり、
R3-R16は、水素および重水素からなる群から独立して選択され、
およびR3-R16の少なくとも1つは、重水素であることを特徴とする、化合物。
【請求項42】
Z1は、ベンジルであることを特徴とする、請求項41に記載の化合物。
【請求項43】
前記化合物は、
【化37】

からなる群から選択される構造式を有することを特徴とする、請求項42に記載の化合物。
【請求項44】
構造式IIの化合物、
【化38】

式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、Z2が、カルボキシル保護基である、構造式IIIの化合物を、テトラヒドロフランなどの適切な溶媒中で、水素化ナトリウムなどの適切な塩基の存在下において、構造式IVの化合物と反応させ、構造式Vの化合物を与える工程、
【化39】

構造式Vの化合物を、水または酸化重水素などの適切な溶媒中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIの化合物を与える工程、
【化40】

および構造式VIの化合物を、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式VIIの化合物を与える工程、
【化41】

を含むことを特徴とする方法。
【請求項45】
構造式IIの化合物、
【化42】

式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、構造式VIIIの化合物を、メタノールなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下、オルソギ酸メチルエステルなどの随意の脱水剤の存在下において、Z3がC1-C2アルキルである、構造式Xの化合物と反応させ、構造式IXの化合物を与える工程、
【化43】

構造式IXの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶媒中で、水酸化ナトリウムまたはd1-水酸化ナトリウム、または塩化重水素などの適切な塩基と反応させ、構造式IXの化合物を与える工程、
構造式IXの化合物を、水または酸化重水素などの適切な溶媒中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIIIの化合物を与える工程、
【化44】

構造式VIIIの化合物を、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式Xの化合物を与える工程、
【化45】

および構造式Xの化合物を、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムまたは重水素化リチウムアルミニウムなどの適切な還元剤と反応させ、構造式Xの化合物を与える工程、
【化46】

を含むことを特徴とする方法。
【請求項46】
構造式XIIIの化合物、
【化47】

式中、
Z1およびZ4は、水素およびアミノ保護基からなる群から独立して選択され、
R3-R18およびR20は、水素および重水素からなる群から独立して選択され、
R3-R18およびR20の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、構造式XIの化合物を、水とテトラヒドロフランの組み合わせなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、構造式IIの化合物と反応させ、構造式XIIの化合物を与える工程、
【化48】

および構造式XIIの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶媒中で、水素または重水素ガスなどの適切な還元剤および炭素上のパラジウムまたは炭素上の水酸化パラジウムなどの適切な触媒と反応させ、構造式XIIIの化合物を与える工程、
【化49】

を含むことを特徴とする方法。
【請求項1】
構造式I
【化1】

の化合物またはその薬学的に許容可能な塩であって、
式中、
R1-R2、R11-R13、またはR20の少なくとも1つは、重水素であり、
または、R3-R10の少なくとも6つは、重水素である場合、
R1-R20は、水素および重水素からなる群から独立して選択されることを特徴とする化合物。
【請求項2】
R1-R20の少なくとも1つは、独立して、約10%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項3】
R1-R20の少なくとも1つは、独立して、約50%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項4】
R1-R20の少なくとも1つは、独立して、約90%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項5】
R1-R20の少なくとも1つは、独立して、約98%以上の重水素濃縮を有することを特徴とする、請求項1に記載の化合物。
【請求項6】
前記化合物は、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

【化12】

【化13】

【化14】

【化15】

【化16】

【化17】

【化18】

【化19】

【化20】

からなる群から選択される構造式を有することを特徴とする、請求項1に記載の化合物。
【請求項7】
Dとして表わされる各位置は、約10%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項8】
Dとして表わされる各位置は、約50%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項9】
Dとして表わされる各位置は、約90%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項10】
Dとして表わされる各位置は、約98%以上の重水素濃縮を有することを特徴とする、請求項6に記載の化合物。
【請求項11】
前記化合物は、
【化21】

【化22】

【化23】

【化24】

【化25】

【化26】

【化27】

【化28】

からなる群から選択される構造式を有することを特徴とする、請求項6に記載の化合物。
【請求項12】
前記化合物は、構造式、
【化29】

を有することを特徴とする、請求項11に記載の化合物。
【請求項13】
前記化合物は、構造式、
【化30】

を有することを特徴とする、請求項11に記載の化合物。
【請求項14】
前記化合物は、構造式、
【化31】

を有することを特徴とする、請求項11に記載の化合物。
【請求項15】
前記化合物は、構造式、
【化32】

を有することを特徴とする、請求項11に記載の化合物。
【請求項16】
前記化合物は、構造式、
【化33】

を有することを特徴とする、請求項11に記載の化合物。
【請求項17】
前記化合物は、構造式、
【化34】

を有することを特徴とする、請求項11に記載の化合物。
【請求項18】
前記化合物は、構造式、
【化35】

を有することを特徴とする、請求項11に記載の化合物。
【請求項19】
薬学的に許容可能な担体とともに請求項1に記載の化合物を含むことを特徴とする医薬組成物。
【請求項20】
請求項1に記載の治療上有効な量の化合物を、それを必要とする患者に投与する工程を含むことを特徴とする、ヤヌスキナーゼ3媒介の障害の処置の方法。
【請求項21】
前記障害は、腎移植拒絶反応、関節リウマチ、乾癬、炎症性大腸疾患、ドライアイ症候群、喘息、および移植拒絶反応からなる群から選択されることを特徴とする、請求項20に記載の方法。
【請求項22】
追加の治療薬を投与する工程をさらに含むことを特徴とする、請求項20に記載の方法。
【請求項23】
前記追加の治療薬は、H+,K+ATPアーゼインヒビター、消化管運動性モジュレーター、非ステロイド性抗炎症剤、アニリド鎮痛剤、抗リウマチ剤、グルココルチコイド、および免疫抑制剤からなる群から選択されることを特徴とする、請求項22に記載の方法。
【請求項24】
前記H+,K+ATPアーゼインヒビターは、エソメプラゾール、ランソプラゾール、オメプラゾール、パントプラゾール、ラベプラゾール、およびテナトプラゾールからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項25】
前記消化管運動性モジュレーターは、ソラベグロン、テガセロッド、アロセトロン、シランセトロン、ドンペリドン、メトクロプラミド、イトプリド、シサプリド、レンザプリド、ザコプリド、オクトレオチド、ナロキソン、エリスロマイシン、およびベタネコールからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項26】
前記非ステロイド性抗炎症剤は、アセクロフェナク、アセメタシン、アモキシプリン、アスピリン、アザプロパゾン、ベノリラート、ブロムフェナク、カルプロフェン、セレコキシブ、コリンサリチル酸マグネシウム、ジクロフェナク、ジフルニサル、エトドラク、エトリコキシブ、ファイスラミン、フェンブフェン、フェノプロフェン、フルルビプロフェン、イブプロフェン、インドメタシン、ケトプロフェン、ケトロラク、ロルノキシカム、ロキソプロフェン、ルミラコキシブ、メロキシカム、メクロフェナム酸、メフェナム酸、メロキシカム、メタミゾール、サリチル酸メチル、サリチル酸マグネシウム、ナブメトン、ナプロキセン、ニメスリド、オキシフェンブタゾン、パレコキシブ、フェニルブタゾン、ピロキシカム、サリチルサリチル酸塩、スリンダク、スルフィンピラゾン、スプロフェン、テノキシカム、チアプロフェン酸、およびトルメチンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項27】
前記アニリド鎮痛剤は、アセトアミノフェンおよびフェナセチンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項28】
前記寛解導入抗リウマチ剤は、アザチオプリン、シクロスポリン A、D-ペニシラミン、金塩、水酸化クロロキン、レフルノミド、メトトレキサート、ミノサイクリン、スルファサラジン、シクロホスファミド、エタネルセプト、インフリキシマブ、アダリムマブ、アナキンラ、リツキシマブ、およびアバタセプトからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項29】
前記グルココルチコイドは、ベクロメタゾン、ブデソニド、フルニソリド、ベタメタゾン、フルチカゾン、トリアムシノロン、モメタゾン、シクレソニド、ヒドロコルチゾン、酢酸コルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニソロン、およびデキサメタゾンからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項30】
前記免疫抑制剤は、フィンゴリモド、シクロスポリン A、アザチオプリン、デキサメタゾン、タクロリムス、シロリムス、ピメクロリムス、ミコフェノール酸塩、エベロリムス、バシリキシマブ、ダクリズマブ、抗胸腺細胞グロブリン、抗リンパ球グロブリン、およびCTLA4IgGからなる群から選択されることを特徴とする、請求項23に記載の方法。
【請求項31】
a. 非同位体的に濃縮された化合物に比べて、前記化合物またはその代謝物質の血漿レベルの減少した個対間変動、
b. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の増加した平均血漿レベル、
c. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、
d. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の増加した平均血漿レベル、および、
e. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における処置の間の改善された臨床効果、
からなる群から選択される、少なくとも1つの効果を結果的にさらにもたらすことを特徴とする、請求項20に記載の方法。
【請求項32】
a. 非同位体的に濃縮された化合物に比べて、前記化合物またはその代謝物質の血漿レベルの減少した個対間変動、
b. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の増加した平均血漿レベル、
c. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の減少した平均血漿レベル、
d. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記化合物の少なくとも1つの代謝物質の増加した平均血漿レベル、および、
e. 非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における処置の間の改善された臨床効果、
からなる群から選択される、少なくとも2つの効果を結果的にさらにもたらすことを特徴とする、請求項20に記載の方法。
【請求項33】
前記方法は、対応する非同位体的に濃縮された化合物に比べて、被験体における少なくとも1つの多形的に発現されたシトクロムP450アイソフォームによる、その投与ユニットごとの化合物の減少した代謝をもたらすことを特徴とする、請求項20に記載の方法。
【請求項34】
シトクロムP450アイソフォームは、CYP2C8、CYP2C9、CYP2C19、およびCYP2D6からなる群から選択されることを特徴とする、請求項33に記載の方法。
【請求項35】
前記化合物は、非同位体的に濃縮された化合物に比べて、その投与ユニットごとの前記被験体における少なくとも1つのシトクロムP450またはモノアミンオキシダーゼアイソフォームの減少した阻害によって特徴付けられることを特徴とする、請求項20に記載の方法。
【請求項36】
前記シトクロムP450またはモノアミンオキシダーゼアイソフォームは、CYP1A1、CYP1A2、CYP1B1、CYP2A6、CYP2A13、CYP2B6、CYP2C8、CYP2C9、CYP2C18、CYP2C19、CYP2D6、CYP2E1、CYP2G1、CYP2J2、CYP2R1、CYP2S1、CYP3A4、CYP3A5、CYP3A5P1、CYP3A5P2、CYP3A7、CYP4A11、CYP4B1、CYP4F2、CYP4F3、CYP4F8、CYP4F11、CYP4F12、CYP4X1、CYP4Z1、CYP5A1、CYP7A1、CYP7B1、CYP8A1、CYP8B1、CYP11A1、CYP11B1、CYP11B2、CYP17、CYP19、CYP21、CYP24、CYP26A1、CYP26B1、CYP27A1、CYP27B1、CYP39、CYP46、CYP51、MAOA、およびMAOBからなる群から選択されることを特徴とする、請求項35に記載の方法。
【請求項37】
前記方法は、対応する非同位体的に濃縮された化合物に比べて、診断上の肝胆道機能エンドポイントの悪化を低減することを特徴とする、請求項20に記載の方法。
【請求項38】
前記診断上の肝胆道機能エンドポイントは、アラニンアミノトランスフェラーゼ(「ALT」)、血清グルタミン酸ピルビン酸トランスアミナーゼ(「SGPT」)、アスパラギン酸アミノトランスフェラーゼ(「AST」、「SGOT」)、ALT/AST比、血清アルドラーゼ、アルカリフォスファターゼ(「ALP」)、アンモニアレベル、ビリルビン、ガンマグルタミントランスペプチダーゼ(「GGTP」、「γ-GTP」、「GGT」)、ロイシンアミノペプチダーゼ(「LAP」)、肝生検、肝臓超音波検査、肝臓核スキャン、5'-ヌクレオチダーゼ、および血液タンパク質からなる群から選択されることを特徴とする、請求項37に記載の方法。
【請求項39】
薬剤として使用されるための、請求項1に記載の化合物。
【請求項40】
ヤヌスキナーゼ3活性を阻害することによって改善された、障害の予防または処置のための薬剤の製造において使用されるための、請求項1に記載の化合物。
【請求項41】
構造式II、
【化36】

を有する化合物、またはその塩であって、
式中、
Z1は、アミノ保護基であり、
R3-R16は、水素および重水素からなる群から独立して選択され、
およびR3-R16の少なくとも1つは、重水素であることを特徴とする、化合物。
【請求項42】
Z1は、ベンジルであることを特徴とする、請求項41に記載の化合物。
【請求項43】
前記化合物は、
【化37】

からなる群から選択される構造式を有することを特徴とする、請求項42に記載の化合物。
【請求項44】
構造式IIの化合物、
【化38】

式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、Z2が、カルボキシル保護基である、構造式IIIの化合物を、テトラヒドロフランなどの適切な溶媒中で、水素化ナトリウムなどの適切な塩基の存在下において、構造式IVの化合物と反応させ、構造式Vの化合物を与える工程、
【化39】

構造式Vの化合物を、水または酸化重水素などの適切な溶媒中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIの化合物を与える工程、
【化40】

および構造式VIの化合物を、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式VIIの化合物を与える工程、
【化41】

を含むことを特徴とする方法。
【請求項45】
構造式IIの化合物、
【化42】

式中、
Z1は、水素およびアミノ保護基からなる群から選択され、
R3-R16は、水素および重水素からなる群から独立して選択され、
R3-R16の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、構造式VIIIの化合物を、メタノールなどの適切な溶媒中で、トルエンスルフォン酸などの適切な酸の存在下、オルソギ酸メチルエステルなどの随意の脱水剤の存在下において、Z3がC1-C2アルキルである、構造式Xの化合物と反応させ、構造式IXの化合物を与える工程、
【化43】

構造式IXの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶媒中で、水酸化ナトリウムまたはd1-水酸化ナトリウム、または塩化重水素などの適切な塩基と反応させ、構造式IXの化合物を与える工程、
構造式IXの化合物を、水または酸化重水素などの適切な溶媒中で、塩化水素または塩化重水素などの適切な酸と反応させ、構造式VIIIの化合物を与える工程、
【化44】

構造式VIIIの化合物を、テトラヒドロフランなどの適切な溶媒中で、トリアセトキシ水素化ホウ素ナトリウムまたはトリアセトキシ重水素化ホウ素ナトリウムなどの適切な還元剤の存在下において、構造式VIIの化合物と反応させ、構造式Xの化合物を与える工程、
【化45】

および構造式Xの化合物を、テトラヒドロフランなどの適切な溶媒中で、水素化アルミニウムリチウムまたは重水素化リチウムアルミニウムなどの適切な還元剤と反応させ、構造式Xの化合物を与える工程、
【化46】

を含むことを特徴とする方法。
【請求項46】
構造式XIIIの化合物、
【化47】

式中、
Z1およびZ4は、水素およびアミノ保護基からなる群から独立して選択され、
R3-R18およびR20は、水素および重水素からなる群から独立して選択され、
R3-R18およびR20の少なくとも1つは、重水素である、を調製する方法であって、
前記方法は、構造式XIの化合物を、水とテトラヒドロフランの組み合わせなどの適切な溶媒中で、炭酸カリウムなどの適切な塩基の存在下において、構造式IIの化合物と反応させ、構造式XIIの化合物を与える工程、
【化48】

および構造式XIIの化合物を、水または酸化重水素およびメタノールまたはd4-メタノールの組み合わせなどの適切な溶媒中で、水素または重水素ガスなどの適切な還元剤および炭素上のパラジウムまたは炭素上の水酸化パラジウムなどの適切な触媒と反応させ、構造式XIIIの化合物を与える工程、
【化49】

を含むことを特徴とする方法。
【公表番号】特表2012−524085(P2012−524085A)
【公表日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願番号】特願2012−506006(P2012−506006)
【出願日】平成22年4月20日(2010.4.20)
【国際出願番号】PCT/US2010/031773
【国際公開番号】WO2010/123919
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(511251940)オースペックス ファーマシューティカルズ,エルエルシー (1)
【Fターム(参考)】
【公表日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願日】平成22年4月20日(2010.4.20)
【国際出願番号】PCT/US2010/031773
【国際公開番号】WO2010/123919
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(511251940)オースペックス ファーマシューティカルズ,エルエルシー (1)
【Fターム(参考)】
[ Back to top ]

