ヨウ化リチウム無水塩、ヨウ化リチウム無水塩の製造方法、固体電解質、及びリチウムイオン電池
【解決課題】イオン導電性を高くすることができるヨウ化リチウムを提供すること。
【解決手段】X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩。
【解決手段】X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヨウ化リチウム無水塩及びその製造方法に関する。また、本発明は、該ヨウ化リチウム無水塩又はその製造方法により得られたヨウ化リチウム無水塩を用いる固体電解質に関する。また、本発明は、該固体電解質を用いるリチウムイオン電池に関する。
【背景技術】
【0002】
金属ヨウ化物の用途としては、分析用試薬、医薬関係(去炎剤、利尿剤)、写真用乳剤などがある。また、最近では、ナイロン繊維添加剤、液晶ディスプレイ、偏光フィルム素材としての用途も報告されている。
【0003】
金属ヨウ化物の中でも、ヨウ化リチウムは、特殊な材料であり、心臓ペースメーカーのバッテリー(リチウムヨウ素電池の電解質)として使用されている。また、中性子検出の燐光体としての用途もある。
【0004】
また、不燃性の無機固体電解質は、電池の安全性を高めることから、特に注目されている材料である。そして、特に、リチウムイオン電池の固体電解質としての用途が、ヨウ化リチウムの用途として注目されている。
【0005】
ヨウ化リチウムには、含水塩と無水塩とがあることが知られている。従来のヨウ化リチウム含水塩の製造方法としては、炭酸リチウムとヨウ化水素酸を反応させる方法(非特許文献1)、炭酸リチウムに水を分散させたスラリーに、ヨウ化水素ガスを吹き込む方法(非特許文献2)が知られている。
【0006】
また、金属ヨウ化物の水溶液を製造する方法として、ヨウ素を鉄粉で処理する方法、ヨウ素を有機酸又はその金属塩で還元する方法、ヨウ素を水加ヒドラジンで還元する方法(特許文献1)が知られている。また、水酸化アルカリ又は炭酸アルカリに、ヒドラジン及びヨウ素を反応させる方法(特許文献2)が提案されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平9−156920号公報
【特許文献2】特開昭61−48403号公報
【非特許文献】
【0008】
【非特許文献1】「化学大辞典 9 縮刷版」、発行所 共立出版 発行年1993年 426頁
【非特許文献2】「新実験化学講座 8 無機化合物の合成(II)」、発行所 丸善 昭和52年発行 462頁
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、従来の製造方法で得られたヨウ化リチウムをリチウムイオン電池の固体電解質に用いた場合、イオン伝導性の高いものが得られないという問題があることを見出した。
【0010】
従って、本発明の目的は、イオン伝導性を高くすることができるヨウ化リチウムを提供することにある。また、本発明の目的は、イオン伝導性が高い固体電解質を提供することにある。
【課題を解決するための手段】
【0011】
本発明者らは、上記従来技術における課題を解決すべく、鋭意研究を重ねた結果、ヨウ化リチウムをリチウムイオン電池用固体電解質の原材料に用いた場合、ヨウ化リチウム中のヨウ化リチウム含水塩が、イオン伝導度の低下に、大きく影響を与えること、及びヨウ化リチウム含水塩を焼成してヨウ化リチウム無水塩を得る際に、ヨウ化リチウム含水塩中に、Na又はKが存在すると、ヨウ化リチウム含水塩からヨウ化リチウム無水塩への転移が起こり難くなることを見出し、本発明を完成させるに至った。
【0012】
すなわち、本発明(1)は、X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩を提供するものである。
【0013】
また、本発明(2)は、Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法を提供するものである。
【0014】
また、本発明(3)は、前記本発明(1)のヨウ化リチウム無水塩を原料に用いて製造された固体電解質を提供するものである。
【0015】
また、本発明(4)は、前記本発明(1)のヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上と、を、反応させることにより得られる固体電解質を提供するものである。
【0016】
また、本発明(5)は、前記本発明(3)又は(4)いずれかの固体電解質が用いられているリチウムイオン電池を提供するものである。
【発明の効果】
【0017】
本発明によれば、イオン導電性を高くすることができるヨウ化リチウムを提供することができる。また、本発明によれば、イオン電導性が高い固体電解質を提供することができる。
【図面の簡単な説明】
【0018】
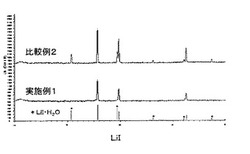
【図1】実施例1及び比較例2で得られたヨウ化リチウム無水塩のX線回折図である。
【図2】比較例1で得られたヨウ化リチウム無水塩のX線回折図である。
【図3】比較例5で得られたヨウ化リチウム無水塩のX線回折図である。
【発明を実施するための形態】
【0019】
本発明のヨウ化リチウム無水塩は、X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下、好ましくは2%以下である。回折ピークの強度比((b/a)×100)が、上記範囲であることにより、イオン伝導性が高くなる。一方、回折ピークの強度比((b/a)×100)が、上記範囲を超えると、イオン伝導性が低くなる。
【0020】
本発明のヨウ化リチウム無水塩の水含有量は、好ましくは2.0質量%以下、特に好ましくは1.5質量%以下である。ヨウ化リチウム無水塩の水含有量が上記範囲であることにより、イオン伝導性が高くなる。なお、ヨウ化リチウム無水塩の水含有量であるが、試料5gを磁性ルツボに採取して、不活性ガス雰囲気下において300℃で1時間加熱したときの重量減少率を、ヨウ化リチウム無水塩の水含有量とする。
【0021】
本発明のヨウ化リチウム無水塩中のFeの含有量は10質量ppm以下であり且つCuの含有量が10質量ppm以下であることが好ましく、Feの含有量が5質量ppm以下であり且つCuの含有量が5質量ppm以下であることが特に好ましい。ヨウ化リチウム無水塩のFe及びCuの含有量が上記範囲にあることにより、Fe及びCuの導電性不純物に起因する電池の短絡の危険性が低くなる。なお、Fe及びCuの含有量は、ICP−AES法等によって測定される。
【0022】
本発明のヨウ化リチウム無水塩の製造方法は、Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法である。
【0023】
本発明のヨウ化リチウム無水塩の製造方法に係る焼成工程は、ヨウ化リチウム含水塩を焼成することにより、ヨウ化リチウム含水塩を無水塩へと転移させて、ヨウ化リチウム無水塩を得る工程である。
【0024】
焼成工程に係るヨウ化リチウム含水塩は、焼成工程において焼成される焼成原料であり、水和水として水を含有するヨウ化リチウムである。焼成工程に係るヨウ化リチウム含水塩は、1水塩に限らず、2水塩あるいは3水塩であってもよく、これらのうち、1水塩が、焼成工程を効率よく行える点で好ましい。
【0025】
焼成工程に係るヨウ化リチウム含水塩中のNa及びKの含有量は、Na及びKの合計で、20質量ppm以下、好ましくは10質量ppm以下である。ヨウ化リチウム含水塩中のNa及びKの含有量の合計が上記範囲にあることにより、含水塩から無水塩への転移が起こり易くなる。一方、ヨウ化リチウム含水塩中のNa及びKの含有量の合計が上記範囲を超えると、Na又はKにより、含水塩から無水塩への転移が阻害されるため、焼成後のヨウ化リチウム含水塩の量が多くなり過ぎ、焼成後のヨウ化リチウムのX線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%を超えてしまい、その結果、イオン伝導性が低くなってしまう。
【0026】
焼成工程に係るヨウ化リチウム含水塩中のCl及びBrの含有量は、好ましくはClの含有量が1000ppm以下且つBrの含有量が1000ppm以下、特に好ましくはClの含有量が500ppm以下且つBrの含有量が1000ppm以下である。ヨウ化リチウム含水塩中のCl及びBrの含有量が上記範囲にあることにより、焼成後のヨウ化リチウム無水塩の回折ピーク強度比((b/a)×100)が小さくなる。
【0027】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの焼成温度は、300〜440℃、好ましくは350〜400℃、特に好ましくは350〜380℃である。焼成工程における焼成温度が上記範囲にあることにより、ヨウ化リチウム含水塩から無水塩への転移を効率良く行うことができる。一方、焼成温度が、上記範囲未満だと、ヨウ化リチウム含水塩から無水塩への転移が起こり難くなるため、焼成後の含水塩の量が多くなり過ぎ、また、上記範囲を超えると、ヨウ化リチウムの融点を超えるため、焼成容器への付着が多くなり過ぎる。
【0028】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの焼成時間は、焼成するヨウ化リチウム含水塩の量により、適宜選択されるが、好ましくは4〜24時間、特に好ましくは6〜15時間である。
【0029】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの雰囲気は、不活性ガス雰囲気下又は真空下である。不活性ガスとしては、例えば、窒素ガス、ヘリウムガス、アルゴンガス等が挙げられる。なお、真空下とは、ゲージ圧で、−0.09MPaG以下、好ましくは−0.10MPaG以下の真空雰囲気を指す。
【0030】
焼成工程を行った後、得られたヨウ化リチウム無水塩を、グローブボックス内や真空デシケーター内等で、空気と接触させない状態で冷却し、必要に応じて、粉砕する。
【0031】
焼成工程に係るヨウ化リチウム含水塩は、どのような製造方法により製造されてもよいが、以下に説明するヨウ化リチウム含水塩の製造方法の第一の形態例(以下、ヨウ化リチウム含水塩の製造方法(1)とも記載)により製造されたヨウ化リチウム含水塩であることが、Na及びKの含有量が極めて低いヨウ化リチウム含水塩が得られるので、焼成後のヨウ化リチウム無水塩の回折ピーク強度比((b/a)×100)が小さくなる点で好ましい。
【0032】
ヨウ化リチウム含水塩の製造方法(1)は、反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させて、該反応原料のリチウム化合物のヨウ化を行うヨウ化反応工程を行うことにより、ヨウ化リチウム含水塩を得るヨウ化リチウム含水塩の製造方法である。
【0033】
ヨウ化反応工程に係る反応原料のリチウム化合物としては、例えば、水酸化リチウム、炭酸リチウム、塩化リチウム、硝酸リチウム、硫酸リチウム等が挙げられる。これらのうち、反応原料のリチウム化合物としては、アニオンが、ヨウ化反応工程の後の濃縮又は乾燥の過程で、ヨウ化リチウム中の不純物として取り込まれて、イオン伝導度が低くなる要因となることがない点で、水酸化リチウム、炭酸リチウムが好ましい。
【0034】
反応原料のリチウム化合物は、不純物が少ないほど好ましく、特に、Na及びKの含有量は、Na及びKの合計量で、20ppm質量以下が好ましく、10質量ppm以下が特に好ましい。また、反応原料のリチウム化合物中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0035】
ヨウ化反応工程に係る反応原料のヨウ素は、不純物が少ないほど好ましく、純度95%質量以上が特に好ましく、純度98質量%以上がより好ましい。特に、ヨウ化反応工程に係る反応原料のヨウ素中のNa及びKの含有量は、Na及びKの合計量で、20質量ppm以下が好ましく、10質量ppm以下が特に好ましい。また、ヨウ化反応工程に係る反応原料のヨウ素中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0036】
ヨウ化反応工程に係る還元剤は、Na及びKのいずれも有さない還元剤である。Na及びKを有さない還元剤とは、分子中にNa及びKのいずれの元素も有さない化合物を指す。ヨウ化反応工程に係る還元剤としては、メタノール、エタノール等のアルコール、蟻酸、蓚酸等の有機酸、ショ糖、ブドウ糖等の糖類、ヒドラジン類などが挙げられる。ヨウ化反応工程に係る還元剤は、不純物が少ないほど好ましく、純度95%質量以上が特に好ましく、純度98質量%以上がより好ましい。特に、ヨウ化反応工程に係る還元剤中のNa及びKの含有量は、Na及びKの合計量で、20質量ppm以下が好ましく、10質量ppm以下が特に好ましい。また、ヨウ化反応工程に係る還元剤中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0037】
Na及びKを有さない還元剤に係るヒドラジン類としては、例えば、水加ヒドラジンが挙げられる。また、Na及びKを有さない還元剤に係るヒドラジン類としては、水加ヒドラジン以外にも、水溶媒中でヒドラジンを存在させることができる化合物であればよく、例えば、炭酸ヒドラジン、硫酸ヒドラジン、塩酸ヒドラジン、臭化水素酸ヒドラジン、アジピン酸ヒドラジド、フェニルヒドラジド、カーボジヒドラジド、イソフタル酸ジヒドラジド、セバシン酸ヒドラジド、ドデカンジヒドラジド、ベンゾフェノンヒドラジド、ステアリン酸ジヒドラジド、マロン酸ジヒドラジド、コハク酸ジヒドラジド、マレイン酸ヒドラジド、マレイン酸ヒドラジドモノカリウム、マレイン酸ヒドラジドモノナトリウム、ベンゼンスルホニルヒドラジド、モノメチルヒドラジン、クエン酸ヒドラジド、p−トルエンスルホニルヒドラジド等が挙げられる。これらのうち、Na及びKを有さない還元剤に係るヒドラジン類としては、水加ヒドラジンが、反応後に窒素と水に分解するので、還元剤に由来する副生成物による不純物の混入がない点で好ましい。
【0038】
ヨウ化反応工程に係る水溶媒は、ヨウ化反応が行われる溶媒である。ヨウ化反応工程に係る水溶媒は、イオン交換樹脂により、Na、K、Ca、Fe、Cu、Cl、SO4等のイオン性不純物が除去された純水であることが、反応中にこれらのイオン性の不純物が混入することを防止でき、イオン伝導性が低くなる原因となる不純物が少ないヨウ化リチウム含水塩が得られる点で好ましい。
【0039】
ヨウ化反応工程において、反応原料のヨウ素の使用量に対する反応原料のリチウム化合物の使用量の比は、反応原料のヨウ素中のI原子換算のモル数に対する反応原料のリチウム化合物中のLi原子換算のモル数の比(Li/I)で、好ましくは0.98〜1.02、特に好ましくは0.99〜1.01である。
【0040】
ヨウ化反応工程において、還元剤の使用量は、残存するヨウ素を低減し且つ還元剤由来の不純物の混入を少なくする点で、使用するヨウ素に対して当量が好ましい。なお、ヨウ化反応工程において、ヨウ素を分割して水溶媒に添加する場合は、分割添加毎に、添加したヨウ素の量に対して当量の還元剤を使用することが好ましい。
【0041】
ヨウ化反応工程に係る反応原料のリチウム化合物、ヨウ素、Na及びKを有さない還元剤は、いずれもFeの含有量が10質量ppm以下であり且つCuの含有量が10質量ppm以下であることが好ましく、Feの含有量が5質量ppm以下であり且つCuの含有量が5質量ppm以下であることが特に好ましい。これらのFe及びCuの含有量が上記範囲にあることにより、Fe及びCuの導電性不純物に起因する電池の短絡の危険性が低くなる。
【0042】
ヨウ化反応工程において、水溶媒の使用量は、特に制限されない。反応原料のリチウム化合物として、炭酸リチウム等の難溶性の化合物を使用する場合、ヨウ化反応工程後の濃縮操作で濃縮に供されるヨウ化リチウム水溶液の濃度が低くなり過ぎないように、スラリー濃度が10〜40質量%程度であることが好ましい。
【0043】
ヨウ化反応工程において、反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させる方法としては、特に制限されないが、反応原料のリチウム化合物が溶解又は分散された水溶媒に、ヨウ素及び還元剤を添加する方法が、反応を制御し易い点で好ましい。
【0044】
リチウム化合物を含有する水溶媒に、ヨウ素及び還元剤を添加する方法では、ヨウ素及び還元剤を、リチウム化合物を含有する水溶媒に添加すると急激に反応することから、全使用量のヨウ素を何回かに分割して、リチウム化合物を含有する水溶媒に添加することが好ましい。このとき、ヨウ素を分割添加する毎に、反応を完結させるために必要量の還元剤を、分割添加したヨウ素の添加量に合わせて添加することが好ましい。すなわち、リチウム化合物を含有する水溶媒に、反応に必要な量のヨウ素を複数回に分けて添加し、且つ、ヨウ素の分割添加毎に、添加したヨウ素が反応するために必要な量の還元剤を添加することにより、ヨウ化反応工程を行うことが好ましい。
【0045】
リチウム化合物を含有する水溶媒に、ヨウ素を分割添加する場合、1回当たりのヨウ素の添加量は、ヨウ素の使用量の1/100〜1/20が好ましい。リチウム化合物を含有する水溶媒にヨウ素を添加した後、しばらくすると、反応液がヨウ素イオンの溶解により茶褐色に着色するので、この色が元の色に戻るまで、リチウム化合物を含有する水溶媒に還元剤を添加すればよい。リチウム化合物を含有する水溶媒に、ヨウ素を分割添加する場合、分割する回数は、特に制限されない。
【0046】
ヨウ化反応工程において、反応温度は、特に制限されないが、80℃以上だと、反応が急激過ぎるため、ヨウ素がリチウム化合物と反応する前に、反応系外に揮散し易いので、25〜70℃が好ましい。
【0047】
ヨウ化反応工程において、反応時間は、特に制限されず、所定量の反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を接触させた後、ヨウ素による反応溶液の茶褐色の着色がなくなるまで、反応を行う。また、所定量の反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を接触させた後、30分以上経過しても、ヨウ素による反応溶液の茶褐色の着色がなくならない場合は、反応溶液に、粉末状の炭酸リチウム又は水酸化リチウムを微量加えて、反応を完結させる。このとき、反応を完結させるために、0.25時間以上、好ましくは0.5〜2時間反応を継続させる。
【0048】
ヨウ化反応工程を行った後、反応液をろ過して、微量の不溶解残渣を分離し、ろ液を濃縮及び乾燥して、ヨウ化リチウム1水塩の結晶を得る。このときの乾燥温度は、ヨウ化リチウム3水塩が1水塩になる温度範囲、具体的には、80〜150℃が好ましい。乾燥後のヨウ化リチウムは、それ自身が1水塩中に自己溶解しており、冷却することにより、塊状の固体として得られる。なお、乾燥雰囲気は、真空下、大気下又はアルゴンガス、ヘリウムガス、窒素ガス等の不活性ガス雰囲気下でもよいが、120℃以上の乾燥温度では、大気下で乾燥を行うと、ヨウ化リチウム含水塩が分解するため、120℃以上で乾燥を行う場合は、真空下又は不活性ガス雰囲気下で行うことが好ましい。
【0049】
このようにして、本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩のX線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)は、3%以下である。更に、本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩のFeの含有量は10ppm以下であり且つCuの含有量は10ppm以下であることが好ましい。
【0050】
本発明のヨウ化リチウム無水塩及び本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩は、リチウムイオン電池の固体電解質の製造原料として、好適である。
【0051】
本発明の固体電解質は、本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩を原料に用いて製造された固体電解質であり、好ましくは本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上の硫化物と、を、反応させることにより得られる固体電解質である。
【0052】
本発明の固体電解質としては、LiI−P2S5−Li2S、LiI−SiS2−Li2S、LiI−GeS2−Li2S等が挙げられる。
【0053】
本発明の固体電解質に係る硫化物の物性は、特に制限されないが、ヨウ化リチウム無水物との均一混合が容易になる観点から、平均粒子径が100μm以下であることが好ましく、20〜80μmであることが特に好ましい。
【0054】
本発明の固体電解質において、ヨウ化リチウム無水塩と硫化物との配合割合は、固体電解質の組成に合わせて、適宜選択される。例えば、固体電解質として、ヨウ化リチウム無水物と硫化リンと硫化リチウムから、LiI/P2S5/Li2S=0.30/0.30/0.40の組成のものを得る場合には、ヨウ化リチウムに対する硫化リンのモル比及びヨウ化リチウムに対する硫化リチウムのモル比が、いずれも、2.2〜2.4、好ましくは2.30〜2.36である。
【0055】
本発明の固体電解質は、例えば、本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩と、本発明の固体電解質に係る硫化物とを、メカニカルミリングにより処理して、反応させることにより得られる。メカニカルミリング処理を行う機器としては、例えば、ビーズミル、遊星型ボールミル、振動ミル等の粉砕機器、つまり、混合対象である粉体中に粒状媒体を存在させて、それらを高速で流動させる機器が挙げられる。そして、ヨウ化リチウム無水物、硫化物及び粒状媒体を高速で流動させることで、粒状媒体により、ヨウ化リチウム無水物及び硫化物に、機械的エネルギーが加えられる。
【0056】
メカニカルミリングの回転速度及び回転時間をコントロールすることで、処理物をより微細で均質にすることができるが、装置の種類や原料の種類あるいは使用用途に応じて、適切な条件を適宜選択して、メカニカルミリング処理を行うことが好ましい。例えば、遊星型ボールミルを使用する場合、回転速度を50〜600回転/分とし、2〜60時間処理することが好ましい。
【0057】
メカニカルミリング処理後、必要によりメカニカルミリング処理物をガラス転移以上の温度で加熱処理することができる。
【0058】
本発明の固体電解質は、固体リチウムイオン電池の構成部材、例えば、電解質層、正極層、負極層等に好適に使用される。
【0059】
本発明のリチウムイオン電池は、本発明の固体電解質が用いられているリチウムイオン電池である。
【実施例】
【0060】
以下、本発明を実施例により詳細に説明するが、本発明はこれらに限定されるものではない。
【0061】
実施例及び比較例で用いた試薬の品位を表1に示す。
【0062】
【表1】

1)表中「−」は、1質量ppm以下であることを示す。
LiOH・H2O(試薬A):LiOH含有量 57.78質量%
LiOH・H2O(試薬B):LiOH含有量 56.80質量%
Li2CO3:Li2CO3含有量 99.65質量%
ヨウ素:I含有量 99質量%以上、純正化学株式会社製、試薬1級
KI:KI含有量 99.5質量%、純正化学株式会社製
水加ヒドラジン:80質量%水溶液、純正化学株式会社製、試薬1級
【0063】
(実施例1)
<ヨウ化リチウム含水塩の製造(ヨウ化反応工程)>
水酸化リチウム1水塩(試薬A)67.1gを、1Lビーカーに秤量した。そこに、イオン交換水350mLを加えて溶解させ、水酸化リチウム水溶液を調製した。次いで、これとは別に、ヨウ素203.0gをマヨネーズ瓶に秤量した。秤量後フタをして、ヨウ素の揮散を防止した。次いで、水加ヒドラジン25gを50mlビーカーに秤量した。
次いで、前記水酸化リチウム水溶液を撹拌しながら、(1)ヨウ素5gを添加した。添加の際、ヨウ素イオンの溶出により、水溶液の色が無色から茶褐色に変化するのを確認した。次いで、(2)ヨウ素を添加した水酸化リチウム水溶液を撹拌しながら、前記水加ヒドラジンを滴下した。水溶液の色が茶褐色から無色に変化するのを確認した。次いで、加水ヒドラジンの滴下による窒素ガスの発泡が無くなったことを確認した後、再び(1)の操作を行い、次いで、(2)の操作を行った。以後は、(1)の操作と(2)の操作を繰り返し、最初に秤量したヨウ素がなくなるまで、繰り返し操作を行った。
ヨウ素を全量添加した後、水加ヒドラジンを滴下し、反応溶液の色が無色になったところを反応の終点とした。
次いで、高純度炭酸リチウム1gを添加して撹拌し、過剰のヨウ素を反応させた。反応溶液をろ過して、微量の不溶解残渣を分離した。なお、ろ過には、フィルターとして、アドバンテック社製5Cろ紙を使用した。次いで、ろ液を加熱して水分を蒸発させて濃縮した。濃縮後、濃縮物を、乾燥機(ヤマト社製送風定温乾燥機DKN402)を用いて、120℃で15時間乾燥させ、冷却及び固化して、ヨウ化リチウム含水塩Aを得た。
得られたヨウ化リチウム含水塩Aについて、不純物の含有量を測定した。その結果を表2に示す。
【0064】
<ヨウ化リチウム無水塩の製造(焼成工程)>
次いで、上記のようにして得たヨウ化リチウム含水塩Aを、雰囲気調製炉(株式会社モトヤマ社製、MS電気炉NKC型)にて、窒素雰囲気下350℃で8時間焼成した。焼成後、焼成物を炉から取り出して、真空デシケーター(−0.10MPaG)に入れ、真空下で冷却し、ヨウ化リチウム無水塩Bを得た。
得られたヨウ化リチウム無水塩Bの水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度を測定した。その結果を表3に示す。
【0065】
(比較例1)
<ヨウ化リチウム含水塩の製造>
ヨウ化カリウム166gを1Lビーカーに秤量し、イオン交換水500mlを加えて、ヨウ化カリウム溶液を調製した。次いで、ここに炭酸リチウム36.9gを加えて撹拌し、分散させた。次いで、ここに17.5%塩酸208gを10分間かけて滴下して反応を行った。反応終了後、反応液が酸性(pH=1.5)を示したので、粉末の炭酸リチウムを添加してpH=7.0に調整した。
以下、実施例1と同様にして、反応溶液のろ過、ろ液の濃縮、濃縮物の乾燥
、冷却及び固化を行い、ヨウ化リチウム含水塩a1を得た。
得られたヨウ化リチウム含水塩a1について、不純物の含有量を測定した。その結果を表2に示す。
<ヨウ化リチウム無水塩の製造>
次いで、ヨウ化リチウム含水塩Aに代えて、ヨウ化リチウム含水塩a1とすること、及び焼成時間8時間に代えて、焼成時間6時間とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b1を得た。
得られたヨウ化リチウム無水塩b1の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0066】
(比較例2)
<ヨウ化リチウム含水塩の製造>
実施例1と同様の方法で行いヨウ化リチウム含水塩Aを得た。
<ヨウ化リチウム無水塩の製造>
焼成温度350℃に代えて、焼成温度280℃とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b2を得た。
得られたヨウ化リチウム無水塩b2の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0067】
(比較例3)
<ヨウ化リチウム含水塩の製造>
水酸化リチウム1水塩(試料A)に代えて、水酸化リチウム1水塩(試料B)とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム含水塩a2を得た。
得られたヨウ化リチウム含水塩a2について、不純物の含有量を測定した。その結果を表2に示す。
<ヨウ化リチウム無水塩の製造>
ヨウ化リチウム含水塩Aに代えて、ヨウ化リチウム含水塩a2とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b3を得た。
得られたヨウ化リチウム無水塩b3の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0068】
(比較例4)
市販の無水ヨウ化リチウム(キシダ化学社製)を、比較例4のヨウ化リチウム無水塩b4とした。
ヨウ化リチウム無水塩b4の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0069】
(比較例5)
比較例4のヨウ化リチウム含水塩b4を、雰囲気調製炉(株式会社モトヤマ社製、MS電気炉NKC型)にて、窒素雰囲気下350℃で8時間焼成した。焼成後、焼成物を炉から取り出して、真空デシケーター(−0.10MPaG)に入れ、真空下で冷却し、ヨウ化リチウム無水塩b5を得た。
得られたヨウ化リチウム無水塩b5の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0070】
【表2】

1)表中「*」は、1000質量ppm以下であることを示す。
【0071】
【表3】

1)回折ピークの強度比:(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)
2)表中「*」は、1000質量ppm以下であることを示す。
【0072】
<ヨウ化リチウムの水含有量の分析>
試料5gを磁性ルツボに採取して、窒素雰囲気下において300℃で2時間加熱したときの重量減少率を測定し、重量減少率を水含有量とした。
【0073】
<XRD回折分析>
ヨウ化リチウムをグローブボックス内にて粉砕したものを試料として、粉末X線回折分析を行い、図1〜図3のチャートを得た。X線回折法(XRD)の測定には、線源としてCuKαを用い、測定装置としてリガク社製UltimaIV型を用いた。
【0074】
<不純物Na、K含有量の測定>
試料1.0gをイオン交換水に溶解して、濃硝酸1mlを添加して、全量を50mlとし、硝酸酸性下で、原子吸光分析装置で測定した。
【0075】
<不純物Cl含有量の測定>
試料1.0gをイオン交換水に溶解して、全量を50mlとし、イオンクロマト分析装置で測定した。
【0076】
<不純物Br含有量の測定>
試料0.1gをイオン交換水に溶解して、全量を100mlとし、イオンクロマト分析装置で測定した。
【0077】
<不純物Fe、Cu、Caの測定>
試料1.0gをイオン交換水に溶解して、濃硝酸1mlを添加して、全量を50mlとし、硝酸酸性下で、ICP−AES分析装置で測定した。
【0078】
<固体電解質の合成及びイオン伝導度の測定>
ヨウ化リチウム無水塩0.514g(45mol%)、五二硫化リン(Aldrich社製試薬)0.341g(18mol%)、硫化リチウム(日本化学工業社製)0.145g(37mol%)を秤量して、遊星型ボールミルで400回転/分で20時間処理を行い、固体電解質を得た。
次いで、得られた固体電解質の両面を電極(ニッケル95質量%、スズ5質量%で構成される電極)0.30gではさんだのち、20MPaで5分間加圧することにより、3層構造の成型体を得た。
次いで、得られた成型体を測定サンプルとして、交流インピーダンス測定装置(東洋テクニカ社製、ソーラトロン1267)を用いて、イオン伝導度を測定した。
【技術分野】
【0001】
本発明は、ヨウ化リチウム無水塩及びその製造方法に関する。また、本発明は、該ヨウ化リチウム無水塩又はその製造方法により得られたヨウ化リチウム無水塩を用いる固体電解質に関する。また、本発明は、該固体電解質を用いるリチウムイオン電池に関する。
【背景技術】
【0002】
金属ヨウ化物の用途としては、分析用試薬、医薬関係(去炎剤、利尿剤)、写真用乳剤などがある。また、最近では、ナイロン繊維添加剤、液晶ディスプレイ、偏光フィルム素材としての用途も報告されている。
【0003】
金属ヨウ化物の中でも、ヨウ化リチウムは、特殊な材料であり、心臓ペースメーカーのバッテリー(リチウムヨウ素電池の電解質)として使用されている。また、中性子検出の燐光体としての用途もある。
【0004】
また、不燃性の無機固体電解質は、電池の安全性を高めることから、特に注目されている材料である。そして、特に、リチウムイオン電池の固体電解質としての用途が、ヨウ化リチウムの用途として注目されている。
【0005】
ヨウ化リチウムには、含水塩と無水塩とがあることが知られている。従来のヨウ化リチウム含水塩の製造方法としては、炭酸リチウムとヨウ化水素酸を反応させる方法(非特許文献1)、炭酸リチウムに水を分散させたスラリーに、ヨウ化水素ガスを吹き込む方法(非特許文献2)が知られている。
【0006】
また、金属ヨウ化物の水溶液を製造する方法として、ヨウ素を鉄粉で処理する方法、ヨウ素を有機酸又はその金属塩で還元する方法、ヨウ素を水加ヒドラジンで還元する方法(特許文献1)が知られている。また、水酸化アルカリ又は炭酸アルカリに、ヒドラジン及びヨウ素を反応させる方法(特許文献2)が提案されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平9−156920号公報
【特許文献2】特開昭61−48403号公報
【非特許文献】
【0008】
【非特許文献1】「化学大辞典 9 縮刷版」、発行所 共立出版 発行年1993年 426頁
【非特許文献2】「新実験化学講座 8 無機化合物の合成(II)」、発行所 丸善 昭和52年発行 462頁
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、従来の製造方法で得られたヨウ化リチウムをリチウムイオン電池の固体電解質に用いた場合、イオン伝導性の高いものが得られないという問題があることを見出した。
【0010】
従って、本発明の目的は、イオン伝導性を高くすることができるヨウ化リチウムを提供することにある。また、本発明の目的は、イオン伝導性が高い固体電解質を提供することにある。
【課題を解決するための手段】
【0011】
本発明者らは、上記従来技術における課題を解決すべく、鋭意研究を重ねた結果、ヨウ化リチウムをリチウムイオン電池用固体電解質の原材料に用いた場合、ヨウ化リチウム中のヨウ化リチウム含水塩が、イオン伝導度の低下に、大きく影響を与えること、及びヨウ化リチウム含水塩を焼成してヨウ化リチウム無水塩を得る際に、ヨウ化リチウム含水塩中に、Na又はKが存在すると、ヨウ化リチウム含水塩からヨウ化リチウム無水塩への転移が起こり難くなることを見出し、本発明を完成させるに至った。
【0012】
すなわち、本発明(1)は、X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩を提供するものである。
【0013】
また、本発明(2)は、Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法を提供するものである。
【0014】
また、本発明(3)は、前記本発明(1)のヨウ化リチウム無水塩を原料に用いて製造された固体電解質を提供するものである。
【0015】
また、本発明(4)は、前記本発明(1)のヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上と、を、反応させることにより得られる固体電解質を提供するものである。
【0016】
また、本発明(5)は、前記本発明(3)又は(4)いずれかの固体電解質が用いられているリチウムイオン電池を提供するものである。
【発明の効果】
【0017】
本発明によれば、イオン導電性を高くすることができるヨウ化リチウムを提供することができる。また、本発明によれば、イオン電導性が高い固体電解質を提供することができる。
【図面の簡単な説明】
【0018】
【図1】実施例1及び比較例2で得られたヨウ化リチウム無水塩のX線回折図である。
【図2】比較例1で得られたヨウ化リチウム無水塩のX線回折図である。
【図3】比較例5で得られたヨウ化リチウム無水塩のX線回折図である。
【発明を実施するための形態】
【0019】
本発明のヨウ化リチウム無水塩は、X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下、好ましくは2%以下である。回折ピークの強度比((b/a)×100)が、上記範囲であることにより、イオン伝導性が高くなる。一方、回折ピークの強度比((b/a)×100)が、上記範囲を超えると、イオン伝導性が低くなる。
【0020】
本発明のヨウ化リチウム無水塩の水含有量は、好ましくは2.0質量%以下、特に好ましくは1.5質量%以下である。ヨウ化リチウム無水塩の水含有量が上記範囲であることにより、イオン伝導性が高くなる。なお、ヨウ化リチウム無水塩の水含有量であるが、試料5gを磁性ルツボに採取して、不活性ガス雰囲気下において300℃で1時間加熱したときの重量減少率を、ヨウ化リチウム無水塩の水含有量とする。
【0021】
本発明のヨウ化リチウム無水塩中のFeの含有量は10質量ppm以下であり且つCuの含有量が10質量ppm以下であることが好ましく、Feの含有量が5質量ppm以下であり且つCuの含有量が5質量ppm以下であることが特に好ましい。ヨウ化リチウム無水塩のFe及びCuの含有量が上記範囲にあることにより、Fe及びCuの導電性不純物に起因する電池の短絡の危険性が低くなる。なお、Fe及びCuの含有量は、ICP−AES法等によって測定される。
【0022】
本発明のヨウ化リチウム無水塩の製造方法は、Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法である。
【0023】
本発明のヨウ化リチウム無水塩の製造方法に係る焼成工程は、ヨウ化リチウム含水塩を焼成することにより、ヨウ化リチウム含水塩を無水塩へと転移させて、ヨウ化リチウム無水塩を得る工程である。
【0024】
焼成工程に係るヨウ化リチウム含水塩は、焼成工程において焼成される焼成原料であり、水和水として水を含有するヨウ化リチウムである。焼成工程に係るヨウ化リチウム含水塩は、1水塩に限らず、2水塩あるいは3水塩であってもよく、これらのうち、1水塩が、焼成工程を効率よく行える点で好ましい。
【0025】
焼成工程に係るヨウ化リチウム含水塩中のNa及びKの含有量は、Na及びKの合計で、20質量ppm以下、好ましくは10質量ppm以下である。ヨウ化リチウム含水塩中のNa及びKの含有量の合計が上記範囲にあることにより、含水塩から無水塩への転移が起こり易くなる。一方、ヨウ化リチウム含水塩中のNa及びKの含有量の合計が上記範囲を超えると、Na又はKにより、含水塩から無水塩への転移が阻害されるため、焼成後のヨウ化リチウム含水塩の量が多くなり過ぎ、焼成後のヨウ化リチウムのX線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%を超えてしまい、その結果、イオン伝導性が低くなってしまう。
【0026】
焼成工程に係るヨウ化リチウム含水塩中のCl及びBrの含有量は、好ましくはClの含有量が1000ppm以下且つBrの含有量が1000ppm以下、特に好ましくはClの含有量が500ppm以下且つBrの含有量が1000ppm以下である。ヨウ化リチウム含水塩中のCl及びBrの含有量が上記範囲にあることにより、焼成後のヨウ化リチウム無水塩の回折ピーク強度比((b/a)×100)が小さくなる。
【0027】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの焼成温度は、300〜440℃、好ましくは350〜400℃、特に好ましくは350〜380℃である。焼成工程における焼成温度が上記範囲にあることにより、ヨウ化リチウム含水塩から無水塩への転移を効率良く行うことができる。一方、焼成温度が、上記範囲未満だと、ヨウ化リチウム含水塩から無水塩への転移が起こり難くなるため、焼成後の含水塩の量が多くなり過ぎ、また、上記範囲を超えると、ヨウ化リチウムの融点を超えるため、焼成容器への付着が多くなり過ぎる。
【0028】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの焼成時間は、焼成するヨウ化リチウム含水塩の量により、適宜選択されるが、好ましくは4〜24時間、特に好ましくは6〜15時間である。
【0029】
焼成工程において、ヨウ化リチウム含水塩を焼成するときの雰囲気は、不活性ガス雰囲気下又は真空下である。不活性ガスとしては、例えば、窒素ガス、ヘリウムガス、アルゴンガス等が挙げられる。なお、真空下とは、ゲージ圧で、−0.09MPaG以下、好ましくは−0.10MPaG以下の真空雰囲気を指す。
【0030】
焼成工程を行った後、得られたヨウ化リチウム無水塩を、グローブボックス内や真空デシケーター内等で、空気と接触させない状態で冷却し、必要に応じて、粉砕する。
【0031】
焼成工程に係るヨウ化リチウム含水塩は、どのような製造方法により製造されてもよいが、以下に説明するヨウ化リチウム含水塩の製造方法の第一の形態例(以下、ヨウ化リチウム含水塩の製造方法(1)とも記載)により製造されたヨウ化リチウム含水塩であることが、Na及びKの含有量が極めて低いヨウ化リチウム含水塩が得られるので、焼成後のヨウ化リチウム無水塩の回折ピーク強度比((b/a)×100)が小さくなる点で好ましい。
【0032】
ヨウ化リチウム含水塩の製造方法(1)は、反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させて、該反応原料のリチウム化合物のヨウ化を行うヨウ化反応工程を行うことにより、ヨウ化リチウム含水塩を得るヨウ化リチウム含水塩の製造方法である。
【0033】
ヨウ化反応工程に係る反応原料のリチウム化合物としては、例えば、水酸化リチウム、炭酸リチウム、塩化リチウム、硝酸リチウム、硫酸リチウム等が挙げられる。これらのうち、反応原料のリチウム化合物としては、アニオンが、ヨウ化反応工程の後の濃縮又は乾燥の過程で、ヨウ化リチウム中の不純物として取り込まれて、イオン伝導度が低くなる要因となることがない点で、水酸化リチウム、炭酸リチウムが好ましい。
【0034】
反応原料のリチウム化合物は、不純物が少ないほど好ましく、特に、Na及びKの含有量は、Na及びKの合計量で、20ppm質量以下が好ましく、10質量ppm以下が特に好ましい。また、反応原料のリチウム化合物中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0035】
ヨウ化反応工程に係る反応原料のヨウ素は、不純物が少ないほど好ましく、純度95%質量以上が特に好ましく、純度98質量%以上がより好ましい。特に、ヨウ化反応工程に係る反応原料のヨウ素中のNa及びKの含有量は、Na及びKの合計量で、20質量ppm以下が好ましく、10質量ppm以下が特に好ましい。また、ヨウ化反応工程に係る反応原料のヨウ素中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0036】
ヨウ化反応工程に係る還元剤は、Na及びKのいずれも有さない還元剤である。Na及びKを有さない還元剤とは、分子中にNa及びKのいずれの元素も有さない化合物を指す。ヨウ化反応工程に係る還元剤としては、メタノール、エタノール等のアルコール、蟻酸、蓚酸等の有機酸、ショ糖、ブドウ糖等の糖類、ヒドラジン類などが挙げられる。ヨウ化反応工程に係る還元剤は、不純物が少ないほど好ましく、純度95%質量以上が特に好ましく、純度98質量%以上がより好ましい。特に、ヨウ化反応工程に係る還元剤中のNa及びKの含有量は、Na及びKの合計量で、20質量ppm以下が好ましく、10質量ppm以下が特に好ましい。また、ヨウ化反応工程に係る還元剤中のCl及びBrの含有量は、好ましくは1000質量ppm以下、特に好ましくは500質量ppm以下である。
【0037】
Na及びKを有さない還元剤に係るヒドラジン類としては、例えば、水加ヒドラジンが挙げられる。また、Na及びKを有さない還元剤に係るヒドラジン類としては、水加ヒドラジン以外にも、水溶媒中でヒドラジンを存在させることができる化合物であればよく、例えば、炭酸ヒドラジン、硫酸ヒドラジン、塩酸ヒドラジン、臭化水素酸ヒドラジン、アジピン酸ヒドラジド、フェニルヒドラジド、カーボジヒドラジド、イソフタル酸ジヒドラジド、セバシン酸ヒドラジド、ドデカンジヒドラジド、ベンゾフェノンヒドラジド、ステアリン酸ジヒドラジド、マロン酸ジヒドラジド、コハク酸ジヒドラジド、マレイン酸ヒドラジド、マレイン酸ヒドラジドモノカリウム、マレイン酸ヒドラジドモノナトリウム、ベンゼンスルホニルヒドラジド、モノメチルヒドラジン、クエン酸ヒドラジド、p−トルエンスルホニルヒドラジド等が挙げられる。これらのうち、Na及びKを有さない還元剤に係るヒドラジン類としては、水加ヒドラジンが、反応後に窒素と水に分解するので、還元剤に由来する副生成物による不純物の混入がない点で好ましい。
【0038】
ヨウ化反応工程に係る水溶媒は、ヨウ化反応が行われる溶媒である。ヨウ化反応工程に係る水溶媒は、イオン交換樹脂により、Na、K、Ca、Fe、Cu、Cl、SO4等のイオン性不純物が除去された純水であることが、反応中にこれらのイオン性の不純物が混入することを防止でき、イオン伝導性が低くなる原因となる不純物が少ないヨウ化リチウム含水塩が得られる点で好ましい。
【0039】
ヨウ化反応工程において、反応原料のヨウ素の使用量に対する反応原料のリチウム化合物の使用量の比は、反応原料のヨウ素中のI原子換算のモル数に対する反応原料のリチウム化合物中のLi原子換算のモル数の比(Li/I)で、好ましくは0.98〜1.02、特に好ましくは0.99〜1.01である。
【0040】
ヨウ化反応工程において、還元剤の使用量は、残存するヨウ素を低減し且つ還元剤由来の不純物の混入を少なくする点で、使用するヨウ素に対して当量が好ましい。なお、ヨウ化反応工程において、ヨウ素を分割して水溶媒に添加する場合は、分割添加毎に、添加したヨウ素の量に対して当量の還元剤を使用することが好ましい。
【0041】
ヨウ化反応工程に係る反応原料のリチウム化合物、ヨウ素、Na及びKを有さない還元剤は、いずれもFeの含有量が10質量ppm以下であり且つCuの含有量が10質量ppm以下であることが好ましく、Feの含有量が5質量ppm以下であり且つCuの含有量が5質量ppm以下であることが特に好ましい。これらのFe及びCuの含有量が上記範囲にあることにより、Fe及びCuの導電性不純物に起因する電池の短絡の危険性が低くなる。
【0042】
ヨウ化反応工程において、水溶媒の使用量は、特に制限されない。反応原料のリチウム化合物として、炭酸リチウム等の難溶性の化合物を使用する場合、ヨウ化反応工程後の濃縮操作で濃縮に供されるヨウ化リチウム水溶液の濃度が低くなり過ぎないように、スラリー濃度が10〜40質量%程度であることが好ましい。
【0043】
ヨウ化反応工程において、反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させる方法としては、特に制限されないが、反応原料のリチウム化合物が溶解又は分散された水溶媒に、ヨウ素及び還元剤を添加する方法が、反応を制御し易い点で好ましい。
【0044】
リチウム化合物を含有する水溶媒に、ヨウ素及び還元剤を添加する方法では、ヨウ素及び還元剤を、リチウム化合物を含有する水溶媒に添加すると急激に反応することから、全使用量のヨウ素を何回かに分割して、リチウム化合物を含有する水溶媒に添加することが好ましい。このとき、ヨウ素を分割添加する毎に、反応を完結させるために必要量の還元剤を、分割添加したヨウ素の添加量に合わせて添加することが好ましい。すなわち、リチウム化合物を含有する水溶媒に、反応に必要な量のヨウ素を複数回に分けて添加し、且つ、ヨウ素の分割添加毎に、添加したヨウ素が反応するために必要な量の還元剤を添加することにより、ヨウ化反応工程を行うことが好ましい。
【0045】
リチウム化合物を含有する水溶媒に、ヨウ素を分割添加する場合、1回当たりのヨウ素の添加量は、ヨウ素の使用量の1/100〜1/20が好ましい。リチウム化合物を含有する水溶媒にヨウ素を添加した後、しばらくすると、反応液がヨウ素イオンの溶解により茶褐色に着色するので、この色が元の色に戻るまで、リチウム化合物を含有する水溶媒に還元剤を添加すればよい。リチウム化合物を含有する水溶媒に、ヨウ素を分割添加する場合、分割する回数は、特に制限されない。
【0046】
ヨウ化反応工程において、反応温度は、特に制限されないが、80℃以上だと、反応が急激過ぎるため、ヨウ素がリチウム化合物と反応する前に、反応系外に揮散し易いので、25〜70℃が好ましい。
【0047】
ヨウ化反応工程において、反応時間は、特に制限されず、所定量の反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を接触させた後、ヨウ素による反応溶液の茶褐色の着色がなくなるまで、反応を行う。また、所定量の反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を接触させた後、30分以上経過しても、ヨウ素による反応溶液の茶褐色の着色がなくならない場合は、反応溶液に、粉末状の炭酸リチウム又は水酸化リチウムを微量加えて、反応を完結させる。このとき、反応を完結させるために、0.25時間以上、好ましくは0.5〜2時間反応を継続させる。
【0048】
ヨウ化反応工程を行った後、反応液をろ過して、微量の不溶解残渣を分離し、ろ液を濃縮及び乾燥して、ヨウ化リチウム1水塩の結晶を得る。このときの乾燥温度は、ヨウ化リチウム3水塩が1水塩になる温度範囲、具体的には、80〜150℃が好ましい。乾燥後のヨウ化リチウムは、それ自身が1水塩中に自己溶解しており、冷却することにより、塊状の固体として得られる。なお、乾燥雰囲気は、真空下、大気下又はアルゴンガス、ヘリウムガス、窒素ガス等の不活性ガス雰囲気下でもよいが、120℃以上の乾燥温度では、大気下で乾燥を行うと、ヨウ化リチウム含水塩が分解するため、120℃以上で乾燥を行う場合は、真空下又は不活性ガス雰囲気下で行うことが好ましい。
【0049】
このようにして、本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩のX線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)は、3%以下である。更に、本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩のFeの含有量は10ppm以下であり且つCuの含有量は10ppm以下であることが好ましい。
【0050】
本発明のヨウ化リチウム無水塩及び本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩は、リチウムイオン電池の固体電解質の製造原料として、好適である。
【0051】
本発明の固体電解質は、本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩を原料に用いて製造された固体電解質であり、好ましくは本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上の硫化物と、を、反応させることにより得られる固体電解質である。
【0052】
本発明の固体電解質としては、LiI−P2S5−Li2S、LiI−SiS2−Li2S、LiI−GeS2−Li2S等が挙げられる。
【0053】
本発明の固体電解質に係る硫化物の物性は、特に制限されないが、ヨウ化リチウム無水物との均一混合が容易になる観点から、平均粒子径が100μm以下であることが好ましく、20〜80μmであることが特に好ましい。
【0054】
本発明の固体電解質において、ヨウ化リチウム無水塩と硫化物との配合割合は、固体電解質の組成に合わせて、適宜選択される。例えば、固体電解質として、ヨウ化リチウム無水物と硫化リンと硫化リチウムから、LiI/P2S5/Li2S=0.30/0.30/0.40の組成のものを得る場合には、ヨウ化リチウムに対する硫化リンのモル比及びヨウ化リチウムに対する硫化リチウムのモル比が、いずれも、2.2〜2.4、好ましくは2.30〜2.36である。
【0055】
本発明の固体電解質は、例えば、本発明のヨウ化リチウム無水塩又は本発明のヨウ化リチウム無水塩の製造方法を行い得られるヨウ化リチウム無水塩と、本発明の固体電解質に係る硫化物とを、メカニカルミリングにより処理して、反応させることにより得られる。メカニカルミリング処理を行う機器としては、例えば、ビーズミル、遊星型ボールミル、振動ミル等の粉砕機器、つまり、混合対象である粉体中に粒状媒体を存在させて、それらを高速で流動させる機器が挙げられる。そして、ヨウ化リチウム無水物、硫化物及び粒状媒体を高速で流動させることで、粒状媒体により、ヨウ化リチウム無水物及び硫化物に、機械的エネルギーが加えられる。
【0056】
メカニカルミリングの回転速度及び回転時間をコントロールすることで、処理物をより微細で均質にすることができるが、装置の種類や原料の種類あるいは使用用途に応じて、適切な条件を適宜選択して、メカニカルミリング処理を行うことが好ましい。例えば、遊星型ボールミルを使用する場合、回転速度を50〜600回転/分とし、2〜60時間処理することが好ましい。
【0057】
メカニカルミリング処理後、必要によりメカニカルミリング処理物をガラス転移以上の温度で加熱処理することができる。
【0058】
本発明の固体電解質は、固体リチウムイオン電池の構成部材、例えば、電解質層、正極層、負極層等に好適に使用される。
【0059】
本発明のリチウムイオン電池は、本発明の固体電解質が用いられているリチウムイオン電池である。
【実施例】
【0060】
以下、本発明を実施例により詳細に説明するが、本発明はこれらに限定されるものではない。
【0061】
実施例及び比較例で用いた試薬の品位を表1に示す。
【0062】
【表1】

1)表中「−」は、1質量ppm以下であることを示す。
LiOH・H2O(試薬A):LiOH含有量 57.78質量%
LiOH・H2O(試薬B):LiOH含有量 56.80質量%
Li2CO3:Li2CO3含有量 99.65質量%
ヨウ素:I含有量 99質量%以上、純正化学株式会社製、試薬1級
KI:KI含有量 99.5質量%、純正化学株式会社製
水加ヒドラジン:80質量%水溶液、純正化学株式会社製、試薬1級
【0063】
(実施例1)
<ヨウ化リチウム含水塩の製造(ヨウ化反応工程)>
水酸化リチウム1水塩(試薬A)67.1gを、1Lビーカーに秤量した。そこに、イオン交換水350mLを加えて溶解させ、水酸化リチウム水溶液を調製した。次いで、これとは別に、ヨウ素203.0gをマヨネーズ瓶に秤量した。秤量後フタをして、ヨウ素の揮散を防止した。次いで、水加ヒドラジン25gを50mlビーカーに秤量した。
次いで、前記水酸化リチウム水溶液を撹拌しながら、(1)ヨウ素5gを添加した。添加の際、ヨウ素イオンの溶出により、水溶液の色が無色から茶褐色に変化するのを確認した。次いで、(2)ヨウ素を添加した水酸化リチウム水溶液を撹拌しながら、前記水加ヒドラジンを滴下した。水溶液の色が茶褐色から無色に変化するのを確認した。次いで、加水ヒドラジンの滴下による窒素ガスの発泡が無くなったことを確認した後、再び(1)の操作を行い、次いで、(2)の操作を行った。以後は、(1)の操作と(2)の操作を繰り返し、最初に秤量したヨウ素がなくなるまで、繰り返し操作を行った。
ヨウ素を全量添加した後、水加ヒドラジンを滴下し、反応溶液の色が無色になったところを反応の終点とした。
次いで、高純度炭酸リチウム1gを添加して撹拌し、過剰のヨウ素を反応させた。反応溶液をろ過して、微量の不溶解残渣を分離した。なお、ろ過には、フィルターとして、アドバンテック社製5Cろ紙を使用した。次いで、ろ液を加熱して水分を蒸発させて濃縮した。濃縮後、濃縮物を、乾燥機(ヤマト社製送風定温乾燥機DKN402)を用いて、120℃で15時間乾燥させ、冷却及び固化して、ヨウ化リチウム含水塩Aを得た。
得られたヨウ化リチウム含水塩Aについて、不純物の含有量を測定した。その結果を表2に示す。
【0064】
<ヨウ化リチウム無水塩の製造(焼成工程)>
次いで、上記のようにして得たヨウ化リチウム含水塩Aを、雰囲気調製炉(株式会社モトヤマ社製、MS電気炉NKC型)にて、窒素雰囲気下350℃で8時間焼成した。焼成後、焼成物を炉から取り出して、真空デシケーター(−0.10MPaG)に入れ、真空下で冷却し、ヨウ化リチウム無水塩Bを得た。
得られたヨウ化リチウム無水塩Bの水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度を測定した。その結果を表3に示す。
【0065】
(比較例1)
<ヨウ化リチウム含水塩の製造>
ヨウ化カリウム166gを1Lビーカーに秤量し、イオン交換水500mlを加えて、ヨウ化カリウム溶液を調製した。次いで、ここに炭酸リチウム36.9gを加えて撹拌し、分散させた。次いで、ここに17.5%塩酸208gを10分間かけて滴下して反応を行った。反応終了後、反応液が酸性(pH=1.5)を示したので、粉末の炭酸リチウムを添加してpH=7.0に調整した。
以下、実施例1と同様にして、反応溶液のろ過、ろ液の濃縮、濃縮物の乾燥
、冷却及び固化を行い、ヨウ化リチウム含水塩a1を得た。
得られたヨウ化リチウム含水塩a1について、不純物の含有量を測定した。その結果を表2に示す。
<ヨウ化リチウム無水塩の製造>
次いで、ヨウ化リチウム含水塩Aに代えて、ヨウ化リチウム含水塩a1とすること、及び焼成時間8時間に代えて、焼成時間6時間とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b1を得た。
得られたヨウ化リチウム無水塩b1の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0066】
(比較例2)
<ヨウ化リチウム含水塩の製造>
実施例1と同様の方法で行いヨウ化リチウム含水塩Aを得た。
<ヨウ化リチウム無水塩の製造>
焼成温度350℃に代えて、焼成温度280℃とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b2を得た。
得られたヨウ化リチウム無水塩b2の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0067】
(比較例3)
<ヨウ化リチウム含水塩の製造>
水酸化リチウム1水塩(試料A)に代えて、水酸化リチウム1水塩(試料B)とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム含水塩a2を得た。
得られたヨウ化リチウム含水塩a2について、不純物の含有量を測定した。その結果を表2に示す。
<ヨウ化リチウム無水塩の製造>
ヨウ化リチウム含水塩Aに代えて、ヨウ化リチウム含水塩a2とすること以外は、実施例1と同様の方法で行い、ヨウ化リチウム無水塩b3を得た。
得られたヨウ化リチウム無水塩b3の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0068】
(比較例4)
市販の無水ヨウ化リチウム(キシダ化学社製)を、比較例4のヨウ化リチウム無水塩b4とした。
ヨウ化リチウム無水塩b4の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0069】
(比較例5)
比較例4のヨウ化リチウム含水塩b4を、雰囲気調製炉(株式会社モトヤマ社製、MS電気炉NKC型)にて、窒素雰囲気下350℃で8時間焼成した。焼成後、焼成物を炉から取り出して、真空デシケーター(−0.10MPaG)に入れ、真空下で冷却し、ヨウ化リチウム無水塩b5を得た。
得られたヨウ化リチウム無水塩b5の水含有量、回折ピークの強度比((b/a)×100)、不純物含有量、及びイオン伝導度の測定結果を表3に示す。
【0070】
【表2】

1)表中「*」は、1000質量ppm以下であることを示す。
【0071】
【表3】

1)回折ピークの強度比:(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)
2)表中「*」は、1000質量ppm以下であることを示す。
【0072】
<ヨウ化リチウムの水含有量の分析>
試料5gを磁性ルツボに採取して、窒素雰囲気下において300℃で2時間加熱したときの重量減少率を測定し、重量減少率を水含有量とした。
【0073】
<XRD回折分析>
ヨウ化リチウムをグローブボックス内にて粉砕したものを試料として、粉末X線回折分析を行い、図1〜図3のチャートを得た。X線回折法(XRD)の測定には、線源としてCuKαを用い、測定装置としてリガク社製UltimaIV型を用いた。
【0074】
<不純物Na、K含有量の測定>
試料1.0gをイオン交換水に溶解して、濃硝酸1mlを添加して、全量を50mlとし、硝酸酸性下で、原子吸光分析装置で測定した。
【0075】
<不純物Cl含有量の測定>
試料1.0gをイオン交換水に溶解して、全量を50mlとし、イオンクロマト分析装置で測定した。
【0076】
<不純物Br含有量の測定>
試料0.1gをイオン交換水に溶解して、全量を100mlとし、イオンクロマト分析装置で測定した。
【0077】
<不純物Fe、Cu、Caの測定>
試料1.0gをイオン交換水に溶解して、濃硝酸1mlを添加して、全量を50mlとし、硝酸酸性下で、ICP−AES分析装置で測定した。
【0078】
<固体電解質の合成及びイオン伝導度の測定>
ヨウ化リチウム無水塩0.514g(45mol%)、五二硫化リン(Aldrich社製試薬)0.341g(18mol%)、硫化リチウム(日本化学工業社製)0.145g(37mol%)を秤量して、遊星型ボールミルで400回転/分で20時間処理を行い、固体電解質を得た。
次いで、得られた固体電解質の両面を電極(ニッケル95質量%、スズ5質量%で構成される電極)0.30gではさんだのち、20MPaで5分間加圧することにより、3層構造の成型体を得た。
次いで、得られた成型体を測定サンプルとして、交流インピーダンス測定装置(東洋テクニカ社製、ソーラトロン1267)を用いて、イオン伝導度を測定した。
【特許請求の範囲】
【請求項1】
X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩。
【請求項2】
水含有量が2.0質量%以下であることを特徴とする請求項1記載のヨウ化リチウム無水塩。
【請求項3】
Feの含有量が10質量ppm以下且つCuの含有量が10質量ppm以下であることを特徴とする請求項1又は2いずれか1項記載のヨウ化リチウム無水塩。
【請求項4】
Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法。
【請求項5】
反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させて、該反応原料のリチウム化合物のヨウ化を行うヨウ化反応工程を行うことにより、前記ヨウ化リチウム含水塩を得ることを特徴とする請求項4記載のヨウ化リチウム無水塩の製造方法。
【請求項6】
前記反応原料のリチウム化合物が炭酸リチウムであり且つ前記還元剤がヒドラジンであることを特徴とする請求項5記載のヨウ化リチウム無水塩の製造方法。
【請求項7】
前記反応原料のリチウム化合物を含有する水溶媒に、反応に必要な量のヨウ素を複数回に分けて添加し、且つ、該ヨウ素の添加毎に、添加したヨウ素が反応するために必要な量の前記還元剤を添加することにより、前記ヨウ化反応工程を行うことを特徴とする請求項5又は6いずれか1項記載のヨウ化リチウム無水塩の製造方法。
【請求項8】
請求項1〜3いずれか1項記載のヨウ化リチウム無水塩を原料に用いて製造された固体電解質。
【請求項9】
請求項1〜3いずれか1項記載のヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上と、を、反応させることにより得られる固体電解質。
【請求項10】
請求項8又は9いずれか1項記載の固体電解質が用いられているリチウムイオン電池。
【請求項1】
X線回折分析における(a)ヨウ化リチウム無水物に由来する2θ=25.8°付近の回折ピークに対する(b)ヨウ化リチウム1水和物に由来する2θ=20.7°付近の回折ピークの強度比((b/a)×100)が3%以下であることを特徴とするヨウ化リチウム無水塩。
【請求項2】
水含有量が2.0質量%以下であることを特徴とする請求項1記載のヨウ化リチウム無水塩。
【請求項3】
Feの含有量が10質量ppm以下且つCuの含有量が10質量ppm以下であることを特徴とする請求項1又は2いずれか1項記載のヨウ化リチウム無水塩。
【請求項4】
Na及びKの含有量が合計で20質量ppm以下であるヨウ化リチウム含水塩を、不活性ガス雰囲気下又は真空下で、300〜440℃で焼成することにより、ヨウ化リチウム無水塩を得る焼成工程を有することを特徴とするヨウ化リチウム無水塩の製造方法。
【請求項5】
反応原料のリチウム化合物と、ヨウ素と、Na及びKを有さない還元剤と、を、水溶媒中で接触させて、該反応原料のリチウム化合物のヨウ化を行うヨウ化反応工程を行うことにより、前記ヨウ化リチウム含水塩を得ることを特徴とする請求項4記載のヨウ化リチウム無水塩の製造方法。
【請求項6】
前記反応原料のリチウム化合物が炭酸リチウムであり且つ前記還元剤がヒドラジンであることを特徴とする請求項5記載のヨウ化リチウム無水塩の製造方法。
【請求項7】
前記反応原料のリチウム化合物を含有する水溶媒に、反応に必要な量のヨウ素を複数回に分けて添加し、且つ、該ヨウ素の添加毎に、添加したヨウ素が反応するために必要な量の前記還元剤を添加することにより、前記ヨウ化反応工程を行うことを特徴とする請求項5又は6いずれか1項記載のヨウ化リチウム無水塩の製造方法。
【請求項8】
請求項1〜3いずれか1項記載のヨウ化リチウム無水塩を原料に用いて製造された固体電解質。
【請求項9】
請求項1〜3いずれか1項記載のヨウ化リチウム無水塩と、Li2S、P2S5、SiS2、GeS2及びB2S3のうちの1種以上と、を、反応させることにより得られる固体電解質。
【請求項10】
請求項8又は9いずれか1項記載の固体電解質が用いられているリチウムイオン電池。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−103851(P2013−103851A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−247346(P2011−247346)
【出願日】平成23年11月11日(2011.11.11)
【出願人】(000230593)日本化学工業株式会社 (296)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月11日(2011.11.11)
【出願人】(000230593)日本化学工業株式会社 (296)
【Fターム(参考)】
[ Back to top ]

