ライゲーション増幅
ライゲーションに基づく指数関数的リボ核酸増幅と、それに続く、核酸ポリメラーゼの基質として3つまたはそれ以上のリン酸を含む末端リン酸標識ヌクレオチドを用いる、核酸ポリメライゼーション反応を使用する検出に関する、方法および試薬が、本明細書中で提供される。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
[0001] 本出願は、すべて“末端リン酸標識ヌクレオチドおよび使用の方法”と題されている、2001年8月29日に出願されたアメリカ合衆国仮特許出願第60/315,798号に基づく優先権を主張する、2002年4月1日に出願されたアメリカ合衆国特許出願第10/113,030号の一部継続出願である、2003年2月5日に出願されたアメリカ合衆国特許出願第10/358,818号の一部継続出願であり、そして、2004年12月23日に出願されたアメリカ合衆国特許出願第60/638,937号であり;2005年5月27日に出願されたアメリカ合衆国仮特許出願第60/685,661号に基づいて優先権を主張し;そして、“ライゲーションに基づくRNA増幅”と題された、2005年12月22日に出願された、国際特許出願第PCT/US2005/046800号である。
【背景技術】
【0002】
[0002] 特異性および感受性を伴って、核酸などの特異的な分析対象物を増幅および検出するための、様々な方法が知られている。前記方法は、一般的に検出段階の前に、増幅段階を行うことを必要とする。増幅方法には、デオキリボ核酸(DNA)およびリボ核酸(RNA)をそれぞれ増幅するために使用される、ポリメラーゼ連鎖反応(PCR)および逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)が含まれる。そして、核酸の検出方法には、例えば、酵素または抗体と結合した、蛍光標識または放射活性標識などの検出可能な標識の使用が、一般的に含まれる。
【0003】
[0003] 多くのリボ核酸(RNA)増幅方法には多段階反応が含まれ、例えば、1つの段階としてはRNAから相補的DNA(cDNA)への変換であり、また、複数の酵素および中間の精製段階が必要とされる。
【0004】
[0004] さらに、増幅および検出の方法は、例えば、電気泳動、またはアフィニティー分離技術を使用して、標識された出発物質を標識された生成物から分離することを必要とする。
【0005】
[0005] 従って、既知の技術の限界を超える、指数関数的RNA増幅、およびそれに続く検出のための方法を提供することは、有益であろう。
【発明の概要】
【0006】
発明の属する分野
[0006] 本発明は、ライゲーションに基づく指数関数的リボ核酸増幅と、それに続く、核酸ポリメラーゼの基質として3つまたはそれ以上のリン酸を含む末端リン酸標識ヌクレオチドを用いる、核酸ポリメラーゼ反応を使用する検出のための方法に、一般的に関連する。特異的な標的の検出および同定のための方法の使用もまた、開示される。
【0007】
発明の詳細な説明
[0007] いくつかの態様において、本発明は標的RNA配列の増幅および検出のための方法を提供する。この方法には、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、少なくとも1つの末端リン酸標識ヌクレオチドの存在下で増幅されたRNA配列を核酸ポリメラーゼと反応させて標識されたポリリン酸を産生する段階、および標識されたポリリン酸を検出する段階が含まれる。いくつかの態様において、標識されたポリリン酸をさらにホスファターゼと反応させて、検出可能種を産生する。いくつかの態様において、個々の段階は、1つの反応容器の中で,同時に行われる。
【0008】
[0008] いくつかの態様において、本発明は、(a)標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、(b)ポリリン酸鎖内に3つまたはそれ以上のリン酸基を含む、少なくとも1つの末端リン酸標識ヌクレオチドの存在下で増幅されたRNA配列に対して核酸ポリメラーゼ反応を行い、その反応の結果、標識されたポリリン酸が産生される段階、そして(c)標識されたポリリン酸を検出する段階を含む、試料中の標的RNA配列の存在を検出する方法を提供する。増幅において、標的RNAを、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列と、はじめにハイブリダイゼーションさせる。ハイブリダイゼーションに続いて、核酸配列の二本鎖領域の5'末端を、標的RNA配列の3'末端とライゲーションして、ライゲーションされた配列を形成する。ライゲーションされた配列は、次にRNAポリメラーゼにより転写されて、増幅されたアンチセンス、相補的RNA配列を形成する。いくつかの態様において、2ラウンド目の増幅が、増幅されたアンチセンス相補的RNA配列に対して行われ、増幅されたセンスRNA配列を提供する。
【0009】
[0010] いくつかの態様において、本発明はさらに、試料中の標的RNA配列の同時的な増幅および検出のためのキットを提供する。キットには、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的リボ核酸配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む少なくとも1つの核酸配列;ライゲーション酵素;ホスファターゼに対して実質的に耐性のあるヌクレオチド;DNAポリメラーゼ、RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の少なくとも1つ;1つまたはそれ以上の末端リン酸標識ヌクレオチド、およびホスファターゼが含まれる。核酸配列の5'陥凹末端はリン酸化され、そして、3'末端はポリメラーゼ伸長ブロッカーでキャップされる。キット中のライゲーション酵素は、ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的RNA配列を核酸配列にライゲーションすることができる。末端リン酸標識ヌクレオチドは式;
B-S-Y-(P)n-P-L
であり、式中、P=リン酸(PO3)およびその誘導体であり、nは2またはそれ以上であり;Yは酸素または硫黄原子であり;Bは窒素含有複素環塩基であり;Sは非環式部分、炭素環式部分、または糖部分であり;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識であり;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である。
【図面の簡単な説明】
【0010】
[0011] 本発明のこれらおよびその他の特徴、観点、および利点は、図面を参照しながら以下の詳細な説明を読むことにより、より良く理解されるであろう。
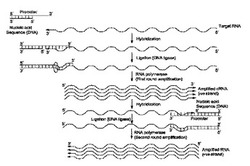
【図1】[0012] 図1は、はじめのライゲーションおよび続く転写反応による、指数関数的RNA増幅の概略図である。
【図2】[0013] 図2は、末端リン酸標識ヌクレオチドを用いる、増幅されたRNA配列の検出の概略図である。
【図3】[0014] 図3は、1つの反応容器中で、はじめのライゲーションおよび続く転写反応、さらに続く末端リン酸標識ヌクレオチドを使用する検出による、同時RNA増幅の概略図を示す。
【図4】[0015] 図4は、3つの異なるリガーゼ(E.coliリガーゼ、T4 DNAリガーゼ、およびT4 RNAリガーゼ)が二本鎖DNAをRNAにライゲーションすることができることを示す、15%7 M尿素TBEゲルの蛍光画像である。
【図5】[0016] 図5は、ライゲーションに基づくmRNA増幅を示す、15%7 M尿素TBEゲルの蛍光画像である。
【図6】[0018] 図6は、ホスファターゼの存在下、鋳型指向性のプロセスにおけるγリン酸標識ddGTPのポリメラーゼ利用により得られる、蛍光を示すグラフである。
【図7】[0019] 図7は、ホスファターゼの存在下、鋳型指向性のプロセスにおけるγリン酸標識ddATPのポリメラーゼ利用により得られる、蛍光を示すグラフである。
【発明を実施するための形態】
【0011】
発明の詳細な説明
[0020] 請求項に記載される発明の主題を、より明確かつ正確に記述および指摘するため、以下の記述および添付の請求の範囲において用いられる特定の用語について、以下の定義が提供される。
【0012】
[0021] 単数形の“a”、“an”および“the”には、文脈上明確にそうでないことを述べていない限り、複数形の対象が含まれる。明細書および請求の範囲にわたってこの中で用いられる場合、概算を意味する用語は、それが関与する基本的な機能に変化をもたらすことなく、許容範囲内で変化させることができる、定量的な表示を修飾するために適用されてよい。従って、“約(about)”などの用語によって修飾される値は、指示された正確な値に限定されない。
【0013】
[0022] 本明細書中で使用される場合、“増幅”という用語または“増幅する(amplifying)”という用語は、標的核酸配列の複数の複製物の産生、または、標的核酸配列に相補的な、複数の核酸配列複製物の産生を言う。
【0014】
[0023] 本明細書中で使用される場合、“増幅されたRNA配列”という用語は、本明細書中で提供される方法を用いて標的RNA配列の増幅/増幅することにより、産生される配列を言う。増幅されたRNA配列は、標的RNA配列に対して同じセンス(2ラウンド目、および続く偶数回目のラウンドの増幅で産生された+ve鎖)あるいはアンチセンス(すなわち、1ラウンド目、および続く奇数回目のラウンドの増幅で産生された-ve鎖)のどちらかであってよい。
【0015】
[0024] 本明細書中で使用される場合、“キャッピング”および“キャップされた”という用語は、分子中の官能基または反応基への、適切な化学修飾部分(chemical moiety)の結合のことを言い、結合した場合、その官能性または反応性を、マスクするか、減少するか、あるいは阻害する。例えば、ヌクレオチドの末端リン酸基を、ホスファターゼによる脱リン酸化を防ぐために、化学修飾部分によりキャップすることが可能である。キャッピングに使用することができる適切な化学修飾部分には、検出可能部分(例えば色素)、またはアルキル基(例えばメチル基またはエチル基)が含まれるが、これらには限定されない。
【0016】
[0025] 本明細書中で使用される場合、“DNA依存性RNAポリメラーゼ”という用語は、そのポリメラーゼ活性の開始のために二本鎖DNAプロモーター配列を認識する、すべてのRNAポリメラーゼのことを言う。RNAポリメラーゼの例には、T7 RNAポリメラーゼ、SP6 RNAポリメラーゼ、およびT3 RNAポリメラーゼが含まれるが、これらには限定されない。
【0017】
[0026] 本明細書中で使用される場合、“電気化学的タグ”という用語は、例えば酸化還元部分などの、電気化学的に活性な部分である。適切な電気化学的タグには、ヌクレオチドの固有の酸化還元電位(例えば、グアニンは約0.75 V、またアデニンは約1.05 Vで電気化学的に酸化されることができる)からは容易に区別できる酸化還元電位を有するものが含まれる。電気化学的タグの例には、1,4-ベンゾキノン(-0.54 V)、フェロセン(+0.307)、テトラシアノキノジメタン(+0.127、-0.291)、N,N,N',N'-テトラメチル-p-フェニレンジアミン(+0.21)、およびテトラチアフルバレン(+0.30)が含まれるが、これらには限定されない。
【0018】
[0027] 本明細書中で使用される場合、“標識されたポリリン酸”という用語は、末端リン酸標識ヌクレオチドの核酸ポリメラーゼ処理の結果として生じる、リン酸転移による無機副産物のことを言う。標識されたポリリン酸は標識を含み、ホスファターゼとの反応により、検出可能種を産生することができる。ホスファターゼを介するリン酸転移によるポリリン酸生成物の切断は、それに結合した標識に検出可能な変化をもたらす。
【0019】
[0028] 本明細書中で使用される場合、“リガーゼ”という用語は、核酸の隣り合う塩基間のニックをつなぐことを触媒する酵素のことを言う。例えば、リガーゼは、5'リン酸基と3'水酸基との間の分子間または分子内共有結合を形成することができるすべての酵素であってよい。適切なリガーゼには、T4 DNAリガーゼ、T4 RNAリガーゼ、およびE.coli DNAリガーゼが含まれてよいが、これらには限定されない。
【0020】
[0029] 本明細書中で使用される場合、“質量タグ”という用語は、質量の違いによって別の成分から容易に区別可能である、質量分析に適する分子量部分のことを言う。質量タグは、スペクトル全体の範囲にわたってよく、そして、質量の違いは一原子質量単位と同じくらい低いことが可能である。
【0021】
[0030] 本明細書中で使用される場合、“核酸ポリメラーゼ”という用語は、その中心的機能が、RNAおよびDNAなどの核酸のポリマーと関与する酵素のことを言う。例えば、核酸ポリメラーゼは、既存のDNAまたはRNA鋳型からの、新規DNAまたはRNAの産生を触媒することが可能である。
【0022】
[0031] 本明細書中で使用される場合、“核酸ポリメラーゼ反応”という用語は、一般に、核酸ポリメラーゼ(例えば、DNAポリメラーゼまたはRNAポリメラーゼ)を使用して、核酸(例えば、DNAまたはRNA)を合成することに関する反応のことを言う。RNAポリメラーゼおよびDNAポリメラーゼは、ヌクレオシド三リン酸(NTP)、デオキシヌクレオシド三リン酸(dNTP)、またはジデオキシヌクレオシド三リン酸(ddNTP)から、伸長しているオリゴヌクレオチド鎖の3'水酸基への、ヌクレオシド一リン酸の転移を介して、オリゴヌクレオチドを合成する。この反応の原動力は、無水物結合の切断、および、無機ピロリン酸の同時形成である。核酸の合成は、ヌクレオチドのαまたはβホスホリル基のみにおける直接的な変化に関与し、ヌクレオチドが、核酸ポリメラーゼ反応における基質として、末端リン酸部位に修飾をもつ、ポリリン酸鎖中に3つまたはそれ以上のリン酸基を有することを可能にする。
【0023】
[0032] 本明細書中で使用される場合、“ヌクレオシド”という用語は、炭素環式部分または非環式部分などの糖または糖代替物に、1'位または同等の位置で結合した、プリン、デアザプリン、ピリミジン、または修飾塩基を有する化合物のことを言い、そして、それには2'-デオキシ体および2'-ヒドロキシル体、および2',3'-ジデオキシ体、並びにその他の置換体を含む。
【0024】
[0033] 本明細書中で使用される場合、“ヌクレオチド”という用語は、天然および修飾されたヌクレオシドリン酸の両方のことを言う。エステル化部位は、ヌクレオシドの五炭糖のC-5位に結合する水酸基に対応することができる。ヌクレオチドを、ホスファターゼに対して実質的に反応性をもたないようにするために、構造的に修飾することができる。構造的修飾には、ホスファターゼがヌクレオチドを脱リン酸化することを防ぐ、化学基によるヌクレオチドのキャッピングが含まれてよい。キャッピングは、ヌクレオチドの末端リン酸にアルキル基(例えばメチル基あるいはエチル基)を結合することにより達せられる。
【0025】
[0034] “オリゴヌクレオチド”という用語には、本明細書中で使用される場合、デオキシリボヌクレオシド、リボヌクレオシドおよび類似体を含む、ヌクレオチドまたはその誘導体の線状オリゴマーが含まれるが、これらには限定されない。本明細書中において、オリゴヌクレオチドが文字の配列により示される場合はいつでも、ヌクレオチドは左から右へ5'→3'の順序であり、Aはアデノシンを示し、Cはシトシンを示し、Gはグアノシンを示し、そしてTはチミジンを示す。
【0026】
[0035] 本明細書中で使用される場合、“ホスファターゼ”という用語は、リン酸モノエステル、リン酸チオエステル、ホスホラミデート、ポリリン酸、およびヌクレオチドを切断し、無機リン酸を遊離させるすべての酵素のことを言う。本発明の文脈において、この酵素は末端標識されたヌクレオシドリン酸を切断しない(すなわち、末端リン酸標識ヌクレオチドは実質的にホスファターゼに対して反応性をもたない)。本明細書中で提供されるホスファターゼの定義には、具体的にはアルカリホスファターゼおよび酸性ホスファターゼ(例えば、細菌アルカリホスファターゼ、子牛腸ホスファターゼ、articエビアルカリホスファターゼ)が含まれるが、これらには限定されない。
【0027】
[0036] 本明細書中で使用される場合、“ポリメラーゼ伸長ブロッカー”という用語は、それがオリゴヌクレオチドの3'末端に結合した場合に、核酸ポリメライゼーション反応により伸長している核酸鎖の3'端からのさらなる伸長を阻害する化学部分のことを言う。ポリメラーゼ伸長ブロッカーは、修飾ヌクレオチド(例えば、ジデオキシリボヌクレオチド)であってもよい。オリゴヌクレオチドの3'末端における修飾ヌクレオチドは、3'末端からの逆転写酵素による伸長反応を遮断することが可能である。
【0028】
[0037] 本明細書中で使用される場合、“プライマーゼ”という用語は、DNA複製に関与するRNAポリメラーゼのことを言う。複製の間、プライマーゼは最初のRNAプライマーを合成し、次にDNAポリメラーゼによるDNA合成を開始する。細菌においては、プライマーゼはDNAへリカーゼに結合し、複合体、プライモソームを形成する。次にプライマーゼはDNAヘリカーゼにより活性化され、そして、長さ約11ヌクレオチドの短いRNAプライマーを合成し、これに新しいヌクレオチドをDNAポリメラーゼにより付加することができる。
【0029】
[0038] 本明細書中で使用される場合、“プライマー”という用語は、あらかじめ定められた核酸配列に特異的にアニールする線状オリゴヌクレオチドのことを言う。プライマーはそれにアニールする標的核酸領域の、逆向き相補的な配列を有するように設計される。プライマーの長さの上限および下限の両方は、経験的に決定される。非常に短いプライマー(長さ12ヌクレオチドより短い)は、ハイブリダイゼーション条件下、熱力学的に安定な二本鎖を形成しないため、プライマーの長さの下限は、安定したハイブリダイゼーションである。上限は、あらかじめ定められた呼び出し(interrogation)標的以外の領域における二本鎖形成の可能性により決定される。適切なプライマーの長さは、約12〜100ヌクレオチドの範囲であり、好ましくは約15〜30ヌクレオチド、そして最も好ましくは、長さ約17〜25ヌクレオチドである。
【0030】
[0039] 本明細書中で使用される場合、“標的核酸配列”という用語は、その配列の固有性、またはヌクレオシドの順序あるいは位置が、1つあるいはそれ以上の本発明の方法によって決定される、核酸配列のことを言う。標的核酸配列は、天然由来または合成由来のリボ核酸(RNA)であってよい。標的RNA配列は、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA、ミトコンドリアRNA、核内低分子RNA(snRNA)、低分子干渉RNA(siRNA)、またはヘテロ核RNA(hnRNA)であってよいが、これらには限定されない。
【0031】
[0040] 本明細書中で使用される場合、“末端リン酸標識ヌクレオチド”という用語は、ヌクレオチドの末端のリン酸において構造的な修飾が含まれるヌクレオチドのことを言う。構造的な修飾は、標識(例えば、化学発光、蛍光、電気化学的、あるいは色素体部分、ラマンアクティブタグ、あるいは質量タグ)の結合であってよく、そして、前記修飾は、ポリメラーゼ反応において機能するヌクレオチドの能力を損なわない。使用される標識は、酵素により活性化可能な標識であってよいが、これらには限定されない。末端リン酸標識ヌクレオチドには、ポリリン酸鎖に3つまたはそれ以上のリン酸基が含まれるといってもよく、そして、これらの末端リン酸標識ヌクレオチドが核酸ポリメラーゼ反応において使用される場合、その反応により、標識されたポリリン酸の産生がもたらされる。
【0032】
[0041] 本明細書中で使用される場合、“転写”および“転写する”という用語は、DNA配列またはRNA配列がRNAポリメラーゼにより酵素的に複製され、相補的なRNAが産生される過程のことを言う。転写は5'→3'方向で進行する(すなわち、鋳型は3'→5'方向で読まれ、そして新規の相補的断片は、5'→3'方向で生成される)。RNA鋳型がそのポリマー活性の開始のための二本鎖DNAプロモーター配列にライゲーションされる場合、DNA依存性RNAポリメラーゼを使用してRNA鋳型を転写することができる。二本鎖DNA領域上のRNAポリメラーゼによる転写開始の後、転写は、観察可能な速度の低下または前進性の低下はなく、RNA-DNA接合点を超えてRNA領域へと進行する。転写される鋳型RNAは、一本鎖RNA、二本鎖RNA、あるいはDNA:RNAヘテロ二本鎖であってよい。
【0033】
態様
[0042] いくつかの態様において、本発明は標的RNA配列を増幅および検出する方法を提供する。この方法には、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、増幅されたRNA配列を少なくとも1つの末端リン酸標識ヌクレオチドの存在下、核酸ポリメラーゼと反応させ、標識されたポリリン酸を産生する段階、および、標識されたポリリン酸を検出する段階、が含まれる。
【0034】
[0043] 目的とする標的核酸を含むことが疑われるか、あるいは知られている試料は、様々な源から入手することができる。試料は、生体試料、食物または農産物試料、あるいは、環境試料であってよいが、これらには限定されない。試料はまた、生体被験体由来であってもよい。生体被験体は、原核生物または真核生物由来であってよく、そしてウイルスが含まれる。そのような試料は、生体組織、あるいは、体液または滲出液(例えば、血液、血漿、血清または尿、乳汁、脳脊髄液、胸膜液、リンパ液、涙液、痰、唾液、便、肺吸引物、咽頭スワブまたは生殖器スワブなど)、全細胞、細胞画分、あるいは培養物のうちのあるもの/由来のものであってよいが、これらには限定されない。特定の状況において、ハイブリダイゼーションのための標的核酸配列を、遊離および/または抽出するために試料を処置することは、必要あるいは望ましいであろう。標的核酸が二本鎖の形態で存在する場合、変性させ、そして、ハイブリダイゼーション可能な一本鎖の形態にさせることもまた、必要あるいは望ましいだろう。試料中の標的核酸は、溶液中に分散させることができ、あるいは固体の支持体(ブロット、アレイまたはマイクロタイター、またはウェルプレートなど)に固定することができる。
【0035】
[0044] 標的RNA配列の検出を、例えば、病原生物の検出、法医学的目的、医療診断目的、または臨床目的で、使用することができる。本発明には、分析的、診断的、または予測的な応用において適用できる方法に、一般的に関与する態様が含まれる。
【0036】
[0045] いくつかの態様において、標的RNA配列は、ヘテロポリメリック、あるいはホモポリメリックな配列であってよい。検出のための標的RNA配列には、天然または合成のRNAおよび/または天然または合成のオリゴリボヌクレオチドが含まれてよい。これは、リボ核酸(RNA)、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA、ミトコンドリアRNA、核内低分子RNA(snRNA)または低分子干渉RNA(siRNA)、およびヘテロ核RNA(hnRNA)であってよいが、これらには限定されない。いくつかの態様において、増幅には、中間体c-DNAを合成する段階が含まれない。
【0037】
[0046] いくつかの態様において、増幅されたRNA配列は、標的RNA配列と比較して、同じ方向(増幅されたセンスRNA配列)である。別の態様において、増幅されたRNA配列は、標的RNA配列と比べて、逆の方向(増幅されたアンチセンス、相補的RNA配列)である。
【0038】
[0047] いくつかの態様において、増幅された核酸配列の核酸ポリメラーゼとの反応は、核酸ポリメライゼーション反応である。いくつかの態様において、標的RNA配列を増幅する段階、核酸ポリメラーゼ反応を行う段階、および標識されたポリリン酸を検出する段階は、1つの反応容器の中で行われる。いくつかの態様において、前述の段階は、均一なアッセイ形式において行われる。いくつかの態様において、前述の段階は、連続して行われる。いくつかの態様において、2つあるいはそれ以上の前述の段階は、同時に行われる。いくつかの態様において、前述のすべての段階は、1つの均一な反応混合液を用いて、一斉に行われる。いくつかの態様において、前述のすべての段階は、1つの均一な反応混合液を用いて、連続的に行われる。
【0039】
[0048] 標識されたポリリン酸の有無および/または濃度は、標的リボ核酸の有無および/または定量と相関する可能性がある。つまり、ある態様において、方法には、1つあるいはそれ以上追加の検出試薬(例えば、標識プローブまたは標識抗体)を、ポリメラーゼ反応に対して加える段階がさらに含まれてよい。
【0040】
[0049] いくつかの態様において、標識されたポリリン酸の検出は、標識されたポリリン酸の有無および/または濃度の検出によって行われる。ある態様において、標識されたポリリン酸をさらにホスファターゼと反応させ、検出可能種を産生する。標識されたポリリン酸の検出は、標識されたポリリン酸をホスファターゼと反応させて検出可能種を産生し、そして形成された検出可能種を検出することによって行うことができる。検出可能種は、比色分析、蛍光、化学発光、質量変化、ラマンシグナル、電気化学的シグナル、またはこれらの組み合わせにより検出可能であってよい。
【0041】
[0050] いくつかの態様において、核酸ポリメラーゼ反応は、DNAまたはRNAポリメラーゼの、少なくとも1つの存在下、行われる。適切なポリメラーゼには、DNA依存性RNAポリメラーゼ、プライマーゼ、テロメラーゼ、ターミナルデオキシヌクレオチドトランスフェラーゼ、またはRNA依存性DNAポリメラーゼ(逆転写酵素)が含まれるが、これらには限定されない。核酸ポリメラーゼは、DNAポリメラーゼI、II、またはIIIなどのDNAポリメラーゼ;DNAポリメラーゼα、β、γ;ターミナルデオキシヌクレオチドトランスフェラーゼ;またはテロメラーゼであってよい。あるいは、使用される核酸ポリメラーゼは、RNA依存性DNAポリメラーゼ(逆転写酵素)である。適切な逆転写酵素には、HIV RT、MMLV RT、または逆転写活性を有するDNAポリメラーゼが含まれるが、これらには限定されない。
【0042】
[0051] いくつかの態様において、核酸ポリメラーゼ反応には、ポリリン酸鎖に3つあるいはそれ以上のリン酸基を含む、少なくとも1つの末端リン酸標識ヌクレオチドが含まれ、副産物として標識されたポリリン酸を産生する。いくつかの態様において、核酸ポリメラーゼ反応段階には、標識されたポリリン酸副産物を検出可能種に変換する、ホスファターゼがさらに含まれてよい。いくつかの態様において、核酸ポリメライゼーション反応には、増幅されたRNA配列を、プライマー、ヌクレオチド、逆転写酵素、および少なくとも1つの末端リン酸標識ヌクレオチドとインキュベーションすることが含まれる。いくつかの態様において、核酸ポリメラーゼ反応には、少なくとも1つの末端リン酸標識ヌクレオチドに加えて、ホスファターゼに実質的に反応性をもたない、少なくとも1つのヌクレオチドが含まれる。
【0043】
[0052] 核酸ポリメラーゼ反応における基質として有用なヌクレオチドには、デオキシリボヌクレオシドポリリン酸、リボヌクレオシドポリリン酸、ジデオキシヌクレオシドボリリン酸、炭素環式ヌクレオシドポリリン酸および非環式ヌクレオシドポリリン酸、およびそれらの類似体などの、ヌクレオシドポリリン酸が含まれてよいが、これらには限定されない。いくつかの態様において、ヌクレオチドは、ホスファターゼがヌクレオチドを脱リン酸化することを防ぐ、保護基によりキャップされることができる。いくつかの態様において、キャッピングは、ヌクレオチドの末端リン酸にアルキル基を結合することにより、達成される。いくつかの態様において、キャッピングに用いられるアルキル基は、メチル基またはエチル基である。
【0044】
[0053] 末端リン酸標識ヌクレオチドは、伸長するヌクレオチド鎖へのヌクレオシド一リン酸の取り込みに付随して放出される標識されたポリリン酸が、検出可能種であるか、あるいは検出可能種を産生することができることを意味する。
【0045】
[0054] いくつかの態様において、末端リン酸標識ヌクレオチドの末端リン酸部位に結合した標識には、化学発光標識、蛍光標識、蛍光標識、発色標識、質量タグ、ラマンタグ、電気化学タグ、またはそれらの組み合わせが含まれてよいが、これらには限定されない。いくつかの態様において、標識は、色、蛍光発光、化学発光、質量変化、ラマンスペクトル、電気化学シグナル、またはそれらの組み合わせの、有無、あるいは変化によって、検出可能であってよい。
【0046】
[0055] いくつかの態様において、末端リン酸標識ヌクレオチドは、ポリリン酸鎖に3つあるいはそれ以上のリン酸を含む。適切な例には、デオキシヌクレオシドポリリン酸、ジデオキヌクレオシドポリリン酸、炭素環式ヌクレオシドポリリン酸、または非環式ヌクレオシドポリリン酸などの、ヌクレオシドポリリン酸、および電気化学標識、比色分析標識、化学発光標識、または蛍光標識、質量タグ、またはラマンタグが末端リン酸に結合した、それらの類似体が含まれる。いくつかの態様において、標識されたポリリン酸は、さらにホスファターゼと反応して、検出可能種を産生する。そのような態様において、標識されたポリリン酸における検出可能種は、ホスファターゼにより処理されるまでは検出されないような方法で、適切にマスクされる。しかしながら、伸長するオリゴヌクレオチド鎖へのヌクレオチド一リン酸の取り込み、およびそれに続く反応物のホスファターゼ処理によって、検出可能種はマスクが外され、検出可能になる。例えば、1,3-ジクロロ-9,9-ジメチル-アクリジン-2-オン(DDAO)の三環構造の側面の水酸基がヌクレオチドの末端リン酸部位に結合すると、DDAOは659 nmにおいて蛍光を発しない。
【0047】
[0056] 核酸ポリメラーゼ反応の間、伸長する核酸にヌクレオシド一リン酸が一度取り込まれると、副産物、DDAOポリリン酸(これもまた659 nmで蛍光を発しない)は、ホスファターゼの基質となる。一度脱リン酸化されてDDAOを形成すると、色素部分は659 nmにおいて蛍光を発するようになり、そのため検出可能になる。脱リン酸化されるとき、DDAOリン酸は、蛍光発光の大きいシフト、および、蛍光強度の大きな増加を示す(DDAO-リン酸は約570 nmにおいて弱い蛍光を発する。脱リン酸化されるとき、蛍光発光は約659 nmにシフトし、そして、蛍光強度は約20倍に増加する)。いくつかの態様において、ポリリン酸生成物の特異的な分析は、ポリメラーゼ反応溶液中で行うことができ、開始物質から反応生成物を分離する必要性を排除する。このことは、検出を可能にし、また、任意で、分光光度計などの日常的な器具を使用してポリメラーゼ反応の間に形成された核酸を定量することを可能にする。
【0048】
[0057] いくつかの態様において、リン酸転移の標識されたポリリン酸副産物を、ホスファターゼ処理を用いずに検出することができる。例えば、天然または修飾されたヌクレオシド塩基、特にグアニンは、蛍光の消光を引き起こすことができる。そのため、標識が蛍光色素分子である、末端リン酸標識ヌクレオチドは、標識が、塩基によって部分的に消光されることができる。ヌクレオシド一リン酸の取り込みに際して、標識ポリリン酸副産物は、その増強した蛍光のため、検出することができる。あるいは、標識されたポリリン酸生成物は、例えば、クロマトグラフィー分離法により、検出前に、物理的に分離することが可能であってよい。
【0049】
[0058] いくつかの態様において、末端リン酸標識ヌクレオチドは式:
B-S-Y-(P)n-P-L
により表されることができ、式中、P=リン酸(PO3)およびその誘導体、nは2またはそれ以上;Yは酸素または硫黄原子;Bは窒素を含む複素環塩基;Sは非環式部分、炭素環式部分、または糖部分;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である。
【0050】
[0059] 末端リン酸標識ヌクレオチド中の糖部分には、リボシル、2'-デオキシリボシル、3'-デオキシリボシル、2',3'-ジデオキシリボシル、2',3'-ジデヒロドロジデオキシリボシル、2'-または3'-アルコキシリボシル、2'-または3'-アミノリボシル、2'-または3'-フルオロリボシル、2'-または3'-メルカプトリボシル、2'-または3'-アルキルチオリボシル、非環式、炭素環式、および、その他の修飾された糖が含まれてよいが、これらには限定されない。
【0051】
[0060] 末端リン酸標識ヌクレオチド中の塩基には、ウラシル、チミン、シトシン、5-メチルシトシン、グアニン、7-デアザグアニン、ヒポキサンチン、7-デアザヒポキサンチン、アデニン、7-デアザアデニン、2,6-ジアミノプリン、および、それらの類似体が含まれてよいが、これらには限定されない。
【0052】
[0061] 本明細書中に提供される方法を使用すると、中間体c-DNA合成段階を省いた、ライゲーションに基づくRNA増幅方法によって、標的RNAを増幅することができる。いくつかの態様において、標的RNA増幅は、はじめに、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列と、標的RNAとをハイブリダイゼーションさせることにより行われる。ハイブリダイゼーションに続いて、核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端にライゲーションして、ライゲーションされた配列を形成する。ライゲーションされた配列は、次にRNAポリメラーゼにより転写されて、増幅されたアンチセンス、相補的RNA配列を形成することができる。いくつかの態様において、2ラウンド目の増幅が、増幅されたアンチセンス相補的RNA配列において行われ、増幅されたセンスRNA配列を提供する。
【0053】
[0062] いくつかの態様において、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階には、(i)ポリA以外の標的RNA配列を提供する段階;(ii)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供する段階;(iii)核酸配列の一本鎖3'末端領域を標的RNA配列とハイブリダイゼーションさせる段階;(iv)核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端にライゲーションして、ライゲーションされた配列を形成する段階;(v)ライゲーションされた配列を、RNAポリメラーゼを用いて転写して、増幅されたアンチセンス、相補的RNA配列を形成する段階;が含まれる。いくつかの態様において、標的RNA配列の増幅は、増幅されたアンチセンス相補的RNAを標的RNA配列として使用して前述の(i)〜(iv)の段階を行って、増幅されたセンスRNA配列を産生することを、さらに含む。
【0054】
[0063] いくつかの態様において、2つまたはそれ以上の前述の段階は、1つの反応容器の中で行われる。あるいは、前述のすべての段階を、1つの反応容器中で実行することができる。いくつかの態様において、個々の段階は、段階的に行われる。いくつかの態様において、使用されるRNAポリメラーゼは、DNA依存性RNAポリメラーゼである。いくつかの態様において、DNA依存性RNAポリメラーゼは、T7 RNAポリメラーゼである。
【0055】
[0064] 転写反応に使用されるデオキシリボヌクレオチドは、実質的にホスファターゼと反応性をもたないように構造的に修飾することが可能であり、それは、ホスファターゼがヌクレオチドを脱リン酸化することを阻害する何らかの保護基で、ヌクレオチドをキャッピングすることにより達することができる。いくつかの態様において、キャッピングは、アルキル基(例えば、メチル基、またはエチル基)をヌクレオチドの末端のリン酸に結合することにより、達せられることができる。
【0056】
[0065] いくつかの態様において、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列とハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列は、合成核酸配列である。いくつかの態様において、核酸配列は、デオキシリボ核酸(DNA)またはオリゴデオキシリボヌクレオチドである。いくつかの態様において、核酸配列の二本鎖領域は、少なくとも長さ約14ヌクレオチド対である。いくつかの態様において、標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域は、少なくとも長さ3ヌクレオチドである。いくつかの態様において、二本鎖DNAオリゴヌクレオチドは、二本鎖領域内にRNAポリメラーゼに対するプロモーターを含み、3'突出部を形成する一本鎖DNA配列のセグメントがそれに続く。
【0057】
[0066] DNAオリゴヌクレオチドはさらに転写開始部位を含むことができる。いくつかの態様において、3'突出部を含む二本鎖DNAオリゴヌクレオチドは、チミジン残基の列を含む。いくつかの態様において、チミジン残基の列を含む一本鎖3'突出領域は、標的メッセンジャーRNA(mRNA)ポリ(A)テールの3'末端とハイブリダイゼーションする。いくつかの態様において、標的RNA配列とハイブリダイゼーション可能な核酸配列の一本鎖3'末端領域は、3'末端において修飾ヌクレオチドを含む。いくつかの態様において、修飾ヌクレオチドは、3'末端からの逆転写酵素による伸長反応を遮断することができる。いくつかの態様において、修飾ヌクレオチドはジデオキシリボヌクレオチドである。
【0058】
[0067] 核酸配列中のプロモーター配列は、細菌性RNAポリメラーゼ(例えば、E.coli RNAポリメラーゼ)により認識される配列を含むことができる。いくつかの態様において、核酸配列中のプロモーター配列は、バクテリオファージ由来のRNAポリメラーゼによって認識される配列を含む。バクテリオファージ由来のRNAポリメラーゼの例には、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、およびSP6 RNAポリメラーゼが含まれてよいが、これらには限定されない。いくつかの態様において、核酸配列中のプロモーター配列には、バクテリオファージT7 RNAポリメラーゼに対するプロモーターが含まれる。
【0059】
[0068] いくつかの態様において、核酸配列の二本鎖領域の5'末端へ、標的RNA配列の3'末端をライゲーションして、ライゲーションされた配列を形成することは、酵素的手段によって実行される。いくつかの態様において、ライゲーションはDNAリガーゼを使用して行われる。適切なDNAリガーゼには、細菌またはバクテリオファージ由来のリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、ライゲーションはT4 DNAリガーゼを使用して行われる。いくつかの態様において、ライゲーションは、実質的にホスファターゼに耐性があるコファクターを利用するDNAリガーゼを使用することにより、行われる。そのようなリガーゼの適切な例には、NAD+依存性DNAリガーゼ(ligA)が含まれるが、これらには限定されない。適切なNAD+依存性DNAリガーゼには、E.coliあるいはマイコバクテリウム由来のDNAリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、使用されるDNAリガーゼはE.coliリガーゼである。
【0060】
[0069] いくつかの態様において、本発明の方法は、温度条件が増幅の各サイクルの間、実質的に一定に保たれる、等温条件下で行われる。反応に適する温度は、15度から50度の範囲である。いくつかの態様において、本発明の方法は、選択された温度が25度から40度の間である、等温条件下で行われる。
【0061】
[0070] いくつかの態様において、本発明は、1つの反応容器中の試料における、標的リボ核酸配列の指数関数的増幅および検出の方法を提供する。この方法には、a)標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、(b)プライマー、およびポリリン酸鎖内に3つまたはそれ以上のリン酸基を含む少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列に対して核酸ポリメラーゼ反応を行って、標識されたポリリン酸の産生をもたらす段階;(c)標識されたポリリン酸をホスファターゼと反応させ、検出可能種を産生する段階;そして(d)検出可能種を検出する段階;が含まれる。いくつかの態様において、前述の段階は同時に行われる。
【0062】
[0071] RNAの増幅は、c-DNA中間体は関与せず、プロモーターに基づく増幅が関与する。増幅には、(i.)ポリA以外の標的RNA配列を提供する段階、(ii.)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供する段階;(iii.)核酸配列の一本鎖3'末端領域と標的RNA配列とをハイブリダイゼーションする段階;(iv.)核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端とライゲーションして、ライゲーションされた配列を作成する段階;(v.)ライゲーションされた配列を、RNAポリメラーゼを用いて転写して、増幅されたアンチセンス、相補的RNA配列を形成する段階;が含まれる。いくつかの態様において、増幅されたアンチセンス相補的RNAを標的RNA配列として使用して(i)〜(iv)の段階が繰り返され、増幅されたセンスRNA配列を形成する。いくつかの態様において、標的RNA配列にハイブリダイゼーション可能な核酸配列の一本鎖3'末端領域は、3'末端において修飾ヌクレオチドを含む。修飾ヌクレオチドは、標的RNA配列を鋳型として使用する、3'末端からの逆転写酵素による伸長反応を、実質的に阻害する。いくつかの態様において、修飾ヌクレオチドはジデオキシリボヌクレオチドである。
【0063】
[0072] いくつかの態様において、核酸配列の二本鎖領域の5'末端の、標的RNA配列の3'末端へのライゲーション反応は、ATP非依存性DNAリガーゼを含む。適切なATP非依存性DNAリガーゼは、E.coliリガーゼまたマイコバクテリウムリガーゼなどの、ニコチンアミドアデニンヌクレオチド(NAD+)依存性DNAリガーゼ(lig A)であってよいが、これらには限定されない。いくつかの態様において、ライゲーションされた配列の転写は、ホスファターゼに対して実質的に反応性をもたない、修飾リボヌクレオチド(rNTP)を使用して行われる。一つの態様において、修飾には、末端リン酸基のアルキル化などの、末端リン酸修飾が含まれる。適切なアルキル化基には、メチル基、またはエチル基が含まれるが、これらには限定されない。
【0064】
[0073] いくつかの態様において、核酸ポリメラーゼ反応は、増幅されたRNA配列を、逆転写酵素、およびホスファターゼに対して実質的に耐性のある修飾されたデオキリボヌクレオチド(dNTP)とともにインキュベーションすることを含む。一態様において、デオキシリボヌクレオチドの修飾には、末端リン酸基のアルキル化などの末端リン酸の修飾が含まれる。
【0065】
[0074] 1つの反応容器中の試料における、標的RNA配列の同時的な指数関数的増幅および検出を可能にする、本発明の方法を実行するために必要とされる試薬を含むキットもまた、本明細書中で提供される。いくつかの態様において、キットは、(a)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的リボ核酸配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、少なくとも1つの核酸配列であり、ここで5'陥凹末端はリン酸化され、そして3'末端はポリメラーゼ伸長ブロッカーでキャップされているもの;(b)ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的リボ核酸配列を核酸配列にライゲーションすることができるライゲーション酵素;(c)ホスファターゼに対して実質的に耐性のあるヌクレオチド;(d)DNAポリメラーゼ、RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の、少なくとも1つ;そして、(e)式;
B-S-Y-(P)n-P-L
に従う、少なくとも1つまたはそれ以上の末端リン酸標識ヌクレオチドであり、式中、P=リン酸(PO3)およびその誘導体、nは2またはそれ以上;Yは酸素または硫黄原子;Bは窒素を含む複素環塩基;Sは非環式部分、炭素環式部分、または糖部分;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である;および(f)ホスファターゼ;が含まれる。
【0066】
[0075] いくつかの態様において、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含むキット中の核酸配列は、合成核酸配列である。いくつかの態様において、このキットは核酸配列としてDNAオリゴヌクレオチドを含む。いくつかの態様において、核酸配列の二本鎖領域は、少なくとも長さ約14ヌクレオチド対であり、そして標的RNA配列とハイブリダイゼーション可能な一本鎖3'末端領域は少なくとも長さ3ヌクレオチドである。いくつかの態様において、このキットはDNA依存性RNAポリメラーゼに対するプロモーター配列を含む核酸配列を含む。適切なDNA依存性RNAポリメラーゼの例は、T7 RNAポリメラーゼ、T4 RNAポリメラーゼ、およびSP6 RNAポリメラーゼであってよいが、これらには限定されない。
【0067】
[0076] いくつかの態様において、このキットには、ポリメラーゼ伸長ブロッカーとしてジデオキシリボヌクレオチドが含まれる。いくつかの態様において、このキットには、ニコチンアミドアデニンジヌクレオチド(NAD+)をそのコファクターとして有するライゲーション酵素が含まれる。NAD+依存性ライゲーション酵素の適切な例には、ligA、E.coliリガーゼ、およびマイコバクテリウムリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、このキットには、キャッピングによりホスファターゼがヌクレオチドを脱リン酸化することを阻害する、キャップ化されたヌクレオチドが含まれる。いくつかの態様において、キャッピングは、ヌクレオチドの末端リン酸にアルキル基を結合することにより達せられる。いくつかの態様において、キャッピングに使用されるアルキル基は、メチル基、またはエチル基である。
【0068】
[0077] いくつかの態様において、このキットは末端リン酸標識デオキシリボヌクレオチドを含む。末端リン酸標識ヌクレオチドは、ポリリン酸鎖に3つまたはそれ以上のリン酸を含むことができる。適切な例には、電気化学的標識、質量タグ、比色分析色素または化学発光標識、あるいは蛍光標識が末端リン酸に結合した、デオキシヌクレオシドポリリン酸、ジデオキシヌクレオシドポリリン酸、炭素環式ヌクレオシドポリリン酸、または非環式ヌクレオシドポリリン酸、およびそれらの類似体などの、ヌクレオシドポリリン酸が含まれるが、これらには限定されない。
【実施例】
【0069】
[0078] 本発明の特定の特徴のみが本明細書中で描写および記述されるが、多数の改良および変化が、当業者には思い当たるであろう。従って、添付の請求の範囲は、本発明の真の精神の範囲に含まれるように、そのような改良および変化のすべてを含むことを意図することが理解されるべきである。本実施例は、例示の目的においてのみ提供され、そして添付の請求の範囲により定義されるように、本発明の範囲を限定するものとして、解釈すべきではない。本明細書中の下記およびその他に与えられる全ての参照は、本明細書中で参照として含まれる。
【0070】
材料
[0079] 水:電気泳動バッファーの調製に用いられる水を含め、本実施例中に用いられるすべての水は、ジエチルピロカーボネート(DEPC)で処理され、さらにオートクレーブされて、あらゆるRNAヌクレアーゼのコンタミネーションを除去した。ライゲーションまたは転写反応の調製に用いられた水はDEPC処理されており、Ambionより入手した。
【0071】
[0080] PT7IVS5(Qiagen Operon)オリゴSEQ ID NO: 1
【0072】
【化1】

【0073】
このデオキリボオリゴヌクレオチド(オリゴ)は、3つの部分からなっている:
1. T7 RNAポリメラーゼに対するプロモーター配列は、太字で示される(Lopezら、1997);
2. 5塩基の介在配列(IVS)、またはそこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基ポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0074】
[0081] cPT7IVS5(Qiagen Operon)
オリゴSEQ ID NO: 2
【0075】
【化2】

【0076】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールのハイブリダイゼーションを促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かって、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0077】
[0082] PT7IVS15(Qiagen Operon)
オリゴSEQ ID NO: 3
【0078】
【化3】

【0079】
このオリゴは3つの部分からなる:
1. 17 RNAポリメラーゼに対するプロモーター配列は、太字で示される;
2. 15塩基のIVS、またはそこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基のポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0080】
[0083] cPT7IVS15(Qiagen Operon)
オリゴSEQ ID NO: 4
【0081】
【化4】

【0082】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールの相補的な結合を促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かい、IVSを通って、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0083】
[0084] RNA35(Dharmacon)
オリゴSEQ ID NO: 5
【0084】
【化5】

【0085】
ライゲーション反応及び転写反応を試験するために設計された合成RNA。この分子の3'水酸基は、cPT7オリゴ(IVS5またはIVS15)の5'リン酸基と、リガーゼ酵素の作用を介して結合することになる。
【0086】
[0085] RNA65(Dharmacon)
オリゴSEQ ID NO: 6
【0087】
【化6】

【0088】
ライゲーション反応及び転写反応を試験するために設計された合成RNA。この分子の3'水酸基は、cPT7オリゴ(IVS5またはIVS15)の5'リン酸基と、リガーゼ酵素の作用を介して結合することになる。
【0089】
[0086] PT3w/T24(Qiagen Operon)
オリゴSEQ ID NO: 7
【0090】
【化7】

【0091】
このオリゴは3つの部分からなる:
1. T3 RNAポリメラーゼに対するプロモーター配列は、太字で示される(Ling M-Lら、1989);
2. 15塩基のIVS、または、そこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基のポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0092】
[0087] cPT3(Qiagen Operon)
オリゴSEQ ID NO: 8
【0093】
【化8】

【0094】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールの相補的な結合を促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かい、IVSを通って、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0095】
[0088] オリゴSEQ ID NO: 9
【0096】
【化9】

【0097】
このオリゴはDNA合成のプライマーであり、そして、人工的な配列である。
【0098】
[0089] オリゴSEQ ID NO: 10
【0099】
【化10】

【0100】
このオリゴはDNA合成の鋳型であり、そして、人工的な配列である。
【0101】
[0090] オリゴSEQ ID NO: 11
【0102】
【化11】

【0103】
このオリゴはDNA合成の鋳型であり、そして、人工的な配列である。
【0104】
実施例1:二本鎖DNAと合成RNAのライゲーション:
[0091] E.coli DNAリガーゼ(New England Biolabs;10 ユニット/μL)を除くすべてのライゲーション反応成分を表1に示される通りに混合した。反応液を60℃、5分間加熱し、そして、室温になるまで放冷した。E.coli DNAリガーゼを適切なチューブに加え、そして、反応液を30℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0105】
【表1】

【0106】
[0092] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、次に95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。試料は、番号順に左から右へそれぞれロードし、DNA分子量マーカーを散在させた。ブロモフェノール・ブルー(BPB)ローディングダイがゲルの一番下にきた時に、電気泳動を止めた。各ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、TyphoonTM 8600 Variable Mode Imager(Typhoon;GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。
【0107】
[0093] DNA分子量マーカーは、100 Base-Pair Ladder(0.5μg)、Homo-Oligomeric pd(A)40-60(1.25×10-3A260 ユニット)およびOligo Sizing Markers(8〜32塩基;0.75μL;すべてGE Healthcare Bio-sciences)の混合物である。
【0108】
[0094] ゲルを緑(532)レーザーおよびフルオレセイン526 SP発光フィルターを使用して、スキャンした。結果は、ライゲーション反応の3つの別々の核酸成分が、自己ライゲーション産物を形成しないことを示す:結果は、完全な反応において、cPT7IVS15とRNA35のライゲーションの予測される産物(DNA:RNAハイブリッド)である、妥当なサイズ(75塩基)のバンドもまた示す。
【0109】
実施例2:3つの異なるリガーゼが二本鎖DNAとRNAをライゲーションする
[0095] リガーゼ酵素以外のすべてのライゲーション反応成分を、表2に示される通りに混合した。反応液を60℃、5分間加熱し、そして室温になるまで放冷した。異なるリガーゼ酵素を適切なチューブに加え、反応液を30℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0110】
[0096] 表2.実施例2における、ライゲーション反応組成。10×ライゲーションバッファーは、酵素とともに提供された。
【0111】
【表2】

【0112】
[0097] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、次に95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。試料は、番号順に左から右へそれぞれロードし、DNA分子量マーカーを散在させた。BPBローディングダイがゲルの一番下にきた時に、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。図4はゲルの蛍光画像である。ゲルは実施例1と同じパラメータを使用してスキャンした。
【0113】
[0098] レーン3に見られるDNA分子量マーカーは、100 Base-Pair Ladder(0.5μg)、Homo-Oligomeric pd(A)40-60(1.25×10-3 A260 ユニット)およびOligo Sizing Markers(8〜32塩基;0.75μL;すべてGE Healthcare Bio-sciences)の混合物である。レーン1および2は、E.coliリガーゼDNAリガーゼを含む(それぞれ反応1および2)。レーン4および5は、T4 DNAリガーゼ反応液を含む(それぞれ反応3および4)。レーン6〜9は、T4 RNAリガーゼ反応液を含む(それぞれ反応5、6、7および8)。ライゲーション産物は、レーン2、5、および7に認められ、3つすべてのリガーゼがDNA 5'リン酸基をRNA 3'水酸基とライゲーションするように機能することを示す。レーン9(反応8)にはライゲーション産物が認められなかった。これはおそらくPT7IVS15オリゴがないため、このライゲーション反応は産物を蓄積するのに時間がかかるだろう。
【0114】
[0099] 実施例3:ライゲーションされたRNAを転写することができる
[0100] E.coli DNAリガーゼ以外のすべてのライゲーション反応成分を、表3に示される通りに混合した。反応液を60℃、5分間加熱し、そして室温になるまで放冷した。E.coli DNAリガーゼを適切なチューブに加え、そして反応液を16℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0115】
【表3】

【0116】
[0101] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。RNA分子量マーカー(AmbionのDecadeTMMarkers)と並べて、試料は、番号順に左から右へそれぞれロードした。BPBローディングダイがゲルの一番下にきた時に、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。
【0117】
[0102] ゲルは実施例1と同じパラメータを使用してスキャンした。予想されるライゲーション産物は反応2および4(表3)より、それぞれに認められた。
【0118】
[0103] 表4に概説される通り、反応液2および4の一部分、および、MEGAscriptTM T7 Kit(Ambion)を使用して、増幅は達せられた。すべての成分を一緒に混合し、そして、37℃、1時間インキュベーションした。
【0119】
【表4】

【0120】
[0104] インキュベーションに続いて、増幅反応液2及び4を、それぞれ等量に分けた。各反応液の一部には、0.5μLの0.5 M EDTAを加え、そしてゲル分析まで氷上に保存した。残りの一部は、70℃、5分間加熱して、SUPERase Inを不活性化した。加熱したそれぞれの部分に1μLのRNase A(44ユニット;US Biochemical, Inc.)を加え、そして、37℃、10分間インキュベーションした。0.5μLの0.5 M EDTAを添加することにより、RNase消化をそれぞれ停止させた。各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。
【0121】
[0105] 反応2および4の転写反応産物は、それぞれに概ねT7 RNAポリメラーゼ(RNAP)反応の典型的なものだった。予測される9ヌクレオチド(nt)のラン・オフ転写物が、BPBダイの上にあることが観察された。この短いラン・オフ転写物は、ライゲーション反応から持ち越された、ライゲーションされなかったPT7IVS5およびcPT7IVS5オリゴから生じる。T7 RNAPは、ラン・オフ反応において、鋳型非依存の1ヌクレオチド付加を行うことが既知であり(Arnaud-Barbeら、1998)、そして、これは9 nt産物のすぐ上にも認められた。さらに、RNAPは二本鎖DNAプロモーターに結合した後、ポリメラーゼがプロモーターを除去するために十分な長さの新生転写物(nascent transcript)が合成されるまで、不完全な転写の周期を経験すること(Lopezら、1997)もまた、既知である。不完全な転写産物は、反応2の9 nt産物の下に観察された。驚くべきことに、反応物は、予測されるサイズ範囲44 ntである、非ラン・オフ転写物を含まなかった。その代わりに、RNAスメアがゲルの上部に観察され、産物サイズが様々な大きさをもつことが示唆される(非特異的産物)。RNAスメアはRNase A処理により消失したが、DNAバンドは残っていた。このスメアは、T7 RNAPの別の特性であり(Macdonaldら、1993)、そして、ホモポリメリックな鋳型に沿ったポリメライゼーションの過程で、酵素が前後に滑ったことの結果である。
【0122】
[0106] 同じ型の反応産物が、PT7IVS15およびcPT7IVS15オリゴを含む転写において認められた。ライゲーション反応から持ち越されたライゲーションされなかったオリゴからの推定19 ntのラン・オフ転写物が、より小さい不完全な転写物とともに観察された。しかしながら、鋳型非依存1ヌクレオチド(nt)付加は、DNA:RNAハイブリッドのRNA部分に入るためポリメラーゼがスタッタリング(stuttering)したように見えるものによって不明瞭となった。また、推定転写物サイズ75 ntは認められなかったが、RNase A処理により消失する、RNAスメアが認められた。RNAスメアはいくつかの反応においてより濃度が濃く、より長いIVSがRNAPをDNA:RNAハイブリッドのRNA部分により効率的に入れることができることが示された。
【0123】
実施例4:二本鎖DNAとmRNAのライゲーションおよび増幅
[0107] 表5に示されるすべての成分を混合し、そして、30℃、15分間インキュベーションした。本実施例には、アニーリング段階は含まれなかった。cPT7IVS15とRNA35のライゲーションに加えて、骨格筋ポリA RNA(smRNA;Russian Cardiology Research and Development Center)もまた、この系のライゲーション標的として使用された。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0124】
[0108] 表5.実施例4におけるライゲーション反応組成。10×ライゲーションバッファーおよびT4 DNAリガーゼは、RNaseフリーであることが保証されており、Takaraより提供された。
【0125】
【表5】

【0126】
[0109] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。オリゴとRNA35の推測されたライゲーション産物が、反応5において認められた。
【0127】
[0110] 表6に概説されるように、反応1および3の一部分、および、MEGAscriptTM T7 Kit(Ambion)を使用して、増幅を行った。すべての成分を一緒に混合し、そして、37℃、1時間インキュベーションした。
【0128】
【表6】

【0129】
[0113] 1μLの0.5 M EDTAを添加することにより、反応をそれぞれ停止した。各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。図5は、ゲルの蛍光画像である。
【0130】
[0114] 図5のレーン1および3は、実施例3で観察されたのと同様に、1塩基鋳型非依存的ヌクレオチド付加、並びに、ラン・オフ転写物と不完全な転写物の両方が示される。レーン3(表6、反応2)における、ゲル上部のRNAスメアと、レーン1(表6、反応1)と比較したときラン・オフ転写物の強度が比較的に減少していることは、二本鎖DNA RNAPプロモーターとmRNAがアニールし、ライゲーションすること、および、DNA:mRNAハイブリッドから相補的RNを転写することの両方の、この系(表6、反応2)の可能性を示唆する。
【0131】
実施例5:γリン酸標識ジデオキシヌクレオチド、ddGTPのポリメラーゼ取り込みを使用する核酸配列検出
[0115] 室温(23℃)で、γ-(4-トリフルオロメチルクマリニル)ddGTP(ddGTP-CF3-クマリン)を使用して、反応を組み立てられた。反応には、プライマーの3'末端に隣接する隣の鋳型ヌクレオチドがdCまたはdTのどちらかであり、それぞれSEQ ID NO: 10、および、SEQ ID NO: 11に対応する、2つの異なるオリゴヌクレオチド鋳型の1つとアニールする、1つのオリゴヌクレオチドプライマー(SEQ ID NO: 9によって示される)を有する、プライマーと鋳型の組み合わせが含まれた。
【0132】
[0116] 本実施例において、鋳型1(SEQ ID NO: 10)について図6を参照すると、DNAポリメラーゼが、標識されたddGTPを用いてプライマーを伸長したことが推測されるだろう。同様に、図6の鋳型2(SEQ ID NO: 11)においては、DNAポリメラーゼが、標識されたddGTPではなく、ddATPを用いてプライマーを伸長したことが推測されるだろう。
【0133】
[0117] 反応条件:25 mM Tris、pH 8.0、5%グルセロール 5 mM MgCl2、0.5 mM β-メルカプトエタノール、0.01%tween-20、0.25ユニットのエビアルカリホスファターゼ、鋳型(示される通り、隣の鋳型ヌクレオチドはdCMPかdTMPのどちらか)にアニールした100 nMプライマー、および、2μM ddGTP-CF3-クマリンを含む反応液70μlを、LS-55 Luminescence Spectrometer(Perkin Elmer)中の、石英蛍光超微量キュベット(quartz fluorescence ultra-microcuvet)にセットし、time driveモードで操作した。励起波長および発光波長は、それぞれ390 nmおよび500 nmである。スリット幅は、励起スリットは5 nm、発光スリットは15 nmであった。3'-5'エキソヌクレアーゼ活性、5'-3'エキソヌクレアーゼ活性、およびジデオキシヌクレオチドに対する識別能を排除するように遺伝子操作されたクローン化DNAポリメラーゼI 0.35μl(11ユニット)、および0.25 mM MnCl2の添加により、反応を開始した。
【0134】
[0118] 図6に示される通り、反応液がγ標識ddGTPを含むため、色素の発光は、鋳型中の隣のヌクレオチドがdCである、プライマー:鋳型1においてのみ検出された。エビアルカリホスファターゼによるリン酸転移によるポリリン酸産物の切断は、CF3-クマリン標識において検出可能な変化をもたらし、それにより核酸の検出を可能になる。プライマー:鋳型2からは、検出可能な色素の発光は得られなかった。
【0135】
実施例6:γリン酸標識ジデオキシヌクレオチド、ddATPのポリメラーゼ取り込みを使用する核酸配列検出
[0119] 室温(23℃)で、ジデオキシヌクレオチド、γ-(3-シアノクマリニル)ddATP(ddATP-CN-クマリン)を使用して、反応を組み立てた。反応には、プライマーの3'末端に隣接する鋳型ヌクレオチドがdCまたはdTのどちらかであり、それぞれSEQ ID NO: 10、および、SEQ ID NO: 11に対応する、2つの異なるオリゴヌクレオチド鋳型の1つとアニールする、1つのオリゴヌクレオチドプライマー(SEQ ID NO: 9)を有する、プライマー:鋳型の組み合わせが含まれた。
【0136】
[0120] 本実施例において、鋳型2(SEQ ID NO: 11)について図7を参照すると、DNAポリメラーゼが、標識されたddATPを用いてプライマーを伸長したことが推測されるだろう。同様に、図7の鋳型1(SEQ ID NO: 10)においては、DNAポリメラーゼが、標識されたddATPではなく、ddGTPを用いてプライマーを伸長したことが推測されるだろう。
【0137】
[0121] 反応条件:25 mM Tris, pH 8.0、5%グルセロール 5 mM MgCl2、0.5 mMβ-メルカプトエタノール、0.01%tween-20、0.25ユニットのエビアルカリホスファターゼ、鋳型にアニールした100 nM プライマー、および2μM ddATP-CN-クマリンを含む、反応液70μlを、LS-55 Luminescence Spectrometer(Perkin Elmer)中の、クオーツ蛍光超微量キュベット(quartz fluorescence ultra-microcuvet)にセットし、time drive モードで操作した。励起波長および発光波長は、それぞれ410 nm、および450 nmである。スリット幅は、励起スリットは5 nm、発光スリットは15 nmであった。3'-5'エキソヌクレアーゼ活性、5'-3'エキソヌクレアーゼ活性、およびジデオキシヌクレオチドに対する識別能を排除するように遺伝子操作された、クローン化DNAポリメラーゼIを0.35μl(11ユニット)、および0.25 mM MnCl2を添加することにより、反応を開始した。
【0138】
[0122] 図7に示される通り、反応液はγ標識ddATPを含むため、色素の発光は、鋳型中の隣のヌクレオチドがdTである、プライマー:鋳型2においてのみ検出された。エビアルカリホスファターゼによるリン酸転移によるポリリン酸産物の切断は、CN-クマリン標識において検出可能な変化を生み出し、核酸の検出を可能にする。プライマー:鋳型1からは、検出可能な色素の発光は得られなかった。
【0139】
実施例7:末端リン酸標識ヌクレオチドを使用する、1つの反応容器中での、同時のRNA増幅および検出
[0123] 反応条件:下記の成分を一緒に混合し、そして、プレートリーダーで37度においてインキュベーションした。バッファー(50 mM Tris:HCl、pH=8.0、7 mM MgCl2、1 mM DDT、0.01%tween-20)、標的RNAを20 ng、プロモーター/プライマー構築物(リン酸化された5'陥凹末端および3'ジデオキシ伸長ブロッカーをもつ)を30 pモル、NADを100μモル、E.coli DNAリガーゼを1ユニット、キャップされたリボヌクレオチド(例えば、rN4P-メチル)を200μモル、T7 RNAポリメラーゼを20ユニット、着目するRNAに対する特異的プライマーを20 pモル、MMLV逆転写酵素を20ユニット、末端リン酸標識ヌクレオチド(例えばdN4P-DDAO)を200μモル、および、細菌性アルカリホスファターゼ0.1ユニット。
【0140】
[0124] ホスファターゼによるシグナルの発生は、裸眼、または、励起波長646 nm、発光波長659 nmを用いたプレートリーダーなどの自動化装置を使用して、可視化されることができる。
【0141】
均等物
[0125] 本発明は、その精神あるいは不可欠な特徴から離れることのない、その他の特異的な形態において具現化されることができる。そのため、前述の態様は、すべての点において、本明細書中に記載される発明に限定するよりもむしろ、例証としてみなされる。このように、本発明の範囲は、前述の説明によるよりもむしろ、添付の請求項によって示され、そして、請求項の均等性(equivalency)の意味および範囲の中に入るすべての変化は、そのため、その中に含まれることが意図される。
【技術分野】
【0001】
関連出願の相互参照
[0001] 本出願は、すべて“末端リン酸標識ヌクレオチドおよび使用の方法”と題されている、2001年8月29日に出願されたアメリカ合衆国仮特許出願第60/315,798号に基づく優先権を主張する、2002年4月1日に出願されたアメリカ合衆国特許出願第10/113,030号の一部継続出願である、2003年2月5日に出願されたアメリカ合衆国特許出願第10/358,818号の一部継続出願であり、そして、2004年12月23日に出願されたアメリカ合衆国特許出願第60/638,937号であり;2005年5月27日に出願されたアメリカ合衆国仮特許出願第60/685,661号に基づいて優先権を主張し;そして、“ライゲーションに基づくRNA増幅”と題された、2005年12月22日に出願された、国際特許出願第PCT/US2005/046800号である。
【背景技術】
【0002】
[0002] 特異性および感受性を伴って、核酸などの特異的な分析対象物を増幅および検出するための、様々な方法が知られている。前記方法は、一般的に検出段階の前に、増幅段階を行うことを必要とする。増幅方法には、デオキリボ核酸(DNA)およびリボ核酸(RNA)をそれぞれ増幅するために使用される、ポリメラーゼ連鎖反応(PCR)および逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)が含まれる。そして、核酸の検出方法には、例えば、酵素または抗体と結合した、蛍光標識または放射活性標識などの検出可能な標識の使用が、一般的に含まれる。
【0003】
[0003] 多くのリボ核酸(RNA)増幅方法には多段階反応が含まれ、例えば、1つの段階としてはRNAから相補的DNA(cDNA)への変換であり、また、複数の酵素および中間の精製段階が必要とされる。
【0004】
[0004] さらに、増幅および検出の方法は、例えば、電気泳動、またはアフィニティー分離技術を使用して、標識された出発物質を標識された生成物から分離することを必要とする。
【0005】
[0005] 従って、既知の技術の限界を超える、指数関数的RNA増幅、およびそれに続く検出のための方法を提供することは、有益であろう。
【発明の概要】
【0006】
発明の属する分野
[0006] 本発明は、ライゲーションに基づく指数関数的リボ核酸増幅と、それに続く、核酸ポリメラーゼの基質として3つまたはそれ以上のリン酸を含む末端リン酸標識ヌクレオチドを用いる、核酸ポリメラーゼ反応を使用する検出のための方法に、一般的に関連する。特異的な標的の検出および同定のための方法の使用もまた、開示される。
【0007】
発明の詳細な説明
[0007] いくつかの態様において、本発明は標的RNA配列の増幅および検出のための方法を提供する。この方法には、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、少なくとも1つの末端リン酸標識ヌクレオチドの存在下で増幅されたRNA配列を核酸ポリメラーゼと反応させて標識されたポリリン酸を産生する段階、および標識されたポリリン酸を検出する段階が含まれる。いくつかの態様において、標識されたポリリン酸をさらにホスファターゼと反応させて、検出可能種を産生する。いくつかの態様において、個々の段階は、1つの反応容器の中で,同時に行われる。
【0008】
[0008] いくつかの態様において、本発明は、(a)標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、(b)ポリリン酸鎖内に3つまたはそれ以上のリン酸基を含む、少なくとも1つの末端リン酸標識ヌクレオチドの存在下で増幅されたRNA配列に対して核酸ポリメラーゼ反応を行い、その反応の結果、標識されたポリリン酸が産生される段階、そして(c)標識されたポリリン酸を検出する段階を含む、試料中の標的RNA配列の存在を検出する方法を提供する。増幅において、標的RNAを、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列と、はじめにハイブリダイゼーションさせる。ハイブリダイゼーションに続いて、核酸配列の二本鎖領域の5'末端を、標的RNA配列の3'末端とライゲーションして、ライゲーションされた配列を形成する。ライゲーションされた配列は、次にRNAポリメラーゼにより転写されて、増幅されたアンチセンス、相補的RNA配列を形成する。いくつかの態様において、2ラウンド目の増幅が、増幅されたアンチセンス相補的RNA配列に対して行われ、増幅されたセンスRNA配列を提供する。
【0009】
[0010] いくつかの態様において、本発明はさらに、試料中の標的RNA配列の同時的な増幅および検出のためのキットを提供する。キットには、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的リボ核酸配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む少なくとも1つの核酸配列;ライゲーション酵素;ホスファターゼに対して実質的に耐性のあるヌクレオチド;DNAポリメラーゼ、RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の少なくとも1つ;1つまたはそれ以上の末端リン酸標識ヌクレオチド、およびホスファターゼが含まれる。核酸配列の5'陥凹末端はリン酸化され、そして、3'末端はポリメラーゼ伸長ブロッカーでキャップされる。キット中のライゲーション酵素は、ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的RNA配列を核酸配列にライゲーションすることができる。末端リン酸標識ヌクレオチドは式;
B-S-Y-(P)n-P-L
であり、式中、P=リン酸(PO3)およびその誘導体であり、nは2またはそれ以上であり;Yは酸素または硫黄原子であり;Bは窒素含有複素環塩基であり;Sは非環式部分、炭素環式部分、または糖部分であり;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識であり;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である。
【図面の簡単な説明】
【0010】
[0011] 本発明のこれらおよびその他の特徴、観点、および利点は、図面を参照しながら以下の詳細な説明を読むことにより、より良く理解されるであろう。
【図1】[0012] 図1は、はじめのライゲーションおよび続く転写反応による、指数関数的RNA増幅の概略図である。
【図2】[0013] 図2は、末端リン酸標識ヌクレオチドを用いる、増幅されたRNA配列の検出の概略図である。
【図3】[0014] 図3は、1つの反応容器中で、はじめのライゲーションおよび続く転写反応、さらに続く末端リン酸標識ヌクレオチドを使用する検出による、同時RNA増幅の概略図を示す。
【図4】[0015] 図4は、3つの異なるリガーゼ(E.coliリガーゼ、T4 DNAリガーゼ、およびT4 RNAリガーゼ)が二本鎖DNAをRNAにライゲーションすることができることを示す、15%7 M尿素TBEゲルの蛍光画像である。
【図5】[0016] 図5は、ライゲーションに基づくmRNA増幅を示す、15%7 M尿素TBEゲルの蛍光画像である。
【図6】[0018] 図6は、ホスファターゼの存在下、鋳型指向性のプロセスにおけるγリン酸標識ddGTPのポリメラーゼ利用により得られる、蛍光を示すグラフである。
【図7】[0019] 図7は、ホスファターゼの存在下、鋳型指向性のプロセスにおけるγリン酸標識ddATPのポリメラーゼ利用により得られる、蛍光を示すグラフである。
【発明を実施するための形態】
【0011】
発明の詳細な説明
[0020] 請求項に記載される発明の主題を、より明確かつ正確に記述および指摘するため、以下の記述および添付の請求の範囲において用いられる特定の用語について、以下の定義が提供される。
【0012】
[0021] 単数形の“a”、“an”および“the”には、文脈上明確にそうでないことを述べていない限り、複数形の対象が含まれる。明細書および請求の範囲にわたってこの中で用いられる場合、概算を意味する用語は、それが関与する基本的な機能に変化をもたらすことなく、許容範囲内で変化させることができる、定量的な表示を修飾するために適用されてよい。従って、“約(about)”などの用語によって修飾される値は、指示された正確な値に限定されない。
【0013】
[0022] 本明細書中で使用される場合、“増幅”という用語または“増幅する(amplifying)”という用語は、標的核酸配列の複数の複製物の産生、または、標的核酸配列に相補的な、複数の核酸配列複製物の産生を言う。
【0014】
[0023] 本明細書中で使用される場合、“増幅されたRNA配列”という用語は、本明細書中で提供される方法を用いて標的RNA配列の増幅/増幅することにより、産生される配列を言う。増幅されたRNA配列は、標的RNA配列に対して同じセンス(2ラウンド目、および続く偶数回目のラウンドの増幅で産生された+ve鎖)あるいはアンチセンス(すなわち、1ラウンド目、および続く奇数回目のラウンドの増幅で産生された-ve鎖)のどちらかであってよい。
【0015】
[0024] 本明細書中で使用される場合、“キャッピング”および“キャップされた”という用語は、分子中の官能基または反応基への、適切な化学修飾部分(chemical moiety)の結合のことを言い、結合した場合、その官能性または反応性を、マスクするか、減少するか、あるいは阻害する。例えば、ヌクレオチドの末端リン酸基を、ホスファターゼによる脱リン酸化を防ぐために、化学修飾部分によりキャップすることが可能である。キャッピングに使用することができる適切な化学修飾部分には、検出可能部分(例えば色素)、またはアルキル基(例えばメチル基またはエチル基)が含まれるが、これらには限定されない。
【0016】
[0025] 本明細書中で使用される場合、“DNA依存性RNAポリメラーゼ”という用語は、そのポリメラーゼ活性の開始のために二本鎖DNAプロモーター配列を認識する、すべてのRNAポリメラーゼのことを言う。RNAポリメラーゼの例には、T7 RNAポリメラーゼ、SP6 RNAポリメラーゼ、およびT3 RNAポリメラーゼが含まれるが、これらには限定されない。
【0017】
[0026] 本明細書中で使用される場合、“電気化学的タグ”という用語は、例えば酸化還元部分などの、電気化学的に活性な部分である。適切な電気化学的タグには、ヌクレオチドの固有の酸化還元電位(例えば、グアニンは約0.75 V、またアデニンは約1.05 Vで電気化学的に酸化されることができる)からは容易に区別できる酸化還元電位を有するものが含まれる。電気化学的タグの例には、1,4-ベンゾキノン(-0.54 V)、フェロセン(+0.307)、テトラシアノキノジメタン(+0.127、-0.291)、N,N,N',N'-テトラメチル-p-フェニレンジアミン(+0.21)、およびテトラチアフルバレン(+0.30)が含まれるが、これらには限定されない。
【0018】
[0027] 本明細書中で使用される場合、“標識されたポリリン酸”という用語は、末端リン酸標識ヌクレオチドの核酸ポリメラーゼ処理の結果として生じる、リン酸転移による無機副産物のことを言う。標識されたポリリン酸は標識を含み、ホスファターゼとの反応により、検出可能種を産生することができる。ホスファターゼを介するリン酸転移によるポリリン酸生成物の切断は、それに結合した標識に検出可能な変化をもたらす。
【0019】
[0028] 本明細書中で使用される場合、“リガーゼ”という用語は、核酸の隣り合う塩基間のニックをつなぐことを触媒する酵素のことを言う。例えば、リガーゼは、5'リン酸基と3'水酸基との間の分子間または分子内共有結合を形成することができるすべての酵素であってよい。適切なリガーゼには、T4 DNAリガーゼ、T4 RNAリガーゼ、およびE.coli DNAリガーゼが含まれてよいが、これらには限定されない。
【0020】
[0029] 本明細書中で使用される場合、“質量タグ”という用語は、質量の違いによって別の成分から容易に区別可能である、質量分析に適する分子量部分のことを言う。質量タグは、スペクトル全体の範囲にわたってよく、そして、質量の違いは一原子質量単位と同じくらい低いことが可能である。
【0021】
[0030] 本明細書中で使用される場合、“核酸ポリメラーゼ”という用語は、その中心的機能が、RNAおよびDNAなどの核酸のポリマーと関与する酵素のことを言う。例えば、核酸ポリメラーゼは、既存のDNAまたはRNA鋳型からの、新規DNAまたはRNAの産生を触媒することが可能である。
【0022】
[0031] 本明細書中で使用される場合、“核酸ポリメラーゼ反応”という用語は、一般に、核酸ポリメラーゼ(例えば、DNAポリメラーゼまたはRNAポリメラーゼ)を使用して、核酸(例えば、DNAまたはRNA)を合成することに関する反応のことを言う。RNAポリメラーゼおよびDNAポリメラーゼは、ヌクレオシド三リン酸(NTP)、デオキシヌクレオシド三リン酸(dNTP)、またはジデオキシヌクレオシド三リン酸(ddNTP)から、伸長しているオリゴヌクレオチド鎖の3'水酸基への、ヌクレオシド一リン酸の転移を介して、オリゴヌクレオチドを合成する。この反応の原動力は、無水物結合の切断、および、無機ピロリン酸の同時形成である。核酸の合成は、ヌクレオチドのαまたはβホスホリル基のみにおける直接的な変化に関与し、ヌクレオチドが、核酸ポリメラーゼ反応における基質として、末端リン酸部位に修飾をもつ、ポリリン酸鎖中に3つまたはそれ以上のリン酸基を有することを可能にする。
【0023】
[0032] 本明細書中で使用される場合、“ヌクレオシド”という用語は、炭素環式部分または非環式部分などの糖または糖代替物に、1'位または同等の位置で結合した、プリン、デアザプリン、ピリミジン、または修飾塩基を有する化合物のことを言い、そして、それには2'-デオキシ体および2'-ヒドロキシル体、および2',3'-ジデオキシ体、並びにその他の置換体を含む。
【0024】
[0033] 本明細書中で使用される場合、“ヌクレオチド”という用語は、天然および修飾されたヌクレオシドリン酸の両方のことを言う。エステル化部位は、ヌクレオシドの五炭糖のC-5位に結合する水酸基に対応することができる。ヌクレオチドを、ホスファターゼに対して実質的に反応性をもたないようにするために、構造的に修飾することができる。構造的修飾には、ホスファターゼがヌクレオチドを脱リン酸化することを防ぐ、化学基によるヌクレオチドのキャッピングが含まれてよい。キャッピングは、ヌクレオチドの末端リン酸にアルキル基(例えばメチル基あるいはエチル基)を結合することにより達せられる。
【0025】
[0034] “オリゴヌクレオチド”という用語には、本明細書中で使用される場合、デオキシリボヌクレオシド、リボヌクレオシドおよび類似体を含む、ヌクレオチドまたはその誘導体の線状オリゴマーが含まれるが、これらには限定されない。本明細書中において、オリゴヌクレオチドが文字の配列により示される場合はいつでも、ヌクレオチドは左から右へ5'→3'の順序であり、Aはアデノシンを示し、Cはシトシンを示し、Gはグアノシンを示し、そしてTはチミジンを示す。
【0026】
[0035] 本明細書中で使用される場合、“ホスファターゼ”という用語は、リン酸モノエステル、リン酸チオエステル、ホスホラミデート、ポリリン酸、およびヌクレオチドを切断し、無機リン酸を遊離させるすべての酵素のことを言う。本発明の文脈において、この酵素は末端標識されたヌクレオシドリン酸を切断しない(すなわち、末端リン酸標識ヌクレオチドは実質的にホスファターゼに対して反応性をもたない)。本明細書中で提供されるホスファターゼの定義には、具体的にはアルカリホスファターゼおよび酸性ホスファターゼ(例えば、細菌アルカリホスファターゼ、子牛腸ホスファターゼ、articエビアルカリホスファターゼ)が含まれるが、これらには限定されない。
【0027】
[0036] 本明細書中で使用される場合、“ポリメラーゼ伸長ブロッカー”という用語は、それがオリゴヌクレオチドの3'末端に結合した場合に、核酸ポリメライゼーション反応により伸長している核酸鎖の3'端からのさらなる伸長を阻害する化学部分のことを言う。ポリメラーゼ伸長ブロッカーは、修飾ヌクレオチド(例えば、ジデオキシリボヌクレオチド)であってもよい。オリゴヌクレオチドの3'末端における修飾ヌクレオチドは、3'末端からの逆転写酵素による伸長反応を遮断することが可能である。
【0028】
[0037] 本明細書中で使用される場合、“プライマーゼ”という用語は、DNA複製に関与するRNAポリメラーゼのことを言う。複製の間、プライマーゼは最初のRNAプライマーを合成し、次にDNAポリメラーゼによるDNA合成を開始する。細菌においては、プライマーゼはDNAへリカーゼに結合し、複合体、プライモソームを形成する。次にプライマーゼはDNAヘリカーゼにより活性化され、そして、長さ約11ヌクレオチドの短いRNAプライマーを合成し、これに新しいヌクレオチドをDNAポリメラーゼにより付加することができる。
【0029】
[0038] 本明細書中で使用される場合、“プライマー”という用語は、あらかじめ定められた核酸配列に特異的にアニールする線状オリゴヌクレオチドのことを言う。プライマーはそれにアニールする標的核酸領域の、逆向き相補的な配列を有するように設計される。プライマーの長さの上限および下限の両方は、経験的に決定される。非常に短いプライマー(長さ12ヌクレオチドより短い)は、ハイブリダイゼーション条件下、熱力学的に安定な二本鎖を形成しないため、プライマーの長さの下限は、安定したハイブリダイゼーションである。上限は、あらかじめ定められた呼び出し(interrogation)標的以外の領域における二本鎖形成の可能性により決定される。適切なプライマーの長さは、約12〜100ヌクレオチドの範囲であり、好ましくは約15〜30ヌクレオチド、そして最も好ましくは、長さ約17〜25ヌクレオチドである。
【0030】
[0039] 本明細書中で使用される場合、“標的核酸配列”という用語は、その配列の固有性、またはヌクレオシドの順序あるいは位置が、1つあるいはそれ以上の本発明の方法によって決定される、核酸配列のことを言う。標的核酸配列は、天然由来または合成由来のリボ核酸(RNA)であってよい。標的RNA配列は、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA、ミトコンドリアRNA、核内低分子RNA(snRNA)、低分子干渉RNA(siRNA)、またはヘテロ核RNA(hnRNA)であってよいが、これらには限定されない。
【0031】
[0040] 本明細書中で使用される場合、“末端リン酸標識ヌクレオチド”という用語は、ヌクレオチドの末端のリン酸において構造的な修飾が含まれるヌクレオチドのことを言う。構造的な修飾は、標識(例えば、化学発光、蛍光、電気化学的、あるいは色素体部分、ラマンアクティブタグ、あるいは質量タグ)の結合であってよく、そして、前記修飾は、ポリメラーゼ反応において機能するヌクレオチドの能力を損なわない。使用される標識は、酵素により活性化可能な標識であってよいが、これらには限定されない。末端リン酸標識ヌクレオチドには、ポリリン酸鎖に3つまたはそれ以上のリン酸基が含まれるといってもよく、そして、これらの末端リン酸標識ヌクレオチドが核酸ポリメラーゼ反応において使用される場合、その反応により、標識されたポリリン酸の産生がもたらされる。
【0032】
[0041] 本明細書中で使用される場合、“転写”および“転写する”という用語は、DNA配列またはRNA配列がRNAポリメラーゼにより酵素的に複製され、相補的なRNAが産生される過程のことを言う。転写は5'→3'方向で進行する(すなわち、鋳型は3'→5'方向で読まれ、そして新規の相補的断片は、5'→3'方向で生成される)。RNA鋳型がそのポリマー活性の開始のための二本鎖DNAプロモーター配列にライゲーションされる場合、DNA依存性RNAポリメラーゼを使用してRNA鋳型を転写することができる。二本鎖DNA領域上のRNAポリメラーゼによる転写開始の後、転写は、観察可能な速度の低下または前進性の低下はなく、RNA-DNA接合点を超えてRNA領域へと進行する。転写される鋳型RNAは、一本鎖RNA、二本鎖RNA、あるいはDNA:RNAヘテロ二本鎖であってよい。
【0033】
態様
[0042] いくつかの態様において、本発明は標的RNA配列を増幅および検出する方法を提供する。この方法には、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、増幅されたRNA配列を少なくとも1つの末端リン酸標識ヌクレオチドの存在下、核酸ポリメラーゼと反応させ、標識されたポリリン酸を産生する段階、および、標識されたポリリン酸を検出する段階、が含まれる。
【0034】
[0043] 目的とする標的核酸を含むことが疑われるか、あるいは知られている試料は、様々な源から入手することができる。試料は、生体試料、食物または農産物試料、あるいは、環境試料であってよいが、これらには限定されない。試料はまた、生体被験体由来であってもよい。生体被験体は、原核生物または真核生物由来であってよく、そしてウイルスが含まれる。そのような試料は、生体組織、あるいは、体液または滲出液(例えば、血液、血漿、血清または尿、乳汁、脳脊髄液、胸膜液、リンパ液、涙液、痰、唾液、便、肺吸引物、咽頭スワブまたは生殖器スワブなど)、全細胞、細胞画分、あるいは培養物のうちのあるもの/由来のものであってよいが、これらには限定されない。特定の状況において、ハイブリダイゼーションのための標的核酸配列を、遊離および/または抽出するために試料を処置することは、必要あるいは望ましいであろう。標的核酸が二本鎖の形態で存在する場合、変性させ、そして、ハイブリダイゼーション可能な一本鎖の形態にさせることもまた、必要あるいは望ましいだろう。試料中の標的核酸は、溶液中に分散させることができ、あるいは固体の支持体(ブロット、アレイまたはマイクロタイター、またはウェルプレートなど)に固定することができる。
【0035】
[0044] 標的RNA配列の検出を、例えば、病原生物の検出、法医学的目的、医療診断目的、または臨床目的で、使用することができる。本発明には、分析的、診断的、または予測的な応用において適用できる方法に、一般的に関与する態様が含まれる。
【0036】
[0045] いくつかの態様において、標的RNA配列は、ヘテロポリメリック、あるいはホモポリメリックな配列であってよい。検出のための標的RNA配列には、天然または合成のRNAおよび/または天然または合成のオリゴリボヌクレオチドが含まれてよい。これは、リボ核酸(RNA)、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA、ミトコンドリアRNA、核内低分子RNA(snRNA)または低分子干渉RNA(siRNA)、およびヘテロ核RNA(hnRNA)であってよいが、これらには限定されない。いくつかの態様において、増幅には、中間体c-DNAを合成する段階が含まれない。
【0037】
[0046] いくつかの態様において、増幅されたRNA配列は、標的RNA配列と比較して、同じ方向(増幅されたセンスRNA配列)である。別の態様において、増幅されたRNA配列は、標的RNA配列と比べて、逆の方向(増幅されたアンチセンス、相補的RNA配列)である。
【0038】
[0047] いくつかの態様において、増幅された核酸配列の核酸ポリメラーゼとの反応は、核酸ポリメライゼーション反応である。いくつかの態様において、標的RNA配列を増幅する段階、核酸ポリメラーゼ反応を行う段階、および標識されたポリリン酸を検出する段階は、1つの反応容器の中で行われる。いくつかの態様において、前述の段階は、均一なアッセイ形式において行われる。いくつかの態様において、前述の段階は、連続して行われる。いくつかの態様において、2つあるいはそれ以上の前述の段階は、同時に行われる。いくつかの態様において、前述のすべての段階は、1つの均一な反応混合液を用いて、一斉に行われる。いくつかの態様において、前述のすべての段階は、1つの均一な反応混合液を用いて、連続的に行われる。
【0039】
[0048] 標識されたポリリン酸の有無および/または濃度は、標的リボ核酸の有無および/または定量と相関する可能性がある。つまり、ある態様において、方法には、1つあるいはそれ以上追加の検出試薬(例えば、標識プローブまたは標識抗体)を、ポリメラーゼ反応に対して加える段階がさらに含まれてよい。
【0040】
[0049] いくつかの態様において、標識されたポリリン酸の検出は、標識されたポリリン酸の有無および/または濃度の検出によって行われる。ある態様において、標識されたポリリン酸をさらにホスファターゼと反応させ、検出可能種を産生する。標識されたポリリン酸の検出は、標識されたポリリン酸をホスファターゼと反応させて検出可能種を産生し、そして形成された検出可能種を検出することによって行うことができる。検出可能種は、比色分析、蛍光、化学発光、質量変化、ラマンシグナル、電気化学的シグナル、またはこれらの組み合わせにより検出可能であってよい。
【0041】
[0050] いくつかの態様において、核酸ポリメラーゼ反応は、DNAまたはRNAポリメラーゼの、少なくとも1つの存在下、行われる。適切なポリメラーゼには、DNA依存性RNAポリメラーゼ、プライマーゼ、テロメラーゼ、ターミナルデオキシヌクレオチドトランスフェラーゼ、またはRNA依存性DNAポリメラーゼ(逆転写酵素)が含まれるが、これらには限定されない。核酸ポリメラーゼは、DNAポリメラーゼI、II、またはIIIなどのDNAポリメラーゼ;DNAポリメラーゼα、β、γ;ターミナルデオキシヌクレオチドトランスフェラーゼ;またはテロメラーゼであってよい。あるいは、使用される核酸ポリメラーゼは、RNA依存性DNAポリメラーゼ(逆転写酵素)である。適切な逆転写酵素には、HIV RT、MMLV RT、または逆転写活性を有するDNAポリメラーゼが含まれるが、これらには限定されない。
【0042】
[0051] いくつかの態様において、核酸ポリメラーゼ反応には、ポリリン酸鎖に3つあるいはそれ以上のリン酸基を含む、少なくとも1つの末端リン酸標識ヌクレオチドが含まれ、副産物として標識されたポリリン酸を産生する。いくつかの態様において、核酸ポリメラーゼ反応段階には、標識されたポリリン酸副産物を検出可能種に変換する、ホスファターゼがさらに含まれてよい。いくつかの態様において、核酸ポリメライゼーション反応には、増幅されたRNA配列を、プライマー、ヌクレオチド、逆転写酵素、および少なくとも1つの末端リン酸標識ヌクレオチドとインキュベーションすることが含まれる。いくつかの態様において、核酸ポリメラーゼ反応には、少なくとも1つの末端リン酸標識ヌクレオチドに加えて、ホスファターゼに実質的に反応性をもたない、少なくとも1つのヌクレオチドが含まれる。
【0043】
[0052] 核酸ポリメラーゼ反応における基質として有用なヌクレオチドには、デオキシリボヌクレオシドポリリン酸、リボヌクレオシドポリリン酸、ジデオキシヌクレオシドボリリン酸、炭素環式ヌクレオシドポリリン酸および非環式ヌクレオシドポリリン酸、およびそれらの類似体などの、ヌクレオシドポリリン酸が含まれてよいが、これらには限定されない。いくつかの態様において、ヌクレオチドは、ホスファターゼがヌクレオチドを脱リン酸化することを防ぐ、保護基によりキャップされることができる。いくつかの態様において、キャッピングは、ヌクレオチドの末端リン酸にアルキル基を結合することにより、達成される。いくつかの態様において、キャッピングに用いられるアルキル基は、メチル基またはエチル基である。
【0044】
[0053] 末端リン酸標識ヌクレオチドは、伸長するヌクレオチド鎖へのヌクレオシド一リン酸の取り込みに付随して放出される標識されたポリリン酸が、検出可能種であるか、あるいは検出可能種を産生することができることを意味する。
【0045】
[0054] いくつかの態様において、末端リン酸標識ヌクレオチドの末端リン酸部位に結合した標識には、化学発光標識、蛍光標識、蛍光標識、発色標識、質量タグ、ラマンタグ、電気化学タグ、またはそれらの組み合わせが含まれてよいが、これらには限定されない。いくつかの態様において、標識は、色、蛍光発光、化学発光、質量変化、ラマンスペクトル、電気化学シグナル、またはそれらの組み合わせの、有無、あるいは変化によって、検出可能であってよい。
【0046】
[0055] いくつかの態様において、末端リン酸標識ヌクレオチドは、ポリリン酸鎖に3つあるいはそれ以上のリン酸を含む。適切な例には、デオキシヌクレオシドポリリン酸、ジデオキヌクレオシドポリリン酸、炭素環式ヌクレオシドポリリン酸、または非環式ヌクレオシドポリリン酸などの、ヌクレオシドポリリン酸、および電気化学標識、比色分析標識、化学発光標識、または蛍光標識、質量タグ、またはラマンタグが末端リン酸に結合した、それらの類似体が含まれる。いくつかの態様において、標識されたポリリン酸は、さらにホスファターゼと反応して、検出可能種を産生する。そのような態様において、標識されたポリリン酸における検出可能種は、ホスファターゼにより処理されるまでは検出されないような方法で、適切にマスクされる。しかしながら、伸長するオリゴヌクレオチド鎖へのヌクレオチド一リン酸の取り込み、およびそれに続く反応物のホスファターゼ処理によって、検出可能種はマスクが外され、検出可能になる。例えば、1,3-ジクロロ-9,9-ジメチル-アクリジン-2-オン(DDAO)の三環構造の側面の水酸基がヌクレオチドの末端リン酸部位に結合すると、DDAOは659 nmにおいて蛍光を発しない。
【0047】
[0056] 核酸ポリメラーゼ反応の間、伸長する核酸にヌクレオシド一リン酸が一度取り込まれると、副産物、DDAOポリリン酸(これもまた659 nmで蛍光を発しない)は、ホスファターゼの基質となる。一度脱リン酸化されてDDAOを形成すると、色素部分は659 nmにおいて蛍光を発するようになり、そのため検出可能になる。脱リン酸化されるとき、DDAOリン酸は、蛍光発光の大きいシフト、および、蛍光強度の大きな増加を示す(DDAO-リン酸は約570 nmにおいて弱い蛍光を発する。脱リン酸化されるとき、蛍光発光は約659 nmにシフトし、そして、蛍光強度は約20倍に増加する)。いくつかの態様において、ポリリン酸生成物の特異的な分析は、ポリメラーゼ反応溶液中で行うことができ、開始物質から反応生成物を分離する必要性を排除する。このことは、検出を可能にし、また、任意で、分光光度計などの日常的な器具を使用してポリメラーゼ反応の間に形成された核酸を定量することを可能にする。
【0048】
[0057] いくつかの態様において、リン酸転移の標識されたポリリン酸副産物を、ホスファターゼ処理を用いずに検出することができる。例えば、天然または修飾されたヌクレオシド塩基、特にグアニンは、蛍光の消光を引き起こすことができる。そのため、標識が蛍光色素分子である、末端リン酸標識ヌクレオチドは、標識が、塩基によって部分的に消光されることができる。ヌクレオシド一リン酸の取り込みに際して、標識ポリリン酸副産物は、その増強した蛍光のため、検出することができる。あるいは、標識されたポリリン酸生成物は、例えば、クロマトグラフィー分離法により、検出前に、物理的に分離することが可能であってよい。
【0049】
[0058] いくつかの態様において、末端リン酸標識ヌクレオチドは式:
B-S-Y-(P)n-P-L
により表されることができ、式中、P=リン酸(PO3)およびその誘導体、nは2またはそれ以上;Yは酸素または硫黄原子;Bは窒素を含む複素環塩基;Sは非環式部分、炭素環式部分、または糖部分;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である。
【0050】
[0059] 末端リン酸標識ヌクレオチド中の糖部分には、リボシル、2'-デオキシリボシル、3'-デオキシリボシル、2',3'-ジデオキシリボシル、2',3'-ジデヒロドロジデオキシリボシル、2'-または3'-アルコキシリボシル、2'-または3'-アミノリボシル、2'-または3'-フルオロリボシル、2'-または3'-メルカプトリボシル、2'-または3'-アルキルチオリボシル、非環式、炭素環式、および、その他の修飾された糖が含まれてよいが、これらには限定されない。
【0051】
[0060] 末端リン酸標識ヌクレオチド中の塩基には、ウラシル、チミン、シトシン、5-メチルシトシン、グアニン、7-デアザグアニン、ヒポキサンチン、7-デアザヒポキサンチン、アデニン、7-デアザアデニン、2,6-ジアミノプリン、および、それらの類似体が含まれてよいが、これらには限定されない。
【0052】
[0061] 本明細書中に提供される方法を使用すると、中間体c-DNA合成段階を省いた、ライゲーションに基づくRNA増幅方法によって、標的RNAを増幅することができる。いくつかの態様において、標的RNA増幅は、はじめに、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列と、標的RNAとをハイブリダイゼーションさせることにより行われる。ハイブリダイゼーションに続いて、核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端にライゲーションして、ライゲーションされた配列を形成する。ライゲーションされた配列は、次にRNAポリメラーゼにより転写されて、増幅されたアンチセンス、相補的RNA配列を形成することができる。いくつかの態様において、2ラウンド目の増幅が、増幅されたアンチセンス相補的RNA配列において行われ、増幅されたセンスRNA配列を提供する。
【0053】
[0062] いくつかの態様において、標的RNA配列を増幅して、増幅されたRNA配列を産生する段階には、(i)ポリA以外の標的RNA配列を提供する段階;(ii)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供する段階;(iii)核酸配列の一本鎖3'末端領域を標的RNA配列とハイブリダイゼーションさせる段階;(iv)核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端にライゲーションして、ライゲーションされた配列を形成する段階;(v)ライゲーションされた配列を、RNAポリメラーゼを用いて転写して、増幅されたアンチセンス、相補的RNA配列を形成する段階;が含まれる。いくつかの態様において、標的RNA配列の増幅は、増幅されたアンチセンス相補的RNAを標的RNA配列として使用して前述の(i)〜(iv)の段階を行って、増幅されたセンスRNA配列を産生することを、さらに含む。
【0054】
[0063] いくつかの態様において、2つまたはそれ以上の前述の段階は、1つの反応容器の中で行われる。あるいは、前述のすべての段階を、1つの反応容器中で実行することができる。いくつかの態様において、個々の段階は、段階的に行われる。いくつかの態様において、使用されるRNAポリメラーゼは、DNA依存性RNAポリメラーゼである。いくつかの態様において、DNA依存性RNAポリメラーゼは、T7 RNAポリメラーゼである。
【0055】
[0064] 転写反応に使用されるデオキシリボヌクレオチドは、実質的にホスファターゼと反応性をもたないように構造的に修飾することが可能であり、それは、ホスファターゼがヌクレオチドを脱リン酸化することを阻害する何らかの保護基で、ヌクレオチドをキャッピングすることにより達することができる。いくつかの態様において、キャッピングは、アルキル基(例えば、メチル基、またはエチル基)をヌクレオチドの末端のリン酸に結合することにより、達せられることができる。
【0056】
[0065] いくつかの態様において、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列とハイブリダイゼーション可能な一本鎖3'末端領域を含む核酸配列は、合成核酸配列である。いくつかの態様において、核酸配列は、デオキシリボ核酸(DNA)またはオリゴデオキシリボヌクレオチドである。いくつかの態様において、核酸配列の二本鎖領域は、少なくとも長さ約14ヌクレオチド対である。いくつかの態様において、標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域は、少なくとも長さ3ヌクレオチドである。いくつかの態様において、二本鎖DNAオリゴヌクレオチドは、二本鎖領域内にRNAポリメラーゼに対するプロモーターを含み、3'突出部を形成する一本鎖DNA配列のセグメントがそれに続く。
【0057】
[0066] DNAオリゴヌクレオチドはさらに転写開始部位を含むことができる。いくつかの態様において、3'突出部を含む二本鎖DNAオリゴヌクレオチドは、チミジン残基の列を含む。いくつかの態様において、チミジン残基の列を含む一本鎖3'突出領域は、標的メッセンジャーRNA(mRNA)ポリ(A)テールの3'末端とハイブリダイゼーションする。いくつかの態様において、標的RNA配列とハイブリダイゼーション可能な核酸配列の一本鎖3'末端領域は、3'末端において修飾ヌクレオチドを含む。いくつかの態様において、修飾ヌクレオチドは、3'末端からの逆転写酵素による伸長反応を遮断することができる。いくつかの態様において、修飾ヌクレオチドはジデオキシリボヌクレオチドである。
【0058】
[0067] 核酸配列中のプロモーター配列は、細菌性RNAポリメラーゼ(例えば、E.coli RNAポリメラーゼ)により認識される配列を含むことができる。いくつかの態様において、核酸配列中のプロモーター配列は、バクテリオファージ由来のRNAポリメラーゼによって認識される配列を含む。バクテリオファージ由来のRNAポリメラーゼの例には、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、およびSP6 RNAポリメラーゼが含まれてよいが、これらには限定されない。いくつかの態様において、核酸配列中のプロモーター配列には、バクテリオファージT7 RNAポリメラーゼに対するプロモーターが含まれる。
【0059】
[0068] いくつかの態様において、核酸配列の二本鎖領域の5'末端へ、標的RNA配列の3'末端をライゲーションして、ライゲーションされた配列を形成することは、酵素的手段によって実行される。いくつかの態様において、ライゲーションはDNAリガーゼを使用して行われる。適切なDNAリガーゼには、細菌またはバクテリオファージ由来のリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、ライゲーションはT4 DNAリガーゼを使用して行われる。いくつかの態様において、ライゲーションは、実質的にホスファターゼに耐性があるコファクターを利用するDNAリガーゼを使用することにより、行われる。そのようなリガーゼの適切な例には、NAD+依存性DNAリガーゼ(ligA)が含まれるが、これらには限定されない。適切なNAD+依存性DNAリガーゼには、E.coliあるいはマイコバクテリウム由来のDNAリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、使用されるDNAリガーゼはE.coliリガーゼである。
【0060】
[0069] いくつかの態様において、本発明の方法は、温度条件が増幅の各サイクルの間、実質的に一定に保たれる、等温条件下で行われる。反応に適する温度は、15度から50度の範囲である。いくつかの態様において、本発明の方法は、選択された温度が25度から40度の間である、等温条件下で行われる。
【0061】
[0070] いくつかの態様において、本発明は、1つの反応容器中の試料における、標的リボ核酸配列の指数関数的増幅および検出の方法を提供する。この方法には、a)標的RNA配列を増幅して、増幅されたRNA配列を産生する段階、(b)プライマー、およびポリリン酸鎖内に3つまたはそれ以上のリン酸基を含む少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列に対して核酸ポリメラーゼ反応を行って、標識されたポリリン酸の産生をもたらす段階;(c)標識されたポリリン酸をホスファターゼと反応させ、検出可能種を産生する段階;そして(d)検出可能種を検出する段階;が含まれる。いくつかの態様において、前述の段階は同時に行われる。
【0062】
[0071] RNAの増幅は、c-DNA中間体は関与せず、プロモーターに基づく増幅が関与する。増幅には、(i.)ポリA以外の標的RNA配列を提供する段階、(ii.)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供する段階;(iii.)核酸配列の一本鎖3'末端領域と標的RNA配列とをハイブリダイゼーションする段階;(iv.)核酸配列の二本鎖領域の5'末端を標的RNA配列の3'末端とライゲーションして、ライゲーションされた配列を作成する段階;(v.)ライゲーションされた配列を、RNAポリメラーゼを用いて転写して、増幅されたアンチセンス、相補的RNA配列を形成する段階;が含まれる。いくつかの態様において、増幅されたアンチセンス相補的RNAを標的RNA配列として使用して(i)〜(iv)の段階が繰り返され、増幅されたセンスRNA配列を形成する。いくつかの態様において、標的RNA配列にハイブリダイゼーション可能な核酸配列の一本鎖3'末端領域は、3'末端において修飾ヌクレオチドを含む。修飾ヌクレオチドは、標的RNA配列を鋳型として使用する、3'末端からの逆転写酵素による伸長反応を、実質的に阻害する。いくつかの態様において、修飾ヌクレオチドはジデオキシリボヌクレオチドである。
【0063】
[0072] いくつかの態様において、核酸配列の二本鎖領域の5'末端の、標的RNA配列の3'末端へのライゲーション反応は、ATP非依存性DNAリガーゼを含む。適切なATP非依存性DNAリガーゼは、E.coliリガーゼまたマイコバクテリウムリガーゼなどの、ニコチンアミドアデニンヌクレオチド(NAD+)依存性DNAリガーゼ(lig A)であってよいが、これらには限定されない。いくつかの態様において、ライゲーションされた配列の転写は、ホスファターゼに対して実質的に反応性をもたない、修飾リボヌクレオチド(rNTP)を使用して行われる。一つの態様において、修飾には、末端リン酸基のアルキル化などの、末端リン酸修飾が含まれる。適切なアルキル化基には、メチル基、またはエチル基が含まれるが、これらには限定されない。
【0064】
[0073] いくつかの態様において、核酸ポリメラーゼ反応は、増幅されたRNA配列を、逆転写酵素、およびホスファターゼに対して実質的に耐性のある修飾されたデオキリボヌクレオチド(dNTP)とともにインキュベーションすることを含む。一態様において、デオキシリボヌクレオチドの修飾には、末端リン酸基のアルキル化などの末端リン酸の修飾が含まれる。
【0065】
[0074] 1つの反応容器中の試料における、標的RNA配列の同時的な指数関数的増幅および検出を可能にする、本発明の方法を実行するために必要とされる試薬を含むキットもまた、本明細書中で提供される。いくつかの態様において、キットは、(a)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的リボ核酸配列にハイブリダイゼーション可能な一本鎖3'末端領域を含む、少なくとも1つの核酸配列であり、ここで5'陥凹末端はリン酸化され、そして3'末端はポリメラーゼ伸長ブロッカーでキャップされているもの;(b)ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的リボ核酸配列を核酸配列にライゲーションすることができるライゲーション酵素;(c)ホスファターゼに対して実質的に耐性のあるヌクレオチド;(d)DNAポリメラーゼ、RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の、少なくとも1つ;そして、(e)式;
B-S-Y-(P)n-P-L
に従う、少なくとも1つまたはそれ以上の末端リン酸標識ヌクレオチドであり、式中、P=リン酸(PO3)およびその誘導体、nは2またはそれ以上;Yは酸素または硫黄原子;Bは窒素を含む複素環塩基;Sは非環式部分、炭素環式部分、または糖部分;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である;および(f)ホスファターゼ;が含まれる。
【0066】
[0075] いくつかの態様において、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的RNA配列にハイブリダイゼーション可能な一本鎖3'末端領域を含むキット中の核酸配列は、合成核酸配列である。いくつかの態様において、このキットは核酸配列としてDNAオリゴヌクレオチドを含む。いくつかの態様において、核酸配列の二本鎖領域は、少なくとも長さ約14ヌクレオチド対であり、そして標的RNA配列とハイブリダイゼーション可能な一本鎖3'末端領域は少なくとも長さ3ヌクレオチドである。いくつかの態様において、このキットはDNA依存性RNAポリメラーゼに対するプロモーター配列を含む核酸配列を含む。適切なDNA依存性RNAポリメラーゼの例は、T7 RNAポリメラーゼ、T4 RNAポリメラーゼ、およびSP6 RNAポリメラーゼであってよいが、これらには限定されない。
【0067】
[0076] いくつかの態様において、このキットには、ポリメラーゼ伸長ブロッカーとしてジデオキシリボヌクレオチドが含まれる。いくつかの態様において、このキットには、ニコチンアミドアデニンジヌクレオチド(NAD+)をそのコファクターとして有するライゲーション酵素が含まれる。NAD+依存性ライゲーション酵素の適切な例には、ligA、E.coliリガーゼ、およびマイコバクテリウムリガーゼが含まれてよいが、これらには限定されない。いくつかの態様において、このキットには、キャッピングによりホスファターゼがヌクレオチドを脱リン酸化することを阻害する、キャップ化されたヌクレオチドが含まれる。いくつかの態様において、キャッピングは、ヌクレオチドの末端リン酸にアルキル基を結合することにより達せられる。いくつかの態様において、キャッピングに使用されるアルキル基は、メチル基、またはエチル基である。
【0068】
[0077] いくつかの態様において、このキットは末端リン酸標識デオキシリボヌクレオチドを含む。末端リン酸標識ヌクレオチドは、ポリリン酸鎖に3つまたはそれ以上のリン酸を含むことができる。適切な例には、電気化学的標識、質量タグ、比色分析色素または化学発光標識、あるいは蛍光標識が末端リン酸に結合した、デオキシヌクレオシドポリリン酸、ジデオキシヌクレオシドポリリン酸、炭素環式ヌクレオシドポリリン酸、または非環式ヌクレオシドポリリン酸、およびそれらの類似体などの、ヌクレオシドポリリン酸が含まれるが、これらには限定されない。
【実施例】
【0069】
[0078] 本発明の特定の特徴のみが本明細書中で描写および記述されるが、多数の改良および変化が、当業者には思い当たるであろう。従って、添付の請求の範囲は、本発明の真の精神の範囲に含まれるように、そのような改良および変化のすべてを含むことを意図することが理解されるべきである。本実施例は、例示の目的においてのみ提供され、そして添付の請求の範囲により定義されるように、本発明の範囲を限定するものとして、解釈すべきではない。本明細書中の下記およびその他に与えられる全ての参照は、本明細書中で参照として含まれる。
【0070】
材料
[0079] 水:電気泳動バッファーの調製に用いられる水を含め、本実施例中に用いられるすべての水は、ジエチルピロカーボネート(DEPC)で処理され、さらにオートクレーブされて、あらゆるRNAヌクレアーゼのコンタミネーションを除去した。ライゲーションまたは転写反応の調製に用いられた水はDEPC処理されており、Ambionより入手した。
【0071】
[0080] PT7IVS5(Qiagen Operon)オリゴSEQ ID NO: 1
【0072】
【化1】

【0073】
このデオキリボオリゴヌクレオチド(オリゴ)は、3つの部分からなっている:
1. T7 RNAポリメラーゼに対するプロモーター配列は、太字で示される(Lopezら、1997);
2. 5塩基の介在配列(IVS)、またはそこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基ポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0074】
[0081] cPT7IVS5(Qiagen Operon)
オリゴSEQ ID NO: 2
【0075】
【化2】

【0076】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールのハイブリダイゼーションを促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かって、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0077】
[0082] PT7IVS15(Qiagen Operon)
オリゴSEQ ID NO: 3
【0078】
【化3】

【0079】
このオリゴは3つの部分からなる:
1. 17 RNAポリメラーゼに対するプロモーター配列は、太字で示される;
2. 15塩基のIVS、またはそこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基のポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0080】
[0083] cPT7IVS15(Qiagen Operon)
オリゴSEQ ID NO: 4
【0081】
【化4】

【0082】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールの相補的な結合を促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かい、IVSを通って、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0083】
[0084] RNA35(Dharmacon)
オリゴSEQ ID NO: 5
【0084】
【化5】

【0085】
ライゲーション反応及び転写反応を試験するために設計された合成RNA。この分子の3'水酸基は、cPT7オリゴ(IVS5またはIVS15)の5'リン酸基と、リガーゼ酵素の作用を介して結合することになる。
【0086】
[0085] RNA65(Dharmacon)
オリゴSEQ ID NO: 6
【0087】
【化6】

【0088】
ライゲーション反応及び転写反応を試験するために設計された合成RNA。この分子の3'水酸基は、cPT7オリゴ(IVS5またはIVS15)の5'リン酸基と、リガーゼ酵素の作用を介して結合することになる。
【0089】
[0086] PT3w/T24(Qiagen Operon)
オリゴSEQ ID NO: 7
【0090】
【化7】

【0091】
このオリゴは3つの部分からなる:
1. T3 RNAポリメラーゼに対するプロモーター配列は、太字で示される(Ling M-Lら、1989);
2. 15塩基のIVS、または、そこからポリ(dT)配列が始まる、転写開始部位に相補的な配列は、斜体で示される;
3. 24塩基のポリ(dT)配列(T24)、またはmRNA 3'ポリ(rA)テールを“捕捉する”ために使用される配列は、下線が引かれている。
【0092】
[0087] cPT3(Qiagen Operon)
オリゴSEQ ID NO: 8
【0093】
【化8】

【0094】
このオリゴは4つの部分からなっており、そして、RNA合成のための鋳型である:
1. 5'リン酸基はmRNAの3'水酸基との共有結合の形成に関与する;
2. 斜体で示される連続した4つのdA残基は、mRNAの3'ポリ(rA)テールの相補的な結合を促進する;
3. RNAポリメラーゼにより転写される一番目の塩基は、下線を引かれたCによって示される。合成は、cPT7IVS5オリゴの5'末端へ向かい、IVSを通って、結合したmRNA配列へと進行するだろう;
4. プロモーター配列と相補的な配列は、太字で示される。
【0095】
[0088] オリゴSEQ ID NO: 9
【0096】
【化9】

【0097】
このオリゴはDNA合成のプライマーであり、そして、人工的な配列である。
【0098】
[0089] オリゴSEQ ID NO: 10
【0099】
【化10】

【0100】
このオリゴはDNA合成の鋳型であり、そして、人工的な配列である。
【0101】
[0090] オリゴSEQ ID NO: 11
【0102】
【化11】

【0103】
このオリゴはDNA合成の鋳型であり、そして、人工的な配列である。
【0104】
実施例1:二本鎖DNAと合成RNAのライゲーション:
[0091] E.coli DNAリガーゼ(New England Biolabs;10 ユニット/μL)を除くすべてのライゲーション反応成分を表1に示される通りに混合した。反応液を60℃、5分間加熱し、そして、室温になるまで放冷した。E.coli DNAリガーゼを適切なチューブに加え、そして、反応液を30℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0105】
【表1】

【0106】
[0092] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、次に95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。試料は、番号順に左から右へそれぞれロードし、DNA分子量マーカーを散在させた。ブロモフェノール・ブルー(BPB)ローディングダイがゲルの一番下にきた時に、電気泳動を止めた。各ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、TyphoonTM 8600 Variable Mode Imager(Typhoon;GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。
【0107】
[0093] DNA分子量マーカーは、100 Base-Pair Ladder(0.5μg)、Homo-Oligomeric pd(A)40-60(1.25×10-3A260 ユニット)およびOligo Sizing Markers(8〜32塩基;0.75μL;すべてGE Healthcare Bio-sciences)の混合物である。
【0108】
[0094] ゲルを緑(532)レーザーおよびフルオレセイン526 SP発光フィルターを使用して、スキャンした。結果は、ライゲーション反応の3つの別々の核酸成分が、自己ライゲーション産物を形成しないことを示す:結果は、完全な反応において、cPT7IVS15とRNA35のライゲーションの予測される産物(DNA:RNAハイブリッド)である、妥当なサイズ(75塩基)のバンドもまた示す。
【0109】
実施例2:3つの異なるリガーゼが二本鎖DNAとRNAをライゲーションする
[0095] リガーゼ酵素以外のすべてのライゲーション反応成分を、表2に示される通りに混合した。反応液を60℃、5分間加熱し、そして室温になるまで放冷した。異なるリガーゼ酵素を適切なチューブに加え、反応液を30℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0110】
[0096] 表2.実施例2における、ライゲーション反応組成。10×ライゲーションバッファーは、酵素とともに提供された。
【0111】
【表2】

【0112】
[0097] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、次に95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。試料は、番号順に左から右へそれぞれロードし、DNA分子量マーカーを散在させた。BPBローディングダイがゲルの一番下にきた時に、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。図4はゲルの蛍光画像である。ゲルは実施例1と同じパラメータを使用してスキャンした。
【0113】
[0098] レーン3に見られるDNA分子量マーカーは、100 Base-Pair Ladder(0.5μg)、Homo-Oligomeric pd(A)40-60(1.25×10-3 A260 ユニット)およびOligo Sizing Markers(8〜32塩基;0.75μL;すべてGE Healthcare Bio-sciences)の混合物である。レーン1および2は、E.coliリガーゼDNAリガーゼを含む(それぞれ反応1および2)。レーン4および5は、T4 DNAリガーゼ反応液を含む(それぞれ反応3および4)。レーン6〜9は、T4 RNAリガーゼ反応液を含む(それぞれ反応5、6、7および8)。ライゲーション産物は、レーン2、5、および7に認められ、3つすべてのリガーゼがDNA 5'リン酸基をRNA 3'水酸基とライゲーションするように機能することを示す。レーン9(反応8)にはライゲーション産物が認められなかった。これはおそらくPT7IVS15オリゴがないため、このライゲーション反応は産物を蓄積するのに時間がかかるだろう。
【0114】
[0099] 実施例3:ライゲーションされたRNAを転写することができる
[0100] E.coli DNAリガーゼ以外のすべてのライゲーション反応成分を、表3に示される通りに混合した。反応液を60℃、5分間加熱し、そして室温になるまで放冷した。E.coli DNAリガーゼを適切なチューブに加え、そして反応液を16℃、2時間、インキュベーションした。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0115】
【表3】

【0116】
[0101] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。RNA分子量マーカー(AmbionのDecadeTMMarkers)と並べて、試料は、番号順に左から右へそれぞれロードした。BPBローディングダイがゲルの一番下にきた時に、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。
【0117】
[0102] ゲルは実施例1と同じパラメータを使用してスキャンした。予想されるライゲーション産物は反応2および4(表3)より、それぞれに認められた。
【0118】
[0103] 表4に概説される通り、反応液2および4の一部分、および、MEGAscriptTM T7 Kit(Ambion)を使用して、増幅は達せられた。すべての成分を一緒に混合し、そして、37℃、1時間インキュベーションした。
【0119】
【表4】

【0120】
[0104] インキュベーションに続いて、増幅反応液2及び4を、それぞれ等量に分けた。各反応液の一部には、0.5μLの0.5 M EDTAを加え、そしてゲル分析まで氷上に保存した。残りの一部は、70℃、5分間加熱して、SUPERase Inを不活性化した。加熱したそれぞれの部分に1μLのRNase A(44ユニット;US Biochemical, Inc.)を加え、そして、37℃、10分間インキュベーションした。0.5μLの0.5 M EDTAを添加することにより、RNase消化をそれぞれ停止させた。各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。
【0121】
[0105] 反応2および4の転写反応産物は、それぞれに概ねT7 RNAポリメラーゼ(RNAP)反応の典型的なものだった。予測される9ヌクレオチド(nt)のラン・オフ転写物が、BPBダイの上にあることが観察された。この短いラン・オフ転写物は、ライゲーション反応から持ち越された、ライゲーションされなかったPT7IVS5およびcPT7IVS5オリゴから生じる。T7 RNAPは、ラン・オフ反応において、鋳型非依存の1ヌクレオチド付加を行うことが既知であり(Arnaud-Barbeら、1998)、そして、これは9 nt産物のすぐ上にも認められた。さらに、RNAPは二本鎖DNAプロモーターに結合した後、ポリメラーゼがプロモーターを除去するために十分な長さの新生転写物(nascent transcript)が合成されるまで、不完全な転写の周期を経験すること(Lopezら、1997)もまた、既知である。不完全な転写産物は、反応2の9 nt産物の下に観察された。驚くべきことに、反応物は、予測されるサイズ範囲44 ntである、非ラン・オフ転写物を含まなかった。その代わりに、RNAスメアがゲルの上部に観察され、産物サイズが様々な大きさをもつことが示唆される(非特異的産物)。RNAスメアはRNase A処理により消失したが、DNAバンドは残っていた。このスメアは、T7 RNAPの別の特性であり(Macdonaldら、1993)、そして、ホモポリメリックな鋳型に沿ったポリメライゼーションの過程で、酵素が前後に滑ったことの結果である。
【0122】
[0106] 同じ型の反応産物が、PT7IVS15およびcPT7IVS15オリゴを含む転写において認められた。ライゲーション反応から持ち越されたライゲーションされなかったオリゴからの推定19 ntのラン・オフ転写物が、より小さい不完全な転写物とともに観察された。しかしながら、鋳型非依存1ヌクレオチド(nt)付加は、DNA:RNAハイブリッドのRNA部分に入るためポリメラーゼがスタッタリング(stuttering)したように見えるものによって不明瞭となった。また、推定転写物サイズ75 ntは認められなかったが、RNase A処理により消失する、RNAスメアが認められた。RNAスメアはいくつかの反応においてより濃度が濃く、より長いIVSがRNAPをDNA:RNAハイブリッドのRNA部分により効率的に入れることができることが示された。
【0123】
実施例4:二本鎖DNAとmRNAのライゲーションおよび増幅
[0107] 表5に示されるすべての成分を混合し、そして、30℃、15分間インキュベーションした。本実施例には、アニーリング段階は含まれなかった。cPT7IVS15とRNA35のライゲーションに加えて、骨格筋ポリA RNA(smRNA;Russian Cardiology Research and Development Center)もまた、この系のライゲーション標的として使用された。1μLのRNaseフリー0.5 M EDTA(US Biochemicals, Inc.)を添加して、それぞれの反応を停止させた。
【0124】
[0108] 表5.実施例4におけるライゲーション反応組成。10×ライゲーションバッファーおよびT4 DNAリガーゼは、RNaseフリーであることが保証されており、Takaraより提供された。
【0125】
【表5】

【0126】
[0109] 各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。オリゴとRNA35の推測されたライゲーション産物が、反応5において認められた。
【0127】
[0110] 表6に概説されるように、反応1および3の一部分、および、MEGAscriptTM T7 Kit(Ambion)を使用して、増幅を行った。すべての成分を一緒に混合し、そして、37℃、1時間インキュベーションした。
【0128】
【表6】

【0129】
[0113] 1μLの0.5 M EDTAを添加することにより、反応をそれぞれ停止した。各反応の試料5μLを、Gel Loading Buffer II(Ambion)5μLと混合し、そして、95℃、2分間、熱変性させた。各試料の全量を15%アクリルアミド、7 M尿素TBEゲル(Invitrogen)の別個のウェルにロードし、製造者の推奨に従って、室温で電気泳動にかけた。BPBローディングダイがゲルの一番下から約2 cmのところで、電気泳動を止めた。ゲルをSYBR Gold Dye(Molecular Probes)を水で1:200に希釈したものに10分間浸すことにより染色した。染色した後、ゲルを蒸留水で洗浄し、そして、Typhoon(GE Healthcare Bio-Sciences)でスキャンすることにより、DNAのバンドを可視化した。ゲルは実施例1と同じパラメータを使用してスキャンした。図5は、ゲルの蛍光画像である。
【0130】
[0114] 図5のレーン1および3は、実施例3で観察されたのと同様に、1塩基鋳型非依存的ヌクレオチド付加、並びに、ラン・オフ転写物と不完全な転写物の両方が示される。レーン3(表6、反応2)における、ゲル上部のRNAスメアと、レーン1(表6、反応1)と比較したときラン・オフ転写物の強度が比較的に減少していることは、二本鎖DNA RNAPプロモーターとmRNAがアニールし、ライゲーションすること、および、DNA:mRNAハイブリッドから相補的RNを転写することの両方の、この系(表6、反応2)の可能性を示唆する。
【0131】
実施例5:γリン酸標識ジデオキシヌクレオチド、ddGTPのポリメラーゼ取り込みを使用する核酸配列検出
[0115] 室温(23℃)で、γ-(4-トリフルオロメチルクマリニル)ddGTP(ddGTP-CF3-クマリン)を使用して、反応を組み立てられた。反応には、プライマーの3'末端に隣接する隣の鋳型ヌクレオチドがdCまたはdTのどちらかであり、それぞれSEQ ID NO: 10、および、SEQ ID NO: 11に対応する、2つの異なるオリゴヌクレオチド鋳型の1つとアニールする、1つのオリゴヌクレオチドプライマー(SEQ ID NO: 9によって示される)を有する、プライマーと鋳型の組み合わせが含まれた。
【0132】
[0116] 本実施例において、鋳型1(SEQ ID NO: 10)について図6を参照すると、DNAポリメラーゼが、標識されたddGTPを用いてプライマーを伸長したことが推測されるだろう。同様に、図6の鋳型2(SEQ ID NO: 11)においては、DNAポリメラーゼが、標識されたddGTPではなく、ddATPを用いてプライマーを伸長したことが推測されるだろう。
【0133】
[0117] 反応条件:25 mM Tris、pH 8.0、5%グルセロール 5 mM MgCl2、0.5 mM β-メルカプトエタノール、0.01%tween-20、0.25ユニットのエビアルカリホスファターゼ、鋳型(示される通り、隣の鋳型ヌクレオチドはdCMPかdTMPのどちらか)にアニールした100 nMプライマー、および、2μM ddGTP-CF3-クマリンを含む反応液70μlを、LS-55 Luminescence Spectrometer(Perkin Elmer)中の、石英蛍光超微量キュベット(quartz fluorescence ultra-microcuvet)にセットし、time driveモードで操作した。励起波長および発光波長は、それぞれ390 nmおよび500 nmである。スリット幅は、励起スリットは5 nm、発光スリットは15 nmであった。3'-5'エキソヌクレアーゼ活性、5'-3'エキソヌクレアーゼ活性、およびジデオキシヌクレオチドに対する識別能を排除するように遺伝子操作されたクローン化DNAポリメラーゼI 0.35μl(11ユニット)、および0.25 mM MnCl2の添加により、反応を開始した。
【0134】
[0118] 図6に示される通り、反応液がγ標識ddGTPを含むため、色素の発光は、鋳型中の隣のヌクレオチドがdCである、プライマー:鋳型1においてのみ検出された。エビアルカリホスファターゼによるリン酸転移によるポリリン酸産物の切断は、CF3-クマリン標識において検出可能な変化をもたらし、それにより核酸の検出を可能になる。プライマー:鋳型2からは、検出可能な色素の発光は得られなかった。
【0135】
実施例6:γリン酸標識ジデオキシヌクレオチド、ddATPのポリメラーゼ取り込みを使用する核酸配列検出
[0119] 室温(23℃)で、ジデオキシヌクレオチド、γ-(3-シアノクマリニル)ddATP(ddATP-CN-クマリン)を使用して、反応を組み立てた。反応には、プライマーの3'末端に隣接する鋳型ヌクレオチドがdCまたはdTのどちらかであり、それぞれSEQ ID NO: 10、および、SEQ ID NO: 11に対応する、2つの異なるオリゴヌクレオチド鋳型の1つとアニールする、1つのオリゴヌクレオチドプライマー(SEQ ID NO: 9)を有する、プライマー:鋳型の組み合わせが含まれた。
【0136】
[0120] 本実施例において、鋳型2(SEQ ID NO: 11)について図7を参照すると、DNAポリメラーゼが、標識されたddATPを用いてプライマーを伸長したことが推測されるだろう。同様に、図7の鋳型1(SEQ ID NO: 10)においては、DNAポリメラーゼが、標識されたddATPではなく、ddGTPを用いてプライマーを伸長したことが推測されるだろう。
【0137】
[0121] 反応条件:25 mM Tris, pH 8.0、5%グルセロール 5 mM MgCl2、0.5 mMβ-メルカプトエタノール、0.01%tween-20、0.25ユニットのエビアルカリホスファターゼ、鋳型にアニールした100 nM プライマー、および2μM ddATP-CN-クマリンを含む、反応液70μlを、LS-55 Luminescence Spectrometer(Perkin Elmer)中の、クオーツ蛍光超微量キュベット(quartz fluorescence ultra-microcuvet)にセットし、time drive モードで操作した。励起波長および発光波長は、それぞれ410 nm、および450 nmである。スリット幅は、励起スリットは5 nm、発光スリットは15 nmであった。3'-5'エキソヌクレアーゼ活性、5'-3'エキソヌクレアーゼ活性、およびジデオキシヌクレオチドに対する識別能を排除するように遺伝子操作された、クローン化DNAポリメラーゼIを0.35μl(11ユニット)、および0.25 mM MnCl2を添加することにより、反応を開始した。
【0138】
[0122] 図7に示される通り、反応液はγ標識ddATPを含むため、色素の発光は、鋳型中の隣のヌクレオチドがdTである、プライマー:鋳型2においてのみ検出された。エビアルカリホスファターゼによるリン酸転移によるポリリン酸産物の切断は、CN-クマリン標識において検出可能な変化を生み出し、核酸の検出を可能にする。プライマー:鋳型1からは、検出可能な色素の発光は得られなかった。
【0139】
実施例7:末端リン酸標識ヌクレオチドを使用する、1つの反応容器中での、同時のRNA増幅および検出
[0123] 反応条件:下記の成分を一緒に混合し、そして、プレートリーダーで37度においてインキュベーションした。バッファー(50 mM Tris:HCl、pH=8.0、7 mM MgCl2、1 mM DDT、0.01%tween-20)、標的RNAを20 ng、プロモーター/プライマー構築物(リン酸化された5'陥凹末端および3'ジデオキシ伸長ブロッカーをもつ)を30 pモル、NADを100μモル、E.coli DNAリガーゼを1ユニット、キャップされたリボヌクレオチド(例えば、rN4P-メチル)を200μモル、T7 RNAポリメラーゼを20ユニット、着目するRNAに対する特異的プライマーを20 pモル、MMLV逆転写酵素を20ユニット、末端リン酸標識ヌクレオチド(例えばdN4P-DDAO)を200μモル、および、細菌性アルカリホスファターゼ0.1ユニット。
【0140】
[0124] ホスファターゼによるシグナルの発生は、裸眼、または、励起波長646 nm、発光波長659 nmを用いたプレートリーダーなどの自動化装置を使用して、可視化されることができる。
【0141】
均等物
[0125] 本発明は、その精神あるいは不可欠な特徴から離れることのない、その他の特異的な形態において具現化されることができる。そのため、前述の態様は、すべての点において、本明細書中に記載される発明に限定するよりもむしろ、例証としてみなされる。このように、本発明の範囲は、前述の説明によるよりもむしろ、添付の請求項によって示され、そして、請求項の均等性(equivalency)の意味および範囲の中に入るすべての変化は、そのため、その中に含まれることが意図される。
【特許請求の範囲】
【請求項1】
(a)標的RNA配列を増幅して、増幅されたRNA配列を産生すること;そして
(b)少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列を核酸ポリメラーゼと反応させて、標識されたポリリン酸を産生すること;
を含む、標識され、増幅されたRNA配列を産生する方法。
【請求項2】
増幅されたRNA配列が、標的RNA配列に対するアンチセンスcRNAである、請求項1の方法。
【請求項3】
増幅されたRNA配列が、標的RNA配列と同方向である、請求項1の方法。
【請求項4】
(a)ポリA以外の標的RNA配列を提供すること;
(b)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
(c)標的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
(d)標的RNA配列の3'末端に、核酸配列の二本鎖領域の5'末端をライゲーションし、ライゲーションされた配列を形成すること;
(e)RNAポリメラーゼを用いてライゲーションされた配列を転写し、増幅されたアンチセンス、相補的RNA配列を形成すること;そして
(f)任意で、増幅されたアンチセンス相補的RNAを標的RNAとして用いて、(a)〜(e)の段階を行い、増幅されたセンスRNA配列を形成すること;
という段階を含む、標的RNA配列を増幅し、増幅されたRNA配列を産生することにより、試料中の標的RNA配列の存在を検出する方法。
【請求項5】
ポリリン酸鎖に3つまたはそれ以上のリン酸基を有する、少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列をポリメラーゼと反応させ、標識されたポリリン酸を産生する段階をさらに含む、請求項4の方法。
【請求項6】
標識されたポリリン酸を検出する段階(c)をさらに含む、請求項1または5の方法。
【請求項7】
増幅段階と検出段階が、1つの反応容器中で行われる、請求項6の方法。
【請求項8】
それらの段階が、実質的に同時に起こる、請求項6の方法。
【請求項9】
標的RNA配列がヘテロポリメリック(heteropolymeric)である、請求項1または4の方法。
【請求項10】
増幅されたRNA配列の、逆転写酵素、ヌクレオチド、およびプライマーとのインキュベーションが、反応段階に含まれる、請求項1または5の方法。
【請求項11】
プライマーが増幅されたRNA配列の内部配列に対して相補的である、請求項10の方法。
【請求項12】
プライマーが約10から約40のヌクレオチドを含む、請求項10の方法。
【請求項13】
ヌクレオチドが実質的にホスファターゼと反応性をもたないように構造的に修飾された、請求項10の方法。
【請求項14】
標識されたポリリン酸がホスファターゼと反応し、検出可能種を産生し、そして形成された検出可能種を検出する、請求項6の方法。
【請求項15】
検出可能種が標的RNA配列の量に実質的に比例する量で産生される、請求項14の方法。
【請求項16】
標的RNA配列を定量する段階をさらに含む、請求項6の方法。
【請求項17】
標的RNA配列の増幅が:
ポリA以外の標的RNA配列を提供すること;
RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
標的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
標的RNA配列の3'末端に、核酸配列の二本鎖領域の5'末端をライゲーションし、ライゲーションされた配列を形成すること;そして
RNAポリメラーゼを用いてライゲーションされた配列を転写し、増幅されたアンチセンス、相補的RNA配列を形成すること;
を含む、請求項1の方法。
【請求項18】
(a)増幅された、アンチセンス、相補的RNA配列を提供すること;
(b)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、およびアンチセンス、相補的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
(c)アンチセンス、相補的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
(d)アンチセンス、相補的RNA配列の3'末端に核酸配列の二本鎖領域の5'末端をライゲーションし、第二のライゲーションされた配列を形成すること;そして
(e)RNAポリメラーゼを用いて第二のライゲーションされた配列を転写し、標的核酸配列と同方向を有する、増幅されたRNA配列を形成すること;
をさらに含む、請求項15の増幅の方法。
【請求項19】
核酸配列がDNAを含む、請求項4または17の方法。
【請求項20】
核酸配列の5'陥凹末端がリン酸化され、そして、末端一本鎖の3'端がジデオキシ伸長ブロッカーにより遮断される、請求項4または17の方法。
【請求項21】
核酸配列の一本鎖3'末端領域が少なくとも長さ3ヌクレオチドである、請求項19の方法。
【請求項22】
核酸配列の二本鎖領域が少なくとも長さ14ヌクレオチオド対である、請求項19の方法。
【請求項23】
ライゲーション段階が酵素的に実行される、請求項4または17の方法。
【請求項24】
RNAポリメラーゼがDNA依存性RNAポリメラーゼである、請求項4または17の方法。
【請求項25】
DNA依存性RNAポリメラーゼがT7 RNAポリメラーゼである、請求項24の方法。
【請求項26】
酵素がDNAリガーゼである、請求項23の方法。
【請求項27】
DNAリガーゼがNAD+依存性リガーゼである、請求項26の方法。
【請求項28】
DNAリガーゼがE.coliリガーゼである、請求項26の方法。
【請求項29】
DNAリガーゼがT4 DNAリガーゼである、請求項26の方法。
【請求項30】
検出に基づく、標的RNA配列の同定、特性決定をさらに含む、請求項4の方法。
【請求項31】
5'陥凹末端がリン酸化され、そして末端の一本鎖3'端がポリメラーゼ伸長ブロッカーでキャップされている、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域と、標的リボ核酸配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域とを含む、少なくとも1つの核酸配列;
ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的RNA配列を核酸配列にライゲーションすることが可能なライゲーション酵素
ホスファターゼに対して実質的に耐性のあるヌクレオチド
RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の少なくとも1つ
以下の式:
B-S-Y-(P)n-P-L
式中、P=リン酸(PO3)およびその誘導体であり、nは2またはそれ以上であり;Yは酸素または硫黄原子であり;Bは窒素を含む複素環塩基であり;Sは非環式部分、炭素環式部分、または糖部分であり;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識であり;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である、
に従う、1つあるいはそれ以上の末端リン酸標識ヌクレオチド;
および、ホスファターゼ
を含む、試料中の標的RNA配列の同時の増幅および検出のためのキット。
【請求項32】
ポリメラーゼ伸長ブロッカーがジデオキシヌクレオチドである、請求項31のキット。
【請求項33】
ヌクレオチドがリボヌクレオチドまたはデオキシリボヌクレオチドおよび/またはそれらの類似体である、請求項31のキット。
【請求項1】
(a)標的RNA配列を増幅して、増幅されたRNA配列を産生すること;そして
(b)少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列を核酸ポリメラーゼと反応させて、標識されたポリリン酸を産生すること;
を含む、標識され、増幅されたRNA配列を産生する方法。
【請求項2】
増幅されたRNA配列が、標的RNA配列に対するアンチセンスcRNAである、請求項1の方法。
【請求項3】
増幅されたRNA配列が、標的RNA配列と同方向である、請求項1の方法。
【請求項4】
(a)ポリA以外の標的RNA配列を提供すること;
(b)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および標的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
(c)標的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
(d)標的RNA配列の3'末端に、核酸配列の二本鎖領域の5'末端をライゲーションし、ライゲーションされた配列を形成すること;
(e)RNAポリメラーゼを用いてライゲーションされた配列を転写し、増幅されたアンチセンス、相補的RNA配列を形成すること;そして
(f)任意で、増幅されたアンチセンス相補的RNAを標的RNAとして用いて、(a)〜(e)の段階を行い、増幅されたセンスRNA配列を形成すること;
という段階を含む、標的RNA配列を増幅し、増幅されたRNA配列を産生することにより、試料中の標的RNA配列の存在を検出する方法。
【請求項5】
ポリリン酸鎖に3つまたはそれ以上のリン酸基を有する、少なくとも1つの末端リン酸標識ヌクレオチドの存在下、増幅されたRNA配列をポリメラーゼと反応させ、標識されたポリリン酸を産生する段階をさらに含む、請求項4の方法。
【請求項6】
標識されたポリリン酸を検出する段階(c)をさらに含む、請求項1または5の方法。
【請求項7】
増幅段階と検出段階が、1つの反応容器中で行われる、請求項6の方法。
【請求項8】
それらの段階が、実質的に同時に起こる、請求項6の方法。
【請求項9】
標的RNA配列がヘテロポリメリック(heteropolymeric)である、請求項1または4の方法。
【請求項10】
増幅されたRNA配列の、逆転写酵素、ヌクレオチド、およびプライマーとのインキュベーションが、反応段階に含まれる、請求項1または5の方法。
【請求項11】
プライマーが増幅されたRNA配列の内部配列に対して相補的である、請求項10の方法。
【請求項12】
プライマーが約10から約40のヌクレオチドを含む、請求項10の方法。
【請求項13】
ヌクレオチドが実質的にホスファターゼと反応性をもたないように構造的に修飾された、請求項10の方法。
【請求項14】
標識されたポリリン酸がホスファターゼと反応し、検出可能種を産生し、そして形成された検出可能種を検出する、請求項6の方法。
【請求項15】
検出可能種が標的RNA配列の量に実質的に比例する量で産生される、請求項14の方法。
【請求項16】
標的RNA配列を定量する段階をさらに含む、請求項6の方法。
【請求項17】
標的RNA配列の増幅が:
ポリA以外の標的RNA配列を提供すること;
RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、および、標的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
標的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
標的RNA配列の3'末端に、核酸配列の二本鎖領域の5'末端をライゲーションし、ライゲーションされた配列を形成すること;そして
RNAポリメラーゼを用いてライゲーションされた配列を転写し、増幅されたアンチセンス、相補的RNA配列を形成すること;
を含む、請求項1の方法。
【請求項18】
(a)増幅された、アンチセンス、相補的RNA配列を提供すること;
(b)RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域、およびアンチセンス、相補的RNA配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域を含む、1つまたはそれ以上の核酸配列を提供すること;
(c)アンチセンス、相補的RNA配列に核酸配列の一本鎖3'末端領域をハイブリダイゼーションすること;
(d)アンチセンス、相補的RNA配列の3'末端に核酸配列の二本鎖領域の5'末端をライゲーションし、第二のライゲーションされた配列を形成すること;そして
(e)RNAポリメラーゼを用いて第二のライゲーションされた配列を転写し、標的核酸配列と同方向を有する、増幅されたRNA配列を形成すること;
をさらに含む、請求項15の増幅の方法。
【請求項19】
核酸配列がDNAを含む、請求項4または17の方法。
【請求項20】
核酸配列の5'陥凹末端がリン酸化され、そして、末端一本鎖の3'端がジデオキシ伸長ブロッカーにより遮断される、請求項4または17の方法。
【請求項21】
核酸配列の一本鎖3'末端領域が少なくとも長さ3ヌクレオチドである、請求項19の方法。
【請求項22】
核酸配列の二本鎖領域が少なくとも長さ14ヌクレオチオド対である、請求項19の方法。
【請求項23】
ライゲーション段階が酵素的に実行される、請求項4または17の方法。
【請求項24】
RNAポリメラーゼがDNA依存性RNAポリメラーゼである、請求項4または17の方法。
【請求項25】
DNA依存性RNAポリメラーゼがT7 RNAポリメラーゼである、請求項24の方法。
【請求項26】
酵素がDNAリガーゼである、請求項23の方法。
【請求項27】
DNAリガーゼがNAD+依存性リガーゼである、請求項26の方法。
【請求項28】
DNAリガーゼがE.coliリガーゼである、請求項26の方法。
【請求項29】
DNAリガーゼがT4 DNAリガーゼである、請求項26の方法。
【請求項30】
検出に基づく、標的RNA配列の同定、特性決定をさらに含む、請求項4の方法。
【請求項31】
5'陥凹末端がリン酸化され、そして末端の一本鎖3'端がポリメラーゼ伸長ブロッカーでキャップされている、RNAポリメラーゼに対するプロモーター配列を含む二本鎖領域と、標的リボ核酸配列にハイブリダイゼーションすることが可能な一本鎖3'末端領域とを含む、少なくとも1つの核酸配列;
ホスファターゼに対して実質的に耐性のあるコファクターの存在下、標的RNA配列を核酸配列にライゲーションすることが可能なライゲーション酵素
ホスファターゼに対して実質的に耐性のあるヌクレオチド
RNAポリメラーゼ、エキソヌクレアーゼ、逆転写酵素、またはそれらの組み合わせの中の少なくとも1つ
以下の式:
B-S-Y-(P)n-P-L
式中、P=リン酸(PO3)およびその誘導体であり、nは2またはそれ以上であり;Yは酸素または硫黄原子であり;Bは窒素を含む複素環塩基であり;Sは非環式部分、炭素環式部分、または糖部分であり;Lは、天然または修飾ヌクレオチドの末端のリン酸において、リン酸エステル、チオエステル、またはホスホラミデート結合を形成するために適する、水酸基、スルフヒドリル基、またはアミノ基を含む、酵素により活性化可能な標識であり;P-Lは、好ましくは、リン酸が除去された場合に独立して検出することが可能になる、リン酸化された標識である、
に従う、1つあるいはそれ以上の末端リン酸標識ヌクレオチド;
および、ホスファターゼ
を含む、試料中の標的RNA配列の同時の増幅および検出のためのキット。
【請求項32】
ポリメラーゼ伸長ブロッカーがジデオキシヌクレオチドである、請求項31のキット。
【請求項33】
ヌクレオチドがリボヌクレオチドまたはデオキシリボヌクレオチドおよび/またはそれらの類似体である、請求項31のキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2010−515433(P2010−515433A)
【公表日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2009−544873(P2009−544873)
【出願日】平成19年12月13日(2007.12.13)
【国際出願番号】PCT/US2007/087325
【国際公開番号】WO2008/085652
【国際公開日】平成20年7月17日(2008.7.17)
【出願人】(390041542)ゼネラル・エレクトリック・カンパニイ (6,332)
【氏名又は名称原語表記】GENERAL ELECTRIC COMPANY
【Fターム(参考)】
【公表日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成19年12月13日(2007.12.13)
【国際出願番号】PCT/US2007/087325
【国際公開番号】WO2008/085652
【国際公開日】平成20年7月17日(2008.7.17)
【出願人】(390041542)ゼネラル・エレクトリック・カンパニイ (6,332)
【氏名又は名称原語表記】GENERAL ELECTRIC COMPANY
【Fターム(参考)】
[ Back to top ]

