ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーション
【課題】心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーション方法を提供する。
【解決手段】冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップ90と、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップ91と、エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップ93と、を含み、前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含む。
【解決手段】冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップ90と、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップ91と、エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップ93と、を含み、前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
米国出願の相互参照
この出願は、2011年9月28日にハリ・サンダーにより出願された米国仮出願第61/540,134号の「心臓インターベンションのガイダンス用のライブ蛍光透視法を用いた冠動脈モデルの非剛体2D/3Dレジストレーション」の優先権を主張するものである。
【0002】
本発明は、デジタル医用画像の解剖モデルの非剛体2D/3Dレジストレーションの方法に関するものである。
【背景技術】
【0003】
X線透視法は、多数の低侵襲的処置、例えば、慢性完全閉塞(CTO)の経皮冠動脈インターベンション(PCI)のガイダンス用に選択されるモダリティである。これらの処置の間、ガイドワイヤを用いたCTOの横断(crossing)は特に有害である。なぜなら、閉塞が造影剤の伝播を阻止し、蛍光透視法下において、血管の閉塞部を不可視にするからである。さらに、蛍光透視法の射影性質は、3D構造の解釈を不明確にし、そのことがさらにインターベンションを複雑にする。同様の問題は、低侵襲的処置にも無数に存在している。
【0004】
現在のプレインターベンショナル計画は、通常、CT血管造影(CTA)あるいは他の3D画像モダリティの取得を含み、視覚的な不確実性を低減している。血液プール造影剤(contrast)注入を用いたCTAの性能特性は、直接の造影剤注入を用いたインターベンショナルX線透視法によって認識可能なものと対照的に、CTOを引き起こす石灰化を明らかに区別可能にする。これは、計画段階にてCTAを非常に有益なツールとするが、これらのデータとインターベンショナル画像との間の対応を確立することは挑戦すべき問題であると判明している。
【0005】
この問題に対処するために、処理前の3次元モデルは取得されたボリュームから抽出され、2D蛍光透視図とアライメントされ、ライブ画像上に重ねられ、それによって、インターベンショナル画像を増加させることができる。しかしながら、このアライメントを達成することは本来困難である。なぜなら、主には、インターモダル対応を見つけることは些細ではないためであり、根本的な最適化の非線形態様のためでもある。さらに、満足な2D/3Dレジストレーションを提供するために、単純な剛体変換では十分でないおそれがある。3D計画画像が呼吸停止(breathold)の状態で得られるので、自由な呼吸状態で得られる術中の画像と比較して、著しい形状変化が存在する。これは、術前モデルを術中のライブ画像にアライメントする間、非剛体レジストレーション方法を使用することを役立つようにする。しかしながら、これは、困難な設定不備の逆の作業である。それにもかかわらず、2D/3Dレジストレーション方法には、既存の臨床の流れに最小の変更を加えるだけで、インターベンショナルX線血管造影法に関する不確定性を大きく低減する可能性がある。より広い展望から、2D/3Dレジストレーション方法は、例えば神経学、整形外科および心臓学の分野における多数の用途を有する。
【0006】
2D/3Dレジストレーションの最適化面は、画像の離散化、レジストレーションされる構造の複雑さおよび剛体あるいはアフィン変換モデルの使用といったいくつかの理由のために非常に非線形になりうる。その結果、コスト関数の最小化は、困難である。レジストレーションプロセスによって、潜在的に達成可能な最大精度は、含まれる変換モデルの複雑さに直接関連している。多数の2D/3Dレジストレーション方法は、剛体変換モデルあるいはわずかにフレキシブルなアフィン・モデルのみを考慮している。一般的に、これは、骨のような剛体構造や、モダリティの第一のアライメントを与えるには適切であるが、フレキシブルな構造の形状変化を説明するには不十分であると判明している。したがって、非剛体変形モデルは、2D/3Dレジストレーションに対して提案されてきた。
【0007】
臨床状況において、1つまたは2つの透視面は、インターベンション・ガイダンスのために用いられる。モノプレン(Monoplane)のシナリオが研究されてきたが、報告された誤差は、面外方向において大きい。この正確性の欠如は、レジストレーションプロセスにおける信頼性を著しく制限する。2方向の取得は、これらのインターベンションに関連した不明確性を大きく低減し、今日、日常的に複雑な心臓インターベンションに実行されている。
【発明の概要】
【0008】
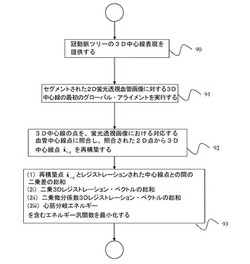
本願明細書に記載されている本発明の実施形態には、概して、2D/3D非剛体レジストレーションためのシステムと方法であって、術前の冠動脈の3D中心線モデルを術中の2以上の蛍光透視画像に非剛体でアライメントし、インターベンショナル画像を視覚的に増加させるシステムと方法が含まれる。本発明の実施形態によるレジストレーションされたモデルは、インターベンショナル血管造影図の上に重ねられ(オーバーレイ可能)、画像導入の慢性完全閉閉塞処理の間、外科的援助を提供し、2Dインターベンショナル画像に固有な不確定性を低減する。本発明の一実施形態による方法は、2つの部分、すなわち、(1)第一の固体またはアフィンアライメントを提供するために算出されるグローバル変換モデルと、(2)最終的なレジストレーションを計算するために使用される完全非剛体モデルと、を含む。グローバル・アライメント・パラメータを推定するために、距離マップを用いて、3次元モデルの射影と2D画像から自動抽出される特徴との間の相違を測定する。第二の部分では、完全非剛体レジストレーション方法を用いて、任意の局所的な形状相違を補償する。本発明の一実施形態による非剛体レジストレーション方法は、変化のフレームワークに基づき、同時照合および再構築プロセスを使用して、非剛体レジストレーションを計算する。最新のハードウェア上の3秒未満の一般的なランタイムでは、本発明の一実施形態によるアルゴリズムは、CTO手順の間、手術中に使われるのに十分急速に解析可能である。さらに、本発明の一実施形態による2D/3Dレジストレーション方法を用いて、フレームシーケンス全体にわたって、対象構造の動きをキャプチャすることもできる。
【課題を解決するための手段】
【0009】
本発明の一実施形態によれば、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法が提供され、前記方法は、Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、を含み、前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される。
【0010】
本発明のさらに別の一実施形態では、前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される。
【0011】
本発明のさらに別の一実施形態では、前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進(translation)のみのレジストレーションを実行するステップと、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、各ステップでは、
【数1】

の形のエネルギー汎関数は最小化され、jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、xは、均一な座標の3D点であり、nは、前記蛍光透視画像上の合計を表し、sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数2】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である。
【0012】
本発明のさらに別の一実施形態では、変換行列Tjは、再センタリングされ、前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する。
【0013】
本発明のさらに別の一実施形態では、時間的に連続したF対の2D蛍光透視画像を提供するステップと、前記エネルギー汎関数
【数3】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、をさらに含み、fは時点の合計であり、Tfは各時点の変換であり、γは所定のパラメータであり、D(Tf・C・xs,q,Tf+1・C・xs,q)はフレーム間距離である。
【0014】
本発明のさらに別の一実施形態では、前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数4】

を再構築するステップをさらに含む。
【0015】
本発明のさらに別の一実施形態では、前記点照合は、各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、xs,pに最も近い点を照合点xnとして選択するステップと、前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数5】

を再構築するステップと、を含む。
【0016】
本発明のさらに別の一実施形態では、再構築された中心線点
【数6】

とレジストレーションされた中心線点
【数7】

との二乗差の前記総和は、
【数8】

であり、
【数9】

は指標関数
【数10】

であり、照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数11】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数12】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、その他の場合、H(xs,p)=1である。
【0017】
本発明のさらに別の一実施形態では、二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数13】

であり、rは、レジストレーション・ベクトルであり、xは、前記3D中心線上の制御点であり、sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる。
【0018】
本発明のさらに別の一実施形態では、前記エネルギー汎関数は、
【数14】

を反復することによって、最小化され、zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、εは、小さい定数であり、Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、μ、υおよびλは、所定のパラメータである。
【0019】
本発明のさらに別の一実施形態では、コンピュータ可読の非一時的プログラム記憶装置が提供され、前記コンピュータにより実行されるとともに、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法を実行する命令プログラムを有する。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施形態に係る、対象とするシステムの形状の概略図である。
【図2】(a)〜(h)は、発明の一実施形態に係る、レジストレーションの複数のステージによる入力データの変換を示す図である。
【図3】発明の一実施形態に係る、非剛体レジストレーションの進行を示す図である。
【図4】発明の一実施形態に係る、中心線制御点照合アルゴリズムのフローチャートである。
【図5】(a)(b)は、本発明の一実施形態に係る、点照合および分岐点における分岐制約の形成を示す。
【図6】本発明の一実施形態に係る、反復回数の関数として、中心線の全移動を示すグラフである。
【図7】本発明の一実施形態に係る非剛体レジストレーション方法において、パラメータλの挙動を示す図である。
【図8】本発明の一実施形態に係る非剛体レジストレーション法の後、平均2Dおよび3D誤差を示す図である。
【図9】本発明の一実施形態に係る、非剛体2D/3Dレジストレーション法のフローチャートである。
【図10】(a)〜(d)は、本発明の一実施形態に係るDDRの形成を示す図である。
【図11】本発明の一実施形態に係る初期位置の摂動に関して、オプティマイザの性能を例示する。
【図12】本発明の実施形態に係るノイズ・レベルに対する入力DRRノイズの標準偏差に関して、オプティマイザの性能を例示する。
【図13】本発明の実施形態に係るシミュレーションデータを有する若干のサンプル非剛体レジストレーションを示す。
【図14】本発明の実施形態に係るシミュレーションの非剛体変形レベルに関する3D残差エラーのグラフである。
【図15】本発明の実施形態に係る、剛体、アフィンおよび非剛体レジストレーション後の入力画像および結果を表す。
【図16】本発明の実施形態に係る、5人の患者のための剛体、アフィンおよび非剛体レジストレーション後の2Dマニュアル・セグメンテーションに関して2つの透視面上の中心線の平均残余の2D射影エラーを示している表である。
【図17】本発明の実施形態に係る、一連のフレーム上のレジストレーションを示す。
【図18】本発明の実施形態に係る、1つの心周期の複数のフレームによるRCAのトラッキングを表す。
【図19】本発明の一実施形態に係る、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションのための方法を実施するためのコンピュータシステムの一例のブロック図である。
【発明を実施するための形態】
【0021】
本発明の例示的実施形態は、概して、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションのためのシステムおよび方法を含む。したがって、本発明は各種変更および代替実施形態の影響を受けるが、特定の実施形態を、単に一例として図面および明細書に詳細に記載する。しかしながら、本発明は、記載されたこの特定の形態に限定することを意図するものではなく、本発明は、本発明の精神および範囲内にある全ての変更、等価および代替を含むものである。
【0022】
本明細書に記載の用語「画像」は、個別の画像要素(例えば、2次元画像のピクセルおよび3次元画像のボクセル)から構成された多次元データを意味する。画像は、例えば、コンピュータ断層撮影法、磁気共鳴映像法、超音波、あるいは、従来当業者に知られている他の任意の医用画像システムによって収集された被写体(subject)の医用画像とすることができる。画像はまた、医学とは関係ない分野、例えば、リモートセンシングシステム、電子顕微鏡法等から提供される場合もある。画像は、R3からRまたはR7の関数とみなすことができるが、本発明の方法はこれらの画像に限定されず、任意の次元、たとえば、2次元画像あるいは3次元体積の画像に適用可能である。2次元あるいは3次元画像のために、画像の定義域は一般的に2次元あるいは3次元の長方形配列であり、各ピクセルあるいはボクセルは、2本あるいは3本の相互に直交する軸に関して方向付け可能である。本明細書に記載の用語「デジタル」および「デジタル化」は、デジタル取得システムを介して、あるいはアナログ画像からの変換によってデジタル化されたフォーマットにおける画像あるいは体積を適切に意味する。
【0023】
本発明の一実施形態によると、術前のCTAからセグメントされた、冠動脈ツリーの3D中心線表現は、2以上の同時の蛍光透視画像に非剛体レジストレーション可能である。初期設定の3D位置から開始し、装置のキャリブレーションから計算し、中心線の3Dアライメントは、並進のみの運動と剛体変換とアフィン変換とを用いて徐々に調節される。最後に、非剛体変換が計算され、最終的なレジストレーションが提供される。
【0024】
本発明の一実施形態によると、冠動脈ツリーは、制御点xs,p∈R、s∈{1,...,S}、q∈{1,...,QS}から構成された一組のSセグメントQsによって表され、方向付けのない(undirected)非巡回グラフを形成する。説明を明確にし、一般性を失わないために、以下の説明は、1対の蛍光透視画像In、n∈{1,2}が与えられる場合に制限されている。しかしながら、この制限は例示であり限定的ではなく、本発明の実施形態に係る方法は、複数の蛍光透視画像に拡張可能であることを理解されたい。さらに、説明を明確にし、一般性を失わないために、両者が同一のサイズW×H∈N2であると仮定する。血管は、既知の方法を用いて入力蛍光透視画像から自動的にセグメント化され、入力画像In(i,j)の2値化Bn(i,j)として表される。位置(i,j)∈{0,...,W-1}×{0,...,H-1}における入力画像ピクセルが対象の構造に対応する場合、Bn(i,j)=1であり、その他の場合、Bn(i,j)=0である。
【0025】
図1には、対象とするシステムの形状が概略的に示され、5つの座標系(CS)を用いて記載されている。図1中のラベルつきのフレームは座標系を表し、破線および太字の符号は変換行列を表す。冠動脈ツリーを表す3D中心線はUに関して記載され、座標系(CS)Cは3D画像装置の基準点に中心がある。2D血管造影法に関して、Xは2方向Cアームの基準CSであり、CSのP1およびP2は、2D結像面に中心を置いている。CとUとの間の変換およびXと{P1,P2}との間の変換は、装置のキャリブレーションから知られており、それぞれ、剛体変換行列C、P1およびP2で符号化される。2つのX線平面の射影形状もまた利用可能に仮定され、射影オペレータΨ1およびΨ2で符号化される。射影オペレータΨ1およびΨ2は、同次座標x=[x,y,z,1]Tの3D点を、対応する透視面上の2D点x’=[x,y]にマップする。2つの画像診断座標系の間の変換は、Tによって表される。
【0026】
完全性のために、例示であり限定的ではないが、自動セグメンテーション方法を以下に簡単に説明する。(1)入力蛍光透視画像は、ヘシアンベースのサトー血管フィルタ(Hessian-based Sato vesselness filter)を用いて処理され、(2)血管測定の閾値化をまばらにサンプリングすることによって、シードポイントが生成され、(3)これらのポイントから開始し、各ピクセル位置にて計算されたヘシアン行列の第1の固有ベクトルに沿って統合されることによって、ファイバが生成され、(4)ファイババンドルは反復して間引かれ(thinned)、血管の中心線を引き出す。
【0027】
並進、剛体およびアフィン変換
一般的な臨床状況では、3D冠動脈中心線をCTA取得から2方向透視における同一構造の画像にアライメントする変換は、大まかにしかできない。なぜなら、患者の位置は高い精度で制御することができないためである。本発明の一実施形態に係る変換T、すなわち、2つの画像診断座標系間のマッピングは、装置のキャリブレーションによって推定可能であり、対象の構造の形状を考慮することによって調整可能である。初期条件から開始し、改良されたアライメント変換(alignment transformations)は、最小化プロセスを用いて計算され、グローバル変換モデルあるいは剛体変換モデルのパラメータが推定される。この点から、アフィン変換モデルもまた用いられ、3D中心線を変形し、CTAと2方向X線との間の形状の不一致を補償する。
【0028】
本発明の一実施形態によると、3D中心線の射影と、各透視面からセグメント化された血管中心線との間の総距離は最小化される。χ(x)=T・C・xは、Uに関する点x=[x,y,x,1]をX座標系にマップするアフィン変換演算子とする。また、Пn(x)=Ψn・Pn・xは、Xからの点を透視面Pnにマップする射影である。本発明の実施形態は、エネルギーを、2つの蛍光透視画像で最小化され加算されるべき量として、以下のように定義する。
【数15】

ここで、
【数16】

は2D点とBn(i,j)=1である最接近点との間の距離である。各画像位置に対する距離
【数17】

は、各Bn(i,j)セグメンテーションの距離変換を形成することによって、事前に計算される。2つの蛍光透視画像を使用することは例示であり限定ではなく、2つより多い蛍光透視画像が用いられる場合、加算は容易に拡張されることを理解されたい。
【0029】
図2(a)〜(h)は、入力データの変換を示している。図2(a)はCT体積からの湾曲した(curved)スライスを示し、図2(b)は3D中心線を示し、図2(c)(d)は、異なる視点からの透視血管造影図を示し、図2(e)(f)は蛍光透視画像のセグメンテーションを示し、図2(g)(h)はセグメンテーションの距離変換を示す。
【0030】
Tの12の値を直接最適化することは、効果的でなく非効率なため、本発明の実施形態では、代わりに、パラメトリック手法を用いる。並進のみの変換TT、剛体変換TRおよびアフィン変換TAは、それぞれ、パラメータセットT∈R3、R∈R6およびA∈R12を用いて表される。TSのパラメトリック表現から行列表現へのマッピングは、以下のように定義される。
【数18】

【数19】

【数20】

【0031】
ここで、Sijは、Sの添え字{i, ... ,j}を伴う要素を含む部分集合である。
【数21】

【数22】

【数23】

ここで、cx=cos(θx)、sx=sin(θx)等である。本発明の実施形態では、変換行列TT、TRおよびTAは、再センタリングされる。回転パラメータのいかなる変化も、Cの原点と対照的に、U座標系の原点周辺で発生するように見える運動を誘導するというような方法で、この動作は、式(1)のエネルギー関数に影響しないが、通常オプティマイザに有益である。なぜならこれは、直観的に、CTボリュームの重心で発生するように見える回転動作またはスケーリング動作に関連して、この種の再センタリングが、パラメータ空間において、距離を減らすためである。最終的なTの定義は、式(4)のとおりである。
【数24】

ここで、CはUからCへの変換であり、j∈{T,R,A}であり、選択された変換モデルに依存する。式(1)は、3つの変換モデルの各々に対して、式(1a)の形をとなる。
【数25】

任意の非派生的な多目的最適化アルゴリズムを用いて、式(1)を最小化できる。
【0032】
初期設定の患者の位置から開始して、本発明の実施形態は、(1)並進のみの変換、(2)剛体変換および(3)アフィン変換を考慮することによって、アライメントを徐々に調整する。
【0033】
マルチ・フレーム・アラインメント
本発明の一実施形態に係るグローバル・アライメント方法は、マルチ・フレーム・シナリオをカバーするために拡大されることができる。この場合、実施形態は、時間的連続性のため、推定されたアライメント変換が1フレームからその他にほとんど何も変えないと仮定する。本発明の一実施形態に係るグローバルなエネルギー関数は、一連の2方向フレームのために以下のように、再定義可能である。
【数26】

あるいは
【数27】

である。ここで、γは自由パラメータであり、χfは、χと同様に定められるが、時点ごとの異なる変換行列Tfを有する。変換行列Tfは、上述したように、並進のみ、リジッドあるいはアフィンとすることができる。上述したように、2つの蛍光透視画像上の合計nは例示であり限定的ではなく、2つ以上の蛍光透視画像が使われている場合、合計は実施形態において、容易に拡張されうる。
【0034】
フレーム間距離D(χf,χf+1)は、リジッド変換あるいはアフィン変換とすることもできる。リジッド変換行列およびアフィン変換行列の空間が線形でないので、本発明の一実施形態に係るフレーム間距離D(χf,χf+1)の定義は精巧である。本発明の実施形態により仮定されているように、剛体変換空間は方向における小さい変化のために局所的に線形化可能である。このフレームを用いて、フレームfからフレームf+1への剛体変換は、並進ベクトル
【数28】

および回転ベクトル
【数29】

によって表され、
【数30】

となるように、単位ベクトル
【数31】

および回転角度θf,f+1のプロダクトとして定義される。並進ベクトルは、剛体変換行列
【数32】

の並進部分に対応し、行列
【数33】

と回転ベクトル
【数34】

との間のマッピングは、
【数35】

および
【数36】

によって与えられる。
【0035】
この表現を使用して、実施形態は、以下の通りにフレーム間距離を形式的に定めることができる。
【数37】

【数38】

ここで、αは、回転部分および並進部分のそれぞれの貢献のバランスをとる実数である。本発明の実施形態は、その内容全体が本願明細書に参照によって取り込まれる、ボワヴェール(Boisvert)等による「Geometric Variability Of The Scoliotic Spine Using Statistics On Articulated Shape Models」(IEEE Trans. Med. Imag.、第27巻、第4号、557〜568頁、2008年4月)に従って、αを0.05に設定する。
【0036】
アフィン変換行列の間の線形距離を定めることは、関連が深い複雑な計算を必要とする。本発明の実施形態では、剛体変換が変換の大部分を捕えると仮定されるので、本発明の実施形態は、変換の剛体部分を正規化し、残りのアフィン・パラメータを無拘束のままにする。形式的に、アフィン変換の場合、正規化定義の変換TfはパラメータA16を使用して構成されるが、12のパラメータのフルセットはエネルギー定義の変換χfを構成するために用いられる。
【0037】
このエネルギー関数は、フレームシーケンスの上のアライメント変換をトラッキングするのに役立ち、または、γ→∞の場合、例えば、3つの隣接するフレームを使用して平均的変換を計算するのに役立つ。シングル・フレーム・エネルギーと同様に、変換χfは、変換モデルの複雑さを順次増加させることによって、次第に精製される。
【0038】
非剛体レジストレーション
グローバル・アフィン変換モデルが、呼吸によって、および、心臓の鼓動によって、生じるインターモダル形状矛盾を完全に補償できるというわけではない。本発明の実施形態は、3D冠状動脈ツリー中心線と、2つのキャリブレーションされた蛍光透視画像と、の間の視覚的な相関関係を改善できる非剛体レジストレーション方法を提供する。本発明の一実施形態に係る方法は、ユーザが相関関係を識別する必要がないという点で自動といえる。
【0039】
本発明の一実施形態に係る非剛体変換は、3D並進ベクトルrs,qのセットrとして表され、3D並進ベクトルrs,qは、座標(CS)のUにおける対応する中心線点xs,pに与えられる。次に、レジストレーション点
【数39】

は
【数40】

を用いて計算される。溶液の品質を測定するために規定された、本発明の一実施形態に係るエネルギーは、以下(8)式の形を有する。
【数41】

本発明の一実施形態に係る最小化プロセスは反復され、位置rs,p=[0,0,0]T|∀{s,q}から開始し、変換rs,qは、勾配降下法に従うことによって徐々に調整される。これは、レジストレーションされた中心線の滑らかな動きを結果として生ずる。図3は、非剛体レジストレーションの進行を示し、図中左から右に、0回、350回および1200回の反復後のサンプル入力画像および中心線位置を示している。
【0040】
画像エネルギー
画像エネルギーという用語は、再構築された中心線の汎関数である。本発明の一実施形態によると、照合および再構築プロセスを用いて、3D中心線モデルにおいて全ての点xsqに対する再構築点
【数42】

を計算することによって、各蛍光透視画像における中心線の射影を構成することができる。図4のフローチャートを参照して、照合は各透視面上で別個に以下のように行われる。本発明の一実施形態に係る照合方法は、ステップ41において、3D中心線の制御点を蛍光透視画像nに射影することによって開始する。蛍光透視画像n上の3D中心線点
【数43】

の射影x′から開始して、ステップ42において、蛍光透視画像nに対応するセグメンテーション画像Bn上の検索が、中心線の射影に垂直な方向に行われる。この方向は、各位置において、偏導関数
【数44】

に基づいて計算される。その結果、ステップ43において、多くても2つの照合点xa"、xb"は各透視面n∈{1,2}上で識別される。ステップ41〜43は、他の蛍光透視画像のためにステップ44から繰り返される。ステップ45において、エピポーラ拘束
【数45】

を最小化するペア(x1,i",x2,i"),i∈a,bが保たれる。ここで、d(x1,i",em,i")は点xn,i"と、xm,i"によって導入されるエピポーラ線との間のユークリッド距離であり、{n,m}∈{1,2}かつn≠mである。ステップ46において、式(9)を最小化するペアは、システムの射影形状を使用して、再構築3D点
【数46】

を計算するために用いられる。ただ1つの点xn,i"が画像面上に見られる場合、それは初期設定により保たれる。図5(a)は、中心線x'からの点と2D構造からの点との照合を示している。点xa"、xb"は、有力候補として識別され、xb"はx'に近いため保たれる。次に、ステップ41〜46は、3D中心線の全制御点のためにステップ47から繰り返される。
【0041】
本発明の実施形態では、中心線の射影に局所的に垂直な方向において照合点の検索が行われる。構造のグローバル・アライメントが正しいということは先験的に知られているので、垂直検索方向は、最短点手法と比較して、多数の非現実的な照合を回避する。このことは、2D自動セグメンテーション(automatic segmentation)が完璧ではない場合に有効である。例えば、3D射影が、自動的にセグメント化された2D曲線より長い曲線になった場合、最短点をとることは、チップからの曲線の著しい短縮である。一方、3D中心線射影のチップにおいて照合は見出されないため、垂直方向での検索は、この効果を低減する。
【0042】
再構築の品質は保証されず、本発明の実施形態は指標関数
【数47】

を用いて異常値を棄却する。(1)あらゆる画像面において照合点が見つからない場合、(2)x'とxn"との間の2D距離がMax2Dより長い場合、(3)xs,qと
【数48】

との間の距離がMax3Dより長い場合、H(xs,p)=0である。ここで、Max2DおよびMax3Dは、所定の閾値である。実施形態によると、一例として、限定的ではないが、Max2Dは50ピクセルであり、Max3Dは6mmである。
【0043】
実施形態によると、式(8)における画像エネルギーは再構築点
【数49】

とレジストレーションされた中心線点との間の二乗誤差の合計として、全ての有効な点に関して以下のように定義される。
【数50】

全てのレジストレーションされた中心線点が再構築点と同一の位置にあるとき、このエネルギーは最小となる。
【0044】
内部エネルギー
本発明の一実施形態によれば、正規化(regularizer)を用いて、視覚的にレジストレーションされた中心線を視覚的にコヒーレントにかつ幾何学的に妥当に保つことができる。本発明の実施形態に従う以下の3つの内部エネルギーの項は、このために考慮可能である。
【数51】

ここで、μ、νおよびλがエネルギー・バランス・フリー・パラメータである。第1の項EDisp(r)は、非剛体変換による変位が小さいとき最小である。この正規化は、一対の2D血管造影によって、わずかにしか拘束されない3D面外動作を最小化する。第2の項ESmooth(r)は、各血管セグメント上の平滑性を確実にすることができる。ここで、
【数52】

および
【数53】

は、それぞれ、セグメントパラメータに対する位置(s,q)のための並進ベクトルrの第1および第2の微分係数を表す。セグメント接合部で、ノイマン境界条件
【数54】

が仮定される。
【0045】
はじめの2つの内部エネルギー項については、中心線モデルはフレキシブルであり、接合ノードにおいて以外は、血管の動作は互いに独立している。実際は、血管動作は、血管自身の固有の剛性によってだけでなく、血管が心筋に取り付けられているという理由によっても機械的に拘束される。この点において、第3の項、EMyocard(r)は、心筋制約の最小モデルとしての機能し、血管分岐で剛性の特定の程度を確保し、小さいセグメントがより大きいセグメント上へ倒れこむのを防止できる。本発明の実施形態は、図5(b)に示すように、3つのセグメントの接合部の周りの人工的なリンクを用いて、この制約をモデル化し、図5(b)は、接合部における3つの心筋制約(k1、k2、k3)の形成を示す。Dsを距離パラメータとし、Nに設定される値と接合部に存在する血管の平均直径とを掛け算する。Nの例示的かつ非限定的な値は3である。接合部から距離Ds程離れた各セグメント上のノードは、機械ばねに類似した方法で、他のセグメントの対応するノードに連結され、各リンクは、レジストレーションプロセスの間、拡大または圧縮される場合、その変位比率と比例する力を発生させている。式(11)において。Kは、ともに結合された全対のノード{i,j}の組として定義される。
【0046】
エネルギー最小化
本発明の一実施形態による完全なエネルギー関数は、式(8)、式(10)および式(11)を使用して定められ、そのオイラー・ラグランジェ方程式を計算して、勾配降下方法に従うことによって、本発明の実施形態において最小化できる。本発明の一実施形態によれば、反復rs,p=[0,0,0]T|∀{s,q}かつ反復z=0での点から開始して、結果として生じる離散更新方程式は、式(12)のとおりである。
【数55】

ここで、数ステップεは、小さい定数であり、Ks,q⊂Kは、ノード(s,q)に作用する制約の中のエンプティセットである。本発明の実施形態では、式(12)は、全体の変位が収束するまで、反復的して評価されうる。より形式的には、全体の変位は、
【数56】

を意味し、停止基準は、z>βに関してΔz-Δz-β<ζΔβとして定められる。図6は、本発明の一実施形態に係る、非剛体レジストレーションの間、反復回数の関数として、中心線の全体の変位を示している。曲線の形状から推論されうるように、最終結果はβおよびζの特定の値にあまり影響されない。例示的かつ非限定的な値は、β=100およびζ=0.001である。
【0047】
パラメータ選択
本発明の一実施形態によれば、3つのパラメータμ、υおよびλは、式(12)の挙動を支配し、特定のタスクに対して選択可能である。特定のパラメータセット(μ=0.10、υ=10.0、λ=1.0)から開始して、以下に詳細に記載されているように、各値を個別に変化させることによって、平均2D射影エラーおよび3Dエラーを計算することによって、方法の挙動についての洞察が得られる。この方法は、後述するように、アフィンアライメントの後、臨床データセットの患者4、および、合成変形を有するデータセットに適用された。前者はRCAを表し、後者はLCAを表す。図8は、非剛体レジストレーション後の平均2Dおよび3Dエラーを示す。図8において、上の行はパラメータμのデータを示し、中間の行はパラメータυのデータを示し、下の行はパラメータγのデータを示す。各グラフに対して、1つのパラメータが変化し、他の2つのパラメータは一定に保たれた。デフォルト・パラメータ値は、μ=0.1、υ=10.0、λ=1.09である。x軸のスケールは、対数関数である。
【0048】
パラメータμは全体の変位(displacement)を拘束することができ、2Dエラー曲線は計算されたエラーがその値とともに増加することを示している。しかしながら、3Dエラー曲線は、μが0.05から0.10の範囲の値を有するとき、最小値を示す。加えて、収束率は、μとともに増加する。例えば、レジストレーションを用いて、μ={0.001,0.01,0.1}をそれぞれ有する4880、3320および、1100の反復に収束した図8(左上)のグラフを生成する。
【0049】
パラメータυは、モデルの剛性を制御できる。この場合、2D射影エラーは、0.50から2.00の範囲の値を使用することを提案する。しかしながら、3Dエラー曲線は、より高い値がより正確なレジストレーションになりうることを示す。本発明の実施形態は、例示的かつ非限定的な値として、2Dエラー曲線と3Dエラー曲線との間の良好なトレードオフを示すυ=10.0を使用する。
【0050】
パラメータλは、心筋制約のバランスをとり、グローバル形状の一般的な整合性を保存できる。臨床RCAデータセットについては、高い値が運動を過度に拘束し、エラーの増加を引き起こすことが判明した。しかしながら、シミュレーションされたLCAデータセットについては、状況はほぼ逆に現れ、10.0までのλ値は、明らかに有益である。この状況は、LCAおよびRCAのデータセットに影響を及ぼす変形の性質における違いによって、おそらく説明可能である。例示的かつ非限定的な値λ=0.5が選択された。なぜなら、それがエラー測定のトレードオフを表し、かつ、図7にて示すように、多くのケースの視覚的外観を改善するためである。図7は、非剛体レジストレーション方法のパラメータλの挙動を、左側のλ=0および右側のλ=0.3に関して示している。LCAおよびRCAデータセットに対して、複数の値のλを用いることができる。本発明の実施形態では、特に言及しない限り、以下の全ての実験において、例示であり限定的ではないパラメータμ=0.5、υ=10.0およびλ=0.5が用いられる。
【0051】
図9には、本発明の一実施形態に係る非剛体2D/3Dレジストレーション方法のフローチャートを示す。方法は、ステップ90において、術前の画像体積、例えばCTA体積からセグメント化された冠動脈ツリーの3D中心線表現を提供することによって開始する。方法は、ステップ91において、2つ以上の分割された、冠動脈血管の2D蛍光透視画像に対する冠動脈ツリーの3D中心線表現の最初のグローバル・アライメントを実行することによって続行する。実施形態では、上述したように、このグローバル・アライメントは、連続的な並進のみの変換、剛体変換およびアフィン変換によって実行可能である。ステップ92において、図4を参照して説明したように、3D中心線の点は、蛍光透視画像における対応する血管中心線点に照合され、照合された2D点から3D中心線を再構築する。ステップ93において、非剛体レジストレーションを実行する。次に、ステップ93において、エネルギー汎関数を最小化することによって非剛体レジストレーションを実行する。ここで、エネルギー汎関数は、再構築点
【数57】

とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含む。
【0052】
実験結果
本発明の実施形態に係るアルゴリズムは、インターベンション中にレジストレーションされたモデルのライブ蛍光透視画像に対するオーバレイを示すプロトタイピング環境においてC++で実施された。C++での実施は例示であり限定的ではなく、本発明の他の実施形態では、他のコンピュータ言語での実施が可能であることを理解されたい。全てのグローバル・オプティマイザはシングルスレッドである。本発明の一実施形態に係る非剛体レジストレーション法は、OpenMPを使用して部分的にマルチスレッドされている。与えられるランタイムはi7 Q820 Quad Core Intel CPU用である。示されたランタイムは2D画像セグメンテーションを構成しない。このオペレーションは、画像ごとに平均して0.200秒のランタイムを有し、標準偏差は0.088秒である。シミュレーションと臨床データの両方に関する実験が行われた。
【0053】
シミュレーション
本発明の実施形態によるアライメントおよびレジストレーションの方法は、シミュレーションのセットにおいてテストされ、いくらか理想的なシナリオにおける本発明の実施形態に従う各種アルゴリズムの性能特性を与え、臨床データを使用する場合には不可能な3Dレジストレーションエラーを評価した。中心線は、以下の通り生成され、512×512ピクセルのサイズおよび0.345ピクセル/mmの解像度を有する、一対のデジタル的に再構築されたX線画像(DRR)にレジストレーションされた。(1)CTボリュームにおいて、セグメントされた冠動脈は、シミュレーションされた透視面に投影され、(2)結果として生じる射影の逆数は、参照背景画像から減算された。図10(a)〜(d)は、DRRの作成を例示する。CTボリュームにおいて、セグメントされた冠状動脈血栓は、図10(a)のシミュレーションされたX線撮影平面に投影される。次に、この画像は、図10(b)に示すように実際の造影剤のない(contrast-free)血管造影法から減算され、図10(c)の最終的なDRRを生成する。一実験において、図10(d)に示すように、σ=50を有するガウス雑音が加えられる。シミュレーションは、後述する3つのシナリオにおいて使われた。すべての変換がシミュレーション中に公知であるので、本願明細書において提示されるすべての3Dエラーは、正確なポイント・ツー・ポイント・エラーである。視覚効果を生じないときでも、エラーのこのスタイルがセグメントの圧縮または拡大を不利にすることに留意する必要がある。それゆえ、それは、大部分のTRE形成より厳格である。2Dエラーは、上述したように、参照セグメンテーションとして実際の中心線の射影を用いて計算される。
【0054】
(1)初期の解決法に対する依存
中心線は一対のDRRによってレジストレーションされ、異なる初期位置から開始する。これは、初期位置の摂動と、同様に、C、P1、P2またはTの剛体変換行列のミスキャリブレーションに対するグローバル・アライメント方法の感度を定量化する機能を果たす。選択された初期位置は、以下の通りである。T0を装置のキャリブレーションによって、与えられる変換であると仮定する。次に、12の初期ポイントは3本の主軸に沿って±αmmだけ変位したT0と、は3本の主軸の周りに±β度だけ回転したT0である。実施形態は、α∈10×{0,1,...,6}mmおよびβ∈3.75×{0,1,...,6}度を使用する。平方二乗平均エラーは、摂動(並進または回転)の同じレベルを有する全結果に対して計算された。図11は、初期位置の摂動に関して、オプティマイザの性能を例示するものであり、左列のグラフは剛体アライメントの結果を示し、右列のグラフはアフィンアライメントの結果を示し、上行は方向における変化(変位)の結果を示し、下行は位置における変化の結果を示す。下行において、失った点は、平方二乗平均エラーが3mm超であることを表す。図11の結果は、回転摂動が10度未満のとき、提示される本発明の実施形態に係るすべてのアルゴリズムが満足であることを示す。
【0055】
(2)画像ノイズに対するロバスト性
分散を有する複数の量のガウス雑音は、蛍光透視画像に加えられ、本発明の実施形態に従う方法の性能上の画質品質の影響を評価した。各オプティマイザは、各ノイズ・レベルに対する13の初期位置から開始した(上述したように、α=5mmおよびβ=7.5度がプラスされたT0)。図12は、本発明の実施形態に従って、ノイズ・レベルに対する入力DRRノイズの標準偏差に関して、オプティマイザの性能を例示し、左列のグラフはリジッドアライメントの結果を表し、右列のグラフはアフィンアライメントの結果を表す。σ∈[0,60]を有するガウス白色雑音モデルが用いられた。この試験の結果は、本発明の実施形態による方法が蛍光透視のガウス雑音の存在に影響されないことを示す傾向がある。臨床設定ではほとんど観察されないσ=60のレベルでさえ、2Dおよび3Dエラー・レベルは、追加されたノイズの量にわずかな相関しか示さない。これは、選択された2Dセグメンテーション・アルゴリズムの性能が良好であるという徴候である。
【0056】
(3)非剛体変形
これらのシミュレーションにおいて、中心線は、CTで走査した領域をカバーしている3×3×3ノード薄板スプライン(TPS)変形モデルを使用して変形した。各TPSノードは、変形パラメータξに応じた係数によって、中心ノードへ移動する。9つの左のノードは、係数ξによってシフトされ、9つの中心のノードは、0.5によってシフトされ、9つの右のノードは、係数2ξによってシフトされた。図13は、シミュレーションされたデータを有する若干のサンプルの非剛体レジストレーションを示す。上行は初期位置を示し、下行は最終位置を示す。本発明の一実施形態による非剛体レジストレーション・アルゴリズムは、変形レベルξ∈{0.020,0.025,...,0.060}に対して試験され、中心線の平均3D変位は、[1.209〜3.638]mmであり、中心線の最大3D変位は、[2.472〜7.416]mmであった。非変形中心線曲線を、初期の解決法として用い、非剛体レジストレーション・アルゴリズムを適用する前に、グローバル・アライメントは、実行されなかった。図14は、定量的評価を示しており、シミュレーションされた非剛体変形レベルに関する3D残差のグラフであり、ベースラインは初期の解決法のエラーに対応する。このアルゴリズムがレベルξ=0.045までは良好な結果を示すことが判明した。この点では、平均的3Dエラーは2.721mmから1.198mmに減少し、このことは、図13に示すように質的に重要である。以下、本願明細書に示されるように、性能のこのレベルは臨床シナリオにおいて適切である。
【0057】
臨床データ
以下のセクションに示される実験に、5つのデータセットが使われた。各データセットは、拡張末期(データセット1、3)または収縮末期(データセット2、4、5)にて得られる1つのCTA走査と、1つの2方向X線透視法記録と、を含む。2つのモダリティはECGゲーティングを用いて時間的にアライメントされ、冠動脈は専門家によって、CTAにおいて、半自動式にセグメントされた。セグメントされた中心線の平均3Dインターポイント距離は、[1.36〜1.60]mmの範囲にあった。血管造影図は、3つの場合の左冠状動脈(LCA)と、その他2の場合の右冠動脈(RCA)と、を撮像する。画像サイズは全ての場合において、512×512であり、画像解像度はデータセット1〜5に対してそれぞれ{0.345,0.279,0.279,0.216,0.279}mm/ピクセルである。獲得率は、15fpsである。標準Cアームキャリブレーション行列が使われた。必須ではないが、キャリブレーション行列は、データセットごとに異なるにもかかわらず、獲得の間一定であった。CTAおよび蛍光透視試験は、冠動脈疾患の治療のための患者に定められた。
【0058】
本発明の一実施形態によるアライメントおよびレジストレーション・アルゴリズムの性能の評価は、平均2D射影エラー
【数58】

を使用して定量化された。ここで、Mは3D中心線モデルの点の総数であり、
【数59】

は参照2DセグメンテーションSnの距離変換であり、対応する蛍光透視画像上で手動追跡によって得られた。
【0059】
グローバル・アライメント:オプティマイザの性能評価
本発明の実施形態は、グローバル・アライメントのために、7つのローカル(L)アルゴリズムおよび2つのグローバル(G)アルゴリズムを検査した。以下、これらのアルゴリズムを簡潔に説明する。
【0060】
ベスト・ネイバー(Best Neighbor)(L)
各反復で、パラメータ空間のすべての主要な方向におけるステップが考慮される。最善の移動が適用され、新規の反復が開始する。移動が解決法を改善しないとき、ステップは半分にされる。
【0061】
ネルダー・ミード(別名滑降シンプレックス)(L)
一般のシンプレックス(またはポリエイラクブカ)のm+1頂点で関数値を評価することによって、m次元関数を最小化する古典的な数の最適化方法である。各反復で、最悪の値を有する頂点は、拡大動作または縮小動作の一方が続く反転動作を使用して、別のものに置換される。ネルダー等による「A Simplex Method For Function Minimization」、Comput.J.第7巻、第4号、308〜313頁、1965年参照。
【0062】
Sbplx3(L)
この方法は、低次元の部分空間の問題を分解し、ネルダー・ミード・アルゴリズムを使用して、検索を実行する。オンラインで利用可能なS.G.ジョンソンによる「The Nlopt Nonlinear-Optimization Package」(http://ab-initio.mit.edu/nlopt)参照。
【0063】
Cobyla(L)
線形近似による位相制約下最適化(Constrained Optimization By Linear Approximation)方法は、頂点シンプレックスを用いたコスト関数および制約の線形近似を構成することによって、機能し、この近似値を最小化する。シンプレックスの半径は次第に減少し、標準形状を維持する。パウエルによる「Advances in Optimization and Numerical Analysis」(A Direct Search Optimization Method That Models the Objective and Constraint Functions by Linear Interpolation、ドルドレヒト、クルーワー アカデミック、1994年、51―67頁)、および、パウエルによる「Direct Search Algorithms For Optimization Calculations」(Dept. Appl. Math. Theoretical Phys., Cambridge Univ., U.K., Tech. Rep., 1998)参照。
【0064】
Bobyqa(L)
二字近似による境界最適化(Bound Optimization By Quadratic Approximation)方法の各反復は、概して展補間点を考慮することによって、構成されたコスト関数の二次近似を使用する。パウエルによる「The BOBYQA Algorithm For Bound Constrained Optimization Without Derivatives」、(Centre Math. Sci., Cambridge Univ., Cambridge, U.K., Tech. Rep., 2009)参照。
【0065】
パウエル・ブレント(L)
各反復で、一連の正確な1D線最適化は、ブレントの方法を使用して実行される。その方法は、共役(conjugate)検索方向のパウエルの方法を使用して更新される。ブレントによる「Minimization Without Derivatives, Englewood Cliffs, NJ: Prentice-Hall, 1973」、および、パウエルによる「An Efficient Method For Finding The Minimum Of A Function Of Several Variables Without Calculating Derivatives」、Comput. J.、第7巻、第2号、155〜162頁、1964年参照。
【0066】
Praxis(L)
ブレントのPRincipal―AXIS方法は、共役検索方向のパウエルの方法を更新したものであり、「Algorithms for Minimization Without Derivatives, Englewood Cliffs, NJ: Prentice-Hall, 1973」に記載されている。
【0067】
微分展開(G)
これは、集団ベースの確率的な大域的最適化方法であり、その主要な特徴は、集団進化の基礎としての個人の対の違いのベクトルの使用である。ストーン等による「Differential Evolution-A Simple And Efficient Heuristic For Global Optimization Over Continuous Spaces」、J. Global Optimizat.、第11巻、341〜359頁、1997年参照。
【0068】
Direct(G)
この大域的最適化アルゴリズムは、本明細書の場合のように、有限境界拘束に関する課題のために設計される。パラメータ空間は、ますます小さいハイパーレクタングルに分割することによって、系統的かつ決定論的に検索される。ジョーンズ等による「Lipschitzian Optimization Without The Lipschitz Constant」、Optimizat. Theory Appl.、第79巻、157〜181頁、1993年参照。
【0069】
各アルゴリズムの自由パラメータは、アルゴリズムの原作者またはメーカーの勧告に従って調整された。以下のアルゴリズムの実施は、SBPLX、Cobyla、BobyqaおよびDirectについて、http://ab-initio.mit.edu/nloptのNLoptライブラリから得られる。課題の性質を変えないために、多数の境界は、オプティマイザに供給され、トランスレーションパラメータ用の±200mm、回転パラメータ用の±45度、スケール・パラメータ用の[0.5,1.5]、スケール・回転パラメータ用の±360度である[式(2)においてA1012]。
【0070】
微分展開を除いて、基準を停止する同一セットが、全オプティマイザ用に用いられた。具体的には、オプティマイザは、1つの最適化の後、(1)コスト関数の値が、1e-14未満で減少するか、あるいは、(2)最適化されたパラメータの値が、並進パラメータに関して1e-4mm未満、回転パラメータに関して1e-5ラジアン、スケーリング・パラメータに関して1e-7だけ変更するまで、進むことが許可された。パラメータ許容度は、直観的な解釈を有する。例えば、1e-4mmの並進の違いは、画像平面上の1/2000ピクセルの最大変位に対応する。微分展開オプティマイザに関しては、確率的なアルゴリズムの収束が規則的ではないので、本発明の実施形態は、コスト関数を、約10秒の中央値の動作に対応する100000回評価するまで、オプティマイザが動作するのを許容した。
【0071】
式(1)にて表される本発明の実施形態に従うグローバル・アライメント・エネルギーを最小化する際および良質の2D/3Dアライメントを生成する際の9つのオプティマイザの性能は、以下の実験的な設定を使用して評価された。5人の患者のデータセットの各々に対して、3対の蛍光透視画像が考慮された。それは、CTA獲得に時間的にアライメントされた画像および前後の隣接するフレームである。時間的アライメントは2つのモダリティ間の観察可能な違いを最小化するのを支援し、それによって、レジストレーションに失敗する危険を減らす。レジストレーション行列が毎秒ほぼ1回更新され、外科的ガイダンスを改善するため、これは臨床的に合理的である。加えて、オプティマイザのロバスト性を試験するために、13の異なる初期点が、初期化のために使われた。T0を、装置のキャリブレーションによって与えられる変換であると仮定する。13の初期点は、T0と、3本の主軸に沿って±5mmだけ位置がずれたT0と、3本の主軸の周りに±7.5度だけ回転したT0と、である。合計5×3×13=195回の実験は、テストされる各オプティマイザに対して実行された。上述したように、式(1)は、(1)並進のみの変換、(2)剛体変換および(3)アフィン変換を連続して用いることにより、最小化可能である。
【0072】
全9つのオプティマイザに対する3つの変換モデルの各々によって、最小化した後残った平均残余のエネルギーの平方二乗平均の分析は、アフィン変換モデルを有するエネルギー関数を最小化するための最善のアルゴリズムが以下の、微分展開、ネルダー・ミード、パウエル・ブレント、ベスト・ネイバー、SbplxおよびDirectであるということを明らかにする。平均2D射影エラーが考慮されると、順番はわずかに変化して、微分展開、パウエル・ブレント、ベスト・ネイバー、Sbplx、ネルダー・ミードおよびDirectとなる。違いは、アライメントプロセスで使用される自動セグメンテーションと、エラーを計算するために使用される手動セグメンテーションと、の間の相違におそらく起因している。それにもかかわらず、上部にランクを付けされたアルゴリズムの性能は、満足であるように見える。BobyqaおよびCobylaアルゴリズムの比較的低い性能は、それぞれ、エネルギー関数の形状がそれらの二次モデルおよび線形モデルによって、良好に表されないという徴候であるかもしれない。Praxis方法は、この課題に最も不適切なローカル・オプティマイザであるように見える。
【0073】
微分展開アルゴリズムが、残余エネルギーおよび平均2Dエラーの観点で最高の性能を有すると判明した。しかしながら、平均2Dエラーの増加は、ローカル・アルゴリズムより長い約100回の計算時間に重要ではなかった。しかし、そのオプティマイザの計算時間の中央値は、ちょうど11秒未満であり、タイム・クリティカルでないアプリケーションには適当となりうる。一般に、グローバル・オプティマイザは、最も高性能のローカル・オプティマイザより低いエネルギーまたはエラー形状に、極めてまれに至るということに留意されたい。これは、後者がグローバルな最適条件の近くにある解決法を実際に見つけるという徴候である。グローバル・オプティマイザが最低の解決法を回避することに一般に成功する点に注意する価値がある。残余エネルギーと認められた視覚の対応との間に良好な相関が存在する。それにもかかわらず、アフィン変換モデルで最高のアライメントに関してさえ、比較的大きい相違が、投影中心線と2D蛍光透視との間に存在する。これは、モダリティ間の時間的アライメントの不正確性による、データセットの非アフィン変形の存在と、さまざまな取得ステップの間、患者の位置の変化により導入される形状変化と、におそらく起因している。
【0074】
グローバル・アライメント方法と非剛体レジストレーションとの比較
ベスト・ネイバー・オプティマイザを用いて得られた詳細なグローバル・アライメントの結果が表示され、非剛体レジストレーション後に得られた結果と比較される。全ての場合において、中心線モデルは、CT再構築用に使用される同一の心臓位相において、ゲートされる蛍光透視フレームでレジストレーションされた。並進、剛体、アフィンおよび非剛体レジストレーション後の結果は、図3および図15の3人の患者からのデータセットに関して示され、図15では、左から右に、入力画像、剛体アライメント、アフィンアライメントおよび非剛体レジストレーションを示す。両方の2方向画像は、すべての場合に示される。矢印は関心領域を示す。2Dマニュアル・セグメンテーションに関する2つの透視面上の中心線の平均残余の2D射影エラーも、5人の患者に対する剛体、アフィンおよび非剛体レジストレーション後に、(ミリメータで)算出され、その結果は図16の表Iに示されている。図15の上の行および下の行は、それぞれ、表Iの患者1および患者2に対応する。図15の2つの左下の画像フレームのCTOラベルは、慢性完全閉塞を意味する。非剛体レジストレーションに必要な計算時間は、730ms〜3300msの範囲にあり、平均1591msであった。
【0075】
モデルの複雑さが増加するにつれて、平均2D射影エラーおよびそれらの標準偏差は減少するか、または、ほぼ一定のままである。しかしながら、剛体、アフィンおよび非剛体変換モデルの相対的な貢献は、データセットごとに変化する。これは、個々のケースにより示される変形の性質によって説明可能であり、変形の性質は、患者の位置、CTAと2D蛍光透視獲得との間の間隔および獲得プロトコルに関連している。また、患者の呼吸によって、非剛体の心臓の変形が生じうる。心臓の鼓動は非剛体変形の原因でもあるため、ECGゲーティングによる時間的アライメントの精度も重要である。最大エラーもモデル複雑さに伴って減少する傾向があるが、時々安定なままである。このような場合、自動のセグメンテーション方法により計算されるため、レジストレーション・アルゴリズムの性能は不完全な2Dセグメンテーションにより制限されるかもしれない。実際、ほとんど情報が利用できない領域では、本発明の実施形態による非剛体レジストレーション方法は、中心線をできるだけ変えてはならない。この特性は、慢性完全閉塞(CTO)の場合のように、構造の一部がX線蛍光透視画像上で十分には見えない状況において望ましい。例えば、図15の下行は、中心線がCTOの上下に良好にアライメントされているが、コントラストが低い部分にほとんど変形がないことを示す。
【0076】
マルチ・フレーム・シナリオのグローバル・アライメント
2方向の一対に対する中心線のアライメントの他の潜在的に役立つシナリオは、2方向血管造影法からの時間的フレームシーケンスに対する中心線のアライメントである。マルチ・フレーム・シナリオにおける本発明の一実施形態によるグローバル・アライメント方法の性能は、患者1のLCAデータセットから一連の11の2方向フレームを使用して示される。グローバル・アライメントは、本発明の実施形態に従う剛体およびアフィン変換モデルを使用して計算された。式(5)のフレーム間組織化パラメータγは、0.0〜1.0の間で変化した。式(5)のコスト関数を最小化するのに最も効果的であると判明したので、ベスト・ネイバー・オプティマイザがこの場合使われた。得られたサンプル結果は図17に示され、図17はフレームシーケンスの上のレジストレーションを示す。図17において、一番上の行は、γ=0.1およびEMulti*=120.284を有する剛体変換モデルを表し、中間の行は、γ=0およびEMulti*=119.356を有するアフィン変換モデルを表し、一番下の行は、γ=0.1およびEMulti*=116.905を有する正規化アフィン変換モデルを表し、ここで、EMulti*は、式(5)の右辺の第1項に対応する。矢印は関心領域を示す。計算時間は、一番上の行、中間の行および一番下の行で示される実験に対して、それぞれ、39秒、89秒および91秒であった。予想されるように、アフィン変換モデルを使用すると剛体変換モデルを使用するより良好な定性的結果に至ることが判明した。アフィン変換モデルを使用するとき、組織化(γ=0.1)を使用することも結果を改善した。大きい組織化値(γ>1.0)を用いると、モデルの剛性は増加し、オプティマイザは初期位置から遠い極小値を見つけることができない。予備調査は、例えば、パラメータが協調して変化可能なことによって、領域に特有のオプティマイザがより良好な結果を達成しうることを示唆する。それにもかかわらず、本発明の実施形態に従う設定は、大部分の心周期の間、LCAのアライメント変換をトラッキングするのに適切に聞こえた。RCAデータセットに関する実験は、説得力のある結果につながらなかった。事実、本発明の一実施形態によるグローバル・アライメント手順が機能しても、CTAおよびX線取得が近い時間的アライメントに近い場合を除き、心周期の間、RCAにより支持される剛体変形の量によって、アフィン・モデルの効果がなくなる。
【0077】
右冠動脈の半自動のトラッキング
この実験では、本発明の実施形態による非剛体レジストレーション方法に基づく半自動手順を用いて、RCAのトラッキングを行った。ゲートされたフレームから開始して、本発明の一実施形態によるグローバル・アライメントおよび非剛体レジストレーションが実行される。次に、本発明の一実施形態によるこの変形した中心線モデルは、次の一対の蛍光透視フレームのための第一のモデルおよび位置としてオペレータにより用いられる。図18に示されるように、このプロセスは1つの心周期上の全フレームのために繰り返され、図18は、左から右に、ゲートされたフレーム、+4、+6、+8および+10フレームを表す。第一の曲線は181であり、レジストレーションされた曲線は182である。了解されるように、この手順は、1つの心周期の間、RCAのトラッキングを成功させる。この実験がシミュレーション研究の前に行われたので、わずかに異なるパラメータセット、μ=0.05、υ=5.0およびλ=0.1が用いられた。必要な時間は約15分であり、これはオフラインの設定において、合理的である。
【0078】
考察
臨床データの実験に基づいて、ネルダー・ミード、パウエル・ブレント、ベスト・ネイバーおよびSbplxのローカル・オプティマイザが短時間(中央値<105ms、最大値<950ms)で良好な結果を与える。シミュレーションも考慮すると、ネルダー・ミード・アルゴリズムは、全体的に最善の性能を与えた。2つのグローバル・オプティマイザは、その結果が大きな改良につながることは極めてまれであり、一桁高い計算時間を必要とした。計算時間を無視すると、微分展開アルゴリズムは、一般に、最善の解決案を提供した。ローカル・オプティマイザを使用するとき、アライメント時間は一貫して1秒未満であるため、この方法は、インターベンション中の使用に適するものになる。剛体変換の代わりにアフィン変換を使用することの利点は、データセットの性質に依存し、場合によっては重要になりうる。3Dおよび2DモダリティはECGゲーティングを使用して時間的にアライメントされるとき、全体として、グローバル・アライメント手順がLCAおよびRCAデータセットの両方の使用に適切であること判明した。CTO患者からのデータセットに関する実験は、類似の臨床ケースに適用されるとき、本発明の実施形態に従う方法の利点を示す。本発明の実施形態による方法は、CTA獲得からセグメント化された3D形状を有する2D画像を増加することによって、インターベンション・ガイダンスを支援することもでき、このことにより2D画像の解釈に固有の曖昧性を著しく低減する。
【0079】
非剛体レジストレーションに関しては、本発明の一実施例による変形モデルに含まれる正規化は、中心線を最小量だけ変形させることによって、残りの構造との一貫性を確実に保つことによって、欠測データ(例えば、図15の患者2)を有する領域の管理を可能にする。過剰な変形または矯正は発生しない。全体の計算時間は、通常、3秒未満であり、これはインタラクティブなアプリケーションに使用できる。本発明の一実施形態による非剛体レジストレーション方法は、適切な初期点から開始するとき、隣接する2D構造に対する中心線をスナップし、特に困難なローコントラストCTOケースに関して、2D画像の解釈をより容易にする。これも、操作上の画像と一緒に更新された3Dモデルを示すことを可能にし、3D空間の改良された認識を提供できる。
【0080】
最終的に、複数のX線2方向血管造影法フレームを使用する実験によって、本発明の一実施形態によるマルチフレーム・グローバル・アライメント方法が、LCAデータセットに良好に作用するとともに、本発明の一実施形態によるフレーム間の正規化が、改良された結果につながるということが判明した。本発明の一実施形態による非剛体半自動のトラッキング方法は、より大きな非剛体変形を有するケース、例えば非時間的にアライメントされたRCAデータセットを有する場合を扱い、そのようなデータセットに適用された。本発明の一実施形態による半自動の方法は、1つの心拍をカバーしているシーケンスに対して約15分の相互作用を必要とし、それは実用的なオフラインのアプリケーションに合理的に思える。
【0081】
システムの実現
本発明の実施形態は、各種形態のハードウェア、ソフトウェア、ファームウェア、特殊目的のプロセスあるいはその組み合わせによって実現可能であることを理解されたい。一実施形態では、本発明は、コンピュータ可読のプログラム記憶装置に具体的に組み込まれたアプリケーションプログラムとしてソフトウェアで実現可能である。アプリケーションプログラムは、任意の適切な構造を有する機械にアップロード可能であるとともに、当該機械によって実行可能である。
【0082】
図19は、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションを実現するコンピュータシステムのブロック図である。図19を参照すると、本発明を実施するためのコンピュータシステム191は、とりわけ、中央処理装置(CPU)192と、メモリ193と、入出力(I/O)インタフェース194と、を具えることができる。コンピュータシステム191は、一般的に、I/Oインタフェース194を介してディスプレイ195と、マウスやキーボードのような複数の入力装置196と、に接続されている。支持回路は、キャッシュ、電源、クロック回路および通信バスのような回路を含むことができる。メモリ193は、ランダムアクセスメモリ(RAM)、読み出し専用メモリ(ROM)、ディスクドライブ、テープドライブ等、あるいはその組み合わせを含むことができる。本発明は、ルーティン197として実現され、このルーティン197はメモリ193に記憶され、CPU192によって実行され、信号源198からの信号を処理する。それゆえ、コンピュータシステム191は、汎用コンピュータシステムであり、本発明のルーティン197を実行するとき特殊目的のコンピュータシステムになる。
【0083】
コンピュータシステム191は、また、オペレーティングシステムと、マイクロ命令コードと、を含む。本明細書に記載した様々な処理および機能は、オペレーティングシステムを介して実行されるマイクロ命令コードの一部あるいはアプリケーションプログラムの一部(あるいはその組み合わせ)とすることができる。さらに、様々なその他の周辺装置、例えば、追加のデータ記憶装置および印刷装置を、コンピュータプラットフォームに接続することができる。
【0084】
添付図面に示されたシステムの構成要素および方法のステップのいくつかは、ソフトウェアによって実施可能であるため、システムの構成要素(あるいはプロセスステップ)間の実際の接続は、本発明がプログラムされる方法に依存して異なるということを理解されたい。本明細書に記載した本発明の教示を考慮すると、当業者は本発明と同一および類似の実施形態あるいは構成を考えることができる。
【0085】
本発明は、例示的実施形態を参照して詳細に説明してきたが、当業者であれば、添付の特許請求の範囲に規定した本発明の精神および範囲から逸脱することなく各種変更および置換が可能であることを理解するであろう。
【技術分野】
【0001】
米国出願の相互参照
この出願は、2011年9月28日にハリ・サンダーにより出願された米国仮出願第61/540,134号の「心臓インターベンションのガイダンス用のライブ蛍光透視法を用いた冠動脈モデルの非剛体2D/3Dレジストレーション」の優先権を主張するものである。
【0002】
本発明は、デジタル医用画像の解剖モデルの非剛体2D/3Dレジストレーションの方法に関するものである。
【背景技術】
【0003】
X線透視法は、多数の低侵襲的処置、例えば、慢性完全閉塞(CTO)の経皮冠動脈インターベンション(PCI)のガイダンス用に選択されるモダリティである。これらの処置の間、ガイドワイヤを用いたCTOの横断(crossing)は特に有害である。なぜなら、閉塞が造影剤の伝播を阻止し、蛍光透視法下において、血管の閉塞部を不可視にするからである。さらに、蛍光透視法の射影性質は、3D構造の解釈を不明確にし、そのことがさらにインターベンションを複雑にする。同様の問題は、低侵襲的処置にも無数に存在している。
【0004】
現在のプレインターベンショナル計画は、通常、CT血管造影(CTA)あるいは他の3D画像モダリティの取得を含み、視覚的な不確実性を低減している。血液プール造影剤(contrast)注入を用いたCTAの性能特性は、直接の造影剤注入を用いたインターベンショナルX線透視法によって認識可能なものと対照的に、CTOを引き起こす石灰化を明らかに区別可能にする。これは、計画段階にてCTAを非常に有益なツールとするが、これらのデータとインターベンショナル画像との間の対応を確立することは挑戦すべき問題であると判明している。
【0005】
この問題に対処するために、処理前の3次元モデルは取得されたボリュームから抽出され、2D蛍光透視図とアライメントされ、ライブ画像上に重ねられ、それによって、インターベンショナル画像を増加させることができる。しかしながら、このアライメントを達成することは本来困難である。なぜなら、主には、インターモダル対応を見つけることは些細ではないためであり、根本的な最適化の非線形態様のためでもある。さらに、満足な2D/3Dレジストレーションを提供するために、単純な剛体変換では十分でないおそれがある。3D計画画像が呼吸停止(breathold)の状態で得られるので、自由な呼吸状態で得られる術中の画像と比較して、著しい形状変化が存在する。これは、術前モデルを術中のライブ画像にアライメントする間、非剛体レジストレーション方法を使用することを役立つようにする。しかしながら、これは、困難な設定不備の逆の作業である。それにもかかわらず、2D/3Dレジストレーション方法には、既存の臨床の流れに最小の変更を加えるだけで、インターベンショナルX線血管造影法に関する不確定性を大きく低減する可能性がある。より広い展望から、2D/3Dレジストレーション方法は、例えば神経学、整形外科および心臓学の分野における多数の用途を有する。
【0006】
2D/3Dレジストレーションの最適化面は、画像の離散化、レジストレーションされる構造の複雑さおよび剛体あるいはアフィン変換モデルの使用といったいくつかの理由のために非常に非線形になりうる。その結果、コスト関数の最小化は、困難である。レジストレーションプロセスによって、潜在的に達成可能な最大精度は、含まれる変換モデルの複雑さに直接関連している。多数の2D/3Dレジストレーション方法は、剛体変換モデルあるいはわずかにフレキシブルなアフィン・モデルのみを考慮している。一般的に、これは、骨のような剛体構造や、モダリティの第一のアライメントを与えるには適切であるが、フレキシブルな構造の形状変化を説明するには不十分であると判明している。したがって、非剛体変形モデルは、2D/3Dレジストレーションに対して提案されてきた。
【0007】
臨床状況において、1つまたは2つの透視面は、インターベンション・ガイダンスのために用いられる。モノプレン(Monoplane)のシナリオが研究されてきたが、報告された誤差は、面外方向において大きい。この正確性の欠如は、レジストレーションプロセスにおける信頼性を著しく制限する。2方向の取得は、これらのインターベンションに関連した不明確性を大きく低減し、今日、日常的に複雑な心臓インターベンションに実行されている。
【発明の概要】
【0008】
本願明細書に記載されている本発明の実施形態には、概して、2D/3D非剛体レジストレーションためのシステムと方法であって、術前の冠動脈の3D中心線モデルを術中の2以上の蛍光透視画像に非剛体でアライメントし、インターベンショナル画像を視覚的に増加させるシステムと方法が含まれる。本発明の実施形態によるレジストレーションされたモデルは、インターベンショナル血管造影図の上に重ねられ(オーバーレイ可能)、画像導入の慢性完全閉閉塞処理の間、外科的援助を提供し、2Dインターベンショナル画像に固有な不確定性を低減する。本発明の一実施形態による方法は、2つの部分、すなわち、(1)第一の固体またはアフィンアライメントを提供するために算出されるグローバル変換モデルと、(2)最終的なレジストレーションを計算するために使用される完全非剛体モデルと、を含む。グローバル・アライメント・パラメータを推定するために、距離マップを用いて、3次元モデルの射影と2D画像から自動抽出される特徴との間の相違を測定する。第二の部分では、完全非剛体レジストレーション方法を用いて、任意の局所的な形状相違を補償する。本発明の一実施形態による非剛体レジストレーション方法は、変化のフレームワークに基づき、同時照合および再構築プロセスを使用して、非剛体レジストレーションを計算する。最新のハードウェア上の3秒未満の一般的なランタイムでは、本発明の一実施形態によるアルゴリズムは、CTO手順の間、手術中に使われるのに十分急速に解析可能である。さらに、本発明の一実施形態による2D/3Dレジストレーション方法を用いて、フレームシーケンス全体にわたって、対象構造の動きをキャプチャすることもできる。
【課題を解決するための手段】
【0009】
本発明の一実施形態によれば、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法が提供され、前記方法は、Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、を含み、前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される。
【0010】
本発明のさらに別の一実施形態では、前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される。
【0011】
本発明のさらに別の一実施形態では、前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進(translation)のみのレジストレーションを実行するステップと、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、各ステップでは、
【数1】

の形のエネルギー汎関数は最小化され、jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、xは、均一な座標の3D点であり、nは、前記蛍光透視画像上の合計を表し、sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数2】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である。
【0012】
本発明のさらに別の一実施形態では、変換行列Tjは、再センタリングされ、前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する。
【0013】
本発明のさらに別の一実施形態では、時間的に連続したF対の2D蛍光透視画像を提供するステップと、前記エネルギー汎関数
【数3】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、をさらに含み、fは時点の合計であり、Tfは各時点の変換であり、γは所定のパラメータであり、D(Tf・C・xs,q,Tf+1・C・xs,q)はフレーム間距離である。
【0014】
本発明のさらに別の一実施形態では、前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数4】

を再構築するステップをさらに含む。
【0015】
本発明のさらに別の一実施形態では、前記点照合は、各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、xs,pに最も近い点を照合点xnとして選択するステップと、前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数5】

を再構築するステップと、を含む。
【0016】
本発明のさらに別の一実施形態では、再構築された中心線点
【数6】

とレジストレーションされた中心線点
【数7】

との二乗差の前記総和は、
【数8】

であり、
【数9】

は指標関数
【数10】

であり、照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数11】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数12】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、その他の場合、H(xs,p)=1である。
【0017】
本発明のさらに別の一実施形態では、二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数13】

であり、rは、レジストレーション・ベクトルであり、xは、前記3D中心線上の制御点であり、sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる。
【0018】
本発明のさらに別の一実施形態では、前記エネルギー汎関数は、
【数14】

を反復することによって、最小化され、zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、εは、小さい定数であり、Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、μ、υおよびλは、所定のパラメータである。
【0019】
本発明のさらに別の一実施形態では、コンピュータ可読の非一時的プログラム記憶装置が提供され、前記コンピュータにより実行されるとともに、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法を実行する命令プログラムを有する。
【図面の簡単な説明】
【0020】
【図1】本発明の一実施形態に係る、対象とするシステムの形状の概略図である。
【図2】(a)〜(h)は、発明の一実施形態に係る、レジストレーションの複数のステージによる入力データの変換を示す図である。
【図3】発明の一実施形態に係る、非剛体レジストレーションの進行を示す図である。
【図4】発明の一実施形態に係る、中心線制御点照合アルゴリズムのフローチャートである。
【図5】(a)(b)は、本発明の一実施形態に係る、点照合および分岐点における分岐制約の形成を示す。
【図6】本発明の一実施形態に係る、反復回数の関数として、中心線の全移動を示すグラフである。
【図7】本発明の一実施形態に係る非剛体レジストレーション方法において、パラメータλの挙動を示す図である。
【図8】本発明の一実施形態に係る非剛体レジストレーション法の後、平均2Dおよび3D誤差を示す図である。
【図9】本発明の一実施形態に係る、非剛体2D/3Dレジストレーション法のフローチャートである。
【図10】(a)〜(d)は、本発明の一実施形態に係るDDRの形成を示す図である。
【図11】本発明の一実施形態に係る初期位置の摂動に関して、オプティマイザの性能を例示する。
【図12】本発明の実施形態に係るノイズ・レベルに対する入力DRRノイズの標準偏差に関して、オプティマイザの性能を例示する。
【図13】本発明の実施形態に係るシミュレーションデータを有する若干のサンプル非剛体レジストレーションを示す。
【図14】本発明の実施形態に係るシミュレーションの非剛体変形レベルに関する3D残差エラーのグラフである。
【図15】本発明の実施形態に係る、剛体、アフィンおよび非剛体レジストレーション後の入力画像および結果を表す。
【図16】本発明の実施形態に係る、5人の患者のための剛体、アフィンおよび非剛体レジストレーション後の2Dマニュアル・セグメンテーションに関して2つの透視面上の中心線の平均残余の2D射影エラーを示している表である。
【図17】本発明の実施形態に係る、一連のフレーム上のレジストレーションを示す。
【図18】本発明の実施形態に係る、1つの心周期の複数のフレームによるRCAのトラッキングを表す。
【図19】本発明の一実施形態に係る、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションのための方法を実施するためのコンピュータシステムの一例のブロック図である。
【発明を実施するための形態】
【0021】
本発明の例示的実施形態は、概して、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションのためのシステムおよび方法を含む。したがって、本発明は各種変更および代替実施形態の影響を受けるが、特定の実施形態を、単に一例として図面および明細書に詳細に記載する。しかしながら、本発明は、記載されたこの特定の形態に限定することを意図するものではなく、本発明は、本発明の精神および範囲内にある全ての変更、等価および代替を含むものである。
【0022】
本明細書に記載の用語「画像」は、個別の画像要素(例えば、2次元画像のピクセルおよび3次元画像のボクセル)から構成された多次元データを意味する。画像は、例えば、コンピュータ断層撮影法、磁気共鳴映像法、超音波、あるいは、従来当業者に知られている他の任意の医用画像システムによって収集された被写体(subject)の医用画像とすることができる。画像はまた、医学とは関係ない分野、例えば、リモートセンシングシステム、電子顕微鏡法等から提供される場合もある。画像は、R3からRまたはR7の関数とみなすことができるが、本発明の方法はこれらの画像に限定されず、任意の次元、たとえば、2次元画像あるいは3次元体積の画像に適用可能である。2次元あるいは3次元画像のために、画像の定義域は一般的に2次元あるいは3次元の長方形配列であり、各ピクセルあるいはボクセルは、2本あるいは3本の相互に直交する軸に関して方向付け可能である。本明細書に記載の用語「デジタル」および「デジタル化」は、デジタル取得システムを介して、あるいはアナログ画像からの変換によってデジタル化されたフォーマットにおける画像あるいは体積を適切に意味する。
【0023】
本発明の一実施形態によると、術前のCTAからセグメントされた、冠動脈ツリーの3D中心線表現は、2以上の同時の蛍光透視画像に非剛体レジストレーション可能である。初期設定の3D位置から開始し、装置のキャリブレーションから計算し、中心線の3Dアライメントは、並進のみの運動と剛体変換とアフィン変換とを用いて徐々に調節される。最後に、非剛体変換が計算され、最終的なレジストレーションが提供される。
【0024】
本発明の一実施形態によると、冠動脈ツリーは、制御点xs,p∈R、s∈{1,...,S}、q∈{1,...,QS}から構成された一組のSセグメントQsによって表され、方向付けのない(undirected)非巡回グラフを形成する。説明を明確にし、一般性を失わないために、以下の説明は、1対の蛍光透視画像In、n∈{1,2}が与えられる場合に制限されている。しかしながら、この制限は例示であり限定的ではなく、本発明の実施形態に係る方法は、複数の蛍光透視画像に拡張可能であることを理解されたい。さらに、説明を明確にし、一般性を失わないために、両者が同一のサイズW×H∈N2であると仮定する。血管は、既知の方法を用いて入力蛍光透視画像から自動的にセグメント化され、入力画像In(i,j)の2値化Bn(i,j)として表される。位置(i,j)∈{0,...,W-1}×{0,...,H-1}における入力画像ピクセルが対象の構造に対応する場合、Bn(i,j)=1であり、その他の場合、Bn(i,j)=0である。
【0025】
図1には、対象とするシステムの形状が概略的に示され、5つの座標系(CS)を用いて記載されている。図1中のラベルつきのフレームは座標系を表し、破線および太字の符号は変換行列を表す。冠動脈ツリーを表す3D中心線はUに関して記載され、座標系(CS)Cは3D画像装置の基準点に中心がある。2D血管造影法に関して、Xは2方向Cアームの基準CSであり、CSのP1およびP2は、2D結像面に中心を置いている。CとUとの間の変換およびXと{P1,P2}との間の変換は、装置のキャリブレーションから知られており、それぞれ、剛体変換行列C、P1およびP2で符号化される。2つのX線平面の射影形状もまた利用可能に仮定され、射影オペレータΨ1およびΨ2で符号化される。射影オペレータΨ1およびΨ2は、同次座標x=[x,y,z,1]Tの3D点を、対応する透視面上の2D点x’=[x,y]にマップする。2つの画像診断座標系の間の変換は、Tによって表される。
【0026】
完全性のために、例示であり限定的ではないが、自動セグメンテーション方法を以下に簡単に説明する。(1)入力蛍光透視画像は、ヘシアンベースのサトー血管フィルタ(Hessian-based Sato vesselness filter)を用いて処理され、(2)血管測定の閾値化をまばらにサンプリングすることによって、シードポイントが生成され、(3)これらのポイントから開始し、各ピクセル位置にて計算されたヘシアン行列の第1の固有ベクトルに沿って統合されることによって、ファイバが生成され、(4)ファイババンドルは反復して間引かれ(thinned)、血管の中心線を引き出す。
【0027】
並進、剛体およびアフィン変換
一般的な臨床状況では、3D冠動脈中心線をCTA取得から2方向透視における同一構造の画像にアライメントする変換は、大まかにしかできない。なぜなら、患者の位置は高い精度で制御することができないためである。本発明の一実施形態に係る変換T、すなわち、2つの画像診断座標系間のマッピングは、装置のキャリブレーションによって推定可能であり、対象の構造の形状を考慮することによって調整可能である。初期条件から開始し、改良されたアライメント変換(alignment transformations)は、最小化プロセスを用いて計算され、グローバル変換モデルあるいは剛体変換モデルのパラメータが推定される。この点から、アフィン変換モデルもまた用いられ、3D中心線を変形し、CTAと2方向X線との間の形状の不一致を補償する。
【0028】
本発明の一実施形態によると、3D中心線の射影と、各透視面からセグメント化された血管中心線との間の総距離は最小化される。χ(x)=T・C・xは、Uに関する点x=[x,y,x,1]をX座標系にマップするアフィン変換演算子とする。また、Пn(x)=Ψn・Pn・xは、Xからの点を透視面Pnにマップする射影である。本発明の実施形態は、エネルギーを、2つの蛍光透視画像で最小化され加算されるべき量として、以下のように定義する。
【数15】

ここで、
【数16】

は2D点とBn(i,j)=1である最接近点との間の距離である。各画像位置に対する距離
【数17】

は、各Bn(i,j)セグメンテーションの距離変換を形成することによって、事前に計算される。2つの蛍光透視画像を使用することは例示であり限定ではなく、2つより多い蛍光透視画像が用いられる場合、加算は容易に拡張されることを理解されたい。
【0029】
図2(a)〜(h)は、入力データの変換を示している。図2(a)はCT体積からの湾曲した(curved)スライスを示し、図2(b)は3D中心線を示し、図2(c)(d)は、異なる視点からの透視血管造影図を示し、図2(e)(f)は蛍光透視画像のセグメンテーションを示し、図2(g)(h)はセグメンテーションの距離変換を示す。
【0030】
Tの12の値を直接最適化することは、効果的でなく非効率なため、本発明の実施形態では、代わりに、パラメトリック手法を用いる。並進のみの変換TT、剛体変換TRおよびアフィン変換TAは、それぞれ、パラメータセットT∈R3、R∈R6およびA∈R12を用いて表される。TSのパラメトリック表現から行列表現へのマッピングは、以下のように定義される。
【数18】

【数19】

【数20】

【0031】
ここで、Sijは、Sの添え字{i, ... ,j}を伴う要素を含む部分集合である。
【数21】

【数22】

【数23】

ここで、cx=cos(θx)、sx=sin(θx)等である。本発明の実施形態では、変換行列TT、TRおよびTAは、再センタリングされる。回転パラメータのいかなる変化も、Cの原点と対照的に、U座標系の原点周辺で発生するように見える運動を誘導するというような方法で、この動作は、式(1)のエネルギー関数に影響しないが、通常オプティマイザに有益である。なぜならこれは、直観的に、CTボリュームの重心で発生するように見える回転動作またはスケーリング動作に関連して、この種の再センタリングが、パラメータ空間において、距離を減らすためである。最終的なTの定義は、式(4)のとおりである。
【数24】

ここで、CはUからCへの変換であり、j∈{T,R,A}であり、選択された変換モデルに依存する。式(1)は、3つの変換モデルの各々に対して、式(1a)の形をとなる。
【数25】

任意の非派生的な多目的最適化アルゴリズムを用いて、式(1)を最小化できる。
【0032】
初期設定の患者の位置から開始して、本発明の実施形態は、(1)並進のみの変換、(2)剛体変換および(3)アフィン変換を考慮することによって、アライメントを徐々に調整する。
【0033】
マルチ・フレーム・アラインメント
本発明の一実施形態に係るグローバル・アライメント方法は、マルチ・フレーム・シナリオをカバーするために拡大されることができる。この場合、実施形態は、時間的連続性のため、推定されたアライメント変換が1フレームからその他にほとんど何も変えないと仮定する。本発明の一実施形態に係るグローバルなエネルギー関数は、一連の2方向フレームのために以下のように、再定義可能である。
【数26】

あるいは
【数27】

である。ここで、γは自由パラメータであり、χfは、χと同様に定められるが、時点ごとの異なる変換行列Tfを有する。変換行列Tfは、上述したように、並進のみ、リジッドあるいはアフィンとすることができる。上述したように、2つの蛍光透視画像上の合計nは例示であり限定的ではなく、2つ以上の蛍光透視画像が使われている場合、合計は実施形態において、容易に拡張されうる。
【0034】
フレーム間距離D(χf,χf+1)は、リジッド変換あるいはアフィン変換とすることもできる。リジッド変換行列およびアフィン変換行列の空間が線形でないので、本発明の一実施形態に係るフレーム間距離D(χf,χf+1)の定義は精巧である。本発明の実施形態により仮定されているように、剛体変換空間は方向における小さい変化のために局所的に線形化可能である。このフレームを用いて、フレームfからフレームf+1への剛体変換は、並進ベクトル
【数28】

および回転ベクトル
【数29】

によって表され、
【数30】

となるように、単位ベクトル
【数31】

および回転角度θf,f+1のプロダクトとして定義される。並進ベクトルは、剛体変換行列
【数32】

の並進部分に対応し、行列
【数33】

と回転ベクトル
【数34】

との間のマッピングは、
【数35】

および
【数36】

によって与えられる。
【0035】
この表現を使用して、実施形態は、以下の通りにフレーム間距離を形式的に定めることができる。
【数37】

【数38】

ここで、αは、回転部分および並進部分のそれぞれの貢献のバランスをとる実数である。本発明の実施形態は、その内容全体が本願明細書に参照によって取り込まれる、ボワヴェール(Boisvert)等による「Geometric Variability Of The Scoliotic Spine Using Statistics On Articulated Shape Models」(IEEE Trans. Med. Imag.、第27巻、第4号、557〜568頁、2008年4月)に従って、αを0.05に設定する。
【0036】
アフィン変換行列の間の線形距離を定めることは、関連が深い複雑な計算を必要とする。本発明の実施形態では、剛体変換が変換の大部分を捕えると仮定されるので、本発明の実施形態は、変換の剛体部分を正規化し、残りのアフィン・パラメータを無拘束のままにする。形式的に、アフィン変換の場合、正規化定義の変換TfはパラメータA16を使用して構成されるが、12のパラメータのフルセットはエネルギー定義の変換χfを構成するために用いられる。
【0037】
このエネルギー関数は、フレームシーケンスの上のアライメント変換をトラッキングするのに役立ち、または、γ→∞の場合、例えば、3つの隣接するフレームを使用して平均的変換を計算するのに役立つ。シングル・フレーム・エネルギーと同様に、変換χfは、変換モデルの複雑さを順次増加させることによって、次第に精製される。
【0038】
非剛体レジストレーション
グローバル・アフィン変換モデルが、呼吸によって、および、心臓の鼓動によって、生じるインターモダル形状矛盾を完全に補償できるというわけではない。本発明の実施形態は、3D冠状動脈ツリー中心線と、2つのキャリブレーションされた蛍光透視画像と、の間の視覚的な相関関係を改善できる非剛体レジストレーション方法を提供する。本発明の一実施形態に係る方法は、ユーザが相関関係を識別する必要がないという点で自動といえる。
【0039】
本発明の一実施形態に係る非剛体変換は、3D並進ベクトルrs,qのセットrとして表され、3D並進ベクトルrs,qは、座標(CS)のUにおける対応する中心線点xs,pに与えられる。次に、レジストレーション点
【数39】

は
【数40】

を用いて計算される。溶液の品質を測定するために規定された、本発明の一実施形態に係るエネルギーは、以下(8)式の形を有する。
【数41】

本発明の一実施形態に係る最小化プロセスは反復され、位置rs,p=[0,0,0]T|∀{s,q}から開始し、変換rs,qは、勾配降下法に従うことによって徐々に調整される。これは、レジストレーションされた中心線の滑らかな動きを結果として生ずる。図3は、非剛体レジストレーションの進行を示し、図中左から右に、0回、350回および1200回の反復後のサンプル入力画像および中心線位置を示している。
【0040】
画像エネルギー
画像エネルギーという用語は、再構築された中心線の汎関数である。本発明の一実施形態によると、照合および再構築プロセスを用いて、3D中心線モデルにおいて全ての点xsqに対する再構築点
【数42】

を計算することによって、各蛍光透視画像における中心線の射影を構成することができる。図4のフローチャートを参照して、照合は各透視面上で別個に以下のように行われる。本発明の一実施形態に係る照合方法は、ステップ41において、3D中心線の制御点を蛍光透視画像nに射影することによって開始する。蛍光透視画像n上の3D中心線点
【数43】

の射影x′から開始して、ステップ42において、蛍光透視画像nに対応するセグメンテーション画像Bn上の検索が、中心線の射影に垂直な方向に行われる。この方向は、各位置において、偏導関数
【数44】

に基づいて計算される。その結果、ステップ43において、多くても2つの照合点xa"、xb"は各透視面n∈{1,2}上で識別される。ステップ41〜43は、他の蛍光透視画像のためにステップ44から繰り返される。ステップ45において、エピポーラ拘束
【数45】

を最小化するペア(x1,i",x2,i"),i∈a,bが保たれる。ここで、d(x1,i",em,i")は点xn,i"と、xm,i"によって導入されるエピポーラ線との間のユークリッド距離であり、{n,m}∈{1,2}かつn≠mである。ステップ46において、式(9)を最小化するペアは、システムの射影形状を使用して、再構築3D点
【数46】

を計算するために用いられる。ただ1つの点xn,i"が画像面上に見られる場合、それは初期設定により保たれる。図5(a)は、中心線x'からの点と2D構造からの点との照合を示している。点xa"、xb"は、有力候補として識別され、xb"はx'に近いため保たれる。次に、ステップ41〜46は、3D中心線の全制御点のためにステップ47から繰り返される。
【0041】
本発明の実施形態では、中心線の射影に局所的に垂直な方向において照合点の検索が行われる。構造のグローバル・アライメントが正しいということは先験的に知られているので、垂直検索方向は、最短点手法と比較して、多数の非現実的な照合を回避する。このことは、2D自動セグメンテーション(automatic segmentation)が完璧ではない場合に有効である。例えば、3D射影が、自動的にセグメント化された2D曲線より長い曲線になった場合、最短点をとることは、チップからの曲線の著しい短縮である。一方、3D中心線射影のチップにおいて照合は見出されないため、垂直方向での検索は、この効果を低減する。
【0042】
再構築の品質は保証されず、本発明の実施形態は指標関数
【数47】

を用いて異常値を棄却する。(1)あらゆる画像面において照合点が見つからない場合、(2)x'とxn"との間の2D距離がMax2Dより長い場合、(3)xs,qと
【数48】

との間の距離がMax3Dより長い場合、H(xs,p)=0である。ここで、Max2DおよびMax3Dは、所定の閾値である。実施形態によると、一例として、限定的ではないが、Max2Dは50ピクセルであり、Max3Dは6mmである。
【0043】
実施形態によると、式(8)における画像エネルギーは再構築点
【数49】

とレジストレーションされた中心線点との間の二乗誤差の合計として、全ての有効な点に関して以下のように定義される。
【数50】

全てのレジストレーションされた中心線点が再構築点と同一の位置にあるとき、このエネルギーは最小となる。
【0044】
内部エネルギー
本発明の一実施形態によれば、正規化(regularizer)を用いて、視覚的にレジストレーションされた中心線を視覚的にコヒーレントにかつ幾何学的に妥当に保つことができる。本発明の実施形態に従う以下の3つの内部エネルギーの項は、このために考慮可能である。
【数51】

ここで、μ、νおよびλがエネルギー・バランス・フリー・パラメータである。第1の項EDisp(r)は、非剛体変換による変位が小さいとき最小である。この正規化は、一対の2D血管造影によって、わずかにしか拘束されない3D面外動作を最小化する。第2の項ESmooth(r)は、各血管セグメント上の平滑性を確実にすることができる。ここで、
【数52】

および
【数53】

は、それぞれ、セグメントパラメータに対する位置(s,q)のための並進ベクトルrの第1および第2の微分係数を表す。セグメント接合部で、ノイマン境界条件
【数54】

が仮定される。
【0045】
はじめの2つの内部エネルギー項については、中心線モデルはフレキシブルであり、接合ノードにおいて以外は、血管の動作は互いに独立している。実際は、血管動作は、血管自身の固有の剛性によってだけでなく、血管が心筋に取り付けられているという理由によっても機械的に拘束される。この点において、第3の項、EMyocard(r)は、心筋制約の最小モデルとしての機能し、血管分岐で剛性の特定の程度を確保し、小さいセグメントがより大きいセグメント上へ倒れこむのを防止できる。本発明の実施形態は、図5(b)に示すように、3つのセグメントの接合部の周りの人工的なリンクを用いて、この制約をモデル化し、図5(b)は、接合部における3つの心筋制約(k1、k2、k3)の形成を示す。Dsを距離パラメータとし、Nに設定される値と接合部に存在する血管の平均直径とを掛け算する。Nの例示的かつ非限定的な値は3である。接合部から距離Ds程離れた各セグメント上のノードは、機械ばねに類似した方法で、他のセグメントの対応するノードに連結され、各リンクは、レジストレーションプロセスの間、拡大または圧縮される場合、その変位比率と比例する力を発生させている。式(11)において。Kは、ともに結合された全対のノード{i,j}の組として定義される。
【0046】
エネルギー最小化
本発明の一実施形態による完全なエネルギー関数は、式(8)、式(10)および式(11)を使用して定められ、そのオイラー・ラグランジェ方程式を計算して、勾配降下方法に従うことによって、本発明の実施形態において最小化できる。本発明の一実施形態によれば、反復rs,p=[0,0,0]T|∀{s,q}かつ反復z=0での点から開始して、結果として生じる離散更新方程式は、式(12)のとおりである。
【数55】

ここで、数ステップεは、小さい定数であり、Ks,q⊂Kは、ノード(s,q)に作用する制約の中のエンプティセットである。本発明の実施形態では、式(12)は、全体の変位が収束するまで、反復的して評価されうる。より形式的には、全体の変位は、
【数56】

を意味し、停止基準は、z>βに関してΔz-Δz-β<ζΔβとして定められる。図6は、本発明の一実施形態に係る、非剛体レジストレーションの間、反復回数の関数として、中心線の全体の変位を示している。曲線の形状から推論されうるように、最終結果はβおよびζの特定の値にあまり影響されない。例示的かつ非限定的な値は、β=100およびζ=0.001である。
【0047】
パラメータ選択
本発明の一実施形態によれば、3つのパラメータμ、υおよびλは、式(12)の挙動を支配し、特定のタスクに対して選択可能である。特定のパラメータセット(μ=0.10、υ=10.0、λ=1.0)から開始して、以下に詳細に記載されているように、各値を個別に変化させることによって、平均2D射影エラーおよび3Dエラーを計算することによって、方法の挙動についての洞察が得られる。この方法は、後述するように、アフィンアライメントの後、臨床データセットの患者4、および、合成変形を有するデータセットに適用された。前者はRCAを表し、後者はLCAを表す。図8は、非剛体レジストレーション後の平均2Dおよび3Dエラーを示す。図8において、上の行はパラメータμのデータを示し、中間の行はパラメータυのデータを示し、下の行はパラメータγのデータを示す。各グラフに対して、1つのパラメータが変化し、他の2つのパラメータは一定に保たれた。デフォルト・パラメータ値は、μ=0.1、υ=10.0、λ=1.09である。x軸のスケールは、対数関数である。
【0048】
パラメータμは全体の変位(displacement)を拘束することができ、2Dエラー曲線は計算されたエラーがその値とともに増加することを示している。しかしながら、3Dエラー曲線は、μが0.05から0.10の範囲の値を有するとき、最小値を示す。加えて、収束率は、μとともに増加する。例えば、レジストレーションを用いて、μ={0.001,0.01,0.1}をそれぞれ有する4880、3320および、1100の反復に収束した図8(左上)のグラフを生成する。
【0049】
パラメータυは、モデルの剛性を制御できる。この場合、2D射影エラーは、0.50から2.00の範囲の値を使用することを提案する。しかしながら、3Dエラー曲線は、より高い値がより正確なレジストレーションになりうることを示す。本発明の実施形態は、例示的かつ非限定的な値として、2Dエラー曲線と3Dエラー曲線との間の良好なトレードオフを示すυ=10.0を使用する。
【0050】
パラメータλは、心筋制約のバランスをとり、グローバル形状の一般的な整合性を保存できる。臨床RCAデータセットについては、高い値が運動を過度に拘束し、エラーの増加を引き起こすことが判明した。しかしながら、シミュレーションされたLCAデータセットについては、状況はほぼ逆に現れ、10.0までのλ値は、明らかに有益である。この状況は、LCAおよびRCAのデータセットに影響を及ぼす変形の性質における違いによって、おそらく説明可能である。例示的かつ非限定的な値λ=0.5が選択された。なぜなら、それがエラー測定のトレードオフを表し、かつ、図7にて示すように、多くのケースの視覚的外観を改善するためである。図7は、非剛体レジストレーション方法のパラメータλの挙動を、左側のλ=0および右側のλ=0.3に関して示している。LCAおよびRCAデータセットに対して、複数の値のλを用いることができる。本発明の実施形態では、特に言及しない限り、以下の全ての実験において、例示であり限定的ではないパラメータμ=0.5、υ=10.0およびλ=0.5が用いられる。
【0051】
図9には、本発明の一実施形態に係る非剛体2D/3Dレジストレーション方法のフローチャートを示す。方法は、ステップ90において、術前の画像体積、例えばCTA体積からセグメント化された冠動脈ツリーの3D中心線表現を提供することによって開始する。方法は、ステップ91において、2つ以上の分割された、冠動脈血管の2D蛍光透視画像に対する冠動脈ツリーの3D中心線表現の最初のグローバル・アライメントを実行することによって続行する。実施形態では、上述したように、このグローバル・アライメントは、連続的な並進のみの変換、剛体変換およびアフィン変換によって実行可能である。ステップ92において、図4を参照して説明したように、3D中心線の点は、蛍光透視画像における対応する血管中心線点に照合され、照合された2D点から3D中心線を再構築する。ステップ93において、非剛体レジストレーションを実行する。次に、ステップ93において、エネルギー汎関数を最小化することによって非剛体レジストレーションを実行する。ここで、エネルギー汎関数は、再構築点
【数57】

とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含む。
【0052】
実験結果
本発明の実施形態に係るアルゴリズムは、インターベンション中にレジストレーションされたモデルのライブ蛍光透視画像に対するオーバレイを示すプロトタイピング環境においてC++で実施された。C++での実施は例示であり限定的ではなく、本発明の他の実施形態では、他のコンピュータ言語での実施が可能であることを理解されたい。全てのグローバル・オプティマイザはシングルスレッドである。本発明の一実施形態に係る非剛体レジストレーション法は、OpenMPを使用して部分的にマルチスレッドされている。与えられるランタイムはi7 Q820 Quad Core Intel CPU用である。示されたランタイムは2D画像セグメンテーションを構成しない。このオペレーションは、画像ごとに平均して0.200秒のランタイムを有し、標準偏差は0.088秒である。シミュレーションと臨床データの両方に関する実験が行われた。
【0053】
シミュレーション
本発明の実施形態によるアライメントおよびレジストレーションの方法は、シミュレーションのセットにおいてテストされ、いくらか理想的なシナリオにおける本発明の実施形態に従う各種アルゴリズムの性能特性を与え、臨床データを使用する場合には不可能な3Dレジストレーションエラーを評価した。中心線は、以下の通り生成され、512×512ピクセルのサイズおよび0.345ピクセル/mmの解像度を有する、一対のデジタル的に再構築されたX線画像(DRR)にレジストレーションされた。(1)CTボリュームにおいて、セグメントされた冠動脈は、シミュレーションされた透視面に投影され、(2)結果として生じる射影の逆数は、参照背景画像から減算された。図10(a)〜(d)は、DRRの作成を例示する。CTボリュームにおいて、セグメントされた冠状動脈血栓は、図10(a)のシミュレーションされたX線撮影平面に投影される。次に、この画像は、図10(b)に示すように実際の造影剤のない(contrast-free)血管造影法から減算され、図10(c)の最終的なDRRを生成する。一実験において、図10(d)に示すように、σ=50を有するガウス雑音が加えられる。シミュレーションは、後述する3つのシナリオにおいて使われた。すべての変換がシミュレーション中に公知であるので、本願明細書において提示されるすべての3Dエラーは、正確なポイント・ツー・ポイント・エラーである。視覚効果を生じないときでも、エラーのこのスタイルがセグメントの圧縮または拡大を不利にすることに留意する必要がある。それゆえ、それは、大部分のTRE形成より厳格である。2Dエラーは、上述したように、参照セグメンテーションとして実際の中心線の射影を用いて計算される。
【0054】
(1)初期の解決法に対する依存
中心線は一対のDRRによってレジストレーションされ、異なる初期位置から開始する。これは、初期位置の摂動と、同様に、C、P1、P2またはTの剛体変換行列のミスキャリブレーションに対するグローバル・アライメント方法の感度を定量化する機能を果たす。選択された初期位置は、以下の通りである。T0を装置のキャリブレーションによって、与えられる変換であると仮定する。次に、12の初期ポイントは3本の主軸に沿って±αmmだけ変位したT0と、は3本の主軸の周りに±β度だけ回転したT0である。実施形態は、α∈10×{0,1,...,6}mmおよびβ∈3.75×{0,1,...,6}度を使用する。平方二乗平均エラーは、摂動(並進または回転)の同じレベルを有する全結果に対して計算された。図11は、初期位置の摂動に関して、オプティマイザの性能を例示するものであり、左列のグラフは剛体アライメントの結果を示し、右列のグラフはアフィンアライメントの結果を示し、上行は方向における変化(変位)の結果を示し、下行は位置における変化の結果を示す。下行において、失った点は、平方二乗平均エラーが3mm超であることを表す。図11の結果は、回転摂動が10度未満のとき、提示される本発明の実施形態に係るすべてのアルゴリズムが満足であることを示す。
【0055】
(2)画像ノイズに対するロバスト性
分散を有する複数の量のガウス雑音は、蛍光透視画像に加えられ、本発明の実施形態に従う方法の性能上の画質品質の影響を評価した。各オプティマイザは、各ノイズ・レベルに対する13の初期位置から開始した(上述したように、α=5mmおよびβ=7.5度がプラスされたT0)。図12は、本発明の実施形態に従って、ノイズ・レベルに対する入力DRRノイズの標準偏差に関して、オプティマイザの性能を例示し、左列のグラフはリジッドアライメントの結果を表し、右列のグラフはアフィンアライメントの結果を表す。σ∈[0,60]を有するガウス白色雑音モデルが用いられた。この試験の結果は、本発明の実施形態による方法が蛍光透視のガウス雑音の存在に影響されないことを示す傾向がある。臨床設定ではほとんど観察されないσ=60のレベルでさえ、2Dおよび3Dエラー・レベルは、追加されたノイズの量にわずかな相関しか示さない。これは、選択された2Dセグメンテーション・アルゴリズムの性能が良好であるという徴候である。
【0056】
(3)非剛体変形
これらのシミュレーションにおいて、中心線は、CTで走査した領域をカバーしている3×3×3ノード薄板スプライン(TPS)変形モデルを使用して変形した。各TPSノードは、変形パラメータξに応じた係数によって、中心ノードへ移動する。9つの左のノードは、係数ξによってシフトされ、9つの中心のノードは、0.5によってシフトされ、9つの右のノードは、係数2ξによってシフトされた。図13は、シミュレーションされたデータを有する若干のサンプルの非剛体レジストレーションを示す。上行は初期位置を示し、下行は最終位置を示す。本発明の一実施形態による非剛体レジストレーション・アルゴリズムは、変形レベルξ∈{0.020,0.025,...,0.060}に対して試験され、中心線の平均3D変位は、[1.209〜3.638]mmであり、中心線の最大3D変位は、[2.472〜7.416]mmであった。非変形中心線曲線を、初期の解決法として用い、非剛体レジストレーション・アルゴリズムを適用する前に、グローバル・アライメントは、実行されなかった。図14は、定量的評価を示しており、シミュレーションされた非剛体変形レベルに関する3D残差のグラフであり、ベースラインは初期の解決法のエラーに対応する。このアルゴリズムがレベルξ=0.045までは良好な結果を示すことが判明した。この点では、平均的3Dエラーは2.721mmから1.198mmに減少し、このことは、図13に示すように質的に重要である。以下、本願明細書に示されるように、性能のこのレベルは臨床シナリオにおいて適切である。
【0057】
臨床データ
以下のセクションに示される実験に、5つのデータセットが使われた。各データセットは、拡張末期(データセット1、3)または収縮末期(データセット2、4、5)にて得られる1つのCTA走査と、1つの2方向X線透視法記録と、を含む。2つのモダリティはECGゲーティングを用いて時間的にアライメントされ、冠動脈は専門家によって、CTAにおいて、半自動式にセグメントされた。セグメントされた中心線の平均3Dインターポイント距離は、[1.36〜1.60]mmの範囲にあった。血管造影図は、3つの場合の左冠状動脈(LCA)と、その他2の場合の右冠動脈(RCA)と、を撮像する。画像サイズは全ての場合において、512×512であり、画像解像度はデータセット1〜5に対してそれぞれ{0.345,0.279,0.279,0.216,0.279}mm/ピクセルである。獲得率は、15fpsである。標準Cアームキャリブレーション行列が使われた。必須ではないが、キャリブレーション行列は、データセットごとに異なるにもかかわらず、獲得の間一定であった。CTAおよび蛍光透視試験は、冠動脈疾患の治療のための患者に定められた。
【0058】
本発明の一実施形態によるアライメントおよびレジストレーション・アルゴリズムの性能の評価は、平均2D射影エラー
【数58】

を使用して定量化された。ここで、Mは3D中心線モデルの点の総数であり、
【数59】

は参照2DセグメンテーションSnの距離変換であり、対応する蛍光透視画像上で手動追跡によって得られた。
【0059】
グローバル・アライメント:オプティマイザの性能評価
本発明の実施形態は、グローバル・アライメントのために、7つのローカル(L)アルゴリズムおよび2つのグローバル(G)アルゴリズムを検査した。以下、これらのアルゴリズムを簡潔に説明する。
【0060】
ベスト・ネイバー(Best Neighbor)(L)
各反復で、パラメータ空間のすべての主要な方向におけるステップが考慮される。最善の移動が適用され、新規の反復が開始する。移動が解決法を改善しないとき、ステップは半分にされる。
【0061】
ネルダー・ミード(別名滑降シンプレックス)(L)
一般のシンプレックス(またはポリエイラクブカ)のm+1頂点で関数値を評価することによって、m次元関数を最小化する古典的な数の最適化方法である。各反復で、最悪の値を有する頂点は、拡大動作または縮小動作の一方が続く反転動作を使用して、別のものに置換される。ネルダー等による「A Simplex Method For Function Minimization」、Comput.J.第7巻、第4号、308〜313頁、1965年参照。
【0062】
Sbplx3(L)
この方法は、低次元の部分空間の問題を分解し、ネルダー・ミード・アルゴリズムを使用して、検索を実行する。オンラインで利用可能なS.G.ジョンソンによる「The Nlopt Nonlinear-Optimization Package」(http://ab-initio.mit.edu/nlopt)参照。
【0063】
Cobyla(L)
線形近似による位相制約下最適化(Constrained Optimization By Linear Approximation)方法は、頂点シンプレックスを用いたコスト関数および制約の線形近似を構成することによって、機能し、この近似値を最小化する。シンプレックスの半径は次第に減少し、標準形状を維持する。パウエルによる「Advances in Optimization and Numerical Analysis」(A Direct Search Optimization Method That Models the Objective and Constraint Functions by Linear Interpolation、ドルドレヒト、クルーワー アカデミック、1994年、51―67頁)、および、パウエルによる「Direct Search Algorithms For Optimization Calculations」(Dept. Appl. Math. Theoretical Phys., Cambridge Univ., U.K., Tech. Rep., 1998)参照。
【0064】
Bobyqa(L)
二字近似による境界最適化(Bound Optimization By Quadratic Approximation)方法の各反復は、概して展補間点を考慮することによって、構成されたコスト関数の二次近似を使用する。パウエルによる「The BOBYQA Algorithm For Bound Constrained Optimization Without Derivatives」、(Centre Math. Sci., Cambridge Univ., Cambridge, U.K., Tech. Rep., 2009)参照。
【0065】
パウエル・ブレント(L)
各反復で、一連の正確な1D線最適化は、ブレントの方法を使用して実行される。その方法は、共役(conjugate)検索方向のパウエルの方法を使用して更新される。ブレントによる「Minimization Without Derivatives, Englewood Cliffs, NJ: Prentice-Hall, 1973」、および、パウエルによる「An Efficient Method For Finding The Minimum Of A Function Of Several Variables Without Calculating Derivatives」、Comput. J.、第7巻、第2号、155〜162頁、1964年参照。
【0066】
Praxis(L)
ブレントのPRincipal―AXIS方法は、共役検索方向のパウエルの方法を更新したものであり、「Algorithms for Minimization Without Derivatives, Englewood Cliffs, NJ: Prentice-Hall, 1973」に記載されている。
【0067】
微分展開(G)
これは、集団ベースの確率的な大域的最適化方法であり、その主要な特徴は、集団進化の基礎としての個人の対の違いのベクトルの使用である。ストーン等による「Differential Evolution-A Simple And Efficient Heuristic For Global Optimization Over Continuous Spaces」、J. Global Optimizat.、第11巻、341〜359頁、1997年参照。
【0068】
Direct(G)
この大域的最適化アルゴリズムは、本明細書の場合のように、有限境界拘束に関する課題のために設計される。パラメータ空間は、ますます小さいハイパーレクタングルに分割することによって、系統的かつ決定論的に検索される。ジョーンズ等による「Lipschitzian Optimization Without The Lipschitz Constant」、Optimizat. Theory Appl.、第79巻、157〜181頁、1993年参照。
【0069】
各アルゴリズムの自由パラメータは、アルゴリズムの原作者またはメーカーの勧告に従って調整された。以下のアルゴリズムの実施は、SBPLX、Cobyla、BobyqaおよびDirectについて、http://ab-initio.mit.edu/nloptのNLoptライブラリから得られる。課題の性質を変えないために、多数の境界は、オプティマイザに供給され、トランスレーションパラメータ用の±200mm、回転パラメータ用の±45度、スケール・パラメータ用の[0.5,1.5]、スケール・回転パラメータ用の±360度である[式(2)においてA1012]。
【0070】
微分展開を除いて、基準を停止する同一セットが、全オプティマイザ用に用いられた。具体的には、オプティマイザは、1つの最適化の後、(1)コスト関数の値が、1e-14未満で減少するか、あるいは、(2)最適化されたパラメータの値が、並進パラメータに関して1e-4mm未満、回転パラメータに関して1e-5ラジアン、スケーリング・パラメータに関して1e-7だけ変更するまで、進むことが許可された。パラメータ許容度は、直観的な解釈を有する。例えば、1e-4mmの並進の違いは、画像平面上の1/2000ピクセルの最大変位に対応する。微分展開オプティマイザに関しては、確率的なアルゴリズムの収束が規則的ではないので、本発明の実施形態は、コスト関数を、約10秒の中央値の動作に対応する100000回評価するまで、オプティマイザが動作するのを許容した。
【0071】
式(1)にて表される本発明の実施形態に従うグローバル・アライメント・エネルギーを最小化する際および良質の2D/3Dアライメントを生成する際の9つのオプティマイザの性能は、以下の実験的な設定を使用して評価された。5人の患者のデータセットの各々に対して、3対の蛍光透視画像が考慮された。それは、CTA獲得に時間的にアライメントされた画像および前後の隣接するフレームである。時間的アライメントは2つのモダリティ間の観察可能な違いを最小化するのを支援し、それによって、レジストレーションに失敗する危険を減らす。レジストレーション行列が毎秒ほぼ1回更新され、外科的ガイダンスを改善するため、これは臨床的に合理的である。加えて、オプティマイザのロバスト性を試験するために、13の異なる初期点が、初期化のために使われた。T0を、装置のキャリブレーションによって与えられる変換であると仮定する。13の初期点は、T0と、3本の主軸に沿って±5mmだけ位置がずれたT0と、3本の主軸の周りに±7.5度だけ回転したT0と、である。合計5×3×13=195回の実験は、テストされる各オプティマイザに対して実行された。上述したように、式(1)は、(1)並進のみの変換、(2)剛体変換および(3)アフィン変換を連続して用いることにより、最小化可能である。
【0072】
全9つのオプティマイザに対する3つの変換モデルの各々によって、最小化した後残った平均残余のエネルギーの平方二乗平均の分析は、アフィン変換モデルを有するエネルギー関数を最小化するための最善のアルゴリズムが以下の、微分展開、ネルダー・ミード、パウエル・ブレント、ベスト・ネイバー、SbplxおよびDirectであるということを明らかにする。平均2D射影エラーが考慮されると、順番はわずかに変化して、微分展開、パウエル・ブレント、ベスト・ネイバー、Sbplx、ネルダー・ミードおよびDirectとなる。違いは、アライメントプロセスで使用される自動セグメンテーションと、エラーを計算するために使用される手動セグメンテーションと、の間の相違におそらく起因している。それにもかかわらず、上部にランクを付けされたアルゴリズムの性能は、満足であるように見える。BobyqaおよびCobylaアルゴリズムの比較的低い性能は、それぞれ、エネルギー関数の形状がそれらの二次モデルおよび線形モデルによって、良好に表されないという徴候であるかもしれない。Praxis方法は、この課題に最も不適切なローカル・オプティマイザであるように見える。
【0073】
微分展開アルゴリズムが、残余エネルギーおよび平均2Dエラーの観点で最高の性能を有すると判明した。しかしながら、平均2Dエラーの増加は、ローカル・アルゴリズムより長い約100回の計算時間に重要ではなかった。しかし、そのオプティマイザの計算時間の中央値は、ちょうど11秒未満であり、タイム・クリティカルでないアプリケーションには適当となりうる。一般に、グローバル・オプティマイザは、最も高性能のローカル・オプティマイザより低いエネルギーまたはエラー形状に、極めてまれに至るということに留意されたい。これは、後者がグローバルな最適条件の近くにある解決法を実際に見つけるという徴候である。グローバル・オプティマイザが最低の解決法を回避することに一般に成功する点に注意する価値がある。残余エネルギーと認められた視覚の対応との間に良好な相関が存在する。それにもかかわらず、アフィン変換モデルで最高のアライメントに関してさえ、比較的大きい相違が、投影中心線と2D蛍光透視との間に存在する。これは、モダリティ間の時間的アライメントの不正確性による、データセットの非アフィン変形の存在と、さまざまな取得ステップの間、患者の位置の変化により導入される形状変化と、におそらく起因している。
【0074】
グローバル・アライメント方法と非剛体レジストレーションとの比較
ベスト・ネイバー・オプティマイザを用いて得られた詳細なグローバル・アライメントの結果が表示され、非剛体レジストレーション後に得られた結果と比較される。全ての場合において、中心線モデルは、CT再構築用に使用される同一の心臓位相において、ゲートされる蛍光透視フレームでレジストレーションされた。並進、剛体、アフィンおよび非剛体レジストレーション後の結果は、図3および図15の3人の患者からのデータセットに関して示され、図15では、左から右に、入力画像、剛体アライメント、アフィンアライメントおよび非剛体レジストレーションを示す。両方の2方向画像は、すべての場合に示される。矢印は関心領域を示す。2Dマニュアル・セグメンテーションに関する2つの透視面上の中心線の平均残余の2D射影エラーも、5人の患者に対する剛体、アフィンおよび非剛体レジストレーション後に、(ミリメータで)算出され、その結果は図16の表Iに示されている。図15の上の行および下の行は、それぞれ、表Iの患者1および患者2に対応する。図15の2つの左下の画像フレームのCTOラベルは、慢性完全閉塞を意味する。非剛体レジストレーションに必要な計算時間は、730ms〜3300msの範囲にあり、平均1591msであった。
【0075】
モデルの複雑さが増加するにつれて、平均2D射影エラーおよびそれらの標準偏差は減少するか、または、ほぼ一定のままである。しかしながら、剛体、アフィンおよび非剛体変換モデルの相対的な貢献は、データセットごとに変化する。これは、個々のケースにより示される変形の性質によって説明可能であり、変形の性質は、患者の位置、CTAと2D蛍光透視獲得との間の間隔および獲得プロトコルに関連している。また、患者の呼吸によって、非剛体の心臓の変形が生じうる。心臓の鼓動は非剛体変形の原因でもあるため、ECGゲーティングによる時間的アライメントの精度も重要である。最大エラーもモデル複雑さに伴って減少する傾向があるが、時々安定なままである。このような場合、自動のセグメンテーション方法により計算されるため、レジストレーション・アルゴリズムの性能は不完全な2Dセグメンテーションにより制限されるかもしれない。実際、ほとんど情報が利用できない領域では、本発明の実施形態による非剛体レジストレーション方法は、中心線をできるだけ変えてはならない。この特性は、慢性完全閉塞(CTO)の場合のように、構造の一部がX線蛍光透視画像上で十分には見えない状況において望ましい。例えば、図15の下行は、中心線がCTOの上下に良好にアライメントされているが、コントラストが低い部分にほとんど変形がないことを示す。
【0076】
マルチ・フレーム・シナリオのグローバル・アライメント
2方向の一対に対する中心線のアライメントの他の潜在的に役立つシナリオは、2方向血管造影法からの時間的フレームシーケンスに対する中心線のアライメントである。マルチ・フレーム・シナリオにおける本発明の一実施形態によるグローバル・アライメント方法の性能は、患者1のLCAデータセットから一連の11の2方向フレームを使用して示される。グローバル・アライメントは、本発明の実施形態に従う剛体およびアフィン変換モデルを使用して計算された。式(5)のフレーム間組織化パラメータγは、0.0〜1.0の間で変化した。式(5)のコスト関数を最小化するのに最も効果的であると判明したので、ベスト・ネイバー・オプティマイザがこの場合使われた。得られたサンプル結果は図17に示され、図17はフレームシーケンスの上のレジストレーションを示す。図17において、一番上の行は、γ=0.1およびEMulti*=120.284を有する剛体変換モデルを表し、中間の行は、γ=0およびEMulti*=119.356を有するアフィン変換モデルを表し、一番下の行は、γ=0.1およびEMulti*=116.905を有する正規化アフィン変換モデルを表し、ここで、EMulti*は、式(5)の右辺の第1項に対応する。矢印は関心領域を示す。計算時間は、一番上の行、中間の行および一番下の行で示される実験に対して、それぞれ、39秒、89秒および91秒であった。予想されるように、アフィン変換モデルを使用すると剛体変換モデルを使用するより良好な定性的結果に至ることが判明した。アフィン変換モデルを使用するとき、組織化(γ=0.1)を使用することも結果を改善した。大きい組織化値(γ>1.0)を用いると、モデルの剛性は増加し、オプティマイザは初期位置から遠い極小値を見つけることができない。予備調査は、例えば、パラメータが協調して変化可能なことによって、領域に特有のオプティマイザがより良好な結果を達成しうることを示唆する。それにもかかわらず、本発明の実施形態に従う設定は、大部分の心周期の間、LCAのアライメント変換をトラッキングするのに適切に聞こえた。RCAデータセットに関する実験は、説得力のある結果につながらなかった。事実、本発明の一実施形態によるグローバル・アライメント手順が機能しても、CTAおよびX線取得が近い時間的アライメントに近い場合を除き、心周期の間、RCAにより支持される剛体変形の量によって、アフィン・モデルの効果がなくなる。
【0077】
右冠動脈の半自動のトラッキング
この実験では、本発明の実施形態による非剛体レジストレーション方法に基づく半自動手順を用いて、RCAのトラッキングを行った。ゲートされたフレームから開始して、本発明の一実施形態によるグローバル・アライメントおよび非剛体レジストレーションが実行される。次に、本発明の一実施形態によるこの変形した中心線モデルは、次の一対の蛍光透視フレームのための第一のモデルおよび位置としてオペレータにより用いられる。図18に示されるように、このプロセスは1つの心周期上の全フレームのために繰り返され、図18は、左から右に、ゲートされたフレーム、+4、+6、+8および+10フレームを表す。第一の曲線は181であり、レジストレーションされた曲線は182である。了解されるように、この手順は、1つの心周期の間、RCAのトラッキングを成功させる。この実験がシミュレーション研究の前に行われたので、わずかに異なるパラメータセット、μ=0.05、υ=5.0およびλ=0.1が用いられた。必要な時間は約15分であり、これはオフラインの設定において、合理的である。
【0078】
考察
臨床データの実験に基づいて、ネルダー・ミード、パウエル・ブレント、ベスト・ネイバーおよびSbplxのローカル・オプティマイザが短時間(中央値<105ms、最大値<950ms)で良好な結果を与える。シミュレーションも考慮すると、ネルダー・ミード・アルゴリズムは、全体的に最善の性能を与えた。2つのグローバル・オプティマイザは、その結果が大きな改良につながることは極めてまれであり、一桁高い計算時間を必要とした。計算時間を無視すると、微分展開アルゴリズムは、一般に、最善の解決案を提供した。ローカル・オプティマイザを使用するとき、アライメント時間は一貫して1秒未満であるため、この方法は、インターベンション中の使用に適するものになる。剛体変換の代わりにアフィン変換を使用することの利点は、データセットの性質に依存し、場合によっては重要になりうる。3Dおよび2DモダリティはECGゲーティングを使用して時間的にアライメントされるとき、全体として、グローバル・アライメント手順がLCAおよびRCAデータセットの両方の使用に適切であること判明した。CTO患者からのデータセットに関する実験は、類似の臨床ケースに適用されるとき、本発明の実施形態に従う方法の利点を示す。本発明の実施形態による方法は、CTA獲得からセグメント化された3D形状を有する2D画像を増加することによって、インターベンション・ガイダンスを支援することもでき、このことにより2D画像の解釈に固有の曖昧性を著しく低減する。
【0079】
非剛体レジストレーションに関しては、本発明の一実施例による変形モデルに含まれる正規化は、中心線を最小量だけ変形させることによって、残りの構造との一貫性を確実に保つことによって、欠測データ(例えば、図15の患者2)を有する領域の管理を可能にする。過剰な変形または矯正は発生しない。全体の計算時間は、通常、3秒未満であり、これはインタラクティブなアプリケーションに使用できる。本発明の一実施形態による非剛体レジストレーション方法は、適切な初期点から開始するとき、隣接する2D構造に対する中心線をスナップし、特に困難なローコントラストCTOケースに関して、2D画像の解釈をより容易にする。これも、操作上の画像と一緒に更新された3Dモデルを示すことを可能にし、3D空間の改良された認識を提供できる。
【0080】
最終的に、複数のX線2方向血管造影法フレームを使用する実験によって、本発明の一実施形態によるマルチフレーム・グローバル・アライメント方法が、LCAデータセットに良好に作用するとともに、本発明の一実施形態によるフレーム間の正規化が、改良された結果につながるということが判明した。本発明の一実施形態による非剛体半自動のトラッキング方法は、より大きな非剛体変形を有するケース、例えば非時間的にアライメントされたRCAデータセットを有する場合を扱い、そのようなデータセットに適用された。本発明の一実施形態による半自動の方法は、1つの心拍をカバーしているシーケンスに対して約15分の相互作用を必要とし、それは実用的なオフラインのアプリケーションに合理的に思える。
【0081】
システムの実現
本発明の実施形態は、各種形態のハードウェア、ソフトウェア、ファームウェア、特殊目的のプロセスあるいはその組み合わせによって実現可能であることを理解されたい。一実施形態では、本発明は、コンピュータ可読のプログラム記憶装置に具体的に組み込まれたアプリケーションプログラムとしてソフトウェアで実現可能である。アプリケーションプログラムは、任意の適切な構造を有する機械にアップロード可能であるとともに、当該機械によって実行可能である。
【0082】
図19は、ライブ蛍光透視画像を用いた冠動脈モデルの非剛体2D/3Dレジストレーションを実現するコンピュータシステムのブロック図である。図19を参照すると、本発明を実施するためのコンピュータシステム191は、とりわけ、中央処理装置(CPU)192と、メモリ193と、入出力(I/O)インタフェース194と、を具えることができる。コンピュータシステム191は、一般的に、I/Oインタフェース194を介してディスプレイ195と、マウスやキーボードのような複数の入力装置196と、に接続されている。支持回路は、キャッシュ、電源、クロック回路および通信バスのような回路を含むことができる。メモリ193は、ランダムアクセスメモリ(RAM)、読み出し専用メモリ(ROM)、ディスクドライブ、テープドライブ等、あるいはその組み合わせを含むことができる。本発明は、ルーティン197として実現され、このルーティン197はメモリ193に記憶され、CPU192によって実行され、信号源198からの信号を処理する。それゆえ、コンピュータシステム191は、汎用コンピュータシステムであり、本発明のルーティン197を実行するとき特殊目的のコンピュータシステムになる。
【0083】
コンピュータシステム191は、また、オペレーティングシステムと、マイクロ命令コードと、を含む。本明細書に記載した様々な処理および機能は、オペレーティングシステムを介して実行されるマイクロ命令コードの一部あるいはアプリケーションプログラムの一部(あるいはその組み合わせ)とすることができる。さらに、様々なその他の周辺装置、例えば、追加のデータ記憶装置および印刷装置を、コンピュータプラットフォームに接続することができる。
【0084】
添付図面に示されたシステムの構成要素および方法のステップのいくつかは、ソフトウェアによって実施可能であるため、システムの構成要素(あるいはプロセスステップ)間の実際の接続は、本発明がプログラムされる方法に依存して異なるということを理解されたい。本明細書に記載した本発明の教示を考慮すると、当業者は本発明と同一および類似の実施形態あるいは構成を考えることができる。
【0085】
本発明は、例示的実施形態を参照して詳細に説明してきたが、当業者であれば、添付の特許請求の範囲に規定した本発明の精神および範囲から逸脱することなく各種変更および置換が可能であることを理解するであろう。
【特許請求の範囲】
【請求項1】
心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法であって、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、
エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
ことを特徴とする方法。
【請求項2】
前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される、
請求項1に記載の方法。
【請求項3】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、
各ステップでは、
【数1】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数2】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である、
請求項2に記載の方法。
【請求項4】
変換行列Tjは、再センタリングされ、
前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する、
請求項3に記載の方法。
【請求項5】
時間的に連続したF対の2D蛍光透視画像を提供するステップと、
前記エネルギー汎関数
【数3】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、
をさらに含み、
fは時点の合計であり、
Tfは各時点の変換であり、
γは所定のパラメータであり、
D(Tf・C・xs,q,Tf+1・C・xs,q)はフレーム間距離である、
請求項3に記載の方法。
【請求項6】
前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数4】

を再構築するステップをさらに含む、
請求項1に記載の方法。
【請求項7】
前記点照合は、
各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、
x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、
xs,pに最も近い点を照合点xnとして選択するステップと、
前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数5】

を再構築するステップと、
を含む、
請求項6に記載の方法。
【請求項8】
再構築された中心線点
【数6】

とレジストレーションされた中心線点
【数7】

との二乗差の前記総和は、
【数8】

であり、
【数9】

は指標関数
【数10】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数11】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数12】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1である、
請求項7に記載の方法。
【請求項9】
二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数13】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、
前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる、
請求項8に記載の方法。
【請求項10】
前記エネルギー汎関数は、
【数14】

を反復することによって、最小化され、
zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、
εは、小さい定数であり、
Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、
μ、υおよびλは、所定のパラメータである、
請求項9に記載の方法。
【請求項11】
心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法であって、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行することによって、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行することによって、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行することによって、前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップと、
を含み、
各ステップでは、
【数15】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数16】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離であり、
前記方法は、前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップを含む、
ことを特徴とする方法。
【請求項12】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップは、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数17】

を再構築するステップと、
エネルギー汎関数を最小化するステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
請求項11に記載の方法。
【請求項13】
前記エネルギー汎関数は、
【数18】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
【数19】

は、再構築された中心線点であり、
【数20】

は、レジストレーションされた中心線点であり、
【数21】

は指標関数
【数22】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数23】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数24】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組である、
請求項12に記載の方法。
【請求項14】
コンピュータ可読の非一時的プログラム記憶装置であって、
前記コンピュータにより実行されるとともに、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法を実行する命令プログラムを有し、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、
エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
ことを特徴とするプログラム記憶装置。
【請求項15】
前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される、
請求項14に記載のコンピュータ可読のプログラム記憶装置。
【請求項16】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、
各ステップでは、
【数25】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数26】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である、
請求項15に記載のコンピュータ可読のプログラム記憶装置。
【請求項17】
変換行列Tjは、再センタリングされ、
前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する、
請求項16に記載のコンピュータ可読のプログラム記憶装置。
【請求項18】
前記方法は、
時間的に連続したF対の2D蛍光透視画像を提供するステップと、
前記エネルギー汎関数
【数27】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、
をさらに含み、
fは、時点の合計であり、
Tfは、各時点の変換であり、
γは所定のパラメータであり、
D(Tf・C・xs,q,Tf+1・C・xs,q)は、フレーム間距離である、
請求項16に記載のコンピュータ可読のプログラム記憶装置。
【請求項19】
前記方法は、
前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数28】

を再構築するステップをさらに含む、
請求項14に記載のコンピュータ可読のプログラム記憶装置。
【請求項20】
前記点照合は、
各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、
x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、
xs,pに最も近い点を照合点xnとして選択するステップと、
前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数29】

を再構築するステップと、
を含む、
請求項19に記載のコンピュータ可読のプログラム記憶装置。
【請求項21】
再構築された中心線点
【数30】

とレジストレーションされた中心線点
【数31】

との二乗差の総和は、
【数32】

であり、
【数33】

は指標関数
【数34】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数35】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数36】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1である、
請求項20に記載のコンピュータ可読のプログラム記憶装置。
【請求項22】
二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数37】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、
前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる、
請求項21に記載のコンピュータ可読のプログラム記憶装置。
【請求項23】
前記エネルギー汎関数は、
【数38】

を反復することによって、最小化され、
zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、
εは、小さい定数であり、
Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、
μ、υおよびλは、所定のパラメータである、
請求項22に記載のコンピュータ可読のプログラム記憶装置。
【請求項1】
心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法であって、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、
エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
ことを特徴とする方法。
【請求項2】
前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される、
請求項1に記載の方法。
【請求項3】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、
各ステップでは、
【数1】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数2】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である、
請求項2に記載の方法。
【請求項4】
変換行列Tjは、再センタリングされ、
前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する、
請求項3に記載の方法。
【請求項5】
時間的に連続したF対の2D蛍光透視画像を提供するステップと、
前記エネルギー汎関数
【数3】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、
をさらに含み、
fは時点の合計であり、
Tfは各時点の変換であり、
γは所定のパラメータであり、
D(Tf・C・xs,q,Tf+1・C・xs,q)はフレーム間距離である、
請求項3に記載の方法。
【請求項6】
前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数4】

を再構築するステップをさらに含む、
請求項1に記載の方法。
【請求項7】
前記点照合は、
各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、
x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、
xs,pに最も近い点を照合点xnとして選択するステップと、
前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数5】

を再構築するステップと、
を含む、
請求項6に記載の方法。
【請求項8】
再構築された中心線点
【数6】

とレジストレーションされた中心線点
【数7】

との二乗差の前記総和は、
【数8】

であり、
【数9】

は指標関数
【数10】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数11】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数12】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1である、
請求項7に記載の方法。
【請求項9】
二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数13】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、
前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる、
請求項8に記載の方法。
【請求項10】
前記エネルギー汎関数は、
【数14】

を反復することによって、最小化され、
zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、
εは、小さい定数であり、
Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、
μ、υおよびλは、所定のパラメータである、
請求項9に記載の方法。
【請求項11】
心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法であって、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行することによって、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行することによって、前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行することによって、前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップと、
を含み、
各ステップでは、
【数15】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数16】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離であり、
前記方法は、前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップを含む、
ことを特徴とする方法。
【請求項12】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップは、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数17】

を再構築するステップと、
エネルギー汎関数を最小化するステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
請求項11に記載の方法。
【請求項13】
前記エネルギー汎関数は、
【数18】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
【数19】

は、再構築された中心線点であり、
【数20】

は、レジストレーションされた中心線点であり、
【数21】

は指標関数
【数22】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数23】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数24】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組である、
請求項12に記載の方法。
【請求項14】
コンピュータ可読の非一時的プログラム記憶装置であって、
前記コンピュータにより実行されるとともに、心臓インターベンション中の2D蛍光透視画像を用いたデジタル3D冠動脈モデルの非剛体レジストレーションのための方法を実行する命令プログラムを有し、前記方法は、
Qsの3D制御点からなる一組のSセグメントを具える3D中心線であって、冠動脈ツリーのデジタル化された3D中心線の表示を提供するステップと、
前記3D中心線を、少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップと、
エネルギー汎関数を最小化することによって、前記3D中心線を、少なくとも2つの2D蛍光透視画像に、非剛体レジストレーションするステップと、
を含み、
前記エネルギー汎関数は、再構築された中心線点とレジストレーションされた中心線点との間の二乗差の総和と、二乗3Dレジストレーション・ベクトルの総和と、二乗微分係数3Dレジストレーション・ベクトルの総和と、心筋分岐エネルギーと、を含み、
前記3D中心線の非剛体レジストレーションは、前記3D中心線の座標系にて、対応する中心線点xs,qに適用される一組の3D並進ベクトルrs,qとして表される、
ことを特徴とするプログラム記憶装置。
【請求項15】
前記冠動脈ツリーは前記2D蛍光透視画像からセグメントされ、前記セグメントされた冠動脈ツリーは前記2D蛍光透視画像の各々の2値化として表される、
請求項14に記載のコンピュータ可読のプログラム記憶装置。
【請求項16】
前記3D中心線を、前記少なくとも2つの2D蛍光透視画像に、グローバル・アライメントするステップは、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の並進のみのレジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線の剛体レジストレーションを実行するステップと、
前記少なくとも2つの2D蛍光透視画像に対する前記3D中心線のアフィン・レジストレーションを実行するステップと、
を含み、
各ステップでは、
【数25】

の形のエネルギー汎関数は最小化され、
jは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、を分類し、
Cは、前記3D中心線の座標系と3D画像形成装置の座標系との間の座標変換であり、
Tjは、前記並進のみのレジストレーションと、前記剛体レジストレーションと、前記アフィン・レジストレーションと、に対して、前記3D画像形成装置の座標系と、前記蛍光透視画像を取得する2方向Cアームの座標系と、の間の座標変換であり、
xは、均一な座標の3D点であり、
nは、前記蛍光透視画像上の合計を表し、
sおよびqは、前記3D中心線の前記セグメント上の制御点を分類し、
Pnは、前記2方向Cアームの前記座標系と、第n番目の蛍光透視画像の前記座標系と、の間の座標変換であり、
Ψnは、前記3D位置xを前記第n番目の蛍光透視画像に射影する射影オペレータであり、
【数26】

は、前記第n番目の蛍光透視画像の2D点と、前記第n番目の二値化された画像Bnの前記セグメントされた冠動脈ツリーに最も近い点と、の間の距離である、
請求項15に記載のコンピュータ可読のプログラム記憶装置。
【請求項17】
変換行列Tjは、再センタリングされ、
前記変換行列Tjの回転パラメータの変化は、前記3D画像形成装置の前記座標系の原点とは対照的に、前記3D中心線の前記座標系の原点の周りで発生するように見える運動を誘導する、
請求項16に記載のコンピュータ可読のプログラム記憶装置。
【請求項18】
前記方法は、
時間的に連続したF対の2D蛍光透視画像を提供するステップと、
前記エネルギー汎関数
【数27】

を最小化することによって、前記3D中心線を、各対の2D蛍光透視画像にグローバル・アライメントするステップと、
をさらに含み、
fは、時点の合計であり、
Tfは、各時点の変換であり、
γは所定のパラメータであり、
D(Tf・C・xs,q,Tf+1・C・xs,q)は、フレーム間距離である、
請求項16に記載のコンピュータ可読のプログラム記憶装置。
【請求項19】
前記方法は、
前記3D中心線を少なくとも2つの2D蛍光透視画像にグローバル・アライメントするステップの後、
前記3D中心線の点を、前記2D蛍光透視画像の対応する血管中心線点に照合し、前記照合した2D点から3D中心線点
【数28】

を再構築するステップをさらに含む、
請求項14に記載のコンピュータ可読のプログラム記憶装置。
【請求項20】
前記点照合は、
各3D中心線点xs,pの射影x'を、前記グローバル・アライメントからの各2D蛍光透視画像上に見つけるステップと、
x'から開始して、各2D蛍光透視画像に対応するセグメンテーション画像Bnを、前記セグメンテーション画像B上の前記3D中心線の射影に垂直な線に沿って検索し、中心線点xs,pに照合する2つまでの点を見つけるステップと、
xs,pに最も近い点を照合点xnとして選択するステップと、
前記蛍光透視画像の照合点を用いて、前記心臓インターベンションに用いられている画像処理システムの射影形状を使用している3D中心線点
【数29】

を再構築するステップと、
を含む、
請求項19に記載のコンピュータ可読のプログラム記憶装置。
【請求項21】
再構築された中心線点
【数30】

とレジストレーションされた中心線点
【数31】

との二乗差の総和は、
【数32】

であり、
【数33】

は指標関数
【数34】

であり、
照合点がいかなる画像平面でも見つからない場合、あるいは、2D蛍光透視画像上の
【数35】

の射影x'と前記第n番目の2D蛍光透視画像の照合点xn"との間の2D距離が所定の閾値Max2Dより大きい場合、あるいは、中心線点xs,qと対応する再構築された点
【数36】

との間の3D距離が所定の閾値Max3Dより大きい場合、H(xs,p)=0であり、
その他の場合、H(xs,p)=1である、
請求項20に記載のコンピュータ可読のプログラム記憶装置。
【請求項22】
二乗3Dレジストレーション・ベクトルの前記総和と、二乗微分係数3Dレジストレーション・ベクトルの前記総和と、前記エネルギー汎関数の前記心筋分岐エネルギーは、
【数37】

であり、
rは、レジストレーション・ベクトルであり、
xは、前記3D中心線上の制御点であり、
sおよびqの前記総和は、前記3D中心線の全セグメントの全制御点の合計であり、
Kは、前記3D中心線の接合部から距離Ds離れた各セグメントの点を、前記接合部で接合される他のセグメントの対応する制御点に連結することにより形成される制御点の全対の一組であり、
前記接合部では、連結がレジストレーションの間拡大または圧縮される場合、各連結はその変位に比例した力を発生させる、
請求項21に記載のコンピュータ可読のプログラム記憶装置。
【請求項23】
前記エネルギー汎関数は、
【数38】

を反復することによって、最小化され、
zは、点rs,p=[0,0,0]T|∀{s,q}から反復z=0で開始する反復カウンタであり、
εは、小さい定数であり、
Ks,q⊂Kは、制御点(s,q)に作用する一組の制約であり、
μ、υおよびλは、所定のパラメータである、
請求項22に記載のコンピュータ可読のプログラム記憶装置。
【図1】


【図4】


【図5】


【図9】


【図16】


【図19】


【図2】


【図3】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図17】


【図18】




【図4】


【図5】


【図9】


【図16】


【図19】


【図2】


【図3】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図17】


【図18】


【公開番号】特開2013−71016(P2013−71016A)
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−217537(P2012−217537)
【出願日】平成24年9月28日(2012.9.28)
【出願人】(510299444)シーメンス コーポレーション (3)
【氏名又は名称原語表記】Siemens Corporation
【住所又は居所原語表記】170 Wood Avenue South, Iselin, New Jersey 08830, United States of America
【Fターム(参考)】
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2012−217537(P2012−217537)
【出願日】平成24年9月28日(2012.9.28)
【出願人】(510299444)シーメンス コーポレーション (3)
【氏名又は名称原語表記】Siemens Corporation
【住所又は居所原語表記】170 Wood Avenue South, Iselin, New Jersey 08830, United States of America
【Fターム(参考)】
[ Back to top ]

