ラカンカレクチン、その製造方法及び用途
【課題】シアル酸α2−6糖鎖に親和性を有する新規なレクチンとその用途を提供する。
【解決手段】本発明の新規なラカンカレクチンは、
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を示す、
(3)シアル酸α2−6糖鎖に特異的に結合する、
という理化学的性質を有する。
【解決手段】本発明の新規なラカンカレクチンは、
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を示す、
(3)シアル酸α2−6糖鎖に特異的に結合する、
という理化学的性質を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、羅漢果植物から得ることのできる新規なレクチン、その製造方法及び用途に関する。
【背景技術】
【0002】
シアル酸は、糖鎖の末端につく酸性糖であって、生体内で、単体の他、複合糖質の構成成分として、細胞膜表面のオリゴ糖の末端に存在する。そして、細胞表層において認識、免疫等に関係している。
【0003】
シアル酸を検出するレクチンとして、従来、日本ニワトコレクチン(SSA)、西洋ニワトコレクチン(SNA)、イヌエンジュレクチン(MAM)、ヤナギマツタケレクチン(ACG)、キカラスウリレクチン(TJA-I)等が知られている。シアル酸特異的レクチンの種類は、他の特異性を有するレクチンと比べて非常に少ない。レクチンは糖鎖研究を行う上で非常に良いプローブであるにも関わらず、充分な種類のレクチンが備わっていないのが現状である。
【0004】
シアル酸特異的レクチンが新規に見つかれば、その特性を利用して、シアル酸関連した疾患の同定等の用途が期待できる。例えば、特開2005−145837(アルツハイマー病の診断方法、特許文献1)には、ヒト由来の試料に含まれるβ−セクレターゼにより切断される分泌型シアル酸転移酵素を検出又は測定することを含む、アルツハイマー病の診断方法が記載されている。特開2006−317210(血清糖蛋白質をバイオマーカーとするアルツハイマー病の診断方法、特許文献2)には、α2,6シアル酸含有糖蛋白質を検出するためのレクチンを含む、アルツハイマー病の診断薬が記載されている。
【0005】
様々なウイルスの感染にもシアル酸が関与していることが報告されている。例えば、インフルエンザウイルスの表面に存在するヘマグルチニン(糖タンパク質)は、感染細胞(例えばヒトの気道粘膜の細胞)表面に存在する糖タンパク質のシアル酸α2−6Galを認識する性質を持ち、この結合を利用してウイルスが細胞へ感染することが知られている。インフルエンザウイルスが感染細胞から未感染細胞へ移動する際には、シアル酸α2−6結合を切る必要があるため、ウイルスは、酵素ノイラミニダーゼを細胞表面に持っている。
【0006】
シアル酸の増加されるレベルは、近年、心臓血管疾患、アルコール依存症、および糖尿病等ついて観察されており、従って、シアル酸を、このような致死的な疾患を診断および検出するためのマーカーとしての研究が進みつつある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2005−145837
【特許文献2】特開2006−317210
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の目的は、新規なシアル酸α2−6特異的レクチンとその用途を提供することにある。
【課題を解決するための手段】
【0009】
本発明者は、上記課題の解決に向けて鋭意研究したところ、羅漢果植物の抽出物から、シアル酸α2−6糖鎖との結合活性を有するレクチンを単離することに成功し、本発明を完成させた。すなわち、本発明は、羅漢果(Momordicae grosvenori)植物から抽出することができ、以下の理化学的性質:
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を示す、
(3)シアル酸α2−6糖鎖に対して親和性を有する、
を特徴とするラカンカレクチンを提供する。
【0010】
上記ラカンカレクチンは、特に、6’−シアリルラクトース又は6’−シアリルラクトサミンへの最小阻害濃度が、5μg/ml以下である。ここで、最小阻害濃度とは、糖が凝集反応を阻止するために要する最小濃度を意味する。すなわち、最小阻害濃度が小さいほど、レクチンに対する親和性が高いことを示している。
【0011】
上記ラカンカレクチンは、特に、イムノグロブリンM及び前立腺特異抗原に対して親和性を有する。
【0012】
本発明は、また、羅漢果植物の水系媒体抽出物から得ることを特徴とする、上記ラカンカレクチンの製造方法を提供する。
【0013】
本発明のラカンカレクチンの製造方法は、ラカンカの水系媒体抽出物を、硫酸アンモニウム沈殿法などのタンパク質沈殿法及びアフィニティークロマトグラフィーに供することを含むことが好ましい。
【0014】
本発明は、また、ラカンカレクチンに糖鎖を作用させることからなる、シアル酸α2−6糖鎖の検出方法を提供する。
【0015】
本発明は、また、ラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法を提供する。
【0016】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための研究用試薬又は研究用キットを提供する。
【0017】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キットを提供する。
【0018】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤を提供する。
【0019】
本発明は、また、ラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法を提供する。
【0020】
本発明は、また、ラカンカレクチンを含む医薬組成物を提供する。
【0021】
本発明は、また、ラカンカレクチンを担持させた衛生用品を提供する。
【0022】
上記衛生用品は、シアル酸α2−6糖鎖に結合性を有する病原体を遮蔽する用途に好適である。
【0023】
前記衛生用品は、例えばマスク、空気清浄機用フィルターのいずれか一種である。
【0024】
本発明は、また、精製したラカンカレクチンを添加した食品を提供する。
【0025】
上記食品は、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗性を有する用途に好適である。上記食品は、例えばトローチ、飴、ドロップ、ガム、茶・コーヒー・ジュース等の飲料のいずれか一種の形態である。
【発明の効果】
【0026】
本発明のレクチンの原料となる「羅漢果植物」は、食品(飲料や甘味料)等で食経験があり、市場に多く流通している。天然由来の安全かつ入手の容易な原料からシアル酸α2−6糖鎖特異的レクチンを製造できる本発明は、利用価値が高い。新規なシアル酸α2−6糖鎖特異的レクチンの提供は、今後の糖鎖研究にとって非常に有意義である。また、シアル酸の研究は、様々な生体反応に関与していることから、それらの研究は、世界中で進められている。本発明のレクチンは、「シアル酸α2−6糖鎖」構造を特異的に見出すことができるので、多くの研究者の研究に使用されることが期待できる。
【0027】
また、シアル酸α2−6糖鎖特異的レクチンは、シアル酸α2−6糖鎖の検出や、シアル酸α2−6糖鎖を持つ糖タンパク質の精製に利用できる。また、シアル酸α2−6糖鎖に関与する癌や疾患の診断方法にも利用可能である。また、新規な腫瘍マーカーの探索等に応用し、腫瘍マーカーの発見につなげることができる。
【0028】
さらに、シアル酸α2−6糖鎖特異的レクチンを、インフルエンザウイルス等の病原体の感染防御方法や衛生用品にも応用できる。
【図面の簡単な説明】
【0029】
【図1】実施例1のラカンカレクチン(MGL)の精製工程を示す図である。
【図2】実施例1のMGLのアフィニティークロマトグラフィーの溶出図である。
【図3】実施例1のMGLのドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS−PAGE)の結果(図面代用写真)である。
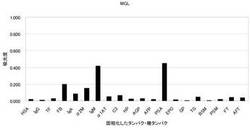
【図4】実施例1のMGLを用いた酵素免疫測定法(ELISA)による糖タンパク質検出の結果である。
【図5】比較例1のSNAを用いたELISAによる糖タンパク質検出の結果である。
【図6】比較例2のSSAを用いたELISAによるタ糖タンパク質検出の結果である。
【図7】比較例3のMAMを用いたELISAによる糖タンパク質検出の結果である。
【図8】比較例4のACGを用いたELISAによる糖タンパク質検出の結果である。
【発明を実施するための形態】
【0030】
羅漢果(Momordicae grosvenori)は、ウリ科ラカンカ属の多年生つる植物であり、中国の桂林周辺が主な産地である。ラカンカは、甘味成分を含んでおり、食材の甘味料や羅漢果茶として用いられる。日本では、主に、乾燥品が輸入されている。
【0031】
本発明のラカンカレクチンのドデシル硫酸ナトリウム−ポリアクリルアミド電気泳動(SDS-PAGE)法によるサブユニット分子量は、分子量が20,000〜70,000であり、好ましくは20,000〜40,000である。ラカンカレクチンは、通常、2〜4個のサブユニットが結合した複合体としても存在することが予想される。そのような複合体も本発明の範囲に属する。なお、SDS−PAGEによる分子量は、例えばLaemmiの方法(Nature,227巻,680頁,1976年)に準じて測定されるものである。
【0032】
本発明のラカンカレクチンは、ウサギ、ヒト(O型、A1型、A2型、及びB型)、ブタ、ニワトリ、ガチョウ及びモルモットの赤血球に対して凝集活性を示す。特に、ウサギ及びブタの赤血球を強く凝集させる。
【0033】
本発明のラカンカレクチンは、種々の糖のうち6’−シアリルラクトース、6’−シアリルラクトサミンに親和性を有する。特に6’−シアリルラクトース又は6’−シアリルラクトサミンへの最小阻害濃度が、5μg/ml以下である。
【0034】
本発明のラカンカレクチンは、種々の糖タンパクのうち、ブタ胃ムチン、ウシ顎下腺ムチン、フェツイン、α1−酸性糖タンパク、チログロブリン、ラクトフェリン、フィブリノーゲン、イムノグロブリンA、α2−マクログロブリン、イムノグロブリンM、前立腺特異抗原に対して親和性を有する。特に、イムノグロブリンM(IgM)及び前立腺特異抗原(PSA)に対して、高い親和性を有する。
【0035】
本発明のラカンカレクチンの製造方法は、羅漢果植物の水系抽出物から公知の分離方法、精製方法等を適宜組み合わせることにより、単離することができる。原料の羅漢果の使用部位は、種子や果実である。これらは、生でも乾燥物でもよい。
【0036】
羅漢果植物と水系媒体とから水系媒体抽出物を得る方法については、水系媒体と羅漢果の果実とを接触させることができれば特に制限はない。抽出効率の観点から、水系媒体中で羅漢果の乾燥物を粉砕して懸濁液とする方法が好ましい。また、粉砕方法としては、ミキサー、ホモジナイザー、ブレンダー、(超)音波装置、加圧型破壊装置、らい潰器具等の汎用の器具や機器を使用した粉砕方法を挙げることができる。
【0037】
前記水系媒体としては、水、緩衝液、水と混合し得る有機溶媒と水又は緩衝液との混合物等を挙げることができる。好ましくは、緩衝液又は有機溶媒と緩衝液との混合物を用いる。上記緩衝液としては、特に制限されることなく公知の緩衝液を用いることができる。中でも、pH3〜10の範囲に緩衝能を有するものが好ましく、pH6〜8の範囲に緩衝能を有するものがより好ましい。具体的には、リン酸緩衝液、クエン酸緩衝液、酢酸緩衝液、トリス緩衝液等を挙げることができる。中でも、抽出効率の観点から、リン酸緩衝液が好ましい。前記緩衝液の塩濃度は、特に制限はないが、抽出効率と緩衝能の点から、1〜100mMであることが好ましく、5〜20mMであることがより好ましい。
【0038】
前記緩衝液は、さらに塩類を含むことができる。例えば、リン酸緩衝液に食塩を更に加えたリン酸緩衝化生理食塩水等は、本発明における水系媒体として好ましい。
【0039】
前記有機溶媒としては、水と混合し得る有機溶媒であれば特に制限なく用いることができる。中でも、アセトン、メタノール、エタノール、n-ブタノール、2−プロパノール及びアセトニトリルが好ましい。有機溶媒と水又は緩衝液とを混合する場合の有機溶媒の含有量としては、5〜50質量%であることが好ましい。
【0040】
前記抽出工程は、水系媒体と羅漢果植物との混合物から、水系媒体に対する不溶物を除去する工程を更に含むことが好ましい。不溶物の除去方法としては、濾過、遠心分離等の方法を挙げることができるが、除去効率の観点から遠心分離が好ましい。
【0041】
前記抽出工程は、リン酸緩衝化生理食塩水中(PBS)で、ラカンカを破砕し、遠心分離によって不溶物を除去して水系媒体抽出物を得る工程であることが好ましい。または、作業効率の観点から、ラカンカを粉砕し、リン酸緩衝化生理食塩水を添加し、よく攪拌し、遠心分離によって不溶物を除去して水系媒体抽出物を得る工程であってもよい。
【0042】
前記ラカンカレクチンの製造方法では、以下の精製手段を採用すると、一層効率的な精製が可能となる。
【0043】
上記工程によって得られた水系媒体抽出物を、硫酸アンモニウム沈殿法によりレクチン含有画分を得て、得られたレクチン画分を、さらにアフィニティークロマトグラフィーで精製する。
【0044】
タンパク質の沈殿方法は上記硫酸アンモニウム沈殿法に限らず、硫酸アンモニウム沈殿(塩析)、トリクロロ酢酸(TCA)沈殿、アセトン沈殿、エタノール沈殿、TCA/アセトン沈殿、酢酸アンモニウム含有メタノールによる沈殿(フェノール抽出前処理)、Clean−Up Kitによる沈殿等、通常の方法を挙げることができる。
【0045】
アフィニティークロマトグラフィーでは、シアル酸2−6を有する糖や糖タンパクを固定したカラムを使用する。例えば、シアリルラクトース、フェツイン、チログロブリンをアガロースゲルに固定化したカラムを使用する。溶出液には、ラクトース、シアリルラクトース、アンモニアや酢酸を使用する。溶出された分画のうち、例えばウサギ赤血球凝集活性画分を採取する。
【0046】
本発明の製造方法は、前記精製工程で得られたレクチンを含む画分を透析する工程、透析処理後のレクチン溶液を限外ろ過等で濃縮する工程、及び濃縮液を凍結乾燥する工程を含んでもよい。これにより、レクチンを容易に単離することができる。透析、濃縮、凍結乾燥は、通常用いられる公知の方法によって行うことができる。上記製造方法により、SDS−PAGEによるサブユニット分子量が20,000〜70,000のレクチンを得る。
【0047】
本発明は、また、前記ラカンカレクチンを用いたシアル酸α2−6糖鎖の検出方法を提供する。前記ラカンカレクチンは、シアル酸α2−6糖鎖を従来よりも特異的に認識して結合できることから、シアル酸α2−6を含有する多糖類、糖脂質、糖タンパク質等の糖鎖化合物の特異的検出に好適である。
【0048】
また、本発明のラカンカレクチンは、シアロ体(例えば6’−シアリルラクトース、6’−シアリルラクトサミン)への阻害濃度とアシアロ体(例えばラクトース)の最小阻害濃度の比が、通常10倍以上、好ましくは50倍以上、特に好ましくは100倍以上である。したがって、本発明のラカンカレクチンは、シアロ体の検出のみならず、疾患等によってシアル酸が脱離もまた鋭敏に検出することができる。
【0049】
また、本発明のラカンカレクチンは、シアル酸α2−6型(例えば6’−シアリルラクトース、6’−シアリルラクトサミン)の阻害濃度とシアル酸α2−3型(例えば3’−シアリルラクトース、3’−シアリルラクトサミン)の最小阻害濃度の比が、通常10倍以上、好ましくは50倍以上、特に好ましくは200倍以上である。したがって、本発明のラカンカレクチンは、シアル酸の結合様式の違いもまた検出することができる。
【0050】
前記検出方法に用いる前記ラカンカレクチンには、標識手段が組み込まれていてもよい。このようなレクチンを以下、標識レクチンということがある。本発明の標識レクチンは、ラカンカレクチンと標識手段とを少なくとも含み、検出可能に標識化されていることを特徴とする。
【0051】
前記標識手段としては、特に制限なく公知の標識化方法を適用することができ、例えば、放射性同位元素による標識化、標識化合物の結合等を挙げることができる。
【0052】
前記標識化合物としては、この用途に通常用いられるものであれば特に制限なく適用することができ、例えば、直接又は間接標識化合物、酵素、蛍光化合物等を挙げることができる。具体的には、ビオチン、ジゴキシゲニン、西洋ワサビ由来ペルオキシダーゼ、フルオレセインイソチオシアネート、CyDye等を挙げることができる。これらの標識化合物は、常法によりレクチンと結合することができる。特に、アビジン−ビオチン又はストレプトアビジン−ビオチン系は、感度が高い点で好ましい。
【0053】
シアル酸α2−6糖鎖の検出又は分別は、例えば固定化された前記ラカンカレクチンを用いるレクチンクロマトグラフィーによって行うことができる。レクチンクロマトグラフィーは、レクチンが糖鎖と特異的に結合する性質を利用したアフィニティークロマトグラフィーである。HPLCと組み合わせる(HPLAC)と、ハイスループットを期待することができる。
【0054】
ラカンカレクチンを固定化する担体としては、アガロース、デキストラン、セルロース、スターチ、ポリアクリルアミド等のゲル材が一般的である。これらには、市販のものを特に制限なく使用でき、例えばセファロース4Bやセファロース6B(共にGEヘルスケアバイオサイエンス社製)が挙げられる。
【0055】
レクチンクロマトグラフィーに用いる材料としては、マイクロプレートやナノウエルにレクチンを固定化したものも含まれる。
【0056】
固定化するラカンカレクチンの濃度は、通常、0.001〜100mg/ml、好ましくは0.01〜20mg/mlである。担体がアガロースゲルの場合、それをCNBr等で活性化してからレクチンとカップリングさせる。活性化スペーサーを導入したゲルにレクチンを固定化してもよい。さらには、ホルミル基を導入したゲルにレクチンを固定化してからNaCNBH3で還元してもよい。また、NHS−セファロース(GEヘルスケアバイオサイエンス社製)のような市販の活性化ゲルを使用してもよい。
【0057】
シアル酸α2−6糖鎖の存在が疑われる試料をカラムにかけた後、洗浄と平衡化の目的で緩衝液を流す。緩衝液の一例は、モル濃度が5〜500mM、好ましくは10〜500mMであり、pHが4.0〜10.0、好ましくは6.0〜9.0であり、NaCl含量が0〜0.5M、好ましくは0.1〜0.2Mであり、CaCl2、MgCl2、又は、MnCl2含量が0〜10mM、好ましくは0〜5mMの緩衝液である。
【0058】
アフィニティーカラムの洗浄後、シアル酸α2−6糖鎖の溶出は、該糖鎖を有効に溶出できる中性の非変性緩衝液中で、塩化ナトリウム、ハプテン糖等の脱着剤を用いて行われる。この緩衝液は、上記と同様であってもよい。脱着剤の濃度は、好ましくは、1〜400mM、特に好ましくは10〜200mM濃度である。
【0059】
糖鎖の検出には、上記以外のクロマトグラフィー、酵素免疫測定法(ELISA)、ウェスタンブロット、レクチンチップ、レクチン染色、免疫沈降、凝集法、表面プラズモン共鳴法、電気泳動等も当業者に周知の方法で使用することができる。
【0060】
前記糖鎖を含む検体は、特に限定されない。例えば、血液、血漿、血清、涙、唾液、体液、乳汁、尿、細胞の培養上清、形質転換動物からの分泌物等が挙げられる。
【0061】
前記検出方法の対象であるシアル酸α2−6糖鎖を有する物質の具体例は、6’−シアリルラクトース、6’−シアリルラクトサミン、イムノグロブリンM(IgM)、前立腺特異抗原(PSA)等が挙げられる。検出方法に作用させる糖鎖は、腫瘍マーカーが好ましい。
【0062】
本発明の検出方法の対象は、好ましくは、シアル酸α2−6糖鎖の関与が指摘される疾患である。具体例としては、アルツハイマー病、心臓血管疾患、アルコール依存症、IgA腎症、肝臓癌、前立腺がん、卵巣がん、心筋梗塞、繊維症、膵炎および糖尿病等が挙げられる。
【0063】
前記ラカンカレクチンは、物理化学的性質、糖鎖への結合特異性等の生化学的性質が従来公知のレクチンと異なる新規のレクチンである。特にシアル酸α2−6糖鎖を特異的に認識することから、シアル酸α2−6糖鎖に起因する疾患の診断薬や検査試薬、シアル酸α2−6糖鎖の分離分析用特異的結合剤、免疫調節剤等として用いることができる。したがって、本発明は、前記ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キット、並びにラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤を提供する。
【0064】
前記診断薬又は診断薬キットは、例えばアルツハイマー病、心臓血管疾患、アルコール依存症、IgA腎症、肝臓癌、前立腺がん、卵巣がん、心筋梗塞、繊維症、膵炎および糖尿病等を診断するのに有用である。
【0065】
上記診断薬又は診断薬キットには、適宜、標識体、酵素とその発色基質、放射性同位元素、発光物質、蛍光物質、着色物質、緩衝液、標準タンパク、反応停止液、プレート等の通常診断薬キットに使われるに公知のものを含む。
【0066】
本発明は、また、前記ラカンカレクチンをシアル酸α2−6糖鎖の結合媒体として用いて、シアル酸α2−6糖鎖と非シアル酸α2−6糖鎖とを分別することからなる、シアル酸α2−6糖鎖の分別方法を提供する。
【0067】
本発明の分別方法は、例えば固定化された前記ラカンカレクチンを用いるレクチンクロマトグラフィーである。その詳細は、前記検出方法で説明したものと同様である。シアル酸α2−6糖鎖の精製を行なう場合、ラカンカレクチンを、アガロースやセルロースからなるカラム担体に官能基を介して共有結合させて親和性カラムを調製し、糖鎖試料を通す。通塔後、吸着したシアル酸α2−6糖鎖を回収する。非シアル酸α2−6糖鎖の精製を行う場合には、上記カラムに糖鎖試料を通塔する際、吸着しないで通過する糖鎖試料を回収する。
【0068】
本発明の分別方法により精製される対象は、シアル酸α2−6糖鎖、非シアル酸α2−6糖鎖の二種類があり得る。
【0069】
本発明は、ラカンカレクチンを含む、シアル酸α2−6糖鎖に起因する疾患を予防・治療するための医薬組成物を提供する。医薬の用途としては、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗薬、感染阻害剤、予防薬、漢方薬、伝承薬が挙げられる。シアル酸α2−6糖鎖に結合性を有する病原体には、ウインフルエンザウィルスやアデノウイルスが挙げられる。例えば、これらのウイルスとラカンカレクチンとが人の喉や鼻の粘膜に拮抗的に働き、ウイルスの進入を防ぐ。
【0070】
本発明のラカンカレクチンを、経口医薬として使用するために、液剤、粉末剤、顆粒剤、錠剤、カプセル剤、シロップ剤などの形態に加工される。
【0071】
本発明の医薬組成物は、薬理学上使用可能な担体、賦形剤、助剤等を本発明の効果を阻害しない範囲で添加することができる。具体的には、乳糖、ショ糖、果糖、ブドウ糖、ブドウ糖水和物、白糖、精製白糖、エリスリトール、キシリトール、ソルビトール、マンニトール、パラチノース、還元パラチノース、粉末還元麦芽糖、水アメ、カルメロース、デキストリン、トウモロコシデンプン、アルファー化デンプン、部分アルファー化デンプン、バレイショデンプン、コーンスターチ、ヒドロキシプロピルスターチ、アミノ酸、カオリン、無水ケイ酸、ケイ酸、ケイ酸アルミニウム、重炭酸ナトリウム、リン酸カルシウム、リン酸二水素カルシウム、炭酸カルシウム、酸化マグネシウム、水酸化アルミニウム、脂肪酸又はその塩、脂肪酸モノグリセリド及びジグリセリド、アルコール、植物油、オリーブ油、ダイズ油、トウモロコシ油、脂肪油、油脂、粘性パラフィン、プロピレングリコール、エチレングリコール、ポリエチレングリコール、グリセリンなどの担体又は賦形剤;結晶セルロース、結晶セルロース・カルメロースナトリウム、メチルセルロース、ヒドロキシプロピルセルロース、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルメロースナトリウム、エチルセルロース、カルボキシメチルエチルセルロース、ヒドロキシエチルセルロース、コムギデンプン、コメデンプン、トウモロコシデンプン、バレイショデンプン、アルファー化デンプン、部分アルファー化デンプン、ヒドロキシプロピルスターチ、デキストリン、プルラン、ポリビニルピロリドン、アミノアルキルメタクリレートコポリマーE、アミノアルキルメタクリレートコポリマーRS、メタクリル酸コポリマーL、メタクリル酸コポリマー、ポリビニルアセタールジエチルアミノアセテート、ポリビニルアルコール、アラビアゴム、アラビアゴム末、寒天、ゼラチン、白色セラック、トラガント、マクロゴールなどの結合剤;コムギデンプン、コメデンプン、トウモロコシデンプン、合成ケイ酸アルミニウム、乾燥水酸化アルミニウムゲル、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウム、無水リン酸水素カルシウム、ロウ類、水素添加植物油、ポリエチレングリコール、軽質無水ケイ酸、合成ケイ酸アルミニウム、ステアリン酸、マクロゴール、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、含水二酸化ケイ素、ショ糖脂肪酸エステルなどの滑沢剤;潤滑剤;結晶セルロース、メチルセルロース、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、コムギデンプン、コメデンプン、トウモロコシデンプン、バレイショデンプン、部分アルファー化デンプン、ヒドロキシプロピルスターチ、カルボキシメチルスターチナトリウム、トラガントなどの崩壊剤;大豆レシチン、ショ糖脂肪酸エステル、ステアリン酸ポリオキシル、ポリオキシエチレン硬化ヒマシ油、ポリオキシエチレンポリオキシプロピレングリコール、セスキオレイン酸ソルビタン、トリオレイン酸ソルビタン、モノステアリン酸ソルビタン、モノパルミチン酸ソルビタン、モノラウリン酸ソルビタン、ポリソルベート、モノステアリン酸グリセリン、ラウリル硫酸ナトリウム、ラウロマクロゴールなどの界面活性剤;乳化剤;リン酸ナトリウムなどの溶解補助剤;吸収促進剤;塩酸、クエン酸、クエン酸ナトリウム、酢酸、酒石酸、水酸化ナトリウム、水酸化カリウム、炭酸水素ナトリウム、炭酸ナトリウム、乳酸などのpH調整剤;天然樹脂などの光沢剤;安定化剤;酸化防止剤;保存剤;湿潤剤;着色剤;芳香剤;無痛化剤などが挙げられる。
【0072】
本発明にラカンカレクチンを点鼻用薬剤として使用する場合、液剤、ゲル状剤、エアゾール剤等の形態をとる。その担体として、オクチルドデカノール等の高級アルコール、ミリスチン酸イソプロピル等の脂肪酸エステル、懸濁化剤等を使用することができる。
【0073】
本発明にラカンカレクチンを軟膏剤やクリーム剤として使用する場合、担体として、ワセリン、流動パラフィン、スクワラン、セタノール、ステアリルアルコール等を使用することができる。
【0074】
本発明のラカンカレクチンの投与量は、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗薬等の用途、投与される患者の状態、投与方法等に依存し、当業者であれば適宜最適化することができる。
【0075】
本発明は、また、ラカンカレクチンを担持させた衛生用品を提供する。空気清浄機のフィルター、マスクのカーゼ等に、活性を保持するような形態で担持することで、空気中のウイルスと拮抗し、人体等への感染を予防する。本発明のラカンカレクチンを、衛生用品としてのスプレー剤としてもよい。
【0076】
本発明のラカンカレクチンを機能性食品として使用するために、液剤、粉末剤、顆粒剤、錠剤、カプセル剤、シロップ剤などの形態に加工される。
【0077】
本発明のラカンカレクチンは、トローチ、飴、ドロップ、ガム、茶、パン、米飯、スープ、惣菜、菓子、などの一般加工食品の製造時に原料に直接添加されてもよい。
【実施例】
【0078】
以下に、実施例及び比較例を用いて本発明をより詳細に説明する。しかし、本発明は以下の実施例に限定されるものではない。
〔実施例1〕ラカンカレクチンの製造
(1)ラカンカレクチンの製造
図1に示す精製工程に従って、ラカンカからラカンカレクチン(MGL)を単離精製した。
【0079】
(脱脂と抽出)
乾燥したラカンカの果実約34gを粉砕機で破砕し、その粉砕物をビーカーに移し、アセトン1Lを加えて攪拌した。次いで、粉砕物の混合液をろ紙でろ過して、アセトン脱脂をおこなった。ろ紙上に残った粉砕物をバットに広げ、ドラフトで一晩乾燥させた。アセトン脱脂後の乾燥させた粉砕物をビーカーに移し、10mM リン酸緩衝化生理食塩水(pH7.4)(以後PBSと略す)160mlを添加した後、スターラーで一晩攪拌(7℃)することにより、抽出をおこなった。この液を遠心分離(15,000rpm、20min、4℃)後、上清をろ過して、ラカンカ抽出液とした。
【0080】
(硫酸アンモニウムによる沈殿)
上記抽出液290mlに、51.04gの硫酸アンモニウム(溶液1Lに対し硫酸アンモニウム176gの割合)を加えた。よく攪拌し、溶解した後、4℃ 3h静置した。混合液を遠心分離(10,000rpm、20min、4℃)後、沈殿物に純水を加えて回収し、30%飽和硫酸アンモニウム沈殿画分とした。遠心分離後の30%飽和硫酸アンモニウム上清画分は次の工程で使用した。
【0081】
上記30%飽和硫酸アンモニウム上清画分に硫酸アンモニウム113.92g(溶液1Lに対し硫酸アンモニウム356gの割合)を加えた。よく攪拌し、溶解した後、4℃ 一晩静置した。混合液を遠心分離(10,000rpm、20min、4℃)後、沈殿物に純水を加えて回収し、透析膜(Spectra Pore 132 650 MWCO:6−8,000)に入れて純水に対して透析した。透析膜から回収し、30-80%飽和硫酸アンモニウム沈殿画分とした。
【0082】
(アフィニティークロマトグラフィー)
上記30-80%飽和硫酸アンモニウム沈殿画分を、PBSで平衡化したフェツイン固定化アガロースに供した。カラムをPBSで洗浄後、0.2M ラクトース/PBSと0.2Mアンモニアで溶出した。赤血球凝集活性(H.A.)を示す画分(図2の←→部)を合一し、限外ろ過で純水に置換後、凍結乾燥した。MGLのラクトース溶出画分及びアンモニア画分を、それぞれ、0.03mg及び0.3mg得た。
【0083】
(SDS−ポリアクリルアミド電気泳動)
MGLのSDS−ポリアクリルアミド電気泳動を、電気泳動装置(製品名:Phastsystem、GEヘルスケアバイオサイエンス社製)を用いて行った。以下に示すMGL及び分子量マーカーを準備し、製品プロトコール及び常法に従って電気泳動を行なった。
レーン1: 分子量マーカー(APRO社)
レーン2: MGL(ラクトース溶出画分) 還元剤(+)
レーン3: MGL(ラクトース溶出画分) 還元剤(−)
レーン4: MGL(アンモニア溶出画分) 還元剤(+)
レーン5: MGL(アンモニア溶出画分) 還元剤(−)
レーン6: 分子量マーカー(APRO社)
Gel: Gradient10−15(GEヘルスケアバイオサイエンス社製)
Sample: 1μL/Lane
Stain: 銀染色
【0084】
図3に、MGLのSDS−ポリアクリルアミド電気泳動(SDS−PAGE)の結果を示す。上記の10−15%ゲルを用いるSDS−PAGEによって、還元剤(+)ではサブユニット分子量が約60,000、還元剤(−)ではサブユニット分子量が約30,000であることを確認した。
【0085】
(赤血球凝集活性試験)
MGLに対して、表1に示す動物の赤血球を用いて、赤血球凝集活性試験を行った。結果を表1に示す。
【0086】
【表1】

【0087】
表1に示すとおり、MGLは、ウサギ及びブタの赤血球に対して凝集活性が高いが、ウシ、ウマ及びヒツジの赤血球に対して凝集活性が低いことが判明した。
【0088】
(糖結合特異性)
表2に示す種々の単糖、オリゴ糖及び多糖、並びに表3に示す糖タンパク質を用いた赤血球凝集反応阻害試験により、MGLの糖結合特異性を評価した。
【0089】
96穴U底マイクロタイタープレートに10μLの単糖、オリゴ糖、多糖及び糖タンパク質溶液の2倍希釈系列を作製した。あらかじめ力価4に調製しておいたレクチン溶液をそれぞれの穴に10μLずつ加えた。室温にて1時間静置して感作させた後、10μLの4%ウサギ赤血球懸濁液をそれぞれの穴に加え、さらに室温にて1時間静置した。その後、赤血球の凝集を完全に阻害する糖及び糖タンパク溶液の希釈倍率を肉眼にて判定した。阻害を示す最低濃度を最小阻害濃度とした。この最小阻害濃度が小さいほど、レクチンに対する親和性が高いことを示している。結果を表2及び3に示す。
【0090】
比較のために、シアル酸特異的レクチンといわれている以下の市販のレクチン:
比較例1:SNA((株)J−オイルミルズ社内調製)、
比較例2:SSA(生化学バイオビジネス(株)−(株)J−オイルミルズ製)、
比較例3:MAM(生化学バイオビジネス(株)−(株)J−オイルミルズ製)、及び
比較例4:ACG((株)J−オイルミルズ社内調製)
を用いて、上記糖結合特異性を評価した。結果を表2及び3に示す。
【0091】
【表2】

【0092】
【表3】

【0093】
表2及び3から、MGLは、6’−シアリルラクトース及び6’−シアリルラクトサミンのようなシアル酸α2−6糖鎖には結合するが、3’−シアリルラクトース及び3’−シアリルラクトサミンのようなシアル酸α2−3糖鎖には結合しなかった。また、糖タンパクでは、シアル酸が脱離したアシアロ体には結合しなかった。
【0094】
(3)ELISA法による糖タンパク質の検出
ビオチン標識化した実施例1のMGL、比較例1のSNA、比較例2のSSA、比較例3のMAM及び比較例4のACGを用いて、酵素免疫測定法による糖タンパク質の検出評価をおこなった。
【0095】
表4に示す糖タンパク質と、コントロールとして糖鎖のないタンパク質であるアルブミンを0.1M炭酸緩衝液(pH9.5)で1mg/ml溶解して、マイクロタイタープレート(Nunc439454)に添加した後、4℃で一晩静置した。0.05% Tween/PBS(以下PBS−Tと略す)で3回洗浄後、1%ウシ血清アルブミン(BSA)含有PBSをウェルに添加して、37℃で1時間培養した。PBSで3回洗浄後、1% BSA含有PBS−Tで適宜希釈したビオチン標識化レクチン溶液を、ウェルに添加して、37℃で1時間静置した。PBS−Tで3回洗浄後、1%BSA含有PBS−Tで希釈したHRP標識ストレプトアビジン溶液を、ウェルに添加して37℃で30分間培養した。PBS−Tで3回洗浄後、TMB Peroxidase substrate system (KPL社製)を添加し、遮光して室温で10分間反応させた。1Mリン酸で反応を停止し、マイクロプレートリーダー(MPR−A4i 東ソー社製)で450nmにおける吸光度を測定した。
【0096】
測定した値から反応値([450nmにおける吸光度]−[プレートに固相化せず反応させたウェル(ブランク)の値])を算出した。相対値を以下の基準で分類することにより、親和性のランク付けを行った。算出結果を表4及び図5〜8に示す。
◎:0.4以上
○:0.2以上〜0.4未満
△:0.1以上〜0.2未満
×:0〜0.1未満
【0097】
【表4】

【0098】
表4から、MGLは、イムノグロブリンM(IgM)と前立腺抗原(PSA)に強く結合した。
【技術分野】
【0001】
本発明は、羅漢果植物から得ることのできる新規なレクチン、その製造方法及び用途に関する。
【背景技術】
【0002】
シアル酸は、糖鎖の末端につく酸性糖であって、生体内で、単体の他、複合糖質の構成成分として、細胞膜表面のオリゴ糖の末端に存在する。そして、細胞表層において認識、免疫等に関係している。
【0003】
シアル酸を検出するレクチンとして、従来、日本ニワトコレクチン(SSA)、西洋ニワトコレクチン(SNA)、イヌエンジュレクチン(MAM)、ヤナギマツタケレクチン(ACG)、キカラスウリレクチン(TJA-I)等が知られている。シアル酸特異的レクチンの種類は、他の特異性を有するレクチンと比べて非常に少ない。レクチンは糖鎖研究を行う上で非常に良いプローブであるにも関わらず、充分な種類のレクチンが備わっていないのが現状である。
【0004】
シアル酸特異的レクチンが新規に見つかれば、その特性を利用して、シアル酸関連した疾患の同定等の用途が期待できる。例えば、特開2005−145837(アルツハイマー病の診断方法、特許文献1)には、ヒト由来の試料に含まれるβ−セクレターゼにより切断される分泌型シアル酸転移酵素を検出又は測定することを含む、アルツハイマー病の診断方法が記載されている。特開2006−317210(血清糖蛋白質をバイオマーカーとするアルツハイマー病の診断方法、特許文献2)には、α2,6シアル酸含有糖蛋白質を検出するためのレクチンを含む、アルツハイマー病の診断薬が記載されている。
【0005】
様々なウイルスの感染にもシアル酸が関与していることが報告されている。例えば、インフルエンザウイルスの表面に存在するヘマグルチニン(糖タンパク質)は、感染細胞(例えばヒトの気道粘膜の細胞)表面に存在する糖タンパク質のシアル酸α2−6Galを認識する性質を持ち、この結合を利用してウイルスが細胞へ感染することが知られている。インフルエンザウイルスが感染細胞から未感染細胞へ移動する際には、シアル酸α2−6結合を切る必要があるため、ウイルスは、酵素ノイラミニダーゼを細胞表面に持っている。
【0006】
シアル酸の増加されるレベルは、近年、心臓血管疾患、アルコール依存症、および糖尿病等ついて観察されており、従って、シアル酸を、このような致死的な疾患を診断および検出するためのマーカーとしての研究が進みつつある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2005−145837
【特許文献2】特開2006−317210
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の目的は、新規なシアル酸α2−6特異的レクチンとその用途を提供することにある。
【課題を解決するための手段】
【0009】
本発明者は、上記課題の解決に向けて鋭意研究したところ、羅漢果植物の抽出物から、シアル酸α2−6糖鎖との結合活性を有するレクチンを単離することに成功し、本発明を完成させた。すなわち、本発明は、羅漢果(Momordicae grosvenori)植物から抽出することができ、以下の理化学的性質:
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を示す、
(3)シアル酸α2−6糖鎖に対して親和性を有する、
を特徴とするラカンカレクチンを提供する。
【0010】
上記ラカンカレクチンは、特に、6’−シアリルラクトース又は6’−シアリルラクトサミンへの最小阻害濃度が、5μg/ml以下である。ここで、最小阻害濃度とは、糖が凝集反応を阻止するために要する最小濃度を意味する。すなわち、最小阻害濃度が小さいほど、レクチンに対する親和性が高いことを示している。
【0011】
上記ラカンカレクチンは、特に、イムノグロブリンM及び前立腺特異抗原に対して親和性を有する。
【0012】
本発明は、また、羅漢果植物の水系媒体抽出物から得ることを特徴とする、上記ラカンカレクチンの製造方法を提供する。
【0013】
本発明のラカンカレクチンの製造方法は、ラカンカの水系媒体抽出物を、硫酸アンモニウム沈殿法などのタンパク質沈殿法及びアフィニティークロマトグラフィーに供することを含むことが好ましい。
【0014】
本発明は、また、ラカンカレクチンに糖鎖を作用させることからなる、シアル酸α2−6糖鎖の検出方法を提供する。
【0015】
本発明は、また、ラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法を提供する。
【0016】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための研究用試薬又は研究用キットを提供する。
【0017】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キットを提供する。
【0018】
本発明は、また、ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤を提供する。
【0019】
本発明は、また、ラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法を提供する。
【0020】
本発明は、また、ラカンカレクチンを含む医薬組成物を提供する。
【0021】
本発明は、また、ラカンカレクチンを担持させた衛生用品を提供する。
【0022】
上記衛生用品は、シアル酸α2−6糖鎖に結合性を有する病原体を遮蔽する用途に好適である。
【0023】
前記衛生用品は、例えばマスク、空気清浄機用フィルターのいずれか一種である。
【0024】
本発明は、また、精製したラカンカレクチンを添加した食品を提供する。
【0025】
上記食品は、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗性を有する用途に好適である。上記食品は、例えばトローチ、飴、ドロップ、ガム、茶・コーヒー・ジュース等の飲料のいずれか一種の形態である。
【発明の効果】
【0026】
本発明のレクチンの原料となる「羅漢果植物」は、食品(飲料や甘味料)等で食経験があり、市場に多く流通している。天然由来の安全かつ入手の容易な原料からシアル酸α2−6糖鎖特異的レクチンを製造できる本発明は、利用価値が高い。新規なシアル酸α2−6糖鎖特異的レクチンの提供は、今後の糖鎖研究にとって非常に有意義である。また、シアル酸の研究は、様々な生体反応に関与していることから、それらの研究は、世界中で進められている。本発明のレクチンは、「シアル酸α2−6糖鎖」構造を特異的に見出すことができるので、多くの研究者の研究に使用されることが期待できる。
【0027】
また、シアル酸α2−6糖鎖特異的レクチンは、シアル酸α2−6糖鎖の検出や、シアル酸α2−6糖鎖を持つ糖タンパク質の精製に利用できる。また、シアル酸α2−6糖鎖に関与する癌や疾患の診断方法にも利用可能である。また、新規な腫瘍マーカーの探索等に応用し、腫瘍マーカーの発見につなげることができる。
【0028】
さらに、シアル酸α2−6糖鎖特異的レクチンを、インフルエンザウイルス等の病原体の感染防御方法や衛生用品にも応用できる。
【図面の簡単な説明】
【0029】
【図1】実施例1のラカンカレクチン(MGL)の精製工程を示す図である。
【図2】実施例1のMGLのアフィニティークロマトグラフィーの溶出図である。
【図3】実施例1のMGLのドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS−PAGE)の結果(図面代用写真)である。
【図4】実施例1のMGLを用いた酵素免疫測定法(ELISA)による糖タンパク質検出の結果である。
【図5】比較例1のSNAを用いたELISAによる糖タンパク質検出の結果である。
【図6】比較例2のSSAを用いたELISAによるタ糖タンパク質検出の結果である。
【図7】比較例3のMAMを用いたELISAによる糖タンパク質検出の結果である。
【図8】比較例4のACGを用いたELISAによる糖タンパク質検出の結果である。
【発明を実施するための形態】
【0030】
羅漢果(Momordicae grosvenori)は、ウリ科ラカンカ属の多年生つる植物であり、中国の桂林周辺が主な産地である。ラカンカは、甘味成分を含んでおり、食材の甘味料や羅漢果茶として用いられる。日本では、主に、乾燥品が輸入されている。
【0031】
本発明のラカンカレクチンのドデシル硫酸ナトリウム−ポリアクリルアミド電気泳動(SDS-PAGE)法によるサブユニット分子量は、分子量が20,000〜70,000であり、好ましくは20,000〜40,000である。ラカンカレクチンは、通常、2〜4個のサブユニットが結合した複合体としても存在することが予想される。そのような複合体も本発明の範囲に属する。なお、SDS−PAGEによる分子量は、例えばLaemmiの方法(Nature,227巻,680頁,1976年)に準じて測定されるものである。
【0032】
本発明のラカンカレクチンは、ウサギ、ヒト(O型、A1型、A2型、及びB型)、ブタ、ニワトリ、ガチョウ及びモルモットの赤血球に対して凝集活性を示す。特に、ウサギ及びブタの赤血球を強く凝集させる。
【0033】
本発明のラカンカレクチンは、種々の糖のうち6’−シアリルラクトース、6’−シアリルラクトサミンに親和性を有する。特に6’−シアリルラクトース又は6’−シアリルラクトサミンへの最小阻害濃度が、5μg/ml以下である。
【0034】
本発明のラカンカレクチンは、種々の糖タンパクのうち、ブタ胃ムチン、ウシ顎下腺ムチン、フェツイン、α1−酸性糖タンパク、チログロブリン、ラクトフェリン、フィブリノーゲン、イムノグロブリンA、α2−マクログロブリン、イムノグロブリンM、前立腺特異抗原に対して親和性を有する。特に、イムノグロブリンM(IgM)及び前立腺特異抗原(PSA)に対して、高い親和性を有する。
【0035】
本発明のラカンカレクチンの製造方法は、羅漢果植物の水系抽出物から公知の分離方法、精製方法等を適宜組み合わせることにより、単離することができる。原料の羅漢果の使用部位は、種子や果実である。これらは、生でも乾燥物でもよい。
【0036】
羅漢果植物と水系媒体とから水系媒体抽出物を得る方法については、水系媒体と羅漢果の果実とを接触させることができれば特に制限はない。抽出効率の観点から、水系媒体中で羅漢果の乾燥物を粉砕して懸濁液とする方法が好ましい。また、粉砕方法としては、ミキサー、ホモジナイザー、ブレンダー、(超)音波装置、加圧型破壊装置、らい潰器具等の汎用の器具や機器を使用した粉砕方法を挙げることができる。
【0037】
前記水系媒体としては、水、緩衝液、水と混合し得る有機溶媒と水又は緩衝液との混合物等を挙げることができる。好ましくは、緩衝液又は有機溶媒と緩衝液との混合物を用いる。上記緩衝液としては、特に制限されることなく公知の緩衝液を用いることができる。中でも、pH3〜10の範囲に緩衝能を有するものが好ましく、pH6〜8の範囲に緩衝能を有するものがより好ましい。具体的には、リン酸緩衝液、クエン酸緩衝液、酢酸緩衝液、トリス緩衝液等を挙げることができる。中でも、抽出効率の観点から、リン酸緩衝液が好ましい。前記緩衝液の塩濃度は、特に制限はないが、抽出効率と緩衝能の点から、1〜100mMであることが好ましく、5〜20mMであることがより好ましい。
【0038】
前記緩衝液は、さらに塩類を含むことができる。例えば、リン酸緩衝液に食塩を更に加えたリン酸緩衝化生理食塩水等は、本発明における水系媒体として好ましい。
【0039】
前記有機溶媒としては、水と混合し得る有機溶媒であれば特に制限なく用いることができる。中でも、アセトン、メタノール、エタノール、n-ブタノール、2−プロパノール及びアセトニトリルが好ましい。有機溶媒と水又は緩衝液とを混合する場合の有機溶媒の含有量としては、5〜50質量%であることが好ましい。
【0040】
前記抽出工程は、水系媒体と羅漢果植物との混合物から、水系媒体に対する不溶物を除去する工程を更に含むことが好ましい。不溶物の除去方法としては、濾過、遠心分離等の方法を挙げることができるが、除去効率の観点から遠心分離が好ましい。
【0041】
前記抽出工程は、リン酸緩衝化生理食塩水中(PBS)で、ラカンカを破砕し、遠心分離によって不溶物を除去して水系媒体抽出物を得る工程であることが好ましい。または、作業効率の観点から、ラカンカを粉砕し、リン酸緩衝化生理食塩水を添加し、よく攪拌し、遠心分離によって不溶物を除去して水系媒体抽出物を得る工程であってもよい。
【0042】
前記ラカンカレクチンの製造方法では、以下の精製手段を採用すると、一層効率的な精製が可能となる。
【0043】
上記工程によって得られた水系媒体抽出物を、硫酸アンモニウム沈殿法によりレクチン含有画分を得て、得られたレクチン画分を、さらにアフィニティークロマトグラフィーで精製する。
【0044】
タンパク質の沈殿方法は上記硫酸アンモニウム沈殿法に限らず、硫酸アンモニウム沈殿(塩析)、トリクロロ酢酸(TCA)沈殿、アセトン沈殿、エタノール沈殿、TCA/アセトン沈殿、酢酸アンモニウム含有メタノールによる沈殿(フェノール抽出前処理)、Clean−Up Kitによる沈殿等、通常の方法を挙げることができる。
【0045】
アフィニティークロマトグラフィーでは、シアル酸2−6を有する糖や糖タンパクを固定したカラムを使用する。例えば、シアリルラクトース、フェツイン、チログロブリンをアガロースゲルに固定化したカラムを使用する。溶出液には、ラクトース、シアリルラクトース、アンモニアや酢酸を使用する。溶出された分画のうち、例えばウサギ赤血球凝集活性画分を採取する。
【0046】
本発明の製造方法は、前記精製工程で得られたレクチンを含む画分を透析する工程、透析処理後のレクチン溶液を限外ろ過等で濃縮する工程、及び濃縮液を凍結乾燥する工程を含んでもよい。これにより、レクチンを容易に単離することができる。透析、濃縮、凍結乾燥は、通常用いられる公知の方法によって行うことができる。上記製造方法により、SDS−PAGEによるサブユニット分子量が20,000〜70,000のレクチンを得る。
【0047】
本発明は、また、前記ラカンカレクチンを用いたシアル酸α2−6糖鎖の検出方法を提供する。前記ラカンカレクチンは、シアル酸α2−6糖鎖を従来よりも特異的に認識して結合できることから、シアル酸α2−6を含有する多糖類、糖脂質、糖タンパク質等の糖鎖化合物の特異的検出に好適である。
【0048】
また、本発明のラカンカレクチンは、シアロ体(例えば6’−シアリルラクトース、6’−シアリルラクトサミン)への阻害濃度とアシアロ体(例えばラクトース)の最小阻害濃度の比が、通常10倍以上、好ましくは50倍以上、特に好ましくは100倍以上である。したがって、本発明のラカンカレクチンは、シアロ体の検出のみならず、疾患等によってシアル酸が脱離もまた鋭敏に検出することができる。
【0049】
また、本発明のラカンカレクチンは、シアル酸α2−6型(例えば6’−シアリルラクトース、6’−シアリルラクトサミン)の阻害濃度とシアル酸α2−3型(例えば3’−シアリルラクトース、3’−シアリルラクトサミン)の最小阻害濃度の比が、通常10倍以上、好ましくは50倍以上、特に好ましくは200倍以上である。したがって、本発明のラカンカレクチンは、シアル酸の結合様式の違いもまた検出することができる。
【0050】
前記検出方法に用いる前記ラカンカレクチンには、標識手段が組み込まれていてもよい。このようなレクチンを以下、標識レクチンということがある。本発明の標識レクチンは、ラカンカレクチンと標識手段とを少なくとも含み、検出可能に標識化されていることを特徴とする。
【0051】
前記標識手段としては、特に制限なく公知の標識化方法を適用することができ、例えば、放射性同位元素による標識化、標識化合物の結合等を挙げることができる。
【0052】
前記標識化合物としては、この用途に通常用いられるものであれば特に制限なく適用することができ、例えば、直接又は間接標識化合物、酵素、蛍光化合物等を挙げることができる。具体的には、ビオチン、ジゴキシゲニン、西洋ワサビ由来ペルオキシダーゼ、フルオレセインイソチオシアネート、CyDye等を挙げることができる。これらの標識化合物は、常法によりレクチンと結合することができる。特に、アビジン−ビオチン又はストレプトアビジン−ビオチン系は、感度が高い点で好ましい。
【0053】
シアル酸α2−6糖鎖の検出又は分別は、例えば固定化された前記ラカンカレクチンを用いるレクチンクロマトグラフィーによって行うことができる。レクチンクロマトグラフィーは、レクチンが糖鎖と特異的に結合する性質を利用したアフィニティークロマトグラフィーである。HPLCと組み合わせる(HPLAC)と、ハイスループットを期待することができる。
【0054】
ラカンカレクチンを固定化する担体としては、アガロース、デキストラン、セルロース、スターチ、ポリアクリルアミド等のゲル材が一般的である。これらには、市販のものを特に制限なく使用でき、例えばセファロース4Bやセファロース6B(共にGEヘルスケアバイオサイエンス社製)が挙げられる。
【0055】
レクチンクロマトグラフィーに用いる材料としては、マイクロプレートやナノウエルにレクチンを固定化したものも含まれる。
【0056】
固定化するラカンカレクチンの濃度は、通常、0.001〜100mg/ml、好ましくは0.01〜20mg/mlである。担体がアガロースゲルの場合、それをCNBr等で活性化してからレクチンとカップリングさせる。活性化スペーサーを導入したゲルにレクチンを固定化してもよい。さらには、ホルミル基を導入したゲルにレクチンを固定化してからNaCNBH3で還元してもよい。また、NHS−セファロース(GEヘルスケアバイオサイエンス社製)のような市販の活性化ゲルを使用してもよい。
【0057】
シアル酸α2−6糖鎖の存在が疑われる試料をカラムにかけた後、洗浄と平衡化の目的で緩衝液を流す。緩衝液の一例は、モル濃度が5〜500mM、好ましくは10〜500mMであり、pHが4.0〜10.0、好ましくは6.0〜9.0であり、NaCl含量が0〜0.5M、好ましくは0.1〜0.2Mであり、CaCl2、MgCl2、又は、MnCl2含量が0〜10mM、好ましくは0〜5mMの緩衝液である。
【0058】
アフィニティーカラムの洗浄後、シアル酸α2−6糖鎖の溶出は、該糖鎖を有効に溶出できる中性の非変性緩衝液中で、塩化ナトリウム、ハプテン糖等の脱着剤を用いて行われる。この緩衝液は、上記と同様であってもよい。脱着剤の濃度は、好ましくは、1〜400mM、特に好ましくは10〜200mM濃度である。
【0059】
糖鎖の検出には、上記以外のクロマトグラフィー、酵素免疫測定法(ELISA)、ウェスタンブロット、レクチンチップ、レクチン染色、免疫沈降、凝集法、表面プラズモン共鳴法、電気泳動等も当業者に周知の方法で使用することができる。
【0060】
前記糖鎖を含む検体は、特に限定されない。例えば、血液、血漿、血清、涙、唾液、体液、乳汁、尿、細胞の培養上清、形質転換動物からの分泌物等が挙げられる。
【0061】
前記検出方法の対象であるシアル酸α2−6糖鎖を有する物質の具体例は、6’−シアリルラクトース、6’−シアリルラクトサミン、イムノグロブリンM(IgM)、前立腺特異抗原(PSA)等が挙げられる。検出方法に作用させる糖鎖は、腫瘍マーカーが好ましい。
【0062】
本発明の検出方法の対象は、好ましくは、シアル酸α2−6糖鎖の関与が指摘される疾患である。具体例としては、アルツハイマー病、心臓血管疾患、アルコール依存症、IgA腎症、肝臓癌、前立腺がん、卵巣がん、心筋梗塞、繊維症、膵炎および糖尿病等が挙げられる。
【0063】
前記ラカンカレクチンは、物理化学的性質、糖鎖への結合特異性等の生化学的性質が従来公知のレクチンと異なる新規のレクチンである。特にシアル酸α2−6糖鎖を特異的に認識することから、シアル酸α2−6糖鎖に起因する疾患の診断薬や検査試薬、シアル酸α2−6糖鎖の分離分析用特異的結合剤、免疫調節剤等として用いることができる。したがって、本発明は、前記ラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キット、並びにラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤を提供する。
【0064】
前記診断薬又は診断薬キットは、例えばアルツハイマー病、心臓血管疾患、アルコール依存症、IgA腎症、肝臓癌、前立腺がん、卵巣がん、心筋梗塞、繊維症、膵炎および糖尿病等を診断するのに有用である。
【0065】
上記診断薬又は診断薬キットには、適宜、標識体、酵素とその発色基質、放射性同位元素、発光物質、蛍光物質、着色物質、緩衝液、標準タンパク、反応停止液、プレート等の通常診断薬キットに使われるに公知のものを含む。
【0066】
本発明は、また、前記ラカンカレクチンをシアル酸α2−6糖鎖の結合媒体として用いて、シアル酸α2−6糖鎖と非シアル酸α2−6糖鎖とを分別することからなる、シアル酸α2−6糖鎖の分別方法を提供する。
【0067】
本発明の分別方法は、例えば固定化された前記ラカンカレクチンを用いるレクチンクロマトグラフィーである。その詳細は、前記検出方法で説明したものと同様である。シアル酸α2−6糖鎖の精製を行なう場合、ラカンカレクチンを、アガロースやセルロースからなるカラム担体に官能基を介して共有結合させて親和性カラムを調製し、糖鎖試料を通す。通塔後、吸着したシアル酸α2−6糖鎖を回収する。非シアル酸α2−6糖鎖の精製を行う場合には、上記カラムに糖鎖試料を通塔する際、吸着しないで通過する糖鎖試料を回収する。
【0068】
本発明の分別方法により精製される対象は、シアル酸α2−6糖鎖、非シアル酸α2−6糖鎖の二種類があり得る。
【0069】
本発明は、ラカンカレクチンを含む、シアル酸α2−6糖鎖に起因する疾患を予防・治療するための医薬組成物を提供する。医薬の用途としては、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗薬、感染阻害剤、予防薬、漢方薬、伝承薬が挙げられる。シアル酸α2−6糖鎖に結合性を有する病原体には、ウインフルエンザウィルスやアデノウイルスが挙げられる。例えば、これらのウイルスとラカンカレクチンとが人の喉や鼻の粘膜に拮抗的に働き、ウイルスの進入を防ぐ。
【0070】
本発明のラカンカレクチンを、経口医薬として使用するために、液剤、粉末剤、顆粒剤、錠剤、カプセル剤、シロップ剤などの形態に加工される。
【0071】
本発明の医薬組成物は、薬理学上使用可能な担体、賦形剤、助剤等を本発明の効果を阻害しない範囲で添加することができる。具体的には、乳糖、ショ糖、果糖、ブドウ糖、ブドウ糖水和物、白糖、精製白糖、エリスリトール、キシリトール、ソルビトール、マンニトール、パラチノース、還元パラチノース、粉末還元麦芽糖、水アメ、カルメロース、デキストリン、トウモロコシデンプン、アルファー化デンプン、部分アルファー化デンプン、バレイショデンプン、コーンスターチ、ヒドロキシプロピルスターチ、アミノ酸、カオリン、無水ケイ酸、ケイ酸、ケイ酸アルミニウム、重炭酸ナトリウム、リン酸カルシウム、リン酸二水素カルシウム、炭酸カルシウム、酸化マグネシウム、水酸化アルミニウム、脂肪酸又はその塩、脂肪酸モノグリセリド及びジグリセリド、アルコール、植物油、オリーブ油、ダイズ油、トウモロコシ油、脂肪油、油脂、粘性パラフィン、プロピレングリコール、エチレングリコール、ポリエチレングリコール、グリセリンなどの担体又は賦形剤;結晶セルロース、結晶セルロース・カルメロースナトリウム、メチルセルロース、ヒドロキシプロピルセルロース、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシプロピルメチルセルロースアセテートサクシネート、カルメロースナトリウム、エチルセルロース、カルボキシメチルエチルセルロース、ヒドロキシエチルセルロース、コムギデンプン、コメデンプン、トウモロコシデンプン、バレイショデンプン、アルファー化デンプン、部分アルファー化デンプン、ヒドロキシプロピルスターチ、デキストリン、プルラン、ポリビニルピロリドン、アミノアルキルメタクリレートコポリマーE、アミノアルキルメタクリレートコポリマーRS、メタクリル酸コポリマーL、メタクリル酸コポリマー、ポリビニルアセタールジエチルアミノアセテート、ポリビニルアルコール、アラビアゴム、アラビアゴム末、寒天、ゼラチン、白色セラック、トラガント、マクロゴールなどの結合剤;コムギデンプン、コメデンプン、トウモロコシデンプン、合成ケイ酸アルミニウム、乾燥水酸化アルミニウムゲル、メタケイ酸アルミン酸マグネシウム、リン酸水素カルシウム、無水リン酸水素カルシウム、ロウ類、水素添加植物油、ポリエチレングリコール、軽質無水ケイ酸、合成ケイ酸アルミニウム、ステアリン酸、マクロゴール、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、含水二酸化ケイ素、ショ糖脂肪酸エステルなどの滑沢剤;潤滑剤;結晶セルロース、メチルセルロース、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、クロスカルメロースナトリウム、コムギデンプン、コメデンプン、トウモロコシデンプン、バレイショデンプン、部分アルファー化デンプン、ヒドロキシプロピルスターチ、カルボキシメチルスターチナトリウム、トラガントなどの崩壊剤;大豆レシチン、ショ糖脂肪酸エステル、ステアリン酸ポリオキシル、ポリオキシエチレン硬化ヒマシ油、ポリオキシエチレンポリオキシプロピレングリコール、セスキオレイン酸ソルビタン、トリオレイン酸ソルビタン、モノステアリン酸ソルビタン、モノパルミチン酸ソルビタン、モノラウリン酸ソルビタン、ポリソルベート、モノステアリン酸グリセリン、ラウリル硫酸ナトリウム、ラウロマクロゴールなどの界面活性剤;乳化剤;リン酸ナトリウムなどの溶解補助剤;吸収促進剤;塩酸、クエン酸、クエン酸ナトリウム、酢酸、酒石酸、水酸化ナトリウム、水酸化カリウム、炭酸水素ナトリウム、炭酸ナトリウム、乳酸などのpH調整剤;天然樹脂などの光沢剤;安定化剤;酸化防止剤;保存剤;湿潤剤;着色剤;芳香剤;無痛化剤などが挙げられる。
【0072】
本発明にラカンカレクチンを点鼻用薬剤として使用する場合、液剤、ゲル状剤、エアゾール剤等の形態をとる。その担体として、オクチルドデカノール等の高級アルコール、ミリスチン酸イソプロピル等の脂肪酸エステル、懸濁化剤等を使用することができる。
【0073】
本発明にラカンカレクチンを軟膏剤やクリーム剤として使用する場合、担体として、ワセリン、流動パラフィン、スクワラン、セタノール、ステアリルアルコール等を使用することができる。
【0074】
本発明のラカンカレクチンの投与量は、シアル酸α2−6糖鎖に結合性を有する病原体の拮抗薬等の用途、投与される患者の状態、投与方法等に依存し、当業者であれば適宜最適化することができる。
【0075】
本発明は、また、ラカンカレクチンを担持させた衛生用品を提供する。空気清浄機のフィルター、マスクのカーゼ等に、活性を保持するような形態で担持することで、空気中のウイルスと拮抗し、人体等への感染を予防する。本発明のラカンカレクチンを、衛生用品としてのスプレー剤としてもよい。
【0076】
本発明のラカンカレクチンを機能性食品として使用するために、液剤、粉末剤、顆粒剤、錠剤、カプセル剤、シロップ剤などの形態に加工される。
【0077】
本発明のラカンカレクチンは、トローチ、飴、ドロップ、ガム、茶、パン、米飯、スープ、惣菜、菓子、などの一般加工食品の製造時に原料に直接添加されてもよい。
【実施例】
【0078】
以下に、実施例及び比較例を用いて本発明をより詳細に説明する。しかし、本発明は以下の実施例に限定されるものではない。
〔実施例1〕ラカンカレクチンの製造
(1)ラカンカレクチンの製造
図1に示す精製工程に従って、ラカンカからラカンカレクチン(MGL)を単離精製した。
【0079】
(脱脂と抽出)
乾燥したラカンカの果実約34gを粉砕機で破砕し、その粉砕物をビーカーに移し、アセトン1Lを加えて攪拌した。次いで、粉砕物の混合液をろ紙でろ過して、アセトン脱脂をおこなった。ろ紙上に残った粉砕物をバットに広げ、ドラフトで一晩乾燥させた。アセトン脱脂後の乾燥させた粉砕物をビーカーに移し、10mM リン酸緩衝化生理食塩水(pH7.4)(以後PBSと略す)160mlを添加した後、スターラーで一晩攪拌(7℃)することにより、抽出をおこなった。この液を遠心分離(15,000rpm、20min、4℃)後、上清をろ過して、ラカンカ抽出液とした。
【0080】
(硫酸アンモニウムによる沈殿)
上記抽出液290mlに、51.04gの硫酸アンモニウム(溶液1Lに対し硫酸アンモニウム176gの割合)を加えた。よく攪拌し、溶解した後、4℃ 3h静置した。混合液を遠心分離(10,000rpm、20min、4℃)後、沈殿物に純水を加えて回収し、30%飽和硫酸アンモニウム沈殿画分とした。遠心分離後の30%飽和硫酸アンモニウム上清画分は次の工程で使用した。
【0081】
上記30%飽和硫酸アンモニウム上清画分に硫酸アンモニウム113.92g(溶液1Lに対し硫酸アンモニウム356gの割合)を加えた。よく攪拌し、溶解した後、4℃ 一晩静置した。混合液を遠心分離(10,000rpm、20min、4℃)後、沈殿物に純水を加えて回収し、透析膜(Spectra Pore 132 650 MWCO:6−8,000)に入れて純水に対して透析した。透析膜から回収し、30-80%飽和硫酸アンモニウム沈殿画分とした。
【0082】
(アフィニティークロマトグラフィー)
上記30-80%飽和硫酸アンモニウム沈殿画分を、PBSで平衡化したフェツイン固定化アガロースに供した。カラムをPBSで洗浄後、0.2M ラクトース/PBSと0.2Mアンモニアで溶出した。赤血球凝集活性(H.A.)を示す画分(図2の←→部)を合一し、限外ろ過で純水に置換後、凍結乾燥した。MGLのラクトース溶出画分及びアンモニア画分を、それぞれ、0.03mg及び0.3mg得た。
【0083】
(SDS−ポリアクリルアミド電気泳動)
MGLのSDS−ポリアクリルアミド電気泳動を、電気泳動装置(製品名:Phastsystem、GEヘルスケアバイオサイエンス社製)を用いて行った。以下に示すMGL及び分子量マーカーを準備し、製品プロトコール及び常法に従って電気泳動を行なった。
レーン1: 分子量マーカー(APRO社)
レーン2: MGL(ラクトース溶出画分) 還元剤(+)
レーン3: MGL(ラクトース溶出画分) 還元剤(−)
レーン4: MGL(アンモニア溶出画分) 還元剤(+)
レーン5: MGL(アンモニア溶出画分) 還元剤(−)
レーン6: 分子量マーカー(APRO社)
Gel: Gradient10−15(GEヘルスケアバイオサイエンス社製)
Sample: 1μL/Lane
Stain: 銀染色
【0084】
図3に、MGLのSDS−ポリアクリルアミド電気泳動(SDS−PAGE)の結果を示す。上記の10−15%ゲルを用いるSDS−PAGEによって、還元剤(+)ではサブユニット分子量が約60,000、還元剤(−)ではサブユニット分子量が約30,000であることを確認した。
【0085】
(赤血球凝集活性試験)
MGLに対して、表1に示す動物の赤血球を用いて、赤血球凝集活性試験を行った。結果を表1に示す。
【0086】
【表1】

【0087】
表1に示すとおり、MGLは、ウサギ及びブタの赤血球に対して凝集活性が高いが、ウシ、ウマ及びヒツジの赤血球に対して凝集活性が低いことが判明した。
【0088】
(糖結合特異性)
表2に示す種々の単糖、オリゴ糖及び多糖、並びに表3に示す糖タンパク質を用いた赤血球凝集反応阻害試験により、MGLの糖結合特異性を評価した。
【0089】
96穴U底マイクロタイタープレートに10μLの単糖、オリゴ糖、多糖及び糖タンパク質溶液の2倍希釈系列を作製した。あらかじめ力価4に調製しておいたレクチン溶液をそれぞれの穴に10μLずつ加えた。室温にて1時間静置して感作させた後、10μLの4%ウサギ赤血球懸濁液をそれぞれの穴に加え、さらに室温にて1時間静置した。その後、赤血球の凝集を完全に阻害する糖及び糖タンパク溶液の希釈倍率を肉眼にて判定した。阻害を示す最低濃度を最小阻害濃度とした。この最小阻害濃度が小さいほど、レクチンに対する親和性が高いことを示している。結果を表2及び3に示す。
【0090】
比較のために、シアル酸特異的レクチンといわれている以下の市販のレクチン:
比較例1:SNA((株)J−オイルミルズ社内調製)、
比較例2:SSA(生化学バイオビジネス(株)−(株)J−オイルミルズ製)、
比較例3:MAM(生化学バイオビジネス(株)−(株)J−オイルミルズ製)、及び
比較例4:ACG((株)J−オイルミルズ社内調製)
を用いて、上記糖結合特異性を評価した。結果を表2及び3に示す。
【0091】
【表2】

【0092】
【表3】

【0093】
表2及び3から、MGLは、6’−シアリルラクトース及び6’−シアリルラクトサミンのようなシアル酸α2−6糖鎖には結合するが、3’−シアリルラクトース及び3’−シアリルラクトサミンのようなシアル酸α2−3糖鎖には結合しなかった。また、糖タンパクでは、シアル酸が脱離したアシアロ体には結合しなかった。
【0094】
(3)ELISA法による糖タンパク質の検出
ビオチン標識化した実施例1のMGL、比較例1のSNA、比較例2のSSA、比較例3のMAM及び比較例4のACGを用いて、酵素免疫測定法による糖タンパク質の検出評価をおこなった。
【0095】
表4に示す糖タンパク質と、コントロールとして糖鎖のないタンパク質であるアルブミンを0.1M炭酸緩衝液(pH9.5)で1mg/ml溶解して、マイクロタイタープレート(Nunc439454)に添加した後、4℃で一晩静置した。0.05% Tween/PBS(以下PBS−Tと略す)で3回洗浄後、1%ウシ血清アルブミン(BSA)含有PBSをウェルに添加して、37℃で1時間培養した。PBSで3回洗浄後、1% BSA含有PBS−Tで適宜希釈したビオチン標識化レクチン溶液を、ウェルに添加して、37℃で1時間静置した。PBS−Tで3回洗浄後、1%BSA含有PBS−Tで希釈したHRP標識ストレプトアビジン溶液を、ウェルに添加して37℃で30分間培養した。PBS−Tで3回洗浄後、TMB Peroxidase substrate system (KPL社製)を添加し、遮光して室温で10分間反応させた。1Mリン酸で反応を停止し、マイクロプレートリーダー(MPR−A4i 東ソー社製)で450nmにおける吸光度を測定した。
【0096】
測定した値から反応値([450nmにおける吸光度]−[プレートに固相化せず反応させたウェル(ブランク)の値])を算出した。相対値を以下の基準で分類することにより、親和性のランク付けを行った。算出結果を表4及び図5〜8に示す。
◎:0.4以上
○:0.2以上〜0.4未満
△:0.1以上〜0.2未満
×:0〜0.1未満
【0097】
【表4】

【0098】
表4から、MGLは、イムノグロブリンM(IgM)と前立腺抗原(PSA)に強く結合した。
【特許請求の範囲】
【請求項1】
羅漢果(Momordicae grosvenori)植物より抽出することができ、以下の理化学的性質:
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を有する、
(3)シアル酸α2−6糖鎖に対して親和性を有する
を特徴とするラカンカレクチン。
【請求項2】
6’−シアリルラクトース及び6’−シアリルラクトサミンに対して、糖結合特異性を有することを特徴とする、請求項1に記載のラカンカレクチン。
【請求項3】
イムノグロブリンM及び前立腺特異抗原に対して糖結合特異性を有することを特徴とする、請求項1又は2に記載のラカンカレクチン。
【請求項4】
請求項1〜3のいずれか一項に記載のラカンカレクチンの製造方法であって、羅漢果植物の水系媒体抽出物から採取することを特徴とする、ラカンカレクチンの製造方法。
【請求項5】
前記水系媒体抽出物を、硫酸アンモニウム沈殿及びアフィニティークロマトグラフィーにかけることを含む、請求項4に記載のラカンカカレクチンの製造方法。
【請求項6】
請求項1〜3のいずれか一項に記載のラカンカレクチンに糖鎖を作用させることからなる、シアル酸α2−6糖鎖の検出方法。
【請求項7】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための研究用試薬又は研究用判定キット。
【請求項8】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キット。
【請求項9】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤。
【請求項10】
請求項1〜3のいずれか一項に記載のラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法。
【請求項1】
羅漢果(Momordicae grosvenori)植物より抽出することができ、以下の理化学的性質:
(1)SDS−ポリアクリルアミド電気泳動法によるサブユニット分子量が20,000〜70,000である、
(2)ウサギ及びブタの赤血球に対して強い凝集活性を有する、
(3)シアル酸α2−6糖鎖に対して親和性を有する
を特徴とするラカンカレクチン。
【請求項2】
6’−シアリルラクトース及び6’−シアリルラクトサミンに対して、糖結合特異性を有することを特徴とする、請求項1に記載のラカンカレクチン。
【請求項3】
イムノグロブリンM及び前立腺特異抗原に対して糖結合特異性を有することを特徴とする、請求項1又は2に記載のラカンカレクチン。
【請求項4】
請求項1〜3のいずれか一項に記載のラカンカレクチンの製造方法であって、羅漢果植物の水系媒体抽出物から採取することを特徴とする、ラカンカレクチンの製造方法。
【請求項5】
前記水系媒体抽出物を、硫酸アンモニウム沈殿及びアフィニティークロマトグラフィーにかけることを含む、請求項4に記載のラカンカカレクチンの製造方法。
【請求項6】
請求項1〜3のいずれか一項に記載のラカンカレクチンに糖鎖を作用させることからなる、シアル酸α2−6糖鎖の検出方法。
【請求項7】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための研究用試薬又は研究用判定キット。
【請求項8】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖を検出するための診断薬又は診断薬キット。
【請求項9】
請求項1〜3のいずれか一項に記載のラカンカレクチンを有効成分とする、シアル酸α2−6糖鎖に対する特異的結合剤。
【請求項10】
請求項1〜3のいずれか一項に記載のラカンカレクチンを作用させることを特徴とする、シアル酸α2−6糖鎖の分別方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−219064(P2012−219064A)
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願番号】特願2011−86915(P2011−86915)
【出願日】平成23年4月11日(2011.4.11)
【出願人】(302042678)株式会社J−オイルミルズ (75)
【Fターム(参考)】
【公開日】平成24年11月12日(2012.11.12)
【国際特許分類】
【出願日】平成23年4月11日(2011.4.11)
【出願人】(302042678)株式会社J−オイルミルズ (75)
【Fターム(参考)】
[ Back to top ]

