ラクダ科動物の変異VHH抗体及びその製造法
【課題】ジスルフィド結合の形成を阻止し、かつ活性を有するVHH抗体及びその製造法を
提供する。
【解決手段】分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH
抗体)において、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソ
ロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
提供する。
【解決手段】分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH
抗体)において、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソ
ロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ラクダ科動物の変異VHH抗体及びその製造法に関する。
【背景技術】
【0002】
偶蹄目、ラクダ科動物(フタコブラクダ、ヒトコブラクダ、ラマ)の血清中には軽鎖を持たない特殊な抗体(VHH抗体)があることが知られている。この抗体の可変領域はVHHと呼ばれ、抗原に結合できる免疫グロブリンフラグメントとしては最も低分子量である。そのため、生産の簡便性、取り扱いの容易さなどで、その利用を目指した研究が活発に進められている。とりわけ生理的構造の形成(フォールディング)と再生(リフォールディング)の容易性がVHH抗体の大きな特徴となっている。この性質を活かして、従来は困難で
あった機能的な組み換え抗体の原核生物(大腸菌)での大量生産が可能になると期待されている。
【0003】
VHH抗体について問題となるのが、分子内のジスルフィド結合である。ジスルフィド結
合は抗体の機能構造の安定化に重要であり、2つのシステイン残基のSH基が酸化的に共有結合して形成される。大腸菌を用いた組換え抗体の生産では、ジスルフィド結合の酸化的再生のための工程が要求され、かつ本来は分子内の結合が分子間で形成されて会合を引き起こす等の問題を生じることもある。
【0004】
現在までの抗体のジスルフィド結合を置換する研究はヒトやマウスの抗体、つまり通常の軽鎖と重鎖よりなるコンベンショナルな抗体を対象にしたものに限られており、その結果から特異なラクダ科動物のVHHのジスルフィド結合を置換する最適なペアを予測するこ
とは出来ない。変異鎖についてはマウスで研究が行われ、システインを置換して、抗原への結合活性を維持したアミノ酸ペアはN末端側バリン、C末端側アラニン(V/A)が報告さ
れているのみである(特許文献1,2)。
【0005】
しかしこのアミノ酸ペア(V/A)についてはヒトの抗体軽鎖、定常鎖であるヒトのCLフ
ラグメントの場合には安定性が低く、ジスルフィド結合を置換するに適切ではないことが明らかとなっている(本発明者により2004年Protein Society Meetingにて報告)。
【0006】
上記CLフラグメント、及び抗体と同じ高次構造(免疫グロブリンフォールド)を持つヒトβ2ミクログロブリンではA/Aの安定性が低く、V/Vの安定性が高い。(本発明者により2004年Protein Society Meetingにて報告)。本発明のVHHでは上記のCLフラグメントやβ2ミクログロブリンとは違い、A/Aの安定性が高く、逆にV/Vが低くなっている。このように、抗体のドメインのジスルフィド結合を置換するペアは、動物種やそのドメインが含まれるタンパク質によって異なり、一概に、予測できるものではなく、実験的な検証によってはじめて明らかになるものである。
【特許文献1】Worn, A. and A. Pluckthun, An intrinsically stable antibody scFv fragment can tolerate the loss of both disulfide bonds and fold correctly. FEBS Lett, 1998. 427(3): p. 357-361.
【特許文献2】Proba, K., A. Worn, A. Honegger, and A. Pluckthun, Antibody scFv fragments without disulfide bonds made by molecular evolution. J Mol Biol, 1998. 275(2): p. 245-253.
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、ジスルフィド結合の形成を阻止し、かつ活性を有するVHH抗体及びその製造
法を提供することを目的とする。
【課題を解決するための手段】
【0008】
そこで本発明者は、生産工程の短縮、及び会合の問題を回避するため、ラクダ科動物のVHH抗体について機能的構造、つまり常温で抗原に結合する活性を維持したままジスルフ
ィド結合の代わりとなるアミノ酸ペアを見出し、本発明を完成した。
【0009】
本発明は、以下のラクダ科動物の変異VHH抗体及びその製造法に関する。
1. 分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)
において、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシ
ン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
2. ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる項1に記載の抗体変異体。3. 2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/S
で置換した項1または2に記載の変異VHH抗体。
4. 分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)
において、該結合を構成する2つのシステイン残基を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン
、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換することを特徴とする、ラクダ科
動物の変異VHH抗体の製造法。
5. ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる項4に記載の製造法。
6. 2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/S
で置換することを特徴とする、項4または5に記載の変異VHH抗体。
【発明の効果】
【0010】
本発明によれば、重鎖のみからなるラクダ科動物のVHH抗体のシステイン残基の1種または2種を他の特定のアミノ酸で置換することにより、抗原を結合する性質を実質的に損なうことなく、分子間のジスルフィド結合の形成を抑制することができ、抗体の製造効率を向上させることができる。
【発明を実施するための最良の形態】
【0011】
本明細書において、ラクダ科動物としては、フタコブラクダ、ヒトコブラクダ、ラマ、アルパカ、ビクーナ、グアノコが挙げられ、好ましくはヒトコブラクダ、ラマが挙げられる。
【0012】
本発明で使用されるラクダ科抗体(VHH抗体)は、軽鎖を有さず、重鎖のみから構成される抗体であり、重鎖は、可変領域を有する限り、不変領域の一部を欠失または置換した抗体またはそのフラグメントであってもよい。
【0013】
本発明で置換の対象となるジスルフィド結合は、VHH抗体の可変領域に存在するため、
そのアミノ酸を変異することにより、抗原結合能に大きく影響すると考えられる。
【0014】
本発明者は、ラクダ科VHH抗体について種々のアミノ酸置換を行ったところ、V/Vでは抗原結合能の大きな低下が見られたが、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/A、A/Lについては十分な抗原結合活性を保持し、特にW/A、A/A、W/P、A/V、W/G、A/I、G/V、A/Sについては、ジスルフィド結合を有する天然型
VHH抗体と同程度の抗原結合能を保持することを確認した。
【0015】
抗体のシスティン残基を他の残基に置換する方法としては、例えばサイトスペシフィック・ミュータゲネシス〔Methods in Enzymology, 154, 350, 367-382 (1987);同 100, 468 (1983);Nucleic Acids Res., 12, 9441 (1984);続生化学実験講座1「遺伝子研究法II」、日本生化学会編, p105 (1986)〕などの遺伝子工学的手法、リン酸トリエステル法
やリン酸アミダイト法などの化学合成手段〔J. Am. Chem. Soc., 89, 4801 (1967);同 91, 3350 (1969);Science, 150, 178 (1968);Tetrahedron Lett., 22, 1859 (1981);同
24, 245 (1983)〕およびそれらの組合せ方法などが例示できる。より具体的には、DN
Aの合成は、ホスホルアミダイト法またはトリエステル法による化学合成によることもでき、市販されている自動オリゴヌクレオチド合成装置上で行うこともできる。二本鎖断片は、相補鎖を合成し、適当な条件下で該鎖を共にアニーリングさせるか、または適当なプライマー配列と共にDNAポリメラーゼを用い相補鎖を付加するかによって、化学合成した一本鎖生成物から得ることもできる。
【0016】
ジスルフィド残基を置換するアミノ酸ペアの表記に関し、「A/V」とは、N末端に近いシステインがアラニン(A)で置換され、C末端に近いシステインがバリン(V)で置換されたこ
とを意味する。
【実施例】
【0017】
以下、本発明を実施例に基づいてより詳細に説明する。
実施例1
ラマVHH:
本実施例で用いたラマVHHはヒト絨毛性ゴナドトロピン(hCG)のαサブユニットを抗原とするものである。Protein Data Bankの1G9Eのアミノ酸配列(配列番号1)をもとに、
酵母のコドン頻度に合わせるとともに、22位、96位のシステインをアラニンに置換した合成DNAをデザインして抗hCGラマVHH変異体のcDNA(配列番号2)を作製し、これをp415GSSE(Hagihara, Y., K. Shiraki, T. Nakamura, K. Uegaki, M. Takagi, T. Imanaka, and N. Yumoto, Screening for stable mutants with amino acid pairs substituted for the disulfide bond between residues 14 and 38 of bovine pancreatic trypsin inhibitor (BPTI). J Biol Chem, 2002. 277(52): p. 51043-51048.;および Hagihara, Y. and P.S. Kim, Toward development of a screen to identify randomly encoded, foldable sequences. Proc Natl Acad Sci U S A, 2002. 99(10): p. 6619-6624.)に組み
込んだ。抗hCGラマVHHの22位、96位をランダム化するプライマー(それぞれ配列番号3及び4)とベクター側のプライマー(N末端側配列番号5、C末端側配列番号6)を用いたPCR法によりシステインをランダムなアミノ酸に置換した変異体ライブラリーを作製し
た。スクリーニングのポジティブコントロールとなるジスルフィド結合を持つ天然型配列VHHは22位、96位にシステインを導入するためのプライマー(それぞれ配列番号7及
び8)とベクター側のプライマー(N末端側配列番号5、C末端側配列番号6)を用いたPCR法により作製した。
品質管理機構スクリーニング:スクリーニングに使用した酵母Saccharomyces cerevisiae
strain RY810556-2B (MATaura3-1 leu2-3, 112 his3-11, 15 can1-100)はWhitehead生物医学研究所(Cambridge, MA)のG. Fink教授より得た。上記のシステインランダム化ライブラリーから機能的構造を形成していると思われる配列を以下のように『細胞の品質管理機構』スクリーニング(Hagihara, Y., K. Shiraki, T. Nakamura, K. Uegaki, M. Takagi, T. Imanaka, and N. Yumoto, Screening for stable mutants with amino acid pairs
substituted for the disulfide bond between residues 14 and 38 of bovine pancreatic trypsin inhibitor (BPTI). J Biol Chem, 2002. 277(52): p. 51043-51048.; Hagihara, Y. and P.S. Kim, Toward development of a screen to identify randomly encoded, foldable sequences. Proc Natl Acad Sci U S A, 2002. 99(10): p. 6619-6624.)により得た。プレート上に発現した蛋白質はニトロセルロース膜に転写後、水で洗浄し
た。分泌蛋白質の可視化は変異配列の末端に導入したFlag-tagを指標にM2抗体(シグマア
ルドリッチ社製)を用い、化学発光により行なった。分泌量が多かったコロニーを選び、
さらにこれらについて液体培地での培養を行い、集菌後、上清をSDS-ポリアクリルアミド電気泳動にかけ、このゲルをPVDF膜に転写後、M2抗体を用いて分泌蛋白を可視化し、顕著な分泌がみられたクローンについてDNA塩基配列を決定した。
安定性の評価:上記のスクリーニングで得られた配列、及び天然型配列を大腸菌の大量発現用ベクター(pAED4; Doering, D.S. and P. Matsudaira, Cysteine scanning mutagenesis at 40 of 76 positions in villin headpiece maps the F-actin binding site and
structural features of the domain. Biochemistry, 1996. 35(39): p. 12677-12685.
)にPCRにより(用いたPCRプライマー:配列番号9、10)組み込み、発現後、Resource
Sカラム(アマシャム社製)で精製し、変異体VHHを得た。さらに、ネガティブコントロ
ールとして、スクリーニングでは得られなかった22位、96位がバリンに置換された変異体をPCR法を用いた部位特異的アミノ酸置換法により作製した(用いたプライマー:配
列番号11、12)。これらについて、中性(20mMリン酸ナトリウム、pH7.8)で円二色
性分散計(日本分光、J-720)を用いて熱による変性過程を調べ、変性の中点温度を測定
した。なお測定は1cmセルを使い、蛋白質濃度4μM、昇温速度は1℃/分で行なった。
抗原hCGとの結合:精製した天然型VHH、及び変異体は臭化シアン活性化セファロース(アマシャムバイオサイエンス社)に付属のプロトコールにより固相化した。それぞれのVHH
を結合した20μLのセファロース樹脂(10μgのVHHを結合)と10μgのhCG(シグマアルド
リッチ社)をバッファー(20 mM Tris-HCl 、0.15 M NaCl、pH 8)中、室温で90分間インキュベートした後、3回同じバッファーで樹脂を洗浄した。洗浄した樹脂に10μLのSDS電
気泳動用のサンプルバッファー(78mM Tris-HCl、pH6.8、2.5% SDS、2%グリセロール、1.25mg/mLブロモフェノールブルー、120mMβ-メルカプトエタノール)を加えて、95℃で1
5分間インキューべートしVHHに結合したhCGを溶出した。樹脂を遠心で沈澱させ、上清をSDS電気泳動にかけ、クーマジーブリリアントブルーで染色を行なった。
結果
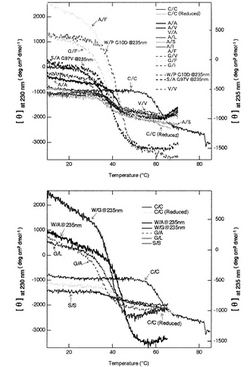
得られた変異体の安定性:「細胞の品質管理機構」スクリーニングによって得られた変異とそれに比較するためのコントロールの、中性に於ける変性曲線を図1に、変性中点温度をまとめたものを表1に示す。スクリーニングで得られた変異体、C22W/C96A(W/A)、C22A/C96A(A/A)、C22A/C96V(A/V)、C22W/C96G(W/G)、C22A/C96I(A/I)、C22A/C96F
(A/F)、C22A/C96S(A/S)、C22G/C96V(G/V)、C22G/C96L(G/L)、C22V/C96A(V/A)、C22S/C96S(S/S)、C22A/C96L(A/L)、C22G/C96A(G/A)、C22G/C96I(G/I)、C22S/C96A/G97V(S/A G97V)、C22G/C96F(G/F)、G10D/C22W/C96P(W/P G10D)は全て協同的な熱
変性を示し、中性、室温で安定な構造を維持していることが見て取れる。すなわちこれらの変異体はジスルフィド結合無しでも立体構造を維持することができる。
【0018】
変性の中点温度は、35℃以上が好ましく、38℃以上がより好ましく、40℃以上が特に好ましく、42℃以上が最も好ましい。
【0019】
得られた変異体の抗原hCGへの結合:得られた変異体について、抗原であるhCGとの結合を調べた。その結果を表1、及び図2に示す。ジスルフィド結合を持つ天然型配列(図2のCC)と比較すると、同等の抗原結合性を示したものはW/A、A/A、A/S、W/G、G/V、S/S、A/I、A/V、W/P G10Dであった。また、A/F、V/A、G/I、S/A G97V、G/Fに関してはやや弱いながらも十分な抗原結合性が観察された。これらの結果は得られた変異ペアは抗原の認識活性を維持したままジスルフィド結合を代替することが発見された。
【0020】
表1中において、「+++」は、非常に強く結合することを示し、「++」は実用的に
十分強く結合することを示し、「+」は弱く結合することを示す。
【0021】
【表1】

【図面の簡単な説明】
【0022】
【図1】得られた変異体の熱変性曲線。W/P G10D、S/A G97V、W/A、W/Gは測定波長は235nm、それ以外は230nmである。ネガティブコントロールとしてスクリーニングでは得ることの出来なかったV/V変異体も合わせて示している。
【図2】得られた変異体のその抗原であるhCGとの結合。各変異体VHHはセファロースビーズに固相化し、そのビーズに対するhCGの結合を調べた。上記のパネル中でbeadsと示したもの(2番目、14番目のレーン)はVHHを結合させていないネガティブコントロールのビーズであり、hCGは結合しない。
【技術分野】
【0001】
本発明は、ラクダ科動物の変異VHH抗体及びその製造法に関する。
【背景技術】
【0002】
偶蹄目、ラクダ科動物(フタコブラクダ、ヒトコブラクダ、ラマ)の血清中には軽鎖を持たない特殊な抗体(VHH抗体)があることが知られている。この抗体の可変領域はVHHと呼ばれ、抗原に結合できる免疫グロブリンフラグメントとしては最も低分子量である。そのため、生産の簡便性、取り扱いの容易さなどで、その利用を目指した研究が活発に進められている。とりわけ生理的構造の形成(フォールディング)と再生(リフォールディング)の容易性がVHH抗体の大きな特徴となっている。この性質を活かして、従来は困難で
あった機能的な組み換え抗体の原核生物(大腸菌)での大量生産が可能になると期待されている。
【0003】
VHH抗体について問題となるのが、分子内のジスルフィド結合である。ジスルフィド結
合は抗体の機能構造の安定化に重要であり、2つのシステイン残基のSH基が酸化的に共有結合して形成される。大腸菌を用いた組換え抗体の生産では、ジスルフィド結合の酸化的再生のための工程が要求され、かつ本来は分子内の結合が分子間で形成されて会合を引き起こす等の問題を生じることもある。
【0004】
現在までの抗体のジスルフィド結合を置換する研究はヒトやマウスの抗体、つまり通常の軽鎖と重鎖よりなるコンベンショナルな抗体を対象にしたものに限られており、その結果から特異なラクダ科動物のVHHのジスルフィド結合を置換する最適なペアを予測するこ
とは出来ない。変異鎖についてはマウスで研究が行われ、システインを置換して、抗原への結合活性を維持したアミノ酸ペアはN末端側バリン、C末端側アラニン(V/A)が報告さ
れているのみである(特許文献1,2)。
【0005】
しかしこのアミノ酸ペア(V/A)についてはヒトの抗体軽鎖、定常鎖であるヒトのCLフ
ラグメントの場合には安定性が低く、ジスルフィド結合を置換するに適切ではないことが明らかとなっている(本発明者により2004年Protein Society Meetingにて報告)。
【0006】
上記CLフラグメント、及び抗体と同じ高次構造(免疫グロブリンフォールド)を持つヒトβ2ミクログロブリンではA/Aの安定性が低く、V/Vの安定性が高い。(本発明者により2004年Protein Society Meetingにて報告)。本発明のVHHでは上記のCLフラグメントやβ2ミクログロブリンとは違い、A/Aの安定性が高く、逆にV/Vが低くなっている。このように、抗体のドメインのジスルフィド結合を置換するペアは、動物種やそのドメインが含まれるタンパク質によって異なり、一概に、予測できるものではなく、実験的な検証によってはじめて明らかになるものである。
【特許文献1】Worn, A. and A. Pluckthun, An intrinsically stable antibody scFv fragment can tolerate the loss of both disulfide bonds and fold correctly. FEBS Lett, 1998. 427(3): p. 357-361.
【特許文献2】Proba, K., A. Worn, A. Honegger, and A. Pluckthun, Antibody scFv fragments without disulfide bonds made by molecular evolution. J Mol Biol, 1998. 275(2): p. 245-253.
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、ジスルフィド結合の形成を阻止し、かつ活性を有するVHH抗体及びその製造
法を提供することを目的とする。
【課題を解決するための手段】
【0008】
そこで本発明者は、生産工程の短縮、及び会合の問題を回避するため、ラクダ科動物のVHH抗体について機能的構造、つまり常温で抗原に結合する活性を維持したままジスルフ
ィド結合の代わりとなるアミノ酸ペアを見出し、本発明を完成した。
【0009】
本発明は、以下のラクダ科動物の変異VHH抗体及びその製造法に関する。
1. 分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)
において、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシ
ン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
2. ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる項1に記載の抗体変異体。3. 2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/S
で置換した項1または2に記載の変異VHH抗体。
4. 分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)
において、該結合を構成する2つのシステイン残基を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン
、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換することを特徴とする、ラクダ科
動物の変異VHH抗体の製造法。
5. ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる項4に記載の製造法。
6. 2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/S
で置換することを特徴とする、項4または5に記載の変異VHH抗体。
【発明の効果】
【0010】
本発明によれば、重鎖のみからなるラクダ科動物のVHH抗体のシステイン残基の1種または2種を他の特定のアミノ酸で置換することにより、抗原を結合する性質を実質的に損なうことなく、分子間のジスルフィド結合の形成を抑制することができ、抗体の製造効率を向上させることができる。
【発明を実施するための最良の形態】
【0011】
本明細書において、ラクダ科動物としては、フタコブラクダ、ヒトコブラクダ、ラマ、アルパカ、ビクーナ、グアノコが挙げられ、好ましくはヒトコブラクダ、ラマが挙げられる。
【0012】
本発明で使用されるラクダ科抗体(VHH抗体)は、軽鎖を有さず、重鎖のみから構成される抗体であり、重鎖は、可変領域を有する限り、不変領域の一部を欠失または置換した抗体またはそのフラグメントであってもよい。
【0013】
本発明で置換の対象となるジスルフィド結合は、VHH抗体の可変領域に存在するため、
そのアミノ酸を変異することにより、抗原結合能に大きく影響すると考えられる。
【0014】
本発明者は、ラクダ科VHH抗体について種々のアミノ酸置換を行ったところ、V/Vでは抗原結合能の大きな低下が見られたが、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/A、A/Lについては十分な抗原結合活性を保持し、特にW/A、A/A、W/P、A/V、W/G、A/I、G/V、A/Sについては、ジスルフィド結合を有する天然型
VHH抗体と同程度の抗原結合能を保持することを確認した。
【0015】
抗体のシスティン残基を他の残基に置換する方法としては、例えばサイトスペシフィック・ミュータゲネシス〔Methods in Enzymology, 154, 350, 367-382 (1987);同 100, 468 (1983);Nucleic Acids Res., 12, 9441 (1984);続生化学実験講座1「遺伝子研究法II」、日本生化学会編, p105 (1986)〕などの遺伝子工学的手法、リン酸トリエステル法
やリン酸アミダイト法などの化学合成手段〔J. Am. Chem. Soc., 89, 4801 (1967);同 91, 3350 (1969);Science, 150, 178 (1968);Tetrahedron Lett., 22, 1859 (1981);同
24, 245 (1983)〕およびそれらの組合せ方法などが例示できる。より具体的には、DN
Aの合成は、ホスホルアミダイト法またはトリエステル法による化学合成によることもでき、市販されている自動オリゴヌクレオチド合成装置上で行うこともできる。二本鎖断片は、相補鎖を合成し、適当な条件下で該鎖を共にアニーリングさせるか、または適当なプライマー配列と共にDNAポリメラーゼを用い相補鎖を付加するかによって、化学合成した一本鎖生成物から得ることもできる。
【0016】
ジスルフィド残基を置換するアミノ酸ペアの表記に関し、「A/V」とは、N末端に近いシステインがアラニン(A)で置換され、C末端に近いシステインがバリン(V)で置換されたこ
とを意味する。
【実施例】
【0017】
以下、本発明を実施例に基づいてより詳細に説明する。
実施例1
ラマVHH:
本実施例で用いたラマVHHはヒト絨毛性ゴナドトロピン(hCG)のαサブユニットを抗原とするものである。Protein Data Bankの1G9Eのアミノ酸配列(配列番号1)をもとに、
酵母のコドン頻度に合わせるとともに、22位、96位のシステインをアラニンに置換した合成DNAをデザインして抗hCGラマVHH変異体のcDNA(配列番号2)を作製し、これをp415GSSE(Hagihara, Y., K. Shiraki, T. Nakamura, K. Uegaki, M. Takagi, T. Imanaka, and N. Yumoto, Screening for stable mutants with amino acid pairs substituted for the disulfide bond between residues 14 and 38 of bovine pancreatic trypsin inhibitor (BPTI). J Biol Chem, 2002. 277(52): p. 51043-51048.;および Hagihara, Y. and P.S. Kim, Toward development of a screen to identify randomly encoded, foldable sequences. Proc Natl Acad Sci U S A, 2002. 99(10): p. 6619-6624.)に組み
込んだ。抗hCGラマVHHの22位、96位をランダム化するプライマー(それぞれ配列番号3及び4)とベクター側のプライマー(N末端側配列番号5、C末端側配列番号6)を用いたPCR法によりシステインをランダムなアミノ酸に置換した変異体ライブラリーを作製し
た。スクリーニングのポジティブコントロールとなるジスルフィド結合を持つ天然型配列VHHは22位、96位にシステインを導入するためのプライマー(それぞれ配列番号7及
び8)とベクター側のプライマー(N末端側配列番号5、C末端側配列番号6)を用いたPCR法により作製した。
品質管理機構スクリーニング:スクリーニングに使用した酵母Saccharomyces cerevisiae
strain RY810556-2B (MATaura3-1 leu2-3, 112 his3-11, 15 can1-100)はWhitehead生物医学研究所(Cambridge, MA)のG. Fink教授より得た。上記のシステインランダム化ライブラリーから機能的構造を形成していると思われる配列を以下のように『細胞の品質管理機構』スクリーニング(Hagihara, Y., K. Shiraki, T. Nakamura, K. Uegaki, M. Takagi, T. Imanaka, and N. Yumoto, Screening for stable mutants with amino acid pairs
substituted for the disulfide bond between residues 14 and 38 of bovine pancreatic trypsin inhibitor (BPTI). J Biol Chem, 2002. 277(52): p. 51043-51048.; Hagihara, Y. and P.S. Kim, Toward development of a screen to identify randomly encoded, foldable sequences. Proc Natl Acad Sci U S A, 2002. 99(10): p. 6619-6624.)により得た。プレート上に発現した蛋白質はニトロセルロース膜に転写後、水で洗浄し
た。分泌蛋白質の可視化は変異配列の末端に導入したFlag-tagを指標にM2抗体(シグマア
ルドリッチ社製)を用い、化学発光により行なった。分泌量が多かったコロニーを選び、
さらにこれらについて液体培地での培養を行い、集菌後、上清をSDS-ポリアクリルアミド電気泳動にかけ、このゲルをPVDF膜に転写後、M2抗体を用いて分泌蛋白を可視化し、顕著な分泌がみられたクローンについてDNA塩基配列を決定した。
安定性の評価:上記のスクリーニングで得られた配列、及び天然型配列を大腸菌の大量発現用ベクター(pAED4; Doering, D.S. and P. Matsudaira, Cysteine scanning mutagenesis at 40 of 76 positions in villin headpiece maps the F-actin binding site and
structural features of the domain. Biochemistry, 1996. 35(39): p. 12677-12685.
)にPCRにより(用いたPCRプライマー:配列番号9、10)組み込み、発現後、Resource
Sカラム(アマシャム社製)で精製し、変異体VHHを得た。さらに、ネガティブコントロ
ールとして、スクリーニングでは得られなかった22位、96位がバリンに置換された変異体をPCR法を用いた部位特異的アミノ酸置換法により作製した(用いたプライマー:配
列番号11、12)。これらについて、中性(20mMリン酸ナトリウム、pH7.8)で円二色
性分散計(日本分光、J-720)を用いて熱による変性過程を調べ、変性の中点温度を測定
した。なお測定は1cmセルを使い、蛋白質濃度4μM、昇温速度は1℃/分で行なった。
抗原hCGとの結合:精製した天然型VHH、及び変異体は臭化シアン活性化セファロース(アマシャムバイオサイエンス社)に付属のプロトコールにより固相化した。それぞれのVHH
を結合した20μLのセファロース樹脂(10μgのVHHを結合)と10μgのhCG(シグマアルド
リッチ社)をバッファー(20 mM Tris-HCl 、0.15 M NaCl、pH 8)中、室温で90分間インキュベートした後、3回同じバッファーで樹脂を洗浄した。洗浄した樹脂に10μLのSDS電
気泳動用のサンプルバッファー(78mM Tris-HCl、pH6.8、2.5% SDS、2%グリセロール、1.25mg/mLブロモフェノールブルー、120mMβ-メルカプトエタノール)を加えて、95℃で1
5分間インキューべートしVHHに結合したhCGを溶出した。樹脂を遠心で沈澱させ、上清をSDS電気泳動にかけ、クーマジーブリリアントブルーで染色を行なった。
結果
得られた変異体の安定性:「細胞の品質管理機構」スクリーニングによって得られた変異とそれに比較するためのコントロールの、中性に於ける変性曲線を図1に、変性中点温度をまとめたものを表1に示す。スクリーニングで得られた変異体、C22W/C96A(W/A)、C22A/C96A(A/A)、C22A/C96V(A/V)、C22W/C96G(W/G)、C22A/C96I(A/I)、C22A/C96F
(A/F)、C22A/C96S(A/S)、C22G/C96V(G/V)、C22G/C96L(G/L)、C22V/C96A(V/A)、C22S/C96S(S/S)、C22A/C96L(A/L)、C22G/C96A(G/A)、C22G/C96I(G/I)、C22S/C96A/G97V(S/A G97V)、C22G/C96F(G/F)、G10D/C22W/C96P(W/P G10D)は全て協同的な熱
変性を示し、中性、室温で安定な構造を維持していることが見て取れる。すなわちこれらの変異体はジスルフィド結合無しでも立体構造を維持することができる。
【0018】
変性の中点温度は、35℃以上が好ましく、38℃以上がより好ましく、40℃以上が特に好ましく、42℃以上が最も好ましい。
【0019】
得られた変異体の抗原hCGへの結合:得られた変異体について、抗原であるhCGとの結合を調べた。その結果を表1、及び図2に示す。ジスルフィド結合を持つ天然型配列(図2のCC)と比較すると、同等の抗原結合性を示したものはW/A、A/A、A/S、W/G、G/V、S/S、A/I、A/V、W/P G10Dであった。また、A/F、V/A、G/I、S/A G97V、G/Fに関してはやや弱いながらも十分な抗原結合性が観察された。これらの結果は得られた変異ペアは抗原の認識活性を維持したままジスルフィド結合を代替することが発見された。
【0020】
表1中において、「+++」は、非常に強く結合することを示し、「++」は実用的に
十分強く結合することを示し、「+」は弱く結合することを示す。
【0021】
【表1】

【図面の簡単な説明】
【0022】
【図1】得られた変異体の熱変性曲線。W/P G10D、S/A G97V、W/A、W/Gは測定波長は235nm、それ以外は230nmである。ネガティブコントロールとしてスクリーニングでは得ることの出来なかったV/V変異体も合わせて示している。
【図2】得られた変異体のその抗原であるhCGとの結合。各変異体VHHはセファロースビーズに固相化し、そのビーズに対するhCGの結合を調べた。上記のパネル中でbeadsと示したもの(2番目、14番目のレーン)はVHHを結合させていないネガティブコントロールのビーズであり、hCGは結合しない。
【特許請求の範囲】
【請求項1】
分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)におい
て、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A
、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニ
ン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
【請求項2】
ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる請求項1に記載の抗体変異体。
【請求項3】
2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/Sで置換
した請求項1または2に記載の変異VHH抗体。
【請求項4】
分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)におい
て、該結合を構成する2つのシステイン残基を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニ
ルアラニン、Gはグリシンを各々示す。)で置換することを特徴とする、ラクダ科動物の
変異VHH抗体の製造法。
【請求項5】
ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる請求項4に記載の製造法。
【請求項6】
2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/Sで置換
することを特徴とする、請求項4または5に記載の変異VHH抗体。
【請求項1】
分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)におい
て、該結合を構成する2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、S/A
、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニ
ン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニルアラニン、Gはグリシンを各々示す。)で置換した変異VHH抗体。
【請求項2】
ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる請求項1に記載の抗体変異体。
【請求項3】
2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/Sで置換
した請求項1または2に記載の変異VHH抗体。
【請求項4】
分子内ジスルフィド結合を有するラクダ科動物の軽鎖を持たない抗体(VHH抗体)におい
て、該結合を構成する2つのシステイン残基を、W/A、A/A、W/P、A/V、W/G、S/A、A/I、A/F、G/V、G/L、A/S、V/A、G/F、S/S、G/I、G/AまたはA/L(ここで、Aはアラニン、Wはトリプトファン、Pはプロリン、Vはバリン、Sはセリン、Iはイソロイシン、Fはフェニ
ルアラニン、Gはグリシンを各々示す。)で置換することを特徴とする、ラクダ科動物の
変異VHH抗体の製造法。
【請求項5】
ラクダ科動物が、ラマ及びヒトコブラクダから選ばれる請求項4に記載の製造法。
【請求項6】
2つのシステイン残基(C/C)を、W/A、A/A、W/P、A/V、W/G、A/I、G/VまたはA/Sで置換
することを特徴とする、請求項4または5に記載の変異VHH抗体。
【図1】


【図2】




【図2】


【公開番号】特開2006−52201(P2006−52201A)
【公開日】平成18年2月23日(2006.2.23)
【国際特許分類】
【出願番号】特願2005−74157(P2005−74157)
【出願日】平成17年3月16日(2005.3.16)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年12月9日 第27回日本分子生物学会年会組織委員会主催の「第27回 日本分子生物学会年会」において文書をもって発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成18年2月23日(2006.2.23)
【国際特許分類】
【出願日】平成17年3月16日(2005.3.16)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年12月9日 第27回日本分子生物学会年会組織委員会主催の「第27回 日本分子生物学会年会」において文書をもって発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

