ラクトバチルス・リューテリ(Lactobacillusreuteri)株を用いる哺乳類における免疫機能の改善方法
【課題】免疫増進剤としてのラクトバチルス・リューテリ株の使用による哺乳類の免疫機能を改善する方法を提供する。
【解決手段】ラクトバチルス・リューテリの菌株は、良好な毒素の結合と中和効果を発揮し、そして良好なCD4+細胞の動員を発揮する。
【解決手段】ラクトバチルス・リューテリの菌株は、良好な毒素の結合と中和効果を発揮し、そして良好なCD4+細胞の動員を発揮する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫増進剤としてのラクトバチルス・リューテリ(Lactobacillus reuteri)株の使用、およびこの目的のためにもっとも有益である菌株を選択する改善方法に関する。
【背景技術】
【0002】
主に、抗生物質耐性病原菌における増加のために、広範な種々の胃腸内微生物を含む共生生物(probiotics)が製剤化されている。L.リューテリを含む広範なラクトバチルス種の菌株が、共生生物調合物において使用されてきた。ラクトバチルス・リューテリは、動物の胃腸管の自然に存在する棲息生物の1つであり、そして日常的に健康な動物の腸内に見いだされる。それは抗菌活性を有することで知られている。参照、例えば、特許文献1、同2、同3、同4および同5。L.リューテリ細胞はグリセロールの存在下の嫌気的条件下で増殖する場合、それらはリューテリン(reuterin)(β−ヒドロキシ−プロピオンアルデヒド)として既知の抗微生物物質を生産する。
【0003】
免疫調節活性もまたL.リューテリに関連していた。参照、例えば、非特許文献1;しかしながら、効力における差異が菌株間に存在し、そしてもっとも有効な菌株を選択する方法、例えば、本発明で提供されるCD4+細胞を動員する(recruiting)菌株を選択する方法が必要とされる。
【0004】
さらにまた、L.リューテリは一般に有益な共生生物として使用されることが知られているけれども、従来の研究は、胃腸管内に既に存在するこれらの病原菌によって生産される毒素を中和する最良のラクトバチルス菌株を利用するという重要性をある程度実現したに過ぎなかった。参照、例えば、非特許文献2。結合を含むそのような毒素の中和は、報告されたように、これらの毒素生産性病原菌によって惹起される直接効果を改善するために重要であるだけでなく、また本発明による免疫系への全般的負荷を減少されることにおいて重要である。
【0005】
病原性微生物によって惹起される胃腸問題について多くの異なる原因が存在する。例えば、ヘリコバクテリ・ピロリ(Helicobacteri pylori)は、胃と十二指腸の潰瘍、および胃粘膜に関するリンパ系組織のリンパ腫を惹起する。ある種の病原性エシェリヒア・コリ(Escherichia coli)菌株は、E.コリO157:H7によって生産されるベロ毒素(VT)のような毒素を生産し、この菌株に対する抗生物質は少くかつ低い効力である。
【0006】
したがって、本発明の目的は、CD4+細胞の動員(recruitment)と毒素の中和の両方に有効であることが検出されたラクトバチルス・リューテリ株を用いて哺乳類における免疫機能を改善する方法を提供すること、およびそのような免疫改善性L.リューテリ菌株を選択する方法を提供すること、ならびにそのような菌株を含有する製品を提供することである。本発明のさらなる目的は、これらの毒素の免疫負荷を低下することにおいて有効なL.リューテリの菌株の培養上澄液を利用する方法を提供することである。
【0007】
他の目的および利点は、より完全に、次に示す開示および添付される請求項から明らかになるであろう。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第5,439,678号
【特許文献2】米国特許第5,458,875号
【特許文献3】米国特許第5,534,253号
【特許文献4】米国特許第5,837,238号
【特許文献5】米国特許第5,849,289号
【非特許文献】
【0009】
【非特許文献1】“Biotherapeutic effects of Probiotic bacteria on candidiasis in immunodeficient mice” by Wagner RD,et al,Infect Immune 1997 Oct 65:4165−72
【非特許文献2】“Removal of common Fusarium toxins in vitro by strains of Lactobacillus and Propionibacterium” by El−Nezami HS,et al,Food Addit Contam 2002 Jul 19:680−6
【発明の概要】
【0010】
本明細書における発明は、免疫増進剤としてのラクトバチルス・リューテリ株の使用、そのような菌株の細胞を含有する製品においてラクトバチルス・リューテリ株を用いる哺乳類における免疫機能を改善する方法、および製品それ自体に関する。これらの菌株は、良好な毒素結合性と中和性を発揮し、そして良好なCD4+細胞の動員を発揮するように選択される。本発明の他の目的および特徴は、より完全に次に示す開示および添付される請求項から明らかになるであろう。
【図面の簡単な説明】
【0011】
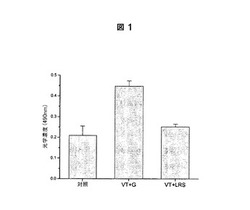
【図1】L.リューテリの培養上澄液におけるベロ細胞毒(VT)とGb3レセプターの結合に対する抑制能力の競合ELISAによる確認。各々は、Gb3でコーティングしたプレート上で次のように反応させ、続いてVTに対するmAbを用いてELISAを実施した。
【0012】
対照: VT+トリプシン処理大豆ブロス(TSB)
VT+G: VT+250mMグリセロール溶液
VT+LRS: VT+250mMグリセロール溶液においてインキュベートしたL.
リューテリの培養上澄液
【発明を実施するための形態】
【0013】
本発明は、哺乳類における免疫機能を改善する組成物の製造のための、良好な毒素結合性と中和性効果を発揮し;そして良好なCD4+細胞の動員を発揮するラクトバチルス・リューテリ株の使用に関する。それはまた、そのようなラクトバチルス・リューテリ株を含有する製品およびそのようなラクトバチルス・リューテリ株を用いて哺乳類における免疫機能を改善する方法に関する。さらにそれは、そのような免疫改善性L.リューテリ株を選択する方法を提供する。
【0014】
サイトカインは生物学的応答の修飾因子である免疫系タンパク質である。それらは抗体とT細胞免疫系の相互作用を調整し、そして免疫反応性を増幅する(10)。サイトカインは、マクロファージによって合成されるモノカインおよび活性化したTリンパ球とナチュラルキラー(NK)細胞によって産生されるリンホカインを含む。両ヒトおよびマウス
におけるCD4+サブセットはサイトカイン産生およびエフェクター機能に基づいている。Th1細胞は、インターフェロン−γ(INF−γ)、IL−2および腫瘍壊死因子(TNF)を合成する。それらは主として、細胞内の微生物に対する細胞性免疫および遅延型過敏症反応に関与している。それらは免疫グロブリンG2a(IgG2a)合成および抗体依存性細胞媒介の細胞障害に影響する。それらが産生するINF−γはマクロファージと、その結果として食作用を活性化する。Th2細胞はインターロイキン−4(IL−4)、インターロイキン−5(IL−5)、インターロイキン−6(IL−6)、インターロイキン−9(IL−9)、インターロイキン−10(IL−10)およびインターロイキン−13(IL−13)を合成する。それらは、IgEとIgG1抗体応答、ならびにマスト細胞の合成および好酸球増殖と分化因子による粘膜性免疫、およびIgA合成の促進を誘導する。
【0015】
本発明には、L.リューテリ株の投与、その菌株の解析およびCD4+細胞動員と毒素中和の両方における使用菌株の効力を確認する種々の例証段階を有する方法が含まれる。データは、例えば、L.リューテリを含有する錠剤調合物が細胞培養物の直接投与によるのと同様な胃腸のコロニー形成レベルを与えることを示している。L.リューテリのコロニー形成はL.リューテリの経口摂取に関係し、そして流出期間(L.リューテリのレベルが摂取前のレベルまで低下するのにかかる時間)は錠剤の投与後少なくとも28日であり、このことは、本明細書の発明がL.リューテリ細胞培養物ならびにそのようなL.リューテリ培養物を含有するよう製剤化された製品のために応用できることを示している。
【0016】
本発明は、好ましくは、哺乳類における免疫機能の予防的改善のための、共生生物としてのL.リューテリ株を含有する製品の使用に関する。そのような製品は選ばれた菌株の細胞を含有する種々の食料、例えば食物サプリメント、菓子類または錠剤であってもよい。
【0017】
また、本発明によるL.リューテリ株は、毒素を生産する種々の微生物、例えばエシェリヒア・コリの処置のための薬物の製造のために使用されてもよい。かくして、腸出血性E.コリおよびVT毒素が処置されてもよい。
【0018】
本発明によれば、L.リューテリ株の細胞およびその培養上澄液の両方が、予防的、共生型および製薬学的組成物の製造のために使用されてもよい。
【0019】
本発明によれば、良好なCD4+細胞動員および/または良好な毒素結合を発揮するいかなるL.リューテリ株が使用されてもよい。CD4+細胞が存在していることは、例えば免疫組織化学的(実施例5におけるように)または免疫蛍光的方法により、CD4に対する抗体を用いて試験することができる。毒素結合は、例えば実施例1において実施されたように、L.リューテリ細胞または上澄液を毒素と接触させ、そして利用できる毒素における差異について試験することによって確認されてもよい。
【0020】
本発明による共生性、予防的および製薬学的製品は、栄養的または製薬学的使用のために許容しうる添加物および賦形剤を含有してもよい。
【0021】
本発明の特徴は、次に示す実施例を参照してより明瞭に理解できるが、これは本発明を限定するものと考えてはならない。
【実施例1】
【0022】
ベロ毒素の研究
3種の乳酸菌、L.リューテリATCC55730、L.ブルガリクス(L.bulgaricus)、菌株LB12(CHR,Horsholm,Denmark)、および
L.カゼイ(L.casei)、菌株01(CHR,Horsholm,Denmark)がこの実験において用いられた。L.リューテリは、MRSブロス(20mMグルコースを補足)に接種した後、37℃で24〜48時間屈気性(aerotropic)固定(fixing)条件下でインキュベートされた。ある場合には、この初期インキュベーションの後、2,500rpmで30分間の遠心、リン酸緩衝化生理食塩水で2回の洗浄による培地成分の除去、250mMグリセロール溶液への懸濁、続いて屈気性固定条件下37℃で6時間のインキュベーションを実施した。L.ブルガリクスおよびL.カゼイは屈気的固定条件下37℃で24〜48時間MRSプラス20mMグルコース(グリセロール不含)においてインキュベートされた。各供試乳酸菌は、2g/30ml(乾燥重量)に調節し、インキュベーション後2,500rpmで30分間遠心し、上澄液を回収し、ベロ(vero)細胞(下記参照)を接種するためにNaOHによりpH7.0に調節し、そして2.0μmフィルターを通して濾過した後使用された。グリセロール溶液およびpH7.0に調節したMRSブロスは、2.0μmフィルターを通して濾過後、対照として使用された。
【0023】
ベロ細胞(African Green Monkey腎細胞、ATCC−CCL81)は、10%胎児ウシ血清(FBS,Sigma)を補足した最小必須培地(MEM,Sigma)において25g/mlゲンタマイシン(Sigma)の存在下で、10%CO2インキュベーター中37℃48時間インキュベートされ、そしてモノレアー形成を確認後使用された。
【0024】
両VT1およびVT2を分泌するエシェリヒア・コリO157:H7(ATCC43894)は、トリプシン処理大豆培地(TSB)に接種し、37℃の振盪インキュベーターにおいて撹拌しつつ24時間インキュベートし、2,500rpmで30分間遠心し、そして培養上澄液を濾過した後使用された。
【0025】
500ベロ細胞(2x105細胞/ml)が96穴プレートに接種され、そして10%CO2インキュベーター中37℃で48時間インキュベートして、モノレアーの形成を確認し、続いて次の処理を用いて実験を実施した: A:VT単独(ポジティブ対照);B:TSB(エシェリヒア・コリO157:H7培地);C:MRSブロス(試験乳酸菌);D:グリセロール溶液(L.リューテリ培地);E:VT+MRSブロス;F:VT+グリセロール溶液;G:VT+L.リューテリのグリセロール溶液培養上澄液;H:VT+L.ブルガリクスのMRSブロス培養上澄液;I:VT+L.ブルガリクスの培養上澄液;およびJ:VT+L.カゼイの培養上澄液。処理B、CおよびDは、各培養液それ自体がベロ細胞に対して細胞障害を惹起するか否かを決定するためであり、そしてEおよびFは、供試乳酸菌の培地がそれ自体においてVTに対する中和能力を有するか否かを決定するためである。G,H,IおよびJにおける供試乳酸菌の各培養上澄液は2x連続希釈にかけられ、供試乳酸菌の希釈した培養上澄液の各々とVTが、400ml+100ml;300ml+200ml;200ml+300ml;および100ml+400mlでそれぞれ合体された後、次いで、10%CO2インキュベーター中37℃で18時間インキュベートされて、細胞変性効果(CPE)が現れるか否かが決定された。
【0026】
リューテリン生産を抑制する300mM中和塩酸セミカルバジド(Sigma)が、250mMグリセロール溶液におけるL.リューテリの培養液に添加されて、リューテリン生産を抑制し、そして上澄液が前記のように回収された。100μlベロ細胞が96穴プレートに接種され、そして10%CO2インキュベーター中37℃で24時間インキュベートされて、モノレアが形成されるか否かが試験され、続いて次の処理を実施した: A:VT単独;B:VT+25mMグリセロール溶液;C:VT+L.リューテリのグリセロール溶液培養上澄液;およびD:VT+リューテリンインヒビターで処理(上記参照)後にインキュベートされたL.リューテリのグリセロール溶液培養上澄液。B,Cおよび
Dにおいてグリセロール溶液およびリューテリンの有無によって処理されたL.リューテリの各培養液が、VTと20+80;30+70;40+60;50+50;60+40;70+30;および80+20μlでそれぞれ合体され、次いで、10%CO2インキュベーター中37℃で18時間インキュベートされて、細胞変性効果が現れるか否かが試験された。顕微鏡観察後、培養液はクリスタルヴァイオレットで染色され、そしてそれらのO.D.(光学濃度)値が490nmにおいて測られた。
【0027】
96穴プレートはGb3(グロボトリアオシルセラミド(globotriaosylceramide))(Sigma)でコーティングされ、5%ウシ血清アルブミン(BSA)でブロックされ、そしてVTまたはVT+250mMグリセロール溶液のいずれかにおいてインキュベートされたL.リューテリ培養上澄液と反応させた。その後、VTに対するモノクローナル抗体(mAb)が一次抗体として使用され、これに対して、セイヨウワサビ・ペルオキシダーゼ(HRP)標識ヤギ・抗マウスIgGが添加され、そしてO−フェニレンジアミンの発色後、その光学濃度(O.D.)がELISAリーダーにより490nmで読まれた。この試験はL.リューテリとGb3レセプター間の相互作用を抑制するいずれかの物質の存在を確認した。
【0028】
Gb3によるコーティング後、VTと250mMグリセロール溶液との間およびVTとグリセロール溶液中でインキュベートされたL.リューテリの培養上澄液との間の相互作用の結果から、図1におけるように、VTとL.リューテリの培養上澄液の組み合わせが、VTのみと比較して有意なレベルで低いO.D.値を示すことが確認された。このことは、L.リューテリの培養上澄液中にVTとGb3レセプターとの結合を抑制する物質の存在が間接的に決定できたことを意味する。
【0029】
96穴プレートはVT/VT+250mMグリセロール溶液においてインキュベートされたL.リューテリ培養上澄液によりコーティングされ、3%BSAでブロックされ、そしてVTと反応させた。その後、VTに対するモノクローナル抗体が一次抗体として使用され、これに、セイヨウワサビ・ペルオキシダーゼ(HRP)標識ヤギ・抗マウスIgG(H+L)が添加され、そしてO−フェニレンジアミンの発色後、その光学濃度(O.D.)がELISAリーダーにより490nmで読まれた。この試験はL.リューテリ上澄液中のVTと相互作用する物質の存在を確認した。
【実施例2】
【0030】
E.コリO157:H7によって分泌されるベロ毒素(VT)IおよびIIに及ぼす乳酸菌の中和効果の探究
TSB、MRSブロスおよびグリセロール溶液がベロ細胞に添加された場合、細胞変性効果は見られなかった。さらに、両VTおよびMRSブロス/グリセロール溶液がベロ細胞に添加された場合、CPEがベロ細胞において観察され、このことは、培養液それ自体はVTに対する中和能力を欠くことを証明している。
【0031】
供試乳酸菌の各培養上澄液がpH7.0に調節され、濾過され、そしてVTと合体された場合、表1に示された結果が見い出された。L.ブルガリクスおよびL.カゼイでは、CPEは全濃度範囲において現れたが、L.リューテリでは、VTに対する供試乳酸菌の比が4:1(この場合、はるかに少ないCPEが見られた)以外は、CPEは多くのグリセロール上澄液において現れなかった。かくして、250mMグリセロール溶液においてインキュベートされた培養上澄液のVTに対する明瞭な中和能力が存在した。MRSブロス(+20mMグルコース)におけるインキュベーションでは、CPEは全濃度において現れた。
【0032】
【表1】

【0033】
競合ELISAおよびVTとL.リューテリ培養上澄液間の結合アッセイの結果は、Microcal Origin 6.1(Microcal Software,Inc.,Boston,MA)プログラムを用いてStudent’s t検定にかけられた。
【実施例3】
【0034】
被験者に対するL.リューテリの投与
この試験では、被験者は2個の咀しゃく錠剤を1日当たり2回与えられたが、各錠剤はL.リューテリ(SD2112:ATCC55730)の1x108CFU(コロニー形成単位)を含有し、4x108CFU L.リューテリの総1日用量になる。錠剤に使用されたすべての他の添加物は周知のものであり、そして国際薬局方に従った。研究は2部:上部胃腸管の探索を含む胃鏡検査セッション、および末端小腸の探索を含む回腸鏡検査セッションにおいて実施された(以下に詳述)。除外基準は、研究2週前および研究中に摂取される抗生物質;研究3週前および研究中に摂取される共生生物、胃腸関連の薬物による進行中の処置および規則的な処置を必要とする重い臓器疾患(例えば、がん)であった。患者の処置に関するプロトコールは、デンマーク医療委員会(Danish Ethical Committee)によって承認され、そしてヘルシンキの布告(decl
aration of Helsinki)にしたがった。研究はデンマークにおいて実施された。
【0035】
Wilcoxon signed−rank testは、L.リューテリの摂取前後の症候、血液試験値、便のL.リューテリ含量、および組織学的差異を比較するために使用された。P<0.05は有意と考えられた。
【0036】
すべての被験者が研究を終了した。胃鏡検査セッションでは、正常な食習慣を有する18歳を超える年齢の10人の健康なボランティアが研究された。胃十二指腸鏡検査は、L.リューテリの摂取前0日目、および研究終了時点、28日目に一夜絶食後に実施された。生検材料は、L.リューテリの培養と組織学的検査の両方のために、胃の体(corpus)および洞(antrum)から、および十二指腸の第3部分から採取された。生検材料の平均サイズは33mgであった。生検材料はPBS中に直接入れられ(2:1vol/サンプルwt)、氷上に保存され、そしてラクトバチルス・リューテリの菌数分析のためにスウェーデンのルンドにあるBiogaia AB研究所に送られた。組織の分離から分析までの時間は36時間以内であった。
【0037】
回腸鏡検査では、潰瘍性大腸炎(3被験者)またはクローン病(6被験者)のために結腸切除後の回腸造瘻を有する9人の被験者が研究された。小腸は全被験者において炎症の症候はなかった。回腸鏡検査は0日および28日目に実施された、生検材料はL.リューテリならびに他の乳酸桿菌の培養のため、および組織学的検査のために小腸の末端20cm内で前記のように採取された。
【実施例4】
【0038】
微生物に関する分析
便サンプルはL.リューテリの摂取前(0日目)および研究の終了時(28日目)に各被験者から収集された。回腸鏡検査の被験者の便(以下に説明する)は小口から採取された。胃鏡検査セッションからの7ボランティアおよび回腸鏡検査セッションからの4ボランティアは42日目(L.リューテリ摂取の停止14日後)に便サンプルを収集した。サンプル(少なくとも5g)が無菌容器中に収集され、そして直ちに冷蔵庫に入れた。24時間内に、0.1%ペプトン水20ml(1:5,wt/vol)が添加された。サンプルはホモジナイズされ、そして一定分量が寒冷容器中に分配された後直ちに−70℃で凍結された。そのサンプルが総ラクトバチルス菌とL.リューテリの分析のためにBiogaia AB研究所に向けてドライアイスで凍結されて発送された。そこで、サンプルは解凍され、希釈され、そしてL.リューテリについてはバンコマイシン(50mg/l)を含有するMRS−3寒天、そして総ラクトバチルス菌数についてはLBS寒天プレート(KEBOLAB AB,Lund,Sweden)上に塗布された。MRS−3は2%酢酸ナトリウム(wt/vol)を含有する改変MRS−3寒天(KEBOLAB AB,Lund,Sweden)である。LBS寒天は1L当たり1.32mlの氷酢酸を添加することによって販売者により推奨されたように調製された。寒天プレートは37℃で48時間嫌気ジャーにおいてBBL Gasパックを用いて嫌気的にインキュベートされた。研究において選ばれた分離株からのDNAはBacterial Barcodes
repPROTM DNA Fingerprintingキット(Bacterial BarCodes,Inc.,Houston,TX)を用いてPCRによって分析され、そしてフィンガープリントはBionumericsソフトウェア(Applied Maths BVBA,Sint−Martens−Latem,Belgium)を用いて解析された。
【0039】
研究の開始時および研究用製品(Study Product)の投与前には、胃鏡検査セッションの被験者の誰も便中に検出可能なL.リューテリを有しなかった(表2)。
L.リューテリ摂取の28日後、彼らのすべては4.0x104CFU/gの平均値をもつ1.0x102〜3.5x105CFU/g(便材料1g当たりのコロニー形成単位)の範囲の量で便中にL.リューテリを有し、これは研究用製品の投与による便中の生存L.リューテリにおける有意な増加を示している。5人の被験者が選ばれて、42日目と56日目(すなわち、研究用製品の投与後28日目まで)における便サンプルを送達した。これらの被験者では、L.リューテリは摂取後4週の便中に維持された(表2)。
【0040】
【表2】

【実施例5】
【0041】
組織学
いずれかの局部的免疫応答を評価するために、B−リンパ球、T−リンパ球およびマクロファージの量における変化が測定された。基礎の生検材料および28日目の生検材料が
ホルマリン固定され、そしてパラフィン中に包埋された。続いて、4μmの切片が切り取られ、そして標準的技術(Hematoxylin−eosin,van Gieson,PeriodicAcidSciff−AlcainおよびPeriodicAcidSciff−diastase)を用いて組織化学的および免疫組織化学的に染色された。CD20(B−リンパ球)、CD3,CD4+,CD8(T−リンパ球)、CD68(組織球)、ヘリコバクターおよびKi−67(増殖マーカー)に対する1次抗体は、DAKO,Glostrup,Denmarkから得られた。免疫組織化学的染色は、均一な染色を得るためにDAKO TechMateTM500イムノステイナーにおいて実施された。
【0042】
病理学者が生検材料を評価した。組織化学的染色に基づいて、組織の損傷がMadsenら(Gastroenterol.1999;116:1107−1114)にしたがって等級付け(1〜10)された。この等級は4つの基準:潰瘍形成、上皮増生、単核細胞量および固有層中の好中球顆粒細胞、の数値の合計を表す。免疫組織化学的染色に基づいて、固有層中のCD20、CD3,CD4+,CD8およびCD68ポジティブ細胞の数が半定量的に評価された。3カ月後、基礎および28日目の生検材料がブラインドされ、そして同じ病理学者によって評価された。基礎の生検材料と28日目の生検材料のポジティブ染色細胞の間の全般的相関関係が各評価において算出され、そして比較された。
【0043】
主として単独の(single)B−リンパ球細胞が、0日目の2被験者と28日目の2被験者の胃(体および洞)において見い出された。1人の被験者は28日目の胃(洞)に分散した細胞を有した。4被験者は0日目の十二指腸中に単独の細胞を有し、そして8被験者は28日目の十二指腸中に主として単独の細胞を有した。8被験者は0日目の胃(体および洞)にCD3、CD4+およびCD8(T−リンパ球)の主として単独の細胞を有し、そして9被験者は28日目の小室(ventricle)(体および洞)中に主として単独の細胞を有した(表3)。分散した細胞は0日目の8被験者における十二指腸中に見い出され、そして主として分散したT−リンパ球が28日目の7被験者の十二指腸中に見い出された。
【0044】
主として単独の組織球細胞が0日目の9被験者および28日目の5被験者における胃(体および洞)に見い出された。主として分散した細胞は0日目と28日目の6被験者(同じ6被験者ではない)の十二指腸において見い出された。
【0045】
体(p=0.025)および洞(p=0.046)からの生検材料における組織球(CD68)の数では統計学的に有意な減少があり、そして被験者がL.リューテリを受けた後の十二指腸ではB細胞(CD20)数の有意な増加があった(p=0.046)(表3)。L.リューテリの摂取によるT−リンパ球の量には有意な変化が見いだせなかった。2つの検討(組織学的サンプルの第1回の非ブラインド、および第2回のブラインド分析)間の一致は76%であった(表3)。体および洞の組織球(CD68)細胞では、一致はそれぞれわずか40%と65%であった。十二指腸のB細胞(CD20)の一致は60%であった。したがって、これらの知見には若干不確かな点があった。CD3、CD4+およびCD8の分析における一致ははるかに高かった(90%まで、表3)。
【0046】
回腸鏡検査セッションでは、すべての生検材料は組織学的に正常であり、そしてヘリコバクターはネガティブであった。Ki−ポジティブ細胞はすべての生検材料において正常であった。主として単独のB−リンパ球細胞が6被験者において見い出され、そして0日目の2被験者では、分散した細胞が見い出された。単独の細胞は28日目の全被験者において観察された。主として分散したCD3細胞(B−リンパ球)は両0日目および28日目の7被験者において見い出された。主として分散したCD4+細胞は0日目の7被験者において、そして28日目の7被験者では主として隣接する細胞群が見い出された。主と
して分散したCD8細胞が0日目の7被験者において、そして28日目の9被験者において見い出された(表3)。主として分散した組織球細胞が両0日目および28日目の7被験者において見い出された。
【0047】
28日間L.リューテリを補充した後には、有意に高い量のCD4+リンパ球が存在した(p=0.046;表3)。L.リューテリの投与によるB−リンパ球または組織球の量には有意な変化が見いだせなかった。2つの検討間の一致は、検査したすべての細胞型について一般に高く、そしてCD4+の知見では、それはこれらのデータにおいて78%を示す良好な信頼度であった(表3)。すべてのヘリコバクター染色はネガティブであった。
【0048】
【表3】

【実施例6】
【0049】
血液の生化学
血液サンプルは0日目および28日目に採取され、そしてヘモグロビン、ヘマトクリット、血小板、白血球、C−反応性タンパク質、カリウム、ナトリウム、クレアチン、b−尿素、p−グルコース、コレステロール、HDL(高密度リポタンパク質)、LDL(低密度リポタンパク質)、VLDL(超低密度リポタンパク質)、トリグリセリド、総ビリルビン、尿酸塩、ALAT、アルカリ性ホスファターゼおよび乳酸塩について分析された。
【0050】
ほとんどの血液試験はL.リューテリの摂取前後でともに正常であった。血液変数において少しの外れたものがあったが、臨床的に有意な異常は見いだされず、そして全身的変化は処置後に観察されなかった。
【実施例7】
【0051】
DNAフィンガープリント
DNAのフィンガープリント分析が本研究から選択されたL.リューテリ分離株において実施された。かくして、28日間L.リューテリを消費した3人の被験者からの便分離株が採取され、そして十二指腸生検材料からの1分離株および回腸生検材料からの1分離株がともに、L.リューテリ投与前0日目に採取された。全分離株は互いに98%の遺伝的類似性を有することが見い出された。これらの分離株のすべては、錠剤に組み入れられた菌株、SD2112に対する97%の類似性を示した。
【実施例8】
【0052】
ヒトにおいて免疫機能を改善するための製品の製剤化
この実施例では、標準ヨーグルトに添加するために、毒素の中和およびCD4+細胞の動員について前記方法を用いてL.リューテリSD2112,ATCC55730が選ばれた。L.リューテリ菌株は、酪農産業においてラクトバチルスを増殖させるための標準的方法を用いて増殖され、そして凍結乾燥された。次いで、この培養物が10E+7CFU/gヨーグルトのレベルで慣用のヨーグルト培養物を用いて予め発酵させた牛乳に添加され、そしてヨーグルトはヒトの免疫機能を改善する手段としてヒトによって使用される。
【0053】
本発明は特定の実施態様に関して記述されたので、種々の改変物、修飾物および実施態様が可能であることが評価でき、したがって、すべてのそのような改変物、修飾物および実施態様が本発明の精神および範囲内にあると見なさねばならない。
【技術分野】
【0001】
本発明は、免疫増進剤としてのラクトバチルス・リューテリ(Lactobacillus reuteri)株の使用、およびこの目的のためにもっとも有益である菌株を選択する改善方法に関する。
【背景技術】
【0002】
主に、抗生物質耐性病原菌における増加のために、広範な種々の胃腸内微生物を含む共生生物(probiotics)が製剤化されている。L.リューテリを含む広範なラクトバチルス種の菌株が、共生生物調合物において使用されてきた。ラクトバチルス・リューテリは、動物の胃腸管の自然に存在する棲息生物の1つであり、そして日常的に健康な動物の腸内に見いだされる。それは抗菌活性を有することで知られている。参照、例えば、特許文献1、同2、同3、同4および同5。L.リューテリ細胞はグリセロールの存在下の嫌気的条件下で増殖する場合、それらはリューテリン(reuterin)(β−ヒドロキシ−プロピオンアルデヒド)として既知の抗微生物物質を生産する。
【0003】
免疫調節活性もまたL.リューテリに関連していた。参照、例えば、非特許文献1;しかしながら、効力における差異が菌株間に存在し、そしてもっとも有効な菌株を選択する方法、例えば、本発明で提供されるCD4+細胞を動員する(recruiting)菌株を選択する方法が必要とされる。
【0004】
さらにまた、L.リューテリは一般に有益な共生生物として使用されることが知られているけれども、従来の研究は、胃腸管内に既に存在するこれらの病原菌によって生産される毒素を中和する最良のラクトバチルス菌株を利用するという重要性をある程度実現したに過ぎなかった。参照、例えば、非特許文献2。結合を含むそのような毒素の中和は、報告されたように、これらの毒素生産性病原菌によって惹起される直接効果を改善するために重要であるだけでなく、また本発明による免疫系への全般的負荷を減少されることにおいて重要である。
【0005】
病原性微生物によって惹起される胃腸問題について多くの異なる原因が存在する。例えば、ヘリコバクテリ・ピロリ(Helicobacteri pylori)は、胃と十二指腸の潰瘍、および胃粘膜に関するリンパ系組織のリンパ腫を惹起する。ある種の病原性エシェリヒア・コリ(Escherichia coli)菌株は、E.コリO157:H7によって生産されるベロ毒素(VT)のような毒素を生産し、この菌株に対する抗生物質は少くかつ低い効力である。
【0006】
したがって、本発明の目的は、CD4+細胞の動員(recruitment)と毒素の中和の両方に有効であることが検出されたラクトバチルス・リューテリ株を用いて哺乳類における免疫機能を改善する方法を提供すること、およびそのような免疫改善性L.リューテリ菌株を選択する方法を提供すること、ならびにそのような菌株を含有する製品を提供することである。本発明のさらなる目的は、これらの毒素の免疫負荷を低下することにおいて有効なL.リューテリの菌株の培養上澄液を利用する方法を提供することである。
【0007】
他の目的および利点は、より完全に、次に示す開示および添付される請求項から明らかになるであろう。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第5,439,678号
【特許文献2】米国特許第5,458,875号
【特許文献3】米国特許第5,534,253号
【特許文献4】米国特許第5,837,238号
【特許文献5】米国特許第5,849,289号
【非特許文献】
【0009】
【非特許文献1】“Biotherapeutic effects of Probiotic bacteria on candidiasis in immunodeficient mice” by Wagner RD,et al,Infect Immune 1997 Oct 65:4165−72
【非特許文献2】“Removal of common Fusarium toxins in vitro by strains of Lactobacillus and Propionibacterium” by El−Nezami HS,et al,Food Addit Contam 2002 Jul 19:680−6
【発明の概要】
【0010】
本明細書における発明は、免疫増進剤としてのラクトバチルス・リューテリ株の使用、そのような菌株の細胞を含有する製品においてラクトバチルス・リューテリ株を用いる哺乳類における免疫機能を改善する方法、および製品それ自体に関する。これらの菌株は、良好な毒素結合性と中和性を発揮し、そして良好なCD4+細胞の動員を発揮するように選択される。本発明の他の目的および特徴は、より完全に次に示す開示および添付される請求項から明らかになるであろう。
【図面の簡単な説明】
【0011】
【図1】L.リューテリの培養上澄液におけるベロ細胞毒(VT)とGb3レセプターの結合に対する抑制能力の競合ELISAによる確認。各々は、Gb3でコーティングしたプレート上で次のように反応させ、続いてVTに対するmAbを用いてELISAを実施した。
【0012】
対照: VT+トリプシン処理大豆ブロス(TSB)
VT+G: VT+250mMグリセロール溶液
VT+LRS: VT+250mMグリセロール溶液においてインキュベートしたL.
リューテリの培養上澄液
【発明を実施するための形態】
【0013】
本発明は、哺乳類における免疫機能を改善する組成物の製造のための、良好な毒素結合性と中和性効果を発揮し;そして良好なCD4+細胞の動員を発揮するラクトバチルス・リューテリ株の使用に関する。それはまた、そのようなラクトバチルス・リューテリ株を含有する製品およびそのようなラクトバチルス・リューテリ株を用いて哺乳類における免疫機能を改善する方法に関する。さらにそれは、そのような免疫改善性L.リューテリ株を選択する方法を提供する。
【0014】
サイトカインは生物学的応答の修飾因子である免疫系タンパク質である。それらは抗体とT細胞免疫系の相互作用を調整し、そして免疫反応性を増幅する(10)。サイトカインは、マクロファージによって合成されるモノカインおよび活性化したTリンパ球とナチュラルキラー(NK)細胞によって産生されるリンホカインを含む。両ヒトおよびマウス
におけるCD4+サブセットはサイトカイン産生およびエフェクター機能に基づいている。Th1細胞は、インターフェロン−γ(INF−γ)、IL−2および腫瘍壊死因子(TNF)を合成する。それらは主として、細胞内の微生物に対する細胞性免疫および遅延型過敏症反応に関与している。それらは免疫グロブリンG2a(IgG2a)合成および抗体依存性細胞媒介の細胞障害に影響する。それらが産生するINF−γはマクロファージと、その結果として食作用を活性化する。Th2細胞はインターロイキン−4(IL−4)、インターロイキン−5(IL−5)、インターロイキン−6(IL−6)、インターロイキン−9(IL−9)、インターロイキン−10(IL−10)およびインターロイキン−13(IL−13)を合成する。それらは、IgEとIgG1抗体応答、ならびにマスト細胞の合成および好酸球増殖と分化因子による粘膜性免疫、およびIgA合成の促進を誘導する。
【0015】
本発明には、L.リューテリ株の投与、その菌株の解析およびCD4+細胞動員と毒素中和の両方における使用菌株の効力を確認する種々の例証段階を有する方法が含まれる。データは、例えば、L.リューテリを含有する錠剤調合物が細胞培養物の直接投与によるのと同様な胃腸のコロニー形成レベルを与えることを示している。L.リューテリのコロニー形成はL.リューテリの経口摂取に関係し、そして流出期間(L.リューテリのレベルが摂取前のレベルまで低下するのにかかる時間)は錠剤の投与後少なくとも28日であり、このことは、本明細書の発明がL.リューテリ細胞培養物ならびにそのようなL.リューテリ培養物を含有するよう製剤化された製品のために応用できることを示している。
【0016】
本発明は、好ましくは、哺乳類における免疫機能の予防的改善のための、共生生物としてのL.リューテリ株を含有する製品の使用に関する。そのような製品は選ばれた菌株の細胞を含有する種々の食料、例えば食物サプリメント、菓子類または錠剤であってもよい。
【0017】
また、本発明によるL.リューテリ株は、毒素を生産する種々の微生物、例えばエシェリヒア・コリの処置のための薬物の製造のために使用されてもよい。かくして、腸出血性E.コリおよびVT毒素が処置されてもよい。
【0018】
本発明によれば、L.リューテリ株の細胞およびその培養上澄液の両方が、予防的、共生型および製薬学的組成物の製造のために使用されてもよい。
【0019】
本発明によれば、良好なCD4+細胞動員および/または良好な毒素結合を発揮するいかなるL.リューテリ株が使用されてもよい。CD4+細胞が存在していることは、例えば免疫組織化学的(実施例5におけるように)または免疫蛍光的方法により、CD4に対する抗体を用いて試験することができる。毒素結合は、例えば実施例1において実施されたように、L.リューテリ細胞または上澄液を毒素と接触させ、そして利用できる毒素における差異について試験することによって確認されてもよい。
【0020】
本発明による共生性、予防的および製薬学的製品は、栄養的または製薬学的使用のために許容しうる添加物および賦形剤を含有してもよい。
【0021】
本発明の特徴は、次に示す実施例を参照してより明瞭に理解できるが、これは本発明を限定するものと考えてはならない。
【実施例1】
【0022】
ベロ毒素の研究
3種の乳酸菌、L.リューテリATCC55730、L.ブルガリクス(L.bulgaricus)、菌株LB12(CHR,Horsholm,Denmark)、および
L.カゼイ(L.casei)、菌株01(CHR,Horsholm,Denmark)がこの実験において用いられた。L.リューテリは、MRSブロス(20mMグルコースを補足)に接種した後、37℃で24〜48時間屈気性(aerotropic)固定(fixing)条件下でインキュベートされた。ある場合には、この初期インキュベーションの後、2,500rpmで30分間の遠心、リン酸緩衝化生理食塩水で2回の洗浄による培地成分の除去、250mMグリセロール溶液への懸濁、続いて屈気性固定条件下37℃で6時間のインキュベーションを実施した。L.ブルガリクスおよびL.カゼイは屈気的固定条件下37℃で24〜48時間MRSプラス20mMグルコース(グリセロール不含)においてインキュベートされた。各供試乳酸菌は、2g/30ml(乾燥重量)に調節し、インキュベーション後2,500rpmで30分間遠心し、上澄液を回収し、ベロ(vero)細胞(下記参照)を接種するためにNaOHによりpH7.0に調節し、そして2.0μmフィルターを通して濾過した後使用された。グリセロール溶液およびpH7.0に調節したMRSブロスは、2.0μmフィルターを通して濾過後、対照として使用された。
【0023】
ベロ細胞(African Green Monkey腎細胞、ATCC−CCL81)は、10%胎児ウシ血清(FBS,Sigma)を補足した最小必須培地(MEM,Sigma)において25g/mlゲンタマイシン(Sigma)の存在下で、10%CO2インキュベーター中37℃48時間インキュベートされ、そしてモノレアー形成を確認後使用された。
【0024】
両VT1およびVT2を分泌するエシェリヒア・コリO157:H7(ATCC43894)は、トリプシン処理大豆培地(TSB)に接種し、37℃の振盪インキュベーターにおいて撹拌しつつ24時間インキュベートし、2,500rpmで30分間遠心し、そして培養上澄液を濾過した後使用された。
【0025】
500ベロ細胞(2x105細胞/ml)が96穴プレートに接種され、そして10%CO2インキュベーター中37℃で48時間インキュベートして、モノレアーの形成を確認し、続いて次の処理を用いて実験を実施した: A:VT単独(ポジティブ対照);B:TSB(エシェリヒア・コリO157:H7培地);C:MRSブロス(試験乳酸菌);D:グリセロール溶液(L.リューテリ培地);E:VT+MRSブロス;F:VT+グリセロール溶液;G:VT+L.リューテリのグリセロール溶液培養上澄液;H:VT+L.ブルガリクスのMRSブロス培養上澄液;I:VT+L.ブルガリクスの培養上澄液;およびJ:VT+L.カゼイの培養上澄液。処理B、CおよびDは、各培養液それ自体がベロ細胞に対して細胞障害を惹起するか否かを決定するためであり、そしてEおよびFは、供試乳酸菌の培地がそれ自体においてVTに対する中和能力を有するか否かを決定するためである。G,H,IおよびJにおける供試乳酸菌の各培養上澄液は2x連続希釈にかけられ、供試乳酸菌の希釈した培養上澄液の各々とVTが、400ml+100ml;300ml+200ml;200ml+300ml;および100ml+400mlでそれぞれ合体された後、次いで、10%CO2インキュベーター中37℃で18時間インキュベートされて、細胞変性効果(CPE)が現れるか否かが決定された。
【0026】
リューテリン生産を抑制する300mM中和塩酸セミカルバジド(Sigma)が、250mMグリセロール溶液におけるL.リューテリの培養液に添加されて、リューテリン生産を抑制し、そして上澄液が前記のように回収された。100μlベロ細胞が96穴プレートに接種され、そして10%CO2インキュベーター中37℃で24時間インキュベートされて、モノレアが形成されるか否かが試験され、続いて次の処理を実施した: A:VT単独;B:VT+25mMグリセロール溶液;C:VT+L.リューテリのグリセロール溶液培養上澄液;およびD:VT+リューテリンインヒビターで処理(上記参照)後にインキュベートされたL.リューテリのグリセロール溶液培養上澄液。B,Cおよび
Dにおいてグリセロール溶液およびリューテリンの有無によって処理されたL.リューテリの各培養液が、VTと20+80;30+70;40+60;50+50;60+40;70+30;および80+20μlでそれぞれ合体され、次いで、10%CO2インキュベーター中37℃で18時間インキュベートされて、細胞変性効果が現れるか否かが試験された。顕微鏡観察後、培養液はクリスタルヴァイオレットで染色され、そしてそれらのO.D.(光学濃度)値が490nmにおいて測られた。
【0027】
96穴プレートはGb3(グロボトリアオシルセラミド(globotriaosylceramide))(Sigma)でコーティングされ、5%ウシ血清アルブミン(BSA)でブロックされ、そしてVTまたはVT+250mMグリセロール溶液のいずれかにおいてインキュベートされたL.リューテリ培養上澄液と反応させた。その後、VTに対するモノクローナル抗体(mAb)が一次抗体として使用され、これに対して、セイヨウワサビ・ペルオキシダーゼ(HRP)標識ヤギ・抗マウスIgGが添加され、そしてO−フェニレンジアミンの発色後、その光学濃度(O.D.)がELISAリーダーにより490nmで読まれた。この試験はL.リューテリとGb3レセプター間の相互作用を抑制するいずれかの物質の存在を確認した。
【0028】
Gb3によるコーティング後、VTと250mMグリセロール溶液との間およびVTとグリセロール溶液中でインキュベートされたL.リューテリの培養上澄液との間の相互作用の結果から、図1におけるように、VTとL.リューテリの培養上澄液の組み合わせが、VTのみと比較して有意なレベルで低いO.D.値を示すことが確認された。このことは、L.リューテリの培養上澄液中にVTとGb3レセプターとの結合を抑制する物質の存在が間接的に決定できたことを意味する。
【0029】
96穴プレートはVT/VT+250mMグリセロール溶液においてインキュベートされたL.リューテリ培養上澄液によりコーティングされ、3%BSAでブロックされ、そしてVTと反応させた。その後、VTに対するモノクローナル抗体が一次抗体として使用され、これに、セイヨウワサビ・ペルオキシダーゼ(HRP)標識ヤギ・抗マウスIgG(H+L)が添加され、そしてO−フェニレンジアミンの発色後、その光学濃度(O.D.)がELISAリーダーにより490nmで読まれた。この試験はL.リューテリ上澄液中のVTと相互作用する物質の存在を確認した。
【実施例2】
【0030】
E.コリO157:H7によって分泌されるベロ毒素(VT)IおよびIIに及ぼす乳酸菌の中和効果の探究
TSB、MRSブロスおよびグリセロール溶液がベロ細胞に添加された場合、細胞変性効果は見られなかった。さらに、両VTおよびMRSブロス/グリセロール溶液がベロ細胞に添加された場合、CPEがベロ細胞において観察され、このことは、培養液それ自体はVTに対する中和能力を欠くことを証明している。
【0031】
供試乳酸菌の各培養上澄液がpH7.0に調節され、濾過され、そしてVTと合体された場合、表1に示された結果が見い出された。L.ブルガリクスおよびL.カゼイでは、CPEは全濃度範囲において現れたが、L.リューテリでは、VTに対する供試乳酸菌の比が4:1(この場合、はるかに少ないCPEが見られた)以外は、CPEは多くのグリセロール上澄液において現れなかった。かくして、250mMグリセロール溶液においてインキュベートされた培養上澄液のVTに対する明瞭な中和能力が存在した。MRSブロス(+20mMグルコース)におけるインキュベーションでは、CPEは全濃度において現れた。
【0032】
【表1】

【0033】
競合ELISAおよびVTとL.リューテリ培養上澄液間の結合アッセイの結果は、Microcal Origin 6.1(Microcal Software,Inc.,Boston,MA)プログラムを用いてStudent’s t検定にかけられた。
【実施例3】
【0034】
被験者に対するL.リューテリの投与
この試験では、被験者は2個の咀しゃく錠剤を1日当たり2回与えられたが、各錠剤はL.リューテリ(SD2112:ATCC55730)の1x108CFU(コロニー形成単位)を含有し、4x108CFU L.リューテリの総1日用量になる。錠剤に使用されたすべての他の添加物は周知のものであり、そして国際薬局方に従った。研究は2部:上部胃腸管の探索を含む胃鏡検査セッション、および末端小腸の探索を含む回腸鏡検査セッションにおいて実施された(以下に詳述)。除外基準は、研究2週前および研究中に摂取される抗生物質;研究3週前および研究中に摂取される共生生物、胃腸関連の薬物による進行中の処置および規則的な処置を必要とする重い臓器疾患(例えば、がん)であった。患者の処置に関するプロトコールは、デンマーク医療委員会(Danish Ethical Committee)によって承認され、そしてヘルシンキの布告(decl
aration of Helsinki)にしたがった。研究はデンマークにおいて実施された。
【0035】
Wilcoxon signed−rank testは、L.リューテリの摂取前後の症候、血液試験値、便のL.リューテリ含量、および組織学的差異を比較するために使用された。P<0.05は有意と考えられた。
【0036】
すべての被験者が研究を終了した。胃鏡検査セッションでは、正常な食習慣を有する18歳を超える年齢の10人の健康なボランティアが研究された。胃十二指腸鏡検査は、L.リューテリの摂取前0日目、および研究終了時点、28日目に一夜絶食後に実施された。生検材料は、L.リューテリの培養と組織学的検査の両方のために、胃の体(corpus)および洞(antrum)から、および十二指腸の第3部分から採取された。生検材料の平均サイズは33mgであった。生検材料はPBS中に直接入れられ(2:1vol/サンプルwt)、氷上に保存され、そしてラクトバチルス・リューテリの菌数分析のためにスウェーデンのルンドにあるBiogaia AB研究所に送られた。組織の分離から分析までの時間は36時間以内であった。
【0037】
回腸鏡検査では、潰瘍性大腸炎(3被験者)またはクローン病(6被験者)のために結腸切除後の回腸造瘻を有する9人の被験者が研究された。小腸は全被験者において炎症の症候はなかった。回腸鏡検査は0日および28日目に実施された、生検材料はL.リューテリならびに他の乳酸桿菌の培養のため、および組織学的検査のために小腸の末端20cm内で前記のように採取された。
【実施例4】
【0038】
微生物に関する分析
便サンプルはL.リューテリの摂取前(0日目)および研究の終了時(28日目)に各被験者から収集された。回腸鏡検査の被験者の便(以下に説明する)は小口から採取された。胃鏡検査セッションからの7ボランティアおよび回腸鏡検査セッションからの4ボランティアは42日目(L.リューテリ摂取の停止14日後)に便サンプルを収集した。サンプル(少なくとも5g)が無菌容器中に収集され、そして直ちに冷蔵庫に入れた。24時間内に、0.1%ペプトン水20ml(1:5,wt/vol)が添加された。サンプルはホモジナイズされ、そして一定分量が寒冷容器中に分配された後直ちに−70℃で凍結された。そのサンプルが総ラクトバチルス菌とL.リューテリの分析のためにBiogaia AB研究所に向けてドライアイスで凍結されて発送された。そこで、サンプルは解凍され、希釈され、そしてL.リューテリについてはバンコマイシン(50mg/l)を含有するMRS−3寒天、そして総ラクトバチルス菌数についてはLBS寒天プレート(KEBOLAB AB,Lund,Sweden)上に塗布された。MRS−3は2%酢酸ナトリウム(wt/vol)を含有する改変MRS−3寒天(KEBOLAB AB,Lund,Sweden)である。LBS寒天は1L当たり1.32mlの氷酢酸を添加することによって販売者により推奨されたように調製された。寒天プレートは37℃で48時間嫌気ジャーにおいてBBL Gasパックを用いて嫌気的にインキュベートされた。研究において選ばれた分離株からのDNAはBacterial Barcodes
repPROTM DNA Fingerprintingキット(Bacterial BarCodes,Inc.,Houston,TX)を用いてPCRによって分析され、そしてフィンガープリントはBionumericsソフトウェア(Applied Maths BVBA,Sint−Martens−Latem,Belgium)を用いて解析された。
【0039】
研究の開始時および研究用製品(Study Product)の投与前には、胃鏡検査セッションの被験者の誰も便中に検出可能なL.リューテリを有しなかった(表2)。
L.リューテリ摂取の28日後、彼らのすべては4.0x104CFU/gの平均値をもつ1.0x102〜3.5x105CFU/g(便材料1g当たりのコロニー形成単位)の範囲の量で便中にL.リューテリを有し、これは研究用製品の投与による便中の生存L.リューテリにおける有意な増加を示している。5人の被験者が選ばれて、42日目と56日目(すなわち、研究用製品の投与後28日目まで)における便サンプルを送達した。これらの被験者では、L.リューテリは摂取後4週の便中に維持された(表2)。
【0040】
【表2】

【実施例5】
【0041】
組織学
いずれかの局部的免疫応答を評価するために、B−リンパ球、T−リンパ球およびマクロファージの量における変化が測定された。基礎の生検材料および28日目の生検材料が
ホルマリン固定され、そしてパラフィン中に包埋された。続いて、4μmの切片が切り取られ、そして標準的技術(Hematoxylin−eosin,van Gieson,PeriodicAcidSciff−AlcainおよびPeriodicAcidSciff−diastase)を用いて組織化学的および免疫組織化学的に染色された。CD20(B−リンパ球)、CD3,CD4+,CD8(T−リンパ球)、CD68(組織球)、ヘリコバクターおよびKi−67(増殖マーカー)に対する1次抗体は、DAKO,Glostrup,Denmarkから得られた。免疫組織化学的染色は、均一な染色を得るためにDAKO TechMateTM500イムノステイナーにおいて実施された。
【0042】
病理学者が生検材料を評価した。組織化学的染色に基づいて、組織の損傷がMadsenら(Gastroenterol.1999;116:1107−1114)にしたがって等級付け(1〜10)された。この等級は4つの基準:潰瘍形成、上皮増生、単核細胞量および固有層中の好中球顆粒細胞、の数値の合計を表す。免疫組織化学的染色に基づいて、固有層中のCD20、CD3,CD4+,CD8およびCD68ポジティブ細胞の数が半定量的に評価された。3カ月後、基礎および28日目の生検材料がブラインドされ、そして同じ病理学者によって評価された。基礎の生検材料と28日目の生検材料のポジティブ染色細胞の間の全般的相関関係が各評価において算出され、そして比較された。
【0043】
主として単独の(single)B−リンパ球細胞が、0日目の2被験者と28日目の2被験者の胃(体および洞)において見い出された。1人の被験者は28日目の胃(洞)に分散した細胞を有した。4被験者は0日目の十二指腸中に単独の細胞を有し、そして8被験者は28日目の十二指腸中に主として単独の細胞を有した。8被験者は0日目の胃(体および洞)にCD3、CD4+およびCD8(T−リンパ球)の主として単独の細胞を有し、そして9被験者は28日目の小室(ventricle)(体および洞)中に主として単独の細胞を有した(表3)。分散した細胞は0日目の8被験者における十二指腸中に見い出され、そして主として分散したT−リンパ球が28日目の7被験者の十二指腸中に見い出された。
【0044】
主として単独の組織球細胞が0日目の9被験者および28日目の5被験者における胃(体および洞)に見い出された。主として分散した細胞は0日目と28日目の6被験者(同じ6被験者ではない)の十二指腸において見い出された。
【0045】
体(p=0.025)および洞(p=0.046)からの生検材料における組織球(CD68)の数では統計学的に有意な減少があり、そして被験者がL.リューテリを受けた後の十二指腸ではB細胞(CD20)数の有意な増加があった(p=0.046)(表3)。L.リューテリの摂取によるT−リンパ球の量には有意な変化が見いだせなかった。2つの検討(組織学的サンプルの第1回の非ブラインド、および第2回のブラインド分析)間の一致は76%であった(表3)。体および洞の組織球(CD68)細胞では、一致はそれぞれわずか40%と65%であった。十二指腸のB細胞(CD20)の一致は60%であった。したがって、これらの知見には若干不確かな点があった。CD3、CD4+およびCD8の分析における一致ははるかに高かった(90%まで、表3)。
【0046】
回腸鏡検査セッションでは、すべての生検材料は組織学的に正常であり、そしてヘリコバクターはネガティブであった。Ki−ポジティブ細胞はすべての生検材料において正常であった。主として単独のB−リンパ球細胞が6被験者において見い出され、そして0日目の2被験者では、分散した細胞が見い出された。単独の細胞は28日目の全被験者において観察された。主として分散したCD3細胞(B−リンパ球)は両0日目および28日目の7被験者において見い出された。主として分散したCD4+細胞は0日目の7被験者において、そして28日目の7被験者では主として隣接する細胞群が見い出された。主と
して分散したCD8細胞が0日目の7被験者において、そして28日目の9被験者において見い出された(表3)。主として分散した組織球細胞が両0日目および28日目の7被験者において見い出された。
【0047】
28日間L.リューテリを補充した後には、有意に高い量のCD4+リンパ球が存在した(p=0.046;表3)。L.リューテリの投与によるB−リンパ球または組織球の量には有意な変化が見いだせなかった。2つの検討間の一致は、検査したすべての細胞型について一般に高く、そしてCD4+の知見では、それはこれらのデータにおいて78%を示す良好な信頼度であった(表3)。すべてのヘリコバクター染色はネガティブであった。
【0048】
【表3】

【実施例6】
【0049】
血液の生化学
血液サンプルは0日目および28日目に採取され、そしてヘモグロビン、ヘマトクリット、血小板、白血球、C−反応性タンパク質、カリウム、ナトリウム、クレアチン、b−尿素、p−グルコース、コレステロール、HDL(高密度リポタンパク質)、LDL(低密度リポタンパク質)、VLDL(超低密度リポタンパク質)、トリグリセリド、総ビリルビン、尿酸塩、ALAT、アルカリ性ホスファターゼおよび乳酸塩について分析された。
【0050】
ほとんどの血液試験はL.リューテリの摂取前後でともに正常であった。血液変数において少しの外れたものがあったが、臨床的に有意な異常は見いだされず、そして全身的変化は処置後に観察されなかった。
【実施例7】
【0051】
DNAフィンガープリント
DNAのフィンガープリント分析が本研究から選択されたL.リューテリ分離株において実施された。かくして、28日間L.リューテリを消費した3人の被験者からの便分離株が採取され、そして十二指腸生検材料からの1分離株および回腸生検材料からの1分離株がともに、L.リューテリ投与前0日目に採取された。全分離株は互いに98%の遺伝的類似性を有することが見い出された。これらの分離株のすべては、錠剤に組み入れられた菌株、SD2112に対する97%の類似性を示した。
【実施例8】
【0052】
ヒトにおいて免疫機能を改善するための製品の製剤化
この実施例では、標準ヨーグルトに添加するために、毒素の中和およびCD4+細胞の動員について前記方法を用いてL.リューテリSD2112,ATCC55730が選ばれた。L.リューテリ菌株は、酪農産業においてラクトバチルスを増殖させるための標準的方法を用いて増殖され、そして凍結乾燥された。次いで、この培養物が10E+7CFU/gヨーグルトのレベルで慣用のヨーグルト培養物を用いて予め発酵させた牛乳に添加され、そしてヨーグルトはヒトの免疫機能を改善する手段としてヒトによって使用される。
【0053】
本発明は特定の実施態様に関して記述されたので、種々の改変物、修飾物および実施態様が可能であることが評価でき、したがって、すべてのそのような改変物、修飾物および実施態様が本発明の精神および範囲内にあると見なさねばならない。
【特許請求の範囲】
【請求項1】
哺乳類における免疫機能を改善するための組成物を製造するための、
a.良好な毒結合および中和効果を示し;
b.良好なCD+4細胞動因を示す、
ラクトバチルス・リューテリ株ATCC55730の使用。
【請求項2】
ラクトバチルス・リューテリ株ATCC55730の培養上済液が、細菌毒素を中和するために用いられる、請求項1に記載の使用。
【請求項3】
製造物が選択された菌株の細胞を含む食品として調製される、請求項1に記載の使用。
【請求項4】
製造物が選択された菌株の細胞を含む錠剤として調製される、請求項3に記載の製品。
【請求項5】
製造物が選択された菌株の細胞を含む食物サプリメントとして調製される、請求項3に記載の使用。
【請求項6】
製造物が選択された菌株の細胞を含む菓子として調製される、請求項3に記載の使用。
【請求項7】
製造物が選択された菌株の細胞を含む薬物として調製される、請求項3に記載の使用。
【請求項1】
哺乳類における免疫機能を改善するための組成物を製造するための、
a.良好な毒結合および中和効果を示し;
b.良好なCD+4細胞動因を示す、
ラクトバチルス・リューテリ株ATCC55730の使用。
【請求項2】
ラクトバチルス・リューテリ株ATCC55730の培養上済液が、細菌毒素を中和するために用いられる、請求項1に記載の使用。
【請求項3】
製造物が選択された菌株の細胞を含む食品として調製される、請求項1に記載の使用。
【請求項4】
製造物が選択された菌株の細胞を含む錠剤として調製される、請求項3に記載の製品。
【請求項5】
製造物が選択された菌株の細胞を含む食物サプリメントとして調製される、請求項3に記載の使用。
【請求項6】
製造物が選択された菌株の細胞を含む菓子として調製される、請求項3に記載の使用。
【請求項7】
製造物が選択された菌株の細胞を含む薬物として調製される、請求項3に記載の使用。
【図1】




【公開番号】特開2010−280664(P2010−280664A)
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−152168(P2010−152168)
【出願日】平成22年7月2日(2010.7.2)
【分割の表示】特願2004−545114(P2004−545114)の分割
【原出願日】平成14年10月18日(2002.10.18)
【出願人】(500155578)バイオガイア・エイビー (13)
【氏名又は名称原語表記】Biogaia AB
【Fターム(参考)】
【公開日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成22年7月2日(2010.7.2)
【分割の表示】特願2004−545114(P2004−545114)の分割
【原出願日】平成14年10月18日(2002.10.18)
【出願人】(500155578)バイオガイア・エイビー (13)
【氏名又は名称原語表記】Biogaia AB
【Fターム(参考)】
[ Back to top ]

