ラッカーゼ及び低温におけるその使用方法
ラッカーゼ酵素及びそのようなラッカーゼ酵素をコードする核酸配列が記載されている。デニム生地の色を変性するための改良された方法においてラッカーゼ酵素を伝達物質と一緒に使用することができる。ラッカーゼ酵素を使用した低温及び単一槽の繊維処理も記載されている。
【発明の詳細な説明】
【技術分野】
【0001】
優先権
本出願は、2008年12月24日に提出された米国仮特許出願第61/140,724号、2009年2月24日に提出された第61/154,882号、及び、2009年8月27日に提出された第61/237,532号に対する優先権を主張する。各文献は言及することによってそっくりそのまま組み込まれている。
【0002】
本発明の系、組成物及び方法は、ラッカーゼ酵素及びそのようなラッカーゼ酵素をコードする核酸配列に関する。ラッカーゼ酵素は、デニム生地の色を変性するための改善された方法において伝達物質と一緒に使用することができる。
【背景技術】
【0003】
ラッカーゼは、酸素の存在下において優れた酸化剤であることがわかっている銅含有フェノール酸化酵素である。ラッカーゼは、微生物、菌類及び高等生物にみられる。ラッカーゼ酵素は、パルプ及び紙の漂白、パルプ廃液の処理、脱インク、工業用の色除去、洗濯用洗剤中の漂白、口腔ケア歯白色化剤、及び、重合及び酸化反応のための触媒又は促進剤を含む多数の用途に使用される。
【0004】
ラッカーゼは、洗剤産業、紙パルプ産業、繊維産業及び食品産業を含む多数の産業における種々の用途に使用可能である。ある用途において、フェノール酸化酵素は、洗剤洗浄中に衣服から食物汚れなどの染みを除去する補助として使用される。ほとんどのラッカーゼは、中性又はアルカリ性のpHにおいて不活性であるが、酸性のpH領域においてpH最適条件を示す。
【0005】
ラッカーゼは、ジーニイアスペルギルス(genii Aspergillus)、ニューロスポラ(Neurospora)、ポドスポラ(Podospora)、ボトリティス(Botrytis)、プルロタス(Pleurotus)、フォルネス(Fornes)、フレビア(Phlebia)、トラメテス(Trametes)、ポリポラス(Polyporus)、スタキボトリス、リゾクトニア(Rhizoctonia)、ビポラリス(Bipolaris)、クルブラリア(Curvularia)、アメロスポリウム(Amerosporium)、レンチヌス(Lentinus)、ミセリオプトラ(Myceliophtora)、コプリナス(Coprinus)、チエラビア(Thielavia)、セレナ(Cerrena)、ストレプトミセス(Streptomyces)及びメラノカルパス(Melanocarpus)の種を含む種々の菌類によって作られることがわかっている。しかしながら、各種用途において様々な性能特性を有するラッカーゼの必要性がなお存在する。
【0006】
多数の用途のために、促進剤としても知られている伝達物質の使用によってラッカーゼの酸化能力を向上させることができる。ラッカーゼ及び伝達物質を含む系は、当業界においてラッカーゼ伝達物質系(LMS)として知られている。ラッカーゼの作用を活性化又は開始させるために同じ化合物を使用することができる。
【0007】
ラッカーゼ伝達物質系において使用するためのいくつかの既知の伝達物質が存在する。これらには、HBT(l−ヒドロキシベンゾトリアゾール)、ABTS[2、2’―アジノビス(3−エチルベンゾチアゾリン−6−スルフィン酸)]、NHA(N−ヒドロキシアセトアニリド)、NEIAA(N−アセチル−N−フェニルヒドキシルアミン)、HBTO(3−ヒドロキシ1,2,3−ベンゾトリアジン−4(3H)−オン)及びVIO(ビオルル酸)が含まれる。さらに、伝達物質として有用であることがわかっているNH−OH基又はN−O基を含むいくつかの化合物が存在する。
【0008】
官能基及び置換基は、伝達物質の能力に大きく影響する。同じクラスの化合物内でさえ、置換基は、基質に対するラッカーゼ特異性を変化させることができ、それによって、伝達物質の能力を大幅に上昇又は低下させる。さらに、伝達物質は、ある特定の用途に有効であるが、他の用途には適さない可能性がある。現行の伝達物質についての他の欠点は、使用中に重合する傾向があることである。したがって、特定の用途のために効率的な伝達物質を発見する必要がある。そのような用途の1つは繊維の漂白であり、伝達物質が過度に高価又は危険でないことも重要である。ラッカーゼ伝達物質系の他の用途を以下に与える。
【0009】
低温におけるラッカーゼの使用の方法は、例えば、処理槽を加熱するためのエネルギー投入量を減らすことができる繊維処理方法において、省エネルギーの点で利益を与える。ラッカーゼ酵素を低温における酵素漂白のような用途において使用する方法を開発することが望ましい。
【発明の概要】
【0010】
ラッカーゼを含む酵素的酸化の系、組成物及び方法を説明する。一態様において、40℃未満の温度において、繊維の色変性を生じさせるのに充分な時間及び条件下で繊維をラッカーゼ酵素及び選択的に伝達物質と接触させるステップを含む繊維処理方法を提供する。いくつかの実施形態においては、色変性は、色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び、漂白から選択される。いくつかの実施形態においては温度が約20℃以上40℃未満である。いくつかの実施形態においては温度が約20℃乃至約35℃である。いくつかの実施形態においては温度が約20℃乃至約30℃である。いくつかの実施形態においては温度が約20℃乃至約23℃である。いくつかの実施形態においては温度が、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態においては温度が水道水の外界温度である。
【0011】
いくつかの実施形態においては繊維が藍染めされたデニムである。いくつかの実施形態においては繊維が硫黄染めされたデニムである。いくつかの実施形態において、繊維をラッカーゼ酵素及び伝達物質と接触させるステップの前に又は接触させるステップと同時に、デニムを糊抜され及び/又はストーンウォッシュする。いくつかの実施形態においては、ストーンウォッシュするステップと、繊維をラッカーゼ酵素及び伝達物質と接触させるステップとを、同じ槽内で行う。
【0012】
いくつかの実施形態において、この方法は、繊維をラッカーゼ酵素及び伝達物質と接触させるステップと同時に又は連続して、繊維をセルラーゼ酵素に接触させるステップをさらに含む。いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップと、繊維をラッカーゼ酵素及び伝達物質と接触させるステップとを連続して実行し、繊維をラッカーゼ酵素及び伝達物質と接触させるステップの前に、繊維をセルラーゼ酵素と接触させるステップを実行する。いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップ、及び、繊維をラッカーゼ酵素及び伝達物質と接触させるステップを、繊維をセルラーゼ酵素と接触させるステップと繊維をラッカーゼ酵素及び伝達物質と接触させるステップとの間に槽を排水することなく、同じ槽内において連続して実行する。
【0013】
いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップ、及び、繊維をラッカーゼ酵素及び伝達物質と接触させるステップを、40℃未満の温度において実行する。いくつかの実施形態においては温度が約20℃以上40℃未満である。いくつかの実施形態においては温度が約20℃乃至約35℃である。いくつかの実施形態においては温度が約20℃乃至約30℃である。いくつかの実施形態においては温度が約20℃乃至約23℃である。いくつかの実施形態においては温度が、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態においては温度が水道水の外界温度である。
【0014】
いくつかの実施形態において、セルラーゼ酵素がラッカーゼ酵素と相乗的に作用することによって、さらに大きい程度の繊維の色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び/又は、漂白を有する繊維を生産する。いくつかの実施形態においては、セルラーゼ酵素がラッカーゼ酵素と相加的に作用することによって、セルラーゼが含まれない同じ方法と比較して、さらに大きな程度の繊維の色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び/又は、漂白を有する繊維を生産する。
【0015】
いくつかの実施形態において、ラッカーゼが微生物によるラッカーゼである。いくつかの実施形態において、ラッカーゼがセレナ(Cerrena)種に由来する。いくつかの実施形態において、ラッカーゼがセレナユニカラー(Cerrena unicolor)に由来する。いくつかの実施形態において、ラッカーゼがセレナユニカラーに由来するラッカーゼDである。
【0016】
いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも70%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも80%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも90%又は少なくとも95%同一のアミノ酸配列を有する。
【0017】
いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも70%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも80%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも90%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも95%同一のアミノ酸配列を有する。
【0018】
いくつかの実施形態において、使用準備済組成物中にラッカーゼ酵素と伝達物質とを一緒に提供する。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とを固体形態で提供する。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とを顆粒として提供する。特定の実施形態においては伝達物質がシリンゴニトリルである。
【0019】
他の一態様において、ラッカーゼ、そのようなラッカーゼをコードする核酸配列、並びに、ラッカーゼを発現するためのベクター及びホスト細胞を提供する。繊維処理のようなエネルギー投入量の低減が望まれる方法において、低温においてラッカーゼを使用することができる。いくつかの実施形態において、ラッカーゼ酵素は、配列番号:2、4、6、8、10、12、14、16、18若しくは20のいずれかに記載のアミノ酸配列を含むか、該アミノ配列からなるか、若しくは、該アミノ配列から本質的になるものであるか、又は、配列番号:2、4、6、8、12、14、16、18、19又は20のいずれかに対して少なくとも約60%、65%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一のアミノ酸配列を有するものである。特定の実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一のアミノ酸配列を有する。さらなる特定の実施形態において、ラッカーゼは、配列番号19又は配列番号20のアミノ酸配列を有する。そのようなポリペプチドがラッカーゼ酵素活性を有することが好ましく、その活性は、例えば、本明細書に記載されている分析を用いて測定することができる。
【0020】
他の一態様において、前述のアミノ酸配列のいずれかを含むか、該アミノ酸配列から本質的になるか、又は、該アミノ酸配列からなるラッカーゼ酵素を含む組成物を提供する。いくつかの実施形態において、この組成物は、溶液中において組成物のpHを約5.5乃至約6.5に維持するための緩衝系をさらに含む。いくつかの実施形態において、この組成物は、伝達物質をさらに含む。この伝達物質は、例えば、アセトシリンゴン、シリングアルデヒド、シリングアミド、メチルシリングアミド、2−ヒドロキシエチルシリングアミド、シリンガ酸メチル、ジメチルシリングアミド、シリンガ酸(shrine acid)、4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(シリンゴニトリル)から選択され得る。一実施形態において、伝達物質は、4−ヒドロキシ−3,5−ジメトキシベンゾニトリルである。いくつかの実施形態において、この組成物は固体形態である。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とは、使用準備済組成物中に一緒に提供される。いくつかの実施形態において、ラッカーゼ酵素及び伝達物質が固体形態で提供される。いくつかの実施形態において、ラッカーゼ酵素及び伝達物質が顆粒として提供される。特定の実施形態においては伝達物質がシリンゴニトリルである。
【0021】
いくつかの実施形態において、ラッカーゼ酵素は、約5乃至約7のpH、約20℃乃至約30℃の温度、約5:1乃至約10:1の液比、及び、約15分乃至約60分の時間で使用される。
【0022】
本発明の系、組成物及び方法のこれらの及び他の態様及び実施形態は、明細書及び添付図面によって明らかになる。
【図面の簡単な説明】
【0023】
【図1】図1は、実施例1に記載されているように、様々な温度においてラッカーゼ酵素を用いてストーンウォッシュしたデニムにおける色を変化させる効果を示している。
【0024】
【図2】図2は、実施例2に記載されているように、ストーンウォッシュしたデニムの色の変化に対するラッカーゼ及び伝達物質の比率の影響を示している。
【0025】
【図3】図3は、実施例3において記載されているように、「使用準備済」ラッカーゼ組成物を用いてストーンウォッシュしたデニムの色の変化に対する温度の影響を示している。
【0026】
【図4】図4は、実施例3に記載されているように、ストーンウォッシュしたデニムに対するラッカーゼ酵素の色を変化させる能力に対する温度の影響を示している。
【0027】
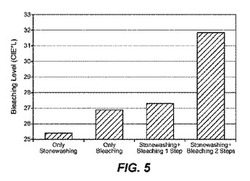
【図5】図5は、実施例4−6に記載されているように、ラッカーゼによって媒介される色変性と組み合わせたセルラーゼ処理の効果を示している。
【発明を実施するための形態】
【0028】
ラッカーゼを含む酵素的酸化の系、組成物及び方法を記載する。これらの系、組成物及び方法は、例えば、色変性に影響を与えるための繊維の低温処理に有用である。そのような処理は、従来の繊維処理技術より少ないエネルギーを使用し、環境によりやさしい化学試薬を含む。これらの系、組成物及び方法の様々な態様及び実施形態を記載する。
【0029】
定義
別段の定めがない限り、ここで使用されている技術及び科学用語のすべては、当業者によって一般に理解されるのと同じ意味を有する。「Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), and Hale and Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, N.Y. (1991)」は、本明細書において使用される用語の多数の一般的な辞書を提供する。さらなる明確性のために以下の用語を定義する。
【0030】
本明細書において用いられているように、「酵素」という用語は、化学反応を触媒するタンパクを意味する。酵素の触媒現象の機能は、その「酵素活性」又は「活性」を構成する。酵素は、一般に、触媒する反応の種類に従って、例えば、フェノールの酸化、ペプチド結合の加水分解、ヌクレオチドの結合などに分類される。
【0031】
本明細書において用いられているように、「基質」という用語は、生成物を生成するように酵素がその触媒能力を発揮する対象となる物質(例えば化合物)を意味する。
【0032】
本明細書において用いられているように、「ラッカーゼ」は、4個の電子の伝達プロセスにおいて酸素を水に同時に還元すると共に、1個の電子を除去することによって、フェノール、ポリフェノール及びアニリンの酸化を触媒する複数銅含有酸化酵素(EC1.10.3.2)である。
【0033】
本明細書において用いられているように、「変異体」タンパクは、少数のアミノ酸置換、挿入及び/又は欠失によって親/基準タンパクとは異なる関連タンパク及び誘導体タンパクを包含する。いくつかの実施形態において、異なるアミノ酸残基の数は、約1、2、3、4、5、10、20、25、30、35、40、45又は50のいずれかである。いくつかの実施形態において、変異体は、約1個乃至約10個のアミノ酸残基が異なる。いくつかの実施形態において、変異体タンパクは、親/基準タンパクに対して少なくとも約35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%のアミノ酸配列同一性を有する。
【0034】
本明細書において用いられているように、「類似配列」という用語は、親/基準タンパク中の配列と類似した機能、三次元構造、及び/又は、保存残基を提供するタンパク中のポリペプチド配列を意味する。例えば、αヘリックス又はβシート構造を含む構造領域において、類似配列中の置換アミノ酸残基は、同じ構造的特徴を維持する。いくつかの実施形態において、類似配列は、変異体が由来した親タンパクと同様の又は向上した機能を示す変異体タンパクを与える。
【0035】
本明細書において用いられているように、「相同タンパク(homologous protein)」又は「同族体(homolog)」は、基準タンパク(例えば、異なる源に由来するラッカーゼ酵素)と同様の機能(例えば、酵素活性)及び/又は構造を有するタンパク(例えば、ラッカーゼ酵素)を意味する。同族体は、進化論的に関連する種又は無関係な種に由来するものであってもよい。いくつかの実施形態において、同族体は、基準タンパクに類似した四次、三次及び/又は一次構造を有し、それによって、非相同タンパクに由来する配列による部分又は断片の置換と比較して、基準タンパクの構造及び/又は機能の破壊を低減しながら、同族体に由来する類似の部分又は断片による基準タンパク中の部分又は断片の置換を潜在的に可能にする。
【0036】
本明細書において用いられているように、「野生型」タンパク、「天然」タンパク及び「天然に存在する」タンパクは、自然界にみられるものである。「野生型の配列」という用語は、自然界にみられる又は天然に存在するアミノ酸又は核酸配列を意味する。いくつかの実施形態において、野生型配列は、タンパクエンジニアリング事業(例えば変異体タンパクの生産)の出発点である。
【0037】
本明細書において用いられているように、「シグナル配列」は、タンパクのN末端部分に結合したアミノ酸の配列を意味し、細胞からタンパクの成熟形態を分泌することを容易にする。細胞外タンパクの成熟形態は、分泌プロセス中に開裂されるシグナル配列を欠いている。
【0038】
本明細書において用いられているように、「培養」という用語は、対象のポリペプチドを発現させるために、液体、半固体又は固体の培地において適切な条件下で微生物細胞の集団を培養することを意味する。当業界において知られているように、いくつかの実施形態において培養を管内又は反応器内で実行する。
【0039】
本明細書において用いられているように、「誘導体」という用語は、N末端及びC末端のいずれか又は両方への1つ以上のアミノ酸の付加、アミノ酸配列中の1つ又は複数の異なる位置における1つ以上のアミノ酸残基の置換、タンパクの一端部若しくは両端部における又はアミノ酸配列中の1つ以上の位置における1つ以上のアミノ酸残基の欠失、及び/又は、アミノ酸配列中の1つ以上の部位における1つ以上のアミノ酸の挿入によって、親/基準タンパクに由来するタンパクを意味する。タンパク誘導体の調製は、多くの場合、天然タンパクをコードするDNA塩基配列を修飾すること、適切な宿主へのそのDNA塩基配列の導入、及び、修飾されたDNA塩基配列を発現させて誘導体タンパクを作ることによって達成される。
【0040】
本明細書において用いられているように、「発現」という用語は、遺伝子の核酸配列に基づいてポリペプチドが生産されるプロセスを意味する。このプロセスは転写及び翻訳の両方を含む。
【0041】
本明細書において用いられているように、「発現ベクター」という用語は、宿主においてコード配列を発現させることができる1つ又はそれ以上の適切な制御配列に作用可能な状態で結合されたDNAコード配列(例えば遺伝子配列)を含むDNA構築物を意味する。そのような制御配列は、転写を達成するためにプロモータ、そのような転写を制御するための選択的なオペレーター配列、適切なmRNAリボソーム結合部位をコードする配列、並びに、転写及び翻訳の停止を制御する配列を含む。ベクターは、プラスミド、ファージ粒子又は単に潜在的ゲノム挿入物であってもよい。適切な宿主に導入されると、ベクターは、宿主ゲノムから独立して複製及び機能することができ、又は、いくつかの例においてはゲノム自体に統合することもできる。
【0042】
本明細書において用いられているように、「宿主細胞」という用語は、ポリペプチド生産用の組み換え発現ベクターをトランスフェクトすることができるか、トランスフォームすることができるか、又は、ポリペプチドの発現のために他の方法で導入することができる細胞又は細胞系を意味する。宿主細胞には、単一の宿主細胞の子孫が含まれ、その子孫は、天然の、偶発的な、又は、意図的な突然変異のせいで、(形態において又は全ゲノムDNA補体において)親細胞と必ずしも同一でない可能性がある。宿主細胞は細菌性又は真菌性であってもよい。宿主細胞には、発現ベクターによってインビボにおいてトランスフェクト又はトランスフォームされた細胞が含まれる。
【0043】
本明細書において用いられているように、細胞に核酸配列を挿入するという文脈における「導入」という用語は、「トランスフェクション」、「トランスフォーメーション」及び「トランスダクション」を包含し、真核生物又は原核細胞中への核酸配列の組み込みであって、その核酸配列が、細胞のゲノム(例えば、染色体、プラスミド、色素体又はミトコンドリアDNA)に組み込まれるか、独立したレプリコンに変換されるか、又は、一時的に発現される組み込みを意味する。
【0044】
本明細書において用いられているように、「洗浄組成物」及び「洗浄調合物」は、生地、皿、コンタクトレンズ、毛髪(シャンプー)、肌(石鹸及びクリーム)、歯(口内洗浄液、練り歯磨き)、並びに、他の固体及び表面のような、洗浄しようとする部材から望まれない化合物を除去するために使用することができる組成物を意味する。この用語は、組成物が組成物中で使用される酵素に適合する限り、特定の種類の望ましい洗浄組成物及び生成物の形態(例えば液体、ゲル、顆粒又はスプレーの組成物)のために選択されるあらゆる物質/化合物を包含する。洗浄組成物材料の具体的選択は、洗浄しようとする表面、部材又は生地と、使用中の洗浄条件に対する組成物の望ましい形態とを考慮することによって容易になされる。
【0045】
この用語は、物及び/又は表面を洗浄、漂白、消毒及び/又は殺菌するのに適したあらゆる組成物をさらに意味する。この用語は、以下に限定されるものではないが、界面活性剤組成物(例えば、液体及び/又は固体の洗濯用洗剤、並びに、きめ細かい生地の洗剤;ガラス、木材、セラミック及び金属のカウンタートップ、並びに、窓などのための硬表面洗浄調合物;カーペットクリーナー;オーブンクリーナー;生地脱臭剤;生地柔軟剤;並びに、繊維及び洗濯前染み抜き、及び、皿洗剤)を含むことが意図されている。
【0046】
実際に、「洗浄組成物」及び「洗浄調合物」という用語は、(別段の定めがない限り)粒状又は粉末形態の万能洗剤又は重質洗剤、特に洗浄洗剤;液体、ゲル又はペースト形態の万能洗剤、特にいわゆる重質液体(HDL)タイプ;きめ細かい生地用の液体洗剤;食器洗い洗剤又は軽質食器洗い洗剤、特に高発泡タイプ;家庭及び企業の使用のための様々な錠剤、顆粒、液体、及び、洗浄補助援助のタイプを含む食器洗浄機用洗剤;抗菌性手洗いタイプ、洗浄石鹸(cleaning bar)、口内洗浄液、義歯クリーナ、自動車シャンプー又はカーペットシャンプー、浴室洗剤を含む液体の洗浄剤及び殺菌剤;ヘアシャンプー及びヘアリンス;シャワー用ジェル及び泡風呂及び金属クリーナー;並びに、漂白添加剤及び「しみ取りスティック(stain-stick)」若しくは前処理タイプのような洗浄補助剤を包含する。
【0047】
本明細書において用いられているように、「界面活性剤組成物」及び「洗剤調合物」という用語は、汚染された物の洗浄のための洗浄媒体中における使用が意図された混合物について使用される。いくつかの実施形態において、この用語は、生地及び/又は衣服を洗濯するもの(例えば「洗濯用洗剤」)について使用される。代替実施形態において、この用語は、皿、刃物などを洗浄するために使用されるもの(例えば「食器用洗剤」)のような他の洗剤を意味する。酵素に加えて、「界面活性剤組成物」及び「洗浄調合物」は、界面活性剤、ビルダ、漂白剤、漂白剤促進剤、青味剤及び蛍光染料、固化防止剤、マスキング剤、酵素活性剤、酸化防止剤、並びに、可溶化剤を含む洗剤を包含する。
【0048】
本明細書において用いられているように、「洗剤安定性」というフレーズは、界面活性剤組成物における酵素の安定性、並びに、選択的には、付随する基質又は伝達物質の安定性を意味する。いくつかの実施形態においてはこの安定性を洗剤の使用中に評価するが、他の実施形態において、この用語は、保存中の界面活性剤組成物の安定性を意味する。
【0049】
本明細書において用いられているように、「硬表面洗浄組成物」という用語は、床、壁、タイル、ステンレススチール管(例えば発酵槽)、浴槽及びキッチン据え付け設備などのような硬い表面を洗浄するための界面活性剤組成物を意味する。そのような組成物は、以下に限定されるものではないが、固体、液体、乳剤などを含む任意の形態で提供可能である。
【0050】
本明細書において用いられているように、「皿洗浄組成物」という用語は、以下に限定されるものではないが、粒状及び液体の形態を含む、皿を洗浄するための組成物のすべての形態を意味する。
【0051】
本明細書において用いられているように、「消毒」という用語は、真菌、細菌、胞子などを含む微生物の除去又は致死を意味する。
【0052】
本明細書において用いられているように、「生地洗浄組成物」という用語は、以下に限定されるものではないが、顆粒、液体及び固体の形態を含む、生地を洗浄するための界面活性剤組成物の形態を意味する。
【0053】
本明細書において用いられているように、「ポリヌクレオチド」、「核酸」及び「オリゴヌクレオチド」という用語は、一本鎖又は複数鎖(例えば、一本鎖、二本鎖、三重螺旋など)であるかに関わらず、デオキシリボヌクレオチド、リボヌクレオチド、並びに/又は、(修飾されたヌクレオチド若しくは塩基又はそれらの類似体を含む)デオキシリボヌクレオチド若しくはリボヌクレオチドの類似体若しくは修飾された形態を含む任意の長さ及び任意の三次元構造のヌクレオチドの重合体の形態を意味するように互いに区別なく使用される。遺伝子コードが退化しているので、特定のアミノ酸をコードするために1つよりも多いコドンを使用してもよい。使用条件下においてポリヌクレオチドが所望の機能を保持する限り、ヌクレアーゼ耐性を増大させる修飾(例えば、デオキシ、2’−O−Me、ホスホロチオエートなど)を含む、任意の種類の修飾されたヌクレオチド又はヌクレオチド類似体を使用することができる。検出又は補足の目的のために、例えば、放射性ラベル若しくは非放射性ラベル、又は、アンカー(例えば、ビオチン)などのラベルを組み込むこともできる。ポリヌクレオチドという用語は、ペプチド核酸(PNA)も包含する。ポリヌクレオチドは、天然に存在するものであってもよいし又は天然に存在しないものであってもよい。ヌクレオチドの配列は、非ヌクレオチド成分が割り込んだものであってもよい。1つ又はそれ以上のリン酸ジエステル結合を代替連結基によって置換することができる。例えば、リン酸塩は、P(O)S(「チオアート」)、P(S)S(「ジチオアート」)、(O)NR2(「アミデート」)、P(O)R、P(O)OR’、CO又はCH2(「ホルムアセタル」)によって置換されてもよい。ここで、R又はR’は、それぞれ、独立して、H、又は、選択的にエーテル(−O−)結合、アリール、アルケニル、シクロアルキル、シクロアルケニル若しくはアラルキル(araldyl)を含む置換された若しくは置換されていないアルキル(炭素数1乃至20)である。ポリヌクレオチド中のすべての結合が同じである必要はない。ポリヌクレオチドは、直鎖状若しくは環状であってもよいし、又は、直鎖部分と環状部分との組み合わせで構成されていてもよい。
【0054】
本明細書において用いられているように、「ポリペプチド」、「タンパク」及び「ペプチド」という用語は、アミノ酸(すなわち、アミノ酸残基)を含む成分を意味する。アミノ酸残基を表す従来の1文字又は3文字のコードを使用する。ポリペプチドは、直鎖若しくは分岐であってもよいし、修飾されたアミノ酸を含んでいてもよいし、また、アミノ酸でないものが割り込だものであってもよい。この用語は、自然に、又は、例えば、ジスルフィド結合形成、糖鎖形成、脂質化、アセチル化、リン酸化、又は、ラベリング成分との結合のような他の操作若しくは修飾のような介在によって、修飾されたアミノ酸重合体も包含する。その定義には、例えば、1つ又はそれ以上のアミノ酸の類似体(例えば、非天然アミノ酸などを含む)、及び、当業界において知られている他の修飾を含むポリペプチドも含まれる。
【0055】
本明細書において用いられているように、「プライマー」という用語は、天然に存在するものであるか又は合成されたものであるかに関わらず、例えば、精製された制限断片のように、適切な温度及び適切なpHにおいて、ヌクレオチド及びポリメラーゼの存在下において相補的な核酸と共にインキュベートされたときに、核酸合成の開始点として機能することができるオリゴヌクレオチドを意味する。プライマーは、好ましくは一本鎖であるが、代替的に二本鎖であってもよい。二本鎖である場合、プライマーは、伸張生成物を調製するために使用される前に、最初にその鎖を分離するように処理される。プライマーはオリゴデオキシリボヌクレオチドであることが好ましい。プライマーの正確な長さは、温度、プライマーの由来、及び、使用する方法を含む多くの要因に応じて変わるであろう。
【0056】
本明細書において用いられているように、「回収された」、「分離された」、「精製された」及び「分離された」という用語は、天然状態において付随する又は異種発現の結果として付随する少なくとも1つの成分から除去された材料(例えばタンパク、核酸又は細胞)を意味する。
【0057】
本明細書において用いられているように、「繊維」という用語は、ファイバー、毛糸、生地、衣服及び不織生地の材料を意味する。この用語は、天然材料及び合成材料(例えば、製造されたもの)、並びに、天然物と合成物との混合物から作られた繊維を包含する。「繊維」という用語は、処理されていない若しくは処理されたファイバーの両方、毛糸、織った若しくは編んだ生地、不織生地、並びに、衣服を意味する。いくつかの実施形態において、繊維はセルロースを含む。
【0058】
本明細書において用いられているように、「処理を必要とする繊維」というフレーズは、所望の効果を生じさせるために、糊抜き、研磨、漂白及び/又はバイオ研磨する必要がある繊維を意味する。
【0059】
本明細書において用いられているように、「色変性を必要とする繊維」というフレーズは、色に関して変化させる必要がある繊維を意味する。これらの繊維は、他の処理に既に供されたものであってもよいし、まだ供されていないものであってもよい。同様に、これらの繊維は、後処理を必要とするものであってもよいし、必要としないものであってもよい。
【0060】
本明細書において用いられているように、「生地」という用語は、線維及び/又は糸の製造された集成体であって、厚さに対して相対的に大きい表面積と、該集成体に有用な機械強度を与えるのに充分な凝集力とを有する集成体を意味する。
【0061】
本明細書において用いられているように、「色変性」という用語は、まとめて繊維材料と呼ばれる線維、毛糸、生地、衣服又は不織生地の材料に付随する色の彩度、飽和度、強度、輝度、及び/又は、色調における変化を意味する。理論に拘束されるものではないが、色変性は、繊維材料に付随する発色基の変性に起因するものであり、それによってその外観を変化させることが提唱されている。発色基は、繊維を製造するために使用される材料に自然に付随するもの(例えば、綿の白色)であってもよいし、又は、染色若しくは印刷のような特殊な仕上剤に付随するものであってもよい。色変性は、発色基が付着した材料に対する化学的修飾を包含するのみでなく、発色基に対する化学的修飾も包含する。色変性の例には、退色させること、漂白すること、色合いを変えることが含まれる。藍染めされたデニムに対する特別な色変性は、「ヴィンテージ外観」に退色させることであり、それは、新たに染色されたデニムほど強くない青色/紫色の色調、及び、新たに染色されたデニムよりくすんだ灰色の外観を有する。
【0062】
本明細書において用いられているように、「漂白」という用語は、より薄い色を作るために、線維、毛糸、生地、衣服又は不織生地の材料のような繊維材料を処理するプロセスを意味する。この用語は、例えば、繊維処理用途の文脈におけるより明るい又はより白い繊維の生産、及び、例えば、洗浄用途の文脈における汚れの色の軽減も包含する。
【0063】
本明細書において用いられているように、「糊(size)」及び「糊付けする(sizing)」という用語は、繊維工業において糸の耐摩耗性及び強度を増大させることによって製織性能を向上させるために用いられる化合物を意味する。糊は、通常、デンプン又はデンプン用化合物から作られる。
【0064】
本明細書において用いられているように、「糊抜き(desize)」及び「糊抜きする(desizing)」という用語は、通常は特殊な仕上剤、染料又は漂白剤を塗生地する前に、繊維から糊(通常はデンプン)を排除/除去するプロセスを意味する。
【0065】
本明細書において用いられているように、「糊抜き酵素(desizing enzyme)」という用語は、糊を除去するために使用される酵素を意味する。典型的な酵素は、アミラーゼ、セルラーゼ及びマンナナーゼである。
【0066】
本明細書において用いられているように、「同一性%」という用語は、本明細書に記載されているようなラッカーゼをコードする核酸配列と他の核酸配列との間の核酸配列の同一性のレベル、又は、本明細書に記載されているようなラッカーゼ酵素と他のアミノ酸配列との間のアミノ酸配列の同一性のレベルを意味する。配列比較は、従来の配列比較プログラムを使用して実行することができる。核酸及びアミノ酸の配列同一性の典型的なレベルは、以下に限定されるものではないが、本明細書に記載されているように、規定の配列(例えば、ラッカーゼのためのコード配列又はラッカーゼのアミノ酸配列)に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超える配列同一性を含む。
【0067】
2つの配列間の同一性を決定するために使用することができる典型的なコンピュータプログラムは、以下に限定されるものではないが、<www.ncbi.nlm.nih.gov/BLAST>においてインターネット上で公的に利用可能な、例えば、BLASTN、BLASTX、並びに、TBLASTX、BLASTP及びTBLASTNなどのBLASTプログラムの組み合わせを含む。また、「Altschul, et al., 1990」及び「Altschul, et al., 1997」を参照されたい。
【0068】
配列検索は、通常、与えられた核酸配列をGenBank DNA塩基配列及び他の公のデータベースの核酸配列と比較して評価するときは、BLASTNプログラムを使用して行う。BLASTXプログラムは、GenBankタンパク配列及び他の公のデータベースのアミノ酸配列に対して、すべてのリーディングフレームに翻訳される核酸配列を検索するのに好まれる。BLASTN及びBLASTXの両方は、11.0のオープンギャップペナルティ及び1.0の拡張ギャップペナルティのデフォルトパラメーターを使用して実行され、BLOSUM−62マトリクスを利用する(例えば、Altschul, et al., 1997を参照されたい。)
【0069】
2つ以上の配列間の「同一性%」を決定するために選択した複数の配列の配列比較は、例えば、10.0のオープンギャップペナルティ、0.1の拡張ギャップペナルティ及びBLOSUM30シミラリティマトリックスを含むデフォルトパラメーターで動作させたMacVectorバージョン6.5のCLUSTAL−Wプログラムを使用して実行することができる。
【0070】
本明細書において用いられているように、「化学伝達物質」及び「伝達物質」という用語は、酸化酵素活性を示す酵素(例えばラッカーゼ)と第2基質又は電子供与体と間で電子を輸送するための酸化還元伝達物質として機能する化合物を意味するように互いに区別なく使用される。そのような化学伝達物質は、当業界において「エンハンサー(enhancers)」及び「アクセラレ−タ(accelerator)」としても知られている。
【0071】
本明細書において用いられているように、繊維材料が存在する槽に関する「排水する(draining)」又は「落とす(dropping)」という用語は、槽中に存在する溶媒及び試薬を完全に又は部分的に放出すること/空にすることを意味する。槽を排水するステップは、通常、ある工程段階において存在する溶媒及び試薬が後の工程段階を妨げないようにするために、工程段階の間に実行される。脱水は、そのような溶媒及び試薬をさらに除去するための1つ又はそれ以上のすすぎステップを伴うものであってもよい。
【0072】
本明細書において用いられているように、「第2基質」及び「電子供与体」という用語は、酸化酵素活性を示す酵素によって電子を与えることができる及び受け取ることができる染料、色素(例えば藍)、発色基(例えば、ポリフェノール、アントシアニン、若しくは、カロチノイド)又は他の第2基質を意味するように相互に区別なく使用される。
【0073】
以下の略語/頭字語は、別段の定めがない限り以下の意味を有する。
EC 酵素委員会
EDTA エチレンジアミン四酢酸
kDa キロダルトン
MW 分子量
w/v 重量/体積
w/w 重量/重量
v/v 体積/体積
wt% 重量パーセント
℃ 摂氏温度
H2O 水
dH20又はDI 脱イオン水
dIH2O 脱イオン水、ミリQ濾過
g又はgm グラム
μg マイクログラム
mg ミリグラム
kg キログラム
μL及びμl マイクロリットル
mL及びml ミリリットル
mm ミリメートル
μm マイクロメートル
M モル
mM ミリモル
μM マイクロモル
U ユニット
sec及び” 秒
min及び’ 分
hr 時間
eq. 当量
N ノーマル
RTU 使用準備済(ready-to-use)
U 単位
owg 物の重量に対して(on weight of goods)
CIE 国際照明委員会(International Commission on Illumination)
【0074】
数値範囲は、その範囲を定義する数を含む。文脈から明示的に明らかにされていない限り、単数形の冠詞「1つの(a)」、「1つの(an)」及び「その(the)」は、複数の指示対象を含む。別段の定めがない限り、ポリペプチドは、N末端からC末端の標準的な方向で記載されており、また、ポリヌクレオチドは、5’から3’の標準的な方向で記載されている。本発明の組成物及び方法の実施又は試験において均等な方法及び材料を使用することができるので、記載されている特定の方法論、プロトコル及び試薬が限定されるように意図されていないことは理解されるに違いない。読者を助けるために明細書を複数の章に分けているが、限定するものとして章の見出しを解釈してはならず、ある章における記載を別の章に適用することができる。本明細書において引用されているすべての刊行物は、言及することによって明示的に組み込まれている。
【0075】
ラッカーゼ及びラッカーゼ関連酵素
酵素的酸化の系、組成物及び方法は、本明細書においてまとめて「ラッカーゼ」又は「ラッカーゼ酵素」と呼ばれるラッカーゼ又はラッカーゼ関連酵素の1つ又はそれ以上を含む。そのようなラッカーゼは、生化学及び分子生物学の国際連合の命名法委員会(Nomenclature Committee of the International Union of Biochemistry and Molecular Biology)(IUBMB)による、EC1.10.3.2に包含されるあらゆるラッカーゼ酵素を包含する。微生物及び植物に由来するラッカーゼ酵素は、当業界において知られている。微生物のラッカーゼ酵素は、細菌又は真菌(糸状菌及び酵母菌を含む)に由来するものであってもよい。好適な例には、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)(例えば、N.クラッサ(N. crassa))、ポドスポラ(Podospora)、ボトリティス(Botrytis)、コリビア(Collybia)、セレナ(Cerrena)(例えば、ユニカラー)、スタキボトリス(Stachybotrys)、パヌス(Panus)(例えばP.ルディス)、チエラビア(Thielavia)、フォメス(Fomes)、レンチヌス(Lentinus)、プルーロタス(Pleurotus)、トラメテス(Trametes)(例えば、T.ビロッサ(T. villosa)及びT.ベルシカラー(T. versicolor))、リゾクトニア(Rhizoctonia)(例えばR.ソラニ(R.solani)、コプリナス(Coprinus)(例えばC.プリカティリス(C.plicatilis)、C.シネレウス(C. cinereus))、ムジナタケ(Psatyrella)、ミセリオフトラ(例えばM.サーモンヒラ(thermonhila))、シタリディウム(Schytalidium)、フレビア(Phlebia)(例えばP.ラディタ(radita)(WO92/01046)、若しくはコリオルス(Coriolus)(例えばC.ヒルスタス(hirsutus)(JP2238885))、スポンジペリス(Spongipellis)、ポリポラス(Polyporus)、セリポリオプシス サブベルミスポラ(Ceriporiopsis subvermispora)、ガノデルマ ツノダエ(Ganoderma tsunodae)、並びに、トリコデルマ(Trichoderma)の種から由来する又は由来し得るラッカーゼが含まれる。
【0076】
ラッカーゼは、ラッカーゼをコードするヌクレオチド配列を含む組み換えDNAベクターでトランスフォームされた宿主細胞を培養することによって生産することができる。DNAベクターには、培地中におけるラッカーゼの発現を可能にし、また、その培養液からラッカーゼを選択的に回収できるようにするヌクレオチド配列がさらに含まれていてもよい。
【0077】
ラッカーゼ酵素をコードするポリヌクレオチド配列を含む発現ベクターを、適切な宿主細胞内にトランスフォームすることができる。宿主細胞は、糸状菌細胞のような真菌細胞であってもよく、その例は、以下に限定されないが、トリコデルマ[例えば、T.リーゼイ(従来、T.ロンギブラキアツム(longibrachiatum)として分類され、また、現在、ハイポクレアジェコリナ(Hypocrea jecorina)としても知られている)、T.ビリデ(Viride)、T.コニンジ(koningii)及びT.ハルジアヌム(harzianum)]、アスペルギルス(Aspergillus)(例えば、A.ニガー(A. niger)、A.ニデュランス(A. nidulans)、A.オリザエ(A. oryzae)及びA.アワモリ(A. awamori))、ペニシリウム(Penicillium)、フミコラ(Humicola)(例えば、H.インソレンズ(H. insolens)及びH.グリシー(H.grisea))、フザリウム(Fusarium)(例えばF.グラミナム(F. Graminum)及びF.ベネナツム(F.venenatum))、ニューロスポラ(Neurospora)、ボタンタケ(Hypocrea)、並びに、ケカビ(Mucor)の種を包含する。ラッカーゼ酵素の発現用の宿主細胞は、セレナ(Cerrena)(例えば、C.ユニカラー)の一種に由来するものであってもよい。真菌細胞は、当業界において知られている技術を使用して、細胞壁の再生を後に伴う、原形質体形成及び原形質体のトランスフォーメーションを含むプロセスによってトランスフォームすることができる。
【0078】
代替的に、宿主生物は、バチルス[例えば、B.サブチリス、B.リケニホルミス、B.レンタス、B.(ナウゲオバシラス)ステアロサーモフィラス、及び、B.ブレビス]、シュードモナスストレプトミセス(例えば、S.コエリカラー、S.リビダンス)、又は、大腸菌のような細菌の一種に由来するものであってもよい。細菌細胞のトランスフォーメーションは、例えば、「Maniatis, T. et al., "Molecular Cloning: A Laboratory Manual," Cold Spring Harbor, 1982」に記載されているように、従来の方法に従って実行することができる。適切なDNA塩基配列のスクリーニング及びベクターの構築もまた、標準的手順(上記参照)によって実行可能である。
【0079】
トランスフォームされた宿主細胞を培養するために使用される培地は、宿主細胞を培養するのに適した従来のあらゆる培地であり得る。いくつかの実施形態において、発現された酵素は、培地中に分泌され、その培地から公知の手順に従って回収することができる。ラッカーゼは、例えば、米国特許公開公報第2008/0196173号に記載されているような培地から回収することができる。いくつかの実施形態において、酵素は、細胞内で発現され、細胞膜の破壊後に回収される。
【0080】
特定の実施形態において、発現宿主は、CBH1プロモータ及びターミネータの制御下にラッカーゼコード領域を有するトリコデルマリーゼイであってもよい(例えば、米国特許第5,861,271号参照)。発現ベクターは、例えば、米国特許第7,413,887号に開示されているような、pTrex3gであってもよい。いくつかの実施形態において、ラッカーゼは、米国特許公開公報第2008/0196173号又は第2009/0221030号に記載されているように発現される。
【0081】
以下のラッカーゼ遺伝子及びラッカーゼは、米国公開公報第2008/0196173号に記載されている。
A.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼA1遺伝子
ポリヌクレオチド配列(配列番号1):
ATGAGCTCAA AGCTACTTGC TCTTATCACT GTCGCTCTCG TCTTGCCACT 50
AGGCACCGAC GCCGGCATCG GTCCTGTTAC CGACTTGCGC ATCACCAACC 100
AGGATATCGC TCCAGATGGC TTCACCCGAC CAGCGGTACT AGCTGGGGGC 150
ACATTCCCTG GAGCACTTAT TACCGGTCAG AAGGTATGGG AGATCAACTT 200
GGTTGAATAG AGAAATAAAA GTGACAACAA ATCCTTATAG GGAGACAGCT 250
TCCAAATCAA TGTCATCGAC GAGCTTACCG ATGCCAGCAT GTTGACCCAG 300
ACATCCATTG TGAGTATAAT TTAGGTCCGC TCTTCTGGCT ATCCTTTCTA 350
ACTCTTACCG TCTAGCATTG GCACGGCTTC TTTCAGAAGG GATCTGCGTG 400
GGCCGATGGT CCTGCCTTCG TTACTCAATG CCCTATCGTC ACCGGAAATT 450
CCTTCCTGTA CGACTTTGAT GTTCCCGACC AACCTGGTAC TTTCTGGTAC 500
CATAGTCACT TGTCTACTCA ATATTGCGAT GGTCTTCGTG GCCCGTTCGT 550
TGTATACGAT CCAAAGGATC CTAATAAACG GTTGTACGAC ATTGACAATG 600
GTATGTGCAT CATCATAGAG ATATAATTCA TGCAGCTACT GACCGTGACT 650
GATGCTGCCA GATCATACGG TTATTACCCT GGCAGACTGG TACCACGTTC 700
TCGCAAGAAC TGTTGTCGGA GTCGCGTAAG TACAGTCTCA CTTATAGTGG 750
TCTTCTTACT CATTTTGACA TAGGACACCC GACGCAACCT TGATCAACGG 800
TTTGGGCCGT TCTCCAGACG GGCCAGCAGA TGCTGAGTTG GCTGTCATCA 850
ACGTTAAACG CGGCAAACGG TATGTTATTG AACTCCCGAT TTCTCCATAC 900
ACAGTGAAAT GACTGTCTGG TCTAGTTATC GATTTCGTCT GGTCTCCATC 950
TCATGTGACC CTAATTACAT CTTTTCTATC GACAACCATT CTATGACTGT 1000
CATCGAAGTC GATGGTGTCA ACACCCAATC CCTGACCGTC GATTCTATTC 1050
AAATCTTCGC AGGCCAACGA TACTCGTTCG TCGTAAGTCT CTTTGCACGA 1100
TTACTGCTTC TTTGTCCATT CTCTGACCTG TTTAAACAGC TCCATGCCAA 1150
CCGTCCTGAA AACAACTATT GGATCAGGGC CAAACCTAAT ATCGGTACGG 1200
ATACTACCAC AGACAACGGC ATGAACTCTG CCATTCTGCG ATACAACGGC 1250
GCACCTGTTG CGGAACCGCA AACTGTTCAA TCTCCCAGTC TCACCCCTTT 1300
GCTCGAACAG AACCTTCGCC CTCTCGTGTA CACTCCTGTG GTATGTTTCA 1350
AAGCGTTGTA ATTTGATTGT GGTCATTCTA ACGTTACTGC GTTTGCATAG 1400
CCTGGAAACC CTACGCCTGG CGGCGCCGAT ATTGTCCATA CTCTTGACTT 1450
GAGTTTTGTG CGGAGTCAAC ATTCGTAAAG ATAAGAGTGT TTCTAATTTC 1500
TTCAATAATA GGATGCTGGT CGCTTCAGTA TCAACGGTGC CTCGTTCCTT 1550
GATCCTACCG TCCCCGTTCT CCTGCAAATT CTCAGCGGCA CGCAGAATGC 1600
ACAAGATCTA CTCCCTCCTG GAAGTGTGAT TCCTCTCGAA TTAGGCAAGG 1650
TCGTCGAATT AGTCATACCT GCAGGTGTCG TCGGTGGACC TCATCCGTTC 1700
CATCTCCATG GGGTACGTAA CCCGAACTTA TAACAGTCTT GGACTTACCC 1750
GCTGACAAGT GCATAGCATA ACTTCTGGGT CGTGCGAAGT GCCGGAACCG 1800
ACCAGTACAA CTTTAACGAT GCCATTCTCC GAGACGTCGT CAGTATAGGA 1850
GGAACCGGGG ATCAAGTCAC CATTCGTTTC GTGGTATGTT TCATTCTTGT 1900
GGATGTATGT GCTCTAGGAT ACTAACCGGC TTGCGCGTAT AGACCGATAA 1950
CCCCGGACCG TGGTTCCTCC ATTGCCATAT CGACTGGCAC TTGGAAGCGG 2000
GTCTCGCTAT CGTATTTGCA GAGGGAATTG AAAATACTGC TGCGTCTAAT 2050
TTAACCCCCC GTACGCGGTT TCCCTCACAT CCTGGAGCTA AGCAGCTTAC 2100
TAACATACAT TTGCAGAGGC TTGGGATGAG CTTTGCCCGA AGTATAACGC 2150
GCTCAGCGCA CAAAAGAAGG TTGCATCTAA GAAAGGCACT GCCATCTAAT 2200
TTTTGTAACA AACAAGGAGG GTCTCTTGTA CTTTTATTGG GATTTCTTTC 2250
TTGGGGTTTA TTGTTAAACT TGACTCTACT ATGTTTGGAA GACGAAAGGG 2300
GCTCGCGCAT TTATATACTA TCTCTCTTGG CATCACCTGC AGCTCAATCC 2350
TTCAACCACC TAA 2363
翻訳されたタンパク配列(配列番号2):
MSSKLLALIT VALVLPLGTD AGIGPVTDLR ITNQDIAPDG FTRPAVLAGG 50
TFPGALITGQ KGDSFQINVI DELTDASMLT QTSIHWHGFF QKGSAWADGP 100
AFVTQCPIVT GNSFLYDFDV PDQPGTFWYH SHLSTQYCDG LRGPFVVYDP 150
KDPNKRLYDI DNDHTVITLA DWYHVLARTV VGVATPDATL INGLGRSPDG 200
PADAELAVIN VKRGKRYRFR LVSISCDPNY IFSIDNHSMT VIEVDGVNTQ 250
SLTVDSIQIF AGQRYSFVLH ANRPENNYWI RAKPNIGTDT TTDSGMNSAI 300
LRYNGAPVAE PQTVQSPSLT PLLEQNLRPL VYTPVPGNPT PGGADIVHTL 350
DLSFDAGRFS INGASFLDPT VPVLLQILSG TQNAQDLLPP GSVIPLELGK 400
VVELVIPAGV VGGPHPFHLH GHNFWVVRSA GTDQYNFNDA ILRDVVSIGG 450
TGDQVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIE NTAASNLTPQ 500
AWDELCPKYN ALSAQKKLNP STT 523
B.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼA2遺伝子
ポリヌクレオチド配列(配列番号3):
ATGAGCTCAA AGCTACTTGC TCTTATTACT GTCGCTCTCG TCTTGCCACT 50
AGGCACTGAC GCCGGCATCG GTCCTGTTAC CGACTTGCGC ATCACCAACC 100
AGGATATCGC TCCAGATGGC TTCACCCGAC CAGCTGTACT GGCTGGGGGC 150
ACATTCCCCG GAGCACTGAT TACCGGTCAG AAGGTATGGG AGATCGATTT 200
CGTTGAATAG AGAAATACAA CTGAAAACAA ATTCTTATAG GGAGACAGCT 250
TCCAAATCAA TGTCATCGAC GAGCTTACCG ATGCCAGCAT GTTGACCCAG 300
ACATCCATTG TGAGTATAAT ATGGGTCCGC TCTTCTAGCT ATCCTTTCTA 350
ACTCTTACCC TCTAGCATTG GCACGGCTTC TTTCAGAAGG GATCTGCGTG 400
GGCCGATGGT CCTGCCTTCG TTACTCAATG TCCTATCGTC ACCGGAAATT 450
CCTTCCTGTA CGACTTTGAT GTCCCCGACC AACCTGGTAC TTTCTGGTAC 500
CATAGTCACT TGTCTACTCA ATATTGCGAT GGTCTTCGGG GCCCGTTCGT 550
TGTATACGAT CCAAAGGATC CTAATAAACG GTTGTACGAC ATTGACAATG 600
GTATGTGCAT CATCATAAAA ATATAATTCA TGCAGCTACT GACCGCGACT 650
GATGCTGCCA GATCATACGG TTATTACCCT GGCAGACTGG TACCACGTTC 700
TCGCACGAAC TGTTGTCGGA GTCGCGTAAG TACAGTCTGA CTTATAGTGG 750
TCTTCTTACT CATTTTGACA TAGGACACCC GACGCAACCT TGATCAACGG 800
TTTGGGCCGT TCTCCAGACG GGCCAGCAGA TGCTGAGTTG GCTGTCATCA 850
ACGTTAAACG CGGCAAACGG TATGTCATTG AACTCCCGAT TTCTCCATTC 900
ACATTGAAAT GACTGTCTGG TCTAGTTATC GATTCCGTCT GGTCTCCATC 950
TCATGTGACC CTAATTACAT CTTTTCTATC GACAACCATT CTATGACTGT 1000
CATCGAAGTC GATGGTGTCA ACACCCAATC CCTGACCGTC GATTCTATCC 1050
AAATCTTCGC AGGCCAACGC TACTCGTTCG TCGTAAGTCT CTTTGAATGG 1100
TTGGTGCTTT TTCTGTCCAT TCTCTAACCT GTTTATACAG CTCCATGCCA 1150
ACCGTCCTGA AAACAACTAT TGGATCAGGG CCAAACCTAA TATCGGTACG 1200
GATACTACCA CAGACAACGG CATGAACTCT GCCATTCTGC GATACAACGG 1250
CGCACCTGTT GCGGAACCGC AAACTGTTCA ATCTCCCAGT CTCACCCCTT 1300
TGCTCGAACA GAACCTTCGC CCTCTCGTGT ACACTCCTGT GGTATGTTTC 1350
AAAGCGTTGT AATTTGATTG TGGTCATTCT AACGTTACTG CCTTTGCACA 1400
GCCTGGAAAT CCTACGCCTG GCGGGGCCGA TATTGTCCAT ACTCTTGACT 1450
TGAGTTTTGT GCGGAGTCAA CATTCGTAAA GATAAGAGTG TTTCTAATTT 1500
CTTCAATAAT AGGATGCTGG TCGCTTCAGT ATCAACGGTG CCTCGTTCCT 1550
TGATCCTACC GTCCCTGTTC TCCTGCAAAT TCTCAGCGGC ACGCAGAATG 1600
CACAAGATCT ACTCCCTCCT GGAAGTGTGA TTCCTCTCGA ATTAGGCAAG 1650
GTCGTCGAAT TAGTCATACC TGCAGGTGTT GTCGGTGGAC CTCATCCGTT 1700
CCATCTCCAT GGGGTACGTA ACCCGAACTT ATAACAGTCT TGGACTTACC 1750
CGCTGACAAG TGTATAGCAT AACTTCTGGG TCGTGCGAAG TGCCGGAACC 1800
GACCAGTACA ACTTTAACGA TGCCATTCTC CGAGACGTCG TCAGTATAGG 1850
AGGAACCGAG GATCAAGTCA CCATTCGATT CGTGGTATAT ACTTCATTCT 1900
TGTGGATGTA TGTGCTCTAG GATACTAACT GGCTTGCGCG TATAGACCGA 1950
TAACCCCGGA CCGTGGTTCC TCCATTGCCA TATCGACTGG CACTTGGAAG 2000
CGGGTCTCGC TATCGTATTT GCAGAGGGAA TTGAAAATAC TGCTGCGTCT 2050
AATCCAACCC CCCGTATGCG GTTTCCCACA CATTCTGAAT CTAAGCAGCT 2100
TACTAATATA CATTTGCAGA GGCTTGGGAT GAGCTTTGCC CGAAGTATAA 2150
CGCGCTCAAC GCACAAAAGA AGGTTGCATC TAAGAAAGGC ACTGCCATCT 2200
AATCCTTGTA ACAAACAAGG AGGGTCTCTT GTACTTTTAT TGGGATTTAT 2250
TTCTTGGGGT TTATTGTTCA ACTTGATTCT ACTATGTTTG GAAGTAGCGA 2300
TTACGAAAGG GGCTTGCGCA TTTATATACC ATCTTTCTTG GCACCACCTG 2350
CAGCTCAATC CTTCAACCAC CTAA 2374
翻訳されたタンパク配列(配列番号4):
MSSKLLALIT VALVLPLGTD AGIGPVTDLR ITNQDIAPDG FTRPAVLAGG 50
TFPGALITGQ KGDSFQINVI DELTDASMLT QTSIHWHGFF QKGSAWADGP 100
AFVTQCPIVT GNSFLYDFDV PDQPGTFWYH SHLSTQYCDG LRGPFVVYDP 150
KDPNKRLYDI DNDHTVITLA DWYHVLARTV VGVATPDATL INGLGRSPDG 200
PADAELAVIN VKRGKRYRFR LVSISCDPNY IFSIDNHSMT VIEVDGVNTQ 250
SLTVDSIQIF AGQRYSFVLH ANRPENNYWI RAKPNIGTDT TTDNGMNSAI 300
LRYNGAPVAE PQTVQSPSLT PLLEQNLRPL VYTPVPGNPT PGGADIVHTL 350
DLSFDAGRFS INGASFLDPT VPVLLQILSG TQNAQDLLPP GSVIPLELGK 400
VVELVIPAGV VGGPHPFHLH GHNFWVVRSA GTDQYNFNDA ILRDVVSIGG 450
TEDQVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIE NTAASNPTPQ 500
AWDELCPKYN ALNAQKKLNP STT 523
C.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼB1遺伝子
ポリヌクレオチド配列(配列番号5):
ATGTCTCTTC TTCGTAGCTT GACCTCCCTC ATCGTACTAG TCATTGGTGC 50
ATTTGCTGCA ATCGGTCCAG TCACTGACCT ACATATAGTG AACCAGAATC 100
TCGACCCAGA TGGTTTCAAC CGCCCCACTG TACTCGCAGG TGGTACTTTC 150
CCCGGTCCTC TGATTCGTGG TAACAAGGTA CGCTTCATAA CCGCCCTCCG 200
TAGACGTAGG CTTCGGCTGA CATGACCATC ATCTGTAGGG AGATAACTTT 250
AAAATTAATG TGATTGACGA CTTGACAGAG CACAGTATGC TCAAGGCTAC 300
GTCCATCGTA AGTCCCTGAT TAACGTTTCA CCTGGTCATA TCGCTCAACG 350
TCTCGAAGCA CTGGCATGGG TTCTTCCAGA AGGGAACCAA CTGGGCCGAT 400
GGCCCCGCCT TTGTCACCCA ATGTCCTATC ACATCAGGAA ACGCCTTCCT 450
GTATGATTTC AACGTTCCGG ACCAAGCTGG TACTTTCTGG TACCACAGCC 500
ATCTCTCTAC ACAGTATTGT GACGGTCTTC GTGGTGCCTT TGTCGTCTAT 550
GATCCTAATG ATCCCAACAA GCAACTCTAT GATGTTGATA ACGGCAAGTT 600
CCTTGCATAT TTCATTTCTA TCATATCCTC ACCTGTATTG GCACAGAAAG 650
CACCGTGATT ACCTTGGCTG ATTGGTATCA TGCCCTTGCT CAGACTGTCA 700
CTGGTGTCGC GTGAGTGACA AATGGCCCTC AATTGTTCAC ATATTTTCCT 750
GATTATCATA TGATAGAGTA TCTGATGCAA CGTTGATCAA CGGATTGGGA 800
CGTTCGGCCA CCGGCCCCGC AAATGCCCCT CTGGCGGTCA TCAGTGTCGA 850
GCGGAATAAG AGGTCAGTTC CATAATTATG ATTATTTCCC GCGTTACTTC 900
CTAACAATTA TTTTTGTATC CCTCCACAGA TATCGTTTCC GATTGGTTTC 950
TATTTCTTGC GACCCTAACT TTATTTTCTC AATTGACCAC CACCCAATGA 1000
CCGTAATTGA GATGGACGGT GTTAATACCC AATCTATGAC CGTAGATTCG 1050
ATCCAAATAT TCGCAGGTCA ACGATATTCA TTTGTCGTAG GTTATTATAA 1100
ACTGCCCACC GATCATCTCT CACGTAACTG TTATAGATGC AAGCCAACCA 1150
ACCAGTTGGA AATTATTGGA TCCGCGCTAA ACCTAATGTT GGGAACACAA 1200
CTTTCCTTGG AGGCCTGAAC TCCGCTATAT TACGATATGT GGGAGCCCCT 1250
GACCAAGAAC CGACCACTGA CCAAACACCC AACTCTACAC CGCTCGTTGA 1300
GGCGAACCTA CGACCCCTCG TCTATACTCC TGTGGTATGT TGTTCTCGTT 1350
ACATATACCA AACCTAATAT GAAGACTGAA CGGATCTACT AGCCGGGACA 1400
GCCATTCCCT GGCGGTGCTG ATATCGTCAA GAACTTAGCT TTGGGTTTCG 1450
TACGTGTATT TCACTTCCCT TTTGGCAGTA ACTGAGGTGG AATGTATATA 1500
GAATGCCGGG CGTTTCACAA TCAATGGAGC GTCCCTCACA CCTCCTACAG 1550
TCCCTGTACT ACTCCAGATC CTCAGTGGTA CTCACAATGC ACAGGATCTT 1600
CTCCCAGCAG GAAGCGTGAT CGAACTTGAA CAGAATAAAG TTGTCGAAAT 1650
CGTTTTGCCC GCTGCGGGCG CCGTTGGCGG TCCTCATCCT TTTCACTTAC 1700
ATGGTGTAAG TATCAGACGT CCTCATGCCC ATATTGCTCC GAACCTTACA 1750
CACCTGATTT CAGCACAATT TCTGGGTGGT TCGTAGCGCC GGTCAAACCA 1800
CATACAATTT CAATGATGCT CCTATCCGTG ATGTTGTCAG TATTGGCGGT 1850
GCAAACGATC AAGTCACGAT CCGATTTGTG GTATGTATCT CGTGCCTTGC 1900
ATTCATTCCA CGAGTAATGA TCCTTACACT TCGGGTTCTC AGACCGATAA 1950
CCCTGGCCCA TGGTTCCTTC ACTGTCACAT TGACTGGCAT TTGGAGGCTG 2000
GGTTCGCTGT AGTCTTTGCG GAGGGAATCA ATGGTACTGC AGCTGCTAAT 2050
CCAGTCCCAG GTAAGACTCT CGCTGCTTTG CGTAATATCT ATGAATTTAA 2100
ATCATATCAA TTTGCAGCGG CTTGGAATCA ATTGTGCCCA TTGTATGATG 2150
CCTTGAGCCC AGGTGATACA TGA 2173
翻訳されたタンパク配列(配列番号6):
MSLLRSLTSL IVLVIGAFAA IGPVTDLHIV NQNLDPDGFN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN AFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GNTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWIRA KPNVGNTTFL GGLNSAILRY 300
VGAPDQEPTT DQTPNSTPLV EANLRPLVYT PVPGQPFPGG ADIVKNLALG 350
FNAGRFTING ASLTPPTVPV LLQILSGTHN AQDLLPAGSV IELEQNKVVE 400
IVLPAAGAVG GPHPFHLHGH NFWVVRSAGQ TTYNFNDAPI RDVVSIGGAN 450
DQVTIRFVTD NPGPWFLHCH IDWHLEAGFA VVFAEGINGT AAANPVPAAW 500
NQLCPLYDAL SPGDT 515
D.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼB2遺伝子
ポリヌクレオチド配列(配列番号7):
CACCGCGATG TCTCTTCTTC GTAGCTTGAC CTCCCTCATC GTACTAGCCA 50
CTGGTGCATT TGCTGCAATC GGTCCAGTCA CCGACCTACA TATAGTGAAC 100
CAGAATCTCG CCCCAGATGG TTTAAACCGC CCCACTGTAC TCGCAGGTGG 150
TACTTTCCCC GGTCCTCTGA TTCGTGGTAA CAAGGTACGC TTCATAACCG 200
CCCTCCGTAG ACGTAGGCTT CGGCTGACAT GACCATCATC TGTAGGGAGA 250
TAACTTTAAA ATTAATGTGA TTGACGACTT GACAGAACAC AGTATGCTCA 300
AGGCTACGTC CATTGTAAGT CCCTGATTAA CGTTTCACCT GGTCATATCG 350
CTCAACGTCT CGAAGCACTG GCATGGGTTC TTCCAGAAGG GAACCAACTG 400
GGCCGATGGC CCCGCCTTTG TCACCCAATG TCCTATCACA TCAGGAAACG 450
CCTTCTTGTA TGATTTCAAC GTTCCGGACC AAGCTGGTAC TTTCTGGTAC 500
CACAGCCATC TCTCYACACA GTATTGTGAC GGTCTTCGTG GTGCCTTTGT 550
CGTCTATGAT CCTAATGATC CCAACAAGCA ACTCTATGAT GTTGATAACG 600
GCAAGTCCCT TGCATATTTC AGTTCTATCA TATCCTCACC TGTATTGGCA 650
CAGAAAGCAC CGTGATTACC TTGGCTGATT GGTATCATGC CCTTGCTCAG 700
ACTGTCACTG GTGTCGCGTG AGTGACAAAT GGCCCTTAAT TGTTCACATA 750
TTTTCCTGAT TATCATATGA TAGAGTATCT GATGCAACGT TGATCAACGG 800
ATTGGGACGT TCGGCCACCG GCCCCGCAAA TGCCCCTCTG GCGGTCATCA 850
GTGTCGAGCG GAATAAGAGG TCAGTTCCAT AATTATGATT ATTTCCCGCG 900
TTACTTCCTA ACGATTATTT TTGTATCCCT CCACAGATAT CGTTTCCGAT 950
TGGTTTCTAT TTCTTGCGAC CCTAACTTTA TTTTCTCAAT TGACCACCAC 1000
CCAATGACCG TAATTGAGAT GGACGGTGTT AATACCCAAT CTATGACCGT 1050
AGATTCGATC CAAATATTCG CAGGTCAACG ATATTCATTT GTCGTAGGTT 1100
ATTATAAACT GCCCACCGAT CATCTCTCAC GTAACTGTTA TAGATGCAAG 1150
CCAACCAACC AGTTGGAAAT TATTGGATCC GYGCTAAACC TAATGTTGGG 1200
AACACAACTT TCCTTGGAGG CCTGAACTCC GCTATATTAC GATATGTGGG 1250
AGCCCCTGAC CAAGAACCGA CCACTGACCA AACACCCAAC TCTACACCGC 1300
TCGTCGAGGC GAACCTACGT CCCCTCGTCT ATACTCCTGT GGTATGTTGT 1350
TCTCGTTACA TATACCAAAC CTAATATGAG GACTGAACGG ATCTACTAGC 1400
CGGGACAGCC ATTCCCTGGC GGTGCTGATA TCGTCAAGAA CTTAGCTTTG 1450
GGTTTCGTAC GTGTATTTCA CTTCCCTTTT GGCAGTAACT GAGGTGGAAT 1500
GTATATAGAA TGCCGGGCGT TTCACAATCA ATGGAACATC CTTCACACCT 1550
CCTACAGTCC CTGTACTACT CCAGATCCTC AGTGGTACTC ACAATGCACA 1600
GGATCTTCTT CCAGCAGGAA GCGTGATCGA ACTTGAACAG AATAAAGTTG 1650
TCGAAATCGT TCTGCCCGCT GCGGGCGCCG TTGGCGGTCC TCATCCTTTC 1700
CACTTACATG GTGTAAGTAT CAGACGTCCT CATGCCTATA TTGCTCCGAA 1750
CCTTACACAC CTGATTTCAG CACAATTTCT GGGTGGTTCG TAGCGCCGGT 1800
CAAACCACAT ACAATTTCAA TGATGCTCCT ATCCGTGATG TTGTCAGTAT 1850
TGGCGGTGCA AACGATCAAG TCACGATCCG ATTTGTGGTA TGTATCTCGT 1900
GCCTTGCATT CATTCCACGA GTAATGATCC TTACACTTCG GGTTCTCAGA 1950
CCGATAACCC TGGCCCATGG TTCCTTCACT GTCACATTGA CTGGCATTTG 2000
GAGGCTGGGT TCGCTGTAGT CTTTGCGGAG GGAATCAATG GCACTGCAGC 2050
TGCTAATCCA GTCCCAGGTA AGACTCTCGC TGCTTTGCGT AATATCTATG 2100
AATTTAAAGC ATATCAATTT GCAGCGGCTT GGAATCAATT GTGCCCGTTG 2150
TATGATGCCT TGAGCCCAGG TGATACATGA TTACTCGTAG CTGTGCTTTC 2200
TTATACATAT TCTATGGGTA TATCGGAGTA GCTGTACTAT AGTATGTACT 2250
ATACTAGGTG GGATATGYTG ATGTTGATTT ATATAATTTT GTTTGAAGAG 2300
TGACTTTATC GACTTGGGAT TTAGCCGAGT ACATACTGAT CTCTCACTAC 2350
AGGCTTGTTT TGTCTTTGGG CGCTTACTCA ACAGTTGACT GTTTTTGCTA 2400
TTACGCATTG AACCGCATTC CGGTCYGACT CGTGTCCTCT ACTGTGACTT 2450
GTATTGGCAT TCTAGCACAT ATGTCTCTTA CCTATAGGAA CAATATGTCT 2500
CAACACTGTT CCAAAACCTG CGTAAACCAA ATATCGTCCA TCAGATCAGA 2550
TCATTAACAG TGCCGCACTA ACCTAATACA CTGGCARGGA CTGTGGAAAT 2600
CCCTATAAAT GACCTCTAGA CCGTGAGGTC ATTGCAAGGT CGCTCTCCTT 2650
GTCAAGATGA CCC 2663
翻訳されたタンパク配列(配列番号8):
MSLLRSLTSL IVLATGAFAA IGPVTDLHIV NQNLAPDGLN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN AFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GNTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWIRA KPNVGNTTFL GGLNSAILRY 300
VGAPDQEPTT DQTPNSTPLV EANLRPLVYT PVPGQPFPGG ADIVKNLALG 350
FNAGRFTING TSFTPPTVPV LLQILSGTHN AQDLLPAGSV IELEQNKVVE 400
IVLPAAGAVG GPHPFHLHGH NFWVVRSAGQ TTYNFNDAPI RDVVSIGGAN 450
DQVTIRFVTD NPGPWFLHCH IDWHLEAGFA VVFAEGINGT AAANPVPAAW 500
NQLCPLYDAL SPGDT 515
E.ATCC20013株に由来するセレナ(Cerrena)ラッカーゼB3遺伝子(一部)
ポリヌクレオチド配列(配列番号:9):
GTGGGGGCGG ATCCCTAACT GTTTCGAATC GGCACCGAAG TATGCAGGTG 50
TGACGGAGAT GAGGCGTTTT TTCATCTTCC ACTGCAGTAT AAAATGTCTC 100
AGGTAACGTC CAGCTTTTTG TACCAGAGCT ACCTCCAAAT ACCTTTACTC 150
GCAAAGGTTT CGCGATGTCT CTTCTTCGTA GCTTGACCTC CCTCATCGTA 200
CTAGCCACTG GTGCATTTGC TGCAATCGGT CCAGTCACTG ACCTACATAT 250
AGTGAACCAG AATCTCGCCC CAGATGGTTT CAACCGCCCC ACTGTACTCG 300
CAGGTGGTAC TTTCCCCGGT CCTCTGATTC GTGGTAACAA GGTACGCTTC 350
ATAACCGCCC TCCGTAGACG TAGGCTTCGG CTGACATGAC CATCATCTGT 400
AGGGAGATAA CTTTAAAATT AATGTGATTG ACGACTTGAC AGAACACAGT 450
ATGCTCAAGG CCACGTCCAT TGTAAGTCCC TGATTAACGT TTCACCTGGT 500
CATATCGCTC AACGTCTCGA AGCACTGGCA TGGGTTCTTC CAGAAGGGAA 550
CCAACTGGGC CGATGGCCCC GCCTTTGTCA CCCAATGTCC TATCACATCA 600
GGAAACTCCT TCCTGTATGA TTTCAACGTT CCGGACCAAG CTGGTACTTT 650
CTGGTACCAC AGCCATCTCT CTACACAGTA TTGTGACGGT CTTCGTGGTG 700
CCTTTGTCGT CTATGATCCT AATGATCCCA ACAAGCAACT CTATGATGTT 750
GATAACGGCA AGTCCCTTGC ATATTTCATT TCTATCATAT CCTCACCTGT 800
ATTGGCACAG AAAGCACCGT GATTACCTTG GCTGATTGGT ATCATGCCCT 850
TGCTCAGACT GTCACTGGTG TCGCGTGAGT GACAAATGGC CCTCAATTGT 900
TCACATATTT TCCTGATTAT CATATGATAG AGTATCTGAT GCAACGTTGA 950
TCAACGGATT GGGACGTTCG GCCACCGGCC CCGCAAATGC CCCTCTGGCG 1000
GTCATCAGTG TCGAGCGGAA TAAGAGGTCA GTTCCATAAT TATGATTATT 1050
TCCCGCGTTA CTTCCTAACA ATTATTCTTG TATCCCTCCA CAGATATCGC 1100
TTCCGATTGG TGTCTATTTC TTGCGACCCT AACTTTATTT TCTCAATTGA 1150
TCACCACCCA ATGACCGTAA TTGAGATGGA CGGTGTTAAT ACCCAATCTA 1200
TGACCGTAGA TTCGATCCAA ATATTCGCAG GTCAACGATA TTCATTTGTC 1250
GTAGGTTATT ATAAACTGCC CACCGATCAT CTCTCACGTA ACTGTTATAG 1300
ATGCAAGCCA ACCAACCRGT TGGAAATTAT TGGATCC 1337
翻訳されたタンパク配列(配列番号10):
MSLLRSLTSL IVLATGAFAA IGPVTDLHIV NQNLAPDGFN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN SFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GKTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWI 278
F.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼC遺伝子(一部)
ポリヌクレオチド配列(配列番号11):
TGCAATCGGA CCGGTBGCTG ACCTTCACAT TACGGACGAT ACCATTGCCC 50
CCGATGGTTT CTCTCGTCCT GCTGTTCTCG CTGGCGGGGG TTTCCCTGGC 100
CCTCTCATCA CCGGAAACAA GGTAATGCCT AATGGTTGCG TCTTTGTTGG 150
TGCTCTCATT CATCCACGAC ATTTTGTACC AGGGCGACGC CTTTAAACTC 200
AATGTCATCG ATGAACTAAC GGACGCATCC ATGCTGAAGY CGACTTCCAT 250
CGTAAGTCTC GCTGTATTGC TCCTTGAGCC ATTTCATTGA CTATAACTAC 300
AACCAGCACT GGCATGGATT CTTCCAAAAG GGTACTAATT GGGCAGATGG 350
TCCCGCTTTT GTGAACCAAT GCCCCATCAC CACGGGAAAC TCCTTCTTGT 400
ACGACTTCCA GGTTCCTGAT CAAGCTGGTA AGCATGAGAT TACACTAGGA 450
AAGTTTAATT TAATAACTAT TCAATCAGGA ACCTACTGGT ATCATAGTCA 500
TTTGTCTACG CAATACTGTG ATGGTCTCAG AGGTGCATTC GTTGTCTACG 550
ACCCTTCAGA TCCTCACAAG GATCTCTACG ACGTCGACGA CGGTGAGCTT 600
TGCTTTTTTC ATTGGTATCC ATTATCGCTC ACGTGTCATT ACTGCGCCAC 650
AGAAAGTACC GTCATCACTT TGGCTGATTG GTATCATACT TTGGCTCGTC 700
AGATTGTTGG CGTTGCGTGA GTAGTCTTGT ACCGACTGAA ACATATTCCA 750
GTTGCTGACT TCCCCACAGC ATTTCTGATA CTACCTTGAT AAACGGTTTG 800
GGCCGCAATA CCAATGGTCC GGCTGATGCT GCTCTTGCTG TGATCAATGT 850
TGACGCTGGC AAACGGTGTG TCCAGATTAC TATACTCCCC ATGACGTCTC 900
AATGCTGATG TGTACTACTT CCAGGTACCG TTTCCGTCTT GTTTCCATAT 950
CCTGTGACCC CAATTGGGTA TTCTCGATTG ACAACCATGA CTTTACGGTC 1000
ATTGAAGTCG ATGGTGTTAA CAGTCAACCT CTCAACGTCG ATTCTGTTCA 1050
GATCTTCGCC GGACAACGTT ACTCGTTCGT 1080
翻訳されたタンパク配列(配列番号12):
AIGPVADLHI TDDTIAPDGF SRPAVLAGGG FPGPLITGNK GDAFKLNVID 50
ELTDASMLKX TSIHWHGFFQ KGTNWADGPA FVNQCPITTG NSFLYDFQVP 100
DQAGTYWYHS HLSTQYCDGL RGAFVVYDPS DPHKDLYDVD DESTVITLAD 150
WYHTLARQIV GVAISDTTLI NGLGRNTNGP ADAALAVINV DAGKRYRFRL 200
VSISCDPNWV FSIDNHDFTV IEVDGVNSQP LNVDSVQIFA GQRYSF 246
G.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼD1遺伝子
ポリヌクレオチド配列(配列番号13):
GATTCTAATA GACCAGGCAT ACCAAGAGAT CTACAGGTTG ACAGACCATT 50
CTTCTAGGCG GCATTTATGC TGTAGCGTCA GAAATTATCT CTCCATTTGT 100
ATCCCACAGG TCCTGTAATA ACACGGAGAC AGTCCAAACT GGGATGCCTT 150
TTTTCTCAAC TATGGGCGCA CATAGTCTGG ACGATGGTAT ATAAGACGAT 200
GGTATGAGAC CCATGAAGTC AGAACACTTT TGCTCTCTGA CATTTCATGG 250
TTCACACTCT CGAGATGGGA TTGAACTCGG CTATTACATC GCTTGCTATC 300
TTAGCTCTGT CAGTCGGAAG CTATGCTGCA ATTGGGCCCG TGGCCGACAT 350
ACACATTGTC AACAAAGACC TTGCTCCAGA TGGCGTACAA CGTCCAACCG 400
TGCTTGCCGG AGGCACTTTT CCTGGGACGT TGATCACCGG TCAGAAAGTA 450
AGGGATATTA GTTTGCGTCA AAGAGCCAAC CAAAACTAAC CGTCCCGTAC 500
TATAGGGTGA CAACTTCCAG CTCAATGTCA TCGATGATCT TACCGACGAT 550
CGGATGTTGA CGCCAACTTC CATTGTGAGC CTATTATTGT ATGATTTATC 600
CGAATAGTTT CGCAGTCTGA TCATTGGATC TCTATCGCTA GCATTGGCAC 650
GGTTTCTTCC AGAAGGGAAC CGCTTGGGCC GACGGTCCCG CCTTCGTAAC 700
TCAGTGCCCT ATAATAGCAG ATAACTCTTT TCTGTATGAC TTCGACGTCC 750
CAGACCAAGC TGGTACTTTC TGGTATCATA GTCATCTATC CACTCAGTAC 800
TGTGACGGTT TACGTGGTGC CTTCGTTGTG TACGATCCTA ACGATCCTCA 850
CAAAGACCTA TACGATGTTG ATGACGGTGG GTTCCAAATA TTTGTTCTGC 900
AGACATTGTA TTGACGGTGT TCATTATAAT TTCAGAGAGC ACCGTGATTA 950
CCCTTGCGGA TTGGTACCAT GTTCTCGCCC AGACCGTTGT CGGCGCTGCG 1000
TGAGTAACAC ATACACGCGC TCCGGCACAC TGATACTAAT TTTTTTTTAT 1050
TGTAGCACTC CTGATTCTAC CTTGATCAAC GGGTTAGGCC GTTCACAGAC 1100
CGGACCCGCT GATGCTGAGC TGGCTGTTAT CAGCGTTGAA CATAACAAAC 1150
GGTATGTCAT CTCTACCCAG TATCTTCTCT CCTGCTCTAA TTCGCTGTTT 1200
CACCATAGAT ACCGTTTCCG TTTGGTTTCG ATTTCGTGCG ACCCCAACTT 1250
TACCTTCTCC GTTGATGGTC ATAATATGAC TGTCATCGAA GTCGATGGTG 1300
TCAACACACG ACCCCTGACC GTTGACTCTA TTCAAATCTT CGCCGGACAG 1350
AGGTATTCCT TTGTCGTAAG TTAATCGATA TATTCTCCTT ATTACCCCTG 1400
TGTAATTGAT GTCAATAGCT CAATGCTAAC CAACCCGAAG ACAATTACTG 1450
GATCCGTGCT ATGCCAAACA TCGGTAGAAA TACAACAACA CTGGACGGAA 1500
AGAATGCCGC TATCCTTCGA TACAAGAATG CTTCTGTAGA AGAGCCCAAG 1550
ACCGTTGGGG GCCCCGCTCA ATCCCCGTTG AATGAAGCGG ACCTGCGTCC 1600
ACTCGTACCT GCTCCTGTGG TATGTCTTGT CGCGCTGTTC CATCGCTATT 1650
TCATATTAAC GTTTTGTTTT TGTCAAGCCT GGAAACGCTG TTCCAGGTGG 1700
CGCAGACATC AATCACAGGC TTAACTTAAC TTTCGTACGT ACACCTGGTT 1750
GAAACATTAT ATTTCCAGTC TAACCTCTCT TGTAGAGTAA CGGCCTCTTC 1800
AGCATCAACA ACGCCTCCTT CACTAATCCT TCGGTCCCCG CCTTATTACA 1850
AATTCTGAGC GGTGCTCAGA ACGCTCAAGA TTTACTTCCA ACGGGTAGTT 1900
ACATTGGCCT TGAACTAGGC AAGGTTGTGG AGCTCGTTAT ACCTCCTCTG 1950
GCAGTTGGAG GACCGCACCC TTTCCATCTT CATGGCGTAA GCATACCACA 2000
CTCCCGCAGC CAGAATGACG CAAACTAATC ATGATATGCA GCACAATTTC 2050
TGGGTCGTCC GTAGTGCAGG TAGCGATGAG TATAACTTTG ACGATGCTAT 2100
CCTCAGGGAC GTCGTRAGCA TTGGAGCGGG GACTGATGAA GTCACAATCC 2150
GTTTCGTGGT ATGTCTCACC CCTCGCATTT TGAGACGCAA GAGCTGATAT 2200
ATTTTAACAT AGACCGACAA TCCGGGCCCG TGGTTCCTCC ATTGCCATAT 2250
TGATTGGCAT TTGGAGGCAG GCCTTGCCAT CGTCTTCGCT GAGGGCATCA 2300
ATCAGACCGC TGCAGCCAAC CCAACACCCC GTACGTGACA CTGAGGGTTT 2350
CTTTATAGTG CTGGATTACT GAATCGAGAT TTCTCCACAG AAGCATGGGA 2400
TGAGCTTTGC CCCAAATATA ACGGGTTGAG TGCGAGCCAG AAGGTCAAGC 2450
CTAAGAAAGG AACTGCTATT TAAACGTGGT CCTAGACTAC GGGCATATAA 2500
GTATTCGGGT AGCGCGTGTG AGCAATGTTC CGATACACGT AGATTCATCA 2550
CCGGACACGC TGGGACAATT TGTGTATAAT GGCTAGTAAC GTATCTGAGT 2600
TCTGGTGTGT AGTTCAAAGA GACAGCCCTT CCTGAGACAG CCCTTCCTGA 2650
GACAGCCCTT CCTGAGACGT GACCTCCGTA GTCTGCACAC GATACTYCTA 2700
AATACGTATG GCAAGATGAC AAAGAGGAGG ATGTGAGTTA CTACGAACAG 2750
AAATAGTGCC CGGCCTCGGA GAGATGTTCT TGAATATGGG ACTGGGACCA 2800
ACATCCGGA 2809
翻訳されたタンパク配列(配列番号14):
MGLNSAITSL AILALSVGSY AAIGPVADIH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPEDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
H.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼD2遺伝子
ポリヌクレオチド配列(配列番号15):
GATCTGGACG ATGGTATATA AGACGATGGT ATGAGACCCA TGAAGTCTGA 50
ACACTTTTGC TCTCTGACAT TTCATGGTTC ATACTCTCGA GATGGGATTG 100
AACTCGGCTA TTACATCGCT TGCTATCTTA GCTCTGTCAG TCGGAAGCTA 150
TGCTGCAATT GGGCCCGTGG CCGACATACA CATTGTCAAC AAAGACCTTG 200
CTCCAGATGG TGTACAACGT CCAACCGTGC TCGCCGGAGG CACTTTTCCT 250
GGGACGTTGA TCACCGGTCA GAAAGTAAGG AATATTAGTT TGCGTCAAAG 300
AGCCAACCAA AATTAACCGT CCCGTCCCAT AGGGTGACAA CTTCCAGCTC 350
AATGTCATTG ATGATCTTAC CGACGATCGG ATGTTGACAC CAACTTCCAT 400
TGTGAGCCTA TTATTGTATG ATTTATCCGT ATAGTTTCTC AGTCTGATCA 450
TTGGCTCTCT ATCGCTAGCA TTGGCACGGT TTCTTCCAGA AGGGAACCGC 500
TTGGGCCGAC GGTCCCGCCT TCGTAACTCA GTGCCCTATA ATAGCAGATA 550
ACTCTTTTCT GTATGACTTC GACGTCCCCG ACCAAGCTGG TACTTTCTGG 600
TATCATAGTC ATCTATCCAC TCAGTACTGT GACGGTTTAC GTGGTGCCTT 650
CGTTGTGTAC GATCCTAACG ATCCTCACAA AGACCTATAC GATGTTGATG 700
ACGGTGGGTT CCAAATACTT GACCAAGAAA CATTATATTG ATAGTATCCA 750
CTCTGATTTT CAGAGAGCAC CGTGATTACC CTTGCGGATT GGTACCATGT 800
TCTCGCCCAG ACCGTTGTCG GCGCTGCGTG AGTAACACAT ACACGCGCTC 850
CGGCACACTG ATACTAATTT TTTATTGTAG CACTCCTGAT TCTACCTTGA 900
TCAACGGGTT AGGCCGTTCA CAGACCGGAC CCGCTGATGC TGAGCTGGCT 950
GTTATCAGCG TTGAACATAA CAAACGGTAT GTCATCTCTA CCCATTATCT 1000
TCTCTCCTGC TTTAATTCGC TGTTTCACCA TAGATACCGA TTCCGTTTGG 1050
TTTCGATTTC GTGCGACCCC AACTTTACCT TCTCCGTTGA TGGTCATAAT 1100
ATGACTGTCA TCGAAGTCGA CGGTGTCAAC ACACGACCCC TGACCGTTGA 1150
CTCTATTCAA ATCTTCGCCG GACAGAGGTA TTCCTTTGTC GTAAGTTAAT 1200
CGATATATTC TCCCTATTAC CCCTGTGTAA TTGATGTCAA CAGCTCAATG 1250
CTAACCAACC CGACGACAAT TACTGGATCC GTGCTATGCC AAACATCGGT 1300
AGAAATACAA CAACACTGGA CGGAAAGAAT GCCGCTATCC TTCGATACAA 1350
GAATGCTTCT GTAGAAGAGC CCAAGACCGT TGGGGGCCCC GCTCAATCCC 1400
CGTTGAATGA AGCGGACCTG CGTCCACTCG TACCTGCTCC TGTGGTATGT 1450
CTTGTCGTGC TGTTCCATCG CTATTTCATA TTAACGTTTT GTTTTTGTCA 1500
AGCCTGGAAA CGCTGTTCCA GGTGGCGCAG ACATCAATCA CAGGCTTAAC 1550
TTAACTTTCG TACGTACACC TGGTTGAAAC ATTATATTTC CAGTCTAACC 1600
TCTTGTAGAG TAACGGCCTT TTCAGCATCA ACAACGCCTC CTTCACTAAT 1650
CCTTCGGTCC CCGCCTTATT ACAAATTCTG AGCGGTGCTC AGAACGCTCA 1700
AGATTTACTT CCAACGGGTA GTTACATTGG CCTTGAACTA GGCAAGGTTG 1750
TGGAGCTCGT TATACCTCCT CTGGCAGTTG GAGGACCGCA CCCTTTCCAT 1800
CTTCATGGCG TAAGCATACC ACACTCCCGC AGCCAGAATG ACGCAAACTA 1850
ATCATGATAT GCAGCACAAT TTCTGGGTCG TCCGTAGTGC AGGTAGCGAT 1900
GAGTATAACT TTGACGATGC TATCCTCAGG GACGTCGTGA GCATTGGAGC 1950
GGGGACTGAT GAAGTCACAA TCCGTTTCGT GGTATGTCTC ACCCCTCGCA 2000
TTTTGAGACG CAAGAGCTGA TATATTTTAA CATAGACCGA CAATCCGGGC 2050
CCGTGGTTCC TCCATTGCCA TATTGATTGG CATTTGGAGG CAGGCCTTGC 2100
CATCGTCTTC GCTGAGGGCA TCAATCAGAC CGCTGCAGCC AACCCAACAC 2150
CCCGTACGTG ACACTGAGGG TTTCTTTATA GTGCTGGATT ACTGAATCGA 2200
GATTTCTCCA CAGAAGCATG GGATGAGCTT TGCCCCAAAT ATAACGGGTT 2250
GAGTGCGAGC CAGAAGGTCA AGCCTAAGAA AGGAACTGCT ATTTAAACG 2299
翻訳されたタンパク配列(配列番号16):
MGLNSAITSL AILALSVGSY AAIGPVADIH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPDDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
I.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼE遺伝子(一部)
ポリヌクレオチド配列(配列番号17):
TGCAATCGGA CCGGTGGCCG ACCTCAAGAT CGTAAACCGA GACATTGCAC 50
CTGACGGTTT TATTCGTCCC GCCGTTCTCG CTGGAGGGTC GTTCCCTGGT 100
CCTCTCATTA CAGGGCAGAA AGTACGTTAC GCTATCTCGG TGCTTTGGCT 150
TAATTAAACT ATTTGACTTT GTGTTCTCTT AGGGGAACGA GTTCAAAATC 200
AATGTAGTCA ATCAACTGAC CGATGGTTCT ATGTTAAAAT CCACCTCAAT 250
CGTAAGCAGA ATGAGCCCTT TGCATCTCGT TTTATTGTTA ATGCGCCCAC 300
TATAGCATTG GCATGGATTC TTCCAGAAGG GAACAAACTG GGCAGACGGT 350
CCTGCGTTCG TGAACCAATG TCCAATCGCC ACGAACAATT CGTTCTTGTA 400
TCAGTTTACC TCACAGGAAC AGCCAGGTGA GTATGAGATG GAGTTCATCC 450
GAGCATGAAC TGATTTATTT GGAACCTAGG CACATTTTGG TACCATAGTC 500
ATCTTTCCAC ACAATACTGC GATGGTTTGC GAGGGCCACT CGTGGTGTAT 550
GACCCACAAG ACCCGCATGC TGTTCTCTAC GACGTCGACG ATGGTTCGTA 600
CTTCGCATAT CCACGCTCGC TTTCATACAA TGTAAACTTT GTTCCTCCAG 650
AAAGTACAAT CATCACGCTC GCGGATTGGT ATCATACCTT GGCTCGGCAA 700
GTGAAAGGCC CAGCGTAAGG CACTTTAGTG TTTCCTCATA GTCCAAGAAA 750
TTCTAACACG CCTTCTTCAT CAGGGTTCCT GGTACGACCT TGATCAACGG 800
GTTGGGGCGT CACAACAATG GTCCTCTAGA TGCTGAACTA GCGGTGATCA 850
GTGTTCAAGC CGGCAAACGG CAAGTTCAAT TCACACTTTT CACTCTGTAC 900
CTTCTTCCTG ACATTCTTTT CTTGTAGTTA CCGCTTCCGC CTGATTTCAA 950
TTTCATGCGA TCCCAACTAC GTATTCTCCA TTGATGGCCA TGATATGACT 1000
GTCATCGAAG TGGATAGTGT TAACAGTCAA CCTCTCAAGG TAGATTCTAT 1050
CCAAATATTT GCAGGTCAGA GATATTCGTT CGTGGTGAGT CAGATCAGGG 1100
CATATCCTTT TGTCGATACG TCATTGACCA TATAATGCTA CAAGCTGAAT 1150
GCCAACCAAC CAG 1163
翻訳されたタンパク配列(配列番号18):
AIGPVADLKI VNRDIAPDGF IRPAVLAGGS FPGPLITGQK GNEFKINVVN 50
QLTDGSMLKS TSIHWHGFFQ KGTNWADGPA FVNQCPIATN NSFLYQFTSQ 100
EQPGTFWYHS HLSTQYCDGL RGPLVVYDPQ DPHAVLYDVD DESTIITLAD 150
WYHTLARQVK GPAVPGTTLI NGLGRHNNGP LDAELAVISV QAGKRQVQFT 200
LFTLYRFRLI SISCDPNYVF SIDGHDMTVI EVDSVNSQPL KVDSIQIFAG 250
QRYSFVLNAN QP 262
以下のアミノ酸配列(配列番号19:シグナル配列はイタリック体)を有するラッカーゼD酵素は、本明細書に記載されている方法において使用可能である。
MGLNSAITSL AILALSVGSY AAIGPVADLH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPEDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
このポリペプチドの処理された成熟形態は、以下のとおりである(配列番号20)。
AIGPVADLHIVNKDLAPDGVQRPTVLAGGTFPGTLITGQKGDNFQLNVIDDLTDDRMLTPTSIHWHGFFQKGTAWADGPAFVTQCPIIADNSFLYDFDVPDQAGTFWYHSHLSTQYCDGLRGAFVVYDPNDPHKDLYDVDDGGTVITLADWYHVLAQTVVGAATPDSTLINGLGRSQTGPADAELAVISVEHNKRYRFRLVSISCDPNFTFSVDGHNMTVIEVDGVNTRPLTVDSIQIFAGQRYSFVLNANQPEDNYWIRAMPNIGRNTTTLDGKNAAILRYKNASVEEPKTVGGPAQSPLNEADLRPLVPAPVPGNAVPGGADINHRLNLTFSNGLFSINNASFTNPSVPALLQILSGAQNAQDLLPTGSYIGLELGKVVELVIPPLAVGGPHPFHLHGHNFWVVRSAGSDEYNFDDAILRDVVSIGAGTDEVTIRFVTDNPGPWFLHCHIDWHLEAGLAIVFAEGINQTAAANPTPQAWDELCPKYNGLSASQKVKPKKGTAI
【0082】
いくつかの実施形態において、本発明の組成物及び方法において使用するのに適したラッカーゼ酵素は、細胞からの完全長ポリペプチドの分泌を導くために使用することができるシグナル配列を欠く成熟ポリペプチドである。適切な成熟ポリペプチドは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19、及び、配列番号20からなる群より選択されるアミノ酸配列に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超えるアミノ酸配列同一性を有していてもよい。本明細書に記載されている分析及び手順を使用して決定したときに、そのようなポリペプチドが、酵素的ラッカーゼ活性を有することが好ましい。
【0083】
いくつかの実施形態において、本発明の組成物及び方法において使用するのに適したラッカーゼ酵素は、完全長の又は成熟した親/基準配列に比べると切断されたものである。そのような切断されたペプチドは、完全長の又は成熟したポリペプチド配列のタンパク分解によって、又は、切断されたペプチドをコードするようにポリヌクレオチドを設計することによって生成され得る。典型的なポリペプチドは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列と比較して、アミノ及び/又はカルボキシル末端において切断されたものである。切断部分は、少数(例えば、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸残基であってもよいし、又は、構造ドメイン又は機能ドメインの全体であってもよい。適切な切断されたペプチドは、上記参照アミノ酸配列の1つ又はそれ以上の対応部分に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超えるアミノ酸配列の同一性を有していてもよい。好ましくは、本明細書に記載されている分析及び手順を使用して決定されるように、そのようなポリペプチドは、酵素的ラッカーゼ活性を有する。
【0084】
伝達物質
いくつかの実施形態において、酵素的酸化の系、組成物及び方法は、ラッカーゼ酵素の活性を増強する化学伝達物質剤の1つ又はそれ以上をさらに含む。伝達物質(エンハンサ又はアクセラレータとも呼ばれる)は、酸化酵素活性を示す酵素と、染料、色素(例えば藍)、発色基(例えば、色のついた汚れの中の、例えば、ポリフェノール、アントシアニン又はカロチノイド)、又は、他の第2基質若しくは電子供与体と間で有効に電子を輸送するための酸化還元伝達物質として作用する化学物質である。
【0085】
いくつかの実施形態において、化学伝達物質は、例えば、PCT出願WO95/01426及びWO96/12845に記載されているように、フェノール化合物、例えば、シリンガ酸メチル、又は、関連化合物である。伝達物質は、例えば、N−ヒドロキシベンゾトリアゾール、ビオルル酸、N−ヒドロキシアセトアニリドのようなN−ヒドロキシ化合物、N−オキシム化合物又はN−オキシド化合物であってもよい。伝達物質は、例えば、フェノチアジン−10−プロピオネートのようなフェノキサジン/フェノチアジン化合物でもあってもよい。伝達物質は、2,2’−アジノビス−(3−エチルベンゾチアゾリン−6−スルホン酸でもあり得る。他の化学伝達物質は、例えば、PCT出願WO95/01426に開示されている化合物(この化合物は、ラッカーゼ活性を増大させることがわかっている)のように、当業界において周知である。伝達物質は、アセトシリンゴン、シリンガ酸メチル、シリンガ酸エチル、シリンガ酸プロピル、シリンガ酸ブチル、シリンガ酸ヘキシル又はシリンガ酸オクチルであってもよい。
【0086】
いくつかの実施形態において、伝達物質は、例えば、4−(N−メチルカルボキシアミド)−2,6−ジメトキシフェノール、4−[N−(2−ヒドロキシエチル)カルボキシアミド]−2,6−ジメトキシフェノール)、又は、4−(N,N−ジメチルカルボキシアミド)−2,6−ジメトキシフェノールのような、4−シアノ−2,6−ジメトキシフェノール、4−カルボキシアミド−2,6−ジメトキシフェノール、又は、これらのN置換誘導体である。
【0087】
いくつかの実施形態において、伝達物質は、下記式:

(ここで、Aは、−R、−D、−CH=CH−D、−CH=CH−CH=CH−D、−CH=N−D、−N=N−D、又は、−N=CH−Dなどの基であり、Dは、−CO−E、−SO2−E、−CN、−NXY、及び、−N+XYZからなる群より選択され、Eは、−H、−OH、−R、−OR、又は、−NXYであり、X、Y及びZは、−H、−OH、−OR及び−Rから独立して選択され;Rは、C1−C16アルキル、好ましくはC1−C8アルキルであり、該アルキルは、飽和又は不飽和のいずれであってもよく、分岐又は非分岐のいずれであってもよく、また、選択的にカルボキシ基、スルフォ基又はアミノ基で置換されていてもよく;B及びCは、CmH2m+1(1≦m≦5)から独立して選択される)によって表される。
【0088】
いくつかの実施形態において、上記式中のAは、−CN又は−CO−Eであり、ここで、Eは、−H、−OH、−R、−OR、又は、−NXYであり、X及びYは、−H、−OH、−OR及び−Rから独立して選択され、Rは、C1−C16アルキル、好ましくはC1−C8アルキルであり、該アルキルは、飽和又は不飽和のいずれであってもよく、分岐又は非分岐のいずれであってもよく、また、選択的にカルボキシ基、スルフォ基又はアミノ基で置換されていてもよく;B及びCは、CmH2m+1(1≦m≦5)から独立して選択される。いくつかの実施形態において、伝達物質は、4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(「シリンゴニトリル」又は「SN」とも呼ばれる)である。
【0089】
上記式において、Aは、示されているようにパラ位に位置するのに代えて、水酸基に対してメタに位置してもよいことに留意されたい。
【0090】
繊維処理のような用途のために、伝達物質は、デニム1グラム当たり約0.005μモル乃至約1000μモル、デニム1グラム当たり約0.05μモル乃至約500μモル、デニム1グラム当たり約0.1μモル乃至約100μモル、デニム1グラム当たり約1μモル乃至約50μモル、又は、デニム1グラム当たり約2μモル乃至約20μモルの濃度で存在していてもよい。
【0091】
伝達物質は、PCT出願WO97/11217及びWO96/12845並びに米国特許第5,752,980号に開示されているような当業者に知られている方法によって調製することができる。他の適切な伝達物質は、例えば、米国特許公開公報第2008/0189871号に記載されている。
【0092】
使用の方法
本発明の系及び組成物は、酵素的ラッカーゼ活性が有用であるか又は望ましい用途において使用することができる。これらの中でも、用途/方法は、基材の色変性であり、その基材は、繊維に関連するものであってもよい。いくつかの実施形態において、そのような方法は、例えば約40℃以下のような低温において適切な基質と共にラッカーゼ酵素をインキュベートするステップを含む。いくつかの実施形態において、温度は、約20℃と約40℃との間である。いくつかの実施形態において、温度は、約20℃と約35℃との間である。いくつかの実施形態において、温度は、約20℃、約25℃、約30℃又は約35℃である。いくつかの実施形態において、温度は、例えば、約20℃乃至約23℃のような、水道水の外界温度である。温度は、狭い範囲内に維持されてもよいし、又は、系及び組成物の性能に著しく影響することなく変動するようにしてもよい。
【0093】
この方法は、本明細書に記載されている1つ又はそれ以上のラッカーゼの使用を意図する。いくつかの実施形態において、ラッカーゼは、C.ユニカラーのようなセレナ(Cerrena)種に由来する。いくつかの実施形態において、ラッカーゼは、本明細書に記載されているC.ユニカラーラッカーゼ酵素のいずれかのアミノ酸配列、又は、本明細書に記載されているC.ユニカラーラッカーゼ酵素のいずれかに対して、少なくとも約35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は、99.5%もの同一性を有し、かつ、ラッカーゼ酵素活性を有するアミノ酸配列を含むか、それらのアミノ酸配列からなるか、又は、それらのアミノ酸配列から本質的になる。
【0094】
いくつかの実施形態において、例えば、この系及び方法は、例えば、線維、毛糸、生地、又は、完成品の衣服を含む繊維製品の色を変化させるための方法のような、繊維処理方法において使用される。一般に、この方法は、例えば、色の変化、着色の変化、脱色、漂白、退色、及び/又は、再沈着/裏面染色の低減から選択される少なくとも1つ(すなわち、1つ又はそれ以上)の測定可能な効果をもたらすのに充分な時間及び条件下において、繊維をラッカーゼ及び伝達物質に接触させるステップを含む。いくつかの実施形態において、この方法は、染色されたデニム製品に「ヴィンテージ外観」を与えるために使用される。藍染めされたデニムの場合において、ヴィンテージ外観は、新たに染めたデニムより弱い青色/紫色の色調、及び、新たに染めたデニムより抑制された灰色の外観を有する。硫黄染めされたデニムの場合において、ヴィンテージ外観は、次亜塩素酸塩処理によって生じ得る茶色の色合いを伴わずに、色が退色している。従って、ラッカーゼを用いて得られる色変性の態様を「漂白」作用として特徴付けることができるが、この言葉は、ラッカーゼの使用によって可能な色変性を完全に表すものではない。
【0095】
色変性のために提供される繊維は、セルロース繊維であってもよいし、又は、セルロース繊維と合成繊維との混合物であってもよい。いくつかの実施形態において、繊維は、藍及び/又は硫黄をベースとした染料で染色されたデニムである。特定の実施形態において、繊維は、藍で染色され、また、ラッカーゼ酵素及び伝達物質は、藍をイサチンに酸化させるために使用される。デニムを、ラッカーゼ酵素による色変性の前に、選択的に糊抜き及び/又はストーンウォッシュすることができる。
【0096】
一般に、繊維処理方法において同じ程度の摩耗を与えると仮定すると、デニムの強度は、より低い温度と比較して、より高温度においてさらに低下する。本発明の方法は、従来の方法と比較してより低い温度において実施可能であるので、従来の方法と比較して、処理中の繊維に対するダメージを軽減するという長所を有する。さらに、ラッカーゼ酵素は、一般に、処理中にセルロース織物繊維との反応によってその強度を低下させることがない。従って、いくつかの実施形態において、本発明の方法は、従来の方法と比較してデニムの物理的強度に影響せず、また、従来の方法と比較して物理的強度の低下が小さい。デニムが伸張デニム(例えばエラステーン、スパンデックス)で構成されている場合、本発明の方法は、従来の方法と比較して生地の伸張性能に影響せず、また、伸張性能の低下を小さくする。
【0097】
いくつかの実施形態において、ラッカーゼは、少なくとも1つの他の酵素と組み合わされて繊維処理方法において使用される。そのような処理を同時に行う場合は、本明細書に記載されているような低温において酵素処理を実行することができる。その処理が連続的である場合には、本明細書に記載されているような低温においてラッカーゼを使用することができ、また、選択的に低温において他の酵素も使用することができる。いくつかの実施形態において、ラッカーゼは、セルラーゼ酵素と組み合わされて同時に又は連続して使用される。一実施形態においては、繊維を、ラッカーゼ及びセルラーゼと同時に接触させる。他の一実施形態においては、繊維を、ラッカーゼ及びセルラーゼと連続的に接触させる。一実施形態において、繊維を、まず、「ストーンウォッシュ」を達成するためにセルラーゼに接触させ、次に、色変性に影響を与えるためにラッカーゼに接触させる。他の一実施形態においては、繊維を、まずラッカーゼに、その後にセルラーゼに接触させる。セルラーゼ処理とラッカーゼ処理とが連続する場合には、2つの処理ステップを同じ槽内において、かつ、2つの処理の間に槽を排水することなく実行することができる。そのような方法を「単一槽」方法と呼ぶ。
【0098】
適切なセルラーゼは、例えば、フミコラ(Humicola)、サーモミセス(Thermomyces)、バチルス(Bacillus)、トリコデルマ(Trichoderma)、フザリウム(Fusarium)、ミセリオフトラ(Myceliophthora)、ファネロカエテ(Phanerochaete)、イルペックス(Irpex)、スキタリジウム(Scytalidium)、シゾフィラム(Schizophyllum)、ペニシリウム(Penicillium)、アスペルギルス(Aspergillus)、又は、ジオトリクム(Geotricum)の種のような、セルロース分解酵素を生産できることが知られた微生物に由来するものであってもよい。セルロース分解酵素の生産に有能な既知の種は、フミコラインソレンズ(Humicola insolens)、フザリウムオキシスポルム(Fusarium oxysporum)、又は、トリコデルマリーゼイ(Trichoderma reesei)を含む。適切なセルラーゼの非限定的な例は、米国特許第4,435,307号;欧州特許出願第0495257号;PCT特許出願番号WO91/17244;及び、欧州特許出願番号EP−A2−271004に開示されており、これらのすべてはここで言及することによって組み込まれている。
【0099】
いくつかの実施形態において、セルラーゼを使用した酵素的な「ストーンウォッシュ」、アリルエステラーゼを使用した漂白、及び、ラッカーゼを使用した色修飾は、包括的な酵素繊維処理系を提供するために、組み合わされてもよい。そのような系は、繊維処理装置によって、従来の繊維処理化学物質を使用する必要性を伴わずに、様々な仕上げ加工を有する繊維を生産することを可能にする。
【0100】
ラッカーゼは、処理の態様、処理、仕上げ、研磨、又は、線維の生産などを一般に含む繊維製造の他の態様において使用することもできる。染色されたデニムの色を変性することに加えて、染色された廃棄物(藍染めされた廃棄物を含む)の脱色において、生地染色において、汚れを繊維漂白において、線維変性において;改良された線維又は生地の特性などの実現において、ラッカーゼを使用することもできる。
【0101】
さらなる実施形態においては、本発明の系及び組成物を、羊毛の色を変化させる方法において使用することもできる。例えば、欧州特許番号EP0504005は、羊毛を染色するためにラッカーゼを使用することができることを開示する。ラッカーゼは、皮革工業においても使用することができる。例えば、ラッカーゼは、以下に限定されないが、皮の脱毛、石灰処理、酵解、及び/又は、なめし革法を含む動物皮の処理において使用することができる。
【0102】
本発明の系及び組成物は、パルプ又は紙製作品の色を変性する方法において使用することもできる。そのような方法は、色変性を必要とするパルプ又は紙の製品を、本明細書に記載されているようなラッカーゼに、色変性が生じるのに充分な時間及び条件下において接触させるステップを含む。特定の実施形態において、色変性が漂白である。
【0103】
本発明の系及び組成物は、毛髪の色を変性するための方法において使用することもできる。ラッカーゼは、毛髪染色剤に有用であると報告されている(例えば、WO95/33836、WO95/33837参照)。そのような方法は、変性しようとする色を有する毛髪を、毛髪の色を変化させるのに適した時間及び条件下において、ラッカーゼに接触させるステップを含む。
【0104】
本発明の系及び組成物を廃水処理の分野において使用することもできる。例えば、ラッカーゼは、有色化合物の脱色において、フェノール成分の解毒において、抗微生物活性のために(例えば、水リサイクルにおいて)、バイオレメディエーションなどにおいて使用可能である。
【0105】
本発明の系及び組成物は、高分子量の凝集体の解重合、廃紙の脱インキ、芳香族化合物の重合、ラジカルによって媒介される重合及び架橋反応(例えば、ペイント、コーティング、生体材料)、染料の活性化、並びに、有機化合物の連結においても使用可能である。
【0106】
本発明の系及び組成物は、洗浄組成物若しくはその成分として、又は、洗浄方法における使用のための洗剤としても使用可能である。例えば、ラッカーゼは、衣類又は生地のような洗濯物の洗浄、処理又は手入れにおいて、家庭用の硬表面の洗浄において;食器洗機用途を含む皿の手入れにおいて;並びに、石鹸の固体及び液体、並びに/又は、合成界面活性剤の棒及び液体として使用可能である。本明細書に示されている酵素は、例えば、汚れの除去/脱色において、及び/又は、匂いの除去、及び/又は、浄化などに有用であり得る。ラッカーゼ伝達物質は、ラッカーゼ酵素と別に又はラッカーゼ酵素と共に、浄化剤及び抗生剤(例えば、木材保護、洗剤)として使用することができる。
【0107】
ラッカーゼは、パーソナルケア分野の他の態様において使用することができる。例えば、ラッカーゼは、香水のような人間のための身体用製品、並びに、人間のためのスキンケア、毛髪ケア、口腔ケア、身体の洗浄及び防臭及び/又は制汗剤のための製品の調製において使用することができる。ラッカーゼは、例えば、毛髪の染色及び/又は脱色、爪の染色及び/又は漂白において;皮膚の染色及び/又は漂白;表面改質(例えばカップリング試薬として);抗生剤として;臭気除去において;歯の白色化など;に有用であり得る。ラッカーゼは、コンタクトレンズ洗浄の分野において使用可能である。ラッカーゼは、例えば、コンタクトレンズの洗浄、保管、殺菌及び/又は保存において使用可能である。
【0108】
ラッカーゼは、バイオ材料の分野において使用可能である。例えば、ラッカーゼは、様々な有機反応のための生体触媒として;及び/又は、生体高分子に関連して;パッケージングに関連して;接着剤に関連して;表面改質(活性化及びカップリング剤)において;第一級アルコールの生産において;バイオセンサー及び/又は有機合成に関連して;使用することができる。ラッカーゼは、酸素を電子受容体として使用して、種々の化学構造を有する多様な有色化合物を酸化することができる。
【0109】
本発明の系及び組成物は、リグノセルロース含有材料からのリグニンの除去(例えば、パルプの脱リグニン)、リグノセルロース含有材料の漂白(すなわち、再生紙の酵素による脱インキ)、及び/又は、紙若しくはセルロースの製造から発生する廃水の処理に使用することもできる。このようなプロセスは、フェノール芳香族酸化還元化合物及び/又は非フェノール芳香族酸化還元化合物に加えて、非芳香族酸化還元剤を添加又は計量供給することに組み合わせて、ラッカーゼ酵素を使用することができ、リグニンのフェノール単位及び非フェノール単位は、これらのフェノール芳香族化合物及び/又は非フェノール芳香族化合物の作用によって直接的に酸化され、又は、リグニンは、これらの化合物の酸化作用によって生産された他のフェノール類及び/又は非フェノール類によって酸化される。
【0110】
ラッカーゼは、パルプ及び紙に関係する他の態様において使用することができる。例えば、ラッカーゼは、木材、竹及び穀物の稲わらのような原料からの紙パルプ及び毛羽パルプの製造;印刷及び筆記のための紙及びボードの製造、パッキング、衛生用途及び他の技術的用途;紙及びボードを作成する目的のためのアセテート繊維のリサイクル;パルプ若しくは紙の工場、並びに、紙、パルプ若しくは毛羽の製造に特に専念する他の設備によって生じて処理される廃棄物の処理において使用することができる。ラッカーゼは、例えば、木材処理において;パルプ漂白において;木材線維変性において;MDF製作のためのバイオ接着剤(リグニン活性剤)において;紙特性を改良するために;インク除去において;紙の染色において;接着剤(例えば、削片板又は繊維板のためのリグニンをベースとした接着剤)などにおいて;有用であり得る。
【0111】
ラッカーゼは、飼料の分野において使用することができる。例えば、ラッカーゼは、ニワトリ、ウシ、ブタ、魚及びペットのようなあらゆる種類の動物用飼料の栄養的価値を高めるために飼料添加物として単独で又は飼料添加物の一部として;及び/又は、飼料原料として適切な材料/製品を生産するために植物性材料及び食品工業副産物を加工するための加工助剤として、使用することができる。
【0112】
ラッカーゼは、デンプン処理の分野において使用することができる。例えば、ラッカーゼは、デンプン及び/又は穀類を含む基質を、グルコース(デキストロース)シロップ、フルクトースシロップ若しくは他のシロップ、アルコール(飲料又は燃料)又は糖に加工する際に使用することができる。そのようなデンプン処理は、基質の液化、糖化、異性化及び脱分岐のような処理ステップを含んでいてもよい。
【0113】
ラッカーゼは、食品の分野において使用することができる。ラッカーゼは、例えば、その調製、処理において、又は、人間消費のための、黄色脂肪、お茶をベースとした飲料、調理用製品、パン及び冷凍食品のような食品中の有効成分として使用することができる。ラッカーゼは、例えば、パン改良剤として、食品保存において、脱酸素剤などとして使用することができる。ラッカーゼは、種々の食品(例えば、肉)又は飼料の微生物的負荷の軽減又は除去のために使用することができる。
【0114】
本明細書に記載されているラッカーゼのための方法又は使用のあらゆるものは、低温、例えば、約40℃未満の温度、例えば、約40℃未満、約37℃未満、約35℃未満、約32℃未満、約30℃未満、約27℃未満、約25℃未満、約22℃未満において実施することができる。典型的な温度範囲は、約20℃以上約40℃未満である。典型的な温度は、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態において、温度は、室温又は水道水の外界温度、例えば、約20℃乃至約23℃である。
【0115】
本明細書に記載されているラッカーゼのための方法又は使用のあらゆるものは、本明細書に記載されているラッカーゼ酵素のいずれか、例えば、セレナユニカラー(Cerrena unicolor)に由来するラッカーゼを使用して実施することができる。いくつかの実施形態において、ラッカーゼは、約0.005mg/リットル乃至約5000mg/リットル、約0.05mg/リットル乃至約500mg/リットル、約0.1mg/リットル乃至約100mg/リットル、又は、約0.5mg/リットル乃至約10mg/リットルの濃度で使用される。いくつかのデニム処理実施形態において、ラッカーゼは、デニム1kg当たり約0.005mg乃至約5000mg、デニム1kg当たり約0.05mg乃至約500mg、デニム1kg当たり約0.1mg乃至約100mg、又は、デニム1kg当たり約0.5mg乃至約10mgの濃度で使用される。いくつかの実施形態において、ラッカーゼは、約5乃至約7、約5.5乃至約6.5、約5乃至約6、又は、約6のpHにおいて使用される。典型的なpHは、おおよそ、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9及び7.0である。
【0116】
使用準備済の組成物及びキット
上述したように、本発明の組成物は、1つ又はそれ以上のラッカーゼを含み、さらに、選択的に1つ又はそれ以上の伝達物質を含む。いくつかの実施形態において、この組成物は、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19、配列番号20、又は、これらの変異体若しくは断片から選択されるアミノ酸配列を含む、該アミノ酸配列からなる、又は、該アミノ酸配列から本質的になるポリペプチドを含む。特定の実施形態において、この組成物は、配列番号19及び20又はこれらの変異体若しくは断片から選択されるアミノ酸配列を含む、該アミノ酸配列からなる、又は、該アミノ酸配列から本質的になるポリペプチドを含む。好ましくは、そのようなポリペプチドが酵素のラッカーゼ活性を有する。その活性は、本明細書に記載されている分析及び手順を使用して測定することができる。
【0117】
ラッカーゼ酵素及び伝達物質を含む、ラッカーゼ酵素及び伝達物質からなる、又は、ラッカーゼ酵素及び伝達物質から本質的になる「使用準備済」(RTU)組成物の形態でそのような組成物を提供することもできる。いくつかの実施形態において、伝達物質は、アセトシリンゴン、シリングアルデヒド、シリングアミド、メチルシリングアミド、2−ヒドロキシエチルシリングアミド、シリンガ酸メチル、シリンゴニトリル、ジメチルシリンガアミド、及び、シリンガ酸から選択される。一実施形態において、伝達物質は、シリンゴニトリル(4−ヒドロキシ−3,5−ジメトキシベンゾニトリル)である。このRTU組成物は、この組成物が溶液中に存在する場合には、pH緩衝を提供するための1つ又はそれ以上の化合物をさらに含んでいてもよい。例えば、いくつかの実施形態において、この組成物は、緩衝系としてモノナトリウムリン酸塩及びアジピン酸を含む。RTU組成物は、保存及び輸送の容易さのために、固体の顆粒形態であってもよい。その後、この組成物は、例えば、説明されているような使用のための水溶液を提供するために水で希釈される。RTU組成物は、分散剤、界面活性剤、遮断薬、ポリマー、及び、保存剤のような任意の数のさらなる試薬を含んでいてもよい。
【0118】
以下の実施例は、系、組成物及び方法を説明するために提供されるものであり、どのようにも限定的なものとして解釈してはならない。他の態様及び実施形態は、明細書を参照した当業者に明らかになるであろう。
【0119】
実施例
実施例において以下の酵素命名法を使用する。

実施例1−ストーンウォッシュされたデニムのラッカーゼによる色変性に対する温度の影響
【0120】
酵素
この試験においては、セレナユニカラーに由来する顆粒状のラッカーゼD酵素(38,000U/g)を使用した。1ラッカーゼ単位は、ラッカーゼ酵素がABTS(2,2’−アジノビス(3−エチルベンズチアゾリン−6−スルフォナート))をその対応する安定なカチオンラジカル、ABTS+に酸化する能力に基づいた分析の条件下において、1nmolのABTS基質を酸化するラッカーゼ活性の量として定義される。ラジカルの蓄積は、ABTSを濃緑色にし、また、420nmにおける吸収度を増大させる。色生成は、ラッカーゼ活性に比例しており、ラッカーゼ基準に対してモニターする。
伝達物質
【0121】
Punjab Chemicals & Crop Protection Limited(ムンバイ、インド)から4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(シリンゴニトリル、SN)を購入した。
手順
【0122】
約3kg(合計)の重さの12本のデニムの脚を、Unimac UF50洗浄機内で以下の条件において糊抜きした。
・0.5g/l(15g)のOPTISIZE(登録商標)160アミラーゼ(15g)(Genencor)及び0.5g/lの非イオンの界面活性剤[例えば、Rucogen BFA(Rudolf Chemie)又はUltravon RW(Huntsman)]を用いた10:1の液比における50℃での15分間の糊抜き
・30:1の液比における5分間にわたる2回の冷水すすぎ
【0123】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュした。
・10:1の液比における5分間の冷水すすぎ
・1kgの軽石、pH4.5(1g/lのトリクエン酸ナトリウム二水和物及び1g/lのクエン酸一水和物)、及び、1.2g/lのINDIAGE(登録商標)2XLセルラーゼ(Genencor)を用いた10:1の液比における55℃での60分間のストーンウォッシュ
・30:1の液比における5分間にわたる2回の冷水すすぎ
【0124】
ストーンウォッシュ後に、以下のプロセスに従って、Unimac UF50洗浄機内においてラッカーゼ処理を実施した。
(i)pH6のC.ユニカラーのラッカーゼD及びシリンゴニトリル(0.7g/lのモノナトリウムリン酸塩及び0.17g/lのアジピン酸)、並びに、40℃、30℃又は23℃の温度
(ii)pH4.8のNOVOPRIME(登録商標)Base268及びNOVOPRIME(登録商標)F258(0.29g/lのモノナトリウムリン酸塩及び0.56g/lのアジピン酸)、並びに、40℃又は30℃の温度
・30:1の液比における5分間の2回の冷水すすぎ
デニムの脚の評価
【0125】
D65光源を備えたCIE試験色空間において、Minolta Chromameter CR 310を用いたラッカーゼ処理の後にデニムの脚の「漂白」として報告された色変性の量を評価した。CIELUV色空間としても知られているCIE色空間系は、1976年に国際照明委員会(CIE)に採用されたものであり、以下のように算出される値L*、u*及びv*を含む。

ここで、
Y:三刺激値Y(三刺激値Y10を使用することもできる)
u’、v’:CIE1976UCSダイアグラムから得た色度座標
Y0、u’0、v’0:完全反射拡散器の三刺激値Y(又はY10)及び色度座標u’、v’
【0126】
それぞれのデニムの脚について8回の測定値を得て、12本の脚(合計96個の測定値)の結果を平均した。その結果を表1及び表2並びに図1に示す。
表1

表2

【0127】
この結果は、ストーンウォッシュされたデニムの色変化に影響を与えることにおけるC.ユニカラーのラッカーゼ及びシリンゴニトリルの有効性を示している。
実施例2−ラッカーゼの効果:ストーンウォッシュされたデニムの色変性に対する伝達物質比率
手順
【0128】
実施例1に記載されているように、約3kg(合計)の重さの12本のデニムの脚を糊抜き及びストーンウォッシュした。ストーンウォッシュの後に、以下のプロセスに従ってUnimac UF50洗浄機内でラッカーゼ処理を実施した。
・C.ユニカラーのラッカーゼD及びシリンゴニトリル、10:1の液比において30分間、40℃においてpH6(0.7g/lのモノナトリウムリン酸塩及び0.17g/lのアジピン酸)
・30:1の液比において5分間にわたる2回の冷水すすぎ
デニムの脚の評価
【0129】
実施例1に記載されているようにデニムの脚の色変性を評価した。その結果を表3及び図2に示す。
表3

【0130】
この結果は、伝達物質に対するラッカーゼ酵素の比率を操作することによって、色変性を変化させることができることを示している。
実施例3−ストーンウォッシュされたデニムに対する、ラッカーゼと伝達物質とを含む組成物の色変性性能に対する温度の影響
【0131】
低温におけるラッカーゼによる色変性性能を調べるために、表4に示されているように「使用準備済」(RTU)組成物を調製した。モノナトリウムリン酸塩及びアジピン酸は、以下に記載されているような使用の用途において、約pH6の緩衝機能を提供する。
表4

手順
【0132】
実施例1に記載されているように、約3kg(合計)の重さの12本のデニムの脚を糊抜き及びストーンウォッシュした。ストーンウォッシュの後に、以下のプロセスに従って、Unimac UF50洗浄機内でラッカーゼ処理を実施した。
・30分間10:1の液比において30℃において又は流入スチームなし(すなわち、21℃乃至22℃の温度)で、表5及び表6に記載されている濃度及び温度において、上記RTUラッカーゼ組成物又はDENILITE(登録商標)IIS(Novozymes)を用いる
・30:1の液比において5分間の2回の冷水すすぎ
デニムの脚の評価
【0133】
実施例1に記載されているようにデニムの脚の色変性を評価した。この結果を表5及び表6並びに図3及び図4に示す。
表5

表6

【0134】
これらの結果は、C.ユニカラーラッカーゼRTU組成物は、従来の市販のラッカーゼ組成物と比較して、低温においてより優れた色変性を提供することを示している。
実施例4−30℃においてワンステップストーンウォッシュ及び色変性
【0135】
実施例1に記載されているように約3kg(合計)の重さの12本のデニムの脚をUnimac UF50洗浄機内で糊抜きした。
【0136】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュ及び漂白した。
・30分間、30℃で、10:1の液比において、pH6において、(i)物に対して0.4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)+実施例3(すなわち、「ストーンウォッシュ+漂白の1ステップ」)に記載されている、物に対して3重量%のRTUラッカーゼ組成物、又は、(ii)INDIAGE(登録商標)Super GXセルラーゼのみ(すなわち、「ストーンウォッシュ」のみ)
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。これらの結果を表7及び図5に示す。
表7

【0137】
これらの結果は、ラッカーゼとセルラーゼとを同時に使用して色変性を達成することができることを示している。
実施例5−30℃における2ステップのストーンウォッシュ及び色変性
【0138】
実施例1に記載されているように、Unimac UF50洗浄機内で約3kg(合計)の重さの12本のデニムの脚を糊抜きした。
【0139】
糊抜きの後に、デニムは、以下の条件下において、Unimac UF50洗浄機内でストーンウォッシュした。
・30分間、10:1の液比において、30℃で、pH5.5において、物に対して0.4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)
【0140】
ストーンウォッシュの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内で漂白した。
・30分間、10:1の液比において、30℃で、pH6において、物に対して3重量%の、実施例3に記載されているRTUラッカーゼ組成物
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。
【0141】
これらの結果を表8及び図5に示す。ストーンウォッシュと色変性との2ステップによる結果を、実施例4に記載されているストーンウォッシュのみの結果と比較した。
表8

【0142】
これらの結果は、ラッカーゼ処理による色変性がストーンウォッシュの後に達成可能であることを示している。
実施例6−ストーンウォッシュを用いない30℃におけるデニムのラッカーゼによる色変性
【0143】
実施例1に記載されているように、Unimac UF50洗浄機内で約3kg(合計)の重さの12本のデニムの脚を糊抜きした。
【0144】
糊抜きの後に、そのデニムを、以下の条件下においてUnimac UF50洗浄機内で漂白した。
・30分間、10:1の液比において、30℃で、pH6において、物に対して3重量%の、実施例3に記載のRTUラッカーゼ組成物
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。
【0145】
これらの結果を表9及び図5に示す。実施例4に記載されているように、色変性の結果を、ストーンウォッシュのみの結果と比較した。
表9

【0146】
これらの結果は、ストーンウォッシュを伴わないラッカーゼ処理によって生じる色変性の程度がストーンウォッシュのみより高いことを示している。
実施例7−軽石を含まない単一槽中のプロセスにおけるセルラーゼ及びラッカーゼによるストーンウォッシュ及び色変性
【0147】
この実施例は、単一槽のプロセスにおいてラッカーゼ及びセルラーゼを使用して有効なストーンウォッシュ及び色変性が得られることを示している。
酵素
【0148】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチNo.780913616、6,292GLacU/g)。
手順
【0149】
出発物質は、重さ約3kgの糊抜きしたデニム(バラスト+評価用の2脚)であった。
【0150】
このデニムを、以下の条件下において、Renzacci LX 22洗浄機内でストーンウォッシュした。
・40分間、50℃、10:1の液比、pH6.5、物に対して0.4重量%のINDIAGE(登録商標)Neutra Lセルラーゼ(バッチNo.40105358001、活性5197NPCNU/g)(Genencor)。
・ストーンウォッシュした後に、1本の脚を取り出して、評価のために乾燥した。
・ストーンウォッシュの後に、槽を排出(すなわち、排水)することなく、以下の条件下において第2のデニムの脚を色変性に供した。
・40分間、40℃、10:1の液比、及び、物に対して1%重量の使用準備済み(RTU)のPRIMAGREEN(登録商標)EcoFade LT 100。
・3分間にわたる2回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥した。
デニムの脚の評価
【0151】
ラッカーゼ処理の後及びセルラーゼ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムの脚に対する色変性及びストーンウォッシュを評価した。各脚について6回の測定値を得て、結果を平均化した。
【0152】
これらの結果を表10にまとめる。単一槽中におけるセルラーゼとラッカーゼとの連続的な(すなわち、2ステップの)添加によって得られた色変性の程度は、実施例4のようにセルラーゼとラッカーゼとを同時に添加することによって得られた程度より大きかった。
表10

【0153】
これらの結果は、単一浴槽におけるセルラーゼとラッカーゼとの連続的な(すなわち、2ステップ)の添加によって得られた色変性の程度が、実施例4のようにセルラーゼとラッカーゼとを同時に添加することによって得られた程度より大きいことを示している。
実施例8−ラッカーゼ及び軽石を用いた色変性
【0154】
この実施例は、単一槽プロセスにおいて軽石とラッカーゼ伝達物質系とを使用して、有効なストーンウォッシュ及び色変性を得ることができることを示している。
酵素
【0155】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチ7809136160番、6,292のGLacU/g)。
手順
【0156】
実施例1に記載されているように、重さ約3kg(合計)の12本のデニムの脚を、Unimac UF50洗浄機内で糊抜きした。
【0157】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュした。
・30分間、30℃、10:1の液比、3kgの軽石、3%のPRIMAGREEN(登録商標)EcoFade LT100(Genencor)を用いた。水中で石のみを用いてブランク/コントロールを実施した。
・30:1の液比において5分間にわたる2回の冷水すすぎ。
デニムの脚の評価
【0158】
先のように、ラッカーゼ処理の後及びストーンウォッシュ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムの脚に対する色変性を評価した。各脚の外側で得た8回の測定値の平均を漂白レベルとして報告した。各脚の内側で得た4回の測定値の平均を裏面染色レベルとして報告した。
【0159】
これらの結果を表11及び表12にまとめる。
表11

表12

【0160】
これらの結果は、軽石が存在していても、ラッカーゼ処理が、色変性を提供し、裏面染色の低減/除去をさらに示すことを示している。
実施例9−硫黄染色された衣服のストーンウォッシュ及び色変性
【0161】
試験用の衣服は、硫黄のカーキーブラウン染料で染色された100%綿綾織物生地でできていた。以下の条件下において、25kgのベリーウォッシャー(36rpm)において約7kg(合計)の重さの21着の衣服をストーンウォッシュした。
・45分間、55℃、18:1の液比、pH4.5、1g/lのINDIAGE(登録商標)2XL
・12:1の液比で3分間の1回の冷水すすぎ。軽石を使用しなかった。
・洗浄した後に、評価のために衣服を乾燥した。
・以下の条件下において上記のようにストーンウォッシュした3着の衣服(合計約1kg)をPRIMAGREEN(登録商標)EcoFade LT 100で処理した。
・15分間、30分間又は45分間、50:1の液比、40℃、及び、1g/l、2g/l又は3g/lのPRIMAGREEN(登録商標)EcoFade LT 100。ブランク/コントロールは、水のみで15分間、30分間又は45分間にわたって洗浄した衣服を用いて実施した。
・3分間の1回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥させた。
デニムの脚の評価
【0162】
ラッカーゼ処理後及びストーンウォッシュ処理後に、上述されているように、D65光源を備えたCIE試験空間においてMinolta Chromameter CR 310を用いて、硫黄染色された衣服の色変性及びストーンウォッシュを評価した。各衣服について10回の測定値を得て、結果を平均化した。
【0163】
これらの結果を表13にまとめる。
表13

【0164】
これらの結果は、色空間のa値及びb値が、未処理及びブランクの生地と比較して著しく変化することを示している。衣服の色合いに対する変性は目視によって確認される。
実施例10−ストーンウォッシュを伴わない硫黄染色された衣服の色変性
【0165】
硫黄のカーキーブラウン染料で染色された約1kg(合計)の重さの100%綿綾織物生地でできた3着の衣服を、以下の条件下において、5kgのビリーウォッシャーにおいて(36rpm)処理した。
・15分間、30分間又は45分間、40:1の液比、40℃、及び、1g/l、2g/l又は3g/lのPRIMAGREEN(登録商標)EcoFade LT 100。ブランク/コントロールは、水のみで15分間、30分間又は45分間にわたって洗浄した衣服を用いて実施した。
・3分間の1回の冷水すすぎ。
・工業用ドライヤーでデニムを乾燥させた。
デニムの脚の評価
【0166】
ラッカーゼ処理後及びストーンウォッシュ処理後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、硫黄染色された衣服に対する色変性及びストーンウォッシュを評価した。各衣服について、10回の測定値を得て、結果を平均化した。
【0167】
これらの結果を表14にまとめる。
表14

【0168】
これらの結果は、色空間のa値及びb値が、未処理及びブランクの生地と比較して著しく変化することを示している。衣服の色合いに対する変性は目視によって確認される。
実施例11−界面活性剤及び軽石の存在下における単一槽プロセス中のセルラーゼ及びラッカーゼによるストーンウォッシュ及び漂白の性能
酵素
【0169】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチNo.780913616、6,292GLacU/g)
手順
【0170】
純粋な藍で染色された重さ10kg(合計)の12着のデニム衣服を、以下の条件下でTupesaフロントローディングマシン(36rpm)において糊抜きした。
・10分間、40℃、10:1の液比、pH7、並びに、0.5g/lの潤滑剤、0.2g/lの分散剤(非イオン性界面活性剤)、及び、0.2g/lのポリエステル遮断薬(非イオン性の親水性コポリマー)。
【0171】
糊抜きの後に、そのデニムを、以下の条件下でストーンウォッシュした。
・30分間、47℃、5:1の液比、pH6、7kgの軽石、物に対して4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)を用いる。評価のために1着の衣服を取り出した。
・ストーンウォッシュの後に、槽を排水(下垂)することなく、以下の条件下においてデニムを漂白した。
・30分間、5:1の液比、47℃、及び、物に対して2重量%の使用準備済(RTU)PRIMAGREEN(登録商標)EcoFade LT100
・1:50の液比における2分間にわたる2回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥させた。
デニムの脚の評価
【0172】
ラッカーゼ処理の後及びセルラーゼ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムに対する色変性及びストーンウォッシュを評価した。各脚について8回の測定値を得て、結果を平均化した。
【0173】
これらの結果を表15にまとめる。
表15

【0174】
これらの結果は、軽石及び界面活性剤の存在下におけるラッカーゼ処理によって色変性が生じることを示している。
【0175】
本明細書に記載されている態様、実施形態及び実施例は、説明のみを目的とする。様々な変形は、当業者に明らかであり、この出願の精神及び範囲並びに添付されている特許請求の範囲の範囲内に包含される。本明細書において引用された刊行物及び特許文献のすべては、ここで言及することによってそれらの全体がそのまま組み込まれている。
【技術分野】
【0001】
優先権
本出願は、2008年12月24日に提出された米国仮特許出願第61/140,724号、2009年2月24日に提出された第61/154,882号、及び、2009年8月27日に提出された第61/237,532号に対する優先権を主張する。各文献は言及することによってそっくりそのまま組み込まれている。
【0002】
本発明の系、組成物及び方法は、ラッカーゼ酵素及びそのようなラッカーゼ酵素をコードする核酸配列に関する。ラッカーゼ酵素は、デニム生地の色を変性するための改善された方法において伝達物質と一緒に使用することができる。
【背景技術】
【0003】
ラッカーゼは、酸素の存在下において優れた酸化剤であることがわかっている銅含有フェノール酸化酵素である。ラッカーゼは、微生物、菌類及び高等生物にみられる。ラッカーゼ酵素は、パルプ及び紙の漂白、パルプ廃液の処理、脱インク、工業用の色除去、洗濯用洗剤中の漂白、口腔ケア歯白色化剤、及び、重合及び酸化反応のための触媒又は促進剤を含む多数の用途に使用される。
【0004】
ラッカーゼは、洗剤産業、紙パルプ産業、繊維産業及び食品産業を含む多数の産業における種々の用途に使用可能である。ある用途において、フェノール酸化酵素は、洗剤洗浄中に衣服から食物汚れなどの染みを除去する補助として使用される。ほとんどのラッカーゼは、中性又はアルカリ性のpHにおいて不活性であるが、酸性のpH領域においてpH最適条件を示す。
【0005】
ラッカーゼは、ジーニイアスペルギルス(genii Aspergillus)、ニューロスポラ(Neurospora)、ポドスポラ(Podospora)、ボトリティス(Botrytis)、プルロタス(Pleurotus)、フォルネス(Fornes)、フレビア(Phlebia)、トラメテス(Trametes)、ポリポラス(Polyporus)、スタキボトリス、リゾクトニア(Rhizoctonia)、ビポラリス(Bipolaris)、クルブラリア(Curvularia)、アメロスポリウム(Amerosporium)、レンチヌス(Lentinus)、ミセリオプトラ(Myceliophtora)、コプリナス(Coprinus)、チエラビア(Thielavia)、セレナ(Cerrena)、ストレプトミセス(Streptomyces)及びメラノカルパス(Melanocarpus)の種を含む種々の菌類によって作られることがわかっている。しかしながら、各種用途において様々な性能特性を有するラッカーゼの必要性がなお存在する。
【0006】
多数の用途のために、促進剤としても知られている伝達物質の使用によってラッカーゼの酸化能力を向上させることができる。ラッカーゼ及び伝達物質を含む系は、当業界においてラッカーゼ伝達物質系(LMS)として知られている。ラッカーゼの作用を活性化又は開始させるために同じ化合物を使用することができる。
【0007】
ラッカーゼ伝達物質系において使用するためのいくつかの既知の伝達物質が存在する。これらには、HBT(l−ヒドロキシベンゾトリアゾール)、ABTS[2、2’―アジノビス(3−エチルベンゾチアゾリン−6−スルフィン酸)]、NHA(N−ヒドロキシアセトアニリド)、NEIAA(N−アセチル−N−フェニルヒドキシルアミン)、HBTO(3−ヒドロキシ1,2,3−ベンゾトリアジン−4(3H)−オン)及びVIO(ビオルル酸)が含まれる。さらに、伝達物質として有用であることがわかっているNH−OH基又はN−O基を含むいくつかの化合物が存在する。
【0008】
官能基及び置換基は、伝達物質の能力に大きく影響する。同じクラスの化合物内でさえ、置換基は、基質に対するラッカーゼ特異性を変化させることができ、それによって、伝達物質の能力を大幅に上昇又は低下させる。さらに、伝達物質は、ある特定の用途に有効であるが、他の用途には適さない可能性がある。現行の伝達物質についての他の欠点は、使用中に重合する傾向があることである。したがって、特定の用途のために効率的な伝達物質を発見する必要がある。そのような用途の1つは繊維の漂白であり、伝達物質が過度に高価又は危険でないことも重要である。ラッカーゼ伝達物質系の他の用途を以下に与える。
【0009】
低温におけるラッカーゼの使用の方法は、例えば、処理槽を加熱するためのエネルギー投入量を減らすことができる繊維処理方法において、省エネルギーの点で利益を与える。ラッカーゼ酵素を低温における酵素漂白のような用途において使用する方法を開発することが望ましい。
【発明の概要】
【0010】
ラッカーゼを含む酵素的酸化の系、組成物及び方法を説明する。一態様において、40℃未満の温度において、繊維の色変性を生じさせるのに充分な時間及び条件下で繊維をラッカーゼ酵素及び選択的に伝達物質と接触させるステップを含む繊維処理方法を提供する。いくつかの実施形態においては、色変性は、色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び、漂白から選択される。いくつかの実施形態においては温度が約20℃以上40℃未満である。いくつかの実施形態においては温度が約20℃乃至約35℃である。いくつかの実施形態においては温度が約20℃乃至約30℃である。いくつかの実施形態においては温度が約20℃乃至約23℃である。いくつかの実施形態においては温度が、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態においては温度が水道水の外界温度である。
【0011】
いくつかの実施形態においては繊維が藍染めされたデニムである。いくつかの実施形態においては繊維が硫黄染めされたデニムである。いくつかの実施形態において、繊維をラッカーゼ酵素及び伝達物質と接触させるステップの前に又は接触させるステップと同時に、デニムを糊抜され及び/又はストーンウォッシュする。いくつかの実施形態においては、ストーンウォッシュするステップと、繊維をラッカーゼ酵素及び伝達物質と接触させるステップとを、同じ槽内で行う。
【0012】
いくつかの実施形態において、この方法は、繊維をラッカーゼ酵素及び伝達物質と接触させるステップと同時に又は連続して、繊維をセルラーゼ酵素に接触させるステップをさらに含む。いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップと、繊維をラッカーゼ酵素及び伝達物質と接触させるステップとを連続して実行し、繊維をラッカーゼ酵素及び伝達物質と接触させるステップの前に、繊維をセルラーゼ酵素と接触させるステップを実行する。いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップ、及び、繊維をラッカーゼ酵素及び伝達物質と接触させるステップを、繊維をセルラーゼ酵素と接触させるステップと繊維をラッカーゼ酵素及び伝達物質と接触させるステップとの間に槽を排水することなく、同じ槽内において連続して実行する。
【0013】
いくつかの実施形態においては、繊維をセルラーゼ酵素と接触させるステップ、及び、繊維をラッカーゼ酵素及び伝達物質と接触させるステップを、40℃未満の温度において実行する。いくつかの実施形態においては温度が約20℃以上40℃未満である。いくつかの実施形態においては温度が約20℃乃至約35℃である。いくつかの実施形態においては温度が約20℃乃至約30℃である。いくつかの実施形態においては温度が約20℃乃至約23℃である。いくつかの実施形態においては温度が、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態においては温度が水道水の外界温度である。
【0014】
いくつかの実施形態において、セルラーゼ酵素がラッカーゼ酵素と相乗的に作用することによって、さらに大きい程度の繊維の色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び/又は、漂白を有する繊維を生産する。いくつかの実施形態においては、セルラーゼ酵素がラッカーゼ酵素と相加的に作用することによって、セルラーゼが含まれない同じ方法と比較して、さらに大きな程度の繊維の色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び/又は、漂白を有する繊維を生産する。
【0015】
いくつかの実施形態において、ラッカーゼが微生物によるラッカーゼである。いくつかの実施形態において、ラッカーゼがセレナ(Cerrena)種に由来する。いくつかの実施形態において、ラッカーゼがセレナユニカラー(Cerrena unicolor)に由来する。いくつかの実施形態において、ラッカーゼがセレナユニカラーに由来するラッカーゼDである。
【0016】
いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも70%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも80%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも90%又は少なくとも95%同一のアミノ酸配列を有する。
【0017】
いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも70%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも80%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも90%同一のアミノ酸配列を有する。いくつかの実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも95%同一のアミノ酸配列を有する。
【0018】
いくつかの実施形態において、使用準備済組成物中にラッカーゼ酵素と伝達物質とを一緒に提供する。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とを固体形態で提供する。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とを顆粒として提供する。特定の実施形態においては伝達物質がシリンゴニトリルである。
【0019】
他の一態様において、ラッカーゼ、そのようなラッカーゼをコードする核酸配列、並びに、ラッカーゼを発現するためのベクター及びホスト細胞を提供する。繊維処理のようなエネルギー投入量の低減が望まれる方法において、低温においてラッカーゼを使用することができる。いくつかの実施形態において、ラッカーゼ酵素は、配列番号:2、4、6、8、10、12、14、16、18若しくは20のいずれかに記載のアミノ酸配列を含むか、該アミノ配列からなるか、若しくは、該アミノ配列から本質的になるものであるか、又は、配列番号:2、4、6、8、12、14、16、18、19又は20のいずれかに対して少なくとも約60%、65%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一のアミノ酸配列を有するものである。特定の実施形態において、ラッカーゼは、配列番号19又は配列番号20に対して少なくとも70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%同一のアミノ酸配列を有する。さらなる特定の実施形態において、ラッカーゼは、配列番号19又は配列番号20のアミノ酸配列を有する。そのようなポリペプチドがラッカーゼ酵素活性を有することが好ましく、その活性は、例えば、本明細書に記載されている分析を用いて測定することができる。
【0020】
他の一態様において、前述のアミノ酸配列のいずれかを含むか、該アミノ酸配列から本質的になるか、又は、該アミノ酸配列からなるラッカーゼ酵素を含む組成物を提供する。いくつかの実施形態において、この組成物は、溶液中において組成物のpHを約5.5乃至約6.5に維持するための緩衝系をさらに含む。いくつかの実施形態において、この組成物は、伝達物質をさらに含む。この伝達物質は、例えば、アセトシリンゴン、シリングアルデヒド、シリングアミド、メチルシリングアミド、2−ヒドロキシエチルシリングアミド、シリンガ酸メチル、ジメチルシリングアミド、シリンガ酸(shrine acid)、4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(シリンゴニトリル)から選択され得る。一実施形態において、伝達物質は、4−ヒドロキシ−3,5−ジメトキシベンゾニトリルである。いくつかの実施形態において、この組成物は固体形態である。いくつかの実施形態において、ラッカーゼ酵素と伝達物質とは、使用準備済組成物中に一緒に提供される。いくつかの実施形態において、ラッカーゼ酵素及び伝達物質が固体形態で提供される。いくつかの実施形態において、ラッカーゼ酵素及び伝達物質が顆粒として提供される。特定の実施形態においては伝達物質がシリンゴニトリルである。
【0021】
いくつかの実施形態において、ラッカーゼ酵素は、約5乃至約7のpH、約20℃乃至約30℃の温度、約5:1乃至約10:1の液比、及び、約15分乃至約60分の時間で使用される。
【0022】
本発明の系、組成物及び方法のこれらの及び他の態様及び実施形態は、明細書及び添付図面によって明らかになる。
【図面の簡単な説明】
【0023】
【図1】図1は、実施例1に記載されているように、様々な温度においてラッカーゼ酵素を用いてストーンウォッシュしたデニムにおける色を変化させる効果を示している。
【0024】
【図2】図2は、実施例2に記載されているように、ストーンウォッシュしたデニムの色の変化に対するラッカーゼ及び伝達物質の比率の影響を示している。
【0025】
【図3】図3は、実施例3において記載されているように、「使用準備済」ラッカーゼ組成物を用いてストーンウォッシュしたデニムの色の変化に対する温度の影響を示している。
【0026】
【図4】図4は、実施例3に記載されているように、ストーンウォッシュしたデニムに対するラッカーゼ酵素の色を変化させる能力に対する温度の影響を示している。
【0027】
【図5】図5は、実施例4−6に記載されているように、ラッカーゼによって媒介される色変性と組み合わせたセルラーゼ処理の効果を示している。
【発明を実施するための形態】
【0028】
ラッカーゼを含む酵素的酸化の系、組成物及び方法を記載する。これらの系、組成物及び方法は、例えば、色変性に影響を与えるための繊維の低温処理に有用である。そのような処理は、従来の繊維処理技術より少ないエネルギーを使用し、環境によりやさしい化学試薬を含む。これらの系、組成物及び方法の様々な態様及び実施形態を記載する。
【0029】
定義
別段の定めがない限り、ここで使用されている技術及び科学用語のすべては、当業者によって一般に理解されるのと同じ意味を有する。「Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994), and Hale and Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, N.Y. (1991)」は、本明細書において使用される用語の多数の一般的な辞書を提供する。さらなる明確性のために以下の用語を定義する。
【0030】
本明細書において用いられているように、「酵素」という用語は、化学反応を触媒するタンパクを意味する。酵素の触媒現象の機能は、その「酵素活性」又は「活性」を構成する。酵素は、一般に、触媒する反応の種類に従って、例えば、フェノールの酸化、ペプチド結合の加水分解、ヌクレオチドの結合などに分類される。
【0031】
本明細書において用いられているように、「基質」という用語は、生成物を生成するように酵素がその触媒能力を発揮する対象となる物質(例えば化合物)を意味する。
【0032】
本明細書において用いられているように、「ラッカーゼ」は、4個の電子の伝達プロセスにおいて酸素を水に同時に還元すると共に、1個の電子を除去することによって、フェノール、ポリフェノール及びアニリンの酸化を触媒する複数銅含有酸化酵素(EC1.10.3.2)である。
【0033】
本明細書において用いられているように、「変異体」タンパクは、少数のアミノ酸置換、挿入及び/又は欠失によって親/基準タンパクとは異なる関連タンパク及び誘導体タンパクを包含する。いくつかの実施形態において、異なるアミノ酸残基の数は、約1、2、3、4、5、10、20、25、30、35、40、45又は50のいずれかである。いくつかの実施形態において、変異体は、約1個乃至約10個のアミノ酸残基が異なる。いくつかの実施形態において、変異体タンパクは、親/基準タンパクに対して少なくとも約35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は99.5%のアミノ酸配列同一性を有する。
【0034】
本明細書において用いられているように、「類似配列」という用語は、親/基準タンパク中の配列と類似した機能、三次元構造、及び/又は、保存残基を提供するタンパク中のポリペプチド配列を意味する。例えば、αヘリックス又はβシート構造を含む構造領域において、類似配列中の置換アミノ酸残基は、同じ構造的特徴を維持する。いくつかの実施形態において、類似配列は、変異体が由来した親タンパクと同様の又は向上した機能を示す変異体タンパクを与える。
【0035】
本明細書において用いられているように、「相同タンパク(homologous protein)」又は「同族体(homolog)」は、基準タンパク(例えば、異なる源に由来するラッカーゼ酵素)と同様の機能(例えば、酵素活性)及び/又は構造を有するタンパク(例えば、ラッカーゼ酵素)を意味する。同族体は、進化論的に関連する種又は無関係な種に由来するものであってもよい。いくつかの実施形態において、同族体は、基準タンパクに類似した四次、三次及び/又は一次構造を有し、それによって、非相同タンパクに由来する配列による部分又は断片の置換と比較して、基準タンパクの構造及び/又は機能の破壊を低減しながら、同族体に由来する類似の部分又は断片による基準タンパク中の部分又は断片の置換を潜在的に可能にする。
【0036】
本明細書において用いられているように、「野生型」タンパク、「天然」タンパク及び「天然に存在する」タンパクは、自然界にみられるものである。「野生型の配列」という用語は、自然界にみられる又は天然に存在するアミノ酸又は核酸配列を意味する。いくつかの実施形態において、野生型配列は、タンパクエンジニアリング事業(例えば変異体タンパクの生産)の出発点である。
【0037】
本明細書において用いられているように、「シグナル配列」は、タンパクのN末端部分に結合したアミノ酸の配列を意味し、細胞からタンパクの成熟形態を分泌することを容易にする。細胞外タンパクの成熟形態は、分泌プロセス中に開裂されるシグナル配列を欠いている。
【0038】
本明細書において用いられているように、「培養」という用語は、対象のポリペプチドを発現させるために、液体、半固体又は固体の培地において適切な条件下で微生物細胞の集団を培養することを意味する。当業界において知られているように、いくつかの実施形態において培養を管内又は反応器内で実行する。
【0039】
本明細書において用いられているように、「誘導体」という用語は、N末端及びC末端のいずれか又は両方への1つ以上のアミノ酸の付加、アミノ酸配列中の1つ又は複数の異なる位置における1つ以上のアミノ酸残基の置換、タンパクの一端部若しくは両端部における又はアミノ酸配列中の1つ以上の位置における1つ以上のアミノ酸残基の欠失、及び/又は、アミノ酸配列中の1つ以上の部位における1つ以上のアミノ酸の挿入によって、親/基準タンパクに由来するタンパクを意味する。タンパク誘導体の調製は、多くの場合、天然タンパクをコードするDNA塩基配列を修飾すること、適切な宿主へのそのDNA塩基配列の導入、及び、修飾されたDNA塩基配列を発現させて誘導体タンパクを作ることによって達成される。
【0040】
本明細書において用いられているように、「発現」という用語は、遺伝子の核酸配列に基づいてポリペプチドが生産されるプロセスを意味する。このプロセスは転写及び翻訳の両方を含む。
【0041】
本明細書において用いられているように、「発現ベクター」という用語は、宿主においてコード配列を発現させることができる1つ又はそれ以上の適切な制御配列に作用可能な状態で結合されたDNAコード配列(例えば遺伝子配列)を含むDNA構築物を意味する。そのような制御配列は、転写を達成するためにプロモータ、そのような転写を制御するための選択的なオペレーター配列、適切なmRNAリボソーム結合部位をコードする配列、並びに、転写及び翻訳の停止を制御する配列を含む。ベクターは、プラスミド、ファージ粒子又は単に潜在的ゲノム挿入物であってもよい。適切な宿主に導入されると、ベクターは、宿主ゲノムから独立して複製及び機能することができ、又は、いくつかの例においてはゲノム自体に統合することもできる。
【0042】
本明細書において用いられているように、「宿主細胞」という用語は、ポリペプチド生産用の組み換え発現ベクターをトランスフェクトすることができるか、トランスフォームすることができるか、又は、ポリペプチドの発現のために他の方法で導入することができる細胞又は細胞系を意味する。宿主細胞には、単一の宿主細胞の子孫が含まれ、その子孫は、天然の、偶発的な、又は、意図的な突然変異のせいで、(形態において又は全ゲノムDNA補体において)親細胞と必ずしも同一でない可能性がある。宿主細胞は細菌性又は真菌性であってもよい。宿主細胞には、発現ベクターによってインビボにおいてトランスフェクト又はトランスフォームされた細胞が含まれる。
【0043】
本明細書において用いられているように、細胞に核酸配列を挿入するという文脈における「導入」という用語は、「トランスフェクション」、「トランスフォーメーション」及び「トランスダクション」を包含し、真核生物又は原核細胞中への核酸配列の組み込みであって、その核酸配列が、細胞のゲノム(例えば、染色体、プラスミド、色素体又はミトコンドリアDNA)に組み込まれるか、独立したレプリコンに変換されるか、又は、一時的に発現される組み込みを意味する。
【0044】
本明細書において用いられているように、「洗浄組成物」及び「洗浄調合物」は、生地、皿、コンタクトレンズ、毛髪(シャンプー)、肌(石鹸及びクリーム)、歯(口内洗浄液、練り歯磨き)、並びに、他の固体及び表面のような、洗浄しようとする部材から望まれない化合物を除去するために使用することができる組成物を意味する。この用語は、組成物が組成物中で使用される酵素に適合する限り、特定の種類の望ましい洗浄組成物及び生成物の形態(例えば液体、ゲル、顆粒又はスプレーの組成物)のために選択されるあらゆる物質/化合物を包含する。洗浄組成物材料の具体的選択は、洗浄しようとする表面、部材又は生地と、使用中の洗浄条件に対する組成物の望ましい形態とを考慮することによって容易になされる。
【0045】
この用語は、物及び/又は表面を洗浄、漂白、消毒及び/又は殺菌するのに適したあらゆる組成物をさらに意味する。この用語は、以下に限定されるものではないが、界面活性剤組成物(例えば、液体及び/又は固体の洗濯用洗剤、並びに、きめ細かい生地の洗剤;ガラス、木材、セラミック及び金属のカウンタートップ、並びに、窓などのための硬表面洗浄調合物;カーペットクリーナー;オーブンクリーナー;生地脱臭剤;生地柔軟剤;並びに、繊維及び洗濯前染み抜き、及び、皿洗剤)を含むことが意図されている。
【0046】
実際に、「洗浄組成物」及び「洗浄調合物」という用語は、(別段の定めがない限り)粒状又は粉末形態の万能洗剤又は重質洗剤、特に洗浄洗剤;液体、ゲル又はペースト形態の万能洗剤、特にいわゆる重質液体(HDL)タイプ;きめ細かい生地用の液体洗剤;食器洗い洗剤又は軽質食器洗い洗剤、特に高発泡タイプ;家庭及び企業の使用のための様々な錠剤、顆粒、液体、及び、洗浄補助援助のタイプを含む食器洗浄機用洗剤;抗菌性手洗いタイプ、洗浄石鹸(cleaning bar)、口内洗浄液、義歯クリーナ、自動車シャンプー又はカーペットシャンプー、浴室洗剤を含む液体の洗浄剤及び殺菌剤;ヘアシャンプー及びヘアリンス;シャワー用ジェル及び泡風呂及び金属クリーナー;並びに、漂白添加剤及び「しみ取りスティック(stain-stick)」若しくは前処理タイプのような洗浄補助剤を包含する。
【0047】
本明細書において用いられているように、「界面活性剤組成物」及び「洗剤調合物」という用語は、汚染された物の洗浄のための洗浄媒体中における使用が意図された混合物について使用される。いくつかの実施形態において、この用語は、生地及び/又は衣服を洗濯するもの(例えば「洗濯用洗剤」)について使用される。代替実施形態において、この用語は、皿、刃物などを洗浄するために使用されるもの(例えば「食器用洗剤」)のような他の洗剤を意味する。酵素に加えて、「界面活性剤組成物」及び「洗浄調合物」は、界面活性剤、ビルダ、漂白剤、漂白剤促進剤、青味剤及び蛍光染料、固化防止剤、マスキング剤、酵素活性剤、酸化防止剤、並びに、可溶化剤を含む洗剤を包含する。
【0048】
本明細書において用いられているように、「洗剤安定性」というフレーズは、界面活性剤組成物における酵素の安定性、並びに、選択的には、付随する基質又は伝達物質の安定性を意味する。いくつかの実施形態においてはこの安定性を洗剤の使用中に評価するが、他の実施形態において、この用語は、保存中の界面活性剤組成物の安定性を意味する。
【0049】
本明細書において用いられているように、「硬表面洗浄組成物」という用語は、床、壁、タイル、ステンレススチール管(例えば発酵槽)、浴槽及びキッチン据え付け設備などのような硬い表面を洗浄するための界面活性剤組成物を意味する。そのような組成物は、以下に限定されるものではないが、固体、液体、乳剤などを含む任意の形態で提供可能である。
【0050】
本明細書において用いられているように、「皿洗浄組成物」という用語は、以下に限定されるものではないが、粒状及び液体の形態を含む、皿を洗浄するための組成物のすべての形態を意味する。
【0051】
本明細書において用いられているように、「消毒」という用語は、真菌、細菌、胞子などを含む微生物の除去又は致死を意味する。
【0052】
本明細書において用いられているように、「生地洗浄組成物」という用語は、以下に限定されるものではないが、顆粒、液体及び固体の形態を含む、生地を洗浄するための界面活性剤組成物の形態を意味する。
【0053】
本明細書において用いられているように、「ポリヌクレオチド」、「核酸」及び「オリゴヌクレオチド」という用語は、一本鎖又は複数鎖(例えば、一本鎖、二本鎖、三重螺旋など)であるかに関わらず、デオキシリボヌクレオチド、リボヌクレオチド、並びに/又は、(修飾されたヌクレオチド若しくは塩基又はそれらの類似体を含む)デオキシリボヌクレオチド若しくはリボヌクレオチドの類似体若しくは修飾された形態を含む任意の長さ及び任意の三次元構造のヌクレオチドの重合体の形態を意味するように互いに区別なく使用される。遺伝子コードが退化しているので、特定のアミノ酸をコードするために1つよりも多いコドンを使用してもよい。使用条件下においてポリヌクレオチドが所望の機能を保持する限り、ヌクレアーゼ耐性を増大させる修飾(例えば、デオキシ、2’−O−Me、ホスホロチオエートなど)を含む、任意の種類の修飾されたヌクレオチド又はヌクレオチド類似体を使用することができる。検出又は補足の目的のために、例えば、放射性ラベル若しくは非放射性ラベル、又は、アンカー(例えば、ビオチン)などのラベルを組み込むこともできる。ポリヌクレオチドという用語は、ペプチド核酸(PNA)も包含する。ポリヌクレオチドは、天然に存在するものであってもよいし又は天然に存在しないものであってもよい。ヌクレオチドの配列は、非ヌクレオチド成分が割り込んだものであってもよい。1つ又はそれ以上のリン酸ジエステル結合を代替連結基によって置換することができる。例えば、リン酸塩は、P(O)S(「チオアート」)、P(S)S(「ジチオアート」)、(O)NR2(「アミデート」)、P(O)R、P(O)OR’、CO又はCH2(「ホルムアセタル」)によって置換されてもよい。ここで、R又はR’は、それぞれ、独立して、H、又は、選択的にエーテル(−O−)結合、アリール、アルケニル、シクロアルキル、シクロアルケニル若しくはアラルキル(araldyl)を含む置換された若しくは置換されていないアルキル(炭素数1乃至20)である。ポリヌクレオチド中のすべての結合が同じである必要はない。ポリヌクレオチドは、直鎖状若しくは環状であってもよいし、又は、直鎖部分と環状部分との組み合わせで構成されていてもよい。
【0054】
本明細書において用いられているように、「ポリペプチド」、「タンパク」及び「ペプチド」という用語は、アミノ酸(すなわち、アミノ酸残基)を含む成分を意味する。アミノ酸残基を表す従来の1文字又は3文字のコードを使用する。ポリペプチドは、直鎖若しくは分岐であってもよいし、修飾されたアミノ酸を含んでいてもよいし、また、アミノ酸でないものが割り込だものであってもよい。この用語は、自然に、又は、例えば、ジスルフィド結合形成、糖鎖形成、脂質化、アセチル化、リン酸化、又は、ラベリング成分との結合のような他の操作若しくは修飾のような介在によって、修飾されたアミノ酸重合体も包含する。その定義には、例えば、1つ又はそれ以上のアミノ酸の類似体(例えば、非天然アミノ酸などを含む)、及び、当業界において知られている他の修飾を含むポリペプチドも含まれる。
【0055】
本明細書において用いられているように、「プライマー」という用語は、天然に存在するものであるか又は合成されたものであるかに関わらず、例えば、精製された制限断片のように、適切な温度及び適切なpHにおいて、ヌクレオチド及びポリメラーゼの存在下において相補的な核酸と共にインキュベートされたときに、核酸合成の開始点として機能することができるオリゴヌクレオチドを意味する。プライマーは、好ましくは一本鎖であるが、代替的に二本鎖であってもよい。二本鎖である場合、プライマーは、伸張生成物を調製するために使用される前に、最初にその鎖を分離するように処理される。プライマーはオリゴデオキシリボヌクレオチドであることが好ましい。プライマーの正確な長さは、温度、プライマーの由来、及び、使用する方法を含む多くの要因に応じて変わるであろう。
【0056】
本明細書において用いられているように、「回収された」、「分離された」、「精製された」及び「分離された」という用語は、天然状態において付随する又は異種発現の結果として付随する少なくとも1つの成分から除去された材料(例えばタンパク、核酸又は細胞)を意味する。
【0057】
本明細書において用いられているように、「繊維」という用語は、ファイバー、毛糸、生地、衣服及び不織生地の材料を意味する。この用語は、天然材料及び合成材料(例えば、製造されたもの)、並びに、天然物と合成物との混合物から作られた繊維を包含する。「繊維」という用語は、処理されていない若しくは処理されたファイバーの両方、毛糸、織った若しくは編んだ生地、不織生地、並びに、衣服を意味する。いくつかの実施形態において、繊維はセルロースを含む。
【0058】
本明細書において用いられているように、「処理を必要とする繊維」というフレーズは、所望の効果を生じさせるために、糊抜き、研磨、漂白及び/又はバイオ研磨する必要がある繊維を意味する。
【0059】
本明細書において用いられているように、「色変性を必要とする繊維」というフレーズは、色に関して変化させる必要がある繊維を意味する。これらの繊維は、他の処理に既に供されたものであってもよいし、まだ供されていないものであってもよい。同様に、これらの繊維は、後処理を必要とするものであってもよいし、必要としないものであってもよい。
【0060】
本明細書において用いられているように、「生地」という用語は、線維及び/又は糸の製造された集成体であって、厚さに対して相対的に大きい表面積と、該集成体に有用な機械強度を与えるのに充分な凝集力とを有する集成体を意味する。
【0061】
本明細書において用いられているように、「色変性」という用語は、まとめて繊維材料と呼ばれる線維、毛糸、生地、衣服又は不織生地の材料に付随する色の彩度、飽和度、強度、輝度、及び/又は、色調における変化を意味する。理論に拘束されるものではないが、色変性は、繊維材料に付随する発色基の変性に起因するものであり、それによってその外観を変化させることが提唱されている。発色基は、繊維を製造するために使用される材料に自然に付随するもの(例えば、綿の白色)であってもよいし、又は、染色若しくは印刷のような特殊な仕上剤に付随するものであってもよい。色変性は、発色基が付着した材料に対する化学的修飾を包含するのみでなく、発色基に対する化学的修飾も包含する。色変性の例には、退色させること、漂白すること、色合いを変えることが含まれる。藍染めされたデニムに対する特別な色変性は、「ヴィンテージ外観」に退色させることであり、それは、新たに染色されたデニムほど強くない青色/紫色の色調、及び、新たに染色されたデニムよりくすんだ灰色の外観を有する。
【0062】
本明細書において用いられているように、「漂白」という用語は、より薄い色を作るために、線維、毛糸、生地、衣服又は不織生地の材料のような繊維材料を処理するプロセスを意味する。この用語は、例えば、繊維処理用途の文脈におけるより明るい又はより白い繊維の生産、及び、例えば、洗浄用途の文脈における汚れの色の軽減も包含する。
【0063】
本明細書において用いられているように、「糊(size)」及び「糊付けする(sizing)」という用語は、繊維工業において糸の耐摩耗性及び強度を増大させることによって製織性能を向上させるために用いられる化合物を意味する。糊は、通常、デンプン又はデンプン用化合物から作られる。
【0064】
本明細書において用いられているように、「糊抜き(desize)」及び「糊抜きする(desizing)」という用語は、通常は特殊な仕上剤、染料又は漂白剤を塗生地する前に、繊維から糊(通常はデンプン)を排除/除去するプロセスを意味する。
【0065】
本明細書において用いられているように、「糊抜き酵素(desizing enzyme)」という用語は、糊を除去するために使用される酵素を意味する。典型的な酵素は、アミラーゼ、セルラーゼ及びマンナナーゼである。
【0066】
本明細書において用いられているように、「同一性%」という用語は、本明細書に記載されているようなラッカーゼをコードする核酸配列と他の核酸配列との間の核酸配列の同一性のレベル、又は、本明細書に記載されているようなラッカーゼ酵素と他のアミノ酸配列との間のアミノ酸配列の同一性のレベルを意味する。配列比較は、従来の配列比較プログラムを使用して実行することができる。核酸及びアミノ酸の配列同一性の典型的なレベルは、以下に限定されるものではないが、本明細書に記載されているように、規定の配列(例えば、ラッカーゼのためのコード配列又はラッカーゼのアミノ酸配列)に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超える配列同一性を含む。
【0067】
2つの配列間の同一性を決定するために使用することができる典型的なコンピュータプログラムは、以下に限定されるものではないが、<www.ncbi.nlm.nih.gov/BLAST>においてインターネット上で公的に利用可能な、例えば、BLASTN、BLASTX、並びに、TBLASTX、BLASTP及びTBLASTNなどのBLASTプログラムの組み合わせを含む。また、「Altschul, et al., 1990」及び「Altschul, et al., 1997」を参照されたい。
【0068】
配列検索は、通常、与えられた核酸配列をGenBank DNA塩基配列及び他の公のデータベースの核酸配列と比較して評価するときは、BLASTNプログラムを使用して行う。BLASTXプログラムは、GenBankタンパク配列及び他の公のデータベースのアミノ酸配列に対して、すべてのリーディングフレームに翻訳される核酸配列を検索するのに好まれる。BLASTN及びBLASTXの両方は、11.0のオープンギャップペナルティ及び1.0の拡張ギャップペナルティのデフォルトパラメーターを使用して実行され、BLOSUM−62マトリクスを利用する(例えば、Altschul, et al., 1997を参照されたい。)
【0069】
2つ以上の配列間の「同一性%」を決定するために選択した複数の配列の配列比較は、例えば、10.0のオープンギャップペナルティ、0.1の拡張ギャップペナルティ及びBLOSUM30シミラリティマトリックスを含むデフォルトパラメーターで動作させたMacVectorバージョン6.5のCLUSTAL−Wプログラムを使用して実行することができる。
【0070】
本明細書において用いられているように、「化学伝達物質」及び「伝達物質」という用語は、酸化酵素活性を示す酵素(例えばラッカーゼ)と第2基質又は電子供与体と間で電子を輸送するための酸化還元伝達物質として機能する化合物を意味するように互いに区別なく使用される。そのような化学伝達物質は、当業界において「エンハンサー(enhancers)」及び「アクセラレ−タ(accelerator)」としても知られている。
【0071】
本明細書において用いられているように、繊維材料が存在する槽に関する「排水する(draining)」又は「落とす(dropping)」という用語は、槽中に存在する溶媒及び試薬を完全に又は部分的に放出すること/空にすることを意味する。槽を排水するステップは、通常、ある工程段階において存在する溶媒及び試薬が後の工程段階を妨げないようにするために、工程段階の間に実行される。脱水は、そのような溶媒及び試薬をさらに除去するための1つ又はそれ以上のすすぎステップを伴うものであってもよい。
【0072】
本明細書において用いられているように、「第2基質」及び「電子供与体」という用語は、酸化酵素活性を示す酵素によって電子を与えることができる及び受け取ることができる染料、色素(例えば藍)、発色基(例えば、ポリフェノール、アントシアニン、若しくは、カロチノイド)又は他の第2基質を意味するように相互に区別なく使用される。
【0073】
以下の略語/頭字語は、別段の定めがない限り以下の意味を有する。
EC 酵素委員会
EDTA エチレンジアミン四酢酸
kDa キロダルトン
MW 分子量
w/v 重量/体積
w/w 重量/重量
v/v 体積/体積
wt% 重量パーセント
℃ 摂氏温度
H2O 水
dH20又はDI 脱イオン水
dIH2O 脱イオン水、ミリQ濾過
g又はgm グラム
μg マイクログラム
mg ミリグラム
kg キログラム
μL及びμl マイクロリットル
mL及びml ミリリットル
mm ミリメートル
μm マイクロメートル
M モル
mM ミリモル
μM マイクロモル
U ユニット
sec及び” 秒
min及び’ 分
hr 時間
eq. 当量
N ノーマル
RTU 使用準備済(ready-to-use)
U 単位
owg 物の重量に対して(on weight of goods)
CIE 国際照明委員会(International Commission on Illumination)
【0074】
数値範囲は、その範囲を定義する数を含む。文脈から明示的に明らかにされていない限り、単数形の冠詞「1つの(a)」、「1つの(an)」及び「その(the)」は、複数の指示対象を含む。別段の定めがない限り、ポリペプチドは、N末端からC末端の標準的な方向で記載されており、また、ポリヌクレオチドは、5’から3’の標準的な方向で記載されている。本発明の組成物及び方法の実施又は試験において均等な方法及び材料を使用することができるので、記載されている特定の方法論、プロトコル及び試薬が限定されるように意図されていないことは理解されるに違いない。読者を助けるために明細書を複数の章に分けているが、限定するものとして章の見出しを解釈してはならず、ある章における記載を別の章に適用することができる。本明細書において引用されているすべての刊行物は、言及することによって明示的に組み込まれている。
【0075】
ラッカーゼ及びラッカーゼ関連酵素
酵素的酸化の系、組成物及び方法は、本明細書においてまとめて「ラッカーゼ」又は「ラッカーゼ酵素」と呼ばれるラッカーゼ又はラッカーゼ関連酵素の1つ又はそれ以上を含む。そのようなラッカーゼは、生化学及び分子生物学の国際連合の命名法委員会(Nomenclature Committee of the International Union of Biochemistry and Molecular Biology)(IUBMB)による、EC1.10.3.2に包含されるあらゆるラッカーゼ酵素を包含する。微生物及び植物に由来するラッカーゼ酵素は、当業界において知られている。微生物のラッカーゼ酵素は、細菌又は真菌(糸状菌及び酵母菌を含む)に由来するものであってもよい。好適な例には、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)(例えば、N.クラッサ(N. crassa))、ポドスポラ(Podospora)、ボトリティス(Botrytis)、コリビア(Collybia)、セレナ(Cerrena)(例えば、ユニカラー)、スタキボトリス(Stachybotrys)、パヌス(Panus)(例えばP.ルディス)、チエラビア(Thielavia)、フォメス(Fomes)、レンチヌス(Lentinus)、プルーロタス(Pleurotus)、トラメテス(Trametes)(例えば、T.ビロッサ(T. villosa)及びT.ベルシカラー(T. versicolor))、リゾクトニア(Rhizoctonia)(例えばR.ソラニ(R.solani)、コプリナス(Coprinus)(例えばC.プリカティリス(C.plicatilis)、C.シネレウス(C. cinereus))、ムジナタケ(Psatyrella)、ミセリオフトラ(例えばM.サーモンヒラ(thermonhila))、シタリディウム(Schytalidium)、フレビア(Phlebia)(例えばP.ラディタ(radita)(WO92/01046)、若しくはコリオルス(Coriolus)(例えばC.ヒルスタス(hirsutus)(JP2238885))、スポンジペリス(Spongipellis)、ポリポラス(Polyporus)、セリポリオプシス サブベルミスポラ(Ceriporiopsis subvermispora)、ガノデルマ ツノダエ(Ganoderma tsunodae)、並びに、トリコデルマ(Trichoderma)の種から由来する又は由来し得るラッカーゼが含まれる。
【0076】
ラッカーゼは、ラッカーゼをコードするヌクレオチド配列を含む組み換えDNAベクターでトランスフォームされた宿主細胞を培養することによって生産することができる。DNAベクターには、培地中におけるラッカーゼの発現を可能にし、また、その培養液からラッカーゼを選択的に回収できるようにするヌクレオチド配列がさらに含まれていてもよい。
【0077】
ラッカーゼ酵素をコードするポリヌクレオチド配列を含む発現ベクターを、適切な宿主細胞内にトランスフォームすることができる。宿主細胞は、糸状菌細胞のような真菌細胞であってもよく、その例は、以下に限定されないが、トリコデルマ[例えば、T.リーゼイ(従来、T.ロンギブラキアツム(longibrachiatum)として分類され、また、現在、ハイポクレアジェコリナ(Hypocrea jecorina)としても知られている)、T.ビリデ(Viride)、T.コニンジ(koningii)及びT.ハルジアヌム(harzianum)]、アスペルギルス(Aspergillus)(例えば、A.ニガー(A. niger)、A.ニデュランス(A. nidulans)、A.オリザエ(A. oryzae)及びA.アワモリ(A. awamori))、ペニシリウム(Penicillium)、フミコラ(Humicola)(例えば、H.インソレンズ(H. insolens)及びH.グリシー(H.grisea))、フザリウム(Fusarium)(例えばF.グラミナム(F. Graminum)及びF.ベネナツム(F.venenatum))、ニューロスポラ(Neurospora)、ボタンタケ(Hypocrea)、並びに、ケカビ(Mucor)の種を包含する。ラッカーゼ酵素の発現用の宿主細胞は、セレナ(Cerrena)(例えば、C.ユニカラー)の一種に由来するものであってもよい。真菌細胞は、当業界において知られている技術を使用して、細胞壁の再生を後に伴う、原形質体形成及び原形質体のトランスフォーメーションを含むプロセスによってトランスフォームすることができる。
【0078】
代替的に、宿主生物は、バチルス[例えば、B.サブチリス、B.リケニホルミス、B.レンタス、B.(ナウゲオバシラス)ステアロサーモフィラス、及び、B.ブレビス]、シュードモナスストレプトミセス(例えば、S.コエリカラー、S.リビダンス)、又は、大腸菌のような細菌の一種に由来するものであってもよい。細菌細胞のトランスフォーメーションは、例えば、「Maniatis, T. et al., "Molecular Cloning: A Laboratory Manual," Cold Spring Harbor, 1982」に記載されているように、従来の方法に従って実行することができる。適切なDNA塩基配列のスクリーニング及びベクターの構築もまた、標準的手順(上記参照)によって実行可能である。
【0079】
トランスフォームされた宿主細胞を培養するために使用される培地は、宿主細胞を培養するのに適した従来のあらゆる培地であり得る。いくつかの実施形態において、発現された酵素は、培地中に分泌され、その培地から公知の手順に従って回収することができる。ラッカーゼは、例えば、米国特許公開公報第2008/0196173号に記載されているような培地から回収することができる。いくつかの実施形態において、酵素は、細胞内で発現され、細胞膜の破壊後に回収される。
【0080】
特定の実施形態において、発現宿主は、CBH1プロモータ及びターミネータの制御下にラッカーゼコード領域を有するトリコデルマリーゼイであってもよい(例えば、米国特許第5,861,271号参照)。発現ベクターは、例えば、米国特許第7,413,887号に開示されているような、pTrex3gであってもよい。いくつかの実施形態において、ラッカーゼは、米国特許公開公報第2008/0196173号又は第2009/0221030号に記載されているように発現される。
【0081】
以下のラッカーゼ遺伝子及びラッカーゼは、米国公開公報第2008/0196173号に記載されている。
A.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼA1遺伝子
ポリヌクレオチド配列(配列番号1):
ATGAGCTCAA AGCTACTTGC TCTTATCACT GTCGCTCTCG TCTTGCCACT 50
AGGCACCGAC GCCGGCATCG GTCCTGTTAC CGACTTGCGC ATCACCAACC 100
AGGATATCGC TCCAGATGGC TTCACCCGAC CAGCGGTACT AGCTGGGGGC 150
ACATTCCCTG GAGCACTTAT TACCGGTCAG AAGGTATGGG AGATCAACTT 200
GGTTGAATAG AGAAATAAAA GTGACAACAA ATCCTTATAG GGAGACAGCT 250
TCCAAATCAA TGTCATCGAC GAGCTTACCG ATGCCAGCAT GTTGACCCAG 300
ACATCCATTG TGAGTATAAT TTAGGTCCGC TCTTCTGGCT ATCCTTTCTA 350
ACTCTTACCG TCTAGCATTG GCACGGCTTC TTTCAGAAGG GATCTGCGTG 400
GGCCGATGGT CCTGCCTTCG TTACTCAATG CCCTATCGTC ACCGGAAATT 450
CCTTCCTGTA CGACTTTGAT GTTCCCGACC AACCTGGTAC TTTCTGGTAC 500
CATAGTCACT TGTCTACTCA ATATTGCGAT GGTCTTCGTG GCCCGTTCGT 550
TGTATACGAT CCAAAGGATC CTAATAAACG GTTGTACGAC ATTGACAATG 600
GTATGTGCAT CATCATAGAG ATATAATTCA TGCAGCTACT GACCGTGACT 650
GATGCTGCCA GATCATACGG TTATTACCCT GGCAGACTGG TACCACGTTC 700
TCGCAAGAAC TGTTGTCGGA GTCGCGTAAG TACAGTCTCA CTTATAGTGG 750
TCTTCTTACT CATTTTGACA TAGGACACCC GACGCAACCT TGATCAACGG 800
TTTGGGCCGT TCTCCAGACG GGCCAGCAGA TGCTGAGTTG GCTGTCATCA 850
ACGTTAAACG CGGCAAACGG TATGTTATTG AACTCCCGAT TTCTCCATAC 900
ACAGTGAAAT GACTGTCTGG TCTAGTTATC GATTTCGTCT GGTCTCCATC 950
TCATGTGACC CTAATTACAT CTTTTCTATC GACAACCATT CTATGACTGT 1000
CATCGAAGTC GATGGTGTCA ACACCCAATC CCTGACCGTC GATTCTATTC 1050
AAATCTTCGC AGGCCAACGA TACTCGTTCG TCGTAAGTCT CTTTGCACGA 1100
TTACTGCTTC TTTGTCCATT CTCTGACCTG TTTAAACAGC TCCATGCCAA 1150
CCGTCCTGAA AACAACTATT GGATCAGGGC CAAACCTAAT ATCGGTACGG 1200
ATACTACCAC AGACAACGGC ATGAACTCTG CCATTCTGCG ATACAACGGC 1250
GCACCTGTTG CGGAACCGCA AACTGTTCAA TCTCCCAGTC TCACCCCTTT 1300
GCTCGAACAG AACCTTCGCC CTCTCGTGTA CACTCCTGTG GTATGTTTCA 1350
AAGCGTTGTA ATTTGATTGT GGTCATTCTA ACGTTACTGC GTTTGCATAG 1400
CCTGGAAACC CTACGCCTGG CGGCGCCGAT ATTGTCCATA CTCTTGACTT 1450
GAGTTTTGTG CGGAGTCAAC ATTCGTAAAG ATAAGAGTGT TTCTAATTTC 1500
TTCAATAATA GGATGCTGGT CGCTTCAGTA TCAACGGTGC CTCGTTCCTT 1550
GATCCTACCG TCCCCGTTCT CCTGCAAATT CTCAGCGGCA CGCAGAATGC 1600
ACAAGATCTA CTCCCTCCTG GAAGTGTGAT TCCTCTCGAA TTAGGCAAGG 1650
TCGTCGAATT AGTCATACCT GCAGGTGTCG TCGGTGGACC TCATCCGTTC 1700
CATCTCCATG GGGTACGTAA CCCGAACTTA TAACAGTCTT GGACTTACCC 1750
GCTGACAAGT GCATAGCATA ACTTCTGGGT CGTGCGAAGT GCCGGAACCG 1800
ACCAGTACAA CTTTAACGAT GCCATTCTCC GAGACGTCGT CAGTATAGGA 1850
GGAACCGGGG ATCAAGTCAC CATTCGTTTC GTGGTATGTT TCATTCTTGT 1900
GGATGTATGT GCTCTAGGAT ACTAACCGGC TTGCGCGTAT AGACCGATAA 1950
CCCCGGACCG TGGTTCCTCC ATTGCCATAT CGACTGGCAC TTGGAAGCGG 2000
GTCTCGCTAT CGTATTTGCA GAGGGAATTG AAAATACTGC TGCGTCTAAT 2050
TTAACCCCCC GTACGCGGTT TCCCTCACAT CCTGGAGCTA AGCAGCTTAC 2100
TAACATACAT TTGCAGAGGC TTGGGATGAG CTTTGCCCGA AGTATAACGC 2150
GCTCAGCGCA CAAAAGAAGG TTGCATCTAA GAAAGGCACT GCCATCTAAT 2200
TTTTGTAACA AACAAGGAGG GTCTCTTGTA CTTTTATTGG GATTTCTTTC 2250
TTGGGGTTTA TTGTTAAACT TGACTCTACT ATGTTTGGAA GACGAAAGGG 2300
GCTCGCGCAT TTATATACTA TCTCTCTTGG CATCACCTGC AGCTCAATCC 2350
TTCAACCACC TAA 2363
翻訳されたタンパク配列(配列番号2):
MSSKLLALIT VALVLPLGTD AGIGPVTDLR ITNQDIAPDG FTRPAVLAGG 50
TFPGALITGQ KGDSFQINVI DELTDASMLT QTSIHWHGFF QKGSAWADGP 100
AFVTQCPIVT GNSFLYDFDV PDQPGTFWYH SHLSTQYCDG LRGPFVVYDP 150
KDPNKRLYDI DNDHTVITLA DWYHVLARTV VGVATPDATL INGLGRSPDG 200
PADAELAVIN VKRGKRYRFR LVSISCDPNY IFSIDNHSMT VIEVDGVNTQ 250
SLTVDSIQIF AGQRYSFVLH ANRPENNYWI RAKPNIGTDT TTDSGMNSAI 300
LRYNGAPVAE PQTVQSPSLT PLLEQNLRPL VYTPVPGNPT PGGADIVHTL 350
DLSFDAGRFS INGASFLDPT VPVLLQILSG TQNAQDLLPP GSVIPLELGK 400
VVELVIPAGV VGGPHPFHLH GHNFWVVRSA GTDQYNFNDA ILRDVVSIGG 450
TGDQVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIE NTAASNLTPQ 500
AWDELCPKYN ALSAQKKLNP STT 523
B.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼA2遺伝子
ポリヌクレオチド配列(配列番号3):
ATGAGCTCAA AGCTACTTGC TCTTATTACT GTCGCTCTCG TCTTGCCACT 50
AGGCACTGAC GCCGGCATCG GTCCTGTTAC CGACTTGCGC ATCACCAACC 100
AGGATATCGC TCCAGATGGC TTCACCCGAC CAGCTGTACT GGCTGGGGGC 150
ACATTCCCCG GAGCACTGAT TACCGGTCAG AAGGTATGGG AGATCGATTT 200
CGTTGAATAG AGAAATACAA CTGAAAACAA ATTCTTATAG GGAGACAGCT 250
TCCAAATCAA TGTCATCGAC GAGCTTACCG ATGCCAGCAT GTTGACCCAG 300
ACATCCATTG TGAGTATAAT ATGGGTCCGC TCTTCTAGCT ATCCTTTCTA 350
ACTCTTACCC TCTAGCATTG GCACGGCTTC TTTCAGAAGG GATCTGCGTG 400
GGCCGATGGT CCTGCCTTCG TTACTCAATG TCCTATCGTC ACCGGAAATT 450
CCTTCCTGTA CGACTTTGAT GTCCCCGACC AACCTGGTAC TTTCTGGTAC 500
CATAGTCACT TGTCTACTCA ATATTGCGAT GGTCTTCGGG GCCCGTTCGT 550
TGTATACGAT CCAAAGGATC CTAATAAACG GTTGTACGAC ATTGACAATG 600
GTATGTGCAT CATCATAAAA ATATAATTCA TGCAGCTACT GACCGCGACT 650
GATGCTGCCA GATCATACGG TTATTACCCT GGCAGACTGG TACCACGTTC 700
TCGCACGAAC TGTTGTCGGA GTCGCGTAAG TACAGTCTGA CTTATAGTGG 750
TCTTCTTACT CATTTTGACA TAGGACACCC GACGCAACCT TGATCAACGG 800
TTTGGGCCGT TCTCCAGACG GGCCAGCAGA TGCTGAGTTG GCTGTCATCA 850
ACGTTAAACG CGGCAAACGG TATGTCATTG AACTCCCGAT TTCTCCATTC 900
ACATTGAAAT GACTGTCTGG TCTAGTTATC GATTCCGTCT GGTCTCCATC 950
TCATGTGACC CTAATTACAT CTTTTCTATC GACAACCATT CTATGACTGT 1000
CATCGAAGTC GATGGTGTCA ACACCCAATC CCTGACCGTC GATTCTATCC 1050
AAATCTTCGC AGGCCAACGC TACTCGTTCG TCGTAAGTCT CTTTGAATGG 1100
TTGGTGCTTT TTCTGTCCAT TCTCTAACCT GTTTATACAG CTCCATGCCA 1150
ACCGTCCTGA AAACAACTAT TGGATCAGGG CCAAACCTAA TATCGGTACG 1200
GATACTACCA CAGACAACGG CATGAACTCT GCCATTCTGC GATACAACGG 1250
CGCACCTGTT GCGGAACCGC AAACTGTTCA ATCTCCCAGT CTCACCCCTT 1300
TGCTCGAACA GAACCTTCGC CCTCTCGTGT ACACTCCTGT GGTATGTTTC 1350
AAAGCGTTGT AATTTGATTG TGGTCATTCT AACGTTACTG CCTTTGCACA 1400
GCCTGGAAAT CCTACGCCTG GCGGGGCCGA TATTGTCCAT ACTCTTGACT 1450
TGAGTTTTGT GCGGAGTCAA CATTCGTAAA GATAAGAGTG TTTCTAATTT 1500
CTTCAATAAT AGGATGCTGG TCGCTTCAGT ATCAACGGTG CCTCGTTCCT 1550
TGATCCTACC GTCCCTGTTC TCCTGCAAAT TCTCAGCGGC ACGCAGAATG 1600
CACAAGATCT ACTCCCTCCT GGAAGTGTGA TTCCTCTCGA ATTAGGCAAG 1650
GTCGTCGAAT TAGTCATACC TGCAGGTGTT GTCGGTGGAC CTCATCCGTT 1700
CCATCTCCAT GGGGTACGTA ACCCGAACTT ATAACAGTCT TGGACTTACC 1750
CGCTGACAAG TGTATAGCAT AACTTCTGGG TCGTGCGAAG TGCCGGAACC 1800
GACCAGTACA ACTTTAACGA TGCCATTCTC CGAGACGTCG TCAGTATAGG 1850
AGGAACCGAG GATCAAGTCA CCATTCGATT CGTGGTATAT ACTTCATTCT 1900
TGTGGATGTA TGTGCTCTAG GATACTAACT GGCTTGCGCG TATAGACCGA 1950
TAACCCCGGA CCGTGGTTCC TCCATTGCCA TATCGACTGG CACTTGGAAG 2000
CGGGTCTCGC TATCGTATTT GCAGAGGGAA TTGAAAATAC TGCTGCGTCT 2050
AATCCAACCC CCCGTATGCG GTTTCCCACA CATTCTGAAT CTAAGCAGCT 2100
TACTAATATA CATTTGCAGA GGCTTGGGAT GAGCTTTGCC CGAAGTATAA 2150
CGCGCTCAAC GCACAAAAGA AGGTTGCATC TAAGAAAGGC ACTGCCATCT 2200
AATCCTTGTA ACAAACAAGG AGGGTCTCTT GTACTTTTAT TGGGATTTAT 2250
TTCTTGGGGT TTATTGTTCA ACTTGATTCT ACTATGTTTG GAAGTAGCGA 2300
TTACGAAAGG GGCTTGCGCA TTTATATACC ATCTTTCTTG GCACCACCTG 2350
CAGCTCAATC CTTCAACCAC CTAA 2374
翻訳されたタンパク配列(配列番号4):
MSSKLLALIT VALVLPLGTD AGIGPVTDLR ITNQDIAPDG FTRPAVLAGG 50
TFPGALITGQ KGDSFQINVI DELTDASMLT QTSIHWHGFF QKGSAWADGP 100
AFVTQCPIVT GNSFLYDFDV PDQPGTFWYH SHLSTQYCDG LRGPFVVYDP 150
KDPNKRLYDI DNDHTVITLA DWYHVLARTV VGVATPDATL INGLGRSPDG 200
PADAELAVIN VKRGKRYRFR LVSISCDPNY IFSIDNHSMT VIEVDGVNTQ 250
SLTVDSIQIF AGQRYSFVLH ANRPENNYWI RAKPNIGTDT TTDNGMNSAI 300
LRYNGAPVAE PQTVQSPSLT PLLEQNLRPL VYTPVPGNPT PGGADIVHTL 350
DLSFDAGRFS INGASFLDPT VPVLLQILSG TQNAQDLLPP GSVIPLELGK 400
VVELVIPAGV VGGPHPFHLH GHNFWVVRSA GTDQYNFNDA ILRDVVSIGG 450
TEDQVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIE NTAASNPTPQ 500
AWDELCPKYN ALNAQKKLNP STT 523
C.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼB1遺伝子
ポリヌクレオチド配列(配列番号5):
ATGTCTCTTC TTCGTAGCTT GACCTCCCTC ATCGTACTAG TCATTGGTGC 50
ATTTGCTGCA ATCGGTCCAG TCACTGACCT ACATATAGTG AACCAGAATC 100
TCGACCCAGA TGGTTTCAAC CGCCCCACTG TACTCGCAGG TGGTACTTTC 150
CCCGGTCCTC TGATTCGTGG TAACAAGGTA CGCTTCATAA CCGCCCTCCG 200
TAGACGTAGG CTTCGGCTGA CATGACCATC ATCTGTAGGG AGATAACTTT 250
AAAATTAATG TGATTGACGA CTTGACAGAG CACAGTATGC TCAAGGCTAC 300
GTCCATCGTA AGTCCCTGAT TAACGTTTCA CCTGGTCATA TCGCTCAACG 350
TCTCGAAGCA CTGGCATGGG TTCTTCCAGA AGGGAACCAA CTGGGCCGAT 400
GGCCCCGCCT TTGTCACCCA ATGTCCTATC ACATCAGGAA ACGCCTTCCT 450
GTATGATTTC AACGTTCCGG ACCAAGCTGG TACTTTCTGG TACCACAGCC 500
ATCTCTCTAC ACAGTATTGT GACGGTCTTC GTGGTGCCTT TGTCGTCTAT 550
GATCCTAATG ATCCCAACAA GCAACTCTAT GATGTTGATA ACGGCAAGTT 600
CCTTGCATAT TTCATTTCTA TCATATCCTC ACCTGTATTG GCACAGAAAG 650
CACCGTGATT ACCTTGGCTG ATTGGTATCA TGCCCTTGCT CAGACTGTCA 700
CTGGTGTCGC GTGAGTGACA AATGGCCCTC AATTGTTCAC ATATTTTCCT 750
GATTATCATA TGATAGAGTA TCTGATGCAA CGTTGATCAA CGGATTGGGA 800
CGTTCGGCCA CCGGCCCCGC AAATGCCCCT CTGGCGGTCA TCAGTGTCGA 850
GCGGAATAAG AGGTCAGTTC CATAATTATG ATTATTTCCC GCGTTACTTC 900
CTAACAATTA TTTTTGTATC CCTCCACAGA TATCGTTTCC GATTGGTTTC 950
TATTTCTTGC GACCCTAACT TTATTTTCTC AATTGACCAC CACCCAATGA 1000
CCGTAATTGA GATGGACGGT GTTAATACCC AATCTATGAC CGTAGATTCG 1050
ATCCAAATAT TCGCAGGTCA ACGATATTCA TTTGTCGTAG GTTATTATAA 1100
ACTGCCCACC GATCATCTCT CACGTAACTG TTATAGATGC AAGCCAACCA 1150
ACCAGTTGGA AATTATTGGA TCCGCGCTAA ACCTAATGTT GGGAACACAA 1200
CTTTCCTTGG AGGCCTGAAC TCCGCTATAT TACGATATGT GGGAGCCCCT 1250
GACCAAGAAC CGACCACTGA CCAAACACCC AACTCTACAC CGCTCGTTGA 1300
GGCGAACCTA CGACCCCTCG TCTATACTCC TGTGGTATGT TGTTCTCGTT 1350
ACATATACCA AACCTAATAT GAAGACTGAA CGGATCTACT AGCCGGGACA 1400
GCCATTCCCT GGCGGTGCTG ATATCGTCAA GAACTTAGCT TTGGGTTTCG 1450
TACGTGTATT TCACTTCCCT TTTGGCAGTA ACTGAGGTGG AATGTATATA 1500
GAATGCCGGG CGTTTCACAA TCAATGGAGC GTCCCTCACA CCTCCTACAG 1550
TCCCTGTACT ACTCCAGATC CTCAGTGGTA CTCACAATGC ACAGGATCTT 1600
CTCCCAGCAG GAAGCGTGAT CGAACTTGAA CAGAATAAAG TTGTCGAAAT 1650
CGTTTTGCCC GCTGCGGGCG CCGTTGGCGG TCCTCATCCT TTTCACTTAC 1700
ATGGTGTAAG TATCAGACGT CCTCATGCCC ATATTGCTCC GAACCTTACA 1750
CACCTGATTT CAGCACAATT TCTGGGTGGT TCGTAGCGCC GGTCAAACCA 1800
CATACAATTT CAATGATGCT CCTATCCGTG ATGTTGTCAG TATTGGCGGT 1850
GCAAACGATC AAGTCACGAT CCGATTTGTG GTATGTATCT CGTGCCTTGC 1900
ATTCATTCCA CGAGTAATGA TCCTTACACT TCGGGTTCTC AGACCGATAA 1950
CCCTGGCCCA TGGTTCCTTC ACTGTCACAT TGACTGGCAT TTGGAGGCTG 2000
GGTTCGCTGT AGTCTTTGCG GAGGGAATCA ATGGTACTGC AGCTGCTAAT 2050
CCAGTCCCAG GTAAGACTCT CGCTGCTTTG CGTAATATCT ATGAATTTAA 2100
ATCATATCAA TTTGCAGCGG CTTGGAATCA ATTGTGCCCA TTGTATGATG 2150
CCTTGAGCCC AGGTGATACA TGA 2173
翻訳されたタンパク配列(配列番号6):
MSLLRSLTSL IVLVIGAFAA IGPVTDLHIV NQNLDPDGFN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN AFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GNTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWIRA KPNVGNTTFL GGLNSAILRY 300
VGAPDQEPTT DQTPNSTPLV EANLRPLVYT PVPGQPFPGG ADIVKNLALG 350
FNAGRFTING ASLTPPTVPV LLQILSGTHN AQDLLPAGSV IELEQNKVVE 400
IVLPAAGAVG GPHPFHLHGH NFWVVRSAGQ TTYNFNDAPI RDVVSIGGAN 450
DQVTIRFVTD NPGPWFLHCH IDWHLEAGFA VVFAEGINGT AAANPVPAAW 500
NQLCPLYDAL SPGDT 515
D.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼB2遺伝子
ポリヌクレオチド配列(配列番号7):
CACCGCGATG TCTCTTCTTC GTAGCTTGAC CTCCCTCATC GTACTAGCCA 50
CTGGTGCATT TGCTGCAATC GGTCCAGTCA CCGACCTACA TATAGTGAAC 100
CAGAATCTCG CCCCAGATGG TTTAAACCGC CCCACTGTAC TCGCAGGTGG 150
TACTTTCCCC GGTCCTCTGA TTCGTGGTAA CAAGGTACGC TTCATAACCG 200
CCCTCCGTAG ACGTAGGCTT CGGCTGACAT GACCATCATC TGTAGGGAGA 250
TAACTTTAAA ATTAATGTGA TTGACGACTT GACAGAACAC AGTATGCTCA 300
AGGCTACGTC CATTGTAAGT CCCTGATTAA CGTTTCACCT GGTCATATCG 350
CTCAACGTCT CGAAGCACTG GCATGGGTTC TTCCAGAAGG GAACCAACTG 400
GGCCGATGGC CCCGCCTTTG TCACCCAATG TCCTATCACA TCAGGAAACG 450
CCTTCTTGTA TGATTTCAAC GTTCCGGACC AAGCTGGTAC TTTCTGGTAC 500
CACAGCCATC TCTCYACACA GTATTGTGAC GGTCTTCGTG GTGCCTTTGT 550
CGTCTATGAT CCTAATGATC CCAACAAGCA ACTCTATGAT GTTGATAACG 600
GCAAGTCCCT TGCATATTTC AGTTCTATCA TATCCTCACC TGTATTGGCA 650
CAGAAAGCAC CGTGATTACC TTGGCTGATT GGTATCATGC CCTTGCTCAG 700
ACTGTCACTG GTGTCGCGTG AGTGACAAAT GGCCCTTAAT TGTTCACATA 750
TTTTCCTGAT TATCATATGA TAGAGTATCT GATGCAACGT TGATCAACGG 800
ATTGGGACGT TCGGCCACCG GCCCCGCAAA TGCCCCTCTG GCGGTCATCA 850
GTGTCGAGCG GAATAAGAGG TCAGTTCCAT AATTATGATT ATTTCCCGCG 900
TTACTTCCTA ACGATTATTT TTGTATCCCT CCACAGATAT CGTTTCCGAT 950
TGGTTTCTAT TTCTTGCGAC CCTAACTTTA TTTTCTCAAT TGACCACCAC 1000
CCAATGACCG TAATTGAGAT GGACGGTGTT AATACCCAAT CTATGACCGT 1050
AGATTCGATC CAAATATTCG CAGGTCAACG ATATTCATTT GTCGTAGGTT 1100
ATTATAAACT GCCCACCGAT CATCTCTCAC GTAACTGTTA TAGATGCAAG 1150
CCAACCAACC AGTTGGAAAT TATTGGATCC GYGCTAAACC TAATGTTGGG 1200
AACACAACTT TCCTTGGAGG CCTGAACTCC GCTATATTAC GATATGTGGG 1250
AGCCCCTGAC CAAGAACCGA CCACTGACCA AACACCCAAC TCTACACCGC 1300
TCGTCGAGGC GAACCTACGT CCCCTCGTCT ATACTCCTGT GGTATGTTGT 1350
TCTCGTTACA TATACCAAAC CTAATATGAG GACTGAACGG ATCTACTAGC 1400
CGGGACAGCC ATTCCCTGGC GGTGCTGATA TCGTCAAGAA CTTAGCTTTG 1450
GGTTTCGTAC GTGTATTTCA CTTCCCTTTT GGCAGTAACT GAGGTGGAAT 1500
GTATATAGAA TGCCGGGCGT TTCACAATCA ATGGAACATC CTTCACACCT 1550
CCTACAGTCC CTGTACTACT CCAGATCCTC AGTGGTACTC ACAATGCACA 1600
GGATCTTCTT CCAGCAGGAA GCGTGATCGA ACTTGAACAG AATAAAGTTG 1650
TCGAAATCGT TCTGCCCGCT GCGGGCGCCG TTGGCGGTCC TCATCCTTTC 1700
CACTTACATG GTGTAAGTAT CAGACGTCCT CATGCCTATA TTGCTCCGAA 1750
CCTTACACAC CTGATTTCAG CACAATTTCT GGGTGGTTCG TAGCGCCGGT 1800
CAAACCACAT ACAATTTCAA TGATGCTCCT ATCCGTGATG TTGTCAGTAT 1850
TGGCGGTGCA AACGATCAAG TCACGATCCG ATTTGTGGTA TGTATCTCGT 1900
GCCTTGCATT CATTCCACGA GTAATGATCC TTACACTTCG GGTTCTCAGA 1950
CCGATAACCC TGGCCCATGG TTCCTTCACT GTCACATTGA CTGGCATTTG 2000
GAGGCTGGGT TCGCTGTAGT CTTTGCGGAG GGAATCAATG GCACTGCAGC 2050
TGCTAATCCA GTCCCAGGTA AGACTCTCGC TGCTTTGCGT AATATCTATG 2100
AATTTAAAGC ATATCAATTT GCAGCGGCTT GGAATCAATT GTGCCCGTTG 2150
TATGATGCCT TGAGCCCAGG TGATACATGA TTACTCGTAG CTGTGCTTTC 2200
TTATACATAT TCTATGGGTA TATCGGAGTA GCTGTACTAT AGTATGTACT 2250
ATACTAGGTG GGATATGYTG ATGTTGATTT ATATAATTTT GTTTGAAGAG 2300
TGACTTTATC GACTTGGGAT TTAGCCGAGT ACATACTGAT CTCTCACTAC 2350
AGGCTTGTTT TGTCTTTGGG CGCTTACTCA ACAGTTGACT GTTTTTGCTA 2400
TTACGCATTG AACCGCATTC CGGTCYGACT CGTGTCCTCT ACTGTGACTT 2450
GTATTGGCAT TCTAGCACAT ATGTCTCTTA CCTATAGGAA CAATATGTCT 2500
CAACACTGTT CCAAAACCTG CGTAAACCAA ATATCGTCCA TCAGATCAGA 2550
TCATTAACAG TGCCGCACTA ACCTAATACA CTGGCARGGA CTGTGGAAAT 2600
CCCTATAAAT GACCTCTAGA CCGTGAGGTC ATTGCAAGGT CGCTCTCCTT 2650
GTCAAGATGA CCC 2663
翻訳されたタンパク配列(配列番号8):
MSLLRSLTSL IVLATGAFAA IGPVTDLHIV NQNLAPDGLN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN AFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GNTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWIRA KPNVGNTTFL GGLNSAILRY 300
VGAPDQEPTT DQTPNSTPLV EANLRPLVYT PVPGQPFPGG ADIVKNLALG 350
FNAGRFTING TSFTPPTVPV LLQILSGTHN AQDLLPAGSV IELEQNKVVE 400
IVLPAAGAVG GPHPFHLHGH NFWVVRSAGQ TTYNFNDAPI RDVVSIGGAN 450
DQVTIRFVTD NPGPWFLHCH IDWHLEAGFA VVFAEGINGT AAANPVPAAW 500
NQLCPLYDAL SPGDT 515
E.ATCC20013株に由来するセレナ(Cerrena)ラッカーゼB3遺伝子(一部)
ポリヌクレオチド配列(配列番号:9):
GTGGGGGCGG ATCCCTAACT GTTTCGAATC GGCACCGAAG TATGCAGGTG 50
TGACGGAGAT GAGGCGTTTT TTCATCTTCC ACTGCAGTAT AAAATGTCTC 100
AGGTAACGTC CAGCTTTTTG TACCAGAGCT ACCTCCAAAT ACCTTTACTC 150
GCAAAGGTTT CGCGATGTCT CTTCTTCGTA GCTTGACCTC CCTCATCGTA 200
CTAGCCACTG GTGCATTTGC TGCAATCGGT CCAGTCACTG ACCTACATAT 250
AGTGAACCAG AATCTCGCCC CAGATGGTTT CAACCGCCCC ACTGTACTCG 300
CAGGTGGTAC TTTCCCCGGT CCTCTGATTC GTGGTAACAA GGTACGCTTC 350
ATAACCGCCC TCCGTAGACG TAGGCTTCGG CTGACATGAC CATCATCTGT 400
AGGGAGATAA CTTTAAAATT AATGTGATTG ACGACTTGAC AGAACACAGT 450
ATGCTCAAGG CCACGTCCAT TGTAAGTCCC TGATTAACGT TTCACCTGGT 500
CATATCGCTC AACGTCTCGA AGCACTGGCA TGGGTTCTTC CAGAAGGGAA 550
CCAACTGGGC CGATGGCCCC GCCTTTGTCA CCCAATGTCC TATCACATCA 600
GGAAACTCCT TCCTGTATGA TTTCAACGTT CCGGACCAAG CTGGTACTTT 650
CTGGTACCAC AGCCATCTCT CTACACAGTA TTGTGACGGT CTTCGTGGTG 700
CCTTTGTCGT CTATGATCCT AATGATCCCA ACAAGCAACT CTATGATGTT 750
GATAACGGCA AGTCCCTTGC ATATTTCATT TCTATCATAT CCTCACCTGT 800
ATTGGCACAG AAAGCACCGT GATTACCTTG GCTGATTGGT ATCATGCCCT 850
TGCTCAGACT GTCACTGGTG TCGCGTGAGT GACAAATGGC CCTCAATTGT 900
TCACATATTT TCCTGATTAT CATATGATAG AGTATCTGAT GCAACGTTGA 950
TCAACGGATT GGGACGTTCG GCCACCGGCC CCGCAAATGC CCCTCTGGCG 1000
GTCATCAGTG TCGAGCGGAA TAAGAGGTCA GTTCCATAAT TATGATTATT 1050
TCCCGCGTTA CTTCCTAACA ATTATTCTTG TATCCCTCCA CAGATATCGC 1100
TTCCGATTGG TGTCTATTTC TTGCGACCCT AACTTTATTT TCTCAATTGA 1150
TCACCACCCA ATGACCGTAA TTGAGATGGA CGGTGTTAAT ACCCAATCTA 1200
TGACCGTAGA TTCGATCCAA ATATTCGCAG GTCAACGATA TTCATTTGTC 1250
GTAGGTTATT ATAAACTGCC CACCGATCAT CTCTCACGTA ACTGTTATAG 1300
ATGCAAGCCA ACCAACCRGT TGGAAATTAT TGGATCC 1337
翻訳されたタンパク配列(配列番号10):
MSLLRSLTSL IVLATGAFAA IGPVTDLHIV NQNLAPDGFN RPTVLAGGTF 50
PGPLIRGNKG DNFKINVIDD LTEHSMLKAT SIHWHGFFQK GTNWADGPAF 100
VTQCPITSGN SFLYDFNVPD QAGTFWYHSH LSTQYCDGLR GAFVVYDPND 150
PNKQLYDVDN GKTVITLADW YHALAQTVTG VAVSDATLIN GLGRSATGPA 200
NAPLAVISVE RNKRYRFRLV SISCDPNFIF SIDHHPMTVI EMDGVNTQSM 250
TVDSIQIFAG QRYSFVMQAN QPVGNYWI 278
F.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼC遺伝子(一部)
ポリヌクレオチド配列(配列番号11):
TGCAATCGGA CCGGTBGCTG ACCTTCACAT TACGGACGAT ACCATTGCCC 50
CCGATGGTTT CTCTCGTCCT GCTGTTCTCG CTGGCGGGGG TTTCCCTGGC 100
CCTCTCATCA CCGGAAACAA GGTAATGCCT AATGGTTGCG TCTTTGTTGG 150
TGCTCTCATT CATCCACGAC ATTTTGTACC AGGGCGACGC CTTTAAACTC 200
AATGTCATCG ATGAACTAAC GGACGCATCC ATGCTGAAGY CGACTTCCAT 250
CGTAAGTCTC GCTGTATTGC TCCTTGAGCC ATTTCATTGA CTATAACTAC 300
AACCAGCACT GGCATGGATT CTTCCAAAAG GGTACTAATT GGGCAGATGG 350
TCCCGCTTTT GTGAACCAAT GCCCCATCAC CACGGGAAAC TCCTTCTTGT 400
ACGACTTCCA GGTTCCTGAT CAAGCTGGTA AGCATGAGAT TACACTAGGA 450
AAGTTTAATT TAATAACTAT TCAATCAGGA ACCTACTGGT ATCATAGTCA 500
TTTGTCTACG CAATACTGTG ATGGTCTCAG AGGTGCATTC GTTGTCTACG 550
ACCCTTCAGA TCCTCACAAG GATCTCTACG ACGTCGACGA CGGTGAGCTT 600
TGCTTTTTTC ATTGGTATCC ATTATCGCTC ACGTGTCATT ACTGCGCCAC 650
AGAAAGTACC GTCATCACTT TGGCTGATTG GTATCATACT TTGGCTCGTC 700
AGATTGTTGG CGTTGCGTGA GTAGTCTTGT ACCGACTGAA ACATATTCCA 750
GTTGCTGACT TCCCCACAGC ATTTCTGATA CTACCTTGAT AAACGGTTTG 800
GGCCGCAATA CCAATGGTCC GGCTGATGCT GCTCTTGCTG TGATCAATGT 850
TGACGCTGGC AAACGGTGTG TCCAGATTAC TATACTCCCC ATGACGTCTC 900
AATGCTGATG TGTACTACTT CCAGGTACCG TTTCCGTCTT GTTTCCATAT 950
CCTGTGACCC CAATTGGGTA TTCTCGATTG ACAACCATGA CTTTACGGTC 1000
ATTGAAGTCG ATGGTGTTAA CAGTCAACCT CTCAACGTCG ATTCTGTTCA 1050
GATCTTCGCC GGACAACGTT ACTCGTTCGT 1080
翻訳されたタンパク配列(配列番号12):
AIGPVADLHI TDDTIAPDGF SRPAVLAGGG FPGPLITGNK GDAFKLNVID 50
ELTDASMLKX TSIHWHGFFQ KGTNWADGPA FVNQCPITTG NSFLYDFQVP 100
DQAGTYWYHS HLSTQYCDGL RGAFVVYDPS DPHKDLYDVD DESTVITLAD 150
WYHTLARQIV GVAISDTTLI NGLGRNTNGP ADAALAVINV DAGKRYRFRL 200
VSISCDPNWV FSIDNHDFTV IEVDGVNSQP LNVDSVQIFA GQRYSF 246
G.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼD1遺伝子
ポリヌクレオチド配列(配列番号13):
GATTCTAATA GACCAGGCAT ACCAAGAGAT CTACAGGTTG ACAGACCATT 50
CTTCTAGGCG GCATTTATGC TGTAGCGTCA GAAATTATCT CTCCATTTGT 100
ATCCCACAGG TCCTGTAATA ACACGGAGAC AGTCCAAACT GGGATGCCTT 150
TTTTCTCAAC TATGGGCGCA CATAGTCTGG ACGATGGTAT ATAAGACGAT 200
GGTATGAGAC CCATGAAGTC AGAACACTTT TGCTCTCTGA CATTTCATGG 250
TTCACACTCT CGAGATGGGA TTGAACTCGG CTATTACATC GCTTGCTATC 300
TTAGCTCTGT CAGTCGGAAG CTATGCTGCA ATTGGGCCCG TGGCCGACAT 350
ACACATTGTC AACAAAGACC TTGCTCCAGA TGGCGTACAA CGTCCAACCG 400
TGCTTGCCGG AGGCACTTTT CCTGGGACGT TGATCACCGG TCAGAAAGTA 450
AGGGATATTA GTTTGCGTCA AAGAGCCAAC CAAAACTAAC CGTCCCGTAC 500
TATAGGGTGA CAACTTCCAG CTCAATGTCA TCGATGATCT TACCGACGAT 550
CGGATGTTGA CGCCAACTTC CATTGTGAGC CTATTATTGT ATGATTTATC 600
CGAATAGTTT CGCAGTCTGA TCATTGGATC TCTATCGCTA GCATTGGCAC 650
GGTTTCTTCC AGAAGGGAAC CGCTTGGGCC GACGGTCCCG CCTTCGTAAC 700
TCAGTGCCCT ATAATAGCAG ATAACTCTTT TCTGTATGAC TTCGACGTCC 750
CAGACCAAGC TGGTACTTTC TGGTATCATA GTCATCTATC CACTCAGTAC 800
TGTGACGGTT TACGTGGTGC CTTCGTTGTG TACGATCCTA ACGATCCTCA 850
CAAAGACCTA TACGATGTTG ATGACGGTGG GTTCCAAATA TTTGTTCTGC 900
AGACATTGTA TTGACGGTGT TCATTATAAT TTCAGAGAGC ACCGTGATTA 950
CCCTTGCGGA TTGGTACCAT GTTCTCGCCC AGACCGTTGT CGGCGCTGCG 1000
TGAGTAACAC ATACACGCGC TCCGGCACAC TGATACTAAT TTTTTTTTAT 1050
TGTAGCACTC CTGATTCTAC CTTGATCAAC GGGTTAGGCC GTTCACAGAC 1100
CGGACCCGCT GATGCTGAGC TGGCTGTTAT CAGCGTTGAA CATAACAAAC 1150
GGTATGTCAT CTCTACCCAG TATCTTCTCT CCTGCTCTAA TTCGCTGTTT 1200
CACCATAGAT ACCGTTTCCG TTTGGTTTCG ATTTCGTGCG ACCCCAACTT 1250
TACCTTCTCC GTTGATGGTC ATAATATGAC TGTCATCGAA GTCGATGGTG 1300
TCAACACACG ACCCCTGACC GTTGACTCTA TTCAAATCTT CGCCGGACAG 1350
AGGTATTCCT TTGTCGTAAG TTAATCGATA TATTCTCCTT ATTACCCCTG 1400
TGTAATTGAT GTCAATAGCT CAATGCTAAC CAACCCGAAG ACAATTACTG 1450
GATCCGTGCT ATGCCAAACA TCGGTAGAAA TACAACAACA CTGGACGGAA 1500
AGAATGCCGC TATCCTTCGA TACAAGAATG CTTCTGTAGA AGAGCCCAAG 1550
ACCGTTGGGG GCCCCGCTCA ATCCCCGTTG AATGAAGCGG ACCTGCGTCC 1600
ACTCGTACCT GCTCCTGTGG TATGTCTTGT CGCGCTGTTC CATCGCTATT 1650
TCATATTAAC GTTTTGTTTT TGTCAAGCCT GGAAACGCTG TTCCAGGTGG 1700
CGCAGACATC AATCACAGGC TTAACTTAAC TTTCGTACGT ACACCTGGTT 1750
GAAACATTAT ATTTCCAGTC TAACCTCTCT TGTAGAGTAA CGGCCTCTTC 1800
AGCATCAACA ACGCCTCCTT CACTAATCCT TCGGTCCCCG CCTTATTACA 1850
AATTCTGAGC GGTGCTCAGA ACGCTCAAGA TTTACTTCCA ACGGGTAGTT 1900
ACATTGGCCT TGAACTAGGC AAGGTTGTGG AGCTCGTTAT ACCTCCTCTG 1950
GCAGTTGGAG GACCGCACCC TTTCCATCTT CATGGCGTAA GCATACCACA 2000
CTCCCGCAGC CAGAATGACG CAAACTAATC ATGATATGCA GCACAATTTC 2050
TGGGTCGTCC GTAGTGCAGG TAGCGATGAG TATAACTTTG ACGATGCTAT 2100
CCTCAGGGAC GTCGTRAGCA TTGGAGCGGG GACTGATGAA GTCACAATCC 2150
GTTTCGTGGT ATGTCTCACC CCTCGCATTT TGAGACGCAA GAGCTGATAT 2200
ATTTTAACAT AGACCGACAA TCCGGGCCCG TGGTTCCTCC ATTGCCATAT 2250
TGATTGGCAT TTGGAGGCAG GCCTTGCCAT CGTCTTCGCT GAGGGCATCA 2300
ATCAGACCGC TGCAGCCAAC CCAACACCCC GTACGTGACA CTGAGGGTTT 2350
CTTTATAGTG CTGGATTACT GAATCGAGAT TTCTCCACAG AAGCATGGGA 2400
TGAGCTTTGC CCCAAATATA ACGGGTTGAG TGCGAGCCAG AAGGTCAAGC 2450
CTAAGAAAGG AACTGCTATT TAAACGTGGT CCTAGACTAC GGGCATATAA 2500
GTATTCGGGT AGCGCGTGTG AGCAATGTTC CGATACACGT AGATTCATCA 2550
CCGGACACGC TGGGACAATT TGTGTATAAT GGCTAGTAAC GTATCTGAGT 2600
TCTGGTGTGT AGTTCAAAGA GACAGCCCTT CCTGAGACAG CCCTTCCTGA 2650
GACAGCCCTT CCTGAGACGT GACCTCCGTA GTCTGCACAC GATACTYCTA 2700
AATACGTATG GCAAGATGAC AAAGAGGAGG ATGTGAGTTA CTACGAACAG 2750
AAATAGTGCC CGGCCTCGGA GAGATGTTCT TGAATATGGG ACTGGGACCA 2800
ACATCCGGA 2809
翻訳されたタンパク配列(配列番号14):
MGLNSAITSL AILALSVGSY AAIGPVADIH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPEDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
H.CBS115.075株に由来するセレナ(Cerrena)ラッカーゼD2遺伝子
ポリヌクレオチド配列(配列番号15):
GATCTGGACG ATGGTATATA AGACGATGGT ATGAGACCCA TGAAGTCTGA 50
ACACTTTTGC TCTCTGACAT TTCATGGTTC ATACTCTCGA GATGGGATTG 100
AACTCGGCTA TTACATCGCT TGCTATCTTA GCTCTGTCAG TCGGAAGCTA 150
TGCTGCAATT GGGCCCGTGG CCGACATACA CATTGTCAAC AAAGACCTTG 200
CTCCAGATGG TGTACAACGT CCAACCGTGC TCGCCGGAGG CACTTTTCCT 250
GGGACGTTGA TCACCGGTCA GAAAGTAAGG AATATTAGTT TGCGTCAAAG 300
AGCCAACCAA AATTAACCGT CCCGTCCCAT AGGGTGACAA CTTCCAGCTC 350
AATGTCATTG ATGATCTTAC CGACGATCGG ATGTTGACAC CAACTTCCAT 400
TGTGAGCCTA TTATTGTATG ATTTATCCGT ATAGTTTCTC AGTCTGATCA 450
TTGGCTCTCT ATCGCTAGCA TTGGCACGGT TTCTTCCAGA AGGGAACCGC 500
TTGGGCCGAC GGTCCCGCCT TCGTAACTCA GTGCCCTATA ATAGCAGATA 550
ACTCTTTTCT GTATGACTTC GACGTCCCCG ACCAAGCTGG TACTTTCTGG 600
TATCATAGTC ATCTATCCAC TCAGTACTGT GACGGTTTAC GTGGTGCCTT 650
CGTTGTGTAC GATCCTAACG ATCCTCACAA AGACCTATAC GATGTTGATG 700
ACGGTGGGTT CCAAATACTT GACCAAGAAA CATTATATTG ATAGTATCCA 750
CTCTGATTTT CAGAGAGCAC CGTGATTACC CTTGCGGATT GGTACCATGT 800
TCTCGCCCAG ACCGTTGTCG GCGCTGCGTG AGTAACACAT ACACGCGCTC 850
CGGCACACTG ATACTAATTT TTTATTGTAG CACTCCTGAT TCTACCTTGA 900
TCAACGGGTT AGGCCGTTCA CAGACCGGAC CCGCTGATGC TGAGCTGGCT 950
GTTATCAGCG TTGAACATAA CAAACGGTAT GTCATCTCTA CCCATTATCT 1000
TCTCTCCTGC TTTAATTCGC TGTTTCACCA TAGATACCGA TTCCGTTTGG 1050
TTTCGATTTC GTGCGACCCC AACTTTACCT TCTCCGTTGA TGGTCATAAT 1100
ATGACTGTCA TCGAAGTCGA CGGTGTCAAC ACACGACCCC TGACCGTTGA 1150
CTCTATTCAA ATCTTCGCCG GACAGAGGTA TTCCTTTGTC GTAAGTTAAT 1200
CGATATATTC TCCCTATTAC CCCTGTGTAA TTGATGTCAA CAGCTCAATG 1250
CTAACCAACC CGACGACAAT TACTGGATCC GTGCTATGCC AAACATCGGT 1300
AGAAATACAA CAACACTGGA CGGAAAGAAT GCCGCTATCC TTCGATACAA 1350
GAATGCTTCT GTAGAAGAGC CCAAGACCGT TGGGGGCCCC GCTCAATCCC 1400
CGTTGAATGA AGCGGACCTG CGTCCACTCG TACCTGCTCC TGTGGTATGT 1450
CTTGTCGTGC TGTTCCATCG CTATTTCATA TTAACGTTTT GTTTTTGTCA 1500
AGCCTGGAAA CGCTGTTCCA GGTGGCGCAG ACATCAATCA CAGGCTTAAC 1550
TTAACTTTCG TACGTACACC TGGTTGAAAC ATTATATTTC CAGTCTAACC 1600
TCTTGTAGAG TAACGGCCTT TTCAGCATCA ACAACGCCTC CTTCACTAAT 1650
CCTTCGGTCC CCGCCTTATT ACAAATTCTG AGCGGTGCTC AGAACGCTCA 1700
AGATTTACTT CCAACGGGTA GTTACATTGG CCTTGAACTA GGCAAGGTTG 1750
TGGAGCTCGT TATACCTCCT CTGGCAGTTG GAGGACCGCA CCCTTTCCAT 1800
CTTCATGGCG TAAGCATACC ACACTCCCGC AGCCAGAATG ACGCAAACTA 1850
ATCATGATAT GCAGCACAAT TTCTGGGTCG TCCGTAGTGC AGGTAGCGAT 1900
GAGTATAACT TTGACGATGC TATCCTCAGG GACGTCGTGA GCATTGGAGC 1950
GGGGACTGAT GAAGTCACAA TCCGTTTCGT GGTATGTCTC ACCCCTCGCA 2000
TTTTGAGACG CAAGAGCTGA TATATTTTAA CATAGACCGA CAATCCGGGC 2050
CCGTGGTTCC TCCATTGCCA TATTGATTGG CATTTGGAGG CAGGCCTTGC 2100
CATCGTCTTC GCTGAGGGCA TCAATCAGAC CGCTGCAGCC AACCCAACAC 2150
CCCGTACGTG ACACTGAGGG TTTCTTTATA GTGCTGGATT ACTGAATCGA 2200
GATTTCTCCA CAGAAGCATG GGATGAGCTT TGCCCCAAAT ATAACGGGTT 2250
GAGTGCGAGC CAGAAGGTCA AGCCTAAGAA AGGAACTGCT ATTTAAACG 2299
翻訳されたタンパク配列(配列番号16):
MGLNSAITSL AILALSVGSY AAIGPVADIH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPDDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
I.CBS154.29株に由来するセレナ(Cerrena)ラッカーゼE遺伝子(一部)
ポリヌクレオチド配列(配列番号17):
TGCAATCGGA CCGGTGGCCG ACCTCAAGAT CGTAAACCGA GACATTGCAC 50
CTGACGGTTT TATTCGTCCC GCCGTTCTCG CTGGAGGGTC GTTCCCTGGT 100
CCTCTCATTA CAGGGCAGAA AGTACGTTAC GCTATCTCGG TGCTTTGGCT 150
TAATTAAACT ATTTGACTTT GTGTTCTCTT AGGGGAACGA GTTCAAAATC 200
AATGTAGTCA ATCAACTGAC CGATGGTTCT ATGTTAAAAT CCACCTCAAT 250
CGTAAGCAGA ATGAGCCCTT TGCATCTCGT TTTATTGTTA ATGCGCCCAC 300
TATAGCATTG GCATGGATTC TTCCAGAAGG GAACAAACTG GGCAGACGGT 350
CCTGCGTTCG TGAACCAATG TCCAATCGCC ACGAACAATT CGTTCTTGTA 400
TCAGTTTACC TCACAGGAAC AGCCAGGTGA GTATGAGATG GAGTTCATCC 450
GAGCATGAAC TGATTTATTT GGAACCTAGG CACATTTTGG TACCATAGTC 500
ATCTTTCCAC ACAATACTGC GATGGTTTGC GAGGGCCACT CGTGGTGTAT 550
GACCCACAAG ACCCGCATGC TGTTCTCTAC GACGTCGACG ATGGTTCGTA 600
CTTCGCATAT CCACGCTCGC TTTCATACAA TGTAAACTTT GTTCCTCCAG 650
AAAGTACAAT CATCACGCTC GCGGATTGGT ATCATACCTT GGCTCGGCAA 700
GTGAAAGGCC CAGCGTAAGG CACTTTAGTG TTTCCTCATA GTCCAAGAAA 750
TTCTAACACG CCTTCTTCAT CAGGGTTCCT GGTACGACCT TGATCAACGG 800
GTTGGGGCGT CACAACAATG GTCCTCTAGA TGCTGAACTA GCGGTGATCA 850
GTGTTCAAGC CGGCAAACGG CAAGTTCAAT TCACACTTTT CACTCTGTAC 900
CTTCTTCCTG ACATTCTTTT CTTGTAGTTA CCGCTTCCGC CTGATTTCAA 950
TTTCATGCGA TCCCAACTAC GTATTCTCCA TTGATGGCCA TGATATGACT 1000
GTCATCGAAG TGGATAGTGT TAACAGTCAA CCTCTCAAGG TAGATTCTAT 1050
CCAAATATTT GCAGGTCAGA GATATTCGTT CGTGGTGAGT CAGATCAGGG 1100
CATATCCTTT TGTCGATACG TCATTGACCA TATAATGCTA CAAGCTGAAT 1150
GCCAACCAAC CAG 1163
翻訳されたタンパク配列(配列番号18):
AIGPVADLKI VNRDIAPDGF IRPAVLAGGS FPGPLITGQK GNEFKINVVN 50
QLTDGSMLKS TSIHWHGFFQ KGTNWADGPA FVNQCPIATN NSFLYQFTSQ 100
EQPGTFWYHS HLSTQYCDGL RGPLVVYDPQ DPHAVLYDVD DESTIITLAD 150
WYHTLARQVK GPAVPGTTLI NGLGRHNNGP LDAELAVISV QAGKRQVQFT 200
LFTLYRFRLI SISCDPNYVF SIDGHDMTVI EVDSVNSQPL KVDSIQIFAG 250
QRYSFVLNAN QP 262
以下のアミノ酸配列(配列番号19:シグナル配列はイタリック体)を有するラッカーゼD酵素は、本明細書に記載されている方法において使用可能である。
MGLNSAITSL AILALSVGSY AAIGPVADLH IVNKDLAPDG VQRPTVLAGG 50
TFPGTLITGQ KGDNFQLNVI DDLTDDRMLT PTSIHWHGFF QKGTAWADGP 100
AFVTQCPIIA DNSFLYDFDV PDQAGTFWYH SHLSTQYCDG LRGAFVVYDP 150
NDPHKDLYDV DDGGTVITLA DWYHVLAQTV VGAATPDSTL INGLGRSQTG 200
PADAELAVIS VEHNKRYRFR LVSISCDPNF TFSVDGHNMT VIEVDGVNTR 250
PLTVDSIQIF AGQRYSFVLN ANQPEDNYWI RAMPNIGRNT TTLDGKNAAI 300
LRYKNASVEE PKTVGGPAQS PLNEADLRPL VPAPVPGNAV PGGADINHRL 350
NLTFSNGLFS INNASFTNPS VPALLQILSG AQNAQDLLPT GSYIGLELGK 400
VVELVIPPLA VGGPHPFHLH GHNFWVVRSA GSDEYNFDDA ILRDVVSIGA 450
GTDEVTIRFV TDNPGPWFLH CHIDWHLEAG LAIVFAEGIN QTAAANPTPQ 500
AWDELCPKYN GLSASQKVKP KKGTAI 526
このポリペプチドの処理された成熟形態は、以下のとおりである(配列番号20)。
AIGPVADLHIVNKDLAPDGVQRPTVLAGGTFPGTLITGQKGDNFQLNVIDDLTDDRMLTPTSIHWHGFFQKGTAWADGPAFVTQCPIIADNSFLYDFDVPDQAGTFWYHSHLSTQYCDGLRGAFVVYDPNDPHKDLYDVDDGGTVITLADWYHVLAQTVVGAATPDSTLINGLGRSQTGPADAELAVISVEHNKRYRFRLVSISCDPNFTFSVDGHNMTVIEVDGVNTRPLTVDSIQIFAGQRYSFVLNANQPEDNYWIRAMPNIGRNTTTLDGKNAAILRYKNASVEEPKTVGGPAQSPLNEADLRPLVPAPVPGNAVPGGADINHRLNLTFSNGLFSINNASFTNPSVPALLQILSGAQNAQDLLPTGSYIGLELGKVVELVIPPLAVGGPHPFHLHGHNFWVVRSAGSDEYNFDDAILRDVVSIGAGTDEVTIRFVTDNPGPWFLHCHIDWHLEAGLAIVFAEGINQTAAANPTPQAWDELCPKYNGLSASQKVKPKKGTAI
【0082】
いくつかの実施形態において、本発明の組成物及び方法において使用するのに適したラッカーゼ酵素は、細胞からの完全長ポリペプチドの分泌を導くために使用することができるシグナル配列を欠く成熟ポリペプチドである。適切な成熟ポリペプチドは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19、及び、配列番号20からなる群より選択されるアミノ酸配列に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超えるアミノ酸配列同一性を有していてもよい。本明細書に記載されている分析及び手順を使用して決定したときに、そのようなポリペプチドが、酵素的ラッカーゼ活性を有することが好ましい。
【0083】
いくつかの実施形態において、本発明の組成物及び方法において使用するのに適したラッカーゼ酵素は、完全長の又は成熟した親/基準配列に比べると切断されたものである。そのような切断されたペプチドは、完全長の又は成熟したポリペプチド配列のタンパク分解によって、又は、切断されたペプチドをコードするようにポリヌクレオチドを設計することによって生成され得る。典型的なポリペプチドは、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列と比較して、アミノ及び/又はカルボキシル末端において切断されたものである。切断部分は、少数(例えば、1個、2個、3個、4個、5個、6個、7個、8個、9個又は10個)のアミノ酸残基であってもよいし、又は、構造ドメイン又は機能ドメインの全体であってもよい。適切な切断されたペプチドは、上記参照アミノ酸配列の1つ又はそれ以上の対応部分に対して、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、若しくは、少なくとも99%、又は、それを超えるアミノ酸配列の同一性を有していてもよい。好ましくは、本明細書に記載されている分析及び手順を使用して決定されるように、そのようなポリペプチドは、酵素的ラッカーゼ活性を有する。
【0084】
伝達物質
いくつかの実施形態において、酵素的酸化の系、組成物及び方法は、ラッカーゼ酵素の活性を増強する化学伝達物質剤の1つ又はそれ以上をさらに含む。伝達物質(エンハンサ又はアクセラレータとも呼ばれる)は、酸化酵素活性を示す酵素と、染料、色素(例えば藍)、発色基(例えば、色のついた汚れの中の、例えば、ポリフェノール、アントシアニン又はカロチノイド)、又は、他の第2基質若しくは電子供与体と間で有効に電子を輸送するための酸化還元伝達物質として作用する化学物質である。
【0085】
いくつかの実施形態において、化学伝達物質は、例えば、PCT出願WO95/01426及びWO96/12845に記載されているように、フェノール化合物、例えば、シリンガ酸メチル、又は、関連化合物である。伝達物質は、例えば、N−ヒドロキシベンゾトリアゾール、ビオルル酸、N−ヒドロキシアセトアニリドのようなN−ヒドロキシ化合物、N−オキシム化合物又はN−オキシド化合物であってもよい。伝達物質は、例えば、フェノチアジン−10−プロピオネートのようなフェノキサジン/フェノチアジン化合物でもあってもよい。伝達物質は、2,2’−アジノビス−(3−エチルベンゾチアゾリン−6−スルホン酸でもあり得る。他の化学伝達物質は、例えば、PCT出願WO95/01426に開示されている化合物(この化合物は、ラッカーゼ活性を増大させることがわかっている)のように、当業界において周知である。伝達物質は、アセトシリンゴン、シリンガ酸メチル、シリンガ酸エチル、シリンガ酸プロピル、シリンガ酸ブチル、シリンガ酸ヘキシル又はシリンガ酸オクチルであってもよい。
【0086】
いくつかの実施形態において、伝達物質は、例えば、4−(N−メチルカルボキシアミド)−2,6−ジメトキシフェノール、4−[N−(2−ヒドロキシエチル)カルボキシアミド]−2,6−ジメトキシフェノール)、又は、4−(N,N−ジメチルカルボキシアミド)−2,6−ジメトキシフェノールのような、4−シアノ−2,6−ジメトキシフェノール、4−カルボキシアミド−2,6−ジメトキシフェノール、又は、これらのN置換誘導体である。
【0087】
いくつかの実施形態において、伝達物質は、下記式:

(ここで、Aは、−R、−D、−CH=CH−D、−CH=CH−CH=CH−D、−CH=N−D、−N=N−D、又は、−N=CH−Dなどの基であり、Dは、−CO−E、−SO2−E、−CN、−NXY、及び、−N+XYZからなる群より選択され、Eは、−H、−OH、−R、−OR、又は、−NXYであり、X、Y及びZは、−H、−OH、−OR及び−Rから独立して選択され;Rは、C1−C16アルキル、好ましくはC1−C8アルキルであり、該アルキルは、飽和又は不飽和のいずれであってもよく、分岐又は非分岐のいずれであってもよく、また、選択的にカルボキシ基、スルフォ基又はアミノ基で置換されていてもよく;B及びCは、CmH2m+1(1≦m≦5)から独立して選択される)によって表される。
【0088】
いくつかの実施形態において、上記式中のAは、−CN又は−CO−Eであり、ここで、Eは、−H、−OH、−R、−OR、又は、−NXYであり、X及びYは、−H、−OH、−OR及び−Rから独立して選択され、Rは、C1−C16アルキル、好ましくはC1−C8アルキルであり、該アルキルは、飽和又は不飽和のいずれであってもよく、分岐又は非分岐のいずれであってもよく、また、選択的にカルボキシ基、スルフォ基又はアミノ基で置換されていてもよく;B及びCは、CmH2m+1(1≦m≦5)から独立して選択される。いくつかの実施形態において、伝達物質は、4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(「シリンゴニトリル」又は「SN」とも呼ばれる)である。
【0089】
上記式において、Aは、示されているようにパラ位に位置するのに代えて、水酸基に対してメタに位置してもよいことに留意されたい。
【0090】
繊維処理のような用途のために、伝達物質は、デニム1グラム当たり約0.005μモル乃至約1000μモル、デニム1グラム当たり約0.05μモル乃至約500μモル、デニム1グラム当たり約0.1μモル乃至約100μモル、デニム1グラム当たり約1μモル乃至約50μモル、又は、デニム1グラム当たり約2μモル乃至約20μモルの濃度で存在していてもよい。
【0091】
伝達物質は、PCT出願WO97/11217及びWO96/12845並びに米国特許第5,752,980号に開示されているような当業者に知られている方法によって調製することができる。他の適切な伝達物質は、例えば、米国特許公開公報第2008/0189871号に記載されている。
【0092】
使用の方法
本発明の系及び組成物は、酵素的ラッカーゼ活性が有用であるか又は望ましい用途において使用することができる。これらの中でも、用途/方法は、基材の色変性であり、その基材は、繊維に関連するものであってもよい。いくつかの実施形態において、そのような方法は、例えば約40℃以下のような低温において適切な基質と共にラッカーゼ酵素をインキュベートするステップを含む。いくつかの実施形態において、温度は、約20℃と約40℃との間である。いくつかの実施形態において、温度は、約20℃と約35℃との間である。いくつかの実施形態において、温度は、約20℃、約25℃、約30℃又は約35℃である。いくつかの実施形態において、温度は、例えば、約20℃乃至約23℃のような、水道水の外界温度である。温度は、狭い範囲内に維持されてもよいし、又は、系及び組成物の性能に著しく影響することなく変動するようにしてもよい。
【0093】
この方法は、本明細書に記載されている1つ又はそれ以上のラッカーゼの使用を意図する。いくつかの実施形態において、ラッカーゼは、C.ユニカラーのようなセレナ(Cerrena)種に由来する。いくつかの実施形態において、ラッカーゼは、本明細書に記載されているC.ユニカラーラッカーゼ酵素のいずれかのアミノ酸配列、又は、本明細書に記載されているC.ユニカラーラッカーゼ酵素のいずれかに対して、少なくとも約35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は、99.5%もの同一性を有し、かつ、ラッカーゼ酵素活性を有するアミノ酸配列を含むか、それらのアミノ酸配列からなるか、又は、それらのアミノ酸配列から本質的になる。
【0094】
いくつかの実施形態において、例えば、この系及び方法は、例えば、線維、毛糸、生地、又は、完成品の衣服を含む繊維製品の色を変化させるための方法のような、繊維処理方法において使用される。一般に、この方法は、例えば、色の変化、着色の変化、脱色、漂白、退色、及び/又は、再沈着/裏面染色の低減から選択される少なくとも1つ(すなわち、1つ又はそれ以上)の測定可能な効果をもたらすのに充分な時間及び条件下において、繊維をラッカーゼ及び伝達物質に接触させるステップを含む。いくつかの実施形態において、この方法は、染色されたデニム製品に「ヴィンテージ外観」を与えるために使用される。藍染めされたデニムの場合において、ヴィンテージ外観は、新たに染めたデニムより弱い青色/紫色の色調、及び、新たに染めたデニムより抑制された灰色の外観を有する。硫黄染めされたデニムの場合において、ヴィンテージ外観は、次亜塩素酸塩処理によって生じ得る茶色の色合いを伴わずに、色が退色している。従って、ラッカーゼを用いて得られる色変性の態様を「漂白」作用として特徴付けることができるが、この言葉は、ラッカーゼの使用によって可能な色変性を完全に表すものではない。
【0095】
色変性のために提供される繊維は、セルロース繊維であってもよいし、又は、セルロース繊維と合成繊維との混合物であってもよい。いくつかの実施形態において、繊維は、藍及び/又は硫黄をベースとした染料で染色されたデニムである。特定の実施形態において、繊維は、藍で染色され、また、ラッカーゼ酵素及び伝達物質は、藍をイサチンに酸化させるために使用される。デニムを、ラッカーゼ酵素による色変性の前に、選択的に糊抜き及び/又はストーンウォッシュすることができる。
【0096】
一般に、繊維処理方法において同じ程度の摩耗を与えると仮定すると、デニムの強度は、より低い温度と比較して、より高温度においてさらに低下する。本発明の方法は、従来の方法と比較してより低い温度において実施可能であるので、従来の方法と比較して、処理中の繊維に対するダメージを軽減するという長所を有する。さらに、ラッカーゼ酵素は、一般に、処理中にセルロース織物繊維との反応によってその強度を低下させることがない。従って、いくつかの実施形態において、本発明の方法は、従来の方法と比較してデニムの物理的強度に影響せず、また、従来の方法と比較して物理的強度の低下が小さい。デニムが伸張デニム(例えばエラステーン、スパンデックス)で構成されている場合、本発明の方法は、従来の方法と比較して生地の伸張性能に影響せず、また、伸張性能の低下を小さくする。
【0097】
いくつかの実施形態において、ラッカーゼは、少なくとも1つの他の酵素と組み合わされて繊維処理方法において使用される。そのような処理を同時に行う場合は、本明細書に記載されているような低温において酵素処理を実行することができる。その処理が連続的である場合には、本明細書に記載されているような低温においてラッカーゼを使用することができ、また、選択的に低温において他の酵素も使用することができる。いくつかの実施形態において、ラッカーゼは、セルラーゼ酵素と組み合わされて同時に又は連続して使用される。一実施形態においては、繊維を、ラッカーゼ及びセルラーゼと同時に接触させる。他の一実施形態においては、繊維を、ラッカーゼ及びセルラーゼと連続的に接触させる。一実施形態において、繊維を、まず、「ストーンウォッシュ」を達成するためにセルラーゼに接触させ、次に、色変性に影響を与えるためにラッカーゼに接触させる。他の一実施形態においては、繊維を、まずラッカーゼに、その後にセルラーゼに接触させる。セルラーゼ処理とラッカーゼ処理とが連続する場合には、2つの処理ステップを同じ槽内において、かつ、2つの処理の間に槽を排水することなく実行することができる。そのような方法を「単一槽」方法と呼ぶ。
【0098】
適切なセルラーゼは、例えば、フミコラ(Humicola)、サーモミセス(Thermomyces)、バチルス(Bacillus)、トリコデルマ(Trichoderma)、フザリウム(Fusarium)、ミセリオフトラ(Myceliophthora)、ファネロカエテ(Phanerochaete)、イルペックス(Irpex)、スキタリジウム(Scytalidium)、シゾフィラム(Schizophyllum)、ペニシリウム(Penicillium)、アスペルギルス(Aspergillus)、又は、ジオトリクム(Geotricum)の種のような、セルロース分解酵素を生産できることが知られた微生物に由来するものであってもよい。セルロース分解酵素の生産に有能な既知の種は、フミコラインソレンズ(Humicola insolens)、フザリウムオキシスポルム(Fusarium oxysporum)、又は、トリコデルマリーゼイ(Trichoderma reesei)を含む。適切なセルラーゼの非限定的な例は、米国特許第4,435,307号;欧州特許出願第0495257号;PCT特許出願番号WO91/17244;及び、欧州特許出願番号EP−A2−271004に開示されており、これらのすべてはここで言及することによって組み込まれている。
【0099】
いくつかの実施形態において、セルラーゼを使用した酵素的な「ストーンウォッシュ」、アリルエステラーゼを使用した漂白、及び、ラッカーゼを使用した色修飾は、包括的な酵素繊維処理系を提供するために、組み合わされてもよい。そのような系は、繊維処理装置によって、従来の繊維処理化学物質を使用する必要性を伴わずに、様々な仕上げ加工を有する繊維を生産することを可能にする。
【0100】
ラッカーゼは、処理の態様、処理、仕上げ、研磨、又は、線維の生産などを一般に含む繊維製造の他の態様において使用することもできる。染色されたデニムの色を変性することに加えて、染色された廃棄物(藍染めされた廃棄物を含む)の脱色において、生地染色において、汚れを繊維漂白において、線維変性において;改良された線維又は生地の特性などの実現において、ラッカーゼを使用することもできる。
【0101】
さらなる実施形態においては、本発明の系及び組成物を、羊毛の色を変化させる方法において使用することもできる。例えば、欧州特許番号EP0504005は、羊毛を染色するためにラッカーゼを使用することができることを開示する。ラッカーゼは、皮革工業においても使用することができる。例えば、ラッカーゼは、以下に限定されないが、皮の脱毛、石灰処理、酵解、及び/又は、なめし革法を含む動物皮の処理において使用することができる。
【0102】
本発明の系及び組成物は、パルプ又は紙製作品の色を変性する方法において使用することもできる。そのような方法は、色変性を必要とするパルプ又は紙の製品を、本明細書に記載されているようなラッカーゼに、色変性が生じるのに充分な時間及び条件下において接触させるステップを含む。特定の実施形態において、色変性が漂白である。
【0103】
本発明の系及び組成物は、毛髪の色を変性するための方法において使用することもできる。ラッカーゼは、毛髪染色剤に有用であると報告されている(例えば、WO95/33836、WO95/33837参照)。そのような方法は、変性しようとする色を有する毛髪を、毛髪の色を変化させるのに適した時間及び条件下において、ラッカーゼに接触させるステップを含む。
【0104】
本発明の系及び組成物を廃水処理の分野において使用することもできる。例えば、ラッカーゼは、有色化合物の脱色において、フェノール成分の解毒において、抗微生物活性のために(例えば、水リサイクルにおいて)、バイオレメディエーションなどにおいて使用可能である。
【0105】
本発明の系及び組成物は、高分子量の凝集体の解重合、廃紙の脱インキ、芳香族化合物の重合、ラジカルによって媒介される重合及び架橋反応(例えば、ペイント、コーティング、生体材料)、染料の活性化、並びに、有機化合物の連結においても使用可能である。
【0106】
本発明の系及び組成物は、洗浄組成物若しくはその成分として、又は、洗浄方法における使用のための洗剤としても使用可能である。例えば、ラッカーゼは、衣類又は生地のような洗濯物の洗浄、処理又は手入れにおいて、家庭用の硬表面の洗浄において;食器洗機用途を含む皿の手入れにおいて;並びに、石鹸の固体及び液体、並びに/又は、合成界面活性剤の棒及び液体として使用可能である。本明細書に示されている酵素は、例えば、汚れの除去/脱色において、及び/又は、匂いの除去、及び/又は、浄化などに有用であり得る。ラッカーゼ伝達物質は、ラッカーゼ酵素と別に又はラッカーゼ酵素と共に、浄化剤及び抗生剤(例えば、木材保護、洗剤)として使用することができる。
【0107】
ラッカーゼは、パーソナルケア分野の他の態様において使用することができる。例えば、ラッカーゼは、香水のような人間のための身体用製品、並びに、人間のためのスキンケア、毛髪ケア、口腔ケア、身体の洗浄及び防臭及び/又は制汗剤のための製品の調製において使用することができる。ラッカーゼは、例えば、毛髪の染色及び/又は脱色、爪の染色及び/又は漂白において;皮膚の染色及び/又は漂白;表面改質(例えばカップリング試薬として);抗生剤として;臭気除去において;歯の白色化など;に有用であり得る。ラッカーゼは、コンタクトレンズ洗浄の分野において使用可能である。ラッカーゼは、例えば、コンタクトレンズの洗浄、保管、殺菌及び/又は保存において使用可能である。
【0108】
ラッカーゼは、バイオ材料の分野において使用可能である。例えば、ラッカーゼは、様々な有機反応のための生体触媒として;及び/又は、生体高分子に関連して;パッケージングに関連して;接着剤に関連して;表面改質(活性化及びカップリング剤)において;第一級アルコールの生産において;バイオセンサー及び/又は有機合成に関連して;使用することができる。ラッカーゼは、酸素を電子受容体として使用して、種々の化学構造を有する多様な有色化合物を酸化することができる。
【0109】
本発明の系及び組成物は、リグノセルロース含有材料からのリグニンの除去(例えば、パルプの脱リグニン)、リグノセルロース含有材料の漂白(すなわち、再生紙の酵素による脱インキ)、及び/又は、紙若しくはセルロースの製造から発生する廃水の処理に使用することもできる。このようなプロセスは、フェノール芳香族酸化還元化合物及び/又は非フェノール芳香族酸化還元化合物に加えて、非芳香族酸化還元剤を添加又は計量供給することに組み合わせて、ラッカーゼ酵素を使用することができ、リグニンのフェノール単位及び非フェノール単位は、これらのフェノール芳香族化合物及び/又は非フェノール芳香族化合物の作用によって直接的に酸化され、又は、リグニンは、これらの化合物の酸化作用によって生産された他のフェノール類及び/又は非フェノール類によって酸化される。
【0110】
ラッカーゼは、パルプ及び紙に関係する他の態様において使用することができる。例えば、ラッカーゼは、木材、竹及び穀物の稲わらのような原料からの紙パルプ及び毛羽パルプの製造;印刷及び筆記のための紙及びボードの製造、パッキング、衛生用途及び他の技術的用途;紙及びボードを作成する目的のためのアセテート繊維のリサイクル;パルプ若しくは紙の工場、並びに、紙、パルプ若しくは毛羽の製造に特に専念する他の設備によって生じて処理される廃棄物の処理において使用することができる。ラッカーゼは、例えば、木材処理において;パルプ漂白において;木材線維変性において;MDF製作のためのバイオ接着剤(リグニン活性剤)において;紙特性を改良するために;インク除去において;紙の染色において;接着剤(例えば、削片板又は繊維板のためのリグニンをベースとした接着剤)などにおいて;有用であり得る。
【0111】
ラッカーゼは、飼料の分野において使用することができる。例えば、ラッカーゼは、ニワトリ、ウシ、ブタ、魚及びペットのようなあらゆる種類の動物用飼料の栄養的価値を高めるために飼料添加物として単独で又は飼料添加物の一部として;及び/又は、飼料原料として適切な材料/製品を生産するために植物性材料及び食品工業副産物を加工するための加工助剤として、使用することができる。
【0112】
ラッカーゼは、デンプン処理の分野において使用することができる。例えば、ラッカーゼは、デンプン及び/又は穀類を含む基質を、グルコース(デキストロース)シロップ、フルクトースシロップ若しくは他のシロップ、アルコール(飲料又は燃料)又は糖に加工する際に使用することができる。そのようなデンプン処理は、基質の液化、糖化、異性化及び脱分岐のような処理ステップを含んでいてもよい。
【0113】
ラッカーゼは、食品の分野において使用することができる。ラッカーゼは、例えば、その調製、処理において、又は、人間消費のための、黄色脂肪、お茶をベースとした飲料、調理用製品、パン及び冷凍食品のような食品中の有効成分として使用することができる。ラッカーゼは、例えば、パン改良剤として、食品保存において、脱酸素剤などとして使用することができる。ラッカーゼは、種々の食品(例えば、肉)又は飼料の微生物的負荷の軽減又は除去のために使用することができる。
【0114】
本明細書に記載されているラッカーゼのための方法又は使用のあらゆるものは、低温、例えば、約40℃未満の温度、例えば、約40℃未満、約37℃未満、約35℃未満、約32℃未満、約30℃未満、約27℃未満、約25℃未満、約22℃未満において実施することができる。典型的な温度範囲は、約20℃以上約40℃未満である。典型的な温度は、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃又は35℃である。いくつかの実施形態において、温度は、室温又は水道水の外界温度、例えば、約20℃乃至約23℃である。
【0115】
本明細書に記載されているラッカーゼのための方法又は使用のあらゆるものは、本明細書に記載されているラッカーゼ酵素のいずれか、例えば、セレナユニカラー(Cerrena unicolor)に由来するラッカーゼを使用して実施することができる。いくつかの実施形態において、ラッカーゼは、約0.005mg/リットル乃至約5000mg/リットル、約0.05mg/リットル乃至約500mg/リットル、約0.1mg/リットル乃至約100mg/リットル、又は、約0.5mg/リットル乃至約10mg/リットルの濃度で使用される。いくつかのデニム処理実施形態において、ラッカーゼは、デニム1kg当たり約0.005mg乃至約5000mg、デニム1kg当たり約0.05mg乃至約500mg、デニム1kg当たり約0.1mg乃至約100mg、又は、デニム1kg当たり約0.5mg乃至約10mgの濃度で使用される。いくつかの実施形態において、ラッカーゼは、約5乃至約7、約5.5乃至約6.5、約5乃至約6、又は、約6のpHにおいて使用される。典型的なpHは、おおよそ、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9及び7.0である。
【0116】
使用準備済の組成物及びキット
上述したように、本発明の組成物は、1つ又はそれ以上のラッカーゼを含み、さらに、選択的に1つ又はそれ以上の伝達物質を含む。いくつかの実施形態において、この組成物は、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19、配列番号20、又は、これらの変異体若しくは断片から選択されるアミノ酸配列を含む、該アミノ酸配列からなる、又は、該アミノ酸配列から本質的になるポリペプチドを含む。特定の実施形態において、この組成物は、配列番号19及び20又はこれらの変異体若しくは断片から選択されるアミノ酸配列を含む、該アミノ酸配列からなる、又は、該アミノ酸配列から本質的になるポリペプチドを含む。好ましくは、そのようなポリペプチドが酵素のラッカーゼ活性を有する。その活性は、本明細書に記載されている分析及び手順を使用して測定することができる。
【0117】
ラッカーゼ酵素及び伝達物質を含む、ラッカーゼ酵素及び伝達物質からなる、又は、ラッカーゼ酵素及び伝達物質から本質的になる「使用準備済」(RTU)組成物の形態でそのような組成物を提供することもできる。いくつかの実施形態において、伝達物質は、アセトシリンゴン、シリングアルデヒド、シリングアミド、メチルシリングアミド、2−ヒドロキシエチルシリングアミド、シリンガ酸メチル、シリンゴニトリル、ジメチルシリンガアミド、及び、シリンガ酸から選択される。一実施形態において、伝達物質は、シリンゴニトリル(4−ヒドロキシ−3,5−ジメトキシベンゾニトリル)である。このRTU組成物は、この組成物が溶液中に存在する場合には、pH緩衝を提供するための1つ又はそれ以上の化合物をさらに含んでいてもよい。例えば、いくつかの実施形態において、この組成物は、緩衝系としてモノナトリウムリン酸塩及びアジピン酸を含む。RTU組成物は、保存及び輸送の容易さのために、固体の顆粒形態であってもよい。その後、この組成物は、例えば、説明されているような使用のための水溶液を提供するために水で希釈される。RTU組成物は、分散剤、界面活性剤、遮断薬、ポリマー、及び、保存剤のような任意の数のさらなる試薬を含んでいてもよい。
【0118】
以下の実施例は、系、組成物及び方法を説明するために提供されるものであり、どのようにも限定的なものとして解釈してはならない。他の態様及び実施形態は、明細書を参照した当業者に明らかになるであろう。
【0119】
実施例
実施例において以下の酵素命名法を使用する。

実施例1−ストーンウォッシュされたデニムのラッカーゼによる色変性に対する温度の影響
【0120】
酵素
この試験においては、セレナユニカラーに由来する顆粒状のラッカーゼD酵素(38,000U/g)を使用した。1ラッカーゼ単位は、ラッカーゼ酵素がABTS(2,2’−アジノビス(3−エチルベンズチアゾリン−6−スルフォナート))をその対応する安定なカチオンラジカル、ABTS+に酸化する能力に基づいた分析の条件下において、1nmolのABTS基質を酸化するラッカーゼ活性の量として定義される。ラジカルの蓄積は、ABTSを濃緑色にし、また、420nmにおける吸収度を増大させる。色生成は、ラッカーゼ活性に比例しており、ラッカーゼ基準に対してモニターする。
伝達物質
【0121】
Punjab Chemicals & Crop Protection Limited(ムンバイ、インド)から4−ヒドロキシ−3,5−ジメトキシベンゾニトリル(シリンゴニトリル、SN)を購入した。
手順
【0122】
約3kg(合計)の重さの12本のデニムの脚を、Unimac UF50洗浄機内で以下の条件において糊抜きした。
・0.5g/l(15g)のOPTISIZE(登録商標)160アミラーゼ(15g)(Genencor)及び0.5g/lの非イオンの界面活性剤[例えば、Rucogen BFA(Rudolf Chemie)又はUltravon RW(Huntsman)]を用いた10:1の液比における50℃での15分間の糊抜き
・30:1の液比における5分間にわたる2回の冷水すすぎ
【0123】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュした。
・10:1の液比における5分間の冷水すすぎ
・1kgの軽石、pH4.5(1g/lのトリクエン酸ナトリウム二水和物及び1g/lのクエン酸一水和物)、及び、1.2g/lのINDIAGE(登録商標)2XLセルラーゼ(Genencor)を用いた10:1の液比における55℃での60分間のストーンウォッシュ
・30:1の液比における5分間にわたる2回の冷水すすぎ
【0124】
ストーンウォッシュ後に、以下のプロセスに従って、Unimac UF50洗浄機内においてラッカーゼ処理を実施した。
(i)pH6のC.ユニカラーのラッカーゼD及びシリンゴニトリル(0.7g/lのモノナトリウムリン酸塩及び0.17g/lのアジピン酸)、並びに、40℃、30℃又は23℃の温度
(ii)pH4.8のNOVOPRIME(登録商標)Base268及びNOVOPRIME(登録商標)F258(0.29g/lのモノナトリウムリン酸塩及び0.56g/lのアジピン酸)、並びに、40℃又は30℃の温度
・30:1の液比における5分間の2回の冷水すすぎ
デニムの脚の評価
【0125】
D65光源を備えたCIE試験色空間において、Minolta Chromameter CR 310を用いたラッカーゼ処理の後にデニムの脚の「漂白」として報告された色変性の量を評価した。CIELUV色空間としても知られているCIE色空間系は、1976年に国際照明委員会(CIE)に採用されたものであり、以下のように算出される値L*、u*及びv*を含む。

ここで、
Y:三刺激値Y(三刺激値Y10を使用することもできる)
u’、v’:CIE1976UCSダイアグラムから得た色度座標
Y0、u’0、v’0:完全反射拡散器の三刺激値Y(又はY10)及び色度座標u’、v’
【0126】
それぞれのデニムの脚について8回の測定値を得て、12本の脚(合計96個の測定値)の結果を平均した。その結果を表1及び表2並びに図1に示す。
表1

表2

【0127】
この結果は、ストーンウォッシュされたデニムの色変化に影響を与えることにおけるC.ユニカラーのラッカーゼ及びシリンゴニトリルの有効性を示している。
実施例2−ラッカーゼの効果:ストーンウォッシュされたデニムの色変性に対する伝達物質比率
手順
【0128】
実施例1に記載されているように、約3kg(合計)の重さの12本のデニムの脚を糊抜き及びストーンウォッシュした。ストーンウォッシュの後に、以下のプロセスに従ってUnimac UF50洗浄機内でラッカーゼ処理を実施した。
・C.ユニカラーのラッカーゼD及びシリンゴニトリル、10:1の液比において30分間、40℃においてpH6(0.7g/lのモノナトリウムリン酸塩及び0.17g/lのアジピン酸)
・30:1の液比において5分間にわたる2回の冷水すすぎ
デニムの脚の評価
【0129】
実施例1に記載されているようにデニムの脚の色変性を評価した。その結果を表3及び図2に示す。
表3

【0130】
この結果は、伝達物質に対するラッカーゼ酵素の比率を操作することによって、色変性を変化させることができることを示している。
実施例3−ストーンウォッシュされたデニムに対する、ラッカーゼと伝達物質とを含む組成物の色変性性能に対する温度の影響
【0131】
低温におけるラッカーゼによる色変性性能を調べるために、表4に示されているように「使用準備済」(RTU)組成物を調製した。モノナトリウムリン酸塩及びアジピン酸は、以下に記載されているような使用の用途において、約pH6の緩衝機能を提供する。
表4

手順
【0132】
実施例1に記載されているように、約3kg(合計)の重さの12本のデニムの脚を糊抜き及びストーンウォッシュした。ストーンウォッシュの後に、以下のプロセスに従って、Unimac UF50洗浄機内でラッカーゼ処理を実施した。
・30分間10:1の液比において30℃において又は流入スチームなし(すなわち、21℃乃至22℃の温度)で、表5及び表6に記載されている濃度及び温度において、上記RTUラッカーゼ組成物又はDENILITE(登録商標)IIS(Novozymes)を用いる
・30:1の液比において5分間の2回の冷水すすぎ
デニムの脚の評価
【0133】
実施例1に記載されているようにデニムの脚の色変性を評価した。この結果を表5及び表6並びに図3及び図4に示す。
表5

表6

【0134】
これらの結果は、C.ユニカラーラッカーゼRTU組成物は、従来の市販のラッカーゼ組成物と比較して、低温においてより優れた色変性を提供することを示している。
実施例4−30℃においてワンステップストーンウォッシュ及び色変性
【0135】
実施例1に記載されているように約3kg(合計)の重さの12本のデニムの脚をUnimac UF50洗浄機内で糊抜きした。
【0136】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュ及び漂白した。
・30分間、30℃で、10:1の液比において、pH6において、(i)物に対して0.4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)+実施例3(すなわち、「ストーンウォッシュ+漂白の1ステップ」)に記載されている、物に対して3重量%のRTUラッカーゼ組成物、又は、(ii)INDIAGE(登録商標)Super GXセルラーゼのみ(すなわち、「ストーンウォッシュ」のみ)
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。これらの結果を表7及び図5に示す。
表7

【0137】
これらの結果は、ラッカーゼとセルラーゼとを同時に使用して色変性を達成することができることを示している。
実施例5−30℃における2ステップのストーンウォッシュ及び色変性
【0138】
実施例1に記載されているように、Unimac UF50洗浄機内で約3kg(合計)の重さの12本のデニムの脚を糊抜きした。
【0139】
糊抜きの後に、デニムは、以下の条件下において、Unimac UF50洗浄機内でストーンウォッシュした。
・30分間、10:1の液比において、30℃で、pH5.5において、物に対して0.4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)
【0140】
ストーンウォッシュの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内で漂白した。
・30分間、10:1の液比において、30℃で、pH6において、物に対して3重量%の、実施例3に記載されているRTUラッカーゼ組成物
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。
【0141】
これらの結果を表8及び図5に示す。ストーンウォッシュと色変性との2ステップによる結果を、実施例4に記載されているストーンウォッシュのみの結果と比較した。
表8

【0142】
これらの結果は、ラッカーゼ処理による色変性がストーンウォッシュの後に達成可能であることを示している。
実施例6−ストーンウォッシュを用いない30℃におけるデニムのラッカーゼによる色変性
【0143】
実施例1に記載されているように、Unimac UF50洗浄機内で約3kg(合計)の重さの12本のデニムの脚を糊抜きした。
【0144】
糊抜きの後に、そのデニムを、以下の条件下においてUnimac UF50洗浄機内で漂白した。
・30分間、10:1の液比において、30℃で、pH6において、物に対して3重量%の、実施例3に記載のRTUラッカーゼ組成物
・30:1の液比において5分間にわたる2回の冷水すすぎ。軽石を使用しなかった。
【0145】
これらの結果を表9及び図5に示す。実施例4に記載されているように、色変性の結果を、ストーンウォッシュのみの結果と比較した。
表9

【0146】
これらの結果は、ストーンウォッシュを伴わないラッカーゼ処理によって生じる色変性の程度がストーンウォッシュのみより高いことを示している。
実施例7−軽石を含まない単一槽中のプロセスにおけるセルラーゼ及びラッカーゼによるストーンウォッシュ及び色変性
【0147】
この実施例は、単一槽のプロセスにおいてラッカーゼ及びセルラーゼを使用して有効なストーンウォッシュ及び色変性が得られることを示している。
酵素
【0148】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチNo.780913616、6,292GLacU/g)。
手順
【0149】
出発物質は、重さ約3kgの糊抜きしたデニム(バラスト+評価用の2脚)であった。
【0150】
このデニムを、以下の条件下において、Renzacci LX 22洗浄機内でストーンウォッシュした。
・40分間、50℃、10:1の液比、pH6.5、物に対して0.4重量%のINDIAGE(登録商標)Neutra Lセルラーゼ(バッチNo.40105358001、活性5197NPCNU/g)(Genencor)。
・ストーンウォッシュした後に、1本の脚を取り出して、評価のために乾燥した。
・ストーンウォッシュの後に、槽を排出(すなわち、排水)することなく、以下の条件下において第2のデニムの脚を色変性に供した。
・40分間、40℃、10:1の液比、及び、物に対して1%重量の使用準備済み(RTU)のPRIMAGREEN(登録商標)EcoFade LT 100。
・3分間にわたる2回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥した。
デニムの脚の評価
【0151】
ラッカーゼ処理の後及びセルラーゼ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムの脚に対する色変性及びストーンウォッシュを評価した。各脚について6回の測定値を得て、結果を平均化した。
【0152】
これらの結果を表10にまとめる。単一槽中におけるセルラーゼとラッカーゼとの連続的な(すなわち、2ステップの)添加によって得られた色変性の程度は、実施例4のようにセルラーゼとラッカーゼとを同時に添加することによって得られた程度より大きかった。
表10

【0153】
これらの結果は、単一浴槽におけるセルラーゼとラッカーゼとの連続的な(すなわち、2ステップ)の添加によって得られた色変性の程度が、実施例4のようにセルラーゼとラッカーゼとを同時に添加することによって得られた程度より大きいことを示している。
実施例8−ラッカーゼ及び軽石を用いた色変性
【0154】
この実施例は、単一槽プロセスにおいて軽石とラッカーゼ伝達物質系とを使用して、有効なストーンウォッシュ及び色変性を得ることができることを示している。
酵素
【0155】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチ7809136160番、6,292のGLacU/g)。
手順
【0156】
実施例1に記載されているように、重さ約3kg(合計)の12本のデニムの脚を、Unimac UF50洗浄機内で糊抜きした。
【0157】
糊抜きの後に、このデニムを、以下の条件下においてUnimac UF50洗浄機内でストーンウォッシュした。
・30分間、30℃、10:1の液比、3kgの軽石、3%のPRIMAGREEN(登録商標)EcoFade LT100(Genencor)を用いた。水中で石のみを用いてブランク/コントロールを実施した。
・30:1の液比において5分間にわたる2回の冷水すすぎ。
デニムの脚の評価
【0158】
先のように、ラッカーゼ処理の後及びストーンウォッシュ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムの脚に対する色変性を評価した。各脚の外側で得た8回の測定値の平均を漂白レベルとして報告した。各脚の内側で得た4回の測定値の平均を裏面染色レベルとして報告した。
【0159】
これらの結果を表11及び表12にまとめる。
表11

表12

【0160】
これらの結果は、軽石が存在していても、ラッカーゼ処理が、色変性を提供し、裏面染色の低減/除去をさらに示すことを示している。
実施例9−硫黄染色された衣服のストーンウォッシュ及び色変性
【0161】
試験用の衣服は、硫黄のカーキーブラウン染料で染色された100%綿綾織物生地でできていた。以下の条件下において、25kgのベリーウォッシャー(36rpm)において約7kg(合計)の重さの21着の衣服をストーンウォッシュした。
・45分間、55℃、18:1の液比、pH4.5、1g/lのINDIAGE(登録商標)2XL
・12:1の液比で3分間の1回の冷水すすぎ。軽石を使用しなかった。
・洗浄した後に、評価のために衣服を乾燥した。
・以下の条件下において上記のようにストーンウォッシュした3着の衣服(合計約1kg)をPRIMAGREEN(登録商標)EcoFade LT 100で処理した。
・15分間、30分間又は45分間、50:1の液比、40℃、及び、1g/l、2g/l又は3g/lのPRIMAGREEN(登録商標)EcoFade LT 100。ブランク/コントロールは、水のみで15分間、30分間又は45分間にわたって洗浄した衣服を用いて実施した。
・3分間の1回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥させた。
デニムの脚の評価
【0162】
ラッカーゼ処理後及びストーンウォッシュ処理後に、上述されているように、D65光源を備えたCIE試験空間においてMinolta Chromameter CR 310を用いて、硫黄染色された衣服の色変性及びストーンウォッシュを評価した。各衣服について10回の測定値を得て、結果を平均化した。
【0163】
これらの結果を表13にまとめる。
表13

【0164】
これらの結果は、色空間のa値及びb値が、未処理及びブランクの生地と比較して著しく変化することを示している。衣服の色合いに対する変性は目視によって確認される。
実施例10−ストーンウォッシュを伴わない硫黄染色された衣服の色変性
【0165】
硫黄のカーキーブラウン染料で染色された約1kg(合計)の重さの100%綿綾織物生地でできた3着の衣服を、以下の条件下において、5kgのビリーウォッシャーにおいて(36rpm)処理した。
・15分間、30分間又は45分間、40:1の液比、40℃、及び、1g/l、2g/l又は3g/lのPRIMAGREEN(登録商標)EcoFade LT 100。ブランク/コントロールは、水のみで15分間、30分間又は45分間にわたって洗浄した衣服を用いて実施した。
・3分間の1回の冷水すすぎ。
・工業用ドライヤーでデニムを乾燥させた。
デニムの脚の評価
【0166】
ラッカーゼ処理後及びストーンウォッシュ処理後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、硫黄染色された衣服に対する色変性及びストーンウォッシュを評価した。各衣服について、10回の測定値を得て、結果を平均化した。
【0167】
これらの結果を表14にまとめる。
表14

【0168】
これらの結果は、色空間のa値及びb値が、未処理及びブランクの生地と比較して著しく変化することを示している。衣服の色合いに対する変性は目視によって確認される。
実施例11−界面活性剤及び軽石の存在下における単一槽プロセス中のセルラーゼ及びラッカーゼによるストーンウォッシュ及び漂白の性能
酵素
【0169】
PRIMAGREEN(登録商標)EcoFade LT 100ラッカーゼ(バッチNo.780913616、6,292GLacU/g)
手順
【0170】
純粋な藍で染色された重さ10kg(合計)の12着のデニム衣服を、以下の条件下でTupesaフロントローディングマシン(36rpm)において糊抜きした。
・10分間、40℃、10:1の液比、pH7、並びに、0.5g/lの潤滑剤、0.2g/lの分散剤(非イオン性界面活性剤)、及び、0.2g/lのポリエステル遮断薬(非イオン性の親水性コポリマー)。
【0171】
糊抜きの後に、そのデニムを、以下の条件下でストーンウォッシュした。
・30分間、47℃、5:1の液比、pH6、7kgの軽石、物に対して4重量%のINDIAGE(登録商標)Super GXセルラーゼ(Genencor)を用いる。評価のために1着の衣服を取り出した。
・ストーンウォッシュの後に、槽を排水(下垂)することなく、以下の条件下においてデニムを漂白した。
・30分間、5:1の液比、47℃、及び、物に対して2重量%の使用準備済(RTU)PRIMAGREEN(登録商標)EcoFade LT100
・1:50の液比における2分間にわたる2回の冷水すすぎ。
・デニムを工業用ドライヤーで乾燥させた。
デニムの脚の評価
【0172】
ラッカーゼ処理の後及びセルラーゼ処理の後に、D65光源を備えたCIE試験色空間においてMinolta Chromameter CR 310を用いて、デニムに対する色変性及びストーンウォッシュを評価した。各脚について8回の測定値を得て、結果を平均化した。
【0173】
これらの結果を表15にまとめる。
表15

【0174】
これらの結果は、軽石及び界面活性剤の存在下におけるラッカーゼ処理によって色変性が生じることを示している。
【0175】
本明細書に記載されている態様、実施形態及び実施例は、説明のみを目的とする。様々な変形は、当業者に明らかであり、この出願の精神及び範囲並びに添付されている特許請求の範囲の範囲内に包含される。本明細書において引用された刊行物及び特許文献のすべては、ここで言及することによってそれらの全体がそのまま組み込まれている。
【特許請求の範囲】
【請求項1】
40℃未満の温度において、繊維の色変性を生じさせるのに充分な時間及び条件下において、繊維をラッカーゼ酵素及び伝達物質に接触させるステップを含むことを特徴とする繊維処理方法。
【請求項2】
前記色変性が、色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び、漂白から選択されることを特徴とする請求項2に記載の方法。
【請求項3】
前記温度が約20℃以上40℃未満であることを特徴とする請求項1に記載の繊維処理方法。
【請求項4】
前記温度が約20℃乃至約30℃であることを特徴とする請求項1に記載の繊維処理方法。
【請求項5】
前記繊維が藍染めされたデニムであることを特徴とする請求項1に記載の繊維処理方法。
【請求項6】
前記繊維が硫黄染めされたデニムであることを特徴とする請求項1に記載の繊維処理方法。
【請求項7】
前記繊維をラッカーゼ酵素及び伝達物質に接触させるステップの前に又は同時に、前記デニムを糊抜き及び/又はストーンウォッシュすることを特徴とする請求項1に記載の繊維処理方法。
【請求項8】
ストーンウォッシュするステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、同じ槽内で実行することを特徴とする請求項1に記載の繊維処理方法。
【請求項9】
繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップと同時に又は連続して、繊維をセルラーゼ酵素に接触させるステップをさらに含むことを特徴とする請求項1に記載の繊維処理方法。
【請求項10】
繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを連続して実行し、かつ、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップの前に、繊維をセルラーゼ酵素に接触させる前記ステップを実行することを特徴とする請求項9に記載の繊維処理方法。
【請求項11】
繊維をセルラーゼ酵素に接触させる前記ステップと繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとの間に槽を排水することなく、繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、同一槽内において連続して実行することを特徴とする請求項10に記載の繊維処理方法。
【請求項12】
繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、40℃未満の温度において実行することを特徴とする請求項9乃至11のいずれか1項に記載の繊維処理方法。
【請求項13】
前記ラッカーゼが微生物のラッカーゼであることを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項14】
前記ラッカーゼがセレナ(Cerrena)種に由来することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項15】
前記ラッカーゼがセレナユニカラー(C. unicolor)に由来することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項16】
前記ラッカーゼがセレナユニカラー(C. unicolor)に由来するラッカーゼDであることを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項17】
前記ラッカーゼが、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも70%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項18】
前記ラッカーゼが、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも80%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項19】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも70%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項20】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも80%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項21】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも90%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項22】
前記伝達物質がシリンゴニトリルであることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項23】
前記温度が約20℃乃至約35℃であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項24】
前記温度が約20℃乃至約23℃であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項25】
前記温度が水道水の外界温度であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項26】
使用準備済組成物中に前記ラッカーゼ酵素と前記伝達物質とを一緒に提供することを特徴とする請求項1乃至25のいずれか1項に記載の方法。
【請求項27】
前記ラッカーゼ酵素及び伝達物質を固体形態で提供することを特徴とする請求項1乃至25のいずれか1項に記載の方法。
【請求項1】
40℃未満の温度において、繊維の色変性を生じさせるのに充分な時間及び条件下において、繊維をラッカーゼ酵素及び伝達物質に接触させるステップを含むことを特徴とする繊維処理方法。
【請求項2】
前記色変性が、色の薄色化、色の変化、色合いの変化、再沈着/裏面染色の低減、及び、漂白から選択されることを特徴とする請求項2に記載の方法。
【請求項3】
前記温度が約20℃以上40℃未満であることを特徴とする請求項1に記載の繊維処理方法。
【請求項4】
前記温度が約20℃乃至約30℃であることを特徴とする請求項1に記載の繊維処理方法。
【請求項5】
前記繊維が藍染めされたデニムであることを特徴とする請求項1に記載の繊維処理方法。
【請求項6】
前記繊維が硫黄染めされたデニムであることを特徴とする請求項1に記載の繊維処理方法。
【請求項7】
前記繊維をラッカーゼ酵素及び伝達物質に接触させるステップの前に又は同時に、前記デニムを糊抜き及び/又はストーンウォッシュすることを特徴とする請求項1に記載の繊維処理方法。
【請求項8】
ストーンウォッシュするステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、同じ槽内で実行することを特徴とする請求項1に記載の繊維処理方法。
【請求項9】
繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップと同時に又は連続して、繊維をセルラーゼ酵素に接触させるステップをさらに含むことを特徴とする請求項1に記載の繊維処理方法。
【請求項10】
繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを連続して実行し、かつ、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップの前に、繊維をセルラーゼ酵素に接触させる前記ステップを実行することを特徴とする請求項9に記載の繊維処理方法。
【請求項11】
繊維をセルラーゼ酵素に接触させる前記ステップと繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとの間に槽を排水することなく、繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、同一槽内において連続して実行することを特徴とする請求項10に記載の繊維処理方法。
【請求項12】
繊維をセルラーゼ酵素に接触させる前記ステップと、繊維をラッカーゼ酵素及び伝達物質に接触させる前記ステップとを、40℃未満の温度において実行することを特徴とする請求項9乃至11のいずれか1項に記載の繊維処理方法。
【請求項13】
前記ラッカーゼが微生物のラッカーゼであることを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項14】
前記ラッカーゼがセレナ(Cerrena)種に由来することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項15】
前記ラッカーゼがセレナユニカラー(C. unicolor)に由来することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項16】
前記ラッカーゼがセレナユニカラー(C. unicolor)に由来するラッカーゼDであることを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項17】
前記ラッカーゼが、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも70%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項18】
前記ラッカーゼが、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号19及び配列番号20からなる群より選択されるアミノ酸配列に対して少なくとも80%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項19】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも70%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項20】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも80%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項21】
前記ラッカーゼが、配列番号19又は配列番号20に対して少なくとも90%同一のアミノ酸配列を有することを特徴とする請求項1乃至12のいずれか1項に記載の方法。
【請求項22】
前記伝達物質がシリンゴニトリルであることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項23】
前記温度が約20℃乃至約35℃であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項24】
前記温度が約20℃乃至約23℃であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項25】
前記温度が水道水の外界温度であることを特徴とする請求項1乃至21のいずれか1項に記載の方法。
【請求項26】
使用準備済組成物中に前記ラッカーゼ酵素と前記伝達物質とを一緒に提供することを特徴とする請求項1乃至25のいずれか1項に記載の方法。
【請求項27】
前記ラッカーゼ酵素及び伝達物質を固体形態で提供することを特徴とする請求項1乃至25のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2012−514139(P2012−514139A)
【公表日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2011−543642(P2011−543642)
【出願日】平成21年12月22日(2009.12.22)
【国際出願番号】PCT/US2009/069229
【国際公開番号】WO2010/075402
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
【公表日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願日】平成21年12月22日(2009.12.22)
【国際出願番号】PCT/US2009/069229
【国際公開番号】WO2010/075402
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
[ Back to top ]

