リグノセルロース系バイオマスをエタノールに変換する好熱性生物
【課題】有機酸(特に酢酸)を作り続けるT.saccharolyticum株を提供する。
【解決手段】種々のバイオマスに由来する基質を消費する変異型の好熱性生物が本明細書において開示される。アセテートキナーゼおよびホスホトランスアセチラーゼの発現が排除されたThermoanaerobacterium saccharolyticumの株が、本明細書において開示される。さらに、ALK1株は、 部位特定相同組換えにより操作されて、酢酸および乳酸の生成をノックアウトされている。基質濃度の刺激を伴う連続培養は、ALK1の進化と、より頑健なALK2と称される株の形成をもたらす。両方の生物は、ピルビン酸デカルボキシラーゼを発現することなく、理論収量に近いエタノールを生成する。
【解決手段】種々のバイオマスに由来する基質を消費する変異型の好熱性生物が本明細書において開示される。アセテートキナーゼおよびホスホトランスアセチラーゼの発現が排除されたThermoanaerobacterium saccharolyticumの株が、本明細書において開示される。さらに、ALK1株は、 部位特定相同組換えにより操作されて、酢酸および乳酸の生成をノックアウトされている。基質濃度の刺激を伴う連続培養は、ALK1の進化と、より頑健なALK2と称される株の形成をもたらす。両方の生物は、ピルビン酸デカルボキシラーゼを発現することなく、理論収量に近いエタノールを生成する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本願は、米国特許出願第60/731,674号(2005年10月31日出願)および米国特許出願第60/796,380号(2006年5月1日出願)に対する優先権を主張し、これら特許出願の各々は、本明細書中に参考として援用される。
【0002】
(政府の権利)
本発明の進展に関する研究がNational Institute of Standards and Technology(NIST)契約番号60NANB1D0064によって資金援助されたので、米国政府は、本発明において一定を権利を有し得る。
【0003】
(背景)
(1.発明の分野)
本発明は、エタノールを生成するためのバイオマス処理の分野に関する。特に、種々のバイオマス由来の基質を消費しかつ高収量でエタノールを生成する新規な好熱性生物、ならびに上記生成のプロセスおよび上記生物の使用が開示される。
【背景技術】
【0004】
(2.関連技術の説明)
バイオマスは、安価でかつ容易に入手可能なセルロース分解基質の代表であり、この基質から糖が生成され得る。これら糖は、単独で使用されてもよいし、アルコールおよび他の生成物を生成するために醗酵されてもよい。生物変換生成物の中で、エタノールにおける関心は高い。なぜなら、エタノールは、再生可能家庭用燃料(renewable domestic fuel)として使用され得るからである。
【0005】
反応器設計、前処理プロトコールおよび分離技術の分野でかなりの研究が行われてきた。その結果、生物変換プロセスは、石油燃料技術と経済的に競争できる関係になっている。しかし、最大の費用削減は、2つ以上の処理工程を組み合わせたときに得られ得ると予測される。例えば、同時に存在する糖化と醗酵(SSF)、および同時に存在する糖化と並行醗酵(co−fermentation)(SSCF)プロセスとを併用すると、1つの反応器または連続処理装置において酵素的糖化工程と醗酵とが一体となって行われる。より短期間の発酵時間および資本金縮小に関連する費用削減に加えて、並行醗酵プロセスはまた、生成物収量の改善を提供し得る。なぜなら、別の方法では代謝的分解(metabolysis)または加水分解を阻害するレベルにまで蓄積してしまう特定の化合物が、並行醗酵生物によって消費されるからである。1つのこのような例において、β−グルコシダーゼは、グルコースの存在下でセロビオースを加水分解するのをやめてしまい、次には、セロビオースの蓄積が、セルロース分解を妨げる。セルロースおよびヘミセルロースの加水分解生成物の並行醗酵に伴うSSCFプロセスは、β−グルコシダーゼの加水分解活性を阻害しない1種以上の生成物へとグルコースを変換することによって、この課題を多少解決し得る。
【0006】
統合バイオプロセス処理(consolidated bioprocessing)(CBP)は、4つの生物媒介事象(biologically−mediated events)を伴う:(1)酵素生成、(2)基質加水分解、(3)ヘキソース醗酵および(4)ペントース醗酵。これら事象は、1つの工程において行われ得る。このストラテジーは、セルロースおよびヘミセルロースを利用する微生物を要する。CBP生物の開発は、専ら特定の目的のための(dedicated)処理工程において糖分解性酵素を生成するという、より従来のアプローチと比較して、潜在的に非常に多額の費用削減を生じ得る。1種より多い生物を利用して上記4つの生物媒介事象を達成するCBPプロセスは、統合バイオプロセス処理並行培養醗酵(consolidated bioprocessing co−culture fermentation)といわれる。
【0007】
いくらかの細菌は、ペントース糖をヘキソース糖に変換し、かつそのヘキソースを有機酸と解糖による他の生成物との混合物へと醗酵する能力を有する。上記解糖経路は、6炭のグルコース分子を2つの3炭素分子であるピルビン酸(pyruvate)に変換することで始まる。次いで、ピルビン酸は、乳酸デヒドロゲナーゼ(「ldh」)の作用によって乳酸へと変換され得るか、またはピルビン酸デヒドロゲナーゼもしくはピルビン酸−フェレドキシンオキシドレダクターゼの作用によってアセチルコエンザイムA(「アセチル−CoA」)へと変換され得る。アセチル−CoAはさらに、ホスホトランスアセチラーゼおよびアセテートキナーゼによって酢酸へと変換されるか、またはアセトアルデヒドデヒドロゲナーゼ(「AcDH」)およびアルコールデヒドロゲナーゼ(「adh」)によってエタノールへと還元される。全般的に、エタノール生成生物の能力は、エタノール以外の有機生成物の生成によって(特に、ピルビン酸から乳酸へのldh媒介変換によって、およびホスホトランスアセチラーゼおよびアセテートキナーゼによるアセチル−CoAから酢酸への変換によって)損なわれる。
【0008】
細菌の代謝的操作によって、好熱性嫌気性グラム陽性細菌T.saccharolyticumにおいて乳酸デヒドロゲナーゼのノックアウトが近年作り出された。非特許文献1を参照のこと。
【0009】
上記ldhのノックアウトは、当該分野においてある進歩を与えているものの、T.saccharolyticumのこの株が、有機酸(特に酢酸)を作り続ける点において、この生物のいくらかの用途にとっては問題である。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Desai,S.G.;Guerinot,M.L.;Lynd,L.R.「Cloning of L−lactate dehydrogenase and elimination of lactic acid production via gene knockout in Thermoanaerobacterium saccharolyticum JW/SL−YS485」Appl.Microbiol.Biotechnol.65:600−605,2004
【発明の概要】
【課題を解決するための手段】
【0011】
本発明の手段は、種々のバイオマス由来の物質を消費し、そして、理論収量に近いエタノールを生成する好熱性嫌気性細菌を提供することによって、当該分野においてある進歩を与え、上記に概説する問題を克服する。生物を使用してエタノールを生成するための方法もまた開示される。
【0012】
本明細書において報告される手段は、単独でまたは組み合わせてのいずれかでの種々の遺伝子のノックアウトをもたらし、ネイティブの生物におけるこのような遺伝子は、ノックアウトされなければ、有機酸の形成をもたらす。例えば、T.saccharolyticum JW/SL−YS485における(a)アセテートキナーゼおよび/またはホスホトランスアセチラーゼ、ならびに(b)乳酸デヒドロゲナーゼ(ldh)、アセテートキナーゼ(ack)およびホスホトランスアセチラーゼ(ptd)のノックアウトが存在し得る。本明細書において報告される結果は、T.saccharolyticumについてのものであるが、これらの方法および材料はまた、Thermoanaerobacterium thermosulfurigenes、Thermoanaerobacterium aotearoense、Thermoanaerobacterium polysaccharolyticum、Thermoanaerobacterium zeae、Thermoanaerobacterium thermosaccharolyticumおよびThermoanaerobacterium xylanolyticumを含むThermoanaerobacter属の他のメンバーにも適用される。これらの方法および材料は、代謝的操作された好熱性グラム陽性細菌の分野全般において有用である。
【0013】
1つの実施形態において、ピルビン酸デカルボキシラーゼを発現しない単離された生物は、セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する。
【0014】
1つの実施形態において、ネイティブの状態において、醗酵生成物として酢酸を生成する能力をグラム陽性細菌に付与する少なくとも1種の遺伝子を含むグラム陽性細菌は、この少なくとも1種の遺伝子の発現を排除するように形質転換される。この細菌は、Thermoanaerobacterium saccharofyticumのようなThermoanaerobacterであり得る。醗酵生成物として酢酸を生成する能力をグラム陽性細菌に付与する遺伝子は、アセテートキナーゼおよび/またはホスホトランスアセチラーゼの発現をコードし得る。
【0015】
別の実施形態において、グラム陽性細菌は、醗酵生成物として乳酸を生成する能力をグラム陽性細菌に付与する1種以上の遺伝子の発現を排除するようにさらに形質され得る。例えば、乳酸を生成する能力を付与する遺伝子は、乳酸デヒドロゲナーゼであり得る。
【0016】
1つの実施形態において、エタノールを生成するための方法は、ネイティブの生物を形質転換して、醗酵生成物として有機酸を生成する能力をグラム陽性細菌に付与する全ての遺伝子の発現を排除するように形質転換されたグラム陽性細菌を生成して、形質転換細菌宿主を生成する工程、ならびにこの形質転換細菌宿主を、グルコース、キシロース、セロビオース、スクロース、キシラン、澱粉およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、これらの基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程を包含する。
【0017】
1つの実施形態において、ALK1と称され、かつ特許寄託指定番号PTA−7206の下でATCCに寄託されている微生物の生物学的に純粋な培養物が記載される。
【0018】
1つの実施形態において、単離されたポリヌクレオチドは、(a)配列番号10の配列、または(b)配列番号9および配列番号10の配列、または(c)(a)もしくは(b)の配列に対して少なくとも約90%の配列同一性を有する配列を含む。(a)、(b)または(c)の単離されたポリヌクレオチドを含むベクター、ならびに、(a)、(b)または(c)の単離されたポリヌクレオチドの相補体を発現するように遺伝子操作された宿主細胞が記載される。別の実施形態において、単離されたポリヌクレオチドは、(a)または(b)の配列に対して少なくとも約95%の配列同一性を有する配列を含む。
【0019】
1つの実施形態において、エタノールを生成する方法は、(a)、(b)または(c)の単離されたポリヌクレオチドの相補体を発現する変異細菌を、グルコース、キシロース、セロビオース、スクロース、キシラン、澱粉およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、これらの基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程を包含する。
本発明はまた、以下の項目を提供する。
(項目1)
セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する単離された生物であって、該生物は、ピルビン酸デカルボキシラーゼを発現しない、単離された生物。
(項目2)
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、項目1に記載の単離された生物を生成し、形質転換宿主を提供する工程;ならびに
該形質転換宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目3)
形質転換生物であって、該形質転換生物は、
ネイティブの状態において、醗酵生成物として酢酸を生成する能力を付与する少なくとも1種の遺伝子を含むグラム陽性細菌
を含み、
該グラム陽性細菌は、該少なくとも1種の遺伝子の発現を排除するように形質転換されている、
形質転換生物。
(項目4)
上記グラム陽性細菌は、Thermoanaerobacter属のメンバーである、項目3に記載のグラム陽性細菌。
(項目5)
上記グラム陽性細菌は、Thermoanaerobacterium saccharolyticumである、項目3に記載のグラム陽性細菌。
(項目6)
上記少なくとも1種の遺伝子は、アセテートキナーゼの発現をコードする、項目3に記載のグラム陽性細菌。
(項目7)
上記少なくとも1種の遺伝子は、ホスホトランスアセチラーゼの発現をコードする、項目3に記載のグラム陽性細菌。
(項目8)
上記少なくとも1種の遺伝子は、複数種の遺伝子を含む、項目3に記載のグラム陽性細菌。
(項目9)
上記複数種の遺伝子は、アセテートキナーゼおよびホスホトランスアセチラーゼの発現をコードする、項目8に記載のグラム陽性細菌。
(項目10)
上記グラム陽性細菌に醗酵生成物として乳酸を生成する能力を付与する1種以上の遺伝子の発現を排除するように、さらに形質転換されている、項目9に記載のグラム陽性細菌。
(項目11)
上記グラム陽性細菌に醗酵生成物として乳酸を生成する能力を付与する1種以上の遺伝子の発現を排除するように、さらに形質転換されている、項目3に記載のグラム陽性細菌。
(項目12)
上記少なくとも1種の遺伝子は、乳酸デヒドロゲナーゼの発現をコードする、項目11に記載のグラム陽性細菌。
(項目13)
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、項目11に記載のグラム陽性細菌を生成し、形質転換細菌宿主を生成する工程;ならびに
該形質転換細菌宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目14)
上記細菌宿主は、Thermoanaerobacterium saccharolyticumである、項目13に記載の方法。
(項目15)
上記遺伝子は、乳酸デヒドロゲナーゼ、アセテートキナーゼ、およびホスホトランスアセチラーゼの発現をコードする、項目13に記載の方法。
(項目16)
ALK1と称されかつ特許寄託指定番号PTA−7206の下で寄託されている微生物の生物学的に純粋な培養物。
(項目17)
単離されたポリヌクレオチドであって、
(a)配列番号10の配列;
(b)配列番号9および配列番号10の配列;または
(c)(a)もしくは(b)の配列に対して少なくとも約90%の配列同一性を有する配列
を含む、単離されたポリヌクレオチド。
(項目18)
上記(a)または(b)の配列に対して約95%の配列同一性を有する、項目17に記載の単離されたポリヌクレオチド。
(項目19)
項目18に記載の単離されたポリヌクレオチドを含む、ベクター。
(項目20)
項目18に記載のポリヌクレオチドの相補体を発現するように遺伝子操作された宿主細胞。
(項目21)
上記宿主細胞は細菌細胞である、項目20に記載の宿主細胞。
(項目22)
エタノールを生成するための方法であって、該方法は、
項目21に記載の変異細菌を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、該基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目23)
上記変異細菌は、Thermoanaerobacterium saccharolyticumである、項目22に記載の方法。
(項目24)
上記変異細菌は、Thermoanaerobacterium saccharolyticum ALK1(JW/SL−YS485 ALK1)である、項目23に記載の方法。
(項目25)
細菌において発現できるプロモーターに作動可能に連結された配列番号10を含む、遺伝子構築物。
(項目26)
項目25に記載の遺伝子構築物を含む、組換え細菌。
(項目27)
上記細菌は、Thermoanaerobacterium saccharolyticumである、項目26に記載の組換え細菌。
【図面の簡単な説明】
【0020】
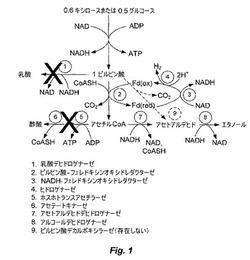
【図1】図1は、解糖経路の反応を示す。
【図2】図2は、T.saccharolyticumの種々のノックアウト株と比較した、野生型のT.saccharolyticumにおける水素生成を示す。
【図3−1】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−2】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−3】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−4】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−5】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−1】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−2】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−3】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−4】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−5】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−6】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図5】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図6】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図7】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図8】図8は、ALK1株による醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図9】図9は、野生型T.saccharolyticumによる醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図10】図10は、ALK1の連続培養刺激の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図11】図11は、ALK2株による醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【発明を実施するための形態】
【0021】
(詳細な説明)
ここで、バイオマスのエタノールへの変換において好熱性嫌気性グラム陽性細菌を操作および利用するための方法が示され、かつ記載される。
【0022】
本明細書において使用される場合、生物は、その生物の遺伝子および/または表現型の構成を意図的に変更する様式で人間の手によって遺伝子操作または他の方法で操作されていない場合、「ネイティブの状態」にある。例えば、野生型の生物は、ネイティブの状態にあると考えられ得る。
【0023】
ネイティブの状態のT.saccharolyticumからの有機酸の生成の完全なる排除は、2回の部位特定DNA相同組換え事象を用いて達成された。変異株であるThermoanaerobacterium saccharolyticum JW/SL−YS485 ALK1(「ALK1」)は、約30℃〜66℃の範囲の温度および約3.85〜6.5の範囲のpHの大量培養において、少ない基質の補給で、理論量に近いエタノールを生成する。1つの実施形態において、エタノール収量は、理論最大量の少なくとも約90%である。ALK1およびその子孫(decendent)は、その増殖条件に起因して、リグノセルロース系(lignocellulosic)バイオマスからのエタノールへの変換において有意な費用削減に寄与する潜在能力を有する。この増殖条件は、同時に存在する糖化および平行醗酵(SSCF)プロセスにおけるセルラーゼ活性が実質的に最適である。例えば、最適なセルラーゼ活性のパラーメータとしては、4〜5の間のpHと40℃〜50℃の間の温度が挙げられる。さらに、有機酸を生成する能力を欠くノックアウト生物が使用される場合は、醗酵培養液のpHを調整する必要はない。ALK1および類似する生物はまた、統合バイオプロセス処理並行培養醗酵に適切であり得、この統合バイオプロセス処理並行培養醗酵においては、ノックアウト生物が、ペントースをエタノールへと変換し、そして、セルロースが、C.thermocellumのようなセルロース加水分解生物によって分解される。
【0024】
好熱性の温度においてSSCFプロセスまたはCBPプロセスのいずれかを行うことにより、3従来の0℃〜37℃の中温性の醗酵温度を上回るいくつかの重要な利益が提供される。特に、セルラーゼ生成専用のプロセス工程のための費用が、好熱性のSSCFについては実質的に削減され(例えば、2倍以上)、そして、CBPについては排除される。醗酵槽(fermentor)の冷却そしてまた醗酵前後の熱交換に付随する費用もまた、好熱性のSSCFおよびCBPの両方について削減されることが予想される。最後に、好熱性の生体触媒を特徴とするプロセスは、従来の中温性の生体触媒を特徴とするプロセスと比較して、細菌混入に対する感受性が低下し得る。
【0025】
天然に存在するSaccharomyces cerevisiaeおよびZymomonas mobilis、ならびに、Escherchia coliおよびKlebsiella oxytocaの組換え株のような公知の「ホモエタノール醗酵」微生物とは対照的に、本明細書により開示される生物は、ピルビン酸デカルボキシラーゼの作用によるピルビン酸のアセトアルデヒドへの変換に依存しない(図1、9)。実際、Thermoanaerobacter属に属する細菌は、ネイティブの状態でピルビン酸デカルボキシラーゼを発現しない。図1に示す解糖経路の反応から、酵素ピルビン酸−フェレドキシンオキシドレダクターゼ(2)によって、ピルビン酸がアセチル−CoA、二酸化炭素および還元フェレドキシンへと代謝され得ることが観察され得る。しかし、エタノールを唯一の醗酵生成物として生成するために、NAD:フェレドキシンオキシドレダクターゼ(3)によって、還元フェレドキシンにより運搬される電子が全て、NADへと転移され、NADHAを形成しなければならない。NADHは、その後、アセトアルデヒドデヒドロゲナーゼ(7)、およびアルコールデヒドロゲナーゼ(8)によるアセチル−CoAのエタノールへの2段階の還元の過程で、酸化されてNADへと戻る。NADHの効率的な利用の証拠は、図2において、ackおよびptaを発現できないアセテートノックアウト生物と、ack、ptaおよびldhを発現できない二重ノックアウト生物(ALK1)との両方によるH2生成の減少として、観察され得る。これらの生物は、還元フェレドキシンからNADへの、そして、その後のエタノールへの化学量論に関する電子の転移という第一の論証を提供する。
【0026】
PDCを発現する能力を有さない生物において化学量論に関するエタノール収量を生成する上記の経路は、これまでに記載されてきたホモエタノール醗酵株において用いられる経路とは対照的である。これまでに記載されてきた株は、内因性のピルビン酸デカルボキシラーゼ(PDC)を利用するか、または、外因性のPDCを発現するように操作される。PDCの発現は、微生物界においては稀なことであるので、改変によって、電子の流れを炭素の流れへと方向を変える能力は、広範な影響を有する。例えば、このアプローチは、T.saccharotyticum以外の株において高いエタノール収量を生成するため、そして/または、エタノール以外の溶媒を生成するために使用され得る。特に、Thermoanaerober属のメンバー;Clostridium thermocellumならびに他の好熱性および中温性のClostridia種;好熱性および中温性のBacillus種のようなグラム陽性細菌;Escherichia coliおよびKlebsiella oxytoca;Fihrobacter succinogenesおよび他のFibrobacter種;Thermoga neopolitanaおよび他のThermotoga種;ならびに嫌気性菌門(Neocallimatix種およびPiromyces種を含む)のようなグラム陰性細菌は、PDCを発現する能力を欠き、そして、開示される手段から利益を受け得る。
【0027】
リグノセルロース系の物質が、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナンおよび澱粉のうちの1種以上を含有する任意の補給ストックであり得ることが理解される。種々の実施形態において、リグノセルロース系バイオマスは、木、トウモロコシ飼料、おが屑、樹皮、葉、農林業の残留物、アメリカクサキビのような草、反芻動物の消化産物、市の廃棄物、製紙工場の流出物、新聞紙、ボール紙、またはこれらの組み合わせを含む。
【実施例】
【0028】
(実施例1 ALK1株の生成)
(材料および方法)
Thermoanaerobacterium saccharolyticum株であるJW/SL−YS485(DSM 8691)は、West Thumb Basin in Yellowstone National Park, Wyomingから単離された好熱性嫌気性細菌である(Lui,S.Y.;Gherardini,F.C.;Matuschek,M.;Bahl,H.;Wiegel,J.「Cloning,sequencing,and expression of the gene encoding a large S−layer−associated endoxylanase from Thermoanaerobacterium sp strain JW/SL−YS485 in Escherichia coli」J.Bacteriol.178:1539−1547,1996;Mai,V.;Wiegel,J.「Advances in development of a genetic system for Thermoanaerobacterium spp:Expression of genes encoding hydrolytic enzymes,development of a second shuttle vector,and integration of genes into the chromosome」Appl.Environ.Microbiol.66:4817−4821,2000)。この株は、30℃〜66℃の範囲の温度および3.85〜6.5の範囲のpHにおいて増殖する。この株は、単糖類であるグルコースおよびキシロース、二糖類であるセロビオースおよびスクロース、ならびに、多糖類であるキシランおよび澱粉を含めた、種々のバイオマス由来の基質を消費するが、セルロースは消費しない。この生物は、エタノール、ならびに、有機酸である乳酸および酢酸を、一次醗酵生成物として生成する。
【0029】
(クローニングおよび配列決定)
乳酸デヒドロゲナーゼ(L−ldh)遺伝子、ホスホトランスアセチラーゼ(ptd)遺伝子およびアセテートキナーゼ(ack)遺伝子を、L−ldhについてこれまでに報告されたような標準的な方法(Desai、2004)を用いて、同定および配列決定した。CODE−HOPアルゴリズム(Rose,T.;Schultz,E.;Henikoff,J.;Pietrokovski,S.;McCallum,C.;Henikoff,S.「Consensus−degenerate hybrid oligonucleotide primers for amplification of distantly−related sequences」Nucleic Acids Research,26(7):1628−1635,1998年4月1日)を用いて変質プライマーを作製し、そして、PCR反応を行って、保存された領域の間のDNA配列を得た。この保存された領域の外側の遺伝子フラグメントを、BigDye Terminatorキットv3.1(ABI,Foster City,CA)と共にThermoFidelase(Fidelity Systems,Gaithersburg,MD)酵素を用いて、ゲノムDNAから直接配列決定した。
【0030】
(適切なベクターの構築)
(アセテートキナーゼおよびホスホトランスアセチラーゼノックアウトベクター、pSGD9)
標準的なクローニング技術に従った(Sambrook)。6.2kbの自殺ベクターpSGD9は、pBLUESCRIPT II SK(+)(Stratagene)に基づき、これまでに報告されたものに類似する設計アプローチを用いた(Desai、2004;Mai、2000)。pta/ack配列の遺伝子フラグメント(pta−上流(約1.2kb)およびack−下流(約0.6kb))を、配列番号1〜2および配列番号3〜4のプライマー対を用いて、ゲノムDNAから増幅した。pfu DNAポリメラーゼを用いてPCR増幅を行い、そして、このフラグメントを、1%電気泳動ゲルから抽出した。次いで、このフラグメント(pta−上流およびack−下流)に、Taqポリメラーゼを用いてAテイルを付加し、そして、TOPO pCR2.1(Invitrogen,Carlsbad,CA)にクローニングした。pIKM1のPstI/XbaI消化からカナマイシンマーカーを含む1.5kbフラグメントを得て、これをpBLUESCRIPT II SK(+)にサブクローニングした。pta−上流を含むTOPOを、XhoI/BsiHKAIで消化し、そしてこれを、PstI/XbaI消化したpBLUESCRIPT II SK(+)の、先にサブクローニングしたカナマイシンマーカーの上流にサブクローニングした。ack−下流を含むTOPOを、XbaI/SphIで消化し、そしてこれを、pUC19(Invitrogen)にサブクローニングした。ack−下流を含むXbal/AflIIIフラグメントを消化し、そしてこれをカナマイシンマーカーの下流にサブクローニングして、最終構築物であるpSGD9を得た。
【0031】
(エリスロマイシン耐性を有する乳酸デヒドロゲナーゼノックアウトベクター、pSGD8−Erm)
5.5kbの自殺ベクターpSGD−Ermは、Desaiら、2004によって生成されたようなプラスミドpSGD8に基づいた。aphカナマイシン抗生物質マーカーの代わりに、pIKM1に由来するaphプロモーターと、プラスミドpCTC1(Klapatch,T.R.;Guerinot,M.L.;Lynd,L.R.「Electrotransformation of Clostridium thermosaccharolyticum」、J.Ind.Microbiol.16(6):342−7,1996年6月)に由来するエリスロマイシン耐性を付与するアデニンメチラーゼ遺伝子とに基づく融合遺伝子を選択のために使用した。pfuポリメラーゼ(Stategene)と、aphプロモーターについては配列番号5〜6のプライマーとを、そして、アデニンメチラーゼオープンリーディングフレームについては配列番号7〜8のプライマーとを用いて、PCR遺伝子フラグメントを作製した。このフラグメントを、XbaI/BamHI(aphフラグメント)およびBamHI/EcoRI(アデニンメチラーゼ)を用いて消化し、そして、pIKM1のマルチプルクローニングサイトにライゲーションした。次いで、この融合遺伝子を、BseRI/EcoRIで切除し、そして、同様に消化したpSGD8内にライゲーションした。
【0032】
(T.saccharolyticumの形質転換)
交換可能な2つの方法(第一の方法は、以前に記載された方法(Mai,V.;Lorenz,W.;Weigel,J.「Transformation of Thermoanaerobacterium sp.strain JW/SL−YS485 with plasmid PIKM1 conferring kanamycin resistance」FEMS Microbiol.Lett.148:163−167,1997)であり、第二の方法は、細胞の収穫後にいくつかの改変を加えたものであり、Clostridium thermocellumについて開発された方法に基づくもの(Tyurin,M.V.;Desai,S.G.;Lynd,L.R.「Electrotransformation of Clostridium thermocellum」Appl.Environ.Microbiol.70(2):883−890,2004)であった)を用いて、T.saccharolyticumの形質転換を行った。予め還元した培地DSMZ 122を用いて、55℃に維持したインキュベーター内の嫌気性の区画の内側に置いた滅菌の使い捨て培養チューブにおいて、細胞を一晩増殖させた。その後、細胞を、分けて、4μg/mlのイソニコチン酸ヒドラジド(イソニナイアシン)と共に培養し、最初の遅延期の後に、この培地に、細胞壁細胞壁弱化剤(cell wall weakening agent)(Hermans,J.;Boschloo,J.G.;de Bont,J.A.M.「Transformation of M. aurum by electroporation:the use of glycine,lysozyme and isonicotinic acid hydrazide in enhancing transformation efficiency」FEMS Microbiol.Lett.72,221−224,1990)を加えた。指数増殖期の細胞を収穫し、そして、予め還元し冷やした滅菌の200mMセロビオース溶液で洗浄し、そして、同じ溶液中に再懸濁して、氷上に維持した。細胞を収穫した後は、遠心分離の間の時間を含めていつ何時も、細胞を冷やした状態(約4℃)に維持することに最大の注意を払った。
【0033】
90μlの細胞懸濁液と、パルス波を加える直前に添加した2〜6μlのpSGD9またはpSDG8−Erm(1〜3μg)とから構成されるサンプルを、電気による形質転換用のキュベットとしてはたらく、2mlのポリプロピレン製の微小遠心分離使い捨てチューブ内に入れた。注文製のパルス発生器/チタン電極システムを用いて、10msに設定したパルス長を有する四角波を加えた。パルス電圧を200Vの増分で線形的に増加させるときの、細胞サンプルにおける電気穿孔(electropore)の形成に対応する電圧の閾値を、非線形の電流変化として評価した。所定のDNA濃度において、形質転換収量 対 細胞生存率の最良の比率を与えた特定の電圧(この特定の場合においては、25kV/cmであった)を使用した。パルス波を加えた細胞を、まず、500μlのDSM 122培地で希釈し、氷上に10分間保持し、次いで、55℃にて4〜6時間回復させた。回復させた後、pSGD9で形質転換した細胞を、75μg/mlのカナマイシンを含有する2%寒天培地と混合し、そして、ペトリ皿上に注ぎ、嫌気性ジャー内で4日間インキュベートした。pSGD8−Ermで形質転換した細胞を、48℃にて4〜6時間回復させ、そして、5μg/mlのエリスロマイシンを含有するpH6.0の2%寒天培地中、または、類似の液体培地中のいずれかにプレーティングし、そして、48℃の嫌気性ジャー内で6日間インキュベートした。形質転換した細胞株のいずれかを、さらに操作することなく使用し得る。しかし、第二の(次の)形質転換を行うことによって、有機酸を生成する能力を付与する全ての遺伝子の発現を排除した生物を得た。この第二の形質転換は、形質転換していない細胞の懸濁物を、最初の形質転換体で置き換えて、上記のようにして行った。第二の形質転換体であるALK1を、カナマイシンおよびエリスロマイシンの両方を含有する培地において増殖させた。
【0034】
(ノックアウト領域の配列決定)
部位特定ノックアウト領域の配列決定を、Taqポリメラーゼ(New England Biolabs)、および、ゲノムと自殺ベクターとの間の相同性のオーバーラップ領域の外側のプライマーを用いる、ゲノムDNAからのPCRにより行った。BigDye Terminatorキットv3.1(ABI,Poster City,CA)を用いた配列決定のために、PCR生成物の内側のプライマーを用いた。CAP3ソフトウェアプログラム(Huang,X.「An improved sequence assembly program」Genomics 33:21−31,1996)を用いてこれらの領域を整え、そして、CLUSTALWアルゴリズム(Higgins,D.G.;Bleasby,A.J.;Fuchs,R.「CLUSTAL V:improved software for multiple sequence alignment」Computer Applications in the Biosciences(CABIOS),8(2):189−191,1992)を用いて予想されるDNA配列と比較した。実験的に編成した配列と、公知の野生型および自殺ベクターの配列を元にした予想配列との間には、高い程度の相同性(同一性%)が存在した(図3および4)。
【0035】
「同一性」とは、核酸分子対またはアミノ酸分子対の間の比較をいう。配列同一性を決定するための方法は公知である。例えば、この目的のために一般に用いられるコンピュータープログラム(例えば、SmithおよびWaterman、1981,Adv.Appl.Math.2:482−489のアルゴリズムを使用するGapプログラム(Wisconsin Sequence Analysis Package,Version 8 for Unix(登録商標),Genetics Computer Group,University Research Park,Madison Wisconsin))を参照のこと。
【0036】
(変異株の検証)
変異株Thermoanaerobacterium saccharolyticum JW/SL−YS485 ALK1(「ALK1」)由来のゲノムDNAは、DNA配列決定により、L−ldhおよびpta/ack遺伝子座において予想された部位特定相同組換えを示した。両方の組込み事象は、二重組込みであり、これは、より遺伝的に安定な遺伝子型である。
【0037】
(実施例2 ALK1および野生型T.saccharolyticumによるエタノールの生成を示す比較データ)
T.saccharolyticumを、2.5g/Lの酵母抽出物を含有する部分的に規定されたMTC培地(Zhang,Y.;Lynd,L.R.「Quantification of cell and cellulase mass concentrations during anaerobic cellulose fermentation:development of an enzyme−linked immunosorbent assay−based method with application to Clostridium thermocellum batch cultures」Anal.Chem.75:219−222,2003)中で増殖させた。グルコース、キシロース、酢酸、乳酸およびエタノールを、55℃においてAminex 87Hカラム(BioRad Laboratories,Hercules,CA)上のHPLCにより分析した。移動相は、5mM スルホン酸から構成され、流速は0.7ml/分であった。Waters 410屈折計(Milford,MA)を用いて、屈折率により検出を行った。酢酸についての最小の検出レベルは1.0mMであった。5g/Lのキシロース、5g/Lの乳酸、5g/Lの酢酸および5g/Lのエタノールを含有する標準追跡物を、図5に示す。
【0038】
ALK1株は、17g/Lまでのキシロース、または、5g/Lのキシロースおよび5g/Lのグルコースを含むエタノールのみを生成し、有機酸または他の生成物はHPLCにより検出されなかった。図6は、ALK1株の0時間における醗酵を示し、そして、図7は、ALK1株の72時間における醗酵を示す。6.0の初期pH、55℃および100rpmでの、8g/LのMESで緩衝化したキシロース培地における、ALK1株および野生型の経時的な醗酵のプロットは、ALK1株が99%を超えるキシロースをエタノールへと変換し得ること(図8)、一方で、同じ条件下の野生型は、有機酸の生成に起因してpHの制限を受け、存在する全てのキシロースを消費できないこと(図9)を示す。野生型の生物は、0.15mMのエタノールを得、一方で、ALK1は、0.46mMのエタノールを得た。
【0039】
(実施例3 ALK1の進化)
図10に示されるように、補給する基質濃度を経時的に増加させる連続培養を利用して、ALK1に刺激を与えた。図10は、連続培養の間の、キシロース、キシルロースおよびエタノールの濃度を示す。このストレス−進化サイクルに対して1000時間を超えて曝露した後、改善された株ALK2を、醗酵培養液から単離した。ALK2は、大量培養中、50g/Lのキシロースにおいて増殖を開始し得た。図11は、ALK2株による醗酵の間のキシロース、有機酸、光学濃度(OD)およびエタノール濃度を示す。
【0040】
(ALK1の寄託)
ALK1は、American Type Culture Collection(Manassas,VA 20110−2209)に寄託されている。この寄託は、2005年11月1日になされ、特許寄託指定番号PTA−7206を受けた。この寄託は、ブダペスト条約の要件(寄託期間は、寄託の日から30年間、または最新の分譲請求後5年間、または、本願の出願から米国特許の強制力のある期間が満了するまで、のいずれか長い方であるべきである)に従ってなされた。ALK1は、寄託当局において生存できない状態となった場合には、補充される。
【0041】
特定の実施形態の説明は、一般的な概念を明らかにし、この一般的な概念は、他の者が、この一般的な概念から逸脱しない種々の用途または使用のために修正および/または適合し得る。したがって、このような適合および修正は、開示される実施形態の等価物の意味および範囲内であるものと理解されることが意図される。本明細書において使用される語法または用語法は、説明する目的のためのものであり、制限するものではないことが理解されるべきである。
【0042】
上記の実施例は、あらゆるグラム陽性細菌、特に、Thermoanaerobacter属のメンバー(Thermoanaerohacterium thermosulfurigenes、Thermoanaerobacterium aotearoense、Thermoanaerobacterium polysaccharolyticum、Thermoanaerobacterium zeae、Thermoanaerobacterium thermosaccharofyticumおよびThermoanaerobacterium xylanofyticumを含む)と共に使用するために適切に改変され得る。
【0043】
本願において言及される全ての参考文献は、まるで本明細書において完全に模写されるかのような程度まで、参考として援用される。
【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【技術分野】
【0001】
(関連出願)
本願は、米国特許出願第60/731,674号(2005年10月31日出願)および米国特許出願第60/796,380号(2006年5月1日出願)に対する優先権を主張し、これら特許出願の各々は、本明細書中に参考として援用される。
【0002】
(政府の権利)
本発明の進展に関する研究がNational Institute of Standards and Technology(NIST)契約番号60NANB1D0064によって資金援助されたので、米国政府は、本発明において一定を権利を有し得る。
【0003】
(背景)
(1.発明の分野)
本発明は、エタノールを生成するためのバイオマス処理の分野に関する。特に、種々のバイオマス由来の基質を消費しかつ高収量でエタノールを生成する新規な好熱性生物、ならびに上記生成のプロセスおよび上記生物の使用が開示される。
【背景技術】
【0004】
(2.関連技術の説明)
バイオマスは、安価でかつ容易に入手可能なセルロース分解基質の代表であり、この基質から糖が生成され得る。これら糖は、単独で使用されてもよいし、アルコールおよび他の生成物を生成するために醗酵されてもよい。生物変換生成物の中で、エタノールにおける関心は高い。なぜなら、エタノールは、再生可能家庭用燃料(renewable domestic fuel)として使用され得るからである。
【0005】
反応器設計、前処理プロトコールおよび分離技術の分野でかなりの研究が行われてきた。その結果、生物変換プロセスは、石油燃料技術と経済的に競争できる関係になっている。しかし、最大の費用削減は、2つ以上の処理工程を組み合わせたときに得られ得ると予測される。例えば、同時に存在する糖化と醗酵(SSF)、および同時に存在する糖化と並行醗酵(co−fermentation)(SSCF)プロセスとを併用すると、1つの反応器または連続処理装置において酵素的糖化工程と醗酵とが一体となって行われる。より短期間の発酵時間および資本金縮小に関連する費用削減に加えて、並行醗酵プロセスはまた、生成物収量の改善を提供し得る。なぜなら、別の方法では代謝的分解(metabolysis)または加水分解を阻害するレベルにまで蓄積してしまう特定の化合物が、並行醗酵生物によって消費されるからである。1つのこのような例において、β−グルコシダーゼは、グルコースの存在下でセロビオースを加水分解するのをやめてしまい、次には、セロビオースの蓄積が、セルロース分解を妨げる。セルロースおよびヘミセルロースの加水分解生成物の並行醗酵に伴うSSCFプロセスは、β−グルコシダーゼの加水分解活性を阻害しない1種以上の生成物へとグルコースを変換することによって、この課題を多少解決し得る。
【0006】
統合バイオプロセス処理(consolidated bioprocessing)(CBP)は、4つの生物媒介事象(biologically−mediated events)を伴う:(1)酵素生成、(2)基質加水分解、(3)ヘキソース醗酵および(4)ペントース醗酵。これら事象は、1つの工程において行われ得る。このストラテジーは、セルロースおよびヘミセルロースを利用する微生物を要する。CBP生物の開発は、専ら特定の目的のための(dedicated)処理工程において糖分解性酵素を生成するという、より従来のアプローチと比較して、潜在的に非常に多額の費用削減を生じ得る。1種より多い生物を利用して上記4つの生物媒介事象を達成するCBPプロセスは、統合バイオプロセス処理並行培養醗酵(consolidated bioprocessing co−culture fermentation)といわれる。
【0007】
いくらかの細菌は、ペントース糖をヘキソース糖に変換し、かつそのヘキソースを有機酸と解糖による他の生成物との混合物へと醗酵する能力を有する。上記解糖経路は、6炭のグルコース分子を2つの3炭素分子であるピルビン酸(pyruvate)に変換することで始まる。次いで、ピルビン酸は、乳酸デヒドロゲナーゼ(「ldh」)の作用によって乳酸へと変換され得るか、またはピルビン酸デヒドロゲナーゼもしくはピルビン酸−フェレドキシンオキシドレダクターゼの作用によってアセチルコエンザイムA(「アセチル−CoA」)へと変換され得る。アセチル−CoAはさらに、ホスホトランスアセチラーゼおよびアセテートキナーゼによって酢酸へと変換されるか、またはアセトアルデヒドデヒドロゲナーゼ(「AcDH」)およびアルコールデヒドロゲナーゼ(「adh」)によってエタノールへと還元される。全般的に、エタノール生成生物の能力は、エタノール以外の有機生成物の生成によって(特に、ピルビン酸から乳酸へのldh媒介変換によって、およびホスホトランスアセチラーゼおよびアセテートキナーゼによるアセチル−CoAから酢酸への変換によって)損なわれる。
【0008】
細菌の代謝的操作によって、好熱性嫌気性グラム陽性細菌T.saccharolyticumにおいて乳酸デヒドロゲナーゼのノックアウトが近年作り出された。非特許文献1を参照のこと。
【0009】
上記ldhのノックアウトは、当該分野においてある進歩を与えているものの、T.saccharolyticumのこの株が、有機酸(特に酢酸)を作り続ける点において、この生物のいくらかの用途にとっては問題である。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Desai,S.G.;Guerinot,M.L.;Lynd,L.R.「Cloning of L−lactate dehydrogenase and elimination of lactic acid production via gene knockout in Thermoanaerobacterium saccharolyticum JW/SL−YS485」Appl.Microbiol.Biotechnol.65:600−605,2004
【発明の概要】
【課題を解決するための手段】
【0011】
本発明の手段は、種々のバイオマス由来の物質を消費し、そして、理論収量に近いエタノールを生成する好熱性嫌気性細菌を提供することによって、当該分野においてある進歩を与え、上記に概説する問題を克服する。生物を使用してエタノールを生成するための方法もまた開示される。
【0012】
本明細書において報告される手段は、単独でまたは組み合わせてのいずれかでの種々の遺伝子のノックアウトをもたらし、ネイティブの生物におけるこのような遺伝子は、ノックアウトされなければ、有機酸の形成をもたらす。例えば、T.saccharolyticum JW/SL−YS485における(a)アセテートキナーゼおよび/またはホスホトランスアセチラーゼ、ならびに(b)乳酸デヒドロゲナーゼ(ldh)、アセテートキナーゼ(ack)およびホスホトランスアセチラーゼ(ptd)のノックアウトが存在し得る。本明細書において報告される結果は、T.saccharolyticumについてのものであるが、これらの方法および材料はまた、Thermoanaerobacterium thermosulfurigenes、Thermoanaerobacterium aotearoense、Thermoanaerobacterium polysaccharolyticum、Thermoanaerobacterium zeae、Thermoanaerobacterium thermosaccharolyticumおよびThermoanaerobacterium xylanolyticumを含むThermoanaerobacter属の他のメンバーにも適用される。これらの方法および材料は、代謝的操作された好熱性グラム陽性細菌の分野全般において有用である。
【0013】
1つの実施形態において、ピルビン酸デカルボキシラーゼを発現しない単離された生物は、セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する。
【0014】
1つの実施形態において、ネイティブの状態において、醗酵生成物として酢酸を生成する能力をグラム陽性細菌に付与する少なくとも1種の遺伝子を含むグラム陽性細菌は、この少なくとも1種の遺伝子の発現を排除するように形質転換される。この細菌は、Thermoanaerobacterium saccharofyticumのようなThermoanaerobacterであり得る。醗酵生成物として酢酸を生成する能力をグラム陽性細菌に付与する遺伝子は、アセテートキナーゼおよび/またはホスホトランスアセチラーゼの発現をコードし得る。
【0015】
別の実施形態において、グラム陽性細菌は、醗酵生成物として乳酸を生成する能力をグラム陽性細菌に付与する1種以上の遺伝子の発現を排除するようにさらに形質され得る。例えば、乳酸を生成する能力を付与する遺伝子は、乳酸デヒドロゲナーゼであり得る。
【0016】
1つの実施形態において、エタノールを生成するための方法は、ネイティブの生物を形質転換して、醗酵生成物として有機酸を生成する能力をグラム陽性細菌に付与する全ての遺伝子の発現を排除するように形質転換されたグラム陽性細菌を生成して、形質転換細菌宿主を生成する工程、ならびにこの形質転換細菌宿主を、グルコース、キシロース、セロビオース、スクロース、キシラン、澱粉およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、これらの基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程を包含する。
【0017】
1つの実施形態において、ALK1と称され、かつ特許寄託指定番号PTA−7206の下でATCCに寄託されている微生物の生物学的に純粋な培養物が記載される。
【0018】
1つの実施形態において、単離されたポリヌクレオチドは、(a)配列番号10の配列、または(b)配列番号9および配列番号10の配列、または(c)(a)もしくは(b)の配列に対して少なくとも約90%の配列同一性を有する配列を含む。(a)、(b)または(c)の単離されたポリヌクレオチドを含むベクター、ならびに、(a)、(b)または(c)の単離されたポリヌクレオチドの相補体を発現するように遺伝子操作された宿主細胞が記載される。別の実施形態において、単離されたポリヌクレオチドは、(a)または(b)の配列に対して少なくとも約95%の配列同一性を有する配列を含む。
【0019】
1つの実施形態において、エタノールを生成する方法は、(a)、(b)または(c)の単離されたポリヌクレオチドの相補体を発現する変異細菌を、グルコース、キシロース、セロビオース、スクロース、キシラン、澱粉およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、これらの基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程を包含する。
本発明はまた、以下の項目を提供する。
(項目1)
セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する単離された生物であって、該生物は、ピルビン酸デカルボキシラーゼを発現しない、単離された生物。
(項目2)
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、項目1に記載の単離された生物を生成し、形質転換宿主を提供する工程;ならびに
該形質転換宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目3)
形質転換生物であって、該形質転換生物は、
ネイティブの状態において、醗酵生成物として酢酸を生成する能力を付与する少なくとも1種の遺伝子を含むグラム陽性細菌
を含み、
該グラム陽性細菌は、該少なくとも1種の遺伝子の発現を排除するように形質転換されている、
形質転換生物。
(項目4)
上記グラム陽性細菌は、Thermoanaerobacter属のメンバーである、項目3に記載のグラム陽性細菌。
(項目5)
上記グラム陽性細菌は、Thermoanaerobacterium saccharolyticumである、項目3に記載のグラム陽性細菌。
(項目6)
上記少なくとも1種の遺伝子は、アセテートキナーゼの発現をコードする、項目3に記載のグラム陽性細菌。
(項目7)
上記少なくとも1種の遺伝子は、ホスホトランスアセチラーゼの発現をコードする、項目3に記載のグラム陽性細菌。
(項目8)
上記少なくとも1種の遺伝子は、複数種の遺伝子を含む、項目3に記載のグラム陽性細菌。
(項目9)
上記複数種の遺伝子は、アセテートキナーゼおよびホスホトランスアセチラーゼの発現をコードする、項目8に記載のグラム陽性細菌。
(項目10)
上記グラム陽性細菌に醗酵生成物として乳酸を生成する能力を付与する1種以上の遺伝子の発現を排除するように、さらに形質転換されている、項目9に記載のグラム陽性細菌。
(項目11)
上記グラム陽性細菌に醗酵生成物として乳酸を生成する能力を付与する1種以上の遺伝子の発現を排除するように、さらに形質転換されている、項目3に記載のグラム陽性細菌。
(項目12)
上記少なくとも1種の遺伝子は、乳酸デヒドロゲナーゼの発現をコードする、項目11に記載のグラム陽性細菌。
(項目13)
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、項目11に記載のグラム陽性細菌を生成し、形質転換細菌宿主を生成する工程;ならびに
該形質転換細菌宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目14)
上記細菌宿主は、Thermoanaerobacterium saccharolyticumである、項目13に記載の方法。
(項目15)
上記遺伝子は、乳酸デヒドロゲナーゼ、アセテートキナーゼ、およびホスホトランスアセチラーゼの発現をコードする、項目13に記載の方法。
(項目16)
ALK1と称されかつ特許寄託指定番号PTA−7206の下で寄託されている微生物の生物学的に純粋な培養物。
(項目17)
単離されたポリヌクレオチドであって、
(a)配列番号10の配列;
(b)配列番号9および配列番号10の配列;または
(c)(a)もしくは(b)の配列に対して少なくとも約90%の配列同一性を有する配列
を含む、単離されたポリヌクレオチド。
(項目18)
上記(a)または(b)の配列に対して約95%の配列同一性を有する、項目17に記載の単離されたポリヌクレオチド。
(項目19)
項目18に記載の単離されたポリヌクレオチドを含む、ベクター。
(項目20)
項目18に記載のポリヌクレオチドの相補体を発現するように遺伝子操作された宿主細胞。
(項目21)
上記宿主細胞は細菌細胞である、項目20に記載の宿主細胞。
(項目22)
エタノールを生成するための方法であって、該方法は、
項目21に記載の変異細菌を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、該基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
(項目23)
上記変異細菌は、Thermoanaerobacterium saccharolyticumである、項目22に記載の方法。
(項目24)
上記変異細菌は、Thermoanaerobacterium saccharolyticum ALK1(JW/SL−YS485 ALK1)である、項目23に記載の方法。
(項目25)
細菌において発現できるプロモーターに作動可能に連結された配列番号10を含む、遺伝子構築物。
(項目26)
項目25に記載の遺伝子構築物を含む、組換え細菌。
(項目27)
上記細菌は、Thermoanaerobacterium saccharolyticumである、項目26に記載の組換え細菌。
【図面の簡単な説明】
【0020】
【図1】図1は、解糖経路の反応を示す。
【図2】図2は、T.saccharolyticumの種々のノックアウト株と比較した、野生型のT.saccharolyticumにおける水素生成を示す。
【図3−1】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−2】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−3】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−4】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図3−5】図3は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD9のldh領域(配列番号9)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−1】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−2】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−3】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−4】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−5】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図4−6】図4は、T.saccharolyticumのゲノム内に挿入された自殺ベクターpSGD8−Ermのpta/ack領域(配列番号10)についての、実験により生成したポリヌクレオチド配列と、予想されるポリヌクレオチド配列との比較を示す。
【図5】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図6】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図7】図5〜7は、ALK1の増殖の間の、種々の時間間隔における醗酵培養液の高速液体クロマトグラフィー(HPLC)の追跡を示す。
【図8】図8は、ALK1株による醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図9】図9は、野生型T.saccharolyticumによる醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図10】図10は、ALK1の連続培養刺激の間の、キシロース、有機酸およびエタノールの濃度を示す。
【図11】図11は、ALK2株による醗酵の間の、キシロース、有機酸およびエタノールの濃度を示す。
【発明を実施するための形態】
【0021】
(詳細な説明)
ここで、バイオマスのエタノールへの変換において好熱性嫌気性グラム陽性細菌を操作および利用するための方法が示され、かつ記載される。
【0022】
本明細書において使用される場合、生物は、その生物の遺伝子および/または表現型の構成を意図的に変更する様式で人間の手によって遺伝子操作または他の方法で操作されていない場合、「ネイティブの状態」にある。例えば、野生型の生物は、ネイティブの状態にあると考えられ得る。
【0023】
ネイティブの状態のT.saccharolyticumからの有機酸の生成の完全なる排除は、2回の部位特定DNA相同組換え事象を用いて達成された。変異株であるThermoanaerobacterium saccharolyticum JW/SL−YS485 ALK1(「ALK1」)は、約30℃〜66℃の範囲の温度および約3.85〜6.5の範囲のpHの大量培養において、少ない基質の補給で、理論量に近いエタノールを生成する。1つの実施形態において、エタノール収量は、理論最大量の少なくとも約90%である。ALK1およびその子孫(decendent)は、その増殖条件に起因して、リグノセルロース系(lignocellulosic)バイオマスからのエタノールへの変換において有意な費用削減に寄与する潜在能力を有する。この増殖条件は、同時に存在する糖化および平行醗酵(SSCF)プロセスにおけるセルラーゼ活性が実質的に最適である。例えば、最適なセルラーゼ活性のパラーメータとしては、4〜5の間のpHと40℃〜50℃の間の温度が挙げられる。さらに、有機酸を生成する能力を欠くノックアウト生物が使用される場合は、醗酵培養液のpHを調整する必要はない。ALK1および類似する生物はまた、統合バイオプロセス処理並行培養醗酵に適切であり得、この統合バイオプロセス処理並行培養醗酵においては、ノックアウト生物が、ペントースをエタノールへと変換し、そして、セルロースが、C.thermocellumのようなセルロース加水分解生物によって分解される。
【0024】
好熱性の温度においてSSCFプロセスまたはCBPプロセスのいずれかを行うことにより、3従来の0℃〜37℃の中温性の醗酵温度を上回るいくつかの重要な利益が提供される。特に、セルラーゼ生成専用のプロセス工程のための費用が、好熱性のSSCFについては実質的に削減され(例えば、2倍以上)、そして、CBPについては排除される。醗酵槽(fermentor)の冷却そしてまた醗酵前後の熱交換に付随する費用もまた、好熱性のSSCFおよびCBPの両方について削減されることが予想される。最後に、好熱性の生体触媒を特徴とするプロセスは、従来の中温性の生体触媒を特徴とするプロセスと比較して、細菌混入に対する感受性が低下し得る。
【0025】
天然に存在するSaccharomyces cerevisiaeおよびZymomonas mobilis、ならびに、Escherchia coliおよびKlebsiella oxytocaの組換え株のような公知の「ホモエタノール醗酵」微生物とは対照的に、本明細書により開示される生物は、ピルビン酸デカルボキシラーゼの作用によるピルビン酸のアセトアルデヒドへの変換に依存しない(図1、9)。実際、Thermoanaerobacter属に属する細菌は、ネイティブの状態でピルビン酸デカルボキシラーゼを発現しない。図1に示す解糖経路の反応から、酵素ピルビン酸−フェレドキシンオキシドレダクターゼ(2)によって、ピルビン酸がアセチル−CoA、二酸化炭素および還元フェレドキシンへと代謝され得ることが観察され得る。しかし、エタノールを唯一の醗酵生成物として生成するために、NAD:フェレドキシンオキシドレダクターゼ(3)によって、還元フェレドキシンにより運搬される電子が全て、NADへと転移され、NADHAを形成しなければならない。NADHは、その後、アセトアルデヒドデヒドロゲナーゼ(7)、およびアルコールデヒドロゲナーゼ(8)によるアセチル−CoAのエタノールへの2段階の還元の過程で、酸化されてNADへと戻る。NADHの効率的な利用の証拠は、図2において、ackおよびptaを発現できないアセテートノックアウト生物と、ack、ptaおよびldhを発現できない二重ノックアウト生物(ALK1)との両方によるH2生成の減少として、観察され得る。これらの生物は、還元フェレドキシンからNADへの、そして、その後のエタノールへの化学量論に関する電子の転移という第一の論証を提供する。
【0026】
PDCを発現する能力を有さない生物において化学量論に関するエタノール収量を生成する上記の経路は、これまでに記載されてきたホモエタノール醗酵株において用いられる経路とは対照的である。これまでに記載されてきた株は、内因性のピルビン酸デカルボキシラーゼ(PDC)を利用するか、または、外因性のPDCを発現するように操作される。PDCの発現は、微生物界においては稀なことであるので、改変によって、電子の流れを炭素の流れへと方向を変える能力は、広範な影響を有する。例えば、このアプローチは、T.saccharotyticum以外の株において高いエタノール収量を生成するため、そして/または、エタノール以外の溶媒を生成するために使用され得る。特に、Thermoanaerober属のメンバー;Clostridium thermocellumならびに他の好熱性および中温性のClostridia種;好熱性および中温性のBacillus種のようなグラム陽性細菌;Escherichia coliおよびKlebsiella oxytoca;Fihrobacter succinogenesおよび他のFibrobacter種;Thermoga neopolitanaおよび他のThermotoga種;ならびに嫌気性菌門(Neocallimatix種およびPiromyces種を含む)のようなグラム陰性細菌は、PDCを発現する能力を欠き、そして、開示される手段から利益を受け得る。
【0027】
リグノセルロース系の物質が、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナンおよび澱粉のうちの1種以上を含有する任意の補給ストックであり得ることが理解される。種々の実施形態において、リグノセルロース系バイオマスは、木、トウモロコシ飼料、おが屑、樹皮、葉、農林業の残留物、アメリカクサキビのような草、反芻動物の消化産物、市の廃棄物、製紙工場の流出物、新聞紙、ボール紙、またはこれらの組み合わせを含む。
【実施例】
【0028】
(実施例1 ALK1株の生成)
(材料および方法)
Thermoanaerobacterium saccharolyticum株であるJW/SL−YS485(DSM 8691)は、West Thumb Basin in Yellowstone National Park, Wyomingから単離された好熱性嫌気性細菌である(Lui,S.Y.;Gherardini,F.C.;Matuschek,M.;Bahl,H.;Wiegel,J.「Cloning,sequencing,and expression of the gene encoding a large S−layer−associated endoxylanase from Thermoanaerobacterium sp strain JW/SL−YS485 in Escherichia coli」J.Bacteriol.178:1539−1547,1996;Mai,V.;Wiegel,J.「Advances in development of a genetic system for Thermoanaerobacterium spp:Expression of genes encoding hydrolytic enzymes,development of a second shuttle vector,and integration of genes into the chromosome」Appl.Environ.Microbiol.66:4817−4821,2000)。この株は、30℃〜66℃の範囲の温度および3.85〜6.5の範囲のpHにおいて増殖する。この株は、単糖類であるグルコースおよびキシロース、二糖類であるセロビオースおよびスクロース、ならびに、多糖類であるキシランおよび澱粉を含めた、種々のバイオマス由来の基質を消費するが、セルロースは消費しない。この生物は、エタノール、ならびに、有機酸である乳酸および酢酸を、一次醗酵生成物として生成する。
【0029】
(クローニングおよび配列決定)
乳酸デヒドロゲナーゼ(L−ldh)遺伝子、ホスホトランスアセチラーゼ(ptd)遺伝子およびアセテートキナーゼ(ack)遺伝子を、L−ldhについてこれまでに報告されたような標準的な方法(Desai、2004)を用いて、同定および配列決定した。CODE−HOPアルゴリズム(Rose,T.;Schultz,E.;Henikoff,J.;Pietrokovski,S.;McCallum,C.;Henikoff,S.「Consensus−degenerate hybrid oligonucleotide primers for amplification of distantly−related sequences」Nucleic Acids Research,26(7):1628−1635,1998年4月1日)を用いて変質プライマーを作製し、そして、PCR反応を行って、保存された領域の間のDNA配列を得た。この保存された領域の外側の遺伝子フラグメントを、BigDye Terminatorキットv3.1(ABI,Foster City,CA)と共にThermoFidelase(Fidelity Systems,Gaithersburg,MD)酵素を用いて、ゲノムDNAから直接配列決定した。
【0030】
(適切なベクターの構築)
(アセテートキナーゼおよびホスホトランスアセチラーゼノックアウトベクター、pSGD9)
標準的なクローニング技術に従った(Sambrook)。6.2kbの自殺ベクターpSGD9は、pBLUESCRIPT II SK(+)(Stratagene)に基づき、これまでに報告されたものに類似する設計アプローチを用いた(Desai、2004;Mai、2000)。pta/ack配列の遺伝子フラグメント(pta−上流(約1.2kb)およびack−下流(約0.6kb))を、配列番号1〜2および配列番号3〜4のプライマー対を用いて、ゲノムDNAから増幅した。pfu DNAポリメラーゼを用いてPCR増幅を行い、そして、このフラグメントを、1%電気泳動ゲルから抽出した。次いで、このフラグメント(pta−上流およびack−下流)に、Taqポリメラーゼを用いてAテイルを付加し、そして、TOPO pCR2.1(Invitrogen,Carlsbad,CA)にクローニングした。pIKM1のPstI/XbaI消化からカナマイシンマーカーを含む1.5kbフラグメントを得て、これをpBLUESCRIPT II SK(+)にサブクローニングした。pta−上流を含むTOPOを、XhoI/BsiHKAIで消化し、そしてこれを、PstI/XbaI消化したpBLUESCRIPT II SK(+)の、先にサブクローニングしたカナマイシンマーカーの上流にサブクローニングした。ack−下流を含むTOPOを、XbaI/SphIで消化し、そしてこれを、pUC19(Invitrogen)にサブクローニングした。ack−下流を含むXbal/AflIIIフラグメントを消化し、そしてこれをカナマイシンマーカーの下流にサブクローニングして、最終構築物であるpSGD9を得た。
【0031】
(エリスロマイシン耐性を有する乳酸デヒドロゲナーゼノックアウトベクター、pSGD8−Erm)
5.5kbの自殺ベクターpSGD−Ermは、Desaiら、2004によって生成されたようなプラスミドpSGD8に基づいた。aphカナマイシン抗生物質マーカーの代わりに、pIKM1に由来するaphプロモーターと、プラスミドpCTC1(Klapatch,T.R.;Guerinot,M.L.;Lynd,L.R.「Electrotransformation of Clostridium thermosaccharolyticum」、J.Ind.Microbiol.16(6):342−7,1996年6月)に由来するエリスロマイシン耐性を付与するアデニンメチラーゼ遺伝子とに基づく融合遺伝子を選択のために使用した。pfuポリメラーゼ(Stategene)と、aphプロモーターについては配列番号5〜6のプライマーとを、そして、アデニンメチラーゼオープンリーディングフレームについては配列番号7〜8のプライマーとを用いて、PCR遺伝子フラグメントを作製した。このフラグメントを、XbaI/BamHI(aphフラグメント)およびBamHI/EcoRI(アデニンメチラーゼ)を用いて消化し、そして、pIKM1のマルチプルクローニングサイトにライゲーションした。次いで、この融合遺伝子を、BseRI/EcoRIで切除し、そして、同様に消化したpSGD8内にライゲーションした。
【0032】
(T.saccharolyticumの形質転換)
交換可能な2つの方法(第一の方法は、以前に記載された方法(Mai,V.;Lorenz,W.;Weigel,J.「Transformation of Thermoanaerobacterium sp.strain JW/SL−YS485 with plasmid PIKM1 conferring kanamycin resistance」FEMS Microbiol.Lett.148:163−167,1997)であり、第二の方法は、細胞の収穫後にいくつかの改変を加えたものであり、Clostridium thermocellumについて開発された方法に基づくもの(Tyurin,M.V.;Desai,S.G.;Lynd,L.R.「Electrotransformation of Clostridium thermocellum」Appl.Environ.Microbiol.70(2):883−890,2004)であった)を用いて、T.saccharolyticumの形質転換を行った。予め還元した培地DSMZ 122を用いて、55℃に維持したインキュベーター内の嫌気性の区画の内側に置いた滅菌の使い捨て培養チューブにおいて、細胞を一晩増殖させた。その後、細胞を、分けて、4μg/mlのイソニコチン酸ヒドラジド(イソニナイアシン)と共に培養し、最初の遅延期の後に、この培地に、細胞壁細胞壁弱化剤(cell wall weakening agent)(Hermans,J.;Boschloo,J.G.;de Bont,J.A.M.「Transformation of M. aurum by electroporation:the use of glycine,lysozyme and isonicotinic acid hydrazide in enhancing transformation efficiency」FEMS Microbiol.Lett.72,221−224,1990)を加えた。指数増殖期の細胞を収穫し、そして、予め還元し冷やした滅菌の200mMセロビオース溶液で洗浄し、そして、同じ溶液中に再懸濁して、氷上に維持した。細胞を収穫した後は、遠心分離の間の時間を含めていつ何時も、細胞を冷やした状態(約4℃)に維持することに最大の注意を払った。
【0033】
90μlの細胞懸濁液と、パルス波を加える直前に添加した2〜6μlのpSGD9またはpSDG8−Erm(1〜3μg)とから構成されるサンプルを、電気による形質転換用のキュベットとしてはたらく、2mlのポリプロピレン製の微小遠心分離使い捨てチューブ内に入れた。注文製のパルス発生器/チタン電極システムを用いて、10msに設定したパルス長を有する四角波を加えた。パルス電圧を200Vの増分で線形的に増加させるときの、細胞サンプルにおける電気穿孔(electropore)の形成に対応する電圧の閾値を、非線形の電流変化として評価した。所定のDNA濃度において、形質転換収量 対 細胞生存率の最良の比率を与えた特定の電圧(この特定の場合においては、25kV/cmであった)を使用した。パルス波を加えた細胞を、まず、500μlのDSM 122培地で希釈し、氷上に10分間保持し、次いで、55℃にて4〜6時間回復させた。回復させた後、pSGD9で形質転換した細胞を、75μg/mlのカナマイシンを含有する2%寒天培地と混合し、そして、ペトリ皿上に注ぎ、嫌気性ジャー内で4日間インキュベートした。pSGD8−Ermで形質転換した細胞を、48℃にて4〜6時間回復させ、そして、5μg/mlのエリスロマイシンを含有するpH6.0の2%寒天培地中、または、類似の液体培地中のいずれかにプレーティングし、そして、48℃の嫌気性ジャー内で6日間インキュベートした。形質転換した細胞株のいずれかを、さらに操作することなく使用し得る。しかし、第二の(次の)形質転換を行うことによって、有機酸を生成する能力を付与する全ての遺伝子の発現を排除した生物を得た。この第二の形質転換は、形質転換していない細胞の懸濁物を、最初の形質転換体で置き換えて、上記のようにして行った。第二の形質転換体であるALK1を、カナマイシンおよびエリスロマイシンの両方を含有する培地において増殖させた。
【0034】
(ノックアウト領域の配列決定)
部位特定ノックアウト領域の配列決定を、Taqポリメラーゼ(New England Biolabs)、および、ゲノムと自殺ベクターとの間の相同性のオーバーラップ領域の外側のプライマーを用いる、ゲノムDNAからのPCRにより行った。BigDye Terminatorキットv3.1(ABI,Poster City,CA)を用いた配列決定のために、PCR生成物の内側のプライマーを用いた。CAP3ソフトウェアプログラム(Huang,X.「An improved sequence assembly program」Genomics 33:21−31,1996)を用いてこれらの領域を整え、そして、CLUSTALWアルゴリズム(Higgins,D.G.;Bleasby,A.J.;Fuchs,R.「CLUSTAL V:improved software for multiple sequence alignment」Computer Applications in the Biosciences(CABIOS),8(2):189−191,1992)を用いて予想されるDNA配列と比較した。実験的に編成した配列と、公知の野生型および自殺ベクターの配列を元にした予想配列との間には、高い程度の相同性(同一性%)が存在した(図3および4)。
【0035】
「同一性」とは、核酸分子対またはアミノ酸分子対の間の比較をいう。配列同一性を決定するための方法は公知である。例えば、この目的のために一般に用いられるコンピュータープログラム(例えば、SmithおよびWaterman、1981,Adv.Appl.Math.2:482−489のアルゴリズムを使用するGapプログラム(Wisconsin Sequence Analysis Package,Version 8 for Unix(登録商標),Genetics Computer Group,University Research Park,Madison Wisconsin))を参照のこと。
【0036】
(変異株の検証)
変異株Thermoanaerobacterium saccharolyticum JW/SL−YS485 ALK1(「ALK1」)由来のゲノムDNAは、DNA配列決定により、L−ldhおよびpta/ack遺伝子座において予想された部位特定相同組換えを示した。両方の組込み事象は、二重組込みであり、これは、より遺伝的に安定な遺伝子型である。
【0037】
(実施例2 ALK1および野生型T.saccharolyticumによるエタノールの生成を示す比較データ)
T.saccharolyticumを、2.5g/Lの酵母抽出物を含有する部分的に規定されたMTC培地(Zhang,Y.;Lynd,L.R.「Quantification of cell and cellulase mass concentrations during anaerobic cellulose fermentation:development of an enzyme−linked immunosorbent assay−based method with application to Clostridium thermocellum batch cultures」Anal.Chem.75:219−222,2003)中で増殖させた。グルコース、キシロース、酢酸、乳酸およびエタノールを、55℃においてAminex 87Hカラム(BioRad Laboratories,Hercules,CA)上のHPLCにより分析した。移動相は、5mM スルホン酸から構成され、流速は0.7ml/分であった。Waters 410屈折計(Milford,MA)を用いて、屈折率により検出を行った。酢酸についての最小の検出レベルは1.0mMであった。5g/Lのキシロース、5g/Lの乳酸、5g/Lの酢酸および5g/Lのエタノールを含有する標準追跡物を、図5に示す。
【0038】
ALK1株は、17g/Lまでのキシロース、または、5g/Lのキシロースおよび5g/Lのグルコースを含むエタノールのみを生成し、有機酸または他の生成物はHPLCにより検出されなかった。図6は、ALK1株の0時間における醗酵を示し、そして、図7は、ALK1株の72時間における醗酵を示す。6.0の初期pH、55℃および100rpmでの、8g/LのMESで緩衝化したキシロース培地における、ALK1株および野生型の経時的な醗酵のプロットは、ALK1株が99%を超えるキシロースをエタノールへと変換し得ること(図8)、一方で、同じ条件下の野生型は、有機酸の生成に起因してpHの制限を受け、存在する全てのキシロースを消費できないこと(図9)を示す。野生型の生物は、0.15mMのエタノールを得、一方で、ALK1は、0.46mMのエタノールを得た。
【0039】
(実施例3 ALK1の進化)
図10に示されるように、補給する基質濃度を経時的に増加させる連続培養を利用して、ALK1に刺激を与えた。図10は、連続培養の間の、キシロース、キシルロースおよびエタノールの濃度を示す。このストレス−進化サイクルに対して1000時間を超えて曝露した後、改善された株ALK2を、醗酵培養液から単離した。ALK2は、大量培養中、50g/Lのキシロースにおいて増殖を開始し得た。図11は、ALK2株による醗酵の間のキシロース、有機酸、光学濃度(OD)およびエタノール濃度を示す。
【0040】
(ALK1の寄託)
ALK1は、American Type Culture Collection(Manassas,VA 20110−2209)に寄託されている。この寄託は、2005年11月1日になされ、特許寄託指定番号PTA−7206を受けた。この寄託は、ブダペスト条約の要件(寄託期間は、寄託の日から30年間、または最新の分譲請求後5年間、または、本願の出願から米国特許の強制力のある期間が満了するまで、のいずれか長い方であるべきである)に従ってなされた。ALK1は、寄託当局において生存できない状態となった場合には、補充される。
【0041】
特定の実施形態の説明は、一般的な概念を明らかにし、この一般的な概念は、他の者が、この一般的な概念から逸脱しない種々の用途または使用のために修正および/または適合し得る。したがって、このような適合および修正は、開示される実施形態の等価物の意味および範囲内であるものと理解されることが意図される。本明細書において使用される語法または用語法は、説明する目的のためのものであり、制限するものではないことが理解されるべきである。
【0042】
上記の実施例は、あらゆるグラム陽性細菌、特に、Thermoanaerobacter属のメンバー(Thermoanaerohacterium thermosulfurigenes、Thermoanaerobacterium aotearoense、Thermoanaerobacterium polysaccharolyticum、Thermoanaerobacterium zeae、Thermoanaerobacterium thermosaccharofyticumおよびThermoanaerobacterium xylanofyticumを含む)と共に使用するために適切に改変され得る。
【0043】
本願において言及される全ての参考文献は、まるで本明細書において完全に模写されるかのような程度まで、参考として援用される。
【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【特許請求の範囲】
【請求項1】
セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する単離された生物であって、該生物は、ピルビン酸デカルボキシラーゼを発現せず、少なくとも2つの遺伝子が該生物において破壊されており、該少なくとも2つの遺伝子は、ホスホトランスアセチラーゼ(pta)遺伝子、およびアセテートキナーゼ(ack)遺伝子を含む、単離された生物。
【請求項2】
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、請求項1に記載の単離された生物を生成し、形質転換宿主を提供する工程;ならびに
該形質転換宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項3】
形質転換生物であって、該形質転換生物は、
ネイティブの状態において、醗酵生成物として酢酸を生成する能力を付与する2以上の遺伝子を含むグラム陽性細菌
を含み、
該グラム陽性細菌は、該2以上の遺伝子の発現を排除するように形質転換されており、該2以上の遺伝子は、アセテートキナーゼ(ack)およびホスホトランスアセチラーゼ(pta)をコードする、
形質転換生物。
【請求項4】
前記グラム陽性細菌は、サーモアネロバクター(Thermoanaerobacter)属のメンバーである、請求項3に記載のグラム陽性細菌。
【請求項5】
前記グラム陽性細菌は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項3に記載のグラム陽性細菌。
【請求項6】
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、請求項3に記載のグラム陽性細菌を生成し、形質転換細菌宿主を生成する工程;ならびに
該形質転換細菌宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項7】
前記細菌宿主は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項6に記載の方法。
【請求項8】
ALK2と称されかつ特許寄託指定番号PTA−12025の下で寄託されている微生物の生物学的に純粋な培養物。
【請求項9】
単離されたポリヌクレオチドであって、
(a)配列番号10の配列;
(b)配列番号9および配列番号10の配列;または
(c)(a)または(b)の配列に対して少なくとも90%の配列同一性を有する配列
を含む、単離されたポリヌクレオチド。
【請求項10】
前記(a)または(b)の配列に対して少なくとも95%の配列同一性を有する、請求項9に記載の単離されたポリヌクレオチド。
【請求項11】
請求項9または10に記載の単離されたポリヌクレオチドを含む、ベクター。
【請求項12】
請求項9または10に記載のポリヌクレオチドに含まれるコード配列を発現するように遺伝子操作された宿主細胞。
【請求項13】
前記宿主細胞は細菌細胞である、請求項12に記載の宿主細胞。
【請求項14】
エタノールを生成するための方法であって、該方法は、
請求項13に記載の宿主細胞を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、該基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項15】
前記宿主細胞は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項14に記載の方法。
【請求項16】
前記宿主細胞は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum) ALK2(JW/SL−YS485 ALK2)である、請求項15に記載の方法。
【請求項1】
セルロース分解基質を醗酵して、理論収量の少なくとも90%である濃度においてエタノールを生成する単離された生物であって、該生物は、ピルビン酸デカルボキシラーゼを発現せず、少なくとも2つの遺伝子が該生物において破壊されており、該少なくとも2つの遺伝子は、ホスホトランスアセチラーゼ(pta)遺伝子、およびアセテートキナーゼ(ack)遺伝子を含む、単離された生物。
【請求項2】
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、請求項1に記載の単離された生物を生成し、形質転換宿主を提供する工程;ならびに
該形質転換宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項3】
形質転換生物であって、該形質転換生物は、
ネイティブの状態において、醗酵生成物として酢酸を生成する能力を付与する2以上の遺伝子を含むグラム陽性細菌
を含み、
該グラム陽性細菌は、該2以上の遺伝子の発現を排除するように形質転換されており、該2以上の遺伝子は、アセテートキナーゼ(ack)およびホスホトランスアセチラーゼ(pta)をコードする、
形質転換生物。
【請求項4】
前記グラム陽性細菌は、サーモアネロバクター(Thermoanaerobacter)属のメンバーである、請求項3に記載のグラム陽性細菌。
【請求項5】
前記グラム陽性細菌は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項3に記載のグラム陽性細菌。
【請求項6】
エタノールを生成するための方法であって、該方法は、
ネイティブの生物を形質転換して、請求項3に記載のグラム陽性細菌を生成し、形質転換細菌宿主を生成する工程;ならびに
該形質転換細菌宿主を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される物質を含む基質を含有する培地中で、該基質の糖化および醗酵を可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項7】
前記細菌宿主は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項6に記載の方法。
【請求項8】
ALK2と称されかつ特許寄託指定番号PTA−12025の下で寄託されている微生物の生物学的に純粋な培養物。
【請求項9】
単離されたポリヌクレオチドであって、
(a)配列番号10の配列;
(b)配列番号9および配列番号10の配列;または
(c)(a)または(b)の配列に対して少なくとも90%の配列同一性を有する配列
を含む、単離されたポリヌクレオチド。
【請求項10】
前記(a)または(b)の配列に対して少なくとも95%の配列同一性を有する、請求項9に記載の単離されたポリヌクレオチド。
【請求項11】
請求項9または10に記載の単離されたポリヌクレオチドを含む、ベクター。
【請求項12】
請求項9または10に記載のポリヌクレオチドに含まれるコード配列を発現するように遺伝子操作された宿主細胞。
【請求項13】
前記宿主細胞は細菌細胞である、請求項12に記載の宿主細胞。
【請求項14】
エタノールを生成するための方法であって、該方法は、
請求項13に記載の宿主細胞を、グルコース、キシロース、マンノース、アラビノース、ガラクトース、フルクトース、セロビオース、スクロース、マルトース、キシラン、マンナン、澱粉、およびこれらの組み合わせからなる群より選択される基質を含有する培地中で、該基質をエタノールへと醗酵させることを可能にするに十分な期間にわたって適した条件下で培養する工程、
を包含する、方法。
【請求項15】
前記宿主細胞は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum)である、請求項14に記載の方法。
【請求項16】
前記宿主細胞は、サーモアネロバクテリウム・サッカロリティカム(Thermoanaerobacterium saccharolyticum) ALK2(JW/SL−YS485 ALK2)である、請求項15に記載の方法。
【図1】


【図2】


【図3−1】


【図3−2】


【図3−3】


【図3−4】


【図3−5】


【図4−1】


【図4−2】


【図4−3】


【図4−4】


【図4−5】


【図4−6】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3−1】


【図3−2】


【図3−3】


【図3−4】


【図3−5】


【図4−1】


【図4−2】


【図4−3】


【図4−4】


【図4−5】


【図4−6】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2012−187121(P2012−187121A)
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−141137(P2012−141137)
【出願日】平成24年6月22日(2012.6.22)
【分割の表示】特願2008−538101(P2008−538101)の分割
【原出願日】平成18年10月31日(2006.10.31)
【出願人】(504303713)ザ トラスティーズ オブ ダートマウス カレッジ (12)
【Fターム(参考)】
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2012−141137(P2012−141137)
【出願日】平成24年6月22日(2012.6.22)
【分割の表示】特願2008−538101(P2008−538101)の分割
【原出願日】平成18年10月31日(2006.10.31)
【出願人】(504303713)ザ トラスティーズ オブ ダートマウス カレッジ (12)
【Fターム(参考)】
[ Back to top ]

