リグノフェノール誘導体の分離精製方法
【課題】リグノフェノール誘導体の分離精製を効率的に行う方法を提供する。
【解決手段】リグノフェノール誘導体の分離精製方法は、(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触し、不溶区分と親和層とに分画する工程と、(2)得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含む。
【解決手段】リグノフェノール誘導体の分離精製方法は、(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触し、不溶区分と親和層とに分画する工程と、(2)得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオマス由来のフェノール性リグニン系高分子(以下、リグノフェノール誘導体という)の分離精製方法に関する。
【背景技術】
【0002】
これまで廃棄又は焼却して処分していた木材や草、廃木材、建築廃材等のバイオマス由来のリグニンを有効に活用するための研究開発が、近時、盛んに行われている。リグニンを利用する技術として、例えば特許文献1には、植物由来のリグニンをフェノール誘導体及び酸と反応させてリグノフェノール誘導体に変換して分離精製する、リグノフェノール誘導体の製造方法が開示されている。
【0003】
このリグノフェノール誘導体の製造方法は、以下の工程からなる。
(1)リグノセルロース系材料であるバイオマスにフェノール誘導体(具体的にはp−クレゾール)と酸(具体的には硫酸)を加え、リグニンをフェノール誘導体で溶媒和すると共に炭水化物を加水分解する工程、
(2)フェノール誘導体層を酸と分離する工程、
(3)得られたフェノール誘導体層をリグノフェノール誘導体の貧溶媒(具体的にはジエチルエーテルやジイソプロピルエーテル)に滴下して、リグノフェノール誘導体をフェノール誘導体と分離して不溶区分として回収する工程(1次精製)、
(4)得られた不溶区分をアセトンに溶解してさらにリグノフェノール誘導体の貧溶媒に滴下することにより、不溶区分に含まれるフェノール誘導体を分離してリグノフェノール誘導体を回収する工程(2次精製)。
【0004】
得られたリグノフェノール誘導体は、各種の材料に塗布し、乾燥して成形体とすることができる。また、リグノフェノール誘導体はアセトンに溶けるため、成形体が不要となった場合でも回収することが容易であり、繰り返し利用が可能であるという利点がある。
さらに、成形体以外の塗料以外の用途についても電子や電気用材料、医薬などへの幅広い応用が期待されている。
【特許文献1】特開平02−233701号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明者等はリグノセルロース系材料からリグノフェノール誘導体を製造する方法の実用化を検討してきた。小規模な実験レベルから実用化に向けたスケールアップを図る場合、小規模な実験レベルで使用していた高速遠心分離は大量の処理に向かないことと、初期投資およびランニングコストのアップに繋がるため、遠心分離機を使用しないかあるいは低速の遠心分離にも対応可能な方法を確立することが求められている。
【0006】
ところが、遠心分離を低速回転で行う、あるいは遠心分離機を使用しない液相分離に変更すると、リグノフェノール誘導体の分離精製の効率が悪く、リグノフェノール誘導体の貧溶媒を使用した分離操作を5〜8回繰り返えさなければならないという問題がある。
リグノフェノール誘導体の貧溶媒を使用したリグノフェノール誘導体の分離精製の操作回数が増えると、ジエチルエーテルやジイソプロピルエーテルのような低沸点の有機溶媒を大量に必要とすることになる。しかも、前述の方法では、低沸点の有機溶媒の使用量は一回の操作でフェノール誘導体量やアセトン量の15〜20倍にもなることから、低沸点の有機溶媒を多量に使用する操作が増えることは、安全面やコストの点から好ましくない。
【0007】
上記課題に鑑み、本発明者等が鋭意研究を重ねたところ、フェノール誘導体層を比重差によって分離する液相分離において、高速遠心分離手段を使用しない場合、フェノール誘導体層に酸が残留するために低沸点の有機溶媒を使用した精製回数が増加することに気づき、本発明を完成するに至った。
すなわち、本発明はリグノフェノール誘導体の分離精製を効率的に行う方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明のリグノフェノール誘導体の分離精製方法は、リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触させた後、不溶区分と親和層とに分画する工程と、得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程とを含むことを特徴とする。
本発明はまた、リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触させた後、不溶区分と親和層とに分画する工程と、得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程とを含むことを特徴とするリグノフェノール誘導体の分離精製方法を提供する。
【発明の効果】
【0009】
本発明のリグノフェノール誘導体の分離精製方法は、低沸点の有機溶媒を使用したリグノフェノール誘導体の精製を繰り返して行う必要がなく、また、リグニンをリグノフェノール誘導体に変換する過程で使用する酸や溶媒及びリグノフェノール誘導体フラグメント等の低分子化合物を精製の過程で効率的に除去することが可能である。
【発明を実施するための最良の形態】
【0010】
以下、本発明について説明する。
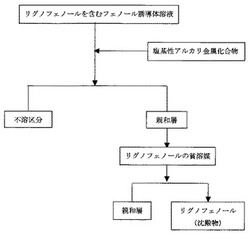
図1は、本発明のリグノフェノール誘導体の分離精製方法を示すフロー図である。すなわち、リグノフェノール誘導体の分離精製方法は以下の工程を含む。
(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触し、不溶区分と親和層(すなわち溶解層)とに分画する工程。
(2)得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【0011】
また、図2は以下の工程を含む、別のリグノフェノール誘導体の分離精製方法を示すフロー図である。
(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触し、不溶区分と親和層(すなわち溶解層)を分画する工程。
(2)得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物としてリグノフェノール誘導体を分離する工程。
【0012】
リグノフェノール誘導体とは、フェニルプロパン骨格のC1(ベンジル位)にフェノール誘導体が結合した1,1−ビス(アリール)プロパン−2−O−アリールエーテル型構造を有する化合物であり、例えば、リグノセルロース系材料にフェノール誘導体が溶解した溶媒を浸透させた後、酸を混合することによって、リグノセルロースの複合状態を緩和させ、同時にリグニンのフェニルプロパン骨格のC1(ベンジル位)にフェノール誘導体を結合させることによって得ることができる。ここで酸は、バイオマスの加水分解に用いられる酸であればよく、例えば硫酸が一般的に用いられている。なお、リグノセルロース系材料に代えてセルロースから分離されたリグニンをフェノール誘導体と接触させてもよい。
【0013】
フェノール誘導体は、p−クレゾールが用いられることが多いが、p−クレゾール以外のフェノール誘導体としては、フェノール、m(メタ)−クレゾール、o(オルト)−クレゾール、アニソール、2,4−ジメトキシフェノール、2,6−ジメトキシフェノール、2,4−ジメチルフェノール、2,6−ジメチルフェノール、プロピルフェノール、i−プロピルフェノール、tert−ブチルフェノール、カテコール、レゾルシノール、ピロガロール、フロログルシノール、ビスフェノール、バニリン、シリンゴール、グアイアゴール、フェルラ酸、クマル酸の何れか、又は、これらの組み合わせを使用することができる。
【0014】
リグノフェノール誘導体を含むフェノール誘導体溶液中には、リグノフェノール誘導体、リグノフェノール誘導体フラグメント等の低分子化合物、フェノール誘導体、酸が含まれている。ただし、酸は、遠心分離等の手段によりほぼ完全に取り除かれていてもよい。後述するように、酸が存在しない場合でも、フェノール誘導体がアルカリ金属との反応により別の化合物に変わるため、フェノール誘導体とリグノフェノール誘導体との分離効率を高めることが出来るからである。
【0015】
アルカリ金属化合物としては、ナトリウム、カリウム等のアルカリ金属の水酸化物、アルカリ金属塩、炭酸塩やアンモニア塩のような弱塩基性のアルカリ金属塩を用いることができる。
【0016】
アルカリ金属化合物は、酸を中和するためだけでなく、後述するように、フェノール誘導体をリグノフェノール誘導体の親溶媒に不溶の塩とする効果もある。フェノール誘導体との反応を効果的に行うためには、弱塩基性のアルカリ金属化合物が好ましく、特にナトリウムの弱塩基性塩であるナトリウムの炭酸塩やアンモニア塩が好ましい。具体的には、炭酸水素ナトリウムや炭酸水素ナトリウムを挙げることができる。
なお、アルカリ金属化合物との接触はpH9以下の条件下で行うことが望ましく、特に弱塩基性以外のアルカリ金属化合物を使用する場合は、反応条件をコントロールする必要がある。
【0017】
このように、アルカリ金属化合物によって、フェノール誘導体溶液中の酸は中和され、フェノール誘導体溶液から除去される。
【0018】
前述したように、アルカリ金属化合物は、リグノフェノール誘導体の貧溶媒を使用した精製に悪影響を及ぼす酸をフェノール誘導体溶液から除去するだけでなく、フェノール誘導体と反応して、フェノール誘導体をアセトンのようなリグノフェノール誘導体の親溶媒に不溶の塩とする効果もある。しかし、pH9以上の反応条件下では、アルカリ金属化合物はリグノフェノール誘導体とも反応し、リグノフェノール誘導体を親溶媒に不溶の化合物に変換してしまうので好ましくない。したがって、弱塩基性以外のアルカリ金属化合物を使用する場合は、急激にpHがアルカリ側にならないように添加量等の条件を選択する必要がある。
【0019】
リグノフェノール誘導体の溶媒溶解性は、次の序列になることがわかった。
強アルカリ溶液>アセトン、メチルエチルケトンなどのアルキルケトン類>ジメチルフォルムアミド(DMF)、N-メチルピロリドン(NMP)のような非プロトン極性溶媒>テトラヒドロフラン(THF)、ジオキサンのような環状エーテル類>ピリジンのようなヘテロ環状化合物>エタノール、セロソルブのようなアルコール類>tert-ブチルメチルエーテル(TBME)、シクロペンチルメチルエーテル(CPME)などの非対称エーテル類>ジエチルエーテルやジプロピルエーテル、ジイソプロピルエーテルなどの対称アルキルエーテル>トルエン又はキシレンとヘキサンとの混合溶媒>ベンゼン、トルエン、ヘキサンなどの環状炭化水素類>水
【0020】
リグノフェノール誘導体の親溶媒は、強アルカリ溶液、アルキルケトン類、非プロトン極性溶媒、環状エーテル類、ヘテロ環状化合物、アルコール類であり、リグノフェノール誘導体の貧溶媒は、非対称エーテル類、対称アルキルエーテル、環状炭化水素類、直鎖状炭化水素、エステル類、水を使用することができる。具体的には、リグノフェノール誘導体の親溶媒としてアセトン、リグノフェノール誘導体の貧溶媒としてジイソプロピルエーテル、ジエチルエーテル、n−ヘキサン、ペンタン、ベンゼン、トルエン、酢酸エチルを挙げることができる。なお、上述した貧溶媒を混合して、極性を変化させて使用することは当分野において常套手段であり、極性の異なる溶媒を組み合わせたものを貧溶媒として使用してもよい。混合貧溶媒の例としては、上述した混合溶媒の他に、n−ヘキサンと酢酸エチルを挙げることができる。
【0021】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物との接触において、反応系にリグノフェノール誘導体の親溶媒を存在させてもよい。リグノフェノール誘導体の親溶媒が存在することにより、反応系で、リグノフェノール誘導体が親溶媒に再溶解するので、次工程であるリグノフェノール誘導体の貧溶媒を使用した沈殿物の分離の効率を高めることができる。リグノフェノール誘導体の親溶媒が存在しない場合には、親和層(フェノール誘導体溶液の画分)を次工程に供することになる。
リグノフェノール誘導体の親溶媒の量は、特に限定されるものでなく、例えば、フェノール誘導体溶液の約20容量%以上が好ましい。
【0022】
また、この工程において、バイオマス由来の炭水化物の加水分解物は不溶区分に分画されることになり、親和層へ炭水化物の加水分解物が混入することはない。
【0023】
得られたリグノフェノール誘導体の親和層をリグノフェノール誘導体の貧溶媒層に滴下して、リグノフェノール誘導体を沈殿物として分離精製して回収する。
【実施例1】
【0024】
広葉樹カバ脱脂木粉1gにp−クレゾール10mリットルを加え、これに72%のH2SO4を20mリットル添加し、激しく攪拌した。60分攪拌後、遠心分離(500/rpm)によりp−クレゾール層と硫酸層に分離した。このp−クレゾール層をゲル浸透クロマトグラフィー分析した結果を図3に示す。
【0025】
p−クレゾール層を20mリットルのアセトンで希釈し、炭酸水素ナトリウム2gを添加して2時間攪拌した結果、アセトン溶液はpH1からpH6まで上昇した。さらに約60分攪拌後、遠心分離した。
これによりフェノール層に混入した硫酸のほとんどが除去された。この炭酸水素ナトリウム処理過程で少量のアセトン不溶区分が生成した。これを遠心分離で除去した。
アセトン可溶部を濃縮後、ジイソプロピルエーテルに滴下したところ、淡桃白色のリグノフェノール誘導体が得られた。ゲル浸透クロマトグラフィー分析した結果を図4に示す。
炭酸水素ナトリウム処理を行わない常法の精製法で得られたリグノフェノール誘導体と比べ、少量のp−クレゾールが残ってはいたが、ほぼ同じ分子量分布を示している。
【0026】
一方、炭酸水素ナトリウム処理時に生成したアセトン不溶区分には、炭酸水素ナトリウムが含まれているため、メタノールを加え、炭酸水素ナトリウムをメタノール不溶区分として除去した。このアセトン不溶−メタノール可溶区分をゲル浸透クロマトグラフィー分析した。結果を図5に示す。アセトン不溶区分のほとんどはp−クレゾールであった。
これは、炭酸水素ナトリウム処理過程でp−クレゾールの一部が、ナトリウム塩となり、アセトン不溶となったことによると考えられる。リグノフェノール誘導体は高分子であるため低分子のp−クレゾールと比べナトリウム塩を形成しにくく、炭酸水素ナトリウム処理過程で、p−クレゾールが選択的にナトリウム塩になったといえる。
【0027】
なお、ゲル浸透クロマトグラフィーの条件を以下に示す。
Column: Shodex KF−801, KF−802, KF−803, KF−804 (8.0mm ID × 30cm L)
Eluent: Tetrahydrofuran,Flow rate: 1.0 mリットル/min
Temp: : 40℃
Detect: 280 nm
Standard; polystyrene (Mw=196,000, 76,600, 28,500, 13,100, 9,860, 7,000, 5,000, 2,960, 1270, 682, 578, 474, 370, 266, 162),p−クレゾール (Mw=108)
【0028】
<比較例>
実施例1と同様に、広葉樹カバ脱脂木粉1gにp−クレゾール10mリットルを加え、これに72%のH2SO4を20mリットル添加し、激しく攪拌した。60分攪拌後、遠心分離(3500/rpm)によりp−クレゾール層と硫酸層に分離した。このp−クレゾール層を炭酸水素ナトリウム処理せずに、ジイソプロピルエーテルに滴下したところ、滴下初期は分散状態となったが、すぐに油状凝集物を生成し、淡桃白色のリグノフェノール誘導体を得ることができず、さらに2〜3回の分離精製処理を必要とした。
【0029】
以上の結果から、フェノール層を炭酸水素ナトリウム処理することにより、フェノール層中に残存する硫酸が除去されるとともに、フェノール層であるp−クレゾールの一部も除去されることがわかる。親溶媒層(親和層)には少量のp−クレゾールは残っていたが、次工程のジイソプロピルエーテルを用いた精製1回で精製リグノフェノール誘導体を得ることが可能となった。
【図面の簡単な説明】
【0030】
【図1】本発明のリグノフェノール誘導体の分離精製方法の工程を示すフロー図である。
【図2】リグノフェノール誘導体の分離精製方法の別の工程を示すフロー図である。
【図3】炭酸水素ナトリウムの処理をする前のp−クレゾール画分のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【図4】炭酸水素ナトリウム処理後の精製物のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【図5】炭酸水素ナトリウム処理後のアセトン不溶画分のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【技術分野】
【0001】
本発明は、バイオマス由来のフェノール性リグニン系高分子(以下、リグノフェノール誘導体という)の分離精製方法に関する。
【背景技術】
【0002】
これまで廃棄又は焼却して処分していた木材や草、廃木材、建築廃材等のバイオマス由来のリグニンを有効に活用するための研究開発が、近時、盛んに行われている。リグニンを利用する技術として、例えば特許文献1には、植物由来のリグニンをフェノール誘導体及び酸と反応させてリグノフェノール誘導体に変換して分離精製する、リグノフェノール誘導体の製造方法が開示されている。
【0003】
このリグノフェノール誘導体の製造方法は、以下の工程からなる。
(1)リグノセルロース系材料であるバイオマスにフェノール誘導体(具体的にはp−クレゾール)と酸(具体的には硫酸)を加え、リグニンをフェノール誘導体で溶媒和すると共に炭水化物を加水分解する工程、
(2)フェノール誘導体層を酸と分離する工程、
(3)得られたフェノール誘導体層をリグノフェノール誘導体の貧溶媒(具体的にはジエチルエーテルやジイソプロピルエーテル)に滴下して、リグノフェノール誘導体をフェノール誘導体と分離して不溶区分として回収する工程(1次精製)、
(4)得られた不溶区分をアセトンに溶解してさらにリグノフェノール誘導体の貧溶媒に滴下することにより、不溶区分に含まれるフェノール誘導体を分離してリグノフェノール誘導体を回収する工程(2次精製)。
【0004】
得られたリグノフェノール誘導体は、各種の材料に塗布し、乾燥して成形体とすることができる。また、リグノフェノール誘導体はアセトンに溶けるため、成形体が不要となった場合でも回収することが容易であり、繰り返し利用が可能であるという利点がある。
さらに、成形体以外の塗料以外の用途についても電子や電気用材料、医薬などへの幅広い応用が期待されている。
【特許文献1】特開平02−233701号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明者等はリグノセルロース系材料からリグノフェノール誘導体を製造する方法の実用化を検討してきた。小規模な実験レベルから実用化に向けたスケールアップを図る場合、小規模な実験レベルで使用していた高速遠心分離は大量の処理に向かないことと、初期投資およびランニングコストのアップに繋がるため、遠心分離機を使用しないかあるいは低速の遠心分離にも対応可能な方法を確立することが求められている。
【0006】
ところが、遠心分離を低速回転で行う、あるいは遠心分離機を使用しない液相分離に変更すると、リグノフェノール誘導体の分離精製の効率が悪く、リグノフェノール誘導体の貧溶媒を使用した分離操作を5〜8回繰り返えさなければならないという問題がある。
リグノフェノール誘導体の貧溶媒を使用したリグノフェノール誘導体の分離精製の操作回数が増えると、ジエチルエーテルやジイソプロピルエーテルのような低沸点の有機溶媒を大量に必要とすることになる。しかも、前述の方法では、低沸点の有機溶媒の使用量は一回の操作でフェノール誘導体量やアセトン量の15〜20倍にもなることから、低沸点の有機溶媒を多量に使用する操作が増えることは、安全面やコストの点から好ましくない。
【0007】
上記課題に鑑み、本発明者等が鋭意研究を重ねたところ、フェノール誘導体層を比重差によって分離する液相分離において、高速遠心分離手段を使用しない場合、フェノール誘導体層に酸が残留するために低沸点の有機溶媒を使用した精製回数が増加することに気づき、本発明を完成するに至った。
すなわち、本発明はリグノフェノール誘導体の分離精製を効率的に行う方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明のリグノフェノール誘導体の分離精製方法は、リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触させた後、不溶区分と親和層とに分画する工程と、得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程とを含むことを特徴とする。
本発明はまた、リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触させた後、不溶区分と親和層とに分画する工程と、得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程とを含むことを特徴とするリグノフェノール誘導体の分離精製方法を提供する。
【発明の効果】
【0009】
本発明のリグノフェノール誘導体の分離精製方法は、低沸点の有機溶媒を使用したリグノフェノール誘導体の精製を繰り返して行う必要がなく、また、リグニンをリグノフェノール誘導体に変換する過程で使用する酸や溶媒及びリグノフェノール誘導体フラグメント等の低分子化合物を精製の過程で効率的に除去することが可能である。
【発明を実施するための最良の形態】
【0010】
以下、本発明について説明する。
図1は、本発明のリグノフェノール誘導体の分離精製方法を示すフロー図である。すなわち、リグノフェノール誘導体の分離精製方法は以下の工程を含む。
(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触し、不溶区分と親和層(すなわち溶解層)とに分画する工程。
(2)得られたフェノール誘導体溶液層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【0011】
また、図2は以下の工程を含む、別のリグノフェノール誘導体の分離精製方法を示すフロー図である。
(1)リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触し、不溶区分と親和層(すなわち溶解層)を分画する工程。
(2)得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物としてリグノフェノール誘導体を分離する工程。
【0012】
リグノフェノール誘導体とは、フェニルプロパン骨格のC1(ベンジル位)にフェノール誘導体が結合した1,1−ビス(アリール)プロパン−2−O−アリールエーテル型構造を有する化合物であり、例えば、リグノセルロース系材料にフェノール誘導体が溶解した溶媒を浸透させた後、酸を混合することによって、リグノセルロースの複合状態を緩和させ、同時にリグニンのフェニルプロパン骨格のC1(ベンジル位)にフェノール誘導体を結合させることによって得ることができる。ここで酸は、バイオマスの加水分解に用いられる酸であればよく、例えば硫酸が一般的に用いられている。なお、リグノセルロース系材料に代えてセルロースから分離されたリグニンをフェノール誘導体と接触させてもよい。
【0013】
フェノール誘導体は、p−クレゾールが用いられることが多いが、p−クレゾール以外のフェノール誘導体としては、フェノール、m(メタ)−クレゾール、o(オルト)−クレゾール、アニソール、2,4−ジメトキシフェノール、2,6−ジメトキシフェノール、2,4−ジメチルフェノール、2,6−ジメチルフェノール、プロピルフェノール、i−プロピルフェノール、tert−ブチルフェノール、カテコール、レゾルシノール、ピロガロール、フロログルシノール、ビスフェノール、バニリン、シリンゴール、グアイアゴール、フェルラ酸、クマル酸の何れか、又は、これらの組み合わせを使用することができる。
【0014】
リグノフェノール誘導体を含むフェノール誘導体溶液中には、リグノフェノール誘導体、リグノフェノール誘導体フラグメント等の低分子化合物、フェノール誘導体、酸が含まれている。ただし、酸は、遠心分離等の手段によりほぼ完全に取り除かれていてもよい。後述するように、酸が存在しない場合でも、フェノール誘導体がアルカリ金属との反応により別の化合物に変わるため、フェノール誘導体とリグノフェノール誘導体との分離効率を高めることが出来るからである。
【0015】
アルカリ金属化合物としては、ナトリウム、カリウム等のアルカリ金属の水酸化物、アルカリ金属塩、炭酸塩やアンモニア塩のような弱塩基性のアルカリ金属塩を用いることができる。
【0016】
アルカリ金属化合物は、酸を中和するためだけでなく、後述するように、フェノール誘導体をリグノフェノール誘導体の親溶媒に不溶の塩とする効果もある。フェノール誘導体との反応を効果的に行うためには、弱塩基性のアルカリ金属化合物が好ましく、特にナトリウムの弱塩基性塩であるナトリウムの炭酸塩やアンモニア塩が好ましい。具体的には、炭酸水素ナトリウムや炭酸水素ナトリウムを挙げることができる。
なお、アルカリ金属化合物との接触はpH9以下の条件下で行うことが望ましく、特に弱塩基性以外のアルカリ金属化合物を使用する場合は、反応条件をコントロールする必要がある。
【0017】
このように、アルカリ金属化合物によって、フェノール誘導体溶液中の酸は中和され、フェノール誘導体溶液から除去される。
【0018】
前述したように、アルカリ金属化合物は、リグノフェノール誘導体の貧溶媒を使用した精製に悪影響を及ぼす酸をフェノール誘導体溶液から除去するだけでなく、フェノール誘導体と反応して、フェノール誘導体をアセトンのようなリグノフェノール誘導体の親溶媒に不溶の塩とする効果もある。しかし、pH9以上の反応条件下では、アルカリ金属化合物はリグノフェノール誘導体とも反応し、リグノフェノール誘導体を親溶媒に不溶の化合物に変換してしまうので好ましくない。したがって、弱塩基性以外のアルカリ金属化合物を使用する場合は、急激にpHがアルカリ側にならないように添加量等の条件を選択する必要がある。
【0019】
リグノフェノール誘導体の溶媒溶解性は、次の序列になることがわかった。
強アルカリ溶液>アセトン、メチルエチルケトンなどのアルキルケトン類>ジメチルフォルムアミド(DMF)、N-メチルピロリドン(NMP)のような非プロトン極性溶媒>テトラヒドロフラン(THF)、ジオキサンのような環状エーテル類>ピリジンのようなヘテロ環状化合物>エタノール、セロソルブのようなアルコール類>tert-ブチルメチルエーテル(TBME)、シクロペンチルメチルエーテル(CPME)などの非対称エーテル類>ジエチルエーテルやジプロピルエーテル、ジイソプロピルエーテルなどの対称アルキルエーテル>トルエン又はキシレンとヘキサンとの混合溶媒>ベンゼン、トルエン、ヘキサンなどの環状炭化水素類>水
【0020】
リグノフェノール誘導体の親溶媒は、強アルカリ溶液、アルキルケトン類、非プロトン極性溶媒、環状エーテル類、ヘテロ環状化合物、アルコール類であり、リグノフェノール誘導体の貧溶媒は、非対称エーテル類、対称アルキルエーテル、環状炭化水素類、直鎖状炭化水素、エステル類、水を使用することができる。具体的には、リグノフェノール誘導体の親溶媒としてアセトン、リグノフェノール誘導体の貧溶媒としてジイソプロピルエーテル、ジエチルエーテル、n−ヘキサン、ペンタン、ベンゼン、トルエン、酢酸エチルを挙げることができる。なお、上述した貧溶媒を混合して、極性を変化させて使用することは当分野において常套手段であり、極性の異なる溶媒を組み合わせたものを貧溶媒として使用してもよい。混合貧溶媒の例としては、上述した混合溶媒の他に、n−ヘキサンと酢酸エチルを挙げることができる。
【0021】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物との接触において、反応系にリグノフェノール誘導体の親溶媒を存在させてもよい。リグノフェノール誘導体の親溶媒が存在することにより、反応系で、リグノフェノール誘導体が親溶媒に再溶解するので、次工程であるリグノフェノール誘導体の貧溶媒を使用した沈殿物の分離の効率を高めることができる。リグノフェノール誘導体の親溶媒が存在しない場合には、親和層(フェノール誘導体溶液の画分)を次工程に供することになる。
リグノフェノール誘導体の親溶媒の量は、特に限定されるものでなく、例えば、フェノール誘導体溶液の約20容量%以上が好ましい。
【0022】
また、この工程において、バイオマス由来の炭水化物の加水分解物は不溶区分に分画されることになり、親和層へ炭水化物の加水分解物が混入することはない。
【0023】
得られたリグノフェノール誘導体の親和層をリグノフェノール誘導体の貧溶媒層に滴下して、リグノフェノール誘導体を沈殿物として分離精製して回収する。
【実施例1】
【0024】
広葉樹カバ脱脂木粉1gにp−クレゾール10mリットルを加え、これに72%のH2SO4を20mリットル添加し、激しく攪拌した。60分攪拌後、遠心分離(500/rpm)によりp−クレゾール層と硫酸層に分離した。このp−クレゾール層をゲル浸透クロマトグラフィー分析した結果を図3に示す。
【0025】
p−クレゾール層を20mリットルのアセトンで希釈し、炭酸水素ナトリウム2gを添加して2時間攪拌した結果、アセトン溶液はpH1からpH6まで上昇した。さらに約60分攪拌後、遠心分離した。
これによりフェノール層に混入した硫酸のほとんどが除去された。この炭酸水素ナトリウム処理過程で少量のアセトン不溶区分が生成した。これを遠心分離で除去した。
アセトン可溶部を濃縮後、ジイソプロピルエーテルに滴下したところ、淡桃白色のリグノフェノール誘導体が得られた。ゲル浸透クロマトグラフィー分析した結果を図4に示す。
炭酸水素ナトリウム処理を行わない常法の精製法で得られたリグノフェノール誘導体と比べ、少量のp−クレゾールが残ってはいたが、ほぼ同じ分子量分布を示している。
【0026】
一方、炭酸水素ナトリウム処理時に生成したアセトン不溶区分には、炭酸水素ナトリウムが含まれているため、メタノールを加え、炭酸水素ナトリウムをメタノール不溶区分として除去した。このアセトン不溶−メタノール可溶区分をゲル浸透クロマトグラフィー分析した。結果を図5に示す。アセトン不溶区分のほとんどはp−クレゾールであった。
これは、炭酸水素ナトリウム処理過程でp−クレゾールの一部が、ナトリウム塩となり、アセトン不溶となったことによると考えられる。リグノフェノール誘導体は高分子であるため低分子のp−クレゾールと比べナトリウム塩を形成しにくく、炭酸水素ナトリウム処理過程で、p−クレゾールが選択的にナトリウム塩になったといえる。
【0027】
なお、ゲル浸透クロマトグラフィーの条件を以下に示す。
Column: Shodex KF−801, KF−802, KF−803, KF−804 (8.0mm ID × 30cm L)
Eluent: Tetrahydrofuran,Flow rate: 1.0 mリットル/min
Temp: : 40℃
Detect: 280 nm
Standard; polystyrene (Mw=196,000, 76,600, 28,500, 13,100, 9,860, 7,000, 5,000, 2,960, 1270, 682, 578, 474, 370, 266, 162),p−クレゾール (Mw=108)
【0028】
<比較例>
実施例1と同様に、広葉樹カバ脱脂木粉1gにp−クレゾール10mリットルを加え、これに72%のH2SO4を20mリットル添加し、激しく攪拌した。60分攪拌後、遠心分離(3500/rpm)によりp−クレゾール層と硫酸層に分離した。このp−クレゾール層を炭酸水素ナトリウム処理せずに、ジイソプロピルエーテルに滴下したところ、滴下初期は分散状態となったが、すぐに油状凝集物を生成し、淡桃白色のリグノフェノール誘導体を得ることができず、さらに2〜3回の分離精製処理を必要とした。
【0029】
以上の結果から、フェノール層を炭酸水素ナトリウム処理することにより、フェノール層中に残存する硫酸が除去されるとともに、フェノール層であるp−クレゾールの一部も除去されることがわかる。親溶媒層(親和層)には少量のp−クレゾールは残っていたが、次工程のジイソプロピルエーテルを用いた精製1回で精製リグノフェノール誘導体を得ることが可能となった。
【図面の簡単な説明】
【0030】
【図1】本発明のリグノフェノール誘導体の分離精製方法の工程を示すフロー図である。
【図2】リグノフェノール誘導体の分離精製方法の別の工程を示すフロー図である。
【図3】炭酸水素ナトリウムの処理をする前のp−クレゾール画分のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【図4】炭酸水素ナトリウム処理後の精製物のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【図5】炭酸水素ナトリウム処理後のアセトン不溶画分のゲル浸透クロマトグラフィー分析結果を示すグラフである。
【特許請求の範囲】
【請求項1】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触させ、不溶区分と親和層とに分画する工程と、
得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【請求項2】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触させ、不溶区分と親和層とに分画する工程と、
得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【請求項3】
前記リグノフェノール誘導体を含むフェノール誘導体溶液が酸を含有する、請求項1又は2記載のリグノフェノール誘導体の分離精製方法。
【請求項4】
前記アルカリ金属化合物が、弱塩基性のアルカリ金属塩である、請求項1〜3のいずれかに記載のリグノフェノール誘導体の分離精製方法。
【請求項5】
前記弱塩基性のアルカリ金属塩が、ナトリウムの炭酸塩である、請求項4記載のリグノフェノール誘導体の分離精製方法。
【請求項6】
前記リグノフェノール誘導体の親溶媒が、アルキルケトン類、非プロトン極性溶媒、環状エーテル類、ヘテロ環状化合物、アルコール類から選ばれる溶媒である、請求項2〜5のいずれかに記載のリグノフェノール誘導体の分離精製方法。
【請求項7】
前記リグノフェノール誘導体の貧溶媒が、非対称エーテル類、対称アルキルエーテル、環状炭化水素類、直鎖状炭化水素から選ばれる溶媒である、請求項1〜5の何れかに記載のリグノフェノール誘導体の分離精製方法。
【請求項8】
前記アルカリ金属化合物が炭酸水素ナトリウム又は炭酸ナトリウムであり、前記リグノフェノール誘導体の貧溶媒がジイソプロピルエーテル、ジエチルエーテル又はn−ヘキサンである、請求項1記載のリグノフェノール誘導体の分離精製方法。
【請求項9】
前記アルカリ金属化合物が炭酸水素ナトリウム又は炭酸ナトリウムであり、前記リグノフェノール誘導体の親溶媒がアセトンであり、前記リグノフェノール誘導体の貧溶媒がジイソプロピルエーテル、ジエチルエーテル又はn−ヘキサンである、請求項2記載のリグノフェノール誘導体の分離精製方法。
【請求項10】
前記リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物との接触がpH9以下で行われる、請求項1又は2記載のリグノフェノール誘導体の分離精製方法。
【請求項1】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とを接触させ、不溶区分と親和層とに分画する工程と、
得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【請求項2】
リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物とをリグノフェノール誘導体の親溶媒の存在下で接触させ、不溶区分と親和層とに分画する工程と、
得られた親和層をリグノフェノール誘導体の貧溶媒に加え、沈殿物を分離する工程と、を含むリグノフェノール誘導体の分離精製方法。
【請求項3】
前記リグノフェノール誘導体を含むフェノール誘導体溶液が酸を含有する、請求項1又は2記載のリグノフェノール誘導体の分離精製方法。
【請求項4】
前記アルカリ金属化合物が、弱塩基性のアルカリ金属塩である、請求項1〜3のいずれかに記載のリグノフェノール誘導体の分離精製方法。
【請求項5】
前記弱塩基性のアルカリ金属塩が、ナトリウムの炭酸塩である、請求項4記載のリグノフェノール誘導体の分離精製方法。
【請求項6】
前記リグノフェノール誘導体の親溶媒が、アルキルケトン類、非プロトン極性溶媒、環状エーテル類、ヘテロ環状化合物、アルコール類から選ばれる溶媒である、請求項2〜5のいずれかに記載のリグノフェノール誘導体の分離精製方法。
【請求項7】
前記リグノフェノール誘導体の貧溶媒が、非対称エーテル類、対称アルキルエーテル、環状炭化水素類、直鎖状炭化水素から選ばれる溶媒である、請求項1〜5の何れかに記載のリグノフェノール誘導体の分離精製方法。
【請求項8】
前記アルカリ金属化合物が炭酸水素ナトリウム又は炭酸ナトリウムであり、前記リグノフェノール誘導体の貧溶媒がジイソプロピルエーテル、ジエチルエーテル又はn−ヘキサンである、請求項1記載のリグノフェノール誘導体の分離精製方法。
【請求項9】
前記アルカリ金属化合物が炭酸水素ナトリウム又は炭酸ナトリウムであり、前記リグノフェノール誘導体の親溶媒がアセトンであり、前記リグノフェノール誘導体の貧溶媒がジイソプロピルエーテル、ジエチルエーテル又はn−ヘキサンである、請求項2記載のリグノフェノール誘導体の分離精製方法。
【請求項10】
前記リグノフェノール誘導体を含むフェノール誘導体溶液とアルカリ金属化合物との接触がpH9以下で行われる、請求項1又は2記載のリグノフェノール誘導体の分離精製方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−95488(P2010−95488A)
【公開日】平成22年4月30日(2010.4.30)
【国際特許分類】
【出願番号】特願2008−269241(P2008−269241)
【出願日】平成20年10月18日(2008.10.18)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成22年4月30日(2010.4.30)
【国際特許分類】
【出願日】平成20年10月18日(2008.10.18)
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

