リザーバ溶出ステント
【課題】ステントの壁厚を増大させることなく、また機械的拡張特性に悪影響を与えることなく、表面皮膜に薬剤を含有するステントを提供する。
【解決手段】拡張可能な医療デバイス10は、第一の直径から第二の直径へ拡張可能な実質的に円筒形のデバイス12を形成する複数の細長いストラット18を含む。複数の異なる薬剤がストラット内の異なる開口部30a,30b内に充填されて組織に送達される。異なる疾病を処置するために、異なる薬剤を同一の薬物送達デバイスから使用することもできる。加えて、抗血栓剤が医療デバイスの表面の少なくとも一部分に付着されて、亜急性血栓症を予防することができる。
【解決手段】拡張可能な医療デバイス10は、第一の直径から第二の直径へ拡張可能な実質的に円筒形のデバイス12を形成する複数の細長いストラット18を含む。複数の異なる薬剤がストラット内の異なる開口部30a,30b内に充填されて組織に送達される。異なる疾病を処置するために、異なる薬剤を同一の薬物送達デバイスから使用することもできる。加えて、抗血栓剤が医療デバイスの表面の少なくとも一部分に付着されて、亜急性血栓症を予防することができる。
【発明の詳細な説明】
【開示の内容】
【0001】
〔技術分野〕
本願は2009年1月30日に出願された米国仮特許出願第61/148,610号の利益を主張するものである。
【0002】
本発明は、組織を支持する医療デバイスに関し、より詳細には、臓器を支持し、開通性を維持するために、生きている動物又はヒトの体腔内に埋め込まれ、複数の有益な薬剤の介入部位への送達のための開口部、並びに抗血栓剤の表面皮膜を有する、拡張可能な固定型デバイスに関する。
【0003】
〔背景技術〕
(関連技術の考察)
従来、身体通路内に埋め込んで、通路の開通性を維持するための永久又は生分解性デバイスが開発されてきた。これらのデバイスは、通常、経皮的に導入され、所望の位置に配置されるまで、経腔的に移送される。次いで、これらのデバイスは、デバイスの内部に配置されたマンドレル又はバルーンの拡張等により機械的に、又は身体内での作動時に貯蔵エネルギーを放出することによりそれ自体を拡張する。一旦管腔内で拡張したら、ステントと称されるこれらのデバイスは、身体組織内に閉じ込められた状態となり、永久インプラントとして残留する。
【0004】
公知のステントのデザインには、単繊維ワイヤコイルステント(米国特許第4,969,458号)、溶接金属ケージ(米国特許第4,733,665号及び同第4,776,337号)並びに、最も顕著には、周囲に軸方向スロットを有する薄壁金属円筒(米国特許第4,733,665号、同第4,739,762号及び同第4,776,337号)が挙げられる。ステントに使用するための公知の構成材料には、ポリマー、有機織物、及び、例えばステンレス鋼、金、銀、タンタル、チタン等の生体適合性金属、並びに例えばニッケル−チタン等の形状記憶合金が挙げられる。
【0005】
その全体が参照により本明細書に組み込まれる米国特許第6,241,762号は、これまでのステントのいくつかの性能不備を改良する非角柱ステントデザインを開示している。加えて、この特許に開示されている好ましい実施形態は、大きい非変形性ストラット及び連結要素を有するステントを提供し、このステントは、ストラット若しくは連結要素、又はデバイス全体の機械的特性を損なわずに孔を含み得る。更に、これらの孔は、ステント上の表面皮膜を必要とすることなく、様々な有益な薬剤をデバイス埋め込み部位に送達するための、大きい保護されたリザーバとしての役割を果たし得る。
【0006】
有益な薬剤のステントベースの局所送達により対処し得る多数の問題の中でも、最も重要なものの1つは再狭窄である。再狭窄は、例えば血管形成術及びステントの埋め込み等の血管介入後に生じ得る主な合併症である。簡単に定義すると、再狭窄とは、細胞外マトリックス沈着及び血管平滑筋増殖による血管腔径を縮小させる創傷治癒過程であり、最終的に管腔の再狭小化又は再閉塞さえももたらし得る。改良された外科技術、デバイス及び薬剤の導入にも関わらず、地金ステントに関する全再狭窄率は、尚、血管形成術から6〜12カ月以内で約25%〜約50%の範囲にあることが報告されている。この状態を処置するために、高い頻度で、追加の血管再建術が必要であり、それにより患者に対する外傷及び危険性が増大する。
【0007】
様々な有益な薬剤の表面皮膜を有する従来のステントは、再狭窄の低下に期待できる結果を示している。例えば米国特許第5,716,981号は、ポリマー担体及びパクリタキセルを含有する組成物で表面被覆されたステントを開示している。同特許は、噴霧及び浸漬等のステント表面を被覆するための方法、並びに皮膜自体の望ましい特徴の詳細な説明を提供している。それは「ステントを滑らか、かつ均等に被覆する」及び「抗血管新生因子の均一で、予想可能な、持続放出を提供する」べきである。しかしながら、表面皮膜は、有益な薬剤の放出動力学を実際に制御することはほとんどないと思われる。これらの皮膜は必然的に非常に薄く、通常深さ5〜8マイクロメートルである。それと比較してステントの表面積は非常に大きいため、有益な薬剤の全容積は周囲組織内に放出する非常に短い放散経路を有している。得られる累積的な薬物放出プロファイルは、所望の「均一な、持続放出」、即ち線形的な放出ではなく、大きい初期バーストと、その後の漸近線への急速な接近により特徴づけられる。
【0008】
表面皮膜の厚さの増大には、薬物放出をよりよく制御する能力及び薬物負荷の増加を可能にする能力を含む、薬物放出動力学を改善する有益な効果がある。しかしながら、皮膜の厚さを増大させる結果、ステント壁の全厚が増大する。このことは、多数の理由により望ましくなく、この理由には、埋め込み中に血管腔に対する外傷が増大する可能性、埋め込み後の管腔の流断面の減少並びに拡張及び埋め込み中の皮膜の機械的破損又は損傷の受け易さが含まれる。皮膜の厚さは、有益な薬剤の放出動力学に影響を与えるいくつかの要素の1つであり、したがって厚さに対する制限は、達成し得る放出速度、持続時間等の範囲を制限する。
【0009】
表面皮膜はまた、ステントから多種の薬物の送達を制限し得る。例えば、複数の薬物が表面皮膜から放出される場合、放出速度、送達期間及び他の放出特性は、簡易な方法で独立して制御することはできない。しかしながら、再狭窄は多数の生物学的過程を含み、これら異なる生物学的過程に作用するよう選択された薬物の組み合わせによって最も効果的に処置し得る。
【0010】
チャオ・ウェイ・ファン(Chao-Wei Hwang)らによる「生理学上の輸送力はステントベースの送達に関する薬物分布に影響を与える(Physiological Transport Forces Govern Drug Distribution for Stent-Based Delivery)」と題された論文は、薬物溶出ステントの空間的及び時間的な薬物分布特性と、細胞の薬物輸送機構との間の相互関係が重要であることを明らかにしている。機械的性能及び構造的特性の向上の追求において、ステント設計は、ステントのストラットの周辺方向及び長手方向の分布における固有の不均一性を有する、より複雑な形状に進化してきた。この傾向の例は、身体の管腔内に配置された際にほぼダイアモンド形又は多角形に拡張する、市販の一般的なステントである。両方が、表面皮膜の形態にて有益な薬剤を送達することに使用されてきた。研究により、ストラットのすぐ近傍にある管腔組織部分は、より遠方の、例えば「ダイアモンド」形のストラットセルの中央に位置する組織部分等よりも、遥かに高い濃度の薬物を獲得することが示されている。有意には、この管腔壁内での薬物の濃度勾配は、今日まで最も有効な抗再狭窄剤であると証明されているパクリタキセル又はラパマイシン等の疎水性の有益な薬剤に関して、長期間に亘って高いままであることである。局所薬物濃度と勾配は、生物学的効果に密接に関連するため、有益な薬剤の源(ステントストラット)の最初の空間的分布が有効性の鍵である。
【0011】
有益な薬剤の準最適な空間的分布に加えて、表面被覆ステントには更なる潜在的な不都合が存在する。デバイス皮膜に頻繁に使用される所定の固定マトリックスポリマー担体は、通常、有意な割合の有益な薬剤を皮膜内に永久に保持する。これらの有益な薬剤、例えばパクリタキセルは細胞毒性を有する場合があるため、慢性炎症、遅発性血栓症及び血管壁の治癒が遅れる又は完全には治癒しないといった亜急性及び慢性の問題が発生し得る。加えて、担体ポリマー自体が多くの場合、血管壁の組織に対して炎症性を有する。他方では、ステント表面上の生分解性ポリマー担体の使用により、ポリマー担体が分解した後に「不完全密着」がもたらされ、即ちステントと血管壁の組織との間の隙間が生じ得る。この隙間により、ステントと隣接する組織との間で差動運動が可能となる。結果として生じる問題として、ミクロ摩耗及び炎症、ステント移動並びに血管壁の再内皮形成(re-endothelialize)の不成功が挙げられる。
【0012】
早期ヒト臨床試験は、第一世代の薬物送達デバイスに関連した所定の不都合が存在し得ることを示唆している。薬物被覆されたステント埋め込み後6〜18ヶ月目における、臨床試験患者のフォローアップ検査は、有意な数の患者にステントストラットの動脈壁に対する不完全密着及び縁効果再狭窄が発生し得ることを示している。縁効果再狭窄は、ステントの基端及び先端を丁度超えた箇所に生じ、ステント縁の周囲及び内部(管腔)空間に進行し、繰り返される患者の血管再開通術を高い頻度で必要とする。
【0013】
他の潜在的な不都合の1つは、ステントの拡張が、覆っているポリマー皮膜に応力を加えて、皮膜を剥離、亀裂又は断裂させ、それが薬物放出動力学に影響を与え、又は他の悪影響を有し得ることである。これらの影響は、第一世代の薬物被覆ステントがより大きい直径に拡張した際にステントにて観察されており、それ故、それらをより大きい直径の動脈にて使用することが阻まれている。更に、アテローム性動脈硬化症血管内でのこのような被覆ステントの拡張は、ポリマー皮膜上に周囲方向のせん断力を与え、このせん断力は、皮膜をその下のステント表面から分離させ得る。かかる分離は、再度、血管閉塞を生じる皮膜断片の塞栓を含む悪影響を有し得る。
【0014】
有益な薬剤のステントベースの局所送達を介して対処し得る別の問題の1つは、血栓症である。ステントは、再狭窄を治療するために、1種以上の治療薬に加えて抗凝固剤を被覆され得る。
〔課題を解決するための手段〕
【0015】
先行技術の不都合に鑑みて、有効なステントの壁厚を増大させることなく、またステントの機械的拡張特性に悪影響を与えることなく、比較的大量の有益な薬剤を血管管腔内の傷ついた部位に送達できると共に、有益な薬剤を含有する表面皮膜に関連した多数の潜在的問題を回避するステントを提供することは有利であろう。
【0016】
更に、異なる孔内に提供された異なる有益な薬剤を有する組織支持デバイスを提供して、2つ又はそれ以上の有益な薬剤の所望の空間的配置を達成することは有利であろう。
【0017】
更に、異なる孔内に提供された異なる有益な薬剤を有する組織支持デバイスを提供して、同一のデバイスからの2つの異なる有益な薬剤に関する所望の異なる放出動力学をもたらすことは有利であろう。
【0018】
更に、全表面が抗血栓剤で被覆された後、内部の孔又は開口部内にプライマーを使用して、孔を満たす1種以上の有益な薬剤の接着を増大させる、組織支持デバイスを提供することは有利であろう。
【図面の簡単な説明】
【0019】
本発明の前述並びに他の特徴及び利点は、付随する図面に示される本発明の好ましい実施形態の、以下のより詳細な説明から明らかとなるであろう。
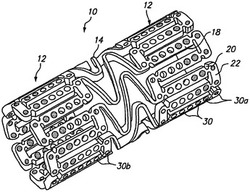
【図1】端部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図2】中心部分に有益な薬剤を有し、端部に有益な薬剤を有さない、本発明による拡張可能な医療デバイスの等角図。
【図3】異なる孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図4】交互孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図5】架橋要素内の開口部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの一部分の拡大された側面図。
【図6】分岐開口部を有する、本発明による拡張可能な医療デバイスの一部分の拡大側面図。
【図7】第一の複数の孔内の、例えば抗炎症剤等の第一の薬剤と、第二の複数の孔内の、例えば抗増殖剤等の第二の薬剤との組み合わせを有する、本発明による拡張可能な医療デバイスの断面図。
【図8】本発明による図7の拡張可能な医療デバイスにより送達される、抗炎症剤及び抗増殖剤の一例の放出速度のグラフ。
【図9A】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図9B】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図9C】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図10】本発明によるカルボン酸末端基を有するPLGAと低分子量PEIとの間の抱合反応を示す図。
【図11】本発明によるカルボン酸末端基を有するPLGAと高分子量又は分枝状PEIとの間の抱合反応を示す図。
【図12】本発明による表面皮膜とリザーバからの放出動力学を示す図。
【発明を実施するための形態】
【0020】
図1は、拡張可能な医療デバイスにより組織に送達するための有益な薬剤を含む複数の孔を有する拡張可能な医療デバイスを示す。図1に示す拡張可能な医療デバイス10は、材料の管から切られて、円筒形の拡張可能なデバイスが形成される。拡張可能な医療デバイス10は、複数の架橋要素14により相互接続された複数の円筒形部分12を含む。架橋要素14は、脈管の曲がりくねった経路を配備部位まで通過する際に、組織支持デバイスが軸方向に屈曲することを可能にし、また支持される管腔の屈曲に一致する必要がある場合、デバイスが軸方向に屈曲することを可能にする。円筒形の管12のそれぞれは、延性ヒンジ20により相互接続された細長いストラット18及び周方向ストラット22の網状組織から形成されている。医療デバイス10の拡張中、延性ヒンジ20は変形する一方、ストラット18は変形しない。拡張可能な医療デバイスの一例の更なる詳細は、その全体が参照により本明細書に組み込まれる米国特許第6,241,762号に記載されている。
【0021】
図1に示すように、細長いストラット18及び周方向ストラット22は開口部30を含み、開口部の数個は、内部に拡張可能な医療デバイスが埋め込まれた管腔に送達するための有益な薬剤を含んでいる。加えて、架橋要素14等のデバイス10の他の部分は、図5に関して下記に説明する開口部を含んでもよい。開口部30は、ストラット18等のデバイス10の非変形部分に提供されて、それ故、デバイスの拡張中に開口部が変形されず、有益な薬剤は破砕、排出又は別様に損傷される危険性なしに送達されることが好ましい。有益な薬剤が開口部30内に充填され得る様式の一例の更なる説明は、その全体が参照により本明細書に組み込まれる2001年9月7日出願の米国特許出願第09/948,987号に記載されている。
【0022】
本発明の例示的な実施形態は、有限要素解析(Finite Element Analysis)及び他の手法を用いて更に改善されて、開口部30内での有益な薬剤の配置を最適化し得る。基本的には、開口部30の形状及び位置は、延性のあるヒンジ部20に対して、相対的に高いストラットの強度及び剛性を維持しつつ、空隙の体積を最大にするように修正することができる。本発明の好ましい例示的な一実施形態によれば、開口部の面積は少なくとも3.2×10−5cm2(5×10−6平方インチ)であり、好ましくは少なくとも4.5×10−5cm2(7×10−6平方インチ)である。一般に、開口部は、約50%〜約95%だけ有益な薬剤で満たされる。
【0023】
定義
用語「薬剤」、「治療薬」又は「有益な薬剤」は、本明細書で使用されるとき、可能な限り広く解釈されることを意図し、任意の治療薬又は薬物、及び例えばバリア層、担体層、治療層又は保護層等の不活性薬剤を含むよう使用される。
【0024】
用語「薬物」及び「治療薬」は、交換可能に使用されて、生物の身体管腔に送達されて、所望の、通常有益な効果を生成する任意の治療的に活性な物質を指す。有益な薬剤は、1種以上の薬物又は治療薬を含んでもよい。
【0025】
本発明は、例えば、抗新生物薬、血管新生阻害剤、血管新生因子、抗炎症剤、例えばラパマイシン等の免疫抑制剤、抗再狭窄剤、抗血小板薬、血管拡張剤、抗血栓剤、パクリタキセル等の抗増殖剤及びヘパリン等の抗トロンビンの送達に特に好適である。
【0026】
用語「浸食」は、媒体又はマトリックスの成分が、化学的又は物理的又は酵素的過程により生体吸収及び/又は分解及び/又は崩壊される過程を意味する。例えば、生分解性ポリマーマトリックスに関して、浸食はポリマー鎖の切断又は加水分解により生じ、それによりマトリックス及び浮遊した有益な薬剤の溶解性が増大し得る。
【0027】
用語「浸食速度」は、浸食過程の発生に要する時間量の尺度であり、通常、単位時間当たりの単位面積で報告される。
【0028】
用語「マトリックス」又は「生体吸収性マトリックス」は、交換可能に使用されて、対象内に埋め込まれた際にこのマトリックスの拒絶をもたらすのに十分な有害な応答を引き出さない媒体又は材料を指す。マトリックスは、通常それ自体で任意の治療応答を提供しないが、本明細書に定義される有益な薬剤を含有又は取り囲むことができる。マトリックスはまた、単に支持、構造的一体性又は構造的バリアを提供することができる媒体でもある。マトリックスは、ポリマー性、非ポリマー性、疎水性、親水性、親油性、両親媒性等であり得る。加えて、生体吸収性マトリックスは、時間と共に身体により完全に吸収されるマトリックスも意味すると理解されるものとする。
【0029】
用語「開口部」は、貫通開口部及び凹部の両方を含む。
【0030】
用語「薬学的に許容され得る」は、宿主又は患者に無毒であり、有益な薬剤の安定性の維持に好適で、また標的細胞又は組織に有益な薬剤を送達することができる特性を指す。
【0031】
用語「ポリマー」は、モノマーと称される2つ又はそれ以上の繰り返し単位の化学結合から形成される分子を指す。したがって、用語「ポリマー」には、例えば二量体、三量体及びオリゴマーが含まれ得る。ポリマーは、合成であっても、天然に存在していても、又は半合成であってもよい。好ましい形態において、用語「ポリマー」は、通常約3000より大きい、好ましくは約10,000より大きいMWを有し、約1000万より小さい、好ましくは約100万、より好ましくは約200,000より小さいMWを有する分子を指す。ポリマーの例は、ポリ乳酸(PLLA又はDLPLA)、ポリグリコール酸、ポリ乳酸−コ−グリコール酸(PLGA)、ポリ乳酸−コ−カプロラクトン等のポリ−.α.−ヒドロキシ酸エステル;ポリ(ブロック−エチレンオキシド−ブロック−ラクチド−コ−グリコリド)ポリマー(PEO−ブロック−PLGA及びPEO−ブロック−PLGA−ブロック−PEO);ポリエチレングリコール及びポリエチレンオキシド、ポリ(ブロック−エチレンオキシド−ブロック−プロピレンオキシド−ブロック−エチレンオキシド);ポリビニルピロリドン;ポリオルトエステル;ポリヒアルロン酸、ポリ(ブドウ糖)、ポリアルギン酸、キチン、キトサン、キトサン誘導体、セルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、シクロデキストリン及び例えばβ−シクロデキストリンスルホブチルエーテル等の置換シクロデキストリン等の多糖及び多糖誘導体;ポリリシン、ポリグルタミン酸、アルブミン等のポリペプチド及びタンパク質;ポリ無水物;ポリヒドロキシバレレート、ポリヒドロキシブチレート等のポリヒドロキシアルカノエートを含むが、これらに限定されない。
【0032】
定方向送達に関する用語「主に」は、血管に提供される治療薬の全量の約50%よりも多い量が、主要な方向に提供されることを指す。
【0033】
本明細書に記載される本発明の様々な例示的な実施形態は、拡張可能なデバイス内の異なる開口部内に異なる有益な薬剤を提供し、又は数個の開口部内に有益な薬剤を提供して他には提供しない。拡張可能な医療デバイスの特定の構造は、本発明の趣旨から逸脱せずに変更することができる。各開口部が独立して満たされるので、各開口部における有益な薬剤に別々の化学組成及び薬物動態学特性を付与することができる。
【0034】
拡張可能な医療デバイス内の異なる開口部内に異なる有益な薬剤を使用すること、又は一部の開口部内にはあるが他の開口部内にはない有益な薬剤の使用の一例は、縁効果再狭窄の対処におけるものである。上記に説明したように、現世代の被覆ステントは、縁効果再狭窄、又はステント縁を丁度超えた箇所で生じ、ステントの周囲及び管腔空間内に進行する再狭窄での困難を有し得る。
【0035】
第一世代の薬物送達ステントにおける縁効果再狭窄の原因は、現在よく理解されていない。血管形成術及び/又はステント埋め込みによる組織損傷領域が、パクリタキセル等の現世代の有益な薬剤の放散範囲を超えて拡大し、これが組織内で強く仕切る傾向を有するためであり得る。同様の現象が放射線療法に観察されており、この療法にてステントの縁における低線量の放射線が、損傷の存在下で刺激性を有することが証明されている。この場合、無傷の組織が照射されるまで、より長い長さに亘り放射することが、問題を解決した。薬物送達ステントの場合、より高い用量若しくはより高い濃度の有益な薬剤をステント縁に沿って配置し、より容易に組織を通して拡散する異なる薬剤をステント縁に配置し、又は異なる有益な薬剤若しくは有益な薬剤の組み合わせをデバイスの縁に配置することは、縁効果再狭窄の問題を改善する助けとなり得る。
【0036】
図1に、縁効果再狭窄を処置及び低減するために「ホットエンド」又は有益な薬剤がデバイスの端部の開口部30a内に提供された拡張可能な医療デバイス10を示す。デバイスの中心部分内のその他の開口部30bは、空(図示するように)であっても、又はより低い濃度の有益な薬剤を含んでいてもよい。
【0037】
縁効果再狭窄の他の機構は、特定の薬物又は薬物の組み合わせの細胞毒性に関するものであり得る。そのような機構は、上皮瘢痕組織形成にて見られるものと同様の組織の物理的又は機械的収縮を含んでもよく、ステントはそれ自体の境界内で収縮反応を防止し得るが、その縁を越えては防止しない。更に、再狭窄のこの後者の形態の機構は、薬物自体がもはや壁内に存在しなくなった後でも発生する動脈壁に対する持続又は局所薬物送達の後遺症に関連している場合がある。即ち、再狭窄は、薬物及び/又は薬物担体に関連した有害な損傷の形態に対する反応であり得る。この状況下で、デバイスの縁から所定の薬剤を排除することは有益であり得る。
【0038】
図2は、デバイスの中心部分内の開口部230bが有益な薬剤で満たされ、デバイスの縁の開口部230aが空のままで残留している、複数の開口部230を有する拡張可能な医療デバイス200の別の例示的な実施形態を示す。図2のデバイスは、「クールエンド」を有すると称される。
【0039】
縁効果再狭窄の低減における使用に加えて、図2の拡張可能な医療デバイス200は、最初のステント配備の手順が追加のステントを用いて補足される必要がある場合、図1の拡張可能な医療デバイス10又は別の薬物送達ステントと共に使用することができる。例えば、場合によっては、「ホットエンド」を有する図1のデバイス10、又は均一な薬物分配を有するデバイスは、不適切に埋め込まれ得る。デバイスが管腔の十分な部分を覆っていないと医者が確定した場合、補足デバイスを現存するデバイスの一端部に、この現存するデバイスと僅かに重なって付加することができる。補足デバイスが埋め込まれる際、図2のデバイス200は、医療デバイス200の「クールエンド」がデバイス10及びデバイス200の重なる部分に有益な薬剤が二重に投与されることを防止するように使用される。
【0040】
図3に、異なる有益な薬剤が拡張可能な医療デバイス300の異なる孔内に配置されている、更なる別の例示的な実施形態を示す。第一の有益な薬剤はデバイス端部の孔330a内に提供され、第二の有益な薬剤は、デバイスの中心部分の孔330b内に提供されている。有益な薬剤は、異なる薬物、異なる濃度の同一の薬物、又は同一の薬物の異なる変更物を含有し得る。図3の例示的な実施形態を使用して、「ホットエンド」又は「クールエンド」のいずれかを有する拡張可能な医療デバイス300を提供することができる。
【0041】
好ましくは、第一の有益な薬剤を含む孔330aを有するデバイス300の各端部は、縁から少なくとも1つの孔から最大約15個の孔まで延びる。この距離は、未拡張デバイスの縁から約0.013〜約0.25cm(約0.005〜約0.1インチ)に対応する。第一の有益な薬剤を含むデバイス300の縁からの距離は、好ましくは約一部分(セクション)であり、ここで一部分は架橋要素間で画定される。
【0042】
異なる薬物を含む異なる有益な薬剤は、ステント内の異なる開口部内に配置され得る。このことは、単一のステントから任意の所望の送達パターンで2種又はそれ以上の有益な薬剤を送達することを可能にする。代替的に、異なる濃度の同一の薬物を含む異なる有益な薬剤を、異なる開口部内に配置してもよい。このことは、非均一なデバイス構造により薬物を組織に均一に分配することを可能にする。
【0043】
本明細書に記載されるデバイス内に提供される2種又はそれ以上の異なる有益な薬剤は、(1)異なる薬物、(2)異なる濃度の同一の薬物、(3)異なる放出動力学、即ち、異なるマトリックス浸食速度を有する同一の薬物又は(4)異なる形態の同一の薬物を含み得る。異なる放出動力学を有する同一の薬物を含む異なる有益な薬剤の例は、異なる担体を使用して、異なる形状の溶出プロファイルをもたらし得る。同一の薬物の異なる形態のいくつかの例は、様々な親水性又は親油性を有する薬物の形態を含む。
【0044】
図3のデバイス300の一例において、デバイスの端部の孔330aは、高い親油性を有する薬物を含有する第一の有益な薬剤で充填される一方、デバイスの中心部分の孔330bは、より低い親油性を有する薬物を含む第二の有益な薬剤で充填される。「ホットエンド」で高い親油性を有する第一の有益な薬剤は、より容易に周辺の組織に放散して、縁効果再狭窄を低減する。
【0045】
デバイス300は、有益な薬剤が第一の薬剤から第二の薬剤へ変化する突然移行ラインを有していてもよい。例えば、デバイス端部の0.13cm(0.05インチ)以内の全開口部が第一の薬剤を含む一方、その他の開口部は第二の薬剤を含んでいてもよい。あるいは、デバイスは、第一の薬剤と第二の薬剤との間の漸進的な移行を有してもよい。例えば、開口部内の薬物の濃度は、デバイス端部に向かって次第に増大(又は低下)してもよい。別の実施例において、デバイス端部に向かって移動するにつれ、開口部内の第一の薬物の量が増加する一方、開口部内の第二の薬物の量は減少する。
【0046】
図4に、拡張可能な医療デバイス400の更なる別の例示的な実施形態を示すが、ここで異なる有益な薬剤は、デバイス内の異なる開口部430a、430b内に交互又は散在様式で配置されている。この様式では、デバイスにより支持される全面積又は面積の一部分上の組織に、多数の有益な薬剤を送達することができる。この例示的な実施形態は、有益な薬剤間の相互作用又は安定性の問題により、多数の薬剤を単一の組成物に組み合わせてデバイス内に充填することが不可能な場合に、多数の有益な薬剤の送達に有用であろう。
【0047】
拡張可能な医療デバイスが拡張形態にて非均一な開口部の分配を有する場合、異なる既定組織領域にて異なる薬物濃度を達成するために、異なる開口部内における異なる有益な薬剤の使用に加えて、異なる開口部内に異なる有益な薬剤を充填して、送達される有益な薬剤のより均一な空間分配を提供することができる。
【0048】
異なる開口部内に異なる薬物を散在又は交互様式にて使用することにより、同一のポリマー/薬物マトリックス組成物中で組み合わされた場合に送達不可能であり得る2種の異なる薬物を送達することができる。例えば、薬物自体は、望ましくないように相互作用し得る。代替的に、2種の薬物は、マトリックス形成用の同一のポリマー、又はポリマー/薬物マトリックスの開口部内への送達用の同一の溶媒と適合可能でなくてもよい。
【0049】
更に、散在配置で異なる開口部内に異なる薬物を有する図4の例示的な実施形態は、異なる薬物を同一の医療デバイス又はステントから極めて異なる所望の放出動力学で送達する能力と、個々の薬剤の作用機構及び性質に応じて放出動力学を最適化する能力とを提供する。例えば、薬剤の水溶性は、ポリマー又は他のマトリックスからの薬剤放出に多大に影響する。高い水溶性を有する化合物は、一般にポリマーマトリックスから非常に迅速に送達される一方、親油性薬剤は同一のマトリックスからより長い時間に亘り送達されるであろう。したがって、親水性薬剤及び親油性薬剤が医療デバイスから二重の薬物の組み合わせとして送達される場合、同一のポリマーマトリクスから送達されるこれら2種の薬剤に関する所望の放出プロファイルをもたらすことは困難である。
【0050】
図4のシステムにより、同一のステントから親水性薬物及び親油性薬物を容易に送達することができる。更に、図4のシステムにより、2種の薬剤を2つの異なる放出動力学及び/又は投与期間にて送達することができる。最初の24時間の各初期放出、最初の24時間後の放出速度、2種の薬物の総投与期間及び任意の他の放出特性は、独立して制御することができる。例えば、第一の有益な薬剤の放出速度を、最初の24時間中に送達される薬物の少なくとも40%(好ましくは、少なくとも50%)が送達されるように準備し、第二の有益な薬剤は最初の24時間中に送達される薬物の20%(好ましくは、10%より少ない)未満が送達されるよう準備することができる。第一の有益な薬剤の投与期間は、約3週間又はそれ未満(好ましくは、2週間又はそれ未満)であってもよく、第二の有益な薬剤の投与期間は、約4週間又はそれ以上であってもよい。
【0051】
再狭窄、即ち介入後の閉塞の再発は、生物学的過程の組み合わせ又は一連の生物学的過程を伴う。これらの過程は、血小板及びマクロファージの活性化を含む。サイトカイン及び増殖因子は、平滑筋細胞増殖に寄与し、遺伝子及びメタロプロテイナーゼの上方制御は、細胞増殖、細胞外マトリックスのリモデリング、及び平滑筋細胞遊走を誘導する。複数のこれらの過程に対処する、薬物の組み合わせによる薬物療法は、最も成功する抗再狭窄療法であり得る。本発明は、そのような成功する組み合わせられた薬物療法を達成する手段を提供する。
【0052】
以下に説明する実施例は、異なる孔又は開口部内の異なる薬物を放出する能力から利益を得る、組み合わせられた薬物システムのいくつかを示す。散在する又は交互の孔から2種の薬物を送達するための有益なシステムの一例は、抗増殖剤又は抗遊走剤と組み合わせた抗炎症剤又は免疫抑制剤の送達である。再狭窄に関与する多数の生物学的過程を標的とするのに、これら薬剤の他の組み合わせも使用することができる。抗炎症剤は血管形成術及びステント配備に対する血管の最初の炎症性反応を緩和し、炎症性反応を刺激するマクロファージの発達のピークに一致させて、最初は速い速度で送達され、その後、約2週間の期間にわたりゆっくりと送達される。抗増殖剤は、より長期間に亘って比較的均等な速度で送達されて、平滑筋細胞の移動及び増殖を低下させる。
【0053】
以下に提供する実施例に加えて、次表は、薬物を医療デバイスの異なる開口部の中に配置することにより達成できる有用な2種薬物複合治療の一部を説明する。
【表1】

【0054】
異なる開口部内に薬物を配置することにより、薬物が疎水性又は疎油性であるかに関わらず、特定の薬剤に対して放出動力学を誂えることができる。実質的に一定又は線形の放出速度における親油性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年12月23日公開の国際公開第04/110302号に記載されている。親水性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年5月27日公開の国際公開第04/043510号に記載されている。上記に列挙した親水性薬物には、CdA、グリベック、VIP、インスリン、及びアポリポタンパク質A−1ミラノが挙げられる。上記に列挙した親油性薬物には、パクリタキセル、エポシロンD、ラパマイシン、ピメクロリムス、PKC−412及びデキサメタゾンが挙げられる。ファルグリタザルは、一部親油性で、一部親水性である。
【0055】
再狭窄に関連した異なる生物学的過程に対処する多数の薬物の送達に加えて、本発明は、同一のステントから2種の異なる薬物を送達して、異なる疾病を処置することができる。例えば、ステントは、例えばパクリタキセル又はリムス(limus)薬等の抗増殖剤を、一組の開口部から送達して再狭窄を処置する一方、例えばインスリン等の心筋保護剤を他の開口部から送達して、急性心筋梗塞を処置することができる。
【0056】
公知の拡張可能なデバイスの多数において、また図5に示したデバイスに関して、デバイス500の適用範囲は、架橋要素514においてよりもデバイスの円筒形の管部分512において大きい。適用範囲は、デバイス表面積の、デバイスが配備される管腔の面積に対する比として定義される。様々な適用範囲を有するデバイスが、デバイス内の開口部内に含まれる有益な薬剤を送達するのに使用される際、円筒形の管部分512に隣接する組織に送達される有益な薬剤の濃度は、架橋要素514に隣接する組織に送達される有益な薬剤の濃度よりも高い。有益な薬剤の不均等な送達濃度に繋がるこのデバイス構造の長手方向の変動性、及びデバイス適用範囲内の他の変動性に対処するために、有益な薬剤の濃度を、デバイスの一部分における開口部内で変動させて、組織全体に対する有益な薬剤の均等な分配を達成し得る。図5に示す例示的な実施形態の場合、管部分512内の開口部530aは、架橋要素514内の開口部530bと比較して低い薬物濃度を有する有益な薬剤を含む。薬剤送達の均一性は、薬物濃度、開口部の直径若しくは形状、開口部内の薬剤の量(即ち、開口部を満たす(filed)割合)、マトリックス材料、又は薬物形態の変更を含む様々な方法でもたらすことができる。
【0057】
異なる開口部内に異なる有益な薬剤を使用する他の適用の例は、血管内の分岐に使用するよう構成された図6に示す拡張可能な医療デバイス600である。分岐デバイスは側部孔610を含み、この側部孔は、血管の側枝を通して血液を流すように配置されている。分岐デバイスの一例は、その全体が参照により本明細書に組み込まれる米国特許第6,293,967号に記載されている。分岐デバイス600は、デバイスのその他の部分を形成するビームの規則的なパターンを中断する側部孔の特徴610を含む。分岐の周囲の領域は、再狭窄に関して特に問題のある領域であるため、抗増殖薬物の濃度は、デバイス600の側部孔610を囲む領域における開口部830a内で増大されて、必要な場所に、増大した濃度の薬物を送達することができる。側部孔から離れた範囲内の残りの開口部630bは、より低い濃度の抗増殖剤を有する有益な薬物を含有する。分岐孔を囲む領域への抗増殖剤送達の増大は、異なる薬物を含有する異なる有益な薬剤、又はより高い濃度の同一の薬物を含有する異なる有益な薬剤により提供され得る。
【0058】
拡張可能な医療デバイスの壁面又は反管腔側に異なる有益な薬剤を送達して、血管壁を処置することに加えて、有益な薬剤は拡張可能な医療デバイスの管腔側に送達されて、血栓症を予防又は低減することができる。デバイスの管腔側から血液流中に送達される薬物は、デバイスの基端部、又はデバイスの先端部に位置していてもよい。
【0059】
異なる有益な薬剤を、拡張可能な医療デバイス内の異なる開口部内に充填するための方法は、例えば浸漬及び被覆等の公知の技術、並びに公知の圧電マイクロジェット技術も含み得る。マイクロインジェクション装置は、コンピュータ制御されて、正確な量の2種又はそれ以上の有益な液体薬剤を、公知の方法にて、拡張可能な医療デバイス上の正確な位置へ送達することができる。例えば、二重薬剤噴射デバイスは、2種の薬剤を同時に又は連続的に開口部内に送達することができる。有益な薬剤が、拡張可能な医療デバイス内の貫通開口部内へ充填される際に、貫通開口部の管腔側は、充填中、弾性マンドレルにより遮断されて、有益な薬剤が液体形態で、例えば溶媒と共に送達されることを可能にし得る。有益な薬剤は、手動インジェクション装置によっても充填することができる。
【実施例】
【0060】
(実施例1)
図7に、ステント内の異なる孔から送達される抗炎症剤及び抗増殖剤を有して、再狭窄の生物学的過程に一致するよう特にプログラムされた2種の薬物の独立した放出動力学を提供する二重薬物ステント700を示す。この実施例によれば、二重薬物ステントは、第一セットの開口部710内の抗炎症剤ピメクロリムスを、第二セットの開口部720内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、ステント孔内のマトリックス材料内に、図8に示す放出動力学をもたらすよう構成された特定のインレー配置にて提供される。各薬物は、再狭窄の処置のために、主として壁面から送達される。
【0061】
図7に示すように、ピメクロリムスは、孔の管腔側にバリア712を用いることにより、ステントの壁面側に定方向送達されるようステント内に提供されている。バリア712は、生分解性ポリマーにより形成されている。ピメクロリムスは、二重相を有する放出動力学を形成する様式で孔内に充填される。ピメクロリムス放出の第一相は、マトリックスの壁面に位置する領域716により提供され、この領域は急速放出製剤を含み、製剤は、ピメクロリムスと生分解性ポリマー(PLGA)とを含み、ここで薬物は高い割合を有し、例えば約10%のポリマーに対して約90%の薬物を含む。放出の第二相は、ピメクロリムスと生分解性ポリマー(PLGA)が、50%のポリマーに対して約50%の薬物の比を有するマトリックスの中心領域714により提供される。図8のグラフから明らかであり得るように、ピメクロリムス放出の第一相は、ほぼ最初の24時間にて約50%の充填薬物を送達する。放出の第二相は、残りの50%を約2週間かけて送達する。この放出は、血管形成術及びステント配備に続く炎症過程の進行に一致するよう詳細にプログラミングされる。2つの領域間で薬物濃度を変えて二相放出を達成することに加えて、又はそれに代替して、異なるポリマー又は異なるコモノマー比の同一のポリマーを、2つの薬物の異なる領域内で使用して、2つの異なる放出速度を達成することができる。
【0062】
パクリタキセルは、図8に示すように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成する様式にて、開口部720内に充填される。パクリタキセル開口部720は3つの領域で充填され、この領域は、孔の管腔側の最小限の薬物を含む主にポリマーの基部領域722、濃度勾配にて提供されるパクリタキセル及びポリマー(PLGA)を有する中心領域724、並びにパクリタキセル放出を制御する主にポリマーを有するキャップ領域726を含む。パクリタキセルは、第一日目にて全薬物負荷の約5〜約15%が初期放出された後、約20〜90日間、実質的に線形放出される。濃度勾配を有する孔内のパクリタキセルに関する配置の更なる例は、上記の国際公開第04/110302号に記載されている。
【0063】
図7に、説明を容易にするために、開口部内の区別される領域として薬物、バリア、及びキャップ領域を示す。これらの領域は不明瞭であり、異なる領域を一体化することにより形成されることを理解するべきである。それ故、バリア層は薬物を有さない主にポリマーであるが、使用する製造過程に応じて、続く領域のいくらかの少量の薬物がバリア領域内に組み込まれ得る。
【0064】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、ピメクロリムスの量は、約50〜約300マイクログラム、好ましくは約100〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。一例において、約200マイクログラムのピメクロリムス及び約20マイクログラムのパクリタキセルが送達される。薬物は、ステント内の交互孔内に位置していてもよい。しかしながら、送達される2種の薬物の用量間の大きな相違に鑑みると、パクリタキセルをステント内の4つの孔の各3番目に配置することが望ましいと思われる。あるいは、低用量の薬物(パクリタキセル)を送達するための孔は、高用量用の孔よりも小さく形成されてもよい。
【0065】
ポリマー/薬物インレーは、その全体が参照により本明細書に組み込まれる2004年4月1日公開の国際公開第04/026182号に記載されている、コンピュータ制御による圧電インジェクション技術により形成される。第一の薬剤のインレーが最初に形成された後、圧電インジェクタを使用して第二の薬剤のインレーが形成され得る。代替的に、国際公開第04/02182号のシステムに二重圧電ディスペンサーを搭載して、2種の薬剤を同時に分配してもよい。
【0066】
(実施例2)
この実施例によれば、二重薬物ステントは、第一セットの開口部710内のグリベックを、第二セットの開口部720内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、図8に示す放出動力学をもたらすよう構成された特定のインレー配置にて、ステントの孔内のマトリックス材料中に提供される。
【0067】
グリベックは、二相放出により送達され、この放出は、第1日目の高い初期放出と、次の1〜2週間の遅延放出とを含む。グリベック放出の第一の相は、ほぼ最初の24時間で、充填した薬物の約50%を送達する。放出の第二の相は、残りの50%を約1〜2週間で送達する。パクリタキセルは、図8に示し、また実施例1にて上述したように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部720内に充填される。
【0068】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、グリベックの量は、約200〜約500マイクログラム、好ましくは約300〜約400マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。実施例1のように、薬物は、ステント内の交互孔内に位置し、又は非交互様式にて散在されていてもよい。ポリマー/薬物インレーは、実施例1に記載した方法で形成される。
【0069】
(実施例3)
この実施例によれば、二重薬物ステントは、第一セットの開口部内のPKC−412(細胞増殖制御因子)を、第二セットの開口部内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、ステントの孔内のマトリックス材料中に、以下に説明する放出動力学をもたらすよう構成された特定のインレー配置で提供される。
【0070】
PKC−412は、実質的に一定の放出速度で送達され、最初の約24時間放出された後、約4〜16週間、好ましくは約6〜12週間の間放出される。パクリタキセルは、最初の約24時間後、約4〜16週間、好ましくは約6〜12週間の間、実質的に線形の放出を有する放出動力学を形成するように、開口部内に充填される。
【0071】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、PKC−412の量は、約100〜約400マイクログラム、好ましくは約150〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。実施例1のように、薬物は、ステント内の交互孔内に位置し、又は非交互様式にて散在されていてもよい。ポリマー/薬物インレーは、実施例1に記載した方法で形成される。
【0072】
治療薬
本発明は、パクリタキセル、ラパマイシン、クラドリビン(CdA)、及びそれらの誘導体を含む抗再狭窄剤、並びに他の細胞毒性又は細胞分裂阻害剤、及び微小管安定化剤の送達に関する。抗再狭窄剤が主に本明細書に記載されているが、本発明は他の薬剤を単独で、又は抗再狭窄剤と組み合わせて送達するのにも使用することができる。本発明と共に使用するための治療薬のいくつかは、主に管腔側から、主に壁面から、又はその両方で、単独で、又は組み合わせで伝達することができ、それらは抗増殖剤、抗トロンビン、シロリムスを含む免疫抑制剤、抗高脂血薬、抗炎症剤、抗新生物薬、抗血小板薬、血管形成剤、血管新生阻害剤、ビタミン、有糸分裂阻害剤、メタプロテアーゼ阻害剤、NOドナー、エストラジオール、抗硬化剤、及び血管作動薬、内皮増殖因子、エストロゲン、β遮断薬、AZ遮断薬、ホルモン、スタチン、インスリン増殖因子、抗酸化剤、膜安定化剤、カルシウム拮抗剤、レチノイド(retenoid)、ビバリルジン、フェノキソジオール、エトポシド、チクロピジン、ジピリダモール及びトラピジルを含むがこれらに限定されず、これらは単独で、又は本明細書に言及した任意の治療薬と組み合わせて送達することができる。治療薬は、いくつか例を挙げれば、ペプチド、リポタンパク質、ポリペプチド、ポリペプチドをコードするポリヌクレオチド、脂質、タンパク質−薬物、タンパク質コンジュゲート薬、酵素、オリゴヌクレオチド及びそれらの誘導体、リボザイム、他の遺伝子材料、細胞、アンチセンス、オリゴヌクレオチド、モノクローナル抗体、血小板、プリオン、ウイルス、細菌、及び内皮細胞等の真核生物細胞、幹細胞、ACE阻害剤、単球/マクロファージ又は血管平滑筋細胞を含む。治療薬は、宿主に投与された際に、所望の薬物に代謝されるプロ−ドラッグであってもよい。加えて、治療薬は、治療層内に組み込まれるに先立って、マイクロカプセル、ミクロスフェア、微小気泡、リポソーム、ニオゾーム(niosome)、乳剤、分散剤又は同様物として予め調製されてもよい。治療薬は、放射性同位体、又は光若しくは超音波エネルギー等の数種の他の形態のエネルギーにより、若しくは全身投与し得る他の循環分子により活性化された薬剤であってもよい。治療薬は、血管新生、再狭窄、細胞増殖、血栓症、血小板凝集、血塊、及び血管拡張の調整を含む多数の機能を実行し得る。
【0073】
抗炎症剤は、例えばアリール酢酸誘導体、例えばジクロフェナク;アリールプロピオン酸誘導体、例えばナプロキセン;及びサリチル酸誘導体、例えばジフルニサル等の非ステロイド性抗炎症剤(NSAID)を含むが、これらに限定されない。抗炎症剤は、デキサメタゾン、アスピリン、プレドニゾロン、及びトライアムシナロン等のグルココルチコイド(ステロイド)、ピルフェニドン、メクロフェナム酸、トラニラスト、並びに非ステロイド性抗炎症剤も含む。抗炎症剤は抗増殖剤と組み合わせて使用されて、抗増殖剤に対する組織反応を緩和し得る。
【0074】
薬剤は更に、抗リンパ球剤;抗マクロファージ物質;免疫調節剤;シクロオキシゲナーゼ阻害剤;抗酸化剤;コレステロール低下薬;スタチン及びアンジオテンシン変換酵素(ACE);繊維素溶解剤;内因性凝固カスケードの阻害剤;抗高リポタンパク血症剤;及び抗血小板剤;2−クロロデオキシアデノシン(2CdA又はクラドリビン)などの抗代謝剤;シロリムス、エベロリムス、タクロリムス、エトポシド、及びミトキサントロン等の免疫抑制剤;2−CdA、IL−1阻害剤、抗CD116/CD18モノクローナル抗体、VCAM又はICAMに対するモノクローナル抗体、亜鉛プロトポルフィリン等の抗白血球剤;NOを上昇させる薬剤等の抗マクロファージ物質;グリタゾン等のインスリンへの細胞感作剤;高密度リポタンパク質(HDL)及び誘導体;並びに、リパトール(lipator)、ロベスタチン、プラナスタチン、アトルバスタチン、シンバスタチン、及びスタチン誘導体等のHDLの合成複製物;アデノシン及びジピリダモール等の血管拡張剤;一酸化窒素供与体;プロスタグランジン及びその誘導体;抗TNF化合物;β遮断薬、ACE阻害剤、及びカルシウムチャンネル遮断薬等の高血圧薬;血管作動性腸管ポリペプチド(VIP)などの血管作動性物質;インスリン;グリタゾン、PPAR作動薬、メトフォルミンなどのインスリンへの細胞感作剤;タンパク質キナーゼ;レステンNGなどのアンチセンスオリゴヌクレオチド;チロフィバン、エプチフィバチド、及びアブシキシマブ等の抗血小板剤;VIP、脳下垂体アデニル酸シクラーゼ活性化ペプチド(PACAP)、アポリポタンパク質A−lミラノ、アムロジピン、ニコランジル、シロスタキソン、及びチエノピリジン等の心臓保護剤;COX−1阻害剤及びCOX−2阻害剤等のシクロオキシゲナーゼ阻害剤;並びにオムニパトリラット等の解糖系の代謝を高めるペチドース(petidose)阻害剤を含み得る。炎症の処置に使用し得る他の薬物には、脂質低下剤、エストロゲン及びプロゲスチン、エンドセリン受容体作動薬及びインターロイキン−6拮抗薬、並びにアディポネクチンが挙げられる。治療薬は、シラスタゾール(cilastazol)及びアデノシン受容体、好ましくはA2A受容体作動薬等のホスホジエステラーゼ阻害薬(PDEi)、リガデノソン等の作動薬も含み得る。
【0075】
薬剤は、遺伝子療法ベースの手法を、拡張可能な医療デバイスと組み合わせて用いて送達することができる。遺伝子療法は、外来遺伝子を細胞又は組織に送達して、標的細胞に外来遺伝子産物を発現させることを指す。遺伝子は、通常、機械的又はベクター仲介による方法のいずれかで送達される。
【0076】
本明細書に記載される薬剤のいくつかは、それらの活性を保存する添加剤と組み合わされてもよい。例えば界面活性剤、制酸薬、抗酸化剤、及び洗剤を含む添加剤を使用してタンパク質薬物の変性及び凝集を最小にすることができる。陰イオン性、陽イオン性、又は非イオン性界面活性剤を使用することができる。非イオン性賦形剤の例には、ソルビトール、ショ糖、トレハロースを含む糖;デキストラン、カルボキシメチル(CM)デキストラン、ジエチルアミノエチル(DEAE)デキストランを含むデキストラン;D−グルコサミン酸、及びD−ブドウ糖ジエチルメルカプタル(mercaptal)を含む糖誘導体;ポリエチレングリコール(PEO)及びポリビニルピロリドン(PVP)を含む合成ポリエステル;D−乳酸、グリコール酸、及びプロピオン酸を含むカルボン酸;n−ドデシル−.β.−D−マルトシド、n−オクチル−.β.−D−グルコシド、PEO−脂肪酸エステル(例えば、ステアリン酸エステル(myrj59)又はオレイン酸エステル)、PEO−ソルビタン−脂肪酸エステル(例えば、Tween 80、PEO−20モノオレイン酸ソルビタン)、ソルビタン−脂肪酸エステル(例えば、SPAN 60、モノステアリン酸ソルビタン)、PEO−グリセリル−脂肪酸エステルを含む、疎水性界面のための親和性を伴う界面活性剤;グリセリル脂肪酸エステル(例えば、モノステアリン酸グリセリル)、PEO−炭化水素−エーテル(例えば、PEO−10オレイルエーテル;トリトンX−100;並びにルブロールが挙げられるが、これらに限定されない。イオン性洗剤の例は、ステアリン酸カルシウム、ステアリン酸マグネシウム、及びステアリン酸亜鉛を含む脂肪酸塩;レシチン及びホスファチジルコリンを含むリン脂質;(PC)CM−PEG;コール酸;ドデシル硫酸ナトリウム(SDS);ドクサート(AOT);並びにタウロコール酸(taumocholic acid)を含むが、これらに限定されない。
【0077】
別の例示的な実施形態によれば、ステント又は管腔内骨格は、本明細書に記載されるように、孔又は開口部内に堆積した1種以上の治療薬に加えて、抗血栓剤で被覆され得る。例示的な一実施形態において、ステントは、内部に開口部を製作され、開口部内に他の治療薬を追加又は堆積するに先立って、担体ビヒクル(ポリマー又はポリマー性マトリックス)を伴う又は伴わない抗血栓剤が、ステント又はこのステントの一部分に付着され得る。この例示的な実施形態において、ステントの管腔側及び反管腔側表面を、また開口部の壁の表面を、抗血栓剤又は皮膜で被覆し得る。代替的な例示的な実施形態において、ステントは、最初に抗血栓剤又は皮膜を被覆された後、開口部が製作され得る。この例示的な実施形態では、管腔側表面と反管腔側表面のみが抗血栓剤又は皮膜を有し、開口部の壁は皮膜を有さない。これらの各実施形態において、任意の数の抗血栓薬剤を、ステントの全部又は一部に付着させることができる。加えて、例えばコーディス社(Cordis Corporation)製のBxベロシティ(Bx Velocity)(登録商標)冠状動脈ステント上のヘパコート(HEPACOAT)(商標)と共に使用されるような任意の数の公知の技術を使用して抗血栓剤をステントに付着させることができる。あるいは、ステントは、抗血栓皮膜とは独立して又はこの皮膜に加えて、粗い表面テクスチャーで加工されてもよく、又はマイクロテクスチャーを有して、細胞付着性及び内皮化を向上させてもよい。加えて、任意の数の治療薬を開口部内に堆積することができ、また、異なる薬剤をステントの異なる領域内に使用することができる。
【0078】
上述したように、本発明によれば、ビンカアルカロイド(すなわちビンブラスチン、ビンクリスチン、及びビノレルビン)等の天然産物、パクリタキセル、エピディポドフィロトキシン(すなわちエトポシド、テニポシド)、抗生物質(ダクチノマイシン(アクチノマイシンD)ダウノルビシン、ドキソルビシン、及びイダルビシン)、アントラサイクリン、ミトキサントロン、ブレオマイシン、プリカマイシン(ミトラマイシン)、及びマイトマイシン、酵素(L−アスパラギンを全身代謝し、自身のアスパラギンの合成能を有さない細胞を枯渇させるL−アスパラギナーゼ)を含む抗増殖剤/有糸分裂阻害剤;G(GP)IIbIIIa阻害剤、及びビトロネクチン受容体拮抗薬などの抗血小板剤;ナイトロジェンマスタード(メクロレタミン、シクロフォスファミド及び類似体、メルファラン、クロラムブシル)、エチレンイミン及びメチルメラミン(ヘキサメチルメラミン及びチオテパ)、アルキルスルホン酸−ブスルファン、ニトロソウレア(カルムスチン(BCNU)及び類似体、ストレプトゾシン)、トラゼン−ダカルバジニン(trazenes-dacarbazinine)(DTIC)等の抗増殖性/抗有糸分裂アルキル化剤;葉酸類似体(メトトレキサート)、ピリミジン類似体(フルオロウラシル、フロクスウリジン、及びシタラビン)、プリン類似体及び関連阻害剤(メルカプトプリン、チオグアニン、ペントスタチン、及び2−クロロデオキシアデノシン{クラドリビン})などの抗増殖性/抗有糸分裂代謝拮抗薬;プラチナ配位錯体(シスプラチン、カルボプラチン)、プロカルバジン、ヒドロキシウレア、ミトタン、アミノグルテチミド;ホルモン(すなわちエストロゲン);抗凝固剤(ヘパリン、合成ヘパリン塩、及び他のトロンビン阻害剤);線維素溶解剤(組織プラスミノゲン活性化剤、ストレプトキナーゼ、及びウロキナーゼ等)、アスピリン、ジピリダモール、チクロピジン、クロピドグレル、アブシキシマブ;抗遊走剤;抗分泌剤(ブレベルジン);副腎皮質ステロイド(コルチゾール、コルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、6α−メチルプレドニゾロン、トリアムシノロン、ベタメタゾン、及びデキサメタゾン)、非ステロイド剤(サリチル酸誘導体すなわちアスピリン;パラ−アミノフェノール誘導体すなわちアセトアミノフェン;インドール及びインデン酢酸(インドメタシン、スリンダク、及びエトドラク)、ヘテロアリール酢酸(トルメチン、ジクロフェナク、及びケトロラク)、アリールプロピオン酸(イブプロフェン及び誘導体)、アントラニル酸(メフェナム酸及びメクロフェナム酸)、エノール酸(ピロキシカム、テノキシカム、フェニルブタゾン、及びオキシフェンタトラゾン)、ナブメトン、金化合物(オーラノフィン、オーロチオグルコース、金チオリンゴ酸ナトリウム)等の抗炎症薬;免疫抑制剤:(シクロスポリン、タクロリムス(FK−506)、シロリムス(ラパマイシン)、アザチオプリン、ミコフェノール酸モフェチル);血管新生剤:血管内皮増殖因子(VEGF)、線維芽細胞成長因子(FGF)、血小板由来成長因子(PDGF)、エリスロポエチン;アンジオテンシン受容体拮抗薬;一酸化窒素供与体;アンチセンスオリゴヌクレオチド及びそれらの組み合わせ;細胞周期阻害剤、mTOR抑制剤、並びに成長因子シグナル伝達キナーゼ阻害剤を含む、任意の数の薬物及び/又は薬剤を使用することができる点に注意することは重要である。
【0079】
図9A、図9B及び図9Cを参照すると、ステントの一部分の図表示が示されている。
【0080】
図9Aに示すように、ステント900は、実質的に円形の複数の開口部902を含む。この例示的な実施形態では、実質的に円形の複数の開口部902は、ステント900の壁を貫通して延びている。換言すれば、実質的に円形の複数の開口部902は、ステントの反管腔側表面904からステントの反管腔側表面906へ延び、ここで壁厚は管腔側表面と反管腔側表面との間の距離として定められる。しかしながら、他の実施形態では開口部はステント900の壁を貫通して延びる必要はない。例えば、開口部又はリザーバは、管腔側表面又は反管腔側表面のいずれか、又は両方から部分的に延びていてよい。図9Aのステント900は、未処理の表面904及び表面906並びに空の開口部902を有する。
【0081】
図9Bでは、少なくとも1つの表面が、治療薬908で被覆されている。治療薬は、好ましくは例えばヘパリン等の抗血栓剤を含む。しかしながら、任意の抗血栓剤を使用することができる。抗血栓剤は、上記に簡略的に記載したように、任意の技術を用いて付着させることができる。この例示的な実施形態では、反管腔側表面及び管腔側表面の両方が、そこに付着された抗血栓剤を有している。加えて、この時点では、複数の実質的に円形の開口部902内に何も存在しないため、開口部902の壁は、そこに付着された幾分かの抗血栓剤を有し得る。開口部910の壁に付着される抗血栓剤の量は、薬物の付着方法に依存する。例えば、薬剤が浸漬被覆により付着される場合、開口部の壁には、薬剤が噴霧被覆技術を用いて付着される場合より多量の薬剤が付着されるであろう。本明細書に記載するように、この例示的な実施形態において、暴露される全表面は、相当の抗血栓皮膜が付着される。しかしながら、別の例示的な実施形態では、特定の表面のみに抗血栓が付着されてよい。例えば、例示的な一実施形態では、血液と接触する表面のみが、抗凝固剤で処理されてよい。尚別の例示的な一実施形態では、片方又は両方の表面が抗血栓剤で被覆され得る一方、開口部の壁は被覆されない。これは、被覆前に開口部を塞ぎ、又は抗血栓剤の付着後に開口部を形成することを含む、多数の方法にて達成することができる。
【0082】
図9Cに、この例示的な実施形態に従った完全なステントを示す。この図に示すように、実質的に円形の複数の開口部902は、再狭窄及び炎症等の血管疾病、又は本明細書に記載される任意の他の疾病(dieses)を治療するための1種以上の治療薬で満たされている。各開口部902は、上記に詳細に説明したように、同一の治療薬又は異なる薬剤で満たされ得る。図に示すように、これらの異なる薬剤912、914及び916は、特定のパターンで使用される。しかしながら、上記に詳細したように、任意の組み合わせが可能であり、1種の薬剤を異なる濃度で使用することも可能である。ラパマイシン等の薬物は、任意の好適な方法にて開口部902内に堆積されることができる。薬剤を堆積する技術には、マイクロピペッティング及び/又はインクジェット充填方法が挙げられる。例示的な一実施形態において、薬物は、開口部内の薬物及び/又は薬物/ポリマーマトリックスが、ステント表面の水平面の下方となり、周辺の組織と接触しないように満たされ得る。代替的に、開口部は、薬物及び/又は薬物/ポリマーマトリックスが、周辺の組織と接触し得るように満たされてもよい。加えて、各薬物の総用量は、多数の薬物が使用される場合、最大の柔軟性をもって構成され得る。加えて、各薬物の放出速度は、個別に制御され得る。例えば、端部付近の開口部は、縁再狭窄を処置するよう、より多量の薬物を含み得る。
【0083】
この例示的な実施形態によれば、孔又は開口部は、最も有効な薬物療法のためにのみ構成されるのではなく、異なる薬物間に物理的分離を形成するためにも構成され得る。この物理的分離は、薬剤の相互作用を防止するのを助けることができる。
【0084】
本明細書で使用されるように、ラパマイシンは、ラパマイシン及び全類似体、誘導体、並びにFKBP12に結合するコンジュゲート、並びに他のイムノフィリンを含み、TORの阻害を含む、ラパマイシンと同一の薬理学的性質を所有する。加えて、本明細書に記載される全薬物及び薬剤の類似体、誘導体及びコンジュゲート。
【0085】
本明細書に記載されるように、内部に貫通孔、孔、リザーバ又は開口部を有するステントは、抗血栓剤及び/又は本明細書に記載されるような薬物若しくは薬物の組み合わせを被覆され、開口部が1種以上の治療薬を、単独で、又は1種若しくはそれ以上のポリマーと組み合わせて満たされることができる。本質的に、ステントは、内部の開口部と共に製作されてもよく、開口部内に治療薬を単独で又は1種若しくはそれ以上のポリマーと組み合わせて添加又は堆積されるに先立って、担体ビヒクルを伴う又は伴わない抗血栓剤が、ステント又はその一部分に付着されてもよい。本明細書に記載される例示的な実施形態において、ステントの管腔側及び反管腔側表面、並びに開口部の壁の表面は、抗血栓剤で被覆されてよい。この例示的な実施形態において、抗血栓剤は、ヘパリン又はその様々な誘導体、例えば低分子量ヘパリン(LMWH)を含むが、任意の数の好適な抗血栓剤を使用することができる。ヘパリン及び/又はLMWHは、非常に高い負電荷を有する。
【0086】
治療薬及び/又はポリマーと治療薬との組み合わせのためのリザーバとなる貫通孔又は開口部の内部表面を含む、本明細書に記載されるステントの全表面は、最初に、共有結合したヘパリン皮膜を付与される。ヘパリン皮膜自体は、それ自体のプライマーによりステントの金属表面に結合され、このプライマーは、略語PEIにより公知の強い陽イオン性のポリマーであるポリ(エチレンイミン)と、ポリマー性陰イオンである硫酸デキストランとの交互層を含む。この種類のプライマーの適用は、当技術分野にて公知であり、米国特許第5,213,898号、同第5,049,403号、同第6,461,665号及び同第6,767,405号を含む多数の特許に記載されている。より詳細には、ヘパリンは、PEI−硫酸デキストラン層を含むプライマーに共有結合され、このプライマーは、次に金属表面に結合される。全表面がヘパリン混合物で被覆されたら、各孔又はリザーバは、本明細書に記載される方法の1つを用いて満たされる。
【0087】
別の例示的な実施形態によれば、本発明は、薬物送達マトリックス、例えば治療薬とポリマーとの組み合わせの、医療デバイス、例えばステントのヘパリン被覆表面に対する接着を改善するための、プライマー組成物及び構成に関する。本発明は、特に、ヘパリン皮膜が医療デバイスの金属又はポリマー表面に共有結合している場合に有利である。本発明において、プライマーは高分子量成分又は低分子量成分を含み、薬物送達マトリックスは、薬物及び/又は他の有益な薬剤並びに賦形剤、好ましくはポリマー性賦形剤を含むことが好ましい。加えて、プライマーはまた、好ましくは、下にある層、例えばヘパリンと反対の電荷及び同様の電荷密度を有する材料を含み得る。
【0088】
任意の他のマトリックス又は皮膜に対するヘパリン被覆表面の結合を増大させるヘパリン層又は皮膜上のプライマーの概念は、通常のヘパリン表面が抗血栓性を付与するために使用され、それ故、実際の使用において覆われないことを考えると独特である。本発明において、本発明のプライマーで覆われるのは、薬物−ポリマーリザーバを保持するステント内の孔又は開口部の内部壁表面のみであり、それ故、リザーバ外のヘパリン表面に実質的に影響を与えずに2つの層間の接着を増強し、薬物−ポリマーマトリックスの潜在的な損失を制限する。本発明によるヘパリン遮断プライマーは、元の意図される用途において生体適合性であることに留意することが重要である。
【0089】
本発明のプライマーは、いかなる種類のステントにも使用することができる。本明細書に記載される例示的な実施形態において、プライマーは図1、図2、図3及び図4に示されるステント(1つ又は複数)と共に使用される。
【0090】
例示的な一実施形態によれば、プライマーは、ポリマー−ポリ(エチレンイミン)コンジュゲート、例えばポリ乳酸−コ−グリコール酸(PLGA)及びポリ(エチレンイミン)PEI及び/又はPLGA−プロタミンを含む。ポリ(エチレンイミン)は強力な陽イオン性のポリマーであり、負に帯電した所定のタンパク質又は多糖に結合する。PEIに加えて、このコンジュゲートにて有用な他の材料は、プロタミンである。プロタミンは、ヘパリンに対する解毒剤として使用される承認された低分子量タンパク質薬物である。それは、僅かに水溶性である。このように、プライマーはヘパリン皮膜及び薬物含有マトリックスの両方と強力に同時に相互作用して、2つの物質間の接着を改善することができる。ヘパリンはポリ(陰イオン)種であるため、例えばプロタミン等のポリ(陽イオン性)種はヘパリンに良好に結合するが、その構造の他の部分においては十分に疎水性で、リザーバ内の薬物ポリマーマトリックスのPLGA成分に良好に結合することができると予想される。
【0091】
PLGAとPEI、及びPEIとヘパリンとの間の結合反応は、イオン結合又は共有結合反応であり得る。図10に、PLGAとPEIとの間の共有結合の例を示す。より詳細には、図10は、カルボン酸末端基を有するPLGAと低分子量PEIとの間の結合反応を示す。あるいは、プライマーは、高分子量PEI又は分枝状PEIを含んでいてもよい。図11を参照すると、カルボン酸末端基を有するPLGAと高分子量又は分枝状PEIとの間の結合反応が示されている。図示するように、反応は、1対1の比又はPLGA−PEI−PLGAのコンジュゲートに関してPLGAとPEIとの間で2:1の比で構成されてもよい。
【0092】
下表は、ヘパリン被覆された表面に対して薬物/高分子複合体の接着を増強するためのプライマーとしてのPEIの有効性を説明する。試験ステントは、リン酸緩衝生理食塩水と、生理液の状態をシミュレートするウシ血清アルブミンとを含む試験媒体中に浸漬される。薬物/ポリマー複合体は、ラパマイシン及びPLGAを含む。
【表2】

【0093】
別の例示的な実施形態において、プライマーは、塩化ベンズアルコニウム及び/若しくはオリゴアルギニンペプチドを含む、ヘパリンに対する低分子量錯化陽イオン、又はポリリシン、ポリ(アルギニン)、プロタミン、ポリ(ジメチルアミノエチル)メタクリレート若しくはポリ(ジメチルアミノエチル)アクリレートを含む高分子量錯化陽イオンを含んでもよい。
【0094】
本発明によれば、薬物複合体のヘパリンへの接着を増強させる方法は、接着促進プライマー、及び続くポリマー/薬物充填溶液の適用、又は接着促進プライマー、次いでカルボキシル末端PLGA若しくはカルボキシル末端PLGAと通常のPLGAとのブレンド及びPLGA/薬物充填溶液の適用を含み得る。
【0095】
本発明のプライマーは、開口部が局所薬物送達マトリックスで満たされるのに先立って、ステント内の孔又は開口部の内部のヘパリン被覆壁に適用される。換言すれば、完成した薬物溶出ステントにおいて、プライマーはヘパリン皮膜表面と薬物送達マトリックス本体との間の空間を占有し、ヘパリン皮膜と薬物送達マトリックスとの間の接着を増強させるであろう。接着の強化は複数の要因によりもたらされ、この要因には陽イオン性プライマーにより電荷中和した後の使用におけるヘパリン皮膜の浸透圧/水浸入の低下、ヘパリン表面単独と比較して低下したヘパリン/陽イオン性プライマー複合体の水性溶解度、イオン結合、共有結合、及びプライマーとポリマー/薬物マトリックスとの間の、表面張力によるより良好な物理的接着等が含まれる。
【0096】
本発明の別の例示的な実施形態において、本発明のプライマーは、負に帯電したヘパリン皮膜に対して結合するための、その分子構造の正に帯電した部分と、薬物送達マトリックスのポリマー成分に結合するための、疎水性、親水性又は均衡の取れた部分とを有することが好ましいであろう。このプライマーの部分は、薬物送達マトリックスの性質に応じて変動するであろう。より詳細には、プライマーは、ステントのヘパリン被覆開口部に対する薬物送達マトリックスの接着を改善して、ステントが、例えば生理食塩水、血液及び/又は組織間液等の水性流体と接触した際に、開口部又はリザーバがどれも、又は実質的にどれもその内容物を損失しないように構成されている。
【0097】
本発明のプライマーは、ステントリザーバのヘパリン被覆内部壁と、リザーバを満たす薬物/ポリマー混合物との間の接着を増強させるものとして詳細に記載されてきたが、このプライマーは、任意の基質をヘパリン被覆表面の部分に付着又は結合させるのに有用であり得る。例えば、血液と接触するプラスチック医療デバイスは、多くの場合、デバイス上の血栓(thrombosis)を最小にするためにヘパリンで被覆されているが、後にその表面に対して結合することが所望される場合がある。溶媒中の本発明のプライマー混合物をデバイスの選択された領域に適用し、溶媒を蒸発させてヘパリン表面上にプライマー被覆領域を提供し、次にそれに続いて新しいサブシステムをプライマーで覆われた領域に結合させてもよい。
【0098】
プライマー材料は、例えばジメチルスルホキシド(DMSO)、N−メチルピロリドン、又はそれらの水混合物等の溶媒中のポリマー性プライマー溶液として有利に適用され、また本願に記載した任意の充填技術を用いてリザーバ内に導入されるであろう。このようなプライマー溶液は、次に乾燥されてヘパリン被覆表面上にプライマー層の皮膜を提供できる。プライマー層の適用は、ステント充填プロセス中、堆積工程を1回のみ必要とすることが好ましい。陽イオン性プライマーの堆積に好適な溶媒の選択は、主としてそのプライマーを溶解する能力と、本明細書に記載される充填装置及び方法に対する適合性とにより決定される。
【0099】
本発明は、単に埋め込み型医療デバイスとして特徴付けることができる。本医療デバイスは、内部に複数の開口部を有する管腔内骨格と、この管腔内骨格の表面及び複数の開口部の表面のうちの少なくとも一部分に付着される、第一の電荷を有する材料を含有する第一の皮膜と、この第一の皮膜の少なくとも一部分に付着した、第二の電荷を有する材料を含有する第二の皮膜であって、第二の電荷が第一の電荷の反対である、第二の皮膜と、複数の開口部のうちの少なくとも1つに堆積された少なくとも1種の治療薬と、を含み、第二の皮膜は、第一の皮膜と少なくとも1種の治療薬との間の中間層として構成されている。
【0100】
第一の皮膜は、本明細書に記載される任意の好適な抗血栓剤を含有していてもよい。例えば、ヘパリン等の多糖を使用することができる。第二の皮膜は、ポリマー性陽イオン、又は本明細書に記載されるような陽イオン性部分を有するポリマー性コンジュゲートを含有してもよい。ポリマー性陽イオンの例には、オリゴアルギニンペプチド、ポリリシン、ポリ(アルギニン)、プロタミン、ポリ(ジメチルアミノエチル)ポリ(エチレンイミン)が挙げられる。ポリマー性陽イオン性コンジュゲートの例には、ポリ乳酸−コ−グリコール酸等の第一の成分、及び上記に挙げた任意の陽イオンを含む第二の成分が挙げられる。治療薬は、抗再狭窄剤、抗炎症剤、抗血栓剤、抗増殖剤、梗塞組織に対する損傷を最小にする薬剤、又はそれらの任意の組み合わせを含み得る。
【0101】
より一般的な意味において、本発明の概念は、親水性表面と疎水性表面との間の結合強度を増大させるプライマーの包含に拡大され得る。例えば、他の対象の親水性表面は、カテーテルと共に使用されるもののような、いわゆる「潤滑性」皮膜と称されている。これらの親水性表面も、多くの場合共有結合されているが、単なるコンフォーマル皮膜であってもよい。潤滑性皮膜で生じる化学構造の例は、ポリビニルピロリドン、ヒドロキシエチルメタクリレート、ポリ(エチレンオキシド)又はポリ(エチレングリコール)及び同様物に基づくものである。
【0102】
別の例示的実施形態によれば、本発明は、ステント内のリザーバからの治療薬の放出動力学を制御することに関する。
【0103】
NEVO(商標)(カリフォルニア州メンロパーク)はRES技術を用いてシロリムスを送達するものである。ステント配備から90〜120日以内に安全に再吸収するPLGAが収容されたリザーバ(RES技術)からのシロリムスの送達は、CYPHER(登録商標)の臨床的効果及び地金ステントと同様の治癒特性を実現する可能性を有する。3.5mmのNEVO(商標)プロトタイプの前臨床的安全性については報告がなされている。この実験は、2.5mm径のNEVO(商標)のプロトタイプデザインの安全性及び放出動力学を評価するために行ったものである。
【0104】
2.5mm径のNEVO(商標)のプロトタイプ、地金ステント(BMS;空のリザーバステント)、及びCYPHER(登録商標)ステントを、ブタの左冠動脈前下行枝(LAD)、左冠動脈回旋枝(LCx)及び/又は右冠状動脈に1、3、8、14、30、60及び90日間(d)埋め込んでシロリムスの放出動力学を評価し、30、90、又は180日間埋め込んで組織病理学及び組織形態計測を評価した。
【0105】
RES技術を利用したNEVO(商標)からのシロリムスの放出動力学は、埋め込み後1〜14日ではCYPHER(登録商標)ステントよりも若干低かった(図12)。しかしながら、NEVO(商標)によって得られたシロリムスの動脈含量は、CYPHER(登録商標)ステントにおけるよりも若干高かった。NEVO(商標)に取り込まれたシロリムス/NEVO(商標)から放出されたシロリムスの量は、CYPHER(登録商標)ステントに取り込まれたシロリムス/CYPHER(登録商標)ステントから放出されたシロリムスの約3.2倍多かった。これらの知見は、RES技術を用いて送達されたシロリムスはCYPHER(登録商標)ステントによって送達された場合と比較してより効率的であり得ることを示すものである。しかしながら、NEVO(商標)によって得られた動脈のシロリムス含量は、過去に安全かつ有効であることが示されている範囲内であった。NEVO(商標)によって得られた動脈のシロリムス含量はCYPHER(登録商標)ステントよりも若干高かったが、NEVO(商標)による血管の治癒効果は地金ステント及びCYPHER(登録商標)ステントと同様であった。ステントはすべて、30日目に内皮形成されていた。NEVO(商標)におけるストラット周囲の炎症スコアは最小であり、30日目では地金ステントにおけるよりも大幅に低かった(NEVO(商標):0.87±0.60に対し、地金ステント:1.05±0.19、p<0.05;CYPHER(登録商標)ステント:1.07±0.60)。炎症は90及び180日目に最小に維持され、群間で差は認められなかった。新生内膜の厚さは、ステント群間で差は見られなかった(30日目において、NEVO(商標):0.21±0.07mm、CYPHER(登録商標)ステント:0.22±0.10mm、地金ステント:0.18±0.05mm)。予想されたように、30日後のNEVO(商標)及びCYPHER(登録商標)ステントにおけるストラット周囲のフィブリンは地金ステントよりも大幅に高く、90及び180日目には次第に減少した。これらの知見は3.5mm径のNEVO(商標)プロトタイプで以前に観察されたものと一致していた。
【0106】
シロリムスを送達するためにRES技術を用いたNEVO(商標)プロトタイプは、CYPHER(登録商標)ステントよりも効率的であるが、血管治癒効果はCYPHER(登録商標)ステント及び地金ステントと同等である。更に、2.5及び3.5mm径のNEVO(商標)プロトタイプの安全性プロファイルは同等であった。
【0107】
最も実際的で好ましいと思われる実施形態を示し記載したが、記載し示した特定の構成及び方法からの逸脱は、それ自体が当業者に示唆され、本発明の趣旨から逸脱することなく使用され得ることは明らかである。本発明は、記載及び図示された特定の構造に限定されず、添付の特許請求の範囲内に含まれ得る全ての変更物と一致するよう構成されるべきである。
【0108】
〔実施態様〕
(1) 内部に複数の開口部を有し、ほぼ管状の形態を有するとともに複数の架橋要素によって相互連結された複数の円筒形部分を含む管腔内骨格であって、前記円筒形部分のそれぞれは、延性ヒンジ及び周方向ストラットによって相互連結された細長いストラットの網状組織で形成されている、管腔内骨格と、
前記複数の開口部のうちの少なくとも1つに堆積した少なくとも1種の治療薬であって、周辺組織中への前記治療薬の放出速度及び全放出量を制御するためにPLGAマトリックス中に取り込まれ、ラパマイシンを含む、治療薬と、を含む、埋め込み型医療デバイス。
【開示の内容】
【0001】
〔技術分野〕
本願は2009年1月30日に出願された米国仮特許出願第61/148,610号の利益を主張するものである。
【0002】
本発明は、組織を支持する医療デバイスに関し、より詳細には、臓器を支持し、開通性を維持するために、生きている動物又はヒトの体腔内に埋め込まれ、複数の有益な薬剤の介入部位への送達のための開口部、並びに抗血栓剤の表面皮膜を有する、拡張可能な固定型デバイスに関する。
【0003】
〔背景技術〕
(関連技術の考察)
従来、身体通路内に埋め込んで、通路の開通性を維持するための永久又は生分解性デバイスが開発されてきた。これらのデバイスは、通常、経皮的に導入され、所望の位置に配置されるまで、経腔的に移送される。次いで、これらのデバイスは、デバイスの内部に配置されたマンドレル又はバルーンの拡張等により機械的に、又は身体内での作動時に貯蔵エネルギーを放出することによりそれ自体を拡張する。一旦管腔内で拡張したら、ステントと称されるこれらのデバイスは、身体組織内に閉じ込められた状態となり、永久インプラントとして残留する。
【0004】
公知のステントのデザインには、単繊維ワイヤコイルステント(米国特許第4,969,458号)、溶接金属ケージ(米国特許第4,733,665号及び同第4,776,337号)並びに、最も顕著には、周囲に軸方向スロットを有する薄壁金属円筒(米国特許第4,733,665号、同第4,739,762号及び同第4,776,337号)が挙げられる。ステントに使用するための公知の構成材料には、ポリマー、有機織物、及び、例えばステンレス鋼、金、銀、タンタル、チタン等の生体適合性金属、並びに例えばニッケル−チタン等の形状記憶合金が挙げられる。
【0005】
その全体が参照により本明細書に組み込まれる米国特許第6,241,762号は、これまでのステントのいくつかの性能不備を改良する非角柱ステントデザインを開示している。加えて、この特許に開示されている好ましい実施形態は、大きい非変形性ストラット及び連結要素を有するステントを提供し、このステントは、ストラット若しくは連結要素、又はデバイス全体の機械的特性を損なわずに孔を含み得る。更に、これらの孔は、ステント上の表面皮膜を必要とすることなく、様々な有益な薬剤をデバイス埋め込み部位に送達するための、大きい保護されたリザーバとしての役割を果たし得る。
【0006】
有益な薬剤のステントベースの局所送達により対処し得る多数の問題の中でも、最も重要なものの1つは再狭窄である。再狭窄は、例えば血管形成術及びステントの埋め込み等の血管介入後に生じ得る主な合併症である。簡単に定義すると、再狭窄とは、細胞外マトリックス沈着及び血管平滑筋増殖による血管腔径を縮小させる創傷治癒過程であり、最終的に管腔の再狭小化又は再閉塞さえももたらし得る。改良された外科技術、デバイス及び薬剤の導入にも関わらず、地金ステントに関する全再狭窄率は、尚、血管形成術から6〜12カ月以内で約25%〜約50%の範囲にあることが報告されている。この状態を処置するために、高い頻度で、追加の血管再建術が必要であり、それにより患者に対する外傷及び危険性が増大する。
【0007】
様々な有益な薬剤の表面皮膜を有する従来のステントは、再狭窄の低下に期待できる結果を示している。例えば米国特許第5,716,981号は、ポリマー担体及びパクリタキセルを含有する組成物で表面被覆されたステントを開示している。同特許は、噴霧及び浸漬等のステント表面を被覆するための方法、並びに皮膜自体の望ましい特徴の詳細な説明を提供している。それは「ステントを滑らか、かつ均等に被覆する」及び「抗血管新生因子の均一で、予想可能な、持続放出を提供する」べきである。しかしながら、表面皮膜は、有益な薬剤の放出動力学を実際に制御することはほとんどないと思われる。これらの皮膜は必然的に非常に薄く、通常深さ5〜8マイクロメートルである。それと比較してステントの表面積は非常に大きいため、有益な薬剤の全容積は周囲組織内に放出する非常に短い放散経路を有している。得られる累積的な薬物放出プロファイルは、所望の「均一な、持続放出」、即ち線形的な放出ではなく、大きい初期バーストと、その後の漸近線への急速な接近により特徴づけられる。
【0008】
表面皮膜の厚さの増大には、薬物放出をよりよく制御する能力及び薬物負荷の増加を可能にする能力を含む、薬物放出動力学を改善する有益な効果がある。しかしながら、皮膜の厚さを増大させる結果、ステント壁の全厚が増大する。このことは、多数の理由により望ましくなく、この理由には、埋め込み中に血管腔に対する外傷が増大する可能性、埋め込み後の管腔の流断面の減少並びに拡張及び埋め込み中の皮膜の機械的破損又は損傷の受け易さが含まれる。皮膜の厚さは、有益な薬剤の放出動力学に影響を与えるいくつかの要素の1つであり、したがって厚さに対する制限は、達成し得る放出速度、持続時間等の範囲を制限する。
【0009】
表面皮膜はまた、ステントから多種の薬物の送達を制限し得る。例えば、複数の薬物が表面皮膜から放出される場合、放出速度、送達期間及び他の放出特性は、簡易な方法で独立して制御することはできない。しかしながら、再狭窄は多数の生物学的過程を含み、これら異なる生物学的過程に作用するよう選択された薬物の組み合わせによって最も効果的に処置し得る。
【0010】
チャオ・ウェイ・ファン(Chao-Wei Hwang)らによる「生理学上の輸送力はステントベースの送達に関する薬物分布に影響を与える(Physiological Transport Forces Govern Drug Distribution for Stent-Based Delivery)」と題された論文は、薬物溶出ステントの空間的及び時間的な薬物分布特性と、細胞の薬物輸送機構との間の相互関係が重要であることを明らかにしている。機械的性能及び構造的特性の向上の追求において、ステント設計は、ステントのストラットの周辺方向及び長手方向の分布における固有の不均一性を有する、より複雑な形状に進化してきた。この傾向の例は、身体の管腔内に配置された際にほぼダイアモンド形又は多角形に拡張する、市販の一般的なステントである。両方が、表面皮膜の形態にて有益な薬剤を送達することに使用されてきた。研究により、ストラットのすぐ近傍にある管腔組織部分は、より遠方の、例えば「ダイアモンド」形のストラットセルの中央に位置する組織部分等よりも、遥かに高い濃度の薬物を獲得することが示されている。有意には、この管腔壁内での薬物の濃度勾配は、今日まで最も有効な抗再狭窄剤であると証明されているパクリタキセル又はラパマイシン等の疎水性の有益な薬剤に関して、長期間に亘って高いままであることである。局所薬物濃度と勾配は、生物学的効果に密接に関連するため、有益な薬剤の源(ステントストラット)の最初の空間的分布が有効性の鍵である。
【0011】
有益な薬剤の準最適な空間的分布に加えて、表面被覆ステントには更なる潜在的な不都合が存在する。デバイス皮膜に頻繁に使用される所定の固定マトリックスポリマー担体は、通常、有意な割合の有益な薬剤を皮膜内に永久に保持する。これらの有益な薬剤、例えばパクリタキセルは細胞毒性を有する場合があるため、慢性炎症、遅発性血栓症及び血管壁の治癒が遅れる又は完全には治癒しないといった亜急性及び慢性の問題が発生し得る。加えて、担体ポリマー自体が多くの場合、血管壁の組織に対して炎症性を有する。他方では、ステント表面上の生分解性ポリマー担体の使用により、ポリマー担体が分解した後に「不完全密着」がもたらされ、即ちステントと血管壁の組織との間の隙間が生じ得る。この隙間により、ステントと隣接する組織との間で差動運動が可能となる。結果として生じる問題として、ミクロ摩耗及び炎症、ステント移動並びに血管壁の再内皮形成(re-endothelialize)の不成功が挙げられる。
【0012】
早期ヒト臨床試験は、第一世代の薬物送達デバイスに関連した所定の不都合が存在し得ることを示唆している。薬物被覆されたステント埋め込み後6〜18ヶ月目における、臨床試験患者のフォローアップ検査は、有意な数の患者にステントストラットの動脈壁に対する不完全密着及び縁効果再狭窄が発生し得ることを示している。縁効果再狭窄は、ステントの基端及び先端を丁度超えた箇所に生じ、ステント縁の周囲及び内部(管腔)空間に進行し、繰り返される患者の血管再開通術を高い頻度で必要とする。
【0013】
他の潜在的な不都合の1つは、ステントの拡張が、覆っているポリマー皮膜に応力を加えて、皮膜を剥離、亀裂又は断裂させ、それが薬物放出動力学に影響を与え、又は他の悪影響を有し得ることである。これらの影響は、第一世代の薬物被覆ステントがより大きい直径に拡張した際にステントにて観察されており、それ故、それらをより大きい直径の動脈にて使用することが阻まれている。更に、アテローム性動脈硬化症血管内でのこのような被覆ステントの拡張は、ポリマー皮膜上に周囲方向のせん断力を与え、このせん断力は、皮膜をその下のステント表面から分離させ得る。かかる分離は、再度、血管閉塞を生じる皮膜断片の塞栓を含む悪影響を有し得る。
【0014】
有益な薬剤のステントベースの局所送達を介して対処し得る別の問題の1つは、血栓症である。ステントは、再狭窄を治療するために、1種以上の治療薬に加えて抗凝固剤を被覆され得る。
〔課題を解決するための手段〕
【0015】
先行技術の不都合に鑑みて、有効なステントの壁厚を増大させることなく、またステントの機械的拡張特性に悪影響を与えることなく、比較的大量の有益な薬剤を血管管腔内の傷ついた部位に送達できると共に、有益な薬剤を含有する表面皮膜に関連した多数の潜在的問題を回避するステントを提供することは有利であろう。
【0016】
更に、異なる孔内に提供された異なる有益な薬剤を有する組織支持デバイスを提供して、2つ又はそれ以上の有益な薬剤の所望の空間的配置を達成することは有利であろう。
【0017】
更に、異なる孔内に提供された異なる有益な薬剤を有する組織支持デバイスを提供して、同一のデバイスからの2つの異なる有益な薬剤に関する所望の異なる放出動力学をもたらすことは有利であろう。
【0018】
更に、全表面が抗血栓剤で被覆された後、内部の孔又は開口部内にプライマーを使用して、孔を満たす1種以上の有益な薬剤の接着を増大させる、組織支持デバイスを提供することは有利であろう。
【図面の簡単な説明】
【0019】
本発明の前述並びに他の特徴及び利点は、付随する図面に示される本発明の好ましい実施形態の、以下のより詳細な説明から明らかとなるであろう。
【図1】端部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図2】中心部分に有益な薬剤を有し、端部に有益な薬剤を有さない、本発明による拡張可能な医療デバイスの等角図。
【図3】異なる孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図4】交互孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図5】架橋要素内の開口部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの一部分の拡大された側面図。
【図6】分岐開口部を有する、本発明による拡張可能な医療デバイスの一部分の拡大側面図。
【図7】第一の複数の孔内の、例えば抗炎症剤等の第一の薬剤と、第二の複数の孔内の、例えば抗増殖剤等の第二の薬剤との組み合わせを有する、本発明による拡張可能な医療デバイスの断面図。
【図8】本発明による図7の拡張可能な医療デバイスにより送達される、抗炎症剤及び抗増殖剤の一例の放出速度のグラフ。
【図9A】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図9B】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図9C】本発明による拡張可能な医療デバイスの別の例示的な実施形態の部分図表示。
【図10】本発明によるカルボン酸末端基を有するPLGAと低分子量PEIとの間の抱合反応を示す図。
【図11】本発明によるカルボン酸末端基を有するPLGAと高分子量又は分枝状PEIとの間の抱合反応を示す図。
【図12】本発明による表面皮膜とリザーバからの放出動力学を示す図。
【発明を実施するための形態】
【0020】
図1は、拡張可能な医療デバイスにより組織に送達するための有益な薬剤を含む複数の孔を有する拡張可能な医療デバイスを示す。図1に示す拡張可能な医療デバイス10は、材料の管から切られて、円筒形の拡張可能なデバイスが形成される。拡張可能な医療デバイス10は、複数の架橋要素14により相互接続された複数の円筒形部分12を含む。架橋要素14は、脈管の曲がりくねった経路を配備部位まで通過する際に、組織支持デバイスが軸方向に屈曲することを可能にし、また支持される管腔の屈曲に一致する必要がある場合、デバイスが軸方向に屈曲することを可能にする。円筒形の管12のそれぞれは、延性ヒンジ20により相互接続された細長いストラット18及び周方向ストラット22の網状組織から形成されている。医療デバイス10の拡張中、延性ヒンジ20は変形する一方、ストラット18は変形しない。拡張可能な医療デバイスの一例の更なる詳細は、その全体が参照により本明細書に組み込まれる米国特許第6,241,762号に記載されている。
【0021】
図1に示すように、細長いストラット18及び周方向ストラット22は開口部30を含み、開口部の数個は、内部に拡張可能な医療デバイスが埋め込まれた管腔に送達するための有益な薬剤を含んでいる。加えて、架橋要素14等のデバイス10の他の部分は、図5に関して下記に説明する開口部を含んでもよい。開口部30は、ストラット18等のデバイス10の非変形部分に提供されて、それ故、デバイスの拡張中に開口部が変形されず、有益な薬剤は破砕、排出又は別様に損傷される危険性なしに送達されることが好ましい。有益な薬剤が開口部30内に充填され得る様式の一例の更なる説明は、その全体が参照により本明細書に組み込まれる2001年9月7日出願の米国特許出願第09/948,987号に記載されている。
【0022】
本発明の例示的な実施形態は、有限要素解析(Finite Element Analysis)及び他の手法を用いて更に改善されて、開口部30内での有益な薬剤の配置を最適化し得る。基本的には、開口部30の形状及び位置は、延性のあるヒンジ部20に対して、相対的に高いストラットの強度及び剛性を維持しつつ、空隙の体積を最大にするように修正することができる。本発明の好ましい例示的な一実施形態によれば、開口部の面積は少なくとも3.2×10−5cm2(5×10−6平方インチ)であり、好ましくは少なくとも4.5×10−5cm2(7×10−6平方インチ)である。一般に、開口部は、約50%〜約95%だけ有益な薬剤で満たされる。
【0023】
定義
用語「薬剤」、「治療薬」又は「有益な薬剤」は、本明細書で使用されるとき、可能な限り広く解釈されることを意図し、任意の治療薬又は薬物、及び例えばバリア層、担体層、治療層又は保護層等の不活性薬剤を含むよう使用される。
【0024】
用語「薬物」及び「治療薬」は、交換可能に使用されて、生物の身体管腔に送達されて、所望の、通常有益な効果を生成する任意の治療的に活性な物質を指す。有益な薬剤は、1種以上の薬物又は治療薬を含んでもよい。
【0025】
本発明は、例えば、抗新生物薬、血管新生阻害剤、血管新生因子、抗炎症剤、例えばラパマイシン等の免疫抑制剤、抗再狭窄剤、抗血小板薬、血管拡張剤、抗血栓剤、パクリタキセル等の抗増殖剤及びヘパリン等の抗トロンビンの送達に特に好適である。
【0026】
用語「浸食」は、媒体又はマトリックスの成分が、化学的又は物理的又は酵素的過程により生体吸収及び/又は分解及び/又は崩壊される過程を意味する。例えば、生分解性ポリマーマトリックスに関して、浸食はポリマー鎖の切断又は加水分解により生じ、それによりマトリックス及び浮遊した有益な薬剤の溶解性が増大し得る。
【0027】
用語「浸食速度」は、浸食過程の発生に要する時間量の尺度であり、通常、単位時間当たりの単位面積で報告される。
【0028】
用語「マトリックス」又は「生体吸収性マトリックス」は、交換可能に使用されて、対象内に埋め込まれた際にこのマトリックスの拒絶をもたらすのに十分な有害な応答を引き出さない媒体又は材料を指す。マトリックスは、通常それ自体で任意の治療応答を提供しないが、本明細書に定義される有益な薬剤を含有又は取り囲むことができる。マトリックスはまた、単に支持、構造的一体性又は構造的バリアを提供することができる媒体でもある。マトリックスは、ポリマー性、非ポリマー性、疎水性、親水性、親油性、両親媒性等であり得る。加えて、生体吸収性マトリックスは、時間と共に身体により完全に吸収されるマトリックスも意味すると理解されるものとする。
【0029】
用語「開口部」は、貫通開口部及び凹部の両方を含む。
【0030】
用語「薬学的に許容され得る」は、宿主又は患者に無毒であり、有益な薬剤の安定性の維持に好適で、また標的細胞又は組織に有益な薬剤を送達することができる特性を指す。
【0031】
用語「ポリマー」は、モノマーと称される2つ又はそれ以上の繰り返し単位の化学結合から形成される分子を指す。したがって、用語「ポリマー」には、例えば二量体、三量体及びオリゴマーが含まれ得る。ポリマーは、合成であっても、天然に存在していても、又は半合成であってもよい。好ましい形態において、用語「ポリマー」は、通常約3000より大きい、好ましくは約10,000より大きいMWを有し、約1000万より小さい、好ましくは約100万、より好ましくは約200,000より小さいMWを有する分子を指す。ポリマーの例は、ポリ乳酸(PLLA又はDLPLA)、ポリグリコール酸、ポリ乳酸−コ−グリコール酸(PLGA)、ポリ乳酸−コ−カプロラクトン等のポリ−.α.−ヒドロキシ酸エステル;ポリ(ブロック−エチレンオキシド−ブロック−ラクチド−コ−グリコリド)ポリマー(PEO−ブロック−PLGA及びPEO−ブロック−PLGA−ブロック−PEO);ポリエチレングリコール及びポリエチレンオキシド、ポリ(ブロック−エチレンオキシド−ブロック−プロピレンオキシド−ブロック−エチレンオキシド);ポリビニルピロリドン;ポリオルトエステル;ポリヒアルロン酸、ポリ(ブドウ糖)、ポリアルギン酸、キチン、キトサン、キトサン誘導体、セルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、シクロデキストリン及び例えばβ−シクロデキストリンスルホブチルエーテル等の置換シクロデキストリン等の多糖及び多糖誘導体;ポリリシン、ポリグルタミン酸、アルブミン等のポリペプチド及びタンパク質;ポリ無水物;ポリヒドロキシバレレート、ポリヒドロキシブチレート等のポリヒドロキシアルカノエートを含むが、これらに限定されない。
【0032】
定方向送達に関する用語「主に」は、血管に提供される治療薬の全量の約50%よりも多い量が、主要な方向に提供されることを指す。
【0033】
本明細書に記載される本発明の様々な例示的な実施形態は、拡張可能なデバイス内の異なる開口部内に異なる有益な薬剤を提供し、又は数個の開口部内に有益な薬剤を提供して他には提供しない。拡張可能な医療デバイスの特定の構造は、本発明の趣旨から逸脱せずに変更することができる。各開口部が独立して満たされるので、各開口部における有益な薬剤に別々の化学組成及び薬物動態学特性を付与することができる。
【0034】
拡張可能な医療デバイス内の異なる開口部内に異なる有益な薬剤を使用すること、又は一部の開口部内にはあるが他の開口部内にはない有益な薬剤の使用の一例は、縁効果再狭窄の対処におけるものである。上記に説明したように、現世代の被覆ステントは、縁効果再狭窄、又はステント縁を丁度超えた箇所で生じ、ステントの周囲及び管腔空間内に進行する再狭窄での困難を有し得る。
【0035】
第一世代の薬物送達ステントにおける縁効果再狭窄の原因は、現在よく理解されていない。血管形成術及び/又はステント埋め込みによる組織損傷領域が、パクリタキセル等の現世代の有益な薬剤の放散範囲を超えて拡大し、これが組織内で強く仕切る傾向を有するためであり得る。同様の現象が放射線療法に観察されており、この療法にてステントの縁における低線量の放射線が、損傷の存在下で刺激性を有することが証明されている。この場合、無傷の組織が照射されるまで、より長い長さに亘り放射することが、問題を解決した。薬物送達ステントの場合、より高い用量若しくはより高い濃度の有益な薬剤をステント縁に沿って配置し、より容易に組織を通して拡散する異なる薬剤をステント縁に配置し、又は異なる有益な薬剤若しくは有益な薬剤の組み合わせをデバイスの縁に配置することは、縁効果再狭窄の問題を改善する助けとなり得る。
【0036】
図1に、縁効果再狭窄を処置及び低減するために「ホットエンド」又は有益な薬剤がデバイスの端部の開口部30a内に提供された拡張可能な医療デバイス10を示す。デバイスの中心部分内のその他の開口部30bは、空(図示するように)であっても、又はより低い濃度の有益な薬剤を含んでいてもよい。
【0037】
縁効果再狭窄の他の機構は、特定の薬物又は薬物の組み合わせの細胞毒性に関するものであり得る。そのような機構は、上皮瘢痕組織形成にて見られるものと同様の組織の物理的又は機械的収縮を含んでもよく、ステントはそれ自体の境界内で収縮反応を防止し得るが、その縁を越えては防止しない。更に、再狭窄のこの後者の形態の機構は、薬物自体がもはや壁内に存在しなくなった後でも発生する動脈壁に対する持続又は局所薬物送達の後遺症に関連している場合がある。即ち、再狭窄は、薬物及び/又は薬物担体に関連した有害な損傷の形態に対する反応であり得る。この状況下で、デバイスの縁から所定の薬剤を排除することは有益であり得る。
【0038】
図2は、デバイスの中心部分内の開口部230bが有益な薬剤で満たされ、デバイスの縁の開口部230aが空のままで残留している、複数の開口部230を有する拡張可能な医療デバイス200の別の例示的な実施形態を示す。図2のデバイスは、「クールエンド」を有すると称される。
【0039】
縁効果再狭窄の低減における使用に加えて、図2の拡張可能な医療デバイス200は、最初のステント配備の手順が追加のステントを用いて補足される必要がある場合、図1の拡張可能な医療デバイス10又は別の薬物送達ステントと共に使用することができる。例えば、場合によっては、「ホットエンド」を有する図1のデバイス10、又は均一な薬物分配を有するデバイスは、不適切に埋め込まれ得る。デバイスが管腔の十分な部分を覆っていないと医者が確定した場合、補足デバイスを現存するデバイスの一端部に、この現存するデバイスと僅かに重なって付加することができる。補足デバイスが埋め込まれる際、図2のデバイス200は、医療デバイス200の「クールエンド」がデバイス10及びデバイス200の重なる部分に有益な薬剤が二重に投与されることを防止するように使用される。
【0040】
図3に、異なる有益な薬剤が拡張可能な医療デバイス300の異なる孔内に配置されている、更なる別の例示的な実施形態を示す。第一の有益な薬剤はデバイス端部の孔330a内に提供され、第二の有益な薬剤は、デバイスの中心部分の孔330b内に提供されている。有益な薬剤は、異なる薬物、異なる濃度の同一の薬物、又は同一の薬物の異なる変更物を含有し得る。図3の例示的な実施形態を使用して、「ホットエンド」又は「クールエンド」のいずれかを有する拡張可能な医療デバイス300を提供することができる。
【0041】
好ましくは、第一の有益な薬剤を含む孔330aを有するデバイス300の各端部は、縁から少なくとも1つの孔から最大約15個の孔まで延びる。この距離は、未拡張デバイスの縁から約0.013〜約0.25cm(約0.005〜約0.1インチ)に対応する。第一の有益な薬剤を含むデバイス300の縁からの距離は、好ましくは約一部分(セクション)であり、ここで一部分は架橋要素間で画定される。
【0042】
異なる薬物を含む異なる有益な薬剤は、ステント内の異なる開口部内に配置され得る。このことは、単一のステントから任意の所望の送達パターンで2種又はそれ以上の有益な薬剤を送達することを可能にする。代替的に、異なる濃度の同一の薬物を含む異なる有益な薬剤を、異なる開口部内に配置してもよい。このことは、非均一なデバイス構造により薬物を組織に均一に分配することを可能にする。
【0043】
本明細書に記載されるデバイス内に提供される2種又はそれ以上の異なる有益な薬剤は、(1)異なる薬物、(2)異なる濃度の同一の薬物、(3)異なる放出動力学、即ち、異なるマトリックス浸食速度を有する同一の薬物又は(4)異なる形態の同一の薬物を含み得る。異なる放出動力学を有する同一の薬物を含む異なる有益な薬剤の例は、異なる担体を使用して、異なる形状の溶出プロファイルをもたらし得る。同一の薬物の異なる形態のいくつかの例は、様々な親水性又は親油性を有する薬物の形態を含む。
【0044】
図3のデバイス300の一例において、デバイスの端部の孔330aは、高い親油性を有する薬物を含有する第一の有益な薬剤で充填される一方、デバイスの中心部分の孔330bは、より低い親油性を有する薬物を含む第二の有益な薬剤で充填される。「ホットエンド」で高い親油性を有する第一の有益な薬剤は、より容易に周辺の組織に放散して、縁効果再狭窄を低減する。
【0045】
デバイス300は、有益な薬剤が第一の薬剤から第二の薬剤へ変化する突然移行ラインを有していてもよい。例えば、デバイス端部の0.13cm(0.05インチ)以内の全開口部が第一の薬剤を含む一方、その他の開口部は第二の薬剤を含んでいてもよい。あるいは、デバイスは、第一の薬剤と第二の薬剤との間の漸進的な移行を有してもよい。例えば、開口部内の薬物の濃度は、デバイス端部に向かって次第に増大(又は低下)してもよい。別の実施例において、デバイス端部に向かって移動するにつれ、開口部内の第一の薬物の量が増加する一方、開口部内の第二の薬物の量は減少する。
【0046】
図4に、拡張可能な医療デバイス400の更なる別の例示的な実施形態を示すが、ここで異なる有益な薬剤は、デバイス内の異なる開口部430a、430b内に交互又は散在様式で配置されている。この様式では、デバイスにより支持される全面積又は面積の一部分上の組織に、多数の有益な薬剤を送達することができる。この例示的な実施形態は、有益な薬剤間の相互作用又は安定性の問題により、多数の薬剤を単一の組成物に組み合わせてデバイス内に充填することが不可能な場合に、多数の有益な薬剤の送達に有用であろう。
【0047】
拡張可能な医療デバイスが拡張形態にて非均一な開口部の分配を有する場合、異なる既定組織領域にて異なる薬物濃度を達成するために、異なる開口部内における異なる有益な薬剤の使用に加えて、異なる開口部内に異なる有益な薬剤を充填して、送達される有益な薬剤のより均一な空間分配を提供することができる。
【0048】
異なる開口部内に異なる薬物を散在又は交互様式にて使用することにより、同一のポリマー/薬物マトリックス組成物中で組み合わされた場合に送達不可能であり得る2種の異なる薬物を送達することができる。例えば、薬物自体は、望ましくないように相互作用し得る。代替的に、2種の薬物は、マトリックス形成用の同一のポリマー、又はポリマー/薬物マトリックスの開口部内への送達用の同一の溶媒と適合可能でなくてもよい。
【0049】
更に、散在配置で異なる開口部内に異なる薬物を有する図4の例示的な実施形態は、異なる薬物を同一の医療デバイス又はステントから極めて異なる所望の放出動力学で送達する能力と、個々の薬剤の作用機構及び性質に応じて放出動力学を最適化する能力とを提供する。例えば、薬剤の水溶性は、ポリマー又は他のマトリックスからの薬剤放出に多大に影響する。高い水溶性を有する化合物は、一般にポリマーマトリックスから非常に迅速に送達される一方、親油性薬剤は同一のマトリックスからより長い時間に亘り送達されるであろう。したがって、親水性薬剤及び親油性薬剤が医療デバイスから二重の薬物の組み合わせとして送達される場合、同一のポリマーマトリクスから送達されるこれら2種の薬剤に関する所望の放出プロファイルをもたらすことは困難である。
【0050】
図4のシステムにより、同一のステントから親水性薬物及び親油性薬物を容易に送達することができる。更に、図4のシステムにより、2種の薬剤を2つの異なる放出動力学及び/又は投与期間にて送達することができる。最初の24時間の各初期放出、最初の24時間後の放出速度、2種の薬物の総投与期間及び任意の他の放出特性は、独立して制御することができる。例えば、第一の有益な薬剤の放出速度を、最初の24時間中に送達される薬物の少なくとも40%(好ましくは、少なくとも50%)が送達されるように準備し、第二の有益な薬剤は最初の24時間中に送達される薬物の20%(好ましくは、10%より少ない)未満が送達されるよう準備することができる。第一の有益な薬剤の投与期間は、約3週間又はそれ未満(好ましくは、2週間又はそれ未満)であってもよく、第二の有益な薬剤の投与期間は、約4週間又はそれ以上であってもよい。
【0051】
再狭窄、即ち介入後の閉塞の再発は、生物学的過程の組み合わせ又は一連の生物学的過程を伴う。これらの過程は、血小板及びマクロファージの活性化を含む。サイトカイン及び増殖因子は、平滑筋細胞増殖に寄与し、遺伝子及びメタロプロテイナーゼの上方制御は、細胞増殖、細胞外マトリックスのリモデリング、及び平滑筋細胞遊走を誘導する。複数のこれらの過程に対処する、薬物の組み合わせによる薬物療法は、最も成功する抗再狭窄療法であり得る。本発明は、そのような成功する組み合わせられた薬物療法を達成する手段を提供する。
【0052】
以下に説明する実施例は、異なる孔又は開口部内の異なる薬物を放出する能力から利益を得る、組み合わせられた薬物システムのいくつかを示す。散在する又は交互の孔から2種の薬物を送達するための有益なシステムの一例は、抗増殖剤又は抗遊走剤と組み合わせた抗炎症剤又は免疫抑制剤の送達である。再狭窄に関与する多数の生物学的過程を標的とするのに、これら薬剤の他の組み合わせも使用することができる。抗炎症剤は血管形成術及びステント配備に対する血管の最初の炎症性反応を緩和し、炎症性反応を刺激するマクロファージの発達のピークに一致させて、最初は速い速度で送達され、その後、約2週間の期間にわたりゆっくりと送達される。抗増殖剤は、より長期間に亘って比較的均等な速度で送達されて、平滑筋細胞の移動及び増殖を低下させる。
【0053】
以下に提供する実施例に加えて、次表は、薬物を医療デバイスの異なる開口部の中に配置することにより達成できる有用な2種薬物複合治療の一部を説明する。
【表1】

【0054】
異なる開口部内に薬物を配置することにより、薬物が疎水性又は疎油性であるかに関わらず、特定の薬剤に対して放出動力学を誂えることができる。実質的に一定又は線形の放出速度における親油性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年12月23日公開の国際公開第04/110302号に記載されている。親水性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年5月27日公開の国際公開第04/043510号に記載されている。上記に列挙した親水性薬物には、CdA、グリベック、VIP、インスリン、及びアポリポタンパク質A−1ミラノが挙げられる。上記に列挙した親油性薬物には、パクリタキセル、エポシロンD、ラパマイシン、ピメクロリムス、PKC−412及びデキサメタゾンが挙げられる。ファルグリタザルは、一部親油性で、一部親水性である。
【0055】
再狭窄に関連した異なる生物学的過程に対処する多数の薬物の送達に加えて、本発明は、同一のステントから2種の異なる薬物を送達して、異なる疾病を処置することができる。例えば、ステントは、例えばパクリタキセル又はリムス(limus)薬等の抗増殖剤を、一組の開口部から送達して再狭窄を処置する一方、例えばインスリン等の心筋保護剤を他の開口部から送達して、急性心筋梗塞を処置することができる。
【0056】
公知の拡張可能なデバイスの多数において、また図5に示したデバイスに関して、デバイス500の適用範囲は、架橋要素514においてよりもデバイスの円筒形の管部分512において大きい。適用範囲は、デバイス表面積の、デバイスが配備される管腔の面積に対する比として定義される。様々な適用範囲を有するデバイスが、デバイス内の開口部内に含まれる有益な薬剤を送達するのに使用される際、円筒形の管部分512に隣接する組織に送達される有益な薬剤の濃度は、架橋要素514に隣接する組織に送達される有益な薬剤の濃度よりも高い。有益な薬剤の不均等な送達濃度に繋がるこのデバイス構造の長手方向の変動性、及びデバイス適用範囲内の他の変動性に対処するために、有益な薬剤の濃度を、デバイスの一部分における開口部内で変動させて、組織全体に対する有益な薬剤の均等な分配を達成し得る。図5に示す例示的な実施形態の場合、管部分512内の開口部530aは、架橋要素514内の開口部530bと比較して低い薬物濃度を有する有益な薬剤を含む。薬剤送達の均一性は、薬物濃度、開口部の直径若しくは形状、開口部内の薬剤の量(即ち、開口部を満たす(filed)割合)、マトリックス材料、又は薬物形態の変更を含む様々な方法でもたらすことができる。
【0057】
異なる開口部内に異なる有益な薬剤を使用する他の適用の例は、血管内の分岐に使用するよう構成された図6に示す拡張可能な医療デバイス600である。分岐デバイスは側部孔610を含み、この側部孔は、血管の側枝を通して血液を流すように配置されている。分岐デバイスの一例は、その全体が参照により本明細書に組み込まれる米国特許第6,293,967号に記載されている。分岐デバイス600は、デバイスのその他の部分を形成するビームの規則的なパターンを中断する側部孔の特徴610を含む。分岐の周囲の領域は、再狭窄に関して特に問題のある領域であるため、抗増殖薬物の濃度は、デバイス600の側部孔610を囲む領域における開口部830a内で増大されて、必要な場所に、増大した濃度の薬物を送達することができる。側部孔から離れた範囲内の残りの開口部630bは、より低い濃度の抗増殖剤を有する有益な薬物を含有する。分岐孔を囲む領域への抗増殖剤送達の増大は、異なる薬物を含有する異なる有益な薬剤、又はより高い濃度の同一の薬物を含有する異なる有益な薬剤により提供され得る。
【0058】
拡張可能な医療デバイスの壁面又は反管腔側に異なる有益な薬剤を送達して、血管壁を処置することに加えて、有益な薬剤は拡張可能な医療デバイスの管腔側に送達されて、血栓症を予防又は低減することができる。デバイスの管腔側から血液流中に送達される薬物は、デバイスの基端部、又はデバイスの先端部に位置していてもよい。
【0059】
異なる有益な薬剤を、拡張可能な医療デバイス内の異なる開口部内に充填するための方法は、例えば浸漬及び被覆等の公知の技術、並びに公知の圧電マイクロジェット技術も含み得る。マイクロインジェクション装置は、コンピュータ制御されて、正確な量の2種又はそれ以上の有益な液体薬剤を、公知の方法にて、拡張可能な医療デバイス上の正確な位置へ送達することができる。例えば、二重薬剤噴射デバイスは、2種の薬剤を同時に又は連続的に開口部内に送達することができる。有益な薬剤が、拡張可能な医療デバイス内の貫通開口部内へ充填される際に、貫通開口部の管腔側は、充填中、弾性マンドレルにより遮断されて、有益な薬剤が液体形態で、例えば溶媒と共に送達されることを可能にし得る。有益な薬剤は、手動インジェクション装置によっても充填することができる。
【実施例】
【0060】
(実施例1)
図7に、ステント内の異なる孔から送達される抗炎症剤及び抗増殖剤を有して、再狭窄の生物学的過程に一致するよう特にプログラムされた2種の薬物の独立した放出動力学を提供する二重薬物ステント700を示す。この実施例によれば、二重薬物ステントは、第一セットの開口部710内の抗炎症剤ピメクロリムスを、第二セットの開口部720内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、ステント孔内のマトリックス材料内に、図8に示す放出動力学をもたらすよう構成された特定のインレー配置にて提供される。各薬物は、再狭窄の処置のために、主として壁面から送達される。
【0061】
図7に示すように、ピメクロリムスは、孔の管腔側にバリア712を用いることにより、ステントの壁面側に定方向送達されるようステント内に提供されている。バリア712は、生分解性ポリマーにより形成されている。ピメクロリムスは、二重相を有する放出動力学を形成する様式で孔内に充填される。ピメクロリムス放出の第一相は、マトリックスの壁面に位置する領域716により提供され、この領域は急速放出製剤を含み、製剤は、ピメクロリムスと生分解性ポリマー(PLGA)とを含み、ここで薬物は高い割合を有し、例えば約10%のポリマーに対して約90%の薬物を含む。放出の第二相は、ピメクロリムスと生分解性ポリマー(PLGA)が、50%のポリマーに対して約50%の薬物の比を有するマトリックスの中心領域714により提供される。図8のグラフから明らかであり得るように、ピメクロリムス放出の第一相は、ほぼ最初の24時間にて約50%の充填薬物を送達する。放出の第二相は、残りの50%を約2週間かけて送達する。この放出は、血管形成術及びステント配備に続く炎症過程の進行に一致するよう詳細にプログラミングされる。2つの領域間で薬物濃度を変えて二相放出を達成することに加えて、又はそれに代替して、異なるポリマー又は異なるコモノマー比の同一のポリマーを、2つの薬物の異なる領域内で使用して、2つの異なる放出速度を達成することができる。
【0062】
パクリタキセルは、図8に示すように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成する様式にて、開口部720内に充填される。パクリタキセル開口部720は3つの領域で充填され、この領域は、孔の管腔側の最小限の薬物を含む主にポリマーの基部領域722、濃度勾配にて提供されるパクリタキセル及びポリマー(PLGA)を有する中心領域724、並びにパクリタキセル放出を制御する主にポリマーを有するキャップ領域726を含む。パクリタキセルは、第一日目にて全薬物負荷の約5〜約15%が初期放出された後、約20〜90日間、実質的に線形放出される。濃度勾配を有する孔内のパクリタキセルに関する配置の更なる例は、上記の国際公開第04/110302号に記載されている。
【0063】
図7に、説明を容易にするために、開口部内の区別される領域として薬物、バリア、及びキャップ領域を示す。これらの領域は不明瞭であり、異なる領域を一体化することにより形成されることを理解するべきである。それ故、バリア層は薬物を有さない主にポリマーであるが、使用する製造過程に応じて、続く領域のいくらかの少量の薬物がバリア領域内に組み込まれ得る。
【0064】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、ピメクロリムスの量は、約50〜約300マイクログラム、好ましくは約100〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。一例において、約200マイクログラムのピメクロリムス及び約20マイクログラムのパクリタキセルが送達される。薬物は、ステント内の交互孔内に位置していてもよい。しかしながら、送達される2種の薬物の用量間の大きな相違に鑑みると、パクリタキセルをステント内の4つの孔の各3番目に配置することが望ましいと思われる。あるいは、低用量の薬物(パクリタキセル)を送達するための孔は、高用量用の孔よりも小さく形成されてもよい。
【0065】
ポリマー/薬物インレーは、その全体が参照により本明細書に組み込まれる2004年4月1日公開の国際公開第04/026182号に記載されている、コンピュータ制御による圧電インジェクション技術により形成される。第一の薬剤のインレーが最初に形成された後、圧電インジェクタを使用して第二の薬剤のインレーが形成され得る。代替的に、国際公開第04/02182号のシステムに二重圧電ディスペンサーを搭載して、2種の薬剤を同時に分配してもよい。
【0066】
(実施例2)
この実施例によれば、二重薬物ステントは、第一セットの開口部710内のグリベックを、第二セットの開口部720内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、図8に示す放出動力学をもたらすよう構成された特定のインレー配置にて、ステントの孔内のマトリックス材料中に提供される。
【0067】
グリベックは、二相放出により送達され、この放出は、第1日目の高い初期放出と、次の1〜2週間の遅延放出とを含む。グリベック放出の第一の相は、ほぼ最初の24時間で、充填した薬物の約50%を送達する。放出の第二の相は、残りの50%を約1〜2週間で送達する。パクリタキセルは、図8に示し、また実施例1にて上述したように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部720内に充填される。
【0068】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、グリベックの量は、約200〜約500マイクログラム、好ましくは約300〜約400マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。実施例1のように、薬物は、ステント内の交互孔内に位置し、又は非交互様式にて散在されていてもよい。ポリマー/薬物インレーは、実施例1に記載した方法で形成される。
【0069】
(実施例3)
この実施例によれば、二重薬物ステントは、第一セットの開口部内のPKC−412(細胞増殖制御因子)を、第二セットの開口部内の抗増殖剤パクリタキセルと組み合わせて含む。各薬剤は、ステントの孔内のマトリックス材料中に、以下に説明する放出動力学をもたらすよう構成された特定のインレー配置で提供される。
【0070】
PKC−412は、実質的に一定の放出速度で送達され、最初の約24時間放出された後、約4〜16週間、好ましくは約6〜12週間の間放出される。パクリタキセルは、最初の約24時間後、約4〜16週間、好ましくは約6〜12週間の間、実質的に線形の放出を有する放出動力学を形成するように、開口部内に充填される。
【0071】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、PKC−412の量は、約100〜約400マイクログラム、好ましくは約150〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。実施例1のように、薬物は、ステント内の交互孔内に位置し、又は非交互様式にて散在されていてもよい。ポリマー/薬物インレーは、実施例1に記載した方法で形成される。
【0072】
治療薬
本発明は、パクリタキセル、ラパマイシン、クラドリビン(CdA)、及びそれらの誘導体を含む抗再狭窄剤、並びに他の細胞毒性又は細胞分裂阻害剤、及び微小管安定化剤の送達に関する。抗再狭窄剤が主に本明細書に記載されているが、本発明は他の薬剤を単独で、又は抗再狭窄剤と組み合わせて送達するのにも使用することができる。本発明と共に使用するための治療薬のいくつかは、主に管腔側から、主に壁面から、又はその両方で、単独で、又は組み合わせで伝達することができ、それらは抗増殖剤、抗トロンビン、シロリムスを含む免疫抑制剤、抗高脂血薬、抗炎症剤、抗新生物薬、抗血小板薬、血管形成剤、血管新生阻害剤、ビタミン、有糸分裂阻害剤、メタプロテアーゼ阻害剤、NOドナー、エストラジオール、抗硬化剤、及び血管作動薬、内皮増殖因子、エストロゲン、β遮断薬、AZ遮断薬、ホルモン、スタチン、インスリン増殖因子、抗酸化剤、膜安定化剤、カルシウム拮抗剤、レチノイド(retenoid)、ビバリルジン、フェノキソジオール、エトポシド、チクロピジン、ジピリダモール及びトラピジルを含むがこれらに限定されず、これらは単独で、又は本明細書に言及した任意の治療薬と組み合わせて送達することができる。治療薬は、いくつか例を挙げれば、ペプチド、リポタンパク質、ポリペプチド、ポリペプチドをコードするポリヌクレオチド、脂質、タンパク質−薬物、タンパク質コンジュゲート薬、酵素、オリゴヌクレオチド及びそれらの誘導体、リボザイム、他の遺伝子材料、細胞、アンチセンス、オリゴヌクレオチド、モノクローナル抗体、血小板、プリオン、ウイルス、細菌、及び内皮細胞等の真核生物細胞、幹細胞、ACE阻害剤、単球/マクロファージ又は血管平滑筋細胞を含む。治療薬は、宿主に投与された際に、所望の薬物に代謝されるプロ−ドラッグであってもよい。加えて、治療薬は、治療層内に組み込まれるに先立って、マイクロカプセル、ミクロスフェア、微小気泡、リポソーム、ニオゾーム(niosome)、乳剤、分散剤又は同様物として予め調製されてもよい。治療薬は、放射性同位体、又は光若しくは超音波エネルギー等の数種の他の形態のエネルギーにより、若しくは全身投与し得る他の循環分子により活性化された薬剤であってもよい。治療薬は、血管新生、再狭窄、細胞増殖、血栓症、血小板凝集、血塊、及び血管拡張の調整を含む多数の機能を実行し得る。
【0073】
抗炎症剤は、例えばアリール酢酸誘導体、例えばジクロフェナク;アリールプロピオン酸誘導体、例えばナプロキセン;及びサリチル酸誘導体、例えばジフルニサル等の非ステロイド性抗炎症剤(NSAID)を含むが、これらに限定されない。抗炎症剤は、デキサメタゾン、アスピリン、プレドニゾロン、及びトライアムシナロン等のグルココルチコイド(ステロイド)、ピルフェニドン、メクロフェナム酸、トラニラスト、並びに非ステロイド性抗炎症剤も含む。抗炎症剤は抗増殖剤と組み合わせて使用されて、抗増殖剤に対する組織反応を緩和し得る。
【0074】
薬剤は更に、抗リンパ球剤;抗マクロファージ物質;免疫調節剤;シクロオキシゲナーゼ阻害剤;抗酸化剤;コレステロール低下薬;スタチン及びアンジオテンシン変換酵素(ACE);繊維素溶解剤;内因性凝固カスケードの阻害剤;抗高リポタンパク血症剤;及び抗血小板剤;2−クロロデオキシアデノシン(2CdA又はクラドリビン)などの抗代謝剤;シロリムス、エベロリムス、タクロリムス、エトポシド、及びミトキサントロン等の免疫抑制剤;2−CdA、IL−1阻害剤、抗CD116/CD18モノクローナル抗体、VCAM又はICAMに対するモノクローナル抗体、亜鉛プロトポルフィリン等の抗白血球剤;NOを上昇させる薬剤等の抗マクロファージ物質;グリタゾン等のインスリンへの細胞感作剤;高密度リポタンパク質(HDL)及び誘導体;並びに、リパトール(lipator)、ロベスタチン、プラナスタチン、アトルバスタチン、シンバスタチン、及びスタチン誘導体等のHDLの合成複製物;アデノシン及びジピリダモール等の血管拡張剤;一酸化窒素供与体;プロスタグランジン及びその誘導体;抗TNF化合物;β遮断薬、ACE阻害剤、及びカルシウムチャンネル遮断薬等の高血圧薬;血管作動性腸管ポリペプチド(VIP)などの血管作動性物質;インスリン;グリタゾン、PPAR作動薬、メトフォルミンなどのインスリンへの細胞感作剤;タンパク質キナーゼ;レステンNGなどのアンチセンスオリゴヌクレオチド;チロフィバン、エプチフィバチド、及びアブシキシマブ等の抗血小板剤;VIP、脳下垂体アデニル酸シクラーゼ活性化ペプチド(PACAP)、アポリポタンパク質A−lミラノ、アムロジピン、ニコランジル、シロスタキソン、及びチエノピリジン等の心臓保護剤;COX−1阻害剤及びCOX−2阻害剤等のシクロオキシゲナーゼ阻害剤;並びにオムニパトリラット等の解糖系の代謝を高めるペチドース(petidose)阻害剤を含み得る。炎症の処置に使用し得る他の薬物には、脂質低下剤、エストロゲン及びプロゲスチン、エンドセリン受容体作動薬及びインターロイキン−6拮抗薬、並びにアディポネクチンが挙げられる。治療薬は、シラスタゾール(cilastazol)及びアデノシン受容体、好ましくはA2A受容体作動薬等のホスホジエステラーゼ阻害薬(PDEi)、リガデノソン等の作動薬も含み得る。
【0075】
薬剤は、遺伝子療法ベースの手法を、拡張可能な医療デバイスと組み合わせて用いて送達することができる。遺伝子療法は、外来遺伝子を細胞又は組織に送達して、標的細胞に外来遺伝子産物を発現させることを指す。遺伝子は、通常、機械的又はベクター仲介による方法のいずれかで送達される。
【0076】
本明細書に記載される薬剤のいくつかは、それらの活性を保存する添加剤と組み合わされてもよい。例えば界面活性剤、制酸薬、抗酸化剤、及び洗剤を含む添加剤を使用してタンパク質薬物の変性及び凝集を最小にすることができる。陰イオン性、陽イオン性、又は非イオン性界面活性剤を使用することができる。非イオン性賦形剤の例には、ソルビトール、ショ糖、トレハロースを含む糖;デキストラン、カルボキシメチル(CM)デキストラン、ジエチルアミノエチル(DEAE)デキストランを含むデキストラン;D−グルコサミン酸、及びD−ブドウ糖ジエチルメルカプタル(mercaptal)を含む糖誘導体;ポリエチレングリコール(PEO)及びポリビニルピロリドン(PVP)を含む合成ポリエステル;D−乳酸、グリコール酸、及びプロピオン酸を含むカルボン酸;n−ドデシル−.β.−D−マルトシド、n−オクチル−.β.−D−グルコシド、PEO−脂肪酸エステル(例えば、ステアリン酸エステル(myrj59)又はオレイン酸エステル)、PEO−ソルビタン−脂肪酸エステル(例えば、Tween 80、PEO−20モノオレイン酸ソルビタン)、ソルビタン−脂肪酸エステル(例えば、SPAN 60、モノステアリン酸ソルビタン)、PEO−グリセリル−脂肪酸エステルを含む、疎水性界面のための親和性を伴う界面活性剤;グリセリル脂肪酸エステル(例えば、モノステアリン酸グリセリル)、PEO−炭化水素−エーテル(例えば、PEO−10オレイルエーテル;トリトンX−100;並びにルブロールが挙げられるが、これらに限定されない。イオン性洗剤の例は、ステアリン酸カルシウム、ステアリン酸マグネシウム、及びステアリン酸亜鉛を含む脂肪酸塩;レシチン及びホスファチジルコリンを含むリン脂質;(PC)CM−PEG;コール酸;ドデシル硫酸ナトリウム(SDS);ドクサート(AOT);並びにタウロコール酸(taumocholic acid)を含むが、これらに限定されない。
【0077】
別の例示的な実施形態によれば、ステント又は管腔内骨格は、本明細書に記載されるように、孔又は開口部内に堆積した1種以上の治療薬に加えて、抗血栓剤で被覆され得る。例示的な一実施形態において、ステントは、内部に開口部を製作され、開口部内に他の治療薬を追加又は堆積するに先立って、担体ビヒクル(ポリマー又はポリマー性マトリックス)を伴う又は伴わない抗血栓剤が、ステント又はこのステントの一部分に付着され得る。この例示的な実施形態において、ステントの管腔側及び反管腔側表面を、また開口部の壁の表面を、抗血栓剤又は皮膜で被覆し得る。代替的な例示的な実施形態において、ステントは、最初に抗血栓剤又は皮膜を被覆された後、開口部が製作され得る。この例示的な実施形態では、管腔側表面と反管腔側表面のみが抗血栓剤又は皮膜を有し、開口部の壁は皮膜を有さない。これらの各実施形態において、任意の数の抗血栓薬剤を、ステントの全部又は一部に付着させることができる。加えて、例えばコーディス社(Cordis Corporation)製のBxベロシティ(Bx Velocity)(登録商標)冠状動脈ステント上のヘパコート(HEPACOAT)(商標)と共に使用されるような任意の数の公知の技術を使用して抗血栓剤をステントに付着させることができる。あるいは、ステントは、抗血栓皮膜とは独立して又はこの皮膜に加えて、粗い表面テクスチャーで加工されてもよく、又はマイクロテクスチャーを有して、細胞付着性及び内皮化を向上させてもよい。加えて、任意の数の治療薬を開口部内に堆積することができ、また、異なる薬剤をステントの異なる領域内に使用することができる。
【0078】
上述したように、本発明によれば、ビンカアルカロイド(すなわちビンブラスチン、ビンクリスチン、及びビノレルビン)等の天然産物、パクリタキセル、エピディポドフィロトキシン(すなわちエトポシド、テニポシド)、抗生物質(ダクチノマイシン(アクチノマイシンD)ダウノルビシン、ドキソルビシン、及びイダルビシン)、アントラサイクリン、ミトキサントロン、ブレオマイシン、プリカマイシン(ミトラマイシン)、及びマイトマイシン、酵素(L−アスパラギンを全身代謝し、自身のアスパラギンの合成能を有さない細胞を枯渇させるL−アスパラギナーゼ)を含む抗増殖剤/有糸分裂阻害剤;G(GP)IIbIIIa阻害剤、及びビトロネクチン受容体拮抗薬などの抗血小板剤;ナイトロジェンマスタード(メクロレタミン、シクロフォスファミド及び類似体、メルファラン、クロラムブシル)、エチレンイミン及びメチルメラミン(ヘキサメチルメラミン及びチオテパ)、アルキルスルホン酸−ブスルファン、ニトロソウレア(カルムスチン(BCNU)及び類似体、ストレプトゾシン)、トラゼン−ダカルバジニン(trazenes-dacarbazinine)(DTIC)等の抗増殖性/抗有糸分裂アルキル化剤;葉酸類似体(メトトレキサート)、ピリミジン類似体(フルオロウラシル、フロクスウリジン、及びシタラビン)、プリン類似体及び関連阻害剤(メルカプトプリン、チオグアニン、ペントスタチン、及び2−クロロデオキシアデノシン{クラドリビン})などの抗増殖性/抗有糸分裂代謝拮抗薬;プラチナ配位錯体(シスプラチン、カルボプラチン)、プロカルバジン、ヒドロキシウレア、ミトタン、アミノグルテチミド;ホルモン(すなわちエストロゲン);抗凝固剤(ヘパリン、合成ヘパリン塩、及び他のトロンビン阻害剤);線維素溶解剤(組織プラスミノゲン活性化剤、ストレプトキナーゼ、及びウロキナーゼ等)、アスピリン、ジピリダモール、チクロピジン、クロピドグレル、アブシキシマブ;抗遊走剤;抗分泌剤(ブレベルジン);副腎皮質ステロイド(コルチゾール、コルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、6α−メチルプレドニゾロン、トリアムシノロン、ベタメタゾン、及びデキサメタゾン)、非ステロイド剤(サリチル酸誘導体すなわちアスピリン;パラ−アミノフェノール誘導体すなわちアセトアミノフェン;インドール及びインデン酢酸(インドメタシン、スリンダク、及びエトドラク)、ヘテロアリール酢酸(トルメチン、ジクロフェナク、及びケトロラク)、アリールプロピオン酸(イブプロフェン及び誘導体)、アントラニル酸(メフェナム酸及びメクロフェナム酸)、エノール酸(ピロキシカム、テノキシカム、フェニルブタゾン、及びオキシフェンタトラゾン)、ナブメトン、金化合物(オーラノフィン、オーロチオグルコース、金チオリンゴ酸ナトリウム)等の抗炎症薬;免疫抑制剤:(シクロスポリン、タクロリムス(FK−506)、シロリムス(ラパマイシン)、アザチオプリン、ミコフェノール酸モフェチル);血管新生剤:血管内皮増殖因子(VEGF)、線維芽細胞成長因子(FGF)、血小板由来成長因子(PDGF)、エリスロポエチン;アンジオテンシン受容体拮抗薬;一酸化窒素供与体;アンチセンスオリゴヌクレオチド及びそれらの組み合わせ;細胞周期阻害剤、mTOR抑制剤、並びに成長因子シグナル伝達キナーゼ阻害剤を含む、任意の数の薬物及び/又は薬剤を使用することができる点に注意することは重要である。
【0079】
図9A、図9B及び図9Cを参照すると、ステントの一部分の図表示が示されている。
【0080】
図9Aに示すように、ステント900は、実質的に円形の複数の開口部902を含む。この例示的な実施形態では、実質的に円形の複数の開口部902は、ステント900の壁を貫通して延びている。換言すれば、実質的に円形の複数の開口部902は、ステントの反管腔側表面904からステントの反管腔側表面906へ延び、ここで壁厚は管腔側表面と反管腔側表面との間の距離として定められる。しかしながら、他の実施形態では開口部はステント900の壁を貫通して延びる必要はない。例えば、開口部又はリザーバは、管腔側表面又は反管腔側表面のいずれか、又は両方から部分的に延びていてよい。図9Aのステント900は、未処理の表面904及び表面906並びに空の開口部902を有する。
【0081】
図9Bでは、少なくとも1つの表面が、治療薬908で被覆されている。治療薬は、好ましくは例えばヘパリン等の抗血栓剤を含む。しかしながら、任意の抗血栓剤を使用することができる。抗血栓剤は、上記に簡略的に記載したように、任意の技術を用いて付着させることができる。この例示的な実施形態では、反管腔側表面及び管腔側表面の両方が、そこに付着された抗血栓剤を有している。加えて、この時点では、複数の実質的に円形の開口部902内に何も存在しないため、開口部902の壁は、そこに付着された幾分かの抗血栓剤を有し得る。開口部910の壁に付着される抗血栓剤の量は、薬物の付着方法に依存する。例えば、薬剤が浸漬被覆により付着される場合、開口部の壁には、薬剤が噴霧被覆技術を用いて付着される場合より多量の薬剤が付着されるであろう。本明細書に記載するように、この例示的な実施形態において、暴露される全表面は、相当の抗血栓皮膜が付着される。しかしながら、別の例示的な実施形態では、特定の表面のみに抗血栓が付着されてよい。例えば、例示的な一実施形態では、血液と接触する表面のみが、抗凝固剤で処理されてよい。尚別の例示的な一実施形態では、片方又は両方の表面が抗血栓剤で被覆され得る一方、開口部の壁は被覆されない。これは、被覆前に開口部を塞ぎ、又は抗血栓剤の付着後に開口部を形成することを含む、多数の方法にて達成することができる。
【0082】
図9Cに、この例示的な実施形態に従った完全なステントを示す。この図に示すように、実質的に円形の複数の開口部902は、再狭窄及び炎症等の血管疾病、又は本明細書に記載される任意の他の疾病(dieses)を治療するための1種以上の治療薬で満たされている。各開口部902は、上記に詳細に説明したように、同一の治療薬又は異なる薬剤で満たされ得る。図に示すように、これらの異なる薬剤912、914及び916は、特定のパターンで使用される。しかしながら、上記に詳細したように、任意の組み合わせが可能であり、1種の薬剤を異なる濃度で使用することも可能である。ラパマイシン等の薬物は、任意の好適な方法にて開口部902内に堆積されることができる。薬剤を堆積する技術には、マイクロピペッティング及び/又はインクジェット充填方法が挙げられる。例示的な一実施形態において、薬物は、開口部内の薬物及び/又は薬物/ポリマーマトリックスが、ステント表面の水平面の下方となり、周辺の組織と接触しないように満たされ得る。代替的に、開口部は、薬物及び/又は薬物/ポリマーマトリックスが、周辺の組織と接触し得るように満たされてもよい。加えて、各薬物の総用量は、多数の薬物が使用される場合、最大の柔軟性をもって構成され得る。加えて、各薬物の放出速度は、個別に制御され得る。例えば、端部付近の開口部は、縁再狭窄を処置するよう、より多量の薬物を含み得る。
【0083】
この例示的な実施形態によれば、孔又は開口部は、最も有効な薬物療法のためにのみ構成されるのではなく、異なる薬物間に物理的分離を形成するためにも構成され得る。この物理的分離は、薬剤の相互作用を防止するのを助けることができる。
【0084】
本明細書で使用されるように、ラパマイシンは、ラパマイシン及び全類似体、誘導体、並びにFKBP12に結合するコンジュゲート、並びに他のイムノフィリンを含み、TORの阻害を含む、ラパマイシンと同一の薬理学的性質を所有する。加えて、本明細書に記載される全薬物及び薬剤の類似体、誘導体及びコンジュゲート。
【0085】
本明細書に記載されるように、内部に貫通孔、孔、リザーバ又は開口部を有するステントは、抗血栓剤及び/又は本明細書に記載されるような薬物若しくは薬物の組み合わせを被覆され、開口部が1種以上の治療薬を、単独で、又は1種若しくはそれ以上のポリマーと組み合わせて満たされることができる。本質的に、ステントは、内部の開口部と共に製作されてもよく、開口部内に治療薬を単独で又は1種若しくはそれ以上のポリマーと組み合わせて添加又は堆積されるに先立って、担体ビヒクルを伴う又は伴わない抗血栓剤が、ステント又はその一部分に付着されてもよい。本明細書に記載される例示的な実施形態において、ステントの管腔側及び反管腔側表面、並びに開口部の壁の表面は、抗血栓剤で被覆されてよい。この例示的な実施形態において、抗血栓剤は、ヘパリン又はその様々な誘導体、例えば低分子量ヘパリン(LMWH)を含むが、任意の数の好適な抗血栓剤を使用することができる。ヘパリン及び/又はLMWHは、非常に高い負電荷を有する。
【0086】
治療薬及び/又はポリマーと治療薬との組み合わせのためのリザーバとなる貫通孔又は開口部の内部表面を含む、本明細書に記載されるステントの全表面は、最初に、共有結合したヘパリン皮膜を付与される。ヘパリン皮膜自体は、それ自体のプライマーによりステントの金属表面に結合され、このプライマーは、略語PEIにより公知の強い陽イオン性のポリマーであるポリ(エチレンイミン)と、ポリマー性陰イオンである硫酸デキストランとの交互層を含む。この種類のプライマーの適用は、当技術分野にて公知であり、米国特許第5,213,898号、同第5,049,403号、同第6,461,665号及び同第6,767,405号を含む多数の特許に記載されている。より詳細には、ヘパリンは、PEI−硫酸デキストラン層を含むプライマーに共有結合され、このプライマーは、次に金属表面に結合される。全表面がヘパリン混合物で被覆されたら、各孔又はリザーバは、本明細書に記載される方法の1つを用いて満たされる。
【0087】
別の例示的な実施形態によれば、本発明は、薬物送達マトリックス、例えば治療薬とポリマーとの組み合わせの、医療デバイス、例えばステントのヘパリン被覆表面に対する接着を改善するための、プライマー組成物及び構成に関する。本発明は、特に、ヘパリン皮膜が医療デバイスの金属又はポリマー表面に共有結合している場合に有利である。本発明において、プライマーは高分子量成分又は低分子量成分を含み、薬物送達マトリックスは、薬物及び/又は他の有益な薬剤並びに賦形剤、好ましくはポリマー性賦形剤を含むことが好ましい。加えて、プライマーはまた、好ましくは、下にある層、例えばヘパリンと反対の電荷及び同様の電荷密度を有する材料を含み得る。
【0088】
任意の他のマトリックス又は皮膜に対するヘパリン被覆表面の結合を増大させるヘパリン層又は皮膜上のプライマーの概念は、通常のヘパリン表面が抗血栓性を付与するために使用され、それ故、実際の使用において覆われないことを考えると独特である。本発明において、本発明のプライマーで覆われるのは、薬物−ポリマーリザーバを保持するステント内の孔又は開口部の内部壁表面のみであり、それ故、リザーバ外のヘパリン表面に実質的に影響を与えずに2つの層間の接着を増強し、薬物−ポリマーマトリックスの潜在的な損失を制限する。本発明によるヘパリン遮断プライマーは、元の意図される用途において生体適合性であることに留意することが重要である。
【0089】
本発明のプライマーは、いかなる種類のステントにも使用することができる。本明細書に記載される例示的な実施形態において、プライマーは図1、図2、図3及び図4に示されるステント(1つ又は複数)と共に使用される。
【0090】
例示的な一実施形態によれば、プライマーは、ポリマー−ポリ(エチレンイミン)コンジュゲート、例えばポリ乳酸−コ−グリコール酸(PLGA)及びポリ(エチレンイミン)PEI及び/又はPLGA−プロタミンを含む。ポリ(エチレンイミン)は強力な陽イオン性のポリマーであり、負に帯電した所定のタンパク質又は多糖に結合する。PEIに加えて、このコンジュゲートにて有用な他の材料は、プロタミンである。プロタミンは、ヘパリンに対する解毒剤として使用される承認された低分子量タンパク質薬物である。それは、僅かに水溶性である。このように、プライマーはヘパリン皮膜及び薬物含有マトリックスの両方と強力に同時に相互作用して、2つの物質間の接着を改善することができる。ヘパリンはポリ(陰イオン)種であるため、例えばプロタミン等のポリ(陽イオン性)種はヘパリンに良好に結合するが、その構造の他の部分においては十分に疎水性で、リザーバ内の薬物ポリマーマトリックスのPLGA成分に良好に結合することができると予想される。
【0091】
PLGAとPEI、及びPEIとヘパリンとの間の結合反応は、イオン結合又は共有結合反応であり得る。図10に、PLGAとPEIとの間の共有結合の例を示す。より詳細には、図10は、カルボン酸末端基を有するPLGAと低分子量PEIとの間の結合反応を示す。あるいは、プライマーは、高分子量PEI又は分枝状PEIを含んでいてもよい。図11を参照すると、カルボン酸末端基を有するPLGAと高分子量又は分枝状PEIとの間の結合反応が示されている。図示するように、反応は、1対1の比又はPLGA−PEI−PLGAのコンジュゲートに関してPLGAとPEIとの間で2:1の比で構成されてもよい。
【0092】
下表は、ヘパリン被覆された表面に対して薬物/高分子複合体の接着を増強するためのプライマーとしてのPEIの有効性を説明する。試験ステントは、リン酸緩衝生理食塩水と、生理液の状態をシミュレートするウシ血清アルブミンとを含む試験媒体中に浸漬される。薬物/ポリマー複合体は、ラパマイシン及びPLGAを含む。
【表2】

【0093】
別の例示的な実施形態において、プライマーは、塩化ベンズアルコニウム及び/若しくはオリゴアルギニンペプチドを含む、ヘパリンに対する低分子量錯化陽イオン、又はポリリシン、ポリ(アルギニン)、プロタミン、ポリ(ジメチルアミノエチル)メタクリレート若しくはポリ(ジメチルアミノエチル)アクリレートを含む高分子量錯化陽イオンを含んでもよい。
【0094】
本発明によれば、薬物複合体のヘパリンへの接着を増強させる方法は、接着促進プライマー、及び続くポリマー/薬物充填溶液の適用、又は接着促進プライマー、次いでカルボキシル末端PLGA若しくはカルボキシル末端PLGAと通常のPLGAとのブレンド及びPLGA/薬物充填溶液の適用を含み得る。
【0095】
本発明のプライマーは、開口部が局所薬物送達マトリックスで満たされるのに先立って、ステント内の孔又は開口部の内部のヘパリン被覆壁に適用される。換言すれば、完成した薬物溶出ステントにおいて、プライマーはヘパリン皮膜表面と薬物送達マトリックス本体との間の空間を占有し、ヘパリン皮膜と薬物送達マトリックスとの間の接着を増強させるであろう。接着の強化は複数の要因によりもたらされ、この要因には陽イオン性プライマーにより電荷中和した後の使用におけるヘパリン皮膜の浸透圧/水浸入の低下、ヘパリン表面単独と比較して低下したヘパリン/陽イオン性プライマー複合体の水性溶解度、イオン結合、共有結合、及びプライマーとポリマー/薬物マトリックスとの間の、表面張力によるより良好な物理的接着等が含まれる。
【0096】
本発明の別の例示的な実施形態において、本発明のプライマーは、負に帯電したヘパリン皮膜に対して結合するための、その分子構造の正に帯電した部分と、薬物送達マトリックスのポリマー成分に結合するための、疎水性、親水性又は均衡の取れた部分とを有することが好ましいであろう。このプライマーの部分は、薬物送達マトリックスの性質に応じて変動するであろう。より詳細には、プライマーは、ステントのヘパリン被覆開口部に対する薬物送達マトリックスの接着を改善して、ステントが、例えば生理食塩水、血液及び/又は組織間液等の水性流体と接触した際に、開口部又はリザーバがどれも、又は実質的にどれもその内容物を損失しないように構成されている。
【0097】
本発明のプライマーは、ステントリザーバのヘパリン被覆内部壁と、リザーバを満たす薬物/ポリマー混合物との間の接着を増強させるものとして詳細に記載されてきたが、このプライマーは、任意の基質をヘパリン被覆表面の部分に付着又は結合させるのに有用であり得る。例えば、血液と接触するプラスチック医療デバイスは、多くの場合、デバイス上の血栓(thrombosis)を最小にするためにヘパリンで被覆されているが、後にその表面に対して結合することが所望される場合がある。溶媒中の本発明のプライマー混合物をデバイスの選択された領域に適用し、溶媒を蒸発させてヘパリン表面上にプライマー被覆領域を提供し、次にそれに続いて新しいサブシステムをプライマーで覆われた領域に結合させてもよい。
【0098】
プライマー材料は、例えばジメチルスルホキシド(DMSO)、N−メチルピロリドン、又はそれらの水混合物等の溶媒中のポリマー性プライマー溶液として有利に適用され、また本願に記載した任意の充填技術を用いてリザーバ内に導入されるであろう。このようなプライマー溶液は、次に乾燥されてヘパリン被覆表面上にプライマー層の皮膜を提供できる。プライマー層の適用は、ステント充填プロセス中、堆積工程を1回のみ必要とすることが好ましい。陽イオン性プライマーの堆積に好適な溶媒の選択は、主としてそのプライマーを溶解する能力と、本明細書に記載される充填装置及び方法に対する適合性とにより決定される。
【0099】
本発明は、単に埋め込み型医療デバイスとして特徴付けることができる。本医療デバイスは、内部に複数の開口部を有する管腔内骨格と、この管腔内骨格の表面及び複数の開口部の表面のうちの少なくとも一部分に付着される、第一の電荷を有する材料を含有する第一の皮膜と、この第一の皮膜の少なくとも一部分に付着した、第二の電荷を有する材料を含有する第二の皮膜であって、第二の電荷が第一の電荷の反対である、第二の皮膜と、複数の開口部のうちの少なくとも1つに堆積された少なくとも1種の治療薬と、を含み、第二の皮膜は、第一の皮膜と少なくとも1種の治療薬との間の中間層として構成されている。
【0100】
第一の皮膜は、本明細書に記載される任意の好適な抗血栓剤を含有していてもよい。例えば、ヘパリン等の多糖を使用することができる。第二の皮膜は、ポリマー性陽イオン、又は本明細書に記載されるような陽イオン性部分を有するポリマー性コンジュゲートを含有してもよい。ポリマー性陽イオンの例には、オリゴアルギニンペプチド、ポリリシン、ポリ(アルギニン)、プロタミン、ポリ(ジメチルアミノエチル)ポリ(エチレンイミン)が挙げられる。ポリマー性陽イオン性コンジュゲートの例には、ポリ乳酸−コ−グリコール酸等の第一の成分、及び上記に挙げた任意の陽イオンを含む第二の成分が挙げられる。治療薬は、抗再狭窄剤、抗炎症剤、抗血栓剤、抗増殖剤、梗塞組織に対する損傷を最小にする薬剤、又はそれらの任意の組み合わせを含み得る。
【0101】
より一般的な意味において、本発明の概念は、親水性表面と疎水性表面との間の結合強度を増大させるプライマーの包含に拡大され得る。例えば、他の対象の親水性表面は、カテーテルと共に使用されるもののような、いわゆる「潤滑性」皮膜と称されている。これらの親水性表面も、多くの場合共有結合されているが、単なるコンフォーマル皮膜であってもよい。潤滑性皮膜で生じる化学構造の例は、ポリビニルピロリドン、ヒドロキシエチルメタクリレート、ポリ(エチレンオキシド)又はポリ(エチレングリコール)及び同様物に基づくものである。
【0102】
別の例示的実施形態によれば、本発明は、ステント内のリザーバからの治療薬の放出動力学を制御することに関する。
【0103】
NEVO(商標)(カリフォルニア州メンロパーク)はRES技術を用いてシロリムスを送達するものである。ステント配備から90〜120日以内に安全に再吸収するPLGAが収容されたリザーバ(RES技術)からのシロリムスの送達は、CYPHER(登録商標)の臨床的効果及び地金ステントと同様の治癒特性を実現する可能性を有する。3.5mmのNEVO(商標)プロトタイプの前臨床的安全性については報告がなされている。この実験は、2.5mm径のNEVO(商標)のプロトタイプデザインの安全性及び放出動力学を評価するために行ったものである。
【0104】
2.5mm径のNEVO(商標)のプロトタイプ、地金ステント(BMS;空のリザーバステント)、及びCYPHER(登録商標)ステントを、ブタの左冠動脈前下行枝(LAD)、左冠動脈回旋枝(LCx)及び/又は右冠状動脈に1、3、8、14、30、60及び90日間(d)埋め込んでシロリムスの放出動力学を評価し、30、90、又は180日間埋め込んで組織病理学及び組織形態計測を評価した。
【0105】
RES技術を利用したNEVO(商標)からのシロリムスの放出動力学は、埋め込み後1〜14日ではCYPHER(登録商標)ステントよりも若干低かった(図12)。しかしながら、NEVO(商標)によって得られたシロリムスの動脈含量は、CYPHER(登録商標)ステントにおけるよりも若干高かった。NEVO(商標)に取り込まれたシロリムス/NEVO(商標)から放出されたシロリムスの量は、CYPHER(登録商標)ステントに取り込まれたシロリムス/CYPHER(登録商標)ステントから放出されたシロリムスの約3.2倍多かった。これらの知見は、RES技術を用いて送達されたシロリムスはCYPHER(登録商標)ステントによって送達された場合と比較してより効率的であり得ることを示すものである。しかしながら、NEVO(商標)によって得られた動脈のシロリムス含量は、過去に安全かつ有効であることが示されている範囲内であった。NEVO(商標)によって得られた動脈のシロリムス含量はCYPHER(登録商標)ステントよりも若干高かったが、NEVO(商標)による血管の治癒効果は地金ステント及びCYPHER(登録商標)ステントと同様であった。ステントはすべて、30日目に内皮形成されていた。NEVO(商標)におけるストラット周囲の炎症スコアは最小であり、30日目では地金ステントにおけるよりも大幅に低かった(NEVO(商標):0.87±0.60に対し、地金ステント:1.05±0.19、p<0.05;CYPHER(登録商標)ステント:1.07±0.60)。炎症は90及び180日目に最小に維持され、群間で差は認められなかった。新生内膜の厚さは、ステント群間で差は見られなかった(30日目において、NEVO(商標):0.21±0.07mm、CYPHER(登録商標)ステント:0.22±0.10mm、地金ステント:0.18±0.05mm)。予想されたように、30日後のNEVO(商標)及びCYPHER(登録商標)ステントにおけるストラット周囲のフィブリンは地金ステントよりも大幅に高く、90及び180日目には次第に減少した。これらの知見は3.5mm径のNEVO(商標)プロトタイプで以前に観察されたものと一致していた。
【0106】
シロリムスを送達するためにRES技術を用いたNEVO(商標)プロトタイプは、CYPHER(登録商標)ステントよりも効率的であるが、血管治癒効果はCYPHER(登録商標)ステント及び地金ステントと同等である。更に、2.5及び3.5mm径のNEVO(商標)プロトタイプの安全性プロファイルは同等であった。
【0107】
最も実際的で好ましいと思われる実施形態を示し記載したが、記載し示した特定の構成及び方法からの逸脱は、それ自体が当業者に示唆され、本発明の趣旨から逸脱することなく使用され得ることは明らかである。本発明は、記載及び図示された特定の構造に限定されず、添付の特許請求の範囲内に含まれ得る全ての変更物と一致するよう構成されるべきである。
【0108】
〔実施態様〕
(1) 内部に複数の開口部を有し、ほぼ管状の形態を有するとともに複数の架橋要素によって相互連結された複数の円筒形部分を含む管腔内骨格であって、前記円筒形部分のそれぞれは、延性ヒンジ及び周方向ストラットによって相互連結された細長いストラットの網状組織で形成されている、管腔内骨格と、
前記複数の開口部のうちの少なくとも1つに堆積した少なくとも1種の治療薬であって、周辺組織中への前記治療薬の放出速度及び全放出量を制御するためにPLGAマトリックス中に取り込まれ、ラパマイシンを含む、治療薬と、を含む、埋め込み型医療デバイス。
【特許請求の範囲】
【請求項1】
内部に複数の開口部を有し、ほぼ管状の形態を有するとともに複数の架橋要素によって相互連結された複数の円筒形部分を含む管腔内骨格であって、前記円筒形部分のそれぞれは、延性ヒンジ及び周方向ストラットによって相互連結された細長いストラットの網状組織で形成されている、管腔内骨格と、
前記複数の開口部のうちの少なくとも1つに堆積した少なくとも1種の治療薬であって、周辺組織中への前記治療薬の放出速度及び全放出量を制御するためにPLGAマトリックス中に取り込まれ、ラパマイシンを含む、治療薬と、を含む、埋め込み型医療デバイス。
【請求項1】
内部に複数の開口部を有し、ほぼ管状の形態を有するとともに複数の架橋要素によって相互連結された複数の円筒形部分を含む管腔内骨格であって、前記円筒形部分のそれぞれは、延性ヒンジ及び周方向ストラットによって相互連結された細長いストラットの網状組織で形成されている、管腔内骨格と、
前記複数の開口部のうちの少なくとも1つに堆積した少なくとも1種の治療薬であって、周辺組織中への前記治療薬の放出速度及び全放出量を制御するためにPLGAマトリックス中に取り込まれ、ラパマイシンを含む、治療薬と、を含む、埋め込み型医療デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11】


【図12】


【公開番号】特開2010−172705(P2010−172705A)
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2010−18280(P2010−18280)
【出願日】平成22年1月29日(2010.1.29)
【出願人】(597041828)コーディス・コーポレイション (206)
【氏名又は名称原語表記】Cordis Corporation
【Fターム(参考)】
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【出願番号】特願2010−18280(P2010−18280)
【出願日】平成22年1月29日(2010.1.29)
【出願人】(597041828)コーディス・コーポレイション (206)
【氏名又は名称原語表記】Cordis Corporation
【Fターム(参考)】
[ Back to top ]

