リソフィリン類縁体とその使用方法
【課題】リソフィリン(LSF)の類縁体と、その使用方法の提供。
【解決手段】

R1は、水素原子であるか、もしくは構造式-C(=O)R3を有する基である。この化合物はLSFの活性側鎖部分(5-R-ヒドロキシヘキシル基)を持ち、LSFよりも高い力価と経口生体内利用率を有しうる。また、Rは低級アルキル基である。化合物は、糖尿病、炎症、および自己免疫疾患の処置に使われる。病状または病態が、1型糖尿病、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、もしくはアルツハイマー病、である。
【解決手段】

R1は、水素原子であるか、もしくは構造式-C(=O)R3を有する基である。この化合物はLSFの活性側鎖部分(5-R-ヒドロキシヘキシル基)を持ち、LSFよりも高い力価と経口生体内利用率を有しうる。また、Rは低級アルキル基である。化合物は、糖尿病、炎症、および自己免疫疾患の処置に使われる。病状または病態が、1型糖尿病、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、もしくはアルツハイマー病、である。
【発明の詳細な説明】
【技術分野】
【0001】
〔政府補助金〕
ここに記載する発明は、the National Institute of HealthによるGrant Numbers DK 63521 and R21DK 063521を冠する政府援助を受けてなされたものである。米国政府は、本発明に一定の権利を有する。
【0002】
〔関連出願〕
本出願は、下記の仮出願の優先権を請求するものである。則ち、本出願は、provisional patent application serial no. 60/712,114(2005年08月29日出願、この参照により本開示に含まれる)の優先権を請求する。
【背景技術】
【0003】
1型糖尿病は自己免疫疾患であり、膵島中のインスリン産生β細胞が、免疫介在性炎症で破壊されることによって起こる。1型糖尿病の具体的な病因機構は未知ではあるが、発症には活性化したT細胞およびマクロファージの関与があると考えられている。マクロファージは活性化すると、数種類の炎症性サイトカインを分泌し、例えば、インターロイキン 1β(IL-1β)、インターロイキン12(IL-12)、および腫瘍壊死因子α(TNF-α)が分泌され、さらには、インターフェロン-γ(IFN-γ)の活性化T細胞からの産生も誘発する(参照: Z. D. Yang, M. Chen, R. Wu, M. McDuffie, J. L. Nadler, Diabetologia, 2002, 45, 1307-1314)。こうしたサイトカインは、β細胞への細胞毒性を有し、且つ、β細胞の破壊に関与していると思われるTh1介在型炎症反応を増幅することが報告されている(参照: M. Chen, Z. D. Yang, R. Wu, J. L. Nadler, Endocrinology, 2002, 143(6), 2341-2348)。
【0004】
抗炎症化合物であるリソフィリン(LSF; 1-(5-R-ヒドロキシ-ヘキシル)-3,7-ジメチルキサンチン)は、インスリン分泌機能および細胞生存力を維持することで、β細胞をいろいろな炎症性サイトカイン介在型損傷から保護する能力を持っていることが明らかになっている。
【0005】
1型糖尿病の進行につれてのβ細胞の損傷を予防する上で、リソフィリンなどの薬剤は臨牀的に有用な可能性があるとされている。この仮説は、リソフィリンが、非肥満型糖尿病(NOD)マウスの特発性1型糖尿病の進行を大幅に抑えることができたという研究(文献Yangを参照)を拠り所としている。しかしながら、経口生体内利用ができずしかも力価が比較的小さいという欠点があるために、リソフィリンの臨牀的な開発には制限がかかってしまう可能性がある。LSFの構造を構造式Iに示した。
【0006】
現在、リソフィリン骨格に基づき、新規であり力価を持ち選択的であって、強化された力価と選択性と経口生体内利用率を持つような薬剤が求められている。本発明はその求めを充たすものである。
【発明の開示】
【0007】
本発明は、リソフィリン(LSF)の類縁体と、それらを調製するための合成方法とを提供する。これらの類縁体は、LSFよりも高い力価と経口生体内利用率を有しうる。これらの類縁体は、LSFの活性側鎖部分(5-R-ヒドロキシヘキシル基)を持つ。本発明は、LSFの誘導体をも含む。LSFは下記の構造式Iを有する。
【化1】

【0008】
本発明にかかる類縁体は、さまざまな窒素含有複素環化合物で置換することができ、もしくは、その側鎖が持つヒドロキシル基上に置換することも可能である。したがって本発明は、1位が置換された5-ヘキサノール化合物のヒドロキシル基上にさらに置換基がついたような化合物も提供する。この化合物は下記の構造式IIあるいはその薬学的に許容される塩を有する。
【化2】

なおここで、 R1 は、水素原子であるか、もしくは構造式 -C(=O)R3 を有する基である( R3は低級アルキル基である)。また、 R2 は、以下の
【化3】

から成る群から選択される。また、 n は1もしくは2である。
【0009】
別の実施形態においては、本発明は下記の構造式IIIを有する類縁体を提供し、
【化4】

ここで R4 のそれぞれは独立に、水素原子であるかもしくは -(CH2)m-OR1 であり、ここでR1 は、水素原子であるかもしくは構造式 -C(=O)R3を有する基である(ただし R4 のうちの少なくともひとつは水素原子では無い)。なおここで R3 は低級アルキル基、 m は2から約22までの範囲の整数である。
【0010】
別の実施形態においては、本発明は下記の構造式IVを有する類縁体を提供し、
【化5】

ここで R5 のそれぞれは独立に、水素原子であるかもしくは構造式 -(CH2)i-(CHOR1,)-(CH2)j-CH3を有する基である。なおここで、 R1 は水素原子であるかもしくは -C(=O)R3 を有する基である(R3 は低級アルキル基である)。また、 i は1から約20までの範囲の整数であり、 j は0から約20までの範囲の整数であって、ただし各 R5 基に関する i と j との和は2から約22まであり、且つ R5 基のうちの少なくともひとつは水素原子では無い。
【0011】
別の実施形態においては、本発明は、細胞生存力を保護する能力(特に膵臓β細胞を保護する能力)のあるLSF類縁体を提供する。したがって、本発明にかかる類縁体により、膵臓のインスリン分泌能が維持できるようになる。
【0012】
別の実施形態においては、本発明は、1型糖尿病の処置に有用なLSFの類縁体を提供する。別の実施形態においては、本発明は、1型糖尿病の進行を抑制できるLSFの類縁体を提供する。
【0013】
別の実施形態においては、本発明は、1型糖尿病の処置に有用なLSFの類縁体を提供する。別の実施形態においては、本発明は、身体がβ細胞を再生できるようにして1型糖尿病から恢復できるようにするLSFの類縁体を提供する。
【0014】
別の態様では、本発明は以下に挙げるものも提供する。
構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩、ならびに、薬学的に許容される担体もしくは添加剤とを含んだ薬学的組成物(この組成物は、そうした化合物もしくは塩の有効量を含むのが好ましい)。
1型糖尿病の処置方法もしくは予防方法であって、そうした処置を要する哺乳類(ヒトなど)へと、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩を投与すること、を含んだ方法。
細胞生存力の保護のための方法(特に膵臓β細胞を保護する能力)であって、細胞に(in vitroもしくはin vivoで)保護に有効な量の構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩を接触させること、を含んだ方法。
医療処置(1型糖尿病の処置など)に使用するための、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩。
哺乳類(ヒトなど)の1型糖尿病を処置するための医薬を調製するための、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩の使用方法。
【0015】
本発明にかかる類縁体は、炎症性自己免疫疾患の処置に有用である。こうした疾患の例としては、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病(非アルコール性脂肪肝炎(NASH))、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、アルツハイマー病などが含まれるがこれらに限定はされない。
【0016】
また、本発明は、本発明にかかる化合物の活性を検査する方法も提供する。開示されていない方法については、当業者に知られている。当業者は、本発明にかかる化合物から所望の効果が得られたかどうかを判定するために数多の手法を使用できる、ということを正しく理解できる。
【0017】
また、本発明は、本発明にかかる化合物を投与するためのキットも提供する。
【0018】
また、本発明は、構造式II、構造式III、もしくは構造式IVの類縁体を調製する上で有用な、本明細書で開示される新規な中間生成物および過程をも提供する。こうした中間生成物および過程としては、総括的な中間生成物および具体的な中間生成物が含まれ、さらには本明細書中の図表と実施例で開示された合成過程も含まれる。
【図面の簡単な説明】
【0019】
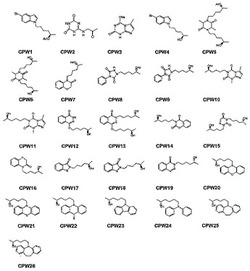
【図1】本発明にかかる化合物の具体例を示してある。
【図2】化合物 CPW11 を調製する反応式を示してある。
【図3A】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3B】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3C】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3D】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図4】2,3-ジヒドロ-ピリダジノ[4,5-d]ピリダジン-1,4-ジオンおよび関連する類縁体を調製する反応式を示してある。
【図5A】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5B】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5C】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5D】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5E】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5F】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5G】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5H】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5I】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5J】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5K】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5L】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5M】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5N】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5O】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5P】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図6】マウス膵島細胞からのインスリン放出を示している。
【図7A】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7B】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7C】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7D】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図8A】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図8B】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図8C】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図9A】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9B】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9C】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9D】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9E】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9F】、LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9G】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9H】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9I】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9J】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9K】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9L】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9M】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9N】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9O】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9P】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図10】本発明にかかる化合物(類縁体)の、マウス脾細胞中のSTAT4燐酸化を低減する能力を示すものである(immunodot-ブロット)。
【発明を実施するための最良の形態】
【0020】
〔略語〕
特に他に定めない限りは、本明細書中で用いる術語と科学用語のすべては、本発明の属する技術分野の当業者が常識として理解している意味と、同じ意味を有する。本明細書に開示した方法および物質と類似するかもしくは等しい方法および物質のすべてを、本発明の実施と試験に使うことが可能ではあるのだが、本明細書には好ましい方法および物質について記載してある。
【0021】
本発明を記載し請求するにあたり、下記の術語を後述する定義に従って使用してゆく。
【0022】
本発明を説明する上で、本明細書中の冠詞 "a" および "an" は、その冠詞が文法的にかかる対象語が、ひとつ以上(即ち、少なくともひとつ)であるということを意味する。あくまで例として、「或る要素」("an element")とは、ひとつ以上の要素という意味である。
【0023】
病気もしくは障碍が「軽減」("alleviated")されるのは、そうした病気、症状、もしくは障碍の症候の重篤度が低減される場合か、あるいは、こういった症候が被験者に顕われる頻度が低減される場合か、あるいはその両方かの場合である。
【0024】
本明細書では、化学物質の「類縁体(アナログ)」("analog")とは、例示すれば類似している別の構造を持つが必ずしも異性体ではないような化合物、のことである(例えば、5-フルオロウラシルはチミンの類縁体である)。
【0025】
「対照」("control")の細胞、組織、試料、もしくは被験者は、供試する細胞、組織、試料、もしくは被験者と同じ型のものである。こうした対照を試験するにあたっては、例えば、供試する細胞、組織、試料、もしくは被験者を試験するのと精確に同じ時刻もしくはほぼ同じ時刻に行うようにすることができる。また、こうした対照の試験を、例えば、供試する細胞、組織、試料、もしくは被験者を試験する時刻から或る時間だけ離れた時刻に行うようにしてもよい。また、対照の試験結果を記録しておいて、供試する細胞、組織、試料、もしくは被験者で得られた試験結果と比較してもよい。また、試験を行う目的とする疾病もしくは障碍を有する疑いのある被験者から供試試料を得ているような場合には、対照を、供試群もしくは供試被験者以外の別の源もしくは類似する源から得てくるようにしてもよい。
【0026】
「供試」("test")の細胞、組織、試料、もしくは被験者とは、試験もしくは処置する対象となるもののことである。
【0027】
「病徴」("pathoindicative")を呈する細胞、組織、もしくは試料とは、それらが存在する場合に、そうした細胞、組織、もしくは試料を裡に持つ動物(あるいは、そうした組織を得る元になった動物)が、疾病もしくは障碍に冒された徴候となるもののことである。
【0028】
組織が、疾病もしくは障碍に冒されていない動物中の組織内にひとつ以上の細胞を有する場合、このことを組織が細胞を「正常に含む」("normally comprises")と称する。
【0029】
「化合物」という語と「類縁体」という語は、本明細書では同義である。本明細書では、これらの語は、普通は薬品であると見做されるか、あるいは、本発明にかかる、薬品、併用剤、およびそれらの混合物、さらにはポリペプチドおよび抗体として使用される候補であるような、任意の型の物質もしくは剤のことを指す。
【0030】
本明細書では、化合物の「誘導体」("derivative")とは、類似する構造を持つ別の化合物からひとつ以上の過程を経てつくられる化合物のことを指し、そうした過程としては例えば、水素原子を、アルキル基、アシル基、もしくはアミノ基で置換することがある。
【0031】
本明細書では、「有効量」("effective amount")とは、選択した効果が得られる上で充分な量のことを指す。
【0032】
「検出」("detect")という語およびその文法的派生語を使用しているときには、定量的ではなく化学種を評定することを意図しており、一方、「定量する」("determine")もしくは「測る」("measure")という語およびそれらの文法的派生語を使っているときには、定量的に化学種を測定していることを意味している。「検出」という語と「同定」("identify")という語は、本明細書では同義である。
【0033】
本明細書では、「疾病」("disease")とは、生体恒常性を保てなくなった動物の健康状態のことであり、そうした疾病が改善されなければ、動物の健康は悪化してゆくことになる。
【0034】
対照的に、本明細書では、動物の「障碍」("disorder")とは、動物が生体恒常性は維持できるが、そうした障碍が無かったとしたときに較べて、動物の健康状態は不都合なものになっているような状態を指す。処置しないままに放置したとしても、障碍は、必ずしも動物の健康状態をさらに悪化させるとは限らない。
【0035】
本明細書では、「官能性(機能性)」("functional")の類縁体もしくは分子とは、特徴的な性質もしくは活性を呈する形状の分子のことである。
【0036】
本明細書では、「阻害」("inhibit")という語は、記載した機能を、本発明にかかる化合物が低減もしくは遅延させる能力のことを指す。阻害は、10%以上であるのが好ましく、25%以上であるのがさらに好ましく、50%以上であるのがより一層好ましく、機能を75%以上阻害するのがもっとも好ましい。
【0037】
本明細書では、「(ひとつもしくは複数の)説明書」("instructional material(s)")とは、そうした説明書が含まれるキット内の本発明にかかる類縁体の有用性を伝え、本明細書中で述べた種々の疾病もしくは障碍を軽減する作用を発揮させるために使用できるような、出版物、記録、図解、もしくは他の任意の表現媒体、を含む。そういった説明書には、哺乳類の細胞または組織における疾病もしくは障碍を軽減する、ひとつもしくは複数の方法についての記載を付け加えてもよいし、あるいはそうした記載を上述したものに代えて有してもよい。本発明にかかるキット内の説明書は例えば、同定した化合物発明を含有する容器に添付してもよいし、あるいは、同定した化合物を含有する容器と併せて出荷してもよい。別の手法として、受納者は説明書と本発明にかかる化合物とを組み合わせて使うよう促す注意書きを添えつつ、説明書をそうした容器とは分けて出荷するようにしてもよい。
【0038】
本明細書では、「精製した」("purified")という語およびその類語は、或る分子もしくは化合物の比率を、天然環境下でその分子もしくは化合物が存在する場合に通常付随している他の成分に較べて高めること、に関するものである。「精製した」という語は、過程中に特定の分子が完全に純粋であるということを、必ずしも意味しない。本明細書では、「高純度に精製した」("highly purified")化合物とは、90%よりも高い純度を持つ化合物のことを指す。
【0039】
本明細書では、「薬学的に許容される担体」("pharmaceutically acceptable carrier")という語は、任意の標準的な薬学的担体を含み、例えば、燐酸緩衝生理食塩水、水、乳濁液(油/水乳濁液もしくは水/油乳濁液など)、ならびに、種々の保湿剤が含まれる。また、この語には、監督官庁たる米国連邦政府に認可された全ての薬剤、もしくは米国薬局方(US Pharmacopeia)にヒトを含む動物へ使用できる薬剤として記載された全ての薬剤を含む。これらの担体および他の薬学的に許容される担体の例については、 Remington's Pharmaceutical Sciences (1991, Mack Publication Co., New Jersey) に記載されている。
【0040】
本明細書では「試料」("sample")とは、好ましくは被験者から採取した生物学的試料を指し、正常組織試料(normal tissue samples)、患部組織試料(diseased tissue samples)、生検試料、血液、唾液、排泄物、精液、涙液、および、尿が含まれるが、これらに限られるわけではない。試料はまた、特定の細胞、組織、もしくは関連する体液を含む、被験者から得られる物質についての、任意の他の源であってもよい。試料は、細胞培養もしくは組織培養からも得ることができる。
【0041】
本明細書では「標準」("standard")とは、比較をするために用いるものを指す。標準は例えば、投与されたかもしくは対照試料に添加された既知の標準物質または既知の標準化合物であって、その化合物を供試試料中で測定したときの結果と比較するために用いるものであってもよい。また、標準とは、「内部標準」("internal standard")のことを指すものであってもよく、これの既知量を例えば、目的物質の標識(マーカー)を測定しようとするに先立ち試料に加えることで、試料の処理をする際かまたは精製過程もしくは抽出過程にかける際に、純度または収率を計測するように使える。
【0042】
分析、診断、もしくは処置の「被験者」("subject")は動物である。こうした動物としては哺乳類が含まれ、好ましくはヒトである。
【0043】
本明細書では、「処置する」("treating")もしくは「処置」("treatment")という語は、特定の障碍もしくは症状の予防、または、特定の障碍もしくは症状状態に伴う症状の軽減、および/または、前記症状を予防するかもしくは除去すること、を含む。
【0044】
本明細書では、「予防としての」("prophylactic")処置とは、症候を呈していないかもしくは疾病の早期兆候のみしか示していない被験者に、そうした疾病に因る症状が重くならないようにする目的で施す処置である。
【0045】
本明細書では、「治療上の」("therapeutic")処置とは、病徴を呈している被験者へ、そうした病徴を軽減するかもしくは除去する目的で施す処置である。
【0046】
本明細書では、化合物もしくは類縁体の「治療上有効量」("therapeutically effective amount")とは、その化合物が投与される被験者に対して有益な効果を示す上で充分な化合物の量である。
【0047】
〔化学的定義〕
本明細書では、「ハロゲン」("halogen")もしくは「ハロ」("halo")という語には、ブロモ、クロロ、フルオロ、およびヨードが含まれる。本明細書では、「ハロアルキル(基)」("haloalkyl")という語は、ひとつ以上のハログン置換基を具えたアルキル基のことを指し、例えば、クロロメチル基、フルオロエチル基、もしくはトリフルオロメチル基などである。
【0048】
「低級アルキル(基)」("lower alkyl")という語は、一個から六個の範囲で炭素原子を有するアルキル基を指す。C1-C6アルキル基の典型例としては、メチル基、エチル基、n-プロピル基、イソプロピル基、ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基などが含まれるが、それらに限定はされない。
【0049】
本発明にかかる化合物には不斉中心が存在する場合があり、本発明にかかる化合物を任意に光学活性体およびラセミ体の形で単離できる、ということを当業者は正しく理解できる。いくつかの化合物は多形(polymorphism)となることがある。本発明には、本明細書に記載した有用な特性を有する、本発明にかかる化合物の任意のラセミ体、光学活性体、多形体、もしくは、立体異性体、またはそれらの混合物、が含まれることを理解されたい。また当該技術分野では、光学活性体の調製法(例えば、再結晶法によるラセミ体の光学分割、光学活性な出発物質からの合成、キラル合成、もしくは、キラル固定相を用いたクロマトグラフィーによる分離などによる)は公知である。さらには、cADPRアゴニストもしくはアンタゴニストの活性の測定を、本明細書に記載した標準的なテストを用いるか、もしくは当該技術分野において既知の他の同様のテストを用いることで行う手法についても公知である。
【0050】
本発明にかかる化合物は、互変異性体として存在する場合がある。本発明は、個々の互変異性体の混合物も包含し、且つそれぞれの互変異性体単体も包含する。例えば、下記の構造式
【化6】

は、下記の構造の混合物であると理解される。
【化7】

【0051】
「薬学的に許容される塩」("pharmaceutically-acceptable salt")という語は、本発明にかかる化合物の生物学的効果および特性を保持しており、且つ生物学的もしくは他の視座から見て望ましくないものでは無いような、塩のことを指す。多くの場合、本発明にかかる化合物からは、アミノ基および/もしくはカルボキシル基あるいはそれらの類似基を使って、酸性塩および/もしくは塩基性塩をつくりだすことが可能である。
【0052】
薬学的に許容される塩基付加塩は、無機塩基および有機塩基から調製できる。無機塩基からつくることができる塩としては、あくまで例として、ナトリウム塩、カリウム塩、リチウム塩、アンモニウム塩、カルシウム塩、およびマグネシウム塩が含まれる。有機塩基からつくることができる塩としては、一級アミン塩、二級アミン塩、および三級アミンが含まれ、例えば、アルキルアミン、ジアルキルアミン、トリアルキルアミン、置換アルキルアミン、ジ(置換アルキル)アミン、トリ(置換アルキル)アミン、アルケニルアミン、ジアルケニルアミン、トリアルケニルアミン、置換アルケニルアミン、ジ(置換アルケニル)アミン、トリ(置換アルケニル)アミン、シクロアルキルアミン、ジ(シクロアルキル)アミン、トリ(シクロアルキル)アミン、置換シクロアルキルアミン、二置換シクロアルキルアミン、三置換シクロアルキルアミン、シクロアルケニルアミン、ジ(シクロアルケニル)アミン、トリ(シクロアルケニル)アミン、置換シクロアルケニルアミン、二置換シクロアルケニルアミン、三置換シクロアルケニルアミン、アリールアミン、ジアリールアミン、トリアリールアミン、ヘテロアリールアミン、ジヘテロアリールアミン、トリヘテロアリールアミン、複素環アミン、二複素環アミン、三複素環アミン、ならびに、二箇所以上のアミンの置換基が異なっていて且つそれらの置換基がアルキル基、置換アルキル基、アルケニル基、置換アルケニル基、シクロアルキル基、置換シクロアルキル基、シクロアルケニル基、置換シクロアルケニル基、アリール基、ヘテロアリール基、複素環性置換基などからなる群から選択されるような、ジ-アミンとトリ-アミンの混合物、といったものの塩が含まれるが、これらに限定はされない。加えて、二個もしくは三個の置換基が、アミノ基の窒素原子と共に、複素環またはヘテロアリール基を形成しているようなアミンについても、こうした例として含まれる。適切なアミンの例としては、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリイソプロピルアミン、トリ(n-プロピル)アミン、エタノールアミン、2-ジメチルアミノエタノール、トロメタミン、リジン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン、コリン、ベタイン、エチレンジアミン、グルコサミン、N-アルキルグルカミン、テオブロミン、プリン類、ピペラジン、ピペリジン、モルフォリン、N-エチルピペリジンなどが含まれるが、これらに限定はされない。また、例えば、カルボキサミド、低級アルキルカルボキサミド、ジアルキルカルボキサミド、などを含むカルボン酸アミド類や、その他のカルボン酸誘導体も本発明の実施をするにあたっておそらく有用であろうことも理解されたい。
【0053】
薬学的に許容される酸付加塩は、無機酸および有機酸から調製できる。無機酸からつくる塩には、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、燐酸塩などが含まれる。有機酸からつくる塩には、酢酸塩、プロピオン酸塩、グリコール酸塩、ピルビン酸塩、蓚酸塩、林檎酸塩、マロン酸塩、琥珀酸塩、マレイン酸塩、フマル酸塩、酒石酸塩、枸櫞酸塩、安息香酸塩、桂皮酸塩、マンデル酸塩、メタンスルホン酸塩、エタンスルホン酸塩、p-トルエンスルホン酸塩、サリチル酸塩などが含まれる。
【0054】
薬学的に許容される塩を得るにあたっては、例えば、アミンなどの充分に塩基性である化合物を、生理学的に許容されるアニオンを与える適切な酸と反応させるなどの、当業者によって知られている通常の手法を用いることができる。アルカリ金属(ナトリウム、カリウム、もしくはリチウムなど)、またはアルカリ土類金属(カルシウムなど)とのカルボン酸塩も調製できる。
【0055】
別の実施形態においては、本発明は、本発明にかかる化合物を投与するかもしくは使用するためのキットも提供する。
【0056】
化合物が、充分に塩基性であるか酸性であって酸性塩もしくは塩基性塩をつくることができるような場合には、そうした化合物を塩として用いるのが適切なことがある。許容される塩の例としては、生理学的に許容されるアニオンをつくる酸から形成できる有機酸付加塩があり、こうした酸の例としては、トシル酸、メタンスルホン酸、酢酸、枸櫞酸、マロン酸、酒石酸、琥珀酸、安息香酸、アスコルビン酸、α-ケトグルタル酸、およびα-グリセロ燐酸などがある。また、適切な無機塩も形成でき、例えば、塩酸塩、硫酸塩、硝酸塩、炭酸水素塩、炭酸塩などを形成できる。
【0057】
基(ラジカル)、置換基、および範囲について以下に挙げてある具体的な好ましい値は、例示に過ぎない。これらは、他に定まる値や、基および置換基について定めた範囲内の別の値を排除するものでは無い。
【0058】
具体的には、(C1-C6)アルキル基は、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec-ブチル基、ペンチル基、3-ペンチル基、ヘキシル基などである。
【0059】
本発明にかかる化合物は、IUPAC命名法もしくはCAS命名法にだいたい基づいて命名してある。当業者に知られた略語を使用している場合もある(例えば、フェニル基を "Ph" 、メチル基を "Me" 、エチル基を "Et" 、時間を "h" 、室温を "rt" 、ラセミ混合物を "rac" と略すなど)。
【0060】
また本発明は、医療に使うための、構造式IIの化合物、構造式IIIの化合物、もしくは構造式IVの化合物も提供する。
【0061】
R3 は、水素原子、メチル基、エチル基、もしくはプロピル基であるのが好ましい。
【0062】
R3 は、メチル基もしくはエチル基であるのがより好ましい。
【0063】
R3 は、メチル基であるのがより好ましい。
【0064】
R3 は、水素原子であるのがより好ましい。
【0065】
R2 は、
【化8】

であるのが好ましい。
【0066】
或る特徴として、本発明にかかる好ましい類縁体は、下記の構造式
【化9】




か、それらの薬学的に許容される塩を有しうる。
【0067】
本発明にかかるより好ましい類縁体は、下記の構造式を有しうる。
【化10】

【0068】
本発明のさらなる実施形態として、構造式II、構造式III、もしくは構造式IVを持つ類縁体をつくる過程について、以下に述べる手法を以って説明してゆく。なお、総括的な基が意味するところは、特に他に定めない限りは、上述したものである。本発明にかかる、構造式IIを持つ類縁体をつくる概括的な反応式をScheme 1として以下に示す。
【化11】

【0069】
Scheme 2(図2)では、類縁体11 をつくる経路を示してある。本発明にかかる、構造式IIIもしくは構造式IVを持つ特別な類縁体のつくりかたは、図3Aから図3D、そして図4に示してある。
【0070】
構造式Iの化合物を薬学的組成物として処方し、哺乳類宿主(ヒト患者など)へと、選択した投与経路に沿った形態にして投与できる。そうした投与としては、経口投与や、または非経口的投与(静脈内、筋肉内、局所、もしくは皮下などを介したもの)がある。
【0071】
したがって、本発明にかかる化合物を、薬学的に許容される媒体(不活性な増量剤もしくは同化性可食担体など)と組み合わせて、(例えば経口で)全身へと投与できる。またこれらの剤を、ハードシェルゼラチンカプセルもしくはソフトシェルゼラチンカプセルに封入することもできるし、あるいは打錠することもできるし、あるいは患者の食餌に直接混ぜ込むことも可能である。経口治療投与にあたっては、活性化合物を、一種類もしくは複数種類の添加剤と組み合わせて、嚥下可能な錠剤、口内錠、トローチ、カプセル、エリキシル剤、懸濁液、シロップ、ウェハースなどといった形態として使用できる。こうした組成物および処方には、活性化合物を0.1%以上含めるべきである。組成物と剤型の比率は当然のことながら変更でき、所定の剤型単位の重量の約2%から約60%の範囲とするのが好ましい。治療上有用な組成物の活性化合物の量は、有効な用量が得られるようなものとする。
【0072】
こうした錠剤、トローチ、丸剤、カプセルなどには、以下に挙げるもののを含めることもできる。則ち、トラガカントゴム、アラビアゴム、コーンスターチ、もしくはゼラチンなどの結合剤;リン酸水素カルシウムなどのような賦形剤;コーンスターチ、ジャガイモ澱粉、アルギン酸などの崩壊剤;ステアリン酸マグネシウムなどの潤滑剤;スクロース、フルクトース、ラクトース、もしくはアスパルテームなどの甘味料、を含めることができる。さらに、ペパーミント、冬緑油、もしくはチェリーフレーバーなどの香料を加えてもよい。剤形単位(unit dosage)がカプセルである場合には、前述した類の物質に加えて、植物油もしくはポリエチエレングリコールのような液状担体を含めてもよい。その他さまざまな物質を、外被(コーティング)としてかもしくは別の手法により固体の剤形単位の物理的形状を改変するために使用してもよい。例えば、錠剤、丸薬、もしくはカプセルを、ゼラチン、ワックス、セラック(shellac)、もしくは糖などでコーティングしてもよい。シロップ剤もしくはエリキシル剤には、活性物質と、甘味剤としてスクロースもしくはフルクトースと、保存剤としてメチルパラベンおよびプロピルパラベンと、着色料と、香料としてチェリーフレーバーもしくはオレンジフレーバーと、を含めてもよい。当然のことながら、剤形単位の調合に用いられるいかなる物質も薬学的に許容され、用いられる量においては事実上毒性が無いものでなくてはならない。さらに、本発明にかかる活性化合物を、徐放性の処方および装置に組み入れてもよい。
【0073】
また、本発明にかかる活性化合物を、輸液もしくは注射によって、静脈内へもしくは腹腔内へと投与してもよい。活性化合物もしくはその塩の溶液は、水で調製でき、任意に非毒性界面活性剤を混ぜてもよい。また、グリセロール、液体ポリエチレングリコール、トリアセチン、およびこれらの混合物の中で分散剤をつくってもよいし、また油中でつくってもよい。通常の状況下で保管および使用する場合は、これらの製剤は、微生物の増殖を防ぐための保存料を含む。
【0074】
注射もしくは輸液に適した薬学的調剤には、滅菌水溶液もしくは分散液(懸濁液)、または、活性成分を含んだ滅菌粉末を含めることができる。こうした滅菌粉末は、滅菌済注射として、または滅菌済の輸液もしくは分散液として、即座に調製できるようにするために用いられ、また、任意にリポソーム内に包むこともできる。すべての場合において、最終的な剤型は、滅菌され、滑沢性とされ、製造および貯蔵の条件下で安定であるようにするべきである。このような分散液もしくは溶液は公知技術に従って処方でき、また、活性成分に加えて、分散剤、保湿剤、もしくは懸濁剤といった付加的な成分を含むこともできる。液状担体もしくは媒体としては、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、液体ポリエチレングリコール類など)、植物油、無毒性グリセリルエステル類、ならびにこれらの適切な混合物、を含むような溶媒もしくは分散液を使用できる。その他の許容される増量剤および溶媒としては、Ringer(リンゲル)溶液、等張塩化ナトリウム水溶液(生理食塩水)、ならびに不揮発性油(合成モノグリセリドもしくは合成ジグリセリドなど)、が含まれるがこれらに限定はされない。例えば、リポソームを用いた処方によって、もしくは分散液の場合に必要とする粒子径を維持することによって、もしくは界面活性剤の使用によって、適切な流動性を保つことができる。例えば、パラベン類、クロロブタノール、フェノール、ソルビン酸、チメロサールなどの、種々の抗真菌剤ならびに抗菌剤によって、微生物の活動を抑えることができる。多くの場合には、例えば糖類、緩衝物(バッファー)、もしくは塩化ナトリウムであるような等張化剤を含むことが好ましい。また、例えばモノステアリン酸アルミニウムおよびゼラチンであるような吸収遅延剤を用いることによって、注入可能な組成物の吸収を引き伸ばすことが可能である。
【0075】
滅菌溶液を調製するときには、上で列挙した種々の他の成分を(必要であれば)滅菌濾過してから加えた適切な溶液に、活性化合物の必要量を併せることによって、滅菌注射液を調製することができる。滅菌粉末を用いて滅菌注射液の調製を行う場合には、真空乾燥および凍結乾燥の技法を用いることで、活性成分の粉末に、予め滅菌濾過した溶液に含まれる所望の任意の添加成分を足したものが得られるようにするのが好ましい。滅菌溶液もしくは滅菌粉末を適切な担体と組み合わせて、注入による投与をすることができる。加えて、滅菌溶液もしくは滅菌粉末を、適切な担体および/もしくは推進剤と組み合わせて、吸入による投与をすることができる。
【0076】
局部への投与のために、本発明にかかる化合物を、純粋な形態(則ち液体)として与えることができる。しかしながら皮膚への投与においては、皮膚科学的に許容される担体(固体でもよいし液体でもよい)と組み合わせた組成物または処方として投与するのが一般的には望ましい。
【0077】
有用な固体担体としては、滑石(タルク)、粘土、セルロース微細結晶、シリカ、アルミナなどといった細粒状固体が含まれる。有用な液体担体には、水、アルコールもしくはグリコール類、または水-アルコール/グリコール混合液、が含まれ、これには本発明にかかる化合物の有効量を溶解するかもしくは分散することができ、また、任意に無毒性界面活性剤を添加することもできる。香料などの佐剤、および付加的な抗微生物剤を、所定の使用方法のための特質を最大限にするために添加できる。得られる液体組成物は、包帯および他の手当用品に含浸させて吸収性パッドから投与することができ、あるいは、ポンプ型スプレーもしくはエアロゾルスプレーを用いて、患部に噴霧して投与することもできる。
【0078】
合成ポリマー、脂肪酸、脂肪酸塩および脂肪酸エステル、脂肪アルコール、修飾セルロース、または修飾無機物質などの増粘剤を液状担体として使用することで、使用者の皮膚に直接塗布するための、薄く塗り拡げることができるようなペースト、ゲル、軟膏、石鹸、などといったものを形成することもできる。
【0079】
構造式IIの化合物の有用な用量は、in vitro活性と、動物モデルでのin vivo活性とを比較することで定量できる。マウスおよび他の動物での有効量をヒトへと外挿する手法は当該技術分野において公知であり、例えば、U.S. Pat. No. 4,938,949を参照のこと。
【0080】
構造式IIの(一種もしくは複数種の)化合物を溶液や懸濁液などの液状組成物にする場合の濃度は、一般的には約0.1 wt%から25 wt%とし、好ましくは約0.5 wt%から10 wt% とする。ゲルもしくは粉末のような半固体または固体の組成物にした場合の濃度は、約0.1 wt%から5 wt%とし、好ましくは約0.5 wt%から2.5 wt%とする。
【0081】
本発明にかかる化合物またはその活性塩もしくは誘導体の、処置に使用する上で必要な量は、選択した特定の塩に依存するだけでは無く、投与経路、ならびに、患者の処置しようとする症状の性質および年齢および体調にも依存して調整できるものであるが、最終的にはかかりつけの医師もしくは臨床医の裁量で決めることになる。
【0082】
しかしながら一般的に、適切な投与量は、体重に対して約0.5 mg/kgから約20 mg/kgの範囲と考えられ、例えば、体重に対して一日あたり約1 mg/kgから約18 mg/kgの範囲、則ち患者の体重キログラムに対して一日あたり3 mgから約16 mgの範囲、好ましくは6 mg/kg/dayから14 mg/kg/dayの範囲、最も好ましくは9 mg/kg/dayから11 mg/kg/dayの範囲とする。
【0083】
化合物は剤型単位で投与されることが好ましく、例えば、剤型単位あたりに、活性成分が5 mgから1000 mg、好ましくは10 mgから750 mg、最も好ましくは50 mgから500 mgの範囲で含まれる。
【0084】
理想的には、活性成分は、活性成分の血漿中濃度のピークが約0.5 μMから約75 μMの範囲となるように投与されるべきであり、好ましくは約1 μMから50 μMの範囲、最も好ましくは約2 μMから約30 μMの範囲である。こういったことの実施にあたっては、例えば活性成分の0.05%〜5%溶液に、任意に生理食塩水を加えたものを、静脈注射によって投与してもよいし、あるいは、約1 mgから100 mgの活性成分を含んだボーラス(巨丸薬; bolus)として経口投与してもよい。また、約0.01 mg/kg/hrから5.0 mg/kg/hrの(一種もしくは複数種の)活性成分を与える継続的な注入によってか、あるいは、約0.4 mg/kgから15 mg/kgの(一種もしくは複数種の)活性成分を含む間歇的な注射によって、望ましい血中濃度を維持することができる。
【0085】
望ましい投与量を与える際には、単独の投与を行うか、または、例えば一日につき二回、三回、もしくは四回以上の投与となるように適切な間隔をとった分割投与を行うことが好ましい。分割された投与をさらに分割することもでき、例えば、気腹装置からの複数回の吸入、もしくは複数の錠剤の投与といった、多数の不均一な間隔をとった投与とすることもできる。
【0086】
本明細書に記載の方法群のいずれかを用いて同定される化合物を、被験者に処方し投与することで、本明細書に記載の疾病および障碍のいずれかの処置を行うことが可能である。しかしながら、本発明にかかる化合物の使用先が、本明細書に記載の疾病および障碍のみであるとは解釈されぬよう願いたい。こうした被験者は、ヒトであるのが好ましい。
【0087】
本明細書に記載の薬学的組成物の処方は、薬理学分野で既知である手法か今後開発される手法のいずれかを用いて調製できる。一般的に云って、こうした調製方法としては、活性成分を、担体または一種もしくは複数種の他の補助成分と併せてから、(必要であるかもしくは希望であれば)所望の単独剤型単位もしくは複数剤型単位へと成形するかまたは包装して製品を作成するという工程、が含まれる。
【0088】
本明細書にて述べた薬学的組成物の記載は、主として、ヒトへの医療上の投与に適する薬学的組成物を指向してはいるが、熟達した技術者には、こうした組成物は大概にして、あらゆる種類の動物への投与にも適するということが理解できる。
【0089】
ヒトへの投与に適した薬学的組成物を、種々の動物への投与に適したものとなるように改変する行為については公知であって、通常の知識を有する獣薬理学者は、こうした改変の設計および実施を(必要ならば通常の実験を用いて)することができる。本発明にかかる薬学的組成物の投与が想定される被験者としては、ヒトおよび他の霊長類ならびに哺乳類が含まれるがそれらに限定はされない。こうした哺乳類としては、ウシ、ブタ、ウマ、ヒツジ、ネコ、およびイヌなどの市販の適当な哺乳類が含まれる。
【0090】
本発明にかかる薬学的組成物は、バルクか、単独剤型単位か、もしくは複数の単独剤型単位として、調製するかまたは包装するかまたは販売できる。本明細書では、「剤型単位」("unit dose")とは、所定量の活性成分を含んだ薬学的組成物の個別の量のことを指す。活性成分の量は、被験者へ投与されうる活性成分の用量とほぼ等しいか、あるいはそうした用量の適切な分割分(用量の半分もしくは三分の一など)とほぼ等しい。
【0091】
本発明にかかる薬学的組成物中の、活性成分と、薬学的に許容される担体と、その他の付加的な成分の相対量については、処置を受ける被験者の素性、体格、および体調に沿って変更可能であり、さらには組成物を投与しようとする経路に応じても変更できる。一例として、組成物は0.1%から100% (w/w) の範囲で活性成分を含むことができる。
【0092】
活性成分に加えて、本発明にかかる薬学的組成物には、一種もしくは複数種の付加的な薬学的活性薬剤を含めてもよい。特に想定される付加的な薬剤としては、制吐剤ならびに捕捉剤(シアン化物捕捉剤およびシアナート捕捉剤など)が含まれる。
【0093】
本発明にかかる薬学的組成物の制御放出処方もしくは徐放処方を、従来技術を用いて作成できる。
【0094】
場合によっては、例えばヒドロプロピルメチルセルロース、他のポリマー母材、ゲル、隔膜、浸透性系、多層コーティング、微粒子、リポソーム、もしくはマイクロスフィア、または、望ましい放出特性を得るためのさまざまな割合でのこれらの組み合わせなどを活用することで、使おうとする剤型で、その剤型中の一種もしくは複数種の活性成分が徐放(コントロールリリース)されるように構成できる。当業者に知られた適切な徐放処方(本明細書に記載したものを含む)は、本発明にかかる薬学的組成物と併用する目的で容易に選択できる。したがって、徐放目的に使われる、経口投与に適する単独の剤型単位(錠剤、カプセル、ジェルカプ(gelcaps)、およびカプレット(caplets)など)についても、本発明に包摂される。
【0095】
多くの徐放処方の設計に際しては、所望の治療効果が迅速に得られる薬剤の量を最初に放出し、それから、長時間に亘り、この治療効果のレベルを維持するように、薬剤の他の量を徐ろに継続して放出するようにする。身体中の薬剤を定常量に保つためには、その薬剤を剤型から、身体が代謝し排出する薬物の量を補う速度で放出する必要がある。
【0096】
活性成分の徐放は、種々の誘導源を使って刺激でき、例えば、pH、温度、酵素、水、または、他の生理学的条件もしくは化合物を使って刺激できる。
【0097】
本発明にかかる薬学的調剤の粉末処方および粒状処方を、既知の手法により調製できる。こうした処方を、被験者に直接投与することもできるし、あるいは、錠剤などをつくるために使ってもよいし、あるいは、カプセルに詰めるために使ってもよいし、あるいは、その処方に水性媒体もしくは油性媒体を足すことで水性もしくは油性の懸濁液もしくは溶液をつくってもよい。こうした処方のそれぞれには、一種もしくは複数種の、分散剤(保湿剤)、懸濁剤、ならびに保存料をさらに含めてもよい。また、付加的な医薬品添加剤(賦形剤、ならびに、甘味料、香料、もしくは着色料など)をこうした処方へ加えてもよい。
【0098】
本発明にかかる薬学的組成物の、経口投与に適した処方を、個別の固体剤型単位として、調製・包装・販売が可能である。そうした固体剤型単位としては、錠剤、ハードカプセル、ソフトカプセル、包、トローチ、もしくは薬用錠剤(lozenge)(いずれも所定量の活性成分を含む)、といったものが含まれるが、これらに限定はされない。経口投与に適した他の処方としては、粉末処方もしくは粒状処方、水性懸濁液もしくは油性懸濁液、水性溶液もしくは油性溶液、ペースト、ゲル、歯磨き粉、含嗽剤、外被物(コーティング)、洗口液、または乳液、が含まれるがこれらに限定はされない。本明細書では、洗口液(oral rinse)という語と含嗽剤(mouthwash)という語は同義である。
【0099】
活性成分を含んだ錠剤は例えば、活性成分を(任意に一種もしくは複数種の付加的な成分を加えてから)圧縮するかまたは湿製して、つくることができる。適切な装置で、流動体(粉末状もしくは細粒状の構成など)である活性成分を、任意に一種もしくは複数種の結合剤、滑沢剤、賦形剤、界面活性剤、および分散剤と混ぜ合わせて、圧縮することで圧縮錠を作成できる。湿製錠(molded tablets)は、適切な装置で、活性成分と薬学的に許容される担体と得られるものに水分を与える量以上の液体との混合物を練り合わせることで作成できる。錠剤製造において使われる薬学的に許容される医薬品添加剤としては、不活性増量剤、整粒剤および崩壊剤、結合剤、ならびに滑沢剤、が含まれるがこれらに限定はされない。公知である分散剤としては、ジャガイモ澱粉、および澱粉グリコール酸ナトリウム(sodium starch glycollate)が含まれるがこれらに限定されない。公知の界面活性剤としては、ラウリル硫酸ナトリウムが含まれるがこれに限定はされない。公知の増量剤としては、炭酸カルシウム、炭酸ナトリウム、ラクトース、微細結晶セルロース、燐酸カルシウム、燐酸水素カルシウム、および燐酸ナトリウム、が含まれるがこれらに限定はされない。公知の整粒剤および崩壊剤としては、コーンスターチ、およびアルギン酸が含まれるがこれらに限定はされない。公知の結合剤としては、ゼラチン、アラビアゴム、未アルファ化トウモロコシ澱粉、ポリビニルピロリドン、およびヒドロキシプロピル-メチルセルロース、が含まれるがこれらに限定はされない。公知の滑沢剤としては、ステアリン酸マグネシウム、ステアリン酸、シリカ、および滑石(タルク)、が含まれるがこれらに限定はされない。
【0100】
錠剤には、外被をかけなくてもよく、あるいは、被験者の消化管内でゆっくりと崩壊してゆくようにすることで活性成分が徐ろに放出され吸収されるような既知の手法を使って外被をかけてもよい。一例として、モノステアリン酸グリセリルもしくはジステアリン酸グリセリルなどの物質を使って、錠剤を覆うことができる。さらなる例として、U.S. Patent No. 4,256,108、U.S. Patent No. 4,160,452、およびU.S. Patent No. 4,265,874に記載の手法を用いて錠剤を覆うことで、滲透圧による徐放錠剤をつくることができる。また、錠剤に、甘味料、香料、着色料、保存料、もしくはそれらの組み合わせを含めることにより、薬学的に洗練された口あたりのよい処方を得ることも可能である。
【0101】
活性成分を含んだハードカプセルは、生理学的に分解可能な組成物(ゼラチンなど)を使って作成できる。こうしたハードカプセルには、例えば不活性固体増量剤(炭酸カルシウム、燐酸カルシウム、もしくはカオリンなど)を含む付加的な成分を含めてもよい。
【0102】
活性成分を包含したソフトゼラチンカプセルは、生理学的に分解可能な組成物(ゼラチンなど)を使って作成できる。こうしたソフトカプセルには、水または油媒体(ピーナツ油、液体パラフィン、もしくはオリーブ油など)と混ぜた活性成分が含まれる。
【0103】
本発明にかかる薬学的組成物の、経口投与に適した液状処方を、液状の形態としてか、あるいは、使用前に水もしくは他の適切な媒体に溶かして再構成するよう企図された乾燥物の形態として、調製・包装・販売が可能である。
【0104】
注射可能な処方を、アンプルに封入した剤型単位やもしくは保存料を含めた複数回分の用量の入る容器に収めた剤型単位として、調製・包装・販売が可能である。非経口投与のための処方には、懸濁液、溶液、油性媒体もしくは水性媒体を用いた乳濁液、ペースト、ならびに、移植可能な徐放性処方もしくは生分解性処方、が含まれるがこれらに限定はされない。こういった処方には、懸濁剤、安定剤、もしくは分散剤を含むがこれらに限定されない付加的成分を、さらに一種類以上含めてもよい。非経口的投与用処方の或る実施形態においては、有効成分は乾いた状態(すなわち、粉末もしくは顆粒)で与えられ、非経口投与をする前に、適切な媒体(例えば、無菌であり発熱因子(パイロジェン)が含まれていない水)に溶かすことで、組成物を再構成できる。
【0105】
本発明にかかる薬学的組成物は、口内投与(buccal administration)に適した処方として、調製・包装・販売が可能である。こうした処方は、従来の手法を使って錠剤の形態もしくは薬用錠剤(lozenge)の形態として作成することができ、例えば、0.1% (w/w)から20% (w/w)の活性成分と、その残りとして経口で溶解もしくは崩壊する組成物(ならびに任意に本明細書で示した付加的な一種もしくは複数の成分)とを有するようにできる。そのほか、口内投与に適する処方としては、活性成分を含んだ粉末も含まれ、または、活性成分を含んだ溶液もしくは懸濁液をエアロゾル化した(噴霧した)ものも含まれる。こうした粉末化した処方、エアロゾル化した処方、およびエアロゾル化した処方は、分散させた際には、平均粒子径もしくは平均滴径が、約0.1ナノメートルから約200ナノメートルの範囲であるのが好ましい。また、こうした処方は、本明細書に記載した付加的な一種もしくは複数種の成分を含んでもよい。
【0106】
本明細書では、「付加的な成分」("additional ingredients")には、以下に挙げるもののうちの一種類以上が含まれるが、それらに限定はされない。則ち、賦形剤、界面活性剤、分散剤、不活性増量剤、整粒剤および崩壊剤、結合剤、滑沢剤、甘味料、香料、着色料、保存料、生理学的に分解する組成物(ゼラチンなど)、水性媒体(溶液)および油性媒体(溶液)、懸濁剤、分散剤もしくは保湿剤、乳化剤、粘滑剤、緩衝剤、塩、増粘剤、賦形剤、乳化剤、酸化防止剤、抗生物質、抗真菌剤、安定剤、ならびに、薬学的に許容される高分子もしくは疎水性の物質、である。Genaro, ed., 1985, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PAを参照せよ(この参照により本開示に含まれる)。
【0107】
本発明にかかる化合物を被験者へと投与するにあたっては、一日数度といった頻度で投与してもよく、あるいは、それよりも少ない頻度、即ち一日一度、一週一度、二週間に一度、一ヶ月に一度、またはさらに少なく数ヶ月に一度もしくは一年に一度もしくはそれよりも少ない頻度で投与してもよい。用量の頻度は、熟達した技術者には容易にわかるものであって、因子(処置する疾病の種類と重症度、型、ならびに被験者の年齢、などであるがこれらに限定はされない)のうちのいずれかに依存して決定できる。
【0108】
また本発明は、薬学的なパックもしくはキットも提供し、これには、本発明にかかる薬学的組成物のうちの一種もしくは複数種の成分を詰めた一個または複数個の容器が含まれる。或る実施形態においては、こうしたキットを提供して、免疫変調への処置を必要とする被験者を処置する。こうした被験者はヒトであるのが好ましい。或る実施形態においては、こうしたキットは、本発明にかかる一種類以上の特別な類縁体を含み、さらに一種類以上の既知の免疫抑制剤を含んでもよい。これらの調合薬を、さまざまな容器に詰めることができ、例えば、バイアル瓶、管、微量測定用wellプレート(マイクロタイターウェルプレート)、瓶、などに詰めることができる。また、陽性対照試料、陰性対照試料、緩衝液、細胞培地などの他の薬剤をキット中の別の容器に入れることもできる。キットには説明書を含めるのが好ましい。
【0109】
本明細書に記載の方法および物質と類似するかまたは等価である任意の方法および物質も、本発明の実施もしくは試験において使用可能であるが、本明細書では好ましい方法および物質について記載してある。
【0110】
本発明では、上述したようにかもしくは以降の実施例にて記載しているように、当業者に公知な従来技術である、臨牀技術、化学技術、細胞学技術、組織化学技術、生化学技術、分子生物学技術、微生物学技術、DNA組み換え技術法を使うこともできる。こうした技術については文献に詳しく説明されている。
【実施例】
【0111】
本発明を、以下の実施例および実施形態を参照しながら説明してゆく。当業者は、前述した記載および以降の実施例をもとに(さらなる記載を必要とすること無く)、本発明を作成し利用でき、且つ本発明にかかる方法を実施できる。したがって、後述の実施可能な実施例は、本発明のうちのいくつかの実施形態のみについて例示し指摘するために記載したものであって、本開示のそれ以外の部分をいかなる意味でも限定しようとするものでは無い。よって、これらの実施例は、本明細書での教示の結果の証左となりえる任意のすべての変形例を包摂すべきものである。
【0112】
〔実施例1: LSF類縁体〕
側鎖部分(5-R-ヒドロキシヘキシル基)を保っておいて、キサンチン類似骨格(5-アザ-7-デアザキサンチン-LSF)およびキサンチン非類似骨格を含む種々の窒素含有複素環化合物を調製して、そのヒドロキシヘキシル基と置換した。これらの複素環化合物のほとんどは市販されていたものである。5-アザ-7-デアザキサンチン(化合物10 および化合物 11 として示した)については、1,3,5-トリアジン誘導体である塩化シアヌルから合成した。J. D. Hepworth., Org. Synth., 5, 27-29; R. Calabretta, C. Giordano, C. Gallina, V. Morea, V. Consalvi and R. Scandurra., Eur. J. Med. Chem., 1995, 30, 931-941; S. Horrobin., J. Chem. Soc., 1963, 4130-4145; そして S. H. Kim, D. G. Bartholomew, and L. B. Allen., J. Med. Chem., 1978, 21(9), 883-888を参照のこと。LSF類縁体の合成の一般的な反応式は、Scheme 1として示してある。本発明にかかる化合物の具体例は、図1に示した。化合物11 (CPW11)の合成を、図2のScheme 2に示してある。
【0113】
〔実施例2: LSF類縁体の生物学的評価〕
本発明にかかる類縁体(CPW1からCPW15まで)を、膵臓β細胞株に用いて、炎症性サイトカインによる処理後のアポトーシス保護(OD450の減少を反映する)に関してと、インスリン放出に関して評価を行った(図5および図6)。β細胞の保護作用について述べると、いくつかの類縁体がLSFに比肩する力価を示し、また、特別な類縁体は低濃度(nM以下)で細胞を保護できた(図5)。インスリン放出アッセイでは、いくつかの化合物は、グルコースに反応してLSFと同様の効果を呈した(CPW1-15、図6)。
【0114】
本発明にかかるLSF類縁体のうちのいくつかを用い、MDSアッセイ、溶解性、生体的経口利用性、および安定性に関してさらに評価を行った(表1)。
【表1】

【0115】
50%よりも高い阻害率を有する類縁体を、高活性であると見做した。また、20%から49%までの範囲の阻害率を有する類縁体を、中間の活性を持つと見做した。また、20%未満の阻害率を有する類縁体を、低活性であると見做した。
【0116】
〔実施例3: ヒト膵島でのLSF類縁体の生物学的評価〕
四種の化合物(CPW7、CPW8、CPW11、およびCPW12)について、インスリン分泌、細胞内ATP濃度、および、サイトカイン(ヒトIL-1βとIFN-γとTNF-αの混合物)に曝露しての細胞死の低減効果、を誘導する能力に関してヒト膵島上で評価を行った。結果は図7Aから図7Dに示した。
【0117】
試験結果からは、CPW12が、マウス膵島細胞株で、β細胞の保護およびインスリン放出への正の作用を示したことがわかった。またこの類縁体CPW12は、シトクロムp450の阻害は少なめであった(薬剤相互作用をする可能性が低い安全な化合物であった)。Caco-2滲透性検査の結果からは、経口投与されたCPW12は胃腸管から吸収されうることがわかり、このことは生体経口利用度が良好であることと符合する。類縁体CPW12は、許容できる安定性と溶解性を示す。
【0118】
ヒト膵島での評価では、CPW12は、炎症性サイトカインの存在下でのインスリン分泌の改善への正の効果を呈し、且つ、ヒトβ細胞でのミトコンドリア機能とセル生存率の維持に対しても有効であった。
【0119】
〔実施例4: LSFと類縁体のβ細胞への作用〕
マウスのインスリン分泌性INS-1細胞株を用いて、LSF類縁体のβ細胞への作用を研究した。細胞をRPMI 1640培地(Life Technologies, Inc., Gaithersburg, MD)に入れ、10% 熱失活FBS、10 mM HEPES、200 μM L-グルタミン、1 mM ピルビン酸ナトリウム、5 nM 2-メルカプトエタノール、50 U/ml ペニシリン、および50 μg/ml ストレプトマイシンを加えてpH 7.4とした。細胞を、加湿培養器に5% 二酸化炭素を流して37℃で培養した。二日ごとに新鮮な培地に交換した。細胞の播種密度は105/cm2とした。培養容器はポリ-D-リジンおよびゼラチン(Sigma, St. Louis, MO)で覆い、剥離して死んだ細胞を逃さないようにして、播種した細胞数が、すべての処置条件の後に実際の細胞数に反映されるようにした。マウス組換え体IL-1β(5 ng/ml)、IFNγ(100 ng/ml)、およびTNFα(10 ng/ml; R&D Systems, Inc., Minneapolis, MN)を併せて完全RPMI培地に懸濁させたものを、INS-1細胞に与えて処置した。LSF(Cell Therapeutics, Inc., Seattle, WAから提供)および類縁体を、サイトカインと同時に、完全RPMI培地に加えた。すべての処置は18時間に亘って行った。
【0120】
図8aから図8cに示した結果からは、LSF類縁体が、サイトカインに起因する細胞死からβ細胞を保護できたことが示された。INS-1細胞は、組換え体IL-1βとIFNγとTNFαの混合物に、10-5 μMから103 μMのLSFとその類縁体を加えたもので処置をした。LSFの保護作用は、濃度10-2 μMで最大となった(図8a)。LSF濃度を10-2 μMから102 μMへと増加させても、β細胞保護作用がそれ以上に増すことは無かった。LSF類縁体は、β細胞への保護作用を多少示し、特に化合物CPW11(図8b)およびCPW12(図8c)は低濃度で良好に作用した。化合物CPW11と化合物CPW12はどちらも、濃度10-2 μMで、LSFと比肩する活性を示した。類縁体の濃度を高めても、β細胞保護作用がさらに増大することは無かった。
【0121】
〔実施例5: LSFおよび類縁体のインスリン分泌への作用〕
炎症性サイトカインのある場合とない場合についての、INS-1細胞のインスリン分泌への、LSF類縁体の作用。β細胞を、アポトーシス検出色素で2時間から3時間に亘って室温で処置した。顕微鏡で見ると、アポトーシス細胞は赤紫色であった。結合しなかった色素を洗い流して、色素乖離剤を加えた後に、色濃度をOD 450nMで読みとって定量した。処置の終了時に、細胞をKrebs-Ringer-bicarbonate-HEPES緩衝液(KRB; 内容: 134 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgSO4、1.0 mM CaCl2、10 mM HEPES、0.1% BSA; 37℃、pH 7.4)で洗った。細胞を同じ緩衝液中で30分間に亘り前培養してから、15 mM D-グルコースを加えたKRB中で60分間培養した(J. T. Baker, Phillipsburg, NJ)。上清を回収し、遠心して残存細胞を除去した。上清中に分泌されていたインスリンを、マウスインスリンを基準として用い、RIAで定量した。細胞は基底状態(3 mM)、およびグルコース刺激状態(28 mM)に保持した。インスリン放出を、20 μMのLSFおよびその類縁体を使って観察した。INS-1細胞のインスリン分泌は以下の通りである。 (a) LSF、 (b) 化合物(compound)CPW11、および (c) 化合物 CPW12(+C-G3 = w/compound, w/o cytokines, 3 mM glucose; -C-G3 = w/o compound, w/o cytokines, 3 mM glucose; +C-G28 = w/compound, w/o cytokine, 28 mM glucose; -C-G28 = w/compound, w/o cytokine, 28 mM glucose; +C+G3 = w/compound, w/cytokines, 3 mM glucose; -C+G3 = w/o compound, w/cytokines, 3 mM glucose; +C+G28 = w/compound, w/cytokines, 28 mM glucose; -C+G28 = w/o compound, w/cytokines, 28 mM glucose)。結果は図9aから図9cに示してある。
【0122】
〔実施例6: CPW12からのLSF類縁体の開発〕
CPW12に付加をした類縁体群についての反応式を示した(図3Aから図3DのScheme 3AからScheme 3D、図4のScheme 4を参照のこと)。図3Aから図3Dには、Scheme 3AからScheme 3Dとして、側鎖部分の改変について記してある(参考:V. Cere, C. Mazzini, C. Paolucci, S. Pollicino and A. Fava, J. Org. Chem., 1993, 58, 4567-4571; C. Paolucci, S. Pollicino and A. Fava, J. Org. Chem., 1995, 60, 169-175; F. Sato, Y. Tomuro, H. Ishikawa and M. Sato., Chem. Lett., 1980, 99-102; およびG. Cerichelli, C. Grande, L. Luchetti and G. Mancini, J. Org. Chem., 1991, 56, 3025-3030)。
【0123】
図4のScheme 4では、核となる部分(R2)の改変について記してある(参考:N. Haider, E. Mavrokordatou and A. Steinwender., Syn. Comm., 1999, 29(9), 1577-1584)。
【0124】
〔実施例7: マウスインスリン分泌性細胞株 β-TC6〕
◆ 細胞調製
β-TC6細胞株を、RPMI 1640培地(Life Technologies, Rockville, MD)に入れ、10% 熱失活ウシ胎児血清、10 mM HEPES、200 pM L-グルタミン、50 units/ml ペニシリン、および50 μg/ml ストレプトマイシンを加えてpH 7.4とする。細胞は、37℃の加湿培養器に5% 二酸化炭素を流して培養する。二日ごとに新鮮な培地に交換する。特に他に定めない限りは、細胞の播種密度は105/cm2である。実験に用いた細胞容器(ディッシュとチャンバースライド)は、ポリ-D-リジンおよびゼラチン(Sigma, St. Louis, MO)で覆い、剥離して死んだ細胞を逃さないようにして、播種した細胞数が、すべての処置条件の後に実際の細胞数に反映されるようにした。
【0125】
◆ サイトカインおよびLSF類縁体によるβ-TC6細胞の処置
β-TC6細胞を、媒体単独で処置するか、または、組換え体マウスIL-1β(5 ng/ml)とIFN-γ(100 ng/ml)とTNF-α(10 ng/ml)(R&D Systems, Minneapolis, MN)とを混合して完全RPMI培地に懸濁させたもので処置する。LSF(Cell Therapeutics, Inc., Seattle, WA)もしくはその類縁体を、サイトカインと同時に、完全RPMI培地に、濃度1 nMから20 pMの範囲で加える。すべての処置は18時間に亘って行う。結果は図8Aから図8Pに示した。
【0126】
〔実施例8: インスリンの静的分泌〕
処置の終了時に、細胞をKrebs-Ringer-bicarbonate-HEPES緩衝液(KRB; 内容: 134 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgSO4、1.0 mM CaCl2、10 mM HEPES、0.1% ウシ血清アルブミン; 37℃、pH 7.4)で洗った。細胞を同じ緩衝液中で30分間に亘り前培養してから、15 mM D-グルコースを加えたKRB中で60分間培養する(J. T. Baker, Phillipsburg, NJ)。上清を回収し、遠心して残存細胞を除去する。上清中に分泌されていたインスリンを、マウスインスリンを基準として用い、EIAで定量する。結果は図9Aから図9Pに示した。
【0127】
〔実施例9: STAT4燐酸化反応〕
マウス脾細胞を96-wellプレートに均等に播種して、LPS(1.0 ng/ml)を使う場合と使わない場合のそれぞれについて、LSFもしくは一連の類縁体を加えて、18時間処置する。蛋白質溶解物をHybond-P膜に転写し、続いて燐酸化STAT4に対するポリクローナル抗体でプローブする。ハイブリダイゼーションした膜を、ECLおよびオートラジオグラフィーにかける。試料は三回繰り返す。結果は図10に示してある。
【0128】
使用できると考えられるが本明細書に開示されていない他の方法についても周知であって、医療・化学・細胞学・組織化学・生化学・分子生物学・微生物学・DNA組み換え法の当業者の力の及ぶ範疇にある。
【0129】
本発明は、目標を達成して上述したような目的と利点を得ること、さらにはそうした目標に本来的に具わった目的と利点を得る上で有用である、ということを、当業者は容易に理解できる。本発明は、本発明の本質もしくは不可欠な属性から逸れること無く、他の特定の形態を実現できる。
【0130】
本明細書中で用いる略語は、化学分野内および生物学分野内で従来より使用されている意味を有している。本明細書で参照した公報、特許、および特許文献のすべては、この参照により個々の全体が本開示に含まれる。何らかの矛盾があった場合、本開示(および本開示に含まれる定義のすべて)が優先することになる。本発明を記載するに際しては、特定の具体的な好ましい実施形態および技法を参照して行っている。しかしながら、本発明の本質から逸れること無く、数多の変形例を構成できるということも理解されたい。
【技術分野】
【0001】
〔政府補助金〕
ここに記載する発明は、the National Institute of HealthによるGrant Numbers DK 63521 and R21DK 063521を冠する政府援助を受けてなされたものである。米国政府は、本発明に一定の権利を有する。
【0002】
〔関連出願〕
本出願は、下記の仮出願の優先権を請求するものである。則ち、本出願は、provisional patent application serial no. 60/712,114(2005年08月29日出願、この参照により本開示に含まれる)の優先権を請求する。
【背景技術】
【0003】
1型糖尿病は自己免疫疾患であり、膵島中のインスリン産生β細胞が、免疫介在性炎症で破壊されることによって起こる。1型糖尿病の具体的な病因機構は未知ではあるが、発症には活性化したT細胞およびマクロファージの関与があると考えられている。マクロファージは活性化すると、数種類の炎症性サイトカインを分泌し、例えば、インターロイキン 1β(IL-1β)、インターロイキン12(IL-12)、および腫瘍壊死因子α(TNF-α)が分泌され、さらには、インターフェロン-γ(IFN-γ)の活性化T細胞からの産生も誘発する(参照: Z. D. Yang, M. Chen, R. Wu, M. McDuffie, J. L. Nadler, Diabetologia, 2002, 45, 1307-1314)。こうしたサイトカインは、β細胞への細胞毒性を有し、且つ、β細胞の破壊に関与していると思われるTh1介在型炎症反応を増幅することが報告されている(参照: M. Chen, Z. D. Yang, R. Wu, J. L. Nadler, Endocrinology, 2002, 143(6), 2341-2348)。
【0004】
抗炎症化合物であるリソフィリン(LSF; 1-(5-R-ヒドロキシ-ヘキシル)-3,7-ジメチルキサンチン)は、インスリン分泌機能および細胞生存力を維持することで、β細胞をいろいろな炎症性サイトカイン介在型損傷から保護する能力を持っていることが明らかになっている。
【0005】
1型糖尿病の進行につれてのβ細胞の損傷を予防する上で、リソフィリンなどの薬剤は臨牀的に有用な可能性があるとされている。この仮説は、リソフィリンが、非肥満型糖尿病(NOD)マウスの特発性1型糖尿病の進行を大幅に抑えることができたという研究(文献Yangを参照)を拠り所としている。しかしながら、経口生体内利用ができずしかも力価が比較的小さいという欠点があるために、リソフィリンの臨牀的な開発には制限がかかってしまう可能性がある。LSFの構造を構造式Iに示した。
【0006】
現在、リソフィリン骨格に基づき、新規であり力価を持ち選択的であって、強化された力価と選択性と経口生体内利用率を持つような薬剤が求められている。本発明はその求めを充たすものである。
【発明の開示】
【0007】
本発明は、リソフィリン(LSF)の類縁体と、それらを調製するための合成方法とを提供する。これらの類縁体は、LSFよりも高い力価と経口生体内利用率を有しうる。これらの類縁体は、LSFの活性側鎖部分(5-R-ヒドロキシヘキシル基)を持つ。本発明は、LSFの誘導体をも含む。LSFは下記の構造式Iを有する。
【化1】

【0008】
本発明にかかる類縁体は、さまざまな窒素含有複素環化合物で置換することができ、もしくは、その側鎖が持つヒドロキシル基上に置換することも可能である。したがって本発明は、1位が置換された5-ヘキサノール化合物のヒドロキシル基上にさらに置換基がついたような化合物も提供する。この化合物は下記の構造式IIあるいはその薬学的に許容される塩を有する。
【化2】

なおここで、 R1 は、水素原子であるか、もしくは構造式 -C(=O)R3 を有する基である( R3は低級アルキル基である)。また、 R2 は、以下の
【化3】

から成る群から選択される。また、 n は1もしくは2である。
【0009】
別の実施形態においては、本発明は下記の構造式IIIを有する類縁体を提供し、
【化4】

ここで R4 のそれぞれは独立に、水素原子であるかもしくは -(CH2)m-OR1 であり、ここでR1 は、水素原子であるかもしくは構造式 -C(=O)R3を有する基である(ただし R4 のうちの少なくともひとつは水素原子では無い)。なおここで R3 は低級アルキル基、 m は2から約22までの範囲の整数である。
【0010】
別の実施形態においては、本発明は下記の構造式IVを有する類縁体を提供し、
【化5】

ここで R5 のそれぞれは独立に、水素原子であるかもしくは構造式 -(CH2)i-(CHOR1,)-(CH2)j-CH3を有する基である。なおここで、 R1 は水素原子であるかもしくは -C(=O)R3 を有する基である(R3 は低級アルキル基である)。また、 i は1から約20までの範囲の整数であり、 j は0から約20までの範囲の整数であって、ただし各 R5 基に関する i と j との和は2から約22まであり、且つ R5 基のうちの少なくともひとつは水素原子では無い。
【0011】
別の実施形態においては、本発明は、細胞生存力を保護する能力(特に膵臓β細胞を保護する能力)のあるLSF類縁体を提供する。したがって、本発明にかかる類縁体により、膵臓のインスリン分泌能が維持できるようになる。
【0012】
別の実施形態においては、本発明は、1型糖尿病の処置に有用なLSFの類縁体を提供する。別の実施形態においては、本発明は、1型糖尿病の進行を抑制できるLSFの類縁体を提供する。
【0013】
別の実施形態においては、本発明は、1型糖尿病の処置に有用なLSFの類縁体を提供する。別の実施形態においては、本発明は、身体がβ細胞を再生できるようにして1型糖尿病から恢復できるようにするLSFの類縁体を提供する。
【0014】
別の態様では、本発明は以下に挙げるものも提供する。
構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩、ならびに、薬学的に許容される担体もしくは添加剤とを含んだ薬学的組成物(この組成物は、そうした化合物もしくは塩の有効量を含むのが好ましい)。
1型糖尿病の処置方法もしくは予防方法であって、そうした処置を要する哺乳類(ヒトなど)へと、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩を投与すること、を含んだ方法。
細胞生存力の保護のための方法(特に膵臓β細胞を保護する能力)であって、細胞に(in vitroもしくはin vivoで)保護に有効な量の構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩を接触させること、を含んだ方法。
医療処置(1型糖尿病の処置など)に使用するための、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩。
哺乳類(ヒトなど)の1型糖尿病を処置するための医薬を調製するための、構造式II、構造式III、構造式IVの化合物、もしくはそれらの薬学的に許容される塩の使用方法。
【0015】
本発明にかかる類縁体は、炎症性自己免疫疾患の処置に有用である。こうした疾患の例としては、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病(非アルコール性脂肪肝炎(NASH))、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、アルツハイマー病などが含まれるがこれらに限定はされない。
【0016】
また、本発明は、本発明にかかる化合物の活性を検査する方法も提供する。開示されていない方法については、当業者に知られている。当業者は、本発明にかかる化合物から所望の効果が得られたかどうかを判定するために数多の手法を使用できる、ということを正しく理解できる。
【0017】
また、本発明は、本発明にかかる化合物を投与するためのキットも提供する。
【0018】
また、本発明は、構造式II、構造式III、もしくは構造式IVの類縁体を調製する上で有用な、本明細書で開示される新規な中間生成物および過程をも提供する。こうした中間生成物および過程としては、総括的な中間生成物および具体的な中間生成物が含まれ、さらには本明細書中の図表と実施例で開示された合成過程も含まれる。
【図面の簡単な説明】
【0019】
【図1】本発明にかかる化合物の具体例を示してある。
【図2】化合物 CPW11 を調製する反応式を示してある。
【図3A】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3B】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3C】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図3D】2,3-ジヒドロ-フタラジン-1,4-ジオンを使って、 R2 基を持つ類縁体を調製する反応式を示してある。
【図4】2,3-ジヒドロ-ピリダジノ[4,5-d]ピリダジン-1,4-ジオンおよび関連する類縁体を調製する反応式を示してある。
【図5A】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5B】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5C】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5D】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5E】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5F】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5G】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5H】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5I】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5J】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5K】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5L】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5M】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5N】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5O】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図5P】LSFと本発明で付加された類縁体が持つβ細胞保護作用を、マウス由来β-TC6細胞およびマウス膵島細胞について示したものである。
【図6】マウス膵島細胞からのインスリン放出を示している。
【図7A】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7B】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7C】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図7D】マウス膵島細胞からのインスリン放出を示している。図7Aは、基底刺激インスリン放出を示す。図7Bは、グルコース刺激したときのインスリン放出を示す。図7CはATP濃度を示し、また図7Dはβ細胞の生存度を示す。
【図8A】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図8B】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図8C】本発明にかかる類縁体の、β細胞からのインスリン放出を刺激する能力を示すものである。
【図9A】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9B】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9C】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9D】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9E】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9F】、LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9G】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9H】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9I】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9J】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9K】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9L】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9M】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9N】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9O】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図9P】LSFおよび特別な類縁体の、マウス由来β-TC6細胞のインスリン放出を促す能力を示すものである。
【図10】本発明にかかる化合物(類縁体)の、マウス脾細胞中のSTAT4燐酸化を低減する能力を示すものである(immunodot-ブロット)。
【発明を実施するための最良の形態】
【0020】
〔略語〕
特に他に定めない限りは、本明細書中で用いる術語と科学用語のすべては、本発明の属する技術分野の当業者が常識として理解している意味と、同じ意味を有する。本明細書に開示した方法および物質と類似するかもしくは等しい方法および物質のすべてを、本発明の実施と試験に使うことが可能ではあるのだが、本明細書には好ましい方法および物質について記載してある。
【0021】
本発明を記載し請求するにあたり、下記の術語を後述する定義に従って使用してゆく。
【0022】
本発明を説明する上で、本明細書中の冠詞 "a" および "an" は、その冠詞が文法的にかかる対象語が、ひとつ以上(即ち、少なくともひとつ)であるということを意味する。あくまで例として、「或る要素」("an element")とは、ひとつ以上の要素という意味である。
【0023】
病気もしくは障碍が「軽減」("alleviated")されるのは、そうした病気、症状、もしくは障碍の症候の重篤度が低減される場合か、あるいは、こういった症候が被験者に顕われる頻度が低減される場合か、あるいはその両方かの場合である。
【0024】
本明細書では、化学物質の「類縁体(アナログ)」("analog")とは、例示すれば類似している別の構造を持つが必ずしも異性体ではないような化合物、のことである(例えば、5-フルオロウラシルはチミンの類縁体である)。
【0025】
「対照」("control")の細胞、組織、試料、もしくは被験者は、供試する細胞、組織、試料、もしくは被験者と同じ型のものである。こうした対照を試験するにあたっては、例えば、供試する細胞、組織、試料、もしくは被験者を試験するのと精確に同じ時刻もしくはほぼ同じ時刻に行うようにすることができる。また、こうした対照の試験を、例えば、供試する細胞、組織、試料、もしくは被験者を試験する時刻から或る時間だけ離れた時刻に行うようにしてもよい。また、対照の試験結果を記録しておいて、供試する細胞、組織、試料、もしくは被験者で得られた試験結果と比較してもよい。また、試験を行う目的とする疾病もしくは障碍を有する疑いのある被験者から供試試料を得ているような場合には、対照を、供試群もしくは供試被験者以外の別の源もしくは類似する源から得てくるようにしてもよい。
【0026】
「供試」("test")の細胞、組織、試料、もしくは被験者とは、試験もしくは処置する対象となるもののことである。
【0027】
「病徴」("pathoindicative")を呈する細胞、組織、もしくは試料とは、それらが存在する場合に、そうした細胞、組織、もしくは試料を裡に持つ動物(あるいは、そうした組織を得る元になった動物)が、疾病もしくは障碍に冒された徴候となるもののことである。
【0028】
組織が、疾病もしくは障碍に冒されていない動物中の組織内にひとつ以上の細胞を有する場合、このことを組織が細胞を「正常に含む」("normally comprises")と称する。
【0029】
「化合物」という語と「類縁体」という語は、本明細書では同義である。本明細書では、これらの語は、普通は薬品であると見做されるか、あるいは、本発明にかかる、薬品、併用剤、およびそれらの混合物、さらにはポリペプチドおよび抗体として使用される候補であるような、任意の型の物質もしくは剤のことを指す。
【0030】
本明細書では、化合物の「誘導体」("derivative")とは、類似する構造を持つ別の化合物からひとつ以上の過程を経てつくられる化合物のことを指し、そうした過程としては例えば、水素原子を、アルキル基、アシル基、もしくはアミノ基で置換することがある。
【0031】
本明細書では、「有効量」("effective amount")とは、選択した効果が得られる上で充分な量のことを指す。
【0032】
「検出」("detect")という語およびその文法的派生語を使用しているときには、定量的ではなく化学種を評定することを意図しており、一方、「定量する」("determine")もしくは「測る」("measure")という語およびそれらの文法的派生語を使っているときには、定量的に化学種を測定していることを意味している。「検出」という語と「同定」("identify")という語は、本明細書では同義である。
【0033】
本明細書では、「疾病」("disease")とは、生体恒常性を保てなくなった動物の健康状態のことであり、そうした疾病が改善されなければ、動物の健康は悪化してゆくことになる。
【0034】
対照的に、本明細書では、動物の「障碍」("disorder")とは、動物が生体恒常性は維持できるが、そうした障碍が無かったとしたときに較べて、動物の健康状態は不都合なものになっているような状態を指す。処置しないままに放置したとしても、障碍は、必ずしも動物の健康状態をさらに悪化させるとは限らない。
【0035】
本明細書では、「官能性(機能性)」("functional")の類縁体もしくは分子とは、特徴的な性質もしくは活性を呈する形状の分子のことである。
【0036】
本明細書では、「阻害」("inhibit")という語は、記載した機能を、本発明にかかる化合物が低減もしくは遅延させる能力のことを指す。阻害は、10%以上であるのが好ましく、25%以上であるのがさらに好ましく、50%以上であるのがより一層好ましく、機能を75%以上阻害するのがもっとも好ましい。
【0037】
本明細書では、「(ひとつもしくは複数の)説明書」("instructional material(s)")とは、そうした説明書が含まれるキット内の本発明にかかる類縁体の有用性を伝え、本明細書中で述べた種々の疾病もしくは障碍を軽減する作用を発揮させるために使用できるような、出版物、記録、図解、もしくは他の任意の表現媒体、を含む。そういった説明書には、哺乳類の細胞または組織における疾病もしくは障碍を軽減する、ひとつもしくは複数の方法についての記載を付け加えてもよいし、あるいはそうした記載を上述したものに代えて有してもよい。本発明にかかるキット内の説明書は例えば、同定した化合物発明を含有する容器に添付してもよいし、あるいは、同定した化合物を含有する容器と併せて出荷してもよい。別の手法として、受納者は説明書と本発明にかかる化合物とを組み合わせて使うよう促す注意書きを添えつつ、説明書をそうした容器とは分けて出荷するようにしてもよい。
【0038】
本明細書では、「精製した」("purified")という語およびその類語は、或る分子もしくは化合物の比率を、天然環境下でその分子もしくは化合物が存在する場合に通常付随している他の成分に較べて高めること、に関するものである。「精製した」という語は、過程中に特定の分子が完全に純粋であるということを、必ずしも意味しない。本明細書では、「高純度に精製した」("highly purified")化合物とは、90%よりも高い純度を持つ化合物のことを指す。
【0039】
本明細書では、「薬学的に許容される担体」("pharmaceutically acceptable carrier")という語は、任意の標準的な薬学的担体を含み、例えば、燐酸緩衝生理食塩水、水、乳濁液(油/水乳濁液もしくは水/油乳濁液など)、ならびに、種々の保湿剤が含まれる。また、この語には、監督官庁たる米国連邦政府に認可された全ての薬剤、もしくは米国薬局方(US Pharmacopeia)にヒトを含む動物へ使用できる薬剤として記載された全ての薬剤を含む。これらの担体および他の薬学的に許容される担体の例については、 Remington's Pharmaceutical Sciences (1991, Mack Publication Co., New Jersey) に記載されている。
【0040】
本明細書では「試料」("sample")とは、好ましくは被験者から採取した生物学的試料を指し、正常組織試料(normal tissue samples)、患部組織試料(diseased tissue samples)、生検試料、血液、唾液、排泄物、精液、涙液、および、尿が含まれるが、これらに限られるわけではない。試料はまた、特定の細胞、組織、もしくは関連する体液を含む、被験者から得られる物質についての、任意の他の源であってもよい。試料は、細胞培養もしくは組織培養からも得ることができる。
【0041】
本明細書では「標準」("standard")とは、比較をするために用いるものを指す。標準は例えば、投与されたかもしくは対照試料に添加された既知の標準物質または既知の標準化合物であって、その化合物を供試試料中で測定したときの結果と比較するために用いるものであってもよい。また、標準とは、「内部標準」("internal standard")のことを指すものであってもよく、これの既知量を例えば、目的物質の標識(マーカー)を測定しようとするに先立ち試料に加えることで、試料の処理をする際かまたは精製過程もしくは抽出過程にかける際に、純度または収率を計測するように使える。
【0042】
分析、診断、もしくは処置の「被験者」("subject")は動物である。こうした動物としては哺乳類が含まれ、好ましくはヒトである。
【0043】
本明細書では、「処置する」("treating")もしくは「処置」("treatment")という語は、特定の障碍もしくは症状の予防、または、特定の障碍もしくは症状状態に伴う症状の軽減、および/または、前記症状を予防するかもしくは除去すること、を含む。
【0044】
本明細書では、「予防としての」("prophylactic")処置とは、症候を呈していないかもしくは疾病の早期兆候のみしか示していない被験者に、そうした疾病に因る症状が重くならないようにする目的で施す処置である。
【0045】
本明細書では、「治療上の」("therapeutic")処置とは、病徴を呈している被験者へ、そうした病徴を軽減するかもしくは除去する目的で施す処置である。
【0046】
本明細書では、化合物もしくは類縁体の「治療上有効量」("therapeutically effective amount")とは、その化合物が投与される被験者に対して有益な効果を示す上で充分な化合物の量である。
【0047】
〔化学的定義〕
本明細書では、「ハロゲン」("halogen")もしくは「ハロ」("halo")という語には、ブロモ、クロロ、フルオロ、およびヨードが含まれる。本明細書では、「ハロアルキル(基)」("haloalkyl")という語は、ひとつ以上のハログン置換基を具えたアルキル基のことを指し、例えば、クロロメチル基、フルオロエチル基、もしくはトリフルオロメチル基などである。
【0048】
「低級アルキル(基)」("lower alkyl")という語は、一個から六個の範囲で炭素原子を有するアルキル基を指す。C1-C6アルキル基の典型例としては、メチル基、エチル基、n-プロピル基、イソプロピル基、ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基などが含まれるが、それらに限定はされない。
【0049】
本発明にかかる化合物には不斉中心が存在する場合があり、本発明にかかる化合物を任意に光学活性体およびラセミ体の形で単離できる、ということを当業者は正しく理解できる。いくつかの化合物は多形(polymorphism)となることがある。本発明には、本明細書に記載した有用な特性を有する、本発明にかかる化合物の任意のラセミ体、光学活性体、多形体、もしくは、立体異性体、またはそれらの混合物、が含まれることを理解されたい。また当該技術分野では、光学活性体の調製法(例えば、再結晶法によるラセミ体の光学分割、光学活性な出発物質からの合成、キラル合成、もしくは、キラル固定相を用いたクロマトグラフィーによる分離などによる)は公知である。さらには、cADPRアゴニストもしくはアンタゴニストの活性の測定を、本明細書に記載した標準的なテストを用いるか、もしくは当該技術分野において既知の他の同様のテストを用いることで行う手法についても公知である。
【0050】
本発明にかかる化合物は、互変異性体として存在する場合がある。本発明は、個々の互変異性体の混合物も包含し、且つそれぞれの互変異性体単体も包含する。例えば、下記の構造式
【化6】

は、下記の構造の混合物であると理解される。
【化7】

【0051】
「薬学的に許容される塩」("pharmaceutically-acceptable salt")という語は、本発明にかかる化合物の生物学的効果および特性を保持しており、且つ生物学的もしくは他の視座から見て望ましくないものでは無いような、塩のことを指す。多くの場合、本発明にかかる化合物からは、アミノ基および/もしくはカルボキシル基あるいはそれらの類似基を使って、酸性塩および/もしくは塩基性塩をつくりだすことが可能である。
【0052】
薬学的に許容される塩基付加塩は、無機塩基および有機塩基から調製できる。無機塩基からつくることができる塩としては、あくまで例として、ナトリウム塩、カリウム塩、リチウム塩、アンモニウム塩、カルシウム塩、およびマグネシウム塩が含まれる。有機塩基からつくることができる塩としては、一級アミン塩、二級アミン塩、および三級アミンが含まれ、例えば、アルキルアミン、ジアルキルアミン、トリアルキルアミン、置換アルキルアミン、ジ(置換アルキル)アミン、トリ(置換アルキル)アミン、アルケニルアミン、ジアルケニルアミン、トリアルケニルアミン、置換アルケニルアミン、ジ(置換アルケニル)アミン、トリ(置換アルケニル)アミン、シクロアルキルアミン、ジ(シクロアルキル)アミン、トリ(シクロアルキル)アミン、置換シクロアルキルアミン、二置換シクロアルキルアミン、三置換シクロアルキルアミン、シクロアルケニルアミン、ジ(シクロアルケニル)アミン、トリ(シクロアルケニル)アミン、置換シクロアルケニルアミン、二置換シクロアルケニルアミン、三置換シクロアルケニルアミン、アリールアミン、ジアリールアミン、トリアリールアミン、ヘテロアリールアミン、ジヘテロアリールアミン、トリヘテロアリールアミン、複素環アミン、二複素環アミン、三複素環アミン、ならびに、二箇所以上のアミンの置換基が異なっていて且つそれらの置換基がアルキル基、置換アルキル基、アルケニル基、置換アルケニル基、シクロアルキル基、置換シクロアルキル基、シクロアルケニル基、置換シクロアルケニル基、アリール基、ヘテロアリール基、複素環性置換基などからなる群から選択されるような、ジ-アミンとトリ-アミンの混合物、といったものの塩が含まれるが、これらに限定はされない。加えて、二個もしくは三個の置換基が、アミノ基の窒素原子と共に、複素環またはヘテロアリール基を形成しているようなアミンについても、こうした例として含まれる。適切なアミンの例としては、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリイソプロピルアミン、トリ(n-プロピル)アミン、エタノールアミン、2-ジメチルアミノエタノール、トロメタミン、リジン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン、コリン、ベタイン、エチレンジアミン、グルコサミン、N-アルキルグルカミン、テオブロミン、プリン類、ピペラジン、ピペリジン、モルフォリン、N-エチルピペリジンなどが含まれるが、これらに限定はされない。また、例えば、カルボキサミド、低級アルキルカルボキサミド、ジアルキルカルボキサミド、などを含むカルボン酸アミド類や、その他のカルボン酸誘導体も本発明の実施をするにあたっておそらく有用であろうことも理解されたい。
【0053】
薬学的に許容される酸付加塩は、無機酸および有機酸から調製できる。無機酸からつくる塩には、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、燐酸塩などが含まれる。有機酸からつくる塩には、酢酸塩、プロピオン酸塩、グリコール酸塩、ピルビン酸塩、蓚酸塩、林檎酸塩、マロン酸塩、琥珀酸塩、マレイン酸塩、フマル酸塩、酒石酸塩、枸櫞酸塩、安息香酸塩、桂皮酸塩、マンデル酸塩、メタンスルホン酸塩、エタンスルホン酸塩、p-トルエンスルホン酸塩、サリチル酸塩などが含まれる。
【0054】
薬学的に許容される塩を得るにあたっては、例えば、アミンなどの充分に塩基性である化合物を、生理学的に許容されるアニオンを与える適切な酸と反応させるなどの、当業者によって知られている通常の手法を用いることができる。アルカリ金属(ナトリウム、カリウム、もしくはリチウムなど)、またはアルカリ土類金属(カルシウムなど)とのカルボン酸塩も調製できる。
【0055】
別の実施形態においては、本発明は、本発明にかかる化合物を投与するかもしくは使用するためのキットも提供する。
【0056】
化合物が、充分に塩基性であるか酸性であって酸性塩もしくは塩基性塩をつくることができるような場合には、そうした化合物を塩として用いるのが適切なことがある。許容される塩の例としては、生理学的に許容されるアニオンをつくる酸から形成できる有機酸付加塩があり、こうした酸の例としては、トシル酸、メタンスルホン酸、酢酸、枸櫞酸、マロン酸、酒石酸、琥珀酸、安息香酸、アスコルビン酸、α-ケトグルタル酸、およびα-グリセロ燐酸などがある。また、適切な無機塩も形成でき、例えば、塩酸塩、硫酸塩、硝酸塩、炭酸水素塩、炭酸塩などを形成できる。
【0057】
基(ラジカル)、置換基、および範囲について以下に挙げてある具体的な好ましい値は、例示に過ぎない。これらは、他に定まる値や、基および置換基について定めた範囲内の別の値を排除するものでは無い。
【0058】
具体的には、(C1-C6)アルキル基は、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec-ブチル基、ペンチル基、3-ペンチル基、ヘキシル基などである。
【0059】
本発明にかかる化合物は、IUPAC命名法もしくはCAS命名法にだいたい基づいて命名してある。当業者に知られた略語を使用している場合もある(例えば、フェニル基を "Ph" 、メチル基を "Me" 、エチル基を "Et" 、時間を "h" 、室温を "rt" 、ラセミ混合物を "rac" と略すなど)。
【0060】
また本発明は、医療に使うための、構造式IIの化合物、構造式IIIの化合物、もしくは構造式IVの化合物も提供する。
【0061】
R3 は、水素原子、メチル基、エチル基、もしくはプロピル基であるのが好ましい。
【0062】
R3 は、メチル基もしくはエチル基であるのがより好ましい。
【0063】
R3 は、メチル基であるのがより好ましい。
【0064】
R3 は、水素原子であるのがより好ましい。
【0065】
R2 は、
【化8】

であるのが好ましい。
【0066】
或る特徴として、本発明にかかる好ましい類縁体は、下記の構造式
【化9】




か、それらの薬学的に許容される塩を有しうる。
【0067】
本発明にかかるより好ましい類縁体は、下記の構造式を有しうる。
【化10】

【0068】
本発明のさらなる実施形態として、構造式II、構造式III、もしくは構造式IVを持つ類縁体をつくる過程について、以下に述べる手法を以って説明してゆく。なお、総括的な基が意味するところは、特に他に定めない限りは、上述したものである。本発明にかかる、構造式IIを持つ類縁体をつくる概括的な反応式をScheme 1として以下に示す。
【化11】

【0069】
Scheme 2(図2)では、類縁体11 をつくる経路を示してある。本発明にかかる、構造式IIIもしくは構造式IVを持つ特別な類縁体のつくりかたは、図3Aから図3D、そして図4に示してある。
【0070】
構造式Iの化合物を薬学的組成物として処方し、哺乳類宿主(ヒト患者など)へと、選択した投与経路に沿った形態にして投与できる。そうした投与としては、経口投与や、または非経口的投与(静脈内、筋肉内、局所、もしくは皮下などを介したもの)がある。
【0071】
したがって、本発明にかかる化合物を、薬学的に許容される媒体(不活性な増量剤もしくは同化性可食担体など)と組み合わせて、(例えば経口で)全身へと投与できる。またこれらの剤を、ハードシェルゼラチンカプセルもしくはソフトシェルゼラチンカプセルに封入することもできるし、あるいは打錠することもできるし、あるいは患者の食餌に直接混ぜ込むことも可能である。経口治療投与にあたっては、活性化合物を、一種類もしくは複数種類の添加剤と組み合わせて、嚥下可能な錠剤、口内錠、トローチ、カプセル、エリキシル剤、懸濁液、シロップ、ウェハースなどといった形態として使用できる。こうした組成物および処方には、活性化合物を0.1%以上含めるべきである。組成物と剤型の比率は当然のことながら変更でき、所定の剤型単位の重量の約2%から約60%の範囲とするのが好ましい。治療上有用な組成物の活性化合物の量は、有効な用量が得られるようなものとする。
【0072】
こうした錠剤、トローチ、丸剤、カプセルなどには、以下に挙げるもののを含めることもできる。則ち、トラガカントゴム、アラビアゴム、コーンスターチ、もしくはゼラチンなどの結合剤;リン酸水素カルシウムなどのような賦形剤;コーンスターチ、ジャガイモ澱粉、アルギン酸などの崩壊剤;ステアリン酸マグネシウムなどの潤滑剤;スクロース、フルクトース、ラクトース、もしくはアスパルテームなどの甘味料、を含めることができる。さらに、ペパーミント、冬緑油、もしくはチェリーフレーバーなどの香料を加えてもよい。剤形単位(unit dosage)がカプセルである場合には、前述した類の物質に加えて、植物油もしくはポリエチエレングリコールのような液状担体を含めてもよい。その他さまざまな物質を、外被(コーティング)としてかもしくは別の手法により固体の剤形単位の物理的形状を改変するために使用してもよい。例えば、錠剤、丸薬、もしくはカプセルを、ゼラチン、ワックス、セラック(shellac)、もしくは糖などでコーティングしてもよい。シロップ剤もしくはエリキシル剤には、活性物質と、甘味剤としてスクロースもしくはフルクトースと、保存剤としてメチルパラベンおよびプロピルパラベンと、着色料と、香料としてチェリーフレーバーもしくはオレンジフレーバーと、を含めてもよい。当然のことながら、剤形単位の調合に用いられるいかなる物質も薬学的に許容され、用いられる量においては事実上毒性が無いものでなくてはならない。さらに、本発明にかかる活性化合物を、徐放性の処方および装置に組み入れてもよい。
【0073】
また、本発明にかかる活性化合物を、輸液もしくは注射によって、静脈内へもしくは腹腔内へと投与してもよい。活性化合物もしくはその塩の溶液は、水で調製でき、任意に非毒性界面活性剤を混ぜてもよい。また、グリセロール、液体ポリエチレングリコール、トリアセチン、およびこれらの混合物の中で分散剤をつくってもよいし、また油中でつくってもよい。通常の状況下で保管および使用する場合は、これらの製剤は、微生物の増殖を防ぐための保存料を含む。
【0074】
注射もしくは輸液に適した薬学的調剤には、滅菌水溶液もしくは分散液(懸濁液)、または、活性成分を含んだ滅菌粉末を含めることができる。こうした滅菌粉末は、滅菌済注射として、または滅菌済の輸液もしくは分散液として、即座に調製できるようにするために用いられ、また、任意にリポソーム内に包むこともできる。すべての場合において、最終的な剤型は、滅菌され、滑沢性とされ、製造および貯蔵の条件下で安定であるようにするべきである。このような分散液もしくは溶液は公知技術に従って処方でき、また、活性成分に加えて、分散剤、保湿剤、もしくは懸濁剤といった付加的な成分を含むこともできる。液状担体もしくは媒体としては、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、液体ポリエチレングリコール類など)、植物油、無毒性グリセリルエステル類、ならびにこれらの適切な混合物、を含むような溶媒もしくは分散液を使用できる。その他の許容される増量剤および溶媒としては、Ringer(リンゲル)溶液、等張塩化ナトリウム水溶液(生理食塩水)、ならびに不揮発性油(合成モノグリセリドもしくは合成ジグリセリドなど)、が含まれるがこれらに限定はされない。例えば、リポソームを用いた処方によって、もしくは分散液の場合に必要とする粒子径を維持することによって、もしくは界面活性剤の使用によって、適切な流動性を保つことができる。例えば、パラベン類、クロロブタノール、フェノール、ソルビン酸、チメロサールなどの、種々の抗真菌剤ならびに抗菌剤によって、微生物の活動を抑えることができる。多くの場合には、例えば糖類、緩衝物(バッファー)、もしくは塩化ナトリウムであるような等張化剤を含むことが好ましい。また、例えばモノステアリン酸アルミニウムおよびゼラチンであるような吸収遅延剤を用いることによって、注入可能な組成物の吸収を引き伸ばすことが可能である。
【0075】
滅菌溶液を調製するときには、上で列挙した種々の他の成分を(必要であれば)滅菌濾過してから加えた適切な溶液に、活性化合物の必要量を併せることによって、滅菌注射液を調製することができる。滅菌粉末を用いて滅菌注射液の調製を行う場合には、真空乾燥および凍結乾燥の技法を用いることで、活性成分の粉末に、予め滅菌濾過した溶液に含まれる所望の任意の添加成分を足したものが得られるようにするのが好ましい。滅菌溶液もしくは滅菌粉末を適切な担体と組み合わせて、注入による投与をすることができる。加えて、滅菌溶液もしくは滅菌粉末を、適切な担体および/もしくは推進剤と組み合わせて、吸入による投与をすることができる。
【0076】
局部への投与のために、本発明にかかる化合物を、純粋な形態(則ち液体)として与えることができる。しかしながら皮膚への投与においては、皮膚科学的に許容される担体(固体でもよいし液体でもよい)と組み合わせた組成物または処方として投与するのが一般的には望ましい。
【0077】
有用な固体担体としては、滑石(タルク)、粘土、セルロース微細結晶、シリカ、アルミナなどといった細粒状固体が含まれる。有用な液体担体には、水、アルコールもしくはグリコール類、または水-アルコール/グリコール混合液、が含まれ、これには本発明にかかる化合物の有効量を溶解するかもしくは分散することができ、また、任意に無毒性界面活性剤を添加することもできる。香料などの佐剤、および付加的な抗微生物剤を、所定の使用方法のための特質を最大限にするために添加できる。得られる液体組成物は、包帯および他の手当用品に含浸させて吸収性パッドから投与することができ、あるいは、ポンプ型スプレーもしくはエアロゾルスプレーを用いて、患部に噴霧して投与することもできる。
【0078】
合成ポリマー、脂肪酸、脂肪酸塩および脂肪酸エステル、脂肪アルコール、修飾セルロース、または修飾無機物質などの増粘剤を液状担体として使用することで、使用者の皮膚に直接塗布するための、薄く塗り拡げることができるようなペースト、ゲル、軟膏、石鹸、などといったものを形成することもできる。
【0079】
構造式IIの化合物の有用な用量は、in vitro活性と、動物モデルでのin vivo活性とを比較することで定量できる。マウスおよび他の動物での有効量をヒトへと外挿する手法は当該技術分野において公知であり、例えば、U.S. Pat. No. 4,938,949を参照のこと。
【0080】
構造式IIの(一種もしくは複数種の)化合物を溶液や懸濁液などの液状組成物にする場合の濃度は、一般的には約0.1 wt%から25 wt%とし、好ましくは約0.5 wt%から10 wt% とする。ゲルもしくは粉末のような半固体または固体の組成物にした場合の濃度は、約0.1 wt%から5 wt%とし、好ましくは約0.5 wt%から2.5 wt%とする。
【0081】
本発明にかかる化合物またはその活性塩もしくは誘導体の、処置に使用する上で必要な量は、選択した特定の塩に依存するだけでは無く、投与経路、ならびに、患者の処置しようとする症状の性質および年齢および体調にも依存して調整できるものであるが、最終的にはかかりつけの医師もしくは臨床医の裁量で決めることになる。
【0082】
しかしながら一般的に、適切な投与量は、体重に対して約0.5 mg/kgから約20 mg/kgの範囲と考えられ、例えば、体重に対して一日あたり約1 mg/kgから約18 mg/kgの範囲、則ち患者の体重キログラムに対して一日あたり3 mgから約16 mgの範囲、好ましくは6 mg/kg/dayから14 mg/kg/dayの範囲、最も好ましくは9 mg/kg/dayから11 mg/kg/dayの範囲とする。
【0083】
化合物は剤型単位で投与されることが好ましく、例えば、剤型単位あたりに、活性成分が5 mgから1000 mg、好ましくは10 mgから750 mg、最も好ましくは50 mgから500 mgの範囲で含まれる。
【0084】
理想的には、活性成分は、活性成分の血漿中濃度のピークが約0.5 μMから約75 μMの範囲となるように投与されるべきであり、好ましくは約1 μMから50 μMの範囲、最も好ましくは約2 μMから約30 μMの範囲である。こういったことの実施にあたっては、例えば活性成分の0.05%〜5%溶液に、任意に生理食塩水を加えたものを、静脈注射によって投与してもよいし、あるいは、約1 mgから100 mgの活性成分を含んだボーラス(巨丸薬; bolus)として経口投与してもよい。また、約0.01 mg/kg/hrから5.0 mg/kg/hrの(一種もしくは複数種の)活性成分を与える継続的な注入によってか、あるいは、約0.4 mg/kgから15 mg/kgの(一種もしくは複数種の)活性成分を含む間歇的な注射によって、望ましい血中濃度を維持することができる。
【0085】
望ましい投与量を与える際には、単独の投与を行うか、または、例えば一日につき二回、三回、もしくは四回以上の投与となるように適切な間隔をとった分割投与を行うことが好ましい。分割された投与をさらに分割することもでき、例えば、気腹装置からの複数回の吸入、もしくは複数の錠剤の投与といった、多数の不均一な間隔をとった投与とすることもできる。
【0086】
本明細書に記載の方法群のいずれかを用いて同定される化合物を、被験者に処方し投与することで、本明細書に記載の疾病および障碍のいずれかの処置を行うことが可能である。しかしながら、本発明にかかる化合物の使用先が、本明細書に記載の疾病および障碍のみであるとは解釈されぬよう願いたい。こうした被験者は、ヒトであるのが好ましい。
【0087】
本明細書に記載の薬学的組成物の処方は、薬理学分野で既知である手法か今後開発される手法のいずれかを用いて調製できる。一般的に云って、こうした調製方法としては、活性成分を、担体または一種もしくは複数種の他の補助成分と併せてから、(必要であるかもしくは希望であれば)所望の単独剤型単位もしくは複数剤型単位へと成形するかまたは包装して製品を作成するという工程、が含まれる。
【0088】
本明細書にて述べた薬学的組成物の記載は、主として、ヒトへの医療上の投与に適する薬学的組成物を指向してはいるが、熟達した技術者には、こうした組成物は大概にして、あらゆる種類の動物への投与にも適するということが理解できる。
【0089】
ヒトへの投与に適した薬学的組成物を、種々の動物への投与に適したものとなるように改変する行為については公知であって、通常の知識を有する獣薬理学者は、こうした改変の設計および実施を(必要ならば通常の実験を用いて)することができる。本発明にかかる薬学的組成物の投与が想定される被験者としては、ヒトおよび他の霊長類ならびに哺乳類が含まれるがそれらに限定はされない。こうした哺乳類としては、ウシ、ブタ、ウマ、ヒツジ、ネコ、およびイヌなどの市販の適当な哺乳類が含まれる。
【0090】
本発明にかかる薬学的組成物は、バルクか、単独剤型単位か、もしくは複数の単独剤型単位として、調製するかまたは包装するかまたは販売できる。本明細書では、「剤型単位」("unit dose")とは、所定量の活性成分を含んだ薬学的組成物の個別の量のことを指す。活性成分の量は、被験者へ投与されうる活性成分の用量とほぼ等しいか、あるいはそうした用量の適切な分割分(用量の半分もしくは三分の一など)とほぼ等しい。
【0091】
本発明にかかる薬学的組成物中の、活性成分と、薬学的に許容される担体と、その他の付加的な成分の相対量については、処置を受ける被験者の素性、体格、および体調に沿って変更可能であり、さらには組成物を投与しようとする経路に応じても変更できる。一例として、組成物は0.1%から100% (w/w) の範囲で活性成分を含むことができる。
【0092】
活性成分に加えて、本発明にかかる薬学的組成物には、一種もしくは複数種の付加的な薬学的活性薬剤を含めてもよい。特に想定される付加的な薬剤としては、制吐剤ならびに捕捉剤(シアン化物捕捉剤およびシアナート捕捉剤など)が含まれる。
【0093】
本発明にかかる薬学的組成物の制御放出処方もしくは徐放処方を、従来技術を用いて作成できる。
【0094】
場合によっては、例えばヒドロプロピルメチルセルロース、他のポリマー母材、ゲル、隔膜、浸透性系、多層コーティング、微粒子、リポソーム、もしくはマイクロスフィア、または、望ましい放出特性を得るためのさまざまな割合でのこれらの組み合わせなどを活用することで、使おうとする剤型で、その剤型中の一種もしくは複数種の活性成分が徐放(コントロールリリース)されるように構成できる。当業者に知られた適切な徐放処方(本明細書に記載したものを含む)は、本発明にかかる薬学的組成物と併用する目的で容易に選択できる。したがって、徐放目的に使われる、経口投与に適する単独の剤型単位(錠剤、カプセル、ジェルカプ(gelcaps)、およびカプレット(caplets)など)についても、本発明に包摂される。
【0095】
多くの徐放処方の設計に際しては、所望の治療効果が迅速に得られる薬剤の量を最初に放出し、それから、長時間に亘り、この治療効果のレベルを維持するように、薬剤の他の量を徐ろに継続して放出するようにする。身体中の薬剤を定常量に保つためには、その薬剤を剤型から、身体が代謝し排出する薬物の量を補う速度で放出する必要がある。
【0096】
活性成分の徐放は、種々の誘導源を使って刺激でき、例えば、pH、温度、酵素、水、または、他の生理学的条件もしくは化合物を使って刺激できる。
【0097】
本発明にかかる薬学的調剤の粉末処方および粒状処方を、既知の手法により調製できる。こうした処方を、被験者に直接投与することもできるし、あるいは、錠剤などをつくるために使ってもよいし、あるいは、カプセルに詰めるために使ってもよいし、あるいは、その処方に水性媒体もしくは油性媒体を足すことで水性もしくは油性の懸濁液もしくは溶液をつくってもよい。こうした処方のそれぞれには、一種もしくは複数種の、分散剤(保湿剤)、懸濁剤、ならびに保存料をさらに含めてもよい。また、付加的な医薬品添加剤(賦形剤、ならびに、甘味料、香料、もしくは着色料など)をこうした処方へ加えてもよい。
【0098】
本発明にかかる薬学的組成物の、経口投与に適した処方を、個別の固体剤型単位として、調製・包装・販売が可能である。そうした固体剤型単位としては、錠剤、ハードカプセル、ソフトカプセル、包、トローチ、もしくは薬用錠剤(lozenge)(いずれも所定量の活性成分を含む)、といったものが含まれるが、これらに限定はされない。経口投与に適した他の処方としては、粉末処方もしくは粒状処方、水性懸濁液もしくは油性懸濁液、水性溶液もしくは油性溶液、ペースト、ゲル、歯磨き粉、含嗽剤、外被物(コーティング)、洗口液、または乳液、が含まれるがこれらに限定はされない。本明細書では、洗口液(oral rinse)という語と含嗽剤(mouthwash)という語は同義である。
【0099】
活性成分を含んだ錠剤は例えば、活性成分を(任意に一種もしくは複数種の付加的な成分を加えてから)圧縮するかまたは湿製して、つくることができる。適切な装置で、流動体(粉末状もしくは細粒状の構成など)である活性成分を、任意に一種もしくは複数種の結合剤、滑沢剤、賦形剤、界面活性剤、および分散剤と混ぜ合わせて、圧縮することで圧縮錠を作成できる。湿製錠(molded tablets)は、適切な装置で、活性成分と薬学的に許容される担体と得られるものに水分を与える量以上の液体との混合物を練り合わせることで作成できる。錠剤製造において使われる薬学的に許容される医薬品添加剤としては、不活性増量剤、整粒剤および崩壊剤、結合剤、ならびに滑沢剤、が含まれるがこれらに限定はされない。公知である分散剤としては、ジャガイモ澱粉、および澱粉グリコール酸ナトリウム(sodium starch glycollate)が含まれるがこれらに限定されない。公知の界面活性剤としては、ラウリル硫酸ナトリウムが含まれるがこれに限定はされない。公知の増量剤としては、炭酸カルシウム、炭酸ナトリウム、ラクトース、微細結晶セルロース、燐酸カルシウム、燐酸水素カルシウム、および燐酸ナトリウム、が含まれるがこれらに限定はされない。公知の整粒剤および崩壊剤としては、コーンスターチ、およびアルギン酸が含まれるがこれらに限定はされない。公知の結合剤としては、ゼラチン、アラビアゴム、未アルファ化トウモロコシ澱粉、ポリビニルピロリドン、およびヒドロキシプロピル-メチルセルロース、が含まれるがこれらに限定はされない。公知の滑沢剤としては、ステアリン酸マグネシウム、ステアリン酸、シリカ、および滑石(タルク)、が含まれるがこれらに限定はされない。
【0100】
錠剤には、外被をかけなくてもよく、あるいは、被験者の消化管内でゆっくりと崩壊してゆくようにすることで活性成分が徐ろに放出され吸収されるような既知の手法を使って外被をかけてもよい。一例として、モノステアリン酸グリセリルもしくはジステアリン酸グリセリルなどの物質を使って、錠剤を覆うことができる。さらなる例として、U.S. Patent No. 4,256,108、U.S. Patent No. 4,160,452、およびU.S. Patent No. 4,265,874に記載の手法を用いて錠剤を覆うことで、滲透圧による徐放錠剤をつくることができる。また、錠剤に、甘味料、香料、着色料、保存料、もしくはそれらの組み合わせを含めることにより、薬学的に洗練された口あたりのよい処方を得ることも可能である。
【0101】
活性成分を含んだハードカプセルは、生理学的に分解可能な組成物(ゼラチンなど)を使って作成できる。こうしたハードカプセルには、例えば不活性固体増量剤(炭酸カルシウム、燐酸カルシウム、もしくはカオリンなど)を含む付加的な成分を含めてもよい。
【0102】
活性成分を包含したソフトゼラチンカプセルは、生理学的に分解可能な組成物(ゼラチンなど)を使って作成できる。こうしたソフトカプセルには、水または油媒体(ピーナツ油、液体パラフィン、もしくはオリーブ油など)と混ぜた活性成分が含まれる。
【0103】
本発明にかかる薬学的組成物の、経口投与に適した液状処方を、液状の形態としてか、あるいは、使用前に水もしくは他の適切な媒体に溶かして再構成するよう企図された乾燥物の形態として、調製・包装・販売が可能である。
【0104】
注射可能な処方を、アンプルに封入した剤型単位やもしくは保存料を含めた複数回分の用量の入る容器に収めた剤型単位として、調製・包装・販売が可能である。非経口投与のための処方には、懸濁液、溶液、油性媒体もしくは水性媒体を用いた乳濁液、ペースト、ならびに、移植可能な徐放性処方もしくは生分解性処方、が含まれるがこれらに限定はされない。こういった処方には、懸濁剤、安定剤、もしくは分散剤を含むがこれらに限定されない付加的成分を、さらに一種類以上含めてもよい。非経口的投与用処方の或る実施形態においては、有効成分は乾いた状態(すなわち、粉末もしくは顆粒)で与えられ、非経口投与をする前に、適切な媒体(例えば、無菌であり発熱因子(パイロジェン)が含まれていない水)に溶かすことで、組成物を再構成できる。
【0105】
本発明にかかる薬学的組成物は、口内投与(buccal administration)に適した処方として、調製・包装・販売が可能である。こうした処方は、従来の手法を使って錠剤の形態もしくは薬用錠剤(lozenge)の形態として作成することができ、例えば、0.1% (w/w)から20% (w/w)の活性成分と、その残りとして経口で溶解もしくは崩壊する組成物(ならびに任意に本明細書で示した付加的な一種もしくは複数の成分)とを有するようにできる。そのほか、口内投与に適する処方としては、活性成分を含んだ粉末も含まれ、または、活性成分を含んだ溶液もしくは懸濁液をエアロゾル化した(噴霧した)ものも含まれる。こうした粉末化した処方、エアロゾル化した処方、およびエアロゾル化した処方は、分散させた際には、平均粒子径もしくは平均滴径が、約0.1ナノメートルから約200ナノメートルの範囲であるのが好ましい。また、こうした処方は、本明細書に記載した付加的な一種もしくは複数種の成分を含んでもよい。
【0106】
本明細書では、「付加的な成分」("additional ingredients")には、以下に挙げるもののうちの一種類以上が含まれるが、それらに限定はされない。則ち、賦形剤、界面活性剤、分散剤、不活性増量剤、整粒剤および崩壊剤、結合剤、滑沢剤、甘味料、香料、着色料、保存料、生理学的に分解する組成物(ゼラチンなど)、水性媒体(溶液)および油性媒体(溶液)、懸濁剤、分散剤もしくは保湿剤、乳化剤、粘滑剤、緩衝剤、塩、増粘剤、賦形剤、乳化剤、酸化防止剤、抗生物質、抗真菌剤、安定剤、ならびに、薬学的に許容される高分子もしくは疎水性の物質、である。Genaro, ed., 1985, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PAを参照せよ(この参照により本開示に含まれる)。
【0107】
本発明にかかる化合物を被験者へと投与するにあたっては、一日数度といった頻度で投与してもよく、あるいは、それよりも少ない頻度、即ち一日一度、一週一度、二週間に一度、一ヶ月に一度、またはさらに少なく数ヶ月に一度もしくは一年に一度もしくはそれよりも少ない頻度で投与してもよい。用量の頻度は、熟達した技術者には容易にわかるものであって、因子(処置する疾病の種類と重症度、型、ならびに被験者の年齢、などであるがこれらに限定はされない)のうちのいずれかに依存して決定できる。
【0108】
また本発明は、薬学的なパックもしくはキットも提供し、これには、本発明にかかる薬学的組成物のうちの一種もしくは複数種の成分を詰めた一個または複数個の容器が含まれる。或る実施形態においては、こうしたキットを提供して、免疫変調への処置を必要とする被験者を処置する。こうした被験者はヒトであるのが好ましい。或る実施形態においては、こうしたキットは、本発明にかかる一種類以上の特別な類縁体を含み、さらに一種類以上の既知の免疫抑制剤を含んでもよい。これらの調合薬を、さまざまな容器に詰めることができ、例えば、バイアル瓶、管、微量測定用wellプレート(マイクロタイターウェルプレート)、瓶、などに詰めることができる。また、陽性対照試料、陰性対照試料、緩衝液、細胞培地などの他の薬剤をキット中の別の容器に入れることもできる。キットには説明書を含めるのが好ましい。
【0109】
本明細書に記載の方法および物質と類似するかまたは等価である任意の方法および物質も、本発明の実施もしくは試験において使用可能であるが、本明細書では好ましい方法および物質について記載してある。
【0110】
本発明では、上述したようにかもしくは以降の実施例にて記載しているように、当業者に公知な従来技術である、臨牀技術、化学技術、細胞学技術、組織化学技術、生化学技術、分子生物学技術、微生物学技術、DNA組み換え技術法を使うこともできる。こうした技術については文献に詳しく説明されている。
【実施例】
【0111】
本発明を、以下の実施例および実施形態を参照しながら説明してゆく。当業者は、前述した記載および以降の実施例をもとに(さらなる記載を必要とすること無く)、本発明を作成し利用でき、且つ本発明にかかる方法を実施できる。したがって、後述の実施可能な実施例は、本発明のうちのいくつかの実施形態のみについて例示し指摘するために記載したものであって、本開示のそれ以外の部分をいかなる意味でも限定しようとするものでは無い。よって、これらの実施例は、本明細書での教示の結果の証左となりえる任意のすべての変形例を包摂すべきものである。
【0112】
〔実施例1: LSF類縁体〕
側鎖部分(5-R-ヒドロキシヘキシル基)を保っておいて、キサンチン類似骨格(5-アザ-7-デアザキサンチン-LSF)およびキサンチン非類似骨格を含む種々の窒素含有複素環化合物を調製して、そのヒドロキシヘキシル基と置換した。これらの複素環化合物のほとんどは市販されていたものである。5-アザ-7-デアザキサンチン(化合物10 および化合物 11 として示した)については、1,3,5-トリアジン誘導体である塩化シアヌルから合成した。J. D. Hepworth., Org. Synth., 5, 27-29; R. Calabretta, C. Giordano, C. Gallina, V. Morea, V. Consalvi and R. Scandurra., Eur. J. Med. Chem., 1995, 30, 931-941; S. Horrobin., J. Chem. Soc., 1963, 4130-4145; そして S. H. Kim, D. G. Bartholomew, and L. B. Allen., J. Med. Chem., 1978, 21(9), 883-888を参照のこと。LSF類縁体の合成の一般的な反応式は、Scheme 1として示してある。本発明にかかる化合物の具体例は、図1に示した。化合物11 (CPW11)の合成を、図2のScheme 2に示してある。
【0113】
〔実施例2: LSF類縁体の生物学的評価〕
本発明にかかる類縁体(CPW1からCPW15まで)を、膵臓β細胞株に用いて、炎症性サイトカインによる処理後のアポトーシス保護(OD450の減少を反映する)に関してと、インスリン放出に関して評価を行った(図5および図6)。β細胞の保護作用について述べると、いくつかの類縁体がLSFに比肩する力価を示し、また、特別な類縁体は低濃度(nM以下)で細胞を保護できた(図5)。インスリン放出アッセイでは、いくつかの化合物は、グルコースに反応してLSFと同様の効果を呈した(CPW1-15、図6)。
【0114】
本発明にかかるLSF類縁体のうちのいくつかを用い、MDSアッセイ、溶解性、生体的経口利用性、および安定性に関してさらに評価を行った(表1)。
【表1】

【0115】
50%よりも高い阻害率を有する類縁体を、高活性であると見做した。また、20%から49%までの範囲の阻害率を有する類縁体を、中間の活性を持つと見做した。また、20%未満の阻害率を有する類縁体を、低活性であると見做した。
【0116】
〔実施例3: ヒト膵島でのLSF類縁体の生物学的評価〕
四種の化合物(CPW7、CPW8、CPW11、およびCPW12)について、インスリン分泌、細胞内ATP濃度、および、サイトカイン(ヒトIL-1βとIFN-γとTNF-αの混合物)に曝露しての細胞死の低減効果、を誘導する能力に関してヒト膵島上で評価を行った。結果は図7Aから図7Dに示した。
【0117】
試験結果からは、CPW12が、マウス膵島細胞株で、β細胞の保護およびインスリン放出への正の作用を示したことがわかった。またこの類縁体CPW12は、シトクロムp450の阻害は少なめであった(薬剤相互作用をする可能性が低い安全な化合物であった)。Caco-2滲透性検査の結果からは、経口投与されたCPW12は胃腸管から吸収されうることがわかり、このことは生体経口利用度が良好であることと符合する。類縁体CPW12は、許容できる安定性と溶解性を示す。
【0118】
ヒト膵島での評価では、CPW12は、炎症性サイトカインの存在下でのインスリン分泌の改善への正の効果を呈し、且つ、ヒトβ細胞でのミトコンドリア機能とセル生存率の維持に対しても有効であった。
【0119】
〔実施例4: LSFと類縁体のβ細胞への作用〕
マウスのインスリン分泌性INS-1細胞株を用いて、LSF類縁体のβ細胞への作用を研究した。細胞をRPMI 1640培地(Life Technologies, Inc., Gaithersburg, MD)に入れ、10% 熱失活FBS、10 mM HEPES、200 μM L-グルタミン、1 mM ピルビン酸ナトリウム、5 nM 2-メルカプトエタノール、50 U/ml ペニシリン、および50 μg/ml ストレプトマイシンを加えてpH 7.4とした。細胞を、加湿培養器に5% 二酸化炭素を流して37℃で培養した。二日ごとに新鮮な培地に交換した。細胞の播種密度は105/cm2とした。培養容器はポリ-D-リジンおよびゼラチン(Sigma, St. Louis, MO)で覆い、剥離して死んだ細胞を逃さないようにして、播種した細胞数が、すべての処置条件の後に実際の細胞数に反映されるようにした。マウス組換え体IL-1β(5 ng/ml)、IFNγ(100 ng/ml)、およびTNFα(10 ng/ml; R&D Systems, Inc., Minneapolis, MN)を併せて完全RPMI培地に懸濁させたものを、INS-1細胞に与えて処置した。LSF(Cell Therapeutics, Inc., Seattle, WAから提供)および類縁体を、サイトカインと同時に、完全RPMI培地に加えた。すべての処置は18時間に亘って行った。
【0120】
図8aから図8cに示した結果からは、LSF類縁体が、サイトカインに起因する細胞死からβ細胞を保護できたことが示された。INS-1細胞は、組換え体IL-1βとIFNγとTNFαの混合物に、10-5 μMから103 μMのLSFとその類縁体を加えたもので処置をした。LSFの保護作用は、濃度10-2 μMで最大となった(図8a)。LSF濃度を10-2 μMから102 μMへと増加させても、β細胞保護作用がそれ以上に増すことは無かった。LSF類縁体は、β細胞への保護作用を多少示し、特に化合物CPW11(図8b)およびCPW12(図8c)は低濃度で良好に作用した。化合物CPW11と化合物CPW12はどちらも、濃度10-2 μMで、LSFと比肩する活性を示した。類縁体の濃度を高めても、β細胞保護作用がさらに増大することは無かった。
【0121】
〔実施例5: LSFおよび類縁体のインスリン分泌への作用〕
炎症性サイトカインのある場合とない場合についての、INS-1細胞のインスリン分泌への、LSF類縁体の作用。β細胞を、アポトーシス検出色素で2時間から3時間に亘って室温で処置した。顕微鏡で見ると、アポトーシス細胞は赤紫色であった。結合しなかった色素を洗い流して、色素乖離剤を加えた後に、色濃度をOD 450nMで読みとって定量した。処置の終了時に、細胞をKrebs-Ringer-bicarbonate-HEPES緩衝液(KRB; 内容: 134 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgSO4、1.0 mM CaCl2、10 mM HEPES、0.1% BSA; 37℃、pH 7.4)で洗った。細胞を同じ緩衝液中で30分間に亘り前培養してから、15 mM D-グルコースを加えたKRB中で60分間培養した(J. T. Baker, Phillipsburg, NJ)。上清を回収し、遠心して残存細胞を除去した。上清中に分泌されていたインスリンを、マウスインスリンを基準として用い、RIAで定量した。細胞は基底状態(3 mM)、およびグルコース刺激状態(28 mM)に保持した。インスリン放出を、20 μMのLSFおよびその類縁体を使って観察した。INS-1細胞のインスリン分泌は以下の通りである。 (a) LSF、 (b) 化合物(compound)CPW11、および (c) 化合物 CPW12(+C-G3 = w/compound, w/o cytokines, 3 mM glucose; -C-G3 = w/o compound, w/o cytokines, 3 mM glucose; +C-G28 = w/compound, w/o cytokine, 28 mM glucose; -C-G28 = w/compound, w/o cytokine, 28 mM glucose; +C+G3 = w/compound, w/cytokines, 3 mM glucose; -C+G3 = w/o compound, w/cytokines, 3 mM glucose; +C+G28 = w/compound, w/cytokines, 28 mM glucose; -C+G28 = w/o compound, w/cytokines, 28 mM glucose)。結果は図9aから図9cに示してある。
【0122】
〔実施例6: CPW12からのLSF類縁体の開発〕
CPW12に付加をした類縁体群についての反応式を示した(図3Aから図3DのScheme 3AからScheme 3D、図4のScheme 4を参照のこと)。図3Aから図3Dには、Scheme 3AからScheme 3Dとして、側鎖部分の改変について記してある(参考:V. Cere, C. Mazzini, C. Paolucci, S. Pollicino and A. Fava, J. Org. Chem., 1993, 58, 4567-4571; C. Paolucci, S. Pollicino and A. Fava, J. Org. Chem., 1995, 60, 169-175; F. Sato, Y. Tomuro, H. Ishikawa and M. Sato., Chem. Lett., 1980, 99-102; およびG. Cerichelli, C. Grande, L. Luchetti and G. Mancini, J. Org. Chem., 1991, 56, 3025-3030)。
【0123】
図4のScheme 4では、核となる部分(R2)の改変について記してある(参考:N. Haider, E. Mavrokordatou and A. Steinwender., Syn. Comm., 1999, 29(9), 1577-1584)。
【0124】
〔実施例7: マウスインスリン分泌性細胞株 β-TC6〕
◆ 細胞調製
β-TC6細胞株を、RPMI 1640培地(Life Technologies, Rockville, MD)に入れ、10% 熱失活ウシ胎児血清、10 mM HEPES、200 pM L-グルタミン、50 units/ml ペニシリン、および50 μg/ml ストレプトマイシンを加えてpH 7.4とする。細胞は、37℃の加湿培養器に5% 二酸化炭素を流して培養する。二日ごとに新鮮な培地に交換する。特に他に定めない限りは、細胞の播種密度は105/cm2である。実験に用いた細胞容器(ディッシュとチャンバースライド)は、ポリ-D-リジンおよびゼラチン(Sigma, St. Louis, MO)で覆い、剥離して死んだ細胞を逃さないようにして、播種した細胞数が、すべての処置条件の後に実際の細胞数に反映されるようにした。
【0125】
◆ サイトカインおよびLSF類縁体によるβ-TC6細胞の処置
β-TC6細胞を、媒体単独で処置するか、または、組換え体マウスIL-1β(5 ng/ml)とIFN-γ(100 ng/ml)とTNF-α(10 ng/ml)(R&D Systems, Minneapolis, MN)とを混合して完全RPMI培地に懸濁させたもので処置する。LSF(Cell Therapeutics, Inc., Seattle, WA)もしくはその類縁体を、サイトカインと同時に、完全RPMI培地に、濃度1 nMから20 pMの範囲で加える。すべての処置は18時間に亘って行う。結果は図8Aから図8Pに示した。
【0126】
〔実施例8: インスリンの静的分泌〕
処置の終了時に、細胞をKrebs-Ringer-bicarbonate-HEPES緩衝液(KRB; 内容: 134 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgSO4、1.0 mM CaCl2、10 mM HEPES、0.1% ウシ血清アルブミン; 37℃、pH 7.4)で洗った。細胞を同じ緩衝液中で30分間に亘り前培養してから、15 mM D-グルコースを加えたKRB中で60分間培養する(J. T. Baker, Phillipsburg, NJ)。上清を回収し、遠心して残存細胞を除去する。上清中に分泌されていたインスリンを、マウスインスリンを基準として用い、EIAで定量する。結果は図9Aから図9Pに示した。
【0127】
〔実施例9: STAT4燐酸化反応〕
マウス脾細胞を96-wellプレートに均等に播種して、LPS(1.0 ng/ml)を使う場合と使わない場合のそれぞれについて、LSFもしくは一連の類縁体を加えて、18時間処置する。蛋白質溶解物をHybond-P膜に転写し、続いて燐酸化STAT4に対するポリクローナル抗体でプローブする。ハイブリダイゼーションした膜を、ECLおよびオートラジオグラフィーにかける。試料は三回繰り返す。結果は図10に示してある。
【0128】
使用できると考えられるが本明細書に開示されていない他の方法についても周知であって、医療・化学・細胞学・組織化学・生化学・分子生物学・微生物学・DNA組み換え法の当業者の力の及ぶ範疇にある。
【0129】
本発明は、目標を達成して上述したような目的と利点を得ること、さらにはそうした目標に本来的に具わった目的と利点を得る上で有用である、ということを、当業者は容易に理解できる。本発明は、本発明の本質もしくは不可欠な属性から逸れること無く、他の特定の形態を実現できる。
【0130】
本明細書中で用いる略語は、化学分野内および生物学分野内で従来より使用されている意味を有している。本明細書で参照した公報、特許、および特許文献のすべては、この参照により個々の全体が本開示に含まれる。何らかの矛盾があった場合、本開示(および本開示に含まれる定義のすべて)が優先することになる。本発明を記載するに際しては、特定の具体的な好ましい実施形態および技法を参照して行っている。しかしながら、本発明の本質から逸れること無く、数多の変形例を構成できるということも理解されたい。
【特許請求の範囲】
【請求項1】
下記の構造式IIIを有する化合物あるいはその薬学的に許容される塩であって、
【化12】

ここで、 R4のそれぞれは独立に、水素原子であるかもしくは-(CH2)m-OR1であり、また、 R1 は水素原子であるかもしくは構造式-C(=O)R3 を有する基であり、また、 R3は低級アルキル基であり、 また、 m は2から約22までの整数であり、また、 R4 のうちの少なくともひとつは水素原子では無いことを特徴とする、化合物。
【請求項2】
下記の構造式IVを有する化合物あるいはその薬学的に許容される塩であって、
【化13】

ここで、 R5のそれぞれは独立に、水素原子であるかもしくは-(CH2)i-(CHOR1)-(CH2)j-CH3であり、また、 R1 は水素原子であるかもしくは構造式 -C(=O)R3を有する基であり、
また、R3 は低級アルキル基であり、 また、 i は1から約20の範囲の整数であり、また、j は0から約20の範囲の整数であり、また、各 R5基中の i と j との和が、2から約22の範囲であり、また、 R5 基のうちのひとつ以上が水素原子では無いことを特徴とする、化合物。
【請求項3】
R3のそれぞれが独立に、水素原子、メチル基、エチル基、もしくはプロピル基であることを特徴とする、請求項1もしくは2に記載の化合物。
【請求項4】
R3のそれぞれが独立に、水素原子、メチル基、もしくはエチル基であることを特徴とする、請求項3記載の化合物。
【請求項5】
R3のそれぞれが独立に、水素原子もしくはメチル基であることを特徴とする、請求項4記載の化合物。
【請求項6】
R3のそれぞれが、水素原子であることを特徴とする、請求項5記載の化合物。
【請求項7】
下記の構造式V又はVIを有する化合物あるいはその薬学的に許容される塩であって、
【化14】

ここで、R1が水素原子であるかもしくは構造式-C(=O)R2を有する基であり、また、 R2 が、低級アルキル基であり、また、 n が4,5,6,7,8,又は10であることを特徴とする、化合物。
【請求項8】
以下の構造式:
【化15】


を有する化合物、又はその薬学的に許容される塩である請求項7に記載の化合物。
【請求項9】
以下の構造式VII、VIII、IXを有する化合物あるいはその薬学的に許容される塩であって、
【化16】

ここで、式中の R1が、水素原子であるかもしくは構造式-C(=O)R3を有する基であり、また、 R3 が、低級アルキル基であり、また、 R2 が、下記の
【化17】

であり、また、 n が1もしくは2であることを特徴とする、化合物。
【請求項10】
以下の構造式:
【化18】

を有する化合物あるいはその薬学的に許容される塩である請求項9に記載の化合物。
【請求項11】
請求項1から10のいずれか一項に記載の化合物を、薬学的に許容される担体と組み合わせて含むことを特徴とする、薬学的組成物。
【請求項12】
医療に使うための、請求項1から10のいずれか一項に記載の化合物。
【請求項13】
請求項1から10のいずれか一項に記載の化合物の、哺乳類の病状または病態を予防するかもしくは処置する上で有効な医薬を調製するための使用方法であって、
前記病状もしくは前記病態が、炎症であるかもしくは自己免疫疾患症状であることを特徴とする、使用方法。
【請求項14】
前記医薬が、液体である担体を含むことを特徴とする、請求項13記載の使用方法。
【請求項15】
前記医薬が、固体である担体を含むことを特徴とする、請求項13記載の使用方法。
【請求項16】
前記病状または病態が、1型糖尿病、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、もしくはアルツハイマー病、であることを特徴とする、請求項13から15のいずれか一項に記載の使用方法。
【請求項17】
前記病状または病態が1型糖尿病であることを特徴とする、請求項16記載の使用方法。
【請求項1】
下記の構造式IIIを有する化合物あるいはその薬学的に許容される塩であって、
【化12】

ここで、 R4のそれぞれは独立に、水素原子であるかもしくは-(CH2)m-OR1であり、また、 R1 は水素原子であるかもしくは構造式-C(=O)R3 を有する基であり、また、 R3は低級アルキル基であり、 また、 m は2から約22までの整数であり、また、 R4 のうちの少なくともひとつは水素原子では無いことを特徴とする、化合物。
【請求項2】
下記の構造式IVを有する化合物あるいはその薬学的に許容される塩であって、
【化13】

ここで、 R5のそれぞれは独立に、水素原子であるかもしくは-(CH2)i-(CHOR1)-(CH2)j-CH3であり、また、 R1 は水素原子であるかもしくは構造式 -C(=O)R3を有する基であり、
また、R3 は低級アルキル基であり、 また、 i は1から約20の範囲の整数であり、また、j は0から約20の範囲の整数であり、また、各 R5基中の i と j との和が、2から約22の範囲であり、また、 R5 基のうちのひとつ以上が水素原子では無いことを特徴とする、化合物。
【請求項3】
R3のそれぞれが独立に、水素原子、メチル基、エチル基、もしくはプロピル基であることを特徴とする、請求項1もしくは2に記載の化合物。
【請求項4】
R3のそれぞれが独立に、水素原子、メチル基、もしくはエチル基であることを特徴とする、請求項3記載の化合物。
【請求項5】
R3のそれぞれが独立に、水素原子もしくはメチル基であることを特徴とする、請求項4記載の化合物。
【請求項6】
R3のそれぞれが、水素原子であることを特徴とする、請求項5記載の化合物。
【請求項7】
下記の構造式V又はVIを有する化合物あるいはその薬学的に許容される塩であって、
【化14】

ここで、R1が水素原子であるかもしくは構造式-C(=O)R2を有する基であり、また、 R2 が、低級アルキル基であり、また、 n が4,5,6,7,8,又は10であることを特徴とする、化合物。
【請求項8】
以下の構造式:
【化15】


を有する化合物、又はその薬学的に許容される塩である請求項7に記載の化合物。
【請求項9】
以下の構造式VII、VIII、IXを有する化合物あるいはその薬学的に許容される塩であって、
【化16】

ここで、式中の R1が、水素原子であるかもしくは構造式-C(=O)R3を有する基であり、また、 R3 が、低級アルキル基であり、また、 R2 が、下記の
【化17】

であり、また、 n が1もしくは2であることを特徴とする、化合物。
【請求項10】
以下の構造式:
【化18】

を有する化合物あるいはその薬学的に許容される塩である請求項9に記載の化合物。
【請求項11】
請求項1から10のいずれか一項に記載の化合物を、薬学的に許容される担体と組み合わせて含むことを特徴とする、薬学的組成物。
【請求項12】
医療に使うための、請求項1から10のいずれか一項に記載の化合物。
【請求項13】
請求項1から10のいずれか一項に記載の化合物の、哺乳類の病状または病態を予防するかもしくは処置する上で有効な医薬を調製するための使用方法であって、
前記病状もしくは前記病態が、炎症であるかもしくは自己免疫疾患症状であることを特徴とする、使用方法。
【請求項14】
前記医薬が、液体である担体を含むことを特徴とする、請求項13記載の使用方法。
【請求項15】
前記医薬が、固体である担体を含むことを特徴とする、請求項13記載の使用方法。
【請求項16】
前記病状または病態が、1型糖尿病、アテローム性動脈硬化症、2型糖尿病、内臓肥満に関係した疾病、多発性硬化症、腸炎、乾癬、リウマチ様関節炎、もしくはアルツハイマー病、であることを特徴とする、請求項13から15のいずれか一項に記載の使用方法。
【請求項17】
前記病状または病態が1型糖尿病であることを特徴とする、請求項16記載の使用方法。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図5H】


【図5I】


【図5J】


【図5K】


【図5L】


【図5M】


【図5N】


【図5O】


【図5P】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図8C】


【図9A】


【図9B】


【図9C】


【図9D】


【図9E】


【図9F】


【図9G】


【図9H】


【図9I】


【図9J】


【図9K】


【図9L】


【図9M】


【図9N】


【図9O】


【図9P】


【図10】




【図2】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図5H】


【図5I】


【図5J】


【図5K】


【図5L】


【図5M】


【図5N】


【図5O】


【図5P】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図8C】


【図9A】


【図9B】


【図9C】


【図9D】


【図9E】


【図9F】


【図9G】


【図9H】


【図9I】


【図9J】


【図9K】


【図9L】


【図9M】


【図9N】


【図9O】


【図9P】


【図10】


【公開番号】特開2012−229251(P2012−229251A)
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2012−157360(P2012−157360)
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2008−529208(P2008−529208)の分割
【原出願日】平成18年8月29日(2006.8.29)
【出願人】(501038296)ユニバーシティ オブ バージニア パテント ファンデーション (17)
【氏名又は名称原語表記】UNIVERSITY OF VIRGINIA PATENT FOUNDATION
【Fターム(参考)】
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2008−529208(P2008−529208)の分割
【原出願日】平成18年8月29日(2006.8.29)
【出願人】(501038296)ユニバーシティ オブ バージニア パテント ファンデーション (17)
【氏名又は名称原語表記】UNIVERSITY OF VIRGINIA PATENT FOUNDATION
【Fターム(参考)】
[ Back to top ]

