リチウムイオン二次電池用負極活物質およびその製造方法ならびにリチウムイオン二次電池
【課題】Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質、およびこの負極活物質の製造方法、ならびに負極活物質としてSnを含み充放電容量が大きくかつ一般的な用途に利用できるリチウムイオン二次電池を提供すること。
【解決手段】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法を、SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、で構成する。SnOをメカニカルミリング処理することによりSnとSnO2とが生じ、この生成物をさらに酸化処理することでSnO2量がさらに増大すると考えられる。SnとSnO2とはそれぞれ別々に負極活物質としてLiと可逆的に反応するため、充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能と考えられる。
【解決手段】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法を、SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、で構成する。SnOをメカニカルミリング処理することによりSnとSnO2とが生じ、この生成物をさらに酸化処理することでSnO2量がさらに増大すると考えられる。SnとSnO2とはそれぞれ別々に負極活物質としてLiと可逆的に反応するため、充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能と考えられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はスズを含みリチウムイオン二次電池に用いられる負極活物質およびその製造方法ならびにこの負極活物質を用いたリチウムイオン二次電池に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、小型で大容量であるため、携帯電話やノートパソコン等の二次電池として広く用いられている。近年では、電気自動車やハイブリッド自動車等のバッテリとしての用途も提案されている。
【0003】
リチウムイオン二次電池は、リチウム(Li)を挿入および脱離できる活物質を正極と負極とに持つ。リチウムイオン二次電池は、リチウムイオンの両極間の移動によって動作する。
【0004】
近年、リチウムイオン二次電池の初期容量を高めるために、負極活物質としてスズ(Sn)を含むものを用いることが提案されている。SnはLiと合金可能な元素であり、炭素材料に比べて理論容量が大きいため、リチウムイオン二次電池用の負極活物質として有用であると考えられている。すなわち、Snを含む負極活物質を用いることにより、炭素材料等を用いるよりも高容量のリチウムイオン二次電池を得ることができる。
【0005】
Snを含む一般的な負極活物質として、SnOが挙げられる。しかし近年、Liとのコンバージョン反応を生じ得るSnO2を負極活物質として用いる場合に、Liとの合金化反応を生じ得るSnを負極活物質として用いる場合に比べて、リチウムイオン二次電池をさらに高容量化できると考えられている(例えば、非特許文献1参照)。
【0006】
しかし、コンバージョン反応は一般に反応速度が遅いとされている。つまり、SnO2を負極活物質とし、コンバージョン反応を生じさせるためには、充放電速度を非常に遅くする必要があった。このためこのような負極活物質は、一般的な用途のリチウムイオン二次電池に適用し難い問題があった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】イアン・A.コートニーおよびJ.R.ダーン(Ian A.Courtney and J.R.Dahn)著、「エレクトロケミカルアンドインサイチュエックスレイディフラクションスタディーズオブザリアクションオブリチウムウイズティンオキサイドコンポジッツ(Electrochemical and In Situ X−ray Diffraction Studies of the Reaction of Lithium with Tin Oxide Composites)」、ジャーナルオブザエレクトロケミカルソサイエティ(Journal of The Electrochemical Society)、第144巻、第6号、1997年6月、p.2045−2052
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記の事情に鑑みてなされたものであり、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質、およびこの負極活物質の製造方法、ならびに負極活物質としてSnを含み充放電容量が大きくかつ一般的な用途に利用できるリチウムイオン二次電池を提供することを、解決すべき課題とする。
【課題を解決するための手段】
【0009】
上記課題を解決する本発明の負極活物質の製造方法は、スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法であって、
SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、を含むことを特徴とする。
【0010】
上記課題を解決する本発明の負極活物質は、スズ(Sn)を含むリチウムイオン二次電池用負極活物質であって、
SnとSnO2とを含み、
該SnO2に含まれるSn原子の量は、該負極活物質に含まれるSn原子全体を100原子%としたときに、50原子%を超えるSn原子をSnO2として含むことを特徴とする。
【0011】
また、上記課題を解決する本発明のリチウムイオン二次電池は、本発明の負極活物質を負極に含むことを特徴とする。
【発明の効果】
【0012】
以下、特に説明のない場合、本発明のリチウムイオン二次電池用負極活物質を本発明の負極活物質と略する。また、本発明のリチウムイオン二次電池用負極活物質の製造方法を本発明の製造方法と略する。
【0013】
本発明の製造方法によると、一般的な速度で充放電した場合にもリチウムイオン二次電池の充放電容量を増大できる負極活物質を製造できる。これは、メカニカルミリング処理により酸化第1スズすなわちSnOを微細化かつ不均化(2SnO→Sn+SnO2)させ、さらにメカニカルミリング処理後のスズ原料に含まれるSn、および、メカニカルミリング処理で処理しきれていないSnO(換言すると、残存するSnO)を酸化処理により酸化してSnO2を生成させることで、SnOからSnおよびSnO2の2相を生成できたことによると考えられる。ここで生成したSnおよびSnO2は、それぞれ別々にリチウムイオン二次電池用負極活物質として機能すると考えられる。また、SnおよびSnO2はLiと可逆的に反応すると考えられる。このため、このような負極活物質を用いれば、負極活物資としてSnOを用いる場合やSnのみを用いる場合に比べて、リチウムイオン二次電池を高容量化でき、かつ、反応速度もさほど低下しないと考えられる。よって、本発明の製造方法によると、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質を製造できる。
【0014】
また、本発明の負極活物質は、上述したように、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能である。以下、必要に応じてメカニカルミリング処理をMM処理と略する。
【図面の簡単な説明】
【0015】
【図1】スズ原料のSEM像である。
【図2】比較例2の負極活物質(スズ原料をメカニカルミリング処理したもの)のSEM像である。
【図3】実施例の負極活物質(スズ原料をメカニカルミリング処理および加熱処理したもの)のSEM像である。
【図4】実施例の負極活物質および比較例2の負極活物質のX線回折パターンである。
【図5】比較例1の負極活物質および比較例2の負極活物質の熱質量−示差熱分析結果である。
【図6】実施例および比較例1、2のリチウムイオン二次電池の1サイクル目の充放電曲線である。
【図7】実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果であり、具体的にはサイクル経過に伴う放電容量の変化を表すグラフである。
【図8】実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果であり、具体的にはサイクル経過に伴うクーロン効率の変化を表すグラフである。
【発明を実施するための形態】
【0016】
本発明の製造方法は第1工程と第2工程とを備える。
【0017】
第1工程は、SnOを主成分とするスズ原料をメカニカルミリング処理する工程である。ここで、メカニカルミリングとは、遊星ボールミル等を用いて機械的な力を加えることで、物質に化学反応を起こさせる(または化学反応を起こしやすくする)処理を指す。物質を微粒子状にでき、かつ、不均化反応による物質の表面改質等を生じさせ得る。
【0018】
上述したように、第1工程でスズ原料(SnO)をメカニカルミリング処理することで、2SnO→Sn+SnO2の不均化反応が生じ、Sn相と、SnO2相とが生成すると考えられる。このSn相はメカニカルミリング処理されたスズ原料(負極活物質前駆体)における芯部を構成すると考えられ、SnO2相は芯部を覆う被覆部を構成すると考えられる。スズ原料は、SnOのみからなっても良いし、SnやSnO2等のスズ含有物質を含んでも良いし、その他の不可避不純物を含んでも良い。
【0019】
第2工程は、上述した負極活物質前駆体を酸化処理する工程である。酸化処理は、既知の種々の方法を用いることができる。例えば、負極活物質前駆体に、酸素ガスやオゾンガス等の酸素元素含有ガスを高濃度で接触させても良い。或いは、負極活物質前駆体を、酸素元素存在下(例えば空気等の酸素元素含有雰囲気下)で加熱しても良い。負極活物質前駆体を酸素元素存在下で加熱する場合には、負極活物質前駆体を効率よくかつ安価に酸化できる利点がある。
【0020】
上述したように、負極活物質前駆体は芯部と被覆部とを持つ多層構造をなすと考えられる。第2工程においては、負極活物質前駆体を酸化することで、負極活物質前駆体の被覆部にSnO2を生成させる。メカニカルミリング処理で得られた被覆部には、SnO2(および、場合によっては未処理のSnO)が存在すると考えられる。第2工程においては、芯部に含まれるSnが酸化されてSnO2が生成する。または、被覆部に含まれるSnOが酸化してSnO2が生成する。このような反応によって、SnとSnO2とを含む負極活物質が得られる。なお、第2工程は、第1工程後に行っても良いし、第1工程と同時に行っても良い。何れの場合にも、メカニカルミリング処理されたスズ原料をさらに酸化することで、SnとSnO2とを含む負極活物質におけるSnO2含量を多くできる。
【0021】
ところで、SnOからなる従来の負極活物質において、SnOとLiとの反応は以下のように進行すると考えられている。
【0022】
SnO+2Li+2e→Li2O+Sn・・・(1)
Sn+4.4Li+4.4e←→Li4.4Sn・・・(2)
上記反応(1)は不可逆反応であり、反応(2)は可逆反応であるため、(1)で消費されたLi(Li2Oに含まれるLi)はリチウムイオン二次電池の充放電に関与しない。このためSnOを負極活物質とするリチウムイオン二次電池においては不可逆容量が生じる問題があった。なお、反応(2)は可逆反応であり、この反応によってリチウムイオン二次電池の充放電が可能になる。反応(2)は合金化反応と呼ばれる反応である。
【0023】
本発明の負極活物質は、上述したように、SnとSnO2とを含む。SnO2とLiとの反応は以下のように進行すると考えられている。
【0024】
SnO2+4Li+4e←→Sn+2Li2O・・・(3)
Sn+4.4Li+4.4e←→Li4.4Sn・・・(2)
上式のように、SnO2とLiとの反応には、不可逆反応がなく、可逆反応のみである。上式(3)の反応はコンバージョン反応と呼ばれる反応であり、上式(2)はSnOとLiとの反応と同様の合金化反応である。本発明の負極活物質においては、コンバージョン反応を利用することで、容量を大幅に増大させ得る。
【0025】
さらに、本発明の製造方法で得られた負極活物質にはSnO2だけでなくSnが含まれるが、このSnもまた上式(2)のようにLiと可逆的に反応するため、負極活物質として利用できる。つまり、本発明の製造方法で得られた負極活物質はSn元素を含む2種類の物質(つまり、SnおよびSnO2)を別々に負極活物質として利用でき、かつ、不可逆容量を生じないため、リチウムイオン二次電池を大容量にできる利点がある。参考までに、SnOからなる負極活物質の理論容量は875mAh/gであり、SnO2からなる負極活物質の理論容量は1494mAh/gである。
【0026】
なお、上述したように、コンバージョン反応は反応速度が遅いとされている。しかし、本発明の負極活物質においては、充放電の際にコンバージョン反応と合金化反応との2つの反応を用いているため、一般的なリチウムイオン二次電池の充放電速度と同様の速度で充放電しても、合金化反応のみの場合に比べて充放電容量を大きくできる。
【0027】
SnとSnO2とを含む負極活物質の形状は特に問わないが、粒子状であるのが好ましい。この粒子は一次粒子であっても良いし二次粒子であっても良いが、小径であるのが好ましい。例えば負極活物質粒子は平均粒径0.2μm〜5μmの範囲にあることが望ましい。平均粒径が5μmより大きいと、この負極活物質を用いたリチウムイオン二次電池の充放電特性が低下する場合がある。また、平均粒径が0.2μmより小さいと凝集して粗大な粒子となる場合があるため、同様に、この負極活物質を用いたリチウムイオン二次電池の充放電特性が低下する場合がある。なお、ここでいう平均粒径とは、レーザー光回折法による粒度分布測定における質量平均粒子径を指す。本発明の製造方法におけるスズ原料(SnO)の粒径もまた特に限定しないが、上記した粒径の負極活物質を製造するためには平均粒径10〜20μm程度であるのが好ましい。
【0028】
本発明の負極活物質はLiを含まないか、またはLiを多く含まない。このため、本発明の負極活物質を用いたリチウムイオン二次電池においては、正極活物質としてLiを含む材料を用いたり、負極活物質にLiをプリドープしたりする必要がある。負極活物質にLiをプリドープする場合、Liを一般的な方法でSn、SnOおよびSnO2の少なくとも一種にプリドープすれば良く、その方法は特に限定しない。例えば、Liのプリドープにあたって、Sn、SnOおよびSnO2の少なくとも一種をLiと接触させればよい。このとき、上記したSn、SnOおよびSnO2の少なくとも一種とLiとは、イオン、固体、液体、ガスの何れの状態で接触させても良い。さらにこのときLiは酸化物、塩化物等のLi含有化合物であっても良い。
【0029】
本発明の負極活物質を負極に含むリチウムイオン二次電池の構成を以下に説明する。負極は、上述した本発明の負極活物質以外の材料を含み得る。例えば、バインダー樹脂、導電助剤等の負極材料を構成する既知の材料を含み得る。
【0030】
バインダー樹脂は、負極活物質及び導電助剤を集電体に結着するための結着剤として用いられる。バインダー樹脂には、なるべく少ない量で負極活物質等を結着させることが求められる。バインダー樹脂の配合量は、負極活物質、導電助剤、及びバインダー樹脂の合計量を100質量%としたときに、0.5〜50質量%であるのが好ましい。バインダー樹脂量が0.5質量%未満では電極の成形性が低下し、50質量%を超えると電極のエネルギー密度が低くなる。バインダー樹脂の種類は限定的ではないが、ポリフッ化ビニリデン(PVDF)、ポリテトラフルオロエチレン(PTFE)等のフッ素系ポリマー、スチレンブタジエンゴム(SBR)等のゴム、ポリイミド等のイミド系ポリマー、アルコキシルシリル基含有樹脂、ポリアクリル酸、ポリメタクリル酸、ポリイタコン酸などが例示される。
【0031】
導電助剤は、電極の導電性を高めるために添加される。導電助剤として、炭素質微粒子であるカーボンブラック、黒鉛、アセチレンブラック(AB)、ケッチェンブラック(KB)、気相法炭素繊維(Vapor Grown Carbon Fiber:VGCF)等を単独でまたは二種以上組み合わせて添加することが出来る。導電助剤の使用量については、特に限定的ではないが、負極活物質100質量部に対して、1〜10質量部程度とすることができる。また、充放電に伴うSnの体積変化を考慮すると、Snの体積変化を緩衝し得る黒鉛を導電助剤として配合しても良い。負極は、これらの材料に有機溶剤を加えて混合しスラリーにしたものを、ロールコート法、ディップコート法、ドクターブレード法、スプレーコート法、カーテンコート法などの方法で集電体に塗布(積層)し、バインダー樹脂を硬化させることによって作製することができる。
【0032】
集電体としては、箔、板、メッシュ等の形状を採用することが出来るが、目的に応じた形状であれば特に限定されない。集電体として、例えば銅箔やアルミニウム箔等を好適に用いることができる。
【0033】
上記した負極を用いるリチウムイオン二次電池の負極以外の構成要素としては、特に限定されない公知の正極、電解液、セパレータを用いることが出来る。正極は、リチウムイオン二次電池で使用可能なものであれば良い。正極は、集電体と、集電体上に結着された正極活物質層とを有する。正極活物質層は、正極活物質と、バインダーとを含み、さらには導電助剤を含んでも良い。正極活物質、導電助材およびバインダーは、特に限定はなく、リチウムイオン二次電池で使用可能なものであれば良い。
【0034】
正極活物質としては、金属リチウム、LiCoO2、LiNi1/3Co1/3Mn1/3O2、Li2MnO2、Sなどが挙げられる。集電体は、アルミニウム、ニッケル、ステンレス鋼など、リチウムイオン二次電池の正極に一般的に使用されるものであれば良い。導電助剤は上記の負極で記載したものと同様のものを使用できる。
【0035】
電解液は、有機溶媒に電解質であるLi金属塩を溶解させたものである。電解液は、特に限定されない。有機溶媒として、非プロトン性有機溶媒、たとえばプロピレンカーボネート(PC)、エチレンカーボネート(EC)、ジメチルカーボネート(DMC)、ジエチルカーボネート(DEC)、エチルメチルカーボネート(EMC)等から選ばれる一種以上を用いることができる。また、溶解させる電解質としては、LiPF6、LiBF4、LiAsF6、LiI、LiClO4、LiCF3SO3等の有機溶媒に可溶なLi金属塩を用いることができる。
【0036】
例えば、エチレンカーボネート、ジメチルカーボネート、プロピレンカーボネート、ジメチルカーボネートなどの有機溶媒にLiClO4、LiPF6、LiBF4、LiCF3SO3等のLi金属塩を0.5mol/L〜1.7mol/L程度の濃度で溶解させた溶液を使用することが出来る。
【0037】
セパレータは、リチウムイオン二次電池に使用されることが出来るものであれば特に限定されない。セパレータは、正極と負極とを分離し電解液を保持するものであり、ポリエチレン、ポリプロピレン等の薄い微多孔膜を用いることができる。
【0038】
本発明の負極活物質を用いたリチウムイオン二次電池の形状には特に限定はなく、円筒型、積層型、コイン型等、種々の形状を採用することができる。いずれの形状を採る場合であっても、正極および負極にセパレータを挟装させ電極体とし、正極集電体および負極集電体から外部に通ずる正極端子および負極端子までの間を、集電用リード等を用いて接続した後、この電極体を電解液とともに電池ケースに密閉して電池となる。
【0039】
以下、実施例により本発明の製造方法および本発明の負極活物質を具体的に説明する。
【実施例】
【0040】
(実施例)
<負極活物質の製造方法>
スズ原料として、SnO粉末(株式会社高純度研究所社製)を準備した。このスズ原料をボールミル装置(ドイツ・フリッチュ社製、P−7)に投入し、空気中、室温、回転数450rpmで20時間メカニカルミリング処理した。
【0041】
次いで、メカニカルミリング処理後のスズ原料を、加熱炉にて空気中、400℃で3時間加熱した。このときの昇温速度は10℃/分であった。
【0042】
3時間加熱した後、熱処理したスズ原料を自然冷却して実施例の負極活物質を得た。
【0043】
<負極>
得られた負極活物質と、導電助剤としてのアセチレンブラック(AB)と、バインダー樹脂としてのポリアミック酸溶液(ポリイミド前駆体)とを混合し、スラリーを調製した。スラリー中の各成分の組成比は固形分として、負極活物質:AB:ポリイミドバインダー=85:5:10である。このスラリーを、厚さ20μmの電解銅箔(集電体)の表面にドクターブレードを用いて塗布し、銅箔上に負極活物質層を形成した。
【0044】
その後、80℃で20分間乾燥し、次いで200℃で20時間真空乾燥した。この工程により、負極活物質層から有機溶媒を揮発させて除去した。その後、直径15mmの円板状に打ち抜き、プレス機により、集電体と負極活物質層を強固に密着接合させた。これを200℃で20時間加熱硬化させて、活物質層の厚さが15μm程度の電極を形成した。
【0045】
<正極>
正極としては、直径15.5mmの円板状、厚さ500μmの金属Li箔を用いた。
【0046】
<電解液>
エチレンカーボネートと、エチルメチルカーボネートとを3:7(体積比)で混合し、混合溶媒を調製した。この混合溶媒に、LiPF6を1Mの濃度となるように溶解することで、非水電解液を調製した。
【0047】
<リチウムイオン二次電池>
上記の負極、正極および電解液を用いてコイン電池を製作した。詳しくは、ドライルーム内で、厚さ25μmのポリプロピレン微孔質膜からなるセパレータ(Celgard2400)と、厚さ500μmのガラス不織布フィルタと、を正極と負極との間に挟装して、電極体電池とした。この電極体電池を、ステンレス容器からなる電池ケース(CR2032型コイン電池用部材、宝泉株式会社製)に収容した。電池ケースには上記の電解液を注入した。電池ケースをカシメ機で密閉して、実施例のリチウムイオン二次電池を得た。
【0048】
(比較例1)
比較例1の負極活物質はSnである。このSnを負極活物質とし、実施例1と同じ方法で比較例1のリチウムイオン二次電池を製造した。
【0049】
(比較例2)
比較例2の負極活物質の製造方法は、スズ原料すなわちSnOにメカニカルミリング処理のみを施し加熱処理を施さなかったこと以外は実施例1の負極活物質の製造方法と同じである。比較例2の負極活物質は、メカニカルミリング処理されたスズ原料(すなわち負極活物質前駆体)である。比較例2の負極活物質を用い、実施例1と同じ方法で比較例2のリチウムイオン二次電池を製造した。
【0050】
<試験>
(SEMによる硫黄系正極活物質の分析)
スズ原料、実施例の負極活物質および比較例2の負極活物質を、走査型電子顕微鏡(SEM;Scanning Electron Microscope)により表面観察した。このときの加速電圧は20kVであり倍率は500倍と2000倍であった。スズ原料のSEM像を図1に示し、比較例2の負極活物質のSEM像を図2に示し、実施例の負極活物質のSEM像を図3に示す。
【0051】
図1〜図3に示すように、メカニカルミリング処理後の負極活物質つまり比較例2および実施例の負極活物質は、メカニカルミリング処理前の負極活物質つまりスズ原料に比べて小径である。具体的には、比較例2の負極活物質の平均粒径は1μm程度であり、実施例の負極活物質の平均粒径は2μm程度である。これに対して、スズ原料の平均粒径は15μm程度である。これは、スズ原料すなわちSnOがメカニカルミリング処理により微粉化されたためと考えられる。つまり、負極活物質の粒径により、スズ原料(SnO)がメカニカルミリング処理されているか否かを推測できる。スズ原料を原料とする負極活物質の平均粒径は0.2〜5μm程度であるのが好ましく、0.5〜2μm程度であるのがより好ましいと考えられる。平均粒径がこれらの範囲内にあれば、SnOが充分にメカニカルミリング処理されていると判断できる。なお、実施例の負極活物質の平均粒径が比較例2の負極活物質の平均粒径よりも大きいのは、メカニカルミリング処理後の加熱処理により、負極活物質が凝集したためだと考えられる。参考までに、本明細書においては、SEM像を基に10〜20個の負極活物質の粒子径を測定し、測定した粒子径の平均値を算出した。この平均値を負極活物質の平均粒径とした。
【0052】
(X線回折による硫黄系正極活物質の分析)
実施例の負極活物質および比較例2の負極活物質について、X線回折分析を行った。装置として粉末X線回折装置(リガク社製、MiniFlex)を用いた。測定条件は、CuKα線、電圧:30kV、電流:20mA、スキャン速度:2°/分、サンプリング:0.01°、積算回数:1回、回折角(2θ):5°〜80°であった。X線回折で得られた回折パターンを図4に示す。図4に示すように、実施例の負極活物質および比較例2の負極活物質には、Snのピーク(図中▲)、SnOのピーク(図中×)およびSnO2のピーク(図中○)が確認された。また、実施例の負極活物質において確認されたSnのピークは、比較例2の負極活物質で検出されたSnのピークに比べて、強度が低く数も少なかった。このことから、SnOをメカニカルミリング処理することでSnが生成することがわかる。また、実施例(酸化処理後)の負極活物質におけるSnのピークが、SnO2のピークに比べて相対的に小さくなっていることから、酸化処理によりSnの表面の酸化被膜が成長したことがわかる。つまりこの結果から、実施例の負極活物質はSnからなる芯部と芯部を覆う被覆部とで構成され、被覆部にはSnO2が含まれていることがわかる。
【0053】
(熱質量分析による硫黄系正極活物質の分析)
比較例1の負極活物質および比較例2の負極活物質の熱質量変化(TG)を測定した。測定装置としてはリガク製熱分析装置(Thermo Plus TG8120)を用いた。詳しくは、空気を300ml/分の流量で供給しつつ、各試料を室温から400℃まで10℃/分の昇温速度で加熱し、温度と質量変化との関係を測定することによって、熱質量−示差熱分析を行った。分析結果を図5に示す。図5に示すように、比較例2の負極活物質(つまり、SnOのメカニカルミリング処理品)は、比較例1の負極活物質(つまり単体Sn)に比べて質量変化が大きい。具体的には、比較例2の負極活物質の質量は、加熱前には23mgであり、室温から100℃まで加熱すると0.11mg減少し、その後、400℃まで加熱すると0.636mg増加した。つまり、SnOのメカニカルミリング処理品を加熱すると、100℃までの加熱で吸着水0.11mgが蒸発し、その後、0.636−(−0.11)=0.746mg質量増加した。
【0054】
Sn1モルは118.69gであり、SnO21モルは150.69gである。メカニカルミリング処理によるSnOの不均化反応は、2SnO→Sn+SnO2であると考えられる。このためSnOのメカニカルミリング処理品(加熱前)に含まれるSnの質量は、{118.69/(118.69+150.69)}×23≒10.134(mg)であると考えられる。
【0055】
SnOのメカニカルミリング処理品に含まれるSn全てがSnO2にまで酸化されたと仮定し、そのときに増加した質量をxとすると、O2/Sn=32/118.69=x/10.134であるため、x=2.732(mg)となる。上述した加熱で増加した質量全てがSnの酸化によると仮定すると、実際に生じた質量増加は0.746mgであったため、SnがSnO2に変化した割合は(0.746/2.7)×100=27.6%であった。
【0056】
上述したように、理論上、SnOに含まれるSn原子の50%がメカニカルミリング処理でSnO2になると考えられる。また、SnOのメカニカルミリング処理品に含まれるSnの27.6%が酸化処理によりSnO2に変化すると考えられる。このため、メカニカルミリング処理および加熱処理後の実施例の負極活物質にSnO2として含まれているSn原子は、この負極活物質全体に含まれているSn原子を100原子%とすると、(メカニカルミリング処理で生じた50原子%)+(酸化処理で生じた27.6原子%)=77.6原子%であると考えられる。
【0057】
なお、SnOのメカニカルミリング処理品は、酸化処理前の段階で、50原子%のSnO2を含むと考えられる。したがって、本発明の負極活物質は、負極活物質全体に含まれているSn原子を100原子%としたときに、50原子%を超えるSn原子をSnO2として含めば良い。なお、本発明の負極活物質は、負極活物質全体に含まれているSn原子を100原子%としたときに65原子%を超えるSn原子をSnO2として含むのが好ましく、70原子%を超えるSn原子をSnO2として含むのがより好ましく、75原子%を超えるSn原子をSnO2として含むのがさらに好ましい。本発明の負極活物質において、SnO2の大部分は、Snの表面に配置されると考えられる。つまり、本発明の負極活物質は、Snからなる芯部と、この芯部を覆いSnO2を含む被覆部と、を持つと考えられる。芯部はメカニカルミリング処理時に生成すると考えられ、被覆部の一部もまたメカニカルミリング処理時に生成すると考えられる。さらに、被覆部の他の一部は、芯部の一部が酸化処理によって酸化され、生成したSnO2で構成されると考えられる。
【0058】
ところで、Snを加熱酸化する場合、加熱温度が270℃以下であればSnOが生じ、280℃以上390℃未満であればSnOとSnO2との両方が生じ、390℃以上であればほぼSnO2のみが生じることが知られている(例えば、「金属酸化物と複合酸化物」、田部浩三 他 編、講談社、1978年、p134参照)。したがって、Snを充分に酸化させSnO2を生成させるためには、酸化工程における加熱温度は280℃以上であるのが好ましく、390℃以上であるのがより好ましいといえる。
【0059】
(電池特性の評価)
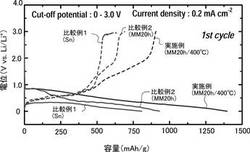
実施例および比較例1、2のリチウムイオン二次電池の充放電容量を測定した。詳しくは、各リチウムイオン二次電池に、負極活物質1cm2あたり0.2mAとなる電流密度、放電終止電圧0V、充電終止電圧3.0V、0.1Cで1サイクル目の充放電を行った。2サイクル目以降は、負極活物質1cm2あたり0.5mAとなる電流密度で充放電をおこなった。なお、2サイクル目以降の放電終止電圧、充電終止電圧およびCレートは1サイクル目と同じである。充放電は10サイクル繰り返した。評価試験(1サイクル目)の結果を表1に示す。実施例および比較例1、2のリチウムイオン二次電池の1サイクル目の充放電曲線を図6に示す。実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果を図7および図8に示す。なお、図7はサイクル経過に伴う放電容量の変化を表すグラフであり、図8はサイクル経過に伴うクーロン効率の変化を表すグラフである。
【0060】
【表1】

【0061】
表1および図6に示すように、実施例のリチウムイオン二次電池は、比較例1、2のリチウムイオン二次電池に比べて充放電容量が大きい。実施例のリチウムイオン二次電池の容量はSnOの理論容量875を超えている。このため、実施例の負極活物質においては比較例1、2では生じていないコンバージョン反応が生じていると考えられる。また、この充放電容量は0.1Cという一般的なCレートで充放電した場合の容量である。このため、実施例のリチウムイオン二次電池は、通常の速度で充放電する場合にも充分に大きな容量を示すといえる。つまり、SnOにメカニカルミリング処理と酸化処理とを施す実施例の製造方法によると、充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質を製造できる。
【0062】
また、図7に示すように、実施例のリチウムイオン二次電池は比較例1、2のリチウムイオン二次電池に比べてサイクル経過後にも充放電容量が大きかった。つまり実施例のリチウムイオン二次電池は比較例1、2のリチウムイオン二次電池に比べてサイクル特性に優れる。これは、実施例のリチウムイオン二次電池はSnおよびSnO以外にSnO2を含むために体積変化が緩和されたこと、および、コンバージョン反応する活物質量(割合)が増加したことに由来すると考えられる。なお、図8に示すように、実施例および比較例2のリチウムイオン二次電池における2回目充放電時のクーロン効率は、初回充放電時のクーロン効率に比べて上昇している。これは、活物質の不可逆容量が低減したためと考えられる。このクーロン効率の上昇は、実施例のリチウムイオン二次電池においてより顕著である。このため、実施例のリチウムイオン二次電池はサイクル特性に優れているといえる。さらに、比較例1のリチウムイオン二次電池における2回目充放電時のクーロン効率は、初回充放電時のクーロン効率に比べて大幅に減少している。これは比較例1の負極活物質において不可逆容量が生じていること、つまり、比較例1の負極活物質では合金化反応が生じコンバージョン反応が生じていないことを示している。
【技術分野】
【0001】
本発明はスズを含みリチウムイオン二次電池に用いられる負極活物質およびその製造方法ならびにこの負極活物質を用いたリチウムイオン二次電池に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、小型で大容量であるため、携帯電話やノートパソコン等の二次電池として広く用いられている。近年では、電気自動車やハイブリッド自動車等のバッテリとしての用途も提案されている。
【0003】
リチウムイオン二次電池は、リチウム(Li)を挿入および脱離できる活物質を正極と負極とに持つ。リチウムイオン二次電池は、リチウムイオンの両極間の移動によって動作する。
【0004】
近年、リチウムイオン二次電池の初期容量を高めるために、負極活物質としてスズ(Sn)を含むものを用いることが提案されている。SnはLiと合金可能な元素であり、炭素材料に比べて理論容量が大きいため、リチウムイオン二次電池用の負極活物質として有用であると考えられている。すなわち、Snを含む負極活物質を用いることにより、炭素材料等を用いるよりも高容量のリチウムイオン二次電池を得ることができる。
【0005】
Snを含む一般的な負極活物質として、SnOが挙げられる。しかし近年、Liとのコンバージョン反応を生じ得るSnO2を負極活物質として用いる場合に、Liとの合金化反応を生じ得るSnを負極活物質として用いる場合に比べて、リチウムイオン二次電池をさらに高容量化できると考えられている(例えば、非特許文献1参照)。
【0006】
しかし、コンバージョン反応は一般に反応速度が遅いとされている。つまり、SnO2を負極活物質とし、コンバージョン反応を生じさせるためには、充放電速度を非常に遅くする必要があった。このためこのような負極活物質は、一般的な用途のリチウムイオン二次電池に適用し難い問題があった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】イアン・A.コートニーおよびJ.R.ダーン(Ian A.Courtney and J.R.Dahn)著、「エレクトロケミカルアンドインサイチュエックスレイディフラクションスタディーズオブザリアクションオブリチウムウイズティンオキサイドコンポジッツ(Electrochemical and In Situ X−ray Diffraction Studies of the Reaction of Lithium with Tin Oxide Composites)」、ジャーナルオブザエレクトロケミカルソサイエティ(Journal of The Electrochemical Society)、第144巻、第6号、1997年6月、p.2045−2052
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記の事情に鑑みてなされたものであり、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質、およびこの負極活物質の製造方法、ならびに負極活物質としてSnを含み充放電容量が大きくかつ一般的な用途に利用できるリチウムイオン二次電池を提供することを、解決すべき課題とする。
【課題を解決するための手段】
【0009】
上記課題を解決する本発明の負極活物質の製造方法は、スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法であって、
SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、を含むことを特徴とする。
【0010】
上記課題を解決する本発明の負極活物質は、スズ(Sn)を含むリチウムイオン二次電池用負極活物質であって、
SnとSnO2とを含み、
該SnO2に含まれるSn原子の量は、該負極活物質に含まれるSn原子全体を100原子%としたときに、50原子%を超えるSn原子をSnO2として含むことを特徴とする。
【0011】
また、上記課題を解決する本発明のリチウムイオン二次電池は、本発明の負極活物質を負極に含むことを特徴とする。
【発明の効果】
【0012】
以下、特に説明のない場合、本発明のリチウムイオン二次電池用負極活物質を本発明の負極活物質と略する。また、本発明のリチウムイオン二次電池用負極活物質の製造方法を本発明の製造方法と略する。
【0013】
本発明の製造方法によると、一般的な速度で充放電した場合にもリチウムイオン二次電池の充放電容量を増大できる負極活物質を製造できる。これは、メカニカルミリング処理により酸化第1スズすなわちSnOを微細化かつ不均化(2SnO→Sn+SnO2)させ、さらにメカニカルミリング処理後のスズ原料に含まれるSn、および、メカニカルミリング処理で処理しきれていないSnO(換言すると、残存するSnO)を酸化処理により酸化してSnO2を生成させることで、SnOからSnおよびSnO2の2相を生成できたことによると考えられる。ここで生成したSnおよびSnO2は、それぞれ別々にリチウムイオン二次電池用負極活物質として機能すると考えられる。また、SnおよびSnO2はLiと可逆的に反応すると考えられる。このため、このような負極活物質を用いれば、負極活物資としてSnOを用いる場合やSnのみを用いる場合に比べて、リチウムイオン二次電池を高容量化でき、かつ、反応速度もさほど低下しないと考えられる。よって、本発明の製造方法によると、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質を製造できる。
【0014】
また、本発明の負極活物質は、上述したように、Snを含み充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能である。以下、必要に応じてメカニカルミリング処理をMM処理と略する。
【図面の簡単な説明】
【0015】
【図1】スズ原料のSEM像である。
【図2】比較例2の負極活物質(スズ原料をメカニカルミリング処理したもの)のSEM像である。
【図3】実施例の負極活物質(スズ原料をメカニカルミリング処理および加熱処理したもの)のSEM像である。
【図4】実施例の負極活物質および比較例2の負極活物質のX線回折パターンである。
【図5】比較例1の負極活物質および比較例2の負極活物質の熱質量−示差熱分析結果である。
【図6】実施例および比較例1、2のリチウムイオン二次電池の1サイクル目の充放電曲線である。
【図7】実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果であり、具体的にはサイクル経過に伴う放電容量の変化を表すグラフである。
【図8】実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果であり、具体的にはサイクル経過に伴うクーロン効率の変化を表すグラフである。
【発明を実施するための形態】
【0016】
本発明の製造方法は第1工程と第2工程とを備える。
【0017】
第1工程は、SnOを主成分とするスズ原料をメカニカルミリング処理する工程である。ここで、メカニカルミリングとは、遊星ボールミル等を用いて機械的な力を加えることで、物質に化学反応を起こさせる(または化学反応を起こしやすくする)処理を指す。物質を微粒子状にでき、かつ、不均化反応による物質の表面改質等を生じさせ得る。
【0018】
上述したように、第1工程でスズ原料(SnO)をメカニカルミリング処理することで、2SnO→Sn+SnO2の不均化反応が生じ、Sn相と、SnO2相とが生成すると考えられる。このSn相はメカニカルミリング処理されたスズ原料(負極活物質前駆体)における芯部を構成すると考えられ、SnO2相は芯部を覆う被覆部を構成すると考えられる。スズ原料は、SnOのみからなっても良いし、SnやSnO2等のスズ含有物質を含んでも良いし、その他の不可避不純物を含んでも良い。
【0019】
第2工程は、上述した負極活物質前駆体を酸化処理する工程である。酸化処理は、既知の種々の方法を用いることができる。例えば、負極活物質前駆体に、酸素ガスやオゾンガス等の酸素元素含有ガスを高濃度で接触させても良い。或いは、負極活物質前駆体を、酸素元素存在下(例えば空気等の酸素元素含有雰囲気下)で加熱しても良い。負極活物質前駆体を酸素元素存在下で加熱する場合には、負極活物質前駆体を効率よくかつ安価に酸化できる利点がある。
【0020】
上述したように、負極活物質前駆体は芯部と被覆部とを持つ多層構造をなすと考えられる。第2工程においては、負極活物質前駆体を酸化することで、負極活物質前駆体の被覆部にSnO2を生成させる。メカニカルミリング処理で得られた被覆部には、SnO2(および、場合によっては未処理のSnO)が存在すると考えられる。第2工程においては、芯部に含まれるSnが酸化されてSnO2が生成する。または、被覆部に含まれるSnOが酸化してSnO2が生成する。このような反応によって、SnとSnO2とを含む負極活物質が得られる。なお、第2工程は、第1工程後に行っても良いし、第1工程と同時に行っても良い。何れの場合にも、メカニカルミリング処理されたスズ原料をさらに酸化することで、SnとSnO2とを含む負極活物質におけるSnO2含量を多くできる。
【0021】
ところで、SnOからなる従来の負極活物質において、SnOとLiとの反応は以下のように進行すると考えられている。
【0022】
SnO+2Li+2e→Li2O+Sn・・・(1)
Sn+4.4Li+4.4e←→Li4.4Sn・・・(2)
上記反応(1)は不可逆反応であり、反応(2)は可逆反応であるため、(1)で消費されたLi(Li2Oに含まれるLi)はリチウムイオン二次電池の充放電に関与しない。このためSnOを負極活物質とするリチウムイオン二次電池においては不可逆容量が生じる問題があった。なお、反応(2)は可逆反応であり、この反応によってリチウムイオン二次電池の充放電が可能になる。反応(2)は合金化反応と呼ばれる反応である。
【0023】
本発明の負極活物質は、上述したように、SnとSnO2とを含む。SnO2とLiとの反応は以下のように進行すると考えられている。
【0024】
SnO2+4Li+4e←→Sn+2Li2O・・・(3)
Sn+4.4Li+4.4e←→Li4.4Sn・・・(2)
上式のように、SnO2とLiとの反応には、不可逆反応がなく、可逆反応のみである。上式(3)の反応はコンバージョン反応と呼ばれる反応であり、上式(2)はSnOとLiとの反応と同様の合金化反応である。本発明の負極活物質においては、コンバージョン反応を利用することで、容量を大幅に増大させ得る。
【0025】
さらに、本発明の製造方法で得られた負極活物質にはSnO2だけでなくSnが含まれるが、このSnもまた上式(2)のようにLiと可逆的に反応するため、負極活物質として利用できる。つまり、本発明の製造方法で得られた負極活物質はSn元素を含む2種類の物質(つまり、SnおよびSnO2)を別々に負極活物質として利用でき、かつ、不可逆容量を生じないため、リチウムイオン二次電池を大容量にできる利点がある。参考までに、SnOからなる負極活物質の理論容量は875mAh/gであり、SnO2からなる負極活物質の理論容量は1494mAh/gである。
【0026】
なお、上述したように、コンバージョン反応は反応速度が遅いとされている。しかし、本発明の負極活物質においては、充放電の際にコンバージョン反応と合金化反応との2つの反応を用いているため、一般的なリチウムイオン二次電池の充放電速度と同様の速度で充放電しても、合金化反応のみの場合に比べて充放電容量を大きくできる。
【0027】
SnとSnO2とを含む負極活物質の形状は特に問わないが、粒子状であるのが好ましい。この粒子は一次粒子であっても良いし二次粒子であっても良いが、小径であるのが好ましい。例えば負極活物質粒子は平均粒径0.2μm〜5μmの範囲にあることが望ましい。平均粒径が5μmより大きいと、この負極活物質を用いたリチウムイオン二次電池の充放電特性が低下する場合がある。また、平均粒径が0.2μmより小さいと凝集して粗大な粒子となる場合があるため、同様に、この負極活物質を用いたリチウムイオン二次電池の充放電特性が低下する場合がある。なお、ここでいう平均粒径とは、レーザー光回折法による粒度分布測定における質量平均粒子径を指す。本発明の製造方法におけるスズ原料(SnO)の粒径もまた特に限定しないが、上記した粒径の負極活物質を製造するためには平均粒径10〜20μm程度であるのが好ましい。
【0028】
本発明の負極活物質はLiを含まないか、またはLiを多く含まない。このため、本発明の負極活物質を用いたリチウムイオン二次電池においては、正極活物質としてLiを含む材料を用いたり、負極活物質にLiをプリドープしたりする必要がある。負極活物質にLiをプリドープする場合、Liを一般的な方法でSn、SnOおよびSnO2の少なくとも一種にプリドープすれば良く、その方法は特に限定しない。例えば、Liのプリドープにあたって、Sn、SnOおよびSnO2の少なくとも一種をLiと接触させればよい。このとき、上記したSn、SnOおよびSnO2の少なくとも一種とLiとは、イオン、固体、液体、ガスの何れの状態で接触させても良い。さらにこのときLiは酸化物、塩化物等のLi含有化合物であっても良い。
【0029】
本発明の負極活物質を負極に含むリチウムイオン二次電池の構成を以下に説明する。負極は、上述した本発明の負極活物質以外の材料を含み得る。例えば、バインダー樹脂、導電助剤等の負極材料を構成する既知の材料を含み得る。
【0030】
バインダー樹脂は、負極活物質及び導電助剤を集電体に結着するための結着剤として用いられる。バインダー樹脂には、なるべく少ない量で負極活物質等を結着させることが求められる。バインダー樹脂の配合量は、負極活物質、導電助剤、及びバインダー樹脂の合計量を100質量%としたときに、0.5〜50質量%であるのが好ましい。バインダー樹脂量が0.5質量%未満では電極の成形性が低下し、50質量%を超えると電極のエネルギー密度が低くなる。バインダー樹脂の種類は限定的ではないが、ポリフッ化ビニリデン(PVDF)、ポリテトラフルオロエチレン(PTFE)等のフッ素系ポリマー、スチレンブタジエンゴム(SBR)等のゴム、ポリイミド等のイミド系ポリマー、アルコキシルシリル基含有樹脂、ポリアクリル酸、ポリメタクリル酸、ポリイタコン酸などが例示される。
【0031】
導電助剤は、電極の導電性を高めるために添加される。導電助剤として、炭素質微粒子であるカーボンブラック、黒鉛、アセチレンブラック(AB)、ケッチェンブラック(KB)、気相法炭素繊維(Vapor Grown Carbon Fiber:VGCF)等を単独でまたは二種以上組み合わせて添加することが出来る。導電助剤の使用量については、特に限定的ではないが、負極活物質100質量部に対して、1〜10質量部程度とすることができる。また、充放電に伴うSnの体積変化を考慮すると、Snの体積変化を緩衝し得る黒鉛を導電助剤として配合しても良い。負極は、これらの材料に有機溶剤を加えて混合しスラリーにしたものを、ロールコート法、ディップコート法、ドクターブレード法、スプレーコート法、カーテンコート法などの方法で集電体に塗布(積層)し、バインダー樹脂を硬化させることによって作製することができる。
【0032】
集電体としては、箔、板、メッシュ等の形状を採用することが出来るが、目的に応じた形状であれば特に限定されない。集電体として、例えば銅箔やアルミニウム箔等を好適に用いることができる。
【0033】
上記した負極を用いるリチウムイオン二次電池の負極以外の構成要素としては、特に限定されない公知の正極、電解液、セパレータを用いることが出来る。正極は、リチウムイオン二次電池で使用可能なものであれば良い。正極は、集電体と、集電体上に結着された正極活物質層とを有する。正極活物質層は、正極活物質と、バインダーとを含み、さらには導電助剤を含んでも良い。正極活物質、導電助材およびバインダーは、特に限定はなく、リチウムイオン二次電池で使用可能なものであれば良い。
【0034】
正極活物質としては、金属リチウム、LiCoO2、LiNi1/3Co1/3Mn1/3O2、Li2MnO2、Sなどが挙げられる。集電体は、アルミニウム、ニッケル、ステンレス鋼など、リチウムイオン二次電池の正極に一般的に使用されるものであれば良い。導電助剤は上記の負極で記載したものと同様のものを使用できる。
【0035】
電解液は、有機溶媒に電解質であるLi金属塩を溶解させたものである。電解液は、特に限定されない。有機溶媒として、非プロトン性有機溶媒、たとえばプロピレンカーボネート(PC)、エチレンカーボネート(EC)、ジメチルカーボネート(DMC)、ジエチルカーボネート(DEC)、エチルメチルカーボネート(EMC)等から選ばれる一種以上を用いることができる。また、溶解させる電解質としては、LiPF6、LiBF4、LiAsF6、LiI、LiClO4、LiCF3SO3等の有機溶媒に可溶なLi金属塩を用いることができる。
【0036】
例えば、エチレンカーボネート、ジメチルカーボネート、プロピレンカーボネート、ジメチルカーボネートなどの有機溶媒にLiClO4、LiPF6、LiBF4、LiCF3SO3等のLi金属塩を0.5mol/L〜1.7mol/L程度の濃度で溶解させた溶液を使用することが出来る。
【0037】
セパレータは、リチウムイオン二次電池に使用されることが出来るものであれば特に限定されない。セパレータは、正極と負極とを分離し電解液を保持するものであり、ポリエチレン、ポリプロピレン等の薄い微多孔膜を用いることができる。
【0038】
本発明の負極活物質を用いたリチウムイオン二次電池の形状には特に限定はなく、円筒型、積層型、コイン型等、種々の形状を採用することができる。いずれの形状を採る場合であっても、正極および負極にセパレータを挟装させ電極体とし、正極集電体および負極集電体から外部に通ずる正極端子および負極端子までの間を、集電用リード等を用いて接続した後、この電極体を電解液とともに電池ケースに密閉して電池となる。
【0039】
以下、実施例により本発明の製造方法および本発明の負極活物質を具体的に説明する。
【実施例】
【0040】
(実施例)
<負極活物質の製造方法>
スズ原料として、SnO粉末(株式会社高純度研究所社製)を準備した。このスズ原料をボールミル装置(ドイツ・フリッチュ社製、P−7)に投入し、空気中、室温、回転数450rpmで20時間メカニカルミリング処理した。
【0041】
次いで、メカニカルミリング処理後のスズ原料を、加熱炉にて空気中、400℃で3時間加熱した。このときの昇温速度は10℃/分であった。
【0042】
3時間加熱した後、熱処理したスズ原料を自然冷却して実施例の負極活物質を得た。
【0043】
<負極>
得られた負極活物質と、導電助剤としてのアセチレンブラック(AB)と、バインダー樹脂としてのポリアミック酸溶液(ポリイミド前駆体)とを混合し、スラリーを調製した。スラリー中の各成分の組成比は固形分として、負極活物質:AB:ポリイミドバインダー=85:5:10である。このスラリーを、厚さ20μmの電解銅箔(集電体)の表面にドクターブレードを用いて塗布し、銅箔上に負極活物質層を形成した。
【0044】
その後、80℃で20分間乾燥し、次いで200℃で20時間真空乾燥した。この工程により、負極活物質層から有機溶媒を揮発させて除去した。その後、直径15mmの円板状に打ち抜き、プレス機により、集電体と負極活物質層を強固に密着接合させた。これを200℃で20時間加熱硬化させて、活物質層の厚さが15μm程度の電極を形成した。
【0045】
<正極>
正極としては、直径15.5mmの円板状、厚さ500μmの金属Li箔を用いた。
【0046】
<電解液>
エチレンカーボネートと、エチルメチルカーボネートとを3:7(体積比)で混合し、混合溶媒を調製した。この混合溶媒に、LiPF6を1Mの濃度となるように溶解することで、非水電解液を調製した。
【0047】
<リチウムイオン二次電池>
上記の負極、正極および電解液を用いてコイン電池を製作した。詳しくは、ドライルーム内で、厚さ25μmのポリプロピレン微孔質膜からなるセパレータ(Celgard2400)と、厚さ500μmのガラス不織布フィルタと、を正極と負極との間に挟装して、電極体電池とした。この電極体電池を、ステンレス容器からなる電池ケース(CR2032型コイン電池用部材、宝泉株式会社製)に収容した。電池ケースには上記の電解液を注入した。電池ケースをカシメ機で密閉して、実施例のリチウムイオン二次電池を得た。
【0048】
(比較例1)
比較例1の負極活物質はSnである。このSnを負極活物質とし、実施例1と同じ方法で比較例1のリチウムイオン二次電池を製造した。
【0049】
(比較例2)
比較例2の負極活物質の製造方法は、スズ原料すなわちSnOにメカニカルミリング処理のみを施し加熱処理を施さなかったこと以外は実施例1の負極活物質の製造方法と同じである。比較例2の負極活物質は、メカニカルミリング処理されたスズ原料(すなわち負極活物質前駆体)である。比較例2の負極活物質を用い、実施例1と同じ方法で比較例2のリチウムイオン二次電池を製造した。
【0050】
<試験>
(SEMによる硫黄系正極活物質の分析)
スズ原料、実施例の負極活物質および比較例2の負極活物質を、走査型電子顕微鏡(SEM;Scanning Electron Microscope)により表面観察した。このときの加速電圧は20kVであり倍率は500倍と2000倍であった。スズ原料のSEM像を図1に示し、比較例2の負極活物質のSEM像を図2に示し、実施例の負極活物質のSEM像を図3に示す。
【0051】
図1〜図3に示すように、メカニカルミリング処理後の負極活物質つまり比較例2および実施例の負極活物質は、メカニカルミリング処理前の負極活物質つまりスズ原料に比べて小径である。具体的には、比較例2の負極活物質の平均粒径は1μm程度であり、実施例の負極活物質の平均粒径は2μm程度である。これに対して、スズ原料の平均粒径は15μm程度である。これは、スズ原料すなわちSnOがメカニカルミリング処理により微粉化されたためと考えられる。つまり、負極活物質の粒径により、スズ原料(SnO)がメカニカルミリング処理されているか否かを推測できる。スズ原料を原料とする負極活物質の平均粒径は0.2〜5μm程度であるのが好ましく、0.5〜2μm程度であるのがより好ましいと考えられる。平均粒径がこれらの範囲内にあれば、SnOが充分にメカニカルミリング処理されていると判断できる。なお、実施例の負極活物質の平均粒径が比較例2の負極活物質の平均粒径よりも大きいのは、メカニカルミリング処理後の加熱処理により、負極活物質が凝集したためだと考えられる。参考までに、本明細書においては、SEM像を基に10〜20個の負極活物質の粒子径を測定し、測定した粒子径の平均値を算出した。この平均値を負極活物質の平均粒径とした。
【0052】
(X線回折による硫黄系正極活物質の分析)
実施例の負極活物質および比較例2の負極活物質について、X線回折分析を行った。装置として粉末X線回折装置(リガク社製、MiniFlex)を用いた。測定条件は、CuKα線、電圧:30kV、電流:20mA、スキャン速度:2°/分、サンプリング:0.01°、積算回数:1回、回折角(2θ):5°〜80°であった。X線回折で得られた回折パターンを図4に示す。図4に示すように、実施例の負極活物質および比較例2の負極活物質には、Snのピーク(図中▲)、SnOのピーク(図中×)およびSnO2のピーク(図中○)が確認された。また、実施例の負極活物質において確認されたSnのピークは、比較例2の負極活物質で検出されたSnのピークに比べて、強度が低く数も少なかった。このことから、SnOをメカニカルミリング処理することでSnが生成することがわかる。また、実施例(酸化処理後)の負極活物質におけるSnのピークが、SnO2のピークに比べて相対的に小さくなっていることから、酸化処理によりSnの表面の酸化被膜が成長したことがわかる。つまりこの結果から、実施例の負極活物質はSnからなる芯部と芯部を覆う被覆部とで構成され、被覆部にはSnO2が含まれていることがわかる。
【0053】
(熱質量分析による硫黄系正極活物質の分析)
比較例1の負極活物質および比較例2の負極活物質の熱質量変化(TG)を測定した。測定装置としてはリガク製熱分析装置(Thermo Plus TG8120)を用いた。詳しくは、空気を300ml/分の流量で供給しつつ、各試料を室温から400℃まで10℃/分の昇温速度で加熱し、温度と質量変化との関係を測定することによって、熱質量−示差熱分析を行った。分析結果を図5に示す。図5に示すように、比較例2の負極活物質(つまり、SnOのメカニカルミリング処理品)は、比較例1の負極活物質(つまり単体Sn)に比べて質量変化が大きい。具体的には、比較例2の負極活物質の質量は、加熱前には23mgであり、室温から100℃まで加熱すると0.11mg減少し、その後、400℃まで加熱すると0.636mg増加した。つまり、SnOのメカニカルミリング処理品を加熱すると、100℃までの加熱で吸着水0.11mgが蒸発し、その後、0.636−(−0.11)=0.746mg質量増加した。
【0054】
Sn1モルは118.69gであり、SnO21モルは150.69gである。メカニカルミリング処理によるSnOの不均化反応は、2SnO→Sn+SnO2であると考えられる。このためSnOのメカニカルミリング処理品(加熱前)に含まれるSnの質量は、{118.69/(118.69+150.69)}×23≒10.134(mg)であると考えられる。
【0055】
SnOのメカニカルミリング処理品に含まれるSn全てがSnO2にまで酸化されたと仮定し、そのときに増加した質量をxとすると、O2/Sn=32/118.69=x/10.134であるため、x=2.732(mg)となる。上述した加熱で増加した質量全てがSnの酸化によると仮定すると、実際に生じた質量増加は0.746mgであったため、SnがSnO2に変化した割合は(0.746/2.7)×100=27.6%であった。
【0056】
上述したように、理論上、SnOに含まれるSn原子の50%がメカニカルミリング処理でSnO2になると考えられる。また、SnOのメカニカルミリング処理品に含まれるSnの27.6%が酸化処理によりSnO2に変化すると考えられる。このため、メカニカルミリング処理および加熱処理後の実施例の負極活物質にSnO2として含まれているSn原子は、この負極活物質全体に含まれているSn原子を100原子%とすると、(メカニカルミリング処理で生じた50原子%)+(酸化処理で生じた27.6原子%)=77.6原子%であると考えられる。
【0057】
なお、SnOのメカニカルミリング処理品は、酸化処理前の段階で、50原子%のSnO2を含むと考えられる。したがって、本発明の負極活物質は、負極活物質全体に含まれているSn原子を100原子%としたときに、50原子%を超えるSn原子をSnO2として含めば良い。なお、本発明の負極活物質は、負極活物質全体に含まれているSn原子を100原子%としたときに65原子%を超えるSn原子をSnO2として含むのが好ましく、70原子%を超えるSn原子をSnO2として含むのがより好ましく、75原子%を超えるSn原子をSnO2として含むのがさらに好ましい。本発明の負極活物質において、SnO2の大部分は、Snの表面に配置されると考えられる。つまり、本発明の負極活物質は、Snからなる芯部と、この芯部を覆いSnO2を含む被覆部と、を持つと考えられる。芯部はメカニカルミリング処理時に生成すると考えられ、被覆部の一部もまたメカニカルミリング処理時に生成すると考えられる。さらに、被覆部の他の一部は、芯部の一部が酸化処理によって酸化され、生成したSnO2で構成されると考えられる。
【0058】
ところで、Snを加熱酸化する場合、加熱温度が270℃以下であればSnOが生じ、280℃以上390℃未満であればSnOとSnO2との両方が生じ、390℃以上であればほぼSnO2のみが生じることが知られている(例えば、「金属酸化物と複合酸化物」、田部浩三 他 編、講談社、1978年、p134参照)。したがって、Snを充分に酸化させSnO2を生成させるためには、酸化工程における加熱温度は280℃以上であるのが好ましく、390℃以上であるのがより好ましいといえる。
【0059】
(電池特性の評価)
実施例および比較例1、2のリチウムイオン二次電池の充放電容量を測定した。詳しくは、各リチウムイオン二次電池に、負極活物質1cm2あたり0.2mAとなる電流密度、放電終止電圧0V、充電終止電圧3.0V、0.1Cで1サイクル目の充放電を行った。2サイクル目以降は、負極活物質1cm2あたり0.5mAとなる電流密度で充放電をおこなった。なお、2サイクル目以降の放電終止電圧、充電終止電圧およびCレートは1サイクル目と同じである。充放電は10サイクル繰り返した。評価試験(1サイクル目)の結果を表1に示す。実施例および比較例1、2のリチウムイオン二次電池の1サイクル目の充放電曲線を図6に示す。実施例および比較例1、2のリチウムイオン二次電池のサイクル試験の結果を図7および図8に示す。なお、図7はサイクル経過に伴う放電容量の変化を表すグラフであり、図8はサイクル経過に伴うクーロン効率の変化を表すグラフである。
【0060】
【表1】

【0061】
表1および図6に示すように、実施例のリチウムイオン二次電池は、比較例1、2のリチウムイオン二次電池に比べて充放電容量が大きい。実施例のリチウムイオン二次電池の容量はSnOの理論容量875を超えている。このため、実施例の負極活物質においては比較例1、2では生じていないコンバージョン反応が生じていると考えられる。また、この充放電容量は0.1Cという一般的なCレートで充放電した場合の容量である。このため、実施例のリチウムイオン二次電池は、通常の速度で充放電する場合にも充分に大きな容量を示すといえる。つまり、SnOにメカニカルミリング処理と酸化処理とを施す実施例の製造方法によると、充放電容量が大きくかつ一般的な用途のリチウムイオン二次電池に適用可能な負極活物質を製造できる。
【0062】
また、図7に示すように、実施例のリチウムイオン二次電池は比較例1、2のリチウムイオン二次電池に比べてサイクル経過後にも充放電容量が大きかった。つまり実施例のリチウムイオン二次電池は比較例1、2のリチウムイオン二次電池に比べてサイクル特性に優れる。これは、実施例のリチウムイオン二次電池はSnおよびSnO以外にSnO2を含むために体積変化が緩和されたこと、および、コンバージョン反応する活物質量(割合)が増加したことに由来すると考えられる。なお、図8に示すように、実施例および比較例2のリチウムイオン二次電池における2回目充放電時のクーロン効率は、初回充放電時のクーロン効率に比べて上昇している。これは、活物質の不可逆容量が低減したためと考えられる。このクーロン効率の上昇は、実施例のリチウムイオン二次電池においてより顕著である。このため、実施例のリチウムイオン二次電池はサイクル特性に優れているといえる。さらに、比較例1のリチウムイオン二次電池における2回目充放電時のクーロン効率は、初回充放電時のクーロン効率に比べて大幅に減少している。これは比較例1の負極活物質において不可逆容量が生じていること、つまり、比較例1の負極活物質では合金化反応が生じコンバージョン反応が生じていないことを示している。
【特許請求の範囲】
【請求項1】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法であって、
SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、を含むことを特徴とするリチウムイオン二次電池用負極活物質の製造方法。
【請求項2】
前記第2工程は酸素(O)存在下で前記スズ原料を加熱する工程である請求項1に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項3】
前記第2工程における加熱温度は280℃以上である請求項1または請求項2に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項4】
前記第2工程における加熱温度は390℃以上である請求項1〜請求項3の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項5】
前記第1工程においてSnOからSnおよびSnO2を生成させる請求項1〜請求項4の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項6】
前記第2工程において少なくとも一部のSnを酸化しSnO2を生成させる請求項1〜請求項5の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項7】
前記SnO2に含まれるSn原子の量は、前記第1工程前のスズ原料に含まれるSn原子を100原子%としたときに、50原子%を超える請求項5または請求項6に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項8】
前記第1工程において、Snからなる芯部と、SnO2を含み該芯部を覆う被覆部と、を持つ負極活物質前駆体を生成させ、
前記第2工程において、該負極活物質前駆体の該被覆部にSnO2を生成させる請求項5〜請求項7の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項9】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質であって、
SnとSnO2とを含み、
該SnO2に含まれるSn原子の量は、該負極活物質に含まれるSn原子全体を100原子%としたときに、50原子%を超えることを特徴とするリチウムイオン二次電池用負極活物質。
【請求項10】
前記負極活物質は、Snからなる芯部と、SnO2を含み該芯部を覆う被覆部と、を持つ請求項9に記載のリチウムイオン二次電池用負極活物質。
【請求項11】
請求項9または請求項10に記載の負極活物質を負極に含むことを特徴とするリチウムイオン二次電池。
【請求項12】
請求項11に記載のリチウムイオン二次電池を備えることを特徴とする車両。
【請求項1】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質を製造する方法であって、
SnOを主成分とするスズ原料をメカニカルミリング処理する第1工程と、該メカニカルミリング処理されたスズ原料を酸化処理する第2工程と、を含むことを特徴とするリチウムイオン二次電池用負極活物質の製造方法。
【請求項2】
前記第2工程は酸素(O)存在下で前記スズ原料を加熱する工程である請求項1に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項3】
前記第2工程における加熱温度は280℃以上である請求項1または請求項2に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項4】
前記第2工程における加熱温度は390℃以上である請求項1〜請求項3の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項5】
前記第1工程においてSnOからSnおよびSnO2を生成させる請求項1〜請求項4の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項6】
前記第2工程において少なくとも一部のSnを酸化しSnO2を生成させる請求項1〜請求項5の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項7】
前記SnO2に含まれるSn原子の量は、前記第1工程前のスズ原料に含まれるSn原子を100原子%としたときに、50原子%を超える請求項5または請求項6に記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項8】
前記第1工程において、Snからなる芯部と、SnO2を含み該芯部を覆う被覆部と、を持つ負極活物質前駆体を生成させ、
前記第2工程において、該負極活物質前駆体の該被覆部にSnO2を生成させる請求項5〜請求項7の何れか一つに記載のリチウムイオン二次電池用負極活物質の製造方法。
【請求項9】
スズ(Sn)を含むリチウムイオン二次電池用負極活物質であって、
SnとSnO2とを含み、
該SnO2に含まれるSn原子の量は、該負極活物質に含まれるSn原子全体を100原子%としたときに、50原子%を超えることを特徴とするリチウムイオン二次電池用負極活物質。
【請求項10】
前記負極活物質は、Snからなる芯部と、SnO2を含み該芯部を覆う被覆部と、を持つ請求項9に記載のリチウムイオン二次電池用負極活物質。
【請求項11】
請求項9または請求項10に記載の負極活物質を負極に含むことを特徴とするリチウムイオン二次電池。
【請求項12】
請求項11に記載のリチウムイオン二次電池を備えることを特徴とする車両。
【図4】


【図5】


【図1】


【図2】


【図3】


【図6】


【図7】


【図8】




【図5】


【図1】


【図2】


【図3】


【図6】


【図7】


【図8】


【公開番号】特開2013−93259(P2013−93259A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−235661(P2011−235661)
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000003218)株式会社豊田自動織機 (4,162)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月27日(2011.10.27)
【出願人】(000003218)株式会社豊田自動織機 (4,162)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

