リチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム及びリチウムイオン電池の充放電制御回路
【課題】 負極にシリコンを用いた全固体リチウム電池の充放電を繰り返しても、サイクル特性が劣化しないようにする。
【解決手段】 シリコンを含む負極1と、固体電解質を含む電解質層2と、を備えるリチウムイオン電池の充放電制御システムであって、リチウムイオン電池の充電量を測定する充電量測定手段から送信される充電量と閾値を比較する充電量閾値比較手段と、充電量閾値比較手段により充電量が閾値より大きいと判断された場合に充電を中止する信号を送信する充電指示手段と、を備え、閾値として設定される充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とする。
【解決手段】 シリコンを含む負極1と、固体電解質を含む電解質層2と、を備えるリチウムイオン電池の充放電制御システムであって、リチウムイオン電池の充電量を測定する充電量測定手段から送信される充電量と閾値を比較する充電量閾値比較手段と、充電量閾値比較手段により充電量が閾値より大きいと判断された場合に充電を中止する信号を送信する充電指示手段と、を備え、閾値として設定される充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、リチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム、及び、リチウムイオン電池の充放電制御回路に関する。
【背景技術】
【0002】
現行のリチウムイオン電池には、電解質として有機系電解液が主に用いられている。有機系電解液は、高いイオン伝導度を示すものの、電解液が液体でかつ可燃性であることから、電池として用いた場合、漏洩、発火等の危険性が懸念されている。従って、次世代リチウムイオン電池用電解質として、より安全性の高い固体電解質の開発が期待されている。
【0003】
かかる課題を解決するために、イオウ元素、リチウム元素及びリン元素を主成分として含有する硫化物系固体電解質が開発され、この硫化物系固体電解質を用いた電池として全固体リチウム電池が開発された(例えば、特許文献1参照。)。
しかしながら、全固体リチウム電池に用いられている負極は、カーボンが多く、電気容量が小さいという欠点があった。
【0004】
かかる欠点を解消するため、負極にシリコンを用いる方法がある。
しかしながら、負極にシリコンを用いた全固体リチウム電池では、充放電を繰り返すと電気容量が小さくなるという欠点がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2011−129316号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、負極にシリコンを用いた全固体リチウム電池の充放電を繰り返しても、サイクル特性が劣化しないリチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム及びリチウムイオン電池の充放電制御回路を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充電方法であって、充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とするリチウムイオン電池の充電方法が提供される。
【0008】
また、本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御システムであって、リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する充電量制御手段を備えるリチウムイオン電池の充放電制御システムが提供される。
【0009】
また、本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御回路であって、リチウムイオン電池に対して充電を行う充電回路と、リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する信号を充電回路に送信する充電量制御手段と、を備えるリチウムイオン電池の充放電制御回路が提供される。
【発明の効果】
【0010】
負極にシリコンを用いた全固体リチウム電池の充放電を繰り返し行っても、サイクル特性が劣化しない充電方法及び充電システムを得ることができる。
【図面の簡単な説明】
【0011】
【図1】リチウムイオン電池の構成を示すブロック図である。
【図2】リチウムイオン電池の充放電制御システムの構成を示すブロック図である。
【図3】リチウムイオン電池の充放電制御システムの他の構成を示すブロック図である。
【図4】リチウムイオン電池の充放電制御回路の構成を示すブロック図である。
【図5】充放電制御システムの動作を示すフローチャートである。
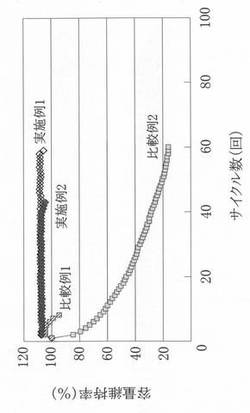
【図6】実施例1,2及び比較例1,2における初期容量の維持率を示すグラフである。
【発明を実施するための形態】
【0012】
[リチウムイオン電池]
本発明のリチウムイオン電池は、図1に示すように、シリコン負極1と、電解質層2と、正極層3とを備える。
【0013】
(1)負極
負極1は、シリコンを含む。
ここで、負極1は、シリコン薄膜である場合とシリコン粒子を含む場合に分けることができる。
【0014】
(a)シリコン薄膜
シリコン薄膜の厚さは、特に制限しないが、充放電を繰り返すとサイクル特定が劣化する膜厚である。
例えば、シリコン薄膜の厚さは、50nm以上であることが望ましい。
より好ましくは、100nm以上であり、さらに好ましくは、200nm以上であり、最も好ましくは、300nm以上である。
これは、シリコン薄膜の厚さが厚くなるほど電気容量を高くすることができるからである。
【0015】
(b)シリコン粒子
シリコン粒子の大きさは、特に制限しないが、充放電を繰り返すとサイクル特定が劣化する粒径である。
例えば、シリコン粒子の粒径は、50nm以上であることが望ましい。
より好ましくは、100nm以上であり、さらに好ましくは、200nm以上であり、最も好ましくは、300nm以上である。
粒径が小さいと一次粒子が凝集してしまい、負極を塗布などにより製造すると均一な厚さの負極ができないおそれがある。また、一次粒子の粒径を小さくするためにはシリコン粒子を粉砕する必要があるが、粒径の小さい一次粒子を製造することは困難な場合がある。
負極1は、シリコン粒子以外に、導電助剤(例えば、カーボンなど)、下記する固体電解質粒子を含んでいても良い。固体電解質の形状は問わず、粒子状であってもよく、シリコン粒子に融着していてもよい。
導電助剤と固体電解質を含むと充放電密度を高くすることができる。
【0016】
(c)シリコンの種類
シリコンの種類としては、非晶質シリコン、微結晶シリコン、多結晶シリコン、単結晶シリコンなどがある。
ただし、シリコンの種類としては、特にそれらに限定されるものではなく、高純度のシリコンでも良く、P,As,B,Alなどやその他の不純物を含んでいても良い。また、シリコン粒子の性状としては、多結晶又は単結晶性のものでも良く、非晶質でも良く、またはこれらの混合物であっても良い。また、形状は、球状、ワイヤー状、鱗片状など、どのような形態であっても良い。
【0017】
(2)電解質層
電解質層2は、固体電解質を含む。固体電解質としては、無機固体電解質とポリマー電解質がある。無機固体電解質は、ポリマー電解質と比較して有機物を含まないため安全性が高く、イオン伝導度も高いため、無機固体電解質が好ましい。
【0018】
より好ましくは、硫化物系固体電解質である。硫化物系固体電解質は、イオン伝導度が他の無機化合物より高いことが知られている。例えば、特開平4−202024等に記載の無機固体電解質を使用できる。具体的には、Li2SとSiS2、GeS2、P2S5、B2S3の組合せから成る無機固体電解質に、適宜、Li3PO4やハロゲン、ハロゲン化合物を添加した無機固体電解質を用いることができる。硫化物系固体電解質はさらに難燃処理を施したものでもよい。
【0019】
本発明では、下記(式1)に示す組成を満たすリチウムイオン伝導性無機固体電解質が好ましい。
LiaMbPcSd (式1)
(式1)において、Mは、B、Zn、Si、Cu、Ga又はGeから選択される元素を示す。
a〜dは各元素の組成比(モル比)を示し、a:b:c:dは1〜12:0〜0.2:1:2〜9を満たす。
好ましくは、bは0であり、より好ましくは、a、c及びdの比(a:c:d)がa:c:d=1〜9:1:3〜7、さらに好ましくは、a:c:d=1.5〜4:1:3.25〜4.5である。
各元素の組成比は、固体電解質を製造する際の原料化合物の配合量を調整することにより制御できる。
【0020】
硫化物系固体電解質は、非結晶(ガラス化)であっても結晶化(ガラスセラミックス化)していてもよく、一部のみ結晶化していてもよい。
ここで、結晶化させるとガラスよりもイオン伝導度が高くなる場合があり、その場合には結晶化させることが好ましい。
【0021】
結晶構造として、例えば、特開2002−109955に開示されているLi7PS6構造、Li4P2S6構造、Li3PS4構造、Li4SiS4構造、Li2SiS3構造、特開2005−228570やWO2007/066539に開示されているLi7P3S11構造が好ましい。
ここで、Li7P3S11構造は、X線回折(CuKα:λ=1.5418Å)において、2θ=17.8±0.3deg,18.2±0.3deg,19.8±0.3deg,21.8±0.3deg,23.8±0.3deg,25.9±0.3deg,29.5±0.3deg,30.0±0.3degに回折ピークを有する。
上記結晶構造であれば、非晶体よりイオン伝導度が高くなるからである。
【0022】
硫化物系固体電解質の結晶化された部分は、1つの結晶構造のみからなっていてもよく、複数の結晶構造を有していてもよい。尚、結晶化方法については後述する。
【0023】
硫化物系固体電解質の結晶化度(非晶体よりイオン伝導度が高い結晶構造の結晶化度)は、50%以上が好ましく、より好ましくは、60%以上である。
硫化物系固体電解質の結晶化度が50%未満の場合は、結晶化によりイオン伝導度を高くするという効果が少なくなるためである。
結晶化度は、NMRスペクトル装置を用いることにより測定できる。具体的には、硫化物系固体電解質の固体31P−NMRスペクトルを測定し、得られたスペクトルについて、70−120ppmに観測される共鳴線を、非線形最少二乗法を用いたガウス曲線に分離し、各曲線の面積比を求めることにより測定できる。
【0024】
硫化物系固体電解質の製造方法について、硫化物系固体電解質の原料は、Li2S(硫化リチウム)、P2S3(三硫化二リン)、P2S5(五硫化二リン)、SiS2(硫化珪素)、Li4SiO4(オルト珪酸リチウム)、Al2S3(硫化アルミニウム)、単体リン(P)、単体の硫黄(S)、シリコン(Si)、GeS2(硫化ゲルマニウム)、B2S3(三硫化二砒素)、Li3PO4(燐酸リチウム)、Li4GeO4(ゲルマン酸リチウム)、LiBO2(メタホウ酸リチウム)、LiAlO3(リチウムアルミネート)等を用いることができる。
好ましい硫化物系固体電解質の原料は、Li2S(硫化リチウム)、P2S5(五硫化二リン)である。
以下、硫化物系固体電解質の原料として、Li2S(硫化リチウム)、P2S5(五硫化二リン)を用いた硫化物系固体電解質について説明する。
【0025】
硫化リチウムは、特に制限なく工業的に入手可能なものが使用できるが、高純度のものが好ましい。
硫化リチウムは、例えば、特開平7−330312号、特開平9−283156号、特開2010−163356、特願2009−238952に記載の方法により製造することができる。
例えば、特開2010−163356では、炭化水素系有機溶媒中で水酸化リチウムと硫化水素とを70℃〜300℃で反応させて、水硫化リチウムを生成し、次いでこの反応液を脱硫化水素化することにより硫化リチウムを合成する。
また、特願2009−238952では、水溶媒中で水酸化リチウムと硫化水素とを10℃〜100℃で反応させて、水硫化リチウムを生成し、次いでこの反応液を脱硫化水素化することにより硫化リチウムを合成する。
【0026】
硫化リチウムは、硫黄酸化物のリチウム塩の総含有量が0.15質量%以下であることが好ましく、より好ましくは0.1質量%以下であり、かつN−メチルアミノ酪酸リチウムの含有量が0.15質量%以下であることが好ましく、より好ましくは0.1質量%以下である。硫黄酸化物のリチウム塩の総含有量が0.15質量%以下であると、溶融急冷法やメカニカルミリング法で得られる固体電解質は、ガラス状電解質(完全非晶質)となる。一方、硫黄酸化物のリチウム塩の総含有量が0.15質量%を越えると、得られる電解質は、最初から結晶化物となるおそれがあり、この結晶化物のイオン伝導度は低い。さらに、この結晶化物について熱処理を施しても結晶化物には変化がなく、高イオン伝導度の硫化物系固体電解質を得ることができないおそれがある。
また、N−メチルアミノ酪酸リチウムの含有量が0.15質量%以下であると、N−メチルアミノ酪酸リチウムの劣化物がリチウムイオン電池のサイクル性能を低下させることがない。このように不純物が低減された硫化リチウムを用いると、高イオン伝導性電解質が得られる。
【0027】
尚、特開平7−330312号及び特開平9−283156号に記載の硫化リチウムは、硫黄酸化物のリチウム塩等を含むため、精製することが好ましい。
一方、特開2010−163356に記載の硫化リチウムの製法で製造した硫化リチウムは、硫黄酸化物のリチウム塩等の含有量が非常に少ないため、精製せずに硫化物系固体電解質の製造に用いても良い。
好ましい精製法としては、例えば、国際公開WO2005/40039号に記載された精製法等が挙げられる。具体的には、上記のようにして得られた硫化リチウムを、有機溶媒を用い、100℃以上の温度で洗浄する。
【0028】
五硫化二リン(P2S5)は、工業的に製造され、販売されているものであれば、特に限定なく使用することができる。
【0029】
硫化リチウムと五硫化二リンの割合(モル比)は、通常50:50〜80:20、好ましくは60:40〜75:25である。
特に好ましくは、Li2S:P2S5=68:32〜74:26(モル比)である。
【0030】
硫化物系ガラス固体電解質の製造方法としては、溶融急冷法、メカニカルミリング法(MM法)、有機溶媒中で原料を反応させるスラリー法等がある。
(a)溶融急冷法
溶融急冷法は、例えば、特開平6−279049、WO2005/119706に記載されている。
具体的には、P2S5とLi2Sを所定量乳鉢にて混合しペレット状にしたものを、カーボンコートした石英管中に入れ真空封入する。所定の反応温度で反応させた後、氷中に投入し急冷することにより、硫化物系ガラス固体電解質が得られる。
反応温度は、好ましくは400℃〜1000℃、より好ましくは、800℃〜900℃である。
反応時間は、好ましくは0.1時間〜12時間、より好ましくは、1〜12時間である。
上記反応物の急冷温度は、通常10℃以下、好ましくは0℃以下であり、その冷却速度は、通常1〜10000K/sec程度、好ましくは10〜10000K/secである。
【0031】
(b)メカニカルミリング法
メカニカルミリング法は、例えば、特開平11−134937、特開2004−348972、特開2004−348973に記載されている。
具体的には、P2S5とLi2Sを所定量乳鉢にて混合し、例えば、各種ボールミル等を使用して所定時間反応させることにより、硫化物系ガラス固体電解質が得られる。
上記原料を用いたMM法は、室温で反応を行うことができる。MM法によれば、室温でガラス固体電解質を製造できるため、原料の熱分解が起らず、仕込み組成のガラス固体電解質を得ることができるという利点がある。
また、MM法では、ガラス固体電解質の製造と同時に、ガラス固体電解質を微粉末化できるという利点もある。
MM法は回転ボールミル、転動ボールミル、振動ボールミル、遊星ボールミル等種々の形式を用いることができる。
MM法の条件としては、例えば、遊星型ボールミル機を使用した場合、回転速度を数十〜数百回転/分とし、0.5時間〜100時間処理すればよい。
また、特開2010−90003に記載されているように、ボールミルのボールは異なる径のボールを混合して使用してもよい。
また、特開2009−110920や特開2009−211950に記載されているように、原料に有機溶媒を添加してスラリー状にし、このスラリーをメカニカルミリング処理してもよい。
また、特開2010−30889に記載のようにメカニカルミリング処理の際のミル内の温度を調整してもよい。
メカニカルミリングの際に原料が60℃以上160℃以下になるようにすることが好ましい。
【0032】
(c)スラリー法
スラリー法は、WO2004/093099、WO2009/047977に記載されている。
具体的には、所定量のP2S5粒子とLi2S粒子を有機溶媒中で所定時間反応させることにより、硫化物系ガラス固体電解質が得られる。
ここで、特開2010−140893に記載されているように、反応を進行させるため、原料を含むスラリーをビーズミルと反応容器との間で循環させながら反応させてもよい。
また、WO2009/047977に記載されているように、原料の硫化リチウムを予め粉砕しておくと効率的に反応を進行させることができる。
また、特願2010−270191に記載されているように、原料の硫化リチウムの比表面積を大きくするために溶解パラメーターが9.0以上の極性溶媒(例えば、メタノール、ジエチルカーネート、アセトニトリル)に所定時間浸漬してもよい。
【0033】
反応温度は、好ましくは20℃以上80℃以下、より好ましくは、20℃以上60℃以下である。
反応時間は、好ましくは1時間以上16時間以下、より好ましくは、2時間以上14時間以下である。
原料である硫化リチウムと五硫化二りんが、有機溶媒の添加により溶液又はスラリー状になる程度であることが好ましい。通常、有機溶媒1リットルに対する原料(合計量)の添加量は0.001kg以上1kg以下程度となる。好ましくは0.005kg以上0.5kg以下、特に好ましくは0.01kg以上〜0.3kgである。
【0034】
有機溶媒としては特に制限はないが、非プロトン性有機溶媒が特に好ましい。
非プロトン性有機溶媒としては、非プロトン性有機溶媒(例えば、炭化水素系有機溶媒)、非プロトン性の極性有機化合物(たとえば、アミド化合物,ラクタム化合物,尿素化合物,有機イオウ化合物,
環式有機リン化合物等)を、単独溶媒として、又は、混合溶媒として、好適に使用することができる。
炭化水素系有機溶媒としては、溶媒である炭化水素系溶媒としては、飽和炭化水素、不飽和炭化水素又は芳香族炭化水素が使用できる。
飽和炭化水素としては、ヘキサン、ペンタン、2−エチルヘキサン、ヘプタン、デカン、シクロヘキサン等が挙げられる。
不飽和炭化水素しては、ヘキセン、ヘプテン、シクロヘキセン等が挙げられる。
芳香族炭化水素としては、トルエン、キシレン、デカリン、1,2,3,4−テトラヒドロナフタレン等が挙げられる。
これらのうち、特にトルエン、キシレンが好ましい。
【0035】
炭化水素系溶媒は、あらかじめ脱水されていることが好ましい。具体的には、水分含有量として100重量ppm以下が好ましく、特に30重量ppm以下であることが好ましい。
尚、必要に応じて炭化水素系溶媒に他の溶媒を添加してもよい。具体的には、アセトン、メチルエチルケトン等のケトン類、テトラヒドロフラン等のエーテル類、エタノール、ブタノール等のアルコール類、酢酸エチル等のエステル類等、ジクロロメタン、クロロベンゼン等のハロゲン化炭化水素等が挙げられる。
【0036】
上記溶融急冷法、MM法及びスラリー法の温度条件、処理時間、仕込み料等の製造条件は、使用設備等に合わせて適宜調整することができる。
【0037】
硫化物系固体電解質(ガラスセラミックス)の製造方法は、特開2005−228570、WO2007/066539、特開2002−109955に開示されている。
具体的には、上記で得られた硫化物系固体電解質(ガラス)を所定の温度で熱処理し、硫化物系結晶化ガラス(ガラスセラミックス)固体電解質を生成させる。
また、加熱は、露点−40℃以下の環境下で行うことが好ましく、より好ましくは露点−60℃以下の環境下で行うことが好ましい。
また、加熱時の圧力は、常圧であってもよく、減圧下であってもよい。
また、雰囲気は、空気であってもよく、不活性雰囲気下であってもよい。
さらに特開2010−186744に記載されているように溶媒中で加熱してもよい。
【0038】
例えば、Li7P3S11構造のガラスセラミックスを生成させる熱処理温度は、好ましくは180℃以上330℃以下、より好ましくは、200℃以上320℃以下、特に好ましくは、210℃以上310℃以下である。180℃より低いと結晶化度の高い結晶化ガラスが得られにくい場合があり、330℃より高いと結晶化度の低い結晶化ガラスが生じるおそれがある。
熱処理時間は、180℃以上210℃以下の温度の場合は、3時間以上240時間以下が好ましく、特に4時間以上230時間以下が好ましい。また、210℃より高く330℃以下の温度の場合は、0.1時間以上240時間以下が好ましく、特に0.2時間以上235時間以下が好ましく、さらに、0.3時間以上230時間以下が好ましい。
熱処理時間が0.1時間より短いと、結晶化度の高い結晶化ガラスが得られにくい場合があり、240時間より長いと、結晶化度の低い結晶化ガラスが生じるおそれがある。
【0039】
また、Li7PS6結晶構造、Li4P2S6結晶構造、Li3PS4結晶構造、Li4SiS4結晶構造及びLi2SiS3結晶構造を形成するための加熱条件については、例えば、特開2002−109955に開示されている方法により上記結晶構造を有する結晶化ガラスを製造することができる。
【0040】
硫化物系固体電解質の平均粒径は、0.01μm以上1000μm以下が好ましく、より好ましくは、0.01μm以上100μm以下である。
平均粒径の測定は、レーザー回折式粒度分布測定方法により行うことが好ましい。
【0041】
本発明のリチウムイオン電池は、上述したシリコン薄膜を有する負極1と、固体電解質を含む電解質層2を有していればよく、他の構成部材はリチウムイオン電池で公知の材料及び構成を採用できる。通常、リチウムイオン電池は、正極3と負極1の間に電解質層2を有する。
【0042】
(3)正極層
正極層3は、正極活物質、固体電解質及び導電助剤を含む。
正極活物質としては、リチウムイオンの挿入脱離が可能な物質、電池分野において正極活物質として公知のものが使用できる。
例えば、V2O5、LiCoO2、LiNiO2、LiMnO2、LiMn2O4、Li(NiaCobMnc)O2(ここで、0<a<1、0<b<1、0<c<1、a+b+c=1)、LiNi1−YCoYO2、LiCo1−YMnYO2、LiNi1−YMnYO2(ここで、0≦Y<1)、Li(NiaCobMnc)O4(0<a<2、0<b<2、0<c<2、a+b+c=2)、LiMn2−ZNiZO4、LiMn2−ZCoZO4(ここで、0<Z<2)、LiCoPO4、LiFePO4が挙げられる。
正極材としては、電池分野において正極活物質として使用されているものが使用できる。例えば、硫化物系では、硫化チタン(TiS2)、硫化モリブデン(MoS2)、硫化鉄(FeS、FeS2)、硫化銅(CuS)及び硫化ニッケル(Ni3S2)等が使用できる。好ましくは、TiS2が使用できる。
【0043】
また、酸化物系では、酸化ビスマス(Bi2O3)、鉛酸ビスマス(Bi2Pb2O5)、酸化銅(CuO)、酸化バナジウム(V6O13)、コバルト酸リチウム(LiCoO2)、ニッケル酸リチウム(LiNiO2)、マンガン酸リチウム(LiMnO2)等が使用できる。尚、これらを混合して用いることも可能である。好ましくは、コバルト酸リチウムが使用できる。
【0044】
また、LixCoO2,LixNiO2,LixMn2O4,LixFePO4,LixCoPO4,LixMn1/3Ni1/3Co1/3O2,LixMn1.5Ni0.5O2等も使用できる(Xは0.1〜0.9である。)。
【0045】
尚、上記の他にはセレン化ニオブ(NbSe3)、有機ジスルフィド化合物、カーボンスルフィド化合物、硫黄、金属インジウム等が使用できる。
有機ジスルフィド化合物及びカーボンスルフィド化合物を以下に例示する。
【化1】

【0046】
式(A)〜(C)において、Xはそれぞれ置換基であり、n及びmはそれぞれ独立に1〜2の整数であり、p及びqはそれぞれ独立に1〜4の整数である。
式(D)において、Zはそれぞれ−S−又は−NH−であり、nは繰返数2〜300の整数である。
【0047】
【化2】

【0048】
固体電解質としては、上述した電解質層2で使用する固体電解質と同様なものが例示できる。
【0049】
導電助剤は導電性を有していればよい。導電助剤の導電率は、1×103S/cm以上が好ましく、より好ましくは1×105S/cm以上である。
導電助剤としては、炭素材料、金属粉末及び金属化合物から選択される物質や、これらの混合物が挙げられる。
導電助剤の具体例としては、炭素、ニッケル、銅、アルミニウム、インジウム、銀、コバルト、マグネシウム、リチウム、クロム、金、ルテニウム、白金、ベリリウム、イリジウム、モリブデン、ニオブ、オスニウム、ロジウム、タングステン及び亜鉛からなる群より選択される少なくとも1つの元素を含む物質が好ましい。より好ましくは、導電性が高い炭素単体、炭素、ニッケル、銅、銀、コバルト、マグネシウム、リチウム、ルテニウム、金、白金、ニオブ、オスニウム又はロジウムを含む金属単体、混合物又は化合物である。
炭素材料の具体例としては、ケッチェンブラック、アセチレンブラック、デンカブラック、サーマルブラック、チャンネルブラック等のカーボンブラック、黒鉛、炭素繊維、活性炭等が挙げられる。これらは単独でも2種以上でも併用可能である。
なかでも、電子伝導性が高いアセチレンブラック、デンカブラック、ケッチェンブラックが好適である。
【0050】
結着剤としては、ポリテトラフルオロエチレン(PTFE)、ポリフッ化ビニリデン(PVDF)、フッ素ゴム等の含フッ素樹脂、或いはポリプロピレン、ポリエチレン等の熱可塑性樹脂、エチレン−プロピレン−ジエンマー(EPDM)、スルホン化EPDM、天然ブチルゴム(NBR)等を単独で、あるいは2種以上の混合物として用いることができる。また、水系バインダーであるセルロース系やスチレンブタジエンゴム(SBR)の水分散体等を用いることもできる。
【0051】
正極層3の厚さは、0.01mm以上10mm以下であることが好ましい。
正極層3は、公知の方法により製造することができる。例えば、塗布法、静電法(静電スプレー法、静電スクリーン法等)により製造することができる。
【0052】
(4)集電体
本発明のリチウムイオン電池は、集電体を備えることが好ましい。
集電体として、銅、マグネシウム、ステンレス鋼、チタン、鉄、コバルト、ニッケル、亜鉛、アルミニウム、ゲルマニウム、インジウム、リチウム、又はこれらの合金等からなる板状体や箔状体等が使用できる。
【0053】
本発明のリチウムイオン電池は、上述した各部材を貼り合せ、接合することで製造できる。接合する方法としては、各部材を積層し、加圧・圧着する方法や、2つのロール間を通して加圧する方法(roll to roll)等がある。
また、接合面にイオン伝導性を有する活物質や、イオン伝導性を阻害しない接着物質を介して接合してもよい。
接合においては、固体電解質の結晶構造が変化しない範囲で加熱融着してもよい。
【0054】
[充放電制御システム]
充放電制御システムの第一の実施形態について説明する。
第一の充放電制御システム10は、図2に示すように、充電量測定手段11と、充電制御部12と、充電量閾値比較手段13と、充電指示手段14と、充電手段15とを備えている。
【0055】
充電量測定手段11は、リチウムイオン電池B1の充電量(又は、充電可能な電気量)を測定するための手段であり、公知の装置や回路を用いることができる。
充電制御部12のデータベース16は、シリコンの理論容量又は後述する充電可能容量のうち、少なくとも1つを収納している。
ここで、充電可能容量は、充電可能容量測定手段(図示せず)が測定したリチウムイオン電池B1の充電可能な容量である。
なお、リチウムイオン電池B1は、充放電を繰り返すと電気容量が少なくなるため、充電可能容量は、所定の充放電後に測定した値であってもよく、また、放電、充電または充放電毎に測定した値であってもよい。
【0056】
充電量閾値比較手段13は、充電量測定手段11により測定されたリチウムイオン電池B1の充電量(電池残量)と閾値とを比較し、充電量が閾値より高い場合には、充電指示手段14に充電の中断を指示するものである。
ここで、閾値は、データベース16に格納されたシリコンの理論容量又は充電可能容量に所定の数値を掛けた値である。
閾値は、リチウムイオン電池B1の寿命(充放電の回数、サイクル)により決めることができるが、例えば、シリコンの理論容量の50%、40%、30%、20%とすることができる。また、充電可能容量の60%、50%、25%とすることができる。
充電量に関する閾値については、後記の「充放電制御回路」にて説明する方法により測定した電気量で設定しても良く、あるいは、その電気量に対応する電圧値で設定しても良い。
【0057】
充電指示手段14は、充電手段15に対してリチウムイオン電池B1の充電を指示するものである。
ここで、充電指示手段14は、充電手段15に対してリチウムイオン電池B1の充電量が所定の閾値より高い又は同じと判断したため、充電を中止する指示を出した場合に、充電手段15に充電の中止を指示する。
なお、「充電量」とは、放電後に充電を開始した充電量をいい、リチウムイオン電池B1に充電されている充電量ではない。例えば、まったく充電されていないリチウムイオン電池B1を充電する場合には、放電後に充電を開始した充電量と、リチウムイオン電池B1に充電されている充電量とは、いずれも同じ値になるが、前者を「充電量」とする。また、放電後に充電されている電気量が10%のリチウムイオン電池B1を充電する場合には、充電後のリチウムイオン電池B1の電気量から理論容量の10%の電気量を引いた値が「充電量」となる。
【0058】
充電手段15は、リチウムイオン電池B1に充電するものであり、公知の充電装置や回路を含む。
なお、この第一の充放電制御システム10においては、充電量測定手段11と充電制御部12とを併せて「充電量制御手段」というものとする。
【0059】
充放電制御システムの第二の実施形態について説明する。
第二の充放電制御システム10’は、図3に示すように、電圧測定手段11’と、充電制御部12’と、電圧閾値比較手段13’と、充電指示手段14と、充電手段15とを備えている。
【0060】
電圧測定手段11’は、リチウムイオン電池B1の電圧を検出する。電圧を検出するための手段であり、公知の装置や回路を用いることができる。
充電制御部12’のデータベース16’は、シリコンの理論容量又は充電可能容量のうち、少なくとも1つに対応する電圧値を収納している。
シリコンの理論容量と充電可能容量は、前述した通りであるので、ここでの説明は、省略する。
【0061】
電圧閾値比較手段13’は、電圧測定手段11’により測定されたリチウムイオン電池B1の電圧と閾値(後述)とを比較し、電圧が閾値より高い場合には、充電指示手段14に充電の中断を指示するものである。
ここで、閾値は、データベース16’に格納された電圧値に所定の数値を掛けた値である。
閾値は、リチウムイオン電池B1の寿命(充放電の回数、サイクル)により決めることができるが、例えば、上記シリコンの理論容量の50%、40%、30%、20%となる容量に相当する電圧値とすることができる。また、上記充電可能容量の60%、50%、25%に相当する容量に対応する電圧とすることができる。
充電指示手段14は、第一の充放電制御システム10における充電指示手段14と同様の機能を有しているため、ここでの説明は省略する。
なお、この第二の充放電制御システム10’においては、電圧測定手段11’と充電制御部12’とを併せて「充電量制御手段」というものとする。
【0062】
[充放電制御回路]
充放電制御回路20は、二次電池(リチウムイオン電池)B2の充放電を行う回路であって、図4に示すように、電源部21と、負荷部22と、充電器30とを備えている。
二次電池B2は、[リチウムイオン電池]で説明したリチウムイオン電池Bと同様の構成を有している。
【0063】
電源部21は、充電器30の充電回路31(後述)を通して二次電池B2に供給される充電電圧及び充電電流の供給源である。
電源部21としては、例えば、燃料電池、太陽電池、またはエンジンに設けられた発電機などの電力供給手段を用いることができる。また、商用電源からACアダプタを介して電力を供給するものであってもよい。
なお、携帯型の充放電制御回路20は、二次電池B2から、負荷部22に電力を供給されることにより、駆動される。
【0064】
充電器30は、充電回路31と、電圧検出部32と、充電制御部33とを備えている。
充電回路31は、二次電池B2の充電を行う。
電圧検出部32は、二次電池B2の電圧を検出する。この電圧検出部32は、二つの電圧比較部321a及び321bと、切替手段322とを備えている。電圧検出部32には、充電制御部33において設定された第一閾値Xth1に対応する電圧Vth1(電圧323a)と、第二閾値Xth2に対応する電圧Vth2(電圧323b)の二つの閾値電圧が設定される。電圧検出部32は、これら閾値電圧を電圧基準として、二次電池B2の電圧を検出する。
なお、図4においては、電圧比較部を二つ備えた電圧検出部32を示しているが、電圧比較部は、二つに限るものではなく、一つであってもよい。この場合、閾値は一つのみ設定され、この閾値に対応する電圧Vthと二次電池B2の電圧が比較される。
【0065】
充電制御部33は、電圧検出部32で検出された二次電池B2の電圧と閾値を比較するとともに、その充電電圧が閾値より大きいと判断したときに、充電の中止を指示する信号を充電回路31に送信する。この信号を受信した充電回路31は、充電を中止する。また、充電電圧が閾値より小さいと判断したときは、充電の中止を指示する信号を充電回路31に送信しない(または、充電の継続を指示する信号を充電回路31に送信する)。これにより、充電回路31による二次電池B2への充電が継続される。
【0066】
この充電器30の機能について、さらに説明する。
上述したように、二次電池B2は、電源部21から充電回路31を通して供給される電力により充電される。
本発明においては、二次電池B2に含まれるケイ素へ充電電気量(リチウム挿入量)が所望の電気量となるように充電される。
このような二次電池B2の充電は、充電制御部33からの出力に基づいて、充電回路31が制御している。充電制御部33には、少なくとも1つの所望の充電電気量が、閾値電気量として予め設定されている。
充電されている二次電池B2に含まれるケイ素負極への充電電気量は、例えば、充電されている二次電池B2への電流値と積算時間に基づいて、充電制御部33において計算される。本実施形態において、充電されている二次電池B2への充電電流は、二次電池B2の正極側に設置された電流検出部23により測定される。
【0067】
また、上記充電電気量は、その二次電池B2の充電とともに増加し、また充電電気量の増加とともに、二次電池B2に並列に接続された電圧検出部32で検出される電圧も上昇し、電圧検出部32で検出された電圧と充電電気量の間には所定の関係があるため、二次電池B2の電圧から充電電流量および二次電池B2の温度を測定する温度計測手段24からの出力を考慮して、充電電気量を計算することもできる。これは、Liのモル比の値がxである場合の電池電圧は、二次電池B2の温度及び/又は充電電流によって変化する可能性があるためである。
なお、閾値電気量に対応するVth(Vth1、Vth2)の範囲は、二次電池B2への充電電流、二次電池B2の温度、二次電池B2のインピーダンスなどの変化を考慮し、その充電電気量に対応して決定される電圧の±10%から20%の範囲であることが好ましく、その上限を+0%とし、その下限を−10%とした場合が最も好ましい。
【0068】
二次電池B2に接続された電圧検出部32は、上記閾値電気量における二次電池B2の電圧Vthを閾値電圧とし、これを電圧基準として用いて、充電されている二次電池B2の電圧を検出する。ここで、閾値電圧とは、二次電池B2の負極1に含まれるケイ素の充電電気量が、所定の閾値電気量であるときの、前記二次電池B2の電圧Vthをいう。
充電制御部33においては、図4に示すように、計算された電気量と、予め設定された閾値電気量とが比較され、その計算された電気量が設定されている閾値電気量を超えた場合、充電制御部33から出力された信号に基づいて、充電回路31が、二次電池B2の充電を中止する。
計算された電気量が、設定されている閾値を超えない場合には、充電制御部33から出力された信号に基づいて、充電回路31により、二次電池B2の充電が継続される。
一方、電圧を元に充電制御を行う場合は、充電制御部33においては、計算された電圧と、予め設定された閾値電圧とが比較され、その計算された電圧が設定されている閾値電圧を超えた場合、充電制御部33から出力された信号に基づいて、充電回路31が、二次電池B2の充電を中止する。
計算された電圧が、設定されている閾値を超えない場合には、充電制御部33から出力された信号に基づいて、充電回路31により、二次電池B2の充電が継続される。
【0069】
なお、充電回路31による二次電池B2の充電は、定電流充電、または定電流充電と定電圧充電との組み合わせ等によって行うことができる。本発明においては、充電されている二次電池B2への充電電流を電流検出部23の検出結果に基づいて求め、その電流検出部23からの出力に基づいて、充電制御部33において、ケイ素への充電電気量を求めている。よって、基本的に、二次電池B2の充電は、定電流充電により行うことができる。
また、定電流充電と定電圧充電とを組み合わせても、二次電池B2の充電を行うこともできる。この場合、まず、定電流充電により、二次電池B2に含まれるケイ素への充電電気量が、所望の電気量に近い値にまで充電し、次いで、定電圧充電により、その所望の電気量となるように充電される。
【0070】
なお、充放電制御回路20の電圧検出部32、充電制御部33、充電回路31は、それぞれ充放電制御システム10の充電量測定手段11、充電制御部12、充電手段15に相当するため、充放電制御回路20の上記構成を充放電制御システム10の一部として含めることができる。
また、電圧検出部32の代わりに、二次電池B2の充電量を測定し、所定の閾値と比較し、充電量が所定の閾値より高い場合に充電の中止を指示する充電制御部であってもよい。
この充電制御部12は、第一の充放電制御システム10における充電制御部12と同様の機能を有しているため、その説明を省略する。
【0071】
[リチウムイオン電池の充電方法]
ここでは、リチウムイオン電池の充電方法として、充放電制御システム10の動作手順を例にして、図5を参照して説明する。
充電制御部12のデータベース16には、閾値が予め記憶されている(ステップ10)。ここで、リチウムイオン電池の充電量を、そのリチウムイオン電池の負極1に用いられるシリコンの理論容量の50%以下又は充電可能容量の60%以下となるように、この値を閾値として設定しておく。好ましくは、理論容量の45%以下又は充電可能容量の50%以下にするのがよい。
シリコンの理論容量の50%を超える場合又は充電可能容量の60%を超えるとサイクル特性が劣化する。
【0072】
ここで、理論容量とは、1モルのシリコンに4.4モルのLiが挿入できた際の容量で、4200mAh/gである。
充電可能容量とは、充電時の条件と同一の条件で初めに充電したときに充電できる容量を指す。
例えば、初めに0.2Cレートで充電したときに3000mAh/g充電できたとすると、0.2Cレートで充電する際の充電可能容量は3000mAh/gとなる。
また、初めに0.1Cレートで充電したときに3300mAh/g充電できたとすると、0.1Cレートで充電する際の充電可能容量は3300mAh/gとなる。
【0073】
充電手段15が、リチウムイオン電池B1に対して充電を開始すると(ステップ11)、充電量測定手段11がリチウムイオン電池B1の充電量を測定する(充電量の測定、ステップ12)。
充電量閾値比較手段13は、充電量測定手段11での充電量の測定値とデータベース16に記憶されている閾値とを比較する(ステップ13)。
比較の結果、充電量の測定値が閾値未満であるときは、充電手段15によるリチウムイオン電池B1への充電を継続するとともに、充電量測定手段11による充電量の測定を継続する。
一方、充電量の測定値が閾値以上であるときは、充電量閾値比較手段13は、充電指示手段14に対して、充電の中止を指示する信号を送信する。この信号を受信した充電指示手段14は、その充電の中止を指示する信号を充電手段15に送信して充電を中止させる(ステップ14)。
【0074】
このリチウムイオン電池の充電方法を実行することにより、リチウムイオン電池の充放電を繰り返し行っても、サイクル特性が劣化することがない。
なお、ここでは、充放電制御システム10の動作手順について説明したが、第二の充放電制御システム10’又は充放電回路20の動作手順も同様である。
また、充放電制御システム10の各構成の詳細や閾値の設定の仕方などについては、[充放電制御システム]にて既に説明したので、ここでの説明は省略する。
【実施例】
【0075】
以下、具体的な実施例を挙げて、本発明をより詳細に説明する。
【0076】
[製造例]
A.硫化リチウムの製造
(1)NMP法
硫化リチウムの製造及び精製は、国際公開公報WO2005/040039A1の実施例と同様に行った。
具体的には、下記のように行った。
(a)硫化リチウム(Li2S)の製造
硫化リチウムは、特開平7−330312号公報の第1の態様(2工程法)の方法に従って製造した。具体的には、攪拌翼のついた10リットルオートクレーブにN−メチル−2−ピロリドン(NMP)3326.4g(33.6モル)及び水酸化リチウム287.4g(12モル)を仕込み、300rpm、130℃に昇温した。昇温後、液中に硫化水素を3リットル/分の供給速度で2時間吹き込んだ。
続いて、この反応液を窒素気流下(200cc/分)昇温し、反応した硫化水素の一部を脱硫化水素化した。昇温するにつれ、上記硫化水素と水酸化リチウムの反応による副生した水が蒸発を始めたが、この水はコンデンサにより凝縮し系外に抜き出した。水を系外に留去すると共に反応液の温度は上昇するが、180℃に達した時点で昇温を中止し、一定温度に保持した。脱硫化水素反応が終了後(約80分)反応を終了し、硫化リチウムを得た。
【0077】
(2)硫化リチウムの精製
上記(1)で得られた500mLのスラリー反応溶液(NMP−硫化リチウムスラリー)中のNMPをデカンテーションした後、脱水したNMP100mLを加え、105℃で約1時間攪拌した。その温度のままNMPをデカンテーションした。さらにNMP100mLを加え、105℃で約1時間攪拌し、その温度のままNMPをデカンテーションし、同様の操作を合計4回繰り返した。デカンテーション終了後、窒素気流下230℃(NMPの沸点以上の温度)で硫化リチウムを常圧下で3時間乾燥した。得られた硫化リチウム中の不純物含有量を測定した。
なお、亜硫酸リチウム(Li2SO3)、硫酸リチウム(Li2SO4)、並びにチオ硫酸リチウム(Li2S2O3)の各硫黄酸化物、及び、N−メチルアミノ酪酸リチウム(LMAB)の含有量は、イオンクロマトグラフ法により定量した。その結果、硫黄酸化物の総含有量は0.13質量%であり、LMABは0.07質量%であった。
なお、以下の固体電解質の製造では精製した硫化リチウムを用いた。
【0078】
B.固体電解質の製造
「A.硫化リチウムの製造」に記載した内容で製造した硫化リチウム(精製した硫化リチウム)を用いて、国際公開公報WO07/066539の実施例1と同様の方法で固体電解質の製造及び結晶化を行った。
具体的には、下記のように行った。
【0079】
「A.硫化リチウムの製造」に記載した内容で製造した硫化リチウム(精製した硫化リチウム)0.6508g(0.01417mol)と五硫化二燐(アルドリッチ社製)を1.3492g(0.00607mol)をよく混合した。そして、この混合した粉末と直径10mmのジルコニア製ボール10個と遊星型ボールミル(フリッチュ社製:型番P−7)をアルミナ製ポットに投入し完全密閉するとともに、このアルミナ製ポット内に窒素を充填し、窒素雰囲気にした。
そして、はじめの数分間は、遊星型ボールミルの回転を低速回転(85rpm)にして硫化リチウムと五硫化二燐を十分混合した。その後、徐々に遊星型ボールミルの回転数を上げ370rpmまで回転数を上げた。遊星型ボールミルの回転数を370rpmで20時間メカニカルミリングを行った。このメカニカルミリング処理をした白黄色の粉体をX線測定により評価した結果、ガラス化(硫化物ガラス)していることが確認できた。この硫化物ガラスのガラス転移温度をDSC(示差走査熱量測定)により測定したところ、220℃であった。
この硫化物ガラスを窒素雰囲気下、300℃で2時間加熱した。
得られた硫化物ガラスセラミックスについて、X線回折測定したところ、2θ=17.8、18.2、19.8、21.8、23.8、25.9、29.5、30.0degにピークが観測された。
硫化物ガラスは、粒子状であり、平均粒径は190μmであった。なお、測定方法は、詳細な説明に記載した方法を用いた。
【0080】
C.リチウムイオン電池の製造
電解質60mgを直径10mmのプラスチック製の円筒に投入し加圧成型した。平均粒径5μmのシリコン粒子と固体電解質を重量比で7:3になるように混ぜ合わせた上で上記電解質成型体の上に投入し再び加圧しシリコン負極合材層を形成した。シリコン負極合材層とは、電解質層2を挟んで反対側にインジウム箔(レアメタリック製厚さ0.1mm、10mmφ)およびリチウム箔(本庄金属製、厚さ0.1mm、9mmφ)を1枚ずつ交互に投入し張り合わせた上でチタン箔を貼り付け電池を作製した。このようにして作製したハーフセルの充電可能容量を0.2Cレートで定電流定電圧充電を行ったところ、最大3000mAh/gであったため、3000mAh/gを充電可能容量とした。
【0081】
[実施例1]
上記ハーフセルで0.2Cレートでシリコン合材層に放電(シリコンへのリチウム挿入)を行い、シリコン重量当たりの電気量が750mAh/g(理論容量の18%、充電可能容量の25%)となった時点で放電を終了した。1時間休止後0.2Cレートで充電(シリコンからのリチウム脱離)を行い0.9Vになった時点で充電を終了し、1時間休止した。上記充放電を容量の低下が見られるまで繰り返し行った。
【0082】
[実施例2]
放電時の終了条件を電気量が1500mAh/g(理論容量の36%、充電可能容量の50%)とした以外は、実施例1と同様に充放電を行った。
【0083】
[比較例1]
放電時の終了条件を電気量が2250mAh/g(理論容量の54%、充電可能容量の75%)とした以外は、実施例1と同様に充放電を行った。
【0084】
[比較例2]
放電時の終了条件を定電流充電で電圧−0.61V後、さらに、0.61Vで電流値が0.01C相当に低下するまで定電圧充電を行うこととした以外は、実施例1と同様に充放電を行った。
【0085】
これら実施例1、実施例2、比較例1、比較例2のそれぞれにおける初期容量の維持率を、図6に示す。
同図に示すように、比較例1及び比較例2と実施例1及び実施例2とを比較した場合には、後者の方が、サイクル特性が改善されていることがわかる。すなわち、負極1にシリコンを用いた全固体リチウム電池は、充放電を繰り返し行った場合でも、サイクル特性が劣化しないことが同図に示す測定結果からわかった。
【0086】
以上説明したように、本実施形態のリチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム及びリチウムイオン電池の充放電制御回路によれば、負極にシリコンを用いた全固体リチウム電池の充放電を繰り返し行っても、サイクル特性が劣化しないようにすることができる。
【産業上の利用可能性】
【0087】
本発明のリチウムイオン電池の充電方法、充放電制御システム、充放電制御回路は、リチウムイオン電池を充電する装置や機器に利用できる。また、本発明に係るリチウムイオン電池は、携帯情報端末、携帯電子機器、家庭用小型電力貯蔵装置、モーターを電圧源とする自動二輪車、電気自動車、ハイブリッド電気自動車等の電池として用いることができる。
【符号の説明】
【0088】
1 負極層(負極)
2 固体電解質層
3 正極層(正極)
10 第一の充放電制御システム
11 充電量測定手段
12 充電制御部
13 充電量閾値比較手段
14 充電指示手段
15 充電手段
16 データベース
10’ 第二の充放電制御システム
11’ 電圧測定手段
12’ 充電制御部
13’ 電圧閾値比較手段
16’ データベース
20 充放電制御回路
21 電源部
22 負荷部
23 電流検出部
24 温度計測手段
30 充電器
31 充電回路
32 電圧検出部
33 充電制御部
B、B1、B2 リチウムイオン電池(二次電池)
【技術分野】
【0001】
本発明は、リチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム、及び、リチウムイオン電池の充放電制御回路に関する。
【背景技術】
【0002】
現行のリチウムイオン電池には、電解質として有機系電解液が主に用いられている。有機系電解液は、高いイオン伝導度を示すものの、電解液が液体でかつ可燃性であることから、電池として用いた場合、漏洩、発火等の危険性が懸念されている。従って、次世代リチウムイオン電池用電解質として、より安全性の高い固体電解質の開発が期待されている。
【0003】
かかる課題を解決するために、イオウ元素、リチウム元素及びリン元素を主成分として含有する硫化物系固体電解質が開発され、この硫化物系固体電解質を用いた電池として全固体リチウム電池が開発された(例えば、特許文献1参照。)。
しかしながら、全固体リチウム電池に用いられている負極は、カーボンが多く、電気容量が小さいという欠点があった。
【0004】
かかる欠点を解消するため、負極にシリコンを用いる方法がある。
しかしながら、負極にシリコンを用いた全固体リチウム電池では、充放電を繰り返すと電気容量が小さくなるという欠点がある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2011−129316号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、負極にシリコンを用いた全固体リチウム電池の充放電を繰り返しても、サイクル特性が劣化しないリチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム及びリチウムイオン電池の充放電制御回路を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充電方法であって、充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とするリチウムイオン電池の充電方法が提供される。
【0008】
また、本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御システムであって、リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する充電量制御手段を備えるリチウムイオン電池の充放電制御システムが提供される。
【0009】
また、本発明によれば、シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御回路であって、リチウムイオン電池に対して充電を行う充電回路と、リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する信号を充電回路に送信する充電量制御手段と、を備えるリチウムイオン電池の充放電制御回路が提供される。
【発明の効果】
【0010】
負極にシリコンを用いた全固体リチウム電池の充放電を繰り返し行っても、サイクル特性が劣化しない充電方法及び充電システムを得ることができる。
【図面の簡単な説明】
【0011】
【図1】リチウムイオン電池の構成を示すブロック図である。
【図2】リチウムイオン電池の充放電制御システムの構成を示すブロック図である。
【図3】リチウムイオン電池の充放電制御システムの他の構成を示すブロック図である。
【図4】リチウムイオン電池の充放電制御回路の構成を示すブロック図である。
【図5】充放電制御システムの動作を示すフローチャートである。
【図6】実施例1,2及び比較例1,2における初期容量の維持率を示すグラフである。
【発明を実施するための形態】
【0012】
[リチウムイオン電池]
本発明のリチウムイオン電池は、図1に示すように、シリコン負極1と、電解質層2と、正極層3とを備える。
【0013】
(1)負極
負極1は、シリコンを含む。
ここで、負極1は、シリコン薄膜である場合とシリコン粒子を含む場合に分けることができる。
【0014】
(a)シリコン薄膜
シリコン薄膜の厚さは、特に制限しないが、充放電を繰り返すとサイクル特定が劣化する膜厚である。
例えば、シリコン薄膜の厚さは、50nm以上であることが望ましい。
より好ましくは、100nm以上であり、さらに好ましくは、200nm以上であり、最も好ましくは、300nm以上である。
これは、シリコン薄膜の厚さが厚くなるほど電気容量を高くすることができるからである。
【0015】
(b)シリコン粒子
シリコン粒子の大きさは、特に制限しないが、充放電を繰り返すとサイクル特定が劣化する粒径である。
例えば、シリコン粒子の粒径は、50nm以上であることが望ましい。
より好ましくは、100nm以上であり、さらに好ましくは、200nm以上であり、最も好ましくは、300nm以上である。
粒径が小さいと一次粒子が凝集してしまい、負極を塗布などにより製造すると均一な厚さの負極ができないおそれがある。また、一次粒子の粒径を小さくするためにはシリコン粒子を粉砕する必要があるが、粒径の小さい一次粒子を製造することは困難な場合がある。
負極1は、シリコン粒子以外に、導電助剤(例えば、カーボンなど)、下記する固体電解質粒子を含んでいても良い。固体電解質の形状は問わず、粒子状であってもよく、シリコン粒子に融着していてもよい。
導電助剤と固体電解質を含むと充放電密度を高くすることができる。
【0016】
(c)シリコンの種類
シリコンの種類としては、非晶質シリコン、微結晶シリコン、多結晶シリコン、単結晶シリコンなどがある。
ただし、シリコンの種類としては、特にそれらに限定されるものではなく、高純度のシリコンでも良く、P,As,B,Alなどやその他の不純物を含んでいても良い。また、シリコン粒子の性状としては、多結晶又は単結晶性のものでも良く、非晶質でも良く、またはこれらの混合物であっても良い。また、形状は、球状、ワイヤー状、鱗片状など、どのような形態であっても良い。
【0017】
(2)電解質層
電解質層2は、固体電解質を含む。固体電解質としては、無機固体電解質とポリマー電解質がある。無機固体電解質は、ポリマー電解質と比較して有機物を含まないため安全性が高く、イオン伝導度も高いため、無機固体電解質が好ましい。
【0018】
より好ましくは、硫化物系固体電解質である。硫化物系固体電解質は、イオン伝導度が他の無機化合物より高いことが知られている。例えば、特開平4−202024等に記載の無機固体電解質を使用できる。具体的には、Li2SとSiS2、GeS2、P2S5、B2S3の組合せから成る無機固体電解質に、適宜、Li3PO4やハロゲン、ハロゲン化合物を添加した無機固体電解質を用いることができる。硫化物系固体電解質はさらに難燃処理を施したものでもよい。
【0019】
本発明では、下記(式1)に示す組成を満たすリチウムイオン伝導性無機固体電解質が好ましい。
LiaMbPcSd (式1)
(式1)において、Mは、B、Zn、Si、Cu、Ga又はGeから選択される元素を示す。
a〜dは各元素の組成比(モル比)を示し、a:b:c:dは1〜12:0〜0.2:1:2〜9を満たす。
好ましくは、bは0であり、より好ましくは、a、c及びdの比(a:c:d)がa:c:d=1〜9:1:3〜7、さらに好ましくは、a:c:d=1.5〜4:1:3.25〜4.5である。
各元素の組成比は、固体電解質を製造する際の原料化合物の配合量を調整することにより制御できる。
【0020】
硫化物系固体電解質は、非結晶(ガラス化)であっても結晶化(ガラスセラミックス化)していてもよく、一部のみ結晶化していてもよい。
ここで、結晶化させるとガラスよりもイオン伝導度が高くなる場合があり、その場合には結晶化させることが好ましい。
【0021】
結晶構造として、例えば、特開2002−109955に開示されているLi7PS6構造、Li4P2S6構造、Li3PS4構造、Li4SiS4構造、Li2SiS3構造、特開2005−228570やWO2007/066539に開示されているLi7P3S11構造が好ましい。
ここで、Li7P3S11構造は、X線回折(CuKα:λ=1.5418Å)において、2θ=17.8±0.3deg,18.2±0.3deg,19.8±0.3deg,21.8±0.3deg,23.8±0.3deg,25.9±0.3deg,29.5±0.3deg,30.0±0.3degに回折ピークを有する。
上記結晶構造であれば、非晶体よりイオン伝導度が高くなるからである。
【0022】
硫化物系固体電解質の結晶化された部分は、1つの結晶構造のみからなっていてもよく、複数の結晶構造を有していてもよい。尚、結晶化方法については後述する。
【0023】
硫化物系固体電解質の結晶化度(非晶体よりイオン伝導度が高い結晶構造の結晶化度)は、50%以上が好ましく、より好ましくは、60%以上である。
硫化物系固体電解質の結晶化度が50%未満の場合は、結晶化によりイオン伝導度を高くするという効果が少なくなるためである。
結晶化度は、NMRスペクトル装置を用いることにより測定できる。具体的には、硫化物系固体電解質の固体31P−NMRスペクトルを測定し、得られたスペクトルについて、70−120ppmに観測される共鳴線を、非線形最少二乗法を用いたガウス曲線に分離し、各曲線の面積比を求めることにより測定できる。
【0024】
硫化物系固体電解質の製造方法について、硫化物系固体電解質の原料は、Li2S(硫化リチウム)、P2S3(三硫化二リン)、P2S5(五硫化二リン)、SiS2(硫化珪素)、Li4SiO4(オルト珪酸リチウム)、Al2S3(硫化アルミニウム)、単体リン(P)、単体の硫黄(S)、シリコン(Si)、GeS2(硫化ゲルマニウム)、B2S3(三硫化二砒素)、Li3PO4(燐酸リチウム)、Li4GeO4(ゲルマン酸リチウム)、LiBO2(メタホウ酸リチウム)、LiAlO3(リチウムアルミネート)等を用いることができる。
好ましい硫化物系固体電解質の原料は、Li2S(硫化リチウム)、P2S5(五硫化二リン)である。
以下、硫化物系固体電解質の原料として、Li2S(硫化リチウム)、P2S5(五硫化二リン)を用いた硫化物系固体電解質について説明する。
【0025】
硫化リチウムは、特に制限なく工業的に入手可能なものが使用できるが、高純度のものが好ましい。
硫化リチウムは、例えば、特開平7−330312号、特開平9−283156号、特開2010−163356、特願2009−238952に記載の方法により製造することができる。
例えば、特開2010−163356では、炭化水素系有機溶媒中で水酸化リチウムと硫化水素とを70℃〜300℃で反応させて、水硫化リチウムを生成し、次いでこの反応液を脱硫化水素化することにより硫化リチウムを合成する。
また、特願2009−238952では、水溶媒中で水酸化リチウムと硫化水素とを10℃〜100℃で反応させて、水硫化リチウムを生成し、次いでこの反応液を脱硫化水素化することにより硫化リチウムを合成する。
【0026】
硫化リチウムは、硫黄酸化物のリチウム塩の総含有量が0.15質量%以下であることが好ましく、より好ましくは0.1質量%以下であり、かつN−メチルアミノ酪酸リチウムの含有量が0.15質量%以下であることが好ましく、より好ましくは0.1質量%以下である。硫黄酸化物のリチウム塩の総含有量が0.15質量%以下であると、溶融急冷法やメカニカルミリング法で得られる固体電解質は、ガラス状電解質(完全非晶質)となる。一方、硫黄酸化物のリチウム塩の総含有量が0.15質量%を越えると、得られる電解質は、最初から結晶化物となるおそれがあり、この結晶化物のイオン伝導度は低い。さらに、この結晶化物について熱処理を施しても結晶化物には変化がなく、高イオン伝導度の硫化物系固体電解質を得ることができないおそれがある。
また、N−メチルアミノ酪酸リチウムの含有量が0.15質量%以下であると、N−メチルアミノ酪酸リチウムの劣化物がリチウムイオン電池のサイクル性能を低下させることがない。このように不純物が低減された硫化リチウムを用いると、高イオン伝導性電解質が得られる。
【0027】
尚、特開平7−330312号及び特開平9−283156号に記載の硫化リチウムは、硫黄酸化物のリチウム塩等を含むため、精製することが好ましい。
一方、特開2010−163356に記載の硫化リチウムの製法で製造した硫化リチウムは、硫黄酸化物のリチウム塩等の含有量が非常に少ないため、精製せずに硫化物系固体電解質の製造に用いても良い。
好ましい精製法としては、例えば、国際公開WO2005/40039号に記載された精製法等が挙げられる。具体的には、上記のようにして得られた硫化リチウムを、有機溶媒を用い、100℃以上の温度で洗浄する。
【0028】
五硫化二リン(P2S5)は、工業的に製造され、販売されているものであれば、特に限定なく使用することができる。
【0029】
硫化リチウムと五硫化二リンの割合(モル比)は、通常50:50〜80:20、好ましくは60:40〜75:25である。
特に好ましくは、Li2S:P2S5=68:32〜74:26(モル比)である。
【0030】
硫化物系ガラス固体電解質の製造方法としては、溶融急冷法、メカニカルミリング法(MM法)、有機溶媒中で原料を反応させるスラリー法等がある。
(a)溶融急冷法
溶融急冷法は、例えば、特開平6−279049、WO2005/119706に記載されている。
具体的には、P2S5とLi2Sを所定量乳鉢にて混合しペレット状にしたものを、カーボンコートした石英管中に入れ真空封入する。所定の反応温度で反応させた後、氷中に投入し急冷することにより、硫化物系ガラス固体電解質が得られる。
反応温度は、好ましくは400℃〜1000℃、より好ましくは、800℃〜900℃である。
反応時間は、好ましくは0.1時間〜12時間、より好ましくは、1〜12時間である。
上記反応物の急冷温度は、通常10℃以下、好ましくは0℃以下であり、その冷却速度は、通常1〜10000K/sec程度、好ましくは10〜10000K/secである。
【0031】
(b)メカニカルミリング法
メカニカルミリング法は、例えば、特開平11−134937、特開2004−348972、特開2004−348973に記載されている。
具体的には、P2S5とLi2Sを所定量乳鉢にて混合し、例えば、各種ボールミル等を使用して所定時間反応させることにより、硫化物系ガラス固体電解質が得られる。
上記原料を用いたMM法は、室温で反応を行うことができる。MM法によれば、室温でガラス固体電解質を製造できるため、原料の熱分解が起らず、仕込み組成のガラス固体電解質を得ることができるという利点がある。
また、MM法では、ガラス固体電解質の製造と同時に、ガラス固体電解質を微粉末化できるという利点もある。
MM法は回転ボールミル、転動ボールミル、振動ボールミル、遊星ボールミル等種々の形式を用いることができる。
MM法の条件としては、例えば、遊星型ボールミル機を使用した場合、回転速度を数十〜数百回転/分とし、0.5時間〜100時間処理すればよい。
また、特開2010−90003に記載されているように、ボールミルのボールは異なる径のボールを混合して使用してもよい。
また、特開2009−110920や特開2009−211950に記載されているように、原料に有機溶媒を添加してスラリー状にし、このスラリーをメカニカルミリング処理してもよい。
また、特開2010−30889に記載のようにメカニカルミリング処理の際のミル内の温度を調整してもよい。
メカニカルミリングの際に原料が60℃以上160℃以下になるようにすることが好ましい。
【0032】
(c)スラリー法
スラリー法は、WO2004/093099、WO2009/047977に記載されている。
具体的には、所定量のP2S5粒子とLi2S粒子を有機溶媒中で所定時間反応させることにより、硫化物系ガラス固体電解質が得られる。
ここで、特開2010−140893に記載されているように、反応を進行させるため、原料を含むスラリーをビーズミルと反応容器との間で循環させながら反応させてもよい。
また、WO2009/047977に記載されているように、原料の硫化リチウムを予め粉砕しておくと効率的に反応を進行させることができる。
また、特願2010−270191に記載されているように、原料の硫化リチウムの比表面積を大きくするために溶解パラメーターが9.0以上の極性溶媒(例えば、メタノール、ジエチルカーネート、アセトニトリル)に所定時間浸漬してもよい。
【0033】
反応温度は、好ましくは20℃以上80℃以下、より好ましくは、20℃以上60℃以下である。
反応時間は、好ましくは1時間以上16時間以下、より好ましくは、2時間以上14時間以下である。
原料である硫化リチウムと五硫化二りんが、有機溶媒の添加により溶液又はスラリー状になる程度であることが好ましい。通常、有機溶媒1リットルに対する原料(合計量)の添加量は0.001kg以上1kg以下程度となる。好ましくは0.005kg以上0.5kg以下、特に好ましくは0.01kg以上〜0.3kgである。
【0034】
有機溶媒としては特に制限はないが、非プロトン性有機溶媒が特に好ましい。
非プロトン性有機溶媒としては、非プロトン性有機溶媒(例えば、炭化水素系有機溶媒)、非プロトン性の極性有機化合物(たとえば、アミド化合物,ラクタム化合物,尿素化合物,有機イオウ化合物,
環式有機リン化合物等)を、単独溶媒として、又は、混合溶媒として、好適に使用することができる。
炭化水素系有機溶媒としては、溶媒である炭化水素系溶媒としては、飽和炭化水素、不飽和炭化水素又は芳香族炭化水素が使用できる。
飽和炭化水素としては、ヘキサン、ペンタン、2−エチルヘキサン、ヘプタン、デカン、シクロヘキサン等が挙げられる。
不飽和炭化水素しては、ヘキセン、ヘプテン、シクロヘキセン等が挙げられる。
芳香族炭化水素としては、トルエン、キシレン、デカリン、1,2,3,4−テトラヒドロナフタレン等が挙げられる。
これらのうち、特にトルエン、キシレンが好ましい。
【0035】
炭化水素系溶媒は、あらかじめ脱水されていることが好ましい。具体的には、水分含有量として100重量ppm以下が好ましく、特に30重量ppm以下であることが好ましい。
尚、必要に応じて炭化水素系溶媒に他の溶媒を添加してもよい。具体的には、アセトン、メチルエチルケトン等のケトン類、テトラヒドロフラン等のエーテル類、エタノール、ブタノール等のアルコール類、酢酸エチル等のエステル類等、ジクロロメタン、クロロベンゼン等のハロゲン化炭化水素等が挙げられる。
【0036】
上記溶融急冷法、MM法及びスラリー法の温度条件、処理時間、仕込み料等の製造条件は、使用設備等に合わせて適宜調整することができる。
【0037】
硫化物系固体電解質(ガラスセラミックス)の製造方法は、特開2005−228570、WO2007/066539、特開2002−109955に開示されている。
具体的には、上記で得られた硫化物系固体電解質(ガラス)を所定の温度で熱処理し、硫化物系結晶化ガラス(ガラスセラミックス)固体電解質を生成させる。
また、加熱は、露点−40℃以下の環境下で行うことが好ましく、より好ましくは露点−60℃以下の環境下で行うことが好ましい。
また、加熱時の圧力は、常圧であってもよく、減圧下であってもよい。
また、雰囲気は、空気であってもよく、不活性雰囲気下であってもよい。
さらに特開2010−186744に記載されているように溶媒中で加熱してもよい。
【0038】
例えば、Li7P3S11構造のガラスセラミックスを生成させる熱処理温度は、好ましくは180℃以上330℃以下、より好ましくは、200℃以上320℃以下、特に好ましくは、210℃以上310℃以下である。180℃より低いと結晶化度の高い結晶化ガラスが得られにくい場合があり、330℃より高いと結晶化度の低い結晶化ガラスが生じるおそれがある。
熱処理時間は、180℃以上210℃以下の温度の場合は、3時間以上240時間以下が好ましく、特に4時間以上230時間以下が好ましい。また、210℃より高く330℃以下の温度の場合は、0.1時間以上240時間以下が好ましく、特に0.2時間以上235時間以下が好ましく、さらに、0.3時間以上230時間以下が好ましい。
熱処理時間が0.1時間より短いと、結晶化度の高い結晶化ガラスが得られにくい場合があり、240時間より長いと、結晶化度の低い結晶化ガラスが生じるおそれがある。
【0039】
また、Li7PS6結晶構造、Li4P2S6結晶構造、Li3PS4結晶構造、Li4SiS4結晶構造及びLi2SiS3結晶構造を形成するための加熱条件については、例えば、特開2002−109955に開示されている方法により上記結晶構造を有する結晶化ガラスを製造することができる。
【0040】
硫化物系固体電解質の平均粒径は、0.01μm以上1000μm以下が好ましく、より好ましくは、0.01μm以上100μm以下である。
平均粒径の測定は、レーザー回折式粒度分布測定方法により行うことが好ましい。
【0041】
本発明のリチウムイオン電池は、上述したシリコン薄膜を有する負極1と、固体電解質を含む電解質層2を有していればよく、他の構成部材はリチウムイオン電池で公知の材料及び構成を採用できる。通常、リチウムイオン電池は、正極3と負極1の間に電解質層2を有する。
【0042】
(3)正極層
正極層3は、正極活物質、固体電解質及び導電助剤を含む。
正極活物質としては、リチウムイオンの挿入脱離が可能な物質、電池分野において正極活物質として公知のものが使用できる。
例えば、V2O5、LiCoO2、LiNiO2、LiMnO2、LiMn2O4、Li(NiaCobMnc)O2(ここで、0<a<1、0<b<1、0<c<1、a+b+c=1)、LiNi1−YCoYO2、LiCo1−YMnYO2、LiNi1−YMnYO2(ここで、0≦Y<1)、Li(NiaCobMnc)O4(0<a<2、0<b<2、0<c<2、a+b+c=2)、LiMn2−ZNiZO4、LiMn2−ZCoZO4(ここで、0<Z<2)、LiCoPO4、LiFePO4が挙げられる。
正極材としては、電池分野において正極活物質として使用されているものが使用できる。例えば、硫化物系では、硫化チタン(TiS2)、硫化モリブデン(MoS2)、硫化鉄(FeS、FeS2)、硫化銅(CuS)及び硫化ニッケル(Ni3S2)等が使用できる。好ましくは、TiS2が使用できる。
【0043】
また、酸化物系では、酸化ビスマス(Bi2O3)、鉛酸ビスマス(Bi2Pb2O5)、酸化銅(CuO)、酸化バナジウム(V6O13)、コバルト酸リチウム(LiCoO2)、ニッケル酸リチウム(LiNiO2)、マンガン酸リチウム(LiMnO2)等が使用できる。尚、これらを混合して用いることも可能である。好ましくは、コバルト酸リチウムが使用できる。
【0044】
また、LixCoO2,LixNiO2,LixMn2O4,LixFePO4,LixCoPO4,LixMn1/3Ni1/3Co1/3O2,LixMn1.5Ni0.5O2等も使用できる(Xは0.1〜0.9である。)。
【0045】
尚、上記の他にはセレン化ニオブ(NbSe3)、有機ジスルフィド化合物、カーボンスルフィド化合物、硫黄、金属インジウム等が使用できる。
有機ジスルフィド化合物及びカーボンスルフィド化合物を以下に例示する。
【化1】

【0046】
式(A)〜(C)において、Xはそれぞれ置換基であり、n及びmはそれぞれ独立に1〜2の整数であり、p及びqはそれぞれ独立に1〜4の整数である。
式(D)において、Zはそれぞれ−S−又は−NH−であり、nは繰返数2〜300の整数である。
【0047】
【化2】

【0048】
固体電解質としては、上述した電解質層2で使用する固体電解質と同様なものが例示できる。
【0049】
導電助剤は導電性を有していればよい。導電助剤の導電率は、1×103S/cm以上が好ましく、より好ましくは1×105S/cm以上である。
導電助剤としては、炭素材料、金属粉末及び金属化合物から選択される物質や、これらの混合物が挙げられる。
導電助剤の具体例としては、炭素、ニッケル、銅、アルミニウム、インジウム、銀、コバルト、マグネシウム、リチウム、クロム、金、ルテニウム、白金、ベリリウム、イリジウム、モリブデン、ニオブ、オスニウム、ロジウム、タングステン及び亜鉛からなる群より選択される少なくとも1つの元素を含む物質が好ましい。より好ましくは、導電性が高い炭素単体、炭素、ニッケル、銅、銀、コバルト、マグネシウム、リチウム、ルテニウム、金、白金、ニオブ、オスニウム又はロジウムを含む金属単体、混合物又は化合物である。
炭素材料の具体例としては、ケッチェンブラック、アセチレンブラック、デンカブラック、サーマルブラック、チャンネルブラック等のカーボンブラック、黒鉛、炭素繊維、活性炭等が挙げられる。これらは単独でも2種以上でも併用可能である。
なかでも、電子伝導性が高いアセチレンブラック、デンカブラック、ケッチェンブラックが好適である。
【0050】
結着剤としては、ポリテトラフルオロエチレン(PTFE)、ポリフッ化ビニリデン(PVDF)、フッ素ゴム等の含フッ素樹脂、或いはポリプロピレン、ポリエチレン等の熱可塑性樹脂、エチレン−プロピレン−ジエンマー(EPDM)、スルホン化EPDM、天然ブチルゴム(NBR)等を単独で、あるいは2種以上の混合物として用いることができる。また、水系バインダーであるセルロース系やスチレンブタジエンゴム(SBR)の水分散体等を用いることもできる。
【0051】
正極層3の厚さは、0.01mm以上10mm以下であることが好ましい。
正極層3は、公知の方法により製造することができる。例えば、塗布法、静電法(静電スプレー法、静電スクリーン法等)により製造することができる。
【0052】
(4)集電体
本発明のリチウムイオン電池は、集電体を備えることが好ましい。
集電体として、銅、マグネシウム、ステンレス鋼、チタン、鉄、コバルト、ニッケル、亜鉛、アルミニウム、ゲルマニウム、インジウム、リチウム、又はこれらの合金等からなる板状体や箔状体等が使用できる。
【0053】
本発明のリチウムイオン電池は、上述した各部材を貼り合せ、接合することで製造できる。接合する方法としては、各部材を積層し、加圧・圧着する方法や、2つのロール間を通して加圧する方法(roll to roll)等がある。
また、接合面にイオン伝導性を有する活物質や、イオン伝導性を阻害しない接着物質を介して接合してもよい。
接合においては、固体電解質の結晶構造が変化しない範囲で加熱融着してもよい。
【0054】
[充放電制御システム]
充放電制御システムの第一の実施形態について説明する。
第一の充放電制御システム10は、図2に示すように、充電量測定手段11と、充電制御部12と、充電量閾値比較手段13と、充電指示手段14と、充電手段15とを備えている。
【0055】
充電量測定手段11は、リチウムイオン電池B1の充電量(又は、充電可能な電気量)を測定するための手段であり、公知の装置や回路を用いることができる。
充電制御部12のデータベース16は、シリコンの理論容量又は後述する充電可能容量のうち、少なくとも1つを収納している。
ここで、充電可能容量は、充電可能容量測定手段(図示せず)が測定したリチウムイオン電池B1の充電可能な容量である。
なお、リチウムイオン電池B1は、充放電を繰り返すと電気容量が少なくなるため、充電可能容量は、所定の充放電後に測定した値であってもよく、また、放電、充電または充放電毎に測定した値であってもよい。
【0056】
充電量閾値比較手段13は、充電量測定手段11により測定されたリチウムイオン電池B1の充電量(電池残量)と閾値とを比較し、充電量が閾値より高い場合には、充電指示手段14に充電の中断を指示するものである。
ここで、閾値は、データベース16に格納されたシリコンの理論容量又は充電可能容量に所定の数値を掛けた値である。
閾値は、リチウムイオン電池B1の寿命(充放電の回数、サイクル)により決めることができるが、例えば、シリコンの理論容量の50%、40%、30%、20%とすることができる。また、充電可能容量の60%、50%、25%とすることができる。
充電量に関する閾値については、後記の「充放電制御回路」にて説明する方法により測定した電気量で設定しても良く、あるいは、その電気量に対応する電圧値で設定しても良い。
【0057】
充電指示手段14は、充電手段15に対してリチウムイオン電池B1の充電を指示するものである。
ここで、充電指示手段14は、充電手段15に対してリチウムイオン電池B1の充電量が所定の閾値より高い又は同じと判断したため、充電を中止する指示を出した場合に、充電手段15に充電の中止を指示する。
なお、「充電量」とは、放電後に充電を開始した充電量をいい、リチウムイオン電池B1に充電されている充電量ではない。例えば、まったく充電されていないリチウムイオン電池B1を充電する場合には、放電後に充電を開始した充電量と、リチウムイオン電池B1に充電されている充電量とは、いずれも同じ値になるが、前者を「充電量」とする。また、放電後に充電されている電気量が10%のリチウムイオン電池B1を充電する場合には、充電後のリチウムイオン電池B1の電気量から理論容量の10%の電気量を引いた値が「充電量」となる。
【0058】
充電手段15は、リチウムイオン電池B1に充電するものであり、公知の充電装置や回路を含む。
なお、この第一の充放電制御システム10においては、充電量測定手段11と充電制御部12とを併せて「充電量制御手段」というものとする。
【0059】
充放電制御システムの第二の実施形態について説明する。
第二の充放電制御システム10’は、図3に示すように、電圧測定手段11’と、充電制御部12’と、電圧閾値比較手段13’と、充電指示手段14と、充電手段15とを備えている。
【0060】
電圧測定手段11’は、リチウムイオン電池B1の電圧を検出する。電圧を検出するための手段であり、公知の装置や回路を用いることができる。
充電制御部12’のデータベース16’は、シリコンの理論容量又は充電可能容量のうち、少なくとも1つに対応する電圧値を収納している。
シリコンの理論容量と充電可能容量は、前述した通りであるので、ここでの説明は、省略する。
【0061】
電圧閾値比較手段13’は、電圧測定手段11’により測定されたリチウムイオン電池B1の電圧と閾値(後述)とを比較し、電圧が閾値より高い場合には、充電指示手段14に充電の中断を指示するものである。
ここで、閾値は、データベース16’に格納された電圧値に所定の数値を掛けた値である。
閾値は、リチウムイオン電池B1の寿命(充放電の回数、サイクル)により決めることができるが、例えば、上記シリコンの理論容量の50%、40%、30%、20%となる容量に相当する電圧値とすることができる。また、上記充電可能容量の60%、50%、25%に相当する容量に対応する電圧とすることができる。
充電指示手段14は、第一の充放電制御システム10における充電指示手段14と同様の機能を有しているため、ここでの説明は省略する。
なお、この第二の充放電制御システム10’においては、電圧測定手段11’と充電制御部12’とを併せて「充電量制御手段」というものとする。
【0062】
[充放電制御回路]
充放電制御回路20は、二次電池(リチウムイオン電池)B2の充放電を行う回路であって、図4に示すように、電源部21と、負荷部22と、充電器30とを備えている。
二次電池B2は、[リチウムイオン電池]で説明したリチウムイオン電池Bと同様の構成を有している。
【0063】
電源部21は、充電器30の充電回路31(後述)を通して二次電池B2に供給される充電電圧及び充電電流の供給源である。
電源部21としては、例えば、燃料電池、太陽電池、またはエンジンに設けられた発電機などの電力供給手段を用いることができる。また、商用電源からACアダプタを介して電力を供給するものであってもよい。
なお、携帯型の充放電制御回路20は、二次電池B2から、負荷部22に電力を供給されることにより、駆動される。
【0064】
充電器30は、充電回路31と、電圧検出部32と、充電制御部33とを備えている。
充電回路31は、二次電池B2の充電を行う。
電圧検出部32は、二次電池B2の電圧を検出する。この電圧検出部32は、二つの電圧比較部321a及び321bと、切替手段322とを備えている。電圧検出部32には、充電制御部33において設定された第一閾値Xth1に対応する電圧Vth1(電圧323a)と、第二閾値Xth2に対応する電圧Vth2(電圧323b)の二つの閾値電圧が設定される。電圧検出部32は、これら閾値電圧を電圧基準として、二次電池B2の電圧を検出する。
なお、図4においては、電圧比較部を二つ備えた電圧検出部32を示しているが、電圧比較部は、二つに限るものではなく、一つであってもよい。この場合、閾値は一つのみ設定され、この閾値に対応する電圧Vthと二次電池B2の電圧が比較される。
【0065】
充電制御部33は、電圧検出部32で検出された二次電池B2の電圧と閾値を比較するとともに、その充電電圧が閾値より大きいと判断したときに、充電の中止を指示する信号を充電回路31に送信する。この信号を受信した充電回路31は、充電を中止する。また、充電電圧が閾値より小さいと判断したときは、充電の中止を指示する信号を充電回路31に送信しない(または、充電の継続を指示する信号を充電回路31に送信する)。これにより、充電回路31による二次電池B2への充電が継続される。
【0066】
この充電器30の機能について、さらに説明する。
上述したように、二次電池B2は、電源部21から充電回路31を通して供給される電力により充電される。
本発明においては、二次電池B2に含まれるケイ素へ充電電気量(リチウム挿入量)が所望の電気量となるように充電される。
このような二次電池B2の充電は、充電制御部33からの出力に基づいて、充電回路31が制御している。充電制御部33には、少なくとも1つの所望の充電電気量が、閾値電気量として予め設定されている。
充電されている二次電池B2に含まれるケイ素負極への充電電気量は、例えば、充電されている二次電池B2への電流値と積算時間に基づいて、充電制御部33において計算される。本実施形態において、充電されている二次電池B2への充電電流は、二次電池B2の正極側に設置された電流検出部23により測定される。
【0067】
また、上記充電電気量は、その二次電池B2の充電とともに増加し、また充電電気量の増加とともに、二次電池B2に並列に接続された電圧検出部32で検出される電圧も上昇し、電圧検出部32で検出された電圧と充電電気量の間には所定の関係があるため、二次電池B2の電圧から充電電流量および二次電池B2の温度を測定する温度計測手段24からの出力を考慮して、充電電気量を計算することもできる。これは、Liのモル比の値がxである場合の電池電圧は、二次電池B2の温度及び/又は充電電流によって変化する可能性があるためである。
なお、閾値電気量に対応するVth(Vth1、Vth2)の範囲は、二次電池B2への充電電流、二次電池B2の温度、二次電池B2のインピーダンスなどの変化を考慮し、その充電電気量に対応して決定される電圧の±10%から20%の範囲であることが好ましく、その上限を+0%とし、その下限を−10%とした場合が最も好ましい。
【0068】
二次電池B2に接続された電圧検出部32は、上記閾値電気量における二次電池B2の電圧Vthを閾値電圧とし、これを電圧基準として用いて、充電されている二次電池B2の電圧を検出する。ここで、閾値電圧とは、二次電池B2の負極1に含まれるケイ素の充電電気量が、所定の閾値電気量であるときの、前記二次電池B2の電圧Vthをいう。
充電制御部33においては、図4に示すように、計算された電気量と、予め設定された閾値電気量とが比較され、その計算された電気量が設定されている閾値電気量を超えた場合、充電制御部33から出力された信号に基づいて、充電回路31が、二次電池B2の充電を中止する。
計算された電気量が、設定されている閾値を超えない場合には、充電制御部33から出力された信号に基づいて、充電回路31により、二次電池B2の充電が継続される。
一方、電圧を元に充電制御を行う場合は、充電制御部33においては、計算された電圧と、予め設定された閾値電圧とが比較され、その計算された電圧が設定されている閾値電圧を超えた場合、充電制御部33から出力された信号に基づいて、充電回路31が、二次電池B2の充電を中止する。
計算された電圧が、設定されている閾値を超えない場合には、充電制御部33から出力された信号に基づいて、充電回路31により、二次電池B2の充電が継続される。
【0069】
なお、充電回路31による二次電池B2の充電は、定電流充電、または定電流充電と定電圧充電との組み合わせ等によって行うことができる。本発明においては、充電されている二次電池B2への充電電流を電流検出部23の検出結果に基づいて求め、その電流検出部23からの出力に基づいて、充電制御部33において、ケイ素への充電電気量を求めている。よって、基本的に、二次電池B2の充電は、定電流充電により行うことができる。
また、定電流充電と定電圧充電とを組み合わせても、二次電池B2の充電を行うこともできる。この場合、まず、定電流充電により、二次電池B2に含まれるケイ素への充電電気量が、所望の電気量に近い値にまで充電し、次いで、定電圧充電により、その所望の電気量となるように充電される。
【0070】
なお、充放電制御回路20の電圧検出部32、充電制御部33、充電回路31は、それぞれ充放電制御システム10の充電量測定手段11、充電制御部12、充電手段15に相当するため、充放電制御回路20の上記構成を充放電制御システム10の一部として含めることができる。
また、電圧検出部32の代わりに、二次電池B2の充電量を測定し、所定の閾値と比較し、充電量が所定の閾値より高い場合に充電の中止を指示する充電制御部であってもよい。
この充電制御部12は、第一の充放電制御システム10における充電制御部12と同様の機能を有しているため、その説明を省略する。
【0071】
[リチウムイオン電池の充電方法]
ここでは、リチウムイオン電池の充電方法として、充放電制御システム10の動作手順を例にして、図5を参照して説明する。
充電制御部12のデータベース16には、閾値が予め記憶されている(ステップ10)。ここで、リチウムイオン電池の充電量を、そのリチウムイオン電池の負極1に用いられるシリコンの理論容量の50%以下又は充電可能容量の60%以下となるように、この値を閾値として設定しておく。好ましくは、理論容量の45%以下又は充電可能容量の50%以下にするのがよい。
シリコンの理論容量の50%を超える場合又は充電可能容量の60%を超えるとサイクル特性が劣化する。
【0072】
ここで、理論容量とは、1モルのシリコンに4.4モルのLiが挿入できた際の容量で、4200mAh/gである。
充電可能容量とは、充電時の条件と同一の条件で初めに充電したときに充電できる容量を指す。
例えば、初めに0.2Cレートで充電したときに3000mAh/g充電できたとすると、0.2Cレートで充電する際の充電可能容量は3000mAh/gとなる。
また、初めに0.1Cレートで充電したときに3300mAh/g充電できたとすると、0.1Cレートで充電する際の充電可能容量は3300mAh/gとなる。
【0073】
充電手段15が、リチウムイオン電池B1に対して充電を開始すると(ステップ11)、充電量測定手段11がリチウムイオン電池B1の充電量を測定する(充電量の測定、ステップ12)。
充電量閾値比較手段13は、充電量測定手段11での充電量の測定値とデータベース16に記憶されている閾値とを比較する(ステップ13)。
比較の結果、充電量の測定値が閾値未満であるときは、充電手段15によるリチウムイオン電池B1への充電を継続するとともに、充電量測定手段11による充電量の測定を継続する。
一方、充電量の測定値が閾値以上であるときは、充電量閾値比較手段13は、充電指示手段14に対して、充電の中止を指示する信号を送信する。この信号を受信した充電指示手段14は、その充電の中止を指示する信号を充電手段15に送信して充電を中止させる(ステップ14)。
【0074】
このリチウムイオン電池の充電方法を実行することにより、リチウムイオン電池の充放電を繰り返し行っても、サイクル特性が劣化することがない。
なお、ここでは、充放電制御システム10の動作手順について説明したが、第二の充放電制御システム10’又は充放電回路20の動作手順も同様である。
また、充放電制御システム10の各構成の詳細や閾値の設定の仕方などについては、[充放電制御システム]にて既に説明したので、ここでの説明は省略する。
【実施例】
【0075】
以下、具体的な実施例を挙げて、本発明をより詳細に説明する。
【0076】
[製造例]
A.硫化リチウムの製造
(1)NMP法
硫化リチウムの製造及び精製は、国際公開公報WO2005/040039A1の実施例と同様に行った。
具体的には、下記のように行った。
(a)硫化リチウム(Li2S)の製造
硫化リチウムは、特開平7−330312号公報の第1の態様(2工程法)の方法に従って製造した。具体的には、攪拌翼のついた10リットルオートクレーブにN−メチル−2−ピロリドン(NMP)3326.4g(33.6モル)及び水酸化リチウム287.4g(12モル)を仕込み、300rpm、130℃に昇温した。昇温後、液中に硫化水素を3リットル/分の供給速度で2時間吹き込んだ。
続いて、この反応液を窒素気流下(200cc/分)昇温し、反応した硫化水素の一部を脱硫化水素化した。昇温するにつれ、上記硫化水素と水酸化リチウムの反応による副生した水が蒸発を始めたが、この水はコンデンサにより凝縮し系外に抜き出した。水を系外に留去すると共に反応液の温度は上昇するが、180℃に達した時点で昇温を中止し、一定温度に保持した。脱硫化水素反応が終了後(約80分)反応を終了し、硫化リチウムを得た。
【0077】
(2)硫化リチウムの精製
上記(1)で得られた500mLのスラリー反応溶液(NMP−硫化リチウムスラリー)中のNMPをデカンテーションした後、脱水したNMP100mLを加え、105℃で約1時間攪拌した。その温度のままNMPをデカンテーションした。さらにNMP100mLを加え、105℃で約1時間攪拌し、その温度のままNMPをデカンテーションし、同様の操作を合計4回繰り返した。デカンテーション終了後、窒素気流下230℃(NMPの沸点以上の温度)で硫化リチウムを常圧下で3時間乾燥した。得られた硫化リチウム中の不純物含有量を測定した。
なお、亜硫酸リチウム(Li2SO3)、硫酸リチウム(Li2SO4)、並びにチオ硫酸リチウム(Li2S2O3)の各硫黄酸化物、及び、N−メチルアミノ酪酸リチウム(LMAB)の含有量は、イオンクロマトグラフ法により定量した。その結果、硫黄酸化物の総含有量は0.13質量%であり、LMABは0.07質量%であった。
なお、以下の固体電解質の製造では精製した硫化リチウムを用いた。
【0078】
B.固体電解質の製造
「A.硫化リチウムの製造」に記載した内容で製造した硫化リチウム(精製した硫化リチウム)を用いて、国際公開公報WO07/066539の実施例1と同様の方法で固体電解質の製造及び結晶化を行った。
具体的には、下記のように行った。
【0079】
「A.硫化リチウムの製造」に記載した内容で製造した硫化リチウム(精製した硫化リチウム)0.6508g(0.01417mol)と五硫化二燐(アルドリッチ社製)を1.3492g(0.00607mol)をよく混合した。そして、この混合した粉末と直径10mmのジルコニア製ボール10個と遊星型ボールミル(フリッチュ社製:型番P−7)をアルミナ製ポットに投入し完全密閉するとともに、このアルミナ製ポット内に窒素を充填し、窒素雰囲気にした。
そして、はじめの数分間は、遊星型ボールミルの回転を低速回転(85rpm)にして硫化リチウムと五硫化二燐を十分混合した。その後、徐々に遊星型ボールミルの回転数を上げ370rpmまで回転数を上げた。遊星型ボールミルの回転数を370rpmで20時間メカニカルミリングを行った。このメカニカルミリング処理をした白黄色の粉体をX線測定により評価した結果、ガラス化(硫化物ガラス)していることが確認できた。この硫化物ガラスのガラス転移温度をDSC(示差走査熱量測定)により測定したところ、220℃であった。
この硫化物ガラスを窒素雰囲気下、300℃で2時間加熱した。
得られた硫化物ガラスセラミックスについて、X線回折測定したところ、2θ=17.8、18.2、19.8、21.8、23.8、25.9、29.5、30.0degにピークが観測された。
硫化物ガラスは、粒子状であり、平均粒径は190μmであった。なお、測定方法は、詳細な説明に記載した方法を用いた。
【0080】
C.リチウムイオン電池の製造
電解質60mgを直径10mmのプラスチック製の円筒に投入し加圧成型した。平均粒径5μmのシリコン粒子と固体電解質を重量比で7:3になるように混ぜ合わせた上で上記電解質成型体の上に投入し再び加圧しシリコン負極合材層を形成した。シリコン負極合材層とは、電解質層2を挟んで反対側にインジウム箔(レアメタリック製厚さ0.1mm、10mmφ)およびリチウム箔(本庄金属製、厚さ0.1mm、9mmφ)を1枚ずつ交互に投入し張り合わせた上でチタン箔を貼り付け電池を作製した。このようにして作製したハーフセルの充電可能容量を0.2Cレートで定電流定電圧充電を行ったところ、最大3000mAh/gであったため、3000mAh/gを充電可能容量とした。
【0081】
[実施例1]
上記ハーフセルで0.2Cレートでシリコン合材層に放電(シリコンへのリチウム挿入)を行い、シリコン重量当たりの電気量が750mAh/g(理論容量の18%、充電可能容量の25%)となった時点で放電を終了した。1時間休止後0.2Cレートで充電(シリコンからのリチウム脱離)を行い0.9Vになった時点で充電を終了し、1時間休止した。上記充放電を容量の低下が見られるまで繰り返し行った。
【0082】
[実施例2]
放電時の終了条件を電気量が1500mAh/g(理論容量の36%、充電可能容量の50%)とした以外は、実施例1と同様に充放電を行った。
【0083】
[比較例1]
放電時の終了条件を電気量が2250mAh/g(理論容量の54%、充電可能容量の75%)とした以外は、実施例1と同様に充放電を行った。
【0084】
[比較例2]
放電時の終了条件を定電流充電で電圧−0.61V後、さらに、0.61Vで電流値が0.01C相当に低下するまで定電圧充電を行うこととした以外は、実施例1と同様に充放電を行った。
【0085】
これら実施例1、実施例2、比較例1、比較例2のそれぞれにおける初期容量の維持率を、図6に示す。
同図に示すように、比較例1及び比較例2と実施例1及び実施例2とを比較した場合には、後者の方が、サイクル特性が改善されていることがわかる。すなわち、負極1にシリコンを用いた全固体リチウム電池は、充放電を繰り返し行った場合でも、サイクル特性が劣化しないことが同図に示す測定結果からわかった。
【0086】
以上説明したように、本実施形態のリチウムイオン電池の充電方法、リチウムイオン電池の充放電制御システム及びリチウムイオン電池の充放電制御回路によれば、負極にシリコンを用いた全固体リチウム電池の充放電を繰り返し行っても、サイクル特性が劣化しないようにすることができる。
【産業上の利用可能性】
【0087】
本発明のリチウムイオン電池の充電方法、充放電制御システム、充放電制御回路は、リチウムイオン電池を充電する装置や機器に利用できる。また、本発明に係るリチウムイオン電池は、携帯情報端末、携帯電子機器、家庭用小型電力貯蔵装置、モーターを電圧源とする自動二輪車、電気自動車、ハイブリッド電気自動車等の電池として用いることができる。
【符号の説明】
【0088】
1 負極層(負極)
2 固体電解質層
3 正極層(正極)
10 第一の充放電制御システム
11 充電量測定手段
12 充電制御部
13 充電量閾値比較手段
14 充電指示手段
15 充電手段
16 データベース
10’ 第二の充放電制御システム
11’ 電圧測定手段
12’ 充電制御部
13’ 電圧閾値比較手段
16’ データベース
20 充放電制御回路
21 電源部
22 負荷部
23 電流検出部
24 温度計測手段
30 充電器
31 充電回路
32 電圧検出部
33 充電制御部
B、B1、B2 リチウムイオン電池(二次電池)
【特許請求の範囲】
【請求項1】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充電方法であって、
充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とする
ことを特徴とするリチウムイオン電池の充電方法。
【請求項2】
前記充電量をシリコンの理論容量の45%以下又は前記充電可能容量の50%以下とする
ことを特徴とする請求項1記載のリチウムイオン電池の充電方法。
【請求項3】
前記シリコンが粒子であって、粒径が50nm以上である
ことを特徴とする請求項1又は2記載のリチウムイオン電池の充電方法。
【請求項4】
前記負極が、膜厚が50nm以上のシリコン薄膜からなる
ことを特徴とする請求項1〜3のいずれかに記載のリチウムイオン電池の充電方法。
【請求項5】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御システムであって、
リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する充電量制御手段を備える
ことを特徴とするリチウムイオン電池の充放電制御システム。
【請求項6】
前記充電量制御手段が、
リチウムイオン電池の充電量を測定する充電量測定手段から送信される充電量と閾値を比較する充電量閾値比較手段と、
充電量閾値比較手段により充電量が閾値より大きいと判断された場合に充電を中止する信号を送信する充電指示手段と、を備える
ことを特徴とする請求項5に記載のリチウムイオン電池の充放電制御システム。
【請求項7】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御回路であって、
リチウムイオン電池に対して充電を行う充電回路と、
リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する信号を前記充電回路に送信する充電量制御手段と、を備える
ことを特徴とするリチウムイオン電池の充放電制御回路。
【請求項8】
前記充電量制御手段が、
前記リチウムイオン電池の充電電圧を検出する電圧検出部と、
この電圧検出部で検出された充電電圧と閾値を比較するとともに、前記充電電圧が閾値より大きいと判断したときに、充電の中止を指示する信号を前記充電回路に送信する充電制御部と、を備える
ことを特徴とする請求項7に記載のリチウムイオン電池の充放電制御回路。
【請求項1】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充電方法であって、
充電量をシリコンの理論容量の50%以下又は充電可能容量の60%以下とする
ことを特徴とするリチウムイオン電池の充電方法。
【請求項2】
前記充電量をシリコンの理論容量の45%以下又は前記充電可能容量の50%以下とする
ことを特徴とする請求項1記載のリチウムイオン電池の充電方法。
【請求項3】
前記シリコンが粒子であって、粒径が50nm以上である
ことを特徴とする請求項1又は2記載のリチウムイオン電池の充電方法。
【請求項4】
前記負極が、膜厚が50nm以上のシリコン薄膜からなる
ことを特徴とする請求項1〜3のいずれかに記載のリチウムイオン電池の充電方法。
【請求項5】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御システムであって、
リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する充電量制御手段を備える
ことを特徴とするリチウムイオン電池の充放電制御システム。
【請求項6】
前記充電量制御手段が、
リチウムイオン電池の充電量を測定する充電量測定手段から送信される充電量と閾値を比較する充電量閾値比較手段と、
充電量閾値比較手段により充電量が閾値より大きいと判断された場合に充電を中止する信号を送信する充電指示手段と、を備える
ことを特徴とする請求項5に記載のリチウムイオン電池の充放電制御システム。
【請求項7】
シリコンを含む負極と、固体電解質を含む電解質層と、を備えるリチウムイオン電池の充放電制御回路であって、
リチウムイオン電池に対して充電を行う充電回路と、
リチウムイオン電池の充電量が所定の閾値より高くなると充電の中止を指示する信号を前記充電回路に送信する充電量制御手段と、を備える
ことを特徴とするリチウムイオン電池の充放電制御回路。
【請求項8】
前記充電量制御手段が、
前記リチウムイオン電池の充電電圧を検出する電圧検出部と、
この電圧検出部で検出された充電電圧と閾値を比較するとともに、前記充電電圧が閾値より大きいと判断したときに、充電の中止を指示する信号を前記充電回路に送信する充電制御部と、を備える
ことを特徴とする請求項7に記載のリチウムイオン電池の充放電制御回路。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−105701(P2013−105701A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−250514(P2011−250514)
【出願日】平成23年11月16日(2011.11.16)
【出願人】(000183646)出光興産株式会社 (2,069)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月16日(2011.11.16)
【出願人】(000183646)出光興産株式会社 (2,069)
【Fターム(参考)】
[ Back to top ]

