リチウムマンガン系複合酸化物およびその製造方法
【課題】長期間の充放電サイクルにおいて約3Vの平均放電電圧を保持でき、且つリチウムコバルト酸化物系正極材料と同等若しくはそれ以上の放電容量を有する材料であって、資源的な制約が少なく且つ安価な原料を使用して得ることができ、更に、公知の低価格の正極材料と比較して、より優れた充放電特性を発揮できる新規な材料を提供する
【解決手段】組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
【解決手段】組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、次世代低コストリチウムイオン二次電池の正極材料として有用なリチウムマンガン系複合酸化物およびその製造方法に関する。
【背景技術】
【0002】
現在、我が国において、携帯電話、ノートパソコンなどのポータブル機器に搭載されている二次電池のほとんどは、リチウムイオン二次電池である。また、リチウムイオン二次電池は、今後、電気自動車、電力負荷平準化システムなどの大型電池としても実用化されるものと予想されており、その重要性はますます高まっている。
【0003】
現在、リチウムイオン二次電池においては、正極材料としては主にリチウムコバルト酸化物(LiCoO2)材料が使用され、負極材料としては黒鉛などの炭素材料が使用されている。この正極材料では、充電によりリチウムコバルト酸化物内のコバルトが3価から4価に酸化されつつLi脱離をして負極にLiを供給し、放電時には負極の炭素材料からLi脱離し、4価のコバルトが3価に還元することにより正極側にLi挿入されることにより電池として動作する。
【0004】
この様なリチウムイオン二次電池では、正極材料において可逆的に脱離(充電に相当)、挿入(放電に相当)するリチウムイオン量が電池の容量を決定づけ、脱離・挿入時の電圧が電池の作動電圧を決定づけるために、正極材料であるLiCoO2は、電池性能に関連する重要な電池構成材料である。このため、今後のリチウムイオン二次電池の用途拡大・大型化に伴い、リチウムコバルト酸化物は、一層の需要増加が予想されている。
【0005】
しかしながら、リチウムコバルト酸化物は、希少金属であるコバルトを多量に含むために、リチウムイオン二次電池の素材コストを上昇させる要因の一つとなっている。さらに、現在コバルト資源の約20%が電池産業に用いられていることを考慮すれば、LiCoO2からなる正極材料のみでは今後の需要拡大に対応することは困難と考えられる。
【0006】
現在、より安価で資源的に制約の少ない正極材料として、リチウムニッケル酸化物(LiNiO2)、リチウムマンガン酸化物(LiMn2O4)等が報告されており、一部代替材料として実用化されている。しかしながらリチウムニッケル酸化物には充電時に電池の安全性を低下させるという問題があり、リチウムマンガン酸化物には高温(約60℃)充放電時に3価のマンガンが電解液中に溶出し、それが電池性能を著しく劣化させるという問題があり、これらの材料への代替はあまり進んでいない。またリチウムマンガン酸化物のなかでLiMnO2という正極材料も提案されているが、この材料も充放電に伴って、もとの構造から徐々に上記LiMn2O4に代表されるスピネル型の結晶構造に変化し、充放電曲線の形状が充放電サイクルの進行に伴い大きく変化することから実用化には至っていない。
【0007】
また、マンガンおよびニッケルに比べて、資源的により一層豊富であり、毒性が低く、安価な鉄を含むリチウムフェライト(LiFeO2)について、電極材料としての可能性が検討されている。しかしながら、通常の製造法、すなわち鉄源とリチウム源とを混合し高温焼成することによって得られるリチウムフェライトは、ほとんど充放電しないので、リチウムイオン二次電池正極材料として用いることはできない。
【0008】
一方、イオン交換法により得られるLiFeO2が充放電可能であることが報告されているが(下記特許文献1および2参照)、これらの材料の平均放電電圧は2.5V以下でありLiCoO2の値(約3.7V)に比べて著しく低いため、LiCoO2の代替とすることは困難である。
【0009】
本発明者らは、すでに、鉄に次いで安価かつ資源的に豊富なリチウムマンガン酸化物(Li2MnO3)とリチウムフェライトとからなる層状岩塩型構造の固溶体(Li1+x(FeyMn1-y)1-xO2、(0<x<1/3, 0<y<1)、以下「鉄含有Li2MnO3」という)が、室温での充放電試験においてはリチウムコバルト酸化物並の4V近い平均放電電圧を有することを見出している(下記特許文献3および4参照)。
【0010】
更に、本発明者らは、特定の条件を満足するリチウム−鉄−マンガン複合酸化物が、高温サイクル試験時にLiMn2O4より高容量(150mAh/g)かつ安定した充放電サイクル特性を示すことを見出している(下記特許文献5参照)。
【0011】
加えて、本発明者らは、鉄とともに資源的に豊富で安価なチタンを含有するリチウムマンガン酸化物(チタン含有Li2MnO3や、鉄およびチタン含有Li2MnO3)が、高容量を示し、特に、特定の化学組成、遷移金属イオン分布において、室温における高電流密度下での放電特性や低温での放電特性に優れることを見出している(下記特許文献6-8参照)。
以上の通り、リチウムコバルト系正極材料に代わり得るリチウムマンガン系正極材料について種々の報告がなされているが、より一層の充放電特性改善のためには、正極材料の化学組成や製造条件についての最適化が望まれている。 一方、マグネシウムを含むリチウム含有複合酸化物については、下記特許文献9に、一般式LipNxMyOzFaで表されるリチウム含有複合酸化物が記載されており、元素NとしてCo、Mn及びNiからなる群から選ばれた少なくとも一種の元素が示され、元素Mの具体例の一部として、Mg等のアルカリ土類金属元素が示されている。しかしながら、上記一般式で表されるリチウム含有複合酸化物は、第1工程として、リチウム源と、N元素源と、Alを少なくとも含有するM元素源とを混合して焼成した後、第2工程として、第1工程で得られたリチウム含有複合酸化物粉末と、Zr及び/又はTiを少なくとも含有するM元素塩水溶液とを混合して、焼成する工程を経て得られるものであり、この様な特定の方法で得られるリチウム含有複合酸化物において、Mg等のアルカリ土類金属元素が存在してもよいことを示しているに過ぎない。しかも、M元素の比率を示すyは、0<y≦0.05であり、非常の少量のM元素の存在が許容されているだけである。
【0012】
下記特許文献10に記載されたリチウム含有複合酸化物粉末も、Mg等のアルカリ土類金属の存在を許容するものであるが、この酸化物は、表面層にジルコニウムを含有する特定の構造を有するものであり、この様な特定構造のリチウム含有複合酸化物において、少量のマグネシウムが含まれても良いことが記載されているだけである。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平10-120421号公報
【特許文献2】特開平8-295518号公報
【特許文献3】特開2002-068748号公報
【特許文献4】特開2002-121026号公報
【特許文献5】特開2005-154256号公報
【特許文献6】特開2008-063211号公報
【特許文献7】特開2009-179501号公報
【特許文献8】特開2009-274940号公報
【特許文献9】特再公表2007-52712号公報
【特許文献10】特再公表2007-102407号公報
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、上記した従来技術の現状に鑑みてなされたものであり、その主な目的は、長期間の充放電サイクルにおいて約3Vの平均放電電圧を保持でき、且つリチウムコバルト酸化物系正極材料と同等若しくはそれ以上の放電容量を有する材料であって、資源的な制約が少なく且つ安価な原料を使用して得ることができ、更に、公知の低価格の正極材料と比較して、より優れた充放電特性を発揮できる新規な材料を提供することである。
【課題を解決するための手段】
【0015】
本発明者は、上記した目的を達成すべく鋭意研究を重ねてきた。その結果、比較的安価な原料を用いて得られる特定組成のリチウム−鉄−マンガン系酸化物固溶体またはリチウム−チタン−マンガン系酸化物固溶体を基本構造として、これに、従来知られているリチウム含有複合酸化物におけるマグネシウム含有量より多い特定範囲のマグネシウムを固溶させることによって、マグネシウムを含まないか、或いは、マグネシウム含有量の少ない酸化物と比較して優れた充放電特性を有するものとなり、特に、充放電を繰り返した後の充放電容量が高くなることを見出した。その結果、該酸化物をリチウムイオン二次電池用の正極材料として用いることによって、安価な原料及び金属元素を使用して、充放電サイクル特性に優れた電池を作製できることを見出し、ここに本発明を完成するに至った。
【0016】
即ち、本発明は、下記のリチウムマンガン系複合酸化物、その製造方法、リチウムマンガン系複合酸化物からなるリチウムイオン二次電池正極材料及びリチウムイオン二次電池を提供するものである。
項1. 組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
項2. 単斜晶層状岩塩型構造の結晶相の単相、又は単斜晶層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の混合相からなる上記項1に記載のリチウムマンガン系複合酸化物。
項3. マグネシウム化合物、マンガン化合物、並びに、必要に応じて、チタン化合物及び鉄化合物からなる群から選ばれた少なくとも一種の化合物を含む水溶液をアルカリ性として沈殿を形成した後、形成された沈殿物をリチウム化合物の存在下で焼成することを特徴とする、上記項1又は2に記載のリチウムマンガン系複合酸化物の製造方法。
項4. 沈殿を形成した後、形成された沈殿物を含む水溶液に空気を吹き込んで沈殿物の酸化・熟成処理を行う工程を含む上記項3に記載の方法。
項5. 形成された沈殿物を焼成する前に、酸化剤および水溶性リチウム化合物と共に該沈殿物をアルカリ性条件下で水熱処理する工程を含む上記項3又は4に記載の方法。
項6. 沈殿物の焼成を、不活性雰囲気において有機物の存在下で行う上記項3〜5のいずれかに記載の方法。
項7. 沈殿物の焼成を、リチウム化合物の存在下で焼成した後、不活性雰囲気において有機物の存在下で焼成する二段階の焼成方法で行う、上記項3〜5のいずれかに記載の方法。
項8. 上記項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料。
項9. 上記項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料を構成要素とするリチウムイオン二次電池。
【0017】
以下、本発明のリチウムマンガン系複合酸化物及びその製造方法について具体的に説明する。
(1)リチウムマンガン系複合酸化物本発明のリチウムマンガン系複合酸化物は、組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表される化合物であって、酸化物の一般的な結晶構造である岩塩型構造を基本とし、公知物質であるLi2MnO3に類似する空間群
【0018】
【数1】

【0019】
を有する単斜晶層状岩塩型構造の結晶相を含むものである。
【0020】
本発明のリチウムマンガン系複合酸化物は、上記した単斜晶層状岩塩型構造の結晶相を含んでいればよく、陽イオン分布の異なる他の岩塩型構造(例えば立方晶岩塩型構造など)の結晶相を含む混合相であっても良い。
【0021】
例えば、上記した単斜晶層状岩塩型構造の単相であってもよく、或いは、この様な単斜晶層状岩塩型構造の結晶相の他に、公知物質であるα-LiFeO2に類似する空間群
【0022】
【数2】

【0023】
を有する立方晶岩塩型構造の結晶相を含む混合相であってもよい。これらの単斜晶層状岩塩型構造の結晶相の複合酸化物と立方晶岩塩型構造の結晶相の複合酸化物は、いずれも、優れた充放電性能を発揮するものと考えられる。
【0024】
この場合、層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の割合は、通常、層状岩塩型構造結晶相:立方晶岩塩型構造結晶相(重量比)=10:90〜100:0程度の範囲となる。図1及び図2は、本発明のリチウムマンガン酸化物である単斜晶層状岩塩型構造の結晶相(Li2MnO3)の結晶構造及びMn-Li層内の陽イオン配列を模式的に示す図面であり、図3は立方晶岩塩型構造の結晶相(α-LiFeO2)を模式的に示す図面である。
【0025】
図1においては酸化物イオン配列により形成される酸化物イオン層を介してLiイオンのみからなるLi層とMnとLiイオン両方を含むMn-Li層が交互に積層した構造を有しており、図2においてはMn-Li層内においてMnイオンが六角網目状の規則配列を示し、Liイオンは6つのMnイオンからなる六角形の中心位置を占めていることを示している。他の陽イオンFe、Ti、Mgイオンは、上記Li層、Mn-Li層どちらにも入ることができ、Mn-Li層内のMn位置あるいはLi位置のどちらにも入ることができる。
【0026】
一方、図3においては、Mn、TiおよびMgイオンは、LiとFeの入っている格子位置を占有する。
【0027】
本発明のリチウムマンガン系複合酸化物は、上記した層状岩塩型構造の結晶相の単相、又は立方晶岩塩型構造の結晶相との混合相を基本として、2価元素であるMgを所定量固溶させたものである。この様な特定の岩塩型構造のリチウムマンガン系複合酸化物中に、所定量のMgを固溶させた複合酸化物は、リチウムイオン二次電池用の正極材料として用いる場合に、優れた充放電特性を有するものとなり、特に、サイクル特性が向上して、充放電を繰り返し行った場合にも、高い放電容量を維持することができる。更に、該リチウムマンガン系複合酸化物は、その組成によっては、充放電初期特性も良好となる。
【0028】
固溶させるMgイオン量(y値:Mg/(Mg+M+Mn);MはFe及びTiの少なくとも一種)は、幅広い電圧域(2.0-4.8V)で駆動させるリチウムマンガン系酸化物正極においてMgの効果を十分に発揮させるために、Liイオン以外の金属イオン全量の8モル%〜35モル%(0.08≦Mg/(Mg+M+Mn)≦0.35)程度とすればよく、9.5モル%〜32モル%(0.095≦Mg/(Mg+M+Mn)≦0.32)程度とすることが好ましく、10モル%〜30モル%(0.10≦Mg/(Mg+M+Mn)≦0.30)程度とすることがより好ましい。Mg量が少なすぎると、Mg添加の効果を十分に発揮することができず、一方、Mg量が多すぎると、上記組成式においてxで表される構造中に含まれる過剰Li量が減少し、充放電容量の低下につながるので好ましくない。
【0029】
更に、本発明のリチウムマンガン系複合酸化物には、必要に応じて、上記一般式においてMで表されるFe及びTiからなる群から選ばれる少なくとも一種の元素を固溶させることができる。これらの元素は、いずれも充放電特性上好ましい効果を奏する成分であり、例えば、Feが存在する場合には、初回充電電圧を低下させることができ、Tiが存在する場合には、リチウムマンガン系複合酸化物の製造の際に低温焼成時のLi欠損を抑制することができる。
【0030】
Fe及びTiからなる群から選ばれる少なくとも一種の元素の量(z値:M/(Mg+M+Mn))は、Liイオン以外の金属イオン全量の60モル%程度以下(0≦M/(Mg+M+Mn)≦0.60)とすればよく、40モル%程度以下(0≦M/(Mg+M+Mn)≦0.40)とすることが好ましい。FeとTiはそれぞれLiFeO2とLi2TiO3成分として本発明の複合酸化物に固溶していると考えられる成分であり、両成分ともに電気化学的にLi脱離・挿入が困難であり、これらの成分を多量に含む場合には、充放電容量の大幅な低下を招くので好ましくない。
【0031】
本発明リチウムマンガン系複合酸化物では、層状および立方晶岩塩型の結晶構造を保つことができる限り、Li1+x(MgyMzMn1-y-z)1-xO2のxは、遷移金属イオンの平均価数によって0と1/3の間の値をとることができる。好ましくはxの範囲は、0.05〜0.30である。
【0032】
さらに、本発明複合酸化物は、充放電特性に重大な影響を及ぼさない範囲(最大10モル%程度)の水酸化リチウム、炭酸リチウム、チタン化合物、鉄化合物、マンガン化合物、マグネシウム化合物(それらの水和物および複合化合物も含む)などの不純物相を含んでいても良い。
【0033】
リチウムマンガン系複合酸化物の製造方法
本発明の複合酸化物の製造方法については特に限定はないが、例えば、Mg、M、及びMnイオンの均一混合を可能とする湿式化学製造法の一つである共沈法を用いてMg-M-Mn共沈物を作製し、必要に応じて水熱反応を経由し、その後共沈物または水熱反応生成物をLi塩および必要に応じて水溶性有機物と混合し、焼成する方法によれば、優れた充放電性能を有する複合酸化物を容易に形成できる。以下の項の方法について具体的に説明する。
【0034】
(i)沈殿物の形成
共沈法を用いたMg-M-Mn共沈物を作成する工程は、MgおよびMn、必要に応じて、元素Mの原料となる金属化合物を水、水/アルコール混合物などに溶解させた混合溶液をアルカリ性として得られた沈殿物に対して湿式酸化処理を行うことによって、Mg-M-Mn共沈物を形成する工程である。
【0035】
構成金属源となるマグネシウム、マンガン、鉄、及びチタン化合物としては、これらの化合物を含む混合水溶液を形成できる成分であれば特に限定なく使用できる。通常、水溶性の化合物を用いればよい。この様な水溶性化合物の具体例としては、塩化物、硝酸塩、硫酸塩、シュウ酸塩、酢酸塩などの水溶性塩などを挙げることができる。マンガンの場合は、過マンガン酸塩も用いることができる。これらの水溶性化合物は、無水物および水和物のいずれであってもよい。また、金属そのもの、酸化物あるいは水酸化物などの非水溶性化合物であっても、例えば、塩酸や硝酸などの酸を用いて溶解させて水溶液として用いることが可能である。これらの各原料化合物は、各金属源について、それぞれ単独で使用してもよく、2種以上を併用してもよい。
【0036】
該混合水溶液における上記各金属化合物の混合割合は、目的とする複合酸化物における各元素比と同様の元素比となるようにすればよい。
【0037】
混合水溶液中の各化合物の濃度については、特に限定的ではなく、均一な混合水溶液を形成でき、且つ円滑に共沈物を形成できるように適宜決めればよい。通常、構成金属化合物の合計濃度を、0.01〜5mol/l程度、好ましくは0.1〜2mol/l程度とすればよい。
【0038】
該混合水溶液の溶媒としては、水を単独で用いる他、メタノール、エタノールなどの水溶性アルコールを含む水−アルコール混合溶媒を用いても良い。水−アルコール混合溶媒を用いることにより、0℃を下回る温度での沈殿生成が可能となる。アルコールの使用量は、目的とする沈殿生成温度などに応じて適宜決めればよいが、通常、水100重量部に対して、50重量部程度以下の使用量とすることが適当である。
【0039】
該混合水溶液から沈殿物(共沈物)を生成させるには、該混合水溶液をアルカリ性とすればよい。良好な沈殿物を形成する条件は、混合水溶液に含まれる各化合物の種類、濃度などによって異なるので一概に規定出来ないが、通常、pH8程度以上とすることが好ましく、pH11程度以上とすることがより好ましい。
【0040】
該混合水溶液をアルカリ性にする方法については、特に限定はなく、通常は、該混合水溶液をアルカリ又はアルカリを含む水溶液に添加すればよい。また、アルカリを含む水溶液を該混合水溶液に添加する方法によっても共沈物を形成することができる。 該混合水溶液をアルカリ性にするために用いるアルカリとしては、例えば、水酸化カリウム、水酸化ナトリウム、水酸化リチウムなどのアルカリ金属水酸化物、アンモニアなどを用いることができる。これらのアルカリを水溶液として用いる場合には、例えば、0.1〜20mol/l程度、好ましくは0.3〜10mol/l程度の濃度の水溶液として用いることができる。また、アルカリは、上記した金属化合物の混合水溶液と同様に、水溶性アルコールを含む水−アルコール混合溶媒に溶解しても良い。
【0041】
沈殿生成の際には、混合水溶液の温度を-50℃から+15℃程度、好ましくは-40℃から+10℃程度にすることにより、反応時の中和熱発生に伴う目的組成とは異なるスピネル酸化物等の不純物生成が抑制され微細かつ均質な沈殿が形成されやすくなる。
【0042】
該混合水溶液をアルカリ性とした後、更に、0〜150℃程度(好ましくは10〜100℃程度)で、数時間〜7日間程度(好ましくは0.5日〜4日間程度)にわたり、反応溶液に空気を吹き込みながら、沈殿物の酸化・熟成処理を行うことが好ましい。
【0043】
得られた沈殿を蒸留水等で洗浄して、過剰のアルカリ成分、残留原料等を除去し、濾別することによって、得られたMg-M-Mn共沈物を精製することができる。
(ii)水熱処理
次いで、必要に応じて上記した方法で得られた共沈物を、水溶性リチウム化合物および酸化剤とともにアルカリ性条件下で水熱処理に供する。水熱処理は、該共沈物、水溶性リチウム化合物、及び酸化剤を含む水溶液をアルカリ性条件下で加熱することによって行うことができる。加熱は、通常、密閉容器中で行えばよい。水熱反応に用いる水溶液では、構成金属共沈物の含有量は、水1リットルあたり1〜100g程度とすることが好ましく、10〜80g程度とすることがより好ましい。
【0044】
水溶性リチウム化合物としては、例えば、塩化リチウム、硝酸リチウム等の水溶性リチウム塩、水酸化リチウム等を用いることができる。これらの水溶性リチウム化合物は、一種単独又は二種以上混合して用いることができ、無水物および水和物の何れを用いても良い。
【0045】
水溶性リチウム化合物の使用量は、沈殿生成物中の構成金属の合計モル数に対するリチウム元素モル比として、Li/(M+Mn)=1〜10程度とすることが好ましく、3〜7程度とすることがより好ましい。
【0046】
水溶性リチウム化合物の濃度は、0.1〜10mol/l程度とすることが好ましく、1〜8mol/l程度とすることがより好ましい。
また、酸化剤の存在下に水熱処理を行うことによって、充放電特性上好ましくない不純物相である斜方晶LiMnO2の副生を抑制することができる。特に、マンガン元素の比率の比較的高いリチウムマンガン系複合酸化物、例えば、組成式Li1+x(MgyMzMn1-y-z)1-xO2において、Mnの比率である(1−y−z)の値が0.5程度以上の酸化物を得る場合には、斜方晶LiMnO2が副生し易くなるが、これを抑制できる点で有効である。
【0047】
酸化剤としては、水熱反応時に分解して酸素発生するものであれば、特に限定無く使用でき、具体例として、塩素酸カリウム、塩素酸リチウム、過塩素酸リチウム、塩素酸ナトリウム、過酸化水素水等を挙げることができる。酸化剤は、一種単独又は二種以上混合して用いることができる。酸化剤の濃度は、0.1〜10mol/l程度とすることが好ましく、0.5〜5mol/l程度とすることがより好ましい。
【0048】
水熱反応を行う際の水溶液のpHについては、通常、pH8程度以上とすることが好ましく、pH11程度以上とすることがより好ましい。
【0049】
沈殿物及び水溶液リチウム化合物を含む水溶液がアルカリ性条件下にある場合には、そのまま加熱すればよいが、pH値が低い場合には、例えば、水酸化カリウム、水酸化ナトリウムなどのアルカリ金属水酸化物、アンモニアなどを添加してpH値を上げればよい。
【0050】
水熱反応は、通常の水熱反応装置(例えば、市販のオートクレーブ)を用いて行うことができる。
【0051】
水熱反応条件は、特に限定されるものではないが、通常100〜300℃程度で0.1〜150時間程度とすればよく、好ましくは150〜250℃程度で1〜100時間程度とすればよい。
【0052】
水熱反応終了後、通常、残存するリチウム化合物などの残存物を除去するために、反応生成物を洗浄する。洗浄には、例えば、水、水-アルコール混合溶液、アルコール、アセトンなどを用いることができる。次いで、生成物を濾過し、例えば、80℃以上の温度(通常は100℃程度)で乾燥することにより、後述する焼成用構成金属原料を得ることができる。
【0053】
(iii)焼成処理
次いで、水熱処理前に得られた共沈物または水熱反応生成物を、リチウム化合物と共に、焼成することによって、Li含有量、金属配合比および粉体特性を制御して目的とするMg含有リチウムマンガン系複合酸化物を得ることができる。焼成雰囲気については、特に限定はなく、大気中、酸化性雰囲気中、不活性雰囲気中、還元雰囲気中等任意の雰囲気を選択できる。
【0054】
焼成温度は、200〜1500℃程度とすることが好ましく、300〜1200℃程度とすることがより好ましい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0055】
焼成工程で用いるリチウム化合物としては、リチウム元素を含む化合物であれば特に限定なく使用でき、具体例として、炭酸リチウム、塩化リチウム、硝酸リチウム、酢酸リチウム等のリチウム塩、水酸化リチウム、これらの水和物等を挙げることができる。これらのリチウム化合物は、一種単独又は二種以上混合して用いることができる。リチウム化合物の使用量は、沈殿形成用原料中の金属成分の仕込みモル量に対して0.01〜3倍モル量程度とすればよい。
【0056】
通常、反応性を向上させるために、焼成用原料にリチウム化合物を加えて粉砕混合した後、焼成することが好ましい。粉砕の程度については、粗大粒子が含まれず、混合物が均一な色調となっていればよい。
【0057】
リチウム化合物は、粉末形態、水溶液形態等として用いることができるが、反応の均一性を確保するために、水溶液の形態で使用することが好ましい。この場合、水溶液の濃度については、通常、0.1〜10mol/l程度とすればよい。
【0058】
本発明では、構成する遷移金属の平均価数を低減するため、特に、還元性雰囲気下において焼成することが好ましく、これによって、Li含有量、Mn価数、粉体特性の制御が容易となり、簡単に目的とするリチウムマンガン系複合酸化物を得ることができる。
【0059】
還元性雰囲気下で焼成する方法については、特に限定はないが、例えば、窒素、アルゴンガスなどの不活性ガス気流下等の不活性雰囲気下において、有機物の存在下に焼成することによって、還元性雰囲気下における焼成が可能である。
【0060】
有機物としては、特に限定はなく、後述する焼成温度において分解して還元性雰囲気とすることができる炭素含有化合物であればよい。特に、水溶性の有機物を用いる場合には、水溶液状態でリチウムマンガン複合酸化物粉末と分散混合できるので有利である(このような有機物の具体例としては、ショ糖、ブドウ糖、デンプン、ポリエチレングリコールなどを挙げることができる。
【0061】
有機物の使用量は、沈殿形成用原料中の金属成分の仕込みモル量に対する炭素のモル比換算で0.001倍〜5倍モル程度とすることが好ましく、0.01倍〜1倍モル程度とすることがより好ましい。水溶液として用いる場合には有機物の濃度は、上記した使用量の範囲となるように適宜決めればよい。
【0062】
有機物の存在下で焼成する方法については、特に限定はなく、上記焼成用原料に、上記したリチウム化合物及び有機物を加えて混合した後、80℃以上の温度、好ましくは100℃程度の温度で加熱乾燥後、粉砕して、焼成すればよい。焼成温度は、150〜1000℃程度とすることが好ましく、200〜800℃程度とすることがより好ましい。
【0063】
焼成の際の雰囲気は、有機物の分解によって強い還元性の雰囲気となるように、窒素ガス中などの不活性ガス雰囲気とすればよい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0064】
上記した方法で焼成することによって、目的とするリチウムマンガン系複合酸化物について、Li含有量、構成金属平均価数、粉体特性等を容易に制御することができる。例えば、焼成の際に添加するリチウム化合物の量を適宜設定することによって、リチウムマンガン系複合酸化物中のリチウム含有量を調整することができる。また、焼成温度を高くすることによって、リチウムマンガン系複合酸化物の粒径を大きくすることができる。更に、有機物の添加量を増加させ、更に、焼成温度を上昇することによって、構成金属元素の平均価数をより低下させることが可能となる。
【0065】
上記した焼成処理は、リチウムマンガン系複合酸化物にリチウム化合物を添加して、焼成した後、有機物を添加して焼成する二段階の焼成処理としてもよい。二段階の焼成処理を行う場合には、Li含有量、構成金属平均価数、粉体特性等の制御をより簡単に行うことができる。
【0066】
この場合、リチウムマンガン系複合酸化物にリチウム化合物を添加して行う一段階目の焼成処理については、リチウム化合物の使用量などは上記した焼成処理と同様とすればよい。一段階目の焼成処理の条件については、焼成雰囲気は、大気中、酸化性雰囲気中、不活性雰囲気中、還元雰囲気中等任意の雰囲気を選択できる。焼成温度は、200〜1000℃程度とすることが好ましく、300〜800℃程度とすることがより好ましい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0067】
上記した方法で一段階目の焼成処理を行った後、有機物を添加して焼成する二段階目の焼成処理を行えばよい。二段階目の焼成処理の条件は、上記したリチウム化合物と有機物を同時に添加して焼成処理を行う場合と同様の条件とすればよい。
【0068】
上記した焼成工程でリチウムマンガン系複合酸化物を得た後、通常、過剰のリチウム化合物や不純物等を除去するために、焼成物を水洗処理あるいは溶媒洗浄処理等に供する。その後、濾過を行い、例えば、80℃以上の温度、好ましくは100℃程度の温度で加熱乾燥してもよい。
【0069】
更に、必要に応じて、この加熱乾燥物を粉砕し、リチウム化合物、有機物を加えて、焼成し、洗浄し、乾燥するという一連の操作を繰り返し行うことにより、リチウムマンガン系複合酸化物の優れた特性(リチウムイオン二次電池用正極材料としての作動電圧領域における安定的な充放電特性、高容量など)をより一層改善することができる。
【0070】
リチウムイオン二次電池
本発明によるリチウムマンガン系複合酸化物を用いるリチウムイオン二次電池は、公知の手法により製造することができる。例えば、正極材料として、本発明による新規な複合酸化物を使用し、負極材料として、公知の金属リチウム、炭素系材料(活性炭、黒鉛)、珪素、酸化珪素などを使用し、電解液として、公知のエチレンカーボネート、プロピレンカーボネート、ジメチルカーボネート、ジエチルカーボネートなどからなる混合溶媒に過塩素酸リチウム、LiPF6などのリチウム塩を溶解させた溶液(有機電解液)を使用し、さらにその他の公知の電池構成要素を使用して、常法に従って、リチウムイオン二次電池を組立てればよい。
【発明の効果】
【0071】
本発明によれば、安価な原料及び金属元素を使用して、平均放電電圧が3V以上を保持でき、充放電サイクル特性に優れた正極材料として有用な新規な複合酸化物を得ることができる。
【0072】
本発明のリチウムマンガン系複合酸化物がこのような特性を有するのは、従来の正極材料とは異なり、放電曲線が放電終止電圧(2.0V)に向かって緩やかに低下していく形状であることによるものであり、放電終止電圧を2.0V程度まで下げることによって、容易に高容量化を実現することができ、小型民生用のみならず車載用などの大型リチウムイオン二次電池用正極材料としてきわめて有用である。
【0073】
特に、本発明の複合酸化物は、Mgを含まないか、或いは、Mg含有量が少ない以外は、同様の組成を有する複合酸化物と比較して、充放電を繰り返した後の充放電容量が高いという特徴を有するものである。このため、より長期間にわたり良好な特性を保持することができる。
【0074】
本発明によるリチウムマンガン系複合酸化物は、上記の優れた性能を有するものであり、高容量で、かつ低コストのリチウムイオン二次電池用正極材料として、極めて有用である。
【図面の簡単な説明】
【0075】
【図1】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、単斜晶層状岩塩型構造の結晶相(Li2MnO3)の結晶構造を模式的に示す図面(結晶構造描画ソフトVESTAを用いて描画)。
【図2】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、Li2MnO3の結晶構造内のMn-Li層内のLiおよびMnイオン配列を示す図面(結晶構造描画ソフトVESTAを用いて描画)。
【図3】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、立方晶岩塩型構造の結晶相α-LiFeO2の結晶構造を模式的に示す図面(結晶構造描画ソフトVESTAを用いて描画)。
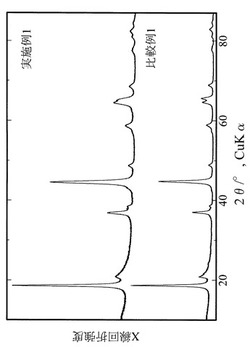
【図4】実施例1および比較例1で得られた試料のX線回折図。
【図5】実施例1および比較例1で得られた試料を正極としたリチウム二次電池の初回および10サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図6】実施例2および比較例2で得られた試料のX線回折図。
【図7】実施例2および比較例2で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図8】実施例3および比較例3で得られた試料のX線回折図。
【図9】実施例3および比較例3で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図10】実施例4および比較例4で得られた試料のX線回折図。
【図11】実施例4および比較例4で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図12】実施例5および比較例2で得られた試料のX線回折図。
【図13】実施例5および比較例2で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【発明を実施するための形態】
【0076】
以下、実施例および比較例を示し、本発明の特徴とするところを一層明確にするが、本発明は以下の実施例、比較例のみに限定されるものではない。
【0077】
実施例1
硝酸マグネシウム(II)6水和物12.82 g、及び塩化マンガン(II)4水和物39.58 g (全量0.25 mol、Mg:Mnモル比=2:8)を500 mlの蒸留水に加え、完全に溶解させ、金属塩水溶液とした。別のビーカーに水酸化リチウム水溶液(蒸留水1000 mlに無水水酸化リチウム60 gを溶解させた溶液)を作製し、この水溶液をチタン製ビーカーに入れて攪拌しながら、上記金属塩水溶液を2〜3時間かけて、室温(約20℃)にて徐々に滴下して、Mg-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で1日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0078】
得られた沈殿を濾別し、沈殿形成用原料中の金属成分の仕込みモル量に対して1.5倍モル量相当の水酸化リチウム1水和物15.74 gを蒸留水200 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0079】
得られた粉末を、大気中で1時間かけて650℃まで昇温し、その温度で20時間保持後、炉冷した。次いで、得られた粉末を粉砕後、沈殿形成用原料中の金属成分の仕込みモル量に対して0.3倍の炭素モル量に相当するショ糖(2.14g)を蒸留水100ml中に溶解させたショ糖水溶液に分散させた後、100℃で乾燥および粉砕した。
【0080】
得られた粉末を窒素中で3時間かけて300 ℃まで昇温後、その温度で窒素中において1時間焼成し、炉中で室温付近まで冷却して、過剰のリチウム塩等を除去するために焼成物を蒸留水で水洗し、濾過および乾燥して最終的に粉末状生成物を得た。
【0081】
生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウム含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0082】
比較例1
沈殿物形成用の原料として、硝酸マグネシウムを含まない塩化マンガン(II)4水和物49.48g (全量0.25 mol)の水溶液を金属塩水溶液として用いる以外は、実施例1と全く同じ操作を行い、目的とするリチウムマンガン系複合酸化物の粉末状生成物を得た。
【0083】
X線回折による評価
図4に、実施例1および比較例1で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表1に示す結晶学パラメーターを算出した。
【0084】
【表1】

【0085】
図4に示す実施例1および比較例1で得られた試料のX線回折ピークから、両試料ともに、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0086】
【数3】

【0087】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。
【0088】
以上の結果から、実施例1及び比較例1で得られた粉末状生成物は、ともに目的の単斜晶層状岩塩型結晶相のみであることが確認できた。
【0089】
化学分析等による評価
ICP発光分析を用いて、実施例1および比較例1で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表2に示す。
【0090】
【表2】

【0091】
表2に示す元素分析結果から、上記方法で得られた実施例1の粉末状組成物は、化学組成式中のx値およびy値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0092】
充放電特性評価
実施例1および比較例1で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、以下の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表3及び図5に示す。
<電池構成及び充放電試験条件>
正極:活物質5 mg+AB 5mg+PTFE 0.5mgを混合しAlメッシュ上に圧着
負極:金属リチウム
電解液:LiPF6をEC+DMC溶媒中に溶解させたもの
試験温度:30 ℃
電流密度(活物質あたり):40 mA/g、
電位範囲:2.0-4.8 V
(充電のみ4.8Vまでの定電流―定電圧充電(10 mA/gに下がるまで4.8Vを維持する方法))
AB:アセチレンブラック、PTFE:ポリテトラフルオロエチレン、EC:エチレンカーボネート、DMC:ジメチルカーボネート
【0093】
【表3】

図5および表3に示す結果より、実施例1で得られた試料は、比較例1で得られた試料と比較すると、初期充電容量がかなり低いにもかかわらず、初期放電容量は同等に近いものであった。その結果、実施例1で得られた試料は、初期充放電効率が86%であり、比較例1で得られた試料(初期充放電効率74 %)と比較して、初期充放電効率が大幅に改善されていた。
【0094】
Mgを含有する実施例1で得られた試料は、初期放電エネルギー密度、平均初期放電電圧が僅かに低いものの、初期充放電効率が高く、10サイクル後放電容量が、比較例1で得られた試料と比べて大きいことから、Mgを含有しない比較例1で得られた試料と比較して充放電サイクル特性に優れたものであることが明らかである。
【0095】
実施例2
硝酸マグネシウム(II)6水和物6.41 g、30%硫酸チタン(IV)溶液60.00g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Ti:Mnモル比=1:3:6)を500 mlの蒸留水に加え、完全に溶解させ、金属塩水溶液を作製した。別のビーカーに水酸化リチウムの水-エタノール溶液(蒸留水500 mlおよびエタノール150mlに水酸化リチウム1水和物50gを溶解させた溶液)を作製した。この水酸化リチウム溶液をチタン製ビーカーに入れ、-10℃に冷却された恒温槽内に固定し、攪拌した。攪拌された水酸化リチウム溶液に上記金属塩水溶液を2〜3時間かけ、徐々に滴下して、Mg-Ti-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で2日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0096】
得られた沈殿を濾別し、沈殿形成用原料中の金属成分の仕込みモル量に対して1.5倍モル量相当の水酸化リチウム1水和物15.74 gを蒸留水200 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0097】
得られた粉末は、大気中で1時間かけて850℃まで昇温し、その温度で大気中1時間保持後、炉冷した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0098】
比較例2
沈殿物形成用の原料として、30%硫酸チタン(IV)溶液80.00g及び塩化マンガン(II)4水和物29.69g (全量0.25 mol、Ti:Mnモル比=4:6)を含む水溶液を用いる以外は、実施例2と全く同じ操作を行い、チタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0099】
X線回折による評価
図6に、実施例2および比較例2で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表4に示す結晶学パラメーターを算出した。
【0100】
【表4】

【0101】
図6に示す実施例2で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0102】
【数4】

【0103】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。一方比較例2の試料は上記層状岩塩型Li2MnO3相の他に、実施例2の試料では見られない、図中矢印で示される不純物由来のピークが存在することから、立方晶スピネル型構造を有するLi4Ti5O12の単位胞(空間群
【0104】
【数5】

【0105】
a=8.352(4) Å, K. Kataoka, Y. Takahashi, N. Kijima, J. Akimoto, K. Ohshima, Journal of Physics and Chemistry of Solids (2008) 69, p1454-p1456.)の2相混合モデルを用いてフィットする必要があった。層状岩塩型結晶相と立方晶スピネル相の存在比率は、98:2であった。
【0106】
以上の結果から、実施例2及び比較例2で得られた粉末状生成物は、ともに単斜晶層状岩塩型結晶相を含んでいるが、Mgを含まない比較例2の試料がスピネル相を含むことから、Mgを導入することにより不純物相であるスピネル相の生成を抑制する効果があることが確認できた。
【0107】
化学分析等による評価
ICP発光分析を用いて、実施例2および比較例2で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表5に示す。
【0108】
【表5】

【0109】
表5に示す元素分析結果から、上記方法で得られた実施例2の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0110】
充放電特性評価
実施例2および比較例2で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表6及び図7に示す。
【0111】
【表6】

【0112】
図7および表6に示す結果より、実施例2で得られた試料は、比較例2で得られた試料と比較すると、初期充放電容量が高くなっていた。実施例2で得られた試料の初期充放電効率が64%であり、比較例2で得られた試料(初期充放電効率75 %)と比較して劣るものの、初期放電エネルギー密度、平均初期放電電圧、50サイクル後放電容量が、比較例2で得られた試料と比べて大きいことから、Mgを含有する実施例2で得られた試料は、Mgを含有しない比較例2で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【0113】
実施例3
実施例2と同様に沈殿物形成用の金属塩水溶液を作製し、同様の操作で沈殿作製、熟成、水酸化リチウム添加、850℃大気中焼成を実施後、炉冷した。次いで、得られた粉末を粉砕し、沈殿形成用原料中の金属成分の仕込みモル量に対して0.3倍の炭素モル量に相当するショ糖(2.14g)を蒸留水100ml中に溶解させたショ糖水溶液に分散し、100℃で乾燥および粉砕した。
【0114】
得られた粉末を窒素中で3時間かけて600 ℃まで昇温後、その温度で窒素中において1時間焼成し、炉中で室温付近まで冷却した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0115】
比較例3
比較例2と同様の金属塩水溶液を用いる以外は、実施例3と全く同じ操作を行い、チタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0116】
X線回折による評価
図8に、実施例3および比較例3で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表7に示す結晶学パラメーターを算出した。
【0117】
【表7】

【0118】
図8に示す実施例3および比較例3で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0119】
【数6】

【0120】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)に加えて、立方晶岩塩型構造を有するLi2TiO3の単位胞(空間群
【0121】
【数7】

【0122】
a=4.1405(3)Å, M. Tabuchi, A. Nakashima, H. Shigemura, K. Ado, H. Kobayashi, H. Sakaebe, K. Tatsumi, H. Kageyama, T. Nakamura and R. Kanno, Journal of Materials Chemistry, 13, 1747-1757 (2003). )を用いて指数付けが可能であり、両結晶相が共存している構造モデルでフィット可能であることがわかった。2相構造モデルにおける単斜晶相と立方晶相の割合は、表7から実施例3の試料の場合に25:75、比較例3の試料の場合は18:82であった。
【0123】
以上の結果から、実施例3及び比較例3で得られた粉末状生成物は、ともに目的物質である単斜晶層状岩塩型結晶相および立方晶岩塩型結晶相を含んでいることが確認できた。
【0124】
化学分析等による評価
ICP発光分析を用いて、実施例3および比較例3で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表8に示す。
【0125】
【表8】

【0126】
表8に示す元素分析結果から、上記方法で得られた実施例3の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0127】
充放電特性評価
実施例3および比較例3で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表9及び図9に示す。
【0128】
【表9】

【0129】
図9および表9に示す結果より、実施例3で得られた試料は、比較例3で得られた試料と比較すると、初期充放電容量が高いのみならず、初期充放電効率、初期放電エネルギー密度、平均初期放電電圧、50サイクル後放電容量に関して優れていることがわかる。すなわち、Mgを含有する実施例3で得られた試料は、Mgを含有しない比較例3で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【0130】
実施例4
硝酸マグネシウム(II)6水和物6.41 g、硝酸鉄(III)9水和物30.30g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Fe:Mnモル比=1:3:6)を500 mlの蒸留水に加え、完全に溶解させた。別のビーカーに水酸化リチウムの水−エタノール溶液(蒸留水500 mlおよびエタノール200mlに水酸化リチウム1水和物50 gを溶解させた溶液)を作製した。この水酸化リチウム溶液をチタン製ビーカーに入れ、-10℃に冷却された恒温槽内で攪拌した。攪拌・冷却された水酸化リチウム溶液に上記金属塩水溶液を2〜3時間かけ、徐々に滴下して、Mg-Fe-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で1日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0131】
得られた沈殿を濾別し、ポリテトラフルオロエチレンビーカー内で蒸留水200mlに水酸化カリウム310g、水酸化リチウム1水和物50g、塩素酸カリウム50gを入れて攪拌したものに、濾別された沈殿を加え、よく分散させた。このポリテトラフルオロエチレンビーカーを水熱反応炉内に設置し、220℃で48時間水熱処理を行った。水熱処理後、室温まで炉冷された水熱反応炉からビーカーを取り出し、固形物を蒸留水2000mlで数回洗浄して、水酸化カリウムなどを除去し、濾過して粉末状生成物を得た。
【0132】
沈殿形成用原料中の金属成分の仕込みモル量に対して0.5倍モル量相当の水酸化リチウム1水和物5.25 gを蒸留水100 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0133】
得られた粉末は大気中で1時間かけて750℃まで昇温し、その温度で大気中5時間保持後、炉冷した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよび鉄含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0134】
比較例4
沈殿物形成用の原料として、硝酸鉄(III)9水和物40.40g及び塩化マンガン(II)4水和物29.69g (全量0.25 mol、Fe:Mnモル比=4:6)を含む水溶液を金属塩水溶液として用いる以外は、実施例4と全く同じ操作を行い、目的とする鉄含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0135】
X線回折による評価
図10に、実施例4および比較例4で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表10に示す結晶学パラメーターを算出した。
【0136】
【表10】

【0137】
図10に示す実施例4および比較例4で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0138】
【数8】

【0139】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。
【0140】
以上の結果から、実施例4及び比較例4で得られた粉末状生成物は、Mgの有無にかかわらず、ともに目的物質である単斜晶層状岩塩型結晶相を含んでいることが確認できた。
【0141】
化学分析等による評価
ICP発光分析を用いて、実施例4および比較例4で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表11に示す。
【0142】
【表11】

【0143】
表11に示す元素分析結果から、上記方法で得られた実施例4の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0144】
充放電特性評価
実施例4および比較例4で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表12及び図11に示す。
【0145】
【表12】

【0146】
図11および表12に示す結果より、実施例4で得られた試料は、比較例4で得られた試料に対して、初期充放電容量および初期充放電効率、初期放電エネルギー密度がほぼ同等であるが、平均初期放電電圧が高く、50サイクル後放電容量が大きいことから、Mgを含有する実施例4で得られた試料は、Mgを含有しない比較例4で得られた試料と比較して充放電サイクル特性に優れたものであることが明らかである。
【0147】
実施例5
沈殿物形成用の原料として、硝酸マグネシウム(II)6水和物19.23 g、30%硫酸チタン(IV)溶液20.00g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Ti:Mnモル比=3:1:6)を含む水溶液を用いる以外は実施例2および比較例2と全く同じ操作で、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0148】
X線回折による評価
図12に、実施例5および比較例2で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表13に示す結晶学パラメーターを算出した。
【0149】
【表13】

【0150】
図12に示す実施例5で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0151】
【数9】

【0152】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。一方比較例2の試料は上記層状岩塩型Li2MnO3相の他に、実施例5の試料では見られない、図中矢印で示される不純物由来のピークが存在することから、立方晶スピネル型構造を有するLi4Ti5O12の単位胞(空間群
【0153】
【数10】

【0154】
a=8.352(4) Å, K. Kataoka, Y. Takahashi, N. Kijima, J. Akimoto, K. Ohshima, Journal of Physics and Chemistry of Solids (2008) 69, p1454-p1456.)の2相混合モデルを用いてフィットする必要があった。層状岩塩型結晶相と立方晶スピネル相の存在比率は、98:2であった。
【0155】
以上の結果から、実施例5及び比較例2で得られた粉末状生成物は、ともに単斜晶層状岩塩型結晶相を含んでいるが、Mgを含まない比較例2の試料がスピネル相を含むものであり、Mgを導入することにより不純物相であるスピネル相の生成を抑制する効果があることが明らかである。
【0156】
化学分析等による評価
ICP発光分析を用いて、実施例5および比較例2で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表14に示す。
【0157】
【表14】

【0158】
表14に示す元素分析結果から、上記方法で得られた実施例5の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0159】
充放電特性評価
実施例5および比較例2で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表15及び図13に示す。
【0160】
【表15】

【0161】
図13および表15に示す結果より、実施例5で得られた試料は、比較例2で得られた試料と比較すると、初期充放電容量、初期充放電効率、及び初期放電エネルギー密度が高くなっていた。実施例5で得られた試料は、平均初期放電電圧は比較例2の試料に劣るものの、50サイクル後放電容量が、比較例2で得られた試料と比べて大きいことから、Mgを含有する実施例5で得られた試料は、Mgを含有しない比較例2で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【技術分野】
【0001】
本発明は、次世代低コストリチウムイオン二次電池の正極材料として有用なリチウムマンガン系複合酸化物およびその製造方法に関する。
【背景技術】
【0002】
現在、我が国において、携帯電話、ノートパソコンなどのポータブル機器に搭載されている二次電池のほとんどは、リチウムイオン二次電池である。また、リチウムイオン二次電池は、今後、電気自動車、電力負荷平準化システムなどの大型電池としても実用化されるものと予想されており、その重要性はますます高まっている。
【0003】
現在、リチウムイオン二次電池においては、正極材料としては主にリチウムコバルト酸化物(LiCoO2)材料が使用され、負極材料としては黒鉛などの炭素材料が使用されている。この正極材料では、充電によりリチウムコバルト酸化物内のコバルトが3価から4価に酸化されつつLi脱離をして負極にLiを供給し、放電時には負極の炭素材料からLi脱離し、4価のコバルトが3価に還元することにより正極側にLi挿入されることにより電池として動作する。
【0004】
この様なリチウムイオン二次電池では、正極材料において可逆的に脱離(充電に相当)、挿入(放電に相当)するリチウムイオン量が電池の容量を決定づけ、脱離・挿入時の電圧が電池の作動電圧を決定づけるために、正極材料であるLiCoO2は、電池性能に関連する重要な電池構成材料である。このため、今後のリチウムイオン二次電池の用途拡大・大型化に伴い、リチウムコバルト酸化物は、一層の需要増加が予想されている。
【0005】
しかしながら、リチウムコバルト酸化物は、希少金属であるコバルトを多量に含むために、リチウムイオン二次電池の素材コストを上昇させる要因の一つとなっている。さらに、現在コバルト資源の約20%が電池産業に用いられていることを考慮すれば、LiCoO2からなる正極材料のみでは今後の需要拡大に対応することは困難と考えられる。
【0006】
現在、より安価で資源的に制約の少ない正極材料として、リチウムニッケル酸化物(LiNiO2)、リチウムマンガン酸化物(LiMn2O4)等が報告されており、一部代替材料として実用化されている。しかしながらリチウムニッケル酸化物には充電時に電池の安全性を低下させるという問題があり、リチウムマンガン酸化物には高温(約60℃)充放電時に3価のマンガンが電解液中に溶出し、それが電池性能を著しく劣化させるという問題があり、これらの材料への代替はあまり進んでいない。またリチウムマンガン酸化物のなかでLiMnO2という正極材料も提案されているが、この材料も充放電に伴って、もとの構造から徐々に上記LiMn2O4に代表されるスピネル型の結晶構造に変化し、充放電曲線の形状が充放電サイクルの進行に伴い大きく変化することから実用化には至っていない。
【0007】
また、マンガンおよびニッケルに比べて、資源的により一層豊富であり、毒性が低く、安価な鉄を含むリチウムフェライト(LiFeO2)について、電極材料としての可能性が検討されている。しかしながら、通常の製造法、すなわち鉄源とリチウム源とを混合し高温焼成することによって得られるリチウムフェライトは、ほとんど充放電しないので、リチウムイオン二次電池正極材料として用いることはできない。
【0008】
一方、イオン交換法により得られるLiFeO2が充放電可能であることが報告されているが(下記特許文献1および2参照)、これらの材料の平均放電電圧は2.5V以下でありLiCoO2の値(約3.7V)に比べて著しく低いため、LiCoO2の代替とすることは困難である。
【0009】
本発明者らは、すでに、鉄に次いで安価かつ資源的に豊富なリチウムマンガン酸化物(Li2MnO3)とリチウムフェライトとからなる層状岩塩型構造の固溶体(Li1+x(FeyMn1-y)1-xO2、(0<x<1/3, 0<y<1)、以下「鉄含有Li2MnO3」という)が、室温での充放電試験においてはリチウムコバルト酸化物並の4V近い平均放電電圧を有することを見出している(下記特許文献3および4参照)。
【0010】
更に、本発明者らは、特定の条件を満足するリチウム−鉄−マンガン複合酸化物が、高温サイクル試験時にLiMn2O4より高容量(150mAh/g)かつ安定した充放電サイクル特性を示すことを見出している(下記特許文献5参照)。
【0011】
加えて、本発明者らは、鉄とともに資源的に豊富で安価なチタンを含有するリチウムマンガン酸化物(チタン含有Li2MnO3や、鉄およびチタン含有Li2MnO3)が、高容量を示し、特に、特定の化学組成、遷移金属イオン分布において、室温における高電流密度下での放電特性や低温での放電特性に優れることを見出している(下記特許文献6-8参照)。
以上の通り、リチウムコバルト系正極材料に代わり得るリチウムマンガン系正極材料について種々の報告がなされているが、より一層の充放電特性改善のためには、正極材料の化学組成や製造条件についての最適化が望まれている。 一方、マグネシウムを含むリチウム含有複合酸化物については、下記特許文献9に、一般式LipNxMyOzFaで表されるリチウム含有複合酸化物が記載されており、元素NとしてCo、Mn及びNiからなる群から選ばれた少なくとも一種の元素が示され、元素Mの具体例の一部として、Mg等のアルカリ土類金属元素が示されている。しかしながら、上記一般式で表されるリチウム含有複合酸化物は、第1工程として、リチウム源と、N元素源と、Alを少なくとも含有するM元素源とを混合して焼成した後、第2工程として、第1工程で得られたリチウム含有複合酸化物粉末と、Zr及び/又はTiを少なくとも含有するM元素塩水溶液とを混合して、焼成する工程を経て得られるものであり、この様な特定の方法で得られるリチウム含有複合酸化物において、Mg等のアルカリ土類金属元素が存在してもよいことを示しているに過ぎない。しかも、M元素の比率を示すyは、0<y≦0.05であり、非常の少量のM元素の存在が許容されているだけである。
【0012】
下記特許文献10に記載されたリチウム含有複合酸化物粉末も、Mg等のアルカリ土類金属の存在を許容するものであるが、この酸化物は、表面層にジルコニウムを含有する特定の構造を有するものであり、この様な特定構造のリチウム含有複合酸化物において、少量のマグネシウムが含まれても良いことが記載されているだけである。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開平10-120421号公報
【特許文献2】特開平8-295518号公報
【特許文献3】特開2002-068748号公報
【特許文献4】特開2002-121026号公報
【特許文献5】特開2005-154256号公報
【特許文献6】特開2008-063211号公報
【特許文献7】特開2009-179501号公報
【特許文献8】特開2009-274940号公報
【特許文献9】特再公表2007-52712号公報
【特許文献10】特再公表2007-102407号公報
【発明の概要】
【発明が解決しようとする課題】
【0014】
本発明は、上記した従来技術の現状に鑑みてなされたものであり、その主な目的は、長期間の充放電サイクルにおいて約3Vの平均放電電圧を保持でき、且つリチウムコバルト酸化物系正極材料と同等若しくはそれ以上の放電容量を有する材料であって、資源的な制約が少なく且つ安価な原料を使用して得ることができ、更に、公知の低価格の正極材料と比較して、より優れた充放電特性を発揮できる新規な材料を提供することである。
【課題を解決するための手段】
【0015】
本発明者は、上記した目的を達成すべく鋭意研究を重ねてきた。その結果、比較的安価な原料を用いて得られる特定組成のリチウム−鉄−マンガン系酸化物固溶体またはリチウム−チタン−マンガン系酸化物固溶体を基本構造として、これに、従来知られているリチウム含有複合酸化物におけるマグネシウム含有量より多い特定範囲のマグネシウムを固溶させることによって、マグネシウムを含まないか、或いは、マグネシウム含有量の少ない酸化物と比較して優れた充放電特性を有するものとなり、特に、充放電を繰り返した後の充放電容量が高くなることを見出した。その結果、該酸化物をリチウムイオン二次電池用の正極材料として用いることによって、安価な原料及び金属元素を使用して、充放電サイクル特性に優れた電池を作製できることを見出し、ここに本発明を完成するに至った。
【0016】
即ち、本発明は、下記のリチウムマンガン系複合酸化物、その製造方法、リチウムマンガン系複合酸化物からなるリチウムイオン二次電池正極材料及びリチウムイオン二次電池を提供するものである。
項1. 組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
項2. 単斜晶層状岩塩型構造の結晶相の単相、又は単斜晶層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の混合相からなる上記項1に記載のリチウムマンガン系複合酸化物。
項3. マグネシウム化合物、マンガン化合物、並びに、必要に応じて、チタン化合物及び鉄化合物からなる群から選ばれた少なくとも一種の化合物を含む水溶液をアルカリ性として沈殿を形成した後、形成された沈殿物をリチウム化合物の存在下で焼成することを特徴とする、上記項1又は2に記載のリチウムマンガン系複合酸化物の製造方法。
項4. 沈殿を形成した後、形成された沈殿物を含む水溶液に空気を吹き込んで沈殿物の酸化・熟成処理を行う工程を含む上記項3に記載の方法。
項5. 形成された沈殿物を焼成する前に、酸化剤および水溶性リチウム化合物と共に該沈殿物をアルカリ性条件下で水熱処理する工程を含む上記項3又は4に記載の方法。
項6. 沈殿物の焼成を、不活性雰囲気において有機物の存在下で行う上記項3〜5のいずれかに記載の方法。
項7. 沈殿物の焼成を、リチウム化合物の存在下で焼成した後、不活性雰囲気において有機物の存在下で焼成する二段階の焼成方法で行う、上記項3〜5のいずれかに記載の方法。
項8. 上記項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料。
項9. 上記項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料を構成要素とするリチウムイオン二次電池。
【0017】
以下、本発明のリチウムマンガン系複合酸化物及びその製造方法について具体的に説明する。
(1)リチウムマンガン系複合酸化物本発明のリチウムマンガン系複合酸化物は、組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表される化合物であって、酸化物の一般的な結晶構造である岩塩型構造を基本とし、公知物質であるLi2MnO3に類似する空間群
【0018】
【数1】

【0019】
を有する単斜晶層状岩塩型構造の結晶相を含むものである。
【0020】
本発明のリチウムマンガン系複合酸化物は、上記した単斜晶層状岩塩型構造の結晶相を含んでいればよく、陽イオン分布の異なる他の岩塩型構造(例えば立方晶岩塩型構造など)の結晶相を含む混合相であっても良い。
【0021】
例えば、上記した単斜晶層状岩塩型構造の単相であってもよく、或いは、この様な単斜晶層状岩塩型構造の結晶相の他に、公知物質であるα-LiFeO2に類似する空間群
【0022】
【数2】

【0023】
を有する立方晶岩塩型構造の結晶相を含む混合相であってもよい。これらの単斜晶層状岩塩型構造の結晶相の複合酸化物と立方晶岩塩型構造の結晶相の複合酸化物は、いずれも、優れた充放電性能を発揮するものと考えられる。
【0024】
この場合、層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の割合は、通常、層状岩塩型構造結晶相:立方晶岩塩型構造結晶相(重量比)=10:90〜100:0程度の範囲となる。図1及び図2は、本発明のリチウムマンガン酸化物である単斜晶層状岩塩型構造の結晶相(Li2MnO3)の結晶構造及びMn-Li層内の陽イオン配列を模式的に示す図面であり、図3は立方晶岩塩型構造の結晶相(α-LiFeO2)を模式的に示す図面である。
【0025】
図1においては酸化物イオン配列により形成される酸化物イオン層を介してLiイオンのみからなるLi層とMnとLiイオン両方を含むMn-Li層が交互に積層した構造を有しており、図2においてはMn-Li層内においてMnイオンが六角網目状の規則配列を示し、Liイオンは6つのMnイオンからなる六角形の中心位置を占めていることを示している。他の陽イオンFe、Ti、Mgイオンは、上記Li層、Mn-Li層どちらにも入ることができ、Mn-Li層内のMn位置あるいはLi位置のどちらにも入ることができる。
【0026】
一方、図3においては、Mn、TiおよびMgイオンは、LiとFeの入っている格子位置を占有する。
【0027】
本発明のリチウムマンガン系複合酸化物は、上記した層状岩塩型構造の結晶相の単相、又は立方晶岩塩型構造の結晶相との混合相を基本として、2価元素であるMgを所定量固溶させたものである。この様な特定の岩塩型構造のリチウムマンガン系複合酸化物中に、所定量のMgを固溶させた複合酸化物は、リチウムイオン二次電池用の正極材料として用いる場合に、優れた充放電特性を有するものとなり、特に、サイクル特性が向上して、充放電を繰り返し行った場合にも、高い放電容量を維持することができる。更に、該リチウムマンガン系複合酸化物は、その組成によっては、充放電初期特性も良好となる。
【0028】
固溶させるMgイオン量(y値:Mg/(Mg+M+Mn);MはFe及びTiの少なくとも一種)は、幅広い電圧域(2.0-4.8V)で駆動させるリチウムマンガン系酸化物正極においてMgの効果を十分に発揮させるために、Liイオン以外の金属イオン全量の8モル%〜35モル%(0.08≦Mg/(Mg+M+Mn)≦0.35)程度とすればよく、9.5モル%〜32モル%(0.095≦Mg/(Mg+M+Mn)≦0.32)程度とすることが好ましく、10モル%〜30モル%(0.10≦Mg/(Mg+M+Mn)≦0.30)程度とすることがより好ましい。Mg量が少なすぎると、Mg添加の効果を十分に発揮することができず、一方、Mg量が多すぎると、上記組成式においてxで表される構造中に含まれる過剰Li量が減少し、充放電容量の低下につながるので好ましくない。
【0029】
更に、本発明のリチウムマンガン系複合酸化物には、必要に応じて、上記一般式においてMで表されるFe及びTiからなる群から選ばれる少なくとも一種の元素を固溶させることができる。これらの元素は、いずれも充放電特性上好ましい効果を奏する成分であり、例えば、Feが存在する場合には、初回充電電圧を低下させることができ、Tiが存在する場合には、リチウムマンガン系複合酸化物の製造の際に低温焼成時のLi欠損を抑制することができる。
【0030】
Fe及びTiからなる群から選ばれる少なくとも一種の元素の量(z値:M/(Mg+M+Mn))は、Liイオン以外の金属イオン全量の60モル%程度以下(0≦M/(Mg+M+Mn)≦0.60)とすればよく、40モル%程度以下(0≦M/(Mg+M+Mn)≦0.40)とすることが好ましい。FeとTiはそれぞれLiFeO2とLi2TiO3成分として本発明の複合酸化物に固溶していると考えられる成分であり、両成分ともに電気化学的にLi脱離・挿入が困難であり、これらの成分を多量に含む場合には、充放電容量の大幅な低下を招くので好ましくない。
【0031】
本発明リチウムマンガン系複合酸化物では、層状および立方晶岩塩型の結晶構造を保つことができる限り、Li1+x(MgyMzMn1-y-z)1-xO2のxは、遷移金属イオンの平均価数によって0と1/3の間の値をとることができる。好ましくはxの範囲は、0.05〜0.30である。
【0032】
さらに、本発明複合酸化物は、充放電特性に重大な影響を及ぼさない範囲(最大10モル%程度)の水酸化リチウム、炭酸リチウム、チタン化合物、鉄化合物、マンガン化合物、マグネシウム化合物(それらの水和物および複合化合物も含む)などの不純物相を含んでいても良い。
【0033】
リチウムマンガン系複合酸化物の製造方法
本発明の複合酸化物の製造方法については特に限定はないが、例えば、Mg、M、及びMnイオンの均一混合を可能とする湿式化学製造法の一つである共沈法を用いてMg-M-Mn共沈物を作製し、必要に応じて水熱反応を経由し、その後共沈物または水熱反応生成物をLi塩および必要に応じて水溶性有機物と混合し、焼成する方法によれば、優れた充放電性能を有する複合酸化物を容易に形成できる。以下の項の方法について具体的に説明する。
【0034】
(i)沈殿物の形成
共沈法を用いたMg-M-Mn共沈物を作成する工程は、MgおよびMn、必要に応じて、元素Mの原料となる金属化合物を水、水/アルコール混合物などに溶解させた混合溶液をアルカリ性として得られた沈殿物に対して湿式酸化処理を行うことによって、Mg-M-Mn共沈物を形成する工程である。
【0035】
構成金属源となるマグネシウム、マンガン、鉄、及びチタン化合物としては、これらの化合物を含む混合水溶液を形成できる成分であれば特に限定なく使用できる。通常、水溶性の化合物を用いればよい。この様な水溶性化合物の具体例としては、塩化物、硝酸塩、硫酸塩、シュウ酸塩、酢酸塩などの水溶性塩などを挙げることができる。マンガンの場合は、過マンガン酸塩も用いることができる。これらの水溶性化合物は、無水物および水和物のいずれであってもよい。また、金属そのもの、酸化物あるいは水酸化物などの非水溶性化合物であっても、例えば、塩酸や硝酸などの酸を用いて溶解させて水溶液として用いることが可能である。これらの各原料化合物は、各金属源について、それぞれ単独で使用してもよく、2種以上を併用してもよい。
【0036】
該混合水溶液における上記各金属化合物の混合割合は、目的とする複合酸化物における各元素比と同様の元素比となるようにすればよい。
【0037】
混合水溶液中の各化合物の濃度については、特に限定的ではなく、均一な混合水溶液を形成でき、且つ円滑に共沈物を形成できるように適宜決めればよい。通常、構成金属化合物の合計濃度を、0.01〜5mol/l程度、好ましくは0.1〜2mol/l程度とすればよい。
【0038】
該混合水溶液の溶媒としては、水を単独で用いる他、メタノール、エタノールなどの水溶性アルコールを含む水−アルコール混合溶媒を用いても良い。水−アルコール混合溶媒を用いることにより、0℃を下回る温度での沈殿生成が可能となる。アルコールの使用量は、目的とする沈殿生成温度などに応じて適宜決めればよいが、通常、水100重量部に対して、50重量部程度以下の使用量とすることが適当である。
【0039】
該混合水溶液から沈殿物(共沈物)を生成させるには、該混合水溶液をアルカリ性とすればよい。良好な沈殿物を形成する条件は、混合水溶液に含まれる各化合物の種類、濃度などによって異なるので一概に規定出来ないが、通常、pH8程度以上とすることが好ましく、pH11程度以上とすることがより好ましい。
【0040】
該混合水溶液をアルカリ性にする方法については、特に限定はなく、通常は、該混合水溶液をアルカリ又はアルカリを含む水溶液に添加すればよい。また、アルカリを含む水溶液を該混合水溶液に添加する方法によっても共沈物を形成することができる。 該混合水溶液をアルカリ性にするために用いるアルカリとしては、例えば、水酸化カリウム、水酸化ナトリウム、水酸化リチウムなどのアルカリ金属水酸化物、アンモニアなどを用いることができる。これらのアルカリを水溶液として用いる場合には、例えば、0.1〜20mol/l程度、好ましくは0.3〜10mol/l程度の濃度の水溶液として用いることができる。また、アルカリは、上記した金属化合物の混合水溶液と同様に、水溶性アルコールを含む水−アルコール混合溶媒に溶解しても良い。
【0041】
沈殿生成の際には、混合水溶液の温度を-50℃から+15℃程度、好ましくは-40℃から+10℃程度にすることにより、反応時の中和熱発生に伴う目的組成とは異なるスピネル酸化物等の不純物生成が抑制され微細かつ均質な沈殿が形成されやすくなる。
【0042】
該混合水溶液をアルカリ性とした後、更に、0〜150℃程度(好ましくは10〜100℃程度)で、数時間〜7日間程度(好ましくは0.5日〜4日間程度)にわたり、反応溶液に空気を吹き込みながら、沈殿物の酸化・熟成処理を行うことが好ましい。
【0043】
得られた沈殿を蒸留水等で洗浄して、過剰のアルカリ成分、残留原料等を除去し、濾別することによって、得られたMg-M-Mn共沈物を精製することができる。
(ii)水熱処理
次いで、必要に応じて上記した方法で得られた共沈物を、水溶性リチウム化合物および酸化剤とともにアルカリ性条件下で水熱処理に供する。水熱処理は、該共沈物、水溶性リチウム化合物、及び酸化剤を含む水溶液をアルカリ性条件下で加熱することによって行うことができる。加熱は、通常、密閉容器中で行えばよい。水熱反応に用いる水溶液では、構成金属共沈物の含有量は、水1リットルあたり1〜100g程度とすることが好ましく、10〜80g程度とすることがより好ましい。
【0044】
水溶性リチウム化合物としては、例えば、塩化リチウム、硝酸リチウム等の水溶性リチウム塩、水酸化リチウム等を用いることができる。これらの水溶性リチウム化合物は、一種単独又は二種以上混合して用いることができ、無水物および水和物の何れを用いても良い。
【0045】
水溶性リチウム化合物の使用量は、沈殿生成物中の構成金属の合計モル数に対するリチウム元素モル比として、Li/(M+Mn)=1〜10程度とすることが好ましく、3〜7程度とすることがより好ましい。
【0046】
水溶性リチウム化合物の濃度は、0.1〜10mol/l程度とすることが好ましく、1〜8mol/l程度とすることがより好ましい。
また、酸化剤の存在下に水熱処理を行うことによって、充放電特性上好ましくない不純物相である斜方晶LiMnO2の副生を抑制することができる。特に、マンガン元素の比率の比較的高いリチウムマンガン系複合酸化物、例えば、組成式Li1+x(MgyMzMn1-y-z)1-xO2において、Mnの比率である(1−y−z)の値が0.5程度以上の酸化物を得る場合には、斜方晶LiMnO2が副生し易くなるが、これを抑制できる点で有効である。
【0047】
酸化剤としては、水熱反応時に分解して酸素発生するものであれば、特に限定無く使用でき、具体例として、塩素酸カリウム、塩素酸リチウム、過塩素酸リチウム、塩素酸ナトリウム、過酸化水素水等を挙げることができる。酸化剤は、一種単独又は二種以上混合して用いることができる。酸化剤の濃度は、0.1〜10mol/l程度とすることが好ましく、0.5〜5mol/l程度とすることがより好ましい。
【0048】
水熱反応を行う際の水溶液のpHについては、通常、pH8程度以上とすることが好ましく、pH11程度以上とすることがより好ましい。
【0049】
沈殿物及び水溶液リチウム化合物を含む水溶液がアルカリ性条件下にある場合には、そのまま加熱すればよいが、pH値が低い場合には、例えば、水酸化カリウム、水酸化ナトリウムなどのアルカリ金属水酸化物、アンモニアなどを添加してpH値を上げればよい。
【0050】
水熱反応は、通常の水熱反応装置(例えば、市販のオートクレーブ)を用いて行うことができる。
【0051】
水熱反応条件は、特に限定されるものではないが、通常100〜300℃程度で0.1〜150時間程度とすればよく、好ましくは150〜250℃程度で1〜100時間程度とすればよい。
【0052】
水熱反応終了後、通常、残存するリチウム化合物などの残存物を除去するために、反応生成物を洗浄する。洗浄には、例えば、水、水-アルコール混合溶液、アルコール、アセトンなどを用いることができる。次いで、生成物を濾過し、例えば、80℃以上の温度(通常は100℃程度)で乾燥することにより、後述する焼成用構成金属原料を得ることができる。
【0053】
(iii)焼成処理
次いで、水熱処理前に得られた共沈物または水熱反応生成物を、リチウム化合物と共に、焼成することによって、Li含有量、金属配合比および粉体特性を制御して目的とするMg含有リチウムマンガン系複合酸化物を得ることができる。焼成雰囲気については、特に限定はなく、大気中、酸化性雰囲気中、不活性雰囲気中、還元雰囲気中等任意の雰囲気を選択できる。
【0054】
焼成温度は、200〜1500℃程度とすることが好ましく、300〜1200℃程度とすることがより好ましい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0055】
焼成工程で用いるリチウム化合物としては、リチウム元素を含む化合物であれば特に限定なく使用でき、具体例として、炭酸リチウム、塩化リチウム、硝酸リチウム、酢酸リチウム等のリチウム塩、水酸化リチウム、これらの水和物等を挙げることができる。これらのリチウム化合物は、一種単独又は二種以上混合して用いることができる。リチウム化合物の使用量は、沈殿形成用原料中の金属成分の仕込みモル量に対して0.01〜3倍モル量程度とすればよい。
【0056】
通常、反応性を向上させるために、焼成用原料にリチウム化合物を加えて粉砕混合した後、焼成することが好ましい。粉砕の程度については、粗大粒子が含まれず、混合物が均一な色調となっていればよい。
【0057】
リチウム化合物は、粉末形態、水溶液形態等として用いることができるが、反応の均一性を確保するために、水溶液の形態で使用することが好ましい。この場合、水溶液の濃度については、通常、0.1〜10mol/l程度とすればよい。
【0058】
本発明では、構成する遷移金属の平均価数を低減するため、特に、還元性雰囲気下において焼成することが好ましく、これによって、Li含有量、Mn価数、粉体特性の制御が容易となり、簡単に目的とするリチウムマンガン系複合酸化物を得ることができる。
【0059】
還元性雰囲気下で焼成する方法については、特に限定はないが、例えば、窒素、アルゴンガスなどの不活性ガス気流下等の不活性雰囲気下において、有機物の存在下に焼成することによって、還元性雰囲気下における焼成が可能である。
【0060】
有機物としては、特に限定はなく、後述する焼成温度において分解して還元性雰囲気とすることができる炭素含有化合物であればよい。特に、水溶性の有機物を用いる場合には、水溶液状態でリチウムマンガン複合酸化物粉末と分散混合できるので有利である(このような有機物の具体例としては、ショ糖、ブドウ糖、デンプン、ポリエチレングリコールなどを挙げることができる。
【0061】
有機物の使用量は、沈殿形成用原料中の金属成分の仕込みモル量に対する炭素のモル比換算で0.001倍〜5倍モル程度とすることが好ましく、0.01倍〜1倍モル程度とすることがより好ましい。水溶液として用いる場合には有機物の濃度は、上記した使用量の範囲となるように適宜決めればよい。
【0062】
有機物の存在下で焼成する方法については、特に限定はなく、上記焼成用原料に、上記したリチウム化合物及び有機物を加えて混合した後、80℃以上の温度、好ましくは100℃程度の温度で加熱乾燥後、粉砕して、焼成すればよい。焼成温度は、150〜1000℃程度とすることが好ましく、200〜800℃程度とすることがより好ましい。
【0063】
焼成の際の雰囲気は、有機物の分解によって強い還元性の雰囲気となるように、窒素ガス中などの不活性ガス雰囲気とすればよい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0064】
上記した方法で焼成することによって、目的とするリチウムマンガン系複合酸化物について、Li含有量、構成金属平均価数、粉体特性等を容易に制御することができる。例えば、焼成の際に添加するリチウム化合物の量を適宜設定することによって、リチウムマンガン系複合酸化物中のリチウム含有量を調整することができる。また、焼成温度を高くすることによって、リチウムマンガン系複合酸化物の粒径を大きくすることができる。更に、有機物の添加量を増加させ、更に、焼成温度を上昇することによって、構成金属元素の平均価数をより低下させることが可能となる。
【0065】
上記した焼成処理は、リチウムマンガン系複合酸化物にリチウム化合物を添加して、焼成した後、有機物を添加して焼成する二段階の焼成処理としてもよい。二段階の焼成処理を行う場合には、Li含有量、構成金属平均価数、粉体特性等の制御をより簡単に行うことができる。
【0066】
この場合、リチウムマンガン系複合酸化物にリチウム化合物を添加して行う一段階目の焼成処理については、リチウム化合物の使用量などは上記した焼成処理と同様とすればよい。一段階目の焼成処理の条件については、焼成雰囲気は、大気中、酸化性雰囲気中、不活性雰囲気中、還元雰囲気中等任意の雰囲気を選択できる。焼成温度は、200〜1000℃程度とすることが好ましく、300〜800℃程度とすることがより好ましい。焼成時間は、焼成温度まで達する時間を含めて0.1〜100時間程度とすることが好ましく、0.5〜60時間程度とすることがより好ましい。
【0067】
上記した方法で一段階目の焼成処理を行った後、有機物を添加して焼成する二段階目の焼成処理を行えばよい。二段階目の焼成処理の条件は、上記したリチウム化合物と有機物を同時に添加して焼成処理を行う場合と同様の条件とすればよい。
【0068】
上記した焼成工程でリチウムマンガン系複合酸化物を得た後、通常、過剰のリチウム化合物や不純物等を除去するために、焼成物を水洗処理あるいは溶媒洗浄処理等に供する。その後、濾過を行い、例えば、80℃以上の温度、好ましくは100℃程度の温度で加熱乾燥してもよい。
【0069】
更に、必要に応じて、この加熱乾燥物を粉砕し、リチウム化合物、有機物を加えて、焼成し、洗浄し、乾燥するという一連の操作を繰り返し行うことにより、リチウムマンガン系複合酸化物の優れた特性(リチウムイオン二次電池用正極材料としての作動電圧領域における安定的な充放電特性、高容量など)をより一層改善することができる。
【0070】
リチウムイオン二次電池
本発明によるリチウムマンガン系複合酸化物を用いるリチウムイオン二次電池は、公知の手法により製造することができる。例えば、正極材料として、本発明による新規な複合酸化物を使用し、負極材料として、公知の金属リチウム、炭素系材料(活性炭、黒鉛)、珪素、酸化珪素などを使用し、電解液として、公知のエチレンカーボネート、プロピレンカーボネート、ジメチルカーボネート、ジエチルカーボネートなどからなる混合溶媒に過塩素酸リチウム、LiPF6などのリチウム塩を溶解させた溶液(有機電解液)を使用し、さらにその他の公知の電池構成要素を使用して、常法に従って、リチウムイオン二次電池を組立てればよい。
【発明の効果】
【0071】
本発明によれば、安価な原料及び金属元素を使用して、平均放電電圧が3V以上を保持でき、充放電サイクル特性に優れた正極材料として有用な新規な複合酸化物を得ることができる。
【0072】
本発明のリチウムマンガン系複合酸化物がこのような特性を有するのは、従来の正極材料とは異なり、放電曲線が放電終止電圧(2.0V)に向かって緩やかに低下していく形状であることによるものであり、放電終止電圧を2.0V程度まで下げることによって、容易に高容量化を実現することができ、小型民生用のみならず車載用などの大型リチウムイオン二次電池用正極材料としてきわめて有用である。
【0073】
特に、本発明の複合酸化物は、Mgを含まないか、或いは、Mg含有量が少ない以外は、同様の組成を有する複合酸化物と比較して、充放電を繰り返した後の充放電容量が高いという特徴を有するものである。このため、より長期間にわたり良好な特性を保持することができる。
【0074】
本発明によるリチウムマンガン系複合酸化物は、上記の優れた性能を有するものであり、高容量で、かつ低コストのリチウムイオン二次電池用正極材料として、極めて有用である。
【図面の簡単な説明】
【0075】
【図1】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、単斜晶層状岩塩型構造の結晶相(Li2MnO3)の結晶構造を模式的に示す図面(結晶構造描画ソフトVESTAを用いて描画)。
【図2】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、Li2MnO3の結晶構造内のMn-Li層内のLiおよびMnイオン配列を示す図面(結晶構造描画ソフトVESTAを用いて描画)。
【図3】本発明のリチウムマンガン系複合酸化物を構成する結晶相の内で、立方晶岩塩型構造の結晶相α-LiFeO2の結晶構造を模式的に示す図面(結晶構造描画ソフトVESTAを用いて描画)。
【図4】実施例1および比較例1で得られた試料のX線回折図。
【図5】実施例1および比較例1で得られた試料を正極としたリチウム二次電池の初回および10サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図6】実施例2および比較例2で得られた試料のX線回折図。
【図7】実施例2および比較例2で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図8】実施例3および比較例3で得られた試料のX線回折図。
【図9】実施例3および比較例3で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図10】実施例4および比較例4で得られた試料のX線回折図。
【図11】実施例4および比較例4で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【図12】実施例5および比較例2で得られた試料のX線回折図。
【図13】実施例5および比較例2で得られた試料を正極としたリチウム二次電池の初回および50サイクル後の充放電曲線(右上がりの曲線が充電曲線、右下がりの曲線が放電曲線を示す)。
【発明を実施するための形態】
【0076】
以下、実施例および比較例を示し、本発明の特徴とするところを一層明確にするが、本発明は以下の実施例、比較例のみに限定されるものではない。
【0077】
実施例1
硝酸マグネシウム(II)6水和物12.82 g、及び塩化マンガン(II)4水和物39.58 g (全量0.25 mol、Mg:Mnモル比=2:8)を500 mlの蒸留水に加え、完全に溶解させ、金属塩水溶液とした。別のビーカーに水酸化リチウム水溶液(蒸留水1000 mlに無水水酸化リチウム60 gを溶解させた溶液)を作製し、この水溶液をチタン製ビーカーに入れて攪拌しながら、上記金属塩水溶液を2〜3時間かけて、室温(約20℃)にて徐々に滴下して、Mg-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で1日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0078】
得られた沈殿を濾別し、沈殿形成用原料中の金属成分の仕込みモル量に対して1.5倍モル量相当の水酸化リチウム1水和物15.74 gを蒸留水200 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0079】
得られた粉末を、大気中で1時間かけて650℃まで昇温し、その温度で20時間保持後、炉冷した。次いで、得られた粉末を粉砕後、沈殿形成用原料中の金属成分の仕込みモル量に対して0.3倍の炭素モル量に相当するショ糖(2.14g)を蒸留水100ml中に溶解させたショ糖水溶液に分散させた後、100℃で乾燥および粉砕した。
【0080】
得られた粉末を窒素中で3時間かけて300 ℃まで昇温後、その温度で窒素中において1時間焼成し、炉中で室温付近まで冷却して、過剰のリチウム塩等を除去するために焼成物を蒸留水で水洗し、濾過および乾燥して最終的に粉末状生成物を得た。
【0081】
生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウム含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0082】
比較例1
沈殿物形成用の原料として、硝酸マグネシウムを含まない塩化マンガン(II)4水和物49.48g (全量0.25 mol)の水溶液を金属塩水溶液として用いる以外は、実施例1と全く同じ操作を行い、目的とするリチウムマンガン系複合酸化物の粉末状生成物を得た。
【0083】
X線回折による評価
図4に、実施例1および比較例1で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表1に示す結晶学パラメーターを算出した。
【0084】
【表1】

【0085】
図4に示す実施例1および比較例1で得られた試料のX線回折ピークから、両試料ともに、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0086】
【数3】

【0087】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。
【0088】
以上の結果から、実施例1及び比較例1で得られた粉末状生成物は、ともに目的の単斜晶層状岩塩型結晶相のみであることが確認できた。
【0089】
化学分析等による評価
ICP発光分析を用いて、実施例1および比較例1で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表2に示す。
【0090】
【表2】

【0091】
表2に示す元素分析結果から、上記方法で得られた実施例1の粉末状組成物は、化学組成式中のx値およびy値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0092】
充放電特性評価
実施例1および比較例1で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、以下の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表3及び図5に示す。
<電池構成及び充放電試験条件>
正極:活物質5 mg+AB 5mg+PTFE 0.5mgを混合しAlメッシュ上に圧着
負極:金属リチウム
電解液:LiPF6をEC+DMC溶媒中に溶解させたもの
試験温度:30 ℃
電流密度(活物質あたり):40 mA/g、
電位範囲:2.0-4.8 V
(充電のみ4.8Vまでの定電流―定電圧充電(10 mA/gに下がるまで4.8Vを維持する方法))
AB:アセチレンブラック、PTFE:ポリテトラフルオロエチレン、EC:エチレンカーボネート、DMC:ジメチルカーボネート
【0093】
【表3】

図5および表3に示す結果より、実施例1で得られた試料は、比較例1で得られた試料と比較すると、初期充電容量がかなり低いにもかかわらず、初期放電容量は同等に近いものであった。その結果、実施例1で得られた試料は、初期充放電効率が86%であり、比較例1で得られた試料(初期充放電効率74 %)と比較して、初期充放電効率が大幅に改善されていた。
【0094】
Mgを含有する実施例1で得られた試料は、初期放電エネルギー密度、平均初期放電電圧が僅かに低いものの、初期充放電効率が高く、10サイクル後放電容量が、比較例1で得られた試料と比べて大きいことから、Mgを含有しない比較例1で得られた試料と比較して充放電サイクル特性に優れたものであることが明らかである。
【0095】
実施例2
硝酸マグネシウム(II)6水和物6.41 g、30%硫酸チタン(IV)溶液60.00g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Ti:Mnモル比=1:3:6)を500 mlの蒸留水に加え、完全に溶解させ、金属塩水溶液を作製した。別のビーカーに水酸化リチウムの水-エタノール溶液(蒸留水500 mlおよびエタノール150mlに水酸化リチウム1水和物50gを溶解させた溶液)を作製した。この水酸化リチウム溶液をチタン製ビーカーに入れ、-10℃に冷却された恒温槽内に固定し、攪拌した。攪拌された水酸化リチウム溶液に上記金属塩水溶液を2〜3時間かけ、徐々に滴下して、Mg-Ti-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で2日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0096】
得られた沈殿を濾別し、沈殿形成用原料中の金属成分の仕込みモル量に対して1.5倍モル量相当の水酸化リチウム1水和物15.74 gを蒸留水200 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0097】
得られた粉末は、大気中で1時間かけて850℃まで昇温し、その温度で大気中1時間保持後、炉冷した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0098】
比較例2
沈殿物形成用の原料として、30%硫酸チタン(IV)溶液80.00g及び塩化マンガン(II)4水和物29.69g (全量0.25 mol、Ti:Mnモル比=4:6)を含む水溶液を用いる以外は、実施例2と全く同じ操作を行い、チタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0099】
X線回折による評価
図6に、実施例2および比較例2で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表4に示す結晶学パラメーターを算出した。
【0100】
【表4】

【0101】
図6に示す実施例2で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0102】
【数4】

【0103】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。一方比較例2の試料は上記層状岩塩型Li2MnO3相の他に、実施例2の試料では見られない、図中矢印で示される不純物由来のピークが存在することから、立方晶スピネル型構造を有するLi4Ti5O12の単位胞(空間群
【0104】
【数5】

【0105】
a=8.352(4) Å, K. Kataoka, Y. Takahashi, N. Kijima, J. Akimoto, K. Ohshima, Journal of Physics and Chemistry of Solids (2008) 69, p1454-p1456.)の2相混合モデルを用いてフィットする必要があった。層状岩塩型結晶相と立方晶スピネル相の存在比率は、98:2であった。
【0106】
以上の結果から、実施例2及び比較例2で得られた粉末状生成物は、ともに単斜晶層状岩塩型結晶相を含んでいるが、Mgを含まない比較例2の試料がスピネル相を含むことから、Mgを導入することにより不純物相であるスピネル相の生成を抑制する効果があることが確認できた。
【0107】
化学分析等による評価
ICP発光分析を用いて、実施例2および比較例2で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表5に示す。
【0108】
【表5】

【0109】
表5に示す元素分析結果から、上記方法で得られた実施例2の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0110】
充放電特性評価
実施例2および比較例2で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表6及び図7に示す。
【0111】
【表6】

【0112】
図7および表6に示す結果より、実施例2で得られた試料は、比較例2で得られた試料と比較すると、初期充放電容量が高くなっていた。実施例2で得られた試料の初期充放電効率が64%であり、比較例2で得られた試料(初期充放電効率75 %)と比較して劣るものの、初期放電エネルギー密度、平均初期放電電圧、50サイクル後放電容量が、比較例2で得られた試料と比べて大きいことから、Mgを含有する実施例2で得られた試料は、Mgを含有しない比較例2で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【0113】
実施例3
実施例2と同様に沈殿物形成用の金属塩水溶液を作製し、同様の操作で沈殿作製、熟成、水酸化リチウム添加、850℃大気中焼成を実施後、炉冷した。次いで、得られた粉末を粉砕し、沈殿形成用原料中の金属成分の仕込みモル量に対して0.3倍の炭素モル量に相当するショ糖(2.14g)を蒸留水100ml中に溶解させたショ糖水溶液に分散し、100℃で乾燥および粉砕した。
【0114】
得られた粉末を窒素中で3時間かけて600 ℃まで昇温後、その温度で窒素中において1時間焼成し、炉中で室温付近まで冷却した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末状生成物を得た。
【0115】
比較例3
比較例2と同様の金属塩水溶液を用いる以外は、実施例3と全く同じ操作を行い、チタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0116】
X線回折による評価
図8に、実施例3および比較例3で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表7に示す結晶学パラメーターを算出した。
【0117】
【表7】

【0118】
図8に示す実施例3および比較例3で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0119】
【数6】

【0120】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)に加えて、立方晶岩塩型構造を有するLi2TiO3の単位胞(空間群
【0121】
【数7】

【0122】
a=4.1405(3)Å, M. Tabuchi, A. Nakashima, H. Shigemura, K. Ado, H. Kobayashi, H. Sakaebe, K. Tatsumi, H. Kageyama, T. Nakamura and R. Kanno, Journal of Materials Chemistry, 13, 1747-1757 (2003). )を用いて指数付けが可能であり、両結晶相が共存している構造モデルでフィット可能であることがわかった。2相構造モデルにおける単斜晶相と立方晶相の割合は、表7から実施例3の試料の場合に25:75、比較例3の試料の場合は18:82であった。
【0123】
以上の結果から、実施例3及び比較例3で得られた粉末状生成物は、ともに目的物質である単斜晶層状岩塩型結晶相および立方晶岩塩型結晶相を含んでいることが確認できた。
【0124】
化学分析等による評価
ICP発光分析を用いて、実施例3および比較例3で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表8に示す。
【0125】
【表8】

【0126】
表8に示す元素分析結果から、上記方法で得られた実施例3の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0127】
充放電特性評価
実施例3および比較例3で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表9及び図9に示す。
【0128】
【表9】

【0129】
図9および表9に示す結果より、実施例3で得られた試料は、比較例3で得られた試料と比較すると、初期充放電容量が高いのみならず、初期充放電効率、初期放電エネルギー密度、平均初期放電電圧、50サイクル後放電容量に関して優れていることがわかる。すなわち、Mgを含有する実施例3で得られた試料は、Mgを含有しない比較例3で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【0130】
実施例4
硝酸マグネシウム(II)6水和物6.41 g、硝酸鉄(III)9水和物30.30g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Fe:Mnモル比=1:3:6)を500 mlの蒸留水に加え、完全に溶解させた。別のビーカーに水酸化リチウムの水−エタノール溶液(蒸留水500 mlおよびエタノール200mlに水酸化リチウム1水和物50 gを溶解させた溶液)を作製した。この水酸化リチウム溶液をチタン製ビーカーに入れ、-10℃に冷却された恒温槽内で攪拌した。攪拌・冷却された水酸化リチウム溶液に上記金属塩水溶液を2〜3時間かけ、徐々に滴下して、Mg-Fe-Mn沈殿物を形成させた。反応液が完全にアルカリ性(pH11以上)になっていることを確認し、攪拌下に共沈物を含む反応液に室温で1日間空気を吹き込んで湿式酸化処理して、沈殿を熟成させた。
【0131】
得られた沈殿を濾別し、ポリテトラフルオロエチレンビーカー内で蒸留水200mlに水酸化カリウム310g、水酸化リチウム1水和物50g、塩素酸カリウム50gを入れて攪拌したものに、濾別された沈殿を加え、よく分散させた。このポリテトラフルオロエチレンビーカーを水熱反応炉内に設置し、220℃で48時間水熱処理を行った。水熱処理後、室温まで炉冷された水熱反応炉からビーカーを取り出し、固形物を蒸留水2000mlで数回洗浄して、水酸化カリウムなどを除去し、濾過して粉末状生成物を得た。
【0132】
沈殿形成用原料中の金属成分の仕込みモル量に対して0.5倍モル量相当の水酸化リチウム1水和物5.25 gを蒸留水100 mlに溶解させた水酸化リチウム水溶液と濾別した沈殿を混合して、撹拌後、100 ℃において一晩乾燥し、粉砕して粉末を作製した。
【0133】
得られた粉末は大気中で1時間かけて750℃まで昇温し、その温度で大気中5時間保持後、炉冷した。生成物を蒸留水で洗浄して、過剰に存在する水酸化リチウムなどの塩類を除去し、濾過および100 ℃で乾燥することにより、目的物であるマグネシウムおよび鉄含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0134】
比較例4
沈殿物形成用の原料として、硝酸鉄(III)9水和物40.40g及び塩化マンガン(II)4水和物29.69g (全量0.25 mol、Fe:Mnモル比=4:6)を含む水溶液を金属塩水溶液として用いる以外は、実施例4と全く同じ操作を行い、目的とする鉄含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0135】
X線回折による評価
図10に、実施例4および比較例4で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表10に示す結晶学パラメーターを算出した。
【0136】
【表10】

【0137】
図10に示す実施例4および比較例4で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0138】
【数8】

【0139】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。
【0140】
以上の結果から、実施例4及び比較例4で得られた粉末状生成物は、Mgの有無にかかわらず、ともに目的物質である単斜晶層状岩塩型結晶相を含んでいることが確認できた。
【0141】
化学分析等による評価
ICP発光分析を用いて、実施例4および比較例4で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表11に示す。
【0142】
【表11】

【0143】
表11に示す元素分析結果から、上記方法で得られた実施例4の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0144】
充放電特性評価
実施例4および比較例4で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表12及び図11に示す。
【0145】
【表12】

【0146】
図11および表12に示す結果より、実施例4で得られた試料は、比較例4で得られた試料に対して、初期充放電容量および初期充放電効率、初期放電エネルギー密度がほぼ同等であるが、平均初期放電電圧が高く、50サイクル後放電容量が大きいことから、Mgを含有する実施例4で得られた試料は、Mgを含有しない比較例4で得られた試料と比較して充放電サイクル特性に優れたものであることが明らかである。
【0147】
実施例5
沈殿物形成用の原料として、硝酸マグネシウム(II)6水和物19.23 g、30%硫酸チタン(IV)溶液20.00g及び塩化マンガン(II)4水和物29.69 g (全量0.25 mol、Mg:Ti:Mnモル比=3:1:6)を含む水溶液を用いる以外は実施例2および比較例2と全く同じ操作で、目的物であるマグネシウムおよびチタン含有リチウムマンガン系複合酸化物の粉末生成物を得た。
【0148】
X線回折による評価
図12に、実施例5および比較例2で得られた各粉末生成物のX線回折(XRD)図を示す。これらのXRDパターンに対して解析プログラムRIETAN-2000(F. Izumi and T. Ikeda, Mater. Sci. Forum, vol.321-324 p.198-203 (2000).)によるリートベルト解析を実施し、表13に示す結晶学パラメーターを算出した。
【0149】
【表13】

【0150】
図12に示す実施例5で得られた試料のX線回折ピークから、以前に報告されている単斜晶層状岩塩型構造を有するLi2MnO3の単位胞(空間群
【0151】
【数9】

【0152】
a=4.937(1) Å , 8.532(1)Å, c=5.030(2)Å ,β=109.46(3)°, P. Strobel and B. Lambert-Andron, Journal of Solid State Chemistry, 75, 90-98 (1988).)のみで指数付けが可能であり、単斜晶層状岩塩型構造を有するLi2MnO3結晶相単相で問題なくフィット可能であった。一方比較例2の試料は上記層状岩塩型Li2MnO3相の他に、実施例5の試料では見られない、図中矢印で示される不純物由来のピークが存在することから、立方晶スピネル型構造を有するLi4Ti5O12の単位胞(空間群
【0153】
【数10】

【0154】
a=8.352(4) Å, K. Kataoka, Y. Takahashi, N. Kijima, J. Akimoto, K. Ohshima, Journal of Physics and Chemistry of Solids (2008) 69, p1454-p1456.)の2相混合モデルを用いてフィットする必要があった。層状岩塩型結晶相と立方晶スピネル相の存在比率は、98:2であった。
【0155】
以上の結果から、実施例5及び比較例2で得られた粉末状生成物は、ともに単斜晶層状岩塩型結晶相を含んでいるが、Mgを含まない比較例2の試料がスピネル相を含むものであり、Mgを導入することにより不純物相であるスピネル相の生成を抑制する効果があることが明らかである。
【0156】
化学分析等による評価
ICP発光分析を用いて、実施例5および比較例2で得られた粉末状生成物の化学組成および遷移金属価数を求めた。結果を表14に示す。
【0157】
【表14】

【0158】
表14に示す元素分析結果から、上記方法で得られた実施例5の粉末状組成物は、化学組成式中のx値、y値およびz値が、いずれも本発明酸化物の組成範囲内であることがわかる。
【0159】
充放電特性評価
実施例5および比較例2で得られた各試料をそれぞれ正極活物質としてリチウム二次電池を作製し、実施例1と同様の電池構成及び充放電試験条件で充放電試験を行った。結果を下記表15及び図13に示す。
【0160】
【表15】

【0161】
図13および表15に示す結果より、実施例5で得られた試料は、比較例2で得られた試料と比較すると、初期充放電容量、初期充放電効率、及び初期放電エネルギー密度が高くなっていた。実施例5で得られた試料は、平均初期放電電圧は比較例2の試料に劣るものの、50サイクル後放電容量が、比較例2で得られた試料と比べて大きいことから、Mgを含有する実施例5で得られた試料は、Mgを含有しない比較例2で得られた試料と比較して充放電初期特性およびサイクル特性に優れたものであることが明らかである。
【特許請求の範囲】
【請求項1】
組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
【請求項2】
単斜晶層状岩塩型構造の結晶相の単相、又は単斜晶層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の混合相からなる請求項1に記載のリチウムマンガン系複合酸化物。
【請求項3】
マグネシウム化合物、マンガン化合物、並びに、必要に応じて、チタン化合物及び鉄化合物からなる群から選ばれた少なくとも一種の化合物を含む水溶液をアルカリ性として沈殿を形成した後、形成された沈殿物をリチウム化合物の存在下で焼成することを特徴とする、請求項1又は2に記載のリチウムマンガン系複合酸化物の製造方法。
【請求項4】
沈殿を形成した後、形成された沈殿物を含む水溶液に空気を吹き込んで沈殿物の酸化・熟成処理を行う工程を含む請求項3に記載の方法。
【請求項5】
形成された沈殿物を焼成する前に、酸化剤および水溶性リチウム化合物と共に該沈殿物をアルカリ性条件下で水熱処理する工程を含む請求項3又は4に記載の方法。
【請求項6】
沈殿物の焼成を、不活性雰囲気において有機物の存在下で行う請求項3〜5のいずれかに記載の方法。
【請求項7】
沈殿物の焼成を、リチウム化合物の存在下で焼成した後、不活性雰囲気において有機物の存在下で焼成する二段階の焼成方法で行う、請求項3〜5のいずれかに記載の方法。
【請求項8】
請求項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料。
【請求項9】
請求項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料を構成要素とするリチウムイオン二次電池。
【請求項1】
組成式:Li1+x(MgyMzMn1-y-z)1-xO2(式中、MはFe及びTiからなる群から選ばれる少なくとも一種の元素であり、x、y及びzの範囲は、0≦x≦1/3, 0.08≦y≦0.35, 0≦z≦0.6である)で表され、単斜晶層状岩塩型構造を有する結晶相を含むリチウムマンガン系複合酸化物。
【請求項2】
単斜晶層状岩塩型構造の結晶相の単相、又は単斜晶層状岩塩型構造の結晶相と立方晶岩塩型構造の結晶相の混合相からなる請求項1に記載のリチウムマンガン系複合酸化物。
【請求項3】
マグネシウム化合物、マンガン化合物、並びに、必要に応じて、チタン化合物及び鉄化合物からなる群から選ばれた少なくとも一種の化合物を含む水溶液をアルカリ性として沈殿を形成した後、形成された沈殿物をリチウム化合物の存在下で焼成することを特徴とする、請求項1又は2に記載のリチウムマンガン系複合酸化物の製造方法。
【請求項4】
沈殿を形成した後、形成された沈殿物を含む水溶液に空気を吹き込んで沈殿物の酸化・熟成処理を行う工程を含む請求項3に記載の方法。
【請求項5】
形成された沈殿物を焼成する前に、酸化剤および水溶性リチウム化合物と共に該沈殿物をアルカリ性条件下で水熱処理する工程を含む請求項3又は4に記載の方法。
【請求項6】
沈殿物の焼成を、不活性雰囲気において有機物の存在下で行う請求項3〜5のいずれかに記載の方法。
【請求項7】
沈殿物の焼成を、リチウム化合物の存在下で焼成した後、不活性雰囲気において有機物の存在下で焼成する二段階の焼成方法で行う、請求項3〜5のいずれかに記載の方法。
【請求項8】
請求項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料。
【請求項9】
請求項1又は2に記載のリチウムマンガン系複合酸化物からなるリチウムイオン二次電池用正極材料を構成要素とするリチウムイオン二次電池。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2013−100197(P2013−100197A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2011−244831(P2011−244831)
【出願日】平成23年11月8日(2011.11.8)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度独立行政法人新エネルギー・産業技術総合開発機構「次世代自動車用高性能蓄電システム技術開発/要素技術開発/高容量・低コスト新規酸化物正極材料の研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(592197418)株式会社田中化学研究所 (34)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成23年11月8日(2011.11.8)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度独立行政法人新エネルギー・産業技術総合開発機構「次世代自動車用高性能蓄電システム技術開発/要素技術開発/高容量・低コスト新規酸化物正極材料の研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(592197418)株式会社田中化学研究所 (34)
【Fターム(参考)】
[ Back to top ]

