リチウム二次電池とその製造方法
【課題】結晶構造の安定性に優れた、リチウム含有リン酸化合物からなる正極活物質を正極に備えるリチウム二次電池を提供する。
【解決手段】本発明により、正極と負極を有する電極体を備えるリチウム二次電池が提供される。ここで、前記正極は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、前記A元素が5価の金属元素であることを特徴とする。
【解決手段】本発明により、正極と負極を有する電極体を備えるリチウム二次電池が提供される。ここで、前記正極は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、前記A元素が5価の金属元素であることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、リチウム二次電池に関する。詳しくは、結晶構造の安定性に優れた正極活物質を正極に備える該電池に関する。
【背景技術】
【0002】
リチウムイオン電池その他のリチウム二次電池は、既存の電池に比べ、小型、軽量かつ高エネルギー密度であって、出力密度に優れる。このため、近年、パソコンや携帯端末等のいわゆるポータブル電源や、車両駆動用電源として好ましく用いられている。
【0003】
この種のリチウム二次電池(典型的にはリチウムイオン電池)は、正極および負極を備える電極体と、電解質(典型的には電解液)とを電池ケースに収容した構成を備える。そして、該電極(正極および負極)は、対応する正負の集電体上に電荷担体(典型的にはリチウムイオン)を可逆的に吸蔵および放出し得る活物質(正極活物質および負極活物質)を主成分とする電極合材層(具体的には、正極合材層および負極合材層)を、それぞれ備えている。かかる正極活物質としては、近年、高エネルギー密度を発現し得るオリビン型リチウム含有リン酸化合物(LiMPO4(ただし、MはNi、Mn、FeおよびCoのうちの少なくとも一種以上の元素))が注目されている。オリビン型リチウム含有リン酸化合物に関する従来技術としては、特許文献1、2が挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2010−267501号公報
【特許文献2】特開2010−040272号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
リチウム二次電池では、充電反応に伴い正極活物質からリチウムイオン(Li+)が放出される。この際、正極活物質中では電荷補償(典型的には、遷移金属イオンの酸化(例えば、Ni2+→Ni3+))が行われ、電気的中性が保たれている。しかし、上記オリビン型リチウム含有リン酸化合物は高電位領域における結晶構造が不安定なため、電荷補償に伴って酸素元素等の脱離を生じ、結晶構造が崩壊する場合がある。かかる場合、それ以降の充放電においてリチウムイオンの吸蔵および放出が行われなくなる(または行われ難くなる)ため、電池性能(例えばサイクル特性)が低下する虞がある。よって、オリビン型リチウム含有リン酸化合物を正極活物質として用いる際の1つの課題として、結晶構造をより安定化させることが挙げられる。
【0006】
本発明はかかる点に鑑みてなされたものであり、その主な目的は、結晶構造の安定性に優れたリチウム含有リン酸化合物を正極活物質として正極に含むリチウム二次電池を提供することである。また他の目的は、かかるリチウム含有リン酸化合物の好適な製造方法を提供することである。
【課題を解決するための手段】
【0007】
上記目的を実現するべく、本発明により、正極と負極を有する電極体を備えるリチウム二次電池が提供される。ここで、上記正極は一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、上記A元素が5価の金属元素であることを特徴とする。
かかるリチウム含有リン酸化合物は、P元素の一部が5価の金属元素(A元素)で置換されることにより、結晶構造の層間隔がリチウムイオンの吸蔵および放出に好適な距離に保たれている。また、従来より結晶構造の安定性に優れている。このため、かかるリチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池の電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を向上することができる。
【0008】
なお、特許文献2には、オリビン型リチウム含有リン酸マンガン化合物中のMn元素の一部を異元素で置換する技術が開示されている。しかし、特許文献2の技術は正極活物質の利用効率の向上を目的としており、上述したような結晶構造の安定性に関しては検討がなされていない。それゆえ合成方法として、いわゆる固相法(粉末原料化合物を溶融することなく混合し、焼成する手法)を採用しているが、後述する試験例≪I.LiNiPWO4に関する評価試験≫の欄に示すように、かかる手法ではここで開示されるような結晶構造の安定性に優れた化合物を得ることはできない。
【0009】
ここで開示されるリチウム二次電池の好ましい一態様では、上記5価の金属元素はWであることが挙げられる。
タングステン(W)を結晶構造に有するリチウム含有リン酸化合物は、構造がより安定化されている。よって、かかるリチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池の電池性能をより向上することができる。
【0010】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、空間群Cmcmと、空間群Pnmaと、を含むことが挙げられる。
空間群Cmcmの結晶構造を有する場合、従来の空間群Pnmaに属するオリビン型構造のみの場合に比べ結晶構造の安定性に優れる。このため、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0011】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、上記M元素としてMnを含んでおり、0<Y≦0.1の条件を満たしていることが挙げられる。
上記条件を満たすリチウムマンガン含有リン酸化合物は、結晶構造の熱安定性に優れるため、高電位領域(即ち、リチウムイオンの脱離量が多い状態)においても酸素元素の脱離等が抑制される。このため、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0012】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、上記M元素としてNiを含んでおり、0<Y≦0.05の条件を満たしていることが挙げられる。
上記条件を満たすリチウムニッケル含有リン酸化合物は、好適に空間群Cmcmの結晶構造を含んでいるため、より結晶構造の安定性に優れる。よって、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0013】
ここで開示されるリチウム二次電池の好ましい一態様では、上記粒状の正極活物質は、該粒子表面の少なくとも一部が導電性粉末で被覆されていることが挙げられる。
オリビン型リチウム含有リン酸化合物は高エネルギー密度を発現し得る反面、導電性が低いという問題があるが、該化合物粒子の表面を導電性粉末で被覆することにより電子伝導性を補うことができる。よって、該化合物を正極活物質として用いたリチウム二次電池の抵抗を低減することができる。
【0014】
ここで開示されるリチウム二次電池の好ましい一態様では、上記粒状の正極活物質は、電子顕微鏡観察における一次粒径が10nm以上200nm以下であることが挙げられる。
一次粒子の粒径が上記範囲にある正極活物質では、充放電反応に伴うリチウムイオンの吸蔵および放出がスムーズである(即ち、抵抗が低減されている)。また、該活物質の利用効率をも向上し得るため、該化合物を正極活物質として用いた該電池の電池性能(例えばエネルギー密度、出力密度)をより向上することができる。
【0015】
ここで開示されるリチウム二次電池の好ましい一態様では、上記負極は、負極活物質として少なくともチタン酸リチウム(LTOともいう;Li4Ti5O12)を含むことが挙げられる。
リチウム含有リン酸化合物は電位が高いため、正極活物質として用いる場合は高電位窓の電解液を使用する必要がある。このため負極活物質としては、標準電位が凡そ1.55Vと高電位なLTOを好適に用いることができる。
【0016】
また、上記目的を実現するべく、本発明により、リチウム二次電池用の正極活物質を製造する方法が提供される。かかる正極活物質の製造方法は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を構成するための原料として、リチウム源と、リン酸源と、M元素源と、A元素源と、を水系溶媒中で混合し、原料混合物を調製すること、上記原料混合物を加熱処理して、ゲル状の原料混合物を得ること、および、上記ゲル状の原料混合物を、800℃以下の温度で焼成すること、を包含する。
ここで開示される製造方法によれば、原子レベルでの結晶構造の制御が可能となり、均質なリチウム含有リン酸化合物を安定して製造することができる。また原料混合物の各成分をゲル内に均一に拡散し得るため、結晶化度が高く、且つ粒径の小さな(典型的には粒径が200nm以下の)該化合物を好適に製造することができる。
【0017】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記原料混合物の調製は、上記水系溶媒のpHが3以下で行うことが挙げられる。
かかる環境下においては、水酸化物等の不純物の生成を抑制し得るため、純度の高いリチウム含有リン酸化合物を効率よく製造することができる。
【0018】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記原料混合物の調製において、キレート剤を添加することが挙げられる。
該キレート剤を添加することにより、粒子状の原料化合物がより均一に水系溶媒中に分散され得る。このため、より均質なリチウム含有リン酸化合物を合成することができる。また、キレート剤が該粒子の表面を被覆することで粒子の成長を抑制し得るため、粒径の小さな該化合物を製造することができる。よって、かかるリチウム含有リン酸化合物を正極に備えたリチウム二次電池では、電池性能(例えば、エネルギー密度)をより向上することができる。
【0019】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記焼成において、上記ゲル状の原料混合物を400℃以下の温度で仮焼成すること、および上記仮焼成物と導電性粉末とを混合し、上記仮焼成温度以上であって800℃以下の温度で本焼成すること、を包含する。
急激な高温焼成する前に、先ず400℃以下の温度で焼成することにより、リチウム含有リン酸化合物の結晶を段階的に成長させることができるため、より均質な該化合物を製造することができる。また、該化合物粒子と導電性粉末とを混合してから本焼成することで、該化合物粒子の表面が導電性粉末で被覆され、導電性が向上する。
【0020】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記仮焼成は、120℃以上400℃以下で行うことが挙げられる。
かかる温度域で仮焼成を行うことにより、水系溶媒をゆっくり揮発させてリチウム含有リン酸化合物結晶の成長を抑制しつつも、該溶媒を十分に除去し得る。このため、その後の本焼成において、該化合物の表面が導電性粉末で良好に被覆され、より導電性の高い該化合物を得ることができる。
【0021】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記導電性粉末として、電子顕微鏡観察における一次粒径が10nm以上100nm以下の炭素材料を用いることが挙げられる。
導電材は、一次粒子の粒径が比較的小さいものほど比表面積が広く、リチウム含有リン酸化合物の導電性を向上させるのに好適である。また、粒径が小さいものほど、該化合物表面を均一にコーティングすることができるため、より均質で薄い導電性膜を形成することができる。
【0022】
また、ここに開示されるいずれかの製造方法により製造された正極活物質を正極用いるリチウム二次電池は、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得る。本発明によって提供されるリチウム二次電池は、各種用途に利用可能であるが、特に上記電池性能は、車両に搭載される電池の電源として好適であり得る。したがって、ここに開示されるリチウム二次電池は、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)、燃料電池自動車(FCV)等の電源として好適に使用され得る。また、かかるリチウム二次電池は、単独で使用(即ち、単電池)されてもよく、直列および/または並列に複数接続されてなる組電池の形態で使用されてもよい。
【図面の簡単な説明】
【0023】
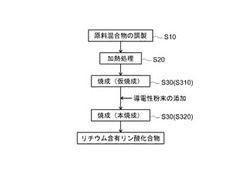
【図1】本発明の一実施形態に係るオリビン型リチウム含有リン酸化合物の製造プロセスを示す工程フロー図である。
【図2】本発明の一実施形態に係るリチウム二次電池の外形を模式的に示す斜視図である。
【図3】本発明の一実施形態に係るリチウム二次電池の構成を示す模式図である。
【図4】本発明の一実施形態に係るリチウム二次電池の捲回電極体の構成を示す模式図である。
【図5】本発明の一実施形態に係るリチウム二次電池を車両駆動用電源として備えた車両(自動車)を模式的に示す側面図である。
【図6】本発明の一実施例に係る、LiNiPWO4の合成直後におけるX線回折パターンを測定したグラフである。
【図7】本発明の一実施例に係る、LiNiPWO4のCV試験後におけるX線回折パターンを測定したグラフである。
【図8】本発明の一比較例に係る、LiNiPWO4の合成直後におけるX線回折パターンを測定したグラフである。
【図9】本発明の一実施例に係る、LiMnPWO4のX線回折パターンを測定したグラフである。
【図10】本発明の一実施例に係る、LiMnPWO4のDSC測定により得られた発熱ピークトップ温度を表したグラフである。
【発明を実施するための形態】
【0024】
本明細書において「リチウム二次電池」とは、電解質イオンとしてリチウムイオンを利用し、正負極間におけるリチウムイオンに伴う電荷の移動により充放電が実現される二次電池をいう。一般にリチウムイオン電池(若しくはリチウムイオン二次電池)、リチウムポリマー電池、リチウム空気電池、リチウム硫黄電池等と称される二次電池は、本明細書におけるリチウム二次電池に包含される典型例である。
また、本明細書において「活物質」とは、正極側又は負極側において蓄電に関与する物質(化合物)をいう。即ち、電池の充放電時において電子の吸蔵および放出(典型的には挿入および脱離)に関与する物質をいう。
【0025】
以下、ここで開示されるリチウム二次電池の好適な実施形態について、説明する。なお、本明細書において特に言及している事項以外の事柄であって、実施に必要な事柄(例えば、正極および負極を備えた電極体の構成および製法、セパレータや電解質の構成および製法、リチウム二次電池その他の電池の構築に係る一般的技術等)は、当該分野における従来技術に基づく当業者の設計事項として把握され得る。かかる構造のリチウム二次電池は、本明細書に開示されている内容と当該分野における技術常識とに基づいて実施することができる。
【0026】
ここで開示されるリチウム二次電池の正極活物質粒子は、一般式LixM〔P(1−Y)AY〕O4で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成されており、P元素がA元素(5価の金属元素)によって置換されていることを特徴とする。かかるリチウム含有リン酸化合物は、従来より結晶構造の安定性に優れているため、該リチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池では電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を向上し得る。
ここで、上記一般式中のM元素は、ニッケル(Ni)、マンガン(Mn)、鉄(Fe)、コバルト(Co)から選択される1種以上の元素である。即ち、M元素としては、例えばNiのみを用いてもよく、例えばNi1/3Co1/3Mn1/3のように複数の元素を組み合わせて用いてもよい。なかでも、M元素がNiであるLiNiPO4は、5V級の高電位を示すため、高エネルギー密度を発現し得る材料として好ましく用いられる。
また、上記一般式中のA元素は5価の金属元素である。かかる金属元素としては、例えば、いわゆるニオブ族(タングステン(W)、モリブデン(Mo)、タンタル(Ta)、ニオブ(Nb))が挙げられ、とりわけ電気化学的に安定性の高い(即ち、活性の低い)6族に属する金属元素(W、Mo)が好適に用いられる。なお、上記M元素の場合と同様に、A元素としても2種以上の複数の元素を含み得る。
【0027】
ここで、上記一般式におけるXの値はこのリチウム含有リン酸化合物におけるリチウムの含有割合を表し、0<X≦2(典型的には、0<X≦1.2)の範囲内における実数とすることができる。かかる化合物の結晶構造を壊すことなく維持し得る範囲において、例えば1<X≦2(典型的にはX=1.2もしくは2)で示されるようなリチウムイオンを過剰に含む、いわゆるリチウム過剰型とすることもできる。
また、上記一般式においてYの値は、このリチウム含有リン酸化合物においてP元素がM元素(5価の金属元素)によって置換された割合を示す値である。かかるYの取り得る範囲は、上記一般式で示されるオリビン型リチウム含有リン酸化合物の結晶構造を崩すことなく該構造を維持し得る限りにおいて、0<Y≦0.15の範囲内であればいずれの実数をとってもよい。また、好ましくは0<Y≦0.1であり、より好ましくは0.01≦Y≦0.1であり、例えば0.01≦Y≦0.05である。
【0028】
ここで用いられる正極活物質の結晶構造は、空間群Cmcmと空間群Pnmaとが混在した状態であることが好ましい。空間群Cmcmに属する斜方晶系の結晶構造を有する場合、従来の空間群Pnmaに属するオリビン型構造に比べ結晶構造が安定性に優れるため、該正極活物質を備えたリチウム二次電池において、高電位領域(例えば6V)においても電池反応(即ち、リチウムイオンの吸蔵および放出)に伴う結晶構造の崩壊を抑制することができる。また、後述する実施例≪I.LiNiPWO4に関する評価試験≫の欄に示す通り、空間群Cmcmと空間群Pnmaとが混在した結晶構造の場合、良好なサイクル特性を発揮し得る。なお、上記「空間群」は、サンプル(粉末状、電極状であり得る)をX線回折測定し、得られた回折パターンを解析することで確認することができる。具体的な測定条件については、後述する実施例≪I.LiNiPWO4に関する評価試験≫の欄に詳細を述べる。
【0029】
ここで用いられる正極活物質粒子としては、一次粒子の粒径が凡そ10nm〜200nm(好ましくは、凡そ10nm〜100nm、より好ましくは、凡そ10nm〜50nm)であることが好ましい。一次粒子径が小さすぎると後述する正極合材スラリーの塗工性が悪化する。一方、かかる粒径が大きすぎると活物質粒子間の接触面積が低下するため、導電性が不足する。また、電池反応に伴うリチウムイオンの吸蔵および放出に伴う抵抗が増大したり、かかる吸蔵および放出自体が困難になったりする虞もある。
なお、本明細書における「粒径」としては、電子顕微鏡(走査型または透過型のいずれも使用可能である。好ましくは透過型電子顕微鏡)により、少なくとも30個以上(例えば50〜200個、典型的には100個)の一次粒子を観察し、得られた写真から計測した粒径の算術平均値(平均粒径)を採用することができる。
【0030】
ここで用いられる正極活物質粒子としては、該粒子表面の少なくとも一部(好ましくは表面積の50%以上、より好ましくは70%以上)が導電性粉末で被覆されていることが好ましい。リチウム含有リン酸化合物は、理論容量が高い反面、導電性が低いという課題があるが、該化合物粒子の表面を導電性粉末で被覆することにより電子伝導性を補うことができる。このため電池抵抗を低減することができ、電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性)を向上し得る。
上記導電性粉末としては、炭素材料(カーボン粉末)を好ましく用いることができる。具体的には、種々のカーボンブラック(例えば、アセチレンブラック(AB)、ファーネスブラック、ケッチェンブラック(KB)、チャンネルブラック、ランプブラック、サーマルブラック)、黒鉛粉末等から選択される、一種または二種以上であり得る。また、ここで用いられる導電材としては、一次粒子の粒径が比較的小さいものほど比表面積が広く、正極活物質の導電性を向上させるのに有利である。例えば、カーボン粉末を使用する場合、該粉末を構成する一次粒子の粒径が、凡そ10nm〜100nm(典型的には凡そ20nm〜70nm、例えば凡そ30nm〜50nm)の範囲にあることが好ましい。
【0031】
ここで開示されるリチウム含有リン酸化合物(一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、Aは5価の金属元素である。また、XとYは、0<x≦2および0<Y≦0.15の条件を満たす実数である。))の製造方法としては、液相法(典型的には、いわゆるゾルゲル法)を用いる。即ち、粒子状の原料を溶媒に分散させた状態のゾルを作成し、得られたゾルを加熱して流動性のないゲルに変えた後、所定の温度で焼成することにより、合成することができる。かかる手法を用いることで、原子レベルでの結晶構造の制御が可能となり、上記一般式におけるP元素とA元素(5価の金属元素)を好適に置換し得る。具体的には、例えば、図1に示すように、原料混合物の調製(S10)、上記得られた原料混合物の加熱処理(S20)、上記加熱処理した原料混合物の焼成(S30)により合成し得る。以下、かかる製造方法の好ましい態様について詳細に説明する。
【0032】
≪原料混合物の調製;S10≫
まず、原料混合物の調製(S10)について説明する。ここでは、リチウム含有リン酸化合物を構成するための出発原料として、リチウム源とリン酸源とM元素(Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素)源とA元素(5価の金属元素)源とを所定の配合比となるように秤量し、これらを水系溶媒中で混合して溶解または分散させ、ゲル状の原料混合物を調製する。出発原料の混合は、一度に全ての原料を水系溶媒中に投入してもよく、何度かに分けて行ってもよい。また、かかる混合の際には、必要に応じて攪拌を行ってもよい。攪拌により原料混合物の調製を短時間で安定して行うことができる。上記攪拌する操作は、例えばマグネティックスターラーや超音波等の適当な攪拌手段を用いて行うことができる。
【0033】
上記出発原料としては、少なくともリチウム供給源とリン酸供給源とM元素(Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素)供給源とA元素(5価の金属元素)供給源とを包含する一種または二種以上の化合物を適宜選択して用いる。
リチウム供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、各種のリチウム化合物を用いることができる。例えば、酢酸リチウム、シュウ酸リチウム等のリチウム有機酸化合物や、炭酸リチウム、水酸化リチウム、リン酸リチウム等のリチウム無機酸化合物等が挙げられる。とりわけ、水系溶媒への溶解度が高い酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕が好適例として挙げられる。
【0034】
リン酸供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、各種のリチウム含有リン酸化合物を用いることができる。例えば、リン酸二水素アンモニウム〔NH4H2PO4〕等のリン酸水素アンモニウムや、亜リン酸トリエチル〔C6H15O3P〕等を用いることができる。あるいは、リン酸〔H3PO4〕またはリン酸を含む溶液をリン酸源として使用してもよい。
【0035】
M元素源供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、Ni、Mn、FeおよびCoの有機酸塩を用いることができる。例えば、酢酸塩、シュウ酸塩が挙げられる。
M元素がNiである場合のニッケル源としては、酢酸ニッケル、炭酸ニッケル、酸化ニッケル、硝酸ニッケル、水酸化ニッケル、オキシ水酸化ニッケル等を用いることができる。とりわけ、水系溶媒への溶解度が高い酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕が好適例として挙げられる。また、M元素がMnである場合のマンガン源としては、酢酸マンガン、炭酸マンガン、酸化マンガン、硝酸マンガン、水酸化マンガン、オキシ水酸化マンガン、シュウ酸マンガン等を用いることができる。とりわけ、水系溶媒への溶解度が高い酢酸マンガン(II)・四水和物〔Mn(CH3COO)2・4H2O〕が好適例として挙げられる。そして、M元素がCoである場合のコバルト源としては、酢酸コバルト、炭酸コバルト、酸化コバルト、硫酸コバルト、硝酸コバルト、水酸化コバルト、オキシ水酸化コバルト等を用いることができる。
【0036】
A元素源供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、5価の金属元素(例えば、W、Mo、Nb、Ta)の各種化合物を用いることができる。典型的には、アルコキシドやオキシアルコキシド等の各種有機金属塩が挙げられる。例えば、A元素がWである場合の元素供給源としては、タングステンエトキシド、タングステンイソプロポキシド、タングステンブトキシド、タングステンヘキサエトキシド、タングステンオキシエトキシド、タングステンオキシブトキシド、タングステンクロライド等を用いることができる。とりわけ、タングステンエトキシドが好適例として挙げられる。
【0037】
ここで用いられる水系溶媒としては、典型には水であるが、全体として水性を示すものであればよく、水以外の溶媒を含む水溶液(混合溶媒)であってもよい。該混合溶媒を構成する水以外の溶媒としては、水と均一に混合し得る有機溶剤(低級アルコール、低級ケトン等)の一種または二種以上を適宜選択して用いることができる。例えば、水系溶媒の凡そ80質量%以上(より好ましくは凡そ90質量%以上、さらに好ましくは凡そ95質量%以上)が水である溶媒の使用が好ましい。特に好ましい例として、実質的に水からなる溶媒(例えば水)が挙げられる。
【0038】
ここで開示される製造方法における好ましい一態様として、上記原料混合物の調製(S10)においては、水系溶媒のpHを3以下(より好ましくは、1.5以下)の強酸性とすることが挙げられる。かかる環境下においては、水酸化物等の不純物の生成を抑制し得るため、純度が高く均質なリチウム含有リン酸化合物を効率よく合成することができる。なお、かかるpHを調整する方法としては、水系溶媒に溶解して酸性を示す化合物を適宜選択し、該化合物を溶解させた酸性水溶液を、所定の量だけ上記原料混合物含有水溶液に加えてればよい。酸性を示す化合物としては、例えば、硫酸、塩酸、硝酸等の無機酸および酢酸、カルボン酸等の有機酸を適宜選択し得る。
【0039】
ここで開示される製造方法における好ましい一態様として、上記原料混合物の調製(S10)において、キレート剤を添加することが挙げられる。該キレート剤を添加することにより、粒子状の原料化合物がより均一に水系溶媒中に分散され得る。このため、より均質なリチウム含有リン酸化合物を合成することができる。また、キレート剤が該粒子の表面を被覆することで粒子の成長を抑制し得るため、粒径の小さな該化合物を製造することができる。よって、かかるリチウム含有リン酸化合物を正極に備えたリチウム二次電池では、電池性能(例えば、エネルギー密度)をより向上することができる。
ここで用いられるキレート剤としては、特に限定するものではないが、水系溶媒に溶解または均一に分散し得るものを用いることができ、例えば、有機酸塩であるヒドロキシ酸やアミノカルボン酸、ホスホン酸およびその塩等を好適に用いることができる。特に水系溶媒への溶解性が高く、安価なグリコール酸〔C2H4O3〕やクエン酸〔C6H8O7〕を好適に使用することができる。上記キレート剤の添加量としては、特に限定されないが、例えば、目的物たるリチウム含有リン酸化合物のモル量に対し、1等量以上(典型的には2倍モル量以上、例えば3倍モル量以上)であって、且つ10倍モル量以下(典型的には9倍モル量以下、例えば8倍モル量以下)の添加量とすることができる。
【0040】
≪加熱処理;S20≫
次に、上記調製した原料混合物を加熱し、溶媒を揮発させる。これによりゲル化が促進され、粒子分散状態のゾル状態から流動性のないゲル状態に変化させることができる。原料混合物を加熱処理する手段は特に限定されず、例えば、オイルバスや電気加熱炉(乾燥機)等の任意の手段を採用することができる。
加熱温度は、使用する水系溶媒によっても異なるが、少なくとも水の揮発が十分に進行する温度で加熱することが必要である。また、加熱温度の上限は、使用する溶媒の沸点を下回る温度であればよい。かかる温度環境下で保持することにより、原料混合物から水系溶媒の一部がゆっくり時間をかけて揮発するため、結晶の成長を抑制しながら、原料混合物の各成分(Li+、PO43−、M2+、A5+等の各種イオン)がゲル内に均一に拡散する。原料混合物の各成分が均一に拡散されると化学量論組成に近い比率で混ざり合い、後述する焼成工程(S30)でさらに加熱することにより、化学量論組成もしくはそれに近いリチウム含有リン酸化合物の微小粒の結晶が安定して成長する。その結果、結晶化度の高い該化合物を合成することができる。例えば溶媒として水を用いる場合、加熱温度は通常、70℃以上であり、例えば凡そ70℃〜90℃(好ましくは凡そ75℃〜85℃、特に好ましくは凡そ80℃)とすることができる。
また、加熱保持時間としては、上記イオンの拡散が十分に進行しゲル状態への変化が十分行われる時間であればよく、特に限定されない。しかしながら、溶媒が全て揮発し原料混合物が固化してしまうと、ゾルゲル法によるメリットを享受できなくなるため、溶媒の乾燥状態を確認し適宜保持時間を調整することが好ましい。通常は5〜72時間程度であり、好ましくは24〜48時間程度である。このような加熱処理によって、原料混合物をゲル状にし得る。なお、保持雰囲気はゲル状態を安定に保つことができる雰囲気であればよく、使用した溶媒や出発原料の種類により必要に応じて、大気雰囲気中の他、窒素ガス等の不活性ガス雰囲気下、あるいは密閉容器内に入れて保持することができる。
【0041】
≪焼成;S30≫
そして、上記ゲル状の原料混合物を800℃以下の温度で焼成することで、目的物たるリチウム含有リン酸化合物を得ることができる。焼成手段は特に限定されず、電気加熱炉等の任意の手段を採用することができる。また、焼成雰囲気も特に限定されず、例えば窒素やアルゴン等の不活性ガス雰囲気下で行ってもよく、大気雰囲気中で行ってもよい。好ましくは、不活性ガス雰囲気下で焼成することで、より均質なリチウム含有リン酸化合物を安定的に合成し得る。また、かかる焼成は、必要に応じて複数回に分けて行うこともできる。
ここで開示される製造方法における好ましい一態様としては、図1に示すように、上記焼成(S30)において、まずゲル状の上記原料混合物を比較的低めの温度域(典型的には、400℃以下)で仮焼成(S310)し、得られた仮焼成物をいったん解砕した後、より高い温度域(典型的には、上記仮焼成温度以上であって800℃以下の温度)で本焼成(S320)する。このように急激な高温焼成する前に、先ず400℃以下の温度で焼成することにより、リチウム含有リン酸化合物の結晶を段階的に成長させることができるため、より均質な該化合物を製造することができる。また、該化合物粒子と導電性粉末とを混合してから本焼成することで、該化合物粒子の表面が導電性粉末で被覆され、導電性が向上する。
【0042】
≪仮焼成;S310≫
仮焼成工程(S310)では、上記得られた上記原料混合物を仮焼成して仮焼成物を得る。仮焼成温度は、特に限定されないが、十分に溶媒を除去し得る温度域であればよく、通常は120℃〜400℃であり、好ましくは200℃〜380℃(例えば350℃)程度である。かかる温度域で仮焼成を行うことにより、水系溶媒をゆっくり揮発させてリチウム含有リン酸化合物結晶の成長を抑制しつつも、該溶媒を十分に除去し得る。このため、その後の本焼成において、該化合物の表面が導電性粉末で良好に被覆され、より導電性の高い該化合物を得ることができる。また、仮焼成時間は、ゲル状の各成分(典型的には各種イオン)が均一に拡散して混ざり合うまでの時間とすればよく、通常は5〜48時間程度であり、好ましくは10〜24時間程度である。
なお上記得られた仮焼成物を、冷却後に粉砕処理し適度に分級することで、より均質化された微粉末状の仮焼成物を得ることができる。かかる粉砕処理は、乳鉢等であってもよく、例えばボールミル、ホモジナイザー、ジェットミル、プラネタリーミキサー、ディスパー、ニーダ等の粉砕装置であってもよい。なお、粉砕装置を用いる場合は、該装置の粉砕力(即ち、粉砕機の運転条件(例えば回転数やせん断速度等)や用いる粉砕媒体の種類)を適度に調整することで、所望の粒径とすることができる。粉砕処理に要する時間は上記粉砕装置の運転条件等によっても異なるが、例えば後述する実施例においては、1時間〜10時間とすることが好ましく、1時間〜3時間とすることがより好ましい。
【0043】
ここで開示される製造方法における好ましい一態様では、上記得られた仮焼成物に導電性粉末を添加して混合することで、仮焼成物(粉末)の粒子表面の少なくとも一部を導電性粉末で被覆する。目的物たるリチウム含有リン酸化合物は、理論容量が高い反面、導電性が低いという課題があるが、かかる導電性粉末の添加により導電性を向上し得る。添加する導電性粉末としては、すでに上述した各種炭素材料を好ましく用いることができる。なかでも、一次粒子の粒径が比較的小さいものほど比表面積が広く、また該化合物表面を均一にコーティングすることができるため、好適である。例えば、電子顕微鏡観察における一次粒径が10nm以上100nm以下の炭素材料を好ましく用いることができる。
なお、混合(攪拌、粉砕を含む)には、既に上述した粉砕装置等を特に限定なく用いることができる。この粉砕処理によって仮焼成物粉末の粒子表面に導電性粉末を物理的に圧着させることで、該粒子表面が被覆される。かかる導電性粉末はその後の本焼成(S320)によって炭化され、リチウム含有リン酸化合物の粒子表面に均一な導電性被膜を形成し得る。その結果、該化合物の導電性を向上することができる。さらに、混合の過程で生じる摩擦熱によってメカノケミカル反応が起こり、反応不十分のため残存していた不純物相(例えば出発原料や反応副生成物)を解砕し得るというメリットもある。
混合時間は、仮焼成物が導電性粉末に均一に被覆され得る限りにおいて特に限定するものではないが、概ね10時間以上にすることが適当であり、通常は15〜30時間(例えば25時間)程度にすることが好ましい。なお、上記では仮焼成物の粉砕処理と、導電性粉末の添加、混合処理を別々に記載したが、かかる処理は一度に行ってもよい。また、段階的に行う場合は、かかる処理を同一の粉砕装置等で行ってもよく、異なる粉砕装置等を用いて行ってもよい。
【0044】
≪本焼成;S320≫
そして、上記得られた仮焼成物と導電性粉末との混合物を、本焼成して目的物たるリチウム含有リン酸化合物を得る。焼成温度は、上記リチウム含有リン酸化合物を合成し得る温度であればよく、特に制限されないが、焼成温度があまりに低い場合は、結晶性が低下する。また焼成温度が800℃より高い場合は、粗結晶の粒子が成長し不純物が増大したり、結晶構造に変化を生じる虞がある。典型的には400〜800℃であり、好ましくは450〜750℃であり、より好ましくは500〜700℃である。また、焼成時間は、原料混合物が均一に反応するまでの時間とすればよく、通常は1〜24時間である。
【0045】
以上のように、本実施形態の製造方法により得られたリチウム含有リン酸化合物は、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得ることから、種々の形態のリチウム二次電池(典型的にはリチウムイオン電池)の正極の構成要素(正極活物質)として好ましく利用され得る。かかるリチウム二次電池は、ここで開示されるリチウム含有リン酸化合物を正極活物質として使用する以外は、従来と同様の材料およびプロセスを用いて構築することができる。
【0046】
ここで開示されるリチウム二次電池の正極としては、例えば、正極活物質としての上記リチウム含有リン酸化合物と、導電材と、バインダ等と、を適当な溶媒中で混合してスラリー状(ペースト状、インク状のものを包含する。)の正極合材層形成用組成物(以下、「正極合材スラリー」という。)を調製し、該スラリーを正極集電体上に付与して正極合材層(正極活物質層ともいう。)を形成した形態のものを用いる。正極合材層を形成する方法としては、上記正極合材スラリーを、正極集電体上に適量付与して乾燥させる方法を好ましく採用することができる。正極合材スラリーの乾燥後、適宜プレス処理を施すことによって正極合材層の厚みや密度を調製することができる。
上記導電材としては、種々のカーボンブラック(例えば、アセチレンブラック、ケッチェンブラック)、黒鉛粉末、炭素繊維等のカーボン材料を好ましく用いることができる。また、上記バインダとしては、ポリフッ化ビニリデン(PVdF)、スチレンブタジエンラバー(SBR)、ポリテトラフルオロエチレン(PTFE)、カルボキシメチルセルロース(CMC)等を好ましく用いることができる。また、集電体としては、アルミニウム、ニッケル、チタン、ステンレス鋼等を好ましく用いることができる。
ここで用いられる溶媒としては、従来からリチウム二次電池に用いられる溶媒のうち一種または二種以上を特に限定することなく使用することができる。かかる溶媒は水系と有機溶剤に大別され、水系としてはすでに上述した溶媒を用いることができる。また有機溶媒としては、例えば、アミド、アルコール、ケトン、エステル、アミン、エーテル、ニトリル、環状エーテル、芳香族炭化水素等が挙げられる。より具体的には、N−メチル−2−ピロリドン(NMP)、N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド、2−プロパノール、エタノール、メタノール、アセトン、メチルエチルケトン、プロペン酸メチル、シクロヘキサノン、酢酸メチル、酢酸エチル、アクリル酸メチル、ジエチルトリアミン、N,N−ジメチルアミノプロピルアミン、アセトニトリル、エチレンオキシド、テトラヒドロフラン(THF)、ジオキサン、ベンゼン、トルエン、エチルベンゼン、キシレンジメチルスルホキシド(DMSO)、ジクロロメタン、トリクロロメタン、ジクロロエタン等が挙げられる。特に、N−メチル−2−ピロリドン(NMP)が好適に用いられる。
【0047】
ここで開示されるリチウム二次電池の負極としては、例えば、負極活物質とバインダ等とを適当な溶媒中で混合してスラリー状(ペースト状、インク状のものを包含する。)の負極合材層形成用組成物(以下、「負極合材スラリー」という。)を調製し、該スラリーを負極集電体上に付与して負極合材層(負極活物質層ともいう。)を形成した形態のものを用いる。負極合材層を形成する方法としては、上記負極合材スラリーを負極集電体上に適量付与して乾燥させる方法を好ましく採用することができる。負極合材スラリーの乾燥後、適宜プレス処理を施すことによって正極合材層の厚みや密度を調製することができる。
ここで用いられる負極活物質としては、例えば、黒鉛、難黒鉛化炭素(ハードカーボン)、易黒鉛化炭素(ソフトカーボン)などの炭素材料や、チタン酸リチウム(LTOともいう;Li4Ti5O12)や酸化鉄(Fe2O3)等の酸化物、スズ(Sn)やケイ素(Si)とリチウムの合金等が挙げられる。ここで開示されるリチウム二次電池では、正極活物質としてのリチウム含有リン酸化合物が高電位となり得るため、作動電位を高くする必要がある。このため、負極活物質としては、標準電位(vs.Li+/Li)が1V以上の物質が好ましく、例えば、標準電位が凡そ1.55VのLTOが好適に用いられる。
【0048】
そして、上記正極および上記負極を積層した電極体を作製し、電解液とともに適当な電池ケースに収容してリチウム二次電池が構築される。なお、ここに開示されるリチウム二次電池の代表的な構成では、正極と負極との間にセパレータが介在される。
ここで用いられる電解液は、典型的には、適当な非水溶媒に支持塩(リチウム塩)を含有させた組成である。上記非水溶媒としては、例えば、プロピレンカーボネート(PC)、エチレンカーボネート(EC)、ジエチルカーボネート(DEC)、ジメチルカーボネート(DMC)、エチルメチルカーボネート(EMC)等からなる群から選択された一種又は二種以上を用いることができる。とりわけ、比誘電率の高いECや、標準酸化電位が高い(即ち、電位窓の広い)DMCやEMC等が好ましく用いられる。また、上記支持塩としては、例えば、LiPF6、LiBF4等を用いることができる。
電池ケースとしては、例えばアルミニウム、スチール等の比較的軽量な金属材や、PPS、ポリイミド樹脂等の樹脂材料等を用いることができる。また、形状は特に限定されず、例えば、円形(円筒形、コイン形、ボタン形)、直方体形、立方体形、袋体形等であり得る。
【0049】
特に限定することを意図したものではないが、本発明の一実施形態に係るリチウム二次電池の概略構成として、扁平に捲回された電極体(捲回電極体)と、非水電解液とを扁平な箱型(直方体形状)の容器に収容した形態のリチウム二次電池(単電池)を例とし、図2〜4にその概略構成を示す。以下の図面において、同じ作用を奏する部材・部位には同じ符号を付し、重複する説明は省略または簡略化することがある。各図における寸法関係(長さ、幅、厚さ等)は、実際の寸法関係を反映するものではない。
【0050】
図2は、本発明の一実施形態に係るリチウム二次電池100の外形を模式的に示す斜視図である。また図3は、上記図2に示したリチウム二次電池III−III線に沿う縦断面構造を模式的に示す図である。
図2および図3に示すように、本実施形態に係るリチウム二次電池100は、直方体形状の電池ケース50を備える。この電池ケース50は、上端が開放された扁平な箱型(直方体形状)の電池ケース本体52と、その開口部を塞ぐ蓋体54とを備える。電池ケース50の上面(すなわち蓋体54)には、捲回電極体80の正極シート10と電気的に接続する正極端子70および該電極体の負極シート20と電気的に接続する負極端子72が設けられている。また、蓋体54には、従来のリチウム二次電池の電池ケースと同様に、電池異常の際にケース内部で発生したガスをケースの外部に排出するための安全弁55が備えられている。
【0051】
電池ケース50の内部には、長尺状の正極シート10と長尺状の負極シート20が長尺状のセパレータ40Aおよび40Bを介して扁平に捲回された形態の電極体(捲回電極体)80が、図示しない非水電解液とともに収容される。また、正極シート10上の正極合材層が形成されていない端部(即ち正極集電体の露出部)74に正極集電板が、負極シート20上の負極合材層が形成されていない端部(即ち負極集電体の露出部)76には負極集電板がそれぞれ付設され、正極端子70および負極端子72とそれぞれ電気的に接続される。
【0052】
図4は、捲回電極体80を組み立てる前段階における長尺状のシート構造(電極シート)を模式的に示す図である。長尺状の正極集電体12の片面または両面(典型的には両面)に長手方向に沿って正極合材層14が形成された正極シート10と、長尺状の負極集電体22の片面または両面(典型的には両面)に長手方向に沿って負極合材層24が形成された負極シート20とを、二枚の長尺状セパレータ40Aおよび40Bとともに重ね合わせて長尺方向に捲回し、捲回電極体が作製される。かかる捲回電極体を側面方向から押しつぶして拉げさせることによって、扁平形状の捲回電極体80を得ることができる。
【0053】
ここで開示されるリチウム二次電池は各種用途に利用可能であるが、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得ることを特徴とする。このため、例えば図5に示すように、自動車等の車両1に搭載されるモーター用の動力源(駆動電源)としてここで開示されるリチウム二次電池100が好適に使用され得る。車両1の種類は特に限定されないが、典型的には、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)、燃料電池自動車(FCV)が挙げられる。また、かかるリチウム二次電池100は、単独で使用(即ち、単電池)されてもよく、直列および/または並列に複数接続されてなる組電池の形態で使用されてもよい。
【0054】
以下、本発明を実施例により具体的に説明するが、本発明をかかる実施例に示すものに限定することを意図したものではない。
【0055】
ここに開示されるオリビン型リチウム含有リン酸化合物を有する正極を用いてリチウム二次電池を構築し、該電池の電池性能について確認を行った。
【0056】
≪I.LiNiPWO4(M元素がNiの場合)に関する評価試験≫
<実施例1:LiNiP0.99W0.01O4>
Li供給源としての酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕(ナカライテスク社製)と、Ni供給源としての酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕(ナカライテスク社製)と、P供給源としてのリン酸二水素アンモニウム〔NH4H2PO4〕(ナカライテスク社製)と、W供給源としてのタングステン(V)エトキシド〔C10H25O5W〕(Alfa Aesar社製)とを、各元素のモル比がLi:Ni:P:W=1:1:0.99:0.01となるように秤量した。これを、溶媒としてのイオン交換水(1L)に、溶液のpHがpH≦1.5となるよう濃硝酸で調整しながら溶解させた。次いで、上記溶液に、粒子の成長を抑制させるキレート剤としてのグリコール酸〔C2H4O3〕(ナカライテスク社製)を、合成されるLiNiPWO4のモル量に対して5倍モル量となるように添加し溶解させ、ゾル状の原料混合物を調製した。得られたゾル状の原料混合物を、撹拌しながらオイルバスで80℃に加熱し、凡そ20時間溶媒を蒸発させて、ゲル状の原料混合物を得た。さらに上記ゲル状の原料混合物を、80℃の乾燥炉で24時間乾燥させた後、350℃で仮焼成した。得られた仮焼成物を乳鉢で粉砕後、100μmメッシュで分級した後に、ボールミルを用いて3時間粉砕した。その後、粉砕した仮焼成物と、導電性粉末としてのケッチェンブラック(ECP−600JD;Ketjen black Ineternational社製)を乳鉢で混合し、ボールミルで25時間混合(攪拌)することにより仮焼成物を導電性粉末で被覆した。そして、導電性粉末で被覆された仮焼成物をアルゴン雰囲気下において600℃で1時間焼成した。
【0057】
<実施例2:LiNiP0.97W0.03O4>
本実施例では、各元素のモル比がLi:Ni:P:W=1:1:0.97:0.03となるように原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0058】
<実施例3:LiNiP0.95W0.05O4>
本実施例では、各元素のモル比がLi:Ni:P:W=1:1:0.95:0.05となるように原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0059】
<比較例1:LiNiPO4>
本比較例では、各元素のモル比がLi:Ni:P:W=1:1:1:0となるように(即ち、W供給源としてのタングステン(V)エトキシド〔C10H25O5W〕を用いずに)原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0060】
<比較例2:LiNiP0.97W0.03O4(固相法)>
本比較例では、固相法による合成を試みた。具体的には、Li供給源としての酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕と、Ni供給源としての酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕と、P供給源としてのリン酸二水素アンモニウム〔NH4H2PO4〕と、W供給源としての酸化タングステン〔WO3〕(Nanostructured&Amorphous Material Inc.)とを、各元素のモル比がLi:Ni:P:W=1:1:0.97:0.03となるように秤量し、乳鉢で混合した。この原料混合物を大気雰囲気下において600℃で1時間焼成した。
【0061】
<X線回折測定>
上記合成直後のLiMnPWO4サンプル(粉末状)について、X線回折装置を用いて、下記の条件で測定を行った。得られた回折パターンを図6(比較例1および実施例1〜3)および図8(比較例2)に示す。
測定装置;株式会社リガク製のX線回折装置、型式「Ultima IV」
X線源;CuKα線
管電圧;50kV、管電流;250mA
走査範囲;10°≦2θ≦80°、走査速度;10°/min.
スリット;発散スリット=1°、散乱スリット=1°、受光スリット=0.1mm
積算回数;3回
【0062】
図6に示されるように、実施例1および実施例2(即ち、W元素の存在比率が1〜3%の場合)では、空間群Cmcmと空間群Pnmaとが混在した構造となっていた。しかし比較例1(Wを添加していない場合)では空間群Pnmaの構造のみが、実施例3(W元素の存在比率が5%)では空間群Cmcmの構造のみが、それぞれ確認された。W元素の存在比率によって結晶構造が異なる理由については、イオン半径のバランスによって安定に存在し得る構造が異なることが考えられる。
また、図8に示されるように、固相法により合成した比較例2では、LiNiPWO4
由来のピークは確認されなかった。よって、リチウム含有リン酸化合物の結晶状態を制御するためには、例えば液相法(典型的には、実施例で示したゾルゲル法)のような、原子レベルで結晶構造を制御し得る手法を用いる必要がある。
【0063】
<正極の作製>
上記合成した実施例1〜3および比較例1に係るLiNiPWO4を用いて、各々正極を作製した。即ち、上記合成した正極活物質としてのLiNiPWO4と、導電材としてのアセチレンブラック(HS−100;電気化学工業製)と、バインダとしてのポリフッ化ビニリデン(クレハKFポリマー#9305;呉羽化学工業製)とを、これら材料の質量比率が凡そ75:20:5となるよう混合し、N−メチルピロリドン(和光純薬工業製)で粘度を調製しながら混練して、正極合材スラリーを調製した。このスラリーを、厚み凡そ15μmの長尺状アルミニウム箔(正極集電体)の片面に、電極目付が凡そ3.0mg/cm2となるようドクターブレード法で塗布した。正極合材スラリーを塗布した正極を80℃で乾燥し、プレス機で圧延することでシート状の正極(正極シート)を得た。これを直径16mmの円形に打ち抜いて、正極(実施例1〜3および比較例1)を作製した。
【0064】
<負極の作製>
次に、負極活物質としてのチタン酸リチウム〔Li4Ti5O12〕と、導電材としてのアセチレンブラック(HS−100;電気化学工業製)と、バインダとしてのポリフッ化ビニリデン(クレハKFポリマー#9305;呉羽化学工業製)とを、これら材料の質量比が85:5:10となるよう混合し、N−メチルピロリドン(和光純薬工業製)で粘度を調製しながら混練して、負極合材スラリーを調製した。このスラリーを、厚み凡そ10μmの長尺状銅箔(負極集電体)の片面に、電極目付が凡そ1.7mg/cm2となるようドクターブレード法で塗布した。負極合材スラリーを塗布した負極を80℃で乾燥し、プレス機で圧延することでシート状の負極(負極シート)を得た。これを直径19mmの円形に打ち抜いて、負極を作製した。
【0065】
<リチウム二次電池の構築>
そして、上記で作製した円形の正極と負極を、セパレータ(直径22mm、厚さ0.02mmのPP(ポリプロピレン)/PE(ポリエチレン)/PP(ポリプロピレン)の3層構造多孔質シートを用いた。)を介して対向するように配置した。かかる電極体を非水電解液(ここでは、エチレンカーボネート(EC)とジメチルカーボネート(DMC)とジメチルカーボネート(EMC)とを3:4:3の体積比で含む混合溶媒に、電解質としてのLiPF6を凡そ1mol/Lの濃度で溶解させたものを用いた。)とともにコイン型ケース(CR2032型セル)に収容した。このようにして、実施例1〜3および比較例1に係るリチウム二次電池を構築した。
【0066】
<サイクリックボルタンメトリー(CV)試験>
上記構築したリチウム二次電池を用いて、以下の条件でサイクリックボルタンメトリー(CV)試験を行った。
測定装置;Solartron 1255B
走査範囲;0V−4V(vs.LTO)
掃引速度;0.2mV/s
サイクル数;3
【0067】
<X線回折測定(CV試験後)>
かかるCV試験後、該電池をグローブボックス内で解体し、正極を取り出し溶媒(ここでは、DMCを用いた。)で数回洗浄した。そして、該正極サンプル(板状)について、上記と同様の方法でXRDを測定し、CV測定前後の結晶構造の変化を確認した。なお、CV試験後のXRD測定は、大気非暴露下で実施した。得られた回折パターンを図7に示す。
【0068】
図7に示されるように、空間群Cmcmと空間群Pnmaとが混在した構造の実施例1および実施例2(即ち、W元素の存在比率が1〜3%の場合)では、CV試験後においても結晶ピークが顕著に表れており、安定性に優れていた。また、空間群Cmcmの構造のみを有する実施例3(W元素の存在比率が5%)では、CV試験後において結晶ピークがやや小さくなった。一方、空間群Pnmaの構造のみを有する比較例1(Wを添加していない場合)では、ブロード状となり、結晶ピークを確認することができなかった。このため、結晶構造が崩壊したものと推定された。
このことから、ここに開示される製造方法において、W元素の存在比率を1%以上であって、好ましくは5%以下とすること(即ち、一般式LixNi〔P(1−Y)AY〕O4における、Yの値を0.01以上であって、好ましくは0.05以下とすること)の技術的意義が示された。また、より好ましくはW元素の存在比率を1%〜3%とすることが確認された。
【0069】
≪II.LiMnPWO4(M元素がMnの場合)に関する評価試験≫
<実施例11:LiMnP0.99W0.01O4>
本実施例では、LiNiW0.01P0.99O4を合成した。具体的には、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した合成方法におけるNi供給源(酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕)に換えて、Mn供給源としての酢酸マンガン(II)・四水和物〔Mn(CH3COO)2・4H2O〕)を用いたこと以外は、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した方法と同様の手順により正極活物質を合成した。
【0070】
<実施例12:LiMnP0.97W0.03O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.97:0.03となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0071】
<実施例13:LiMnP0.95W0.05O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.95:0.05となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0072】
<実施例14:LiMnP0.9W0.1O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.9:0.1となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0073】
<比較例11:LiMnPO4>
本実施例では、各元素のモル比がLi:Mn:P=1:1:1(即ち、結晶構造中にWを含まない組成)となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0074】
<比較例12>
本比較例では、上記比較例11で合成されたLiMnPO4と、酸化タングステン〔WO3〕とを単純に混合した。具体的には、後述する正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.01となるよう、LiMnPO4と、酸化タングステン〔WO3〕とを秤量し、乳鉢で単純に混合することにより、正極活物質を調製した。
【0075】
<比較例13>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.03となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0076】
<比較例14>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.05となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0077】
<比較例15>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.1となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0078】
<一次粒子径の計測>
上記合成直後のLiMnPWO4サンプル(粉末状)について、電子顕微鏡を用いて(比較例11および実施例11については透過型電子顕微鏡を、実施例12および13については走査型電子顕微鏡を、それぞれ用いた。)、一次粒子径の計測を行った。具体的には、電子顕微鏡を用いてサンプルを観察し、100個の一次粒子の大きさを計測し、その算術平均値を粒径とした。各サンプルの粒径を表1に示す。
【0079】
【表1】

【0080】
<X線回折測定>
また、上記得られたLiMnPWO4サンプル(粉末状)について、上記≪I.LiNiPWO4に関する評価試験≫の欄に記載した測定方法と同様のX線回折装置および条件で、結晶構造を測定した。得られた回折パターンを図9に示す。
【0081】
図9より、W元素の存在比率が増加するのに伴い、2θ=35°付近のピークが低角側にシフトした(即ち、結晶格子間隔が広くなった)。これを解析したところ、かかる結晶格子の伸びは、上記一般式中のP元素の位置が、W元素で置換されたことに対応していることが確認された。
【0082】
<正極の作製、リチウム二次電池の構築>
上記合成(調合)した正極活物質を用いて、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した方法と同様の手順により正極(実施例11〜14および比較例11〜15)を作製した。そして、負極として金属リチウム(直径19mm、厚さ0.02mmの金属Li箔を用いた。)を用いたこと以外は、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄と同様の手順により、実施例11〜14および比較例11〜15に係るリチウム二次電池を構築した。
【0083】
<充電試験>
上記構築したリチウム二次電池を用いて、充電試験を行った。具体的には、0.05Cのレートで4.8Vまで定電流充電した後、合計時間が35時間になるまで定電圧充電を行った。
【0084】
<示差熱測定(充電試験後)>
かかる充電試験後、該電池をグローブボックス内で解体し、正極を取り出し溶媒(ここでは、DMCを用いた。)で数回洗浄した。そして、該正極から樹脂製のスパチュラで正極合材層を剥ぎ取り、下記条件で示差熱(DSC;Differential Scanning Calorimetry)測定を行った。なお、DSC測定では、温度変化に伴うサンプルの熱的挙動を測定することができ、かかる測定により得られるピークトップ温度が高いほど、サンプルの熱安定性は高いと考えられる。
DSC測定により得られた発熱ピークトップ温度(℃)と、W元素の存在比率(即ち、実施例では結晶構造中のW元素の存在比率を、比較例では正極合材層内のWO3の存在比率(%)を指す。)の関係を図10に示す。
測定装置;Shimadzu DSC−60
到達温度;400℃、昇温速度;5℃/min.
パージガス;窒素(流量;50ml/min.)
容器;ステンレスパン
サンプル量;凡そ5mg
【0085】
図10に示すように、W供給源としての酸化タングステン〔WO3〕を正極合材層に直接添加した比較例12〜15のリチウム二次電池では、該WO3の存在比率を最大10%(比較例5)まで変化させても、発熱ピークトップ温度にほとんど変化は見られなかった。これに対し、ここで開示される製造方法によって合成されたLiMnPWO4を正極活物質として用いた実施例11〜14のリチウム二次電池では、W元素の存在比率が5%までは存在比率の増加に伴って、発熱ピークトップ温度の上昇が認められた。上述のXRDの結果(図9)から、P元素の位置がW元素で置換されたことで結晶格子間隔が広くなったため、充放電に伴うリチウムイオンの吸蔵および放出がスムーズになり、結晶構造の安定性が向上したものと考えられる。また、W元素の存在比率が5%以上の場合(例えば、W元素の存在比率が10%(実施例14))では、やや発熱ピークトップ温度が低下した。かかる理由としては、例えばW元素の存在比率が安定で存在し得る状態を超えたため、結晶構造の不安定性が増したことが考えられる。以上の結果より、ここに開示される製造方法において、W元素の存在比率を1%〜15%とすること(即ち、一般式LixMn〔P(1−Y)WY〕O4における、Yの値を0.01以上0.15以下とすること)により、従来に比べ熱安定性を向上し得ることが示された。また、より好ましくはW元素の存在比率を1%〜10%とすることが確認された。
【0086】
以上、本発明を詳細に説明したが、上記実施形態および実施例は例示にすぎず、請求の範囲を限定するものではない。請求の範囲に記載の技術には、以上に例示した具体例を様々に変形、変更したものが含まれる。
【産業上の利用可能性】
【0087】
本発明の方法により得られた正極活物質を用いたリチウム二次電池は、上述したように結晶構造の安定性に優れていることを特徴とするため、各種用途に利用可能である。また優れた電池性能(サイクル特性や熱安定性)を発揮し得ることから、特に自動車等の車両に搭載されるモーター用の駆動電源として好適に使用し得る。車両の種類は特に限定されないが、典型的には、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)等が挙げられる。
【符号の説明】
【0088】
S10 原料混合物の調製
S20 加熱処理
S30 焼成
S310 仮焼成
S320 本焼成
1 自動車(車両)
10 正極シート(正極)
12 正極集電体
14 正極合材層
20 負極シート(負極)
22 負極集電体
24 負極合材層
40A、40B セパレータシート
50 電池ケース
52 ケース本体
54 蓋体
55 安全弁
70 正極端子
72 負極端子
80 捲回電極体
100 リチウム二次電池
【技術分野】
【0001】
本発明は、リチウム二次電池に関する。詳しくは、結晶構造の安定性に優れた正極活物質を正極に備える該電池に関する。
【背景技術】
【0002】
リチウムイオン電池その他のリチウム二次電池は、既存の電池に比べ、小型、軽量かつ高エネルギー密度であって、出力密度に優れる。このため、近年、パソコンや携帯端末等のいわゆるポータブル電源や、車両駆動用電源として好ましく用いられている。
【0003】
この種のリチウム二次電池(典型的にはリチウムイオン電池)は、正極および負極を備える電極体と、電解質(典型的には電解液)とを電池ケースに収容した構成を備える。そして、該電極(正極および負極)は、対応する正負の集電体上に電荷担体(典型的にはリチウムイオン)を可逆的に吸蔵および放出し得る活物質(正極活物質および負極活物質)を主成分とする電極合材層(具体的には、正極合材層および負極合材層)を、それぞれ備えている。かかる正極活物質としては、近年、高エネルギー密度を発現し得るオリビン型リチウム含有リン酸化合物(LiMPO4(ただし、MはNi、Mn、FeおよびCoのうちの少なくとも一種以上の元素))が注目されている。オリビン型リチウム含有リン酸化合物に関する従来技術としては、特許文献1、2が挙げられる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2010−267501号公報
【特許文献2】特開2010−040272号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
リチウム二次電池では、充電反応に伴い正極活物質からリチウムイオン(Li+)が放出される。この際、正極活物質中では電荷補償(典型的には、遷移金属イオンの酸化(例えば、Ni2+→Ni3+))が行われ、電気的中性が保たれている。しかし、上記オリビン型リチウム含有リン酸化合物は高電位領域における結晶構造が不安定なため、電荷補償に伴って酸素元素等の脱離を生じ、結晶構造が崩壊する場合がある。かかる場合、それ以降の充放電においてリチウムイオンの吸蔵および放出が行われなくなる(または行われ難くなる)ため、電池性能(例えばサイクル特性)が低下する虞がある。よって、オリビン型リチウム含有リン酸化合物を正極活物質として用いる際の1つの課題として、結晶構造をより安定化させることが挙げられる。
【0006】
本発明はかかる点に鑑みてなされたものであり、その主な目的は、結晶構造の安定性に優れたリチウム含有リン酸化合物を正極活物質として正極に含むリチウム二次電池を提供することである。また他の目的は、かかるリチウム含有リン酸化合物の好適な製造方法を提供することである。
【課題を解決するための手段】
【0007】
上記目的を実現するべく、本発明により、正極と負極を有する電極体を備えるリチウム二次電池が提供される。ここで、上記正極は一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、上記A元素が5価の金属元素であることを特徴とする。
かかるリチウム含有リン酸化合物は、P元素の一部が5価の金属元素(A元素)で置換されることにより、結晶構造の層間隔がリチウムイオンの吸蔵および放出に好適な距離に保たれている。また、従来より結晶構造の安定性に優れている。このため、かかるリチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池の電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を向上することができる。
【0008】
なお、特許文献2には、オリビン型リチウム含有リン酸マンガン化合物中のMn元素の一部を異元素で置換する技術が開示されている。しかし、特許文献2の技術は正極活物質の利用効率の向上を目的としており、上述したような結晶構造の安定性に関しては検討がなされていない。それゆえ合成方法として、いわゆる固相法(粉末原料化合物を溶融することなく混合し、焼成する手法)を採用しているが、後述する試験例≪I.LiNiPWO4に関する評価試験≫の欄に示すように、かかる手法ではここで開示されるような結晶構造の安定性に優れた化合物を得ることはできない。
【0009】
ここで開示されるリチウム二次電池の好ましい一態様では、上記5価の金属元素はWであることが挙げられる。
タングステン(W)を結晶構造に有するリチウム含有リン酸化合物は、構造がより安定化されている。よって、かかるリチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池の電池性能をより向上することができる。
【0010】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、空間群Cmcmと、空間群Pnmaと、を含むことが挙げられる。
空間群Cmcmの結晶構造を有する場合、従来の空間群Pnmaに属するオリビン型構造のみの場合に比べ結晶構造の安定性に優れる。このため、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0011】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、上記M元素としてMnを含んでおり、0<Y≦0.1の条件を満たしていることが挙げられる。
上記条件を満たすリチウムマンガン含有リン酸化合物は、結晶構造の熱安定性に優れるため、高電位領域(即ち、リチウムイオンの脱離量が多い状態)においても酸素元素の脱離等が抑制される。このため、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0012】
ここで開示されるリチウム二次電池の好ましい一態様では、上記リチウム含有リン酸化合物は、上記M元素としてNiを含んでおり、0<Y≦0.05の条件を満たしていることが挙げられる。
上記条件を満たすリチウムニッケル含有リン酸化合物は、好適に空間群Cmcmの結晶構造を含んでいるため、より結晶構造の安定性に優れる。よって、該化合物を正極活物質として用いたリチウム二次電池の電池性能(例えば、サイクル特性)を向上することができる。
【0013】
ここで開示されるリチウム二次電池の好ましい一態様では、上記粒状の正極活物質は、該粒子表面の少なくとも一部が導電性粉末で被覆されていることが挙げられる。
オリビン型リチウム含有リン酸化合物は高エネルギー密度を発現し得る反面、導電性が低いという問題があるが、該化合物粒子の表面を導電性粉末で被覆することにより電子伝導性を補うことができる。よって、該化合物を正極活物質として用いたリチウム二次電池の抵抗を低減することができる。
【0014】
ここで開示されるリチウム二次電池の好ましい一態様では、上記粒状の正極活物質は、電子顕微鏡観察における一次粒径が10nm以上200nm以下であることが挙げられる。
一次粒子の粒径が上記範囲にある正極活物質では、充放電反応に伴うリチウムイオンの吸蔵および放出がスムーズである(即ち、抵抗が低減されている)。また、該活物質の利用効率をも向上し得るため、該化合物を正極活物質として用いた該電池の電池性能(例えばエネルギー密度、出力密度)をより向上することができる。
【0015】
ここで開示されるリチウム二次電池の好ましい一態様では、上記負極は、負極活物質として少なくともチタン酸リチウム(LTOともいう;Li4Ti5O12)を含むことが挙げられる。
リチウム含有リン酸化合物は電位が高いため、正極活物質として用いる場合は高電位窓の電解液を使用する必要がある。このため負極活物質としては、標準電位が凡そ1.55Vと高電位なLTOを好適に用いることができる。
【0016】
また、上記目的を実現するべく、本発明により、リチウム二次電池用の正極活物質を製造する方法が提供される。かかる正極活物質の製造方法は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を構成するための原料として、リチウム源と、リン酸源と、M元素源と、A元素源と、を水系溶媒中で混合し、原料混合物を調製すること、上記原料混合物を加熱処理して、ゲル状の原料混合物を得ること、および、上記ゲル状の原料混合物を、800℃以下の温度で焼成すること、を包含する。
ここで開示される製造方法によれば、原子レベルでの結晶構造の制御が可能となり、均質なリチウム含有リン酸化合物を安定して製造することができる。また原料混合物の各成分をゲル内に均一に拡散し得るため、結晶化度が高く、且つ粒径の小さな(典型的には粒径が200nm以下の)該化合物を好適に製造することができる。
【0017】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記原料混合物の調製は、上記水系溶媒のpHが3以下で行うことが挙げられる。
かかる環境下においては、水酸化物等の不純物の生成を抑制し得るため、純度の高いリチウム含有リン酸化合物を効率よく製造することができる。
【0018】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記原料混合物の調製において、キレート剤を添加することが挙げられる。
該キレート剤を添加することにより、粒子状の原料化合物がより均一に水系溶媒中に分散され得る。このため、より均質なリチウム含有リン酸化合物を合成することができる。また、キレート剤が該粒子の表面を被覆することで粒子の成長を抑制し得るため、粒径の小さな該化合物を製造することができる。よって、かかるリチウム含有リン酸化合物を正極に備えたリチウム二次電池では、電池性能(例えば、エネルギー密度)をより向上することができる。
【0019】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記焼成において、上記ゲル状の原料混合物を400℃以下の温度で仮焼成すること、および上記仮焼成物と導電性粉末とを混合し、上記仮焼成温度以上であって800℃以下の温度で本焼成すること、を包含する。
急激な高温焼成する前に、先ず400℃以下の温度で焼成することにより、リチウム含有リン酸化合物の結晶を段階的に成長させることができるため、より均質な該化合物を製造することができる。また、該化合物粒子と導電性粉末とを混合してから本焼成することで、該化合物粒子の表面が導電性粉末で被覆され、導電性が向上する。
【0020】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記仮焼成は、120℃以上400℃以下で行うことが挙げられる。
かかる温度域で仮焼成を行うことにより、水系溶媒をゆっくり揮発させてリチウム含有リン酸化合物結晶の成長を抑制しつつも、該溶媒を十分に除去し得る。このため、その後の本焼成において、該化合物の表面が導電性粉末で良好に被覆され、より導電性の高い該化合物を得ることができる。
【0021】
ここで開示されるリチウム二次電池の製造方法における好ましい一態様では、上記導電性粉末として、電子顕微鏡観察における一次粒径が10nm以上100nm以下の炭素材料を用いることが挙げられる。
導電材は、一次粒子の粒径が比較的小さいものほど比表面積が広く、リチウム含有リン酸化合物の導電性を向上させるのに好適である。また、粒径が小さいものほど、該化合物表面を均一にコーティングすることができるため、より均質で薄い導電性膜を形成することができる。
【0022】
また、ここに開示されるいずれかの製造方法により製造された正極活物質を正極用いるリチウム二次電池は、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得る。本発明によって提供されるリチウム二次電池は、各種用途に利用可能であるが、特に上記電池性能は、車両に搭載される電池の電源として好適であり得る。したがって、ここに開示されるリチウム二次電池は、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)、燃料電池自動車(FCV)等の電源として好適に使用され得る。また、かかるリチウム二次電池は、単独で使用(即ち、単電池)されてもよく、直列および/または並列に複数接続されてなる組電池の形態で使用されてもよい。
【図面の簡単な説明】
【0023】
【図1】本発明の一実施形態に係るオリビン型リチウム含有リン酸化合物の製造プロセスを示す工程フロー図である。
【図2】本発明の一実施形態に係るリチウム二次電池の外形を模式的に示す斜視図である。
【図3】本発明の一実施形態に係るリチウム二次電池の構成を示す模式図である。
【図4】本発明の一実施形態に係るリチウム二次電池の捲回電極体の構成を示す模式図である。
【図5】本発明の一実施形態に係るリチウム二次電池を車両駆動用電源として備えた車両(自動車)を模式的に示す側面図である。
【図6】本発明の一実施例に係る、LiNiPWO4の合成直後におけるX線回折パターンを測定したグラフである。
【図7】本発明の一実施例に係る、LiNiPWO4のCV試験後におけるX線回折パターンを測定したグラフである。
【図8】本発明の一比較例に係る、LiNiPWO4の合成直後におけるX線回折パターンを測定したグラフである。
【図9】本発明の一実施例に係る、LiMnPWO4のX線回折パターンを測定したグラフである。
【図10】本発明の一実施例に係る、LiMnPWO4のDSC測定により得られた発熱ピークトップ温度を表したグラフである。
【発明を実施するための形態】
【0024】
本明細書において「リチウム二次電池」とは、電解質イオンとしてリチウムイオンを利用し、正負極間におけるリチウムイオンに伴う電荷の移動により充放電が実現される二次電池をいう。一般にリチウムイオン電池(若しくはリチウムイオン二次電池)、リチウムポリマー電池、リチウム空気電池、リチウム硫黄電池等と称される二次電池は、本明細書におけるリチウム二次電池に包含される典型例である。
また、本明細書において「活物質」とは、正極側又は負極側において蓄電に関与する物質(化合物)をいう。即ち、電池の充放電時において電子の吸蔵および放出(典型的には挿入および脱離)に関与する物質をいう。
【0025】
以下、ここで開示されるリチウム二次電池の好適な実施形態について、説明する。なお、本明細書において特に言及している事項以外の事柄であって、実施に必要な事柄(例えば、正極および負極を備えた電極体の構成および製法、セパレータや電解質の構成および製法、リチウム二次電池その他の電池の構築に係る一般的技術等)は、当該分野における従来技術に基づく当業者の設計事項として把握され得る。かかる構造のリチウム二次電池は、本明細書に開示されている内容と当該分野における技術常識とに基づいて実施することができる。
【0026】
ここで開示されるリチウム二次電池の正極活物質粒子は、一般式LixM〔P(1−Y)AY〕O4で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成されており、P元素がA元素(5価の金属元素)によって置換されていることを特徴とする。かかるリチウム含有リン酸化合物は、従来より結晶構造の安定性に優れているため、該リチウム含有リン酸化合物を正極活物質として用いたリチウム二次電池では電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を向上し得る。
ここで、上記一般式中のM元素は、ニッケル(Ni)、マンガン(Mn)、鉄(Fe)、コバルト(Co)から選択される1種以上の元素である。即ち、M元素としては、例えばNiのみを用いてもよく、例えばNi1/3Co1/3Mn1/3のように複数の元素を組み合わせて用いてもよい。なかでも、M元素がNiであるLiNiPO4は、5V級の高電位を示すため、高エネルギー密度を発現し得る材料として好ましく用いられる。
また、上記一般式中のA元素は5価の金属元素である。かかる金属元素としては、例えば、いわゆるニオブ族(タングステン(W)、モリブデン(Mo)、タンタル(Ta)、ニオブ(Nb))が挙げられ、とりわけ電気化学的に安定性の高い(即ち、活性の低い)6族に属する金属元素(W、Mo)が好適に用いられる。なお、上記M元素の場合と同様に、A元素としても2種以上の複数の元素を含み得る。
【0027】
ここで、上記一般式におけるXの値はこのリチウム含有リン酸化合物におけるリチウムの含有割合を表し、0<X≦2(典型的には、0<X≦1.2)の範囲内における実数とすることができる。かかる化合物の結晶構造を壊すことなく維持し得る範囲において、例えば1<X≦2(典型的にはX=1.2もしくは2)で示されるようなリチウムイオンを過剰に含む、いわゆるリチウム過剰型とすることもできる。
また、上記一般式においてYの値は、このリチウム含有リン酸化合物においてP元素がM元素(5価の金属元素)によって置換された割合を示す値である。かかるYの取り得る範囲は、上記一般式で示されるオリビン型リチウム含有リン酸化合物の結晶構造を崩すことなく該構造を維持し得る限りにおいて、0<Y≦0.15の範囲内であればいずれの実数をとってもよい。また、好ましくは0<Y≦0.1であり、より好ましくは0.01≦Y≦0.1であり、例えば0.01≦Y≦0.05である。
【0028】
ここで用いられる正極活物質の結晶構造は、空間群Cmcmと空間群Pnmaとが混在した状態であることが好ましい。空間群Cmcmに属する斜方晶系の結晶構造を有する場合、従来の空間群Pnmaに属するオリビン型構造に比べ結晶構造が安定性に優れるため、該正極活物質を備えたリチウム二次電池において、高電位領域(例えば6V)においても電池反応(即ち、リチウムイオンの吸蔵および放出)に伴う結晶構造の崩壊を抑制することができる。また、後述する実施例≪I.LiNiPWO4に関する評価試験≫の欄に示す通り、空間群Cmcmと空間群Pnmaとが混在した結晶構造の場合、良好なサイクル特性を発揮し得る。なお、上記「空間群」は、サンプル(粉末状、電極状であり得る)をX線回折測定し、得られた回折パターンを解析することで確認することができる。具体的な測定条件については、後述する実施例≪I.LiNiPWO4に関する評価試験≫の欄に詳細を述べる。
【0029】
ここで用いられる正極活物質粒子としては、一次粒子の粒径が凡そ10nm〜200nm(好ましくは、凡そ10nm〜100nm、より好ましくは、凡そ10nm〜50nm)であることが好ましい。一次粒子径が小さすぎると後述する正極合材スラリーの塗工性が悪化する。一方、かかる粒径が大きすぎると活物質粒子間の接触面積が低下するため、導電性が不足する。また、電池反応に伴うリチウムイオンの吸蔵および放出に伴う抵抗が増大したり、かかる吸蔵および放出自体が困難になったりする虞もある。
なお、本明細書における「粒径」としては、電子顕微鏡(走査型または透過型のいずれも使用可能である。好ましくは透過型電子顕微鏡)により、少なくとも30個以上(例えば50〜200個、典型的には100個)の一次粒子を観察し、得られた写真から計測した粒径の算術平均値(平均粒径)を採用することができる。
【0030】
ここで用いられる正極活物質粒子としては、該粒子表面の少なくとも一部(好ましくは表面積の50%以上、より好ましくは70%以上)が導電性粉末で被覆されていることが好ましい。リチウム含有リン酸化合物は、理論容量が高い反面、導電性が低いという課題があるが、該化合物粒子の表面を導電性粉末で被覆することにより電子伝導性を補うことができる。このため電池抵抗を低減することができ、電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性)を向上し得る。
上記導電性粉末としては、炭素材料(カーボン粉末)を好ましく用いることができる。具体的には、種々のカーボンブラック(例えば、アセチレンブラック(AB)、ファーネスブラック、ケッチェンブラック(KB)、チャンネルブラック、ランプブラック、サーマルブラック)、黒鉛粉末等から選択される、一種または二種以上であり得る。また、ここで用いられる導電材としては、一次粒子の粒径が比較的小さいものほど比表面積が広く、正極活物質の導電性を向上させるのに有利である。例えば、カーボン粉末を使用する場合、該粉末を構成する一次粒子の粒径が、凡そ10nm〜100nm(典型的には凡そ20nm〜70nm、例えば凡そ30nm〜50nm)の範囲にあることが好ましい。
【0031】
ここで開示されるリチウム含有リン酸化合物(一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、Aは5価の金属元素である。また、XとYは、0<x≦2および0<Y≦0.15の条件を満たす実数である。))の製造方法としては、液相法(典型的には、いわゆるゾルゲル法)を用いる。即ち、粒子状の原料を溶媒に分散させた状態のゾルを作成し、得られたゾルを加熱して流動性のないゲルに変えた後、所定の温度で焼成することにより、合成することができる。かかる手法を用いることで、原子レベルでの結晶構造の制御が可能となり、上記一般式におけるP元素とA元素(5価の金属元素)を好適に置換し得る。具体的には、例えば、図1に示すように、原料混合物の調製(S10)、上記得られた原料混合物の加熱処理(S20)、上記加熱処理した原料混合物の焼成(S30)により合成し得る。以下、かかる製造方法の好ましい態様について詳細に説明する。
【0032】
≪原料混合物の調製;S10≫
まず、原料混合物の調製(S10)について説明する。ここでは、リチウム含有リン酸化合物を構成するための出発原料として、リチウム源とリン酸源とM元素(Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素)源とA元素(5価の金属元素)源とを所定の配合比となるように秤量し、これらを水系溶媒中で混合して溶解または分散させ、ゲル状の原料混合物を調製する。出発原料の混合は、一度に全ての原料を水系溶媒中に投入してもよく、何度かに分けて行ってもよい。また、かかる混合の際には、必要に応じて攪拌を行ってもよい。攪拌により原料混合物の調製を短時間で安定して行うことができる。上記攪拌する操作は、例えばマグネティックスターラーや超音波等の適当な攪拌手段を用いて行うことができる。
【0033】
上記出発原料としては、少なくともリチウム供給源とリン酸供給源とM元素(Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素)供給源とA元素(5価の金属元素)供給源とを包含する一種または二種以上の化合物を適宜選択して用いる。
リチウム供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、各種のリチウム化合物を用いることができる。例えば、酢酸リチウム、シュウ酸リチウム等のリチウム有機酸化合物や、炭酸リチウム、水酸化リチウム、リン酸リチウム等のリチウム無機酸化合物等が挙げられる。とりわけ、水系溶媒への溶解度が高い酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕が好適例として挙げられる。
【0034】
リン酸供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、各種のリチウム含有リン酸化合物を用いることができる。例えば、リン酸二水素アンモニウム〔NH4H2PO4〕等のリン酸水素アンモニウムや、亜リン酸トリエチル〔C6H15O3P〕等を用いることができる。あるいは、リン酸〔H3PO4〕またはリン酸を含む溶液をリン酸源として使用してもよい。
【0035】
M元素源供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、Ni、Mn、FeおよびCoの有機酸塩を用いることができる。例えば、酢酸塩、シュウ酸塩が挙げられる。
M元素がNiである場合のニッケル源としては、酢酸ニッケル、炭酸ニッケル、酸化ニッケル、硝酸ニッケル、水酸化ニッケル、オキシ水酸化ニッケル等を用いることができる。とりわけ、水系溶媒への溶解度が高い酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕が好適例として挙げられる。また、M元素がMnである場合のマンガン源としては、酢酸マンガン、炭酸マンガン、酸化マンガン、硝酸マンガン、水酸化マンガン、オキシ水酸化マンガン、シュウ酸マンガン等を用いることができる。とりわけ、水系溶媒への溶解度が高い酢酸マンガン(II)・四水和物〔Mn(CH3COO)2・4H2O〕が好適例として挙げられる。そして、M元素がCoである場合のコバルト源としては、酢酸コバルト、炭酸コバルト、酸化コバルト、硫酸コバルト、硝酸コバルト、水酸化コバルト、オキシ水酸化コバルト等を用いることができる。
【0036】
A元素源供給源としては、上記水系溶媒に溶解または均一に分散し得るものであれば特に限定されず、5価の金属元素(例えば、W、Mo、Nb、Ta)の各種化合物を用いることができる。典型的には、アルコキシドやオキシアルコキシド等の各種有機金属塩が挙げられる。例えば、A元素がWである場合の元素供給源としては、タングステンエトキシド、タングステンイソプロポキシド、タングステンブトキシド、タングステンヘキサエトキシド、タングステンオキシエトキシド、タングステンオキシブトキシド、タングステンクロライド等を用いることができる。とりわけ、タングステンエトキシドが好適例として挙げられる。
【0037】
ここで用いられる水系溶媒としては、典型には水であるが、全体として水性を示すものであればよく、水以外の溶媒を含む水溶液(混合溶媒)であってもよい。該混合溶媒を構成する水以外の溶媒としては、水と均一に混合し得る有機溶剤(低級アルコール、低級ケトン等)の一種または二種以上を適宜選択して用いることができる。例えば、水系溶媒の凡そ80質量%以上(より好ましくは凡そ90質量%以上、さらに好ましくは凡そ95質量%以上)が水である溶媒の使用が好ましい。特に好ましい例として、実質的に水からなる溶媒(例えば水)が挙げられる。
【0038】
ここで開示される製造方法における好ましい一態様として、上記原料混合物の調製(S10)においては、水系溶媒のpHを3以下(より好ましくは、1.5以下)の強酸性とすることが挙げられる。かかる環境下においては、水酸化物等の不純物の生成を抑制し得るため、純度が高く均質なリチウム含有リン酸化合物を効率よく合成することができる。なお、かかるpHを調整する方法としては、水系溶媒に溶解して酸性を示す化合物を適宜選択し、該化合物を溶解させた酸性水溶液を、所定の量だけ上記原料混合物含有水溶液に加えてればよい。酸性を示す化合物としては、例えば、硫酸、塩酸、硝酸等の無機酸および酢酸、カルボン酸等の有機酸を適宜選択し得る。
【0039】
ここで開示される製造方法における好ましい一態様として、上記原料混合物の調製(S10)において、キレート剤を添加することが挙げられる。該キレート剤を添加することにより、粒子状の原料化合物がより均一に水系溶媒中に分散され得る。このため、より均質なリチウム含有リン酸化合物を合成することができる。また、キレート剤が該粒子の表面を被覆することで粒子の成長を抑制し得るため、粒径の小さな該化合物を製造することができる。よって、かかるリチウム含有リン酸化合物を正極に備えたリチウム二次電池では、電池性能(例えば、エネルギー密度)をより向上することができる。
ここで用いられるキレート剤としては、特に限定するものではないが、水系溶媒に溶解または均一に分散し得るものを用いることができ、例えば、有機酸塩であるヒドロキシ酸やアミノカルボン酸、ホスホン酸およびその塩等を好適に用いることができる。特に水系溶媒への溶解性が高く、安価なグリコール酸〔C2H4O3〕やクエン酸〔C6H8O7〕を好適に使用することができる。上記キレート剤の添加量としては、特に限定されないが、例えば、目的物たるリチウム含有リン酸化合物のモル量に対し、1等量以上(典型的には2倍モル量以上、例えば3倍モル量以上)であって、且つ10倍モル量以下(典型的には9倍モル量以下、例えば8倍モル量以下)の添加量とすることができる。
【0040】
≪加熱処理;S20≫
次に、上記調製した原料混合物を加熱し、溶媒を揮発させる。これによりゲル化が促進され、粒子分散状態のゾル状態から流動性のないゲル状態に変化させることができる。原料混合物を加熱処理する手段は特に限定されず、例えば、オイルバスや電気加熱炉(乾燥機)等の任意の手段を採用することができる。
加熱温度は、使用する水系溶媒によっても異なるが、少なくとも水の揮発が十分に進行する温度で加熱することが必要である。また、加熱温度の上限は、使用する溶媒の沸点を下回る温度であればよい。かかる温度環境下で保持することにより、原料混合物から水系溶媒の一部がゆっくり時間をかけて揮発するため、結晶の成長を抑制しながら、原料混合物の各成分(Li+、PO43−、M2+、A5+等の各種イオン)がゲル内に均一に拡散する。原料混合物の各成分が均一に拡散されると化学量論組成に近い比率で混ざり合い、後述する焼成工程(S30)でさらに加熱することにより、化学量論組成もしくはそれに近いリチウム含有リン酸化合物の微小粒の結晶が安定して成長する。その結果、結晶化度の高い該化合物を合成することができる。例えば溶媒として水を用いる場合、加熱温度は通常、70℃以上であり、例えば凡そ70℃〜90℃(好ましくは凡そ75℃〜85℃、特に好ましくは凡そ80℃)とすることができる。
また、加熱保持時間としては、上記イオンの拡散が十分に進行しゲル状態への変化が十分行われる時間であればよく、特に限定されない。しかしながら、溶媒が全て揮発し原料混合物が固化してしまうと、ゾルゲル法によるメリットを享受できなくなるため、溶媒の乾燥状態を確認し適宜保持時間を調整することが好ましい。通常は5〜72時間程度であり、好ましくは24〜48時間程度である。このような加熱処理によって、原料混合物をゲル状にし得る。なお、保持雰囲気はゲル状態を安定に保つことができる雰囲気であればよく、使用した溶媒や出発原料の種類により必要に応じて、大気雰囲気中の他、窒素ガス等の不活性ガス雰囲気下、あるいは密閉容器内に入れて保持することができる。
【0041】
≪焼成;S30≫
そして、上記ゲル状の原料混合物を800℃以下の温度で焼成することで、目的物たるリチウム含有リン酸化合物を得ることができる。焼成手段は特に限定されず、電気加熱炉等の任意の手段を採用することができる。また、焼成雰囲気も特に限定されず、例えば窒素やアルゴン等の不活性ガス雰囲気下で行ってもよく、大気雰囲気中で行ってもよい。好ましくは、不活性ガス雰囲気下で焼成することで、より均質なリチウム含有リン酸化合物を安定的に合成し得る。また、かかる焼成は、必要に応じて複数回に分けて行うこともできる。
ここで開示される製造方法における好ましい一態様としては、図1に示すように、上記焼成(S30)において、まずゲル状の上記原料混合物を比較的低めの温度域(典型的には、400℃以下)で仮焼成(S310)し、得られた仮焼成物をいったん解砕した後、より高い温度域(典型的には、上記仮焼成温度以上であって800℃以下の温度)で本焼成(S320)する。このように急激な高温焼成する前に、先ず400℃以下の温度で焼成することにより、リチウム含有リン酸化合物の結晶を段階的に成長させることができるため、より均質な該化合物を製造することができる。また、該化合物粒子と導電性粉末とを混合してから本焼成することで、該化合物粒子の表面が導電性粉末で被覆され、導電性が向上する。
【0042】
≪仮焼成;S310≫
仮焼成工程(S310)では、上記得られた上記原料混合物を仮焼成して仮焼成物を得る。仮焼成温度は、特に限定されないが、十分に溶媒を除去し得る温度域であればよく、通常は120℃〜400℃であり、好ましくは200℃〜380℃(例えば350℃)程度である。かかる温度域で仮焼成を行うことにより、水系溶媒をゆっくり揮発させてリチウム含有リン酸化合物結晶の成長を抑制しつつも、該溶媒を十分に除去し得る。このため、その後の本焼成において、該化合物の表面が導電性粉末で良好に被覆され、より導電性の高い該化合物を得ることができる。また、仮焼成時間は、ゲル状の各成分(典型的には各種イオン)が均一に拡散して混ざり合うまでの時間とすればよく、通常は5〜48時間程度であり、好ましくは10〜24時間程度である。
なお上記得られた仮焼成物を、冷却後に粉砕処理し適度に分級することで、より均質化された微粉末状の仮焼成物を得ることができる。かかる粉砕処理は、乳鉢等であってもよく、例えばボールミル、ホモジナイザー、ジェットミル、プラネタリーミキサー、ディスパー、ニーダ等の粉砕装置であってもよい。なお、粉砕装置を用いる場合は、該装置の粉砕力(即ち、粉砕機の運転条件(例えば回転数やせん断速度等)や用いる粉砕媒体の種類)を適度に調整することで、所望の粒径とすることができる。粉砕処理に要する時間は上記粉砕装置の運転条件等によっても異なるが、例えば後述する実施例においては、1時間〜10時間とすることが好ましく、1時間〜3時間とすることがより好ましい。
【0043】
ここで開示される製造方法における好ましい一態様では、上記得られた仮焼成物に導電性粉末を添加して混合することで、仮焼成物(粉末)の粒子表面の少なくとも一部を導電性粉末で被覆する。目的物たるリチウム含有リン酸化合物は、理論容量が高い反面、導電性が低いという課題があるが、かかる導電性粉末の添加により導電性を向上し得る。添加する導電性粉末としては、すでに上述した各種炭素材料を好ましく用いることができる。なかでも、一次粒子の粒径が比較的小さいものほど比表面積が広く、また該化合物表面を均一にコーティングすることができるため、好適である。例えば、電子顕微鏡観察における一次粒径が10nm以上100nm以下の炭素材料を好ましく用いることができる。
なお、混合(攪拌、粉砕を含む)には、既に上述した粉砕装置等を特に限定なく用いることができる。この粉砕処理によって仮焼成物粉末の粒子表面に導電性粉末を物理的に圧着させることで、該粒子表面が被覆される。かかる導電性粉末はその後の本焼成(S320)によって炭化され、リチウム含有リン酸化合物の粒子表面に均一な導電性被膜を形成し得る。その結果、該化合物の導電性を向上することができる。さらに、混合の過程で生じる摩擦熱によってメカノケミカル反応が起こり、反応不十分のため残存していた不純物相(例えば出発原料や反応副生成物)を解砕し得るというメリットもある。
混合時間は、仮焼成物が導電性粉末に均一に被覆され得る限りにおいて特に限定するものではないが、概ね10時間以上にすることが適当であり、通常は15〜30時間(例えば25時間)程度にすることが好ましい。なお、上記では仮焼成物の粉砕処理と、導電性粉末の添加、混合処理を別々に記載したが、かかる処理は一度に行ってもよい。また、段階的に行う場合は、かかる処理を同一の粉砕装置等で行ってもよく、異なる粉砕装置等を用いて行ってもよい。
【0044】
≪本焼成;S320≫
そして、上記得られた仮焼成物と導電性粉末との混合物を、本焼成して目的物たるリチウム含有リン酸化合物を得る。焼成温度は、上記リチウム含有リン酸化合物を合成し得る温度であればよく、特に制限されないが、焼成温度があまりに低い場合は、結晶性が低下する。また焼成温度が800℃より高い場合は、粗結晶の粒子が成長し不純物が増大したり、結晶構造に変化を生じる虞がある。典型的には400〜800℃であり、好ましくは450〜750℃であり、より好ましくは500〜700℃である。また、焼成時間は、原料混合物が均一に反応するまでの時間とすればよく、通常は1〜24時間である。
【0045】
以上のように、本実施形態の製造方法により得られたリチウム含有リン酸化合物は、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得ることから、種々の形態のリチウム二次電池(典型的にはリチウムイオン電池)の正極の構成要素(正極活物質)として好ましく利用され得る。かかるリチウム二次電池は、ここで開示されるリチウム含有リン酸化合物を正極活物質として使用する以外は、従来と同様の材料およびプロセスを用いて構築することができる。
【0046】
ここで開示されるリチウム二次電池の正極としては、例えば、正極活物質としての上記リチウム含有リン酸化合物と、導電材と、バインダ等と、を適当な溶媒中で混合してスラリー状(ペースト状、インク状のものを包含する。)の正極合材層形成用組成物(以下、「正極合材スラリー」という。)を調製し、該スラリーを正極集電体上に付与して正極合材層(正極活物質層ともいう。)を形成した形態のものを用いる。正極合材層を形成する方法としては、上記正極合材スラリーを、正極集電体上に適量付与して乾燥させる方法を好ましく採用することができる。正極合材スラリーの乾燥後、適宜プレス処理を施すことによって正極合材層の厚みや密度を調製することができる。
上記導電材としては、種々のカーボンブラック(例えば、アセチレンブラック、ケッチェンブラック)、黒鉛粉末、炭素繊維等のカーボン材料を好ましく用いることができる。また、上記バインダとしては、ポリフッ化ビニリデン(PVdF)、スチレンブタジエンラバー(SBR)、ポリテトラフルオロエチレン(PTFE)、カルボキシメチルセルロース(CMC)等を好ましく用いることができる。また、集電体としては、アルミニウム、ニッケル、チタン、ステンレス鋼等を好ましく用いることができる。
ここで用いられる溶媒としては、従来からリチウム二次電池に用いられる溶媒のうち一種または二種以上を特に限定することなく使用することができる。かかる溶媒は水系と有機溶剤に大別され、水系としてはすでに上述した溶媒を用いることができる。また有機溶媒としては、例えば、アミド、アルコール、ケトン、エステル、アミン、エーテル、ニトリル、環状エーテル、芳香族炭化水素等が挙げられる。より具体的には、N−メチル−2−ピロリドン(NMP)、N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド、2−プロパノール、エタノール、メタノール、アセトン、メチルエチルケトン、プロペン酸メチル、シクロヘキサノン、酢酸メチル、酢酸エチル、アクリル酸メチル、ジエチルトリアミン、N,N−ジメチルアミノプロピルアミン、アセトニトリル、エチレンオキシド、テトラヒドロフラン(THF)、ジオキサン、ベンゼン、トルエン、エチルベンゼン、キシレンジメチルスルホキシド(DMSO)、ジクロロメタン、トリクロロメタン、ジクロロエタン等が挙げられる。特に、N−メチル−2−ピロリドン(NMP)が好適に用いられる。
【0047】
ここで開示されるリチウム二次電池の負極としては、例えば、負極活物質とバインダ等とを適当な溶媒中で混合してスラリー状(ペースト状、インク状のものを包含する。)の負極合材層形成用組成物(以下、「負極合材スラリー」という。)を調製し、該スラリーを負極集電体上に付与して負極合材層(負極活物質層ともいう。)を形成した形態のものを用いる。負極合材層を形成する方法としては、上記負極合材スラリーを負極集電体上に適量付与して乾燥させる方法を好ましく採用することができる。負極合材スラリーの乾燥後、適宜プレス処理を施すことによって正極合材層の厚みや密度を調製することができる。
ここで用いられる負極活物質としては、例えば、黒鉛、難黒鉛化炭素(ハードカーボン)、易黒鉛化炭素(ソフトカーボン)などの炭素材料や、チタン酸リチウム(LTOともいう;Li4Ti5O12)や酸化鉄(Fe2O3)等の酸化物、スズ(Sn)やケイ素(Si)とリチウムの合金等が挙げられる。ここで開示されるリチウム二次電池では、正極活物質としてのリチウム含有リン酸化合物が高電位となり得るため、作動電位を高くする必要がある。このため、負極活物質としては、標準電位(vs.Li+/Li)が1V以上の物質が好ましく、例えば、標準電位が凡そ1.55VのLTOが好適に用いられる。
【0048】
そして、上記正極および上記負極を積層した電極体を作製し、電解液とともに適当な電池ケースに収容してリチウム二次電池が構築される。なお、ここに開示されるリチウム二次電池の代表的な構成では、正極と負極との間にセパレータが介在される。
ここで用いられる電解液は、典型的には、適当な非水溶媒に支持塩(リチウム塩)を含有させた組成である。上記非水溶媒としては、例えば、プロピレンカーボネート(PC)、エチレンカーボネート(EC)、ジエチルカーボネート(DEC)、ジメチルカーボネート(DMC)、エチルメチルカーボネート(EMC)等からなる群から選択された一種又は二種以上を用いることができる。とりわけ、比誘電率の高いECや、標準酸化電位が高い(即ち、電位窓の広い)DMCやEMC等が好ましく用いられる。また、上記支持塩としては、例えば、LiPF6、LiBF4等を用いることができる。
電池ケースとしては、例えばアルミニウム、スチール等の比較的軽量な金属材や、PPS、ポリイミド樹脂等の樹脂材料等を用いることができる。また、形状は特に限定されず、例えば、円形(円筒形、コイン形、ボタン形)、直方体形、立方体形、袋体形等であり得る。
【0049】
特に限定することを意図したものではないが、本発明の一実施形態に係るリチウム二次電池の概略構成として、扁平に捲回された電極体(捲回電極体)と、非水電解液とを扁平な箱型(直方体形状)の容器に収容した形態のリチウム二次電池(単電池)を例とし、図2〜4にその概略構成を示す。以下の図面において、同じ作用を奏する部材・部位には同じ符号を付し、重複する説明は省略または簡略化することがある。各図における寸法関係(長さ、幅、厚さ等)は、実際の寸法関係を反映するものではない。
【0050】
図2は、本発明の一実施形態に係るリチウム二次電池100の外形を模式的に示す斜視図である。また図3は、上記図2に示したリチウム二次電池III−III線に沿う縦断面構造を模式的に示す図である。
図2および図3に示すように、本実施形態に係るリチウム二次電池100は、直方体形状の電池ケース50を備える。この電池ケース50は、上端が開放された扁平な箱型(直方体形状)の電池ケース本体52と、その開口部を塞ぐ蓋体54とを備える。電池ケース50の上面(すなわち蓋体54)には、捲回電極体80の正極シート10と電気的に接続する正極端子70および該電極体の負極シート20と電気的に接続する負極端子72が設けられている。また、蓋体54には、従来のリチウム二次電池の電池ケースと同様に、電池異常の際にケース内部で発生したガスをケースの外部に排出するための安全弁55が備えられている。
【0051】
電池ケース50の内部には、長尺状の正極シート10と長尺状の負極シート20が長尺状のセパレータ40Aおよび40Bを介して扁平に捲回された形態の電極体(捲回電極体)80が、図示しない非水電解液とともに収容される。また、正極シート10上の正極合材層が形成されていない端部(即ち正極集電体の露出部)74に正極集電板が、負極シート20上の負極合材層が形成されていない端部(即ち負極集電体の露出部)76には負極集電板がそれぞれ付設され、正極端子70および負極端子72とそれぞれ電気的に接続される。
【0052】
図4は、捲回電極体80を組み立てる前段階における長尺状のシート構造(電極シート)を模式的に示す図である。長尺状の正極集電体12の片面または両面(典型的には両面)に長手方向に沿って正極合材層14が形成された正極シート10と、長尺状の負極集電体22の片面または両面(典型的には両面)に長手方向に沿って負極合材層24が形成された負極シート20とを、二枚の長尺状セパレータ40Aおよび40Bとともに重ね合わせて長尺方向に捲回し、捲回電極体が作製される。かかる捲回電極体を側面方向から押しつぶして拉げさせることによって、扁平形状の捲回電極体80を得ることができる。
【0053】
ここで開示されるリチウム二次電池は各種用途に利用可能であるが、結晶構造の安定性が増し、優れた電池性能(例えばエネルギー密度、出力密度、充放電サイクル特性、熱安定性)を発揮し得ることを特徴とする。このため、例えば図5に示すように、自動車等の車両1に搭載されるモーター用の動力源(駆動電源)としてここで開示されるリチウム二次電池100が好適に使用され得る。車両1の種類は特に限定されないが、典型的には、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)、燃料電池自動車(FCV)が挙げられる。また、かかるリチウム二次電池100は、単独で使用(即ち、単電池)されてもよく、直列および/または並列に複数接続されてなる組電池の形態で使用されてもよい。
【0054】
以下、本発明を実施例により具体的に説明するが、本発明をかかる実施例に示すものに限定することを意図したものではない。
【0055】
ここに開示されるオリビン型リチウム含有リン酸化合物を有する正極を用いてリチウム二次電池を構築し、該電池の電池性能について確認を行った。
【0056】
≪I.LiNiPWO4(M元素がNiの場合)に関する評価試験≫
<実施例1:LiNiP0.99W0.01O4>
Li供給源としての酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕(ナカライテスク社製)と、Ni供給源としての酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕(ナカライテスク社製)と、P供給源としてのリン酸二水素アンモニウム〔NH4H2PO4〕(ナカライテスク社製)と、W供給源としてのタングステン(V)エトキシド〔C10H25O5W〕(Alfa Aesar社製)とを、各元素のモル比がLi:Ni:P:W=1:1:0.99:0.01となるように秤量した。これを、溶媒としてのイオン交換水(1L)に、溶液のpHがpH≦1.5となるよう濃硝酸で調整しながら溶解させた。次いで、上記溶液に、粒子の成長を抑制させるキレート剤としてのグリコール酸〔C2H4O3〕(ナカライテスク社製)を、合成されるLiNiPWO4のモル量に対して5倍モル量となるように添加し溶解させ、ゾル状の原料混合物を調製した。得られたゾル状の原料混合物を、撹拌しながらオイルバスで80℃に加熱し、凡そ20時間溶媒を蒸発させて、ゲル状の原料混合物を得た。さらに上記ゲル状の原料混合物を、80℃の乾燥炉で24時間乾燥させた後、350℃で仮焼成した。得られた仮焼成物を乳鉢で粉砕後、100μmメッシュで分級した後に、ボールミルを用いて3時間粉砕した。その後、粉砕した仮焼成物と、導電性粉末としてのケッチェンブラック(ECP−600JD;Ketjen black Ineternational社製)を乳鉢で混合し、ボールミルで25時間混合(攪拌)することにより仮焼成物を導電性粉末で被覆した。そして、導電性粉末で被覆された仮焼成物をアルゴン雰囲気下において600℃で1時間焼成した。
【0057】
<実施例2:LiNiP0.97W0.03O4>
本実施例では、各元素のモル比がLi:Ni:P:W=1:1:0.97:0.03となるように原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0058】
<実施例3:LiNiP0.95W0.05O4>
本実施例では、各元素のモル比がLi:Ni:P:W=1:1:0.95:0.05となるように原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0059】
<比較例1:LiNiPO4>
本比較例では、各元素のモル比がLi:Ni:P:W=1:1:1:0となるように(即ち、W供給源としてのタングステン(V)エトキシド〔C10H25O5W〕を用いずに)原料を秤量したこと以外は、上記実施例1と同様の手順により合成した。
【0060】
<比較例2:LiNiP0.97W0.03O4(固相法)>
本比較例では、固相法による合成を試みた。具体的には、Li供給源としての酢酸リチウム・二水和物〔Li(CH3COO)・2H2O〕と、Ni供給源としての酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕と、P供給源としてのリン酸二水素アンモニウム〔NH4H2PO4〕と、W供給源としての酸化タングステン〔WO3〕(Nanostructured&Amorphous Material Inc.)とを、各元素のモル比がLi:Ni:P:W=1:1:0.97:0.03となるように秤量し、乳鉢で混合した。この原料混合物を大気雰囲気下において600℃で1時間焼成した。
【0061】
<X線回折測定>
上記合成直後のLiMnPWO4サンプル(粉末状)について、X線回折装置を用いて、下記の条件で測定を行った。得られた回折パターンを図6(比較例1および実施例1〜3)および図8(比較例2)に示す。
測定装置;株式会社リガク製のX線回折装置、型式「Ultima IV」
X線源;CuKα線
管電圧;50kV、管電流;250mA
走査範囲;10°≦2θ≦80°、走査速度;10°/min.
スリット;発散スリット=1°、散乱スリット=1°、受光スリット=0.1mm
積算回数;3回
【0062】
図6に示されるように、実施例1および実施例2(即ち、W元素の存在比率が1〜3%の場合)では、空間群Cmcmと空間群Pnmaとが混在した構造となっていた。しかし比較例1(Wを添加していない場合)では空間群Pnmaの構造のみが、実施例3(W元素の存在比率が5%)では空間群Cmcmの構造のみが、それぞれ確認された。W元素の存在比率によって結晶構造が異なる理由については、イオン半径のバランスによって安定に存在し得る構造が異なることが考えられる。
また、図8に示されるように、固相法により合成した比較例2では、LiNiPWO4
由来のピークは確認されなかった。よって、リチウム含有リン酸化合物の結晶状態を制御するためには、例えば液相法(典型的には、実施例で示したゾルゲル法)のような、原子レベルで結晶構造を制御し得る手法を用いる必要がある。
【0063】
<正極の作製>
上記合成した実施例1〜3および比較例1に係るLiNiPWO4を用いて、各々正極を作製した。即ち、上記合成した正極活物質としてのLiNiPWO4と、導電材としてのアセチレンブラック(HS−100;電気化学工業製)と、バインダとしてのポリフッ化ビニリデン(クレハKFポリマー#9305;呉羽化学工業製)とを、これら材料の質量比率が凡そ75:20:5となるよう混合し、N−メチルピロリドン(和光純薬工業製)で粘度を調製しながら混練して、正極合材スラリーを調製した。このスラリーを、厚み凡そ15μmの長尺状アルミニウム箔(正極集電体)の片面に、電極目付が凡そ3.0mg/cm2となるようドクターブレード法で塗布した。正極合材スラリーを塗布した正極を80℃で乾燥し、プレス機で圧延することでシート状の正極(正極シート)を得た。これを直径16mmの円形に打ち抜いて、正極(実施例1〜3および比較例1)を作製した。
【0064】
<負極の作製>
次に、負極活物質としてのチタン酸リチウム〔Li4Ti5O12〕と、導電材としてのアセチレンブラック(HS−100;電気化学工業製)と、バインダとしてのポリフッ化ビニリデン(クレハKFポリマー#9305;呉羽化学工業製)とを、これら材料の質量比が85:5:10となるよう混合し、N−メチルピロリドン(和光純薬工業製)で粘度を調製しながら混練して、負極合材スラリーを調製した。このスラリーを、厚み凡そ10μmの長尺状銅箔(負極集電体)の片面に、電極目付が凡そ1.7mg/cm2となるようドクターブレード法で塗布した。負極合材スラリーを塗布した負極を80℃で乾燥し、プレス機で圧延することでシート状の負極(負極シート)を得た。これを直径19mmの円形に打ち抜いて、負極を作製した。
【0065】
<リチウム二次電池の構築>
そして、上記で作製した円形の正極と負極を、セパレータ(直径22mm、厚さ0.02mmのPP(ポリプロピレン)/PE(ポリエチレン)/PP(ポリプロピレン)の3層構造多孔質シートを用いた。)を介して対向するように配置した。かかる電極体を非水電解液(ここでは、エチレンカーボネート(EC)とジメチルカーボネート(DMC)とジメチルカーボネート(EMC)とを3:4:3の体積比で含む混合溶媒に、電解質としてのLiPF6を凡そ1mol/Lの濃度で溶解させたものを用いた。)とともにコイン型ケース(CR2032型セル)に収容した。このようにして、実施例1〜3および比較例1に係るリチウム二次電池を構築した。
【0066】
<サイクリックボルタンメトリー(CV)試験>
上記構築したリチウム二次電池を用いて、以下の条件でサイクリックボルタンメトリー(CV)試験を行った。
測定装置;Solartron 1255B
走査範囲;0V−4V(vs.LTO)
掃引速度;0.2mV/s
サイクル数;3
【0067】
<X線回折測定(CV試験後)>
かかるCV試験後、該電池をグローブボックス内で解体し、正極を取り出し溶媒(ここでは、DMCを用いた。)で数回洗浄した。そして、該正極サンプル(板状)について、上記と同様の方法でXRDを測定し、CV測定前後の結晶構造の変化を確認した。なお、CV試験後のXRD測定は、大気非暴露下で実施した。得られた回折パターンを図7に示す。
【0068】
図7に示されるように、空間群Cmcmと空間群Pnmaとが混在した構造の実施例1および実施例2(即ち、W元素の存在比率が1〜3%の場合)では、CV試験後においても結晶ピークが顕著に表れており、安定性に優れていた。また、空間群Cmcmの構造のみを有する実施例3(W元素の存在比率が5%)では、CV試験後において結晶ピークがやや小さくなった。一方、空間群Pnmaの構造のみを有する比較例1(Wを添加していない場合)では、ブロード状となり、結晶ピークを確認することができなかった。このため、結晶構造が崩壊したものと推定された。
このことから、ここに開示される製造方法において、W元素の存在比率を1%以上であって、好ましくは5%以下とすること(即ち、一般式LixNi〔P(1−Y)AY〕O4における、Yの値を0.01以上であって、好ましくは0.05以下とすること)の技術的意義が示された。また、より好ましくはW元素の存在比率を1%〜3%とすることが確認された。
【0069】
≪II.LiMnPWO4(M元素がMnの場合)に関する評価試験≫
<実施例11:LiMnP0.99W0.01O4>
本実施例では、LiNiW0.01P0.99O4を合成した。具体的には、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した合成方法におけるNi供給源(酢酸ニッケル(II)・四水和物〔Ni(CH3COO)2・4H2O〕)に換えて、Mn供給源としての酢酸マンガン(II)・四水和物〔Mn(CH3COO)2・4H2O〕)を用いたこと以外は、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した方法と同様の手順により正極活物質を合成した。
【0070】
<実施例12:LiMnP0.97W0.03O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.97:0.03となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0071】
<実施例13:LiMnP0.95W0.05O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.95:0.05となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0072】
<実施例14:LiMnP0.9W0.1O4>
本実施例では、各元素のモル比がLi:Mn:P:W=1:1:0.9:0.1となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0073】
<比較例11:LiMnPO4>
本実施例では、各元素のモル比がLi:Mn:P=1:1:1(即ち、結晶構造中にWを含まない組成)となるように原料を秤量したこと以外は、上記実施例11と同様の手順により正極活物質を合成した。
【0074】
<比較例12>
本比較例では、上記比較例11で合成されたLiMnPO4と、酸化タングステン〔WO3〕とを単純に混合した。具体的には、後述する正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.01となるよう、LiMnPO4と、酸化タングステン〔WO3〕とを秤量し、乳鉢で単純に混合することにより、正極活物質を調製した。
【0075】
<比較例13>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.03となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0076】
<比較例14>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.05となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0077】
<比較例15>
本実施例では、正極合材層内の組成比率が(WO3/(LiMnPO4+WO3))=0.1となるよう、原料を秤量したこと以外は、上記比較例12と同様の手順により正極活物質を調製した。
【0078】
<一次粒子径の計測>
上記合成直後のLiMnPWO4サンプル(粉末状)について、電子顕微鏡を用いて(比較例11および実施例11については透過型電子顕微鏡を、実施例12および13については走査型電子顕微鏡を、それぞれ用いた。)、一次粒子径の計測を行った。具体的には、電子顕微鏡を用いてサンプルを観察し、100個の一次粒子の大きさを計測し、その算術平均値を粒径とした。各サンプルの粒径を表1に示す。
【0079】
【表1】

【0080】
<X線回折測定>
また、上記得られたLiMnPWO4サンプル(粉末状)について、上記≪I.LiNiPWO4に関する評価試験≫の欄に記載した測定方法と同様のX線回折装置および条件で、結晶構造を測定した。得られた回折パターンを図9に示す。
【0081】
図9より、W元素の存在比率が増加するのに伴い、2θ=35°付近のピークが低角側にシフトした(即ち、結晶格子間隔が広くなった)。これを解析したところ、かかる結晶格子の伸びは、上記一般式中のP元素の位置が、W元素で置換されたことに対応していることが確認された。
【0082】
<正極の作製、リチウム二次電池の構築>
上記合成(調合)した正極活物質を用いて、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄に記載した方法と同様の手順により正極(実施例11〜14および比較例11〜15)を作製した。そして、負極として金属リチウム(直径19mm、厚さ0.02mmの金属Li箔を用いた。)を用いたこと以外は、上記≪I.LiNiPWO4に関する評価試験≫の実施例1の欄と同様の手順により、実施例11〜14および比較例11〜15に係るリチウム二次電池を構築した。
【0083】
<充電試験>
上記構築したリチウム二次電池を用いて、充電試験を行った。具体的には、0.05Cのレートで4.8Vまで定電流充電した後、合計時間が35時間になるまで定電圧充電を行った。
【0084】
<示差熱測定(充電試験後)>
かかる充電試験後、該電池をグローブボックス内で解体し、正極を取り出し溶媒(ここでは、DMCを用いた。)で数回洗浄した。そして、該正極から樹脂製のスパチュラで正極合材層を剥ぎ取り、下記条件で示差熱(DSC;Differential Scanning Calorimetry)測定を行った。なお、DSC測定では、温度変化に伴うサンプルの熱的挙動を測定することができ、かかる測定により得られるピークトップ温度が高いほど、サンプルの熱安定性は高いと考えられる。
DSC測定により得られた発熱ピークトップ温度(℃)と、W元素の存在比率(即ち、実施例では結晶構造中のW元素の存在比率を、比較例では正極合材層内のWO3の存在比率(%)を指す。)の関係を図10に示す。
測定装置;Shimadzu DSC−60
到達温度;400℃、昇温速度;5℃/min.
パージガス;窒素(流量;50ml/min.)
容器;ステンレスパン
サンプル量;凡そ5mg
【0085】
図10に示すように、W供給源としての酸化タングステン〔WO3〕を正極合材層に直接添加した比較例12〜15のリチウム二次電池では、該WO3の存在比率を最大10%(比較例5)まで変化させても、発熱ピークトップ温度にほとんど変化は見られなかった。これに対し、ここで開示される製造方法によって合成されたLiMnPWO4を正極活物質として用いた実施例11〜14のリチウム二次電池では、W元素の存在比率が5%までは存在比率の増加に伴って、発熱ピークトップ温度の上昇が認められた。上述のXRDの結果(図9)から、P元素の位置がW元素で置換されたことで結晶格子間隔が広くなったため、充放電に伴うリチウムイオンの吸蔵および放出がスムーズになり、結晶構造の安定性が向上したものと考えられる。また、W元素の存在比率が5%以上の場合(例えば、W元素の存在比率が10%(実施例14))では、やや発熱ピークトップ温度が低下した。かかる理由としては、例えばW元素の存在比率が安定で存在し得る状態を超えたため、結晶構造の不安定性が増したことが考えられる。以上の結果より、ここに開示される製造方法において、W元素の存在比率を1%〜15%とすること(即ち、一般式LixMn〔P(1−Y)WY〕O4における、Yの値を0.01以上0.15以下とすること)により、従来に比べ熱安定性を向上し得ることが示された。また、より好ましくはW元素の存在比率を1%〜10%とすることが確認された。
【0086】
以上、本発明を詳細に説明したが、上記実施形態および実施例は例示にすぎず、請求の範囲を限定するものではない。請求の範囲に記載の技術には、以上に例示した具体例を様々に変形、変更したものが含まれる。
【産業上の利用可能性】
【0087】
本発明の方法により得られた正極活物質を用いたリチウム二次電池は、上述したように結晶構造の安定性に優れていることを特徴とするため、各種用途に利用可能である。また優れた電池性能(サイクル特性や熱安定性)を発揮し得ることから、特に自動車等の車両に搭載されるモーター用の駆動電源として好適に使用し得る。車両の種類は特に限定されないが、典型的には、プラグインハイブリッド自動車(PHV)、ハイブリッド自動車(HV)、電気自動車(EV)等が挙げられる。
【符号の説明】
【0088】
S10 原料混合物の調製
S20 加熱処理
S30 焼成
S310 仮焼成
S320 本焼成
1 自動車(車両)
10 正極シート(正極)
12 正極集電体
14 正極合材層
20 負極シート(負極)
22 負極集電体
24 負極合材層
40A、40B セパレータシート
50 電池ケース
52 ケース本体
54 蓋体
55 安全弁
70 正極端子
72 負極端子
80 捲回電極体
100 リチウム二次電池
【特許請求の範囲】
【請求項1】
正極と負極を有する電極体を備えるリチウム二次電池であって、
前記正極は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、
ここで、前記A元素が5価の金属元素であることを特徴とする、リチウム二次電池。
【請求項2】
前記5価の金属元素はWである、請求項1に記載のリチウム二次電池。
【請求項3】
前記リチウム含有リン酸化合物の結晶構造は、空間群Cmcmと、空間群Pnmaと、を含む、請求項1または2に記載のリチウム二次電池。
【請求項4】
前記リチウム含有リン酸化合物は、前記M元素としてMnを含んでおり、0<Y≦0.1の条件を満たしている、請求項1から3のいずれか一項に記載のリチウム二次電池。
【請求項5】
前記リチウム含有リン酸化合物は、前記M元素としてNiを含んでおり、0<Y≦0.05の条件を満たしている、請求項1から4のいずれか一項に記載のリチウム二次電池。
【請求項6】
前記粒状の正極活物質は、該粒子表面の少なくとも一部が導電性粉末で被覆されている、請求項1から5のいずれか一項に記載のリチウム二次電池。
【請求項7】
前記粒状の正極活物質は、電子顕微鏡観察における一次粒子の粒径が10nm以上200nm以下である、請求項1から6のいずれか一項に記載のリチウム二次電池。
【請求項8】
前記負極は、負極活物質として少なくともチタン酸リチウムを含む、請求項1から7のいずれか一項に記載のリチウム二次電池。
【請求項9】
リチウム二次電池用の正極活物質を製造する方法であって、
一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を構成するための原料として、リチウム源と、リン酸源と、M元素源と、A元素源と、を水系溶媒中で混合し、原料混合物を調製すること;
前記原料混合物を加熱処理して、ゲル状の原料混合物を得ること;および、
前記ゲル状の原料混合物を、800℃以下の温度で焼成すること;
を包含する、正極活物質の製造方法。
【請求項10】
前記原料混合物の調製は、前記水系溶媒のpHが3以下で行う、請求項9に記載の正極活物質の製造方法。
【請求項11】
前記原料混合物の調製において、キレート剤を添加する、請求項9または10に記載の正極活物質の製造方法。
【請求項12】
前記焼成において、
前記ゲル状の前記原料混合物を、400℃以下の温度で仮焼成すること;および、
前記仮焼成物と導電性粉末とを混合し、前記仮焼成温度以上であって、800℃以下の温度で本焼成すること;
を包含する、請求項9から11のいずれか一項に記載の正極活物質の製造方法。
【請求項13】
前記仮焼成は、120℃以上400℃以下で行う、請求項12に記載の正極活物質の製造方法。
【請求項14】
前記導電性粉末として、電子顕微鏡観察における一次粒子の粒径が10nm以上100nm以下の炭素材料を用いる、請求項12または13に記載の正極活物質の製造方法。
【請求項15】
請求項9から14のいずれか一項に記載の製造方法により得られた正極活物質を正極に備えるリチウム二次電池。
【請求項16】
請求項1から8または請求項15のいずれか一項に記載のリチウム二次電池を駆動用電源として備える車両。
【請求項1】
正極と負極を有する電極体を備えるリチウム二次電池であって、
前記正極は、一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を主成分として構成された粒状の正極活物質を含んでおり、
ここで、前記A元素が5価の金属元素であることを特徴とする、リチウム二次電池。
【請求項2】
前記5価の金属元素はWである、請求項1に記載のリチウム二次電池。
【請求項3】
前記リチウム含有リン酸化合物の結晶構造は、空間群Cmcmと、空間群Pnmaと、を含む、請求項1または2に記載のリチウム二次電池。
【請求項4】
前記リチウム含有リン酸化合物は、前記M元素としてMnを含んでおり、0<Y≦0.1の条件を満たしている、請求項1から3のいずれか一項に記載のリチウム二次電池。
【請求項5】
前記リチウム含有リン酸化合物は、前記M元素としてNiを含んでおり、0<Y≦0.05の条件を満たしている、請求項1から4のいずれか一項に記載のリチウム二次電池。
【請求項6】
前記粒状の正極活物質は、該粒子表面の少なくとも一部が導電性粉末で被覆されている、請求項1から5のいずれか一項に記載のリチウム二次電池。
【請求項7】
前記粒状の正極活物質は、電子顕微鏡観察における一次粒子の粒径が10nm以上200nm以下である、請求項1から6のいずれか一項に記載のリチウム二次電池。
【請求項8】
前記負極は、負極活物質として少なくともチタン酸リチウムを含む、請求項1から7のいずれか一項に記載のリチウム二次電池。
【請求項9】
リチウム二次電池用の正極活物質を製造する方法であって、
一般式LixM〔P(1−Y)AY〕O4(ただし、式中のMは、Ni、Mn、FeおよびCoからなる群から選択される1種以上の元素であり、0<x≦2および0<Y≦0.15の条件を満たす実数である。)で表されるオリビン型のリチウム含有リン酸化合物を構成するための原料として、リチウム源と、リン酸源と、M元素源と、A元素源と、を水系溶媒中で混合し、原料混合物を調製すること;
前記原料混合物を加熱処理して、ゲル状の原料混合物を得ること;および、
前記ゲル状の原料混合物を、800℃以下の温度で焼成すること;
を包含する、正極活物質の製造方法。
【請求項10】
前記原料混合物の調製は、前記水系溶媒のpHが3以下で行う、請求項9に記載の正極活物質の製造方法。
【請求項11】
前記原料混合物の調製において、キレート剤を添加する、請求項9または10に記載の正極活物質の製造方法。
【請求項12】
前記焼成において、
前記ゲル状の前記原料混合物を、400℃以下の温度で仮焼成すること;および、
前記仮焼成物と導電性粉末とを混合し、前記仮焼成温度以上であって、800℃以下の温度で本焼成すること;
を包含する、請求項9から11のいずれか一項に記載の正極活物質の製造方法。
【請求項13】
前記仮焼成は、120℃以上400℃以下で行う、請求項12に記載の正極活物質の製造方法。
【請求項14】
前記導電性粉末として、電子顕微鏡観察における一次粒子の粒径が10nm以上100nm以下の炭素材料を用いる、請求項12または13に記載の正極活物質の製造方法。
【請求項15】
請求項9から14のいずれか一項に記載の製造方法により得られた正極活物質を正極に備えるリチウム二次電池。
【請求項16】
請求項1から8または請求項15のいずれか一項に記載のリチウム二次電池を駆動用電源として備える車両。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−105536(P2013−105536A)
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願番号】特願2011−246658(P2011−246658)
【出願日】平成23年11月10日(2011.11.10)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
【公開日】平成25年5月30日(2013.5.30)
【国際特許分類】
【出願日】平成23年11月10日(2011.11.10)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
[ Back to top ]

