リバーシブル燃料電池
【課題】過充電時に供給される電気エネルギーを、ガスとして貯蔵し電気エネルギーに再変換して利用することが可能で、エネルギー利用効率、エネルギー密度および負荷追従性に優れるリバーシブル燃料電池および電池モジュールを提供する。
【解決手段】水素吸蔵合金を含む負極94と二酸化マンガンを含む正極96とを有するリバーシブル燃料電池において、前記負極と正極との間に介在する、プロトンを通過させ電子を通過させない中空糸製のセパレータ95を用い、前記負極で発生する水素ガスおよび前記正極で発生する酸素ガスをそれぞれ独立に貯蔵する水素ガス貯蔵室88および酸素ガス貯蔵室88を設ける。そして、水素ガス貯蔵室および酸素ガス貯蔵室に貯蔵された水素ガスおよび酸素ガスにより、負極および正極を充電する。
【解決手段】水素吸蔵合金を含む負極94と二酸化マンガンを含む正極96とを有するリバーシブル燃料電池において、前記負極と正極との間に介在する、プロトンを通過させ電子を通過させない中空糸製のセパレータ95を用い、前記負極で発生する水素ガスおよび前記正極で発生する酸素ガスをそれぞれ独立に貯蔵する水素ガス貯蔵室88および酸素ガス貯蔵室88を設ける。そして、水素ガス貯蔵室および酸素ガス貯蔵室に貯蔵された水素ガスおよび酸素ガスにより、負極および正極を充電する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、充電時に供給される電気エネルギーをガスとして貯蔵し、貯蔵されたガスを電気エネルギーに再変換して利用することができる、燃料電池に関する。
【背景技術】
【0002】
従来、主として携帯機器用の電源として使用する充放電可能な種々の二次電池が提案されてきた。さらには、近年、環境への配慮から、自動車や電車などの車両に充放電可能な二次電池を搭載したものが開発されている。車両に二次電池を搭載した場合には、ブレーキ時に生じる回生電力をこの搭載電池に蓄えておき、車両の動力源として使用することができるので、車両のエネルギー効率を高めることができる。
このように車両に搭載する二次電池としては、エネルギー密度、負荷変動追従性、耐久性、製造コストなどの諸条件から、例えばニッケル水素二次電池が適しているとされる(特許文献1)。ニッケル水素二次電池は、負極に水素吸蔵合金、正極に水酸化ニッケルを活物質としてそれぞれ使用しており、正負極間のプロトンの授受により充放電が行われる。正極に水酸化ニッケルの代わりに水酸化マンガンを用いた技術が開示されている(特許文献2)。
【0003】
また、同様に携帯機器の電源や車両の動力源として、燃料電池を用いることが提案されている。燃料電池は、水素と酸素が反応してH2Oを生成する際に、化学エネルギーを電気エネルギーに変換する発電装置であり、環境への負荷が小さい。また、燃料電池は空気中の酸素を利用できるので、燃料となる水素を供給できれば、どこでも電気を取り出すことができ、二次電池のように電気で充電することを要しないという利点がある。
【0004】
通常の二次電池は電気エネルギーにより充電が行われて、電気を蓄えることを可能としている。しかし、電気の供給がある場所でなければ充電できないので、利便性が十分でない。そこで、ガスによる充電も可能にした二次電池が特許文献3に開示されている。更に、蓄電機能を有した燃料電池が特許文献2に開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−110381号公報
【特許文献2】特開2010−15783号公報
【特許文献3】特開2010−15729号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、ニッケル水素二次電池においては、一般的に、あらかじめ負極の容量を正極の容量よりも大きく設定しておくことで、密閉化を可能にしている。すなわち、満充電の状態からさらに充電が行われる過充電時には、正極において下記(1)の反応により酸素ガスが発生する。
OH- → 1/4O2 + 1/2H2O + e- (1)
【0007】
正極で発生した酸素ガスは、下記(2)の反応により負極の水素吸蔵合金(M)中の水素と反応してH2Oとなるので、電池内部の圧力上昇が抑えられ、電池を密閉構造とする
ことができる。
MH + 1/4O2 → M + 1/2H2O (2)
ただし、Mは水素吸蔵合金を示す。
【0008】
上記の、酸素ガスと水素吸蔵合金中の水素とが接触して水を生成する反応は発熱反応である。すなわち、過充電時に電池に供給された電気エネルギーは、熱エネルギーとして廃棄され、再び電気エネルギーとして取り出すことができない。
【0009】
また、二次電池が蓄えることのできる電気容量は、所定の容積を有する電池のケースに固体として充填される負極および正極の活物質の量によって規制される。活物質の質量に対して貯蔵することができる還元物質や酸化物質の質量は質量割合として少なく、例えば水素吸蔵合金AB5に貯蔵することができる水素は1.2重量%程度である。このため、二次電池のエネルギー密度を大幅に高めることは困難である。
【0010】
一方、燃料電池においては、燃料電池自体では蓄電が不可能なので、電極部分に水素ガスおよび酸素ガスを供給するための装置や部材が必要となる。しかも、燃料電池は、放電時の負荷変動に対する追従性に劣るので、燃料電池単独では、車両のような負荷変動の大きい用途に適用することが困難であり、通常は二次電池やキャパシタなどの蓄電装置と組み合わせて使用される。さらに、燃料電池はガス拡散電極という気体と液体と固体が同時に接触する線を反応の場にしているため、反応領域が狭く、反応速度が遅いという構造上の問題があり、これを解決するために白金のような高価な触媒が必要であるなど、種々の課題を抱えている。
【0011】
特許文献3に開示されている二次電池は、ガスを供給すれば、燃料電池のように放電することができるので、通常の二次電池のように電気容量が活物質の量に制限されることはないが、電極部分に水素ガスと酸素ガスを供給するための装置や部材が必要となる。
【0012】
特許文献2に開示されている「燃料電池蓄電池」は、電極部分に水素ガスと酸素ガスを供給するための余分な装置や部材が不要であるが、正極活物質に水酸化マンガンを使用しているので、充放電を繰り返すうちに、充放電反応に寄与しない四三酸化マンガンが生成され、寿命特性が悪いという課題を有している。
【0013】
すなわち、二酸化マンガンはその放電過程において、二酸化マンガンMnO2→オキシ水酸化マンガンMnOOH→水酸化マンガンMn(OH)2と変化するが、水酸化マンガンまで放電すると充電できない四三酸化マンガンMn3O4が生成されるからである。
【0014】
本発明の目的は、上記の課題を解決するために、過充電時に供給された電気エネルギーを水素と酸素の化学エネルギーとして蓄え、これを電気エネルギーに再変換して利用することのできる、パワー密度、エネルギー密度、および負荷追従性に優れ、かつ、寿命特性の優れた燃料電池を提供することである。
【課題を解決するための手段】
【0015】
本発明に係るリバーシブル燃料電池は、水素吸蔵合金を含む負極と、二酸化マンガンを含む正極と、前記負極と正極との間に介在する中空糸製のセパレータと、前記負極で発生する水素ガスを貯蔵する水素ガス貯蔵室と、前記正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室とを備えている。
なお、本発明において酸素ガス貯蔵室および水素ガス貯蔵室は、別個に、かつ、負極および正極と各貯蔵室との間に昇圧装置や連通路などの追加部材を介在させずに直接に、各電極において発生したガスを貯蔵する。また、リバーシブル燃料電池とは燃料と電気エネルギーを可逆的に変換することができる蓄電が可能な燃料電池のことをいう。
【0016】
この構成によれば、電極内部が満充電の状態からさらに電流によって充電を行った場合に、電解液が電気分解されて、負極から水素ガスが、正極から酸素ガスが発生する。発生した水素ガスおよび酸素ガスは、互いに接触・反応させることなく、水素ガス貯蔵室および酸素ガス貯蔵室に、それぞれ直接かつ独立に貯蔵することができる。したがって、追加のガス供給源や供給通路、昇圧装置などを要することなく、水素ガスおよび酸素ガスを各貯蔵室に貯蔵し、貯蔵された水素ガスおよび酸素ガスを、電池の放電時に電気エネルギーに変換して再利用することができる。電池の放電時には、正負極間において、水素−マンガン電池としての通常の放電反応が起こって電気エネルギーを取り出すことができる。つまり、二次電池の電極反応を介して電気エネルギーが出力されるので、急速放電と優れた放電追従性を得ることができる。
【0017】
放電時には、負極および正極のそれぞれにおいて、放電によって減少した電気量分が、水素ガス貯蔵室および酸素ガス貯蔵室にそれぞれ貯蔵された水素ガスおよび酸素ガスによる充電によって補われる。具体的には、負極においては、放電反応を表す反応式(3)に示すように、充電状態の水素吸蔵合金(MH)からプロトンが放出されるが、反応式(4)に示すように、放出された分のプロトンが、水素ガスによって補われ、負極の充電状態が維持される。
MH → M + H+ + e- (3)
M + 1/2H2 → MH (4)
ただし、式(3)および(4)において、Mは水素吸蔵合金を示す。
【0018】
一方正極においては、放電反応を表す反応式(5)に示すように、充電状態の二酸化マンガン(MnO2)から還元されたオキシ水酸化マンガンが、反応式(6)に示すように酸素ガスによって再び酸化され、正極の充電状態が維持される。
MnO2 + H+ + e- → MnOOH (5)
MnOOH + O2 → MnO2 + H2O (6)
【0019】
各貯蔵室の水素ガスおよび酸素ガスが消費された後は、通常の水素−マンガン電池として作動して放電がなされる。
【0020】
正極の二酸化マンガンは放電によりオキシ水酸化マンガンとなるが、オキシ水酸化マンガンは充電すると、二酸化マンガンに戻り放電が可能となる。一方、オキシ水酸化マンガンは酸素ガスに接触させると水素原子と反応して二酸化マンガンになって放電が可能となる。
【0021】
つまり、オキシ水酸化マンガンは充電すると水素原子を放出し放電が可能となり、負極には水素原子が貯蔵される。満充電された後さらに充電を行うと電解液を電気分解して、負極から水素ガスが発生し、正極から酸素ガスが発生する。発生した酸素ガスを容器に貯蔵しておくと放電した際に二酸化マンガン内に水素原子が生成されても気体の酸素ガスが水素原子と反応して燃料電池のように作動する。もちろん二次電池としても作動するので、高出力が可能となる。
【0022】
すなわち、本発明に係るリバーシブル燃料電池において、外部に取り出すことのできる電気エネルギーは、正負極の各活物質量によって規制される二次電池としての容量に加えて、各貯蔵室にガスのエネルギーとして蓄えることが可能である。この場合、各貯蔵室およびこれを含む電池の耐圧性能および密閉性能を高めることにより、体積あたりのガス貯蔵量を増加させる、つまり電池の体積エネルギー密度を向上させることが可能となる。
本発明に係る電池の上記のような作用及び効果は、負極および正極を、それぞれ、水素ガスおよび酸素ガスによって化学的に充電することにより得られるものである。なお、本明細書において、「負極を充電」「正極を充電」、とは、通常の電気化学反応によって当該電池を充電した場合の負極における還元反応および正極における酸化反応を、正負極それぞれにおいて独立に起こさせることをいう。
【0023】
二酸化マンガンを正極とする水溶液系電池として、亜鉛マンガン一次電池が広く知られている。亜鉛マンガン電池は専ら一次電池として使用され、二次電池として使用されない。これは、マンガン電池の正極がその放電過程において、二酸化マンガンMnO2→オキシ水酸化マンガンMnOOH→水酸化マンガンMn(OH)2と変化するのであるが、水酸化マンガンまで放電すると充電できない四三酸化マンガンMn3O4ができてしまうからである。
このため、二酸化マンガンが二次電池の正極として使用されなかった。そこで発明者らは、二酸化マンガンがオキシ水酸化マンガンまでしか放電しなければ四三酸化マンガンを生ずることがなく再度充電が可能なので劣化しないと考え、そのことを実験により確認した。すなわち、
【0024】
二酸化マンガンが放電によりオキシ化しても、酸素ガスに接触させれば二酸化マンガンに戻るので、水酸化マンガンまで反応が進むことがなく不可逆な四三酸化マンガンが生じることがない。つまり二酸化マンガンがオキシ化した段階で、正極を酸素ガスと接触させて充電することにより、二酸化マンガンを正極として用いることに成功した。
【0025】
一方、水酸化ニッケルや水酸化マンガンを正極材料とする技術が開示されているが(例えば特許文献2)、水酸化ニッケルは二次電池正極としては成立するのであるが酸素と反応してオキシ化しないので、本発明のようなリバーシブル燃料電池の正極にはならない。また、特許文献2において正極材料に用いた水酸化マンガンは燃料電池正極反応の触媒として機能するものであって、放電後の活物質が酸素で元の充電状態に戻るのではなく、放電した活物質はそのままの状態であるところ、本願発明のリバーシブル燃料電池において、二酸化マンガンが活物質として電気で充電もできるし、酸素ガスでも充電できるというものである。活物質は放電した後、酸素と化学的に反応することによって、充電したときと全く同じ物質に戻るので、特許文献2における水酸化マンガンとは、反応が全く異なる。
【0026】
二次電池の電気容量は電極材に含まれる活物質の量で定まることは前述した通りである。このため、二次電池は高エネルギー密度化することができない。一方、上記のように酸素により充電が可能となればその電気容量は燃料電池の例の示す通り大きなものとなる。
【0027】
本発明の特徴とするところは、正極に二酸化マンガンを採用し、負極に水素吸蔵合金を採用して、それぞれの電極を酸素ガスおよび水素ガスで充電することにより電気容量の増大を図り、放電時は二次電池反応により速やかな電力の取り出しを可能にしたところにある。すなわち、水素および酸素の化学エネルギーを電気エネルギーに変換して再利用することを可能とし、エネルギー利用効率およびエネルギー密度ならびにパワーを飛躍的に高めることができる。また電池コストの多くは活物質の材料費であり、少ない活物質量で大きな電気容量が可能となることから電池コストの低減が可能となる。
【0028】
正極および負極を、それぞれ酸素ガスおよび水素ガスに触れさせることにより充電できることを、発明者らは、実験によって確認した。図3、4に、正極および負極それぞれについて半電池を構成して、酸素ガスおよび水素ガスによって充電する実験を行った結果を示す。
【0029】
図3は、水素吸蔵合金を負極とし、銀(Ag)を参照極とし、アルカリ系電解液を用いて半電池を構成して、水素ガスの加圧投入による負極の充電を行ったときの充電量の変化を時間に対してプロットしたものである。図3(a)の左右の縦軸は、それぞれ、充電量を水素吸蔵合金の単位重量に対する吸蔵された水素の物質量(mmol/g)、および、単位重量に対する電気容量(mAh/g)で示しており、横軸は経過時間(分)を示している。
この実験では、負極が完全に放電された状態から充電を開始しており、図3(a)の曲線a、bは、それぞれ、水素ガスを0.5MPaおよび0.3Mpaで加圧投入したときの充電量の変化を表わしている。図3(a)から分かるように、水素ガスを供給して充電を開始してから10分間で、0.5MPaおよび0.3Mpaのいずれの条件においても、各圧力における充電量の理論値に対してほぼ80%まで充電された。
【0030】
図3(b)の縦軸は負極の電位(V vs.Ag/AgCl)を、横軸は放電量(mAh/g)を示す。この実験では、水素ガスで充電された負極はアルカリ溶液中でほぼすべて放電可能であることを示している。
【0031】
図4はオキシ水酸化マンガンを正極とし、銀(Ag)を参照極とし、アルカリ系電解液を用いて半電池を構成して、酸素ガスの加圧投入による充電、および放電を行ったときの正極の電位変化を時間に対してプロットしたものである。図4の縦軸は正極の電位(V
vs.Ag/AgCl)を、横軸は経過時間(分)を示す。
図4(a)の(i)は、正極に酸素ガスが加圧投入された後の参照極に対する電位を示しており、(ii)では酸素ガス供給を停止し、0.2C放電を行った場合のグラフである。正極を酸素ガスに接触させた場合(実線)、60分経過でほぼ満充電の状態を示し、その後に0.2Cで放電をしていることを示している。一方、酸素ガスに接触をさせない場合(点線)、殆ど充電が行なわれていないことを示している。これにより、酸素ガスにより燃料電池カソード反応(酸化還元反応)が起こり、酸素ガス遮断後に二次電池反応による放電が確認できた。
図4(b)は、0.2Cでの放電状態での酸素ガスによる充電の状況を示しており、放電中であっても、酸素ガスによる充電が可能であることを示している。
【0032】
これら図3および図4に示した実験結果により、正極と負極にそれぞれ酸素ガスおよび水素ガスを供給することで、それぞれ独立に充電可能であることが確認された。
【0033】
二酸化マンガンは水酸化マンガンまで放電すると充電できない四三酸化マンガンが生じるので二次電池の正極として使用されてこなかった。そこで、発明者らは、二酸化マンガンが水酸化マンガンまで放電しなければ、四三酸化マンガンを生ずることがなく、劣化しないと考え、そのことを実験により確かめた。
【0034】
放電反応深度による充放電サイクル特性の違いを実験により調べた結果を図5に示す。図5のグラフ(a)は、充放電サイクル実験前の電極のXRD測定結果であり、グラフ(b)は二酸化マンガンとオキシ水酸化マンガンの間で充放電を30回繰り返した場合の測定結果であり、グラフ(c)は二酸化マンガンからオキシ水酸化マンガンを経て水酸化マンガンの間で充放電を30回繰り返した場合の測定結果である。
グラフ(b)のケースで充放電を繰り返した電極の場合、実験前の電極の結晶構造以外には新たなピークの生成はほとんどみられない。しかし、グラフ(c)のケースで充放電を繰り返した電極の場合、二酸化マンガン由来の特徴ピークはほとんど無くなり、四三酸化マンガン由来のピークが表れている。このことから、オキシ水酸化マンガンの段階で放電を停止すれば、四三酸化マンガンを生成することがないことが分かった。
【0035】
以上のように、本発明に係るリバーシブル燃料電池によれば、負極および正極に、水素ガスおよび酸素ガスを直接的に、かつ互いに独立に蓄える貯蔵室を設けることにより、追加のガス供給系統を設けることなく充電時に供給された電気エネルギーをガスとして貯蔵し、電気エネルギーに再変換して利用することが可能となる。これにより、従来の密閉型二次電池においては過充電時に熱として廃棄されていたエネルギーを電気エネルギーとして再利用できるので、エネルギー利用効率が向上するとともに、取り出すべき電気エネルギーをガスの化学エネルギーとして蓄えることができ、エネルギー密度が飛躍的に向上する。
また、二次電池の電極反応を介して電気エネルギーを入出力するので、従来の燃料電池と比較して、充電が可能となり、更には負荷変動に対する追従性が大幅に改善される。しかもこのような電池を、ガス供給のための追加の部材・装置を要しない簡単な構造を採用することによって、安価に製造・供給することが可能となる。
【0036】
正極に二酸化マンガンを使用することにより、例えば、水酸化マンガンに比べて耐久性があり、水酸化ニッケルに比べると安価でエネルギー密度が向上するといえる。電池寿命について、これまで四三酸化マンガンにまで還元されて生成された充電不可能な物質の形成を酸素ガスによって阻止し、サイクル耐久性を確保することができた。
【0037】
化学反応を利用して電力を取り出す場合、取り出すことができるエネルギーをΔHとすればΔGを電気として取り出すことができ、TΔSを熱として取り出すことができる。ΔHは反応生成熱と呼ばれ、燃焼反応などの発熱反応であれば負の値であり、発熱量とも呼ばれている。ΔHはΔG+TΔSである。ΔGは自由エネルギーと呼ばれ仕事として取り出すことができるエネルギーであり、有効なエネルギーとしてエクセルギーと呼ばれている。
TΔSは反応に伴って発生する熱であり、エントロピー変化と温度の積で表されている。そして有効なエネルギーを取り出す能力としてΔG/ΔHをエクセルギー効率と呼んでいる。ニッケル水素電池を充放電すると蓄電効率、すなわち充電電力量に対する放電電力量は90〜99%程度まで上げることができるが、水を電気分解して、水素と酸素にすると常温ではエクセルギー効率ΔG/ΔHが83%であるため蓄電効率は83%を超えることができない。
【0038】
本発明により解決しようとしている課題の一つはエクセルギー率ΔG/ΔHを出来る限り1に近づけると共にΔHを熱にする割合を減らし、可能な限り電気エネルギーに変換する装置を提供することである。発電効率ΔG/ΔHを高くするためには、TΔSを減少させてΔGを増加する。ΔGは温度と圧力により決まる値であり、これを最小にして、ΔG/ΔHの値を上げることができる。
【0039】
燃料電池を使用して水素を電気エネルギーに変換する時には水素の発熱量の17%が熱となって発生する。この熱の発生量を低くするためには高圧水素を燃料電池に送り込み、発電すれば熱の発生を抑えることができ、発電効率を上げることが可能となる。燃料電池を使用して水素を電気エネルギーから製造する時には水素の発熱量の17%の熱が必要となり、その時常圧で水素と酸素を発生させると大気に対して仕事をすることになり損失となる。そこで電気分解を密閉空間で行なわせ、17%のTΔSを小さくすることができる。図6は熱力学計算結果であり、圧力が大きいほどTΔSが小さくなることを示している。
【0040】
本発明に係るリバーシブル燃料電池は、前記負極、前記正極、前記セパレータ、前記水素ガス貯蔵室、および前記酸素ガス貯蔵室を収容する筒状の外装体を有していることが好ましい。上述のように、本発明に係るリバーシブル燃料電池においては、単位体積あたりのガス貯蔵可能量が増せば、電気として取り出すことのできるエネルギー量が増す。換言すれば、電池の外装体の耐圧性を向上させることにより、電池のエネルギー密度を高めることが可能となる。
【0041】
本発明に係るリバーシブル燃料電池は、前記水素ガス貯蔵室が、前記水素吸蔵合金の隙間に構成されていることが好ましい。
水素吸蔵合金の粒子径の平均値は20μmであるとすれば、空隙率はおよそ35%となる。空隙率の大きさは、水素吸蔵合金の充填の仕方によって変わり、35%より大きくすることが可能である。このような空隙は水素貯蔵室として機能する。
【0042】
本発明に係るリバーシブル燃料電池は、前記セパレータが有底の筒状であって、前記外装体の内部軸方向に配置されていて、前記正極が有底の筒状であって、前記セパレータの内方に形成されていて、前記酸素ガス貯蔵室が前記正極の内方に形成されていて、前記外装体の内部であって前記セパレータの外方に粒子状の水素吸蔵合金が充填されていることが好ましい。
【0043】
本発明に係るリバーシブル燃料電池は、前記正極中に含まれる四三酸化マンガン(Mn3O4)の量が重量比で5%以下であることが望ましい。
【0044】
リバーシブル燃料電池において、前記正極中に含まれる四三酸化マンガンの量が重量比で5%以下である。この構成によれば、正極の二酸化マンガンが水酸化マンガンまで放電が進むと充電できない四三酸化マンガンMn3O4が生じてしまうことは前述したとおりであるところ、不可逆な四三酸化マンガンMn3O4が生じなければ、正極は劣化することなく、酸素により再度充電ができる。四三酸化マンガンMn3O4が5%以下であれば劣化の程度は小さい。したがって、好ましくは四三酸化マンガンMn3O4の量が重量比で2%以下であって、より好ましくは0.5%未満であることが望ましい。
【0045】
本発明に係るリバーシブル燃料電池は、前記負極および前記正極の少なくともいずれか一方が、前記負極の前記セパレータに接する面に親水性を有する材料を配置して、前記水素ガス貯蔵室に接する面に疎水性を有する材料を配置した負極、および/もしくは、前記正極の前記セパレータに接する面に親水性を有する材料を配置して、前記酸素ガス貯蔵室に接する面に疎水性を有する材料を配置した正極であることが望ましい。
この構成によれば、負極のセパレータに接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。また、水素ガスに接触している側は疎水性にしてあり負極が濡れずに水素ガスと良好な接触を保つようにしてある。正極のセパレータに接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保してある。また、酸素ガスに接触している側は疎水性にしてあり正極が濡れずに酸素ガスと良好な接触を保つようにしてある。なおセパレータは、常に電解液を含んでいて、気体が通過しないようにしてあるので、水素ガス貯蔵室と酸素ガス貯蔵室とは独立して、水素ガスと酸素ガスとが交じり合うことなく独立に貯蔵できるようになっている。
【0046】
固体(電極)と液体(電解質)の反応面をもつ二次電池特性と、固体(電極)と気体と液体の反応面をもつ燃料電池特性を1つの電極中で実現することができれば、更に高出力化と大エネルギー容量化が可能となる。そこで、電極の電解液に接触する界面を親水性とし、気体と接触する界面を疎水性とした。電極の一方の面を親水性とし、他方の面を疎水性とする代わりに、電極全体が親水性と疎水性を併せもつ材料で構成してもよい。
【0047】
本発明に係るリバーシブル燃料電池は、前記電解液が前記酸素ガス貯蔵室に保持されていることが望ましい。その理由は、放電した時に発生する水は正極表面で生成され、充電時に水の電気分解も正極界面で行われるからである。
【発明の効果】
【0048】
以上のように、本発明に係るリバーシブル燃料電池によれば、追加のガス供給装置を要することなく、エネルギー利用効率およびエネルギー密度を飛躍的に高めることができ、負荷変動に対する追従性が大幅に改善することができ、かつ、寿命特性を改善することができる。
【図面の簡単な説明】
【0049】
【図1】本発明の第1実施形態に係る燃料電池の構造を模式的に示す断面図である。
【図2】中空糸リバーシブル燃料電池の構造を示す断面図である。
【図3】水素ガスで水素吸蔵合金を充電したときの実験結果を示すグラフである。
【図4】酸素ガスで二酸化マンガン電極を充電したときの実験結果を示すグラフである。
【図5】放電深度の相違による二酸化マンガン正極の組成の変化を調べたXRD測定結果を示すグラフである。
【図6】自由エネルギーの圧力による影響を熱力学計算により求めたグラフである。
【発明を実施するための形態】
【0050】
以下、本発明に係る実施形態を図面に従って説明するが、本発明はこの実施形態に限定されるものではない。
【0051】
図1は、本発明の基本構成を有する、第1実施形態に係る電池C1の構造を模式的に示す断面図である。この電池C1は、水素および酸素の化学エネルギーを電気エネルギーに変換して利用する燃料電池に二次電池の反応機構を取り込んだリバーシブル燃料電池として構成したものであり、セパレータ5を介して対向する負極4および正極6、水素ガス貯蔵室8を形成する負極ケース1、ならびに酸素ガス貯蔵室9を形成する正極ケース2を主要な構成要素として備えている。
【0052】
負極4は、ニッケル水素二次電池で一般的に用いられているランタンニッケルのような水素吸蔵合金を主要な活物質として含んでいる。正極6の活物質には、二酸化マンガンを採用している。負極4と正極6との間にセパレータ5とともに介在させる電解液3としては、二次電池で一般的に用いられているアルカリ系水溶液、例えば、KOH水溶液、NaOH水溶液、LiOH水溶液などを用いることができる。
【0053】
負極4としては、例えば、負極活物質、導電性フィラーおよび樹脂に溶剤を加えてペースト状にしたものを、基板上に塗布して板状に成形し硬化させたものを使用することができる。同様に、正極6としては、正極活物質、導電性フィラーおよび樹脂に溶剤を加えてペースト状にしたものを、基板上に塗布して板状に成形し硬化させたものを使用することができる。
【0054】
導電性フィラーとしては、炭素繊維、炭素繊維にニッケルメッキを施したもの、炭素粒子、炭素粒子にニッケルメッキを施したもの、有機繊維にニッケルメッキを施したもの、繊維状ニッケル、ニッケル粒子、ニッケル箔のいずれかを単独で、または組み合わせて用いることができる。樹脂はバインダーとして用いるものであって、軟化温度120℃までの熱可塑性樹脂、硬化温度が常温から120℃までの樹脂、120℃以下の蒸発温度を有し溶剤に溶解する樹脂、水に可溶な溶剤に溶解する樹脂、アルコールに可溶な溶剤に溶解する樹脂などを用いることができる。基板としては、ニッケル板のような電気伝導性のある金属板を用いることができる。また、基板の代わりに発泡ニッケルシートを使用してもよい。
【0055】
負極4の水素ガス貯蔵室8に接触している側は疎水性材料を多く使用して水素吸蔵合金が濡れずに水素ガスと接触するようにしてある。セパレータ5に接触する側は親水性にしてあり、水素ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。正極6の酸素ガス貯蔵室9に接触している側は疎水性材料を多く使用して二酸化マンガンが濡れずに酸素ガスと接触するようにしてある。セパレータ5に接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。疎水性を有する炭素やテフロン(登録商標)等を各電極4、6のガス貯蔵室8,9に面する側に塗布もしくは噴霧してもよく、また、親水性を有する改質ナイロンを各電極4,6のセパレータ5に接触する面に塗布もしくは噴霧してもよい。更には、親水性と疎水性の両方の性質をもった酢酸ビニルを造粒してバインダーとして用いてもよい。
【0056】
セパレータ5は、プロトン(H+)を透過させるが水素ガスおよび酸素ガスを透過させにくい孔径を有する膜を使用している。具体的には微多孔膜を使用した。セパレータ5を形成する素材としては、例えば、ポリエチレン繊維やポリプロピレン繊維などのポリオレフィン系繊維、ポリフェニレンサルファイド繊維、ポリフェニレンサルファイド繊維、ポリフルオロエチレン系繊維、ポリアミド系繊維などを使用することができる。セパレータ5には電解液3が保持されている。さらに、本実施形態では、セパレータ5の両表面を水(電解液3)で濡らして水封セパレータとして形成することにより、ガス不透過性を高め、水素ガスおよび酸素ガスがセパレータ5を通過して互いに接触し反応することを一層確実に防止している。
【0057】
負極4の、正極6に対向する面と反対側の面は、箱形の負極ケース1によって気密に覆われており、負極ケース1の内方空間は、負極4で発生する水素ガスを、負極4との間に昇圧装置や連通路などの追加部材を介在させずに貯蔵する水素ガス貯蔵室8として機能する。同様に、正極6の、負極4に対向する面と反対側の面は、箱形の正極ケース2によって覆われており、正極ケース2の内方空間は、正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室9として機能する。水素ガス貯蔵室8と酸素ガス貯蔵室9とは、独立に、つまり、水素ガス貯蔵室8と酸素ガス貯蔵室9とが互いに連通しないように構成されている。酸素ガス貯蔵室9には、正負極間に介在させた電解液3と同種類の電解液が、酸素ガス貯蔵室9の容積の約1/3程度充填されている。
【0058】
酸素ガス貯蔵室9に充填される電解液3の量が少なければ、電気分解されるべき水の量が少なくなり、過充電時に発生する水素ガスおよび酸素ガスの量が少なくなる。一方、電解液の量が多ければ、ガスの貯蔵容積が減少する。このような観点から、酸素ガス貯蔵室9に充填される電解液3の量は、酸素ガス貯蔵室9の容積の20〜50%の範囲にあることが好ましく、25〜40%の範囲にあることがより好ましい。
【0059】
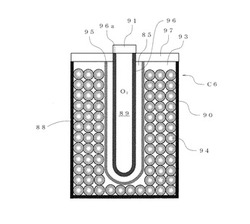
上記のように構成された電池C1の動作について説明する。電池C1が満充電状態に達した後、さらに電流を供給し続けると、負極4からは水素ガスが、正極6からは酸素ガスがそれぞれ発生する。これら水素ガスおよび酸素ガスは、水素ガス貯蔵室8および酸素ガス貯蔵室9にそれぞれ貯蔵される。
【0060】
電池C1が放電すると、放電によって減少した電気量分が、水素ガス貯蔵室8および酸素ガス貯蔵室9にそれぞれ貯蔵された水素ガスおよび酸素ガスによって充電される。
【0061】
次に、発明の第2実施形態に係る電池C6について、図2に示す断面図を用いて説明する。この電池C6は、図1とともに説明した第1実施形態の電池C1と同様の基本構成を有するが、図2に示すように筒状の外装体90を採用して耐圧性能と取扱性能を向上させ、これによりエネルギー密度の増大を図るとともに取り扱いを容易なものとした。なお、本実施形態に係る電池C6の電池としての基本要素である、負極、正極、セパレータおよび電解液については、以下で特に説明する点を除いて、上記の第1実施形態と同様の物質および構造を採用することができる。
【0062】
筒状に形成されている外装体90の内部空間には、電解液93と負極94を形成する粒子状の水素吸蔵合金が充填されている。外装体90のほぼ中央軸方向に中空糸製のセパレータ95の内側に配置された筒状の正極96が収納されている。そして、正極96の内方に形成された空間に酸素ガス貯蔵室89が形成されている。
【0063】
外装体90の内部の空間であって、セパレータ95の外方空間には、平均粒子径が20μmの水素吸蔵合金が充填されている。このとき、空隙率はおよそ35%となる。空隙率の大きさは、水素吸蔵合金の充填の仕方によって変わり、35%より大きくすることが可能である。平均粒子径が5〜50μmであれば、空隙率はおよそ30〜60%となる。このような空隙は水素ガス貯蔵室88を構成する。ここに、平均粒子径は、JIS
Z 8910の光散乱法による球相当径を用いて表した値である。
【0064】
これにより、この電池C6においては、電気分解により発生した水素ガスは水素ガス貯蔵室88に蓄えられ、酸素ガスは酸素ガス貯蔵室89に蓄えられる。また、水素ガス貯蔵室88に蓄えられた水素により負極94が充電可能であり、酸素ガス貯蔵室89に蓄えられた酸素ガスにより正極96が充電可能である。
【0065】
外装体90は、導電性素材、具体的にはニッケルメッキを施した鉄で形成されている。この外装体90の内面は負極を形成する粒子状の水素吸蔵合金が直接および電解液93を介して接触しており、外装体90が電池C6の負極端子として機能する。一方、外装体90の上面には絶縁部材97が配置されており、負極端子として機能する外装体90と正極96とを絶縁する。そして、正極96の上端面96aに、円板状の正極端子91が接合されている。
【0066】
粒状の水素吸蔵合金としては、例えば、活物質である水素吸蔵合金の粉末に、導電剤としてのカーボンおよびバインダーとしてのエチレン酢酸ビニル共重合体(EVA)を加えて混合したものを、造粒して固めたものを使用することができる。一方、正極96としては、例えば、活物質として二酸化マンガンの粉末を、負極94の場合と同様に、導電剤としてのカーボンおよびバインダーとしてのエチレン酢酸ビニル共重合体(EVA)を加えて混合したものを、中空糸に塗布して固めたものを使用することができる。このような構造により両極共大きな固気,固液反応界面となって内部抵抗が下がり、高速充放電が可能となる。
【0067】
以上のとおり、図面を参照しながら本発明の好適な実施形態を説明したが、本発明の趣旨を逸脱しない範囲内で、種々の追加、変更または削除が可能である。したがって、そのようなものも本発明の範囲内に含まれる。
【0068】
上記のように構成された電池C6は、以下のように動作する。電池C1は、満充電の状態までは、二次電池として、通常どおり電流による充電を行うことができる。
電池C6が満充電状態に達した後、さらに電流を供給し続けると、負極94からは水素ガスが、正極96からは酸素ガスがそれぞれ発生するが、これら水素ガスおよび酸素ガスは、互いに接触することなく、水素ガス貯蔵室88および酸素ガス貯蔵室89にそれぞれ貯蔵される。また、ガス貯蔵室88,89に蓄えられた水素ガスもしくは酸素ガスにより、負極94および正極96が充電される。
【0069】
電池C6の放電が開始されると、負極94および正極96間では、二次電池としての通常の放電反応が起こって負荷に電流が流れる。このとき、負極94および正極96のそれぞれにおいて、放電によって減少した電気量分が、水素ガス貯蔵室88および酸素ガス貯蔵室89にそれぞれ貯蔵された水素ガスおよび酸素ガスによる充電によって補われる。すなわち、負極94においては、充電状態の水素吸蔵合金(MH)から放出された分のプロトンが、水素ガスによって補われ、負極の充電状態が維持される(反応式(4)参照)。一方、正極96においては、充電状態の二酸化マンガン(MnO2)から放電(還元)されたオキシ水酸化マンガン(MnOOH)が、酸素ガスによって再び酸化され、正極の充電状態が維持される(反応式(6)参照)。各貯蔵室88,89の水素ガスおよび酸素ガスが消費された後は、通常の二次電池として作動して放電がなされる。
【0070】
すなわち、本実施形態に係る電池C6は、二次電池として通常の充電により電極に蓄えることのできるエネルギーに加えて、過充電時に供給される電気エネルギーを、各貯蔵室88,89にガスとして蓄え、これを電気エネルギーに再変換して利用することが可能である。
この場合、各貯蔵室88,89およびこれを含む電池C6の耐圧性能と密閉性能を高めることにより、体積あたりのガス貯蔵量を増加させて、電池C6のエネルギー密度を従来の二次電池と比較して大幅に、例えば数10倍程度に向上させることが可能となる。しかも、各貯蔵室88,89には、過充電時に負極94で発生した水素ガスおよび正極96で発生した酸素ガスが直接貯蔵されるので、ガスの昇圧装置や連通路を追加で設ける必要がなく、簡単な構造によって、安価に製造・供給することが可能な電池とすることができる。
【0071】
さらには、上述のように、電池C6の放電時には、二次電池の電極反応を介して電気エネルギーが出力されるので、従来の燃料電池と比較して、負荷に対する追従性とパワーが大幅に向上する。これにより、例えば車両のような、瞬間的に高出力が要求される負荷変動の大きい用途にも、追加の二次電池やキャパシタなどの蓄電装置を伴うことなく、単独で適用することが可能となる。
【0072】
しかも、本実施形態に係る電池C6において、正極96は二酸化マンガンであるので耐久性に優れ、正極活物質として用いることにより、充電速度および寿命特性をともに向上させることができる。
【0073】
正極96の活物質に二酸化マンガンを採用していることが本願発明の特徴とするところである。二酸化マンガンが放電によりオキシ化しても、酸素ガスに接触させれば二酸化マンガンに戻るので、水酸化マンガンまで反応が進むことがなく不可逆な四三酸化マンガンが生じることがない。つまり二酸化マンガンがオキシ化した段階で酸素ガスと接触させて充電することにより、二酸化マンガンを正極として用いることに成功した。
【産業上の利用可能性】
【0074】
本発明に係る積層電池は、電力系統に接続して、負荷追従機能のない自然エネルギー発電設備を有する系統や、ピークカット、停電バックアップ、瞬低防止のために利用が可能である。また、民生用に適用する例として、携帯電話やノートパソコン、冷蔵庫やエアコン等の家電製品にも利用可能である。
【符号の説明】
【0075】
1 負極ケース
2 正極ケース
3 電解液
4 負極
5 セパレータ
6 正極
8 水素ガス貯蔵室
9 酸素ガス貯蔵室
88 水素ガス貯蔵室
89 酸素ガス貯蔵室
90 外装体
91 正極端子
93 電解液
94 負極
95 セパレータ
96 正極
【技術分野】
【0001】
本発明は、充電時に供給される電気エネルギーをガスとして貯蔵し、貯蔵されたガスを電気エネルギーに再変換して利用することができる、燃料電池に関する。
【背景技術】
【0002】
従来、主として携帯機器用の電源として使用する充放電可能な種々の二次電池が提案されてきた。さらには、近年、環境への配慮から、自動車や電車などの車両に充放電可能な二次電池を搭載したものが開発されている。車両に二次電池を搭載した場合には、ブレーキ時に生じる回生電力をこの搭載電池に蓄えておき、車両の動力源として使用することができるので、車両のエネルギー効率を高めることができる。
このように車両に搭載する二次電池としては、エネルギー密度、負荷変動追従性、耐久性、製造コストなどの諸条件から、例えばニッケル水素二次電池が適しているとされる(特許文献1)。ニッケル水素二次電池は、負極に水素吸蔵合金、正極に水酸化ニッケルを活物質としてそれぞれ使用しており、正負極間のプロトンの授受により充放電が行われる。正極に水酸化ニッケルの代わりに水酸化マンガンを用いた技術が開示されている(特許文献2)。
【0003】
また、同様に携帯機器の電源や車両の動力源として、燃料電池を用いることが提案されている。燃料電池は、水素と酸素が反応してH2Oを生成する際に、化学エネルギーを電気エネルギーに変換する発電装置であり、環境への負荷が小さい。また、燃料電池は空気中の酸素を利用できるので、燃料となる水素を供給できれば、どこでも電気を取り出すことができ、二次電池のように電気で充電することを要しないという利点がある。
【0004】
通常の二次電池は電気エネルギーにより充電が行われて、電気を蓄えることを可能としている。しかし、電気の供給がある場所でなければ充電できないので、利便性が十分でない。そこで、ガスによる充電も可能にした二次電池が特許文献3に開示されている。更に、蓄電機能を有した燃料電池が特許文献2に開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−110381号公報
【特許文献2】特開2010−15783号公報
【特許文献3】特開2010−15729号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、ニッケル水素二次電池においては、一般的に、あらかじめ負極の容量を正極の容量よりも大きく設定しておくことで、密閉化を可能にしている。すなわち、満充電の状態からさらに充電が行われる過充電時には、正極において下記(1)の反応により酸素ガスが発生する。
OH- → 1/4O2 + 1/2H2O + e- (1)
【0007】
正極で発生した酸素ガスは、下記(2)の反応により負極の水素吸蔵合金(M)中の水素と反応してH2Oとなるので、電池内部の圧力上昇が抑えられ、電池を密閉構造とする
ことができる。
MH + 1/4O2 → M + 1/2H2O (2)
ただし、Mは水素吸蔵合金を示す。
【0008】
上記の、酸素ガスと水素吸蔵合金中の水素とが接触して水を生成する反応は発熱反応である。すなわち、過充電時に電池に供給された電気エネルギーは、熱エネルギーとして廃棄され、再び電気エネルギーとして取り出すことができない。
【0009】
また、二次電池が蓄えることのできる電気容量は、所定の容積を有する電池のケースに固体として充填される負極および正極の活物質の量によって規制される。活物質の質量に対して貯蔵することができる還元物質や酸化物質の質量は質量割合として少なく、例えば水素吸蔵合金AB5に貯蔵することができる水素は1.2重量%程度である。このため、二次電池のエネルギー密度を大幅に高めることは困難である。
【0010】
一方、燃料電池においては、燃料電池自体では蓄電が不可能なので、電極部分に水素ガスおよび酸素ガスを供給するための装置や部材が必要となる。しかも、燃料電池は、放電時の負荷変動に対する追従性に劣るので、燃料電池単独では、車両のような負荷変動の大きい用途に適用することが困難であり、通常は二次電池やキャパシタなどの蓄電装置と組み合わせて使用される。さらに、燃料電池はガス拡散電極という気体と液体と固体が同時に接触する線を反応の場にしているため、反応領域が狭く、反応速度が遅いという構造上の問題があり、これを解決するために白金のような高価な触媒が必要であるなど、種々の課題を抱えている。
【0011】
特許文献3に開示されている二次電池は、ガスを供給すれば、燃料電池のように放電することができるので、通常の二次電池のように電気容量が活物質の量に制限されることはないが、電極部分に水素ガスと酸素ガスを供給するための装置や部材が必要となる。
【0012】
特許文献2に開示されている「燃料電池蓄電池」は、電極部分に水素ガスと酸素ガスを供給するための余分な装置や部材が不要であるが、正極活物質に水酸化マンガンを使用しているので、充放電を繰り返すうちに、充放電反応に寄与しない四三酸化マンガンが生成され、寿命特性が悪いという課題を有している。
【0013】
すなわち、二酸化マンガンはその放電過程において、二酸化マンガンMnO2→オキシ水酸化マンガンMnOOH→水酸化マンガンMn(OH)2と変化するが、水酸化マンガンまで放電すると充電できない四三酸化マンガンMn3O4が生成されるからである。
【0014】
本発明の目的は、上記の課題を解決するために、過充電時に供給された電気エネルギーを水素と酸素の化学エネルギーとして蓄え、これを電気エネルギーに再変換して利用することのできる、パワー密度、エネルギー密度、および負荷追従性に優れ、かつ、寿命特性の優れた燃料電池を提供することである。
【課題を解決するための手段】
【0015】
本発明に係るリバーシブル燃料電池は、水素吸蔵合金を含む負極と、二酸化マンガンを含む正極と、前記負極と正極との間に介在する中空糸製のセパレータと、前記負極で発生する水素ガスを貯蔵する水素ガス貯蔵室と、前記正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室とを備えている。
なお、本発明において酸素ガス貯蔵室および水素ガス貯蔵室は、別個に、かつ、負極および正極と各貯蔵室との間に昇圧装置や連通路などの追加部材を介在させずに直接に、各電極において発生したガスを貯蔵する。また、リバーシブル燃料電池とは燃料と電気エネルギーを可逆的に変換することができる蓄電が可能な燃料電池のことをいう。
【0016】
この構成によれば、電極内部が満充電の状態からさらに電流によって充電を行った場合に、電解液が電気分解されて、負極から水素ガスが、正極から酸素ガスが発生する。発生した水素ガスおよび酸素ガスは、互いに接触・反応させることなく、水素ガス貯蔵室および酸素ガス貯蔵室に、それぞれ直接かつ独立に貯蔵することができる。したがって、追加のガス供給源や供給通路、昇圧装置などを要することなく、水素ガスおよび酸素ガスを各貯蔵室に貯蔵し、貯蔵された水素ガスおよび酸素ガスを、電池の放電時に電気エネルギーに変換して再利用することができる。電池の放電時には、正負極間において、水素−マンガン電池としての通常の放電反応が起こって電気エネルギーを取り出すことができる。つまり、二次電池の電極反応を介して電気エネルギーが出力されるので、急速放電と優れた放電追従性を得ることができる。
【0017】
放電時には、負極および正極のそれぞれにおいて、放電によって減少した電気量分が、水素ガス貯蔵室および酸素ガス貯蔵室にそれぞれ貯蔵された水素ガスおよび酸素ガスによる充電によって補われる。具体的には、負極においては、放電反応を表す反応式(3)に示すように、充電状態の水素吸蔵合金(MH)からプロトンが放出されるが、反応式(4)に示すように、放出された分のプロトンが、水素ガスによって補われ、負極の充電状態が維持される。
MH → M + H+ + e- (3)
M + 1/2H2 → MH (4)
ただし、式(3)および(4)において、Mは水素吸蔵合金を示す。
【0018】
一方正極においては、放電反応を表す反応式(5)に示すように、充電状態の二酸化マンガン(MnO2)から還元されたオキシ水酸化マンガンが、反応式(6)に示すように酸素ガスによって再び酸化され、正極の充電状態が維持される。
MnO2 + H+ + e- → MnOOH (5)
MnOOH + O2 → MnO2 + H2O (6)
【0019】
各貯蔵室の水素ガスおよび酸素ガスが消費された後は、通常の水素−マンガン電池として作動して放電がなされる。
【0020】
正極の二酸化マンガンは放電によりオキシ水酸化マンガンとなるが、オキシ水酸化マンガンは充電すると、二酸化マンガンに戻り放電が可能となる。一方、オキシ水酸化マンガンは酸素ガスに接触させると水素原子と反応して二酸化マンガンになって放電が可能となる。
【0021】
つまり、オキシ水酸化マンガンは充電すると水素原子を放出し放電が可能となり、負極には水素原子が貯蔵される。満充電された後さらに充電を行うと電解液を電気分解して、負極から水素ガスが発生し、正極から酸素ガスが発生する。発生した酸素ガスを容器に貯蔵しておくと放電した際に二酸化マンガン内に水素原子が生成されても気体の酸素ガスが水素原子と反応して燃料電池のように作動する。もちろん二次電池としても作動するので、高出力が可能となる。
【0022】
すなわち、本発明に係るリバーシブル燃料電池において、外部に取り出すことのできる電気エネルギーは、正負極の各活物質量によって規制される二次電池としての容量に加えて、各貯蔵室にガスのエネルギーとして蓄えることが可能である。この場合、各貯蔵室およびこれを含む電池の耐圧性能および密閉性能を高めることにより、体積あたりのガス貯蔵量を増加させる、つまり電池の体積エネルギー密度を向上させることが可能となる。
本発明に係る電池の上記のような作用及び効果は、負極および正極を、それぞれ、水素ガスおよび酸素ガスによって化学的に充電することにより得られるものである。なお、本明細書において、「負極を充電」「正極を充電」、とは、通常の電気化学反応によって当該電池を充電した場合の負極における還元反応および正極における酸化反応を、正負極それぞれにおいて独立に起こさせることをいう。
【0023】
二酸化マンガンを正極とする水溶液系電池として、亜鉛マンガン一次電池が広く知られている。亜鉛マンガン電池は専ら一次電池として使用され、二次電池として使用されない。これは、マンガン電池の正極がその放電過程において、二酸化マンガンMnO2→オキシ水酸化マンガンMnOOH→水酸化マンガンMn(OH)2と変化するのであるが、水酸化マンガンまで放電すると充電できない四三酸化マンガンMn3O4ができてしまうからである。
このため、二酸化マンガンが二次電池の正極として使用されなかった。そこで発明者らは、二酸化マンガンがオキシ水酸化マンガンまでしか放電しなければ四三酸化マンガンを生ずることがなく再度充電が可能なので劣化しないと考え、そのことを実験により確認した。すなわち、
【0024】
二酸化マンガンが放電によりオキシ化しても、酸素ガスに接触させれば二酸化マンガンに戻るので、水酸化マンガンまで反応が進むことがなく不可逆な四三酸化マンガンが生じることがない。つまり二酸化マンガンがオキシ化した段階で、正極を酸素ガスと接触させて充電することにより、二酸化マンガンを正極として用いることに成功した。
【0025】
一方、水酸化ニッケルや水酸化マンガンを正極材料とする技術が開示されているが(例えば特許文献2)、水酸化ニッケルは二次電池正極としては成立するのであるが酸素と反応してオキシ化しないので、本発明のようなリバーシブル燃料電池の正極にはならない。また、特許文献2において正極材料に用いた水酸化マンガンは燃料電池正極反応の触媒として機能するものであって、放電後の活物質が酸素で元の充電状態に戻るのではなく、放電した活物質はそのままの状態であるところ、本願発明のリバーシブル燃料電池において、二酸化マンガンが活物質として電気で充電もできるし、酸素ガスでも充電できるというものである。活物質は放電した後、酸素と化学的に反応することによって、充電したときと全く同じ物質に戻るので、特許文献2における水酸化マンガンとは、反応が全く異なる。
【0026】
二次電池の電気容量は電極材に含まれる活物質の量で定まることは前述した通りである。このため、二次電池は高エネルギー密度化することができない。一方、上記のように酸素により充電が可能となればその電気容量は燃料電池の例の示す通り大きなものとなる。
【0027】
本発明の特徴とするところは、正極に二酸化マンガンを採用し、負極に水素吸蔵合金を採用して、それぞれの電極を酸素ガスおよび水素ガスで充電することにより電気容量の増大を図り、放電時は二次電池反応により速やかな電力の取り出しを可能にしたところにある。すなわち、水素および酸素の化学エネルギーを電気エネルギーに変換して再利用することを可能とし、エネルギー利用効率およびエネルギー密度ならびにパワーを飛躍的に高めることができる。また電池コストの多くは活物質の材料費であり、少ない活物質量で大きな電気容量が可能となることから電池コストの低減が可能となる。
【0028】
正極および負極を、それぞれ酸素ガスおよび水素ガスに触れさせることにより充電できることを、発明者らは、実験によって確認した。図3、4に、正極および負極それぞれについて半電池を構成して、酸素ガスおよび水素ガスによって充電する実験を行った結果を示す。
【0029】
図3は、水素吸蔵合金を負極とし、銀(Ag)を参照極とし、アルカリ系電解液を用いて半電池を構成して、水素ガスの加圧投入による負極の充電を行ったときの充電量の変化を時間に対してプロットしたものである。図3(a)の左右の縦軸は、それぞれ、充電量を水素吸蔵合金の単位重量に対する吸蔵された水素の物質量(mmol/g)、および、単位重量に対する電気容量(mAh/g)で示しており、横軸は経過時間(分)を示している。
この実験では、負極が完全に放電された状態から充電を開始しており、図3(a)の曲線a、bは、それぞれ、水素ガスを0.5MPaおよび0.3Mpaで加圧投入したときの充電量の変化を表わしている。図3(a)から分かるように、水素ガスを供給して充電を開始してから10分間で、0.5MPaおよび0.3Mpaのいずれの条件においても、各圧力における充電量の理論値に対してほぼ80%まで充電された。
【0030】
図3(b)の縦軸は負極の電位(V vs.Ag/AgCl)を、横軸は放電量(mAh/g)を示す。この実験では、水素ガスで充電された負極はアルカリ溶液中でほぼすべて放電可能であることを示している。
【0031】
図4はオキシ水酸化マンガンを正極とし、銀(Ag)を参照極とし、アルカリ系電解液を用いて半電池を構成して、酸素ガスの加圧投入による充電、および放電を行ったときの正極の電位変化を時間に対してプロットしたものである。図4の縦軸は正極の電位(V
vs.Ag/AgCl)を、横軸は経過時間(分)を示す。
図4(a)の(i)は、正極に酸素ガスが加圧投入された後の参照極に対する電位を示しており、(ii)では酸素ガス供給を停止し、0.2C放電を行った場合のグラフである。正極を酸素ガスに接触させた場合(実線)、60分経過でほぼ満充電の状態を示し、その後に0.2Cで放電をしていることを示している。一方、酸素ガスに接触をさせない場合(点線)、殆ど充電が行なわれていないことを示している。これにより、酸素ガスにより燃料電池カソード反応(酸化還元反応)が起こり、酸素ガス遮断後に二次電池反応による放電が確認できた。
図4(b)は、0.2Cでの放電状態での酸素ガスによる充電の状況を示しており、放電中であっても、酸素ガスによる充電が可能であることを示している。
【0032】
これら図3および図4に示した実験結果により、正極と負極にそれぞれ酸素ガスおよび水素ガスを供給することで、それぞれ独立に充電可能であることが確認された。
【0033】
二酸化マンガンは水酸化マンガンまで放電すると充電できない四三酸化マンガンが生じるので二次電池の正極として使用されてこなかった。そこで、発明者らは、二酸化マンガンが水酸化マンガンまで放電しなければ、四三酸化マンガンを生ずることがなく、劣化しないと考え、そのことを実験により確かめた。
【0034】
放電反応深度による充放電サイクル特性の違いを実験により調べた結果を図5に示す。図5のグラフ(a)は、充放電サイクル実験前の電極のXRD測定結果であり、グラフ(b)は二酸化マンガンとオキシ水酸化マンガンの間で充放電を30回繰り返した場合の測定結果であり、グラフ(c)は二酸化マンガンからオキシ水酸化マンガンを経て水酸化マンガンの間で充放電を30回繰り返した場合の測定結果である。
グラフ(b)のケースで充放電を繰り返した電極の場合、実験前の電極の結晶構造以外には新たなピークの生成はほとんどみられない。しかし、グラフ(c)のケースで充放電を繰り返した電極の場合、二酸化マンガン由来の特徴ピークはほとんど無くなり、四三酸化マンガン由来のピークが表れている。このことから、オキシ水酸化マンガンの段階で放電を停止すれば、四三酸化マンガンを生成することがないことが分かった。
【0035】
以上のように、本発明に係るリバーシブル燃料電池によれば、負極および正極に、水素ガスおよび酸素ガスを直接的に、かつ互いに独立に蓄える貯蔵室を設けることにより、追加のガス供給系統を設けることなく充電時に供給された電気エネルギーをガスとして貯蔵し、電気エネルギーに再変換して利用することが可能となる。これにより、従来の密閉型二次電池においては過充電時に熱として廃棄されていたエネルギーを電気エネルギーとして再利用できるので、エネルギー利用効率が向上するとともに、取り出すべき電気エネルギーをガスの化学エネルギーとして蓄えることができ、エネルギー密度が飛躍的に向上する。
また、二次電池の電極反応を介して電気エネルギーを入出力するので、従来の燃料電池と比較して、充電が可能となり、更には負荷変動に対する追従性が大幅に改善される。しかもこのような電池を、ガス供給のための追加の部材・装置を要しない簡単な構造を採用することによって、安価に製造・供給することが可能となる。
【0036】
正極に二酸化マンガンを使用することにより、例えば、水酸化マンガンに比べて耐久性があり、水酸化ニッケルに比べると安価でエネルギー密度が向上するといえる。電池寿命について、これまで四三酸化マンガンにまで還元されて生成された充電不可能な物質の形成を酸素ガスによって阻止し、サイクル耐久性を確保することができた。
【0037】
化学反応を利用して電力を取り出す場合、取り出すことができるエネルギーをΔHとすればΔGを電気として取り出すことができ、TΔSを熱として取り出すことができる。ΔHは反応生成熱と呼ばれ、燃焼反応などの発熱反応であれば負の値であり、発熱量とも呼ばれている。ΔHはΔG+TΔSである。ΔGは自由エネルギーと呼ばれ仕事として取り出すことができるエネルギーであり、有効なエネルギーとしてエクセルギーと呼ばれている。
TΔSは反応に伴って発生する熱であり、エントロピー変化と温度の積で表されている。そして有効なエネルギーを取り出す能力としてΔG/ΔHをエクセルギー効率と呼んでいる。ニッケル水素電池を充放電すると蓄電効率、すなわち充電電力量に対する放電電力量は90〜99%程度まで上げることができるが、水を電気分解して、水素と酸素にすると常温ではエクセルギー効率ΔG/ΔHが83%であるため蓄電効率は83%を超えることができない。
【0038】
本発明により解決しようとしている課題の一つはエクセルギー率ΔG/ΔHを出来る限り1に近づけると共にΔHを熱にする割合を減らし、可能な限り電気エネルギーに変換する装置を提供することである。発電効率ΔG/ΔHを高くするためには、TΔSを減少させてΔGを増加する。ΔGは温度と圧力により決まる値であり、これを最小にして、ΔG/ΔHの値を上げることができる。
【0039】
燃料電池を使用して水素を電気エネルギーに変換する時には水素の発熱量の17%が熱となって発生する。この熱の発生量を低くするためには高圧水素を燃料電池に送り込み、発電すれば熱の発生を抑えることができ、発電効率を上げることが可能となる。燃料電池を使用して水素を電気エネルギーから製造する時には水素の発熱量の17%の熱が必要となり、その時常圧で水素と酸素を発生させると大気に対して仕事をすることになり損失となる。そこで電気分解を密閉空間で行なわせ、17%のTΔSを小さくすることができる。図6は熱力学計算結果であり、圧力が大きいほどTΔSが小さくなることを示している。
【0040】
本発明に係るリバーシブル燃料電池は、前記負極、前記正極、前記セパレータ、前記水素ガス貯蔵室、および前記酸素ガス貯蔵室を収容する筒状の外装体を有していることが好ましい。上述のように、本発明に係るリバーシブル燃料電池においては、単位体積あたりのガス貯蔵可能量が増せば、電気として取り出すことのできるエネルギー量が増す。換言すれば、電池の外装体の耐圧性を向上させることにより、電池のエネルギー密度を高めることが可能となる。
【0041】
本発明に係るリバーシブル燃料電池は、前記水素ガス貯蔵室が、前記水素吸蔵合金の隙間に構成されていることが好ましい。
水素吸蔵合金の粒子径の平均値は20μmであるとすれば、空隙率はおよそ35%となる。空隙率の大きさは、水素吸蔵合金の充填の仕方によって変わり、35%より大きくすることが可能である。このような空隙は水素貯蔵室として機能する。
【0042】
本発明に係るリバーシブル燃料電池は、前記セパレータが有底の筒状であって、前記外装体の内部軸方向に配置されていて、前記正極が有底の筒状であって、前記セパレータの内方に形成されていて、前記酸素ガス貯蔵室が前記正極の内方に形成されていて、前記外装体の内部であって前記セパレータの外方に粒子状の水素吸蔵合金が充填されていることが好ましい。
【0043】
本発明に係るリバーシブル燃料電池は、前記正極中に含まれる四三酸化マンガン(Mn3O4)の量が重量比で5%以下であることが望ましい。
【0044】
リバーシブル燃料電池において、前記正極中に含まれる四三酸化マンガンの量が重量比で5%以下である。この構成によれば、正極の二酸化マンガンが水酸化マンガンまで放電が進むと充電できない四三酸化マンガンMn3O4が生じてしまうことは前述したとおりであるところ、不可逆な四三酸化マンガンMn3O4が生じなければ、正極は劣化することなく、酸素により再度充電ができる。四三酸化マンガンMn3O4が5%以下であれば劣化の程度は小さい。したがって、好ましくは四三酸化マンガンMn3O4の量が重量比で2%以下であって、より好ましくは0.5%未満であることが望ましい。
【0045】
本発明に係るリバーシブル燃料電池は、前記負極および前記正極の少なくともいずれか一方が、前記負極の前記セパレータに接する面に親水性を有する材料を配置して、前記水素ガス貯蔵室に接する面に疎水性を有する材料を配置した負極、および/もしくは、前記正極の前記セパレータに接する面に親水性を有する材料を配置して、前記酸素ガス貯蔵室に接する面に疎水性を有する材料を配置した正極であることが望ましい。
この構成によれば、負極のセパレータに接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。また、水素ガスに接触している側は疎水性にしてあり負極が濡れずに水素ガスと良好な接触を保つようにしてある。正極のセパレータに接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保してある。また、酸素ガスに接触している側は疎水性にしてあり正極が濡れずに酸素ガスと良好な接触を保つようにしてある。なおセパレータは、常に電解液を含んでいて、気体が通過しないようにしてあるので、水素ガス貯蔵室と酸素ガス貯蔵室とは独立して、水素ガスと酸素ガスとが交じり合うことなく独立に貯蔵できるようになっている。
【0046】
固体(電極)と液体(電解質)の反応面をもつ二次電池特性と、固体(電極)と気体と液体の反応面をもつ燃料電池特性を1つの電極中で実現することができれば、更に高出力化と大エネルギー容量化が可能となる。そこで、電極の電解液に接触する界面を親水性とし、気体と接触する界面を疎水性とした。電極の一方の面を親水性とし、他方の面を疎水性とする代わりに、電極全体が親水性と疎水性を併せもつ材料で構成してもよい。
【0047】
本発明に係るリバーシブル燃料電池は、前記電解液が前記酸素ガス貯蔵室に保持されていることが望ましい。その理由は、放電した時に発生する水は正極表面で生成され、充電時に水の電気分解も正極界面で行われるからである。
【発明の効果】
【0048】
以上のように、本発明に係るリバーシブル燃料電池によれば、追加のガス供給装置を要することなく、エネルギー利用効率およびエネルギー密度を飛躍的に高めることができ、負荷変動に対する追従性が大幅に改善することができ、かつ、寿命特性を改善することができる。
【図面の簡単な説明】
【0049】
【図1】本発明の第1実施形態に係る燃料電池の構造を模式的に示す断面図である。
【図2】中空糸リバーシブル燃料電池の構造を示す断面図である。
【図3】水素ガスで水素吸蔵合金を充電したときの実験結果を示すグラフである。
【図4】酸素ガスで二酸化マンガン電極を充電したときの実験結果を示すグラフである。
【図5】放電深度の相違による二酸化マンガン正極の組成の変化を調べたXRD測定結果を示すグラフである。
【図6】自由エネルギーの圧力による影響を熱力学計算により求めたグラフである。
【発明を実施するための形態】
【0050】
以下、本発明に係る実施形態を図面に従って説明するが、本発明はこの実施形態に限定されるものではない。
【0051】
図1は、本発明の基本構成を有する、第1実施形態に係る電池C1の構造を模式的に示す断面図である。この電池C1は、水素および酸素の化学エネルギーを電気エネルギーに変換して利用する燃料電池に二次電池の反応機構を取り込んだリバーシブル燃料電池として構成したものであり、セパレータ5を介して対向する負極4および正極6、水素ガス貯蔵室8を形成する負極ケース1、ならびに酸素ガス貯蔵室9を形成する正極ケース2を主要な構成要素として備えている。
【0052】
負極4は、ニッケル水素二次電池で一般的に用いられているランタンニッケルのような水素吸蔵合金を主要な活物質として含んでいる。正極6の活物質には、二酸化マンガンを採用している。負極4と正極6との間にセパレータ5とともに介在させる電解液3としては、二次電池で一般的に用いられているアルカリ系水溶液、例えば、KOH水溶液、NaOH水溶液、LiOH水溶液などを用いることができる。
【0053】
負極4としては、例えば、負極活物質、導電性フィラーおよび樹脂に溶剤を加えてペースト状にしたものを、基板上に塗布して板状に成形し硬化させたものを使用することができる。同様に、正極6としては、正極活物質、導電性フィラーおよび樹脂に溶剤を加えてペースト状にしたものを、基板上に塗布して板状に成形し硬化させたものを使用することができる。
【0054】
導電性フィラーとしては、炭素繊維、炭素繊維にニッケルメッキを施したもの、炭素粒子、炭素粒子にニッケルメッキを施したもの、有機繊維にニッケルメッキを施したもの、繊維状ニッケル、ニッケル粒子、ニッケル箔のいずれかを単独で、または組み合わせて用いることができる。樹脂はバインダーとして用いるものであって、軟化温度120℃までの熱可塑性樹脂、硬化温度が常温から120℃までの樹脂、120℃以下の蒸発温度を有し溶剤に溶解する樹脂、水に可溶な溶剤に溶解する樹脂、アルコールに可溶な溶剤に溶解する樹脂などを用いることができる。基板としては、ニッケル板のような電気伝導性のある金属板を用いることができる。また、基板の代わりに発泡ニッケルシートを使用してもよい。
【0055】
負極4の水素ガス貯蔵室8に接触している側は疎水性材料を多く使用して水素吸蔵合金が濡れずに水素ガスと接触するようにしてある。セパレータ5に接触する側は親水性にしてあり、水素ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。正極6の酸素ガス貯蔵室9に接触している側は疎水性材料を多く使用して二酸化マンガンが濡れずに酸素ガスと接触するようにしてある。セパレータ5に接触する側は親水性にしてあり、ガスの通過を阻止して電解液に常に濡れている状態を保ってイオン導電性を確保している。疎水性を有する炭素やテフロン(登録商標)等を各電極4、6のガス貯蔵室8,9に面する側に塗布もしくは噴霧してもよく、また、親水性を有する改質ナイロンを各電極4,6のセパレータ5に接触する面に塗布もしくは噴霧してもよい。更には、親水性と疎水性の両方の性質をもった酢酸ビニルを造粒してバインダーとして用いてもよい。
【0056】
セパレータ5は、プロトン(H+)を透過させるが水素ガスおよび酸素ガスを透過させにくい孔径を有する膜を使用している。具体的には微多孔膜を使用した。セパレータ5を形成する素材としては、例えば、ポリエチレン繊維やポリプロピレン繊維などのポリオレフィン系繊維、ポリフェニレンサルファイド繊維、ポリフェニレンサルファイド繊維、ポリフルオロエチレン系繊維、ポリアミド系繊維などを使用することができる。セパレータ5には電解液3が保持されている。さらに、本実施形態では、セパレータ5の両表面を水(電解液3)で濡らして水封セパレータとして形成することにより、ガス不透過性を高め、水素ガスおよび酸素ガスがセパレータ5を通過して互いに接触し反応することを一層確実に防止している。
【0057】
負極4の、正極6に対向する面と反対側の面は、箱形の負極ケース1によって気密に覆われており、負極ケース1の内方空間は、負極4で発生する水素ガスを、負極4との間に昇圧装置や連通路などの追加部材を介在させずに貯蔵する水素ガス貯蔵室8として機能する。同様に、正極6の、負極4に対向する面と反対側の面は、箱形の正極ケース2によって覆われており、正極ケース2の内方空間は、正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室9として機能する。水素ガス貯蔵室8と酸素ガス貯蔵室9とは、独立に、つまり、水素ガス貯蔵室8と酸素ガス貯蔵室9とが互いに連通しないように構成されている。酸素ガス貯蔵室9には、正負極間に介在させた電解液3と同種類の電解液が、酸素ガス貯蔵室9の容積の約1/3程度充填されている。
【0058】
酸素ガス貯蔵室9に充填される電解液3の量が少なければ、電気分解されるべき水の量が少なくなり、過充電時に発生する水素ガスおよび酸素ガスの量が少なくなる。一方、電解液の量が多ければ、ガスの貯蔵容積が減少する。このような観点から、酸素ガス貯蔵室9に充填される電解液3の量は、酸素ガス貯蔵室9の容積の20〜50%の範囲にあることが好ましく、25〜40%の範囲にあることがより好ましい。
【0059】
上記のように構成された電池C1の動作について説明する。電池C1が満充電状態に達した後、さらに電流を供給し続けると、負極4からは水素ガスが、正極6からは酸素ガスがそれぞれ発生する。これら水素ガスおよび酸素ガスは、水素ガス貯蔵室8および酸素ガス貯蔵室9にそれぞれ貯蔵される。
【0060】
電池C1が放電すると、放電によって減少した電気量分が、水素ガス貯蔵室8および酸素ガス貯蔵室9にそれぞれ貯蔵された水素ガスおよび酸素ガスによって充電される。
【0061】
次に、発明の第2実施形態に係る電池C6について、図2に示す断面図を用いて説明する。この電池C6は、図1とともに説明した第1実施形態の電池C1と同様の基本構成を有するが、図2に示すように筒状の外装体90を採用して耐圧性能と取扱性能を向上させ、これによりエネルギー密度の増大を図るとともに取り扱いを容易なものとした。なお、本実施形態に係る電池C6の電池としての基本要素である、負極、正極、セパレータおよび電解液については、以下で特に説明する点を除いて、上記の第1実施形態と同様の物質および構造を採用することができる。
【0062】
筒状に形成されている外装体90の内部空間には、電解液93と負極94を形成する粒子状の水素吸蔵合金が充填されている。外装体90のほぼ中央軸方向に中空糸製のセパレータ95の内側に配置された筒状の正極96が収納されている。そして、正極96の内方に形成された空間に酸素ガス貯蔵室89が形成されている。
【0063】
外装体90の内部の空間であって、セパレータ95の外方空間には、平均粒子径が20μmの水素吸蔵合金が充填されている。このとき、空隙率はおよそ35%となる。空隙率の大きさは、水素吸蔵合金の充填の仕方によって変わり、35%より大きくすることが可能である。平均粒子径が5〜50μmであれば、空隙率はおよそ30〜60%となる。このような空隙は水素ガス貯蔵室88を構成する。ここに、平均粒子径は、JIS
Z 8910の光散乱法による球相当径を用いて表した値である。
【0064】
これにより、この電池C6においては、電気分解により発生した水素ガスは水素ガス貯蔵室88に蓄えられ、酸素ガスは酸素ガス貯蔵室89に蓄えられる。また、水素ガス貯蔵室88に蓄えられた水素により負極94が充電可能であり、酸素ガス貯蔵室89に蓄えられた酸素ガスにより正極96が充電可能である。
【0065】
外装体90は、導電性素材、具体的にはニッケルメッキを施した鉄で形成されている。この外装体90の内面は負極を形成する粒子状の水素吸蔵合金が直接および電解液93を介して接触しており、外装体90が電池C6の負極端子として機能する。一方、外装体90の上面には絶縁部材97が配置されており、負極端子として機能する外装体90と正極96とを絶縁する。そして、正極96の上端面96aに、円板状の正極端子91が接合されている。
【0066】
粒状の水素吸蔵合金としては、例えば、活物質である水素吸蔵合金の粉末に、導電剤としてのカーボンおよびバインダーとしてのエチレン酢酸ビニル共重合体(EVA)を加えて混合したものを、造粒して固めたものを使用することができる。一方、正極96としては、例えば、活物質として二酸化マンガンの粉末を、負極94の場合と同様に、導電剤としてのカーボンおよびバインダーとしてのエチレン酢酸ビニル共重合体(EVA)を加えて混合したものを、中空糸に塗布して固めたものを使用することができる。このような構造により両極共大きな固気,固液反応界面となって内部抵抗が下がり、高速充放電が可能となる。
【0067】
以上のとおり、図面を参照しながら本発明の好適な実施形態を説明したが、本発明の趣旨を逸脱しない範囲内で、種々の追加、変更または削除が可能である。したがって、そのようなものも本発明の範囲内に含まれる。
【0068】
上記のように構成された電池C6は、以下のように動作する。電池C1は、満充電の状態までは、二次電池として、通常どおり電流による充電を行うことができる。
電池C6が満充電状態に達した後、さらに電流を供給し続けると、負極94からは水素ガスが、正極96からは酸素ガスがそれぞれ発生するが、これら水素ガスおよび酸素ガスは、互いに接触することなく、水素ガス貯蔵室88および酸素ガス貯蔵室89にそれぞれ貯蔵される。また、ガス貯蔵室88,89に蓄えられた水素ガスもしくは酸素ガスにより、負極94および正極96が充電される。
【0069】
電池C6の放電が開始されると、負極94および正極96間では、二次電池としての通常の放電反応が起こって負荷に電流が流れる。このとき、負極94および正極96のそれぞれにおいて、放電によって減少した電気量分が、水素ガス貯蔵室88および酸素ガス貯蔵室89にそれぞれ貯蔵された水素ガスおよび酸素ガスによる充電によって補われる。すなわち、負極94においては、充電状態の水素吸蔵合金(MH)から放出された分のプロトンが、水素ガスによって補われ、負極の充電状態が維持される(反応式(4)参照)。一方、正極96においては、充電状態の二酸化マンガン(MnO2)から放電(還元)されたオキシ水酸化マンガン(MnOOH)が、酸素ガスによって再び酸化され、正極の充電状態が維持される(反応式(6)参照)。各貯蔵室88,89の水素ガスおよび酸素ガスが消費された後は、通常の二次電池として作動して放電がなされる。
【0070】
すなわち、本実施形態に係る電池C6は、二次電池として通常の充電により電極に蓄えることのできるエネルギーに加えて、過充電時に供給される電気エネルギーを、各貯蔵室88,89にガスとして蓄え、これを電気エネルギーに再変換して利用することが可能である。
この場合、各貯蔵室88,89およびこれを含む電池C6の耐圧性能と密閉性能を高めることにより、体積あたりのガス貯蔵量を増加させて、電池C6のエネルギー密度を従来の二次電池と比較して大幅に、例えば数10倍程度に向上させることが可能となる。しかも、各貯蔵室88,89には、過充電時に負極94で発生した水素ガスおよび正極96で発生した酸素ガスが直接貯蔵されるので、ガスの昇圧装置や連通路を追加で設ける必要がなく、簡単な構造によって、安価に製造・供給することが可能な電池とすることができる。
【0071】
さらには、上述のように、電池C6の放電時には、二次電池の電極反応を介して電気エネルギーが出力されるので、従来の燃料電池と比較して、負荷に対する追従性とパワーが大幅に向上する。これにより、例えば車両のような、瞬間的に高出力が要求される負荷変動の大きい用途にも、追加の二次電池やキャパシタなどの蓄電装置を伴うことなく、単独で適用することが可能となる。
【0072】
しかも、本実施形態に係る電池C6において、正極96は二酸化マンガンであるので耐久性に優れ、正極活物質として用いることにより、充電速度および寿命特性をともに向上させることができる。
【0073】
正極96の活物質に二酸化マンガンを採用していることが本願発明の特徴とするところである。二酸化マンガンが放電によりオキシ化しても、酸素ガスに接触させれば二酸化マンガンに戻るので、水酸化マンガンまで反応が進むことがなく不可逆な四三酸化マンガンが生じることがない。つまり二酸化マンガンがオキシ化した段階で酸素ガスと接触させて充電することにより、二酸化マンガンを正極として用いることに成功した。
【産業上の利用可能性】
【0074】
本発明に係る積層電池は、電力系統に接続して、負荷追従機能のない自然エネルギー発電設備を有する系統や、ピークカット、停電バックアップ、瞬低防止のために利用が可能である。また、民生用に適用する例として、携帯電話やノートパソコン、冷蔵庫やエアコン等の家電製品にも利用可能である。
【符号の説明】
【0075】
1 負極ケース
2 正極ケース
3 電解液
4 負極
5 セパレータ
6 正極
8 水素ガス貯蔵室
9 酸素ガス貯蔵室
88 水素ガス貯蔵室
89 酸素ガス貯蔵室
90 外装体
91 正極端子
93 電解液
94 負極
95 セパレータ
96 正極
【特許請求の範囲】
【請求項1】
水素吸蔵合金を含む負極と、
二酸化マンガンを含む正極と、
前記負極と正極との間に介在する中空糸製のセパレータと、
前記負極で発生する水素ガスを貯蔵する水素ガス貯蔵室と、
前記正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室と、を備えたリバーシブル燃料電池。
【請求項2】
請求項1において、前記負極、前記正極、前記セパレータ、前記水素ガス貯蔵室、および前記酸素ガス貯蔵室を収容する筒状の外装体を有するリバーシブル燃料電池。
【請求項3】
前記水素ガス貯蔵室が、前記水素吸蔵合金の隙間に構成されている請求項1または2のいずれか一項に記載のリバーシブル燃料電池。
【請求項4】
前記セパレータが有底の筒状であって、前記外装体の内部軸方向に配置されていて、
前記正極が有底の筒状であって、前記セパレータの内方に形成されていて、
前記酸素ガス貯蔵室が前記正極の内方に形成されていて、
前記外装体の内部であって前記セパレータの外方に粒子状の水素吸蔵合金が充填されている請求項1〜3のいずれか一項に記載のリバーシブル燃料電池。
【請求項5】
前記正極中に含まれる四三酸化マンガン(Mn3O4)の量が重量比で5%以下である請求項1〜4のいずれか一項に記載のリバーシブル燃料電池。
【請求項6】
前記負極および前記正極の少なくともいずれか一方が、
前記負極の前記セパレータに接する面に親水性を有する材料を配置して、前記水素ガス貯蔵室に接する面に疎水性を有する材料を配置した負極、
および/もしくは、
前記正極の前記セパレータに接する面に親水性を有する材料を配置して、前記酸素ガス貯蔵室に接する面に疎水性を有する材料を配置した正極、
である請求項1〜5のいずれか一項に記載のリバーシブル燃料電池。
【請求項7】
前記電解液が前記酸素ガス貯蔵室に保持されている請求項1〜6のいずれか一項に記載のリバーシブル燃料電池。
【請求項1】
水素吸蔵合金を含む負極と、
二酸化マンガンを含む正極と、
前記負極と正極との間に介在する中空糸製のセパレータと、
前記負極で発生する水素ガスを貯蔵する水素ガス貯蔵室と、
前記正極で発生する酸素ガスを貯蔵する酸素ガス貯蔵室と、を備えたリバーシブル燃料電池。
【請求項2】
請求項1において、前記負極、前記正極、前記セパレータ、前記水素ガス貯蔵室、および前記酸素ガス貯蔵室を収容する筒状の外装体を有するリバーシブル燃料電池。
【請求項3】
前記水素ガス貯蔵室が、前記水素吸蔵合金の隙間に構成されている請求項1または2のいずれか一項に記載のリバーシブル燃料電池。
【請求項4】
前記セパレータが有底の筒状であって、前記外装体の内部軸方向に配置されていて、
前記正極が有底の筒状であって、前記セパレータの内方に形成されていて、
前記酸素ガス貯蔵室が前記正極の内方に形成されていて、
前記外装体の内部であって前記セパレータの外方に粒子状の水素吸蔵合金が充填されている請求項1〜3のいずれか一項に記載のリバーシブル燃料電池。
【請求項5】
前記正極中に含まれる四三酸化マンガン(Mn3O4)の量が重量比で5%以下である請求項1〜4のいずれか一項に記載のリバーシブル燃料電池。
【請求項6】
前記負極および前記正極の少なくともいずれか一方が、
前記負極の前記セパレータに接する面に親水性を有する材料を配置して、前記水素ガス貯蔵室に接する面に疎水性を有する材料を配置した負極、
および/もしくは、
前記正極の前記セパレータに接する面に親水性を有する材料を配置して、前記酸素ガス貯蔵室に接する面に疎水性を有する材料を配置した正極、
である請求項1〜5のいずれか一項に記載のリバーシブル燃料電池。
【請求項7】
前記電解液が前記酸素ガス貯蔵室に保持されている請求項1〜6のいずれか一項に記載のリバーシブル燃料電池。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−20955(P2013−20955A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−132471(P2012−132471)
【出願日】平成24年6月12日(2012.6.12)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(511146037)エクセルギー工学研究所株式会社 (2)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成24年6月12日(2012.6.12)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(511146037)エクセルギー工学研究所株式会社 (2)
【Fターム(参考)】
[ Back to top ]

