リポソーム、リポソームの製造方法、及び医薬組成物
【課題】病巣部位の造影能が高く、ガス乃至液滴が効率的に封入されており加熱凝固療法の治療効果に優れるリポソームを提供する。
【解決手段】本発明に係るリポソームは、パーフルオロ炭化水素を内包する生体親和性のミセルを内包する。ミセル内部のパーフルオロ炭化水素は、例えばパーフルオロノルマルペンタンである。リポソーム表面にはトランスフェリンが修飾されている。リポソーム内部には、音響化学活性物質としてドキソルビシンが含有されている。
【解決手段】本発明に係るリポソームは、パーフルオロ炭化水素を内包する生体親和性のミセルを内包する。ミセル内部のパーフルオロ炭化水素は、例えばパーフルオロノルマルペンタンである。リポソーム表面にはトランスフェリンが修飾されている。リポソーム内部には、音響化学活性物質としてドキソルビシンが含有されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、超音波加熱凝固治療及び病巣部造影に使用されるリポソーム、そのリポソームの製造方法、及びそのリポソームを含有する医薬組成物に関する。
【背景技術】
【0002】
超音波診断装置は、産婦人科、循環器科、泌尿器科等で使用されており、超音波イメージング剤として、マイクロバブルを投与した後に超音波照射により影像して診断する方法が開発されている(特許文献1〜5参照)。
【0003】
しかしながら、従来のマイクロバブルは、アルブミンで形成された巨大粒子中に気体を含有させるものであることから、粒子径が2〜6μmと大きく、深部組織への移行性は低かった。そのため、深部組織での造影能は不十分であるという問題点がある。
【0004】
一方、加熱凝固療法は、癌治療等の分野にて近年脚光を浴びている治療法であり、ミリメートル単位の微小な領域に強力超音波を集め、瞬時に組織変性を来す温度に上昇させる治療法である(非特許文献1)。
【0005】
特許文献6には、この加熱凝固療法に使用されるフッ化ガスが封入されているガス封入リポソームが記載されている。
【0006】
特許文献6では、リポソームをバイアルに詰めて、ガス加圧条件下でバス型超音波洗浄機を用いて超音波照射を行い、リポソームにフッ化ガスを封入する。
【0007】
このガス封入リポソームを被験者に投与後、病巣部位に低周波超音波を照射する。これにより、その病巣部位で内封されたガスの微少気泡によるキャビテーションが生じ、病巣部位が高温となり死滅する。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第4572205号
【特許文献2】米国特許第4718433号
【特許文献3】米国特許第4774958号
【特許文献4】米国特許第4844852号
【特許文献5】米国特許第4957656号
【特許文献6】特開2005−154282号公報(第3頁、第5頁)
【非特許文献】
【0009】
【非特許文献1】P.P.Lele著「Ultrasound; medical applications,biological effects and hazard potential」Plenum Press New York 1987年
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかし、上述のガス封入リポソームでは、リポソーム内部へのフッ化ガスの封入効率が不十分であり、またパーフルオロノルマルペンタンのような常温で液体のものは、リポソーム内部への封入が困難である問題点がある。
【0011】
本発明はかかる問題点に鑑みてなされたものであって、病巣部位の造影能が高く、ガス乃至液滴が効率的に封入されており加熱凝固療法の治療効果が高いリポソーム、及びそのリポソームを効率的に製造するリポソームの製造方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明の第1の観点に係るリポソームの製造方法は、生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、前記パーフルオロ炭化水素を内包する生体親和性のミセルであるパーフルオロ炭化水素内包ミセルを形成するミセル化工程と、前記パーフルオロ炭化水素内包ミセルを内包するリポソームを形成するリポソーム形成工程とを有することを特徴とする。
【0013】
また、前記リポソーム形成工程は、脂質の薄膜をナノフィルターの一方の面に貼り付け、分散液に分散させた前記パーフルオロ炭化水素内包ミセルを前記脂質の薄膜及び前記ナノフィルターを通過させることで、前記脂質をリポソーム膜とするリポソームを形成することが好ましい。
【0014】
また、前記リポソームの外表面に、標的細胞、標的組織又は標的病巣に対するリガンドを結合させてリガンド修飾リポソームを得るリガンド結合工程を有することが好ましい。
【0015】
また、前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることが可能である。
【0016】
また、前記リガンド修飾リポソームに薬物及び遺伝子の少なくとも何れか一つを封入する封入工程を有することが好ましい。
【0017】
また、前記パーフルオロ炭化水素は、パーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロブタン、パーフロオロペンタン、パーフルオロヘキサン、パーフルオロヘプタン、及びパーフルオロオクタンの少なくとも何れか一つを含有することが好ましい。
【0018】
また、前記リポソーム形成工程は、前記脂質の薄膜及び前記ナノフィルターを通過することにより形成されたリポソームを、超高圧乳化分散機にて粒子径を減少させることが好ましい。
【0019】
本発明の第2の観点に係るリポソームは、パーフルオロ炭化水素を内包する生体親和性のミセルを内包することを特徴とする。
【0020】
また、リポソーム表面に、標的細胞、標的組織又は標的病巣に対するリガンドを有することが好ましい。
【0021】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることが可能である。
【0022】
本発明のリポソームは、更に薬物及び遺伝子の少なくとも何れか一つを内包することが好ましい。
【0023】
本発明の第3の観点に係る医薬組成物は、請求項8乃至11の何れか1項に記載のリポソーム及び薬学的に許容される担体を含む腫瘍を治療するための医薬組成物である。
【発明の効果】
【0024】
本発明に係るリポソームは、病巣部位の造影能が高く、ガス乃至液滴が効率的に封入されているので、加熱凝固療法の治療効果が高い。また、本発明に係るリポソームの製造方法は、本発明に係るリポソームを効率的に製造できる。
【図面の簡単な説明】
【0025】
【図1】本実施形態に係るリポソームを説明する説明図である。
【図2】ガラスフィルター−水和(Hydration)法に使用するガラスフィルター装置を説明する説明図である。
【図3】パーフルオロ炭化水素内包ミセルの直径を示す図である。
【図4】ガラスフィルター−水和(Hydration)法により形成したリポソームの直径を示す図である。
【図5】ナノマイザーによりサイズダウンしたリポソームの直径を示す図である。
【図6】本実施形態に係るリポソームの電子顕微鏡写真図であり、そのうち(a)はパーフルオロ炭化水素内包ミセルが内包されている状態を示すものであり、(b)は近接している2個のリポソームを示すものである。
【図7】本実施例に係るリポソームのマウス結腸癌Colon26細胞に対する結合性を示す図であり、そのうち(a)は実施例1のリポソームの結合性とBare-Liposomeの結合性とを比較するものであり、(b)は実施例1のリポソームの結合性とBSA-Liposomeの結合性とを比較するものである。
【図8】超音波照射によるパーフルオロ炭化水素内包ミセル内のパーフルオロノルマルペンタンのガス化を示す図であり、そのうち(a)は超音波照射前であり、(b)は超音波照射後である。
【図9】超音波照射による造影能を示す図であり、そのうち(a)は本実施例のリポソームの超音波照射前であり、(b)は本実施例のリポソームの超音波照射後であり、(c)はコントロールの超音波照射前であり、(d)はコントロールの超音波照射後である。
【図10】超音波照射による発生するキャビテーションによる発熱の測定結果を示す図である。
【図11】本実施例のリポソームをファントムゲル中に含有させ、超音波照射することによる加熱凝固作用を示す図である。
【図12】超音波照射による一重項酸素の生成を示す図である。
【図13】担癌マウスに本実施例のリポソームを注入し、超音波照射した後の抗腫瘍効果を示す図である。
【図14】超音波照射による加熱凝固治療の結果を示す図であり、そのうち(a)は本実施例のリポソームを担癌マウスに注入し超音波照射した直後の照射部位であり、(b)はその担癌マウスから摘出した肝臓であり、(c)超音波照射のみの担癌マウスの肝臓である。
【発明を実施するための形態】
【0026】
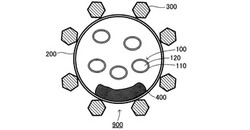
以下、添付の図面を参照して本発明の実施形態について具体的に説明する。本実施形態に係るリポソーム900は、図1に示すように、パーフルオロ炭化水素内包ミセル100を内包する。リポソーム900の脂質組成、帯電状態、密度、重量、粒子径等は、加熱凝固治療の対象となる病巣部の性質等に応じて適宜設計することができる。
【0027】
パーフルオロ炭化水素内包ミセル100の外殻110は、生体親和性且つ両親媒性のミセル外殻形成物質で形成される。生体親和性且つ両親媒性のミセル外殻形成物質は、特に限定されるものではないが、例えば、ブロックコポリマーや両親媒性のリン脂質等である。
【0028】
ブロックコポリマーは、親水性セグメント(以下、Xセグメントとする。)及び疎水性セグメント(以下、Yセグメントとする。)からなる、XY型又はXYX型のブロックコポリマーである。
【0029】
親水性セグメントは、特に限定されるものでないが、例えばポリエチレングリコール、ポリリン酸、ポリオキシエチレン、ポリサッカライド、ポリアクリルアミド、ポリアクリル酸、ポリメタクリルアミド、ポリメタクリル酸、ポリビニルピロリドン、ポリビニルアルコール、ポリメタクリル酸エステル、ポリアクリル酸エステル、ポリアミノ酸あるいはこれらの誘導体由来のセグメントである。好ましいものとしてはポリエチレングリコールである。
【0030】
疎水性セグメントは、特に限定されるものではないが、例えばポリ乳酸、ポリ(アスパラギン酸)、ポリ(グルタミン酸)、ポリアスパラギン酸エステル、ポリグルタミン酸エステル、またこれらの部分加水分解物、ポリリシン、ポリアクリル酸、ポリメタクリル酸、ポリリンゴ酸、ポリアルキレンオキシドあるいはこれらの誘導体由来のセグメントである。好ましいものとしてはポリ乳酸である。
【0031】
親水性セグメントと疎水性セグメントは、ポリマーミセルを形成しうるものであれば、それぞれのセグメントの大きさに制限がないが、例えば親水性セグメントの繰り返し単位は10〜500、好ましくは15〜100にあり、他方、疎水性セグメントの繰り返し単位は5〜100、好ましくは10〜30である。
【0032】
パーフルオロ炭化水素内包ミセル100の内部120には、パーフルオロ炭化水素が内封される。
【0033】
パーフルオロ炭化水素は、特に限定されるものではないが、例えばパーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロイソブタン、パーフロオロノルマルブタン、パーフロオロイソペンタン、パーフロオロノルマルペンタン、パーフルオロイソヘキサン、パーフルオロノルマルヘキサン、パーフルオロイソヘプタン、パーフルオロノルマルヘプタン、パーフルオロイソオクタン、及びパーフルオロノルマルオクタンである。好ましいものはパーフルオロノルマルペンタン(b.p.29℃)である。パーフルオロノルマルペンタンを使用した場合、常温では、パーフルオロ炭化水素内包ミセル100の内部にパーフルオロノルマルペンタンの液滴を内包することになる。
【0034】
パーフルオロ炭化水素内包ミセル100の直径は、特に限定されるものではないが、例えば50nm〜100nmである。本実施形態では70nmである。パーフルオロ炭化水素内包ミセル100の直径は、例えば動的光散乱法により測定される。
【0035】
リポソーム900の膜200は、脂質類を含有する膜構成成分からなる。脂質類は、例えばリン脂質、グリセロ糖脂質及びスフィンゴ糖脂質の他、これらの脂質に、1級アミノ基、2級アミノ基、3級アミノ基又は第4級アンモニウム基が導入されたカチオン性脂質である。
【0036】
リン脂質は、特に限定されるものではないが、例えば、ホスファチジルコリン(大豆ホスファチジルコリン、卵黄ホスファチジルコリン(EPC)、1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)、ジステアロイルホスファチジルコリン(DSPC)、ジパルミトイルホスファチジルコリン等)、ホスファチジルエタノールアミン(ジステアロイルホスファチジルエタノールアミン(DSPE)等)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸(DSPE−PEG)、ホスファチジルセリン(PS)、ホスファチジン酸(PA)、ホスファチジルグリセロール(PG)、ホスファチジルイノシトール(PI)、ジミリストイルホスファチジルグリセロール(DMPG)、ジミリストイルホスファチジルコリン(DMPC)、リゾホスファチジルコリン、スフィンゴミエリン、卵黄レシチン、大豆レシチン、水素添加リン脂質等の天然又は合成のリン脂質等が挙げられる。
【0037】
グリセロ糖脂質は、特に限定されるものではないが、例えば、スルホキシリボシルグリセリド、ジグリコシルジグリセリド、ジガラクトシルジグリセリド、ガラクトシルジグリセリド、グリコシルジグリセリド等が挙げられる。
【0038】
スフィンゴ糖脂質は、特に限定されるものではないが、例えば、ガラクトシルセレブロシド、ラクトシルセレブロシド、ガングリオシド等が挙げられる。
【0039】
カチオン性脂質は、特に限定されるものではないが、例えば、上記リン脂質、グリセロ糖脂質又はスフィンゴ糖脂質に、アミノ基、アルキルアミノ基、ジアルキルアミノ基、トリアルキルアンモニウム基、モノアシルオキシアルキル−ジアルキルアンモニウム基、ジアシルオキシアルキル−モノアルキルアンモニウム基等の第4級アンモニウム基が導入された脂質が挙げられる。また、ポリアルキレングリコール修飾脂質としては、上記リン脂質、グリセロ糖脂質、スフィンゴ糖脂質に、ポリエチレングリコール、ポリプロピレングリコール等が修飾した脂質、例えばジ−C12-24アシル−グリセロール−ホスファチジルエタノールアミン−N−PEG等が挙げられる。
【0040】
不活性な親水性ポリマーであるポリアルキレンオキシド鎖(ポリオキシアルキレン鎖)又はPEG鎖がリポソーム900表面に修飾されることにより、細胞内皮系組織の貪食細胞から捕捉されにくくすることができる。これにより、リポソーム900を目標とする病巣部位に適切に到達させることができる。PEGの使用量は、例えばリポソームを構成する脂質に対して0.1〜30質量%とすることができる。
【0041】
リポソーム900の表面は、リガンド300で誘導化されている。リガンドとは、細胞表面上に存在するレセプター又は表面抗原と結合することができる物質である。リガンド300は、特に限定されるものではないが、例えば、トランスフェリン、葉酸、ヒアルロン酸、ガラクトース、マンノース等の糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドである。
【0042】
リガンド300は好ましくはトランスフェリンである。トランスフェリンは生体内に存在する鉄結合蛋白質であり、細胞表面上のトランスフェリンレセプターと結合して細胞内に取り込まれることにより、鉄を細胞に供給する役割を有する。トランスフェリンレセプターは、癌種を問わず正常組織に比べて発現量が高いため、薬剤をトランスフェリンと結合させることにより、トランスフェリンレセプターを介して薬剤の腫瘍細胞内への取り込みを促進することができる。
【0043】
リポソーム900の表面に修飾されるペプチドは、ドラッグデリバリー用機能性ペプチドである。ペプチドは、特に限定されるものではないが、例えば、ポリアルギニンペプチド等の細胞膜透過性ペプチド、GALAペプチド等のpH応答性膜融合性ペプチド、トランスサイトーシス誘導性ペプチド等である。
【0044】
リポソーム900には、膜構成物質として必要に応じ他の物質を加えることもでき、例えば膜安定化剤としてシトステロール、コレステロール、ジヒドロコレステロール、コレステロールエステル、フィトステロール、スチグマステロール、カンペステロール、コレスタノール、ラノステロール、1−O−ステロールグルコシド、1−O−ステロールマルトシド、及びこれらの混合物を含有させることができる。
【0045】
リポソーム900の重量は特に限定されるものでなく、リポソーム内部に塩化セシウム等の高密度な溶液を充填させることにより上昇させることができる。リポソーム900の密度は、リポソーム内部にデキストラン・サルフェート等の多糖類を含有させることにより上昇させることができる。
【0046】
リポソーム900の直径は、深部組織への到達性及び安定性等を考慮して、適宜調整することができ、例えば100〜200nmである。リポソーム900の直径を係る範囲に設定することにより、深部組織へ到達させることが可能である。ここで、リポソーム900の直径は動的光散乱法により測定される。
【0047】
リポソーム900の内部には薬物400を内包させることができる。薬物400は、長期間血中濃度が維持されることが望まれる薬物又は特定の疾患部位や細胞への標的指向性を意図した投与が必要な薬物等が好ましい。薬物400は、特に限定されるものではないが、例えば抗癌剤、抗生物質、抗喘息薬、抗血栓剤、抗原虫薬、免疫賦活剤、ペプチド系薬物、抗ウイルス薬である。
【0048】
癌組織は多様であり、例えば一箇所の癌組織のうち、その辺縁部は血管新生により血流豊富な領域であるのに対し、中心部では逆に血流が欠乏した状況となるものがある。血流は熱エネルギーを運び去るため、血流豊富な癌病変部では加熱凝固治療の効果が得られにくい場合がある。そこで、薬物400を用いて音響化学治療を組み合わせることにより、血流豊富な癌病変部の治療効果を促進させることができる。新生血管が多く、血流豊富な癌病変部では、薬物400が届きやすく、後述するキャビテーション生成が容易であるため、音響化学治療を組み合わせることが好適である。
【0049】
抗癌剤は、特に限定されるものではないが、例えばドキソルビシン、シスプラチン、マイトマイシン、ブレオマイシン、5−フルオロウラシル、メソトレキサート、ナイトロジェンマスタード、ブスルファン、オギザリプラチン、タキソール、カンプトテシン等である。抗生物質は例えばスルファゼン、ゲンタマイシン、ストレプトマイシン等である。抗喘息薬は例えばテオフィリン等である。抗血栓剤は例えばヘパリン、低分子量ヘパリン、ウロキナーゼ、トロンボモジュリン、ストレプトキナーゼ等である。抗原虫薬は例えばアンチモン酸メグルミン等である。免疫賦活剤は例えばムラミルペプチド類等である。ペプチド系薬物は例えば、天然型又は遺伝子組み換え型のα、β、γ−インターフェロン、インターロイキン、スーパーオキシドデスムターゼ等である。その他にも、薬物400として、例えばプロスタグランジン等の動脈硬化症治療薬、動脈閉塞症、バーチャ病に対するNFカッパーB、デコイ等が挙げられる。
【0050】
また、リポソーム900の内部には薬物400のみならず遺伝子類を内包させることも可能である。遺伝子類は、例えば、DNA、RNA、アンチセンスDNA、siRNA、デコイ、治療用オリゴヌクレオチド等である。
【0051】
次に、本実施形態に係る医薬組成物について説明する。本実施形態に係る医薬組成物は、リポソーム900及び薬学的に許容される担体を含む。薬学的に許容される担体は、例えば滅菌水、緩衝液、食塩水等である。医薬組成物は、更に、種々の塩類、糖類、蛋白質、澱粉、ゼラチン、植物油及びポリエチレングリコール等を含有することができる。本実施形態に係る医薬組成物は、例えばボーラス注射又は連続注入により非経口的に投与できる。投与量は、特に限定されるものではなく、投与経路、症状の重篤度、患者の年齢及び状態、副作用の程度等により適宜設定できる。
【0052】
次に、本実施形態に係るリポソーム900の製造方法について説明する。まず、生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、パーフルオロ炭化水素内包ミセル100を形成する(ミセル化工程)。
【0053】
生体親和性且つ両親媒性のミセル外殻形成物質は、上述したように例えば、ブロックコポリマーや両親媒性のリン脂質等である。ブロックコポリマーは、親水性セグメント及び疎水性セグメントからなり、例えば、ポリエチレングリコール−ポリ乳酸ブロックポリマーである。パーフルオロ炭化水素は、上述したように、例えばパーフルオロノルマルペンタンである。分散液は、特に限定されるものではないが、例えば硫酸アンモニウムである。
【0054】
超高圧乳化分散機は、例えば超高圧ホモジナイザーを用いて行うことができる。超高圧ホモジナイザーとしては、例えば吉田機械興業社のナノマイザー(Nano-Mizer system mark II(登録商標)NM2)を使用できる。
【0055】
超高圧分散、乳化処理の圧力は、例えば圧力20MPa〜50MPa、好ましくは30MPa〜40MPaである。超高圧分散・乳化処理を実施する際の温度は、特に限定されるものではないが、例えば4℃〜50℃、好ましくは10℃〜30℃である。加圧処理時間は、特に限定されないが、例えば1〜30分である。
【0056】
次に、パーフルオロ炭化水素内包ミセル100を内包するリポソームを形成する(リポソーム形成工程)。リポソームの形成は、図2に示すように、ガラスフィルター装置500を使用するガラスフィルター−水和(Hydration)法にて行う。ガラスフィルター装置500は、中央部にナノフィルター530を有する。ナノフィルター530は、複数の細孔531を有する(なお、図2では、図面の簡易化のため細孔531は一つしか記載していない。)。細孔531の直径は、特に限定されるものではなく、所望するリポソーム粒子径により調整され、例えば100nm〜160μmである。ナノフィルター530の上部には、脂質の薄膜520が載置されるか、又はナノフィルター530の上部に脂質の薄膜520がコーティングされる。脂質の薄膜520は、例えば、上述したリン脂質又は糖脂質等を有機溶媒に溶解させた後に、その有機溶媒を乾燥させて形成される。有機溶剤とリン脂質の混合比は、リン脂質が溶解される十分量であれば特に限定されるものではないが、例えば3〜30mg/mlの濃度に調整される。ガラスフィルター装置500の下端部には排出口540が設けられる。
【0057】
ガラスフィルター−水和(Hydration)法にてリポソームを形成する際は、まず、ナノフィルター530の上部空間510に、120mM硫酸アンモニウム等の分散液に分散させたパーフルオロ炭化水素内包ミセル100を導入させる。このときの導入速度は、流速が、0.01〜0.6m/秒、好ましくは0.05〜0.3m/秒、より好ましくは0.1〜0.2m/秒である。これにより、パーフルオロ炭化水素内包ミセル100が細孔531を通過する際には、水和(Hydration)によりパーフルオロ炭化水素内包ミセル100が内包されているリポソームが形成される。ガラスフィルター−水和(Hydration)法によれば、リポソーム内に内包されているパーフルオロ炭化水素内包ミセル100の封入効率は75〜85%である。
【0058】
ガラスフィルター−水和(Hydration)法にて形成されるリポソームの直径が大きい場合は、その後、超高圧乳化分散機にて粒子径を減少させることができる。超高圧乳化分散機は、上述したように、例えば超高圧ホモジナイザーを用いて行うことができる。ガラスフィルター−水和(Hydration)法にて形成されるリポソームの直径が例えば430nm〜580nmである場合は、その後超高圧ホモジナイザーを用いて粒子径を減少させることにより、リポソームの直径を例えば100nm〜270nmとすることができる。
【0059】
次に、粒子径を減少させたリポソームについて、ゲル濾過、透析、限外濾過、遠心分離等の方法により精製を行う。
【0060】
次に、リポソームの外表面にリガンドを結合させてリガンド修飾リポソームを得る(リガンド結合工程)。リガンドは、上述したように例えばトランスフェリンである。リガンドとしてトランスフェリンを用いる場合、トランスフェリンは精製された蛋白質として市販されている。リポソームの外表面にトランスフェリンを結合させるためには、PEG等の親水性ポリマーのリン脂質誘導体にさらに官能基を導入しておくことが好ましい。例えば、リン脂質に、末端にカルボキシル基を導入したPEGのリン脂質誘導体を添加してリポソームを形成させ、外表面にカルボキシル基を有するリポソームを得る。これに、例えば1−エチル−3−(3−ジメチルアミノ−プロピル)カルボジイミド塩酸及びN−ヒドロキシスルホスクシンイミドを結合させる。又は、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)を利用する。次に、このリンカーを付加したリポソームをトランスフェリンと反応させることにより、外表面にトランスフェリンが結合したアポ型のトランスフェリン結合リポソームが得られる。これを、クエン酸鉄−クエン酸ナトリウムで処理して、ホロ型のトランスフェリン結合リポソームが得られる。
【0061】
次に、外側表面にトランスフェリンが結合したリポソームの内部に、薬物を封入する(封入工程)。薬物は、上述したように例えばドキソルビシンである。薬物の封入方法は、薬物の封入効率及び保存安定性等の観点から、予めリポソームを生成させ、リポソームの内水相と外水相との間に生じるイオン勾配やpH勾配を利用してリポソーム内に薬物を封入するリモートローディング(Remote loading)法を採用することができる。リモートローディング法を用いる場合は、リポソーム膜を構成するリン脂質の相転移点以上の加熱下にて、薬物を導入しようとするリポソームの懸濁液と、薬物溶液との混合液を、60℃〜70℃で25〜35分間加温する。
【0062】
なお、薬物のみならず、リポソームの内部には遺伝子類を封入することも可能である。また、薬物又は遺伝子類の封入方法は、リモートローディング法に限定されず、リポソーム調製時に予め薬物を溶解させた水溶液を用いることによる方法、又はリポソーム調製後に、pH勾配法、浸透圧勾配法等を用いて封入する方法等を使用することができる。
【0063】
以上の工程を経て、本実施形態に係るリポソーム900が製造される。本実施形態に係るリポソームの製造方法によれば、ミセル内部にパーフルオロ炭化水素を内包させてパーフルオロ炭化水素内包ミセルを形成し、そのパーフルオロ炭化水素内包ミセルをリポソーム内部に封入するから、常温で気体のパーフルオロ炭化水素(例えばパーフルオロノルマルペンタン)であっても、リポソーム内部に的確に封入することができる。
【0064】
次に、本実施形態に係るリポソーム900の使用態様について説明する。リポソーム900を非経口的に被験者に投与すると、リポソーム900はリガンドの働きにより病巣部位に集まる。そして、病巣部位に超音波を照射して、病巣部位の微小な領域に超音波を集め、瞬時に組織変性を来す温度に上昇させる。超音波照射の条件は、特に限定されるものではないが、例えば、照射強度1W/cm2〜3000W/cm2、周波数1MHz〜10MHz、照射時間10秒間〜20秒間とすることができる。超音波照射により、リポソーム900が割れ、パーフルオロ炭化水素内包ミセル100内部のパーフルオロ炭化水素の気泡が生じる。このパーフルオロ炭化水素の気泡の直径は、例えば40μm〜60μmである。このパーフルオロ炭化水素の気泡の発生により、病巣部位の造影が可能となり、従来はできなかった深層病巣部位の画像化も可能となる。また、このパーフルオロ炭化水素の気泡がキャビテーション現象を起こし、病巣部位の組織内温度が70〜100℃にまで上昇して加熱凝固療法が促進される。また、薬物400が内部に封入されている場合は、音響化学治療を組み合わせることにより、血流豊富な癌病変部の治療効果を促進させることができる。
【0065】
本実施形態に係るリポソーム900を使用する加熱凝固療法を用いることにより、例えば前立腺肥大症や前立腺癌の治療を効果的に促進できる。前立腺は直腸壁に隣接しているので、収束超音波を発生させるアプリケータを直腸内腔に挿入し、直腸壁を隔てて隣接する前立腺に超音波を収束させて、前立腺内部を加熱凝固できる。他にも、例えば肝臓癌、腎臓癌等の加熱凝固療法にも効果的に使用できる。
【実施例】
【0066】
(実施例1)
ポリエチレングリコール(数平均分子量750)−ポリ乳酸(数平均分子量1000)ブロックポリマーを1.3mg/mlと、120mM硫酸アンモニウムを50mlと、パーフルオロノルマルペンタンを200μlとを混合させ、その混合液をナノマイザー(吉田機械興業(株))にて超高圧分散して乳化処理をした。圧力は35MPa、温度は20℃、加圧処理時間は10分であった。このようにして形成されたパーフルオロ炭化水素内包ミセルの直径は、図3に示すように69.5±16.9nmであった。なお、パーフルオロ炭化水素内包ミセルの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0067】
次に、図2に示すガラスフィルター装置500を使用し、ナノフィルター530の上部に脂質の薄膜520を載置した。脂質の薄膜520は、1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)、コレステロール(CH)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸(DSPE−PEG)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)を混合させた混合物にクロロホルム10mlを添加し、完全に溶解するまで攪拌した後、クロロホルムを乾燥させて形成された。ナノフィルター530は、直径29.5mm、厚さ4mmの円盤状ガラスフィルターを10枚重ねて形成された。細孔531の直径は130μmであった。
【0068】
そして、ナノフィルター530の上部空間510に、120mM硫酸アンモニウム等の分散液に分散させたパーフルオロ炭化水素内包ミセル100を導入させた。導入速度は、流速が0.1m/秒であった。排出口540から得られたリポソームにはパーフルオロ炭化水素内包ミセル100が内包されており、パーフルオロ炭化水素内包ミセル100の封入効率は約80%であった。また、リポソームの直径は、図4に示すように、557.7±123.7nmであった。リポソームの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0069】
次に、得られたリポソームをナノマイザー(吉田機械興業(株))にてサイズダウンさせた。これにより直径は図5に示すように、181.8±88.3nmとなった。圧力は30MPa、温度は20℃、加圧処理時間は8分であった。そして、粒子径を減少させたリポソームについて遠心分離により精製を行った。サイズダウンさせたリポソームの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0070】
次に、上述のサイズダウンさせたリポソームに、トランスフェリン(三菱化学メディエンス株式会社)を脂質重量の20%を加え、室温で撹拌した。反応時間は3時間であった。これにより、リポソームの外表面にトランスフェリンが結合していた。
【0071】
次に、上述したリポソームの懸濁液にドキソルビシン溶液を混合させ、65℃で30分間加温して、ドキソルビシンをリポソームの内部にリモートローディング(Remote loading)法により封入させた。このようにして、形成されたリポソームの電子顕微鏡写真を図6に示す。図6(a)に示すように、リポソーム内部にパーフルオロ炭化水素内包ミセルが内包されている。図6(b)は近接している2個のリポソームを示すものである。
【0072】
(実施例2)
マウス結腸癌Colon26細胞に対して、実施例1にて製造したリポソームの結合性と、トランスフェリンによる修飾がなされていないリポソーム(Bare-Liposome)の結合性とを比較した。Bare-Liposomeは、トランスフェリン修飾をしない以外は上述の実施例1と同様の製造方法にして製造した。蛍光標識は、ニトロベンゾキサゾールジパルミトイルフォスファチジルエタノールアミン(NBD-PE)を使用した。この比較結果を図7(a)に示す。トランスフェリン修飾がなされているリポソームのマウス結腸癌Colon26細胞に対する結合性が確認された。
【0073】
次に、マウス結腸癌Colon26細胞に対して、実施例1にて製造したリポソームの結合性と、表面にBSAが吸着しているリポソーム(BSA-Liposome)の結合性とを比較した。BSA-Liposomeは、トランスフェリン修飾をせずにウシ血清アルブミンを吸着させる以外は上述の実施例1と同様の製造方法にして製造した。蛍光標識は、NBD-PEを使用した。この比較結果を図7(b)に示す。トランスフェリン修飾がなされているリポソームのマウス結腸癌Colon26細胞に対する結合性の優位性が確認された。
【0074】
(実施例3)
実施例1にて製造したリポソームに、照射強度1W/cm2、周波数1MHzの超音波を15秒間照射した。図8(a)は超音波照射の前を示す写真であり、図8(b)は超音波照射の後を示す写真である。図8(b)に示すように、超音波照射により、パーフルオロ炭化水素内包ミセルに内包されていたパーフルオロノルマルペンタンの気泡の発生が確認された。気泡の直径は50μm前後であった。直径は、顕微鏡観察写真内で無作為に抽出した150個の気泡の直径の平均から計算した。
【0075】
(実施例4)
次に、実施例1にて製造したリポソームについて、超音波診断装置による超音波造影を行った。図9(a)は、実施例1にて製造したリポソームの超音波照射の前を示す写真であり、図9(b)は、実施例1にて製造したリポソームの超音波照射の後を示す写真であり、図9(c)は、PBSコントロールの超音波照射の前を示す写真であり、図9(d)は、PBSコントロールの超音波照射の後を示す写真である。超音波照射は、照射強度1W/cm2、周波数1MHzの超音波を15秒間行った。図9(b)に示すように、実施例1にて製造したリポソームの超音波造影能が確認された。
【0076】
(実施例5)
次に、実施例1で製造したリポソームに対して超音波照射を行い、発生するキャビテーションによる発熱を熱電対で測定した。超音波照射は、照射強度1000W/cm2、周波数3.35MHz、照射時間30秒であった。実施例1のリポソームの発熱と、PBSの場合の発熱と、無処置の場合(超音波照射無し)の発熱とにおける測定結果を図10に示す。本実施例のリポソームは無処置の場合と比較して、約20℃程度の温度上昇が確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。
【0077】
次に、実施例1で製造したリポソームをファントムゲル中に含有させ、超音波照射することにより加熱凝固作用を確認した。超音波照射は、照射強度1900W/cm2、周波数3.35MHz、照射時間30秒と、照射強度3000W/cm2、周波数3.35MHz、照射時間30秒とで行った。ファントムゲルは、7.5重量%ポリアクリルアミドゲルと6.5重量%ウシ血清アルブミンとを混合させたものである。この加熱凝固作用の結果を図11に示す。照射強度1900W/cm2及び照射強度3000W/cm2のいずれの場合も、キャビテーションによる発熱により加熱凝固作用が生じることが確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。
【0078】
(実施例6)
次に、実施例1で製造したリポソームに超音波照射し、ドキソルビシンによる一重項酸素の発生を通常の手法に従いルミノール反応にて確認した。一重項酸素は反応性に富み、強い酸化作用により腫瘍細胞に傷害を与える。また、生体内における一重項酸素の寿命は非常に短く、影響を及ぼす範囲はそれが生成した局所に限定されるので、腫瘍細胞のみに傷害を与え、それ以外の健康部位には傷害を与えない。超音波の照射条件は、照射強度1W/cm2、周波数1MHz、照射時間15秒間であった。一重項酸素の生成結果を図12に示す。コントロールはPBSである。本実施例に係るリポソームは、ローズベンガルやメチレンブルー溶液と比較しても高い一重項酸素の生成が確認された。
【0079】
(実施例7)
次に、実施例1で製造したリポソームを担癌マウスに投与し、超音波照射による抗腫瘍効果を調べた。担癌マウスは、健康な実験用マウスの後背部にColon26細胞を1×106cells/100μl注入して作成した。リポソームの投与は、Colon26細胞を実験用マウスに投与してから4日後に注入した。超音波の照射条件は、照射強度600W/cm2、周波数3.35MHz、照射時間120秒間であった。超音波照射後に、腫瘍径を計測した。一方で、超音波照射のみの場合と無処理の場合(リポソーム注入も、超音波照射もしていない場合)とについても、同様に作成した担癌マウスに同じ超音波条件で超音波照射して腫瘍径を計測した。この結果を図13に示す。図13に示すように、本実施例のリポソームを注入して超音波照射した場合は、腫瘍体積が著しく減少していることが判明した。
【0080】
次に、実施例1で製造したリポソームを担癌マウスに投与し、超音波照射による抗腫瘍効果を写真にて調べた。超音波の照射条件は、照射強度400W/cm2、周波数3.35MHz、照射時間120秒間であった。この結果を図14(a)及び(b)に示す。図14(a)は、超音波照射直後の照射部位の写真であり、図14(b)は、担癌マウスの摘出した肝臓の写真である。図14(a)及び(b)に示されるように、本実施例のリポソームを注入後、体外からのピンポイントの超音波照射により、照射部位の熱変性が確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。一方、同様の担癌マウスに同じ超音波条件により超音波照射を行い、担癌マウスの肝臓を摘出して調べた。この結果を図14(c)に示す。超音波照射のみの場合は、本実施例の場合と比較して、加熱凝固治療の治療効果は不十分であった。
【符号の説明】
【0081】
100:パーフルオロ炭化水素内包ミセル
200:膜
300:リガンド
400:薬物
500:ガラスフィルター装置
520:薄膜
530:ナノフィルター
540:排出口
900:リポソーム
【技術分野】
【0001】
本発明は、超音波加熱凝固治療及び病巣部造影に使用されるリポソーム、そのリポソームの製造方法、及びそのリポソームを含有する医薬組成物に関する。
【背景技術】
【0002】
超音波診断装置は、産婦人科、循環器科、泌尿器科等で使用されており、超音波イメージング剤として、マイクロバブルを投与した後に超音波照射により影像して診断する方法が開発されている(特許文献1〜5参照)。
【0003】
しかしながら、従来のマイクロバブルは、アルブミンで形成された巨大粒子中に気体を含有させるものであることから、粒子径が2〜6μmと大きく、深部組織への移行性は低かった。そのため、深部組織での造影能は不十分であるという問題点がある。
【0004】
一方、加熱凝固療法は、癌治療等の分野にて近年脚光を浴びている治療法であり、ミリメートル単位の微小な領域に強力超音波を集め、瞬時に組織変性を来す温度に上昇させる治療法である(非特許文献1)。
【0005】
特許文献6には、この加熱凝固療法に使用されるフッ化ガスが封入されているガス封入リポソームが記載されている。
【0006】
特許文献6では、リポソームをバイアルに詰めて、ガス加圧条件下でバス型超音波洗浄機を用いて超音波照射を行い、リポソームにフッ化ガスを封入する。
【0007】
このガス封入リポソームを被験者に投与後、病巣部位に低周波超音波を照射する。これにより、その病巣部位で内封されたガスの微少気泡によるキャビテーションが生じ、病巣部位が高温となり死滅する。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第4572205号
【特許文献2】米国特許第4718433号
【特許文献3】米国特許第4774958号
【特許文献4】米国特許第4844852号
【特許文献5】米国特許第4957656号
【特許文献6】特開2005−154282号公報(第3頁、第5頁)
【非特許文献】
【0009】
【非特許文献1】P.P.Lele著「Ultrasound; medical applications,biological effects and hazard potential」Plenum Press New York 1987年
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかし、上述のガス封入リポソームでは、リポソーム内部へのフッ化ガスの封入効率が不十分であり、またパーフルオロノルマルペンタンのような常温で液体のものは、リポソーム内部への封入が困難である問題点がある。
【0011】
本発明はかかる問題点に鑑みてなされたものであって、病巣部位の造影能が高く、ガス乃至液滴が効率的に封入されており加熱凝固療法の治療効果が高いリポソーム、及びそのリポソームを効率的に製造するリポソームの製造方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明の第1の観点に係るリポソームの製造方法は、生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、前記パーフルオロ炭化水素を内包する生体親和性のミセルであるパーフルオロ炭化水素内包ミセルを形成するミセル化工程と、前記パーフルオロ炭化水素内包ミセルを内包するリポソームを形成するリポソーム形成工程とを有することを特徴とする。
【0013】
また、前記リポソーム形成工程は、脂質の薄膜をナノフィルターの一方の面に貼り付け、分散液に分散させた前記パーフルオロ炭化水素内包ミセルを前記脂質の薄膜及び前記ナノフィルターを通過させることで、前記脂質をリポソーム膜とするリポソームを形成することが好ましい。
【0014】
また、前記リポソームの外表面に、標的細胞、標的組織又は標的病巣に対するリガンドを結合させてリガンド修飾リポソームを得るリガンド結合工程を有することが好ましい。
【0015】
また、前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることが可能である。
【0016】
また、前記リガンド修飾リポソームに薬物及び遺伝子の少なくとも何れか一つを封入する封入工程を有することが好ましい。
【0017】
また、前記パーフルオロ炭化水素は、パーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロブタン、パーフロオロペンタン、パーフルオロヘキサン、パーフルオロヘプタン、及びパーフルオロオクタンの少なくとも何れか一つを含有することが好ましい。
【0018】
また、前記リポソーム形成工程は、前記脂質の薄膜及び前記ナノフィルターを通過することにより形成されたリポソームを、超高圧乳化分散機にて粒子径を減少させることが好ましい。
【0019】
本発明の第2の観点に係るリポソームは、パーフルオロ炭化水素を内包する生体親和性のミセルを内包することを特徴とする。
【0020】
また、リポソーム表面に、標的細胞、標的組織又は標的病巣に対するリガンドを有することが好ましい。
【0021】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることが可能である。
【0022】
本発明のリポソームは、更に薬物及び遺伝子の少なくとも何れか一つを内包することが好ましい。
【0023】
本発明の第3の観点に係る医薬組成物は、請求項8乃至11の何れか1項に記載のリポソーム及び薬学的に許容される担体を含む腫瘍を治療するための医薬組成物である。
【発明の効果】
【0024】
本発明に係るリポソームは、病巣部位の造影能が高く、ガス乃至液滴が効率的に封入されているので、加熱凝固療法の治療効果が高い。また、本発明に係るリポソームの製造方法は、本発明に係るリポソームを効率的に製造できる。
【図面の簡単な説明】
【0025】
【図1】本実施形態に係るリポソームを説明する説明図である。
【図2】ガラスフィルター−水和(Hydration)法に使用するガラスフィルター装置を説明する説明図である。
【図3】パーフルオロ炭化水素内包ミセルの直径を示す図である。
【図4】ガラスフィルター−水和(Hydration)法により形成したリポソームの直径を示す図である。
【図5】ナノマイザーによりサイズダウンしたリポソームの直径を示す図である。
【図6】本実施形態に係るリポソームの電子顕微鏡写真図であり、そのうち(a)はパーフルオロ炭化水素内包ミセルが内包されている状態を示すものであり、(b)は近接している2個のリポソームを示すものである。
【図7】本実施例に係るリポソームのマウス結腸癌Colon26細胞に対する結合性を示す図であり、そのうち(a)は実施例1のリポソームの結合性とBare-Liposomeの結合性とを比較するものであり、(b)は実施例1のリポソームの結合性とBSA-Liposomeの結合性とを比較するものである。
【図8】超音波照射によるパーフルオロ炭化水素内包ミセル内のパーフルオロノルマルペンタンのガス化を示す図であり、そのうち(a)は超音波照射前であり、(b)は超音波照射後である。
【図9】超音波照射による造影能を示す図であり、そのうち(a)は本実施例のリポソームの超音波照射前であり、(b)は本実施例のリポソームの超音波照射後であり、(c)はコントロールの超音波照射前であり、(d)はコントロールの超音波照射後である。
【図10】超音波照射による発生するキャビテーションによる発熱の測定結果を示す図である。
【図11】本実施例のリポソームをファントムゲル中に含有させ、超音波照射することによる加熱凝固作用を示す図である。
【図12】超音波照射による一重項酸素の生成を示す図である。
【図13】担癌マウスに本実施例のリポソームを注入し、超音波照射した後の抗腫瘍効果を示す図である。
【図14】超音波照射による加熱凝固治療の結果を示す図であり、そのうち(a)は本実施例のリポソームを担癌マウスに注入し超音波照射した直後の照射部位であり、(b)はその担癌マウスから摘出した肝臓であり、(c)超音波照射のみの担癌マウスの肝臓である。
【発明を実施するための形態】
【0026】
以下、添付の図面を参照して本発明の実施形態について具体的に説明する。本実施形態に係るリポソーム900は、図1に示すように、パーフルオロ炭化水素内包ミセル100を内包する。リポソーム900の脂質組成、帯電状態、密度、重量、粒子径等は、加熱凝固治療の対象となる病巣部の性質等に応じて適宜設計することができる。
【0027】
パーフルオロ炭化水素内包ミセル100の外殻110は、生体親和性且つ両親媒性のミセル外殻形成物質で形成される。生体親和性且つ両親媒性のミセル外殻形成物質は、特に限定されるものではないが、例えば、ブロックコポリマーや両親媒性のリン脂質等である。
【0028】
ブロックコポリマーは、親水性セグメント(以下、Xセグメントとする。)及び疎水性セグメント(以下、Yセグメントとする。)からなる、XY型又はXYX型のブロックコポリマーである。
【0029】
親水性セグメントは、特に限定されるものでないが、例えばポリエチレングリコール、ポリリン酸、ポリオキシエチレン、ポリサッカライド、ポリアクリルアミド、ポリアクリル酸、ポリメタクリルアミド、ポリメタクリル酸、ポリビニルピロリドン、ポリビニルアルコール、ポリメタクリル酸エステル、ポリアクリル酸エステル、ポリアミノ酸あるいはこれらの誘導体由来のセグメントである。好ましいものとしてはポリエチレングリコールである。
【0030】
疎水性セグメントは、特に限定されるものではないが、例えばポリ乳酸、ポリ(アスパラギン酸)、ポリ(グルタミン酸)、ポリアスパラギン酸エステル、ポリグルタミン酸エステル、またこれらの部分加水分解物、ポリリシン、ポリアクリル酸、ポリメタクリル酸、ポリリンゴ酸、ポリアルキレンオキシドあるいはこれらの誘導体由来のセグメントである。好ましいものとしてはポリ乳酸である。
【0031】
親水性セグメントと疎水性セグメントは、ポリマーミセルを形成しうるものであれば、それぞれのセグメントの大きさに制限がないが、例えば親水性セグメントの繰り返し単位は10〜500、好ましくは15〜100にあり、他方、疎水性セグメントの繰り返し単位は5〜100、好ましくは10〜30である。
【0032】
パーフルオロ炭化水素内包ミセル100の内部120には、パーフルオロ炭化水素が内封される。
【0033】
パーフルオロ炭化水素は、特に限定されるものではないが、例えばパーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロイソブタン、パーフロオロノルマルブタン、パーフロオロイソペンタン、パーフロオロノルマルペンタン、パーフルオロイソヘキサン、パーフルオロノルマルヘキサン、パーフルオロイソヘプタン、パーフルオロノルマルヘプタン、パーフルオロイソオクタン、及びパーフルオロノルマルオクタンである。好ましいものはパーフルオロノルマルペンタン(b.p.29℃)である。パーフルオロノルマルペンタンを使用した場合、常温では、パーフルオロ炭化水素内包ミセル100の内部にパーフルオロノルマルペンタンの液滴を内包することになる。
【0034】
パーフルオロ炭化水素内包ミセル100の直径は、特に限定されるものではないが、例えば50nm〜100nmである。本実施形態では70nmである。パーフルオロ炭化水素内包ミセル100の直径は、例えば動的光散乱法により測定される。
【0035】
リポソーム900の膜200は、脂質類を含有する膜構成成分からなる。脂質類は、例えばリン脂質、グリセロ糖脂質及びスフィンゴ糖脂質の他、これらの脂質に、1級アミノ基、2級アミノ基、3級アミノ基又は第4級アンモニウム基が導入されたカチオン性脂質である。
【0036】
リン脂質は、特に限定されるものではないが、例えば、ホスファチジルコリン(大豆ホスファチジルコリン、卵黄ホスファチジルコリン(EPC)、1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)、ジステアロイルホスファチジルコリン(DSPC)、ジパルミトイルホスファチジルコリン等)、ホスファチジルエタノールアミン(ジステアロイルホスファチジルエタノールアミン(DSPE)等)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸(DSPE−PEG)、ホスファチジルセリン(PS)、ホスファチジン酸(PA)、ホスファチジルグリセロール(PG)、ホスファチジルイノシトール(PI)、ジミリストイルホスファチジルグリセロール(DMPG)、ジミリストイルホスファチジルコリン(DMPC)、リゾホスファチジルコリン、スフィンゴミエリン、卵黄レシチン、大豆レシチン、水素添加リン脂質等の天然又は合成のリン脂質等が挙げられる。
【0037】
グリセロ糖脂質は、特に限定されるものではないが、例えば、スルホキシリボシルグリセリド、ジグリコシルジグリセリド、ジガラクトシルジグリセリド、ガラクトシルジグリセリド、グリコシルジグリセリド等が挙げられる。
【0038】
スフィンゴ糖脂質は、特に限定されるものではないが、例えば、ガラクトシルセレブロシド、ラクトシルセレブロシド、ガングリオシド等が挙げられる。
【0039】
カチオン性脂質は、特に限定されるものではないが、例えば、上記リン脂質、グリセロ糖脂質又はスフィンゴ糖脂質に、アミノ基、アルキルアミノ基、ジアルキルアミノ基、トリアルキルアンモニウム基、モノアシルオキシアルキル−ジアルキルアンモニウム基、ジアシルオキシアルキル−モノアルキルアンモニウム基等の第4級アンモニウム基が導入された脂質が挙げられる。また、ポリアルキレングリコール修飾脂質としては、上記リン脂質、グリセロ糖脂質、スフィンゴ糖脂質に、ポリエチレングリコール、ポリプロピレングリコール等が修飾した脂質、例えばジ−C12-24アシル−グリセロール−ホスファチジルエタノールアミン−N−PEG等が挙げられる。
【0040】
不活性な親水性ポリマーであるポリアルキレンオキシド鎖(ポリオキシアルキレン鎖)又はPEG鎖がリポソーム900表面に修飾されることにより、細胞内皮系組織の貪食細胞から捕捉されにくくすることができる。これにより、リポソーム900を目標とする病巣部位に適切に到達させることができる。PEGの使用量は、例えばリポソームを構成する脂質に対して0.1〜30質量%とすることができる。
【0041】
リポソーム900の表面は、リガンド300で誘導化されている。リガンドとは、細胞表面上に存在するレセプター又は表面抗原と結合することができる物質である。リガンド300は、特に限定されるものではないが、例えば、トランスフェリン、葉酸、ヒアルロン酸、ガラクトース、マンノース等の糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドである。
【0042】
リガンド300は好ましくはトランスフェリンである。トランスフェリンは生体内に存在する鉄結合蛋白質であり、細胞表面上のトランスフェリンレセプターと結合して細胞内に取り込まれることにより、鉄を細胞に供給する役割を有する。トランスフェリンレセプターは、癌種を問わず正常組織に比べて発現量が高いため、薬剤をトランスフェリンと結合させることにより、トランスフェリンレセプターを介して薬剤の腫瘍細胞内への取り込みを促進することができる。
【0043】
リポソーム900の表面に修飾されるペプチドは、ドラッグデリバリー用機能性ペプチドである。ペプチドは、特に限定されるものではないが、例えば、ポリアルギニンペプチド等の細胞膜透過性ペプチド、GALAペプチド等のpH応答性膜融合性ペプチド、トランスサイトーシス誘導性ペプチド等である。
【0044】
リポソーム900には、膜構成物質として必要に応じ他の物質を加えることもでき、例えば膜安定化剤としてシトステロール、コレステロール、ジヒドロコレステロール、コレステロールエステル、フィトステロール、スチグマステロール、カンペステロール、コレスタノール、ラノステロール、1−O−ステロールグルコシド、1−O−ステロールマルトシド、及びこれらの混合物を含有させることができる。
【0045】
リポソーム900の重量は特に限定されるものでなく、リポソーム内部に塩化セシウム等の高密度な溶液を充填させることにより上昇させることができる。リポソーム900の密度は、リポソーム内部にデキストラン・サルフェート等の多糖類を含有させることにより上昇させることができる。
【0046】
リポソーム900の直径は、深部組織への到達性及び安定性等を考慮して、適宜調整することができ、例えば100〜200nmである。リポソーム900の直径を係る範囲に設定することにより、深部組織へ到達させることが可能である。ここで、リポソーム900の直径は動的光散乱法により測定される。
【0047】
リポソーム900の内部には薬物400を内包させることができる。薬物400は、長期間血中濃度が維持されることが望まれる薬物又は特定の疾患部位や細胞への標的指向性を意図した投与が必要な薬物等が好ましい。薬物400は、特に限定されるものではないが、例えば抗癌剤、抗生物質、抗喘息薬、抗血栓剤、抗原虫薬、免疫賦活剤、ペプチド系薬物、抗ウイルス薬である。
【0048】
癌組織は多様であり、例えば一箇所の癌組織のうち、その辺縁部は血管新生により血流豊富な領域であるのに対し、中心部では逆に血流が欠乏した状況となるものがある。血流は熱エネルギーを運び去るため、血流豊富な癌病変部では加熱凝固治療の効果が得られにくい場合がある。そこで、薬物400を用いて音響化学治療を組み合わせることにより、血流豊富な癌病変部の治療効果を促進させることができる。新生血管が多く、血流豊富な癌病変部では、薬物400が届きやすく、後述するキャビテーション生成が容易であるため、音響化学治療を組み合わせることが好適である。
【0049】
抗癌剤は、特に限定されるものではないが、例えばドキソルビシン、シスプラチン、マイトマイシン、ブレオマイシン、5−フルオロウラシル、メソトレキサート、ナイトロジェンマスタード、ブスルファン、オギザリプラチン、タキソール、カンプトテシン等である。抗生物質は例えばスルファゼン、ゲンタマイシン、ストレプトマイシン等である。抗喘息薬は例えばテオフィリン等である。抗血栓剤は例えばヘパリン、低分子量ヘパリン、ウロキナーゼ、トロンボモジュリン、ストレプトキナーゼ等である。抗原虫薬は例えばアンチモン酸メグルミン等である。免疫賦活剤は例えばムラミルペプチド類等である。ペプチド系薬物は例えば、天然型又は遺伝子組み換え型のα、β、γ−インターフェロン、インターロイキン、スーパーオキシドデスムターゼ等である。その他にも、薬物400として、例えばプロスタグランジン等の動脈硬化症治療薬、動脈閉塞症、バーチャ病に対するNFカッパーB、デコイ等が挙げられる。
【0050】
また、リポソーム900の内部には薬物400のみならず遺伝子類を内包させることも可能である。遺伝子類は、例えば、DNA、RNA、アンチセンスDNA、siRNA、デコイ、治療用オリゴヌクレオチド等である。
【0051】
次に、本実施形態に係る医薬組成物について説明する。本実施形態に係る医薬組成物は、リポソーム900及び薬学的に許容される担体を含む。薬学的に許容される担体は、例えば滅菌水、緩衝液、食塩水等である。医薬組成物は、更に、種々の塩類、糖類、蛋白質、澱粉、ゼラチン、植物油及びポリエチレングリコール等を含有することができる。本実施形態に係る医薬組成物は、例えばボーラス注射又は連続注入により非経口的に投与できる。投与量は、特に限定されるものではなく、投与経路、症状の重篤度、患者の年齢及び状態、副作用の程度等により適宜設定できる。
【0052】
次に、本実施形態に係るリポソーム900の製造方法について説明する。まず、生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、パーフルオロ炭化水素内包ミセル100を形成する(ミセル化工程)。
【0053】
生体親和性且つ両親媒性のミセル外殻形成物質は、上述したように例えば、ブロックコポリマーや両親媒性のリン脂質等である。ブロックコポリマーは、親水性セグメント及び疎水性セグメントからなり、例えば、ポリエチレングリコール−ポリ乳酸ブロックポリマーである。パーフルオロ炭化水素は、上述したように、例えばパーフルオロノルマルペンタンである。分散液は、特に限定されるものではないが、例えば硫酸アンモニウムである。
【0054】
超高圧乳化分散機は、例えば超高圧ホモジナイザーを用いて行うことができる。超高圧ホモジナイザーとしては、例えば吉田機械興業社のナノマイザー(Nano-Mizer system mark II(登録商標)NM2)を使用できる。
【0055】
超高圧分散、乳化処理の圧力は、例えば圧力20MPa〜50MPa、好ましくは30MPa〜40MPaである。超高圧分散・乳化処理を実施する際の温度は、特に限定されるものではないが、例えば4℃〜50℃、好ましくは10℃〜30℃である。加圧処理時間は、特に限定されないが、例えば1〜30分である。
【0056】
次に、パーフルオロ炭化水素内包ミセル100を内包するリポソームを形成する(リポソーム形成工程)。リポソームの形成は、図2に示すように、ガラスフィルター装置500を使用するガラスフィルター−水和(Hydration)法にて行う。ガラスフィルター装置500は、中央部にナノフィルター530を有する。ナノフィルター530は、複数の細孔531を有する(なお、図2では、図面の簡易化のため細孔531は一つしか記載していない。)。細孔531の直径は、特に限定されるものではなく、所望するリポソーム粒子径により調整され、例えば100nm〜160μmである。ナノフィルター530の上部には、脂質の薄膜520が載置されるか、又はナノフィルター530の上部に脂質の薄膜520がコーティングされる。脂質の薄膜520は、例えば、上述したリン脂質又は糖脂質等を有機溶媒に溶解させた後に、その有機溶媒を乾燥させて形成される。有機溶剤とリン脂質の混合比は、リン脂質が溶解される十分量であれば特に限定されるものではないが、例えば3〜30mg/mlの濃度に調整される。ガラスフィルター装置500の下端部には排出口540が設けられる。
【0057】
ガラスフィルター−水和(Hydration)法にてリポソームを形成する際は、まず、ナノフィルター530の上部空間510に、120mM硫酸アンモニウム等の分散液に分散させたパーフルオロ炭化水素内包ミセル100を導入させる。このときの導入速度は、流速が、0.01〜0.6m/秒、好ましくは0.05〜0.3m/秒、より好ましくは0.1〜0.2m/秒である。これにより、パーフルオロ炭化水素内包ミセル100が細孔531を通過する際には、水和(Hydration)によりパーフルオロ炭化水素内包ミセル100が内包されているリポソームが形成される。ガラスフィルター−水和(Hydration)法によれば、リポソーム内に内包されているパーフルオロ炭化水素内包ミセル100の封入効率は75〜85%である。
【0058】
ガラスフィルター−水和(Hydration)法にて形成されるリポソームの直径が大きい場合は、その後、超高圧乳化分散機にて粒子径を減少させることができる。超高圧乳化分散機は、上述したように、例えば超高圧ホモジナイザーを用いて行うことができる。ガラスフィルター−水和(Hydration)法にて形成されるリポソームの直径が例えば430nm〜580nmである場合は、その後超高圧ホモジナイザーを用いて粒子径を減少させることにより、リポソームの直径を例えば100nm〜270nmとすることができる。
【0059】
次に、粒子径を減少させたリポソームについて、ゲル濾過、透析、限外濾過、遠心分離等の方法により精製を行う。
【0060】
次に、リポソームの外表面にリガンドを結合させてリガンド修飾リポソームを得る(リガンド結合工程)。リガンドは、上述したように例えばトランスフェリンである。リガンドとしてトランスフェリンを用いる場合、トランスフェリンは精製された蛋白質として市販されている。リポソームの外表面にトランスフェリンを結合させるためには、PEG等の親水性ポリマーのリン脂質誘導体にさらに官能基を導入しておくことが好ましい。例えば、リン脂質に、末端にカルボキシル基を導入したPEGのリン脂質誘導体を添加してリポソームを形成させ、外表面にカルボキシル基を有するリポソームを得る。これに、例えば1−エチル−3−(3−ジメチルアミノ−プロピル)カルボジイミド塩酸及びN−ヒドロキシスルホスクシンイミドを結合させる。又は、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)を利用する。次に、このリンカーを付加したリポソームをトランスフェリンと反応させることにより、外表面にトランスフェリンが結合したアポ型のトランスフェリン結合リポソームが得られる。これを、クエン酸鉄−クエン酸ナトリウムで処理して、ホロ型のトランスフェリン結合リポソームが得られる。
【0061】
次に、外側表面にトランスフェリンが結合したリポソームの内部に、薬物を封入する(封入工程)。薬物は、上述したように例えばドキソルビシンである。薬物の封入方法は、薬物の封入効率及び保存安定性等の観点から、予めリポソームを生成させ、リポソームの内水相と外水相との間に生じるイオン勾配やpH勾配を利用してリポソーム内に薬物を封入するリモートローディング(Remote loading)法を採用することができる。リモートローディング法を用いる場合は、リポソーム膜を構成するリン脂質の相転移点以上の加熱下にて、薬物を導入しようとするリポソームの懸濁液と、薬物溶液との混合液を、60℃〜70℃で25〜35分間加温する。
【0062】
なお、薬物のみならず、リポソームの内部には遺伝子類を封入することも可能である。また、薬物又は遺伝子類の封入方法は、リモートローディング法に限定されず、リポソーム調製時に予め薬物を溶解させた水溶液を用いることによる方法、又はリポソーム調製後に、pH勾配法、浸透圧勾配法等を用いて封入する方法等を使用することができる。
【0063】
以上の工程を経て、本実施形態に係るリポソーム900が製造される。本実施形態に係るリポソームの製造方法によれば、ミセル内部にパーフルオロ炭化水素を内包させてパーフルオロ炭化水素内包ミセルを形成し、そのパーフルオロ炭化水素内包ミセルをリポソーム内部に封入するから、常温で気体のパーフルオロ炭化水素(例えばパーフルオロノルマルペンタン)であっても、リポソーム内部に的確に封入することができる。
【0064】
次に、本実施形態に係るリポソーム900の使用態様について説明する。リポソーム900を非経口的に被験者に投与すると、リポソーム900はリガンドの働きにより病巣部位に集まる。そして、病巣部位に超音波を照射して、病巣部位の微小な領域に超音波を集め、瞬時に組織変性を来す温度に上昇させる。超音波照射の条件は、特に限定されるものではないが、例えば、照射強度1W/cm2〜3000W/cm2、周波数1MHz〜10MHz、照射時間10秒間〜20秒間とすることができる。超音波照射により、リポソーム900が割れ、パーフルオロ炭化水素内包ミセル100内部のパーフルオロ炭化水素の気泡が生じる。このパーフルオロ炭化水素の気泡の直径は、例えば40μm〜60μmである。このパーフルオロ炭化水素の気泡の発生により、病巣部位の造影が可能となり、従来はできなかった深層病巣部位の画像化も可能となる。また、このパーフルオロ炭化水素の気泡がキャビテーション現象を起こし、病巣部位の組織内温度が70〜100℃にまで上昇して加熱凝固療法が促進される。また、薬物400が内部に封入されている場合は、音響化学治療を組み合わせることにより、血流豊富な癌病変部の治療効果を促進させることができる。
【0065】
本実施形態に係るリポソーム900を使用する加熱凝固療法を用いることにより、例えば前立腺肥大症や前立腺癌の治療を効果的に促進できる。前立腺は直腸壁に隣接しているので、収束超音波を発生させるアプリケータを直腸内腔に挿入し、直腸壁を隔てて隣接する前立腺に超音波を収束させて、前立腺内部を加熱凝固できる。他にも、例えば肝臓癌、腎臓癌等の加熱凝固療法にも効果的に使用できる。
【実施例】
【0066】
(実施例1)
ポリエチレングリコール(数平均分子量750)−ポリ乳酸(数平均分子量1000)ブロックポリマーを1.3mg/mlと、120mM硫酸アンモニウムを50mlと、パーフルオロノルマルペンタンを200μlとを混合させ、その混合液をナノマイザー(吉田機械興業(株))にて超高圧分散して乳化処理をした。圧力は35MPa、温度は20℃、加圧処理時間は10分であった。このようにして形成されたパーフルオロ炭化水素内包ミセルの直径は、図3に示すように69.5±16.9nmであった。なお、パーフルオロ炭化水素内包ミセルの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0067】
次に、図2に示すガラスフィルター装置500を使用し、ナノフィルター530の上部に脂質の薄膜520を載置した。脂質の薄膜520は、1−パルミトイル−2−オレオイルホスファチジルコリン(POPC)、コレステロール(CH)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸(DSPE−PEG)、ジステアロイルホスファチジルエタノールアミノカルボニル−ポリ(エチレングリコール)−プロピオン酸N−ヒドロキシスクシンイミジルエステル(DSPE−PEG−NHS)を混合させた混合物にクロロホルム10mlを添加し、完全に溶解するまで攪拌した後、クロロホルムを乾燥させて形成された。ナノフィルター530は、直径29.5mm、厚さ4mmの円盤状ガラスフィルターを10枚重ねて形成された。細孔531の直径は130μmであった。
【0068】
そして、ナノフィルター530の上部空間510に、120mM硫酸アンモニウム等の分散液に分散させたパーフルオロ炭化水素内包ミセル100を導入させた。導入速度は、流速が0.1m/秒であった。排出口540から得られたリポソームにはパーフルオロ炭化水素内包ミセル100が内包されており、パーフルオロ炭化水素内包ミセル100の封入効率は約80%であった。また、リポソームの直径は、図4に示すように、557.7±123.7nmであった。リポソームの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0069】
次に、得られたリポソームをナノマイザー(吉田機械興業(株))にてサイズダウンさせた。これにより直径は図5に示すように、181.8±88.3nmとなった。圧力は30MPa、温度は20℃、加圧処理時間は8分であった。そして、粒子径を減少させたリポソームについて遠心分離により精製を行った。サイズダウンさせたリポソームの直径は大塚電子株式会社のゼータ電位・粒径測定システムを使用して測定した。
【0070】
次に、上述のサイズダウンさせたリポソームに、トランスフェリン(三菱化学メディエンス株式会社)を脂質重量の20%を加え、室温で撹拌した。反応時間は3時間であった。これにより、リポソームの外表面にトランスフェリンが結合していた。
【0071】
次に、上述したリポソームの懸濁液にドキソルビシン溶液を混合させ、65℃で30分間加温して、ドキソルビシンをリポソームの内部にリモートローディング(Remote loading)法により封入させた。このようにして、形成されたリポソームの電子顕微鏡写真を図6に示す。図6(a)に示すように、リポソーム内部にパーフルオロ炭化水素内包ミセルが内包されている。図6(b)は近接している2個のリポソームを示すものである。
【0072】
(実施例2)
マウス結腸癌Colon26細胞に対して、実施例1にて製造したリポソームの結合性と、トランスフェリンによる修飾がなされていないリポソーム(Bare-Liposome)の結合性とを比較した。Bare-Liposomeは、トランスフェリン修飾をしない以外は上述の実施例1と同様の製造方法にして製造した。蛍光標識は、ニトロベンゾキサゾールジパルミトイルフォスファチジルエタノールアミン(NBD-PE)を使用した。この比較結果を図7(a)に示す。トランスフェリン修飾がなされているリポソームのマウス結腸癌Colon26細胞に対する結合性が確認された。
【0073】
次に、マウス結腸癌Colon26細胞に対して、実施例1にて製造したリポソームの結合性と、表面にBSAが吸着しているリポソーム(BSA-Liposome)の結合性とを比較した。BSA-Liposomeは、トランスフェリン修飾をせずにウシ血清アルブミンを吸着させる以外は上述の実施例1と同様の製造方法にして製造した。蛍光標識は、NBD-PEを使用した。この比較結果を図7(b)に示す。トランスフェリン修飾がなされているリポソームのマウス結腸癌Colon26細胞に対する結合性の優位性が確認された。
【0074】
(実施例3)
実施例1にて製造したリポソームに、照射強度1W/cm2、周波数1MHzの超音波を15秒間照射した。図8(a)は超音波照射の前を示す写真であり、図8(b)は超音波照射の後を示す写真である。図8(b)に示すように、超音波照射により、パーフルオロ炭化水素内包ミセルに内包されていたパーフルオロノルマルペンタンの気泡の発生が確認された。気泡の直径は50μm前後であった。直径は、顕微鏡観察写真内で無作為に抽出した150個の気泡の直径の平均から計算した。
【0075】
(実施例4)
次に、実施例1にて製造したリポソームについて、超音波診断装置による超音波造影を行った。図9(a)は、実施例1にて製造したリポソームの超音波照射の前を示す写真であり、図9(b)は、実施例1にて製造したリポソームの超音波照射の後を示す写真であり、図9(c)は、PBSコントロールの超音波照射の前を示す写真であり、図9(d)は、PBSコントロールの超音波照射の後を示す写真である。超音波照射は、照射強度1W/cm2、周波数1MHzの超音波を15秒間行った。図9(b)に示すように、実施例1にて製造したリポソームの超音波造影能が確認された。
【0076】
(実施例5)
次に、実施例1で製造したリポソームに対して超音波照射を行い、発生するキャビテーションによる発熱を熱電対で測定した。超音波照射は、照射強度1000W/cm2、周波数3.35MHz、照射時間30秒であった。実施例1のリポソームの発熱と、PBSの場合の発熱と、無処置の場合(超音波照射無し)の発熱とにおける測定結果を図10に示す。本実施例のリポソームは無処置の場合と比較して、約20℃程度の温度上昇が確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。
【0077】
次に、実施例1で製造したリポソームをファントムゲル中に含有させ、超音波照射することにより加熱凝固作用を確認した。超音波照射は、照射強度1900W/cm2、周波数3.35MHz、照射時間30秒と、照射強度3000W/cm2、周波数3.35MHz、照射時間30秒とで行った。ファントムゲルは、7.5重量%ポリアクリルアミドゲルと6.5重量%ウシ血清アルブミンとを混合させたものである。この加熱凝固作用の結果を図11に示す。照射強度1900W/cm2及び照射強度3000W/cm2のいずれの場合も、キャビテーションによる発熱により加熱凝固作用が生じることが確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。
【0078】
(実施例6)
次に、実施例1で製造したリポソームに超音波照射し、ドキソルビシンによる一重項酸素の発生を通常の手法に従いルミノール反応にて確認した。一重項酸素は反応性に富み、強い酸化作用により腫瘍細胞に傷害を与える。また、生体内における一重項酸素の寿命は非常に短く、影響を及ぼす範囲はそれが生成した局所に限定されるので、腫瘍細胞のみに傷害を与え、それ以外の健康部位には傷害を与えない。超音波の照射条件は、照射強度1W/cm2、周波数1MHz、照射時間15秒間であった。一重項酸素の生成結果を図12に示す。コントロールはPBSである。本実施例に係るリポソームは、ローズベンガルやメチレンブルー溶液と比較しても高い一重項酸素の生成が確認された。
【0079】
(実施例7)
次に、実施例1で製造したリポソームを担癌マウスに投与し、超音波照射による抗腫瘍効果を調べた。担癌マウスは、健康な実験用マウスの後背部にColon26細胞を1×106cells/100μl注入して作成した。リポソームの投与は、Colon26細胞を実験用マウスに投与してから4日後に注入した。超音波の照射条件は、照射強度600W/cm2、周波数3.35MHz、照射時間120秒間であった。超音波照射後に、腫瘍径を計測した。一方で、超音波照射のみの場合と無処理の場合(リポソーム注入も、超音波照射もしていない場合)とについても、同様に作成した担癌マウスに同じ超音波条件で超音波照射して腫瘍径を計測した。この結果を図13に示す。図13に示すように、本実施例のリポソームを注入して超音波照射した場合は、腫瘍体積が著しく減少していることが判明した。
【0080】
次に、実施例1で製造したリポソームを担癌マウスに投与し、超音波照射による抗腫瘍効果を写真にて調べた。超音波の照射条件は、照射強度400W/cm2、周波数3.35MHz、照射時間120秒間であった。この結果を図14(a)及び(b)に示す。図14(a)は、超音波照射直後の照射部位の写真であり、図14(b)は、担癌マウスの摘出した肝臓の写真である。図14(a)及び(b)に示されるように、本実施例のリポソームを注入後、体外からのピンポイントの超音波照射により、照射部位の熱変性が確認された。これにより、本実施例のリポソームは、腫瘍組織の加熱凝固治療に有益であることが示された。一方、同様の担癌マウスに同じ超音波条件により超音波照射を行い、担癌マウスの肝臓を摘出して調べた。この結果を図14(c)に示す。超音波照射のみの場合は、本実施例の場合と比較して、加熱凝固治療の治療効果は不十分であった。
【符号の説明】
【0081】
100:パーフルオロ炭化水素内包ミセル
200:膜
300:リガンド
400:薬物
500:ガラスフィルター装置
520:薄膜
530:ナノフィルター
540:排出口
900:リポソーム
【特許請求の範囲】
【請求項1】
生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、前記パーフルオロ炭化水素を内包する生体親和性のミセルであるパーフルオロ炭化水素内包ミセルを形成するミセル化工程と、前記パーフルオロ炭化水素内包ミセルを内包するリポソームを形成するリポソーム形成工程とを有することを特徴とするリポソームの製造方法。
【請求項2】
前記リポソーム形成工程は、脂質の薄膜をナノフィルターの一方の面に貼り付け、分散液に分散させた前記パーフルオロ炭化水素内包ミセルを前記脂質の薄膜及び前記ナノフィルターを通過させることで、前記脂質をリポソーム膜とするリポソームを形成することを特徴とする請求項1記載のリポソームの製造方法。
【請求項3】
前記リポソームの外表面に、標的細胞、標的組織又は標的病巣に対するリガンドを結合させてリガンド修飾リポソームを得るリガンド結合工程を有することを特徴とする請求項1又は2記載のリポソームの製造方法。
【請求項4】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることを特徴とする請求項3記載のリポソームの製造方法。
【請求項5】
前記リガンド修飾リポソームに薬物及び遺伝子の少なくとも何れか一つを封入する封入工程を有することを特徴とする請求項3又は4記載のリポソームの製造方法。
【請求項6】
前記パーフルオロ炭化水素は、パーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロブタン、パーフロオロペンタン、パーフルオロヘキサン、パーフルオロヘプタン、及びパーフルオロオクタンの少なくとも何れか一つを含有することを特徴とする請求項1乃至5の何れか1項に記載のリポソームの製造方法。
【請求項7】
前記リポソーム形成工程は、前記脂質の薄膜及び前記ナノフィルターを通過することにより形成されたリポソームを、超高圧乳化分散機にて粒子径を減少させることを特徴とする請求項2記載のリポソームの製造方法。
【請求項8】
パーフルオロ炭化水素を内包する生体親和性のミセルを内包するリポソーム。
【請求項9】
リポソーム表面に、標的細胞、標的組織又は標的病巣に対するリガンドを有することを特徴とする請求項8記載のリポソーム。
【請求項10】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることを特徴とする請求項9記載のリポソーム。
【請求項11】
更に薬物及び遺伝子の少なくとも何れか一つを内包することを特徴とする請求項8乃至10の何れか1項に記載のリポソーム。
【請求項12】
請求項8乃至11の何れか1項に記載のリポソーム及び薬学的に許容される担体を含む腫瘍を治療するための医薬組成物。
【請求項1】
生体親和性且つ両親媒性のミセル外殻形成物質と、分散液と、パーフルオロ炭化水素とを含有する混合物を超高圧乳化分散機にて乳化分散させて、前記パーフルオロ炭化水素を内包する生体親和性のミセルであるパーフルオロ炭化水素内包ミセルを形成するミセル化工程と、前記パーフルオロ炭化水素内包ミセルを内包するリポソームを形成するリポソーム形成工程とを有することを特徴とするリポソームの製造方法。
【請求項2】
前記リポソーム形成工程は、脂質の薄膜をナノフィルターの一方の面に貼り付け、分散液に分散させた前記パーフルオロ炭化水素内包ミセルを前記脂質の薄膜及び前記ナノフィルターを通過させることで、前記脂質をリポソーム膜とするリポソームを形成することを特徴とする請求項1記載のリポソームの製造方法。
【請求項3】
前記リポソームの外表面に、標的細胞、標的組織又は標的病巣に対するリガンドを結合させてリガンド修飾リポソームを得るリガンド結合工程を有することを特徴とする請求項1又は2記載のリポソームの製造方法。
【請求項4】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることを特徴とする請求項3記載のリポソームの製造方法。
【請求項5】
前記リガンド修飾リポソームに薬物及び遺伝子の少なくとも何れか一つを封入する封入工程を有することを特徴とする請求項3又は4記載のリポソームの製造方法。
【請求項6】
前記パーフルオロ炭化水素は、パーフルオロメタン、パーフルオロエタン、パーフロオロプロパン、パーフロオロブタン、パーフロオロペンタン、パーフルオロヘキサン、パーフルオロヘプタン、及びパーフルオロオクタンの少なくとも何れか一つを含有することを特徴とする請求項1乃至5の何れか1項に記載のリポソームの製造方法。
【請求項7】
前記リポソーム形成工程は、前記脂質の薄膜及び前記ナノフィルターを通過することにより形成されたリポソームを、超高圧乳化分散機にて粒子径を減少させることを特徴とする請求項2記載のリポソームの製造方法。
【請求項8】
パーフルオロ炭化水素を内包する生体親和性のミセルを内包するリポソーム。
【請求項9】
リポソーム表面に、標的細胞、標的組織又は標的病巣に対するリガンドを有することを特徴とする請求項8記載のリポソーム。
【請求項10】
前記リガンドは、トランスフェリン、葉酸、ヒアルロン酸、糖鎖、モノクローナル抗体、モノクローナル抗体のFab'フラグメント、又はペプチドであることを特徴とする請求項9記載のリポソーム。
【請求項11】
更に薬物及び遺伝子の少なくとも何れか一つを内包することを特徴とする請求項8乃至10の何れか1項に記載のリポソーム。
【請求項12】
請求項8乃至11の何れか1項に記載のリポソーム及び薬学的に許容される担体を含む腫瘍を治療するための医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2010−260828(P2010−260828A)
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2009−113878(P2009−113878)
【出願日】平成21年5月8日(2009.5.8)
【出願人】(502198700)
【出願人】(509129989)
【出願人】(302015926)ネッパジーン株式会社 (5)
【Fターム(参考)】
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成21年5月8日(2009.5.8)
【出願人】(502198700)

【出願人】(509129989)

【出願人】(302015926)ネッパジーン株式会社 (5)
【Fターム(参考)】
[ Back to top ]

