リポタイコ酸由来の糖脂質及びこれを含む組成物
本発明は,リポタイコ酸由来の糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントに関する。
本発明によるリポタイコ酸由来の糖脂質は,炎症性サイトカインの生産を抑制することにより抗炎症効果を有するので,これを含む薬学,食品及び化粧品組成物を炎症性疾患の予防及び治療目的に使用することができ,これをワクチンアジュバントでも使用することができる。
本発明によるリポタイコ酸由来の糖脂質は,炎症性サイトカインの生産を抑制することにより抗炎症効果を有するので,これを含む薬学,食品及び化粧品組成物を炎症性疾患の予防及び治療目的に使用することができ,これをワクチンアジュバントでも使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は,リポタイコ酸由来の糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントに関する。
【背景技術】
【0002】
リポタイコ酸(LTA:Lipoteichoic acid)はグラム陽性菌の細胞壁成分の中の一つである。一般的に,リポタイコ酸は,グルコースまたはD−アラニン置換剤を有するポリグリセロールリン酸(Polyglycerolphosphate)及び糖単位と脂肪酸鎖を含む糖脂質の二つの構造体に区分され,この中でポリグリセロールリン酸のD−アラニン含量によってTNF−αのような炎症性サイトカインの発現が調節されると知られている(非特許文献1)。
【0003】
特に,スタフィロコッカス・アウレウス (Staphylococcus aureus)から分離したLTA(aLTA)の場合,グラム陽性菌から敗血症を誘発する物質として知られているが,aLTAは大食細胞のような兔疫細胞のToll−like
receptor2(TLR2)と細胞膜連関性CD14により認知されてNF−κB及びMAPキナーゼの活性を通じた炎症性サイトカインの発現増加を誘導する。
【0004】
しかし,乳酸菌であるラクトバチルス(Lactobacillus)から分離したLTAの場合,aLTAとは異なる免疫活性を有している(非特許文献2)。すなわち,aLTAは兔疫細胞から過度な炎症反応を誘導するが,ラクトバチルスから分離したLTAは兔疫細胞の炎症反応を抑制する作用をする。このようなLTAの免疫活性の差は二つのLTAの構造的な差に起因することが知られており,したがって,LTAの構造を分析することはLTAの機能を究明して免疫活性を調節することにおいて非常に重要である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Morath, S., A. Geyer, etal. 2001, Structure−function relationshipof cytokine induction by lipoteichoic acid from Staphylococcus aureus. J. Exp. Med. 193:393−397
【非特許文献2】de Vos, W. J. 2005. Lipoteichoic acid in lactobacilli: D−alanine makes the differences. Proc.Natl. Acad. Sci. USA 102 (31):10763−4
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は,抗炎症効果を有する糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントを提供することを目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するため,本発明は,リポタイコ酸由来の糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントを提供する。
【発明の効果】
【0008】
本発明によるリポタイコ酸由来の糖脂質は,炎症性サイトカインの生産を抑制することにより抗炎症効果を有するので,これを含む薬学,食品及び化粧品組成物を炎症性疾患の予防及び治療を目的として使用することができ,これをワクチンアジュバントとしても使用することができる。
【図面の簡単な説明】
【0009】
【図1】L. plantarum LTAの1H,13C及び2D−NMRスペクトラムを示す。
【図2】L. plantarum LTAのCOSYスペクトラムを示す。
【図3】L. plantarum LTAのHMQCスペクトラムを示す(A:オレフィン炭素に結合されたα-メチレンとメテレン,B:α−D−ガラクトースとα−D−グルコースのアノマー陽性子)。
【図4】LTA加水分解物のGC/MS分析結果を示す。
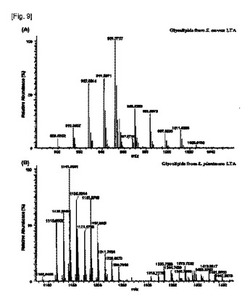
【図5】LTA糖脂質のMALDI−TOF MSスペクトラムを示す(A:S. aureus,B:L. plantarum)。
【図6】(A)aLTA及び(B)pLTAのIntact糖脂質及びO−アセチル化された糖脂質のMALDI-TOFMSスペクトラムを示す。
【図7】pLTAの糖脂質構造を示す。
【図8】pLTA糖脂質の質量を分析した表を示す。
【図9】(A)aLTA糖脂質及び(B)pLTA糖脂質のLTQ-Orbitrap FTMSスペクトラムを示す。
【図10】LTA糖脂質の陰イオンCIDスペクトラムを示す(A:ジヘキソシル−ジアシル−グリセロール,B:トリヘキソシル−ジアシル−グリセロール)。
【図11】aLTA糖脂質の質量を分析した表 を示す。
【図12】aLTAの脱アシル化された糖脂質のMALDI−TOF MSスペクトラムを示す(A:Intact糖脂質,B:NaOH処理した糖脂質,C:Ca(OH)2 処理した糖脂質)。
【図13】pLTA,dLTA,rLTA及びsLTAの糖脂質部位に対するMALDI−TOF分析結果を示す。
【図14】Intact aLTAとpLTA,これらから由来した糖脂質及びポリグリセロールリン酸のTNF−α発現誘導実験結果を示す。
【図15】Intact aLTA,de−alanine aLTA及びde−acyl aLTAの TNF−α発現抑制実験結果を示す。
【図16】Intact pLTA,de−alanine pLTA及びde−acyl pLTAのTNF−α発現抑制実験結果を示す。
【図17】pLTA由来の糖脂質を前処理した細胞でTNF−αの発現が減少することを示す。
【図18】相異なるLTAから分離した糖脂質のTNF−αの発現抑制効果を示す。
【図19】pLTA処理によるS. flexneriペプチドグリカン−誘導TNF−α及びIL−1βの発現抑制効果を示す(A:TNF−αの発現測定,B:IL−1βの発現測定,C:ポリミキシンB処理後のTNF−αの発現測定)。
【図20】S. flexneriペプチドグリカン−誘導炎症反応において,pLTA処理による(A)NOD2 mRNAの発現量の変化,(B)NOD2タンパク質の発現量の変化,及び(C)NF−κBの活性変化を示す。
【図21】S. flexneriペプチドグリカン−誘導炎症反応において,pLTA処理によるTNF−αの発現変化を測定した結果を示す(A:コントロールsiRNAを形質転換させたTHP−1細胞,B:TLR2 siRNAを形質転換させたTHP−1細胞,C:正常マウスから分離したBMM,D:TLR2ノックアウトマウスから分離したBMM)。
【図22】pLTA処理によるMAPキナーゼ及びNF−κBの活性の変化を示す(A:phosphor−ERK及びphosphor−SAPK/JNK活性,B:IκB−α分解活性,C:免疫蛍光染色法によるNF−κB活性測定)。
【図23】PBSまたはpLTAを腹腔注射した敗血症誘発マウスの(A)生存率及び(B)血液内のTNF−αの含有量を示す。
【図24】pLTAの処理による(A)DNCB−誘発アトピーマウスの皮膚病変及び(B)皮膚組織内のIL−4分布を示す。
【図25】rLTAを前処理した細胞においてTNF−αの発現が減少することを示す。
【図26】多様なLTAのTNF−αの発現抑制効果 を示す。
【図27】特定の信号抑制剤処理による多様なLTAのTNF−αの発現抑制効果を示す。
【発明を実施するための最良の形態】
【0010】
乳酸菌由来のリポタイコ酸は炎症性サイトカインの発現を抑制する抗炎症活性を誘導する。本発明者らは,本発明を通じて乳酸菌であるラクトバチルス・プランタラム(Lactobacillus plantarum)由来のリポタイコ酸(pLTA)が炎症反応を誘導するaLTAとは異なる糖脂質構造を有することを知見した。特に,pLTA自体だけではなく,pLTAのポリグリセロールリン酸部分を除去した糖脂質部分だけでも炎症性サイトカインの発現を抑制する抗炎症効果があることを証明することで本発明を完成した。すなわち,pLTAの糖脂質構造を基礎としてこれと類似な多様な糖脂質変異体を製造することにより,抗炎症効果を有する多様な糖脂質変異体を効果的に活用することができる。
【0011】
本発明は,α結合により結合された二重または三重ヘキソースのC1,C3,C4及びC6番位置の中でいずれか1ヶ所以上にC10乃至C30の飽和または不飽和された2乃至6個のアシル鎖が結合されている糖脂質を提供する。
【0012】
この時,前記ヘキソースは,グルコース,ガラクトース,マンノースまたはフルクトースであり,好ましくは,グルコースまたはガラクトースである。
【0013】
好ましくは,前記糖脂質は,一つ以上の不飽和されたアシル鎖を含む。
【0014】
本発明の一つの具体的な例において,前記糖脂質は,下記化学式(I)の構造を有する糖脂質である。
【0015】
【化1】

【0016】
前記式において,R1乃至R4は,各々独立的にヒドロキシ,または,下記の式である。
【0017】
【化2】

【0018】
この時,R’は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。nは,0または1であり,Cmは,C4乃至C30のアルキル,具体的には,C6乃至C26のアルキルまたはC10乃至C24のアルキルである。前記糖脂質内のアシル鎖の総数は,2乃至6,具体的には,2乃至4または2乃至3である。
【0019】
より具体的に,前記化学式(I)において,R1は下記の式である。
【0020】
【化3】

【0021】
この時,R'は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R2乃至R4は,ヒドロキシであり,nは,1であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0022】
また,具体的に,前記化学式(I)において,R1は,下記の式である。
【0023】
【化4】

【0024】
この時,R2,R3またはR4の中でいずれか一つは,下記の式であり,残りはヒドロキシである。
【0025】
【化5】

【0026】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。nは,1であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0027】
例えば,前記化学式(I)の糖脂質は,下記化学式(I−1)または化学式(I−2)の構造を有する糖脂質である。
【0028】
【化6】

【0029】
【化7】

【0030】
この時,前記化学式(I−1)または化学式(I−2)に示した二重結合の位置は変わることができる。
【0031】
本発明の他の具体的な例において,前記糖脂質は乳酸菌由来の糖脂質であり,前記乳酸菌は,これに制限されるのではないが,ラクトバチルス(Lactobacillus),ビフィドバクテリウム(Bifidobacterium),ストレプトコッカス(streptococcus)またはラクトコッカス(Lactococcus)属である。ラクトバチルスは,例えば,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei)であり,ビフィドバクテリウムは,例えば,ビフィドバクテリウム・
ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis)であり,ストレプトコッカスは,例えば,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)であり,ラクトコッカスは,例えば,ラクトコッカス・ラクティス(Lactococcus lactis)である。
【0032】
リポタイコ酸(LTA)の中で構造が一番よく知られているはストレプトコッカス・アウレウス(S. aureus)のLTA(aLTA)である。病原性微生物であるS.
aureus由来のaLTAは,免疫増強活性を誘導して炎症性サイトカインの発現を増加させる。下記化学式(III)に示したように,aLTAの主鎖(Backbone)は二つのグルコースがβ結合により結合されているゲンチオビオース(Gentiobiose)[β1→6結合]として知られており,グルコースのC6と1,3−ホスホジエステル結合されたポリグリセロールリン酸鎖が結合されている。また,平均15個の炭素を有する二つの飽和脂肪酸鎖(C15:0)がエステル結合によりグルコースのC1に結合されている。
【0033】
【化8】

【0034】
一方,乳酸菌であるpLTA由来のリポタイコ酸は,炎症性サイトカインの発現を抑制する抗炎症活性を誘導する。本発明により明らかにしたpLTA糖脂質の構造は,α結合により結合された三つのヘキソースを主鎖で有し,脂肪酸アシル鎖が結合されているヘキソースの反対側の末端ヘキソースのC6位置に,1,3−ホスホジエステル結合されたポリグリセロールリン酸鎖が結合されていることを特徴とする。また,pLTAの糖脂質は,一番目のヘキソースのC1またはC6位置に二つまたは三つの脂肪酸アシル鎖がエステル結合により結合されていることを特徴とする。pLTA由来の糖脂質は,具体的には,化学式(I−1)または化学式(I−2)の構造を有することができ,前記化学式において,二重結合の位置は変更可能である。化学式(I−1)は,ヘキソースのC1位置に炭素数18の飽和脂肪酸アシル鎖(C18:0)と炭素数18の不飽和脂肪酸アシル鎖(C18:2)とが結合されているpLTAのグループI糖脂質を示す。化学式(I−2)は,前記化学式(I−1)の糖脂質のヘキソースのC6位置に炭素数16の飽和脂肪酸鎖(C16:0)を追加で含むことで,pLTAのグループII糖脂質を示す。ヘキソースの結合,脂肪酸鎖の数,これらの結合位置,炭素数,及び不飽和脂肪酸の有無は,TLR2がリポタイコ酸を認知するにあって重要な役割をする。したがって,このような構造的特性がLTAの抗炎症活性を誘導する重要な要因になる。
【0035】
従来,リポタイコ酸のポリグリセロールリン酸のD−アラニン含量によって,TNF−αのような炎症性サイトカインの発現が調節されると知られているが,下記実施例によれば,pLTAの場合,ポリグリセロールリン酸のD−アラニンより脂肪酸アシル鎖を含む糖脂質構造体のほうが,炎症性サイトカインの発現調節において一層重要な役割をすることが分かった。本発明者らは,pLTA由来の糖脂質がそれ自体で炎症性サイトカインであるTNF−αの発現を抑制することで抗炎症効果を有することを突き止めた。pLTA由来の糖脂質以外にもpLTAと類似した構造を有するラクトバチルス・ラムノーサス(L. rhamnosus)由来のrLTA及びラクトバチルス・デルブルッキ(L. delbreukii)由来のdLTAの場合も同様に糖脂質部分だけで炎症性サイトカインであるTNF−αの発現を抑制することで抗炎症効果を有することを確認した。
【0036】
また,本発明は,アシル鎖が結合されているヘキソースの反対側末端ヘキソースのC6位置にポリグリセロールリン酸が追加で結合された糖脂質を提供する。
【0037】
本発明の一つの具体的な例において,前記糖脂質は,下記化学式(II)の構造を有する糖脂質である。
【0038】
【化9】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,または,下記の式である。
【0039】
【化10】

【0040】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。
R’’は,各々独立的にN−アセチルグルコサミン(N−acetylglucosamine),D−アラニン(D−alanine)またはヒドロキシである。nは,0または1であり,Cmは,C4乃至C30のアルキル,具体的には,C6乃至C26のアルキルまたはC10乃至C24のアルキルである。lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20である。前記糖脂質内のアシル鎖の総数は,2乃至6,具体的には,2乃至4,または2乃至3である。
【0041】
具体的に,前記化学式(II)において,R1は,下記の式である。
【0042】
【化11】

この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,R2乃至R4は,ヒドロキシである。nは,1であり,lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0043】
また,具体的に,前記化学式(II)において,R1は,下記の式である。
【0044】
【化12】

この時,R2,R3またはR4の中でいずれの一つは,下記の式であり,残りはヒドロキシである。
【0045】
【化13】

【0046】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシである。nは,1であり,lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0047】
例えば,前記化学式(II)は,下記化学式(II−1)または化学式(II−1)である。
【0048】
【化14】

【0049】
【化15】

【0050】
前記式において,R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,lは,0乃至80,具体的には,0乃至60,0乃至40または0乃至20である。
【0051】
また,前記化学式(I−1)または化学式(I−2)に示した二重結合の位置は変更可能である。
【0052】
本発明の一つの具体的な例において,ポリグリセロールリン酸が追加で結合された糖脂質は,乳酸菌由来のリポタイコ酸であり,前記乳酸菌は,これに制限されるものではないが,ラクトバチルス(Lactobacillus),ビフィドバクテリウム(Bifidobacterium),ストレプトコッカス(streptococcus)またはラクトコッカス(Lactococcus)の属である。ラクトバチルスは,例えば,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei)であり,ビフィドバクテリウムは,例えば,ビフィドバクテリウム・
ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum), ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis)であり,ストレプトコッカスは,例えば,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)であり,ラクトコッカスは,例えば,ラクトコッカス・ラクティス(Lactococcus lactis)である。
【0053】
また,本発明は,前記糖脂質を含む薬学組成物を提供する。
【0054】
本発明による糖脂質は,下記実施例を通じて分かるように,耐性毒素LPS刺激によるNF−kBの活性及びIkB−αの分解を抑制してTLR2の発現を抑制することで,炎症性サイトカインTNF−α及びIL−8の発現を抑制する抗炎症効果を有する。
【0055】
本発明による糖脂質を含む薬学組成物は,通常的な方法によって,散剤,顆粒剤,錠剤,カプセル剤,懸濁液,乳剤,シロップ,エアロゾルの経口製剤,外用剤,坐剤または滅菌注射液剤の形態で剤形化して使用することができ,薬学組成物の製造に通常的に使用する適切な抗生剤,担体,賦形剤及び希釈剤からなる群より選択される一つ以上の添加剤をさらに含む。
【0056】
具体的に,担体,賦形剤及び希釈剤では,ラクトース,デキストロース,スクロース,ソルビトール,マンニトール,キシリトール,エリスリトール,マルチトール,澱粉,アカシアゴム,アルギン酸,ゼラチン,リン酸カルシウム,ケイ酸カルシウム,セルロース,メチルセルロース,マイクロクリスタリンセルロース,ポリビニルピロリドン,水,メチルヒドロキシベンゾエート,プロピルヒドロキシベンゾエート,タルク,ステアリン酸マグネシウム及び鉱物油を使用することができ,製剤化する場合には,一般的に使用する充填剤,増量剤,結合剤,湿潤剤,崩壊剤,界面活性剤などの希釈剤または賦形剤を使用して調剤することができる。経口投与のための固形製剤には,錠剤,丸剤,散剤,顆粒剤,カプセル剤などが含まれ,このような固形製剤は,前記抽出物に少なくとも一つ以上の賦形剤,例えば,澱粉,炭酸カルシウム,スクロースまたはラクトース,ゼラチンなどを混ぜて調剤することができる。また,単純な賦形剤の以外に,ステアリン酸マグネシウム,タルクのような潤滑剤も使用できる。経口のための液状製剤では,懸濁液,内用液剤,乳剤,シロップ剤などがあり,よく使われる単純希釈剤である水,流動パラフィン以外にさまざまな賦形剤,例えば湿潤剤,甘味剤,芳香剤,保存剤などが含まれる。非経口投与のための製剤には,滅菌された水溶液,非水性溶剤,懸濁剤,乳剤,凍結乾燥製剤,坐剤などが含まれる。非水性溶剤,懸濁剤では,プロピレングリコール,ポリエチレングリコール,オリーブオイルのような植物性油,オレイ酸エチルのような注射可能なエステルなどを使用することができる。坐剤の基剤では,ウィテップゾール(witepsol),マクロゴ−ル, ツイーン(tween)61,カカオ脂,ラウリン脂,グリセロールゼラチンなどを使用することができる。
【0057】
本発明による薬学組成物において糖脂質は,薬学組成物100重量部に対して0.01乃至99.9重量部,0.1乃至90重量部,1乃至80重量部,または10乃至80重量部で含むことができるが,これに制限されるのではなく,患者の状態,疾患の種類及び進行程度によって変更することができる。
【0058】
本発明による糖脂質は,抗炎症活性を有する炎症性疾患または免疫関連疾患の予防及び治療に使用することができる。したがって,本発明は前記糖脂質を含む炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物,炎症性疾患または免疫関連疾患の予防及び治療用医薬の製造のための前記糖脂質の用途及び治療上有効量の糖脂質を対象体に投与する段階を含む炎症性疾患の予防及び治療方法を提供する。
【0059】
具体的に,前記炎症性疾患または免疫関連疾患には,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症候群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患などがある。
【0060】
本発明の一つの具体的な例において,前記糖脂質は,経口,直腸または静脈,筋肉,皮下,子宮内硬膜または脳室内(intracerebroventricular)注射により対象体に投与することができる。
【0061】
本発明による糖脂質の投与量は,患者の状態及び体重,疾患の種類及び程度,薬物形態,投与経路及び期間によって変更可能であり,当業者が適切に選択することができる。しかし,1日投与量は,0.01乃至10,000mg/kg,具体的には,0.1乃至10,000mg/kg,より具体的には,0.1乃至1,000mg/kgであることが好ましい。投与は,一日一回投与するか数回に分けて投与することができ,これによって本発明の範囲が制限されるのではない。
【0062】
本発明において,「対象体」とは,人間,オランウータン,チンパンジー,マウス,ラット,犬,牛,ニワトリ,豚,山羊,羊などを含むが,これらの例に限定されるのではない。
【0063】
また,本発明は前記糖脂質を含む食品組成物を提供する。前記食品組成物は,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症侯群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患などの炎症性疾患,または免疫関連疾患の予防及び治療効果がある機能性食品及び一般食品の製造に使用することができる。
【0064】
本発明の一つの具体的な例において,前記食品組成物は,これに制限されるものではないが,有機酸,リン酸ナトリウム,抗酸化剤,乳糖カゼイン,デキストリン,葡萄糖,砂糖及びソルビートルからなる群より選択される一つ以上の添加剤を追加で含むことができる。有機酸は,これに制限されるのではないが,クエン酸,フマル酸,アジピン酸,乳酸またはりんご酸であり,リン酸塩は,これに制限されるものではないが,リン酸ナトリウム,リン酸カリウム,酸性{さんせい}ピロリン酸ナトリウムまたはポリリン酸ナトリウム(重合リン酸ナトリウム)であり,抗酸化剤は,これに制限されるものではないが,ポリフェノール,カテキン,α−トコフェロール,ローズマリー抽出物,甘草抽出物,キトサン,タンニン酸またはフィチン酸などの天然抗酸化剤である。
【0065】
本発明において,糖脂質は,食品組成物100重量部に対して0.01乃至99.9重量部で含むことができ,具体的には,1乃至90重量部または30乃至80重量部で含まれる。
【0066】
また,本発明の一つの具体的な例において,食品組成物の剤形は,これに制限されるものではないが,固形,粉末,課粒,錠剤,カプセルまたは液状形態である。
【0067】
本発明による糖脂質を含む食品組成物は,これに制限されるものではないが,菓子類,糖類,アイスクリーム製品類,乳加工品,食肉製品,魚肉製品,豆腐類または寒天類,食用油脂類,麺類,茶類,飲料類,特殊栄養食品,健康補助食品,調味食品,氷,人参製品類,キムチづけ食品,干し肉類,果物,野菜,果物または野菜の乾燥製品,切断製品,果物ジュース,野菜ジュース,これらの混合ジュース,チップス類,麺類,畜産加工食品,水産加工食品,乳加工食品,発酵類食品,豆類食品,穀類食品,微生物発酵食品,製菓製パン,味付け類,肉加工類,酸性飲料水,甘草類,ハーブ類などの食品製造に使用することができる。前記食品の形態は,これに制限されるものではないが,固形,粉末,顆粒,錠剤,カプセル,液状または飲料形態を含む。
【0068】
本発明の他の具体的な例において,前記糖脂質を含む組成物を健康機能食品の製造に使用する場合には,全体食品重量の0.01乃至15重量%で使用することができ,飲料の製造に使用する場合には,全体飲料重量の0.02乃至10重量%,または0.3乃至1 重量%で使用することができる。
【0069】
本発明による食品組成物には,前記糖脂質の以外にもさまざまな栄養剤,ビタミン,鉱物(電解質),合成風味剤及び天然風味剤などの風味剤,着色剤及び増進剤(チーズ,チョコレートなど),ペクト酸及びその塩,アルギン酸及びその塩,有機酸,保護性コロイド増粘剤,pH調節剤,安定化剤,防腐剤,グリセリン,アルコール,炭酸飲料に使われる炭酸化剤などを添加することができる。また,本発明による食品組成物には,天然果物ジュース,果物ジュース飲料及び野菜飲料の製造のための果肉を添加することができる。このような添加剤の割合は,これに制限されるものではないが,一般的に本発明の組成物100重量部当たり0乃至約20
重量部の範囲で選択する。
【0070】
また,本発明は,前記糖脂質を含む化粧品組成物を提供する。
【0071】
本発明において,糖脂質は,化粧品組成物100重量部に対して0.01乃至99.9重量部で含むことができ,具体的には,1乃至90重量部または30乃至80重量部で含むことができる。
【0072】
本発明による化粧品組成物が使われる化粧品は,その剤形において,これに限定されるものではないが,例えば,柔軟化粧水,栄養化粧水,マッサージクリーム,栄養クリーム,パック,ジェル,エッセンス,リップスティック,メーキャップベース,ファウンデーション,ローション,軟膏,ゲル,クリーム,クレンジング,洗顔剤,せっけん,シャンプー,リンス,トリートメント及び美容液などを含む。このような化粧品は,水性ビタミン,油性ビタミン,高分子ペプチド,高分子多糖,スフィンゴ脂質などの通常の成分を含むことができ,これは当業者に広く知られた技術によって容易に製造できる。
【0073】
また,前記成分とともに化粧品に通常使用される添加剤,例えば,ビタミン,アミノ酸,タンパク質,界面活性剤,乳化剤,香料,色素,安定剤,防腐剤,抗酸化剤,紫外線遮断剤,pH調整剤及びキレート剤からなる群より選択される一つ以上の添加剤を追加で含むことができる。
【0074】
また,本発明は,前記糖脂質からなるか,それを含むワクチンアジュバントを提供する。
【0075】
本発明による糖脂質は多様な目的で利用することができる。その一つの好ましい用途は,免疫原性ポリヌクレオチド(immunogenic polynucleotide),ポリペプチド,抗体,T−細胞,または抗原−提供細胞(APC)を含む医薬組成物用の免疫刺激剤またはアジュバントとして使用されることである。
【0076】
アジュバントワクチンは,より早い抗体形成を誘導することで抗原に対する免疫反応を強化させる気質を意味する。本発明による糖脂質は,炎症性サイトカインの発現に影響を与えるだけではなく,付着分子(adherent molecule)の発現など免疫作用にも影響を与えることで,抗原に対する免疫反応を増加させることができる。また,それ自体として免疫原性(immunogenicity)がないためワクチンアジュバントで使用することができる。
【0077】
本発明による糖脂質が刺激できる一つの免疫反応はTh1またはTh2類型であり,したがって,本発明によるアジュバントは,Th1またはTh2類型の免疫反応を優占的に誘導するようにデザインすることができる。高濃度のTh1−類型サイトカイン(例えば,TNF−α,IFN−N−γ,IL−2及びIL−12)は,投与された抗原に対する細胞媒介された免疫反応の誘導を助力する傾向がある。対照的に,高濃度のTh2−類型サイトカイン(例えば,IL−4,IL−5,IL−6,IL−10及びTNF−β)は,体液性免疫反応の誘導を助力する傾向がある。本発明による糖脂質を含むワクチンを適用した患者は,Th1−及びTH2−類型の反応を含む免疫反応を維持することができる。反応が主にTh1−類型である場合,Th1−類型サイトカインの濃度はTh2−類型サイトキンの濃度より大きく増加する。これらサイトカインの濃度は,標準分析法を利用して容易に評価できる。サイトカインファミリーの調査のために文献[Mosmann and Coffman, Ann. Rev. Immunol. 7:145−173,1989]を参照することができる。また,(CpGディヌクレオチドが非メチル化された)CpG−含有オリゴヌクレオチドが主にTh1反応を誘導するが,このようなオリゴヌクレオチドはよく知られており,例えば,WO1996/02555号公報に記述されている。
【0078】
好ましくは,優勢なTh1またはTh2類型反応を誘導するために使用するアジュバントは,アルミン酸塩と一緒に前記糖脂質を含む。
【0079】
以下,本発明の好ましい実施の形態について詳細に説明する。下記実施例は,本発明の内容を例示するのみで,本発明の範囲が下記実施例に限定されるのではない。本発明の実施例は,当業界で平均的な知識を有した者に本発明をより詳細に説明するために提供されるものである。
【0080】
<実験例>
下記実験例は,本発明による各々の実施例に共通的に適用される実験例を提供するものである。
【0081】
LTA及びLTA由来糖脂質とポリグリセロールリン酸の分離・精製
LTAの分離は,既存に報告された(Morath, S., A. Geyer, et al. 2001. Structure−function relationship of cytokine induction by lipoteichoic
acid from Staphylococcus aureus. J. Exp. Med. 193(3):393−7.)方法を参考して実行した。100gの細胞(wet weight)を0.1Mクエン酸ナトリウムバッファー(pH4.7)400mlで懸濁させた後,超音波処理して細胞を破砕した。同量のn−ブタノールを添加して30分間混ぜた後,遠心分離を通じてLTAが含まれた収容層を分離した。15%n−プロパノールと0.1Mクエン酸ナトリウムバッファー(pH4.7)を添加してLTA切片を分離した後,半透過膜を利用して透析した。以後,オクチル−セファロースカラムCL−4B(2.5cm x10cm)を利用した疎水性相互作用クロマトグラフィーを実行した。15%n−プロパノールと0.1M酢酸ナトリウムバッファー(pH4.7)が含まれたバッファー200mlを利用してカラムを清浄した後,300mlの溶出バッファー(35%n−プロパノール,0.1M酢酸ナトリウム,pH4.7)を利用してLTAを採集した。LTAが含まれた切片は,さらにDEAE−セファロースイオン交換クロマトグラフィー(1.5cmx10cm)のために平衡バッファー(30%n−プロパノール,0.1Mアセテートバッファー,pH4.7)を添加した後カラムに充填した。300mlの一連のNaCl(0〜1M)が含まれた平衡バッファーを利用してLTAを採集した。
【0082】
LTA由来糖脂質の分離は,30mgのIntact
LTAを500mlの98%(v/v)酢酸水溶液に溶かした後,30分間超音波処理して100℃で3時間の間加熱して実行した。vacuumを利用して溶媒を除去した後,クルロロホルム/メタノール/水(1:1:0.9, v/v/v)を利用して糖脂質を分離した。糖脂質は有機層から抽出し,ポリグリセロールリン酸は溶媒層から抽出した。
【0083】
核磁気共鳴(NMR)分光法
NMR実験は,x,y,z−shielded gradient
triple resonanceプローブまたはz−shielded gradient triple resonance cryoプローブを備えているAvance−600MHzとAvance−800MHz高解像度NMR分光器を使用した。10mgのLTAを0.5mlの2H2O溶液に溶かした。2H2Oは基準信号(4.75ppm,1H)で使用した。Homonuclear assignmentは,correlation spectroscopy(COSY),double−quantum filtered correlation
spectroscopy(DQF−COSY),total correlation
spectroscopy(TOCSY),rotating frame
Overhauser enhancement spectroscopy(ROSEY)スペクトラムから得た。13Cassignmentは,heteronuclear multiple−quantum
correlation(HMQC)とheteronuclear
multiple−bond correlation(HMBC)実験に基礎した。すべてのスペクトラムは300Kで記録し,NMRデータはprograms
nmrPipe28を利用して処理しSparkyを使用して視覚化した。
【0084】
糖脂質のマイルドアルカリ加水分解(Mild alkaline hydrolysis)
糖脂質mild alkali−labile componentを結晶するために50μgの試料を200μlの0.5M
NaOHを利用して56℃で60分間溶解した。以後,3 N HClを利用して酸性化させた後ヘクサン(hexane)と混ぜた。脂肪酸が含まれている上層液を除去した後,塩を除去するために下層液を乾燥させた。残基をクルロロホルム/メタノール/水(8:4:3,v/v) 溶液で区画させた後,遠心分離を通じて層を分離して上層液を除去した。また,塩を除去するために下層液を乾燥させた後,残基をクルロロホルム/メタノール(1:1:,v/v)溶液に溶かした後にMALDI−TOF MS分析に使用した。
【0085】
エキソグリコシダーゼ(Exoglycosidase) 処理
糖脂質を0.1%タウロデオキシコール酸ナトリウム(Sodium Taurodeoxycholate)を含む50μlの50mM NH4HCO3バッファーで懸濁した後,α−グルコシダーゼ(Saccharomyces cerevisiae),β−グルコシダーゼ(アーモンド),α−ガラクトシダーゼ(コーヒー生豆),またはβ−ガラクトシダーゼ(E. coli)を添加して37℃で48時間処理した。その後,クルロロホルム:メタノール(1:1,v/v)1.35mlと100μlのDWを添加して層を分離し,下層を乾燥させて連鎖分析(linkage
analysis)した。
【0086】
MALDI−TOF MS
0.5μlの糖脂質溶液をマトリクス溶液(2,5−ジヒドロキシ安息香酸溶液,30mg/ml in 70%アセトニトリル/30%水[v/v],0.5μl)に添加した後,MALDIプローブに適用した。精製された糖脂質を直接またはO−アセチル化した後,MALDI−TOF
MSを通じて分析した。精製された糖脂質を80℃で2時間の間ピリジン:無水酢酸(1:1,v/v)200μlでO−アセチル化させた。その後,溶媒を除去した後,MALDI−TOF
MSで分析を行った。
【0087】
フッ化水素酸を利用したLTAの部分的加水分解
ポリグリセロールリン酸主鎖の部分的または完璧な加水分解のために,1mgのLTAを100μlの48%フッ化水素酸(HF)に添加した後,4℃で5〜48時間処理した。その後,飽和された水酸化{すいさんか}リチウム(LiOH)で中和させた後,遠心分離(12,000xg,10min)を通じて沈殿物を除去した。上層液を収集してTLC及びESI−LIT
MS分析に使用した。
【0088】
ガスクロマトグラフィー/質量分析法(GC/MS)
LTA加水分解物から単糖類構成を分析するためにGC/MS分析を行った。標準化合物(Authentic reference compound)(ガラクトース,グルコース,マンノース,N−アセチルグルコサミン)またはLTA加水分解物の試料をピリジンに溶かした後,常温で48時間放置した。50μlのトリメチルシリルイミダゾールを添加した後,67℃で30分間加熱した。試料を200μlのクルロロホルムで溶かした後,Finnigan MAT system(ガスクロマトグラフィーモデルGCQ,HP19091J−433)に適用した。試料をnonplar capillary column(5%phenyl
methyl siloxane capillary30mx250μm i.d., 0.25μm film thickness,HP−5)に適用した。カラムを100℃で2分間置いた後,分当り4℃の速度で220℃まで増加させて5分間維持した。以後,分当り15℃の速度で300℃まで増加させて5分間維持した。質量分析計は,85℃のイオン試料温度,65eVの電子エネルギー,300mAの放出電流(emission
current)を有する陽イオン化学イオン化モード(positive
ion chemical ionization mode)下で使用した。分析ガス(analyte gas)ではメタンを使用し,0.5torrを維持した。
【0089】
糖脂質の脂肪酸構成は,0.1μgのトリデカン酸を200μgのLTA試料に添加した後,4 N KOH(100℃,4時間)で加水分解することで結晶した。加水分解物のpHを1に近くした後,自由脂肪酸をクルロロホルム(3times,1ml)で抽出した後,N2ガスで乾燥させた。乾燥された脂肪酸をアセトニトリル(30μl)で溶かした後,35%臭化ペンタフルオロベンジル(アセトニトリル添加)10μlとジイソプロピルエチルアミン(10μl)で処理した。溶液を40℃で20分間加熱した後,N2気体で乾燥させた。結果物であるペンタフルオロベンジルエステルをN,O−ビス(トリメチルシリル)-トリフルオロアセチルアミドでO/N処理した。カラムは,85℃を維持し,1分当たり7℃の速度で265℃まで温度を上昇させた後10分間維持した。ヒドロキシ脂肪酸の量はベースピークイオンの選択イオン検出方法を使用して結晶し,トリデカン酸の内部標準方法を使用して抽出物損失を補正した。
【0090】
薄層クロマトグラフィー(TLC)
糖脂質分析のために,pre−coated silica
gel HPTLCプレート上でクルロロホルム−メタノール−酢酸−水(100:20:12:5,v/v/v/v)を利用して実行した。TLC上の糖脂質は,5%硫酸を処理した後,120℃で加熱して検出した。
【0091】
グリセロールリン酸の分析のために,n−ブタノール−ピリジン−水(15:30:20,v/v/v)を利用してTLCを実行した。TLC上でアラニンと糖置換体を検出するために,各々0.5%ニンヒドリン(ブタノール添加)と,5%硫酸(メタノール添加)を使用した。以後,グリセロールリン酸を120℃で加熱して可視化させた。TLCプレートから可視化されたスポット(spot)を集めた後,メタノールを使用してシリカゲルパウダーから試料を抽出してMS分析に使用した。
【0092】
ESI−LIT MS
Ultimate 3000 nano LC coupled
to a LTQ-Orbitrap hybride linear ion trap質量分析計を利用して液体クロマトグラフィー−二重質量分析を実行した。5μlの試料を注入した後,Ultimate 3000 nano LCを利用してZorbax 300 Extended−C18カラム(3.5μm,0.3mm i.d x 150length)に注入した。移動相Aは,0.1%のギ酸(Formic acid)を含む100%水であり,移動相Bは,0.1%ギ酸を含んでいる100%アセトニトリルである。分離はC18カラムを使用した。LCシステムから分離された試料は,エレクトロスプレーイオン化法(ESI)を使用して分析した。試料溶液は高圧(5kVグリセロールリン酸及び4.5kV糖脂質)でメタルキャピラリー(metal capillary)を通じて分当り3μlの速度でイオンソース(ion source)中に注入した。キャピラリー温度は180℃を維持し,シースガス(at a flow rate of 8 arbitrary)として窒素を使用した。分析器機は陰イオンモードで作動させた。イオンエントランスキャピラリー電圧(ion entrance capillary voltage)とチューブレンズオフセット(tube lens offset)は−45Vと−26Vである。MSn破砕(fragmentation)のために35〜37%の標準衝突エネルギー(normalized collision energy)と2.5〜3Daの分離幅(isolation
width)を使用した。最大イオン収集 時間(maximum ion
collection
time)は50msに設定して,3個のマイクロスキャンを利用して平均値を求めた。
【0093】
<実施例 1>
LTA及びLTA糖脂質の構造分析
1H,13C及び2D−NMRスペクトラムによるpLTAの全体的な構造究明
aLTAの1H−NMRスペクトラムにおいて,α−D−N−アセチルグルコサミン(GlcNAc)のアセチル基の共鳴信号(resonance
signal)が化学シフト(chemical shift)(δH)2.1であると報告された。しかし,pLTAの1H−NMRスペクトラムにおいて,
化学シフト(δH)2.1でのピーク形状はaLTAとは異なる様相を見せた。pLTAの共振形状はaLTAに比べて一層広く分布し,自由アセチル基(δH1.9)からの信号は見られなかった(図1)。COSYスペクトラムを利用して分析した結果,δH2.01が(γ−ω)−メチレン−(−CH2-;δH1.28)とオレフィン陽性子(−CH=CH−; δH5.38)と関連があることを確認した(図2)。また,HMQCスペクトラムの分析結果,δH2.01での陽性子がメチレン(CH2; δC27)から割り当てられたことを確認した(図3A)。COSYとHMQCスペクトラム分析に基礎する際,化学シフト(δH)2.01は,脂肪酸にあるアルケニル炭素(−CH2−CH2−CH=CH−CH2−CH2−)に付いているメチレンの信号であることを確認した。結果的に,pLTAはグリセロールリン酸主鎖にGlcNAc置換剤を全く有していないことが分かった。
【0094】
不飽和脂肪酸の存在もδH2.01(CH2−CH=CH)とδH5.38(CH=CH)の信号の相互関係を通じて究明した(図2)。また,1H及び13C
NMRスペクトラムの二つのアノマー陽性子信号[δH5.08(d,J=Hz)及び5.17(d,J=3Hz)]と,二つのアノマー炭素信号[δc96.5及び97.7ppm)とを通じて糖脂質に二つの糖単位が存在することを確認した。糖の測定は,LTA加水分解物のGC/MS分析を通じて実行し(図4),pLTAの糖脂質がグルコースとガラクトースのような糖に置換されたことを確認した。最後に,二つの糖単位のアノマーのJ値(J value)は,D−ピラノースのアノマー中心がα方向であることを示し,δH5.08と5.17の信号は,各々δc96.5と97.7で共鳴するアノマー炭素に相応するα−D−グルコースとα−D−ガラクトースのアノマー陽性子であることを確認した(図3B)。これを通じてpLTAの糖脂質のヘキソースがα結合により結合されていることが分かった。
【0095】
pLTAの糖脂質構造分析
LTAの糖脂質試料をMALDI−TOF MS方法を通じて分析した。
pLTAの糖脂質の質量スペクトラムは二つのグループに分けられる(図5B)。グループIのイオン信号はm/z1103からm/z1227の範囲であり,グループIIではm/z1368からm/z1464の範囲であった。グループIに属する糖脂質は,トリヘキソシル−ジアシル−グリセロール(Hex3−DAG)で判明されたが,C16からC22のアシル鎖を有している。グループIIの糖脂質は,追加的なヘキソース残基またはアシル鎖を有していた。追加的なヘキソース残基は糖脂質のO−アセチル化を通じて確認した(図6A)。
【0096】
ヒドロキシル残基のアセチル化は42質量単位の増加を誘発する。pLTAのグループI糖脂質は,420質量単位(10ヒドロキシル残基)の増加を見せ,トリヘキソースグループであると判明した(図6B)。また,グループIIにある大部分の糖脂質が378質量単位(9ヒドロキシル残基)ほど増加した。O−アセチル化分析によれば,グループIIの糖脂質はヘキソース残基に追加的なアシル鎖を有することが分かる(図7)。
【0097】
追加的に,スペクトラムで12質量単位の差を見せたが,これはアルケニル炭素の追加または減少を意味するもので,糖脂質が不飽和脂肪酸鎖を有していると判断できる。このような可能性はCOSY
NMRを通じて確認した(図2)。pLTA糖脂質の分子構成に対する予測は,図8に示した。次に,二重MS分析のために,ESI−FT
MS(陰イオンモード)を利用して糖脂質を分析し(図9),そこから代表的なピークを選択・分析してアシル鎖の分布を決定した(図10A及び図10B)。
【0098】
結果的に,pLTAの糖脂質の構造は,図9に示したように,三つのヘキソース主鎖を有しており,不飽和脂肪酸を含むトリヘキソシル−ジアシルグリセロール(グループI)とトリヘキソシル−トリアシルグリセロール(グループII)となっており,アシル鎖は平均18個の炭素数を有することが分かる。
【0099】
aLTAの糖脂質構造分析
aLTAの場合,糖脂質の質量対電荷(m/z)の割合がC15からC21の鎖長さを有する脂肪酸であることを確認した(図5A,図11)。aLTAの糖脂質において大部分のm/z信号は294質量単位が増加した。これは7個のヒドロキシルグループのアセチル化が発生したことを意味するもので,二つのヘキソースに該当する。結果的に,aLTAの糖脂質はジヘキソシルグループを有していることと判明した。また,糖脂質の脂肪酸アシル鎖の存在はマイルドアルカリ加水分解を通じて確認することができた(図12)。
【0100】
dLTA,rLTA及びsLTAの糖脂質構造分析
dLTA,rLTA及びsLTAの糖脂質部位の構造を分析するためにMALDI−TOF分析を実行した。dLTAはラクトバチルス・デルブルッキ(L. delbreukii),rLTAはラクトバチルス・ラムノ−サス(L. rhamnosus),sLTAはラクトバチルス・サケイ(L. sakei)由来のLTAを各々示す。
【0101】
図13に示したように,MALDI−TOF分析結果,dLTA由来糖脂質は,pLTAと同様にトリヘキソシル−ジアシルグリセロールとトリヘキソシル−トリアシルグリセロールを有する二つのグループに分けられ,それ以外にも四つのアシル鎖を有する三番目のグループが存在することが観察された。また,アシル鎖の平均炭素数は18個であることが観察された。rLTA由来糖脂質は,pLTAより全体的に分子量が少ない二つのグループに観察された。糖一つの分子量が160Daなので三つのヘキソースではない二つのヘキソース主鎖からなるジヘキソシル−ジアシルグリセロールとジヘキソシル−トリアシルグリセロールを有することが観察された。アシル鎖の平均炭素数は15個であった。sLTA由来糖脂質もジヘキソシル−ジアシルグリセロールとジヘキソシル−トリアシルグリセロールとして,平均炭素数が18個でアシル鎖の長さがrLTAより長いことが観察された。
【0102】
<実施例2>
LTA由来糖脂質の抗炎症効果
LTA由来糖脂質のTNF−α発現抑制効果
Intact LTA,これから分離したLTA由来糖脂質及びLTA由来ポリグリセロ−ルリン酸を各々100μg/mlずつTHP−1細胞に4時間の間処理した後,培養液からTNF−αの発現量をELSIA方法を通じて測定した。
【0103】
図14に示したように,Intact aLTAは,高いTNF−αの発現を誘導したが,Intact pLTAはTNF−αの発現を誘導しなかった。また,aLTA由来の糖脂質及びポリグリセロールリン酸もIntact
aLTAより発現量は少ないがTNF−αの発現をかなり誘導したが,pLTA由来の糖脂質及びポリグリセロールリン酸は,TNF-αの発現をほとんど誘導しなかった。これを通じてIntact pLTAだけではなくpLTA由来の糖脂質もaLTAと異なりTNF-αの発現を誘導しないことが分かる。
【0104】
LTA変形による抗炎症効果実験
aLTA及びpLTAを変形(modification)した後,活性を測定するための実験を実行した。まず,ポリグリセロールリン酸のD−アラニンを除去するためにTris-HClpH8.5にLTAをO/Nで培養した。また,糖脂質の脂肪酸アシル鎖を除去するために0.1N NaOHを使用してLTAを処理した。以後,pHを中和させた後,オクチルクロマトグラフィーを利用して変形されたLTAを精製し,凍結乾燥した後に定量して実験に使用した。THP−1細胞に100μg/mlのD−アラニンを除去したLTA(de−alanine)と,脂肪酸アシル鎖を除去したLTA(de−acyl)と,を18時間前処理した後に,0.5μg/mlのLPSを4時間再処理した。以後,培養液からTNF-αの発現程度をELISA方法を通じて測定した。
【0105】
図15は,aLTAを利用した実験結果を示す。aLTAの場合,Intact
aLTAを前処理したTHP−1細胞でLPSによるTNF−α発現を抑制する効果が多少あったが,D−アラニンと脂肪酸アシル鎖を除去したaLTA(de−alanine,de−acyl)はほとんどこのような効果がなかった。
【0106】
図16は,pLTAを利用した同一な実験の実行結果を示す。aLTAと異なりIntact
pLTAはLPSによるTNF-αの発現を大部分抑制し,ポリグリセロールリン酸アラニンを除去したpLTA(de−alanine)の場合にも同一な効果を示した。しかし,糖脂質のアシル鎖を除去したpLTA(de−acyl)はTNF−αの発現抑制効果を見せなかった。
【0107】
このような結果は,aLTAとpLTAがお互いに異なる生物学的特性を有していることを示し,特に,pLTAのTNF−α発現抑制効果において,ポリグリセロールリン酸内のD−アラニンよりは糖脂質のアシル鎖のほうが一層重要に作用していることを示す。
【0108】
pLTA由来糖脂質の抗炎症効果
pLTAから分離した糖脂質の抗炎症効果を調べるために,THP−1細胞に多様な濃度の糖脂質を20時間の間前処理した後,10μg/mlのflexPGNを4時間の間再処理した。以後,培養液からTNF−αの発現程度をELISA方法を通じて測定した。
【0109】
図17に示したように,10μg/mlのflexPGNだけを処理した細胞の場合,高濃度のTNF-α発現を誘導した。しかし,糖脂質を前処理した細胞において前処理濃度によってTNF−αの発現が減少することを観察した。このような発現抑制効果は,同一な濃度のIntact
pLTAに比しては多少低いが,pLTAの糖脂質部位だけでも十分なTNF-αの発現抑制効果を誘発することを示す。
【0110】
他のLTA由来糖脂質の抗炎症効果
THP−1細胞(5×105cells/ml)にLPS(LPS from
E. coli 111:B4)と実験例に記載された方法により各々のLTA(aLTA,rLTA,pLTA,dLTA,sLTA)から分離した糖脂質0.1μg/mlを6時間処理した後,培養液からTNF-αの発現量をELSIA方法を通じて測定した。
【0111】
図18は,お互いに異なるLTAから分離した糖脂質のTNF-αの発現抑制効果を示す。aLTA及びsLTA由来の糖脂質は,TNF-αの発現抑制効果がほとんどないが,rLTA,pLTA及びdLTA由来の糖脂質は,非常に効果的にTNF-αの発現を抑制することが分かる。
【0112】
<実施例3>
pLTAの抗炎症効果に対するイン・ビトロ(in vitro)実験
pLTAによるShigella flexneriペプチドグリカン(PGN)−誘導TNF−α及びIL−1βの発現抑制効果実験
人間単核球細胞の一つであるTHP−1細胞を熱処理した10%非活性FBSと100U/mlペニシリンと100μg/mlストレプトマイシンとが含まれたRPMI1640培地を使用して,37℃,5%CO2条件下で培養した。THP−1細胞を利用したサイトカイン誘導実験を実行するために,4x105個の細胞/wellを96−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。多様な濃度(0〜100μg/ml)のpLTAを24時間前処理した後,10μg/mlのペプチドグリカンを4時間の間再処理した。
【0113】
TNF-α及びIL−1βの発現量測定は,細胞培養物から遠心分離を通じて細胞上澄液を回収した後,一般的なサンドイッチELISA方法を利用して実行した。ELISA実験は,各々R&D
systemsから購入したanti−TNF−α monoclonal mouse IgG1(clone #28410)/biotinylated anti−human TNF−α specific goat IgGと,anti−human
IL−1β monoclonal
mouse IgG1(clone 2805)/biotinylated
anti−human IL−1β specific goat IgGを使用して行い,ストレプトアビジンHRPを処理した後にサブストレートとしてO−フェニレンジアミンを使用して発光させた。ELISAリーダーを使用してOD
450nmの測定値からOD 550nmの測定値を減算した値を有効値で使用した。
【0114】
図19に示したように,LTAを前処理する場合,ペブチドクリカンにより発現が増加するTNF−α(図19A)とIL−1β(図9B)の発現が,LTAの濃度が増加することに従って減少した。このような炎症性サイトカインの発現抑制が内毒素によるものであるか否かを確認するためにポリミキシンBを利用した実験を実行した。ポリミキシンBはLPSのlipid
Aと結合してLPSの活性を抑制する役割をする。したがって,前記の実験結果が内毒素によるものであれば,ポリミキシンBを処理する場合,炎症性サイトカインの発現抑制現象が発生しないはずである。しかし,pLTAによるTNF−αの発現抑制はポリミキシン(polymyxin)Bが含まれた培地下でも誘導された。このような結果は,LTAによる耐性誘導が内毒素(LPS)により誘導されないことを意味する(図19C)。
【0115】
グラム陰性菌のペプチドグリカンは,兔疫細胞のNOD2を刺激することでこれら細胞から多量のプロ−炎症性サイトカインの発現を増加させる。しかし,pLTAを兔疫細胞に前処理することによりグラム陰性菌のペプチドグリカンによるプロ−炎症性サイトカインの特異的な発現を抑制することができる。
【0116】
pLTAによるペプチドグリカン−誘導NOD2の発現抑制効果実験
pLTAによる敗血症関連収容体NOD2の発現変化測定を次のように実行した。8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。100μg/mlのpLTAを24時間の前処理した後,10μg/mlのS. flexneriペプチドグリカンを再処理して2時間間培養した。遠心分離を通じて各々の細胞を採取してから,全体RNAからcDNAを合成した後,real−time
PCRを使用してNOD2の発現変化を測定した。NOD2のタンパク質変化はウエスタンブロッティングを使用して測定した。上述した条件でpLTAを前処理したTHP−1細胞にペプチドグリカンを2時間処理した。細胞を破砕した後,SDS−PAGEローディング染料を添加して5分間沸騰させ,12%SDS-PAGEを通じてタンパク質を分離した。分離されたタンパク質をナイロンメンブレインに移した後,抗−TLR2,−TLR4,−NOD2抗体を利用してウエスタンブロッティングを実行した。
【0117】
S. flexneriペプチドグリカンによる過度な炎症反応誘導において,NOD2の役割を究明するために次のような実験を実行した。NOD2発現ベクターとpNF−κB−Luc/pRL−SV40ベクターをU937細胞に形質転換させた。24時間後に形質転換された各々の細胞に100μg/mlのpLTAで24時間前処理して,10μg/mlのペプチドグリカンを12時間の間再処理した。マイクロプレートリーダー機を利用して測定されたNF−κBの活性をRenillaの活性値で分けてNOD2発現量によるNF−κBの活性変化を測定した。
【0118】
図20によれば,S. flexneriペプチドグリカンは,THP−1細胞からNOD2の発現を顕著に増加させる。一方,pLTAを前処理した細胞でのNOD2
mRNAの発現は,pLTAの前処理濃度が増加するにしたがって減少した(図20A)。また,pLTAを前処理した細胞でのNOD2タンパク質発現量もpLTAを前処理しなかった細胞に比べて大きく減少した(図20B)。このような結果は,pLTAが敗血症関連収容体NOD2の発現を抑制することよって,NOD2とペプチドグリカンとの相互作用を通じた信号伝逹を抑制させることを意味する。
【0119】
また,pLTAを前処理した細胞でのペプチドグリカン−誘導NF−κB活性がpLTAを前処理しなかった細胞に比べて大きく減少することが確認できる(図20C)。しかし,NOD2発現ベクターを形質転換させることによりこのようなNF−κBの活性抑制が消えた。このような結果は,NOD2がペプチドグリカンの主な収容体として作用していることを意味し,また,pLTAを前処理することによりNOD2の主な転写因子であるNF−κBの活性を抑制させて,結果的にNOD2のmRNA発現を阻害させることを意味する。
【0120】
pLTAとTLR2の関連性実験
pLTAによるサイトカインの発現抑制作用において,TLR2との関連性を試すためにTLR2
siRNA実験を実行した。TLR2をターゲットにするsiRNA duplexは Santacruz Biotechnology(Santa Cruz,SA)から購入した。TLR2 siRNAとコントロール
siRNAをTransIT−TKO感染試薬(Mirus,WI)を使用してTHP−1細胞に形質転換させた後,72時間の間培養した。TLR2
siRNAとControl siRNAが形質転換された細胞に,100μg/mlのpLTAを24時間の間前処理した後,10μg/mlのペプチドグリカンを4時間再処理して培養液からTNF-αの発現量をELISA方法を使用して測定した。
【0121】
また,他の実験として,TLR2がノックアウトされたマウス(C57BL/6)から骨髓油来の大食細胞(BMM)を分離した後,96wellプレートに株分けして37℃,5%CO2下で24時間の間培養した。BMMに100μg/mlのpLTAを24時間前処理した後,10μg/mlのペプチドグリカンを4時間の間再処理して培養液からTNF−αの発現量をELISA方法を通じて測定した。
【0122】
図21に示したように,コントロールsiRNAを形質転換させたTHP−1細胞では,pLTA
前処理による耐性誘導が発生することによりペプチドグリカン−誘導TNF−αの発現が減少した(図21A)。一方,TLR2
siRNAを形質転換させたTHP−1細胞では,このような発現減少が発生しなかった(図21B)。このような結果は,TLR2がノックアウトされたBMMでも見られるが,正常なマウスから分離したBMMの場合,ペプチドグリカンの濃度によってTNF−αの発現が増加したが,このような発現増加はpLTAの前処理により減少した(図21C)。一方,TLR2−/−BMMの場合,pLTAを前処理したか否かに関係なくペプチドグリカンの濃度にしたがってTNF-αの発現が増加した(図21D)。このような結果は,ペプチドグリカン−誘導TNF−αの過発現に対するpLTAの耐性誘導はTLR2が必須的な収容体として作用していることを意味する。
【0123】
pLTAによるNF−κBの活性及びTNF−αの発現抑制
内毒素LPSの処理によるTNF−αの過発現は,MAPキナーゼのリン酸化とNF−κBの活性増加により発生する。pLTAがこのようなMAPキナーゼのリン酸化とNF−κBの活性にどのような影響を及ぶか調べるために,次のようにウエスタンブロッティング及び免疫蛍光染色実験を実行した。
【0124】
ウエスタンブロッティング:8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で,24時間培養して細胞を安定化させた。100μg/mlのpLTAを24時間前処理した後,0.1μg/mlのLPSを添加して1時間の間追加培養した。遠心分離を通じて細胞を採取した後,Laemmliバッファーで細胞を破砕した。SDS−PAGEローディング染料を添加して5分間沸かした後,12%SDS−PAGEを通じてタンパク質を分離した。分離されたタンパク質をナイロンメンブレインに移した後,抗リン酸化−MAPキナーゼ抗体(anti-phospho ERK及びanti-phospho JNK),抗NF−κB抗体,抗β−actin抗体を利用してウエスタンブロッティングを実行した。
【0125】
免疫蛍光染色(immunofluorescence staining):8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。100μg/mlのpLTAまたは培地のみを24時間前処理した後,0.5μg/mlのLPSを再処理して2時間の間培養した。培養した細胞を15分間3,500rpmで遠心分離してスライドグラス上に付着させた後,4%パラホルムアルデヒドで細胞を固定させた。以後,0.5%のトリトンX−100(Triton X−100)で細胞膜の透過性を増加させて,抗−NF−κB p50と抗−NF−κB p65抗体を2時間の間処理した。また,donkey由来の抗−マウスIgG−FITC抗体を90分間処理した後,共焦点顕微鏡を使用して細胞内でのNF−κB p50とNF−κB p65のリン酸化程度を測定した。
【0126】
図22に示したように,pLTA処理によりMAPキナーゼの活性が減少することが確認された(図22A)。すなわち,pLTA耐性を与えない細胞の場合,LPS処理後60分たった時,ERKとJNKの活性(リン酸化)が急激に増加した。一方,pLTA耐性を与えた細胞の場合,このような活性が耐性を与えない細胞に比べて低いことが確認された。
【0127】
LPS−誘導NF−κB活性は,IKKキナーゼのリン酸化を必要とする。活性化されたIKKは,I−κBタンパク質群のリン酸化を誘発してNF−κBからI−κBが分離される。NF−κBは核内に移動して細胞付着,サイトカイン,サイトカイン収容体などに対する遺伝子の転写を増加させる。本実験結果,pLTA耐性を与えない細胞の場合,I−κBαの分解がLPSを処理した後にはやく行われた。しかし,pLTA耐性を与えた細胞の場合,このようなI−κBα分解発生が少ないことを確認した(図22B)。このような結果は,NF-κBの活性が,pLTA耐性を与えた細胞で耐性を与えなかった細胞に比べて抑制されることを意味する。
【0128】
これを確認するために,抗NF−κB抗体を利用した免疫蛍光染色法を実行してpLTA耐性によるNF−κB活性の抑制を確認した(図22C)。このような一連の信号伝逹関連要素の活性抑制は,pLTAがLPSにより誘導されたTNF-αの過発現を抑制する主要原因として作用することを意味する。
【0129】
<実施例4>
pLTAの抗炎症効果に対するイン・ビボ(in vivo)実験
pLTAの敗血症抑制効果
4週齢の雄マウス(BALB/c,15匹)に300mg/kgのpLTAまたはPBSを腹腔注射した後,24時間後に200μlの敗血症誘発水溶液(250mg/kg aLTA+25mg/kg
MDP)を腹腔注射して内毒素性ショックを誘発した。マウスの生存率は敗血症誘発後に4日目まで観察した。
【0130】
また,他の実験として,pLTAを腹腔注射したマウスとPBSを腹腔注射したマウス(各5匹)に敗血症誘発物質を注射した。12時間後に心臓採血を通じてセラムを分離し,ELISA方法を通じて血液内TNF−αの含有量を測定した。
【0131】
図23に示したように,PBSを前処理したマウスの場合,敗血症誘発物質を腹腔注射した時,48時間以内に皆敗死した。一方,pLTAを前処理したマウスの場合,4日目まで約90%の生存率を示した(図23A)。また,pLTAを前処理したマウスの場合,血液内で発見されるTNF−αの量がPBSを前処理したマウスの血液内のTNF−α量に比べて顕著に低く測定されることを確認した(図23B)。
【0132】
このような結果は,pLTAがaLTA+MDPにより生体内で誘導される過度な炎症反応を抑制し,また,グラム陽性菌由来の敗血症を抑制するにおいて効果的であることを意味する。
【0133】
pLTA処理によるアトピー性皮膚疾患の緩和効果
アトピー性皮膚疾患は,バクテリアの感染,化学薬品に対する露出など多様な原因により発生する。4週齢のSPF(Specifirc pathogen free)雄ICRマウス(中央実験動物)及び4週齢のSPF雄NC/Ngaマウス(中央実験動物)を購入して7日間実験動物飼育室で適応させた後に実験に使用した。試験群当りICRマウス20匹,NC/Ngaマウス5匹ずつ二つの群に分けた。すべての試験群の場合,試験物質塗布前日に背部位を除毛し,アトピー性皮膚炎誘発は,以前研究を参考して1%DNCBを4日間隔で2回塗布し,以後,3日間隔で4週間0.2%のDNCB溶液を背に塗布した。アトピーの形成後,350μg/kgのpLTAを腹腔注射してから皮膚病変を観察した。血液内のTh2の偏向性と関連して皮膚炎掻痒付近の皮膚組職内に皮膚炎症及びアトピー関連サイトカイン(IL−4)の分布と水準を測定するためにIHC(Immuno-histochemistry)法を使用した。
【0134】
図24に示したように,DNCBの塗布結果,ICRモデル及びNC/Ngaモデルの両方とも肉眼で全体背部位で紅斑,むくみだけではなく痂皮脱皮と膿瘍性丘疹及び,個体によってひどい場合出血所見まで見られ,人のアトピー皮膚炎の症状と非常に類似した皮膚病変を示した。また,皮膚炎程度においても他のモデルに比べて強く誘発された。しかし,このような現状は,pLTAを注射することで緩和されることが観察された(図24A)。アトピー性皮膚炎の原因と言われるTh2偏向現状を観察するために発病された皮膚組織内の関連cytokineの水準を測定するためにIHCを測定した。測定結果,ICR及びNCの2個の全ての群で皮膚組職内のIL−4が有意的に上昇して分布したが,IFN−rの場合は別に別段差がなかった。一方,pLTAを処理したマウスの場合,皮膚組職内のIL−4の分布が減少することが確認された(図24B)。このような結果は,pLTAがTh2反応を誘導するIL−4の発現を抑制させることでアトピーの症状を減少させたことを意味する。
【0135】
<実施例5>
他のLTAの抗炎症効果実験
rLTAの抗炎症効果
他の種類の乳酸菌 L. rhamnosus(rLTA)から分離したLTAの抗炎症効果を調査するために,THP−1細胞に100μg/ml濃度のrLTAを処理して4時間の間刺激した。以後,培養液からTNF−αの発現量をELISA方法を通じて測定した。
【0136】
図25に示したように,rLTAの前処理濃度が増加するにしたがってTNF−αの発現量は減少した。
【0137】
aLTA,rLTA,pLTA,dLTA,sLTAの抗炎症効果比較
THP−1 cellにLPSと各々のLTAを処理してTNF-αの発現量を確認した。
図26に示したように,10μg/ml濃度で処理した時,aLTA及びsLTAはTNF−αの発現を抑制できなかったが,残りのLTAは効果的にTNF−αの発現を抑制することが分かる。
【0138】
また,LTA別にTNF−αの発現様相が異なる理由は,各々のLTAがその構造的な差により細胞信号経路(cell signal pathway)活性にお互いに異なる影響を及ぼしているはずであると仮定し,これを確認するために細胞信号経路に関連された信号抑制剤(signal inhibitor)を処理した後にLTA別にTNF−αの生成を確認した。
【0139】
その結果,図27及び各LTAのTNF−a発現抑制率を定量化して示した下記の表1のように,特定信号抑制剤を処理した時,TNF−a発現が減少するか増加することを確認した。これを通じてLTAの構造的な差が特定の細胞信号経路にお互いに異なる影響を与えることを確認した。
【0140】
【表1】

【0141】
<実施例6>
pLTA由来糖脂質を利用した抗体反応の誘発
マウスをB型肝炎ウイルス表面抗原(“HBsAg”)2.5μgで0日目に1次免疫化させた。21日目には前記マウスを2次免疫化させた(200μl/注入)。前記1次免疫化した後の第20日と2次免疫化後の第27日にマウスから採血した。血清を収集して抗−HBsAg抗体に対する標準ELISAで検査した。下記表2は,本発明の糖脂質がHBsAgと一緒に動物に投与された時,抗−HBsAg抗体の生産を誘導することを示す。
【0142】
【表2】

【0143】
<製造例1>
pLTAを含む医薬
散剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
乳糖100mg
タルク10mg
前記成分を混合して気密布に充填して散剤を製造する。
錠剤の製造
pLTAまたはpLTA誘導体 (analogues)5mg
トウモロコシ澱粉100mg
乳糖100mg
ステアリン酸マグネシウム2mg
前記成分を混合した後に通常の錠剤製造方法によって打錠して錠剤を製造する。
カプセル剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
結晶性セルロース3mg
ラクトース14.8mg
マグネシウムステアレイト0.2mg
通常のカプセル剤製造方法によって前記成分を混合してゼラチンカプセルに充填してカプセル剤を製造する。
注射剤の製造
pLTAまたはpLTA誘導体(analogues)50 mg
マンニトール180mg
注射用滅菌蒸溜水2974mg
Na2HPO412H2O26mg
通常の注射剤製造方法によって1アンプル当り(2ml)前記成分含量で製造する。
液剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
異性化糖10g
マンニトール5g
精製水適量
通常の液剤製造方法によって精製水に各々の成分を加えて溶解させて,レモン香を適量加えた後に前記成分を混合して,精製水を加えて全体を精製水を加えて全体100mlで調節した後,茶色瓶に充填して滅菌し液剤を製造する。
【0144】
<製造例2>
pLTAを含む健康食品
pLTAまたはpLTA誘導体(analogues)100mg
ビタミン混合物適量
ビタミンAアセテート70μg
ビタミンE1.0mg
ビタミンB10.13mg
ビタミンB20.15mg
ビタミンB60.5mg
ビタミンB120.2μg
ビタミンC10mg
ビオチン10μg
ニコチン酸アミド1.7mg
葉酸50μg
パントテン酸カルシウム0.5mg
無機質混合物適量
硫酸第一鉄1.75mg
酸化亜鉛0.82mg
炭酸マグネシウム25.3mg
リン酸二水素カリウム15mg
リン酸カルシウム55mg
クエン酸カリウム90mg
炭酸カルシウム100mg
塩化マグネシウム24.8mg
前記ビタミン及びミネラル混合物の造成比は,比較的健康食品に適合な成分を好ましい実施例で混合して造成したが,その配合比を任意に変形実施しても構わず,通常の健康食品製造方法によって前記成分を混合した後,課粒を製造して,通常の方法によって健康食品組成物製造に使用することができる。
【0145】
<製造例3>
pLTAを含む飲料
pLTAまたはpLTA誘導体(analogues)100mg
ビタミンC15g
ビタミンE(粉末)100g
乳酸鉄19.75g
酸化亜鉛3.5g
ニコチン酸アミド3.5g
ビタミンA0.2g
ビタミンB10.25g
ビタミンB20.3g
水定量
通常の健康飲料製造方法によって前記成分を混合して,約1時間の間85℃で撹拌加熱した後,作られた溶液を濾過して滅菌された2l容器に取得して密封滅菌して冷蔵保管した後,本発明の健康飲料組成物製造に使用する。
【0146】
前記造成比は,比較的嗜好飲料に適合な成分を好ましい実施例で混合造成したが,需要階層や,需要国家,使用用度など地域的,民族的嗜好度によってその配合比を任意に変形実施しても構わない。
【0147】
<製造例4>
pLTAを含む飲料
柔軟化粧水(スキン)の製造
pLTAまたはpLTA誘導体(analogues)0.1重量%
グリセリン3.0重量%
ブチレングリコール2.0重量%
プロピレングリコール2.0重量%
ポリオキシエチレン(60)硬化ヒマシ油1.00重量%
エタノール10.0重量%
トリエタノールアミン0.1重量%
防腐剤微量
色素微量
香料微量
精製水残量
栄養化粧水(ローション)の製造
pLTAまたはpLTA誘導体(analogues)0.1重量%
シトステロール1.70重量%
オレイン酸ポリグリセリル−2 1.50重量%
セテアレス−4 1.2重量
コレステロール1.5重量
ジセチルホスフェート0.4重量%
濃グリセリン5.0重量%
サンフラワーオイル10.0重量%
カルボキシビニルポリマー 0.2重量%
キサンタンガム0.3重量%
防腐剤微量
香料微量
精製水残量
【0148】
<製造例5>
pLTAを含むアジュバント
pLTAを含むアジュバントの製造
pLTAまたはpLTA誘導体(analogues)25μg
ジオレオイルホスファチジルコリン(DOPC)500μg
コレステロール125μg
ホスフェートNaCl緩衝溶液及び水残量
合計0.5ml
前記成分からなるアジュバントをWO96/33739に記述されたように製造する。
【0149】
【表3】

【技術分野】
【0001】
本発明は,リポタイコ酸由来の糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントに関する。
【背景技術】
【0002】
リポタイコ酸(LTA:Lipoteichoic acid)はグラム陽性菌の細胞壁成分の中の一つである。一般的に,リポタイコ酸は,グルコースまたはD−アラニン置換剤を有するポリグリセロールリン酸(Polyglycerolphosphate)及び糖単位と脂肪酸鎖を含む糖脂質の二つの構造体に区分され,この中でポリグリセロールリン酸のD−アラニン含量によってTNF−αのような炎症性サイトカインの発現が調節されると知られている(非特許文献1)。
【0003】
特に,スタフィロコッカス・アウレウス (Staphylococcus aureus)から分離したLTA(aLTA)の場合,グラム陽性菌から敗血症を誘発する物質として知られているが,aLTAは大食細胞のような兔疫細胞のToll−like
receptor2(TLR2)と細胞膜連関性CD14により認知されてNF−κB及びMAPキナーゼの活性を通じた炎症性サイトカインの発現増加を誘導する。
【0004】
しかし,乳酸菌であるラクトバチルス(Lactobacillus)から分離したLTAの場合,aLTAとは異なる免疫活性を有している(非特許文献2)。すなわち,aLTAは兔疫細胞から過度な炎症反応を誘導するが,ラクトバチルスから分離したLTAは兔疫細胞の炎症反応を抑制する作用をする。このようなLTAの免疫活性の差は二つのLTAの構造的な差に起因することが知られており,したがって,LTAの構造を分析することはLTAの機能を究明して免疫活性を調節することにおいて非常に重要である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Morath, S., A. Geyer, etal. 2001, Structure−function relationshipof cytokine induction by lipoteichoic acid from Staphylococcus aureus. J. Exp. Med. 193:393−397
【非特許文献2】de Vos, W. J. 2005. Lipoteichoic acid in lactobacilli: D−alanine makes the differences. Proc.Natl. Acad. Sci. USA 102 (31):10763−4
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は,抗炎症効果を有する糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントを提供することを目的とする。
【課題を解決するための手段】
【0007】
前記目的を達成するため,本発明は,リポタイコ酸由来の糖脂質及びこれを含む薬学,食品,化粧品組成物及びワクチンアジュバントを提供する。
【発明の効果】
【0008】
本発明によるリポタイコ酸由来の糖脂質は,炎症性サイトカインの生産を抑制することにより抗炎症効果を有するので,これを含む薬学,食品及び化粧品組成物を炎症性疾患の予防及び治療を目的として使用することができ,これをワクチンアジュバントとしても使用することができる。
【図面の簡単な説明】
【0009】
【図1】L. plantarum LTAの1H,13C及び2D−NMRスペクトラムを示す。
【図2】L. plantarum LTAのCOSYスペクトラムを示す。
【図3】L. plantarum LTAのHMQCスペクトラムを示す(A:オレフィン炭素に結合されたα-メチレンとメテレン,B:α−D−ガラクトースとα−D−グルコースのアノマー陽性子)。
【図4】LTA加水分解物のGC/MS分析結果を示す。
【図5】LTA糖脂質のMALDI−TOF MSスペクトラムを示す(A:S. aureus,B:L. plantarum)。
【図6】(A)aLTA及び(B)pLTAのIntact糖脂質及びO−アセチル化された糖脂質のMALDI-TOFMSスペクトラムを示す。
【図7】pLTAの糖脂質構造を示す。
【図8】pLTA糖脂質の質量を分析した表を示す。
【図9】(A)aLTA糖脂質及び(B)pLTA糖脂質のLTQ-Orbitrap FTMSスペクトラムを示す。
【図10】LTA糖脂質の陰イオンCIDスペクトラムを示す(A:ジヘキソシル−ジアシル−グリセロール,B:トリヘキソシル−ジアシル−グリセロール)。
【図11】aLTA糖脂質の質量を分析した表 を示す。
【図12】aLTAの脱アシル化された糖脂質のMALDI−TOF MSスペクトラムを示す(A:Intact糖脂質,B:NaOH処理した糖脂質,C:Ca(OH)2 処理した糖脂質)。
【図13】pLTA,dLTA,rLTA及びsLTAの糖脂質部位に対するMALDI−TOF分析結果を示す。
【図14】Intact aLTAとpLTA,これらから由来した糖脂質及びポリグリセロールリン酸のTNF−α発現誘導実験結果を示す。
【図15】Intact aLTA,de−alanine aLTA及びde−acyl aLTAの TNF−α発現抑制実験結果を示す。
【図16】Intact pLTA,de−alanine pLTA及びde−acyl pLTAのTNF−α発現抑制実験結果を示す。
【図17】pLTA由来の糖脂質を前処理した細胞でTNF−αの発現が減少することを示す。
【図18】相異なるLTAから分離した糖脂質のTNF−αの発現抑制効果を示す。
【図19】pLTA処理によるS. flexneriペプチドグリカン−誘導TNF−α及びIL−1βの発現抑制効果を示す(A:TNF−αの発現測定,B:IL−1βの発現測定,C:ポリミキシンB処理後のTNF−αの発現測定)。
【図20】S. flexneriペプチドグリカン−誘導炎症反応において,pLTA処理による(A)NOD2 mRNAの発現量の変化,(B)NOD2タンパク質の発現量の変化,及び(C)NF−κBの活性変化を示す。
【図21】S. flexneriペプチドグリカン−誘導炎症反応において,pLTA処理によるTNF−αの発現変化を測定した結果を示す(A:コントロールsiRNAを形質転換させたTHP−1細胞,B:TLR2 siRNAを形質転換させたTHP−1細胞,C:正常マウスから分離したBMM,D:TLR2ノックアウトマウスから分離したBMM)。
【図22】pLTA処理によるMAPキナーゼ及びNF−κBの活性の変化を示す(A:phosphor−ERK及びphosphor−SAPK/JNK活性,B:IκB−α分解活性,C:免疫蛍光染色法によるNF−κB活性測定)。
【図23】PBSまたはpLTAを腹腔注射した敗血症誘発マウスの(A)生存率及び(B)血液内のTNF−αの含有量を示す。
【図24】pLTAの処理による(A)DNCB−誘発アトピーマウスの皮膚病変及び(B)皮膚組織内のIL−4分布を示す。
【図25】rLTAを前処理した細胞においてTNF−αの発現が減少することを示す。
【図26】多様なLTAのTNF−αの発現抑制効果 を示す。
【図27】特定の信号抑制剤処理による多様なLTAのTNF−αの発現抑制効果を示す。
【発明を実施するための最良の形態】
【0010】
乳酸菌由来のリポタイコ酸は炎症性サイトカインの発現を抑制する抗炎症活性を誘導する。本発明者らは,本発明を通じて乳酸菌であるラクトバチルス・プランタラム(Lactobacillus plantarum)由来のリポタイコ酸(pLTA)が炎症反応を誘導するaLTAとは異なる糖脂質構造を有することを知見した。特に,pLTA自体だけではなく,pLTAのポリグリセロールリン酸部分を除去した糖脂質部分だけでも炎症性サイトカインの発現を抑制する抗炎症効果があることを証明することで本発明を完成した。すなわち,pLTAの糖脂質構造を基礎としてこれと類似な多様な糖脂質変異体を製造することにより,抗炎症効果を有する多様な糖脂質変異体を効果的に活用することができる。
【0011】
本発明は,α結合により結合された二重または三重ヘキソースのC1,C3,C4及びC6番位置の中でいずれか1ヶ所以上にC10乃至C30の飽和または不飽和された2乃至6個のアシル鎖が結合されている糖脂質を提供する。
【0012】
この時,前記ヘキソースは,グルコース,ガラクトース,マンノースまたはフルクトースであり,好ましくは,グルコースまたはガラクトースである。
【0013】
好ましくは,前記糖脂質は,一つ以上の不飽和されたアシル鎖を含む。
【0014】
本発明の一つの具体的な例において,前記糖脂質は,下記化学式(I)の構造を有する糖脂質である。
【0015】
【化1】

【0016】
前記式において,R1乃至R4は,各々独立的にヒドロキシ,または,下記の式である。
【0017】
【化2】

【0018】
この時,R’は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。nは,0または1であり,Cmは,C4乃至C30のアルキル,具体的には,C6乃至C26のアルキルまたはC10乃至C24のアルキルである。前記糖脂質内のアシル鎖の総数は,2乃至6,具体的には,2乃至4または2乃至3である。
【0019】
より具体的に,前記化学式(I)において,R1は下記の式である。
【0020】
【化3】

【0021】
この時,R'は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R2乃至R4は,ヒドロキシであり,nは,1であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0022】
また,具体的に,前記化学式(I)において,R1は,下記の式である。
【0023】
【化4】

【0024】
この時,R2,R3またはR4の中でいずれか一つは,下記の式であり,残りはヒドロキシである。
【0025】
【化5】

【0026】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。nは,1であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0027】
例えば,前記化学式(I)の糖脂質は,下記化学式(I−1)または化学式(I−2)の構造を有する糖脂質である。
【0028】
【化6】

【0029】
【化7】

【0030】
この時,前記化学式(I−1)または化学式(I−2)に示した二重結合の位置は変わることができる。
【0031】
本発明の他の具体的な例において,前記糖脂質は乳酸菌由来の糖脂質であり,前記乳酸菌は,これに制限されるのではないが,ラクトバチルス(Lactobacillus),ビフィドバクテリウム(Bifidobacterium),ストレプトコッカス(streptococcus)またはラクトコッカス(Lactococcus)属である。ラクトバチルスは,例えば,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei)であり,ビフィドバクテリウムは,例えば,ビフィドバクテリウム・
ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis)であり,ストレプトコッカスは,例えば,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)であり,ラクトコッカスは,例えば,ラクトコッカス・ラクティス(Lactococcus lactis)である。
【0032】
リポタイコ酸(LTA)の中で構造が一番よく知られているはストレプトコッカス・アウレウス(S. aureus)のLTA(aLTA)である。病原性微生物であるS.
aureus由来のaLTAは,免疫増強活性を誘導して炎症性サイトカインの発現を増加させる。下記化学式(III)に示したように,aLTAの主鎖(Backbone)は二つのグルコースがβ結合により結合されているゲンチオビオース(Gentiobiose)[β1→6結合]として知られており,グルコースのC6と1,3−ホスホジエステル結合されたポリグリセロールリン酸鎖が結合されている。また,平均15個の炭素を有する二つの飽和脂肪酸鎖(C15:0)がエステル結合によりグルコースのC1に結合されている。
【0033】
【化8】

【0034】
一方,乳酸菌であるpLTA由来のリポタイコ酸は,炎症性サイトカインの発現を抑制する抗炎症活性を誘導する。本発明により明らかにしたpLTA糖脂質の構造は,α結合により結合された三つのヘキソースを主鎖で有し,脂肪酸アシル鎖が結合されているヘキソースの反対側の末端ヘキソースのC6位置に,1,3−ホスホジエステル結合されたポリグリセロールリン酸鎖が結合されていることを特徴とする。また,pLTAの糖脂質は,一番目のヘキソースのC1またはC6位置に二つまたは三つの脂肪酸アシル鎖がエステル結合により結合されていることを特徴とする。pLTA由来の糖脂質は,具体的には,化学式(I−1)または化学式(I−2)の構造を有することができ,前記化学式において,二重結合の位置は変更可能である。化学式(I−1)は,ヘキソースのC1位置に炭素数18の飽和脂肪酸アシル鎖(C18:0)と炭素数18の不飽和脂肪酸アシル鎖(C18:2)とが結合されているpLTAのグループI糖脂質を示す。化学式(I−2)は,前記化学式(I−1)の糖脂質のヘキソースのC6位置に炭素数16の飽和脂肪酸鎖(C16:0)を追加で含むことで,pLTAのグループII糖脂質を示す。ヘキソースの結合,脂肪酸鎖の数,これらの結合位置,炭素数,及び不飽和脂肪酸の有無は,TLR2がリポタイコ酸を認知するにあって重要な役割をする。したがって,このような構造的特性がLTAの抗炎症活性を誘導する重要な要因になる。
【0035】
従来,リポタイコ酸のポリグリセロールリン酸のD−アラニン含量によって,TNF−αのような炎症性サイトカインの発現が調節されると知られているが,下記実施例によれば,pLTAの場合,ポリグリセロールリン酸のD−アラニンより脂肪酸アシル鎖を含む糖脂質構造体のほうが,炎症性サイトカインの発現調節において一層重要な役割をすることが分かった。本発明者らは,pLTA由来の糖脂質がそれ自体で炎症性サイトカインであるTNF−αの発現を抑制することで抗炎症効果を有することを突き止めた。pLTA由来の糖脂質以外にもpLTAと類似した構造を有するラクトバチルス・ラムノーサス(L. rhamnosus)由来のrLTA及びラクトバチルス・デルブルッキ(L. delbreukii)由来のdLTAの場合も同様に糖脂質部分だけで炎症性サイトカインであるTNF−αの発現を抑制することで抗炎症効果を有することを確認した。
【0036】
また,本発明は,アシル鎖が結合されているヘキソースの反対側末端ヘキソースのC6位置にポリグリセロールリン酸が追加で結合された糖脂質を提供する。
【0037】
本発明の一つの具体的な例において,前記糖脂質は,下記化学式(II)の構造を有する糖脂質である。
【0038】
【化9】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,または,下記の式である。
【0039】
【化10】

【0040】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。
R’’は,各々独立的にN−アセチルグルコサミン(N−acetylglucosamine),D−アラニン(D−alanine)またはヒドロキシである。nは,0または1であり,Cmは,C4乃至C30のアルキル,具体的には,C6乃至C26のアルキルまたはC10乃至C24のアルキルである。lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20である。前記糖脂質内のアシル鎖の総数は,2乃至6,具体的には,2乃至4,または2乃至3である。
【0041】
具体的に,前記化学式(II)において,R1は,下記の式である。
【0042】
【化11】

この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,R2乃至R4は,ヒドロキシである。nは,1であり,lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0043】
また,具体的に,前記化学式(II)において,R1は,下記の式である。
【0044】
【化12】

この時,R2,R3またはR4の中でいずれの一つは,下記の式であり,残りはヒドロキシである。
【0045】
【化13】

【0046】
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖,具体的には,C14乃至C26の飽和または不飽和されたアシル鎖,C14乃至C24の飽和または不飽和されたアシル鎖,C14乃至C22の飽和または不飽和されたアシル鎖,C14乃至C20の飽和または不飽和されたアシル鎖,C14乃至C18の飽和または不飽和されたアシル鎖,C16乃至C20の飽和または不飽和されたアシル鎖,またはC16乃至C18の飽和または不飽和されたアシル鎖である。R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシである。nは,1であり,lは,0乃至80,具体的には,0乃至60,0乃至40,または0乃至20であり,1乃至14個の二重結合,具体的には,1乃至10個の二重結合,1乃至8個の二重結合,1乃至6個の二重結合,1乃至4個の二重結合,1乃至3個の二重結合または1乃至2個の二重結合を有するアシル鎖を一つ以上含む。
【0047】
例えば,前記化学式(II)は,下記化学式(II−1)または化学式(II−1)である。
【0048】
【化14】

【0049】
【化15】

【0050】
前記式において,R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,lは,0乃至80,具体的には,0乃至60,0乃至40または0乃至20である。
【0051】
また,前記化学式(I−1)または化学式(I−2)に示した二重結合の位置は変更可能である。
【0052】
本発明の一つの具体的な例において,ポリグリセロールリン酸が追加で結合された糖脂質は,乳酸菌由来のリポタイコ酸であり,前記乳酸菌は,これに制限されるものではないが,ラクトバチルス(Lactobacillus),ビフィドバクテリウム(Bifidobacterium),ストレプトコッカス(streptococcus)またはラクトコッカス(Lactococcus)の属である。ラクトバチルスは,例えば,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei)であり,ビフィドバクテリウムは,例えば,ビフィドバクテリウム・
ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum), ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis)であり,ストレプトコッカスは,例えば,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)であり,ラクトコッカスは,例えば,ラクトコッカス・ラクティス(Lactococcus lactis)である。
【0053】
また,本発明は,前記糖脂質を含む薬学組成物を提供する。
【0054】
本発明による糖脂質は,下記実施例を通じて分かるように,耐性毒素LPS刺激によるNF−kBの活性及びIkB−αの分解を抑制してTLR2の発現を抑制することで,炎症性サイトカインTNF−α及びIL−8の発現を抑制する抗炎症効果を有する。
【0055】
本発明による糖脂質を含む薬学組成物は,通常的な方法によって,散剤,顆粒剤,錠剤,カプセル剤,懸濁液,乳剤,シロップ,エアロゾルの経口製剤,外用剤,坐剤または滅菌注射液剤の形態で剤形化して使用することができ,薬学組成物の製造に通常的に使用する適切な抗生剤,担体,賦形剤及び希釈剤からなる群より選択される一つ以上の添加剤をさらに含む。
【0056】
具体的に,担体,賦形剤及び希釈剤では,ラクトース,デキストロース,スクロース,ソルビトール,マンニトール,キシリトール,エリスリトール,マルチトール,澱粉,アカシアゴム,アルギン酸,ゼラチン,リン酸カルシウム,ケイ酸カルシウム,セルロース,メチルセルロース,マイクロクリスタリンセルロース,ポリビニルピロリドン,水,メチルヒドロキシベンゾエート,プロピルヒドロキシベンゾエート,タルク,ステアリン酸マグネシウム及び鉱物油を使用することができ,製剤化する場合には,一般的に使用する充填剤,増量剤,結合剤,湿潤剤,崩壊剤,界面活性剤などの希釈剤または賦形剤を使用して調剤することができる。経口投与のための固形製剤には,錠剤,丸剤,散剤,顆粒剤,カプセル剤などが含まれ,このような固形製剤は,前記抽出物に少なくとも一つ以上の賦形剤,例えば,澱粉,炭酸カルシウム,スクロースまたはラクトース,ゼラチンなどを混ぜて調剤することができる。また,単純な賦形剤の以外に,ステアリン酸マグネシウム,タルクのような潤滑剤も使用できる。経口のための液状製剤では,懸濁液,内用液剤,乳剤,シロップ剤などがあり,よく使われる単純希釈剤である水,流動パラフィン以外にさまざまな賦形剤,例えば湿潤剤,甘味剤,芳香剤,保存剤などが含まれる。非経口投与のための製剤には,滅菌された水溶液,非水性溶剤,懸濁剤,乳剤,凍結乾燥製剤,坐剤などが含まれる。非水性溶剤,懸濁剤では,プロピレングリコール,ポリエチレングリコール,オリーブオイルのような植物性油,オレイ酸エチルのような注射可能なエステルなどを使用することができる。坐剤の基剤では,ウィテップゾール(witepsol),マクロゴ−ル, ツイーン(tween)61,カカオ脂,ラウリン脂,グリセロールゼラチンなどを使用することができる。
【0057】
本発明による薬学組成物において糖脂質は,薬学組成物100重量部に対して0.01乃至99.9重量部,0.1乃至90重量部,1乃至80重量部,または10乃至80重量部で含むことができるが,これに制限されるのではなく,患者の状態,疾患の種類及び進行程度によって変更することができる。
【0058】
本発明による糖脂質は,抗炎症活性を有する炎症性疾患または免疫関連疾患の予防及び治療に使用することができる。したがって,本発明は前記糖脂質を含む炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物,炎症性疾患または免疫関連疾患の予防及び治療用医薬の製造のための前記糖脂質の用途及び治療上有効量の糖脂質を対象体に投与する段階を含む炎症性疾患の予防及び治療方法を提供する。
【0059】
具体的に,前記炎症性疾患または免疫関連疾患には,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症候群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患などがある。
【0060】
本発明の一つの具体的な例において,前記糖脂質は,経口,直腸または静脈,筋肉,皮下,子宮内硬膜または脳室内(intracerebroventricular)注射により対象体に投与することができる。
【0061】
本発明による糖脂質の投与量は,患者の状態及び体重,疾患の種類及び程度,薬物形態,投与経路及び期間によって変更可能であり,当業者が適切に選択することができる。しかし,1日投与量は,0.01乃至10,000mg/kg,具体的には,0.1乃至10,000mg/kg,より具体的には,0.1乃至1,000mg/kgであることが好ましい。投与は,一日一回投与するか数回に分けて投与することができ,これによって本発明の範囲が制限されるのではない。
【0062】
本発明において,「対象体」とは,人間,オランウータン,チンパンジー,マウス,ラット,犬,牛,ニワトリ,豚,山羊,羊などを含むが,これらの例に限定されるのではない。
【0063】
また,本発明は前記糖脂質を含む食品組成物を提供する。前記食品組成物は,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症侯群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患などの炎症性疾患,または免疫関連疾患の予防及び治療効果がある機能性食品及び一般食品の製造に使用することができる。
【0064】
本発明の一つの具体的な例において,前記食品組成物は,これに制限されるものではないが,有機酸,リン酸ナトリウム,抗酸化剤,乳糖カゼイン,デキストリン,葡萄糖,砂糖及びソルビートルからなる群より選択される一つ以上の添加剤を追加で含むことができる。有機酸は,これに制限されるのではないが,クエン酸,フマル酸,アジピン酸,乳酸またはりんご酸であり,リン酸塩は,これに制限されるものではないが,リン酸ナトリウム,リン酸カリウム,酸性{さんせい}ピロリン酸ナトリウムまたはポリリン酸ナトリウム(重合リン酸ナトリウム)であり,抗酸化剤は,これに制限されるものではないが,ポリフェノール,カテキン,α−トコフェロール,ローズマリー抽出物,甘草抽出物,キトサン,タンニン酸またはフィチン酸などの天然抗酸化剤である。
【0065】
本発明において,糖脂質は,食品組成物100重量部に対して0.01乃至99.9重量部で含むことができ,具体的には,1乃至90重量部または30乃至80重量部で含まれる。
【0066】
また,本発明の一つの具体的な例において,食品組成物の剤形は,これに制限されるものではないが,固形,粉末,課粒,錠剤,カプセルまたは液状形態である。
【0067】
本発明による糖脂質を含む食品組成物は,これに制限されるものではないが,菓子類,糖類,アイスクリーム製品類,乳加工品,食肉製品,魚肉製品,豆腐類または寒天類,食用油脂類,麺類,茶類,飲料類,特殊栄養食品,健康補助食品,調味食品,氷,人参製品類,キムチづけ食品,干し肉類,果物,野菜,果物または野菜の乾燥製品,切断製品,果物ジュース,野菜ジュース,これらの混合ジュース,チップス類,麺類,畜産加工食品,水産加工食品,乳加工食品,発酵類食品,豆類食品,穀類食品,微生物発酵食品,製菓製パン,味付け類,肉加工類,酸性飲料水,甘草類,ハーブ類などの食品製造に使用することができる。前記食品の形態は,これに制限されるものではないが,固形,粉末,顆粒,錠剤,カプセル,液状または飲料形態を含む。
【0068】
本発明の他の具体的な例において,前記糖脂質を含む組成物を健康機能食品の製造に使用する場合には,全体食品重量の0.01乃至15重量%で使用することができ,飲料の製造に使用する場合には,全体飲料重量の0.02乃至10重量%,または0.3乃至1 重量%で使用することができる。
【0069】
本発明による食品組成物には,前記糖脂質の以外にもさまざまな栄養剤,ビタミン,鉱物(電解質),合成風味剤及び天然風味剤などの風味剤,着色剤及び増進剤(チーズ,チョコレートなど),ペクト酸及びその塩,アルギン酸及びその塩,有機酸,保護性コロイド増粘剤,pH調節剤,安定化剤,防腐剤,グリセリン,アルコール,炭酸飲料に使われる炭酸化剤などを添加することができる。また,本発明による食品組成物には,天然果物ジュース,果物ジュース飲料及び野菜飲料の製造のための果肉を添加することができる。このような添加剤の割合は,これに制限されるものではないが,一般的に本発明の組成物100重量部当たり0乃至約20
重量部の範囲で選択する。
【0070】
また,本発明は,前記糖脂質を含む化粧品組成物を提供する。
【0071】
本発明において,糖脂質は,化粧品組成物100重量部に対して0.01乃至99.9重量部で含むことができ,具体的には,1乃至90重量部または30乃至80重量部で含むことができる。
【0072】
本発明による化粧品組成物が使われる化粧品は,その剤形において,これに限定されるものではないが,例えば,柔軟化粧水,栄養化粧水,マッサージクリーム,栄養クリーム,パック,ジェル,エッセンス,リップスティック,メーキャップベース,ファウンデーション,ローション,軟膏,ゲル,クリーム,クレンジング,洗顔剤,せっけん,シャンプー,リンス,トリートメント及び美容液などを含む。このような化粧品は,水性ビタミン,油性ビタミン,高分子ペプチド,高分子多糖,スフィンゴ脂質などの通常の成分を含むことができ,これは当業者に広く知られた技術によって容易に製造できる。
【0073】
また,前記成分とともに化粧品に通常使用される添加剤,例えば,ビタミン,アミノ酸,タンパク質,界面活性剤,乳化剤,香料,色素,安定剤,防腐剤,抗酸化剤,紫外線遮断剤,pH調整剤及びキレート剤からなる群より選択される一つ以上の添加剤を追加で含むことができる。
【0074】
また,本発明は,前記糖脂質からなるか,それを含むワクチンアジュバントを提供する。
【0075】
本発明による糖脂質は多様な目的で利用することができる。その一つの好ましい用途は,免疫原性ポリヌクレオチド(immunogenic polynucleotide),ポリペプチド,抗体,T−細胞,または抗原−提供細胞(APC)を含む医薬組成物用の免疫刺激剤またはアジュバントとして使用されることである。
【0076】
アジュバントワクチンは,より早い抗体形成を誘導することで抗原に対する免疫反応を強化させる気質を意味する。本発明による糖脂質は,炎症性サイトカインの発現に影響を与えるだけではなく,付着分子(adherent molecule)の発現など免疫作用にも影響を与えることで,抗原に対する免疫反応を増加させることができる。また,それ自体として免疫原性(immunogenicity)がないためワクチンアジュバントで使用することができる。
【0077】
本発明による糖脂質が刺激できる一つの免疫反応はTh1またはTh2類型であり,したがって,本発明によるアジュバントは,Th1またはTh2類型の免疫反応を優占的に誘導するようにデザインすることができる。高濃度のTh1−類型サイトカイン(例えば,TNF−α,IFN−N−γ,IL−2及びIL−12)は,投与された抗原に対する細胞媒介された免疫反応の誘導を助力する傾向がある。対照的に,高濃度のTh2−類型サイトカイン(例えば,IL−4,IL−5,IL−6,IL−10及びTNF−β)は,体液性免疫反応の誘導を助力する傾向がある。本発明による糖脂質を含むワクチンを適用した患者は,Th1−及びTH2−類型の反応を含む免疫反応を維持することができる。反応が主にTh1−類型である場合,Th1−類型サイトカインの濃度はTh2−類型サイトキンの濃度より大きく増加する。これらサイトカインの濃度は,標準分析法を利用して容易に評価できる。サイトカインファミリーの調査のために文献[Mosmann and Coffman, Ann. Rev. Immunol. 7:145−173,1989]を参照することができる。また,(CpGディヌクレオチドが非メチル化された)CpG−含有オリゴヌクレオチドが主にTh1反応を誘導するが,このようなオリゴヌクレオチドはよく知られており,例えば,WO1996/02555号公報に記述されている。
【0078】
好ましくは,優勢なTh1またはTh2類型反応を誘導するために使用するアジュバントは,アルミン酸塩と一緒に前記糖脂質を含む。
【0079】
以下,本発明の好ましい実施の形態について詳細に説明する。下記実施例は,本発明の内容を例示するのみで,本発明の範囲が下記実施例に限定されるのではない。本発明の実施例は,当業界で平均的な知識を有した者に本発明をより詳細に説明するために提供されるものである。
【0080】
<実験例>
下記実験例は,本発明による各々の実施例に共通的に適用される実験例を提供するものである。
【0081】
LTA及びLTA由来糖脂質とポリグリセロールリン酸の分離・精製
LTAの分離は,既存に報告された(Morath, S., A. Geyer, et al. 2001. Structure−function relationship of cytokine induction by lipoteichoic
acid from Staphylococcus aureus. J. Exp. Med. 193(3):393−7.)方法を参考して実行した。100gの細胞(wet weight)を0.1Mクエン酸ナトリウムバッファー(pH4.7)400mlで懸濁させた後,超音波処理して細胞を破砕した。同量のn−ブタノールを添加して30分間混ぜた後,遠心分離を通じてLTAが含まれた収容層を分離した。15%n−プロパノールと0.1Mクエン酸ナトリウムバッファー(pH4.7)を添加してLTA切片を分離した後,半透過膜を利用して透析した。以後,オクチル−セファロースカラムCL−4B(2.5cm x10cm)を利用した疎水性相互作用クロマトグラフィーを実行した。15%n−プロパノールと0.1M酢酸ナトリウムバッファー(pH4.7)が含まれたバッファー200mlを利用してカラムを清浄した後,300mlの溶出バッファー(35%n−プロパノール,0.1M酢酸ナトリウム,pH4.7)を利用してLTAを採集した。LTAが含まれた切片は,さらにDEAE−セファロースイオン交換クロマトグラフィー(1.5cmx10cm)のために平衡バッファー(30%n−プロパノール,0.1Mアセテートバッファー,pH4.7)を添加した後カラムに充填した。300mlの一連のNaCl(0〜1M)が含まれた平衡バッファーを利用してLTAを採集した。
【0082】
LTA由来糖脂質の分離は,30mgのIntact
LTAを500mlの98%(v/v)酢酸水溶液に溶かした後,30分間超音波処理して100℃で3時間の間加熱して実行した。vacuumを利用して溶媒を除去した後,クルロロホルム/メタノール/水(1:1:0.9, v/v/v)を利用して糖脂質を分離した。糖脂質は有機層から抽出し,ポリグリセロールリン酸は溶媒層から抽出した。
【0083】
核磁気共鳴(NMR)分光法
NMR実験は,x,y,z−shielded gradient
triple resonanceプローブまたはz−shielded gradient triple resonance cryoプローブを備えているAvance−600MHzとAvance−800MHz高解像度NMR分光器を使用した。10mgのLTAを0.5mlの2H2O溶液に溶かした。2H2Oは基準信号(4.75ppm,1H)で使用した。Homonuclear assignmentは,correlation spectroscopy(COSY),double−quantum filtered correlation
spectroscopy(DQF−COSY),total correlation
spectroscopy(TOCSY),rotating frame
Overhauser enhancement spectroscopy(ROSEY)スペクトラムから得た。13Cassignmentは,heteronuclear multiple−quantum
correlation(HMQC)とheteronuclear
multiple−bond correlation(HMBC)実験に基礎した。すべてのスペクトラムは300Kで記録し,NMRデータはprograms
nmrPipe28を利用して処理しSparkyを使用して視覚化した。
【0084】
糖脂質のマイルドアルカリ加水分解(Mild alkaline hydrolysis)
糖脂質mild alkali−labile componentを結晶するために50μgの試料を200μlの0.5M
NaOHを利用して56℃で60分間溶解した。以後,3 N HClを利用して酸性化させた後ヘクサン(hexane)と混ぜた。脂肪酸が含まれている上層液を除去した後,塩を除去するために下層液を乾燥させた。残基をクルロロホルム/メタノール/水(8:4:3,v/v) 溶液で区画させた後,遠心分離を通じて層を分離して上層液を除去した。また,塩を除去するために下層液を乾燥させた後,残基をクルロロホルム/メタノール(1:1:,v/v)溶液に溶かした後にMALDI−TOF MS分析に使用した。
【0085】
エキソグリコシダーゼ(Exoglycosidase) 処理
糖脂質を0.1%タウロデオキシコール酸ナトリウム(Sodium Taurodeoxycholate)を含む50μlの50mM NH4HCO3バッファーで懸濁した後,α−グルコシダーゼ(Saccharomyces cerevisiae),β−グルコシダーゼ(アーモンド),α−ガラクトシダーゼ(コーヒー生豆),またはβ−ガラクトシダーゼ(E. coli)を添加して37℃で48時間処理した。その後,クルロロホルム:メタノール(1:1,v/v)1.35mlと100μlのDWを添加して層を分離し,下層を乾燥させて連鎖分析(linkage
analysis)した。
【0086】
MALDI−TOF MS
0.5μlの糖脂質溶液をマトリクス溶液(2,5−ジヒドロキシ安息香酸溶液,30mg/ml in 70%アセトニトリル/30%水[v/v],0.5μl)に添加した後,MALDIプローブに適用した。精製された糖脂質を直接またはO−アセチル化した後,MALDI−TOF
MSを通じて分析した。精製された糖脂質を80℃で2時間の間ピリジン:無水酢酸(1:1,v/v)200μlでO−アセチル化させた。その後,溶媒を除去した後,MALDI−TOF
MSで分析を行った。
【0087】
フッ化水素酸を利用したLTAの部分的加水分解
ポリグリセロールリン酸主鎖の部分的または完璧な加水分解のために,1mgのLTAを100μlの48%フッ化水素酸(HF)に添加した後,4℃で5〜48時間処理した。その後,飽和された水酸化{すいさんか}リチウム(LiOH)で中和させた後,遠心分離(12,000xg,10min)を通じて沈殿物を除去した。上層液を収集してTLC及びESI−LIT
MS分析に使用した。
【0088】
ガスクロマトグラフィー/質量分析法(GC/MS)
LTA加水分解物から単糖類構成を分析するためにGC/MS分析を行った。標準化合物(Authentic reference compound)(ガラクトース,グルコース,マンノース,N−アセチルグルコサミン)またはLTA加水分解物の試料をピリジンに溶かした後,常温で48時間放置した。50μlのトリメチルシリルイミダゾールを添加した後,67℃で30分間加熱した。試料を200μlのクルロロホルムで溶かした後,Finnigan MAT system(ガスクロマトグラフィーモデルGCQ,HP19091J−433)に適用した。試料をnonplar capillary column(5%phenyl
methyl siloxane capillary30mx250μm i.d., 0.25μm film thickness,HP−5)に適用した。カラムを100℃で2分間置いた後,分当り4℃の速度で220℃まで増加させて5分間維持した。以後,分当り15℃の速度で300℃まで増加させて5分間維持した。質量分析計は,85℃のイオン試料温度,65eVの電子エネルギー,300mAの放出電流(emission
current)を有する陽イオン化学イオン化モード(positive
ion chemical ionization mode)下で使用した。分析ガス(analyte gas)ではメタンを使用し,0.5torrを維持した。
【0089】
糖脂質の脂肪酸構成は,0.1μgのトリデカン酸を200μgのLTA試料に添加した後,4 N KOH(100℃,4時間)で加水分解することで結晶した。加水分解物のpHを1に近くした後,自由脂肪酸をクルロロホルム(3times,1ml)で抽出した後,N2ガスで乾燥させた。乾燥された脂肪酸をアセトニトリル(30μl)で溶かした後,35%臭化ペンタフルオロベンジル(アセトニトリル添加)10μlとジイソプロピルエチルアミン(10μl)で処理した。溶液を40℃で20分間加熱した後,N2気体で乾燥させた。結果物であるペンタフルオロベンジルエステルをN,O−ビス(トリメチルシリル)-トリフルオロアセチルアミドでO/N処理した。カラムは,85℃を維持し,1分当たり7℃の速度で265℃まで温度を上昇させた後10分間維持した。ヒドロキシ脂肪酸の量はベースピークイオンの選択イオン検出方法を使用して結晶し,トリデカン酸の内部標準方法を使用して抽出物損失を補正した。
【0090】
薄層クロマトグラフィー(TLC)
糖脂質分析のために,pre−coated silica
gel HPTLCプレート上でクルロロホルム−メタノール−酢酸−水(100:20:12:5,v/v/v/v)を利用して実行した。TLC上の糖脂質は,5%硫酸を処理した後,120℃で加熱して検出した。
【0091】
グリセロールリン酸の分析のために,n−ブタノール−ピリジン−水(15:30:20,v/v/v)を利用してTLCを実行した。TLC上でアラニンと糖置換体を検出するために,各々0.5%ニンヒドリン(ブタノール添加)と,5%硫酸(メタノール添加)を使用した。以後,グリセロールリン酸を120℃で加熱して可視化させた。TLCプレートから可視化されたスポット(spot)を集めた後,メタノールを使用してシリカゲルパウダーから試料を抽出してMS分析に使用した。
【0092】
ESI−LIT MS
Ultimate 3000 nano LC coupled
to a LTQ-Orbitrap hybride linear ion trap質量分析計を利用して液体クロマトグラフィー−二重質量分析を実行した。5μlの試料を注入した後,Ultimate 3000 nano LCを利用してZorbax 300 Extended−C18カラム(3.5μm,0.3mm i.d x 150length)に注入した。移動相Aは,0.1%のギ酸(Formic acid)を含む100%水であり,移動相Bは,0.1%ギ酸を含んでいる100%アセトニトリルである。分離はC18カラムを使用した。LCシステムから分離された試料は,エレクトロスプレーイオン化法(ESI)を使用して分析した。試料溶液は高圧(5kVグリセロールリン酸及び4.5kV糖脂質)でメタルキャピラリー(metal capillary)を通じて分当り3μlの速度でイオンソース(ion source)中に注入した。キャピラリー温度は180℃を維持し,シースガス(at a flow rate of 8 arbitrary)として窒素を使用した。分析器機は陰イオンモードで作動させた。イオンエントランスキャピラリー電圧(ion entrance capillary voltage)とチューブレンズオフセット(tube lens offset)は−45Vと−26Vである。MSn破砕(fragmentation)のために35〜37%の標準衝突エネルギー(normalized collision energy)と2.5〜3Daの分離幅(isolation
width)を使用した。最大イオン収集 時間(maximum ion
collection
time)は50msに設定して,3個のマイクロスキャンを利用して平均値を求めた。
【0093】
<実施例 1>
LTA及びLTA糖脂質の構造分析
1H,13C及び2D−NMRスペクトラムによるpLTAの全体的な構造究明
aLTAの1H−NMRスペクトラムにおいて,α−D−N−アセチルグルコサミン(GlcNAc)のアセチル基の共鳴信号(resonance
signal)が化学シフト(chemical shift)(δH)2.1であると報告された。しかし,pLTAの1H−NMRスペクトラムにおいて,
化学シフト(δH)2.1でのピーク形状はaLTAとは異なる様相を見せた。pLTAの共振形状はaLTAに比べて一層広く分布し,自由アセチル基(δH1.9)からの信号は見られなかった(図1)。COSYスペクトラムを利用して分析した結果,δH2.01が(γ−ω)−メチレン−(−CH2-;δH1.28)とオレフィン陽性子(−CH=CH−; δH5.38)と関連があることを確認した(図2)。また,HMQCスペクトラムの分析結果,δH2.01での陽性子がメチレン(CH2; δC27)から割り当てられたことを確認した(図3A)。COSYとHMQCスペクトラム分析に基礎する際,化学シフト(δH)2.01は,脂肪酸にあるアルケニル炭素(−CH2−CH2−CH=CH−CH2−CH2−)に付いているメチレンの信号であることを確認した。結果的に,pLTAはグリセロールリン酸主鎖にGlcNAc置換剤を全く有していないことが分かった。
【0094】
不飽和脂肪酸の存在もδH2.01(CH2−CH=CH)とδH5.38(CH=CH)の信号の相互関係を通じて究明した(図2)。また,1H及び13C
NMRスペクトラムの二つのアノマー陽性子信号[δH5.08(d,J=Hz)及び5.17(d,J=3Hz)]と,二つのアノマー炭素信号[δc96.5及び97.7ppm)とを通じて糖脂質に二つの糖単位が存在することを確認した。糖の測定は,LTA加水分解物のGC/MS分析を通じて実行し(図4),pLTAの糖脂質がグルコースとガラクトースのような糖に置換されたことを確認した。最後に,二つの糖単位のアノマーのJ値(J value)は,D−ピラノースのアノマー中心がα方向であることを示し,δH5.08と5.17の信号は,各々δc96.5と97.7で共鳴するアノマー炭素に相応するα−D−グルコースとα−D−ガラクトースのアノマー陽性子であることを確認した(図3B)。これを通じてpLTAの糖脂質のヘキソースがα結合により結合されていることが分かった。
【0095】
pLTAの糖脂質構造分析
LTAの糖脂質試料をMALDI−TOF MS方法を通じて分析した。
pLTAの糖脂質の質量スペクトラムは二つのグループに分けられる(図5B)。グループIのイオン信号はm/z1103からm/z1227の範囲であり,グループIIではm/z1368からm/z1464の範囲であった。グループIに属する糖脂質は,トリヘキソシル−ジアシル−グリセロール(Hex3−DAG)で判明されたが,C16からC22のアシル鎖を有している。グループIIの糖脂質は,追加的なヘキソース残基またはアシル鎖を有していた。追加的なヘキソース残基は糖脂質のO−アセチル化を通じて確認した(図6A)。
【0096】
ヒドロキシル残基のアセチル化は42質量単位の増加を誘発する。pLTAのグループI糖脂質は,420質量単位(10ヒドロキシル残基)の増加を見せ,トリヘキソースグループであると判明した(図6B)。また,グループIIにある大部分の糖脂質が378質量単位(9ヒドロキシル残基)ほど増加した。O−アセチル化分析によれば,グループIIの糖脂質はヘキソース残基に追加的なアシル鎖を有することが分かる(図7)。
【0097】
追加的に,スペクトラムで12質量単位の差を見せたが,これはアルケニル炭素の追加または減少を意味するもので,糖脂質が不飽和脂肪酸鎖を有していると判断できる。このような可能性はCOSY
NMRを通じて確認した(図2)。pLTA糖脂質の分子構成に対する予測は,図8に示した。次に,二重MS分析のために,ESI−FT
MS(陰イオンモード)を利用して糖脂質を分析し(図9),そこから代表的なピークを選択・分析してアシル鎖の分布を決定した(図10A及び図10B)。
【0098】
結果的に,pLTAの糖脂質の構造は,図9に示したように,三つのヘキソース主鎖を有しており,不飽和脂肪酸を含むトリヘキソシル−ジアシルグリセロール(グループI)とトリヘキソシル−トリアシルグリセロール(グループII)となっており,アシル鎖は平均18個の炭素数を有することが分かる。
【0099】
aLTAの糖脂質構造分析
aLTAの場合,糖脂質の質量対電荷(m/z)の割合がC15からC21の鎖長さを有する脂肪酸であることを確認した(図5A,図11)。aLTAの糖脂質において大部分のm/z信号は294質量単位が増加した。これは7個のヒドロキシルグループのアセチル化が発生したことを意味するもので,二つのヘキソースに該当する。結果的に,aLTAの糖脂質はジヘキソシルグループを有していることと判明した。また,糖脂質の脂肪酸アシル鎖の存在はマイルドアルカリ加水分解を通じて確認することができた(図12)。
【0100】
dLTA,rLTA及びsLTAの糖脂質構造分析
dLTA,rLTA及びsLTAの糖脂質部位の構造を分析するためにMALDI−TOF分析を実行した。dLTAはラクトバチルス・デルブルッキ(L. delbreukii),rLTAはラクトバチルス・ラムノ−サス(L. rhamnosus),sLTAはラクトバチルス・サケイ(L. sakei)由来のLTAを各々示す。
【0101】
図13に示したように,MALDI−TOF分析結果,dLTA由来糖脂質は,pLTAと同様にトリヘキソシル−ジアシルグリセロールとトリヘキソシル−トリアシルグリセロールを有する二つのグループに分けられ,それ以外にも四つのアシル鎖を有する三番目のグループが存在することが観察された。また,アシル鎖の平均炭素数は18個であることが観察された。rLTA由来糖脂質は,pLTAより全体的に分子量が少ない二つのグループに観察された。糖一つの分子量が160Daなので三つのヘキソースではない二つのヘキソース主鎖からなるジヘキソシル−ジアシルグリセロールとジヘキソシル−トリアシルグリセロールを有することが観察された。アシル鎖の平均炭素数は15個であった。sLTA由来糖脂質もジヘキソシル−ジアシルグリセロールとジヘキソシル−トリアシルグリセロールとして,平均炭素数が18個でアシル鎖の長さがrLTAより長いことが観察された。
【0102】
<実施例2>
LTA由来糖脂質の抗炎症効果
LTA由来糖脂質のTNF−α発現抑制効果
Intact LTA,これから分離したLTA由来糖脂質及びLTA由来ポリグリセロ−ルリン酸を各々100μg/mlずつTHP−1細胞に4時間の間処理した後,培養液からTNF−αの発現量をELSIA方法を通じて測定した。
【0103】
図14に示したように,Intact aLTAは,高いTNF−αの発現を誘導したが,Intact pLTAはTNF−αの発現を誘導しなかった。また,aLTA由来の糖脂質及びポリグリセロールリン酸もIntact
aLTAより発現量は少ないがTNF−αの発現をかなり誘導したが,pLTA由来の糖脂質及びポリグリセロールリン酸は,TNF-αの発現をほとんど誘導しなかった。これを通じてIntact pLTAだけではなくpLTA由来の糖脂質もaLTAと異なりTNF-αの発現を誘導しないことが分かる。
【0104】
LTA変形による抗炎症効果実験
aLTA及びpLTAを変形(modification)した後,活性を測定するための実験を実行した。まず,ポリグリセロールリン酸のD−アラニンを除去するためにTris-HClpH8.5にLTAをO/Nで培養した。また,糖脂質の脂肪酸アシル鎖を除去するために0.1N NaOHを使用してLTAを処理した。以後,pHを中和させた後,オクチルクロマトグラフィーを利用して変形されたLTAを精製し,凍結乾燥した後に定量して実験に使用した。THP−1細胞に100μg/mlのD−アラニンを除去したLTA(de−alanine)と,脂肪酸アシル鎖を除去したLTA(de−acyl)と,を18時間前処理した後に,0.5μg/mlのLPSを4時間再処理した。以後,培養液からTNF-αの発現程度をELISA方法を通じて測定した。
【0105】
図15は,aLTAを利用した実験結果を示す。aLTAの場合,Intact
aLTAを前処理したTHP−1細胞でLPSによるTNF−α発現を抑制する効果が多少あったが,D−アラニンと脂肪酸アシル鎖を除去したaLTA(de−alanine,de−acyl)はほとんどこのような効果がなかった。
【0106】
図16は,pLTAを利用した同一な実験の実行結果を示す。aLTAと異なりIntact
pLTAはLPSによるTNF-αの発現を大部分抑制し,ポリグリセロールリン酸アラニンを除去したpLTA(de−alanine)の場合にも同一な効果を示した。しかし,糖脂質のアシル鎖を除去したpLTA(de−acyl)はTNF−αの発現抑制効果を見せなかった。
【0107】
このような結果は,aLTAとpLTAがお互いに異なる生物学的特性を有していることを示し,特に,pLTAのTNF−α発現抑制効果において,ポリグリセロールリン酸内のD−アラニンよりは糖脂質のアシル鎖のほうが一層重要に作用していることを示す。
【0108】
pLTA由来糖脂質の抗炎症効果
pLTAから分離した糖脂質の抗炎症効果を調べるために,THP−1細胞に多様な濃度の糖脂質を20時間の間前処理した後,10μg/mlのflexPGNを4時間の間再処理した。以後,培養液からTNF−αの発現程度をELISA方法を通じて測定した。
【0109】
図17に示したように,10μg/mlのflexPGNだけを処理した細胞の場合,高濃度のTNF-α発現を誘導した。しかし,糖脂質を前処理した細胞において前処理濃度によってTNF−αの発現が減少することを観察した。このような発現抑制効果は,同一な濃度のIntact
pLTAに比しては多少低いが,pLTAの糖脂質部位だけでも十分なTNF-αの発現抑制効果を誘発することを示す。
【0110】
他のLTA由来糖脂質の抗炎症効果
THP−1細胞(5×105cells/ml)にLPS(LPS from
E. coli 111:B4)と実験例に記載された方法により各々のLTA(aLTA,rLTA,pLTA,dLTA,sLTA)から分離した糖脂質0.1μg/mlを6時間処理した後,培養液からTNF-αの発現量をELSIA方法を通じて測定した。
【0111】
図18は,お互いに異なるLTAから分離した糖脂質のTNF-αの発現抑制効果を示す。aLTA及びsLTA由来の糖脂質は,TNF-αの発現抑制効果がほとんどないが,rLTA,pLTA及びdLTA由来の糖脂質は,非常に効果的にTNF-αの発現を抑制することが分かる。
【0112】
<実施例3>
pLTAの抗炎症効果に対するイン・ビトロ(in vitro)実験
pLTAによるShigella flexneriペプチドグリカン(PGN)−誘導TNF−α及びIL−1βの発現抑制効果実験
人間単核球細胞の一つであるTHP−1細胞を熱処理した10%非活性FBSと100U/mlペニシリンと100μg/mlストレプトマイシンとが含まれたRPMI1640培地を使用して,37℃,5%CO2条件下で培養した。THP−1細胞を利用したサイトカイン誘導実験を実行するために,4x105個の細胞/wellを96−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。多様な濃度(0〜100μg/ml)のpLTAを24時間前処理した後,10μg/mlのペプチドグリカンを4時間の間再処理した。
【0113】
TNF-α及びIL−1βの発現量測定は,細胞培養物から遠心分離を通じて細胞上澄液を回収した後,一般的なサンドイッチELISA方法を利用して実行した。ELISA実験は,各々R&D
systemsから購入したanti−TNF−α monoclonal mouse IgG1(clone #28410)/biotinylated anti−human TNF−α specific goat IgGと,anti−human
IL−1β monoclonal
mouse IgG1(clone 2805)/biotinylated
anti−human IL−1β specific goat IgGを使用して行い,ストレプトアビジンHRPを処理した後にサブストレートとしてO−フェニレンジアミンを使用して発光させた。ELISAリーダーを使用してOD
450nmの測定値からOD 550nmの測定値を減算した値を有効値で使用した。
【0114】
図19に示したように,LTAを前処理する場合,ペブチドクリカンにより発現が増加するTNF−α(図19A)とIL−1β(図9B)の発現が,LTAの濃度が増加することに従って減少した。このような炎症性サイトカインの発現抑制が内毒素によるものであるか否かを確認するためにポリミキシンBを利用した実験を実行した。ポリミキシンBはLPSのlipid
Aと結合してLPSの活性を抑制する役割をする。したがって,前記の実験結果が内毒素によるものであれば,ポリミキシンBを処理する場合,炎症性サイトカインの発現抑制現象が発生しないはずである。しかし,pLTAによるTNF−αの発現抑制はポリミキシン(polymyxin)Bが含まれた培地下でも誘導された。このような結果は,LTAによる耐性誘導が内毒素(LPS)により誘導されないことを意味する(図19C)。
【0115】
グラム陰性菌のペプチドグリカンは,兔疫細胞のNOD2を刺激することでこれら細胞から多量のプロ−炎症性サイトカインの発現を増加させる。しかし,pLTAを兔疫細胞に前処理することによりグラム陰性菌のペプチドグリカンによるプロ−炎症性サイトカインの特異的な発現を抑制することができる。
【0116】
pLTAによるペプチドグリカン−誘導NOD2の発現抑制効果実験
pLTAによる敗血症関連収容体NOD2の発現変化測定を次のように実行した。8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。100μg/mlのpLTAを24時間の前処理した後,10μg/mlのS. flexneriペプチドグリカンを再処理して2時間間培養した。遠心分離を通じて各々の細胞を採取してから,全体RNAからcDNAを合成した後,real−time
PCRを使用してNOD2の発現変化を測定した。NOD2のタンパク質変化はウエスタンブロッティングを使用して測定した。上述した条件でpLTAを前処理したTHP−1細胞にペプチドグリカンを2時間処理した。細胞を破砕した後,SDS−PAGEローディング染料を添加して5分間沸騰させ,12%SDS-PAGEを通じてタンパク質を分離した。分離されたタンパク質をナイロンメンブレインに移した後,抗−TLR2,−TLR4,−NOD2抗体を利用してウエスタンブロッティングを実行した。
【0117】
S. flexneriペプチドグリカンによる過度な炎症反応誘導において,NOD2の役割を究明するために次のような実験を実行した。NOD2発現ベクターとpNF−κB−Luc/pRL−SV40ベクターをU937細胞に形質転換させた。24時間後に形質転換された各々の細胞に100μg/mlのpLTAで24時間前処理して,10μg/mlのペプチドグリカンを12時間の間再処理した。マイクロプレートリーダー機を利用して測定されたNF−κBの活性をRenillaの活性値で分けてNOD2発現量によるNF−κBの活性変化を測定した。
【0118】
図20によれば,S. flexneriペプチドグリカンは,THP−1細胞からNOD2の発現を顕著に増加させる。一方,pLTAを前処理した細胞でのNOD2
mRNAの発現は,pLTAの前処理濃度が増加するにしたがって減少した(図20A)。また,pLTAを前処理した細胞でのNOD2タンパク質発現量もpLTAを前処理しなかった細胞に比べて大きく減少した(図20B)。このような結果は,pLTAが敗血症関連収容体NOD2の発現を抑制することよって,NOD2とペプチドグリカンとの相互作用を通じた信号伝逹を抑制させることを意味する。
【0119】
また,pLTAを前処理した細胞でのペプチドグリカン−誘導NF−κB活性がpLTAを前処理しなかった細胞に比べて大きく減少することが確認できる(図20C)。しかし,NOD2発現ベクターを形質転換させることによりこのようなNF−κBの活性抑制が消えた。このような結果は,NOD2がペプチドグリカンの主な収容体として作用していることを意味し,また,pLTAを前処理することによりNOD2の主な転写因子であるNF−κBの活性を抑制させて,結果的にNOD2のmRNA発現を阻害させることを意味する。
【0120】
pLTAとTLR2の関連性実験
pLTAによるサイトカインの発現抑制作用において,TLR2との関連性を試すためにTLR2
siRNA実験を実行した。TLR2をターゲットにするsiRNA duplexは Santacruz Biotechnology(Santa Cruz,SA)から購入した。TLR2 siRNAとコントロール
siRNAをTransIT−TKO感染試薬(Mirus,WI)を使用してTHP−1細胞に形質転換させた後,72時間の間培養した。TLR2
siRNAとControl siRNAが形質転換された細胞に,100μg/mlのpLTAを24時間の間前処理した後,10μg/mlのペプチドグリカンを4時間再処理して培養液からTNF-αの発現量をELISA方法を使用して測定した。
【0121】
また,他の実験として,TLR2がノックアウトされたマウス(C57BL/6)から骨髓油来の大食細胞(BMM)を分離した後,96wellプレートに株分けして37℃,5%CO2下で24時間の間培養した。BMMに100μg/mlのpLTAを24時間前処理した後,10μg/mlのペプチドグリカンを4時間の間再処理して培養液からTNF−αの発現量をELISA方法を通じて測定した。
【0122】
図21に示したように,コントロールsiRNAを形質転換させたTHP−1細胞では,pLTA
前処理による耐性誘導が発生することによりペプチドグリカン−誘導TNF−αの発現が減少した(図21A)。一方,TLR2
siRNAを形質転換させたTHP−1細胞では,このような発現減少が発生しなかった(図21B)。このような結果は,TLR2がノックアウトされたBMMでも見られるが,正常なマウスから分離したBMMの場合,ペプチドグリカンの濃度によってTNF−αの発現が増加したが,このような発現増加はpLTAの前処理により減少した(図21C)。一方,TLR2−/−BMMの場合,pLTAを前処理したか否かに関係なくペプチドグリカンの濃度にしたがってTNF-αの発現が増加した(図21D)。このような結果は,ペプチドグリカン−誘導TNF−αの過発現に対するpLTAの耐性誘導はTLR2が必須的な収容体として作用していることを意味する。
【0123】
pLTAによるNF−κBの活性及びTNF−αの発現抑制
内毒素LPSの処理によるTNF−αの過発現は,MAPキナーゼのリン酸化とNF−κBの活性増加により発生する。pLTAがこのようなMAPキナーゼのリン酸化とNF−κBの活性にどのような影響を及ぶか調べるために,次のようにウエスタンブロッティング及び免疫蛍光染色実験を実行した。
【0124】
ウエスタンブロッティング:8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で,24時間培養して細胞を安定化させた。100μg/mlのpLTAを24時間前処理した後,0.1μg/mlのLPSを添加して1時間の間追加培養した。遠心分離を通じて細胞を採取した後,Laemmliバッファーで細胞を破砕した。SDS−PAGEローディング染料を添加して5分間沸かした後,12%SDS−PAGEを通じてタンパク質を分離した。分離されたタンパク質をナイロンメンブレインに移した後,抗リン酸化−MAPキナーゼ抗体(anti-phospho ERK及びanti-phospho JNK),抗NF−κB抗体,抗β−actin抗体を利用してウエスタンブロッティングを実行した。
【0125】
免疫蛍光染色(immunofluorescence staining):8x105個のTHP−1細胞/wellを24−wellプレートに移した後,37℃,5%CO2条件下で24時間培養して細胞を安定化させた。100μg/mlのpLTAまたは培地のみを24時間前処理した後,0.5μg/mlのLPSを再処理して2時間の間培養した。培養した細胞を15分間3,500rpmで遠心分離してスライドグラス上に付着させた後,4%パラホルムアルデヒドで細胞を固定させた。以後,0.5%のトリトンX−100(Triton X−100)で細胞膜の透過性を増加させて,抗−NF−κB p50と抗−NF−κB p65抗体を2時間の間処理した。また,donkey由来の抗−マウスIgG−FITC抗体を90分間処理した後,共焦点顕微鏡を使用して細胞内でのNF−κB p50とNF−κB p65のリン酸化程度を測定した。
【0126】
図22に示したように,pLTA処理によりMAPキナーゼの活性が減少することが確認された(図22A)。すなわち,pLTA耐性を与えない細胞の場合,LPS処理後60分たった時,ERKとJNKの活性(リン酸化)が急激に増加した。一方,pLTA耐性を与えた細胞の場合,このような活性が耐性を与えない細胞に比べて低いことが確認された。
【0127】
LPS−誘導NF−κB活性は,IKKキナーゼのリン酸化を必要とする。活性化されたIKKは,I−κBタンパク質群のリン酸化を誘発してNF−κBからI−κBが分離される。NF−κBは核内に移動して細胞付着,サイトカイン,サイトカイン収容体などに対する遺伝子の転写を増加させる。本実験結果,pLTA耐性を与えない細胞の場合,I−κBαの分解がLPSを処理した後にはやく行われた。しかし,pLTA耐性を与えた細胞の場合,このようなI−κBα分解発生が少ないことを確認した(図22B)。このような結果は,NF-κBの活性が,pLTA耐性を与えた細胞で耐性を与えなかった細胞に比べて抑制されることを意味する。
【0128】
これを確認するために,抗NF−κB抗体を利用した免疫蛍光染色法を実行してpLTA耐性によるNF−κB活性の抑制を確認した(図22C)。このような一連の信号伝逹関連要素の活性抑制は,pLTAがLPSにより誘導されたTNF-αの過発現を抑制する主要原因として作用することを意味する。
【0129】
<実施例4>
pLTAの抗炎症効果に対するイン・ビボ(in vivo)実験
pLTAの敗血症抑制効果
4週齢の雄マウス(BALB/c,15匹)に300mg/kgのpLTAまたはPBSを腹腔注射した後,24時間後に200μlの敗血症誘発水溶液(250mg/kg aLTA+25mg/kg
MDP)を腹腔注射して内毒素性ショックを誘発した。マウスの生存率は敗血症誘発後に4日目まで観察した。
【0130】
また,他の実験として,pLTAを腹腔注射したマウスとPBSを腹腔注射したマウス(各5匹)に敗血症誘発物質を注射した。12時間後に心臓採血を通じてセラムを分離し,ELISA方法を通じて血液内TNF−αの含有量を測定した。
【0131】
図23に示したように,PBSを前処理したマウスの場合,敗血症誘発物質を腹腔注射した時,48時間以内に皆敗死した。一方,pLTAを前処理したマウスの場合,4日目まで約90%の生存率を示した(図23A)。また,pLTAを前処理したマウスの場合,血液内で発見されるTNF−αの量がPBSを前処理したマウスの血液内のTNF−α量に比べて顕著に低く測定されることを確認した(図23B)。
【0132】
このような結果は,pLTAがaLTA+MDPにより生体内で誘導される過度な炎症反応を抑制し,また,グラム陽性菌由来の敗血症を抑制するにおいて効果的であることを意味する。
【0133】
pLTA処理によるアトピー性皮膚疾患の緩和効果
アトピー性皮膚疾患は,バクテリアの感染,化学薬品に対する露出など多様な原因により発生する。4週齢のSPF(Specifirc pathogen free)雄ICRマウス(中央実験動物)及び4週齢のSPF雄NC/Ngaマウス(中央実験動物)を購入して7日間実験動物飼育室で適応させた後に実験に使用した。試験群当りICRマウス20匹,NC/Ngaマウス5匹ずつ二つの群に分けた。すべての試験群の場合,試験物質塗布前日に背部位を除毛し,アトピー性皮膚炎誘発は,以前研究を参考して1%DNCBを4日間隔で2回塗布し,以後,3日間隔で4週間0.2%のDNCB溶液を背に塗布した。アトピーの形成後,350μg/kgのpLTAを腹腔注射してから皮膚病変を観察した。血液内のTh2の偏向性と関連して皮膚炎掻痒付近の皮膚組職内に皮膚炎症及びアトピー関連サイトカイン(IL−4)の分布と水準を測定するためにIHC(Immuno-histochemistry)法を使用した。
【0134】
図24に示したように,DNCBの塗布結果,ICRモデル及びNC/Ngaモデルの両方とも肉眼で全体背部位で紅斑,むくみだけではなく痂皮脱皮と膿瘍性丘疹及び,個体によってひどい場合出血所見まで見られ,人のアトピー皮膚炎の症状と非常に類似した皮膚病変を示した。また,皮膚炎程度においても他のモデルに比べて強く誘発された。しかし,このような現状は,pLTAを注射することで緩和されることが観察された(図24A)。アトピー性皮膚炎の原因と言われるTh2偏向現状を観察するために発病された皮膚組織内の関連cytokineの水準を測定するためにIHCを測定した。測定結果,ICR及びNCの2個の全ての群で皮膚組職内のIL−4が有意的に上昇して分布したが,IFN−rの場合は別に別段差がなかった。一方,pLTAを処理したマウスの場合,皮膚組職内のIL−4の分布が減少することが確認された(図24B)。このような結果は,pLTAがTh2反応を誘導するIL−4の発現を抑制させることでアトピーの症状を減少させたことを意味する。
【0135】
<実施例5>
他のLTAの抗炎症効果実験
rLTAの抗炎症効果
他の種類の乳酸菌 L. rhamnosus(rLTA)から分離したLTAの抗炎症効果を調査するために,THP−1細胞に100μg/ml濃度のrLTAを処理して4時間の間刺激した。以後,培養液からTNF−αの発現量をELISA方法を通じて測定した。
【0136】
図25に示したように,rLTAの前処理濃度が増加するにしたがってTNF−αの発現量は減少した。
【0137】
aLTA,rLTA,pLTA,dLTA,sLTAの抗炎症効果比較
THP−1 cellにLPSと各々のLTAを処理してTNF-αの発現量を確認した。
図26に示したように,10μg/ml濃度で処理した時,aLTA及びsLTAはTNF−αの発現を抑制できなかったが,残りのLTAは効果的にTNF−αの発現を抑制することが分かる。
【0138】
また,LTA別にTNF−αの発現様相が異なる理由は,各々のLTAがその構造的な差により細胞信号経路(cell signal pathway)活性にお互いに異なる影響を及ぼしているはずであると仮定し,これを確認するために細胞信号経路に関連された信号抑制剤(signal inhibitor)を処理した後にLTA別にTNF−αの生成を確認した。
【0139】
その結果,図27及び各LTAのTNF−a発現抑制率を定量化して示した下記の表1のように,特定信号抑制剤を処理した時,TNF−a発現が減少するか増加することを確認した。これを通じてLTAの構造的な差が特定の細胞信号経路にお互いに異なる影響を与えることを確認した。
【0140】
【表1】

【0141】
<実施例6>
pLTA由来糖脂質を利用した抗体反応の誘発
マウスをB型肝炎ウイルス表面抗原(“HBsAg”)2.5μgで0日目に1次免疫化させた。21日目には前記マウスを2次免疫化させた(200μl/注入)。前記1次免疫化した後の第20日と2次免疫化後の第27日にマウスから採血した。血清を収集して抗−HBsAg抗体に対する標準ELISAで検査した。下記表2は,本発明の糖脂質がHBsAgと一緒に動物に投与された時,抗−HBsAg抗体の生産を誘導することを示す。
【0142】
【表2】

【0143】
<製造例1>
pLTAを含む医薬
散剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
乳糖100mg
タルク10mg
前記成分を混合して気密布に充填して散剤を製造する。
錠剤の製造
pLTAまたはpLTA誘導体 (analogues)5mg
トウモロコシ澱粉100mg
乳糖100mg
ステアリン酸マグネシウム2mg
前記成分を混合した後に通常の錠剤製造方法によって打錠して錠剤を製造する。
カプセル剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
結晶性セルロース3mg
ラクトース14.8mg
マグネシウムステアレイト0.2mg
通常のカプセル剤製造方法によって前記成分を混合してゼラチンカプセルに充填してカプセル剤を製造する。
注射剤の製造
pLTAまたはpLTA誘導体(analogues)50 mg
マンニトール180mg
注射用滅菌蒸溜水2974mg
Na2HPO412H2O26mg
通常の注射剤製造方法によって1アンプル当り(2ml)前記成分含量で製造する。
液剤の製造
pLTAまたはpLTA誘導体(analogues)10mg
異性化糖10g
マンニトール5g
精製水適量
通常の液剤製造方法によって精製水に各々の成分を加えて溶解させて,レモン香を適量加えた後に前記成分を混合して,精製水を加えて全体を精製水を加えて全体100mlで調節した後,茶色瓶に充填して滅菌し液剤を製造する。
【0144】
<製造例2>
pLTAを含む健康食品
pLTAまたはpLTA誘導体(analogues)100mg
ビタミン混合物適量
ビタミンAアセテート70μg
ビタミンE1.0mg
ビタミンB10.13mg
ビタミンB20.15mg
ビタミンB60.5mg
ビタミンB120.2μg
ビタミンC10mg
ビオチン10μg
ニコチン酸アミド1.7mg
葉酸50μg
パントテン酸カルシウム0.5mg
無機質混合物適量
硫酸第一鉄1.75mg
酸化亜鉛0.82mg
炭酸マグネシウム25.3mg
リン酸二水素カリウム15mg
リン酸カルシウム55mg
クエン酸カリウム90mg
炭酸カルシウム100mg
塩化マグネシウム24.8mg
前記ビタミン及びミネラル混合物の造成比は,比較的健康食品に適合な成分を好ましい実施例で混合して造成したが,その配合比を任意に変形実施しても構わず,通常の健康食品製造方法によって前記成分を混合した後,課粒を製造して,通常の方法によって健康食品組成物製造に使用することができる。
【0145】
<製造例3>
pLTAを含む飲料
pLTAまたはpLTA誘導体(analogues)100mg
ビタミンC15g
ビタミンE(粉末)100g
乳酸鉄19.75g
酸化亜鉛3.5g
ニコチン酸アミド3.5g
ビタミンA0.2g
ビタミンB10.25g
ビタミンB20.3g
水定量
通常の健康飲料製造方法によって前記成分を混合して,約1時間の間85℃で撹拌加熱した後,作られた溶液を濾過して滅菌された2l容器に取得して密封滅菌して冷蔵保管した後,本発明の健康飲料組成物製造に使用する。
【0146】
前記造成比は,比較的嗜好飲料に適合な成分を好ましい実施例で混合造成したが,需要階層や,需要国家,使用用度など地域的,民族的嗜好度によってその配合比を任意に変形実施しても構わない。
【0147】
<製造例4>
pLTAを含む飲料
柔軟化粧水(スキン)の製造
pLTAまたはpLTA誘導体(analogues)0.1重量%
グリセリン3.0重量%
ブチレングリコール2.0重量%
プロピレングリコール2.0重量%
ポリオキシエチレン(60)硬化ヒマシ油1.00重量%
エタノール10.0重量%
トリエタノールアミン0.1重量%
防腐剤微量
色素微量
香料微量
精製水残量
栄養化粧水(ローション)の製造
pLTAまたはpLTA誘導体(analogues)0.1重量%
シトステロール1.70重量%
オレイン酸ポリグリセリル−2 1.50重量%
セテアレス−4 1.2重量
コレステロール1.5重量
ジセチルホスフェート0.4重量%
濃グリセリン5.0重量%
サンフラワーオイル10.0重量%
カルボキシビニルポリマー 0.2重量%
キサンタンガム0.3重量%
防腐剤微量
香料微量
精製水残量
【0148】
<製造例5>
pLTAを含むアジュバント
pLTAを含むアジュバントの製造
pLTAまたはpLTA誘導体(analogues)25μg
ジオレオイルホスファチジルコリン(DOPC)500μg
コレステロール125μg
ホスフェートNaCl緩衝溶液及び水残量
合計0.5ml
前記成分からなるアジュバントをWO96/33739に記述されたように製造する。
【0149】
【表3】

【特許請求の範囲】
【請求項1】
α結合により結合された二重または三重ヘキソースのC1,C3,C4及びC6番の位置の中でいずれか1ヶ所以上にC10乃至C30の飽和または不飽和された2乃至6個のアシル鎖が結合されていることを特徴とする糖脂質。
【請求項2】
前記糖脂質は,下記の化学式(I)の構造を有することを特徴とする請求項1に記載の糖脂質:
【化16】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,
【化17】

であり,
この時,R’は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
nは,0または1であり,
Cmは,C4乃C30のアルキルであり,
前記糖脂質内のアシル鎖の総数は,2乃至6である。
【請求項3】
R1は,
【化18】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R2乃至R4は,ヒドロキシであり,
nは,1であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項2に記載の糖脂質。
【請求項4】
R1は,
【化19】

であり,
R2,R3またはR4の中でいずれの一つは,
【化20】

であり,残りはヒドロキシであり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
nは,1であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項2に記載の糖脂質。
【請求項5】
前記化学式(I)は,下記化学式(I−1)または化学式(I−2)であることを特 とする請求項2に記載の糖脂質:
【化21】

【化22】

【請求項6】
前記糖脂質は,乳酸菌由来であることを特徴とする請求項1に記載の糖脂質。
【請求項7】
前記乳酸菌は,ラクトバチルス,ビフィドバクテリウム,ストレプトコッカスまたはラクトコッカス属であることを特徴とする請求項6に記載の糖脂質。
【請求項8】
前記乳酸菌は,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei),ビフィドバクテリウム・ ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis) ,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)またはラクトコッカス・ラクティス(Lactococcus lactis)であることを特徴とする請求項7に記載の糖脂質。
【請求項9】
アシル鎖が結合されなかったヘキソースのC6位置にポリグリセロールリン酸が追加で結合されたことを特徴とする請求項1に記載の糖脂質。
【請求項10】
前記糖脂質は,下記の化学式(II)の構造を有することを特徴とする請求項9に記載の糖脂質:
【化23】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,
【化24】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン(N−acetylglucosamine),D−アラニン(D−alanine)またはヒドロキシであり,
nは,0または1であり,
Cmは,C4乃至C30のアルキルであり,
lは,0乃至80であり,
前記糖脂質内のアシル鎖の総数は,2乃至6である。
【請求項11】
R1は,
【化25】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
R2乃至R4は,ヒドロキシであり,
nは,1であり,
lは,0乃至80であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項10に記載の糖脂質。
【請求項12】
R1は,
【化26】

であり,
R2,R3またはR4の中でいすれか一つは,
【化27】

であり,残りはヒドロキシであり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
nは,1であり,
lは,0乃至80であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項10に記載の糖脂質。
【請求項13】
前記化学式(II)は,下記化学式(II−1)または化学式(II−2)であることを特徴とする請求項10に記載の糖脂質:
【化28】

【化29】

前記式において,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
lは,0乃至80である。
【請求項14】
前記糖脂質は,乳酸菌由来のリポタイコ酸であることを特徴とする請求項9に記載の糖脂質。
【請求項15】
前記乳酸菌は,ラクトバチルス,ビフィドバクテリウム,ストレプトコッカスまたはラクトコッカス属であることを特徴とする請求項10に記載の糖脂質。
【請求項16】
前記乳酸菌は,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei),ビフィドバクテリウム・ ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis),ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)またはラクトコッカス・ラクティス(Lactococcus lactis)であることを特徴とする請求項10に記載の糖脂質。
【請求項17】
請求項1乃至請求項16の中でいずれの一項による糖脂質を含むことを特徴とする薬学組成物。
【請求項18】
抗生剤,担体,賦形剤及び希釈剤からなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項17に記載の薬学組成物。
【請求項19】
薬学組成物の剤形は,散剤,顆粒剤,錠剤,カプセル剤,懸濁液,乳剤,シロップ,エアロゾルの経口製剤,外用剤,坐剤または滅菌注射液剤であることを特徴とする請求項17に記載の薬学組成物。
【請求項20】
糖脂質は,薬学組成物100重量部に対して0.01乃至99.9重量部で含まれることを特徴とする請求項17に記載の薬学組成物。
【請求項21】
請求項1乃至請求項16の中でいずれか一項による糖脂質を含むことを特徴とする炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項22】
炎症性疾患または免疫関連疾患は,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症候群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,
好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患であることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項23】
薬学組成物の投与形態は,経口,直腸または静脈,筋肉,皮下,子宮内硬膜または脳血管内注射であることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項24】
糖脂質は,1日投与量が0.01乃至10,000mg/kgであることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物 。
【請求項25】
請求項1乃至請求項16の中でいずれの一項による糖脂質を含む ことを特徴とする食品組成物。
【請求項26】
有機酸,リン酸塩,抗酸化剤,乳糖カゼイン,デキストリン,葡萄糖,砂糖及びソルビートルからなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項25に記載の食品組成物。
【請求項27】
糖脂質は,食品組成物100重量部に対して0.01乃至99.9重量部で含まれることを特徴とする請求項25に記載の食品組成物。
【請求項28】
食品組成物の剤形は,固形,粉末,顆粒,錠剤,カプセルまたは液状形態であることを特徴とする請求項25に記載の食品組成物。
【請求項29】
請求項1乃至請求項16の中でいずれか一項による糖脂質を含むことを特徴とする化粧品組成物。
【請求項30】
ビタミン,アミノ酸,タンパク質,界面活性剤,乳化剤,香料,色素,安定製,防腐剤,抗酸化剤,紫外線遮断剤,pH調整剤及びキレート剤からなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項29に記載の化粧品組成物。
【請求項31】
請求項1乃至請求項16の中でいずれか一項による糖脂質からなるか,これを含むことを特徴とするアジュバント。
【請求項1】
α結合により結合された二重または三重ヘキソースのC1,C3,C4及びC6番の位置の中でいずれか1ヶ所以上にC10乃至C30の飽和または不飽和された2乃至6個のアシル鎖が結合されていることを特徴とする糖脂質。
【請求項2】
前記糖脂質は,下記の化学式(I)の構造を有することを特徴とする請求項1に記載の糖脂質:
【化16】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,
【化17】

であり,
この時,R’は各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
nは,0または1であり,
Cmは,C4乃C30のアルキルであり,
前記糖脂質内のアシル鎖の総数は,2乃至6である。
【請求項3】
R1は,
【化18】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R2乃至R4は,ヒドロキシであり,
nは,1であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項2に記載の糖脂質。
【請求項4】
R1は,
【化19】

であり,
R2,R3またはR4の中でいずれの一つは,
【化20】

であり,残りはヒドロキシであり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
nは,1であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項2に記載の糖脂質。
【請求項5】
前記化学式(I)は,下記化学式(I−1)または化学式(I−2)であることを特 とする請求項2に記載の糖脂質:
【化21】

【化22】

【請求項6】
前記糖脂質は,乳酸菌由来であることを特徴とする請求項1に記載の糖脂質。
【請求項7】
前記乳酸菌は,ラクトバチルス,ビフィドバクテリウム,ストレプトコッカスまたはラクトコッカス属であることを特徴とする請求項6に記載の糖脂質。
【請求項8】
前記乳酸菌は,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei),ビフィドバクテリウム・ ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis) ,ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)またはラクトコッカス・ラクティス(Lactococcus lactis)であることを特徴とする請求項7に記載の糖脂質。
【請求項9】
アシル鎖が結合されなかったヘキソースのC6位置にポリグリセロールリン酸が追加で結合されたことを特徴とする請求項1に記載の糖脂質。
【請求項10】
前記糖脂質は,下記の化学式(II)の構造を有することを特徴とする請求項9に記載の糖脂質:
【化23】

前記式において,
R1乃至R4は,各々独立的にヒドロキシ,
【化24】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン(N−acetylglucosamine),D−アラニン(D−alanine)またはヒドロキシであり,
nは,0または1であり,
Cmは,C4乃至C30のアルキルであり,
lは,0乃至80であり,
前記糖脂質内のアシル鎖の総数は,2乃至6である。
【請求項11】
R1は,
【化25】

であり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
R2乃至R4は,ヒドロキシであり,
nは,1であり,
lは,0乃至80であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項10に記載の糖脂質。
【請求項12】
R1は,
【化26】

であり,
R2,R3またはR4の中でいすれか一つは,
【化27】

であり,残りはヒドロキシであり,
この時,R’は,各々独立的にC10乃至C30の飽和または不飽和されたアシル鎖であり,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
nは,1であり,
lは,0乃至80であり,
1乃至14個の二重結合を有するアシル鎖を一つ以上含むことを特徴とする請求項10に記載の糖脂質。
【請求項13】
前記化学式(II)は,下記化学式(II−1)または化学式(II−2)であることを特徴とする請求項10に記載の糖脂質:
【化28】

【化29】

前記式において,
R’’は,各々独立的にN−アセチルグルコサミン,D−アラニンまたはヒドロキシであり,
lは,0乃至80である。
【請求項14】
前記糖脂質は,乳酸菌由来のリポタイコ酸であることを特徴とする請求項9に記載の糖脂質。
【請求項15】
前記乳酸菌は,ラクトバチルス,ビフィドバクテリウム,ストレプトコッカスまたはラクトコッカス属であることを特徴とする請求項10に記載の糖脂質。
【請求項16】
前記乳酸菌は,ラクトバチルス・プランタラム(Lactobacillus plantarum),ラクトバチルス・ラムノーサス(Lactobacillus rhamnosus),ラクトバチルス・デルブルッキ(Lactobacillus delbrueckii),ラクトバチルス・アシドフィルス(Lactobacillus acidophilus),ラクトバチルス・ガセリ(Lactobacillus gasseri),ラクトバチルス・ジョンソニイ(Lactobacillus johnsonii),ラクトバチルス・ヘルベティカス(Lactobacillus helveticus),ラクトバチルス・カゼイ(Lactobacillus casei),ビフィドバクテリウム・ ビフィド(Bifidobacterium bifido),ビフィドバクテリウム・ロンガム(Bifidobacterium longum),ビフィドバクテリウム・インファンティス(Bifidobacterium infantis),ビフィドバクテリウム・アニマリス(bifidobacterium animalis),ストレプトコッカス・サーモフィルス(Streptococcus thermophilus)またはラクトコッカス・ラクティス(Lactococcus lactis)であることを特徴とする請求項10に記載の糖脂質。
【請求項17】
請求項1乃至請求項16の中でいずれの一項による糖脂質を含むことを特徴とする薬学組成物。
【請求項18】
抗生剤,担体,賦形剤及び希釈剤からなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項17に記載の薬学組成物。
【請求項19】
薬学組成物の剤形は,散剤,顆粒剤,錠剤,カプセル剤,懸濁液,乳剤,シロップ,エアロゾルの経口製剤,外用剤,坐剤または滅菌注射液剤であることを特徴とする請求項17に記載の薬学組成物。
【請求項20】
糖脂質は,薬学組成物100重量部に対して0.01乃至99.9重量部で含まれることを特徴とする請求項17に記載の薬学組成物。
【請求項21】
請求項1乃至請求項16の中でいずれか一項による糖脂質を含むことを特徴とする炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項22】
炎症性疾患または免疫関連疾患は,敗血症,動脈硬化,菌血症,全身炎症反応症候群,多臓器機能不全,癌,骨粗鬆症,歯周炎,全身性{ぜんしん せい}エリテマトーデス,リュウマチ性関節炎,退行性関節炎,若年性慢性関節炎,脊椎関節症,全身性硬化症,特発性炎症性筋障害,シェーグレン症候群(Sjoegren's syndrome),全身性脈管炎,サルコイドーシス(sarcoidosis),自己免疫溶血性貧血,自己兔疫性血小板減少症,甲状腺炎,真性糖尿病,免疫介在性神経疾患,中枢神経系または末梢神経系の脱髄鞘疾患,特発性脱髄鞘多発性神経炎,ギラン・バレー症候群(Guillain−Barre syndrome),慢性炎症性脱髄鞘多発性神経炎,肝胆汁性疾患,感染性または自己兔疫性慢性活性肝炎,原発性胆汁性肝硬変,肉芽腫性肝炎,硬化性胆官炎,炎症性腸疾患(IBD:Inflammatory bowel disease),潰瘍性大腸炎(Ulcerative colitis),クローン病(Crohn's disease),過敏性腸症候群(Irritable Bowel Syndrome),グルテン過敏性腸疾患,ウィップル病(Whipple's disease),自己兔疫性または免疫介在性皮膚疾患,水疱性皮膚疾患多形性紅斑,接触性皮膚炎,乾癬,アレルギー性疾患,喘息,アレルギー性鼻炎,アトピー性皮膚炎,飲食過敏症,蕁麻疹,肺の免疫疾患,
好酸球性肺炎,特発性肺纎維症,過敏性肺炎,移植関連疾患移植拒否または移植片対宿主疾患であることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項23】
薬学組成物の投与形態は,経口,直腸または静脈,筋肉,皮下,子宮内硬膜または脳血管内注射であることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物。
【請求項24】
糖脂質は,1日投与量が0.01乃至10,000mg/kgであることを特徴とする請求項21に記載の炎症性疾患または免疫関連疾患の予防及び治療用薬学組成物 。
【請求項25】
請求項1乃至請求項16の中でいずれの一項による糖脂質を含む ことを特徴とする食品組成物。
【請求項26】
有機酸,リン酸塩,抗酸化剤,乳糖カゼイン,デキストリン,葡萄糖,砂糖及びソルビートルからなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項25に記載の食品組成物。
【請求項27】
糖脂質は,食品組成物100重量部に対して0.01乃至99.9重量部で含まれることを特徴とする請求項25に記載の食品組成物。
【請求項28】
食品組成物の剤形は,固形,粉末,顆粒,錠剤,カプセルまたは液状形態であることを特徴とする請求項25に記載の食品組成物。
【請求項29】
請求項1乃至請求項16の中でいずれか一項による糖脂質を含むことを特徴とする化粧品組成物。
【請求項30】
ビタミン,アミノ酸,タンパク質,界面活性剤,乳化剤,香料,色素,安定製,防腐剤,抗酸化剤,紫外線遮断剤,pH調整剤及びキレート剤からなる群より選択される一つ以上の添加剤を追加で含むことを特徴とする請求項29に記載の化粧品組成物。
【請求項31】
請求項1乃至請求項16の中でいずれか一項による糖脂質からなるか,これを含むことを特徴とするアジュバント。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【公表番号】特表2013−502456(P2013−502456A)
【公表日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願番号】特願2012−526660(P2012−526660)
【出願日】平成22年8月26日(2010.8.26)
【国際出願番号】PCT/KR2010/005755
【国際公開番号】WO2011/025286
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(512047472)
【氏名又は名称原語表記】RNA INC.
【Fターム(参考)】
【公表日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願日】平成22年8月26日(2010.8.26)
【国際出願番号】PCT/KR2010/005755
【国際公開番号】WO2011/025286
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(512047472)

【氏名又は名称原語表記】RNA INC.
【Fターム(参考)】
[ Back to top ]

