リポ多糖の分析方法
【課題】 リポ多糖の分析を容易に行う方法を提供する。
【解決手段】 大腸菌、赤痢菌又はサルモネラ菌等のリポ多糖の分析方法であって、トリメチルアミン、トリエチルアミン、トリブチルアミン及びピリジンなどの塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィー又はサイズ排除系液体クロマトグラフィーにより分離する工程、を包含する方法。
【解決手段】 大腸菌、赤痢菌又はサルモネラ菌等のリポ多糖の分析方法であって、トリメチルアミン、トリエチルアミン、トリブチルアミン及びピリジンなどの塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィー又はサイズ排除系液体クロマトグラフィーにより分離する工程、を包含する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、リポ多糖の新規分析方法に関する。より詳しくは、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより容易に分析する方法に関する。
【背景技術】
【0002】
リポ多糖(以下、「LPS」という)とは、共有結合で結ばれた脂質と多糖の複合体であり、特に、主としてグラム陰性細菌の外膜成分として存在するエンドトキシンの本体である。LPSの基本構造には、菌種間で共通性がみられ、分類学的に遠縁の菌では大きな違いがある。LPSは様々な生物活性を示し、病原細菌のLPSは、宿主の免疫系により感染のシグナルとして認識される。
【0003】
一方、エンドトキシンとは内毒素のことであり、細菌の菌体成分中にある毒性物質の総称であり、外毒素が生きた菌が産生して菌体外に放出されるのに対して、エンドトキシンは菌が死ぬことによって遊離する。エンドトキシンの成分はLPSであることから、エンドトキシンは、大腸菌、赤痢菌、サルモネラ菌などのグラム陰性細菌のLPSの同義語として用いられる。エンドトキシンをヒトや動物に注射すると、発熱がおこり、一時的に白血球が減少し、また多量に与えると死に至る。
【0004】
従来知られているLPSの検出方法としては、ウサギ発熱試験又はリムルス試験がある。
【0005】
ウサギ発熱試験は、日本薬局方の発熱性物質試験に準拠するものであり、試験液を、3匹のウサギに静脈注射し、直腸温を注射後3時間観察し、注射直前の体温より0.6℃以上の上昇を示すウサギが2又は3匹の場合、発熱性物質が存在すると判断される。
【0006】
一方、リムルス試験は、アメリカ産カブトガニの学名Limulus polyphemusに由来するものであり、1964年にLevineとBangが“生きた化石”といわれるカブトガニの血液にエンドトキシンを加えると凝固(ゲル化)することを見出し、その血球抽出液(limulus amebocyte lysate,LAL)を用いて凝固の有無をみることにより検体中のエンドトキシンを検出する方法を創案したことに始まる。現在では、リムルス試験の分析キットが市販されている。
【0007】
しかしながら、ウサギ発熱試験は、in vivoでの試験であるので、コストがかかり、一方、リムルス試験は、分析キットが高価であり、いずれもLPSの検出が容易に且つ安価に行えるものではない。
【0008】
一方、糖類の分析方法としては、例えば、分析化学、35巻、869−874ページ(1986年)が知られているが、この方法をリポ多糖に適用した例は存在しない。
【非特許文献1】分析化学、35巻、869−874ページ、(1986年)
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、LPSの分析を容易に行う方法を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、LPSの簡易な分析方法につき検討を行った結果、LPSは両親媒性の化合物であるため、分析が難しく、逆相系液体クロマトグラフィーによる分析例は皆無であることがわかり、又、LPSは、直接マススペクトル分析はできないこともわかった。そこで、発明者らは、更に検討を行い、LPSが、特定なイオンペアの存在下、特定条件下で逆相系液体クロマトグラフィーを用いて容易に分離することが可能であること、又、特定な検出方法を用いることにより、分離したLPSを容易に検出可能であることを見出し、かかる知見に基づいて本発明を完成した。
【0011】
即ち、本発明は、
(1) リポ多糖の分析方法であって、塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィーにより分離する工程、を包含する方法、に関する。
【0012】
更に、本発明は、
(2) リポ多糖の分析方法であって、
(a) 塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィーにより分離する工程、
(b) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(c) 上記(b)で得られた反応物を検出する工程、を包含する方法、に関する。
【0013】
更に、本発明は、
(3) リポ多糖の分析方法であって、
(a) リポ多糖をサイズ排除系液体クロマトグラフィーにより分離する工程、
(b) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(c) 上記(b)で得られた反応物を検出する工程、を包含する方法、にも関する。
【発明の効果】
【0014】
本発明の方法によれば、移動相にトリブチルアミン等の塩基性イオンペアを加えることで、C18等の逆相系のカラムを用いた液体クロマトグラフィー、特に高速液体クロマトグラフィー(以下、「HPLC」という)での分離がはじめて可能になった。
【0015】
本発明の方法によれば、分離したLPSをアミンの存在下で過ヨウ素酸酸化することで、少量のLPSの検出が可能となった。
【0016】
本発明の方法によれば、移動相にトリブチルアミン等のイオンペアを加えることで、LPSの蛍光強度を検出する場合、蛍光強度が増加し、LPSの検出が容易となった。
【発明を実施するための最良の形態】
【0017】
以下に実施例を挙げて本発明をさらに具体的に説明するが、本発明は実施例のみに限定されるものではない。
【0018】
LPSの分離工程
本発明の分析の対象となるLPSの試料としては、特に限定されないが、大腸菌、赤痢菌、サルモネラ菌などのグラム陰性細菌由来のLPSが例示される。
【0019】
分析する試料としては、LPSを含むものであれば特に限定されず、生体試料も含まれるが、生体試料に関しては固相抽出あるはカラムスイッチングバルブを用いる前処理を行ってもよい。更には、試料中のLPSの有無の検出においては、LPSが存在しない試料も対象となる。
【0020】
本発明で用いられる逆相系HPLC用の固定相としては、逆相系のものであれば特に限定されないが、例えば、トリアコンタン(C30)、オクタデシル(C18)、オクチル(C8)、ブチル(C4)、CN、グラファイトカーボン等の担体が例示され、好ましくはC18、C8又はCNが推奨され、特にC18又はCNが推奨される。
【0021】
HPLCは、固定相を含むカラムを市販のHPLC装置を用いて行うことが可能であり、又、固定相を含むカラムも市販のものを用いればよい。カラムに充填する固定相の担体は、球形、破砕形を用いることができ、その粒子径は3〜10μmであり、5μm以下が好ましく、さらに3μmが好ましい。用いるカラムのサイズはサンプルとして用いる試料の容積にもよるが、例えば内径2〜8mm、長さ2.5〜30cmのものを用いればよい。又、必要に応じてカードカラムを使用してもよい。
【0022】
本発明で用いる塩基性イオンペアとしては、塩基性のものであれば特に制限されないが、例えば、トリメチルアミン、トリエチルアミン、トリブチルアミン、ピリジン、トリブチルアンモニウムホルメート、トリヘキシルアンモニウムホルメート、テトラブチルアンモニウム、テトラエチルアンモニウム、テトラメチルブチルアンモニウム等が例示され、好ましくはトリブチルアミン、トリエチルアミン、トリメチルアミンが推奨される。
【0023】
特に、C18カラムを用いる際は、トリエチルアミンとの組み合わせが好ましく、CNカラムを用いる場合は、トリブチルアミンとの組み合わせが好ましい。
【0024】
特に、検出方法として後述する蛍光分析方法を採用する場合、トリブチルアミン、トリエチルアミンは、蛍光強度を増強することが可能であり、より効果的である。
【0025】
塩基性イオンペアの濃度としては、例えば、移動相中、5〜50mMが例示され、好ましくは5〜15mMが推奨される。
【0026】
移動相としては、特に限定されないが、例えば、アセトニトリル、メタノール、テトラヒドロフラン、水又はこれらの混合溶媒が例示され、又、溶出は移動相の組成及び濃度を徐々に変化させるグラジエント溶出により行なうことが好ましい。又、移動層のpHを一定に保つために、更にバッファーを使用してもよい。バッファーとしては、リン酸ナトリウム、リン酸カリウム等が例示される。バッファー濃度としては、例えば、5〜50mMが例示されるが、溶出させるLPSの種類に応じて適宜変更すればよい。
【0027】
特に移動相として、リン酸バッファー−アセトニル系のグラジエント溶出が推奨される。
【0028】
HPLC分離の際の試料の注入量は、試料の種類や用いるカラムにより適宜決定することができるが、例えば1〜100μL、好ましくは5〜20μLが例示される。試料の濃度としては、0.001〜1mg/mlが例示され、好ましくは0.005〜0.05mg/mlが推奨される。
【0029】
HPLC分離の際の移動相の流速は、0.1mL/分〜1mL/分、好ましくは0.2mL/分〜0.5mL/分である。
【0030】
HPLC分離の際のカラム温度は、特に限定されないが、例えば、20〜80℃、より好ましくは25〜40℃である。
【0031】
かくして分離したLPSは、続いて検出のための誘導体化を行う。
【0032】
反応工程(LPSの誘導体化)
上記方法で分離したリポ多糖は、アミンの存在下で過ヨウ素酸ナトリウムと反応させ、検出が容易な誘導体とすることができる。尚、前段階で分離したLPSをそのまま検出することも可能であるが、高感度の分析を行うためには、HPLCにより分離後に誘導体化を行うことが好ましい。
【0033】
誘導体化は、前段階で分離したLPSの移動相を、アミンの存在下で過ヨウ素酸ナトリウムと反応させることにより行う。
【0034】
具体的には、前段階で分離したLPS含有移動相と、アミン及び過ヨウ素酸ナトリウムを含有する移動相とを混合することにより、誘導体化を行えばよい。
【0035】
アミンとしては、アンモニア、タウリン、エチレンジアミン、エタノールアミン、2−アミノプロピオニトリル、2−シアノアセトアミド、アルギニン、フェニルアラニン、ベンズアミジン及びヒドラジン等が例示され、好ましくは、タウリンが挙げられる。
【0036】
アミン及び過ヨウ素酸ナトリウムの使用量としては、移動相中、アミンが、10〜200mM、好ましくは、50〜100mMが例示され、及び過ヨウ素酸ナトリウムを2〜20mM、好ましくは6〜12mMが例示される。
【0037】
アミン及び過ヨウ素酸ナトリウムを含有する移動相としては、LPS分離用の移動相と同じものが例示され、例えば、アセトニトリル−水が例示され、好ましくは、分離後の移動相と同じ溶媒組成の移動相をイソクラティックに溶出することが好ましい。
【0038】
この場合の、アミン及び過ヨウ素酸ナトリウムを含有する移動相の流速としては、LPS分離の際の流速と同じ流速であるか、少なくとも2分の1以上の流速が好ましい。
【0039】
LPS含有移動相と、アミン及び過ヨウ素酸ナトリウムを含有する移動相とを混合するに際しては、T字管により混合することが可能であるほか、必要に応じてミキサーにより混合してもよい。
【0040】
誘導体化の反応温度としては、80〜150℃が例示され、好ましくは100〜120℃が推奨される。
【0041】
尚、LPSをアミン存在下で過ヨウ素酸ナトリウムと反応させて得られる化合物は、LPSの種類に応じて変化するが、ジャーナルオブクロマトグラフィー、720巻、183〜199ページ(1996年)に記載のようなピリジン誘導体が生じているものと考えられる。
【0042】
検出工程
前工程で得られた反応物を検出することにより、LPSを分析する。
【0043】
検出方法としては、誘導体化物を含む移動相を、UV、蛍光強度等の検出手段により検出する。UVを検出する場合は、210nm、254nm等で検出することができ、又、蛍光強度の検出では、励起波長350nm及び蛍光波長430nmにより検出することができる。特に、LPSの試料が少量である場合には、高感度の検出が可能な蛍光強度測定が好ましい。
【0044】
尚、検出は、室温で行うことが好ましいが、誘導体化を行った場合は、移動相の温度は80〜150℃になることがあるので、検出の前に移動相を冷却することが好ましい。
【0045】
分析装置
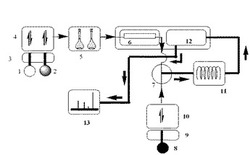
本発明では、LPSを、HPLCによる分析工程、反応工程及び検出工程により行うが、好ましくはこれらの工程は移動相中で連続して行う。用いられる装置の例として、図1に例示するものが挙げられる。
【0046】
即ち、デガッサー3を通した移動相1及び2をバイナリーポンプ4から溶出しながら、LPS含有サンプルをオートサンプラー5でサンプリングする。サンプルは、固定相であるカラム6で分離されたのち、ミキシング部位7に流れる。一方、アミン及び過ヨウ素酸ナトリウムを含有する移動相8は、デガッサー9を通し、バイナリーポンプ10を通じてミキシング部位7に流れる。ミキシング部位7中で、LPSを含有する移動相とアミン及び過ヨウ素酸ナトリウムを含有する移動相とが混合され、サーモリアクター11中で誘導体化を行う。LPSの誘導体化後に、移動相を冷却器12で冷却し、続いて検出器13で検出を行う。
【0047】
ここで、サーモリアクター11としては、例えば資生堂サーモリアクター3019を使用することが可能である。又、検出器13としては、アジレント1100シリーズ蛍光検出器が例示される。
【0048】
このように、本発明の分析工程、反応工程及び検出工程を組み合わせることにより、LPSの分析が、容易に、安価に、高感度に、そして再現性よく可能となった。
【0049】
本発明では、逆相系液体クロマトグラフィーの代わりに、サイズ排除系クロマトグラフィーを用いてLPSを分離してもよい。
【0050】
サイズ排除系クロマトグラフィーに用いるカラムに充填する固定相の担体は、球形、破砕形を用いることができ、その粒子径としては3〜10μmが例示され、5μm以下が好ましい。用いるカラムのサイズは、サンプルとして用いる試料の容積にもよるが、例えば内径2〜8mm、長さ5〜30cmのものを用いればよい。又、必要に応じてカードカラムを使用してもよい。
【0051】
サイズ排除系クロマトグラフィー用のカラムとしては、例えば、ジオール、ポリヒドロキシエチル、ポリヒドロキシメタクリレート等を固定相として充填したものが例示され、好ましくは水系のサイズ排除系クロマトグラフィー用のカラムであって、アセトニトリル、メタノールなどの有機溶媒も使用可能なカラム、例えばジオール、ポリヒドロキシエチルカラムが好ましく、特にジオールカラムが推奨される。
【0052】
サイズ排除系クロマトグラフィーを用いる際の移動相としては、例えば、前記したアセトニトリル、メタノール、アセトニトリル−リン酸バッファーの混合液等が例示され、イソクラティック条件下で溶出させることが好ましい。
【0053】
サイズ排除系クロマトグラフィーを用いる際の試料の注入量、移動相の流速、カラム温度等は逆相系HPLCのものと同じものが適用できる。
【0054】
そして、サイズ排除系クロマトグラフィーを用いて分離したLPSは、前記記載の反応工程、及び前記記載の検出工程により検出することが可能である。
【0055】
特に、サイズ排除系液体クロマトグラフィーとしてジオールカラムを用い、塩基性イオンペアとしてトリブチルアミンを用いた場合、サンプルのカラムへの吸着を防ぐことが可能となり、分析する際の再現性を高めることが可能となる。そして、リポ多糖関連化合物が1ピークで現れるため、検出感度が相対的に増す。
【実施例】
【0056】
本発明を以下の実施例によって具体的に説明するが、本発明はこれらの実施例によって限定されるものではない。
【0057】
実施例1
0.10mgのE. coli C,LPSに1.0mLの50%メタノールを加え、LPS溶液を調製した。溶液の5μLを、下記の条件でHPLC分析した。
【0058】
カラム:サーモサイエンティフィックBioBasic CN(2.1mmφ×50mm)
カラム温度:30℃
【0059】
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整;
移動相B:アセトニトリル;
グラジエント;移動相A:B=80:20→A:B=40:60(%、30min)、続いてA:B=40:60(%、10min)
流速:0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図2に示す。メインピークを含めて、保持時間19.5分、21.8分、25.4分及び26.7分に4本のピークを検出した。
【0060】
このように、CNカラムを用い、移動相にトリブチルアミン(イオンペアー)とアセトニトリルを用いたHPLCにより、LPSをカラムに適当な時間保持させ、各種成分を分離、検出することができた。
【0061】
実施例2
0.1mgのE. coli C, LPSに1.0mLの50%メタノールを加え、LPS溶液を調製した。溶液の5μLを、下記の条件でHPLC分析した。
【0062】
カラム:Waters Symmetry C18(2.1mmφ×50mm)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリエチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
グラジエント;移動相A:B=80:20→40:60(%、30min)、続いてA:B=40:60(%、10min)
流速:0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10mm)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図3に示す。メインピークを含めて保持時間24.5分、33.6分、35.8分及び38.2分に4本のピークを検出した。
【0063】
このように、C18カラムを用い、移動相にトリエチルアミン(イオンペアー)とアセトニトリルを用いたHPLCにより、LPSをカラムに適当な時間保持させ、各種成分を分離、検出することができた。
【0064】
即ち、逆相系のカラムとイオンペアーの脂溶性因子を適切に組み合わせることによりLPSの分離分析が可能になる。しかし、その組み合わせが悪い場合はカラムに保持されない、あるいはLPSがカラムから溶出されない現象が観測される。又、イオン交換樹脂カラムを用いたHPLCでは、LPSを分離することはできなかった。
【0065】
実施例3
E. coli C,LPS,0.10mgに50%メタノール1.0mlを加え、LPS溶液を調製した。溶液の5μlを、下記の条件でHPLC分析した。
カラム: ポリエルシー社PolyHYDROXYETHYL A(4.6mmφ×200mm,5μm,300Å)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
アイソクラチック:移動相A:B=80:20(%、30min)、流速0.5ml/min
検出:カラム出口に三方コックを接続し、0.3ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図4に示す。保持時間7.9分にピークを検出した。
【0066】
以下に、各種LPSをPolyHYDROXYETHYL Aで分析した際の保持時間を示す。
【0067】
E. coli C;7.9分、
E. coli O111:B4;7.7分、
Salmonella enterica serotype Typhimurium;7.6分E. coli J5;8.5分、
E. coli EH100;8.4分
【0068】
このように、PolyHYDROXYETHYL Aカラムを用い、LPSを1本のピークとして、検出することができた。
【0069】
尚、このカラムを用いた分析において、糖類は以下の保持時間を有している。
グルコース;10.9分、
フルクトース;10.7分
マルトース;10.4分
ラクトース;10.2分
α−シクロデキストリン;9.7分
【0070】
実施例4
E. coli C,LPS,0.10mgに50%メタノール1.0mlを加え、LPS溶液を調製した。溶液の5μlを、下記の条件でHPLC分析した。
カラム:GL Science Inc. Inertsil WP300 Diol(3.0mmφ×250mm,5μm,300Å)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
アイソクラチック:移動相A:B=80:20(%、30min)、流速0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図5に示す。保持時間8.8分にピークを検出した。
【0071】
以下に、各種LPSをInertsil WP300 Diolで分析した際の保持時間を示す。
【0072】
E. coli C;8.8分、
E. coli O111:B4;8.0分、10.2分
Salmonella enterica serotype Typhimurium;7.9分、10.1分
E. coli J5;7.8分、
E. coli EH100;8.7分、10.4分
【0073】
このように、Inertsil WP300 Diolカラムを用いて分析し、各種LPSを1本ないし2本のピークとして、検出することができた。
【0074】
尚、このカラムを用いた分析において、以下の糖類は以下の保持時間を有している。
グルコース;10.8分、
フルクトース;10.8分
マルトース;10.7分
ラクトース;10.7分
α−シクロデキストリン;10.6分
【産業上の利用可能性】
【0075】
本発明により、LPSを、特殊なキットを用いることなく、容易に分離し、検出することが可能となった。更に、液体状の医薬の開発において、試料中のエンドトキシンを容易に分析することが可能となった。
【図面の簡単な説明】
【0076】
【図1】本発明に用いる分析装置を示す図である。
【図2】CNカラムを用いてLPSを分析した結果を示す図である。
【図3】C18カラムを用いてLPSを分析した結果を示す図である。
【図4】ポリヒドロキシエチルカラムを用いてLPSを分析した結果を示す図である。
【図5】ジオールカラムを用いてLPSを分析した結果を示す図である。
【符号の説明】
【0077】
1 移動相1
2 移動相2
3 デガッサ
4 バイナリーポンプ
5 オートサンプラー
6 カラム
7 ミキシング部位
8 アミン及び過ヨウ素酸ナトリウム含有移動相
9 デガッサ
10 バイナリーポンプ
11 サーモリアクター
12 冷却器
13 検出器
【技術分野】
【0001】
本発明は、リポ多糖の新規分析方法に関する。より詳しくは、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより容易に分析する方法に関する。
【背景技術】
【0002】
リポ多糖(以下、「LPS」という)とは、共有結合で結ばれた脂質と多糖の複合体であり、特に、主としてグラム陰性細菌の外膜成分として存在するエンドトキシンの本体である。LPSの基本構造には、菌種間で共通性がみられ、分類学的に遠縁の菌では大きな違いがある。LPSは様々な生物活性を示し、病原細菌のLPSは、宿主の免疫系により感染のシグナルとして認識される。
【0003】
一方、エンドトキシンとは内毒素のことであり、細菌の菌体成分中にある毒性物質の総称であり、外毒素が生きた菌が産生して菌体外に放出されるのに対して、エンドトキシンは菌が死ぬことによって遊離する。エンドトキシンの成分はLPSであることから、エンドトキシンは、大腸菌、赤痢菌、サルモネラ菌などのグラム陰性細菌のLPSの同義語として用いられる。エンドトキシンをヒトや動物に注射すると、発熱がおこり、一時的に白血球が減少し、また多量に与えると死に至る。
【0004】
従来知られているLPSの検出方法としては、ウサギ発熱試験又はリムルス試験がある。
【0005】
ウサギ発熱試験は、日本薬局方の発熱性物質試験に準拠するものであり、試験液を、3匹のウサギに静脈注射し、直腸温を注射後3時間観察し、注射直前の体温より0.6℃以上の上昇を示すウサギが2又は3匹の場合、発熱性物質が存在すると判断される。
【0006】
一方、リムルス試験は、アメリカ産カブトガニの学名Limulus polyphemusに由来するものであり、1964年にLevineとBangが“生きた化石”といわれるカブトガニの血液にエンドトキシンを加えると凝固(ゲル化)することを見出し、その血球抽出液(limulus amebocyte lysate,LAL)を用いて凝固の有無をみることにより検体中のエンドトキシンを検出する方法を創案したことに始まる。現在では、リムルス試験の分析キットが市販されている。
【0007】
しかしながら、ウサギ発熱試験は、in vivoでの試験であるので、コストがかかり、一方、リムルス試験は、分析キットが高価であり、いずれもLPSの検出が容易に且つ安価に行えるものではない。
【0008】
一方、糖類の分析方法としては、例えば、分析化学、35巻、869−874ページ(1986年)が知られているが、この方法をリポ多糖に適用した例は存在しない。
【非特許文献1】分析化学、35巻、869−874ページ、(1986年)
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、LPSの分析を容易に行う方法を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、LPSの簡易な分析方法につき検討を行った結果、LPSは両親媒性の化合物であるため、分析が難しく、逆相系液体クロマトグラフィーによる分析例は皆無であることがわかり、又、LPSは、直接マススペクトル分析はできないこともわかった。そこで、発明者らは、更に検討を行い、LPSが、特定なイオンペアの存在下、特定条件下で逆相系液体クロマトグラフィーを用いて容易に分離することが可能であること、又、特定な検出方法を用いることにより、分離したLPSを容易に検出可能であることを見出し、かかる知見に基づいて本発明を完成した。
【0011】
即ち、本発明は、
(1) リポ多糖の分析方法であって、塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィーにより分離する工程、を包含する方法、に関する。
【0012】
更に、本発明は、
(2) リポ多糖の分析方法であって、
(a) 塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系液体クロマトグラフィーにより分離する工程、
(b) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(c) 上記(b)で得られた反応物を検出する工程、を包含する方法、に関する。
【0013】
更に、本発明は、
(3) リポ多糖の分析方法であって、
(a) リポ多糖をサイズ排除系液体クロマトグラフィーにより分離する工程、
(b) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(c) 上記(b)で得られた反応物を検出する工程、を包含する方法、にも関する。
【発明の効果】
【0014】
本発明の方法によれば、移動相にトリブチルアミン等の塩基性イオンペアを加えることで、C18等の逆相系のカラムを用いた液体クロマトグラフィー、特に高速液体クロマトグラフィー(以下、「HPLC」という)での分離がはじめて可能になった。
【0015】
本発明の方法によれば、分離したLPSをアミンの存在下で過ヨウ素酸酸化することで、少量のLPSの検出が可能となった。
【0016】
本発明の方法によれば、移動相にトリブチルアミン等のイオンペアを加えることで、LPSの蛍光強度を検出する場合、蛍光強度が増加し、LPSの検出が容易となった。
【発明を実施するための最良の形態】
【0017】
以下に実施例を挙げて本発明をさらに具体的に説明するが、本発明は実施例のみに限定されるものではない。
【0018】
LPSの分離工程
本発明の分析の対象となるLPSの試料としては、特に限定されないが、大腸菌、赤痢菌、サルモネラ菌などのグラム陰性細菌由来のLPSが例示される。
【0019】
分析する試料としては、LPSを含むものであれば特に限定されず、生体試料も含まれるが、生体試料に関しては固相抽出あるはカラムスイッチングバルブを用いる前処理を行ってもよい。更には、試料中のLPSの有無の検出においては、LPSが存在しない試料も対象となる。
【0020】
本発明で用いられる逆相系HPLC用の固定相としては、逆相系のものであれば特に限定されないが、例えば、トリアコンタン(C30)、オクタデシル(C18)、オクチル(C8)、ブチル(C4)、CN、グラファイトカーボン等の担体が例示され、好ましくはC18、C8又はCNが推奨され、特にC18又はCNが推奨される。
【0021】
HPLCは、固定相を含むカラムを市販のHPLC装置を用いて行うことが可能であり、又、固定相を含むカラムも市販のものを用いればよい。カラムに充填する固定相の担体は、球形、破砕形を用いることができ、その粒子径は3〜10μmであり、5μm以下が好ましく、さらに3μmが好ましい。用いるカラムのサイズはサンプルとして用いる試料の容積にもよるが、例えば内径2〜8mm、長さ2.5〜30cmのものを用いればよい。又、必要に応じてカードカラムを使用してもよい。
【0022】
本発明で用いる塩基性イオンペアとしては、塩基性のものであれば特に制限されないが、例えば、トリメチルアミン、トリエチルアミン、トリブチルアミン、ピリジン、トリブチルアンモニウムホルメート、トリヘキシルアンモニウムホルメート、テトラブチルアンモニウム、テトラエチルアンモニウム、テトラメチルブチルアンモニウム等が例示され、好ましくはトリブチルアミン、トリエチルアミン、トリメチルアミンが推奨される。
【0023】
特に、C18カラムを用いる際は、トリエチルアミンとの組み合わせが好ましく、CNカラムを用いる場合は、トリブチルアミンとの組み合わせが好ましい。
【0024】
特に、検出方法として後述する蛍光分析方法を採用する場合、トリブチルアミン、トリエチルアミンは、蛍光強度を増強することが可能であり、より効果的である。
【0025】
塩基性イオンペアの濃度としては、例えば、移動相中、5〜50mMが例示され、好ましくは5〜15mMが推奨される。
【0026】
移動相としては、特に限定されないが、例えば、アセトニトリル、メタノール、テトラヒドロフラン、水又はこれらの混合溶媒が例示され、又、溶出は移動相の組成及び濃度を徐々に変化させるグラジエント溶出により行なうことが好ましい。又、移動層のpHを一定に保つために、更にバッファーを使用してもよい。バッファーとしては、リン酸ナトリウム、リン酸カリウム等が例示される。バッファー濃度としては、例えば、5〜50mMが例示されるが、溶出させるLPSの種類に応じて適宜変更すればよい。
【0027】
特に移動相として、リン酸バッファー−アセトニル系のグラジエント溶出が推奨される。
【0028】
HPLC分離の際の試料の注入量は、試料の種類や用いるカラムにより適宜決定することができるが、例えば1〜100μL、好ましくは5〜20μLが例示される。試料の濃度としては、0.001〜1mg/mlが例示され、好ましくは0.005〜0.05mg/mlが推奨される。
【0029】
HPLC分離の際の移動相の流速は、0.1mL/分〜1mL/分、好ましくは0.2mL/分〜0.5mL/分である。
【0030】
HPLC分離の際のカラム温度は、特に限定されないが、例えば、20〜80℃、より好ましくは25〜40℃である。
【0031】
かくして分離したLPSは、続いて検出のための誘導体化を行う。
【0032】
反応工程(LPSの誘導体化)
上記方法で分離したリポ多糖は、アミンの存在下で過ヨウ素酸ナトリウムと反応させ、検出が容易な誘導体とすることができる。尚、前段階で分離したLPSをそのまま検出することも可能であるが、高感度の分析を行うためには、HPLCにより分離後に誘導体化を行うことが好ましい。
【0033】
誘導体化は、前段階で分離したLPSの移動相を、アミンの存在下で過ヨウ素酸ナトリウムと反応させることにより行う。
【0034】
具体的には、前段階で分離したLPS含有移動相と、アミン及び過ヨウ素酸ナトリウムを含有する移動相とを混合することにより、誘導体化を行えばよい。
【0035】
アミンとしては、アンモニア、タウリン、エチレンジアミン、エタノールアミン、2−アミノプロピオニトリル、2−シアノアセトアミド、アルギニン、フェニルアラニン、ベンズアミジン及びヒドラジン等が例示され、好ましくは、タウリンが挙げられる。
【0036】
アミン及び過ヨウ素酸ナトリウムの使用量としては、移動相中、アミンが、10〜200mM、好ましくは、50〜100mMが例示され、及び過ヨウ素酸ナトリウムを2〜20mM、好ましくは6〜12mMが例示される。
【0037】
アミン及び過ヨウ素酸ナトリウムを含有する移動相としては、LPS分離用の移動相と同じものが例示され、例えば、アセトニトリル−水が例示され、好ましくは、分離後の移動相と同じ溶媒組成の移動相をイソクラティックに溶出することが好ましい。
【0038】
この場合の、アミン及び過ヨウ素酸ナトリウムを含有する移動相の流速としては、LPS分離の際の流速と同じ流速であるか、少なくとも2分の1以上の流速が好ましい。
【0039】
LPS含有移動相と、アミン及び過ヨウ素酸ナトリウムを含有する移動相とを混合するに際しては、T字管により混合することが可能であるほか、必要に応じてミキサーにより混合してもよい。
【0040】
誘導体化の反応温度としては、80〜150℃が例示され、好ましくは100〜120℃が推奨される。
【0041】
尚、LPSをアミン存在下で過ヨウ素酸ナトリウムと反応させて得られる化合物は、LPSの種類に応じて変化するが、ジャーナルオブクロマトグラフィー、720巻、183〜199ページ(1996年)に記載のようなピリジン誘導体が生じているものと考えられる。
【0042】
検出工程
前工程で得られた反応物を検出することにより、LPSを分析する。
【0043】
検出方法としては、誘導体化物を含む移動相を、UV、蛍光強度等の検出手段により検出する。UVを検出する場合は、210nm、254nm等で検出することができ、又、蛍光強度の検出では、励起波長350nm及び蛍光波長430nmにより検出することができる。特に、LPSの試料が少量である場合には、高感度の検出が可能な蛍光強度測定が好ましい。
【0044】
尚、検出は、室温で行うことが好ましいが、誘導体化を行った場合は、移動相の温度は80〜150℃になることがあるので、検出の前に移動相を冷却することが好ましい。
【0045】
分析装置
本発明では、LPSを、HPLCによる分析工程、反応工程及び検出工程により行うが、好ましくはこれらの工程は移動相中で連続して行う。用いられる装置の例として、図1に例示するものが挙げられる。
【0046】
即ち、デガッサー3を通した移動相1及び2をバイナリーポンプ4から溶出しながら、LPS含有サンプルをオートサンプラー5でサンプリングする。サンプルは、固定相であるカラム6で分離されたのち、ミキシング部位7に流れる。一方、アミン及び過ヨウ素酸ナトリウムを含有する移動相8は、デガッサー9を通し、バイナリーポンプ10を通じてミキシング部位7に流れる。ミキシング部位7中で、LPSを含有する移動相とアミン及び過ヨウ素酸ナトリウムを含有する移動相とが混合され、サーモリアクター11中で誘導体化を行う。LPSの誘導体化後に、移動相を冷却器12で冷却し、続いて検出器13で検出を行う。
【0047】
ここで、サーモリアクター11としては、例えば資生堂サーモリアクター3019を使用することが可能である。又、検出器13としては、アジレント1100シリーズ蛍光検出器が例示される。
【0048】
このように、本発明の分析工程、反応工程及び検出工程を組み合わせることにより、LPSの分析が、容易に、安価に、高感度に、そして再現性よく可能となった。
【0049】
本発明では、逆相系液体クロマトグラフィーの代わりに、サイズ排除系クロマトグラフィーを用いてLPSを分離してもよい。
【0050】
サイズ排除系クロマトグラフィーに用いるカラムに充填する固定相の担体は、球形、破砕形を用いることができ、その粒子径としては3〜10μmが例示され、5μm以下が好ましい。用いるカラムのサイズは、サンプルとして用いる試料の容積にもよるが、例えば内径2〜8mm、長さ5〜30cmのものを用いればよい。又、必要に応じてカードカラムを使用してもよい。
【0051】
サイズ排除系クロマトグラフィー用のカラムとしては、例えば、ジオール、ポリヒドロキシエチル、ポリヒドロキシメタクリレート等を固定相として充填したものが例示され、好ましくは水系のサイズ排除系クロマトグラフィー用のカラムであって、アセトニトリル、メタノールなどの有機溶媒も使用可能なカラム、例えばジオール、ポリヒドロキシエチルカラムが好ましく、特にジオールカラムが推奨される。
【0052】
サイズ排除系クロマトグラフィーを用いる際の移動相としては、例えば、前記したアセトニトリル、メタノール、アセトニトリル−リン酸バッファーの混合液等が例示され、イソクラティック条件下で溶出させることが好ましい。
【0053】
サイズ排除系クロマトグラフィーを用いる際の試料の注入量、移動相の流速、カラム温度等は逆相系HPLCのものと同じものが適用できる。
【0054】
そして、サイズ排除系クロマトグラフィーを用いて分離したLPSは、前記記載の反応工程、及び前記記載の検出工程により検出することが可能である。
【0055】
特に、サイズ排除系液体クロマトグラフィーとしてジオールカラムを用い、塩基性イオンペアとしてトリブチルアミンを用いた場合、サンプルのカラムへの吸着を防ぐことが可能となり、分析する際の再現性を高めることが可能となる。そして、リポ多糖関連化合物が1ピークで現れるため、検出感度が相対的に増す。
【実施例】
【0056】
本発明を以下の実施例によって具体的に説明するが、本発明はこれらの実施例によって限定されるものではない。
【0057】
実施例1
0.10mgのE. coli C,LPSに1.0mLの50%メタノールを加え、LPS溶液を調製した。溶液の5μLを、下記の条件でHPLC分析した。
【0058】
カラム:サーモサイエンティフィックBioBasic CN(2.1mmφ×50mm)
カラム温度:30℃
【0059】
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整;
移動相B:アセトニトリル;
グラジエント;移動相A:B=80:20→A:B=40:60(%、30min)、続いてA:B=40:60(%、10min)
流速:0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図2に示す。メインピークを含めて、保持時間19.5分、21.8分、25.4分及び26.7分に4本のピークを検出した。
【0060】
このように、CNカラムを用い、移動相にトリブチルアミン(イオンペアー)とアセトニトリルを用いたHPLCにより、LPSをカラムに適当な時間保持させ、各種成分を分離、検出することができた。
【0061】
実施例2
0.1mgのE. coli C, LPSに1.0mLの50%メタノールを加え、LPS溶液を調製した。溶液の5μLを、下記の条件でHPLC分析した。
【0062】
カラム:Waters Symmetry C18(2.1mmφ×50mm)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリエチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
グラジエント;移動相A:B=80:20→40:60(%、30min)、続いてA:B=40:60(%、10min)
流速:0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10mm)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図3に示す。メインピークを含めて保持時間24.5分、33.6分、35.8分及び38.2分に4本のピークを検出した。
【0063】
このように、C18カラムを用い、移動相にトリエチルアミン(イオンペアー)とアセトニトリルを用いたHPLCにより、LPSをカラムに適当な時間保持させ、各種成分を分離、検出することができた。
【0064】
即ち、逆相系のカラムとイオンペアーの脂溶性因子を適切に組み合わせることによりLPSの分離分析が可能になる。しかし、その組み合わせが悪い場合はカラムに保持されない、あるいはLPSがカラムから溶出されない現象が観測される。又、イオン交換樹脂カラムを用いたHPLCでは、LPSを分離することはできなかった。
【0065】
実施例3
E. coli C,LPS,0.10mgに50%メタノール1.0mlを加え、LPS溶液を調製した。溶液の5μlを、下記の条件でHPLC分析した。
カラム: ポリエルシー社PolyHYDROXYETHYL A(4.6mmφ×200mm,5μm,300Å)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
アイソクラチック:移動相A:B=80:20(%、30min)、流速0.5ml/min
検出:カラム出口に三方コックを接続し、0.3ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図4に示す。保持時間7.9分にピークを検出した。
【0066】
以下に、各種LPSをPolyHYDROXYETHYL Aで分析した際の保持時間を示す。
【0067】
E. coli C;7.9分、
E. coli O111:B4;7.7分、
Salmonella enterica serotype Typhimurium;7.6分E. coli J5;8.5分、
E. coli EH100;8.4分
【0068】
このように、PolyHYDROXYETHYL Aカラムを用い、LPSを1本のピークとして、検出することができた。
【0069】
尚、このカラムを用いた分析において、糖類は以下の保持時間を有している。
グルコース;10.9分、
フルクトース;10.7分
マルトース;10.4分
ラクトース;10.2分
α−シクロデキストリン;9.7分
【0070】
実施例4
E. coli C,LPS,0.10mgに50%メタノール1.0mlを加え、LPS溶液を調製した。溶液の5μlを、下記の条件でHPLC分析した。
カラム:GL Science Inc. Inertsil WP300 Diol(3.0mmφ×250mm,5μm,300Å)
カラム温度:30℃
移動相A:15mMリン酸、15mMトリブチルアミンの混合溶液を45%水酸化カリウム水溶液でpH7.0に調整
移動相B:アセトニトリル
アイソクラチック:移動相A:B=80:20(%、30min)、流速0.25ml/min
検出:カラム出口に三方コックを接続し、0.25ml/minで反応液(100mMタウリン、6mM過ヨウ素酸ナトリウムの混合溶液を水酸化カリウム水溶液でpH7.0に調整)と混合し、100℃の反応管(0.25mmφ×10m)で反応後、アジレント1100シリーズ蛍光検出器(アジレントテクノロジーズ)に導入し、ゲイン×16の感度で、励起波長350nm、蛍光波長430nmで測定した。分析結果を図5に示す。保持時間8.8分にピークを検出した。
【0071】
以下に、各種LPSをInertsil WP300 Diolで分析した際の保持時間を示す。
【0072】
E. coli C;8.8分、
E. coli O111:B4;8.0分、10.2分
Salmonella enterica serotype Typhimurium;7.9分、10.1分
E. coli J5;7.8分、
E. coli EH100;8.7分、10.4分
【0073】
このように、Inertsil WP300 Diolカラムを用いて分析し、各種LPSを1本ないし2本のピークとして、検出することができた。
【0074】
尚、このカラムを用いた分析において、以下の糖類は以下の保持時間を有している。
グルコース;10.8分、
フルクトース;10.8分
マルトース;10.7分
ラクトース;10.7分
α−シクロデキストリン;10.6分
【産業上の利用可能性】
【0075】
本発明により、LPSを、特殊なキットを用いることなく、容易に分離し、検出することが可能となった。更に、液体状の医薬の開発において、試料中のエンドトキシンを容易に分析することが可能となった。
【図面の簡単な説明】
【0076】
【図1】本発明に用いる分析装置を示す図である。
【図2】CNカラムを用いてLPSを分析した結果を示す図である。
【図3】C18カラムを用いてLPSを分析した結果を示す図である。
【図4】ポリヒドロキシエチルカラムを用いてLPSを分析した結果を示す図である。
【図5】ジオールカラムを用いてLPSを分析した結果を示す図である。
【符号の説明】
【0077】
1 移動相1
2 移動相2
3 デガッサ
4 バイナリーポンプ
5 オートサンプラー
6 カラム
7 ミキシング部位
8 アミン及び過ヨウ素酸ナトリウム含有移動相
9 デガッサ
10 バイナリーポンプ
11 サーモリアクター
12 冷却器
13 検出器
【特許請求の範囲】
【請求項1】
リポ多糖の分析方法であって、塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより分離する工程、を包含する方法。
【請求項2】
リポ多糖の分析方法であって、
(1) 塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより分離する工程、
(2) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(3) 上記(2)で得られた反応物を検出する工程、を包含する方法。
【請求項3】
塩基性イオンペアが、トリメチルアミン、トリエチルアミン及びトリブチルアミンよりなる群から選択される、請求項1又は請求項2に記載の分析方法。
【請求項4】
塩基性イオンペアが、トリブチルアミン又はトリエチルアミンである請求項1又は請求項2に記載の分析方法。
【請求項5】
塩基性イオンペアの濃度が、5〜50mMである、請求項4に記載の分析方法。
【請求項6】
液体クロマトグラフィーが逆相系液体クロマトグラフィーであり、C18カラム、C8カラム又はCNカラムを用いるものである、請求項1〜5のいずれかの請求項に記載の分析方法。
【請求項7】
逆相系液体クロマトグラフィーが、C18カラムを用い、塩基性イオンペアがトリエチルアミンである、請求項6に記載の分析方法。
【請求項8】
逆相系液体クロマトグラフィーが、CNカラムを用い、塩基性イオンペアがトリブチルアミンである、請求項6に記載の分析方法。
【請求項9】
移動相としてリン酸バッファー−アセトニトリルの濃度勾配を用いる、請求項6〜8のいずれかの請求項に記載の分析方法。
【請求項10】
液体クロマトグラフィーがサイズ排除系液体クロマトグラフィーであり、ジオールカラムを用いるものである、請求項1〜5のいずれかの請求項に記載の分析方法。
【請求項11】
サイズ排除系液体クロマトグラフィーが、ジオールカラムを用いるものであり、塩基性イオンペアがトリブチルアミンである、請求項10に記載の分析方法。
【請求項12】
移動相としてアセトニトリルを用いる、請求項10又は請求項11のいずれかの請求項に記載の分析方法。
【請求項13】
(2)の反応工程におけるアミンが、アンモニア、タウリン、エチレンジアミン、エタノールアミン、2−アミノプロピオニトリル、2−シアノアセトアミド、アルギニン、フェニルアラニン、ベンズアミジン及びヒドラジンよりなる群から選択される、請求項2〜12のいずれかの請求項に記載の分析方法。
【請求項14】
(2)の反応工程におけるアミンが、タウリンである、請求項13に記載の分析方法。
【請求項15】
(2)の反応工程が、80〜150℃の温度で反応を行う、請求項2〜14のいずれかの請求項に記載の分析方法。
【請求項16】
タウリンを50〜100mM、及び過ヨウ素酸ナトリウムを2〜20mMの濃度で反応を行う、請求項15に記載の分析方法。
【請求項17】
上記(3)の検出工程が、蛍光強度を測定するものである、請求項2〜16のいずれかの請求項に記載の分析方法。
【請求項18】
蛍光強度の測定が、励起波長350nm及び蛍光波長430nmで行う、請求項17に記載の分析方法。
【請求項19】
リポ多糖が、大腸菌、赤痢菌又はサルモネラ菌由来のものである、請求項1〜18のいずれかの請求項に記載の分析方法。
【請求項20】
上記(1)、(2)及び(3)の工程を移動相中で連続して行う、請求項2〜19のいずれかの請求項に記載の分析方法。
【請求項1】
リポ多糖の分析方法であって、塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより分離する工程、を包含する方法。
【請求項2】
リポ多糖の分析方法であって、
(1) 塩基性イオンペアを含む移動相を用いて、リポ多糖を逆相系又はサイズ排除系液体クロマトグラフィーにより分離する工程、
(2) 分離したリポ多糖をアミンの存在下で過ヨウ素酸ナトリウムと反応させる工程、及び
(3) 上記(2)で得られた反応物を検出する工程、を包含する方法。
【請求項3】
塩基性イオンペアが、トリメチルアミン、トリエチルアミン及びトリブチルアミンよりなる群から選択される、請求項1又は請求項2に記載の分析方法。
【請求項4】
塩基性イオンペアが、トリブチルアミン又はトリエチルアミンである請求項1又は請求項2に記載の分析方法。
【請求項5】
塩基性イオンペアの濃度が、5〜50mMである、請求項4に記載の分析方法。
【請求項6】
液体クロマトグラフィーが逆相系液体クロマトグラフィーであり、C18カラム、C8カラム又はCNカラムを用いるものである、請求項1〜5のいずれかの請求項に記載の分析方法。
【請求項7】
逆相系液体クロマトグラフィーが、C18カラムを用い、塩基性イオンペアがトリエチルアミンである、請求項6に記載の分析方法。
【請求項8】
逆相系液体クロマトグラフィーが、CNカラムを用い、塩基性イオンペアがトリブチルアミンである、請求項6に記載の分析方法。
【請求項9】
移動相としてリン酸バッファー−アセトニトリルの濃度勾配を用いる、請求項6〜8のいずれかの請求項に記載の分析方法。
【請求項10】
液体クロマトグラフィーがサイズ排除系液体クロマトグラフィーであり、ジオールカラムを用いるものである、請求項1〜5のいずれかの請求項に記載の分析方法。
【請求項11】
サイズ排除系液体クロマトグラフィーが、ジオールカラムを用いるものであり、塩基性イオンペアがトリブチルアミンである、請求項10に記載の分析方法。
【請求項12】
移動相としてアセトニトリルを用いる、請求項10又は請求項11のいずれかの請求項に記載の分析方法。
【請求項13】
(2)の反応工程におけるアミンが、アンモニア、タウリン、エチレンジアミン、エタノールアミン、2−アミノプロピオニトリル、2−シアノアセトアミド、アルギニン、フェニルアラニン、ベンズアミジン及びヒドラジンよりなる群から選択される、請求項2〜12のいずれかの請求項に記載の分析方法。
【請求項14】
(2)の反応工程におけるアミンが、タウリンである、請求項13に記載の分析方法。
【請求項15】
(2)の反応工程が、80〜150℃の温度で反応を行う、請求項2〜14のいずれかの請求項に記載の分析方法。
【請求項16】
タウリンを50〜100mM、及び過ヨウ素酸ナトリウムを2〜20mMの濃度で反応を行う、請求項15に記載の分析方法。
【請求項17】
上記(3)の検出工程が、蛍光強度を測定するものである、請求項2〜16のいずれかの請求項に記載の分析方法。
【請求項18】
蛍光強度の測定が、励起波長350nm及び蛍光波長430nmで行う、請求項17に記載の分析方法。
【請求項19】
リポ多糖が、大腸菌、赤痢菌又はサルモネラ菌由来のものである、請求項1〜18のいずれかの請求項に記載の分析方法。
【請求項20】
上記(1)、(2)及び(3)の工程を移動相中で連続して行う、請求項2〜19のいずれかの請求項に記載の分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−145191(P2010−145191A)
【公開日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願番号】特願2008−321780(P2008−321780)
【出願日】平成20年12月18日(2008.12.18)
【出願人】(000005072)萬有製薬株式会社 (51)
【出願人】(304026696)国立大学法人三重大学 (270)
【Fターム(参考)】
【公開日】平成22年7月1日(2010.7.1)
【国際特許分類】
【出願日】平成20年12月18日(2008.12.18)
【出願人】(000005072)萬有製薬株式会社 (51)
【出願人】(304026696)国立大学法人三重大学 (270)
【Fターム(参考)】
[ Back to top ]

