リューマチ性関節炎の診断用組換え抗原
組換え抗原(RAMA)を提供し、患者血清中のRAMA抗原に対するリューマチ性関節炎関連IgM抗体を検出することによりリューマチ性関節炎を診断する方法を開示する。RAMA抗原は配列番号3およびそれに実質的に相同的なペプチドからなる。RAMA抗原をコードする精製され単離されたDNAおよび前記DNAを含むトランスフォームされた宿主も開示される。
【発明の詳細な説明】
リューマチ性関節炎の診断用組換え抗原 発明の背景 本発明はリューマチ性関節炎の診断方法に関する。より具体的には、本発明は組換え抗原と反応する患者血清中のリューマチ性関節炎関連抗体の存在または不存在の定量によるリューマチ性関節炎の客観的な診断方法に関する。さらに、本発明は組換え抗原およびその遺伝子の分子クローンに関する。
リューマチ性関節炎は人口のかなりのパーセントで影響を与える慢性的な全身性リューマチ疾患である。慣習的に、患者による臨床的な観察または主訴により主観的に診断されてきた(P.Llpsky,Rheumatoid Arthritis,Harrison's Principles of Internal Medicine 1423(1987))。よって、リューマチ性関節炎の臨床的な診断は診断医の技能および患者の疾患の症状の重篤度に委ねられている。
リューマチ性関節炎の客観的な診断に関して、リューマチ性関節炎患者の血清中のリューマチ因子(Rf)の存在がルーチン的に測定されている。RfはIgG免疫グロブリン不変部領域に結合する自己抗体である。血液中のRfの存在を測定する標準的な試験は、RfがIgGの凝集を引き起こす凝集試験である。Rfは、リューマチ性関節炎の臨床的症状を示す約70%の患者で検出されてきた。よって、これらの患者は「血清陽性」と称される。残りの30%は「血清陰性」リューマチ性関節炎を有すると分類される。リューマチ性関節炎以外に多くの疾患がリューマチ因子の存在に関連する。したがって、Rfの存在に基づいてリューマチ性関節炎の決定的な診断が確立されることはない。実施するのに迅速で容易であり、放射性同位元素をともなわず、または患者を冒すことがなく侵襲的でない、血清中のRfの存在よりも、臨床的な診断により密接に関連するリューマチ性関節炎の客観的な診断方法が必要とされている。
多様な自己免疫リューマチ疾患を有する患者からの血清は、細胞の主に核成分に対する循環性の自己抗体を含有する(E.Tan,33 Advances in Immunology 167-240(1982))。これらの抗体は抗核抗体(ANA)と称され、それらの各自己免疫疾患に特異的であり、臨床医学における診断用補助物として有用である。これらの抗体に対する抗原の一部はバイオテクノロジーの方法により作られ、各自己免疫疾患の診断に用いられている(R.Michael および J.Keene,Molecular Biology of Nuclear Autoantigen,18 Rheumatoid Disease Clinics of North America 283-310(D.Pisetsky,編,1992))。これらの自己免疫疾患に対する診断試験の開発の成功は、同様なアプローチがリューマチ性関節炎に対して有益であることを示唆する。
リューマチ性関節炎患者からの血清も細胞の成分に対する抗体を含有することが発見された。寒天ゲル拡散試験で、リューマチ性関節炎患者からの血清と、ある種のエプスタイン・バーウイルスでトランスフォームされたヒトBリンパ球細胞系、例えばWIL−2やRaji細胞系からの抽出物とを隣接するウェルに置くと、沈降素のラインが形成される(M.Alspaugh および E.Tan,19 Arthritis and Rheumatism 711-19(1976))。この沈殿の原因となる抗体はIgGタイプであり、それが反応する抗原は核抗原である。よって、この抗原は「リューマチ性関節炎核抗原(rheumatoid arthritis nuclear antigen)」または「RANA」と称されている。
RANAの存在に基づく診断試験を開発可能とする前にいくつかの問題を克服する必要がある。この抗原の同一性(identity)は知られていない。かりにそれが知られていたとしても、細胞中に小量しか存在していないので、均質な程度にまで精製することは困難である。このような純度が必要とされるが、その理由としては小量の抗原を検出するように工夫された血清学的試験の極端な感度の場合、夾雑物がRANAとともに精製されると偽陽性を生じることがあるためである。
これらの理由から、本発明はリューマチ性関節炎の定量的検出に対する異なるアプローチを開示する。このアプローチは組換えDNA技術による組換え抗原の生産、およびこの新規な抗原に対するリューマチ性関節炎関連抗体の患者血清中における検出をともなうものである。この組換え抗原は市販の抗RANA抗体とは反応しない。
発明の目的と要約 本発明の一つの目的は、リューマチ性関節炎の診断方法を提供することにある。
本発明の別の目的は、患者血清の血清学的分析、例えばELISA分析によるリューマチ性関節炎の診断方法を提供することにある。
さらに、本発明の目的は、リューマチ性関節炎関連抗体により検出可能な組換え抗原の発現を指令することのできる核酸を提供することにある。
さらに、本発明の別の目的は、リューマチ性関節炎関連抗体により検出可能な組換え抗原を提供することにある。
これらの目的と他の目的は、配列番号3およびそれと実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなる、リューマチ性関節炎の診断用抗原を提供することにより達成され、前記の抗原はリューマチ性関節炎関連抗体に対して反応性を有するものである。この抗原は原核または真核の宿主細胞で発現させることができ、または化学的に合成することができる。これらのリューマチ性関節炎関連抗体はIgMサブタイプである。
また、本発明は、天然のRAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドの宿主細胞での発現を確実とするのに使用される精製され単離されたDNAを包含し、該DNAは、 (a)配列番号2、 (b)配列番号2とハイブリダイズするDNAまたはその断片、および (c)遺伝子コードの縮退以外は(a)および(b)で定義されたDNAとハイブリダイズするDNAからなる群から選択される。さらに、この精製され単離されたDNAは宿主のトランスフォームに適したベクターを含むことができ、該ベクターはプラスミド、コスミド、ファージミド、ファージ、ウイルス等からなる群から選択される。宿主は大腸菌(E.coli )等の原核細胞でも真核細胞でもよい。
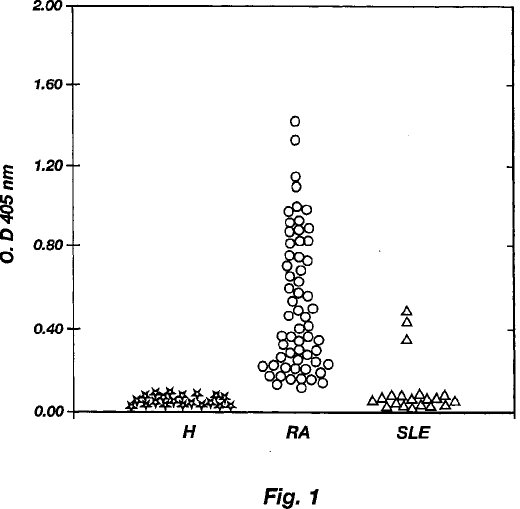
図面の簡単な説明 図1は、健康人(H)からの血清、リューマチ性関節炎(RA)の血清および全身性エリテマトーデス(SLE)の血清の本発明によるELISA試験結果を示すグラフである。
詳細な説明 本発明の組換え抗原および分子的にクローニングされたその遺伝子を開示し、記載する前に、ここに開示された特定の方法の工程と材料とは若干変更してもよいので、本発明はそのような方法の工程と材料とに限定されるものではないことを理解されたい。また、本発明の範囲は添付の請求の範囲とその均等物によってのみ限定されるものであって、ここで使用される用語は特定の実施態様を説明する目的のためにだけに用いられるもので、限定することを意味するものではない。
本明細書および添付の請求の範囲で用いられる単数形("a"、"an"および"the"の単数形)はその文脈が明らかに示さない場合は複数形のものを包含する。よって、例えば「ペプチド」("a peptide" )を含有する抗原と称した場合は2種類以上のペプチドの混合物を包含し、「宿主細胞」("a host cell" )と称した場合は1種類以上のそのような宿主細胞を包含し、「プラスミド」("a plasmid" )と称する場合は2種類以上のプラスミドの混合物を包含するものである。
本発明を説明し、特許請求する際に、以下の用語を以下に示す定義にしたがって用いることにする。
ここに用いられる「RAMA」は、ATCC 69605として寄託されているプラスミドによりコードされる本発明のリューマチ性関節炎IgM関連抗原を意味する。
ここに用いられる「ペプチド」は、どのような長さのペプチドをも意味し、またタンパク質を包含する。「ポリペプチド」および「オリゴペプチド」という用語は特定の大きさが示されない限り、特定の大きさを意図するという限定をすることなしにここで用いられる。
ここに用いられる「DNA」は、DNA、および遺伝情報を保存することができる他の核酸を意味する。例えば、RAMA遺伝子のインビトロ転写により得られるRNAはDNAという用語の範囲に含まれる。
ここに用いられる「ベクター」は、宿主細胞中で複製することができ、かつベクターに挿入される外来核酸を保有することのできる遺伝子要素を意味する。本発明の範囲内で用いることができるベクターとしては、プラスミド、コスミド、ファージミド、ファージ、ウイルス等が例示される。
ここに用いられる「実質的に相同的な」は、比較されるポリヌクレオチドおよびポリペプチドとは一次構造が異なるにもかかわらず機能性を保持するポリヌクレオチドおよびポリペプチドを意味する。例えば、配列番号2に実質的に相同的なポリヌクレオチドは、配列番号3のアミノ酸配列を有する天然タンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するポリペプチド産物の宿主細胞における発現を確保することができるものであり、該ポリヌクレオチドは、(a)配列番号2とハイブリダイズするポリヌクレオチドまたはその断片、および(b)遺伝子コードの縮退以外は配列番号2および(a)とに定義したポリヌクレオチドとハイブリダイズするポリヌクレオチドから選択される。
さらに具体例として、配列番号3に実質的に相同的なポリペプチドはリューマチ性関節炎関連抗体と反応性のある抗原としての機能を保持するものであるが、該ポリペプチドはさらに余分なアミノ酸残基を有していてもよく、または配列番号3のトランケートされた変異体、欠損変異体、または置換変異体であってもよい。
置換変異体は、1個以上のアミノ酸残基の保存的な置換を含有するものである。
保存的な置換とは、ペプチドの機能(この場合はリューマチ性関節炎関連抗体と反応性のある抗原としての機能)を保持しながらあるアミノ酸残基が別のものに置換されたものである。ある種の保存的な置換基に属するアミノ酸残基はしばしば同じグループ内の別のアミノ酸残基と置換することができる。そのような一つのグループは、Pro; Ala, Gly; Ser, Thr; Asn, Gln; Asp; Glu; His; Lys, Arg; Cys; Ile, Leu, Met, Val; およびPhe, Trp, Tyrである(M. Jimenez-Montano および L. Zamora-Cortina 、アミノ酸配列の生成の進化モデルおよびその哺乳類α−ヘモグロビン鎖の研究への応用、Proc. VII th Int'l Biophysics Congress, Mexico City(1981))。実質的に相同的であると思われる他の変異としては、天然Lアミノ酸に対するDアミノ酸置換、例えば付加側鎖を有するようなアミノ酸誘導体の置換、および非標準的なアミノ酸(すなわち、タンパク質中では稀であるかまたは存在しないα−アミノ酸)の置換が挙げられる。実質的に相同的なポリペプチドの一次構造は機能によってのみ限定される。
新規な抗原(「RAMA」)をコードする遺伝子は、ここで文献の援用として挙げる1993年2月19日に出願された同時係属中の米国特許出願第08/019,780号に記載のように、分子的にクローニングされ、細菌および真核タンパク質発現システムで発現される。RAMA抗原のクローニングと発現にともなうステップを簡単に記載すれば以下の通りである。ポリアデニル化mRNAを約1×108個のヒトRaji細胞(ATCC No.CCL 86)から「ファーストトラック(FAST TRACK)」mRNA単離用キット(Invitrogen、サンディエゴ、カリフォルニア州、米国)を用いて単離した。細胞を溶解し、ホモゲナイズし、プロテアーゼとともにインキュベートし、次にオリゴ(dT)セルロースクロマトグラフィーにかけた。得られたポリアデニル化RNAを次に鋳型材料として用い、市販のキット(λライブラリアン(λ Librarian)、Invitrogen)を用いて2本鎖cDNAを調製した。このキットで用いられる方法はOkayamaとBerg(2 Molecular and Cellular Biology 161(1982))およびGublerとHoffman(25 Gene 263(1983))によって記載された方法である。cDNAの両末端をT4ポリメラーゼで処理し平滑化した。EcoRIリンカーをこの平滑化cDNAにT4 DNAリガーゼを用いて連結した。このリンカーは次の配列を有する。

このリンカーを構成する短い方のオリゴマーの5’末端はリン酸化を行ったが、長い方のオリゴマー(配列番号1)の5’末端はリン酸化しなかった。いったんリンカーを付加してから、cDNAをT4ポリヌクレオチドキナーゼで処理して、EcoRIリンカーの突出5’末端をリン酸化した。これらの方法から得られる2本鎖CDNAは、多様な長さの分布を示すcDNAならびに過剰の未反応のリンカーを有していた。この未反応リンカーを除去して、アガロースゲル電気泳動によりcDNAを分画することにより1〜5kbpの範囲のcDNAを選択した。分画完了後、ゲルをゲル装置から取出し、cDNAを臭化エチジウムにより可視化し、cDNAレーンのスライスを1〜5kbpの所望の大きさに対応するように切断した。このcDNAをすぐに電気溶出した。
次に、サイズで選択されたこの2本鎖cDNAをファージλgt11クローングベクター中でクローニングした(R. Young および R. Davis, 80 Proc. Nat'l Acad.Sci USA 1194-98(1983); T. Hyynh ら, 1 DNA Cloning: A Practical Approach 49-78(D. Glover, ed, IRL Press, Oxford, 1985))。このベクターのEcoRIクローニングサイトは、λgt11ベクターを作る際にファージλDNAに挿入されている大腸菌(E. coli)
lacZ遺伝子内に位置している。このlacZ遺伝子は酵素β−ガラクトシダーゼをコードする。EcoRIサイトでのクローニングによりこの遺伝子に挿入されたDNA断片は、lacプロモーターの制御下で不活性な組換えβ−ガラクトシダーゼ酵素を作る融合遺伝子をもたらす。組換えファージは、ラクトース類似体の5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトシド(X−gal)を含有するインディケータープレート上で青色のプラークを形成できないので、これらのファージを認識し、選択することができる。λgt11ファージはlac+であるために、無色のX−galを代謝物質に切断することができ、該代謝物質は自己構築して青色インドール化合物となる。EcoRIで消化され、脱リン酸化されたλgt11DNAをInvitrogenから得た。
連結されたDNAを次に Promega社(ウィスコンシン州、マジソン)から市販され入手した「パッケジーン(PACKAGENE )」ファージλパッケージングシステムでパッケージし、組換えファージの力価を供給会社の指示書にしたがって測定した。
組換え抗原は Promega社からの「プロトブロット(PROTOBLOT )」免疫スクリーニングシステムに関する技術マニュアルに記載された非放射活性免疫ブロット技術を用いて単離した。Y1090宿主細胞を、λgt11ライブラリーからの3×104個のプラーク形成単位(PFU)の組換えファージに感染させ、次にこれを寒天プレートに塗布した。プレートに、10mMのIPTGで前もって飽和しておいた乾いたニトロセルロースフィルターを重ねて37℃でインキュベートした。インキュベーション中、溶菌的に感染した細胞から放出されるファージとタンパク質はフィルターに付着した。フィルターをプレートから除去し、ブロックして他のタンパク質がプレートへ付着するのを防止した。次に、リューマチ性関節炎を有すると臨床的に決定された患者の血清(TBST緩衝液:10mMトリス塩酸、pH8.0、1mM EDTA、0.05%「トゥイーン(TWEEN )−20」、により1:20に希釈)
をフィルターとともにインキュベートした。次に、フィルターをTBSTで洗浄し、非特異的に結合した抗体を除去した。次に、フィルターを抗IgM抗体−アルカリホスファターゼ複合体(Kirkegaard & Perry Laboratories, Inc.、ガイセルブルク、メリーランド州; TBSTにより1:100に希釈)とともにインキュベートした。次に、フィルターを再び洗浄し、顕色基質であるニトロブルーテトラゾリウム(NBT)および5−ブロモ−4−クロロ−3−インドリルホスフェート(BCIP)を加えた。陽性プラークはアルカリホスファターゼの活性の結果として暗い紫色を生じた。陽性プラークを再試験し、試験プレート上のすべてのプラークが陽性シグナルを生じるまでリプレートを行うことにより精製した。
精製された賜性の組換えλgt11ファージの溶原菌(lysogen )を Promega社の技術解説書No.006にしたがって作った。T. Maniatisらにより記載のアルカリ溶解ミニプレップ・プロトコール(Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratories, Cold Spring Harbor, New York, 1982))を用いて、組換えファージDNAをλgt11溶原菌から単離した。このDNAをEcoRIで消化し、得られたDNA断片を0.7%低融点アガロースゲルによる電気泳動で分画した。臭化エチジウム染色および紫外線照射により、特異な2600bpのバンドが明らかとなった。このバンドをゲルからスライス状に切り出し、そのアガロースを70℃でメルトした。次に、DNAをフェノール抽出し、そしてアルコールで沈殿させた。
次に、標準的な方法(例えばJ. Sambrook ら, Molecular Cloning: A Laboratory Manual(第2版,1989); T. Maniatisら, Molecular Cloning: A Laboratory Manual(1982); F. Ausubel ら, Current Protocols in Molecular Biology(1987))を用いて、Invitrogenから得られたプラスミド発現ベクター「pTrcHis C」
のEcoRIサイトで前記の2600bpのEcoRI断片を再クローン化した。このベクターはλgt11と同じリーディングフレームを有し、かつ大腸菌(E. coli )で高いレベルのタンパク質発現を得るためのすべてのDNA配列を有し、さらに6個の連続したヒスチジン残基をコードする配列を有しており、発現されたタンパク質は該ヒスチジン残基によりNi荷電の「プロバンド(PROBOND)」樹脂(Invitrogen)に結合するので、この組換えタンパク質は1ステップ精製で容易に精製することができる。前記の2600bp断片を有するpTrcHis Cプラスミドで大腸菌(E. coli )株Top10(Invitrogenより入手)をトランスフォームした。
組換えタンパク質の発現はウエスタンブロッティング分析により示された。トランスフォーム体はLuriaブロス(LB)で37℃にてOD600が0.5になるまで増殖させた。次に、lacオペロンの誘導物質であるイソプロピルチオ−β−D−ガラクトシド(IPTG)を1mMの最終濃度まで加えて組換えタンパク質の発現を誘導した。誘導後、トランスフォーム体をさらに3時間30℃で成長させた。次に、約200μlの培養物を遠心チューブに入れ、軽く遠心して細胞をペレット状にした。培養液(ブロス)は除去して捨て、ペレットをSDS含有緩衝液に再懸濁した(上記のT.Maniatisら)。この試料を2時間沸騰湯浴中で加熱し、10%SDSポリアクリルアミドゲルにかけ、70ボルトで一晩電気泳動した(上記のT.Maniatisら)。「ポリブロット(POLYBLOT)」エレクトロトランスファーシステム(Americal Bionetics社、ヘイワード、カリフォルニア州)を用い、同社の指示マニュアルにしたがって、タンパク質を電気泳動によりニトロセルロースメンブレンに移した。
移した後、メンブレンを取出し、次にブロックしてタンパク質の非特異的な結合を防いだ。リューマチ性関節炎の患者の血清(1:21に希釈)をメンブレンに加えて1時間インキュベートした。次にこのメンブレンをTBSTで洗浄した。
次に、プラークスクリーニング法と同じように、このメンブレンを抗IgM抗体−アルカリホスファターゼ複合体(Kirkegard & Perry)とともにインキュベートした。次に、このメンブレンをTBSTで洗浄し、NBTとBCIPを加えることで顕色させた。
これらの試験で、リファレンス血清と反応する約48kDのタンパク質に対応する単一バンドが明らかとなった。約4kDのタンパク質配列はプラスミドベクターに由来するもので、発現ベクターにより作られた残りの44kDのタンパク質がリューマチ性関節炎患者の血清と反応する抗原に由来するものであることを示唆している。
組換え抗原遺伝子の配列決定 クローニングしたcDNAをF.Sangerらの方法(DNA Sequencing with Chain-Terminating Inhibitors, 74Proc. Nat'l Acad. Sci. USA 5463(1977))による塩基配列の分析に供した。993bpセグメントのDNAからなるオープンリーディングフレームが明らにされた。このオープンリーディングフレーム(配列番号2)は、本発明の組換えRAMA抗原を構成する331アミノ酸のタンパク質(配列番号3)をコードする。
組換え抗原の細菌からの精製 細菌プラスミド発現ベクターにより発現される組換えRAMAタンパク質は、Invitrogenの「プロボンド(PROBOND )」カラムを用い、該カラムとともに提供される同社の指示書にしたがって精製した。発現プラスミドを含有するBL21細胞(F’ompT hsdSB[rB-mB-dcm])(プロテアーゼ-株、Novagen 、マジソン、ウィスコンシン州)の一晩培養した培養物10mlを、グルコースと50μg/mlのアンピシリンとを含有する約1リットルのLBに接種した。この細胞を2.5時間成長させ、この間にIPTGを1mMの最終濃度まで加えて、組換えRAMAタンパク質の発現を誘導した。誘導後、細胞をさらに3時間37℃でインキュベートした。次に、細胞を遠心により集め、再懸濁し、リゾチームおよび超音波により溶解した。次に細胞を10,000rpmで遠心した。組換えRAMAタンパク質は可溶性であり、上清中にとどまった。
組換えRAMAタンパク質の発現をウエスタンブロッティング分析により確認した。組換えRAMAタンパク質試料をポリアクリルアミドゲル電気泳動にかけ、ニトロセルロースメンブレンへ電気泳動により移した後、タンパク質の非特異的な結合をブロックした。リューマチ性関節炎患者の血清をメンブレンに結合しているタンパク質に1:21の希釈度で加え、1時間インキュベートした。次に、このメンブレンを洗浄し、抗ヒトIgM−アルカリホスファターゼ複合体とともにインキュベートした。顕色基質溶液を加える前にメンブレンを再び洗浄した。約41,000のMrを有する単一のタンパク質バンドがリューマチ性関節炎患者の血清と反応した。これは、その配列に基づくRAMAタンパク質(約34kd)の予想されたサイズとかなり良好な一致を示している。
真核細胞における組換えRAMAの発現 RAMA遺伝子を含有する2600bpのDNA断片を、標準的な方法によりpBlueBacHis C バキュロウイルスベクター(Invitrogen)で再びクローニングした。RAMA遺伝子を有するこのpBlueBacHis C ベクターを「バキュロゴールド(BACULOGOLD)」(Pharmingen、サンディエゴ、カリフォルニア州)バキュロウイルスDNAとともに Spodoptera frugiperda Sf9細胞にコートランスフェクトした。これらのDNA間の相同組換えの結果、ウイルスのポリヘドリンエンハンサー/プロモーターエレメントの制御下で発現されるRAMA遺伝子を有する組換えウイルスが得られた。この組換えウイルスをSf9昆虫細胞で作らせ、Invitrogenのマニュアルに記載されているようにして精製した。次に、Invitrogenのマニュアルにしたがって組換えウイルスのプラーク精製のために、このウイルス保存物を用いて10倍希釈物を調製した。
pBlueBacHis C でのRAMA遺伝子の発現はウエスタンブロッティング分析により確認した。約1mlのSf9昆虫細胞に組換えプラスミドを有するウイルスを感染させ、その3日後にこの細胞をペレット化し、100μlのLaemmli緩衝液に溶解した(U. Laemmli, 227 Nature 680-85(1970))。この試料を2時間沸騰し、次に上記のように7.5%SDS−ポリアクリルアミドゲルに負荷し、70ボルトで一晩電気泳動した。
上記のように、タンパク質を電気泳動によりニトロセルロースメンブレンに移し、タンパク質の非特異的な結合をブロックした。リューマチ性関節炎患者の血清を1:21の希釈度でメンブレン結合タンパク質に加え、1時間インキュベートした。次に、このメンブレンをTBSTで洗浄し、抗ヒトIgM−アルカリホスファターゼ複合体とともに30分間インキュベートした。顕色基質溶液を加える前にこのメンブレンを再びTBSTで洗浄した。約100,000のMrを有する単一のタンパク質バンドがリューマチ性関節炎患者からの血清と反応した。細菌で発現されたRAMAタンパク質と真核細胞で発現されたRAMAタンパク質のMrの違いは、真核細胞中の発現タンパク質のグリコシル化および恐らくはそれ以外の修飾によるものと思われる。この真核細胞システムでの発現により作られた組換えRAMAタンパク質を上記のようにNi荷電「プロボンド(PROBOND)」カラムで精製した。約1.5mgのタンパク質を50mlの培養物から精製した。
組換えRAMAタンパク質のELISA試験 大腸菌(E. coli )系での発現により作られ、「プロボンド(PROBOND )」カラムで精製された約100μlの組換えRAMAタンパク質溶液(PBS緩衝液(pH7.4)中の1μg/mlの精製組換えタンパク質)をポリスチレン製マイクロタイタープレート(高結合(High binding)96ウェルコーニング(Corning)プレート)のウェルに入れ、4℃で一晩インキュベートした。このプレートを洗浄し、次に4℃で一晩ブロックして非特異的な結合を防いだ。1:21で希釈された100μlの血清をウェルに入れ、1時間インキュベートし、次にウェルを洗浄した。アルカリホフファターゼ複合化抗ヒトIgM(Kirkegaard & Perry)の100μlをウェルに入れ、1時間インキュベートし、次にウエルを再び洗浄した。次に、5mgのp−ニトロフェノールホスフェートと1mlの5Xジエタノールアミン緩衝液(Kirkegaard & Perryより供給されたもの)とを4mlの蒸留水に加えて調製した100μlのアルカリホスファターゼ基質をウェルに加えて37℃で15分間インキュベートした。次に、その光学濃度を405nmにて測定した。
リューマチ性関節炎の臨床的症状を有する患者60名(Rfに関して35名は血清陽性であり、25名は血清陰性である)、SLEに関する抗DNA疾患マーカーに対して血清陽性である20名、および健康人20名からの血清を既に概略した方法により調べた。これらの試験の結果を図1と下記の表に要約する。

すべての健康被験者の血清は0.250以下のELISA値を示した。よって、0.250の読みは陽性反応を決定するためのカットオフ値とみなされた。血清陽性のリューマチ性関節炎患者の35血清のうち34血清(すなわち97%)
が0.250以上のELISA値を示したために、これらは陽性反応を示しているとみなされた。血清陰性のリューマチ性関節炎患者からの25血清のうち、11(すなわち44%)が0.250以上のELISA値を示したために、これらは陽性反応を示しているとみなされた。対照の抗DNA+20血清のうち3血清も陽性反応を示した。したがって、これらの結果はほとんどすべての血清陽性のリューマチ性関節炎患者がこのELISA試験の助けによる診断で、RAMA組換え抗原に対する、血清中の抗体の存在を検出することができたことを示している。さらに、血清陰性のリューマチ性関節炎患者のほぼ半数も同様に診断することができた。これらの結果は、標準的なRf試験を用いた場合が約70%にすぎないのに比較して約85%のリューマチ性関節炎のケースが本発明を用いて診断することができることを示唆している。
RAMAがRfではないことを示すために、さらに別の試験を行った。組換えRAMAタンパク質を用いる標準的なRf凝集試験を行うために独立した対照実験室と契約した。IgGの凝集は形成されなかった。これは、Rfを陽性の対照として同じように検定した場合には凝集が形成したために陰性の結果である。さらに、組換えRAMA抗原をマイクロタイタープレートのウェルに付着させ、結台したRAMA抗原を次に酵素複合体化IgG抗体にさらした。酵素活性の比色定量アッセイを上記のように行った。酵素活性は検出されず、IgG抗体がRAMAタンパク質と結合しないことを示している。最後に、Rfとの反応に関してELISAにより試験された場合に陽性の結果を示した7名の臨床的に正常な被験者(すなわちすべての7名の被験者がRfに関して血清陽性である)を一次抗原としてRAMAを用いるELISAを用いて調べた。7名全員がRAMAとの反応で血清陰性であった。これらの結果は本発明の主題である組換えRAMAタンパク質がRfではないことを示している。
RAMA活性を有するペプチド 本発明の範囲はRAMAペプチドの活性を有するものであればいかなるペプチドも包含するものである。そのようなペプチドは配列番号3としての組換えRAMAおよびそれと実質的に相同的なペプチドを包含し得る。天然のRAMAに実質的に相同的なペプチドの具体例は、6個のヒスチジン残基が付加されて、金属含有樹脂を用いるアフィニティークロマトグラフィーによる精製が容易となった上記の組換えRAMAである。6個のヒスチジン残基の付加にもかかわらず、組換えRAMAはリューマチ性関節炎関連IgM抗体に対して反応性があった。RAMAに実質的に相同的なペプチドは既に詳しく説明したように宿主細胞による発現によるか、または化学合成によって合成することができる。
リューマチ性関節炎関連抗体を検出するための短いペプチドは以下のように同定し、調製することができる。エンドプロテイナーゼ−lys C(Boehringer Mannheim)を同社の指示にしたがって用いることでRAMAタンパク質をペプチド断片に消化した。これらの断片をHPLCで分画して、その配列をN. Legendre およびP.T. Matsudairaの方法にしたがって決定した(Gel Electrophoresis, A Practical Guide to Protein and Peptide Purification for Microsequencing 52-66(P.T. Matsudaira編, 1989 ))。さらに別の断片をRAMAのプロテイナーゼ消化とポリアクリルアミドゲルによる分離により調製する(J. Sambrookら, Molecular Cloning: A Laboratory Manual(第2版, 1989))。これらの断片をウエスタンブロッティングに供して(H. Towbinら,Electrophoretic Transfer of Proteins from Polyacrylamide Gels to Nitrocellulose Sheets: Procedure and Some Applications, 76 Proc. Nat'l Acad. Sci. USA 4350(1979))、リューマチ性関節炎関連抗体が結合した断片を同定した。抗体と反応するペプチドの配列決定を行う。リューマチ性関節炎関連抗体により認識されるエピトープを有するRAMAの単一または複数の断片の同定後、プロティナーゼによる消化、ウエスタンブロッティングおよび配列決定のプロセスを、さらに小さいペプチド作る異なるプロテイナーゼを用いて繰り返した。この方法により抗体により認識される配列の同定ができる。これらのデータから、類似の配列を有するオリゴペプチドを化学合成(ここで文献の援用として挙げる B.Merrifield, 85 J. Am. Chem. Soc. 2149-2156(1963); B. Merrifieldら,21 Biochemistry 5020-31(1982); Houghten, 82 Proc. Nat'l Acad. Sci. USA 5131-35(1985))によるか、またはバイオテクノロジーによる方法(J. Sambrookら,Molecular Cloning: A Laboratory Manual(第2版,1989))により合成され、リューマチ性関節炎関連抗体に対する反応性について調べた。酵素のいくつかのペプチド擬似(peptidomimetic)阻害剤がこれらの技術を用いて記載されている(A. Smithら,Design and Synthesis of Peptidomimetic Inhibitors of HIV-1 Protease and Renin: Evidence for Improved Transport, 37 J. Med. Chem.215(1994); S. Francisら,Molecular Characterization and Inhibition of a Plasmodium falciparum Aspartic Hemoglobinase,13 EMBO J. 306(1994); A. Garciaら,Peptidomimetic Inhibitors of Ras Farnesylation and Function in Whole Cells,268 J. Biol. Chem. 18415(1993))。
微生物材料の寄託 ここに記載され、リューマチ性関節炎を診断するために用いられる組換えRAMA抗原をコードする遺伝子を有するプラスミドを含有する大腸菌(E. coli )
株寄託物は1994年4月13日に国際寄託機関であるアメリカンタイプカルチャーコレクション(ATCC)、12301パークローンドライブ、ロックビル、メリーランド州 20852 米国に寄託されている。寄託された株の寄託番号はATCC 69605である。





リューマチ性関節炎の診断用組換え抗原 発明の背景 本発明はリューマチ性関節炎の診断方法に関する。より具体的には、本発明は組換え抗原と反応する患者血清中のリューマチ性関節炎関連抗体の存在または不存在の定量によるリューマチ性関節炎の客観的な診断方法に関する。さらに、本発明は組換え抗原およびその遺伝子の分子クローンに関する。
リューマチ性関節炎は人口のかなりのパーセントで影響を与える慢性的な全身性リューマチ疾患である。慣習的に、患者による臨床的な観察または主訴により主観的に診断されてきた(P.Llpsky,Rheumatoid Arthritis,Harrison's Principles of Internal Medicine 1423(1987))。よって、リューマチ性関節炎の臨床的な診断は診断医の技能および患者の疾患の症状の重篤度に委ねられている。
リューマチ性関節炎の客観的な診断に関して、リューマチ性関節炎患者の血清中のリューマチ因子(Rf)の存在がルーチン的に測定されている。RfはIgG免疫グロブリン不変部領域に結合する自己抗体である。血液中のRfの存在を測定する標準的な試験は、RfがIgGの凝集を引き起こす凝集試験である。Rfは、リューマチ性関節炎の臨床的症状を示す約70%の患者で検出されてきた。よって、これらの患者は「血清陽性」と称される。残りの30%は「血清陰性」リューマチ性関節炎を有すると分類される。リューマチ性関節炎以外に多くの疾患がリューマチ因子の存在に関連する。したがって、Rfの存在に基づいてリューマチ性関節炎の決定的な診断が確立されることはない。実施するのに迅速で容易であり、放射性同位元素をともなわず、または患者を冒すことがなく侵襲的でない、血清中のRfの存在よりも、臨床的な診断により密接に関連するリューマチ性関節炎の客観的な診断方法が必要とされている。
多様な自己免疫リューマチ疾患を有する患者からの血清は、細胞の主に核成分に対する循環性の自己抗体を含有する(E.Tan,33 Advances in Immunology 167-240(1982))。これらの抗体は抗核抗体(ANA)と称され、それらの各自己免疫疾患に特異的であり、臨床医学における診断用補助物として有用である。これらの抗体に対する抗原の一部はバイオテクノロジーの方法により作られ、各自己免疫疾患の診断に用いられている(R.Michael および J.Keene,Molecular Biology of Nuclear Autoantigen,18 Rheumatoid Disease Clinics of North America 283-310(D.Pisetsky,編,1992))。これらの自己免疫疾患に対する診断試験の開発の成功は、同様なアプローチがリューマチ性関節炎に対して有益であることを示唆する。
リューマチ性関節炎患者からの血清も細胞の成分に対する抗体を含有することが発見された。寒天ゲル拡散試験で、リューマチ性関節炎患者からの血清と、ある種のエプスタイン・バーウイルスでトランスフォームされたヒトBリンパ球細胞系、例えばWIL−2やRaji細胞系からの抽出物とを隣接するウェルに置くと、沈降素のラインが形成される(M.Alspaugh および E.Tan,19 Arthritis and Rheumatism 711-19(1976))。この沈殿の原因となる抗体はIgGタイプであり、それが反応する抗原は核抗原である。よって、この抗原は「リューマチ性関節炎核抗原(rheumatoid arthritis nuclear antigen)」または「RANA」と称されている。
RANAの存在に基づく診断試験を開発可能とする前にいくつかの問題を克服する必要がある。この抗原の同一性(identity)は知られていない。かりにそれが知られていたとしても、細胞中に小量しか存在していないので、均質な程度にまで精製することは困難である。このような純度が必要とされるが、その理由としては小量の抗原を検出するように工夫された血清学的試験の極端な感度の場合、夾雑物がRANAとともに精製されると偽陽性を生じることがあるためである。
これらの理由から、本発明はリューマチ性関節炎の定量的検出に対する異なるアプローチを開示する。このアプローチは組換えDNA技術による組換え抗原の生産、およびこの新規な抗原に対するリューマチ性関節炎関連抗体の患者血清中における検出をともなうものである。この組換え抗原は市販の抗RANA抗体とは反応しない。
発明の目的と要約 本発明の一つの目的は、リューマチ性関節炎の診断方法を提供することにある。
本発明の別の目的は、患者血清の血清学的分析、例えばELISA分析によるリューマチ性関節炎の診断方法を提供することにある。
さらに、本発明の目的は、リューマチ性関節炎関連抗体により検出可能な組換え抗原の発現を指令することのできる核酸を提供することにある。
さらに、本発明の別の目的は、リューマチ性関節炎関連抗体により検出可能な組換え抗原を提供することにある。
これらの目的と他の目的は、配列番号3およびそれと実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなる、リューマチ性関節炎の診断用抗原を提供することにより達成され、前記の抗原はリューマチ性関節炎関連抗体に対して反応性を有するものである。この抗原は原核または真核の宿主細胞で発現させることができ、または化学的に合成することができる。これらのリューマチ性関節炎関連抗体はIgMサブタイプである。
また、本発明は、天然のRAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドの宿主細胞での発現を確実とするのに使用される精製され単離されたDNAを包含し、該DNAは、 (a)配列番号2、 (b)配列番号2とハイブリダイズするDNAまたはその断片、および (c)遺伝子コードの縮退以外は(a)および(b)で定義されたDNAとハイブリダイズするDNAからなる群から選択される。さらに、この精製され単離されたDNAは宿主のトランスフォームに適したベクターを含むことができ、該ベクターはプラスミド、コスミド、ファージミド、ファージ、ウイルス等からなる群から選択される。宿主は大腸菌(E.coli )等の原核細胞でも真核細胞でもよい。
図面の簡単な説明 図1は、健康人(H)からの血清、リューマチ性関節炎(RA)の血清および全身性エリテマトーデス(SLE)の血清の本発明によるELISA試験結果を示すグラフである。
詳細な説明 本発明の組換え抗原および分子的にクローニングされたその遺伝子を開示し、記載する前に、ここに開示された特定の方法の工程と材料とは若干変更してもよいので、本発明はそのような方法の工程と材料とに限定されるものではないことを理解されたい。また、本発明の範囲は添付の請求の範囲とその均等物によってのみ限定されるものであって、ここで使用される用語は特定の実施態様を説明する目的のためにだけに用いられるもので、限定することを意味するものではない。
本明細書および添付の請求の範囲で用いられる単数形("a"、"an"および"the"の単数形)はその文脈が明らかに示さない場合は複数形のものを包含する。よって、例えば「ペプチド」("a peptide" )を含有する抗原と称した場合は2種類以上のペプチドの混合物を包含し、「宿主細胞」("a host cell" )と称した場合は1種類以上のそのような宿主細胞を包含し、「プラスミド」("a plasmid" )と称する場合は2種類以上のプラスミドの混合物を包含するものである。
本発明を説明し、特許請求する際に、以下の用語を以下に示す定義にしたがって用いることにする。
ここに用いられる「RAMA」は、ATCC 69605として寄託されているプラスミドによりコードされる本発明のリューマチ性関節炎IgM関連抗原を意味する。
ここに用いられる「ペプチド」は、どのような長さのペプチドをも意味し、またタンパク質を包含する。「ポリペプチド」および「オリゴペプチド」という用語は特定の大きさが示されない限り、特定の大きさを意図するという限定をすることなしにここで用いられる。
ここに用いられる「DNA」は、DNA、および遺伝情報を保存することができる他の核酸を意味する。例えば、RAMA遺伝子のインビトロ転写により得られるRNAはDNAという用語の範囲に含まれる。
ここに用いられる「ベクター」は、宿主細胞中で複製することができ、かつベクターに挿入される外来核酸を保有することのできる遺伝子要素を意味する。本発明の範囲内で用いることができるベクターとしては、プラスミド、コスミド、ファージミド、ファージ、ウイルス等が例示される。
ここに用いられる「実質的に相同的な」は、比較されるポリヌクレオチドおよびポリペプチドとは一次構造が異なるにもかかわらず機能性を保持するポリヌクレオチドおよびポリペプチドを意味する。例えば、配列番号2に実質的に相同的なポリヌクレオチドは、配列番号3のアミノ酸配列を有する天然タンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するポリペプチド産物の宿主細胞における発現を確保することができるものであり、該ポリヌクレオチドは、(a)配列番号2とハイブリダイズするポリヌクレオチドまたはその断片、および(b)遺伝子コードの縮退以外は配列番号2および(a)とに定義したポリヌクレオチドとハイブリダイズするポリヌクレオチドから選択される。
さらに具体例として、配列番号3に実質的に相同的なポリペプチドはリューマチ性関節炎関連抗体と反応性のある抗原としての機能を保持するものであるが、該ポリペプチドはさらに余分なアミノ酸残基を有していてもよく、または配列番号3のトランケートされた変異体、欠損変異体、または置換変異体であってもよい。
置換変異体は、1個以上のアミノ酸残基の保存的な置換を含有するものである。
保存的な置換とは、ペプチドの機能(この場合はリューマチ性関節炎関連抗体と反応性のある抗原としての機能)を保持しながらあるアミノ酸残基が別のものに置換されたものである。ある種の保存的な置換基に属するアミノ酸残基はしばしば同じグループ内の別のアミノ酸残基と置換することができる。そのような一つのグループは、Pro; Ala, Gly; Ser, Thr; Asn, Gln; Asp; Glu; His; Lys, Arg; Cys; Ile, Leu, Met, Val; およびPhe, Trp, Tyrである(M. Jimenez-Montano および L. Zamora-Cortina 、アミノ酸配列の生成の進化モデルおよびその哺乳類α−ヘモグロビン鎖の研究への応用、Proc. VII th Int'l Biophysics Congress, Mexico City(1981))。実質的に相同的であると思われる他の変異としては、天然Lアミノ酸に対するDアミノ酸置換、例えば付加側鎖を有するようなアミノ酸誘導体の置換、および非標準的なアミノ酸(すなわち、タンパク質中では稀であるかまたは存在しないα−アミノ酸)の置換が挙げられる。実質的に相同的なポリペプチドの一次構造は機能によってのみ限定される。
新規な抗原(「RAMA」)をコードする遺伝子は、ここで文献の援用として挙げる1993年2月19日に出願された同時係属中の米国特許出願第08/019,780号に記載のように、分子的にクローニングされ、細菌および真核タンパク質発現システムで発現される。RAMA抗原のクローニングと発現にともなうステップを簡単に記載すれば以下の通りである。ポリアデニル化mRNAを約1×108個のヒトRaji細胞(ATCC No.CCL 86)から「ファーストトラック(FAST TRACK)」mRNA単離用キット(Invitrogen、サンディエゴ、カリフォルニア州、米国)を用いて単離した。細胞を溶解し、ホモゲナイズし、プロテアーゼとともにインキュベートし、次にオリゴ(dT)セルロースクロマトグラフィーにかけた。得られたポリアデニル化RNAを次に鋳型材料として用い、市販のキット(λライブラリアン(λ Librarian)、Invitrogen)を用いて2本鎖cDNAを調製した。このキットで用いられる方法はOkayamaとBerg(2 Molecular and Cellular Biology 161(1982))およびGublerとHoffman(25 Gene 263(1983))によって記載された方法である。cDNAの両末端をT4ポリメラーゼで処理し平滑化した。EcoRIリンカーをこの平滑化cDNAにT4 DNAリガーゼを用いて連結した。このリンカーは次の配列を有する。

このリンカーを構成する短い方のオリゴマーの5’末端はリン酸化を行ったが、長い方のオリゴマー(配列番号1)の5’末端はリン酸化しなかった。いったんリンカーを付加してから、cDNAをT4ポリヌクレオチドキナーゼで処理して、EcoRIリンカーの突出5’末端をリン酸化した。これらの方法から得られる2本鎖CDNAは、多様な長さの分布を示すcDNAならびに過剰の未反応のリンカーを有していた。この未反応リンカーを除去して、アガロースゲル電気泳動によりcDNAを分画することにより1〜5kbpの範囲のcDNAを選択した。分画完了後、ゲルをゲル装置から取出し、cDNAを臭化エチジウムにより可視化し、cDNAレーンのスライスを1〜5kbpの所望の大きさに対応するように切断した。このcDNAをすぐに電気溶出した。
次に、サイズで選択されたこの2本鎖cDNAをファージλgt11クローングベクター中でクローニングした(R. Young および R. Davis, 80 Proc. Nat'l Acad.Sci USA 1194-98(1983); T. Hyynh ら, 1 DNA Cloning: A Practical Approach 49-78(D. Glover, ed, IRL Press, Oxford, 1985))。このベクターのEcoRIクローニングサイトは、λgt11ベクターを作る際にファージλDNAに挿入されている大腸菌(E. coli)
lacZ遺伝子内に位置している。このlacZ遺伝子は酵素β−ガラクトシダーゼをコードする。EcoRIサイトでのクローニングによりこの遺伝子に挿入されたDNA断片は、lacプロモーターの制御下で不活性な組換えβ−ガラクトシダーゼ酵素を作る融合遺伝子をもたらす。組換えファージは、ラクトース類似体の5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトシド(X−gal)を含有するインディケータープレート上で青色のプラークを形成できないので、これらのファージを認識し、選択することができる。λgt11ファージはlac+であるために、無色のX−galを代謝物質に切断することができ、該代謝物質は自己構築して青色インドール化合物となる。EcoRIで消化され、脱リン酸化されたλgt11DNAをInvitrogenから得た。
連結されたDNAを次に Promega社(ウィスコンシン州、マジソン)から市販され入手した「パッケジーン(PACKAGENE )」ファージλパッケージングシステムでパッケージし、組換えファージの力価を供給会社の指示書にしたがって測定した。
組換え抗原は Promega社からの「プロトブロット(PROTOBLOT )」免疫スクリーニングシステムに関する技術マニュアルに記載された非放射活性免疫ブロット技術を用いて単離した。Y1090宿主細胞を、λgt11ライブラリーからの3×104個のプラーク形成単位(PFU)の組換えファージに感染させ、次にこれを寒天プレートに塗布した。プレートに、10mMのIPTGで前もって飽和しておいた乾いたニトロセルロースフィルターを重ねて37℃でインキュベートした。インキュベーション中、溶菌的に感染した細胞から放出されるファージとタンパク質はフィルターに付着した。フィルターをプレートから除去し、ブロックして他のタンパク質がプレートへ付着するのを防止した。次に、リューマチ性関節炎を有すると臨床的に決定された患者の血清(TBST緩衝液:10mMトリス塩酸、pH8.0、1mM EDTA、0.05%「トゥイーン(TWEEN )−20」、により1:20に希釈)
をフィルターとともにインキュベートした。次に、フィルターをTBSTで洗浄し、非特異的に結合した抗体を除去した。次に、フィルターを抗IgM抗体−アルカリホスファターゼ複合体(Kirkegaard & Perry Laboratories, Inc.、ガイセルブルク、メリーランド州; TBSTにより1:100に希釈)とともにインキュベートした。次に、フィルターを再び洗浄し、顕色基質であるニトロブルーテトラゾリウム(NBT)および5−ブロモ−4−クロロ−3−インドリルホスフェート(BCIP)を加えた。陽性プラークはアルカリホスファターゼの活性の結果として暗い紫色を生じた。陽性プラークを再試験し、試験プレート上のすべてのプラークが陽性シグナルを生じるまでリプレートを行うことにより精製した。
精製された賜性の組換えλgt11ファージの溶原菌(lysogen )を Promega社の技術解説書No.006にしたがって作った。T. Maniatisらにより記載のアルカリ溶解ミニプレップ・プロトコール(Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratories, Cold Spring Harbor, New York, 1982))を用いて、組換えファージDNAをλgt11溶原菌から単離した。このDNAをEcoRIで消化し、得られたDNA断片を0.7%低融点アガロースゲルによる電気泳動で分画した。臭化エチジウム染色および紫外線照射により、特異な2600bpのバンドが明らかとなった。このバンドをゲルからスライス状に切り出し、そのアガロースを70℃でメルトした。次に、DNAをフェノール抽出し、そしてアルコールで沈殿させた。
次に、標準的な方法(例えばJ. Sambrook ら, Molecular Cloning: A Laboratory Manual(第2版,1989); T. Maniatisら, Molecular Cloning: A Laboratory Manual(1982); F. Ausubel ら, Current Protocols in Molecular Biology(1987))を用いて、Invitrogenから得られたプラスミド発現ベクター「pTrcHis C」
のEcoRIサイトで前記の2600bpのEcoRI断片を再クローン化した。このベクターはλgt11と同じリーディングフレームを有し、かつ大腸菌(E. coli )で高いレベルのタンパク質発現を得るためのすべてのDNA配列を有し、さらに6個の連続したヒスチジン残基をコードする配列を有しており、発現されたタンパク質は該ヒスチジン残基によりNi荷電の「プロバンド(PROBOND)」樹脂(Invitrogen)に結合するので、この組換えタンパク質は1ステップ精製で容易に精製することができる。前記の2600bp断片を有するpTrcHis Cプラスミドで大腸菌(E. coli )株Top10(Invitrogenより入手)をトランスフォームした。
組換えタンパク質の発現はウエスタンブロッティング分析により示された。トランスフォーム体はLuriaブロス(LB)で37℃にてOD600が0.5になるまで増殖させた。次に、lacオペロンの誘導物質であるイソプロピルチオ−β−D−ガラクトシド(IPTG)を1mMの最終濃度まで加えて組換えタンパク質の発現を誘導した。誘導後、トランスフォーム体をさらに3時間30℃で成長させた。次に、約200μlの培養物を遠心チューブに入れ、軽く遠心して細胞をペレット状にした。培養液(ブロス)は除去して捨て、ペレットをSDS含有緩衝液に再懸濁した(上記のT.Maniatisら)。この試料を2時間沸騰湯浴中で加熱し、10%SDSポリアクリルアミドゲルにかけ、70ボルトで一晩電気泳動した(上記のT.Maniatisら)。「ポリブロット(POLYBLOT)」エレクトロトランスファーシステム(Americal Bionetics社、ヘイワード、カリフォルニア州)を用い、同社の指示マニュアルにしたがって、タンパク質を電気泳動によりニトロセルロースメンブレンに移した。
移した後、メンブレンを取出し、次にブロックしてタンパク質の非特異的な結合を防いだ。リューマチ性関節炎の患者の血清(1:21に希釈)をメンブレンに加えて1時間インキュベートした。次にこのメンブレンをTBSTで洗浄した。
次に、プラークスクリーニング法と同じように、このメンブレンを抗IgM抗体−アルカリホスファターゼ複合体(Kirkegard & Perry)とともにインキュベートした。次に、このメンブレンをTBSTで洗浄し、NBTとBCIPを加えることで顕色させた。
これらの試験で、リファレンス血清と反応する約48kDのタンパク質に対応する単一バンドが明らかとなった。約4kDのタンパク質配列はプラスミドベクターに由来するもので、発現ベクターにより作られた残りの44kDのタンパク質がリューマチ性関節炎患者の血清と反応する抗原に由来するものであることを示唆している。
組換え抗原遺伝子の配列決定 クローニングしたcDNAをF.Sangerらの方法(DNA Sequencing with Chain-Terminating Inhibitors, 74Proc. Nat'l Acad. Sci. USA 5463(1977))による塩基配列の分析に供した。993bpセグメントのDNAからなるオープンリーディングフレームが明らにされた。このオープンリーディングフレーム(配列番号2)は、本発明の組換えRAMA抗原を構成する331アミノ酸のタンパク質(配列番号3)をコードする。
組換え抗原の細菌からの精製 細菌プラスミド発現ベクターにより発現される組換えRAMAタンパク質は、Invitrogenの「プロボンド(PROBOND )」カラムを用い、該カラムとともに提供される同社の指示書にしたがって精製した。発現プラスミドを含有するBL21細胞(F’ompT hsdSB[rB-mB-dcm])(プロテアーゼ-株、Novagen 、マジソン、ウィスコンシン州)の一晩培養した培養物10mlを、グルコースと50μg/mlのアンピシリンとを含有する約1リットルのLBに接種した。この細胞を2.5時間成長させ、この間にIPTGを1mMの最終濃度まで加えて、組換えRAMAタンパク質の発現を誘導した。誘導後、細胞をさらに3時間37℃でインキュベートした。次に、細胞を遠心により集め、再懸濁し、リゾチームおよび超音波により溶解した。次に細胞を10,000rpmで遠心した。組換えRAMAタンパク質は可溶性であり、上清中にとどまった。
組換えRAMAタンパク質の発現をウエスタンブロッティング分析により確認した。組換えRAMAタンパク質試料をポリアクリルアミドゲル電気泳動にかけ、ニトロセルロースメンブレンへ電気泳動により移した後、タンパク質の非特異的な結合をブロックした。リューマチ性関節炎患者の血清をメンブレンに結合しているタンパク質に1:21の希釈度で加え、1時間インキュベートした。次に、このメンブレンを洗浄し、抗ヒトIgM−アルカリホスファターゼ複合体とともにインキュベートした。顕色基質溶液を加える前にメンブレンを再び洗浄した。約41,000のMrを有する単一のタンパク質バンドがリューマチ性関節炎患者の血清と反応した。これは、その配列に基づくRAMAタンパク質(約34kd)の予想されたサイズとかなり良好な一致を示している。
真核細胞における組換えRAMAの発現 RAMA遺伝子を含有する2600bpのDNA断片を、標準的な方法によりpBlueBacHis C バキュロウイルスベクター(Invitrogen)で再びクローニングした。RAMA遺伝子を有するこのpBlueBacHis C ベクターを「バキュロゴールド(BACULOGOLD)」(Pharmingen、サンディエゴ、カリフォルニア州)バキュロウイルスDNAとともに Spodoptera frugiperda Sf9細胞にコートランスフェクトした。これらのDNA間の相同組換えの結果、ウイルスのポリヘドリンエンハンサー/プロモーターエレメントの制御下で発現されるRAMA遺伝子を有する組換えウイルスが得られた。この組換えウイルスをSf9昆虫細胞で作らせ、Invitrogenのマニュアルに記載されているようにして精製した。次に、Invitrogenのマニュアルにしたがって組換えウイルスのプラーク精製のために、このウイルス保存物を用いて10倍希釈物を調製した。
pBlueBacHis C でのRAMA遺伝子の発現はウエスタンブロッティング分析により確認した。約1mlのSf9昆虫細胞に組換えプラスミドを有するウイルスを感染させ、その3日後にこの細胞をペレット化し、100μlのLaemmli緩衝液に溶解した(U. Laemmli, 227 Nature 680-85(1970))。この試料を2時間沸騰し、次に上記のように7.5%SDS−ポリアクリルアミドゲルに負荷し、70ボルトで一晩電気泳動した。
上記のように、タンパク質を電気泳動によりニトロセルロースメンブレンに移し、タンパク質の非特異的な結合をブロックした。リューマチ性関節炎患者の血清を1:21の希釈度でメンブレン結合タンパク質に加え、1時間インキュベートした。次に、このメンブレンをTBSTで洗浄し、抗ヒトIgM−アルカリホスファターゼ複合体とともに30分間インキュベートした。顕色基質溶液を加える前にこのメンブレンを再びTBSTで洗浄した。約100,000のMrを有する単一のタンパク質バンドがリューマチ性関節炎患者からの血清と反応した。細菌で発現されたRAMAタンパク質と真核細胞で発現されたRAMAタンパク質のMrの違いは、真核細胞中の発現タンパク質のグリコシル化および恐らくはそれ以外の修飾によるものと思われる。この真核細胞システムでの発現により作られた組換えRAMAタンパク質を上記のようにNi荷電「プロボンド(PROBOND)」カラムで精製した。約1.5mgのタンパク質を50mlの培養物から精製した。
組換えRAMAタンパク質のELISA試験 大腸菌(E. coli )系での発現により作られ、「プロボンド(PROBOND )」カラムで精製された約100μlの組換えRAMAタンパク質溶液(PBS緩衝液(pH7.4)中の1μg/mlの精製組換えタンパク質)をポリスチレン製マイクロタイタープレート(高結合(High binding)96ウェルコーニング(Corning)プレート)のウェルに入れ、4℃で一晩インキュベートした。このプレートを洗浄し、次に4℃で一晩ブロックして非特異的な結合を防いだ。1:21で希釈された100μlの血清をウェルに入れ、1時間インキュベートし、次にウェルを洗浄した。アルカリホフファターゼ複合化抗ヒトIgM(Kirkegaard & Perry)の100μlをウェルに入れ、1時間インキュベートし、次にウエルを再び洗浄した。次に、5mgのp−ニトロフェノールホスフェートと1mlの5Xジエタノールアミン緩衝液(Kirkegaard & Perryより供給されたもの)とを4mlの蒸留水に加えて調製した100μlのアルカリホスファターゼ基質をウェルに加えて37℃で15分間インキュベートした。次に、その光学濃度を405nmにて測定した。
リューマチ性関節炎の臨床的症状を有する患者60名(Rfに関して35名は血清陽性であり、25名は血清陰性である)、SLEに関する抗DNA疾患マーカーに対して血清陽性である20名、および健康人20名からの血清を既に概略した方法により調べた。これらの試験の結果を図1と下記の表に要約する。

すべての健康被験者の血清は0.250以下のELISA値を示した。よって、0.250の読みは陽性反応を決定するためのカットオフ値とみなされた。血清陽性のリューマチ性関節炎患者の35血清のうち34血清(すなわち97%)
が0.250以上のELISA値を示したために、これらは陽性反応を示しているとみなされた。血清陰性のリューマチ性関節炎患者からの25血清のうち、11(すなわち44%)が0.250以上のELISA値を示したために、これらは陽性反応を示しているとみなされた。対照の抗DNA+20血清のうち3血清も陽性反応を示した。したがって、これらの結果はほとんどすべての血清陽性のリューマチ性関節炎患者がこのELISA試験の助けによる診断で、RAMA組換え抗原に対する、血清中の抗体の存在を検出することができたことを示している。さらに、血清陰性のリューマチ性関節炎患者のほぼ半数も同様に診断することができた。これらの結果は、標準的なRf試験を用いた場合が約70%にすぎないのに比較して約85%のリューマチ性関節炎のケースが本発明を用いて診断することができることを示唆している。
RAMAがRfではないことを示すために、さらに別の試験を行った。組換えRAMAタンパク質を用いる標準的なRf凝集試験を行うために独立した対照実験室と契約した。IgGの凝集は形成されなかった。これは、Rfを陽性の対照として同じように検定した場合には凝集が形成したために陰性の結果である。さらに、組換えRAMA抗原をマイクロタイタープレートのウェルに付着させ、結台したRAMA抗原を次に酵素複合体化IgG抗体にさらした。酵素活性の比色定量アッセイを上記のように行った。酵素活性は検出されず、IgG抗体がRAMAタンパク質と結合しないことを示している。最後に、Rfとの反応に関してELISAにより試験された場合に陽性の結果を示した7名の臨床的に正常な被験者(すなわちすべての7名の被験者がRfに関して血清陽性である)を一次抗原としてRAMAを用いるELISAを用いて調べた。7名全員がRAMAとの反応で血清陰性であった。これらの結果は本発明の主題である組換えRAMAタンパク質がRfではないことを示している。
RAMA活性を有するペプチド 本発明の範囲はRAMAペプチドの活性を有するものであればいかなるペプチドも包含するものである。そのようなペプチドは配列番号3としての組換えRAMAおよびそれと実質的に相同的なペプチドを包含し得る。天然のRAMAに実質的に相同的なペプチドの具体例は、6個のヒスチジン残基が付加されて、金属含有樹脂を用いるアフィニティークロマトグラフィーによる精製が容易となった上記の組換えRAMAである。6個のヒスチジン残基の付加にもかかわらず、組換えRAMAはリューマチ性関節炎関連IgM抗体に対して反応性があった。RAMAに実質的に相同的なペプチドは既に詳しく説明したように宿主細胞による発現によるか、または化学合成によって合成することができる。
リューマチ性関節炎関連抗体を検出するための短いペプチドは以下のように同定し、調製することができる。エンドプロテイナーゼ−lys C(Boehringer Mannheim)を同社の指示にしたがって用いることでRAMAタンパク質をペプチド断片に消化した。これらの断片をHPLCで分画して、その配列をN. Legendre およびP.T. Matsudairaの方法にしたがって決定した(Gel Electrophoresis, A Practical Guide to Protein and Peptide Purification for Microsequencing 52-66(P.T. Matsudaira編, 1989 ))。さらに別の断片をRAMAのプロテイナーゼ消化とポリアクリルアミドゲルによる分離により調製する(J. Sambrookら, Molecular Cloning: A Laboratory Manual(第2版, 1989))。これらの断片をウエスタンブロッティングに供して(H. Towbinら,Electrophoretic Transfer of Proteins from Polyacrylamide Gels to Nitrocellulose Sheets: Procedure and Some Applications, 76 Proc. Nat'l Acad. Sci. USA 4350(1979))、リューマチ性関節炎関連抗体が結合した断片を同定した。抗体と反応するペプチドの配列決定を行う。リューマチ性関節炎関連抗体により認識されるエピトープを有するRAMAの単一または複数の断片の同定後、プロティナーゼによる消化、ウエスタンブロッティングおよび配列決定のプロセスを、さらに小さいペプチド作る異なるプロテイナーゼを用いて繰り返した。この方法により抗体により認識される配列の同定ができる。これらのデータから、類似の配列を有するオリゴペプチドを化学合成(ここで文献の援用として挙げる B.Merrifield, 85 J. Am. Chem. Soc. 2149-2156(1963); B. Merrifieldら,21 Biochemistry 5020-31(1982); Houghten, 82 Proc. Nat'l Acad. Sci. USA 5131-35(1985))によるか、またはバイオテクノロジーによる方法(J. Sambrookら,Molecular Cloning: A Laboratory Manual(第2版,1989))により合成され、リューマチ性関節炎関連抗体に対する反応性について調べた。酵素のいくつかのペプチド擬似(peptidomimetic)阻害剤がこれらの技術を用いて記載されている(A. Smithら,Design and Synthesis of Peptidomimetic Inhibitors of HIV-1 Protease and Renin: Evidence for Improved Transport, 37 J. Med. Chem.215(1994); S. Francisら,Molecular Characterization and Inhibition of a Plasmodium falciparum Aspartic Hemoglobinase,13 EMBO J. 306(1994); A. Garciaら,Peptidomimetic Inhibitors of Ras Farnesylation and Function in Whole Cells,268 J. Biol. Chem. 18415(1993))。
微生物材料の寄託 ここに記載され、リューマチ性関節炎を診断するために用いられる組換えRAMA抗原をコードする遺伝子を有するプラスミドを含有する大腸菌(E. coli )
株寄託物は1994年4月13日に国際寄託機関であるアメリカンタイプカルチャーコレクション(ATCC)、12301パークローンドライブ、ロックビル、メリーランド州 20852 米国に寄託されている。寄託された株の寄託番号はATCC 69605である。





【特許請求の範囲】
1.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなる抗原であって、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原。
2.前記ペプチドが宿主細胞での組換え遺伝子の発現により作られる請求項1に記載の抗原。
3.前記宿主細胞が原核細胞である請求項2に記載の抗原。
4.前記宿主細胞が大腸菌(E.coli)である請求項3に記載の抗原。
5.前記ペプチドが配列番号3として同定されたアミノ酸配列を有する請求項4に記載の抗原。
6.前記宿主細胞が真核細胞である請求項2に記載の抗原。
7.前記ポリペプチドが化学合成により作られる請求項1に記載の抗原。
8.前記リューマチ性関節炎関連抗体がIgM抗体である請求項1に記載の抗原。
9.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなり、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用組換え抗原の作製方法であって、 (a)ヒト細胞から精製されたポリアデニル化RNAからのcDNAライブラリーを作製する工程と、ここで前記ライブラリーは、組換えベクターが作られるように、ポリアデニル化RNAから得られるcDNAをクローニングベクターでのランダムクローニングにより調製されるものであり;
(b)リューマチ性関節炎を有する患者からの血清中の抗体により検出された組換え抗原を発現する組換えベクターを選択する工程と;
(c)工程(b)で選択された組換えベクターで宿主をトランスフォームし、このトランスフォームされた宿主を適当な栄養培地で培養して前記組換え抗原を発現する工程と;およびその後に、 (d)組換え抗原を単離する工程とを備える方法。
10.工程(c)がさらに最適細胞密度まで宿主を増殖させ、次いで組換え抗原の発現を誘導することを備える請求項9に記載の方法。
11.工程(d)がさらに組換え抗原をアフィニティークロマトグラフィーにより精製することをそなえる請求項9に記載の方法。
12.天然RAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドを宿主細胞で発現することを確実とするために使用されるDNAであって、前記DNAは、 (a)配列番号2;
(b)配列番号2とハイブリダイズするDNAまたはその断片;および (c)遺伝子コードの縮退以外は(a)および(b)に定義されるDNAとハイブリダイズするDNA からなる群から選択される精製され単離されたDNA。
13.さらに宿主をトランスフォームするのに適合させたベクターを含む請求項12に記載の精製され単離されたDNA。
14.ベクターがプラスミド、コスミド、ファージミド、ファージおよびウイルスからなる群から選択される請求項13に記載の精製され単離されたDNA。
15.ベクターがプラスミドである請求項14に記載の精製され単離されたDNA。
16.宿主細胞が大腸菌(E.coli )である請求項15に記載の精製され単離されたDNA。
17.前記DNAが配列番号2である請求項16に記載の精製され単離されたDNA。
18.宿主が真核細胞である請求項14に記載の精製され単離されたDNA。
19.天然RAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドをトランスフォームされた宿主で発現することを確実とするために使用され、 (a)配列番号2;
(b)配列番号2とハイブリダイズするDNAまたはその断片;および (c)遺伝子コードの縮退以外は(a)および(b)に定義されるDNAとハイブリダイズするDNA からなる群から選択されるDNAセグメントを含むトランスフォームされた宿主。
20.前記DNAセグメントが組換えベクターに含まれている請求項19に記載のトランスフォームされた宿主。
21.組換えベクターがプラスミド、コスミド、ファージミド、ファージおよびウイルスからなる群から選択される請求項20に記載のトランスフォームされた宿主。
22.組換えベクターがプラスミドである請求項21に記載のトランスフォームされた宿主。
23.宿主細胞が大腸菌(E.coli )である請求項22に記載のトランスフォームされた宿主。
24.前記DNAが配列番号2である請求項23に記載の精製され単離されたDNA。
25.宿主が真核細胞である請求項20に記載の精製され単離されたDNA。
26.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなり、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原をコードする組換えDNAの作製方法であって、 (a)ヒト細胞からポリアデニル化RNAを単離する工程と;
(b)鋳型として単離されたポリアデニル化RNAを用いて2本鎖cDNAを作る工程と;
(c)この2本鎖cDNAをクローニングベクターに挿入して組換え発現ベクターを作製する工程と、ここで前記組換えベクターは抗原の発現のために正しい相で前記抗原をコードするDNAを有するものであり;
(d)この組換え発現ベクターで宿主をトランスフォームして前記抗原を発現させる工程と;および (e)リューマチ性関節炎患者の血清からの抗体を用いて、前記抗体が前記発現抗原に結合することを検出することによりトランスフォームされた宿主を選択する工程と を備える方法。
27.工程(e)において、結合した抗体を有するトランスフォームされた宿主が抗ヒトIgM抗体−アルカリホフファターゼ複合体と、その後に添加する1種類以上のアルカリホスファターゼ顕色基質とによって検出される請求項26に記載の方法。
28.顕色基質がニトロブルーテトラゾリウムおよび5−ブロモ−4−クロロ−3−インドリルホスフェートである請求項27に記載の方法。
1.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなる抗原であって、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原。
2.前記ペプチドが宿主細胞での組換え遺伝子の発現により作られる請求項1に記載の抗原。
3.前記宿主細胞が原核細胞である請求項2に記載の抗原。
4.前記宿主細胞が大腸菌(E.coli)である請求項3に記載の抗原。
5.前記ペプチドが配列番号3として同定されたアミノ酸配列を有する請求項4に記載の抗原。
6.前記宿主細胞が真核細胞である請求項2に記載の抗原。
7.前記ポリペプチドが化学合成により作られる請求項1に記載の抗原。
8.前記リューマチ性関節炎関連抗体がIgM抗体である請求項1に記載の抗原。
9.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなり、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用組換え抗原の作製方法であって、 (a)ヒト細胞から精製されたポリアデニル化RNAからのcDNAライブラリーを作製する工程と、ここで前記ライブラリーは、組換えベクターが作られるように、ポリアデニル化RNAから得られるcDNAをクローニングベクターでのランダムクローニングにより調製されるものであり;
(b)リューマチ性関節炎を有する患者からの血清中の抗体により検出された組換え抗原を発現する組換えベクターを選択する工程と;
(c)工程(b)で選択された組換えベクターで宿主をトランスフォームし、このトランスフォームされた宿主を適当な栄養培地で培養して前記組換え抗原を発現する工程と;およびその後に、 (d)組換え抗原を単離する工程とを備える方法。
10.工程(c)がさらに最適細胞密度まで宿主を増殖させ、次いで組換え抗原の発現を誘導することを備える請求項9に記載の方法。
11.工程(d)がさらに組換え抗原をアフィニティークロマトグラフィーにより精製することをそなえる請求項9に記載の方法。
12.天然RAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドを宿主細胞で発現することを確実とするために使用されるDNAであって、前記DNAは、 (a)配列番号2;
(b)配列番号2とハイブリダイズするDNAまたはその断片;および (c)遺伝子コードの縮退以外は(a)および(b)に定義されるDNAとハイブリダイズするDNA からなる群から選択される精製され単離されたDNA。
13.さらに宿主をトランスフォームするのに適合させたベクターを含む請求項12に記載の精製され単離されたDNA。
14.ベクターがプラスミド、コスミド、ファージミド、ファージおよびウイルスからなる群から選択される請求項13に記載の精製され単離されたDNA。
15.ベクターがプラスミドである請求項14に記載の精製され単離されたDNA。
16.宿主細胞が大腸菌(E.coli )である請求項15に記載の精製され単離されたDNA。
17.前記DNAが配列番号2である請求項16に記載の精製され単離されたDNA。
18.宿主が真核細胞である請求項14に記載の精製され単離されたDNA。
19.天然RAMAタンパク質の一次構造コンフォメーションの少なくとも一部と抗原活性とを有するペプチドをトランスフォームされた宿主で発現することを確実とするために使用され、 (a)配列番号2;
(b)配列番号2とハイブリダイズするDNAまたはその断片;および (c)遺伝子コードの縮退以外は(a)および(b)に定義されるDNAとハイブリダイズするDNA からなる群から選択されるDNAセグメントを含むトランスフォームされた宿主。
20.前記DNAセグメントが組換えベクターに含まれている請求項19に記載のトランスフォームされた宿主。
21.組換えベクターがプラスミド、コスミド、ファージミド、ファージおよびウイルスからなる群から選択される請求項20に記載のトランスフォームされた宿主。
22.組換えベクターがプラスミドである請求項21に記載のトランスフォームされた宿主。
23.宿主細胞が大腸菌(E.coli )である請求項22に記載のトランスフォームされた宿主。
24.前記DNAが配列番号2である請求項23に記載の精製され単離されたDNA。
25.宿主が真核細胞である請求項20に記載の精製され単離されたDNA。
26.配列番号3およびそれに実質的に相同的な配列からなる群から選択されるアミノ酸配列を有するペプチドからなり、リューマチ性関節炎関連抗体に対して反応性を有するリューマチ性関節炎の診断用抗原をコードする組換えDNAの作製方法であって、 (a)ヒト細胞からポリアデニル化RNAを単離する工程と;
(b)鋳型として単離されたポリアデニル化RNAを用いて2本鎖cDNAを作る工程と;
(c)この2本鎖cDNAをクローニングベクターに挿入して組換え発現ベクターを作製する工程と、ここで前記組換えベクターは抗原の発現のために正しい相で前記抗原をコードするDNAを有するものであり;
(d)この組換え発現ベクターで宿主をトランスフォームして前記抗原を発現させる工程と;および (e)リューマチ性関節炎患者の血清からの抗体を用いて、前記抗体が前記発現抗原に結合することを検出することによりトランスフォームされた宿主を選択する工程と を備える方法。
27.工程(e)において、結合した抗体を有するトランスフォームされた宿主が抗ヒトIgM抗体−アルカリホフファターゼ複合体と、その後に添加する1種類以上のアルカリホスファターゼ顕色基質とによって検出される請求項26に記載の方法。
28.顕色基質がニトロブルーテトラゾリウムおよび5−ブロモ−4−クロロ−3−インドリルホスフェートである請求項27に記載の方法。
【図1】




【公表番号】特表平10−513257
【公表日】平成10年(1998)12月15日
【国際特許分類】
【出願番号】特願平8−520501
【出願日】平成7年(1995)12月15日
【国際出願番号】PCT/US95/16558
【国際公開番号】WO96/20213
【国際公開日】平成8年(1996)7月4日
【出願人】
【氏名又は名称】リサーチ コーポレイション テクノロジーズ インコーポレイテッド
【公表日】平成10年(1998)12月15日
【国際特許分類】
【出願日】平成7年(1995)12月15日
【国際出願番号】PCT/US95/16558
【国際公開番号】WO96/20213
【国際公開日】平成8年(1996)7月4日
【出願人】
【氏名又は名称】リサーチ コーポレイション テクノロジーズ インコーポレイテッド
[ Back to top ]

