リンパ増殖症候群の緩和および阻害のためのO−メチル化ラパマイシン誘導体
【課題】哺乳動物におけるリンパ増殖症候群の緩和および阻害方法の提供。
【解決手段】化学構造[式中、Xは(H,H)もしくはOであり;Yは(H,OH)もしくはOであり;R1は、アルキル、チオアルキル等より選択され;R2は、−H、アルキル等より選択され;ならびにR4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]を有するラパマイシン誘導体を有効成分として含んで成る、ヒト患者におけるリンパ増殖症候群を緩和するための医薬組成物であって、ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される医薬組成物。
【解決手段】化学構造[式中、Xは(H,H)もしくはOであり;Yは(H,OH)もしくはOであり;R1は、アルキル、チオアルキル等より選択され;R2は、−H、アルキル等より選択され;ならびにR4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]を有するラパマイシン誘導体を有効成分として含んで成る、ヒト患者におけるリンパ増殖症候群を緩和するための医薬組成物であって、ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト患者におけるリンパ増殖症候群(lymphoproliferative disorder)の緩和方法に関する。
【背景技術】
【0002】
(発明の背景)
エプスタイン−バーウイルス(EBV)に感染したBリンパ球の拡張を通常必要とする移植後リンパ増殖症候群(PTLD)は、移植片拒絶を阻害するため必要な免疫抑制療法の生命を脅かす合併症である(非特許文献1;非特許文献2)。PTLDは、ポリクローン性異型リンパ組織過形成からモノクローナル性の明白に悪性のB細胞リンパ腫までの範囲にわたる、リンパ増殖症候群の全スペクトルを含んで成る(非特許文献1;非特許文献2;非特許文献3;非特許文献4)。より少なく進行した形態のPTLDはより少なく攻撃的な経過の免疫抑制療法に応答する(非特許文献1;非特許文献5)。しかしながら、外来組織を拒絶しかつ破壊する身体の能力を無にする標準的免疫抑制薬の用量を低下させることは、移植片の生存を危険にさらす可能性がある。さらに、慣習的薬剤を用いる治療におけるこの改変は、移植片レシピエントに対し通常致死的である悪性のリンパ腫型のPTLDに対し有効でない。
【0003】
リンパ腫は有意の罹患率および死亡率の原因となり、米国単独で毎年50,000以上の新たな診断の原因である。多くのリンパ腫がホジキンもしくは非ホジキンのいずれかのリンパ腫であり、これらは末梢の成熟B、TもしくはNKリンパ腫から生じることができる。それらの自然の経過に基づき、非ホジキンリンパ腫は低、中間および高悪性度(grade)に分類される。低悪性度リンパ腫は通常ゆっくりと進行性であるが、しかし本質的に治療可能でない。中間および高悪性度リンパ腫の現在の5年の疾患のない治療後生存率はおよそ60%である。これらの攻撃的な型のリンパ腫は、治療に応答しない患者の迅速な死亡をもたらす。AIDSのような免疫無防備状態である患者および移植後患者で発生するリンパ腫の予後はとりわけ不良である。従って、リンパ腫の治癒率を向上させるための新たな治療様式が必要とされる。
【0004】
SDZ RAD(40−O−{2−ヒドロキシエチル}ラパマイシン)は、免疫抑制活性を表すラパマイシン誘導体の一分類の1つである(特許文献1;非特許文献6;非特許文献7;非特許文献8;非特許文献9;非特許文献10)。ラパマイシンを包含するこの分類の化合物は、正常なTリンパ球中にいくつかの作用点を有する。それらは、主として、IL−2レセプター(非特許文献11)および他のサイトカインレセプター(非特許文献12)により媒介される下流のシグナル伝達事象を阻害するが、しかしまた早期のG1期の細胞周期の進行にも影響を及ぼす(非特許文献13;非特許文献14)。SDZ RADおよび他のO−アルキル化ラパマイシン誘導体化合物により表される多くの側面をもつ免疫抑制活性は、これらの化合物を多目的に使える免疫抑制剤にする。
【0005】
リンパ腫およびPTLDのようなリンパ増殖症候群の重症度および頻度を制限するためのより有効な治療および予防方法に対する有意の必要性が存在する。本発明はこの必要性を満足する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】PCT出願第WO 94/09010号明細書
【非特許文献】
【0007】
【非特許文献1】Morrisonら、1994、Am.J.Med.97:14−24
【非特許文献2】Warnkeら、1995、AFIP Fascicle 14:531−535
【非特許文献3】Curtisら、1999、Blood 94:2208−2216
【非特許文献4】Harrisら、1997、Semin.Diagn.Path.14:8−14
【非特許文献5】Sigalら、1992、Ann.Rev.Immunol.10:519−60
【非特許文献6】Schuurmanら、1997、Transplantation 64:32−5
【非特許文献7】Schulerら、1997、Transplantation 64:36−42
【非特許文献8】Sedraniら、1998、Transplant.Proc.30:2192−2194
【非特許文献9】Schuurmanら、1998、Transplant Proc.30:2198−2199
【非特許文献10】Hausenら、1999、J.Heart Lung Transplant 18:150−159
【非特許文献11】Seghal、1998、Clin.Biochem.31:335−340
【非特許文献12】Sakataら、1999、Immunology Letters 68:301−309
【非特許文献13】Teradaら、1993、J.Cell Physiol.154:7−15
【非特許文献14】Flanaganら、1993、Ann.N.Y.Acad.Sci.696:31−37
【発明の概要】
【0008】
(発明の要約)
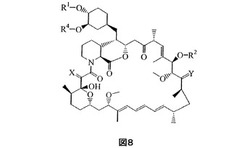
本発明の方法は、図8の式Iに示される化学構造を有するラパマイシン誘導体を、該症候群を緩和するのに十分な量で該患者に投与することを含んで成る。好ましい一態様において、ラパマイシン誘導体は40−O−(2−ヒドロキシ)エチルラパマイシンである。多数の他の有用なラパマイシン誘導体(ラパマイシンそれ自身を包含する)を本開示に記述する。本方法を使用して緩和することができるリンパ増殖症候群は、例えば、PTLD、およびリンパ腫のようなリンパ腺癌を包含する。該方法はまた、免疫抑制療法(例えば組織移植に伴う免疫抑制療法)により引き起こされるもしくはそれによる患者の治療に伴うリンパ増殖症候群を緩和するのにも使用することができる。
【0009】
本発明に包含される別の方法において、リンパ増殖症候群が、こうした障害を発症する危険にさらされる患者(例えば免疫無防備状態の患者もしくは免疫抑制療法を受けている患者)で阻害もしくは予防される。
【0010】
これらの方法において、ラパマイシン誘導体は、免疫抑制剤のような第二の薬理学的有効成分と(単一の組成物中で、もしくは別個に投与される組成物中で)共投与することができる。免疫抑制剤は、移植片拒絶の阻害方法での使用について既知であり、そして、それらの既知の方法を、移植片を受領した患者に免疫抑制剤および本明細書で開示されるラ
パマイシン誘導体の双方を投与することにより改良することができる。
【0011】
本発明はまた、リンパ腺癌に苦しめられるヒト患者におけるリンパ腺腫瘍の転移の阻害方法も包含する。本方法は、式Iに示される化学構造を有するラパマイシン誘導体を、リンパ球増殖を阻害するのに十分な量で患者に投与することを含んで成る。
【0012】
別の局面において、本発明は、ある薬剤がヒト患者におけるリンパ増殖症候群を緩和もしくは阻害するために有用であるかどうかの評価方法を包含する。本方法は、Bリンパ球をエプスタイン−バーウイルスで形質転換すること、該リンパ球を重症の複合免疫不全を有するマウスに注入すること、該マウスに薬剤を投与すること、およびマウスにおける腫瘍の成長を最低約21日間監視することを含んで成る。腫瘍の退縮、腫瘍の根絶、および第二の腫瘍の非存在の1種もしくはそれ以上がマウス中で観察される場合には、これは、該薬剤が哺乳動物における移植後リンパ増殖症候群を緩和もしくは阻害するために有用であることの表示である。
【0013】
(発明の詳細な記述)
本発明は、ヒトのような哺乳動物におけるリンパ腫および移植後リンパ増殖症候群(PTLD)のようなリンパ増殖症候群の緩和もしくは阻害方法に関する。該方法は、哺乳動物におけるリンパ球の増殖を阻害するのに十分な量のSDZ RADのようなO−アルキル化ラパマイシン誘導体を哺乳動物に投与することを含んで成る。
【0014】
O−アルキル化ラパマイシン誘導体は移植片拒絶を阻害することが既知である。従って、ラパマイシン誘導体を、組織もしくは器官移植片(すなわち異種移植片)を受けた哺乳動物に投与する場合、これらの誘導体の1種の投与は移植片拒絶を阻害しかつPTLDを緩和もしくは予防することの双方ができる。PTLDの治療もしくは阻害のために、投与される量は移植片拒絶およびリンパ球の増殖の双方を阻害するのに十分であることができる。
【0015】
本明細書に記述されるもののようなO−アルキル化ラパマイシン誘導体を、リンパ腫を緩和もしくは予防するのに使用することができるという事実は、他者により以前に認識されていない。SDZ RADのようなO−アルキル化ラパマイシン誘導体は、リンパ腫以外の多様なリンパ増殖症候群(例えば慢性リンパ性白血病)で発生するようなリンパ球の増殖を阻害するのにもまた使用することができる。SDZ RADのようなO−アルキル化ラパマイシン誘導体は、インビトロもしくはインビボのいずれかで細胞中で細胞周期の停止もしくはアポトーシスを誘発するため、ならびにリンパ球の成長および増殖を阻害するために使用することができる。
【0016】
本明細書に記述される方法で有用であるO−アルキル化ラパマイシン誘導体は、それらの作成方法がそうであるように他者により記述されている。この点に関して、国際公開番号第WO 94/09010号を有するPCT特許出願が、引用することにより本明細書に組み込まれる。
【0017】
本開示に記述される方法で有用であるO−アルキル化ラパマイシン誘導体は、図8の式I(式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミ
ノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである)
に示される化学的構造を有するものを包含する。
【0018】
R1−R4の記述において、「アルク(alk−)」もしくは「アルキル」はC1−6アルキル部分を指し、該部分は分枝状もしくは直鎖状であり、また、好ましくはC1−3アルキル部分であり、ここで、炭素鎖は場合によってはエーテル(−O−)連結により中断されることができる(例えば、−CH2−CH2−O−CH2−)。R1−R4の記述において、「アル(ar−)」もしくは「アリール」はC5−8アリール部分を指し、該アリール部分は場合によっては炭素原子の代わりに1もしくは2個の窒素原子を有する。R1−R4の記述において、「アリル」は−CH2−CH=CH2を意味する。R1−R4の記述において、「アシル」はC1−6アルカノイル部分(すなわち、アルキル部分のメチレン部分{すなわち−CH2−}部分の代わりにカルボニル{すなわち−CO−}部分を有するアルキル部分)を指す。R1−R4の記述において、「アルキレン」はC1−6アルキレン部分を指し、該部分は分枝状もしくは直鎖状である。
【0019】
本開示に記述される方法での使用に適するO−アルキル化ラパマイシン誘導体の例は、・40−O−ベンジルラパマイシン、
・40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
・40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
・40−O−アリルラパマイシン、
・40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロプ−2’−エン−1’−イル]ラパマイシン、
・(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
・40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
・40−O−(2−ヒドロキシ)エチルラパマイシン、
・40−O−(3−ヒドロキシ)プロピルラパマイシン、
・40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
・40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
・40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
・40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
・40−O−(2−アセトキシ)エチルラパマイシン、
・40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
・40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
・40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
・40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
・39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
・(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
・28−O−メチルラパマイシン、
・40−O−(2−アミノエチル)ラパマイシン、
・40−O−(2−アセトアミノエチル)ラパマイシン、
・40−O−(2−ニコチンアミドエチル)ラパマイシン、
・40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
・40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
・40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
・40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
を包含する。
【0020】
本明細書に記述される方法での使用に好ましい化合物は、XおよびYが双方ともOであり、R2がHであり、R4がメチルであり、そしてR1がヒドロキシアルキル、ヒドロキシアルコキシアルキル、アシルアミノアルキルおよびアミノアルキルから選択される、40−O−置換ラパマイシンである。好ましい化合物の例は、40−O−(2−ヒドロキシ)エチルラパマイシン(すなわちSDZ RAD、その構造は図7に示される)、40−O−(3−ヒドロキシ)プロピルラパマイシン、40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシンおよび40−O−(2−アセトアミノエチル)ラパマイシンを包含する。ラパマイシンそれ自身(すなわち、R1およびR2がそれぞれ−Hであり、R4がメチルであり、そしてXおよびYのそれぞれがOである式Iの構造を有する化合物)もまた本明細書に記述される方法で使用することができる。
【0021】
定義
本明細書で使用されるところの、以下の用語のそれぞれは、本節でそれと関連する意味を有する。
【0022】
冠詞「a」および「an」は、該冠詞の文法上の目的語の1個もしくは1個以上(すなわち最低1個)を指すのに本明細書で使用する。例として、「1個の要素(an element)は、1個の要素もしくは1個以上の要素を意味する。
【0023】
細胞の成長、細胞周期の進行、増殖もしくは腫瘍形成のような細胞中での過程は、細胞への組成物の投与もしくは細胞への治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった細胞中での同一の過程に関して該過程が変えられる場合に、該組成物もしくは該治療方法により「阻害」される。例えば、細胞中での増殖のレベルが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない細胞中での増殖のレベルに比較して減少される場合には、該組成物は細胞中での増殖を阻害する。
【0024】
腫瘍の成長、腫瘍の確立、リンパ増殖性応答もしくは移植片拒絶のような哺乳動物における過程は、哺乳動物への組成物の投与もしくは哺乳動物での治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった哺乳動物における同一の過程に関して該過程の速度もしくは大きさが減少される場合に、該組成物もしくは該治療方法により「阻害」される。例えば、哺乳動物におけるリンパ球の増殖のレベルが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない哺乳動物におけるリンパ球の増殖のレベルに比較して減少される場合には、該組成物は哺乳動物におけるリンパ球の増殖を阻害する。
【0025】
アポトーシスもしくは細胞周期の停止のような細胞中での過程は、細胞への組成物の投与もしくは細胞での治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった細胞中での過程に関して細胞中での該過程のレベルが増大される場合に、該組成物もしくは該治療方法により「誘導」される。例えば、細胞中でのアポトーシスの程度、レベルもしくは見込みが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない細胞中でのアポトーシスの程度、レベルもしくは見込みに
比較して増大される場合には、該組成物は細胞中でのアポトーシスを誘導する。
【0026】
本明細書で使用されるところの「製薬学的に許容できる担体」という用語は、それとO−アルキル化ラパマイシン誘導体を組み合わせることができ、かつ、組み合わせ後に被験体に該ラパマイシン誘導体を投与するのに使用することができる、化学的組成物を意味する。
【0027】
本明細書で使用されるところの「生理学的に許容できる」エステルもしくは塩という用語は、製薬学的組成物のいずれの他の成分とも適合性でありかつ該組成物が投与されるはずである被験体に対し有害でない、エステルもしくは塩の形態のO−アルキル化ラパマイシン誘導体を意味する。
【0028】
本明細書で使用されるところの、製薬学的組成物の「非経口投与」は、被験体の組織の物理的破壊、および組織中の裂け目を通っての該製薬学的組成物の投与を特徴とするいずれの投与経路も包含する。従って、非経口投与は、限定されるものでないが、製薬学的組成物の注入、外科的切開による該組成物の適用、組織を貫通する非外科的創傷による該組成物の適用などによる該組成物の投与を挙げることができる。とりわけ、非経口投与は、限定されるものでないが、皮下、腹腔内、筋肉内、胸骨内の注入、および腎臓透析注入技術を挙げることができる。
【0029】
第一の薬理学的薬剤および第二の薬理学的薬剤は、その間の第一の作用物質に帰される薬理学的効果が少なくともその最大値の半分である期間が、その間の第二の薬剤に帰される薬理学的効果が少なくとのもの最大値の半分である期間と重なり合う時間に、2種の薬剤を十分に緊密に投与する場合に「共投与」される。共投与される薬剤は、該薬剤を含有する単一の組成物中で投与することができるか、もしくはそれらは別個の組成物中で投与することができる。
【0030】
本明細書で使用されるところの「アポトーシスの誘導」という用語は、プログラムされた細胞死の過程を細胞に開始もしくは加速させる過程を意味する。
【0031】
障害は、該障害もしくはその症状の1つの重症度、または該障害もしくはその症状の1つが患者により経験される頻度が低下される場合に、「緩和」される。
【0032】
障害は、該障害もしくはその症状の1つの発生が、治療の非存在下でのその発生に関して遅延もしくは予防される場合に、該治療により「阻害」される。
【0033】
記述
本発明は、哺乳動物におけるリンパ増殖症候群を緩和もしくは治療するためのO−アルキル化ラパマイシン誘導体の使用方法に関する。本明細書に記述される方法を使用して緩和もしくは阻害することができるリンパ増殖症候群は、移植後リンパ増殖症候群(PTLD)、リンパ腫および他の障害を包含する。本方法は、障害を阻害するのに十分な量のO−アルキル化ラパマイシン誘導体を哺乳動物に投与することを含んで成る。リンパ増殖症候群および移植片拒絶の双方に苦しめられる患者において、該症候群および移植片拒絶の双方を緩和もしくは阻害するのに十分な量の誘導体を投与することができる。例えば、移植片(すなわち移植された組織もしくは器官)の拒絶およびPTLDの双方を同時に緩和することができる。
【0034】
PTLDは、ポリクローン性異型リンパ組織過形成からモノクローナル性の明白に悪性のB細胞リンパ腫までの範囲にわたる広範なスペクトルのリンパ増殖症候群を含んで成る。こうした障害の例は当該技術分野で記述されており(例えば、Morrisonら、1
994、Am.J.Med.97:14−24;Warnkeら、1995、AFIP Fascicle 14:531−535;Curtisら、1999、Blood 94:2208−2216;Harrisら、1997、Semin.Diagn.Path.14:8−14)、そして当業者により同定することができる。
【0035】
本明細書に記述される方法が有用であるリンパ増殖症候群の一分類は、エプスタイン−バーウイルス(EBV)によるリンパ球の感染を特徴とする障害である。EBVに感染したリンパ球の増殖は、免疫抑制療法の頻繁な合併症であり、そして、従って、ときに移植片拒絶の予防、癌に関係した化学療法もしくは他の免疫抑制性の医学的介入に関連した免疫抑制の間に起こる。さらに、EBVに感染したリンパ球の増殖は、AIDSもしくは他の免疫障害に苦しめられる患者のような免疫無防備状態の患者で加速される可能性がある。本明細書に記述されるO−アルキル化ラパマイシン誘導体は、これらの他の免疫系に影響を及ぼす障害もしくは治療の1つの治療の前、後もしくは間に使用することができる。例えば、免疫抑制療法を受けるはずである患者に、免疫抑制療法の間のリンパ球の増殖を阻害もしくは予防するために、最初に(すなわち数分、数時間、数日もしくは数週間前に)1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)を投与することができる。1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)は、治療の間のリンパ球の増殖を低下もしくは予防するために、免疫抑制療法の経過の間に共投与(すなわち、単一の組成物中で、または時間が緊密にもしくは交互に投与される別個の組成物中で)することができる。誘導体(1種もしくは複数)は、もしあるとしても治療の前に投与される同一のもの(1種もしくは複数)である必要はない。同様に、1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)はまた(もしくは代わりに)、治療後のリンパ球増殖およびそれに伴う症状を緩和、阻害もしくは予防するために、免疫抑制療法を受けた患者に投与することもできる。
【0036】
本発明の範囲内に包含される特定の一方法は、ヒトの身体中もしくは身体上への組織(すなわち同種移植片もしくは異種移植片)の移植前にヒトにSDZ RADを投与することを含んで成る。こうした投与は、移植の前、間もしくは後、またはこれらのいずれかの組み合わせで起こることができる。例として、SDZ RADは、同種異系の腎移植片を受領する前、間および後にヒト患者に投与することができる。移植片の他の例は、同種異系の心、腎および肝移植片、心臓弁、血管移植片、皮膚移植片、硬膜移植片、心膜移植片、軟骨移植片および埋没物、ならびに異種移植片を包含する。
【0037】
組織移植に関連する可能性がある(しかししばしば関連しない)リンパ増殖症候群の別の型は、リンパ腫およびリンパ性白血病を包含するリンパ腺癌である。リンパ性白血病は急性および慢性リンパ性白血病のような障害を包含する。リンパ腫はリンパ球増殖を特徴とする広範な癌を包含する。リンパ腫の例は、AIDS関連リンパ腫、ホジキンリンパ腫(ときにホジキン病と呼称される)、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、T細胞リンパ腫および皮膚T細胞リンパ腫を包含する。
【0038】
患者が疾患と診断されているか疾患の症状を表しているかに関係なく、とりわけ患者が免疫抑制療法を受けることを期待される場合、もしくは患者が免疫を危うくする障害を発症する特定の危険にさらされている場合は、EBVに感染したリンパ球をもつ患者にとって、リンパ球増殖を阻害することが望ましい可能性がある。こうした患者は、該患者からリンパ球を単離すること、およびそれらのリンパ球中のEBVゲノムの全部もしくは一部の存在もしくは非存在を評価することにより同定することができる。EBVが検出される場合、ラパマイシンもしくはO−アルキル化ラパマイシン誘導体の投与を指示することができる。
【0039】
リンパ増殖症候群を阻害もしくは緩和するための本明細書に記述される方法は、哺乳動物にラパマイシンもしくはO−アルキル化ラパマイシン誘導体を投与することを含んで成る。該化合物が投与される正確な形態は決定的に重要でなく、多数の製薬学的組成物、投薬形態、ならびに製薬学的に許容できる担体および賦形剤が、当該技術分野で既知である。哺乳動物に投与される製剤は、唯一の有効成分としてラパマイシン誘導体を含有することができるか、または、それは1種もしくはそれ以上の他の有効成分(例えば、アザチオプリン、ミコフェノール酸モフェティルのようなミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドのような免疫抑制剤)と混合することができる。
【0040】
本発明は、有効成分として1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)を含んで成る医薬および製薬学的組成物の製造法および使用を包含する。こうした製薬学的組成物は、被験体への投与に適する形態の有効成分単独から成ってよいか、あるいは、製薬学的組成物は、有効成分および1種もしくはそれ以上の製薬学的に許容できる担体、1種もしくはそれ以上の付加的成分、またはこれらのなんらかの組み合わせを含んでよい。これらの製薬学的組成物の1つの被験体への投与は、本開示の別の場所で記述されるとおり、被験体におけるリンパ球の増殖を阻害するために有用である。有効成分は、当該技術分野で公知であるとおり、生理学的に許容できる陽イオンもしくは陰イオンとの組み合わせでのような生理学的に許容できるエステルもしくは塩の形態で、製薬学的組成物中に存在してよい。
【0041】
本明細書に記述される製薬学的組成物の製剤は、既知のもしくは薬理学の技術分野で今後開発されるいずれの方法により製造されてもよい。一般に、こうした準備方法は、有効成分を担体または1種もしくはそれ以上の他の付属成分との連合にすること、およびその後、必要なもしくは望ましい場合は、生成物を所望の単独もしくは複数用量単位に造形もしくは包装することの段階を包含する。
【0042】
本明細書に提供される製薬学的組成物の記述は、原則として、ヒトへの医師の処方による投与に適する製薬学的組成物に向けられるとは言え、こうした組成物が一般に他の哺乳動物への投与に適することが、当業者により理解されるであろう。該組成物を動物への投与に適するようにするための、ヒトへの投与に適する製薬学的組成物の改変は十分に理解されており、また、普通に熟練した家畜薬理学者は、もしあるとしても単に普通の実験だけを用いてこうした改変を設計かつ実施することができる。本発明の製薬学的組成物の投与が企図される被験者は、限定されるものでないがヒトおよび他の霊長類、ならびに畜牛、ブタ、ウマ、ヒツジ、ネコおよびイヌのような商業的に関連性のある哺乳動物を包含する哺乳動物を挙げることができる。
【0043】
本発明の方法で有用である製薬学的組成物は、経口、直腸、膣、非経口、局所、肺、鼻内、口腔内、眼もしくは別の投与経路に適する製剤で製造、包装もしくは販売してよいとは言え、非経口投与が、リンパ増殖症候群を緩和、阻害もしくは予防する目的上のラパマイシン誘導体の最も容易に有効な投与方法であることが企図される。
【0044】
本発明の製薬学的組成物は、バルクで、単一の単位用量として、もしくは複数の単一の単位用量として製造、包装もしくは販売してよい。本明細書で使用されるところの「単位用量」は、予め決められた量の有効成分を含んで成る別個の量の製薬学的組成物である。有効成分の量は、一般に、被験体に投与されるとみられる有効成分の投薬量、または例えばこうした投薬量の1/2もしくは1/3のようなこうした投薬量の便宜的な一部分に等しい。
【0045】
本発明の製薬学的組成物中の有効成分、製薬学的に許容できる担体、およびいかなる付
加的成分の相対量も、治療される被験体の正体、大きさおよび病状に依存して、ならびに該組成物が投与されるはずである経路にさらに依存して、変動することができる。例として、該組成物は0.1%と100%(w/w)の間の有効成分を含んでよい。本発明の製薬学的組成物の単位用量は、一般に約50マイクログラムから約50ミリグラムまでの有効成分を含むことができ、また、好ましくは約500マイクログラムから約10ミリグラムまでの有効成分を含んで成る。一般に、O−アルキル化ラパマイシン誘導体は、ラパマイシンの現在使用される量(例えば、単位用量あたり1〜5ミリグラム)と同一の桁の量で使用することができる。
【0046】
有効成分に加え、本発明の製薬学的組成物は、1種もしくはそれ以上の付加的な製薬学的有効成分をさらに含んでよい。とりわけ企図される付加的薬剤は、アザチオプリン、ミコフェノール酸モフェティルのようなミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドのような免疫抑制剤を包含する。
【0047】
本発明の製薬学的組成物の制御放出もしくは徐放性製剤は、慣習的技術を使用して作成してよい。
【0048】
非経口投与に適する製薬学的組成物の製剤は、滅菌水もしくは滅菌の等張の生理学的食塩水のような製薬学的に許容できる担体と組み合わせられた有効成分を含んで成る。こうした製剤は、ボーラス投与もしくは連続投与に適する形態で製造、包装もしくは販売してよい。注入可能な製剤は、アンプル、保存剤を含有する複数用量の容器、または自動注入もしくは医師による注入のための単回使用装置でのような単位投与剤形で製造、包装もしくは販売してよい。非経口投与のための製剤は、限定されるものでないが、懸濁剤、溶液、油性もしくは水性ベヒクル中の乳剤、パスタ剤、および埋込可能な徐放性もしくは生物分解可能な製剤を挙げることができる。こうした製剤は、限定されるものでないが懸濁化剤、安定剤もしくは分散剤を挙げることができる1種もしくはそれ以上の付加的成分をさらに含んでよい。非経口投与のための製剤の一態様において、有効成分は、再構成される組成物の非経口投与前の適するベヒクル(例えば滅菌の発熱性物質を含まない水)との再構成のための乾燥した(すなわち粉末もしくは顆粒の)形態で提供される。
【0049】
該製薬学的組成物は、滅菌の注入可能な水性もしくは油性の懸濁剤もしくは溶液の形態で製造、包装もしくは販売してよい。本懸濁剤もしくは溶液は既知技術に従って処方してよく、また、有効成分に加えて、本明細書に記述される分散剤、湿潤剤もしくは懸濁化剤のような付加的成分を含んでよい。こうした滅菌の注入可能な製剤は、例えば水もしくは1,3−ブタンジオールのような非毒性の非経口で許容できる希釈剤もしくは溶媒を使用して製造してよい。他の許容できる希釈剤および溶媒は、限定されるものでないがリンゲル液、等張の塩化ナトリウム溶液、および合成のモノもしくはジグリセリドのような不揮発性油を挙げることができる。有用である他の非経口で投与可能な製剤は、微晶質の形態で、リポソーム製剤中に、もしくは生物分解可能なポリマー系の成分として有効成分を含んで成るものを包含する。徐放性もしくは埋込のための組成物は、乳剤、イオン交換樹脂、乏しく可溶性のポリマーもしくは乏しく可溶性の塩のような、製薬学的に許容できるポリマー性もしくは疎水性物質を含んでよい。
【0050】
本明細書で使用されるところの「付加的成分」は、限定されるものでないが、以下、すなわち、賦形剤;界面活性剤;分散剤;不活性希釈剤;顆粒化および崩壊剤;結合剤;滑沢剤;甘味料;着香料;着色料;保存剤;ゼラチンのような生理学的に分解可能な組成物;水性のベヒクルおよび溶媒;油性のベヒクルおよび溶媒;懸濁化剤;分散もしくは湿潤剤;乳化剤、緩和剤;緩衝剤;塩;増粘剤;増量剤;乳化剤;抗酸化剤;抗生物質;抗真菌剤;安定剤;ならびに、製薬学的に許容できるポリマー性もしくは疎水性物質の1種も
しくはそれ以上を挙げることができる。本発明の製薬学的組成物中に包含してよい他の「付加的成分」は当該技術分野で既知であり、かつ、例えば、Genaro編、1985、Remington’s Pharmaceutical Sciences、マック パブリッシング カンパニー(Mack Publishing Co.)、フィラデルフィア州イーストン(引用することにより本明細書に組み込まれる)に記述される。
【0051】
本発明の製薬学的組成物は、被験者に1日あたり体重1キログラムあたり10マイクログラムと1日あたり体重1キログラムあたり1.5ミリグラムとの間の用量を送達するように、および、また、好ましくは1日あたり体重1キログラムあたり20と700マイクログラムとの間の用量を送達するように投与してよい。成体のヒトについては、1日あたり0.1ないし50ミリグラムのラパマイシンもしくはO−アルキル化ラパマイシン誘導体、および好ましくは1日あたり1ないし10ミリグラムの有効成分の投与が企図される。
【0052】
普通に熟練した医師もしくは獣医師は、被験体におけるリンパ増殖症候群を緩和もしくは阻害するのに有効な量の化合物を容易に決定かつ処方することができることが理解される。そうした処置において、医師もしくは獣医師は、例えば、最初に比較的低用量で処方してよく、その後適切な応答が得られるまで用量を増大させる。しかしながら、いずれかの特定の被験体に特定の用量レベルは、使用される特定の化合物の活性、被験体の齢、体重、全身的健康状態、性別および食餌、投与の時間、投与経路、排泄の速度、いずれかの薬物の組み合わせ、ならびに治療もしくは阻害されているリンパ増殖症候群の重症度を包含する多様な因子に依存することができることがさらに理解される。
【0053】
本発明の別の局面は、本発明の製薬学的組成物および説明書資材を含んで成るキットに関する。本明細書で使用されるところの「説明書資材」は、リンパ球の増殖を阻害する、またはリンパ増殖症候群を緩和もしくは阻害するための本発明の製薬学的組成物の有用性を伝達するのに使用される表現の刊行物、録音、図もしくはいずれかの他の媒体を包含する。説明書資材は、例えば、本発明の製薬学的組成物の適切な用量もまた記述することができる。本発明のキットの説明書資材は、例えば、本発明の製薬学的組成物を含有する容器に添付してよいか、もしくは、該製薬学的組成物を含有する容器と一緒に発送してよい。あるいは、説明書資材を、該説明書資材および製薬学的組成物が受領者により協調的に使用されるという意図をもって容器と別個に発送することができる。
【0054】
別の態様において、本発明は、哺乳動物における腫瘍の確立を阻害するためのSDZ RADのようなO−アルキル化ラパマイシン誘導体もしくはラパマイシンの使用方法を包含する。本方法は、第一の腫瘍を有する哺乳動物に、該哺乳動物中での第一の腫瘍由来の第二の腫瘍の確立を阻害するのに十分な量のラパマイシン誘導体を投与することを必要とする。本目的上O−アルキル化ラパマイシン誘導体で治療されるべき哺乳動物は、脳、腎、肝、乳房もしくは卵巣の腫瘍のような実質的にいかなる型の第一の腫瘍も有することができる。SDZ RADのようなO−アルキル化ラパマイシン誘導体により表されることができる他の代表的抗腫瘍活性は、腫瘍形成の阻害、転移の阻害、腫瘍細胞の成長の阻害、腫瘍細胞の増殖の阻害、および腫瘍細胞の死の誘導を包含する。
【0055】
代替の態様において、本発明は、本化合物により表される抗増殖、抗腫瘍および免疫抑制活性に関する生物学的過程に影響を及ぼしかつ治療応答を導き出すための、SDZ RADのようなO−アルキル化ラパマイシン誘導体の使用方法に関する。これらの方法は、例えば、アポトーシスを誘導するため、細胞増殖を阻害するため、または抗腫瘍、抗PTLDもしくは免疫抑制の目的上、該誘導体を使用することを包含する。従って、該誘導体は、これらの過程を伴う障害を阻害する(すなわち、改善、予防、または重症度、頻度、速度もしくは程度を低下する)のに使用することができる。有効な抗増殖剤として、O−
アルキル化ラパマイシン誘導体は、過剰もしくは別の方法で不適切な細胞の増殖を特徴とする、実質的にいかなる障害も緩和するために有用である可能性がある。障害の例は、自己免疫疾患、アレルギー、他の超免疫障害、アテローム硬化症を包含する。
【0056】
本発明は、哺乳動物におけるリンパ増殖症候群を緩和もしくは阻害するために有用である薬剤の同定方法を包含する。本方法は、Bリンパ球をEBVに曝露することによりそれを形質転換することを含んで成る。こうした曝露は標準的な試薬および技術を使用し、かつ、リンパ球を形質転換することができるEBVのいずれかの入手可能な株を使用して実施することができる。本方法に有用なBリンパ球は、例えばヒトドナーから得ることができる。形質転換されたBリンパ球を、SCIDマウスのような重症の複合免疫不全を有するマウスに注入する。形質転換されたリンパ球は、マウスに腹腔内でもしくは皮下に注入することができる。好ましくは、形質転換されたBリンパ球の注入は皮下である。抗リンパ増殖活性を潜在的に表す薬剤もまた該マウスに投与する。該マウスにおける腫瘍の成長を、約21日間のような選択された時間の期間の間監視する。腫瘍の成長もしくは発生の阻害は、該薬剤が抗リンパ増殖活性を表すことの表示である。
【0057】
本発明の一態様において、潜在的な抗リンパ増殖剤を、形質転換されたBリンパ球の注入前にSCIDマウスに投与する。例として、SDZ RADのような薬剤を、形質転換されたBリンパ球をマウスに注入する前に最低約10日間、および好ましくは最低約3日間、1日あたり1キログラムあたり5ミリグラムの用量でSCIDマウスに投与することができる。
【0058】
本方法の別の態様において、潜在的な抗リンパ増殖剤を、形質転換されたBリンパ球の注入およびマウス中での生じる腫瘍の発生後にSCIDマウスに投与する。本態様において、形質転換されたBリンパ球の注入の後に、マウス中での生じる腫瘍の成長を監視する最低約21日、およびほぼ第21日後に開始するマウスへの潜在的抗リンパ増殖剤の投与が続く。例として、SDZ RADのような薬剤を、注入後約第21日に開始して1日あたり1キログラムあたり5ミリグラムの用量でSCIDマウスに投与することができる。
【0059】
本明細書に記述される方法を使用して、抗リンパ増殖活性を有するとしての薬剤の評価は、注入されたマウスにおける腫瘍の退縮(すなわち、該薬剤での治療の開始に関して腫瘍の大きさの低下)、腫瘍の根絶、および第二の腫瘍の非存在の証拠に基づくことができる。同様に、ある薬剤は、注入されたマウスが、腫瘍の成長(すなわち腫瘍の大きさの増大)もしくは第二の腫瘍の発生またはその双方を表す場合に、実質的な抗リンパ増殖活性を有しない。
【0060】
他の態様において、抗リンパ増殖剤の本明細書に記述される同定方法はまた、哺乳動物における腫瘍の確立を阻害することが可能な(例えば、リンパ腺腫瘍の拡がりもしくは転移を阻害することが可能な)薬剤を同定するのにも有用である。例えば、哺乳動物中での腫瘍の確立を阻害する薬剤は、Bリンパ球をEPVに曝露すること(その結果、形質転換されたBリンパ球が生成される)、SCIDマウスのような重症の複合免疫不全を有するマウスに該薬剤を投与すること、形質転換されたBリンパ球を該マウスに注入すること、および選択された期間(例えば最低約21日)の間、マウスにおける腫瘍の成長を監視することにより同定することができる。腫瘍の確立を阻害することが可能な薬剤は、注入されたマウス中での腫瘍の退宿、腫瘍の根絶および第二の腫瘍の非存在の1種もしくはそれ以上を引き起こすことができる。腫瘍の確立を阻害することが可能でない薬剤は、腫瘍の成長および二次的腫瘍の発生に関して、注入されたマウスに対する観察可能な影響を有しないことができる。
【0061】
上述された方法に関して、腫瘍の成長もしくは退縮の測定、Bリンパ球の注入、および
潜在的抗PTLD薬剤を試験するための適切な投薬量の決定のための手順は、免疫薬理学の当業者の能力内にある。本開示を読みかつ本明細書に提供される実施例1の詳細を吟味した結果、抗リンパ増殖活性を表すもしくは腫瘍の確立を阻害することが可能である化合物を同定するために本発明の方法を使用することは、当業者にとって単純な事柄である。
【0062】
本発明は今や、以下の実施例に関して記述される。これらの実施例は具体的説明のみの目的上提供され、また、本発明はこれらの実施例に制限されないが、しかしむしろ、本明細書に提供される教示の結果として明白である全部の変形物を包含する。
【実施例】
【0063】
実施例1
SDZ RADは、インビトロおよびインビボでのヒトのEBVで形質転換されたBリンパ球の成長を阻害する。
本実施例に提示される実験は、SDZ RADが強力な抗拒絶、抗リンパ増殖剤であり、かつ、移植後リンパ増殖症候群(PTLD)の阻害および治療への新規アプローチを表すことを立証する。
【0064】
本実施例に提示される実験で使用された材料および方法を今や記述する。
【0065】
本研究で使用された大部分の細胞系は、末梢血単核球(PBMC)のEBVへのインビトロ感染により得られたリンパ芽球状B細胞系であった。細胞系A1およびA2D6は正常な健康な個体から得た。細胞系15Aおよび20Aは、モノクローナル性のコールドのアグルチニンを用いて低悪性度B細胞リンパ腫を伴う2名の異なる患者から得た(Silbersteinら、1991、Blood 78:2372−2386)。双方の系統は、患者の血清中で見出されるコールドのアグルチニンと同一の特異性をもつコールドのアグルチニンを分泌した(Silbersteinら、1991、Blood 78:2372−2386)。さらに、20A細胞系は低悪性度リンパ腫でみられる細胞発生の異常を表した(48、XX、+3、+12、Silbersteinら、1991、Blood 78:2372−2386による)。LCL B細胞系は進行性皮膚T細胞リンパ増殖症候群を伴う患者から得た(Zhangら、1996、Proc.Natl.Acad.Sci.USA 93:9148−9153)。BC−1は腹膜滲出液B細胞リンパ腫(PEL)由来であり、そして、EBVに加えて、HHSV8ウイルスをもつ(Cesarmanら、1995、Blood 86:2708−2714)。インビトロ成長阻害アッセイで対照として使用された他の3細胞系は、HTLV−I(+)T細胞系ATL−2(Maedaら、1985、Exp.Med.162:2169−2174);C10MJ2(Popovicら、1983、Science 219:856−859);および、成人T細胞白血病/リンパ腫(ATLL)を伴う患者由来のHUT102B(Poiescz、1980、Proc.Natl.Acad.Sci.USA 77:7415−7419;Bunnら、1996、J.Cell.Biochem.Suppl 24:12−23)であった。それらはわれわれにより、SDZ RADおよび関係した免疫抑制性マクロライド、ラパマイシンに対し非応答性であることが示された(Zhangら、1999、Leukemia Res.23:373−384)。全部の細胞系を、標準培地、すなわち10%(v/v)熱不活性化ウシ胎児血清(バイオウィッタカー(BioWhittaker)、メリーランド州ウォーカーズビル)、1%ペニシリン/ストレプトマイシン/フンギゾン混合物(ギブコ BRL(Gibco BRL))および2ミリモル濃度のL−グルタミン(ギブコ BRL(Gibco BRL))を補充されたRPMI培地1640(ギブコ BRL(Gibco BRL)、ニューヨーク州グランドアイランド)中で、5%CO2を含有する雰囲気中、37℃の加湿されたインキュベーター中で維持した。
【0066】
SDZ RADによるインビトロの細胞の成長の阻害を評価するためのアッセイを、記述されたとおり(Zhangら、1999、Leukemia Res.23:373−384;Zhangら、1996、Proc.Natl.Acad.Sci.USA 93:9148−9153)実施した。簡潔には、細胞系を、多様な濃度のSDZ RAD(ノバルティス ファーマ(Novartis Pharma)、バーゼル)の存在下にウェルあたり2×104個の細胞で三重で32時間培養した。0.5マイクロキュリーの3H−チミジン(ニュー イングランド ニュークリア(New England Nuclear)、マサチューセッツ州ボストン)を細胞に適用しかつ細胞を次の18時間培養した後に、細胞中への放射性同位体の取込みを測定した。増殖アッセイの結果は、三重の培養物の平均の放射活性として表した。三重内の標準偏差は<15%であった。
【0067】
細胞周期の阻害およびアポトーシスの検出。
検査されるべき細胞系を、数種の濃度のSDZ RAD(0ないし10ナノモル濃度)とともに24〜48時間培養した。細胞を、DPBS、および3% PEG 6000、1ミリリットルあたり50マイクログラムのDNA蛍光色素、ヨウ化プロピジウム(PI;カルバイオケム(Calbiochem)、カリフォルニア州サンディエゴ)、記述されたようなアネキシン V−FITC(Douglasら、1998、Cytometry 32:57−65)0.1%(v/v)トリトン[TRITON](商標)X(シグマ(Sigma)、ミズーリ州セントルイス)、4ミリモル濃度のクエン酸緩衝液pH7.8、および1ミリリットルあたり360単位のRNアーゼA(ワーシントン バイオケミカルズ(Worthington Biochemicals)、ニュージャージー州フリーホールド)を含有する染色溶液(pH7.2)で、37Cで30分間洗浄した。次に、塩溶液pH7.2(3% w/v PEG 6000、1ミリリットルあたり50マイクログラムのPI、0.1% v/v トリトン[TRITON](商標)Xおよび0.4モル濃度のNaCl)を添加し、そして細胞を、記述されたとおり(Douglasら、1998、Cytometry 32:57−65;Kawamataら、1998、Blood 91:561−569;Pepperら、1998、Leuk.Res.22:439−444)、フローサイトメトリー分析を実施する前に4℃で暗所で1時間インキュベートした。
【0068】
5ないし7週齢の免疫不全SCIDマウス(C.B−17およびICR)をタコニック(Taconic)(ニュージャージー州ジャーマンタウン)から購入し、そして層流空気流設備中、発熱性物質を含まない条件下で、ペンシルバニア大学動物施設(the University of Pennsylvania Animal Facility)で収容し、かつ、滅菌の飼料および水を供給した。毒性試験においては、5−7週齢の近交系BALB/cマウス(タコニック(Taconic))を、SCIDマウスに加えて使用した。
【0069】
異種移植された腫瘍の確立および接種は記述された(Douglasら、1998、Cytometry 32:57−65;Kawamataら、1998、Blood 91:561−569;Pepperら、1998、Leuk.Res.22:439−444)とおり実施した。マクロファージおよびNK細胞を枯渇させかつ腫瘍の生着を高めるために、SCIDマウスに、ヒトEBV+ B細胞系の埋込4日前に1キログラムあたり30〜45ミリグラムのエトポシド(ベッドフォード ラボラトリーズ(Bedford Laboratories)、オハイオ州ベッドフォード)を腹腔内に注入した(Visonneauら、1998、Am.J.Path.152:1299−1311)。使用された各系統の1,000万個の細胞を、200マイクロリットルのダルベッコリン酸緩衝生理的食塩水(DPBS;バイオウィッタカー(BioWhittaker)、メリーランド州ウォーカーズビル)中で、腹腔内もしくは皮下のいずれかでマウスに接種した。複水もしくは触知できる皮下腫瘍が、細胞注入3〜5週間後に発生した。
【0070】
腫瘍の治療および成長の阻害の実験は、確立した皮下腫瘍の断片を使用して実施した(Pasqualucciら、1995、Blood 85:2139−2146、Visonneauら、1998、Am.J.Path.152:1299−1311)。本目的上、マウスを、1キログラムあたり100ミリグラムの腹腔内注入によりケタラール[KETALAR](商標)(ケタミン、パーク−デービス(Parke−Davis)、ニュージャージー州モリスプレインズ)で麻酔した。次に、原発性腫瘍を無菌的に取り出し、そして壊死、脂肪および結合組織から開放し、そしてだいたい等しい大きさの小片に分割し、かつ、マウスあたり3〜4片を皮下に注入した。SDZ RADでの確立した腫瘍の治療は、腫瘍が直径5ミリメートルに達した場合に開始した。成長の阻害の実験においては、治療を腫瘍埋込3日前に開始した。全実験における腫瘍体積は、等式:体積=0.4ab2(式中、aおよびbはそれぞれ腫瘍の長および短直径を表す)から決定した。移植されたマウスを、2ヶ月までの期間の間、腫瘍の成長について監視した。1キログラムあたり5ミリグラムのSDZ RADを、記述された(Schuurmanら、1997、Transplantation 64:32−5;Schulerら 1997、Transplantation 64:36−42)とおり胃管栄養法により1日1回投与した。
【0071】
マウスを、薬物毒性試験の第29日、腫瘍成長阻害試験の第40〜55日、または腫瘍がおよそ直径2センチメートルに到達した場合、または皮膚の潰瘍、重症の呼吸困難、衰弱もしくは嗜眠の兆候が出現した場合に、ホラン[FORANE](商標)(イソフルラン、オーメダ(Ohmeda)、ニュージャージー州リバティプレイス)への曝露により殺した。完全な剖検を、それらの出現に関係なく試験の終了時に全部のマウスで実施した。腫瘍および内部器官(脾、肝、肺、心、腎、小腸および大腸、骨髄のための大腿骨)を10%(v/v)ホルマリン中で固定し、パラフィンに埋込み、0.4ミクロンの切片に切断し、スライドガラスに移し、そしてヘマトキシリンおよびエオシンで染色した。代表的な腫瘍断片を、商業的に入手可能な試薬(リサーチ ジェネティックス(Research Genetics)、アラバマ州ハンツビル)、抗体すなわち抗CD20(L−26)およびLMP−1(双方はダコー(DAKO)、カリフォルニア州カルピンテリアから)ならびにKi67(mib1;イムノテック(Immunotech)、メーン州ウェストブルック)を使用する、標準的ストレプトアビジン−ビオチン複合体技術により免疫組織化学的に染色した。EBVにコードされるRNA(EBER−1)、そして商業的に入手可能な試薬を使用して検出した。
【0072】
本実施例で提示される実験の結果を今や記述する。
【0073】
SDZ RADはインビトロでEBV+ B細胞の成長を阻害する
SDZ RADがPTLDを模倣する細胞の増殖を阻害することができるかどうかを決定するために、6種の異なるEBV+ B細胞系を、多様な濃度の薬物の存在下にインビトロで培養した。SDZ RADに抵抗性の3種のHTLV−I+ T細胞系(Zhangら、1999、Leukemia Res.、23:373−384)を対照として使用した。図1に示されるとおり、全部のPTLD様EBV+ B細胞系はSDZ RADに非常に感受性であった。約1ナノモル濃度程度のSDZ RADの用量が、全細胞系で成長の60〜95%阻害を生じさせた。本結果は、刺激された正常なT細胞の阻害に匹敵した(Schuurmanら、1997、Transplantation 64:32−5;Bohlerら、1998、Transplant.Proc.30:2195−2197)。応答の程度における若干の微妙な差異が、EBV+ B細胞系の間で示された。B細胞リンパ腫を伴う患者由来の、ならびに従って進行した形態のPTLDにより類似する系統(15A、20AおよびBC−1;材料および方法を参照されたい)は、より低い程度の阻害(80〜90%)を示す傾向があった。正常なB細胞から得られた細胞系
(すなわち、より少なく進行した型のPTLDを模倣する)はより大きく阻害された(90〜100%)。該細胞系に、0〜10ナノモル濃度のSDZ RADとともにの32時間培養後に、トリチウム化チミジンを18時間適用した。
【0074】
SDZ RADはEBV+ B細胞における細胞周期の進行を封鎖する
ラパマイシン、およびおそらくSDZ RADのようなO−アルキル化ラパマイシン誘導体は、正常なT細胞において細胞周期の進行を初期段階で封鎖する(Teradaら、1993、J.Cell Physiol.154:7−15;Flanaganら、1993、Ann.N.Y.Acad.Sci.696:31−37)。チミジンの取込みを測定したわれわれの細胞の成長の阻害のデータ(図1)は、SDZ RADがPTLD様B細胞中で細胞周期の進行を阻害することを示唆した。図2に示されるとおり、SDZ
RADは、検討された全4種のPTLD様B細胞系、すなわち、20A、A1、A2D6およびLCLにおいて、早期のG0/G1期で細胞周期の進行を著しく阻害した。該効果は薬物用量および細胞系の型に依存性であった。低SDZ RAD用量(1〜2ナノモル濃度)はG0/G1の細胞のパーセンテージを5〜25だけ増大させた一方、試験された最高用量(10ナノモル濃度)は10〜70%増大をもたらした。細胞周期のより後期(G2−MおよびS)の細胞のパーセンテージは比例して減少した。A1、およびより少ない程度までA2D6細胞系は、SDZ RADにとりわけ感受性であった。4種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADとともに48時間培養し、ヨウ化プロピジウムで標識し、そしてフローサイトメトリーにより分析した。
【0075】
SDZ RADはEBV+ B細胞におけるアポトーシスを増大させる
以前の研究は、ラパマイシンにより代表されるような免疫抑制性マクロライドが、他の薬剤により刺激されたアポトーシスを誘導するもしくは高めることができることを示している(Gottschalkら、1994、Proc.Natl.Acad.Sci.USA 91:7350−7354;Muthukkumarら、1995、Transplantation 60:264−270;Shiら、1995、Cancer Res.55:1982−1988;Hosoiら、1999、Cancer Res.59:886−894)。SDZ RADがPTLD様細胞におけるアポトーシス速度に影響を及ぼすかどうかを決定するために、われわれは、20A、A1、A2D6細胞系においてフローサイトメトリーによりアネキシンVのアポトーシスに誘導される表面発現を試験した(図3)。最低のSDZ RAD用量(1ナノモル濃度)でさえ、細胞の成長および細胞周期の阻害のデータに似ている若干の差異を伴い、全細胞系においてアポトーシス細胞のパーセンテージを著しく増大させた。最も感受性のA1系統において、SDZ RADは、アポトーシス細胞の数を10から16%までのおよそ60%の増大をもたらした。A2D6系統においては、それは11%の増大に、また、20A系統においては12%の増大につながった。最高用量(10ナノモル濃度)では、SDZ RADは、A1系統でおよそ240%の増大、ならびにA2D6および20A双方の系統で45%の増大につながった。
【0076】
毒性試験
以前の研究は、ラットにおけるSDZ RADの最小有効用量は、SDZ RADを単独の免疫抑制剤として使用した場合に、腎および心移植モデルにおいて、それぞれ1日あたり体重1キログラムあたり5ミリグラムおよび1日あたり体重1キログラムあたり>5ミリグラムであったことを示している(Schuurmanら、1997、Transplantation 64:32−5;Schulerら、1997、Transplantation 64:36−42)。SDZ RADへの長期の曝露が免疫能力のあるおよび免疫不全の双方のマウスに対し非毒性であるかどうかを決定するために、正常なBALB/cマウスのコホートを上の用量のSDZ RADで28日間処理した。10匹の処理されたおよび5匹の対照の未処理のマウスを本試験で使用した。後に、ヒトPTLD
様リンパ腫を移植されかつSDZ RADで55日まで治療されたSCIDマウスを評価した。7匹の治療されたおよび5匹の対照の未治療のSCIDマウスを本実験で評価した。薬物の最終投与を受領した後に、全部のマウスを殺し、そして以下の器官、すなわち肝、脾、腎、小腸、大腸、心、肺および骨髄のための大腿骨を、可能な毒性効果について検討するための組織病理学的評価のために収穫した。
【0077】
処理されたマウスのいずれも、薬物毒性のいかなる目に見える兆候も示さなかった。成長および体重増加はSDZ RAD処理された群および対照群について同一であった。全部の処理されたおよび未処理のマウスの器官の顕微鏡的評価は、薬物に帰することができた病理学的変化を示さなかった。従って、われわれは、1日あたり体重1キログラムあたり5ミリグラムの用量のSDZ RADへの長期の曝露は、それらの免疫状態に関係なく、処理されたマウスで副作用を有しないと結論する。
【0078】
SCIDマウスにおけるヒトPTLD様リンパ腫の異種移植モデルの確立。
これらの実験において、マウスに2種の異なる経路、すなわち腹腔内および皮下を介して、EBV+ B細胞系を注入した。腹腔内腫瘍モデルにおいて、SCIDマウス(1群あたり5匹)に、4種の細胞系、すなわち15A、20A、A2D6およびBC−1からの系統あたり約107個の細胞を腹腔内に接種した。21〜35日後に、全部のマウスが腹水および衰弱もしくは嗜眠の症状を伴う致死的疾患を発症した。剖検は、腹膜壁、肝、脾および腎を巻き込む広範囲の腫瘍の浸潤を示した。腫瘍の検鏡は、浸潤性の成長パターン、高い有糸分裂率、病巣および単独細胞の壊死、ならびにいくらかの程度の形質球様細胞分化を伴う大細胞型リンパ腫を示した。リンパ腫の病巣は、肺および骨髄のような遠位の器官にもまた存在し、血行性の拡がりを示した。
【0079】
皮下モデルにおいては、マウス(また1群あたり5匹)に、15A、20AおよびA1系統からの約107個の細胞を注入した。21〜32日後に、全部のマウスが埋込の部位に腫瘍を発生した。剖検は隣接する骨格筋および皮膚を侵襲する皮下腫瘍を示した。腫瘍の遠位の拡がりの肉眼的証拠は存在しなかった。検鏡は、腹腔内モデルにおけると同一の型の高悪性度リンパ腫を示した。遠位の内部器官、主として肝および肺は、小さい腫瘍病巣を時折表した。これは、皮下リンパ腫が直径最低1.5cmの比較的大きな大きさに達した場合にのみ起こった。免疫組織化学的染色は、腫瘍が埋込まれたヒトEBV+ Bリンパ球由来であったことを確認した。図4A−Dに示される20A系統の像は、全3種の細胞系の代表的なものである。
【0080】
事実上全部のリンパ腫細胞がヒトB細胞マーカーCD20について陽性であった。大部分(50〜80%)は、それらの高い増殖速度と一致して、細胞周期に関係したKi−67抗原について陽性であった。EBV関連抗原EBER1についての染色は普遍的に陽性であった(細胞の100%)。細胞の20ないし50%がEBV関連の潜伏性膜タンパク質1(LMP−1)を発現した。これらの結果は、腫瘍が単形性の型のPTLDに対応するヒトEBV+ B細胞リンパ腫を表すことを確認する。
【0081】
皮下リンパ腫モデルは腹膜モデルを上回るいくつかの利点を有した。第一に、小さいリンパ腫でさえ容易に同定することができた。第二に、直径1.5センチメートルまでのリンパ腫が局在化されたままであり、これは大きな正確性を伴い総腫瘍体積の決定を可能にした(Wasikら、1994、Am.J.Path.144:1089−1097)。最後に、皮下腫瘍は、単独細胞懸濁物よりもむしろ腫瘍組織断片を埋込むことにより、数匹のマウスに同時に移すことができた(Wasikら、1994、Am.J.Path.144:1089−1097;Pasqualucciら、1995、Blood 85:2139−2146;Visonneauら、1998、Am.J.Path.152:1299−1311)。こうした埋込は、事実上全部のレシピエントマウスにおける非
常に類似の成長の特徴をもつ腫瘍の迅速な確立をもたらす(Wasikら、1994、Am.J.Path.144:1089−1097;Pasqualucciら、1995、Blood 85:2139−2146;Visonneauら、1998、Am.J.Path.152:1299−1311)。これらの理由から、われわれはさらなる研究に皮下モデルを選択した。
【0082】
確立したEBV+ B細胞腫瘍の治療。
PTLD様細胞に対するSDZ RADのインビボの効果を決定するために、15A、20AおよびA1細胞系の腫瘍を、細胞系あたり7〜15匹のSCIDマウスに埋込んだ。治療は、腫瘍が直径5ミリメートル(50立方ミリメートルの体積に対応する)に達したら開始した。SDZ RADは1キログラムあたり5ミリグラム(非毒性かつ有効な免疫抑制用量に相当する)で、毎日の胃管栄養法により投与した(Schuurmanら、1997、Transplantation 64:32−5;Schulerら 1997、Transplantation 64:36−42)。
【0083】
図5に示されるとおり、SDZ RADは、3種の腫瘍の間の応答の程度の目に見える差異を伴い、異種移植されたPTLD様腫瘍の成長に対する大きな阻害効果を有した。15A腫瘍を埋込まれたマウスにおいて、腫瘍の成長の著しい薬物に誘導される遅延が存在したが、しかし、絶対的な腫瘍の成長の阻害もしくは退縮は存在しなかった。第21日に、腫瘍体積の中央値は、治療されたマウスでおよそ240立方ミリメートル、および対照の未治療のマウスで2720立方ミリメートルであった。およそ第38日に、治療されたマウスにおける15A腫瘍は約1000立方ミリメートルに達したのみであった。20A腫瘍に対するSDZ RADの効果はより著しくさえあった。第19日に、対照の20A腫瘍は1440立方ミリメートルの体積の中央値を表した一方、平均の治療された腫瘍はわずか50立方ミリメートルの量があり、これは初期の腫瘍の大きさに等しかった。さらに、腫瘍体積の有意の退縮が10匹の治療されたマウスのうち6匹でみられた。従って、第53日の腫瘍体積の中央値は、このサブセットについてわずかに<5立方ミリメートルであった。
【0084】
SDZ RADはA1細胞系に対して最も有効であることが判明した。第21日に、治療された腫瘍の体積の中央値は50立方ミリメートルであり、腫瘍のいずれも(0/8)成長のいかなる証拠も示さなかった。その日の未治療の腫瘍の平均体積はおよそ1800立方ミリメートルであった。さらなる治療は全8匹のマウスでの安定した退縮をもたらした。第53日に、平均の腫瘍体積は<5立方ミリメートルに減少し、そしてリンパ腫は4匹のマウスで検出することができず、完全な腫瘍の根絶を示した。他の4匹のマウスは顕微鏡的に確認される残余のリンパ腫を有した。注目すべき、15A、20AおよびA1腫瘍に対するSDZ RADのインビボの有効性の差異は、増殖(図1)ならびに他のインビトロアッセイ(図2および3)でみられる差異に相応した。この観察結果は、インビトロでの細胞分析がインビボでのSDZ RADに対する応答を予言することを示唆する。
【0085】
腫瘍の確立の阻害
SDZ RADは、免疫抑制剤として使用される場合に移植患者に慢性的に投与されるため、PTLDに対するその主な治療的影響は、臨床的に症候性の症例を緩和することよりはむしろそれらの発生を阻害することであるかもしれない。SDZ RADがPTLD様リンパ腫の確立を阻害することができるかどうかを試験するため、体重1キログラムあたり5ミリグラムの薬物での連日治療を、腫瘍埋込の3日前に開始した。図6に示されるとおり、SDZ RADは本モデルで極めて有効であることが判明した。SDZ RADに対し最も少なく感受性である15A腫瘍において(図5)、SDZ RADでの治療は腫瘍の成長を大きく遅延させたが、しかし腫瘍の確立を阻害することは不可能であった。第25日に、治療された腫瘍は平均で38立方ミリメートル、未治療はおよそ1940立
方ミリメートルだけの量があった。第45日に、治療された腫瘍の体積の中央値は480立方ミリメートルであった。20A腫瘍においては、11個の腫瘍のうち6個が第25日に検出可能でなく;残存する5個の体積の中央値は20立方ミリメートルであった。未治療の腫瘍の平均は、その日に210立方ミリメートルだけの量があった。第45日に、治療された腫瘍のいずれも150立方ミリメートルを越えず、未治療の腫瘍の平均はおよそ4200立方ミリメートルだけの量があった。5匹の治療されたマウスは腫瘍の兆候を示さず;埋込部位の顕微鏡的評価は悪性の細胞を示さなかった。最後に、A1マウスにおいて、腫瘍は8匹の治療されたマウスのいずれにおいてもほぼ第29日に検出することができず;未治療のマウスでの腫瘍の平均は580立方ミリメートルだけの量があった。第53日に、3匹のマウスのみが、小さい(<5立方ミリメートル)組織学的に確認されるリンパ腫を示した。残存する5匹のマウスは腫瘍の証拠を示さなかった。
【0086】
標準的免疫抑制剤はPTLDの発生を助長する一方、これらの障害に対するSDZ RADおよび他のマクロライドの影響は決定されないままである。SDZ RADは、PTLD様EBV+ B細胞において、インビトロのリンパ球増殖を大きく抑制し、細胞周期の進行を封鎖し、そしてアポトーシス速度を増大させたことが観察された。インビボのSCIDマウスの異種移植モデルにおいて、SDZ RADは確立したEBV+ B細胞腫瘍の成長を著しく遅延させたか、もしくは退縮を誘導した。該薬物は治療されたマウスのサブセットにおいて、腫瘍の確立を完全に根絶もしくは阻害した。これらの知見は、SDZ RADのようなマクロライドが、PTLDの阻害および治療で有効であるかもしれないことを示す。
【0087】
SDZ RADは、PTLD様EBV+ B細胞において、インビトロ増殖を大きく抑制し、細胞周期の進行を早期のG0/G1段階で停止し、そしてアポトーシス速度を増大させた。3種の異なるPTLD様B細胞腫瘍を異種移植されたSCIDマウスにおいて、SDZ RADは、とりわけ腫瘍埋込前に投与された場合に、これらの腫瘍の成長を著しく阻害した。A1腫瘍において、既に確立した腫瘍の完全な根絶が、8匹のマウスのうち4匹(4/8)で達成された。試験された3系統のうち2種(20AおよびA1)で、SDZ RADはマウスのおよそ50%において腫瘍の確立を完全に阻害した(それぞれ5/11および5/8)。SDZ RADの抗EBV+ B細胞腫瘍特性は、こうした細胞に対する免疫応答を抑制することにより間接的にのみならず、しかしまたそれらをアポトーシス前シグナルの影響から保護することにより直接的にEBV+ B細胞の生長を高めることが最近示唆されている(Beattyら、1998、Transplantation 65:1248−1255)標準的免疫抑制剤シクロスポリンおよびタクロリムスとよい対比をなす。
【0088】
これらの実験の結果は、15Aおよび20A系統がリンパ腫細胞由来であったためにとりわけ有望であり(Silbersteinら、1991、Blood 78:2372−2386)、そして、それ自体、進行した臨床的に攻撃的な形態のPTLDに応答するようである。従って、症例の大多数を含んで成る、他のより少なく悪性の形態のPTLDは、SDZ RADになおより感受性であるはずであることが妥当と思われる。正常な個体から得られたA1細胞系がSDZ RADに対し15Aおよび20Aよりもより感受性であったという事実が、この仮定を支持する。
【0089】
本実施例に提示されるデータはまた、SDZ RADでの単独療法が、数種の確立した明白に悪性のPTLD腫瘍を根絶するのに十分でないかもしれないこと、ならびに、SDZ RAD(または別のO−アルキル化ラパマイシン誘導体もしくはラパマイシン)および1種もしくはそれ以上の慣習的化学療法薬の双方を使用する併用療法を、臨床の場面で考慮することができる(Shiら、1995、Res.55:1982−1988;Mikiら、1998、Transplant.Proc.30:1091−1092)こと
も示唆する。
【0090】
チミジンの取込み(図1)および細胞周期の進行(図2)により測定されるところの細胞の成長の阻害は、EBV+ B細胞に対するSDZ RADの作用の主要な様式であるようであるとは言え、SDZ RADはこうした細胞におけるアポトーシス速度もまた増大させるという本明細書に記述される結果(図3)は、プログラムされた細胞死もまた該薬物の抗腫瘍活性の重要な一成分であるかもしれないことを示唆する。このアポトーシス前効果は、確立したPTLD腫瘍の治療でとりわけ重要である可能性があり、ここでは腫瘍の成長の阻害単独は完全な腫瘍の退縮を達成するのに十分でないかもしれない。SDZ
RADへの長期の曝露のみが多くの腫瘍の著しい退縮もしくは排除につながった(図5)という本明細書の観察結果は、類似の拡大された治療が、確立したPTLDを根治するのに望ましいかもしれないことを示唆する。
【0091】
SDZ RADに感受性のPTLD様B細胞系が全部EBV+であったとは言え、この感受性の媒介におけるウイルスの潜在的役割は、あったとしても完全に理解されていない。EBVは、標的細胞中で、サイトカインシグナル伝達経路を活性化することが可能な数種のタンパク質をコードもしくは誘導する(Rochfordら、1997、Viral
Immunol 10:183−195)。LMP−1と呼称される膜に固定されるウイルスタンパク質が最良に特徴づけられたものであり、そしてTNFレセプターファミリーのTRAFシグナル伝達経路を使用する(Mosialosら、1995、Cell 80:389−399;Devergneら、1998、J.Virol.72:7900−7908;Liebowitzら、1998、New Eng.J.Med.338:1413−1421)。該ファミリーに属し、かつTRAF3タンパク質を介するシグナル伝達を包含するLMP−1と数種の特徴を共有する、CD40を介するシグナル伝達(Eliopoulosら、1996、Oncogene 13:2243−2254;Pullenら、1998、Biochemistry 37:11836−11845)が、最近、ラパマイシンにより阻害されることが示された(Sakataら、1999、Immunology Letters 68:301−309)ことが、この情況で興味深い。免疫組織化学的分析は、LMP−1がEBV+ B細胞の一サブセットによってのみ発現されることを示し、これは、LMP−1がPTLD様細胞の成長およびSDZ
RADに対するそれらの感受性に対して決定的に重要でないかもしれないことを示唆する。EBVはまた、LMP−2AおよびLMP−2Bと呼称される2種の他の関係した膜タンパク質もコードする。これらのタンパク質はEBV+ B細胞のインビボでの成長に不可欠であるようではない(Rochfordら、1997、Arch Virol 142:707−720)。あるいは、SDZ RADは、TNF−αおよびTNF−βのような、標的細胞においてEBVにより誘導されるサイトカインにより媒介されるシグナル伝達を阻害するかもしれない(Rochfordら、1997、Viral Immunol 10:183−195)。
【0092】
SDZ RADは、インビトロおよびインビボの双方で、PTLD様のEBV+リンパ芽球状B細胞系に対する強力な阻害活性を表す。SDZ RADは、こうした細胞のインビトロ増殖を大きく阻害し、かつ、早期のG0/G1段階でそれらの細胞周期の進行を停止する。加えて、該薬物は、EBV+ B細胞のアポトーシス速度を増大させる。インビボで、それは、とりわけ細胞埋込の前に投与される場合に、SCIDマウスに異種移植されたEBV+ B細胞の成長を著しく遅延させるかもしくは完全に阻害する。SDZ RADは、いくつかの場合に、確立した腫瘍を根絶することが可能である。この効果は、細胞系特異的でありかつインビトロでみられる薬物の効果に比例するようである。
【0093】
要約すれば、本実施例に提示されるデータは、SDZ RADがインビトロおよびインビボでEBV+ Bリンパ球に対する強力な阻害効果を有することを立証する。従って、
それは、移植患者におけるPTLDの治療および阻害、もしくは他のリンパ増殖症候群の治療および阻害で有効である可能性がある。
【0094】
新たな治療様式が、PTLDの発症を阻害しかつその治癒率を向上させるのに必要とされる。理想的な抗PTLD薬は、移植片拒絶を阻害しかつ同時にPTLDの発生および発展を阻害するという二重の役割を演じるとみられる。PTLDが治療にもかかわらず発症するとすれば、標準的な免疫抑制薬で現在なされているような薬物用量の減少よりはむしろ増加が有効であるかもしれない。薬物用量を増加させるこのアプローチは、移植片の生存を危険にさらさないという付加的な利点を有するとみられる。本実施例は、マクロライド免疫抑制剤SDZ RADが、抗拒絶剤および抗リンパ増殖剤の二重の役割を有することを示す、インビトロおよびインビボのデータを提示する。
【0095】
本明細書に引用されるすべての特許、特許出願および刊行物の開示は、これによりそっくりそのまま引用することにより本明細書に組み込まれる。
【0096】
本発明は特定の態様に関して開示された一方、本発明の他の態様および変形物が、本発明の真の技術思想および範囲から離れることなく当業者により考案されることができることが明らかである。付属として付けられる請求の範囲は、全部のこうした態様および同等の変形物を包含する。
【0097】
以下に本発明の主な特徴と態様を列挙する。
【0098】
1.化学構造
【化1】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ増殖症候群を緩和するのに十分な量で患者に投与することを含んで成る、ヒト患者における該症候群の緩和方法。
【0099】
2.ラパマイシン誘導体が、
ラパマイシン、
40−O−ベンジルラパマイシン、
40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
40−O−アリルラパマイシン、
40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロプ−2’−エン−1’−イル]ラパマイシン、
(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
40−O−(2−アセトキシ)エチルラパマイシン、
40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
28−O−メチルラパマイシン、
40−O−(2−アミノエチル)ラパマイシン、
40−O−(2−アセトアミノエチル)ラパマイシン、
40−O−(2−ニコチンアミドエチル)ラパマイシン、
40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
より成る群から選択される、1.記載の方法。
【0100】
3.ラパマイシン誘導体が
ラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシン、および
40−O−(2−アセトアミノエチル)ラパマイシン
より成る群から選択される、1.記載の方法。
【0101】
4.ラパマイシン誘導体が
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシン、および
40−O−(2−アセトアミノエチル)ラパマイシン
より成る群から選択される、1.記載の方法。
【0102】
5.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、1.記載の方法。
【0103】
6.ラパマイシン誘導体が第二の薬理学的有効成分と共投与される、1.記載の方法。
【0104】
7.第二の薬剤が免疫抑制剤である、6.記載の方法。
【0105】
8.第二の薬剤が、アザチオプリン、ミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドより成る群から選択される、7.記載の方法。
【0106】
9.ラパマイシン誘導体および第二の薬剤が、ラパマイシン誘導体および第二の薬剤の双方を含んで成る組成物中で患者に投与される、6.記載の方法。
【0107】
10.ラパマイシン誘導体が、第二の薬剤が患者に投与される最低1時間前に患者に投与される、6.記載の方法。
【0108】
11.ラパマイシン誘導体が、第二の薬剤が患者に投与される最低1時間後に患者に投与される、6.記載の方法。
【0109】
12.患者が移植後リンパ増殖症候群に苦しめられる、1.記載の方法。
【0110】
13.患者がリンパ腺癌に苦しめられる、1.記載の方法。
【0111】
14.リンパ腺癌がリンパ性白血病である、13.記載の方法。
【0112】
15.リンパ腺癌がリンパ腫である、13.記載の方法。
【0113】
16.リンパ腫が、AIDS関連リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、T細胞リンパ腫および皮膚T細胞リンパ腫より成る群から選択される、15.記載の方法。
【0114】
17.リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているリンパ球の増殖を特徴とする障害である、1.記載の方法。
【0115】
18.患者が免疫抑制療法を受けており、かつ、リンパ増殖症候群がリンパ腫である、17.記載の方法。
【0116】
19.リンパ増殖症候群が悪性リンパ増殖症候群である、1.記載の方法。
【0117】
20.リンパ増殖症候群が、ポリクローン性異型リンパ組織過形成およびモノクローン性の明白に悪性のB細胞リンパ腫より成る群から選択される、1.記載の方法。
【0118】
21.量が体重1キログラムあたり10マイクログラムから体重1キログラムあたり5ミリグラムまでである、1.記載の方法。
【0119】
22.ラパマイシン誘導体が患者に非経口で投与される、1.記載の方法。
【0120】
23.化学構造
【化2】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ増殖症候群を阻害するのに十分な量で、該症候群を発症する危険にさらされるヒト患者に投与することを含んで成る、該患者における該症候群の阻害方法。
【0121】
24.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、23.記載の方法。
【0122】
25.免疫抑制剤、ならびに化学構造
【化3】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体の双方をヒト患者に投与することを含んで成る、該患者における移植片拒絶の改良された阻害方法。
【0123】
26.免疫抑制剤が、アザチオプリン、ミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドより成る群から選択され、かつ、ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、23.記載の方法。
【0124】
27.化学構造
【化4】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ球増殖を阻害するのに十分な量で、リンパ腺癌に苦しめられるヒト患者に投与することを含んで成る、該患者におけるリンパ腺腫瘍の転移の阻害方法。
【0125】
28.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、27.記載の方法。
【0126】
29.Bリンパ球をエプスタイン−バーウイルスに曝露すること(それにより該Bリンパ球が形質転換された表現型を表す)、
形質転換されたBリンパ球を、重症の複合免疫不全を有するマウスに注入すること、
薬剤をマウスに投与すること、および
該マウスにおける腫瘍の成長を最低約21日間監視することであって、
それにより、腫瘍の退縮、腫瘍の根絶および該マウス中での第二の腫瘍の非存在の1種もしくはそれ以上の該マウス中での観察結果が、該薬剤が哺乳動物における移植後リンパ増殖症候群を緩和もしくは阻害するために有用であることの表示である、
を含んで成る、ある薬剤がヒト患者におけるリンパ増殖症候群を緩和もしくは阻害するために有用であるかどうかの評価方法。
【図面の簡単な説明】
【0127】
【図1】発明にかかる、PTLD様EBV+B細胞のインビトロ増殖のSDZ RADに媒介される阻害を具体的に説明するグラフである。BC−1は原発性滲出液リンパ腫(PEL)由来のEBV+/HSV8+ B細胞系である。他の細胞系は、低悪性度のB細胞リンパ腫を伴う患者(15Aもしくは20A)、T細胞リンパ腫を伴う患者(LCL)または健康な個体(A1もしくはA2D6)の1つ由来のインビトロでEBVで形質転換されたB細胞系である。HTLV−I+悪性T細胞系、HUT−102、C10MJおよびATL−2を、対照細胞系として包含した。
【図2】発明にかかる、PTLD様B細胞における細胞周期の進行のSDZ RADに媒介される阻害を具体的に説明するグラフである。4種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADの存在下で48時間培養し、ヨウ化プロピジウムで標識し、そしてフローサイトメトリーにより分析した。
【図3】発明にかかる、PTLD様B細胞のアポトーシス速度のSDZ RADに媒介される増大を具体的に説明するグラフである。3種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADの存在下で24時間培養し、ヨウ化プロピジウムおよび抗アネキシンV抗体で標識し、そしてフローサイトメトリーにより分析した。
【図4】発明にかかる、図4A−4Dを含んで成る、SCIDマウスに異種移植された20A腫瘍の形態学および表現型を描く一群の顕微鏡写真像である。図4Aにおいて、ヘマトキシリン−エオシン染色は、高い有糸分裂率を伴う大細胞型リンパ腫を示す。図4Bにおいて、ヒトCD20(すなわちB細胞抗原)と特異的に結合する抗体を使用する免疫ペルオキシダーゼ染色は、全部のリンパ腫細胞における細胞膜染色を示す。図4Cにおいて、Ki67(すなわち細胞増殖に関係した抗原)と特異的に結合する抗体を使用する免疫ペルオキシダーゼ染色は、50〜80%の細胞における核染色を示す。図4Dにおいて、EBVにコードされるEBER−1 RNAに関するインシトゥハイブリダイゼーションは、全部のリンパ腫細胞における核の陽性性を示す。
【図5】発明にかかる、図5A−5Cを含んで成る、PTLD様B細胞のインビボの成長のSDZ RADに媒介される阻害;確立した腫瘍の治療を具体的に説明する三つ組のグラフである。EBV+ B細胞系15A(図5C)、20A(図5B)およびA1(図5A)由来の腫瘍の断片を、レシピエントのSCIDマウスに埋込んだ。1群あたりのマウスの数をカッコ内に示す。1日あたり体重1キログラムあたり5ミリグラムの薬物での治療を、腫瘍が直径0.4〜0.5cmに達した場合に開始した。
【図6】発明にかかる、図6A−6Cを含んで成る、悪性のPTLD様B細胞のインビボの成長のSDZ RADに媒介される阻害(すなわち腫瘍の成長の阻害)を具体的に説明する三つ組のグラフである。EBV+ B細胞系15A(図6C)、20A(図6B)およびA1(図6A)由来の腫瘍の断片を、レシピエントのSCIDマウスに埋込んだ。1群あたりのマウスの数をカッコ内に示す。1日あたり体重1キログラムあたり5ミリグラムの薬物での治療を、腫瘍埋込3日前に開始した。
【図7】発明にかかる、SDZ RADの化学構造を描く。
【図8】発明にかかる、本明細書に記述される方法で使用することができるO−メチル化ラパマイシン誘導体の化学式(すなわち式I)を描く。
【技術分野】
【0001】
本発明は、ヒト患者におけるリンパ増殖症候群(lymphoproliferative disorder)の緩和方法に関する。
【背景技術】
【0002】
(発明の背景)
エプスタイン−バーウイルス(EBV)に感染したBリンパ球の拡張を通常必要とする移植後リンパ増殖症候群(PTLD)は、移植片拒絶を阻害するため必要な免疫抑制療法の生命を脅かす合併症である(非特許文献1;非特許文献2)。PTLDは、ポリクローン性異型リンパ組織過形成からモノクローナル性の明白に悪性のB細胞リンパ腫までの範囲にわたる、リンパ増殖症候群の全スペクトルを含んで成る(非特許文献1;非特許文献2;非特許文献3;非特許文献4)。より少なく進行した形態のPTLDはより少なく攻撃的な経過の免疫抑制療法に応答する(非特許文献1;非特許文献5)。しかしながら、外来組織を拒絶しかつ破壊する身体の能力を無にする標準的免疫抑制薬の用量を低下させることは、移植片の生存を危険にさらす可能性がある。さらに、慣習的薬剤を用いる治療におけるこの改変は、移植片レシピエントに対し通常致死的である悪性のリンパ腫型のPTLDに対し有効でない。
【0003】
リンパ腫は有意の罹患率および死亡率の原因となり、米国単独で毎年50,000以上の新たな診断の原因である。多くのリンパ腫がホジキンもしくは非ホジキンのいずれかのリンパ腫であり、これらは末梢の成熟B、TもしくはNKリンパ腫から生じることができる。それらの自然の経過に基づき、非ホジキンリンパ腫は低、中間および高悪性度(grade)に分類される。低悪性度リンパ腫は通常ゆっくりと進行性であるが、しかし本質的に治療可能でない。中間および高悪性度リンパ腫の現在の5年の疾患のない治療後生存率はおよそ60%である。これらの攻撃的な型のリンパ腫は、治療に応答しない患者の迅速な死亡をもたらす。AIDSのような免疫無防備状態である患者および移植後患者で発生するリンパ腫の予後はとりわけ不良である。従って、リンパ腫の治癒率を向上させるための新たな治療様式が必要とされる。
【0004】
SDZ RAD(40−O−{2−ヒドロキシエチル}ラパマイシン)は、免疫抑制活性を表すラパマイシン誘導体の一分類の1つである(特許文献1;非特許文献6;非特許文献7;非特許文献8;非特許文献9;非特許文献10)。ラパマイシンを包含するこの分類の化合物は、正常なTリンパ球中にいくつかの作用点を有する。それらは、主として、IL−2レセプター(非特許文献11)および他のサイトカインレセプター(非特許文献12)により媒介される下流のシグナル伝達事象を阻害するが、しかしまた早期のG1期の細胞周期の進行にも影響を及ぼす(非特許文献13;非特許文献14)。SDZ RADおよび他のO−アルキル化ラパマイシン誘導体化合物により表される多くの側面をもつ免疫抑制活性は、これらの化合物を多目的に使える免疫抑制剤にする。
【0005】
リンパ腫およびPTLDのようなリンパ増殖症候群の重症度および頻度を制限するためのより有効な治療および予防方法に対する有意の必要性が存在する。本発明はこの必要性を満足する。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】PCT出願第WO 94/09010号明細書
【非特許文献】
【0007】
【非特許文献1】Morrisonら、1994、Am.J.Med.97:14−24
【非特許文献2】Warnkeら、1995、AFIP Fascicle 14:531−535
【非特許文献3】Curtisら、1999、Blood 94:2208−2216
【非特許文献4】Harrisら、1997、Semin.Diagn.Path.14:8−14
【非特許文献5】Sigalら、1992、Ann.Rev.Immunol.10:519−60
【非特許文献6】Schuurmanら、1997、Transplantation 64:32−5
【非特許文献7】Schulerら、1997、Transplantation 64:36−42
【非特許文献8】Sedraniら、1998、Transplant.Proc.30:2192−2194
【非特許文献9】Schuurmanら、1998、Transplant Proc.30:2198−2199
【非特許文献10】Hausenら、1999、J.Heart Lung Transplant 18:150−159
【非特許文献11】Seghal、1998、Clin.Biochem.31:335−340
【非特許文献12】Sakataら、1999、Immunology Letters 68:301−309
【非特許文献13】Teradaら、1993、J.Cell Physiol.154:7−15
【非特許文献14】Flanaganら、1993、Ann.N.Y.Acad.Sci.696:31−37
【発明の概要】
【0008】
(発明の要約)
本発明の方法は、図8の式Iに示される化学構造を有するラパマイシン誘導体を、該症候群を緩和するのに十分な量で該患者に投与することを含んで成る。好ましい一態様において、ラパマイシン誘導体は40−O−(2−ヒドロキシ)エチルラパマイシンである。多数の他の有用なラパマイシン誘導体(ラパマイシンそれ自身を包含する)を本開示に記述する。本方法を使用して緩和することができるリンパ増殖症候群は、例えば、PTLD、およびリンパ腫のようなリンパ腺癌を包含する。該方法はまた、免疫抑制療法(例えば組織移植に伴う免疫抑制療法)により引き起こされるもしくはそれによる患者の治療に伴うリンパ増殖症候群を緩和するのにも使用することができる。
【0009】
本発明に包含される別の方法において、リンパ増殖症候群が、こうした障害を発症する危険にさらされる患者(例えば免疫無防備状態の患者もしくは免疫抑制療法を受けている患者)で阻害もしくは予防される。
【0010】
これらの方法において、ラパマイシン誘導体は、免疫抑制剤のような第二の薬理学的有効成分と(単一の組成物中で、もしくは別個に投与される組成物中で)共投与することができる。免疫抑制剤は、移植片拒絶の阻害方法での使用について既知であり、そして、それらの既知の方法を、移植片を受領した患者に免疫抑制剤および本明細書で開示されるラ
パマイシン誘導体の双方を投与することにより改良することができる。
【0011】
本発明はまた、リンパ腺癌に苦しめられるヒト患者におけるリンパ腺腫瘍の転移の阻害方法も包含する。本方法は、式Iに示される化学構造を有するラパマイシン誘導体を、リンパ球増殖を阻害するのに十分な量で患者に投与することを含んで成る。
【0012】
別の局面において、本発明は、ある薬剤がヒト患者におけるリンパ増殖症候群を緩和もしくは阻害するために有用であるかどうかの評価方法を包含する。本方法は、Bリンパ球をエプスタイン−バーウイルスで形質転換すること、該リンパ球を重症の複合免疫不全を有するマウスに注入すること、該マウスに薬剤を投与すること、およびマウスにおける腫瘍の成長を最低約21日間監視することを含んで成る。腫瘍の退縮、腫瘍の根絶、および第二の腫瘍の非存在の1種もしくはそれ以上がマウス中で観察される場合には、これは、該薬剤が哺乳動物における移植後リンパ増殖症候群を緩和もしくは阻害するために有用であることの表示である。
【0013】
(発明の詳細な記述)
本発明は、ヒトのような哺乳動物におけるリンパ腫および移植後リンパ増殖症候群(PTLD)のようなリンパ増殖症候群の緩和もしくは阻害方法に関する。該方法は、哺乳動物におけるリンパ球の増殖を阻害するのに十分な量のSDZ RADのようなO−アルキル化ラパマイシン誘導体を哺乳動物に投与することを含んで成る。
【0014】
O−アルキル化ラパマイシン誘導体は移植片拒絶を阻害することが既知である。従って、ラパマイシン誘導体を、組織もしくは器官移植片(すなわち異種移植片)を受けた哺乳動物に投与する場合、これらの誘導体の1種の投与は移植片拒絶を阻害しかつPTLDを緩和もしくは予防することの双方ができる。PTLDの治療もしくは阻害のために、投与される量は移植片拒絶およびリンパ球の増殖の双方を阻害するのに十分であることができる。
【0015】
本明細書に記述されるもののようなO−アルキル化ラパマイシン誘導体を、リンパ腫を緩和もしくは予防するのに使用することができるという事実は、他者により以前に認識されていない。SDZ RADのようなO−アルキル化ラパマイシン誘導体は、リンパ腫以外の多様なリンパ増殖症候群(例えば慢性リンパ性白血病)で発生するようなリンパ球の増殖を阻害するのにもまた使用することができる。SDZ RADのようなO−アルキル化ラパマイシン誘導体は、インビトロもしくはインビボのいずれかで細胞中で細胞周期の停止もしくはアポトーシスを誘発するため、ならびにリンパ球の成長および増殖を阻害するために使用することができる。
【0016】
本明細書に記述される方法で有用であるO−アルキル化ラパマイシン誘導体は、それらの作成方法がそうであるように他者により記述されている。この点に関して、国際公開番号第WO 94/09010号を有するPCT特許出願が、引用することにより本明細書に組み込まれる。
【0017】
本開示に記述される方法で有用であるO−アルキル化ラパマイシン誘導体は、図8の式I(式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミ
ノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである)
に示される化学的構造を有するものを包含する。
【0018】
R1−R4の記述において、「アルク(alk−)」もしくは「アルキル」はC1−6アルキル部分を指し、該部分は分枝状もしくは直鎖状であり、また、好ましくはC1−3アルキル部分であり、ここで、炭素鎖は場合によってはエーテル(−O−)連結により中断されることができる(例えば、−CH2−CH2−O−CH2−)。R1−R4の記述において、「アル(ar−)」もしくは「アリール」はC5−8アリール部分を指し、該アリール部分は場合によっては炭素原子の代わりに1もしくは2個の窒素原子を有する。R1−R4の記述において、「アリル」は−CH2−CH=CH2を意味する。R1−R4の記述において、「アシル」はC1−6アルカノイル部分(すなわち、アルキル部分のメチレン部分{すなわち−CH2−}部分の代わりにカルボニル{すなわち−CO−}部分を有するアルキル部分)を指す。R1−R4の記述において、「アルキレン」はC1−6アルキレン部分を指し、該部分は分枝状もしくは直鎖状である。
【0019】
本開示に記述される方法での使用に適するO−アルキル化ラパマイシン誘導体の例は、・40−O−ベンジルラパマイシン、
・40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
・40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
・40−O−アリルラパマイシン、
・40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロプ−2’−エン−1’−イル]ラパマイシン、
・(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
・40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
・40−O−(2−ヒドロキシ)エチルラパマイシン、
・40−O−(3−ヒドロキシ)プロピルラパマイシン、
・40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
・40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
・40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
・40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
・40−O−(2−アセトキシ)エチルラパマイシン、
・40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
・40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
・40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
・40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
・39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
・(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
・28−O−メチルラパマイシン、
・40−O−(2−アミノエチル)ラパマイシン、
・40−O−(2−アセトアミノエチル)ラパマイシン、
・40−O−(2−ニコチンアミドエチル)ラパマイシン、
・40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
・40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
・40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
・40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
を包含する。
【0020】
本明細書に記述される方法での使用に好ましい化合物は、XおよびYが双方ともOであり、R2がHであり、R4がメチルであり、そしてR1がヒドロキシアルキル、ヒドロキシアルコキシアルキル、アシルアミノアルキルおよびアミノアルキルから選択される、40−O−置換ラパマイシンである。好ましい化合物の例は、40−O−(2−ヒドロキシ)エチルラパマイシン(すなわちSDZ RAD、その構造は図7に示される)、40−O−(3−ヒドロキシ)プロピルラパマイシン、40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシンおよび40−O−(2−アセトアミノエチル)ラパマイシンを包含する。ラパマイシンそれ自身(すなわち、R1およびR2がそれぞれ−Hであり、R4がメチルであり、そしてXおよびYのそれぞれがOである式Iの構造を有する化合物)もまた本明細書に記述される方法で使用することができる。
【0021】
定義
本明細書で使用されるところの、以下の用語のそれぞれは、本節でそれと関連する意味を有する。
【0022】
冠詞「a」および「an」は、該冠詞の文法上の目的語の1個もしくは1個以上(すなわち最低1個)を指すのに本明細書で使用する。例として、「1個の要素(an element)は、1個の要素もしくは1個以上の要素を意味する。
【0023】
細胞の成長、細胞周期の進行、増殖もしくは腫瘍形成のような細胞中での過程は、細胞への組成物の投与もしくは細胞への治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった細胞中での同一の過程に関して該過程が変えられる場合に、該組成物もしくは該治療方法により「阻害」される。例えば、細胞中での増殖のレベルが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない細胞中での増殖のレベルに比較して減少される場合には、該組成物は細胞中での増殖を阻害する。
【0024】
腫瘍の成長、腫瘍の確立、リンパ増殖性応答もしくは移植片拒絶のような哺乳動物における過程は、哺乳動物への組成物の投与もしくは哺乳動物での治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった哺乳動物における同一の過程に関して該過程の速度もしくは大きさが減少される場合に、該組成物もしくは該治療方法により「阻害」される。例えば、哺乳動物におけるリンパ球の増殖のレベルが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない哺乳動物におけるリンパ球の増殖のレベルに比較して減少される場合には、該組成物は哺乳動物におけるリンパ球の増殖を阻害する。
【0025】
アポトーシスもしくは細胞周期の停止のような細胞中での過程は、細胞への組成物の投与もしくは細胞での治療方法の使用に際して、該組成物が投与されなかったかもしくは該治療方法が使用されなかった細胞中での過程に関して細胞中での該過程のレベルが増大される場合に、該組成物もしくは該治療方法により「誘導」される。例えば、細胞中でのアポトーシスの程度、レベルもしくは見込みが、SDZ RADを含んで成る組成物の投与後に、該組成物が投与されない細胞中でのアポトーシスの程度、レベルもしくは見込みに
比較して増大される場合には、該組成物は細胞中でのアポトーシスを誘導する。
【0026】
本明細書で使用されるところの「製薬学的に許容できる担体」という用語は、それとO−アルキル化ラパマイシン誘導体を組み合わせることができ、かつ、組み合わせ後に被験体に該ラパマイシン誘導体を投与するのに使用することができる、化学的組成物を意味する。
【0027】
本明細書で使用されるところの「生理学的に許容できる」エステルもしくは塩という用語は、製薬学的組成物のいずれの他の成分とも適合性でありかつ該組成物が投与されるはずである被験体に対し有害でない、エステルもしくは塩の形態のO−アルキル化ラパマイシン誘導体を意味する。
【0028】
本明細書で使用されるところの、製薬学的組成物の「非経口投与」は、被験体の組織の物理的破壊、および組織中の裂け目を通っての該製薬学的組成物の投与を特徴とするいずれの投与経路も包含する。従って、非経口投与は、限定されるものでないが、製薬学的組成物の注入、外科的切開による該組成物の適用、組織を貫通する非外科的創傷による該組成物の適用などによる該組成物の投与を挙げることができる。とりわけ、非経口投与は、限定されるものでないが、皮下、腹腔内、筋肉内、胸骨内の注入、および腎臓透析注入技術を挙げることができる。
【0029】
第一の薬理学的薬剤および第二の薬理学的薬剤は、その間の第一の作用物質に帰される薬理学的効果が少なくともその最大値の半分である期間が、その間の第二の薬剤に帰される薬理学的効果が少なくとのもの最大値の半分である期間と重なり合う時間に、2種の薬剤を十分に緊密に投与する場合に「共投与」される。共投与される薬剤は、該薬剤を含有する単一の組成物中で投与することができるか、もしくはそれらは別個の組成物中で投与することができる。
【0030】
本明細書で使用されるところの「アポトーシスの誘導」という用語は、プログラムされた細胞死の過程を細胞に開始もしくは加速させる過程を意味する。
【0031】
障害は、該障害もしくはその症状の1つの重症度、または該障害もしくはその症状の1つが患者により経験される頻度が低下される場合に、「緩和」される。
【0032】
障害は、該障害もしくはその症状の1つの発生が、治療の非存在下でのその発生に関して遅延もしくは予防される場合に、該治療により「阻害」される。
【0033】
記述
本発明は、哺乳動物におけるリンパ増殖症候群を緩和もしくは治療するためのO−アルキル化ラパマイシン誘導体の使用方法に関する。本明細書に記述される方法を使用して緩和もしくは阻害することができるリンパ増殖症候群は、移植後リンパ増殖症候群(PTLD)、リンパ腫および他の障害を包含する。本方法は、障害を阻害するのに十分な量のO−アルキル化ラパマイシン誘導体を哺乳動物に投与することを含んで成る。リンパ増殖症候群および移植片拒絶の双方に苦しめられる患者において、該症候群および移植片拒絶の双方を緩和もしくは阻害するのに十分な量の誘導体を投与することができる。例えば、移植片(すなわち移植された組織もしくは器官)の拒絶およびPTLDの双方を同時に緩和することができる。
【0034】
PTLDは、ポリクローン性異型リンパ組織過形成からモノクローナル性の明白に悪性のB細胞リンパ腫までの範囲にわたる広範なスペクトルのリンパ増殖症候群を含んで成る。こうした障害の例は当該技術分野で記述されており(例えば、Morrisonら、1
994、Am.J.Med.97:14−24;Warnkeら、1995、AFIP Fascicle 14:531−535;Curtisら、1999、Blood 94:2208−2216;Harrisら、1997、Semin.Diagn.Path.14:8−14)、そして当業者により同定することができる。
【0035】
本明細書に記述される方法が有用であるリンパ増殖症候群の一分類は、エプスタイン−バーウイルス(EBV)によるリンパ球の感染を特徴とする障害である。EBVに感染したリンパ球の増殖は、免疫抑制療法の頻繁な合併症であり、そして、従って、ときに移植片拒絶の予防、癌に関係した化学療法もしくは他の免疫抑制性の医学的介入に関連した免疫抑制の間に起こる。さらに、EBVに感染したリンパ球の増殖は、AIDSもしくは他の免疫障害に苦しめられる患者のような免疫無防備状態の患者で加速される可能性がある。本明細書に記述されるO−アルキル化ラパマイシン誘導体は、これらの他の免疫系に影響を及ぼす障害もしくは治療の1つの治療の前、後もしくは間に使用することができる。例えば、免疫抑制療法を受けるはずである患者に、免疫抑制療法の間のリンパ球の増殖を阻害もしくは予防するために、最初に(すなわち数分、数時間、数日もしくは数週間前に)1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)を投与することができる。1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)は、治療の間のリンパ球の増殖を低下もしくは予防するために、免疫抑制療法の経過の間に共投与(すなわち、単一の組成物中で、または時間が緊密にもしくは交互に投与される別個の組成物中で)することができる。誘導体(1種もしくは複数)は、もしあるとしても治療の前に投与される同一のもの(1種もしくは複数)である必要はない。同様に、1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)はまた(もしくは代わりに)、治療後のリンパ球増殖およびそれに伴う症状を緩和、阻害もしくは予防するために、免疫抑制療法を受けた患者に投与することもできる。
【0036】
本発明の範囲内に包含される特定の一方法は、ヒトの身体中もしくは身体上への組織(すなわち同種移植片もしくは異種移植片)の移植前にヒトにSDZ RADを投与することを含んで成る。こうした投与は、移植の前、間もしくは後、またはこれらのいずれかの組み合わせで起こることができる。例として、SDZ RADは、同種異系の腎移植片を受領する前、間および後にヒト患者に投与することができる。移植片の他の例は、同種異系の心、腎および肝移植片、心臓弁、血管移植片、皮膚移植片、硬膜移植片、心膜移植片、軟骨移植片および埋没物、ならびに異種移植片を包含する。
【0037】
組織移植に関連する可能性がある(しかししばしば関連しない)リンパ増殖症候群の別の型は、リンパ腫およびリンパ性白血病を包含するリンパ腺癌である。リンパ性白血病は急性および慢性リンパ性白血病のような障害を包含する。リンパ腫はリンパ球増殖を特徴とする広範な癌を包含する。リンパ腫の例は、AIDS関連リンパ腫、ホジキンリンパ腫(ときにホジキン病と呼称される)、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、T細胞リンパ腫および皮膚T細胞リンパ腫を包含する。
【0038】
患者が疾患と診断されているか疾患の症状を表しているかに関係なく、とりわけ患者が免疫抑制療法を受けることを期待される場合、もしくは患者が免疫を危うくする障害を発症する特定の危険にさらされている場合は、EBVに感染したリンパ球をもつ患者にとって、リンパ球増殖を阻害することが望ましい可能性がある。こうした患者は、該患者からリンパ球を単離すること、およびそれらのリンパ球中のEBVゲノムの全部もしくは一部の存在もしくは非存在を評価することにより同定することができる。EBVが検出される場合、ラパマイシンもしくはO−アルキル化ラパマイシン誘導体の投与を指示することができる。
【0039】
リンパ増殖症候群を阻害もしくは緩和するための本明細書に記述される方法は、哺乳動物にラパマイシンもしくはO−アルキル化ラパマイシン誘導体を投与することを含んで成る。該化合物が投与される正確な形態は決定的に重要でなく、多数の製薬学的組成物、投薬形態、ならびに製薬学的に許容できる担体および賦形剤が、当該技術分野で既知である。哺乳動物に投与される製剤は、唯一の有効成分としてラパマイシン誘導体を含有することができるか、または、それは1種もしくはそれ以上の他の有効成分(例えば、アザチオプリン、ミコフェノール酸モフェティルのようなミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドのような免疫抑制剤)と混合することができる。
【0040】
本発明は、有効成分として1種もしくはそれ以上のO−アルキル化ラパマイシン誘導体(ラパマイシンを包含する)を含んで成る医薬および製薬学的組成物の製造法および使用を包含する。こうした製薬学的組成物は、被験体への投与に適する形態の有効成分単独から成ってよいか、あるいは、製薬学的組成物は、有効成分および1種もしくはそれ以上の製薬学的に許容できる担体、1種もしくはそれ以上の付加的成分、またはこれらのなんらかの組み合わせを含んでよい。これらの製薬学的組成物の1つの被験体への投与は、本開示の別の場所で記述されるとおり、被験体におけるリンパ球の増殖を阻害するために有用である。有効成分は、当該技術分野で公知であるとおり、生理学的に許容できる陽イオンもしくは陰イオンとの組み合わせでのような生理学的に許容できるエステルもしくは塩の形態で、製薬学的組成物中に存在してよい。
【0041】
本明細書に記述される製薬学的組成物の製剤は、既知のもしくは薬理学の技術分野で今後開発されるいずれの方法により製造されてもよい。一般に、こうした準備方法は、有効成分を担体または1種もしくはそれ以上の他の付属成分との連合にすること、およびその後、必要なもしくは望ましい場合は、生成物を所望の単独もしくは複数用量単位に造形もしくは包装することの段階を包含する。
【0042】
本明細書に提供される製薬学的組成物の記述は、原則として、ヒトへの医師の処方による投与に適する製薬学的組成物に向けられるとは言え、こうした組成物が一般に他の哺乳動物への投与に適することが、当業者により理解されるであろう。該組成物を動物への投与に適するようにするための、ヒトへの投与に適する製薬学的組成物の改変は十分に理解されており、また、普通に熟練した家畜薬理学者は、もしあるとしても単に普通の実験だけを用いてこうした改変を設計かつ実施することができる。本発明の製薬学的組成物の投与が企図される被験者は、限定されるものでないがヒトおよび他の霊長類、ならびに畜牛、ブタ、ウマ、ヒツジ、ネコおよびイヌのような商業的に関連性のある哺乳動物を包含する哺乳動物を挙げることができる。
【0043】
本発明の方法で有用である製薬学的組成物は、経口、直腸、膣、非経口、局所、肺、鼻内、口腔内、眼もしくは別の投与経路に適する製剤で製造、包装もしくは販売してよいとは言え、非経口投与が、リンパ増殖症候群を緩和、阻害もしくは予防する目的上のラパマイシン誘導体の最も容易に有効な投与方法であることが企図される。
【0044】
本発明の製薬学的組成物は、バルクで、単一の単位用量として、もしくは複数の単一の単位用量として製造、包装もしくは販売してよい。本明細書で使用されるところの「単位用量」は、予め決められた量の有効成分を含んで成る別個の量の製薬学的組成物である。有効成分の量は、一般に、被験体に投与されるとみられる有効成分の投薬量、または例えばこうした投薬量の1/2もしくは1/3のようなこうした投薬量の便宜的な一部分に等しい。
【0045】
本発明の製薬学的組成物中の有効成分、製薬学的に許容できる担体、およびいかなる付
加的成分の相対量も、治療される被験体の正体、大きさおよび病状に依存して、ならびに該組成物が投与されるはずである経路にさらに依存して、変動することができる。例として、該組成物は0.1%と100%(w/w)の間の有効成分を含んでよい。本発明の製薬学的組成物の単位用量は、一般に約50マイクログラムから約50ミリグラムまでの有効成分を含むことができ、また、好ましくは約500マイクログラムから約10ミリグラムまでの有効成分を含んで成る。一般に、O−アルキル化ラパマイシン誘導体は、ラパマイシンの現在使用される量(例えば、単位用量あたり1〜5ミリグラム)と同一の桁の量で使用することができる。
【0046】
有効成分に加え、本発明の製薬学的組成物は、1種もしくはそれ以上の付加的な製薬学的有効成分をさらに含んでよい。とりわけ企図される付加的薬剤は、アザチオプリン、ミコフェノール酸モフェティルのようなミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドのような免疫抑制剤を包含する。
【0047】
本発明の製薬学的組成物の制御放出もしくは徐放性製剤は、慣習的技術を使用して作成してよい。
【0048】
非経口投与に適する製薬学的組成物の製剤は、滅菌水もしくは滅菌の等張の生理学的食塩水のような製薬学的に許容できる担体と組み合わせられた有効成分を含んで成る。こうした製剤は、ボーラス投与もしくは連続投与に適する形態で製造、包装もしくは販売してよい。注入可能な製剤は、アンプル、保存剤を含有する複数用量の容器、または自動注入もしくは医師による注入のための単回使用装置でのような単位投与剤形で製造、包装もしくは販売してよい。非経口投与のための製剤は、限定されるものでないが、懸濁剤、溶液、油性もしくは水性ベヒクル中の乳剤、パスタ剤、および埋込可能な徐放性もしくは生物分解可能な製剤を挙げることができる。こうした製剤は、限定されるものでないが懸濁化剤、安定剤もしくは分散剤を挙げることができる1種もしくはそれ以上の付加的成分をさらに含んでよい。非経口投与のための製剤の一態様において、有効成分は、再構成される組成物の非経口投与前の適するベヒクル(例えば滅菌の発熱性物質を含まない水)との再構成のための乾燥した(すなわち粉末もしくは顆粒の)形態で提供される。
【0049】
該製薬学的組成物は、滅菌の注入可能な水性もしくは油性の懸濁剤もしくは溶液の形態で製造、包装もしくは販売してよい。本懸濁剤もしくは溶液は既知技術に従って処方してよく、また、有効成分に加えて、本明細書に記述される分散剤、湿潤剤もしくは懸濁化剤のような付加的成分を含んでよい。こうした滅菌の注入可能な製剤は、例えば水もしくは1,3−ブタンジオールのような非毒性の非経口で許容できる希釈剤もしくは溶媒を使用して製造してよい。他の許容できる希釈剤および溶媒は、限定されるものでないがリンゲル液、等張の塩化ナトリウム溶液、および合成のモノもしくはジグリセリドのような不揮発性油を挙げることができる。有用である他の非経口で投与可能な製剤は、微晶質の形態で、リポソーム製剤中に、もしくは生物分解可能なポリマー系の成分として有効成分を含んで成るものを包含する。徐放性もしくは埋込のための組成物は、乳剤、イオン交換樹脂、乏しく可溶性のポリマーもしくは乏しく可溶性の塩のような、製薬学的に許容できるポリマー性もしくは疎水性物質を含んでよい。
【0050】
本明細書で使用されるところの「付加的成分」は、限定されるものでないが、以下、すなわち、賦形剤;界面活性剤;分散剤;不活性希釈剤;顆粒化および崩壊剤;結合剤;滑沢剤;甘味料;着香料;着色料;保存剤;ゼラチンのような生理学的に分解可能な組成物;水性のベヒクルおよび溶媒;油性のベヒクルおよび溶媒;懸濁化剤;分散もしくは湿潤剤;乳化剤、緩和剤;緩衝剤;塩;増粘剤;増量剤;乳化剤;抗酸化剤;抗生物質;抗真菌剤;安定剤;ならびに、製薬学的に許容できるポリマー性もしくは疎水性物質の1種も
しくはそれ以上を挙げることができる。本発明の製薬学的組成物中に包含してよい他の「付加的成分」は当該技術分野で既知であり、かつ、例えば、Genaro編、1985、Remington’s Pharmaceutical Sciences、マック パブリッシング カンパニー(Mack Publishing Co.)、フィラデルフィア州イーストン(引用することにより本明細書に組み込まれる)に記述される。
【0051】
本発明の製薬学的組成物は、被験者に1日あたり体重1キログラムあたり10マイクログラムと1日あたり体重1キログラムあたり1.5ミリグラムとの間の用量を送達するように、および、また、好ましくは1日あたり体重1キログラムあたり20と700マイクログラムとの間の用量を送達するように投与してよい。成体のヒトについては、1日あたり0.1ないし50ミリグラムのラパマイシンもしくはO−アルキル化ラパマイシン誘導体、および好ましくは1日あたり1ないし10ミリグラムの有効成分の投与が企図される。
【0052】
普通に熟練した医師もしくは獣医師は、被験体におけるリンパ増殖症候群を緩和もしくは阻害するのに有効な量の化合物を容易に決定かつ処方することができることが理解される。そうした処置において、医師もしくは獣医師は、例えば、最初に比較的低用量で処方してよく、その後適切な応答が得られるまで用量を増大させる。しかしながら、いずれかの特定の被験体に特定の用量レベルは、使用される特定の化合物の活性、被験体の齢、体重、全身的健康状態、性別および食餌、投与の時間、投与経路、排泄の速度、いずれかの薬物の組み合わせ、ならびに治療もしくは阻害されているリンパ増殖症候群の重症度を包含する多様な因子に依存することができることがさらに理解される。
【0053】
本発明の別の局面は、本発明の製薬学的組成物および説明書資材を含んで成るキットに関する。本明細書で使用されるところの「説明書資材」は、リンパ球の増殖を阻害する、またはリンパ増殖症候群を緩和もしくは阻害するための本発明の製薬学的組成物の有用性を伝達するのに使用される表現の刊行物、録音、図もしくはいずれかの他の媒体を包含する。説明書資材は、例えば、本発明の製薬学的組成物の適切な用量もまた記述することができる。本発明のキットの説明書資材は、例えば、本発明の製薬学的組成物を含有する容器に添付してよいか、もしくは、該製薬学的組成物を含有する容器と一緒に発送してよい。あるいは、説明書資材を、該説明書資材および製薬学的組成物が受領者により協調的に使用されるという意図をもって容器と別個に発送することができる。
【0054】
別の態様において、本発明は、哺乳動物における腫瘍の確立を阻害するためのSDZ RADのようなO−アルキル化ラパマイシン誘導体もしくはラパマイシンの使用方法を包含する。本方法は、第一の腫瘍を有する哺乳動物に、該哺乳動物中での第一の腫瘍由来の第二の腫瘍の確立を阻害するのに十分な量のラパマイシン誘導体を投与することを必要とする。本目的上O−アルキル化ラパマイシン誘導体で治療されるべき哺乳動物は、脳、腎、肝、乳房もしくは卵巣の腫瘍のような実質的にいかなる型の第一の腫瘍も有することができる。SDZ RADのようなO−アルキル化ラパマイシン誘導体により表されることができる他の代表的抗腫瘍活性は、腫瘍形成の阻害、転移の阻害、腫瘍細胞の成長の阻害、腫瘍細胞の増殖の阻害、および腫瘍細胞の死の誘導を包含する。
【0055】
代替の態様において、本発明は、本化合物により表される抗増殖、抗腫瘍および免疫抑制活性に関する生物学的過程に影響を及ぼしかつ治療応答を導き出すための、SDZ RADのようなO−アルキル化ラパマイシン誘導体の使用方法に関する。これらの方法は、例えば、アポトーシスを誘導するため、細胞増殖を阻害するため、または抗腫瘍、抗PTLDもしくは免疫抑制の目的上、該誘導体を使用することを包含する。従って、該誘導体は、これらの過程を伴う障害を阻害する(すなわち、改善、予防、または重症度、頻度、速度もしくは程度を低下する)のに使用することができる。有効な抗増殖剤として、O−
アルキル化ラパマイシン誘導体は、過剰もしくは別の方法で不適切な細胞の増殖を特徴とする、実質的にいかなる障害も緩和するために有用である可能性がある。障害の例は、自己免疫疾患、アレルギー、他の超免疫障害、アテローム硬化症を包含する。
【0056】
本発明は、哺乳動物におけるリンパ増殖症候群を緩和もしくは阻害するために有用である薬剤の同定方法を包含する。本方法は、Bリンパ球をEBVに曝露することによりそれを形質転換することを含んで成る。こうした曝露は標準的な試薬および技術を使用し、かつ、リンパ球を形質転換することができるEBVのいずれかの入手可能な株を使用して実施することができる。本方法に有用なBリンパ球は、例えばヒトドナーから得ることができる。形質転換されたBリンパ球を、SCIDマウスのような重症の複合免疫不全を有するマウスに注入する。形質転換されたリンパ球は、マウスに腹腔内でもしくは皮下に注入することができる。好ましくは、形質転換されたBリンパ球の注入は皮下である。抗リンパ増殖活性を潜在的に表す薬剤もまた該マウスに投与する。該マウスにおける腫瘍の成長を、約21日間のような選択された時間の期間の間監視する。腫瘍の成長もしくは発生の阻害は、該薬剤が抗リンパ増殖活性を表すことの表示である。
【0057】
本発明の一態様において、潜在的な抗リンパ増殖剤を、形質転換されたBリンパ球の注入前にSCIDマウスに投与する。例として、SDZ RADのような薬剤を、形質転換されたBリンパ球をマウスに注入する前に最低約10日間、および好ましくは最低約3日間、1日あたり1キログラムあたり5ミリグラムの用量でSCIDマウスに投与することができる。
【0058】
本方法の別の態様において、潜在的な抗リンパ増殖剤を、形質転換されたBリンパ球の注入およびマウス中での生じる腫瘍の発生後にSCIDマウスに投与する。本態様において、形質転換されたBリンパ球の注入の後に、マウス中での生じる腫瘍の成長を監視する最低約21日、およびほぼ第21日後に開始するマウスへの潜在的抗リンパ増殖剤の投与が続く。例として、SDZ RADのような薬剤を、注入後約第21日に開始して1日あたり1キログラムあたり5ミリグラムの用量でSCIDマウスに投与することができる。
【0059】
本明細書に記述される方法を使用して、抗リンパ増殖活性を有するとしての薬剤の評価は、注入されたマウスにおける腫瘍の退縮(すなわち、該薬剤での治療の開始に関して腫瘍の大きさの低下)、腫瘍の根絶、および第二の腫瘍の非存在の証拠に基づくことができる。同様に、ある薬剤は、注入されたマウスが、腫瘍の成長(すなわち腫瘍の大きさの増大)もしくは第二の腫瘍の発生またはその双方を表す場合に、実質的な抗リンパ増殖活性を有しない。
【0060】
他の態様において、抗リンパ増殖剤の本明細書に記述される同定方法はまた、哺乳動物における腫瘍の確立を阻害することが可能な(例えば、リンパ腺腫瘍の拡がりもしくは転移を阻害することが可能な)薬剤を同定するのにも有用である。例えば、哺乳動物中での腫瘍の確立を阻害する薬剤は、Bリンパ球をEPVに曝露すること(その結果、形質転換されたBリンパ球が生成される)、SCIDマウスのような重症の複合免疫不全を有するマウスに該薬剤を投与すること、形質転換されたBリンパ球を該マウスに注入すること、および選択された期間(例えば最低約21日)の間、マウスにおける腫瘍の成長を監視することにより同定することができる。腫瘍の確立を阻害することが可能な薬剤は、注入されたマウス中での腫瘍の退宿、腫瘍の根絶および第二の腫瘍の非存在の1種もしくはそれ以上を引き起こすことができる。腫瘍の確立を阻害することが可能でない薬剤は、腫瘍の成長および二次的腫瘍の発生に関して、注入されたマウスに対する観察可能な影響を有しないことができる。
【0061】
上述された方法に関して、腫瘍の成長もしくは退縮の測定、Bリンパ球の注入、および
潜在的抗PTLD薬剤を試験するための適切な投薬量の決定のための手順は、免疫薬理学の当業者の能力内にある。本開示を読みかつ本明細書に提供される実施例1の詳細を吟味した結果、抗リンパ増殖活性を表すもしくは腫瘍の確立を阻害することが可能である化合物を同定するために本発明の方法を使用することは、当業者にとって単純な事柄である。
【0062】
本発明は今や、以下の実施例に関して記述される。これらの実施例は具体的説明のみの目的上提供され、また、本発明はこれらの実施例に制限されないが、しかしむしろ、本明細書に提供される教示の結果として明白である全部の変形物を包含する。
【実施例】
【0063】
実施例1
SDZ RADは、インビトロおよびインビボでのヒトのEBVで形質転換されたBリンパ球の成長を阻害する。
本実施例に提示される実験は、SDZ RADが強力な抗拒絶、抗リンパ増殖剤であり、かつ、移植後リンパ増殖症候群(PTLD)の阻害および治療への新規アプローチを表すことを立証する。
【0064】
本実施例に提示される実験で使用された材料および方法を今や記述する。
【0065】
本研究で使用された大部分の細胞系は、末梢血単核球(PBMC)のEBVへのインビトロ感染により得られたリンパ芽球状B細胞系であった。細胞系A1およびA2D6は正常な健康な個体から得た。細胞系15Aおよび20Aは、モノクローナル性のコールドのアグルチニンを用いて低悪性度B細胞リンパ腫を伴う2名の異なる患者から得た(Silbersteinら、1991、Blood 78:2372−2386)。双方の系統は、患者の血清中で見出されるコールドのアグルチニンと同一の特異性をもつコールドのアグルチニンを分泌した(Silbersteinら、1991、Blood 78:2372−2386)。さらに、20A細胞系は低悪性度リンパ腫でみられる細胞発生の異常を表した(48、XX、+3、+12、Silbersteinら、1991、Blood 78:2372−2386による)。LCL B細胞系は進行性皮膚T細胞リンパ増殖症候群を伴う患者から得た(Zhangら、1996、Proc.Natl.Acad.Sci.USA 93:9148−9153)。BC−1は腹膜滲出液B細胞リンパ腫(PEL)由来であり、そして、EBVに加えて、HHSV8ウイルスをもつ(Cesarmanら、1995、Blood 86:2708−2714)。インビトロ成長阻害アッセイで対照として使用された他の3細胞系は、HTLV−I(+)T細胞系ATL−2(Maedaら、1985、Exp.Med.162:2169−2174);C10MJ2(Popovicら、1983、Science 219:856−859);および、成人T細胞白血病/リンパ腫(ATLL)を伴う患者由来のHUT102B(Poiescz、1980、Proc.Natl.Acad.Sci.USA 77:7415−7419;Bunnら、1996、J.Cell.Biochem.Suppl 24:12−23)であった。それらはわれわれにより、SDZ RADおよび関係した免疫抑制性マクロライド、ラパマイシンに対し非応答性であることが示された(Zhangら、1999、Leukemia Res.23:373−384)。全部の細胞系を、標準培地、すなわち10%(v/v)熱不活性化ウシ胎児血清(バイオウィッタカー(BioWhittaker)、メリーランド州ウォーカーズビル)、1%ペニシリン/ストレプトマイシン/フンギゾン混合物(ギブコ BRL(Gibco BRL))および2ミリモル濃度のL−グルタミン(ギブコ BRL(Gibco BRL))を補充されたRPMI培地1640(ギブコ BRL(Gibco BRL)、ニューヨーク州グランドアイランド)中で、5%CO2を含有する雰囲気中、37℃の加湿されたインキュベーター中で維持した。
【0066】
SDZ RADによるインビトロの細胞の成長の阻害を評価するためのアッセイを、記述されたとおり(Zhangら、1999、Leukemia Res.23:373−384;Zhangら、1996、Proc.Natl.Acad.Sci.USA 93:9148−9153)実施した。簡潔には、細胞系を、多様な濃度のSDZ RAD(ノバルティス ファーマ(Novartis Pharma)、バーゼル)の存在下にウェルあたり2×104個の細胞で三重で32時間培養した。0.5マイクロキュリーの3H−チミジン(ニュー イングランド ニュークリア(New England Nuclear)、マサチューセッツ州ボストン)を細胞に適用しかつ細胞を次の18時間培養した後に、細胞中への放射性同位体の取込みを測定した。増殖アッセイの結果は、三重の培養物の平均の放射活性として表した。三重内の標準偏差は<15%であった。
【0067】
細胞周期の阻害およびアポトーシスの検出。
検査されるべき細胞系を、数種の濃度のSDZ RAD(0ないし10ナノモル濃度)とともに24〜48時間培養した。細胞を、DPBS、および3% PEG 6000、1ミリリットルあたり50マイクログラムのDNA蛍光色素、ヨウ化プロピジウム(PI;カルバイオケム(Calbiochem)、カリフォルニア州サンディエゴ)、記述されたようなアネキシン V−FITC(Douglasら、1998、Cytometry 32:57−65)0.1%(v/v)トリトン[TRITON](商標)X(シグマ(Sigma)、ミズーリ州セントルイス)、4ミリモル濃度のクエン酸緩衝液pH7.8、および1ミリリットルあたり360単位のRNアーゼA(ワーシントン バイオケミカルズ(Worthington Biochemicals)、ニュージャージー州フリーホールド)を含有する染色溶液(pH7.2)で、37Cで30分間洗浄した。次に、塩溶液pH7.2(3% w/v PEG 6000、1ミリリットルあたり50マイクログラムのPI、0.1% v/v トリトン[TRITON](商標)Xおよび0.4モル濃度のNaCl)を添加し、そして細胞を、記述されたとおり(Douglasら、1998、Cytometry 32:57−65;Kawamataら、1998、Blood 91:561−569;Pepperら、1998、Leuk.Res.22:439−444)、フローサイトメトリー分析を実施する前に4℃で暗所で1時間インキュベートした。
【0068】
5ないし7週齢の免疫不全SCIDマウス(C.B−17およびICR)をタコニック(Taconic)(ニュージャージー州ジャーマンタウン)から購入し、そして層流空気流設備中、発熱性物質を含まない条件下で、ペンシルバニア大学動物施設(the University of Pennsylvania Animal Facility)で収容し、かつ、滅菌の飼料および水を供給した。毒性試験においては、5−7週齢の近交系BALB/cマウス(タコニック(Taconic))を、SCIDマウスに加えて使用した。
【0069】
異種移植された腫瘍の確立および接種は記述された(Douglasら、1998、Cytometry 32:57−65;Kawamataら、1998、Blood 91:561−569;Pepperら、1998、Leuk.Res.22:439−444)とおり実施した。マクロファージおよびNK細胞を枯渇させかつ腫瘍の生着を高めるために、SCIDマウスに、ヒトEBV+ B細胞系の埋込4日前に1キログラムあたり30〜45ミリグラムのエトポシド(ベッドフォード ラボラトリーズ(Bedford Laboratories)、オハイオ州ベッドフォード)を腹腔内に注入した(Visonneauら、1998、Am.J.Path.152:1299−1311)。使用された各系統の1,000万個の細胞を、200マイクロリットルのダルベッコリン酸緩衝生理的食塩水(DPBS;バイオウィッタカー(BioWhittaker)、メリーランド州ウォーカーズビル)中で、腹腔内もしくは皮下のいずれかでマウスに接種した。複水もしくは触知できる皮下腫瘍が、細胞注入3〜5週間後に発生した。
【0070】
腫瘍の治療および成長の阻害の実験は、確立した皮下腫瘍の断片を使用して実施した(Pasqualucciら、1995、Blood 85:2139−2146、Visonneauら、1998、Am.J.Path.152:1299−1311)。本目的上、マウスを、1キログラムあたり100ミリグラムの腹腔内注入によりケタラール[KETALAR](商標)(ケタミン、パーク−デービス(Parke−Davis)、ニュージャージー州モリスプレインズ)で麻酔した。次に、原発性腫瘍を無菌的に取り出し、そして壊死、脂肪および結合組織から開放し、そしてだいたい等しい大きさの小片に分割し、かつ、マウスあたり3〜4片を皮下に注入した。SDZ RADでの確立した腫瘍の治療は、腫瘍が直径5ミリメートルに達した場合に開始した。成長の阻害の実験においては、治療を腫瘍埋込3日前に開始した。全実験における腫瘍体積は、等式:体積=0.4ab2(式中、aおよびbはそれぞれ腫瘍の長および短直径を表す)から決定した。移植されたマウスを、2ヶ月までの期間の間、腫瘍の成長について監視した。1キログラムあたり5ミリグラムのSDZ RADを、記述された(Schuurmanら、1997、Transplantation 64:32−5;Schulerら 1997、Transplantation 64:36−42)とおり胃管栄養法により1日1回投与した。
【0071】
マウスを、薬物毒性試験の第29日、腫瘍成長阻害試験の第40〜55日、または腫瘍がおよそ直径2センチメートルに到達した場合、または皮膚の潰瘍、重症の呼吸困難、衰弱もしくは嗜眠の兆候が出現した場合に、ホラン[FORANE](商標)(イソフルラン、オーメダ(Ohmeda)、ニュージャージー州リバティプレイス)への曝露により殺した。完全な剖検を、それらの出現に関係なく試験の終了時に全部のマウスで実施した。腫瘍および内部器官(脾、肝、肺、心、腎、小腸および大腸、骨髄のための大腿骨)を10%(v/v)ホルマリン中で固定し、パラフィンに埋込み、0.4ミクロンの切片に切断し、スライドガラスに移し、そしてヘマトキシリンおよびエオシンで染色した。代表的な腫瘍断片を、商業的に入手可能な試薬(リサーチ ジェネティックス(Research Genetics)、アラバマ州ハンツビル)、抗体すなわち抗CD20(L−26)およびLMP−1(双方はダコー(DAKO)、カリフォルニア州カルピンテリアから)ならびにKi67(mib1;イムノテック(Immunotech)、メーン州ウェストブルック)を使用する、標準的ストレプトアビジン−ビオチン複合体技術により免疫組織化学的に染色した。EBVにコードされるRNA(EBER−1)、そして商業的に入手可能な試薬を使用して検出した。
【0072】
本実施例で提示される実験の結果を今や記述する。
【0073】
SDZ RADはインビトロでEBV+ B細胞の成長を阻害する
SDZ RADがPTLDを模倣する細胞の増殖を阻害することができるかどうかを決定するために、6種の異なるEBV+ B細胞系を、多様な濃度の薬物の存在下にインビトロで培養した。SDZ RADに抵抗性の3種のHTLV−I+ T細胞系(Zhangら、1999、Leukemia Res.、23:373−384)を対照として使用した。図1に示されるとおり、全部のPTLD様EBV+ B細胞系はSDZ RADに非常に感受性であった。約1ナノモル濃度程度のSDZ RADの用量が、全細胞系で成長の60〜95%阻害を生じさせた。本結果は、刺激された正常なT細胞の阻害に匹敵した(Schuurmanら、1997、Transplantation 64:32−5;Bohlerら、1998、Transplant.Proc.30:2195−2197)。応答の程度における若干の微妙な差異が、EBV+ B細胞系の間で示された。B細胞リンパ腫を伴う患者由来の、ならびに従って進行した形態のPTLDにより類似する系統(15A、20AおよびBC−1;材料および方法を参照されたい)は、より低い程度の阻害(80〜90%)を示す傾向があった。正常なB細胞から得られた細胞系
(すなわち、より少なく進行した型のPTLDを模倣する)はより大きく阻害された(90〜100%)。該細胞系に、0〜10ナノモル濃度のSDZ RADとともにの32時間培養後に、トリチウム化チミジンを18時間適用した。
【0074】
SDZ RADはEBV+ B細胞における細胞周期の進行を封鎖する
ラパマイシン、およびおそらくSDZ RADのようなO−アルキル化ラパマイシン誘導体は、正常なT細胞において細胞周期の進行を初期段階で封鎖する(Teradaら、1993、J.Cell Physiol.154:7−15;Flanaganら、1993、Ann.N.Y.Acad.Sci.696:31−37)。チミジンの取込みを測定したわれわれの細胞の成長の阻害のデータ(図1)は、SDZ RADがPTLD様B細胞中で細胞周期の進行を阻害することを示唆した。図2に示されるとおり、SDZ
RADは、検討された全4種のPTLD様B細胞系、すなわち、20A、A1、A2D6およびLCLにおいて、早期のG0/G1期で細胞周期の進行を著しく阻害した。該効果は薬物用量および細胞系の型に依存性であった。低SDZ RAD用量(1〜2ナノモル濃度)はG0/G1の細胞のパーセンテージを5〜25だけ増大させた一方、試験された最高用量(10ナノモル濃度)は10〜70%増大をもたらした。細胞周期のより後期(G2−MおよびS)の細胞のパーセンテージは比例して減少した。A1、およびより少ない程度までA2D6細胞系は、SDZ RADにとりわけ感受性であった。4種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADとともに48時間培養し、ヨウ化プロピジウムで標識し、そしてフローサイトメトリーにより分析した。
【0075】
SDZ RADはEBV+ B細胞におけるアポトーシスを増大させる
以前の研究は、ラパマイシンにより代表されるような免疫抑制性マクロライドが、他の薬剤により刺激されたアポトーシスを誘導するもしくは高めることができることを示している(Gottschalkら、1994、Proc.Natl.Acad.Sci.USA 91:7350−7354;Muthukkumarら、1995、Transplantation 60:264−270;Shiら、1995、Cancer Res.55:1982−1988;Hosoiら、1999、Cancer Res.59:886−894)。SDZ RADがPTLD様細胞におけるアポトーシス速度に影響を及ぼすかどうかを決定するために、われわれは、20A、A1、A2D6細胞系においてフローサイトメトリーによりアネキシンVのアポトーシスに誘導される表面発現を試験した(図3)。最低のSDZ RAD用量(1ナノモル濃度)でさえ、細胞の成長および細胞周期の阻害のデータに似ている若干の差異を伴い、全細胞系においてアポトーシス細胞のパーセンテージを著しく増大させた。最も感受性のA1系統において、SDZ RADは、アポトーシス細胞の数を10から16%までのおよそ60%の増大をもたらした。A2D6系統においては、それは11%の増大に、また、20A系統においては12%の増大につながった。最高用量(10ナノモル濃度)では、SDZ RADは、A1系統でおよそ240%の増大、ならびにA2D6および20A双方の系統で45%の増大につながった。
【0076】
毒性試験
以前の研究は、ラットにおけるSDZ RADの最小有効用量は、SDZ RADを単独の免疫抑制剤として使用した場合に、腎および心移植モデルにおいて、それぞれ1日あたり体重1キログラムあたり5ミリグラムおよび1日あたり体重1キログラムあたり>5ミリグラムであったことを示している(Schuurmanら、1997、Transplantation 64:32−5;Schulerら、1997、Transplantation 64:36−42)。SDZ RADへの長期の曝露が免疫能力のあるおよび免疫不全の双方のマウスに対し非毒性であるかどうかを決定するために、正常なBALB/cマウスのコホートを上の用量のSDZ RADで28日間処理した。10匹の処理されたおよび5匹の対照の未処理のマウスを本試験で使用した。後に、ヒトPTLD
様リンパ腫を移植されかつSDZ RADで55日まで治療されたSCIDマウスを評価した。7匹の治療されたおよび5匹の対照の未治療のSCIDマウスを本実験で評価した。薬物の最終投与を受領した後に、全部のマウスを殺し、そして以下の器官、すなわち肝、脾、腎、小腸、大腸、心、肺および骨髄のための大腿骨を、可能な毒性効果について検討するための組織病理学的評価のために収穫した。
【0077】
処理されたマウスのいずれも、薬物毒性のいかなる目に見える兆候も示さなかった。成長および体重増加はSDZ RAD処理された群および対照群について同一であった。全部の処理されたおよび未処理のマウスの器官の顕微鏡的評価は、薬物に帰することができた病理学的変化を示さなかった。従って、われわれは、1日あたり体重1キログラムあたり5ミリグラムの用量のSDZ RADへの長期の曝露は、それらの免疫状態に関係なく、処理されたマウスで副作用を有しないと結論する。
【0078】
SCIDマウスにおけるヒトPTLD様リンパ腫の異種移植モデルの確立。
これらの実験において、マウスに2種の異なる経路、すなわち腹腔内および皮下を介して、EBV+ B細胞系を注入した。腹腔内腫瘍モデルにおいて、SCIDマウス(1群あたり5匹)に、4種の細胞系、すなわち15A、20A、A2D6およびBC−1からの系統あたり約107個の細胞を腹腔内に接種した。21〜35日後に、全部のマウスが腹水および衰弱もしくは嗜眠の症状を伴う致死的疾患を発症した。剖検は、腹膜壁、肝、脾および腎を巻き込む広範囲の腫瘍の浸潤を示した。腫瘍の検鏡は、浸潤性の成長パターン、高い有糸分裂率、病巣および単独細胞の壊死、ならびにいくらかの程度の形質球様細胞分化を伴う大細胞型リンパ腫を示した。リンパ腫の病巣は、肺および骨髄のような遠位の器官にもまた存在し、血行性の拡がりを示した。
【0079】
皮下モデルにおいては、マウス(また1群あたり5匹)に、15A、20AおよびA1系統からの約107個の細胞を注入した。21〜32日後に、全部のマウスが埋込の部位に腫瘍を発生した。剖検は隣接する骨格筋および皮膚を侵襲する皮下腫瘍を示した。腫瘍の遠位の拡がりの肉眼的証拠は存在しなかった。検鏡は、腹腔内モデルにおけると同一の型の高悪性度リンパ腫を示した。遠位の内部器官、主として肝および肺は、小さい腫瘍病巣を時折表した。これは、皮下リンパ腫が直径最低1.5cmの比較的大きな大きさに達した場合にのみ起こった。免疫組織化学的染色は、腫瘍が埋込まれたヒトEBV+ Bリンパ球由来であったことを確認した。図4A−Dに示される20A系統の像は、全3種の細胞系の代表的なものである。
【0080】
事実上全部のリンパ腫細胞がヒトB細胞マーカーCD20について陽性であった。大部分(50〜80%)は、それらの高い増殖速度と一致して、細胞周期に関係したKi−67抗原について陽性であった。EBV関連抗原EBER1についての染色は普遍的に陽性であった(細胞の100%)。細胞の20ないし50%がEBV関連の潜伏性膜タンパク質1(LMP−1)を発現した。これらの結果は、腫瘍が単形性の型のPTLDに対応するヒトEBV+ B細胞リンパ腫を表すことを確認する。
【0081】
皮下リンパ腫モデルは腹膜モデルを上回るいくつかの利点を有した。第一に、小さいリンパ腫でさえ容易に同定することができた。第二に、直径1.5センチメートルまでのリンパ腫が局在化されたままであり、これは大きな正確性を伴い総腫瘍体積の決定を可能にした(Wasikら、1994、Am.J.Path.144:1089−1097)。最後に、皮下腫瘍は、単独細胞懸濁物よりもむしろ腫瘍組織断片を埋込むことにより、数匹のマウスに同時に移すことができた(Wasikら、1994、Am.J.Path.144:1089−1097;Pasqualucciら、1995、Blood 85:2139−2146;Visonneauら、1998、Am.J.Path.152:1299−1311)。こうした埋込は、事実上全部のレシピエントマウスにおける非
常に類似の成長の特徴をもつ腫瘍の迅速な確立をもたらす(Wasikら、1994、Am.J.Path.144:1089−1097;Pasqualucciら、1995、Blood 85:2139−2146;Visonneauら、1998、Am.J.Path.152:1299−1311)。これらの理由から、われわれはさらなる研究に皮下モデルを選択した。
【0082】
確立したEBV+ B細胞腫瘍の治療。
PTLD様細胞に対するSDZ RADのインビボの効果を決定するために、15A、20AおよびA1細胞系の腫瘍を、細胞系あたり7〜15匹のSCIDマウスに埋込んだ。治療は、腫瘍が直径5ミリメートル(50立方ミリメートルの体積に対応する)に達したら開始した。SDZ RADは1キログラムあたり5ミリグラム(非毒性かつ有効な免疫抑制用量に相当する)で、毎日の胃管栄養法により投与した(Schuurmanら、1997、Transplantation 64:32−5;Schulerら 1997、Transplantation 64:36−42)。
【0083】
図5に示されるとおり、SDZ RADは、3種の腫瘍の間の応答の程度の目に見える差異を伴い、異種移植されたPTLD様腫瘍の成長に対する大きな阻害効果を有した。15A腫瘍を埋込まれたマウスにおいて、腫瘍の成長の著しい薬物に誘導される遅延が存在したが、しかし、絶対的な腫瘍の成長の阻害もしくは退縮は存在しなかった。第21日に、腫瘍体積の中央値は、治療されたマウスでおよそ240立方ミリメートル、および対照の未治療のマウスで2720立方ミリメートルであった。およそ第38日に、治療されたマウスにおける15A腫瘍は約1000立方ミリメートルに達したのみであった。20A腫瘍に対するSDZ RADの効果はより著しくさえあった。第19日に、対照の20A腫瘍は1440立方ミリメートルの体積の中央値を表した一方、平均の治療された腫瘍はわずか50立方ミリメートルの量があり、これは初期の腫瘍の大きさに等しかった。さらに、腫瘍体積の有意の退縮が10匹の治療されたマウスのうち6匹でみられた。従って、第53日の腫瘍体積の中央値は、このサブセットについてわずかに<5立方ミリメートルであった。
【0084】
SDZ RADはA1細胞系に対して最も有効であることが判明した。第21日に、治療された腫瘍の体積の中央値は50立方ミリメートルであり、腫瘍のいずれも(0/8)成長のいかなる証拠も示さなかった。その日の未治療の腫瘍の平均体積はおよそ1800立方ミリメートルであった。さらなる治療は全8匹のマウスでの安定した退縮をもたらした。第53日に、平均の腫瘍体積は<5立方ミリメートルに減少し、そしてリンパ腫は4匹のマウスで検出することができず、完全な腫瘍の根絶を示した。他の4匹のマウスは顕微鏡的に確認される残余のリンパ腫を有した。注目すべき、15A、20AおよびA1腫瘍に対するSDZ RADのインビボの有効性の差異は、増殖(図1)ならびに他のインビトロアッセイ(図2および3)でみられる差異に相応した。この観察結果は、インビトロでの細胞分析がインビボでのSDZ RADに対する応答を予言することを示唆する。
【0085】
腫瘍の確立の阻害
SDZ RADは、免疫抑制剤として使用される場合に移植患者に慢性的に投与されるため、PTLDに対するその主な治療的影響は、臨床的に症候性の症例を緩和することよりはむしろそれらの発生を阻害することであるかもしれない。SDZ RADがPTLD様リンパ腫の確立を阻害することができるかどうかを試験するため、体重1キログラムあたり5ミリグラムの薬物での連日治療を、腫瘍埋込の3日前に開始した。図6に示されるとおり、SDZ RADは本モデルで極めて有効であることが判明した。SDZ RADに対し最も少なく感受性である15A腫瘍において(図5)、SDZ RADでの治療は腫瘍の成長を大きく遅延させたが、しかし腫瘍の確立を阻害することは不可能であった。第25日に、治療された腫瘍は平均で38立方ミリメートル、未治療はおよそ1940立
方ミリメートルだけの量があった。第45日に、治療された腫瘍の体積の中央値は480立方ミリメートルであった。20A腫瘍においては、11個の腫瘍のうち6個が第25日に検出可能でなく;残存する5個の体積の中央値は20立方ミリメートルであった。未治療の腫瘍の平均は、その日に210立方ミリメートルだけの量があった。第45日に、治療された腫瘍のいずれも150立方ミリメートルを越えず、未治療の腫瘍の平均はおよそ4200立方ミリメートルだけの量があった。5匹の治療されたマウスは腫瘍の兆候を示さず;埋込部位の顕微鏡的評価は悪性の細胞を示さなかった。最後に、A1マウスにおいて、腫瘍は8匹の治療されたマウスのいずれにおいてもほぼ第29日に検出することができず;未治療のマウスでの腫瘍の平均は580立方ミリメートルだけの量があった。第53日に、3匹のマウスのみが、小さい(<5立方ミリメートル)組織学的に確認されるリンパ腫を示した。残存する5匹のマウスは腫瘍の証拠を示さなかった。
【0086】
標準的免疫抑制剤はPTLDの発生を助長する一方、これらの障害に対するSDZ RADおよび他のマクロライドの影響は決定されないままである。SDZ RADは、PTLD様EBV+ B細胞において、インビトロのリンパ球増殖を大きく抑制し、細胞周期の進行を封鎖し、そしてアポトーシス速度を増大させたことが観察された。インビボのSCIDマウスの異種移植モデルにおいて、SDZ RADは確立したEBV+ B細胞腫瘍の成長を著しく遅延させたか、もしくは退縮を誘導した。該薬物は治療されたマウスのサブセットにおいて、腫瘍の確立を完全に根絶もしくは阻害した。これらの知見は、SDZ RADのようなマクロライドが、PTLDの阻害および治療で有効であるかもしれないことを示す。
【0087】
SDZ RADは、PTLD様EBV+ B細胞において、インビトロ増殖を大きく抑制し、細胞周期の進行を早期のG0/G1段階で停止し、そしてアポトーシス速度を増大させた。3種の異なるPTLD様B細胞腫瘍を異種移植されたSCIDマウスにおいて、SDZ RADは、とりわけ腫瘍埋込前に投与された場合に、これらの腫瘍の成長を著しく阻害した。A1腫瘍において、既に確立した腫瘍の完全な根絶が、8匹のマウスのうち4匹(4/8)で達成された。試験された3系統のうち2種(20AおよびA1)で、SDZ RADはマウスのおよそ50%において腫瘍の確立を完全に阻害した(それぞれ5/11および5/8)。SDZ RADの抗EBV+ B細胞腫瘍特性は、こうした細胞に対する免疫応答を抑制することにより間接的にのみならず、しかしまたそれらをアポトーシス前シグナルの影響から保護することにより直接的にEBV+ B細胞の生長を高めることが最近示唆されている(Beattyら、1998、Transplantation 65:1248−1255)標準的免疫抑制剤シクロスポリンおよびタクロリムスとよい対比をなす。
【0088】
これらの実験の結果は、15Aおよび20A系統がリンパ腫細胞由来であったためにとりわけ有望であり(Silbersteinら、1991、Blood 78:2372−2386)、そして、それ自体、進行した臨床的に攻撃的な形態のPTLDに応答するようである。従って、症例の大多数を含んで成る、他のより少なく悪性の形態のPTLDは、SDZ RADになおより感受性であるはずであることが妥当と思われる。正常な個体から得られたA1細胞系がSDZ RADに対し15Aおよび20Aよりもより感受性であったという事実が、この仮定を支持する。
【0089】
本実施例に提示されるデータはまた、SDZ RADでの単独療法が、数種の確立した明白に悪性のPTLD腫瘍を根絶するのに十分でないかもしれないこと、ならびに、SDZ RAD(または別のO−アルキル化ラパマイシン誘導体もしくはラパマイシン)および1種もしくはそれ以上の慣習的化学療法薬の双方を使用する併用療法を、臨床の場面で考慮することができる(Shiら、1995、Res.55:1982−1988;Mikiら、1998、Transplant.Proc.30:1091−1092)こと
も示唆する。
【0090】
チミジンの取込み(図1)および細胞周期の進行(図2)により測定されるところの細胞の成長の阻害は、EBV+ B細胞に対するSDZ RADの作用の主要な様式であるようであるとは言え、SDZ RADはこうした細胞におけるアポトーシス速度もまた増大させるという本明細書に記述される結果(図3)は、プログラムされた細胞死もまた該薬物の抗腫瘍活性の重要な一成分であるかもしれないことを示唆する。このアポトーシス前効果は、確立したPTLD腫瘍の治療でとりわけ重要である可能性があり、ここでは腫瘍の成長の阻害単独は完全な腫瘍の退縮を達成するのに十分でないかもしれない。SDZ
RADへの長期の曝露のみが多くの腫瘍の著しい退縮もしくは排除につながった(図5)という本明細書の観察結果は、類似の拡大された治療が、確立したPTLDを根治するのに望ましいかもしれないことを示唆する。
【0091】
SDZ RADに感受性のPTLD様B細胞系が全部EBV+であったとは言え、この感受性の媒介におけるウイルスの潜在的役割は、あったとしても完全に理解されていない。EBVは、標的細胞中で、サイトカインシグナル伝達経路を活性化することが可能な数種のタンパク質をコードもしくは誘導する(Rochfordら、1997、Viral
Immunol 10:183−195)。LMP−1と呼称される膜に固定されるウイルスタンパク質が最良に特徴づけられたものであり、そしてTNFレセプターファミリーのTRAFシグナル伝達経路を使用する(Mosialosら、1995、Cell 80:389−399;Devergneら、1998、J.Virol.72:7900−7908;Liebowitzら、1998、New Eng.J.Med.338:1413−1421)。該ファミリーに属し、かつTRAF3タンパク質を介するシグナル伝達を包含するLMP−1と数種の特徴を共有する、CD40を介するシグナル伝達(Eliopoulosら、1996、Oncogene 13:2243−2254;Pullenら、1998、Biochemistry 37:11836−11845)が、最近、ラパマイシンにより阻害されることが示された(Sakataら、1999、Immunology Letters 68:301−309)ことが、この情況で興味深い。免疫組織化学的分析は、LMP−1がEBV+ B細胞の一サブセットによってのみ発現されることを示し、これは、LMP−1がPTLD様細胞の成長およびSDZ
RADに対するそれらの感受性に対して決定的に重要でないかもしれないことを示唆する。EBVはまた、LMP−2AおよびLMP−2Bと呼称される2種の他の関係した膜タンパク質もコードする。これらのタンパク質はEBV+ B細胞のインビボでの成長に不可欠であるようではない(Rochfordら、1997、Arch Virol 142:707−720)。あるいは、SDZ RADは、TNF−αおよびTNF−βのような、標的細胞においてEBVにより誘導されるサイトカインにより媒介されるシグナル伝達を阻害するかもしれない(Rochfordら、1997、Viral Immunol 10:183−195)。
【0092】
SDZ RADは、インビトロおよびインビボの双方で、PTLD様のEBV+リンパ芽球状B細胞系に対する強力な阻害活性を表す。SDZ RADは、こうした細胞のインビトロ増殖を大きく阻害し、かつ、早期のG0/G1段階でそれらの細胞周期の進行を停止する。加えて、該薬物は、EBV+ B細胞のアポトーシス速度を増大させる。インビボで、それは、とりわけ細胞埋込の前に投与される場合に、SCIDマウスに異種移植されたEBV+ B細胞の成長を著しく遅延させるかもしくは完全に阻害する。SDZ RADは、いくつかの場合に、確立した腫瘍を根絶することが可能である。この効果は、細胞系特異的でありかつインビトロでみられる薬物の効果に比例するようである。
【0093】
要約すれば、本実施例に提示されるデータは、SDZ RADがインビトロおよびインビボでEBV+ Bリンパ球に対する強力な阻害効果を有することを立証する。従って、
それは、移植患者におけるPTLDの治療および阻害、もしくは他のリンパ増殖症候群の治療および阻害で有効である可能性がある。
【0094】
新たな治療様式が、PTLDの発症を阻害しかつその治癒率を向上させるのに必要とされる。理想的な抗PTLD薬は、移植片拒絶を阻害しかつ同時にPTLDの発生および発展を阻害するという二重の役割を演じるとみられる。PTLDが治療にもかかわらず発症するとすれば、標準的な免疫抑制薬で現在なされているような薬物用量の減少よりはむしろ増加が有効であるかもしれない。薬物用量を増加させるこのアプローチは、移植片の生存を危険にさらさないという付加的な利点を有するとみられる。本実施例は、マクロライド免疫抑制剤SDZ RADが、抗拒絶剤および抗リンパ増殖剤の二重の役割を有することを示す、インビトロおよびインビボのデータを提示する。
【0095】
本明細書に引用されるすべての特許、特許出願および刊行物の開示は、これによりそっくりそのまま引用することにより本明細書に組み込まれる。
【0096】
本発明は特定の態様に関して開示された一方、本発明の他の態様および変形物が、本発明の真の技術思想および範囲から離れることなく当業者により考案されることができることが明らかである。付属として付けられる請求の範囲は、全部のこうした態様および同等の変形物を包含する。
【0097】
以下に本発明の主な特徴と態様を列挙する。
【0098】
1.化学構造
【化1】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ増殖症候群を緩和するのに十分な量で患者に投与することを含んで成る、ヒト患者における該症候群の緩和方法。
【0099】
2.ラパマイシン誘導体が、
ラパマイシン、
40−O−ベンジルラパマイシン、
40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
40−O−アリルラパマイシン、
40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロプ−2’−エン−1’−イル]ラパマイシン、
(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
40−O−(2−アセトキシ)エチルラパマイシン、
40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
28−O−メチルラパマイシン、
40−O−(2−アミノエチル)ラパマイシン、
40−O−(2−アセトアミノエチル)ラパマイシン、
40−O−(2−ニコチンアミドエチル)ラパマイシン、
40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
より成る群から選択される、1.記載の方法。
【0100】
3.ラパマイシン誘導体が
ラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシン、および
40−O−(2−アセトアミノエチル)ラパマイシン
より成る群から選択される、1.記載の方法。
【0101】
4.ラパマイシン誘導体が
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−[2−(2−ヒドロキシ)エトキシ]エチルラパマイシン、および
40−O−(2−アセトアミノエチル)ラパマイシン
より成る群から選択される、1.記載の方法。
【0102】
5.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、1.記載の方法。
【0103】
6.ラパマイシン誘導体が第二の薬理学的有効成分と共投与される、1.記載の方法。
【0104】
7.第二の薬剤が免疫抑制剤である、6.記載の方法。
【0105】
8.第二の薬剤が、アザチオプリン、ミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドより成る群から選択される、7.記載の方法。
【0106】
9.ラパマイシン誘導体および第二の薬剤が、ラパマイシン誘導体および第二の薬剤の双方を含んで成る組成物中で患者に投与される、6.記載の方法。
【0107】
10.ラパマイシン誘導体が、第二の薬剤が患者に投与される最低1時間前に患者に投与される、6.記載の方法。
【0108】
11.ラパマイシン誘導体が、第二の薬剤が患者に投与される最低1時間後に患者に投与される、6.記載の方法。
【0109】
12.患者が移植後リンパ増殖症候群に苦しめられる、1.記載の方法。
【0110】
13.患者がリンパ腺癌に苦しめられる、1.記載の方法。
【0111】
14.リンパ腺癌がリンパ性白血病である、13.記載の方法。
【0112】
15.リンパ腺癌がリンパ腫である、13.記載の方法。
【0113】
16.リンパ腫が、AIDS関連リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、T細胞リンパ腫および皮膚T細胞リンパ腫より成る群から選択される、15.記載の方法。
【0114】
17.リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているリンパ球の増殖を特徴とする障害である、1.記載の方法。
【0115】
18.患者が免疫抑制療法を受けており、かつ、リンパ増殖症候群がリンパ腫である、17.記載の方法。
【0116】
19.リンパ増殖症候群が悪性リンパ増殖症候群である、1.記載の方法。
【0117】
20.リンパ増殖症候群が、ポリクローン性異型リンパ組織過形成およびモノクローン性の明白に悪性のB細胞リンパ腫より成る群から選択される、1.記載の方法。
【0118】
21.量が体重1キログラムあたり10マイクログラムから体重1キログラムあたり5ミリグラムまでである、1.記載の方法。
【0119】
22.ラパマイシン誘導体が患者に非経口で投与される、1.記載の方法。
【0120】
23.化学構造
【化2】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ増殖症候群を阻害するのに十分な量で、該症候群を発症する危険にさらされるヒト患者に投与することを含んで成る、該患者における該症候群の阻害方法。
【0121】
24.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、23.記載の方法。
【0122】
25.免疫抑制剤、ならびに化学構造
【化3】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体の双方をヒト患者に投与することを含んで成る、該患者における移植片拒絶の改良された阻害方法。
【0123】
26.免疫抑制剤が、アザチオプリン、ミコフェノール酸、RhO(D)免疫グロブリン、シクロスポリン、タクロリムス、シスプラチン、シクロホスファミドおよびレフルノミドより成る群から選択され、かつ、ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、23.記載の方法。
【0124】
27.化学構造
【化4】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1およびR2のそれぞれは、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を、リンパ球増殖を阻害するのに十分な量で、リンパ腺癌に苦しめられるヒト患者に投与することを含んで成る、該患者におけるリンパ腺腫瘍の転移の阻害方法。
【0125】
28.ラパマイシン誘導体が40−O−(2−ヒドロキシ)エチルラパマイシンである、27.記載の方法。
【0126】
29.Bリンパ球をエプスタイン−バーウイルスに曝露すること(それにより該Bリンパ球が形質転換された表現型を表す)、
形質転換されたBリンパ球を、重症の複合免疫不全を有するマウスに注入すること、
薬剤をマウスに投与すること、および
該マウスにおける腫瘍の成長を最低約21日間監視することであって、
それにより、腫瘍の退縮、腫瘍の根絶および該マウス中での第二の腫瘍の非存在の1種もしくはそれ以上の該マウス中での観察結果が、該薬剤が哺乳動物における移植後リンパ増殖症候群を緩和もしくは阻害するために有用であることの表示である、
を含んで成る、ある薬剤がヒト患者におけるリンパ増殖症候群を緩和もしくは阻害するために有用であるかどうかの評価方法。
【図面の簡単な説明】
【0127】
【図1】発明にかかる、PTLD様EBV+B細胞のインビトロ増殖のSDZ RADに媒介される阻害を具体的に説明するグラフである。BC−1は原発性滲出液リンパ腫(PEL)由来のEBV+/HSV8+ B細胞系である。他の細胞系は、低悪性度のB細胞リンパ腫を伴う患者(15Aもしくは20A)、T細胞リンパ腫を伴う患者(LCL)または健康な個体(A1もしくはA2D6)の1つ由来のインビトロでEBVで形質転換されたB細胞系である。HTLV−I+悪性T細胞系、HUT−102、C10MJおよびATL−2を、対照細胞系として包含した。
【図2】発明にかかる、PTLD様B細胞における細胞周期の進行のSDZ RADに媒介される阻害を具体的に説明するグラフである。4種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADの存在下で48時間培養し、ヨウ化プロピジウムで標識し、そしてフローサイトメトリーにより分析した。
【図3】発明にかかる、PTLD様B細胞のアポトーシス速度のSDZ RADに媒介される増大を具体的に説明するグラフである。3種のEBV+ B細胞系を、0〜10ナノモル濃度のSDZ RADの存在下で24時間培養し、ヨウ化プロピジウムおよび抗アネキシンV抗体で標識し、そしてフローサイトメトリーにより分析した。
【図4】発明にかかる、図4A−4Dを含んで成る、SCIDマウスに異種移植された20A腫瘍の形態学および表現型を描く一群の顕微鏡写真像である。図4Aにおいて、ヘマトキシリン−エオシン染色は、高い有糸分裂率を伴う大細胞型リンパ腫を示す。図4Bにおいて、ヒトCD20(すなわちB細胞抗原)と特異的に結合する抗体を使用する免疫ペルオキシダーゼ染色は、全部のリンパ腫細胞における細胞膜染色を示す。図4Cにおいて、Ki67(すなわち細胞増殖に関係した抗原)と特異的に結合する抗体を使用する免疫ペルオキシダーゼ染色は、50〜80%の細胞における核染色を示す。図4Dにおいて、EBVにコードされるEBER−1 RNAに関するインシトゥハイブリダイゼーションは、全部のリンパ腫細胞における核の陽性性を示す。
【図5】発明にかかる、図5A−5Cを含んで成る、PTLD様B細胞のインビボの成長のSDZ RADに媒介される阻害;確立した腫瘍の治療を具体的に説明する三つ組のグラフである。EBV+ B細胞系15A(図5C)、20A(図5B)およびA1(図5A)由来の腫瘍の断片を、レシピエントのSCIDマウスに埋込んだ。1群あたりのマウスの数をカッコ内に示す。1日あたり体重1キログラムあたり5ミリグラムの薬物での治療を、腫瘍が直径0.4〜0.5cmに達した場合に開始した。
【図6】発明にかかる、図6A−6Cを含んで成る、悪性のPTLD様B細胞のインビボの成長のSDZ RADに媒介される阻害(すなわち腫瘍の成長の阻害)を具体的に説明する三つ組のグラフである。EBV+ B細胞系15A(図6C)、20A(図6B)およびA1(図6A)由来の腫瘍の断片を、レシピエントのSCIDマウスに埋込んだ。1群あたりのマウスの数をカッコ内に示す。1日あたり体重1キログラムあたり5ミリグラムの薬物での治療を、腫瘍埋込3日前に開始した。
【図7】発明にかかる、SDZ RADの化学構造を描く。
【図8】発明にかかる、本明細書に記述される方法で使用することができるO−メチル化ラパマイシン誘導体の化学式(すなわち式I)を描く。
【特許請求の範囲】
【請求項1】
化学構造
【化1】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1は、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
R2は、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルよりなる群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を有効成分として含んで成る、ヒト患者におけるリンパ増殖症候群を緩和するための医薬組成物であって、
ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される、上記医薬組成物。
【請求項2】
ラパマイシン誘導体が、
40−O−ベンジルラパマイシン、
40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
40−O−アリルラパマイシン、
40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロ
プ−2’−エン−1’−イル]ラパマイシン、
(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
40−O−(2−アセトキシ)エチルラパマイシン、
40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
28−O−メチルラパマイシン、
40−O−(2−アミノエチル)ラパマイシン、
40−O−(2−アセトアミノエチル)ラパマイシン、
40−O−(2−ニコチンアミドエチル)ラパマイシン、
40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
より成る群から選択される、請求項1記載の医薬組成物。
【請求項3】
第二の薬理学的有効成分を更に含んで成る、請求項1記載の医薬組成物。
【請求項4】
第二の薬理学的有効成分が免疫抑制剤である、請求項3記載の医薬組成物。
【請求項5】
悪性リンパ増殖症候群が移植後リンパ増殖症候群である、請求項1記載の医薬組成物。
【請求項6】
リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖を特徴とする障害である、請求項1記載の医薬組成物。
【請求項7】
悪性リンパ増殖症候群がB細胞リンパ腫である、請求項1記載の医薬組成物。
【請求項8】
B細胞リンパ腫が、AIDS関連リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、腹膜滲出液B細胞リンパ腫およびモノクローン性の明白に悪性のB細胞リンパ腫からなる群から選択される、請求項7に記載の医薬組成物。
【請求項9】
移植後リンパ増殖症候群がポリクローン性異型リンパ組織過形成である、請求項5に記載の医薬組成物。
【請求項10】
化学構造
【化2】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1は、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
R2は、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を有効成分として含んで成る、リンパ増殖症候群を発症する危険にさらされるヒト患者におけるリンパ増殖症候群を阻害するための医薬組成物であって、
ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される、および悪性リンパ増殖症候群からなる群から選択される、上記医薬組成物。
【請求項1】
化学構造
【化1】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1は、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
R2は、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルよりなる群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を有効成分として含んで成る、ヒト患者におけるリンパ増殖症候群を緩和するための医薬組成物であって、
ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される、上記医薬組成物。
【請求項2】
ラパマイシン誘導体が、
40−O−ベンジルラパマイシン、
40−O−(4’−ヒドロキシメチル)ベンジルラパマイシン、
40−O−[4’−(1,2ジヒドロキシエチル)]ベンジルラパマイシン、
40−O−アリルラパマイシン、
40−O−[3’−(2,2−ジメチル−1,3−ジオキソラン−4(S)−イル)プロ
プ−2’−エン−1’−イル]ラパマイシン、
(2’E,4’S)−40−O−(4’,5’−ジヒドロキシペント−2’−エン−1’−イル)ラパマイシン、
40−O−(2−ヒドロキシ)エトキシカルボニルメチルラパマイシン、
40−O−(2−ヒドロキシ)エチルラパマイシン、
40−O−(3−ヒドロキシ)プロピルラパマイシン、
40−O−(6−ヒドロキシ)ヘキシルラパマイシン、
40−O−[2−(2ヒドロキシ)エトキシ]エチルラパマイシン、
40−O−[(3S)−2,2−ジメチルジオキソラン−3−イル]メチルラパマイシン、
40−O−[(2S)−2,3−ジヒドロキシプロプ−1−イル]ラパマイシン、
40−O−(2−アセトキシ)エチルラパマイシン、
40−O−(2−ニコチノイルオキシ)エチルラパマイシン、
40−O−[2−(N−モルホリノ)アセトキシ]エチルラパマイシン、
40−O−(2−N−イミダゾリルアセトキシ)エチルラパマイシン、
40−O−[2−(N−メチル−N’−ピペラジニル)アセトキシ]エチルラパマイシン、
39−O−デスメチル−39,40−O,O−エチレンラパマイシン、
(26R)−26−ジヒドロ−40−O−(2−ヒドロキシ)エチルラパマイシン、
28−O−メチルラパマイシン、
40−O−(2−アミノエチル)ラパマイシン、
40−O−(2−アセトアミノエチル)ラパマイシン、
40−O−(2−ニコチンアミドエチル)ラパマイシン、
40−O−(2−(N−メチルイミダゾ−2’−イルカルブエトキシアミド)エチル)ラパマイシン、
40−O−(2−エトキシカルボニルアミノエチル)ラパマイシン、
40−O−(2−トルイルスルホンアミドエチル)ラパマイシン、および
40−O−[2−(4’5’−ジカルボエトキシ−1’,2’,3’−トリアゾル−1’−イル)エチル]ラパマイシン
より成る群から選択される、請求項1記載の医薬組成物。
【請求項3】
第二の薬理学的有効成分を更に含んで成る、請求項1記載の医薬組成物。
【請求項4】
第二の薬理学的有効成分が免疫抑制剤である、請求項3記載の医薬組成物。
【請求項5】
悪性リンパ増殖症候群が移植後リンパ増殖症候群である、請求項1記載の医薬組成物。
【請求項6】
リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖を特徴とする障害である、請求項1記載の医薬組成物。
【請求項7】
悪性リンパ増殖症候群がB細胞リンパ腫である、請求項1記載の医薬組成物。
【請求項8】
B細胞リンパ腫が、AIDS関連リンパ腫、ホジキンリンパ腫、非ホジキンリンパ腫、バーキットリンパ腫、びまん性大細胞型リンパ腫、腹膜滲出液B細胞リンパ腫およびモノクローン性の明白に悪性のB細胞リンパ腫からなる群から選択される、請求項7に記載の医薬組成物。
【請求項9】
移植後リンパ増殖症候群がポリクローン性異型リンパ組織過形成である、請求項5に記載の医薬組成物。
【請求項10】
化学構造
【化2】

[式中
Xは(H,H)もしくはOであり;
Yは(H,OH)もしくはOであり;
R1は、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
R2は、−H、アルキル、チオアルキル、アリールアルキル、ヒドロキシアルキル、ジヒドロキシアルキル、ヒドロキシアルキルアリールアルキル、ジヒドロキシアルキルアリールアルキル、アルコキシアルキル、アシルオキシアルキル、アミノアルキル、アルキルアミノアルキル、アルコキシカルボニルアミノアルキル、アシルアミノアルキル、アリールスルホンアミドアルキル、アリル、ジヒドロキシアルキルアリル、ジオキソラニルアリル、カルブアルコキシアルキルおよび(R3)3Siより成る群から独立に選択され;
各R3は、−H、メチル、エチル、イソプロピル、tert−ブチルおよびフェニルより成る群から独立に選択され;ならびに
R4はメチルであるか、もしくはR4およびR1は一緒になってC2−5アルキレン部分を形成するかのいずれかである]
を有するラパマイシン誘導体を有効成分として含んで成る、リンパ増殖症候群を発症する危険にさらされるヒト患者におけるリンパ増殖症候群を阻害するための医薬組成物であって、
ここで、該リンパ増殖症候群が、エプスタイン−バーウイルスに感染しているBリンパ球の増殖によって特徴づけられる症候群、および移植後リンパ増殖症候群およびB細胞リンパ腫からなる群から選択される悪性リンパ増殖症候群、からなる群から選択される、および悪性リンパ増殖症候群からなる群から選択される、上記医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−90131(P2010−90131A)
【公開日】平成22年4月22日(2010.4.22)
【国際特許分類】
【出願番号】特願2009−269988(P2009−269988)
【出願日】平成21年11月27日(2009.11.27)
【分割の表示】特願2001−551473(P2001−551473)の分割
【原出願日】平成13年1月12日(2001.1.12)
【出願人】(597149618)ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア (2)
【Fターム(参考)】
【公開日】平成22年4月22日(2010.4.22)
【国際特許分類】
【出願日】平成21年11月27日(2009.11.27)
【分割の表示】特願2001−551473(P2001−551473)の分割
【原出願日】平成13年1月12日(2001.1.12)
【出願人】(597149618)ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア (2)
【Fターム(参考)】
[ Back to top ]

