リン脂質の除去方法
【課題】生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析を可能とするリン脂質の除去方法を提供することにある。
【解決手段】加水分解酵素ホスホリパーゼD又はホスホリパーゼCを作用させて試料溶液中のリン脂質を分解した後、固相抽出法や液体クロマトグラフにより酵素やリン脂質の分解生成物を除去することで、質量分析法で問題となるイオンサプレッションを抑制し、高精度な測定を可能とする。
【解決手段】加水分解酵素ホスホリパーゼD又はホスホリパーゼCを作用させて試料溶液中のリン脂質を分解した後、固相抽出法や液体クロマトグラフにより酵素やリン脂質の分解生成物を除去することで、質量分析法で問題となるイオンサプレッションを抑制し、高精度な測定を可能とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液などの生体試料に含まれる成分を、固相抽出などによる前処理を行った後、質量分析装置により分析する分析方法に適用するに好適なリン脂質の除去方法に関する。
【背景技術】
【0002】
質量分析法は、測定対象成分をイオン化し、生成したイオンの質量に基づいて測定する分析法である。特に質量分析を複数回実施するMS/MSと呼ばれる分析法は、測定対象成分イオンをフラグメント化することにより、夾雑成分を多く含む試料溶液中の微量成分を高感度かつ高選択性をもって検出できることから、生体試料をはじめ多くの分野で利用されている。例えば血清や尿などの生体試料を96穴の固相抽出プレートで処理し、質量分析計で測定することにより、アミノ酸,カルニチン類,糖及び免疫抑制剤などの定量を行うものが知られている(例えば、特許文献1参照)。
【0003】
質量分析法を血液のような夾雑物を多く含む生体試料中の微量成分分析に応用する場合、目的成分の信号強度が夾雑物の存在しない場合よりも低下する、イオンサプレッションと呼ばれる問題が発生する。質量分析法では、エレクトロスプレーイオン化法などのイオン化法により、目的対象成分をイオン化する必要がある。目的成分をイオン化する際に多量の夾雑物が同時に存在すると、目的成分のイオン化効率が低下し、定量結果に影響を与える。血液試料の場合、試料中に多く含まれかつイオン化効率が高いたんぱく質やリン脂質などの夾雑物が、共存物質のイオン化効率を低下させる成分として知られている(例えば、非特許文献1参照)。このようなイオン化効率の低下すなわちイオンサプレッションは、定量値の精度あるいは正確さに悪影響を与えることから、何らかの対策が必要となる。
【0004】
イオンサプレッション対策の一例として、同一のイオンサプレッションを生じるとみなすことができる安定同位体標識物質を用いて定量値を補正する方法がある。しかし、安定同位体標識物質の合成にはコストがかかるだけではなく、合成できない成分については安定同位体標識物質を作製できないという問題がある。そこで、特許文献1では、内部標準物質として、安定同位体標識物質の他に、分子構造の似通った類似化合物を用いている。このように内部標準物質に類似化合物を用いる場合、夾雑成分による影響が、測定対象物質と内部標準物質とで完全には等価でなく、補正をおこなっても正確な値が得られる保証はない。
【0005】
別のイオンサプレッション対策として、夾雑成分と測定対象成分とを分離する、例えば液体クロマトグラフや固相抽出処理の前処理を行うことで、夾雑成分の影響を軽減させる方法も用いられる。液体クロマトグラフのような高価な専用装置を用いる手法に比べ、固相抽出処理は簡便な操作で目的成分の分離濃縮と夾雑物の除去が行える。分子サイズの大きなたんぱく質の場合、固相抽出処理で血液試料中の目的成分との分離除去は比較的容易であるが、リン脂質の目的対象成分との分離除去は容易ではないことが多い。多量のリン脂質が溶液内に存在すると、質量分析法で測定結果に影響を与えるだけでなく、固相抽出処理においても目的対象成分の捕捉回収率を低下させる。そのため、リン脂質と固相抽出剤との接触を避けることが必要となる。
【0006】
リン脂質を選択的に捕捉する方法として、チタニアやジルコニア等の金属酸化物とリン酸化化合物の特異的な相互作用を利用したものが知られている(例えば、非特許文献2,特許文献2参照)。非特許文献2では、チアニア粒子を用いて卵黄由来脂質抽出液から選択的にリン脂質を濃縮している。また、特許文献2では、チタニア粒子を用いて細胞由来脂質抽出液からリン脂質および糖脂質を選択的に分離している。
【0007】
リン脂質を選択的に捕捉する別の方法として、溶媒抽出を用いる方法が知られている(例えば、特許文献3参照)。特許文献3では、卵黄からリン脂質を選択的に分離するため、水を加えた後に混合液のpHを調整後遠心分離によりリン脂質を分離している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第2007/0004044号公報
【特許文献2】特開2008―156571号公報
【特許文献3】特表2003−505007号公報
【非特許文献1】Yuan-Qing Xia and Mohammed Jemal,Rapid Commun,Mass Spectrom,2009,(23),2125-2138
【非特許文献2】Y.Ikeguchi and H.Nakamura,Anal. Sci.,2000,(16),541-543
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、非特許文献2,特許文献2記載の方法は、いずれも溶媒抽出により脂質のみを精製した抽出液を対象としており、血液試料の様な複雑な夾雑物に対するリン脂質の選択的吸着については考慮されていない。
【0010】
また、特許文献3記載の方法は。複数回の遠心分離を必要とする、非常に煩雑な操作である。
【0011】
本発明の目的は、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析を可能とするリン脂質の除去方法を提供することにある。
【課題を解決するための手段】
【0012】
(1)上記目的を達成するために、本発明は、生体液中の目的成分を質量分析装置を用いて測定する分析法に用いられるリン脂質の除去方法であって、前記生体液中のリン脂質分子を分解するようにしたものである。
かかる方法により、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析が可能となる。
【0013】
(2)上記(1)において、好ましくは、リン酸部位で分解できる加水分解酵素をリン脂質に作用させることにより、前記リン脂質分子を分解するようにしたものである。
【0014】
(3)上記(2)において、好ましくは、前記加水分解酵素として、ホスホリパーゼDを用いるようにしたものである。
【0015】
(4)上記(1)において、好ましくは、前記リン脂質分子を分解した後、リン脂質の分解生成物と目的成分を分離するようにしたものである。
【0016】
(5)上記(4)において、好ましくは、前記加水分解酵素として、ホスホリパーゼC若しくはホスホリパーゼDを用いるようにしたものである。
【0017】
(6)上記(4)において、好ましくは、疎水性相互作用により成分を分離可能な手段を用いて、リン脂質の分解生成物と目的成分を分離するようにしたものである。
【0018】
(7)上記(6)において、好ましくは、疎水性相互作用により成分を分離可能な手段として、固相抽出カートリッジ若しくは液体クロマトグラフを用いるようにしたものである。
【発明の効果】
【0019】
本発明によれば、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析を可能となる。
【図面の簡単な説明】
【0020】
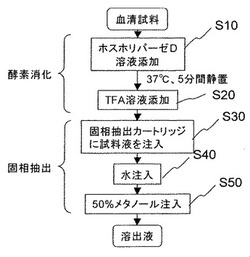
【図1】本発明の第1の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【図2】本発明の第2の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【図3】本発明の第3の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【発明を実施するための形態】
【0021】
以下、図1を用いて、本発明の第1の実施形態によるリン脂質の除去方法について説明する。
図1は、本発明の第1の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0022】
本実施形態は、加水分解酵素ホスホリパーゼDを用いて血清試料中のリン脂質を分解した後、固相抽出処理により極性物質を除去した後、質量分析計にて目的成分であるテオフィリンを測定するものである。
【0023】
ホスホリパーゼとは、リン脂質をリン酸部位で加水分解する酵素の一群のことである。ここで、ホスホリパーゼとは、リン脂質の分解部位により、ホスホリパーゼA1,ホスホリパーゼA2,ホスホリパーゼC,およびホスホリパーゼDの4種類に大別できる。
【0024】
本実施形態では、ホスホリパーゼDを用いている。血清中には多種のリン脂質が存在するが、主要なリン脂質はホスファチジルコリン,スフィンゴミエリン,リゾホスファチジルコリンであり、これら3種類で血清中リン脂質の90%以上を占める。そのため、ここではこれら3種類のリン脂質の加水分解反応について説明する。なおこれら3種類の主要なリン脂質は、いずれも分子構造内に極性官能基であるコリンを有し、そのため質量分析において正イオンで強く検出される。また質量分析で他の測定成分に対してイオン化効率を低下させることが知られている。なお、他の10%以下のリン脂質は、コリンを有しないため、イオン化した際にも影響がないものである。
【0025】
血清など水を多く含む溶液中のリン脂質は、ホスホリパーゼDによりリン酸エステル部の加水分解反応を受ける。ホスホリパーゼDによるリン脂質加水分解反応を、(化1)から(化3)を用いて説明する。
【0026】
【化1】

【0027】
(化1)はホスファチジルコリンの分解反応であり、ホスホリパーゼDにより、コリンとホスファチジン酸に分解される。
【0028】
【化2】

【0029】
(化2)はリゾホスファチジルコリンの分解反応であり、ホスホリパーゼDにより、コリンとリゾホスファチジン酸に分解される。
【0030】
【化3】

【0031】
(化3)はスフィンゴミエリンの分解反応であり、ホスホリパーゼDにより、コリンとN−アシルスフィンゴシルホスフェートに分解される。
【0032】
次に、図1を用いて、本実施形態における分析法フローについて説明する。
【0033】
測定対象である血清には、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0034】
ステップS10において、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼDを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0035】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、(化1)に示したホスホリパーゼDによるリン脂質の加水分解反応が行われる。
【0036】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼDを変性させることで加水分解反応を停止させる。
【0037】
反応停止後、ステップS30において、反応液を含む血清試料溶液全量を、固相抽出カートリッジに注入する。固相抽出カートリッジには、疎水性相互作用を利用して溶液中の成分を捕捉するものが使用可能であり、例えば(株)日立ハイテクノロジーズ製NOBIAS RP−OD1(シリンジ形、1mL)が使用できる。注入された血清試料溶液は、減圧吸引により固相抽出カートリッジから排出される。このとき、溶液中に含まれる測定対象成分テオフィリンやリン脂質の疎水性分解物はカートリッジに捕捉される一方、リン脂質からの親水性分解物であるコリンや血清中に内在するたんぱく質やホスホリパーゼDなどは、固相抽出剤との相互作用が弱いため、固相抽出カートリッジに捕捉されずにカートリッジ外に排出される。
【0038】
次に、ステップS40において、洗浄液として純水1ミリリットルを固相抽出カートリッジに注入し、固相抽出カートリッジ表面に残存した塩類などの低分子成分を排出する。
【0039】
洗浄後、ステップS50において、50%メタノール水溶液1ミリリットルを固相抽出カートリッジに注入し、測定対象であるテオフィリンを溶出させる。溶出液は、遠心濃縮機を用いて蒸発幹固後、20%メタノール水溶液20マイクロリットルに再溶解することで、質量分析計への測定溶液が調製される。
【0040】
質量分析計としては、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0041】
本実施形態による血清中テオフィリンの定量結果は4.6±0.1μg/mLとなり、添加濃度5.0μg/mLに対して回収率92%と高い回収率で定量することができた。
【0042】
以上の説明では、酵素分解した成分と測定対象であるテオフィリンの分離精製を固相抽出カラムにて実施したが、固相抽出カラムと同様に疎水性相互作用により成分を分離可能な分離カラムを備えた液体クロマトグラフを用いても、本例のようにテオフィリンと夾雑成分を分離精製することが可能である。また液体クロマトグラフを用いる場合、カラムスイッチング法を用いることで酵素分解した血清試料溶液の分離精製とテオフィリン定量分析をオンラインで行うことも可能である。
【0043】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0044】
次に、図2を用いて、本発明の第2の実施形態によるリン脂質の除去方法について説明する。
図2は、本発明の第2の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0045】
本実施形態は、加水分解酵素ホスホリパーゼDを用いて血清試料中のリン脂質を分解した後、質量分析計にて目的成分であるテオフィリンを測定するものである。すなわち、第1の実施形態における固相抽出処理による極性物質の除去は行わないものである。
【0046】
測定対象である血清には、第1の実施形態と同様に、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0047】
ステップS10において、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼDを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0048】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、(化1)に示したホスホリパーゼDによるリン脂質の加水分解反応が行われる。
【0049】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼDを変性させることで加水分解反応を停止させる。
【0050】
以上の処理により、3種類のリン脂質は、コリンとホスファチジン酸等に分解される。その後、質量分析計により分析される。ここで、コリンの分子量は約100であり、ホスファチジン酸の分子量は約680である。一方、目的成分であるテオフィリンの分子量は約180である。従って、質量分析計により、質量分析すると、コリンと、目的成分であるテオフィリンとは異なる質量数のピークとして分析されるため、両者を分離して、目的成分であるテオフィリンの定量が可能である。
【0051】
質量分析計としては、第1の実施形態と同様に、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0052】
本実施形態でも、血清中テオフィリンを高い回収率で定量することができた。
【0053】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0054】
次に、図3を用いて、本発明の第3の実施形態によるリン脂質の除去方法について説明する。
図3は、本発明の第3の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0055】
本実施形態は、加水分解酵素ホスホリパーゼCを用いて血清試料中のリン脂質を分解した後、固相抽出処理により極性物質を除去した後、質量分析計にて目的成分であるテオフィリンを測定するものである。
【0056】
ホスホリパーゼDを加水分解酵素として用いると、(化1)等で説明したように、リン脂質の分解部位は、(化1)における酸素基とリン基の間である。それに対して、ホスホリパーゼCを加水分解酵素として用いると、リン脂質の分解部位は、ホスホリパーゼDよりも(化1)における右側となる。その結果、ホスホリパーゼCを加水分解酵素として、ホスファチジルコリンを加水分解すると、ホスホコリンと、ジアシルグリセロールとに分解される。スフィンゴミエリン,リゾホスファチジルコリンについても、ホスホコリンと、他の成分に分解される。
【0057】
図1を用いて、本実施形態における分析法フローについて説明する。
【0058】
測定対象である血清には、第1の実施形態と同様に、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0059】
ステップS10Aにおいて、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼCを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0060】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、ホスホリパーゼCによるリン脂質の加水分解反応が行われる。
【0061】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼCを変性させることで加水分解反応を停止させる。
【0062】
反応停止後、ステップS30において、反応液を含む血清試料溶液全量を、固相抽出カートリッジに注入する。固相抽出カートリッジには、疎水性相互作用を利用して溶液中の成分を捕捉するものが使用可能であり、例えば(株)日立ハイテクノロジーズ製NOBIAS RP−OD1(シリンジ形、1mL)が使用できる。注入された血清試料溶液は、減圧吸引により固相抽出カートリッジから排出される。このとき、溶液中に含まれる測定対象成分テオフィリンやリン脂質の疎水性分解物はカートリッジに捕捉される一方、リン脂質からの親水性分解物であるホスホコリンや血清中に内在するたんぱく質やホスホリパーゼCなどは、固相抽出剤との相互作用が弱いため、固相抽出カートリッジに捕捉されずにカートリッジ外に排出される。
【0063】
次に、ステップS40において、洗浄液として純水1ミリリットルを固相抽出カートリッジに注入し、固相抽出カートリッジ表面に残存した塩類などの低分子成分を排出する。
【0064】
洗浄後、ステップS50において、50%メタノール水溶液1ミリリットルを固相抽出カートリッジに注入し、測定対象であるテオフィリンを溶出させる。溶出液は、遠心濃縮機を用いて蒸発幹固後、20%メタノール水溶液20マイクロリットルに再溶解することで、質量分析計への測定溶液が調製される。
【0065】
質量分析計としては、第1の実施形態と同様に、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0066】
本実施形態でも、血清中テオフィリンを高い回収率で定量することができた。
【0067】
なお、ホスホコリンの分子量は約180であり、目的成分であるテオフィリンの分子量と同様である。従って、図2にて説明した第2の実施形態のようにステップS10,S20だけの処理の後、質量分析すると、ホスホコリンの質量量と、目的成分であるテオフィリンの質量数はほぼ同じであり、両者を分離することはできないものである。従って、加水分解酵素として、ホスホリパーゼCを用いる場合には、ステップS30における固相抽出カートリッジによる分離が必要となる。
【0068】
なお、酵素分解した成分と測定対象であるテオフィリンの分離精製を固相抽出カラムにて実施したが、固相抽出カラムと同様に疎水性相互作用により成分を分離可能な分離カラムを備えた液体クロマトグラフを用いても、本例のようにテオフィリンと夾雑成分を分離精製することが可能である。また液体クロマトグラフを用いる場合、カラムスイッチング法を用いることで酵素分解した血清試料溶液の分離精製とテオフィリン定量分析をオンラインで行うことも可能である。
【0069】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0070】
なお、ホスホリパーゼA1,A2を加水分解酵素として用いると、リン脂質の分解部位は、ホスホリパーゼD,Cよりも(化1)における右側となる。その結果、ホスホリパーゼA2を加水分解酵素として、ホスファチジルコリンを加水分解すると、リゾホスファチジルコリンと、他の成分とに分解される。リゾホスファチジルコリンは、(化2)における左辺の成分であるため、ホスホリパーゼA2では、所望の成分に分解することはできないものである。ホスホリパーゼA1についても、同様である。
【技術分野】
【0001】
本発明は、血液などの生体試料に含まれる成分を、固相抽出などによる前処理を行った後、質量分析装置により分析する分析方法に適用するに好適なリン脂質の除去方法に関する。
【背景技術】
【0002】
質量分析法は、測定対象成分をイオン化し、生成したイオンの質量に基づいて測定する分析法である。特に質量分析を複数回実施するMS/MSと呼ばれる分析法は、測定対象成分イオンをフラグメント化することにより、夾雑成分を多く含む試料溶液中の微量成分を高感度かつ高選択性をもって検出できることから、生体試料をはじめ多くの分野で利用されている。例えば血清や尿などの生体試料を96穴の固相抽出プレートで処理し、質量分析計で測定することにより、アミノ酸,カルニチン類,糖及び免疫抑制剤などの定量を行うものが知られている(例えば、特許文献1参照)。
【0003】
質量分析法を血液のような夾雑物を多く含む生体試料中の微量成分分析に応用する場合、目的成分の信号強度が夾雑物の存在しない場合よりも低下する、イオンサプレッションと呼ばれる問題が発生する。質量分析法では、エレクトロスプレーイオン化法などのイオン化法により、目的対象成分をイオン化する必要がある。目的成分をイオン化する際に多量の夾雑物が同時に存在すると、目的成分のイオン化効率が低下し、定量結果に影響を与える。血液試料の場合、試料中に多く含まれかつイオン化効率が高いたんぱく質やリン脂質などの夾雑物が、共存物質のイオン化効率を低下させる成分として知られている(例えば、非特許文献1参照)。このようなイオン化効率の低下すなわちイオンサプレッションは、定量値の精度あるいは正確さに悪影響を与えることから、何らかの対策が必要となる。
【0004】
イオンサプレッション対策の一例として、同一のイオンサプレッションを生じるとみなすことができる安定同位体標識物質を用いて定量値を補正する方法がある。しかし、安定同位体標識物質の合成にはコストがかかるだけではなく、合成できない成分については安定同位体標識物質を作製できないという問題がある。そこで、特許文献1では、内部標準物質として、安定同位体標識物質の他に、分子構造の似通った類似化合物を用いている。このように内部標準物質に類似化合物を用いる場合、夾雑成分による影響が、測定対象物質と内部標準物質とで完全には等価でなく、補正をおこなっても正確な値が得られる保証はない。
【0005】
別のイオンサプレッション対策として、夾雑成分と測定対象成分とを分離する、例えば液体クロマトグラフや固相抽出処理の前処理を行うことで、夾雑成分の影響を軽減させる方法も用いられる。液体クロマトグラフのような高価な専用装置を用いる手法に比べ、固相抽出処理は簡便な操作で目的成分の分離濃縮と夾雑物の除去が行える。分子サイズの大きなたんぱく質の場合、固相抽出処理で血液試料中の目的成分との分離除去は比較的容易であるが、リン脂質の目的対象成分との分離除去は容易ではないことが多い。多量のリン脂質が溶液内に存在すると、質量分析法で測定結果に影響を与えるだけでなく、固相抽出処理においても目的対象成分の捕捉回収率を低下させる。そのため、リン脂質と固相抽出剤との接触を避けることが必要となる。
【0006】
リン脂質を選択的に捕捉する方法として、チタニアやジルコニア等の金属酸化物とリン酸化化合物の特異的な相互作用を利用したものが知られている(例えば、非特許文献2,特許文献2参照)。非特許文献2では、チアニア粒子を用いて卵黄由来脂質抽出液から選択的にリン脂質を濃縮している。また、特許文献2では、チタニア粒子を用いて細胞由来脂質抽出液からリン脂質および糖脂質を選択的に分離している。
【0007】
リン脂質を選択的に捕捉する別の方法として、溶媒抽出を用いる方法が知られている(例えば、特許文献3参照)。特許文献3では、卵黄からリン脂質を選択的に分離するため、水を加えた後に混合液のpHを調整後遠心分離によりリン脂質を分離している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第2007/0004044号公報
【特許文献2】特開2008―156571号公報
【特許文献3】特表2003−505007号公報
【非特許文献1】Yuan-Qing Xia and Mohammed Jemal,Rapid Commun,Mass Spectrom,2009,(23),2125-2138
【非特許文献2】Y.Ikeguchi and H.Nakamura,Anal. Sci.,2000,(16),541-543
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、非特許文献2,特許文献2記載の方法は、いずれも溶媒抽出により脂質のみを精製した抽出液を対象としており、血液試料の様な複雑な夾雑物に対するリン脂質の選択的吸着については考慮されていない。
【0010】
また、特許文献3記載の方法は。複数回の遠心分離を必要とする、非常に煩雑な操作である。
【0011】
本発明の目的は、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析を可能とするリン脂質の除去方法を提供することにある。
【課題を解決するための手段】
【0012】
(1)上記目的を達成するために、本発明は、生体液中の目的成分を質量分析装置を用いて測定する分析法に用いられるリン脂質の除去方法であって、前記生体液中のリン脂質分子を分解するようにしたものである。
かかる方法により、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析が可能となる。
【0013】
(2)上記(1)において、好ましくは、リン酸部位で分解できる加水分解酵素をリン脂質に作用させることにより、前記リン脂質分子を分解するようにしたものである。
【0014】
(3)上記(2)において、好ましくは、前記加水分解酵素として、ホスホリパーゼDを用いるようにしたものである。
【0015】
(4)上記(1)において、好ましくは、前記リン脂質分子を分解した後、リン脂質の分解生成物と目的成分を分離するようにしたものである。
【0016】
(5)上記(4)において、好ましくは、前記加水分解酵素として、ホスホリパーゼC若しくはホスホリパーゼDを用いるようにしたものである。
【0017】
(6)上記(4)において、好ましくは、疎水性相互作用により成分を分離可能な手段を用いて、リン脂質の分解生成物と目的成分を分離するようにしたものである。
【0018】
(7)上記(6)において、好ましくは、疎水性相互作用により成分を分離可能な手段として、固相抽出カートリッジ若しくは液体クロマトグラフを用いるようにしたものである。
【発明の効果】
【0019】
本発明によれば、生体試料中に含まれるリン脂質を除去することで、イオン化時に起こりうる目的成分に対するイオンサプレッションを抑制し、簡便かつ高精度な質量分析を可能となる。
【図面の簡単な説明】
【0020】
【図1】本発明の第1の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【図2】本発明の第2の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【図3】本発明の第3の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【発明を実施するための形態】
【0021】
以下、図1を用いて、本発明の第1の実施形態によるリン脂質の除去方法について説明する。
図1は、本発明の第1の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0022】
本実施形態は、加水分解酵素ホスホリパーゼDを用いて血清試料中のリン脂質を分解した後、固相抽出処理により極性物質を除去した後、質量分析計にて目的成分であるテオフィリンを測定するものである。
【0023】
ホスホリパーゼとは、リン脂質をリン酸部位で加水分解する酵素の一群のことである。ここで、ホスホリパーゼとは、リン脂質の分解部位により、ホスホリパーゼA1,ホスホリパーゼA2,ホスホリパーゼC,およびホスホリパーゼDの4種類に大別できる。
【0024】
本実施形態では、ホスホリパーゼDを用いている。血清中には多種のリン脂質が存在するが、主要なリン脂質はホスファチジルコリン,スフィンゴミエリン,リゾホスファチジルコリンであり、これら3種類で血清中リン脂質の90%以上を占める。そのため、ここではこれら3種類のリン脂質の加水分解反応について説明する。なおこれら3種類の主要なリン脂質は、いずれも分子構造内に極性官能基であるコリンを有し、そのため質量分析において正イオンで強く検出される。また質量分析で他の測定成分に対してイオン化効率を低下させることが知られている。なお、他の10%以下のリン脂質は、コリンを有しないため、イオン化した際にも影響がないものである。
【0025】
血清など水を多く含む溶液中のリン脂質は、ホスホリパーゼDによりリン酸エステル部の加水分解反応を受ける。ホスホリパーゼDによるリン脂質加水分解反応を、(化1)から(化3)を用いて説明する。
【0026】
【化1】

【0027】
(化1)はホスファチジルコリンの分解反応であり、ホスホリパーゼDにより、コリンとホスファチジン酸に分解される。
【0028】
【化2】

【0029】
(化2)はリゾホスファチジルコリンの分解反応であり、ホスホリパーゼDにより、コリンとリゾホスファチジン酸に分解される。
【0030】
【化3】

【0031】
(化3)はスフィンゴミエリンの分解反応であり、ホスホリパーゼDにより、コリンとN−アシルスフィンゴシルホスフェートに分解される。
【0032】
次に、図1を用いて、本実施形態における分析法フローについて説明する。
【0033】
測定対象である血清には、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0034】
ステップS10において、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼDを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0035】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、(化1)に示したホスホリパーゼDによるリン脂質の加水分解反応が行われる。
【0036】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼDを変性させることで加水分解反応を停止させる。
【0037】
反応停止後、ステップS30において、反応液を含む血清試料溶液全量を、固相抽出カートリッジに注入する。固相抽出カートリッジには、疎水性相互作用を利用して溶液中の成分を捕捉するものが使用可能であり、例えば(株)日立ハイテクノロジーズ製NOBIAS RP−OD1(シリンジ形、1mL)が使用できる。注入された血清試料溶液は、減圧吸引により固相抽出カートリッジから排出される。このとき、溶液中に含まれる測定対象成分テオフィリンやリン脂質の疎水性分解物はカートリッジに捕捉される一方、リン脂質からの親水性分解物であるコリンや血清中に内在するたんぱく質やホスホリパーゼDなどは、固相抽出剤との相互作用が弱いため、固相抽出カートリッジに捕捉されずにカートリッジ外に排出される。
【0038】
次に、ステップS40において、洗浄液として純水1ミリリットルを固相抽出カートリッジに注入し、固相抽出カートリッジ表面に残存した塩類などの低分子成分を排出する。
【0039】
洗浄後、ステップS50において、50%メタノール水溶液1ミリリットルを固相抽出カートリッジに注入し、測定対象であるテオフィリンを溶出させる。溶出液は、遠心濃縮機を用いて蒸発幹固後、20%メタノール水溶液20マイクロリットルに再溶解することで、質量分析計への測定溶液が調製される。
【0040】
質量分析計としては、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0041】
本実施形態による血清中テオフィリンの定量結果は4.6±0.1μg/mLとなり、添加濃度5.0μg/mLに対して回収率92%と高い回収率で定量することができた。
【0042】
以上の説明では、酵素分解した成分と測定対象であるテオフィリンの分離精製を固相抽出カラムにて実施したが、固相抽出カラムと同様に疎水性相互作用により成分を分離可能な分離カラムを備えた液体クロマトグラフを用いても、本例のようにテオフィリンと夾雑成分を分離精製することが可能である。また液体クロマトグラフを用いる場合、カラムスイッチング法を用いることで酵素分解した血清試料溶液の分離精製とテオフィリン定量分析をオンラインで行うことも可能である。
【0043】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0044】
次に、図2を用いて、本発明の第2の実施形態によるリン脂質の除去方法について説明する。
図2は、本発明の第2の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0045】
本実施形態は、加水分解酵素ホスホリパーゼDを用いて血清試料中のリン脂質を分解した後、質量分析計にて目的成分であるテオフィリンを測定するものである。すなわち、第1の実施形態における固相抽出処理による極性物質の除去は行わないものである。
【0046】
測定対象である血清には、第1の実施形態と同様に、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0047】
ステップS10において、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼDを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0048】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、(化1)に示したホスホリパーゼDによるリン脂質の加水分解反応が行われる。
【0049】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼDを変性させることで加水分解反応を停止させる。
【0050】
以上の処理により、3種類のリン脂質は、コリンとホスファチジン酸等に分解される。その後、質量分析計により分析される。ここで、コリンの分子量は約100であり、ホスファチジン酸の分子量は約680である。一方、目的成分であるテオフィリンの分子量は約180である。従って、質量分析計により、質量分析すると、コリンと、目的成分であるテオフィリンとは異なる質量数のピークとして分析されるため、両者を分離して、目的成分であるテオフィリンの定量が可能である。
【0051】
質量分析計としては、第1の実施形態と同様に、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0052】
本実施形態でも、血清中テオフィリンを高い回収率で定量することができた。
【0053】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0054】
次に、図3を用いて、本発明の第3の実施形態によるリン脂質の除去方法について説明する。
図3は、本発明の第3の実施形態によるリン脂質の除去方法の処理内容を示すフローチャートである。
【0055】
本実施形態は、加水分解酵素ホスホリパーゼCを用いて血清試料中のリン脂質を分解した後、固相抽出処理により極性物質を除去した後、質量分析計にて目的成分であるテオフィリンを測定するものである。
【0056】
ホスホリパーゼDを加水分解酵素として用いると、(化1)等で説明したように、リン脂質の分解部位は、(化1)における酸素基とリン基の間である。それに対して、ホスホリパーゼCを加水分解酵素として用いると、リン脂質の分解部位は、ホスホリパーゼDよりも(化1)における右側となる。その結果、ホスホリパーゼCを加水分解酵素として、ホスファチジルコリンを加水分解すると、ホスホコリンと、ジアシルグリセロールとに分解される。スフィンゴミエリン,リゾホスファチジルコリンについても、ホスホコリンと、他の成分に分解される。
【0057】
図1を用いて、本実施形態における分析法フローについて説明する。
【0058】
測定対象である血清には、第1の実施形態と同様に、市販の管理血清(日水製薬製)にテオフィリンを最終濃度5.0μL/min、および内標準としてテオフィリン−d6を最終濃度1.0μL/minになるように添加したものを、評価用血清試料として用いた。
【0059】
ステップS10Aにおいて、血清試料溶液10マイクロリットルが試料保存容器から分注され、反応容器に注入される。試料溶液を注入後、加水分解酵素ホスホリパーゼCを1U/mLおよび塩化カルシウム50mmol/Lを含み緩衝液によりpH7.5に調製された分解液1ミリリットルが分注され、血清試料溶液が注入された反応容器に注入される。
【0060】
分解液を注入後、反応容器を数秒間振動させ、容器内部の試料溶液と分解液を十分に攪拌する。攪拌した後、反応容器は37℃に温度設定された反応槽により10分間加温され、ホスホリパーゼCによるリン脂質の加水分解反応が行われる。
【0061】
そして、5分後、ステップS20において、10%トリフルオロ酢酸(TAF溶液)10マイクロリットルを反応容器に添加し、ホスホリパーゼCを変性させることで加水分解反応を停止させる。
【0062】
反応停止後、ステップS30において、反応液を含む血清試料溶液全量を、固相抽出カートリッジに注入する。固相抽出カートリッジには、疎水性相互作用を利用して溶液中の成分を捕捉するものが使用可能であり、例えば(株)日立ハイテクノロジーズ製NOBIAS RP−OD1(シリンジ形、1mL)が使用できる。注入された血清試料溶液は、減圧吸引により固相抽出カートリッジから排出される。このとき、溶液中に含まれる測定対象成分テオフィリンやリン脂質の疎水性分解物はカートリッジに捕捉される一方、リン脂質からの親水性分解物であるホスホコリンや血清中に内在するたんぱく質やホスホリパーゼCなどは、固相抽出剤との相互作用が弱いため、固相抽出カートリッジに捕捉されずにカートリッジ外に排出される。
【0063】
次に、ステップS40において、洗浄液として純水1ミリリットルを固相抽出カートリッジに注入し、固相抽出カートリッジ表面に残存した塩類などの低分子成分を排出する。
【0064】
洗浄後、ステップS50において、50%メタノール水溶液1ミリリットルを固相抽出カートリッジに注入し、測定対象であるテオフィリンを溶出させる。溶出液は、遠心濃縮機を用いて蒸発幹固後、20%メタノール水溶液20マイクロリットルに再溶解することで、質量分析計への測定溶液が調製される。
【0065】
質量分析計としては、第1の実施形態と同様に、エレクトロスプレーイオン化法を備えたものが使用できる。また質量分析計への試料導入装置としては、液体クロマトグラフがはん用される。本実施形態では、液体クロマトグラフとして、日立ハイテクノロジーズ社製L−2100形ポンプ、L−2200形オートサンプラ、L−2300形カラムオーブンを用いた。液体クロマトグラフの分離カラムには、Hitachi−Inertsil−ODS−3(粒子径3μm、内径2.1mm、長さ100mm)を用いた。質量分析計として、アプライドバイオシステムズ社製三連四重極型質量分析計QTRAP3200を用いた。
【0066】
本実施形態でも、血清中テオフィリンを高い回収率で定量することができた。
【0067】
なお、ホスホコリンの分子量は約180であり、目的成分であるテオフィリンの分子量と同様である。従って、図2にて説明した第2の実施形態のようにステップS10,S20だけの処理の後、質量分析すると、ホスホコリンの質量量と、目的成分であるテオフィリンの質量数はほぼ同じであり、両者を分離することはできないものである。従って、加水分解酵素として、ホスホリパーゼCを用いる場合には、ステップS30における固相抽出カートリッジによる分離が必要となる。
【0068】
なお、酵素分解した成分と測定対象であるテオフィリンの分離精製を固相抽出カラムにて実施したが、固相抽出カラムと同様に疎水性相互作用により成分を分離可能な分離カラムを備えた液体クロマトグラフを用いても、本例のようにテオフィリンと夾雑成分を分離精製することが可能である。また液体クロマトグラフを用いる場合、カラムスイッチング法を用いることで酵素分解した血清試料溶液の分離精製とテオフィリン定量分析をオンラインで行うことも可能である。
【0069】
以上説明したように、本実施形態によれば、質量分析装置での測定に影響を与えるリン脂質を、溶液中から短時間で分解、除去することが可能となり、生体液中の微量成分を高精度な質量分析が実現できる。
【0070】
なお、ホスホリパーゼA1,A2を加水分解酵素として用いると、リン脂質の分解部位は、ホスホリパーゼD,Cよりも(化1)における右側となる。その結果、ホスホリパーゼA2を加水分解酵素として、ホスファチジルコリンを加水分解すると、リゾホスファチジルコリンと、他の成分とに分解される。リゾホスファチジルコリンは、(化2)における左辺の成分であるため、ホスホリパーゼA2では、所望の成分に分解することはできないものである。ホスホリパーゼA1についても、同様である。
【特許請求の範囲】
【請求項1】
生体液中の目的成分を質量分析装置を用いて測定する分析法に用いられるリン脂質の除去方法であって、
前記生体液中のリン脂質分子を分解することを特徴とするリン脂質の除去方法。
【請求項2】
請求項1記載のリン脂質の除去方法において、
リン酸部位で分解できる加水分解酵素をリン脂質に作用させることにより、前記リン脂質分子を分解することを特徴とするリン脂質の除去方法。
【請求項3】
請求項2記載のリン脂質の除去方法において、
前記加水分解酵素として、ホスホリパーゼDを用いることを特徴とするリン脂質の除去方法。
【請求項4】
請求項1記載のリン脂質の除去方法において、
前記リン脂質分子を分解した後、リン脂質の分解生成物と目的成分を分離することを特徴とするリン脂質の除去方法。
【請求項5】
請求項4記載のリン脂質の除去方法において、
前記加水分解酵素として、ホスホリパーゼC若しくはホスホリパーゼDを用いることを特徴とするリン脂質の除去方法。
【請求項6】
請求項4記載のリン脂質の除去方法において、
疎水性相互作用により成分を分離可能な手段を用いて、リン脂質の分解生成物と目的成分を分離することを特徴とするリン脂質の除去方法。
【請求項7】
請求項6記載のリン脂質の除去方法において、
疎水性相互作用により成分を分離可能な手段として、固相抽出カートリッジ若しくは液体クロマトグラフを用いることを特徴とするリン脂質の除去方法。
【請求項1】
生体液中の目的成分を質量分析装置を用いて測定する分析法に用いられるリン脂質の除去方法であって、
前記生体液中のリン脂質分子を分解することを特徴とするリン脂質の除去方法。
【請求項2】
請求項1記載のリン脂質の除去方法において、
リン酸部位で分解できる加水分解酵素をリン脂質に作用させることにより、前記リン脂質分子を分解することを特徴とするリン脂質の除去方法。
【請求項3】
請求項2記載のリン脂質の除去方法において、
前記加水分解酵素として、ホスホリパーゼDを用いることを特徴とするリン脂質の除去方法。
【請求項4】
請求項1記載のリン脂質の除去方法において、
前記リン脂質分子を分解した後、リン脂質の分解生成物と目的成分を分離することを特徴とするリン脂質の除去方法。
【請求項5】
請求項4記載のリン脂質の除去方法において、
前記加水分解酵素として、ホスホリパーゼC若しくはホスホリパーゼDを用いることを特徴とするリン脂質の除去方法。
【請求項6】
請求項4記載のリン脂質の除去方法において、
疎水性相互作用により成分を分離可能な手段を用いて、リン脂質の分解生成物と目的成分を分離することを特徴とするリン脂質の除去方法。
【請求項7】
請求項6記載のリン脂質の除去方法において、
疎水性相互作用により成分を分離可能な手段として、固相抽出カートリッジ若しくは液体クロマトグラフを用いることを特徴とするリン脂質の除去方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−220756(P2011−220756A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−88419(P2010−88419)
【出願日】平成22年4月7日(2010.4.7)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年4月7日(2010.4.7)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

