リン酸イオン吸着剤の製造方法、リン酸イオン回収方法、リン酸肥料の製造方法、リン酸イオン吸着剤
【課題】リン酸イオンを含む被処理溶液からリン酸イオンを効率的に回収することができるリン酸イオン吸着剤の製造方法を提供する。
【解決手段】本発明によれば、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法が提供される。
【解決手段】本発明によれば、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、リン酸イオン吸着剤の製造方法、リン酸イオン回収方法、リン酸肥料の製造方法、リン酸イオン吸着剤に関する。
【背景技術】
【0002】
リンは、農産物の成長にとって必須の元素であり、リン酸が肥料として用いられている。農産物中に取り込まれたリン酸は,人体や家畜などを経由して,最終的には排水に含まれるようになる。リン酸を含む排水が閉鎖性水域に流入すると、その水域で富栄養化が発生し、その現象により、生態系に変化が生じ、水道被害や漁業被害が問題となっている。また、リン酸は、一般にリン鉱石を原料として製造されるが、リン鉱石の埋蔵量には限りがあり、近い将来にリン鉱石が枯渇する可能性が指摘されている。従って、リン資源を有効に活用するために、排水などの、リン酸を含む溶液からリン酸を回収する技術が必要とされている。
【0003】
ところで、日本では、年間100万トンを越える使用済みガラスが再利用されず埋め立てなどによって廃棄処理されており、廃棄物問題は今や、社会問題となっている。特に、ガラス家電製品や自動車に使われる鉄や銅などの金属を作る際には、溶鉱炉で、大量のガラス状の廃棄物が発生する。また2011年からは地上デジタル放送が開始され、今まで多く使用されていたブラウン管テレビも大量に廃棄されると予想される。しかし、使用済みガラスは埋め立て処理されているものの、土壌汚染問題などもあり、将来的には廃棄物処分場の建設問題などが懸念されており、廃ガラスの新たな有効利用法を見出すことが必要とされている。
【0004】
このような状況下において、廃ガラスを粉砕したものを発泡剤と共に加熱処理することによって発泡ガラスを作成し、この発泡ガラスを用いてリン酸溶液からリン酸を回収する方法が提案されている(特許文献1を参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平2005−97065号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1では発泡ガラスをリン酸溶液中に浸漬させることによってリン酸を発泡ガラスに吸着させてリン酸を回収している。しかし、特許文献1に記載の方法では、リン酸の回収効率が十分に高いとはいえず、より効率的にリン酸を回収する方法が望まれている。
【0007】
本発明は上記事情に鑑みてなされたものであり、リン酸イオンを含む被処理溶液からリン酸イオンを効率的に回収することができるリン酸イオン吸着剤の製造方法を提供するものである。
【課題を解決するための手段】
【0008】
本発明によれば、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法が提供される。
【0009】
本発明者らは、鋭意研究を行った結果、上記の加熱処理を行うことによって発泡ガラスのリン酸イオン吸着能が劇的に向上することを見出し、本発明の完成に到った。リン酸イオン吸着能が向上する作用は必ずしも明らかではないが、加熱処理前後の発泡ガラスについてX線回折測定を行ったところ、加熱処理前の発泡ガラスでは鋭いピークが皆無であったのに対し、加熱処理後の発泡ガラスでは新たな鋭いピークが出現したことから、加熱処理によって発泡ガラスに由来する結晶成分が発泡ガラスの表面に形成され、この結晶成分が発泡ガラスのリン酸イオン吸着能向上に寄与していると推測される。
なお、本明細書において、「リン酸イオン」とは、リン酸イオンの種々の化学種(H2PO4−,HPO42−,PO43−)を包含する用語である。
【図面の簡単な説明】
【0010】
【図1】本発明の実施例にかかる、NaOH濃度とリン酸イオン吸着率の関係を示すグラフである(実施例1〜5に対応)。
【図2】本発明の実施例にかかる、加熱処理温度とリン酸イオン吸着率の関係を示すグラフである(実施例6〜10に対応)。
【図3】本発明の実施例にかかる、加熱処理時間とリン酸イオン吸着率の関係を示すグラフである(実施例11〜16に対応)。
【図4】本発明の実施例にかかる、リン酸溶液の初期pHとリン酸イオン吸着率の関係を示すグラフである(実施例17〜24に対応)。
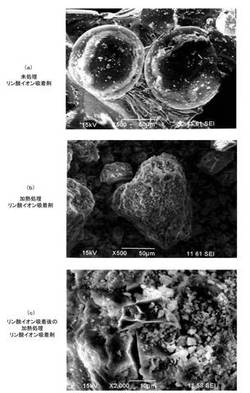
【図5】(a)〜(c)は、それぞれ、未処理リン酸イオン吸着剤、加熱処理済みのリン酸イオン吸着剤、リン酸イオン吸着後のリン酸イオン吸着剤についての電子顕微鏡写真を示す。
【図6】(a)〜(b)は、それぞれ、未処理リン酸イオン吸着剤及び加熱処理済みのリン酸イオン吸着剤についてのX線回折測定の結果を示す。
【図7】本発明の実施例にかかる、硝酸の濃度と、リン酸イオン回収率との関係を示すグラフである。
【発明を実施するための形態】
【0011】
以下、本発明の実施の形態について、図面を用いて説明する。
【0012】
1.リン酸イオン吸着剤の製造方法
本発明の一実施形態のリン酸イオン吸着剤の製造方法は、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備える。
以下、本発明の工程に含まれる各構成要素について詳細に説明する。
【0013】
(1)発泡ガラス
発泡ガラスとは、多数の細孔を有するガラスであり、一例では、粉砕したガラスと発泡剤とを混合したものを焼成することによって製造することができる。
以下、発泡ガラスの製造方法について詳細に説明する。
【0014】
まず、発泡ガラスの原料となるガラス(以下、「原料ガラス」と称する)を粉砕する。原料ガラスの種類は特に限定されないが、ソーダ石灰ガラス、ほうケイ酸ガラス、アルミノケイ酸ガラスなどが例示される。原料のガラスには、ブラウン管、液晶、プラズマディスプレイなどに由来する廃ガラスを用いてもよい。原料ガラスの粉砕方法は特に限定されず、市販の振動ミルなどを用いて粉砕することができる。粉砕後のガラス(以下、「粉砕ガラス」と称する)の粒径は、特に限定されないが、粉砕ガラスと発泡剤とが均一に混合されるように小さい方が好ましい。一例では、原料ガラスの粉砕後に目開きが500μm以下である篩を用いて粒度選別を行って、粉砕ガラスの粒径が500μm以下になるようにすることが好ましい。なお、本明細書において、「粒径がXμm以下である」とは、篩の目開きがXμmである篩を通りぬけるものであることを意味する。
【0015】
次に、粉砕ガラスと発泡剤とを混合する。また、この際、カルシウム、マグネシウム、鉄のうちの少なくとも1種を含む材料を加えることもできる。このような材料としては、具体的には、炭酸カルシウム、水酸化カルシウム、炭酸マグネシウム、水酸化マグネシウム、ベンガラ、フェライトなどが挙げられる。このような材料の含有量は、特に限定されないが、1〜20重量%が好ましく、5〜15重量%が特に好ましい。このような範囲内であれば、リン酸イオン吸着率の向上が顕著であるからである。発泡剤の種類は、特に限定されず、SiC、SiN,CaCO3や、CaCO3を含む材料(貝殻など)などを用いることができる。このような発泡剤は、ガラスが軟化する温度でガスを発生させるので、その結果、ガラス内部に多数の細孔が形成されて、発泡ガラスが製造される。また、発泡剤の含有量は、特に限定されないが、0.1〜5重量%が好ましく、0.2〜2.0重量%が特に好ましい。このような範囲内であれば、発泡が十分に起こり、かつ、発泡過剰による発泡ガラスの強度低下が生じることを避けることができるからである。
【0016】
次に、混合済みの粉砕ガラスと発泡剤を焼成する。焼成の温度や時間は、ガラスが適切に発泡するように、ガラスや発泡剤の種類に応じて適宜設定する。焼成温度は、一例では、600〜1150℃である。焼成温度は、ソーダ石灰ガラスについては、800〜1000℃が好ましい。このような範囲であれば、ガラスが十分に軟化して細孔が適切に形成され、かつ、ガラスが柔らかくなりすぎないので形成された細孔が再度塞がることを避けることができるからである。また、焼成時間は、一例では、1〜60分であり、好ましくは、5〜10分である。このような範囲内であれば、発泡が十分に起こり、かつ、形成された細孔が再度塞がったり泡がくっつきあうことによって表面の微細さが無くなったりすることを避けることができるからである。以上の工程によって発泡ガラスが製造される。製造された発泡ガラスは、塊状のまま用いてもよいが、粉砕したものを用いてもよい。粉砕後の発泡ガラスの粒径は、特に限定されないが、2mm以下が好ましく、1mm以下がさらに好ましく、0.6mm以下がさらに好ましい。
【0017】
(2)アルカリ溶液
アルカリ溶液とは、水に溶解して水酸基を生じさせる溶質が水に溶解した溶液である。溶質の種類は、特に限定されないが、例えば、NaOH、KOH、Na2CO3,及びCa(OH)2から選ばれる1又は2種以上を用いることができる。これらの中でも強アルカリであるNaOH又はKOHが特に好ましい。溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、0.5molL−1以上であることが好ましく、1molL−1以上であることがさらに好ましく、2molL−1以上であることがさらに好ましい。1molL−1以上の場合にリン酸イオンの吸着率が特に高くなり、2molL−1以上の場合にリン酸イオンの吸着率がさらに高くなるからである。また、溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、4molL−1以下であることが好ましく、3molL−1以下であることがさらに好ましい。3molL−1よりも大きくしてもリン酸イオンの吸着率は大きくは変化しないからである。従って、溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、1〜4molL−1が好ましく、2〜3molL−1が特に好ましい。
【0018】
(3)加熱処理
本実施形態の方法では、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う。
加圧の方法は、特に限定されず、加圧を行うための装置を用いて行ってもよく、単純に、前記発泡ガラスと前記アルカリ溶液を密閉容器中に収容した状態で前記加熱処理を行うことによって行ってもよい。後者の場合、アルカリ溶液が110℃以上に加熱されるので、アルカリ溶液に含まれる水の蒸気圧によってアルカリ溶液が加圧される。前者の場合は、印加する圧力を任意に変化させることができるので、加熱温度が比較的低い場合でも加える圧力を高くすることができる。また、後者の方法によれば、特別な装置を用いることなく、アルカリ溶液を加圧することができる。
【0019】
加熱の方法は、特に限定されず、室温が110℃以上である室内に発泡ガラスとアルカリ溶液を収容した容器を必要な時間載置することによって行ってもよく、また、アルカリ溶液に対してマイクロ波を照射することによって加熱してもよい。前者に方法によれば、恒温槽を用いることによって温度制御を比較的容易に行うことができる。後者の方法によれば、アルカリ溶液に含まれる水分子を直接振動させるので、加熱を効率的に行うことができる。
【0020】
加熱処理の温度は、110℃以上にする。110℃よりも加熱処理の温度を低くすると、リン酸イオン吸着率が急激に低下するからである。また、110℃を超えて120℃までは温度上昇に従ってリン酸イオン吸着率が大きく上昇し、120℃を超えると温度上昇に従ってリン酸イオン吸着率が緩やかに上昇し、140℃程度でほぼ上限値に達し、それ以上に温度を上げてもリン酸イオン吸着率がほとんど変化しない。温度を高くするとその分だけ危険性が増すと共にエネルギー消費が増大するので、加熱処理の温度は、180℃以下が好ましく、160℃以下がさらに好ましく、150℃以下がさらに好ましい。従って、加熱処理の温度は、110〜180℃が好ましく、120〜180がさらに好ましく、140〜150℃がさらに好ましい。
【0021】
なお、密閉容器中を用いずにアルカリ溶液を加圧する場合、110℃での水の飽和蒸気圧がほぼ1.4気圧であって上記の密閉容器の場合には若干の蒸気漏れがあることを考慮すると、1.2気圧以上が好ましく、1.4気圧以上がさらに好ましく、2気圧以上が特に好ましい。上限は、特に制限はないが、加える圧力が高くなるほど、加圧装置が高価になるので、20気圧以下が好ましく、10気圧以下がさらに好ましい。なお、180℃での水の飽和蒸気圧は、ほぼ10気圧である。
加熱処理の時間は、特に限定されないが、2時間よりも短い場合はリン酸イオン吸着率が大きく低下するので、2時間以上が好ましい。2時間以上4時間までは時間が長くなるに従ってリン酸イオン吸着率が大きく上昇し、4時間以上6時間までは時間が長くなるに従ってリン酸イオン吸着率が緩やかに上昇し、6時間程度でほぼ上限値に達し、それ以上に時間を長くしてもリン酸イオン吸着率がほとんど変化しない。時間を長くするとその分だけ製造コストが増大するので、加熱処理の時間は、24時間以下が好ましく、8時間以下がさらに好ましい。従って、加熱処理の時間は、2〜24時間が好ましく、4〜24時間がさらに好ましく、6〜8時間が特に好ましい。
【0022】
このような加熱処理の間に発泡ガラスにどのような変化が起きているのかは必ずしも明らかではない。しかし、加熱処理前後の発泡ガラスについてX線回折測定を行ったところ、加熱処理前の発泡ガラスでは鋭いピークが皆無であったのに対し、加熱処理後の発泡ガラスでは鋭いピークが出現したことから、加熱処理によって発泡ガラスに由来する結晶成分が発泡ガラスの表面に形成されていると推測される。従って、本実施形態の方法によれば、発泡ガラスの表面に前記発泡ガラスに由来する結晶成分が形成されているリン酸イオン吸着剤が得られる。
【0023】
加熱処理の際にカルシウムを添加してもよい。これによってリン酸イオン吸着率を向上させることができる。カルシウムの添加量は、1〜20重量%が好ましく、2〜15重量%がさらに好ましい。カルシウム源としては、CaOやCaCO3が好ましい。
【0024】
(4)洗浄処理
上記加熱処理の後、発泡ガラスに付着したアルカリ溶液を除去するために洗浄処理を行ってもよい。この洗浄処理を行う方法はアルカリ溶液を除去出来る方法であれば特に限定されないが、例えば、水又はpH緩衝溶液を用いて行うことができる。また、発泡ガラスにアルカリ溶液が付着していても問題ない場合には、洗浄処理の工程は省略してもよい。
【0025】
2.リン酸イオン回収方法
本発明の一実施形態のリン酸イオン回収方法は、上記のリン酸イオン吸着剤の製造方法で製造されたリン酸イオン吸着剤を被処理溶液中に浸漬させて前記被処理溶液中のリン酸イオンを前記リン酸イオン吸着剤に吸着させる工程を備える。
以下、本実施形態の方法に含まれる各構成要素について詳細に説明する。
【0026】
被処理溶液としては、リン酸イオンが含まれているであれば特に限定されず、例えば、生活排水や農業排水などが例示される。
【0027】
被処理溶液のpHは特に限定されないが、pHが2.4〜7.7であることが好ましく、2.8〜6.8であることが好ましく、pHが3.8〜6であることがさらに好ましい。pHがこのような範囲にある場合に、リン酸イオン吸着率が高くなるからである。また、被処理溶液のpHが上記の範囲外である場合には、酸又は塩基を添加することによって被処理溶液のpHが上記範囲内にするpH調整工程を備えることが好ましい。
【0028】
リン酸イオン吸着剤にリン酸イオンを吸着させた後は、リン酸イオン吸着剤を粉砕してリン酸肥料の原料とすることができる。
【0029】
また、リン酸イオン吸着剤を粉砕する代わりに、硝酸などの強酸を用いてリン酸イオン吸着剤からリン酸イオンを脱着させてリン酸イオンを回収してもよい。強酸の濃度は、特に限定されないが、0.01molL−1以上が好ましく、0.05molL−1以上がさらに好ましく、0.1molL−1がさらに好ましい。0.05molL−1以上の場合にリン酸イオンの回収率が高く、0.1molL−1の場合にリン酸イオンの回収率が特に高いからである。また、強酸の濃度の上限は、特に限定されないが、例えば、3molL−1以下である。
【実施例】
【0030】
以下、本発明の実施例について説明する。
【0031】
1.リン酸イオン吸着剤の製造
まず、ソーダ石灰ガラスを粒径が0.5mm以下になるように粉砕し、SiCからなる発泡剤を0.5重量%添加して、十分に混合したものを、900℃で7分間焼成することによって発泡ガラスを得た。この発泡ガラスを粒径が0.5mm以下になるように粉砕した。
次に、粉砕した発泡ガラス12gと、表1の濃度のNaOH溶液20mLを耐熱耐圧の密閉容器に収容し、表1の加熱処理温度に設定した恒温槽内で表1の加熱処理時間の加熱処理を行った。
その後、生成物を恒温槽から取り出し、デカンテーション法により脱イオン水とエタノールを用いて洗浄し、乾燥させて、リン酸イオン吸着剤を得た。
【0032】
2.リン酸イオン吸着実験
次に、上記方法で製造したリン酸イオン吸着剤0.25gと、1000μgmL−1のリン酸イオン溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加して表1のpHに調整後、25℃に設定した恒温槽内で4時間撹拌させた。
その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。測定値に基づいて、リン酸イオン吸着率を求めた。なお、リン酸イオン吸着率は、(初濃度−吸着平衡濃度)/初濃度×100%で定義される。
【0033】
【表1】

【0034】
3.リン酸イオン吸着実験の結果
上記の実施例1〜実施例24で得られたリン酸イオン吸着率に基づいて図1〜図4のグラフを作成した。図1は、NaOH濃度とリン酸イオン吸着率の関係を示すグラフであり(実施例1〜5に対応)、図2は、加熱処理温度とリン酸イオン吸着率の関係を示すグラフであり(実施例6〜10に対応)、図3は、加熱処理時間とリン酸イオン吸着率の関係を示すグラフであり(実施例11〜16に対応)、図4は、リン酸溶液の初期pHとリン酸イオン吸着率の関係を示すグラフである(実施例17〜24に対応)。
【0035】
図1のグラフから、NaOH濃度は、1〜4molL−1が好ましく、2〜3molL−1がさらに好ましいことが分かった。
また、図2のグラフから、加熱処理温度は、110〜180℃が好ましく、120〜180℃がさらに好ましく、140〜150℃が特に好ましいことが分かった。
また、図3のグラフから、加熱処理時間は、2時間以上が好ましく、4時間以上がさらに好ましく、6〜8時間が特に好ましいことが分かった。
また、図4のグラフから、リン酸溶液の初期pHは、pHが2.4〜7.7であることが好ましく、pHが2.8〜6.8であることがさらに好ましく、pHが3.8〜6であることが特に好ましいことが分かった。
【0036】
また、実施例14でのリン酸イオン吸着率に基づいてリン酸イオン吸着剤1g当たりのリン酸イオン吸着量を算出したところ、56.0mgであった。アルカリ溶液中での加熱処理を行っていないリン酸イオン吸着剤ではリン酸イオン吸着剤1g当たりのリン酸イオン吸着量は0.049mgであるとの報告があるので(稲永 忍他、人間と環境31(2005)11))、実施例14のリン酸イオン吸着剤は、未処理のリン酸イオン吸着剤に比べてリン酸イオン吸着量が100倍以上であることが分かった。
【0037】
4.発泡ガラスをベースとするリン酸イオン吸着剤の電子顕微鏡写真と組成分析結果
未処理のリン酸イオン吸着剤、加熱処理後のリン酸イオン吸着剤(実施例15)、及びリン酸イオン吸着後のリン酸イオン吸着剤のそれぞれについて、電子顕微鏡写真を撮影したものを図5(a)〜(c)に示す。図5(c)を参照すると、リン酸イオンに由来すると思われる白色の物質は、全体に均一に付着するのではなく、局所的に固まって付着する傾向があることが分かった。
また、組成分析を行ったところ、未処理のリン酸イオン吸着剤、加熱処理後のリン酸イオン吸着剤とでは、組成は実質的に変化していないことが分かった。
【0038】
5.リン酸イオン吸着剤のX線回折測定結果
次に、未処理のリン酸イオン吸着剤(発泡ガラス)と、実施例17の条件で加熱処理後のリン酸イオン吸着剤について、X線回折測定を行った。その結果を図6(a)〜(b)に示す。図6(a)は未処理のリン酸イオン吸着剤についてのデータであり、鋭いピークは全く存在していない。一方、図6(b)は加熱処理後のリン酸イオン吸着剤についてのデータであり、鋭いピークが複数存在していることが分かる。加熱処理の前後で組成は実質的に変化しないことが分かっているので、この鋭いピークは、加熱処理によってリン酸イオン吸着剤が部分的に結晶化したことに起因していると推測される。
【0039】
6.リン酸イオンの回収実験
次に、上記方法で製造したリン酸イオン吸着剤1.0gと、1000μgmL−1のリン酸イオン溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加してpH5−6に調整後、25℃に設定した恒温槽内で4時間撹拌させた。その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。この測定によってリン酸イオン吸着剤へのリン酸イオン吸着率を求めた。
【0040】
次に、遠心分離管中のリン酸イオンが吸着したリン酸イオン吸着剤を吸引ろ過器に移し、水で洗浄した。水洗後、フィルター上のリン酸イオン吸着剤を容器に入れ、これに所定濃度の硝酸20mLを加え、25℃に設定した恒温槽内で4時間撹拌させた。その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。これによって、リン酸イオン吸着剤に残留しているリン酸イオンの割合を求めた(「リン酸イオン残留率」と称する。)。
【0041】
次に、リン酸イオン回収率=1−(リン酸イオン残留率/リン酸イオン吸着率)に従って、リン酸イオン回収率を求めた。得られた結果に基づいて作成したグラフを図7に示す。
図7を参照すると、0.05molL−1以上の場合にリン酸イオンの回収率が高く、0.1molL−1の場合にリン酸イオンの回収率が特に高いことが分かる。
【0042】
7.発泡ガラスに鉄を混合することの効果の検証
7−1.リン酸イオン吸着剤の製造
まず、白、茶、緑、青色のソーダ石灰ガラスを混合したものを粒径が0.5mm
以下になるように粉砕し、CaCO3からなる発泡剤を0.5重量%添加して、十分に混合したものを、900℃で7分間焼成することによって発泡ガラスを得た。実施例25では、発泡剤と共にフェライトを12重量%添加した。実施例26では、フェライトを添加しなかった。得られた発泡ガラスを粒径が0.5mm以下になるように粉砕した。
次に、粉砕した発泡ガラス12gと、3molL−1、表1の濃度のNaOH溶液20mLを耐熱耐圧の密閉容器に収容し、140℃に設定した恒温槽内で6時間の加熱処理を行った。
その後、生成物を恒温槽から取り出し、デカンテーション法により脱イオン水とエタノールを用いて洗浄し、乾燥させて、リン酸イオン吸着剤を得た。
【0043】
7−2.リン酸イオン吸着実験
次に、上記方法で製造したリン酸イオン吸着剤0.5gと、100μgmL−1のリン酸溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加してpHを7.5に調整後、25℃に設定した恒温槽内で3時間撹拌させた。
【0044】
その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。測定値に基づいて、リン酸イオン吸着率を求めた。なお、リン酸イオン吸着率は、(初濃度−吸着平衡濃度)/初濃度×100%で定義される。また、リン酸イオン吸着率に基づいてリン酸イオン吸着量も求めた。その結果を表2に示す。
【0045】
【表2】

【0046】
表2から明らかなように、フェライトの添加によってリン酸イオン吸着率及び吸着量が大幅に向上していることが分かる。
なお、別途予備的に行った実験では、アルカリ溶液中での加熱処理の際にカルシウム(CaCO3)0.4gを発泡ガラス10gに混合し、アルカリ処理したところ、リン酸イオン吸着率が上昇した。この予備実験では、リン酸イオン濃度が1mgmL−1のリン酸溶液を用いた。
【技術分野】
【0001】
本発明は、リン酸イオン吸着剤の製造方法、リン酸イオン回収方法、リン酸肥料の製造方法、リン酸イオン吸着剤に関する。
【背景技術】
【0002】
リンは、農産物の成長にとって必須の元素であり、リン酸が肥料として用いられている。農産物中に取り込まれたリン酸は,人体や家畜などを経由して,最終的には排水に含まれるようになる。リン酸を含む排水が閉鎖性水域に流入すると、その水域で富栄養化が発生し、その現象により、生態系に変化が生じ、水道被害や漁業被害が問題となっている。また、リン酸は、一般にリン鉱石を原料として製造されるが、リン鉱石の埋蔵量には限りがあり、近い将来にリン鉱石が枯渇する可能性が指摘されている。従って、リン資源を有効に活用するために、排水などの、リン酸を含む溶液からリン酸を回収する技術が必要とされている。
【0003】
ところで、日本では、年間100万トンを越える使用済みガラスが再利用されず埋め立てなどによって廃棄処理されており、廃棄物問題は今や、社会問題となっている。特に、ガラス家電製品や自動車に使われる鉄や銅などの金属を作る際には、溶鉱炉で、大量のガラス状の廃棄物が発生する。また2011年からは地上デジタル放送が開始され、今まで多く使用されていたブラウン管テレビも大量に廃棄されると予想される。しかし、使用済みガラスは埋め立て処理されているものの、土壌汚染問題などもあり、将来的には廃棄物処分場の建設問題などが懸念されており、廃ガラスの新たな有効利用法を見出すことが必要とされている。
【0004】
このような状況下において、廃ガラスを粉砕したものを発泡剤と共に加熱処理することによって発泡ガラスを作成し、この発泡ガラスを用いてリン酸溶液からリン酸を回収する方法が提案されている(特許文献1を参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平2005−97065号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1では発泡ガラスをリン酸溶液中に浸漬させることによってリン酸を発泡ガラスに吸着させてリン酸を回収している。しかし、特許文献1に記載の方法では、リン酸の回収効率が十分に高いとはいえず、より効率的にリン酸を回収する方法が望まれている。
【0007】
本発明は上記事情に鑑みてなされたものであり、リン酸イオンを含む被処理溶液からリン酸イオンを効率的に回収することができるリン酸イオン吸着剤の製造方法を提供するものである。
【課題を解決するための手段】
【0008】
本発明によれば、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法が提供される。
【0009】
本発明者らは、鋭意研究を行った結果、上記の加熱処理を行うことによって発泡ガラスのリン酸イオン吸着能が劇的に向上することを見出し、本発明の完成に到った。リン酸イオン吸着能が向上する作用は必ずしも明らかではないが、加熱処理前後の発泡ガラスについてX線回折測定を行ったところ、加熱処理前の発泡ガラスでは鋭いピークが皆無であったのに対し、加熱処理後の発泡ガラスでは新たな鋭いピークが出現したことから、加熱処理によって発泡ガラスに由来する結晶成分が発泡ガラスの表面に形成され、この結晶成分が発泡ガラスのリン酸イオン吸着能向上に寄与していると推測される。
なお、本明細書において、「リン酸イオン」とは、リン酸イオンの種々の化学種(H2PO4−,HPO42−,PO43−)を包含する用語である。
【図面の簡単な説明】
【0010】
【図1】本発明の実施例にかかる、NaOH濃度とリン酸イオン吸着率の関係を示すグラフである(実施例1〜5に対応)。
【図2】本発明の実施例にかかる、加熱処理温度とリン酸イオン吸着率の関係を示すグラフである(実施例6〜10に対応)。
【図3】本発明の実施例にかかる、加熱処理時間とリン酸イオン吸着率の関係を示すグラフである(実施例11〜16に対応)。
【図4】本発明の実施例にかかる、リン酸溶液の初期pHとリン酸イオン吸着率の関係を示すグラフである(実施例17〜24に対応)。
【図5】(a)〜(c)は、それぞれ、未処理リン酸イオン吸着剤、加熱処理済みのリン酸イオン吸着剤、リン酸イオン吸着後のリン酸イオン吸着剤についての電子顕微鏡写真を示す。
【図6】(a)〜(b)は、それぞれ、未処理リン酸イオン吸着剤及び加熱処理済みのリン酸イオン吸着剤についてのX線回折測定の結果を示す。
【図7】本発明の実施例にかかる、硝酸の濃度と、リン酸イオン回収率との関係を示すグラフである。
【発明を実施するための形態】
【0011】
以下、本発明の実施の形態について、図面を用いて説明する。
【0012】
1.リン酸イオン吸着剤の製造方法
本発明の一実施形態のリン酸イオン吸着剤の製造方法は、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備える。
以下、本発明の工程に含まれる各構成要素について詳細に説明する。
【0013】
(1)発泡ガラス
発泡ガラスとは、多数の細孔を有するガラスであり、一例では、粉砕したガラスと発泡剤とを混合したものを焼成することによって製造することができる。
以下、発泡ガラスの製造方法について詳細に説明する。
【0014】
まず、発泡ガラスの原料となるガラス(以下、「原料ガラス」と称する)を粉砕する。原料ガラスの種類は特に限定されないが、ソーダ石灰ガラス、ほうケイ酸ガラス、アルミノケイ酸ガラスなどが例示される。原料のガラスには、ブラウン管、液晶、プラズマディスプレイなどに由来する廃ガラスを用いてもよい。原料ガラスの粉砕方法は特に限定されず、市販の振動ミルなどを用いて粉砕することができる。粉砕後のガラス(以下、「粉砕ガラス」と称する)の粒径は、特に限定されないが、粉砕ガラスと発泡剤とが均一に混合されるように小さい方が好ましい。一例では、原料ガラスの粉砕後に目開きが500μm以下である篩を用いて粒度選別を行って、粉砕ガラスの粒径が500μm以下になるようにすることが好ましい。なお、本明細書において、「粒径がXμm以下である」とは、篩の目開きがXμmである篩を通りぬけるものであることを意味する。
【0015】
次に、粉砕ガラスと発泡剤とを混合する。また、この際、カルシウム、マグネシウム、鉄のうちの少なくとも1種を含む材料を加えることもできる。このような材料としては、具体的には、炭酸カルシウム、水酸化カルシウム、炭酸マグネシウム、水酸化マグネシウム、ベンガラ、フェライトなどが挙げられる。このような材料の含有量は、特に限定されないが、1〜20重量%が好ましく、5〜15重量%が特に好ましい。このような範囲内であれば、リン酸イオン吸着率の向上が顕著であるからである。発泡剤の種類は、特に限定されず、SiC、SiN,CaCO3や、CaCO3を含む材料(貝殻など)などを用いることができる。このような発泡剤は、ガラスが軟化する温度でガスを発生させるので、その結果、ガラス内部に多数の細孔が形成されて、発泡ガラスが製造される。また、発泡剤の含有量は、特に限定されないが、0.1〜5重量%が好ましく、0.2〜2.0重量%が特に好ましい。このような範囲内であれば、発泡が十分に起こり、かつ、発泡過剰による発泡ガラスの強度低下が生じることを避けることができるからである。
【0016】
次に、混合済みの粉砕ガラスと発泡剤を焼成する。焼成の温度や時間は、ガラスが適切に発泡するように、ガラスや発泡剤の種類に応じて適宜設定する。焼成温度は、一例では、600〜1150℃である。焼成温度は、ソーダ石灰ガラスについては、800〜1000℃が好ましい。このような範囲であれば、ガラスが十分に軟化して細孔が適切に形成され、かつ、ガラスが柔らかくなりすぎないので形成された細孔が再度塞がることを避けることができるからである。また、焼成時間は、一例では、1〜60分であり、好ましくは、5〜10分である。このような範囲内であれば、発泡が十分に起こり、かつ、形成された細孔が再度塞がったり泡がくっつきあうことによって表面の微細さが無くなったりすることを避けることができるからである。以上の工程によって発泡ガラスが製造される。製造された発泡ガラスは、塊状のまま用いてもよいが、粉砕したものを用いてもよい。粉砕後の発泡ガラスの粒径は、特に限定されないが、2mm以下が好ましく、1mm以下がさらに好ましく、0.6mm以下がさらに好ましい。
【0017】
(2)アルカリ溶液
アルカリ溶液とは、水に溶解して水酸基を生じさせる溶質が水に溶解した溶液である。溶質の種類は、特に限定されないが、例えば、NaOH、KOH、Na2CO3,及びCa(OH)2から選ばれる1又は2種以上を用いることができる。これらの中でも強アルカリであるNaOH又はKOHが特に好ましい。溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、0.5molL−1以上であることが好ましく、1molL−1以上であることがさらに好ましく、2molL−1以上であることがさらに好ましい。1molL−1以上の場合にリン酸イオンの吸着率が特に高くなり、2molL−1以上の場合にリン酸イオンの吸着率がさらに高くなるからである。また、溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、4molL−1以下であることが好ましく、3molL−1以下であることがさらに好ましい。3molL−1よりも大きくしてもリン酸イオンの吸着率は大きくは変化しないからである。従って、溶質がNaOH又はKOHである場合、アルカリ溶液の濃度は、1〜4molL−1が好ましく、2〜3molL−1が特に好ましい。
【0018】
(3)加熱処理
本実施形態の方法では、発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う。
加圧の方法は、特に限定されず、加圧を行うための装置を用いて行ってもよく、単純に、前記発泡ガラスと前記アルカリ溶液を密閉容器中に収容した状態で前記加熱処理を行うことによって行ってもよい。後者の場合、アルカリ溶液が110℃以上に加熱されるので、アルカリ溶液に含まれる水の蒸気圧によってアルカリ溶液が加圧される。前者の場合は、印加する圧力を任意に変化させることができるので、加熱温度が比較的低い場合でも加える圧力を高くすることができる。また、後者の方法によれば、特別な装置を用いることなく、アルカリ溶液を加圧することができる。
【0019】
加熱の方法は、特に限定されず、室温が110℃以上である室内に発泡ガラスとアルカリ溶液を収容した容器を必要な時間載置することによって行ってもよく、また、アルカリ溶液に対してマイクロ波を照射することによって加熱してもよい。前者に方法によれば、恒温槽を用いることによって温度制御を比較的容易に行うことができる。後者の方法によれば、アルカリ溶液に含まれる水分子を直接振動させるので、加熱を効率的に行うことができる。
【0020】
加熱処理の温度は、110℃以上にする。110℃よりも加熱処理の温度を低くすると、リン酸イオン吸着率が急激に低下するからである。また、110℃を超えて120℃までは温度上昇に従ってリン酸イオン吸着率が大きく上昇し、120℃を超えると温度上昇に従ってリン酸イオン吸着率が緩やかに上昇し、140℃程度でほぼ上限値に達し、それ以上に温度を上げてもリン酸イオン吸着率がほとんど変化しない。温度を高くするとその分だけ危険性が増すと共にエネルギー消費が増大するので、加熱処理の温度は、180℃以下が好ましく、160℃以下がさらに好ましく、150℃以下がさらに好ましい。従って、加熱処理の温度は、110〜180℃が好ましく、120〜180がさらに好ましく、140〜150℃がさらに好ましい。
【0021】
なお、密閉容器中を用いずにアルカリ溶液を加圧する場合、110℃での水の飽和蒸気圧がほぼ1.4気圧であって上記の密閉容器の場合には若干の蒸気漏れがあることを考慮すると、1.2気圧以上が好ましく、1.4気圧以上がさらに好ましく、2気圧以上が特に好ましい。上限は、特に制限はないが、加える圧力が高くなるほど、加圧装置が高価になるので、20気圧以下が好ましく、10気圧以下がさらに好ましい。なお、180℃での水の飽和蒸気圧は、ほぼ10気圧である。
加熱処理の時間は、特に限定されないが、2時間よりも短い場合はリン酸イオン吸着率が大きく低下するので、2時間以上が好ましい。2時間以上4時間までは時間が長くなるに従ってリン酸イオン吸着率が大きく上昇し、4時間以上6時間までは時間が長くなるに従ってリン酸イオン吸着率が緩やかに上昇し、6時間程度でほぼ上限値に達し、それ以上に時間を長くしてもリン酸イオン吸着率がほとんど変化しない。時間を長くするとその分だけ製造コストが増大するので、加熱処理の時間は、24時間以下が好ましく、8時間以下がさらに好ましい。従って、加熱処理の時間は、2〜24時間が好ましく、4〜24時間がさらに好ましく、6〜8時間が特に好ましい。
【0022】
このような加熱処理の間に発泡ガラスにどのような変化が起きているのかは必ずしも明らかではない。しかし、加熱処理前後の発泡ガラスについてX線回折測定を行ったところ、加熱処理前の発泡ガラスでは鋭いピークが皆無であったのに対し、加熱処理後の発泡ガラスでは鋭いピークが出現したことから、加熱処理によって発泡ガラスに由来する結晶成分が発泡ガラスの表面に形成されていると推測される。従って、本実施形態の方法によれば、発泡ガラスの表面に前記発泡ガラスに由来する結晶成分が形成されているリン酸イオン吸着剤が得られる。
【0023】
加熱処理の際にカルシウムを添加してもよい。これによってリン酸イオン吸着率を向上させることができる。カルシウムの添加量は、1〜20重量%が好ましく、2〜15重量%がさらに好ましい。カルシウム源としては、CaOやCaCO3が好ましい。
【0024】
(4)洗浄処理
上記加熱処理の後、発泡ガラスに付着したアルカリ溶液を除去するために洗浄処理を行ってもよい。この洗浄処理を行う方法はアルカリ溶液を除去出来る方法であれば特に限定されないが、例えば、水又はpH緩衝溶液を用いて行うことができる。また、発泡ガラスにアルカリ溶液が付着していても問題ない場合には、洗浄処理の工程は省略してもよい。
【0025】
2.リン酸イオン回収方法
本発明の一実施形態のリン酸イオン回収方法は、上記のリン酸イオン吸着剤の製造方法で製造されたリン酸イオン吸着剤を被処理溶液中に浸漬させて前記被処理溶液中のリン酸イオンを前記リン酸イオン吸着剤に吸着させる工程を備える。
以下、本実施形態の方法に含まれる各構成要素について詳細に説明する。
【0026】
被処理溶液としては、リン酸イオンが含まれているであれば特に限定されず、例えば、生活排水や農業排水などが例示される。
【0027】
被処理溶液のpHは特に限定されないが、pHが2.4〜7.7であることが好ましく、2.8〜6.8であることが好ましく、pHが3.8〜6であることがさらに好ましい。pHがこのような範囲にある場合に、リン酸イオン吸着率が高くなるからである。また、被処理溶液のpHが上記の範囲外である場合には、酸又は塩基を添加することによって被処理溶液のpHが上記範囲内にするpH調整工程を備えることが好ましい。
【0028】
リン酸イオン吸着剤にリン酸イオンを吸着させた後は、リン酸イオン吸着剤を粉砕してリン酸肥料の原料とすることができる。
【0029】
また、リン酸イオン吸着剤を粉砕する代わりに、硝酸などの強酸を用いてリン酸イオン吸着剤からリン酸イオンを脱着させてリン酸イオンを回収してもよい。強酸の濃度は、特に限定されないが、0.01molL−1以上が好ましく、0.05molL−1以上がさらに好ましく、0.1molL−1がさらに好ましい。0.05molL−1以上の場合にリン酸イオンの回収率が高く、0.1molL−1の場合にリン酸イオンの回収率が特に高いからである。また、強酸の濃度の上限は、特に限定されないが、例えば、3molL−1以下である。
【実施例】
【0030】
以下、本発明の実施例について説明する。
【0031】
1.リン酸イオン吸着剤の製造
まず、ソーダ石灰ガラスを粒径が0.5mm以下になるように粉砕し、SiCからなる発泡剤を0.5重量%添加して、十分に混合したものを、900℃で7分間焼成することによって発泡ガラスを得た。この発泡ガラスを粒径が0.5mm以下になるように粉砕した。
次に、粉砕した発泡ガラス12gと、表1の濃度のNaOH溶液20mLを耐熱耐圧の密閉容器に収容し、表1の加熱処理温度に設定した恒温槽内で表1の加熱処理時間の加熱処理を行った。
その後、生成物を恒温槽から取り出し、デカンテーション法により脱イオン水とエタノールを用いて洗浄し、乾燥させて、リン酸イオン吸着剤を得た。
【0032】
2.リン酸イオン吸着実験
次に、上記方法で製造したリン酸イオン吸着剤0.25gと、1000μgmL−1のリン酸イオン溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加して表1のpHに調整後、25℃に設定した恒温槽内で4時間撹拌させた。
その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。測定値に基づいて、リン酸イオン吸着率を求めた。なお、リン酸イオン吸着率は、(初濃度−吸着平衡濃度)/初濃度×100%で定義される。
【0033】
【表1】

【0034】
3.リン酸イオン吸着実験の結果
上記の実施例1〜実施例24で得られたリン酸イオン吸着率に基づいて図1〜図4のグラフを作成した。図1は、NaOH濃度とリン酸イオン吸着率の関係を示すグラフであり(実施例1〜5に対応)、図2は、加熱処理温度とリン酸イオン吸着率の関係を示すグラフであり(実施例6〜10に対応)、図3は、加熱処理時間とリン酸イオン吸着率の関係を示すグラフであり(実施例11〜16に対応)、図4は、リン酸溶液の初期pHとリン酸イオン吸着率の関係を示すグラフである(実施例17〜24に対応)。
【0035】
図1のグラフから、NaOH濃度は、1〜4molL−1が好ましく、2〜3molL−1がさらに好ましいことが分かった。
また、図2のグラフから、加熱処理温度は、110〜180℃が好ましく、120〜180℃がさらに好ましく、140〜150℃が特に好ましいことが分かった。
また、図3のグラフから、加熱処理時間は、2時間以上が好ましく、4時間以上がさらに好ましく、6〜8時間が特に好ましいことが分かった。
また、図4のグラフから、リン酸溶液の初期pHは、pHが2.4〜7.7であることが好ましく、pHが2.8〜6.8であることがさらに好ましく、pHが3.8〜6であることが特に好ましいことが分かった。
【0036】
また、実施例14でのリン酸イオン吸着率に基づいてリン酸イオン吸着剤1g当たりのリン酸イオン吸着量を算出したところ、56.0mgであった。アルカリ溶液中での加熱処理を行っていないリン酸イオン吸着剤ではリン酸イオン吸着剤1g当たりのリン酸イオン吸着量は0.049mgであるとの報告があるので(稲永 忍他、人間と環境31(2005)11))、実施例14のリン酸イオン吸着剤は、未処理のリン酸イオン吸着剤に比べてリン酸イオン吸着量が100倍以上であることが分かった。
【0037】
4.発泡ガラスをベースとするリン酸イオン吸着剤の電子顕微鏡写真と組成分析結果
未処理のリン酸イオン吸着剤、加熱処理後のリン酸イオン吸着剤(実施例15)、及びリン酸イオン吸着後のリン酸イオン吸着剤のそれぞれについて、電子顕微鏡写真を撮影したものを図5(a)〜(c)に示す。図5(c)を参照すると、リン酸イオンに由来すると思われる白色の物質は、全体に均一に付着するのではなく、局所的に固まって付着する傾向があることが分かった。
また、組成分析を行ったところ、未処理のリン酸イオン吸着剤、加熱処理後のリン酸イオン吸着剤とでは、組成は実質的に変化していないことが分かった。
【0038】
5.リン酸イオン吸着剤のX線回折測定結果
次に、未処理のリン酸イオン吸着剤(発泡ガラス)と、実施例17の条件で加熱処理後のリン酸イオン吸着剤について、X線回折測定を行った。その結果を図6(a)〜(b)に示す。図6(a)は未処理のリン酸イオン吸着剤についてのデータであり、鋭いピークは全く存在していない。一方、図6(b)は加熱処理後のリン酸イオン吸着剤についてのデータであり、鋭いピークが複数存在していることが分かる。加熱処理の前後で組成は実質的に変化しないことが分かっているので、この鋭いピークは、加熱処理によってリン酸イオン吸着剤が部分的に結晶化したことに起因していると推測される。
【0039】
6.リン酸イオンの回収実験
次に、上記方法で製造したリン酸イオン吸着剤1.0gと、1000μgmL−1のリン酸イオン溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加してpH5−6に調整後、25℃に設定した恒温槽内で4時間撹拌させた。その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。この測定によってリン酸イオン吸着剤へのリン酸イオン吸着率を求めた。
【0040】
次に、遠心分離管中のリン酸イオンが吸着したリン酸イオン吸着剤を吸引ろ過器に移し、水で洗浄した。水洗後、フィルター上のリン酸イオン吸着剤を容器に入れ、これに所定濃度の硝酸20mLを加え、25℃に設定した恒温槽内で4時間撹拌させた。その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。これによって、リン酸イオン吸着剤に残留しているリン酸イオンの割合を求めた(「リン酸イオン残留率」と称する。)。
【0041】
次に、リン酸イオン回収率=1−(リン酸イオン残留率/リン酸イオン吸着率)に従って、リン酸イオン回収率を求めた。得られた結果に基づいて作成したグラフを図7に示す。
図7を参照すると、0.05molL−1以上の場合にリン酸イオンの回収率が高く、0.1molL−1の場合にリン酸イオンの回収率が特に高いことが分かる。
【0042】
7.発泡ガラスに鉄を混合することの効果の検証
7−1.リン酸イオン吸着剤の製造
まず、白、茶、緑、青色のソーダ石灰ガラスを混合したものを粒径が0.5mm
以下になるように粉砕し、CaCO3からなる発泡剤を0.5重量%添加して、十分に混合したものを、900℃で7分間焼成することによって発泡ガラスを得た。実施例25では、発泡剤と共にフェライトを12重量%添加した。実施例26では、フェライトを添加しなかった。得られた発泡ガラスを粒径が0.5mm以下になるように粉砕した。
次に、粉砕した発泡ガラス12gと、3molL−1、表1の濃度のNaOH溶液20mLを耐熱耐圧の密閉容器に収容し、140℃に設定した恒温槽内で6時間の加熱処理を行った。
その後、生成物を恒温槽から取り出し、デカンテーション法により脱イオン水とエタノールを用いて洗浄し、乾燥させて、リン酸イオン吸着剤を得た。
【0043】
7−2.リン酸イオン吸着実験
次に、上記方法で製造したリン酸イオン吸着剤0.5gと、100μgmL−1のリン酸溶液(被処理溶液に相当)20mLとを容器に収容し、硝酸を添加してpHを7.5に調整後、25℃に設定した恒温槽内で3時間撹拌させた。
【0044】
その後、3000rpmで10分間の遠心分離を行い、上澄み液中のリン酸イオン濃度をモリブデンブルー法による吸光光度計により測定した。測定値に基づいて、リン酸イオン吸着率を求めた。なお、リン酸イオン吸着率は、(初濃度−吸着平衡濃度)/初濃度×100%で定義される。また、リン酸イオン吸着率に基づいてリン酸イオン吸着量も求めた。その結果を表2に示す。
【0045】
【表2】

【0046】
表2から明らかなように、フェライトの添加によってリン酸イオン吸着率及び吸着量が大幅に向上していることが分かる。
なお、別途予備的に行った実験では、アルカリ溶液中での加熱処理の際にカルシウム(CaCO3)0.4gを発泡ガラス10gに混合し、アルカリ処理したところ、リン酸イオン吸着率が上昇した。この予備実験では、リン酸イオン濃度が1mgmL−1のリン酸溶液を用いた。
【特許請求の範囲】
【請求項1】
発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法。
【請求項2】
前記加圧は、前記発泡ガラスと前記アルカリ溶液を密閉容器中に収容した状態で前記加熱処理を行うことによって行う請求項1に記載の方法。
【請求項3】
前記加熱処理は、2時間以上行う請求項1又は2に記載の方法。
【請求項4】
前記アルカリ溶液は、NaOH又はKOH溶液であり、その濃度が1〜4molL−1である請求項1〜3の何れか1つに記載の方法。
【請求項5】
前記発泡ガラスは、ソーダ石灰ガラスの発泡体である請求項1〜4の何れか1つに記載の方法。
【請求項6】
前記発泡ガラスは、カルシウム、マグネシウム、鉄のうちの少なくとも1種を含む材料を含む請求項1〜5の何れか1つに記載の方法。
【請求項7】
請求項1〜6の何れか1つに記載の方法で製造されたリン酸イオン吸着剤を被処理溶液中に浸漬させて前記被処理溶液中のリン酸イオンを前記リン酸イオン吸着剤に吸着させる工程を備えるリン酸イオン回収方法。
【請求項8】
前記被処理溶液は、前記リン酸イオン吸着剤を浸漬させる前のpHが2.4〜7.7である請求項7に記載の方法。
【請求項9】
請求項7又は8に記載の方法でリン酸イオンを吸着させた前記リン酸イオン吸着剤を粉砕する工程を備えるリン酸肥料の製造方法。
【請求項10】
請求項1〜6の何れか1つに記載の方法で製造されたリン酸イオン吸着剤。
【請求項11】
発泡ガラスの表面に前記発泡ガラスに由来する結晶成分が形成されているリン酸イオン吸着剤。
【請求項1】
発泡ガラスをアルカリ溶液中に浸漬させた状態で、加圧下で110℃以上の温度での加熱処理を行う工程を備えるリン酸イオン吸着剤の製造方法。
【請求項2】
前記加圧は、前記発泡ガラスと前記アルカリ溶液を密閉容器中に収容した状態で前記加熱処理を行うことによって行う請求項1に記載の方法。
【請求項3】
前記加熱処理は、2時間以上行う請求項1又は2に記載の方法。
【請求項4】
前記アルカリ溶液は、NaOH又はKOH溶液であり、その濃度が1〜4molL−1である請求項1〜3の何れか1つに記載の方法。
【請求項5】
前記発泡ガラスは、ソーダ石灰ガラスの発泡体である請求項1〜4の何れか1つに記載の方法。
【請求項6】
前記発泡ガラスは、カルシウム、マグネシウム、鉄のうちの少なくとも1種を含む材料を含む請求項1〜5の何れか1つに記載の方法。
【請求項7】
請求項1〜6の何れか1つに記載の方法で製造されたリン酸イオン吸着剤を被処理溶液中に浸漬させて前記被処理溶液中のリン酸イオンを前記リン酸イオン吸着剤に吸着させる工程を備えるリン酸イオン回収方法。
【請求項8】
前記被処理溶液は、前記リン酸イオン吸着剤を浸漬させる前のpHが2.4〜7.7である請求項7に記載の方法。
【請求項9】
請求項7又は8に記載の方法でリン酸イオンを吸着させた前記リン酸イオン吸着剤を粉砕する工程を備えるリン酸肥料の製造方法。
【請求項10】
請求項1〜6の何れか1つに記載の方法で製造されたリン酸イオン吸着剤。
【請求項11】
発泡ガラスの表面に前記発泡ガラスに由来する結晶成分が形成されているリン酸イオン吸着剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−161398(P2011−161398A)
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願番号】特願2010−28938(P2010−28938)
【出願日】平成22年2月12日(2010.2.12)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【出願人】(592072791)鳥取県 (19)
【出願人】(510040363)株式会社鳥取再資源化研究所 (2)
【Fターム(参考)】
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願日】平成22年2月12日(2010.2.12)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【出願人】(592072791)鳥取県 (19)
【出願人】(510040363)株式会社鳥取再資源化研究所 (2)
【Fターム(参考)】
[ Back to top ]

