リン酸カルシウム分解活性定量方法
【課題】 多検体の薬剤スクリーニングや機能解析を短時間に実施可能な骨吸収活性評価法を提供すること。
【解決手段】 あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【解決手段】 あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、簡便なリン酸カルシウム分解活性定量方法に関する。
【背景技術】
【0002】
骨組織は、骨を形成する骨芽細胞と、骨を吸収する破骨細胞により恒常性が維持されている。骨芽細胞と破骨細胞は互いに影響することが知られており、両者のバランスが崩れることで骨疾患が誘発されることも明らかになっている。例えば、主要な骨疾患である骨粗鬆症においては、破骨細胞による骨吸収が骨芽細胞による骨形成を上回ることが一因と考えられている。骨粗鬆症に対する医薬品としては、骨芽細胞に作用する薬剤より、破骨細胞に作用する薬剤が現在、多く使用されている。例えば、一連のビスフォスフォネート製剤は、破骨細胞に直接作用し、骨吸収を抑制することが作用機序の一つと考えられている(非特許文献1)。
【0003】
このような、骨代謝のメカニズム、疾患の発症機序および薬剤の効果は、実験動物を用いた薬剤の投与試験や遺伝子ノックアウトの手法により明らかになってきている。しかしながら、これらの手法は、多額の費用と時間を要し、動物倫理の面からの問題点も存在する。さらに、薬効の比較や作用機序の解明には、一定の細胞集団を用いたin vitroの細胞培養系の方が適している場合が多く、分化段階の異なる細胞種を選択することで、薬剤の評価や分子の機能解析を詳細に研究することが可能となる。
【0004】
破骨細胞は、単球・マクロファージ由来の細胞が分化し、融合することで形成された多核細胞である。破骨細胞の分化に関しては、酒石酸耐性酸フォスファターゼ染色やアクチンリングの形成、カテプシンやコラゲナーゼに代表されるマトリックス分解酵素の発現など破骨細胞分化マーカーを用いた評価が可能である。しかしながら、これらの方法は、骨吸収を直接、評価する方法ではなく、また、操作が煩雑あるいは定量性に乏しく、薬剤スクリーニングなどの多サンプルの活性評価系には不向きである。一方、破骨細胞の機能による評価として、ピットアッセイによる骨吸収活性の測定が一般に行われている(非特許文献2、特許文献1)。ピットアッセイとは、象牙などの生体由来硬組織あるいはリン酸カルシウムが固相化されたプレート上で破骨細胞を培養し、リン酸カルシウムの吸収窩(ピット)を評価する方法である。このピットアッセイも、画像解析ソフト等を用いて吸収された面積あるいは数を測定するために、解析に多くの時間を要する。
【0005】
カルシウムと結合する蛍光物質であるカルセイン(分子量622.53)を用いて、破骨細胞が形成したピットを観察した例は存在するが(非特許文献3)、ピットの面積あるいは数を反映するマーカーとしてカルセインを用いた報告はない。さらに、他の定量的な骨吸収法に関する試みも報告されているが、培養条件等が制約されており、一般的な簡便法には至っていない(非特許文献4)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005-192447号公報
【非特許文献】
【0007】
【非特許文献1】Rogers MJ., et al, J Bone Miner Res. 11(10):1482-91, 1996
【非特許文献2】Breuil V., J Bone Miner Res. 13(11):1721-9, 1998
【非特許文献3】Coxon FP., Bone. 42(5):848-60, 2008
【非特許文献4】Sugawara K., Anal Biochem. Jan 15;255(2):204-10, 1998
【発明の概要】
【発明が解決しようとする課題】
【0008】
通常、ピットアッセイは、次亜塩素酸や界面活性剤などを用いて、破骨細胞培養後のプレートから付着している細胞を除き、洗浄した後、そのまま、あるいは色素でリン酸カルシウム層を染色し、光学顕微鏡または電子顕微鏡を用いて、吸収された領域(ピット)の面積を画像解析により測定する方法が一般的である。ピットアッセイは実際の骨吸収活性を評価できる優れた方法であるが、ピットの面積を、画像解析装置を用いて測定するため、評価に時間を要する。また、測定誤差や変動が大きい欠点を有する。このような手間と時間を要し、測定誤差や変動が大きいピットアッセイに代わり、多検体の薬剤スクリーニングや機能解析を短時間に実施可能な骨吸収活性評価法が望まれていた。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決すべく鋭意検討を重ねた結果、エステル硫酸基、またはエステルリン酸基を有する糖、または核酸がリン酸カルシウム層と結合し、かつ、破骨細胞による骨吸収作用により、これらがリン酸カルシウム層から遊出することを発見した。当該現象に基づき、糖または核酸を利用した簡便なリン酸カルシウム分解活性測定方法を発明した。
【0010】
すなわち、本発明は以下の通りである。
1.あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が、下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
2.前記細胞が骨吸収活性を有する細胞またはその前駆細胞であることを特徴とする1記載のリン酸カルシウム分解活性定量方法。
3.前記糖または前記核酸の分子量が5,000以上である1又は2記載のリン酸カルシウム分解活性定量方法。
4.前記糖がグリコサミノグリカンである1乃至3に記載のリン酸カルシウム分解活性定量方法。
5.前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である4記載のリン酸カルシウム分解活性定量方法。
6.前記糖又は前記核酸が、色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上によりさらに標識されている1乃至5いずれか一項記載のリン酸カルシウム分解活性定量方法。
7.前記リン酸カルシウムが、天然由来もしくは合成のリン酸カルシウム結晶または象牙、骨もしくは歯由来硬組織のいずれかより選択される1乃至6いずれか一項記載のリン酸カルシウム分解活性定量方法。
8.下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレート。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
9.前記糖または前記核酸の分子量が5,000以上である8記載の培養プレート。
10.前記糖がグリコサミノグリカンである8又は9記載の培養プレート。
11.前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である10記載の培養プレート。
12.前記糖又は前記核酸が、さらに色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている8乃至11いずれか記載の培養プレート。
【発明の効果】
【0011】
本発明により、簡便で迅速なリン酸カルシウム分解活性定量方法が提供される。
【図面の簡単な説明】
【0012】
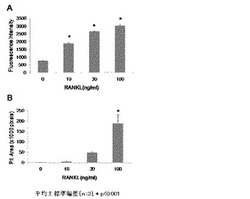
【図1】FACPS基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清の蛍光強度(図1A)と形成されたpitの面積(図1B)で測定した結果である。
【図2】FACPS基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収に対するβ-EstradiolあるいはPamidronateの作用を検討した結果である。図2Aは培養上清中に遊出した蛍光強度を、図2Bは形成されたpitの面積を測定した図である。図2Cは上清中の蛍光強度とpit面積の相関のグラフである。
【図3】DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清中のDNA量(図3A)と形成されたpitの面積(図3B)で測定した結果である。
【図4】標識DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清の蛍光強度(図4A)と形成されたpitの面積(図4B)で測定した結果である。
【図5】標識DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収に対するPamidronateの作用を検討した結果である。図5Aは培養上清中に遊出した蛍光強度を、図5Bは形成されたpitの面積を測定した図である。図5Cは上清中の蛍光強度とpit面積の相関のグラフである。
【図6】カルセイン基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収を、遊出した培養上清の蛍光強度と形成されたpitの面積で測定した結果である。図6A:カルセイン基質を用いた場合の蛍光強度、図6B:カルセイン基質を用いた場合のpit面積。
【発明を実施するための形態】
【0013】
以下、発明を実施するための最良の形態により本発明を詳説する。
【0014】
骨の約70%は無機質(ミネラル)、約20%はたん白質である。たん白質の約90%はコラーゲンである。無機質はリン酸カルシウムの結晶からなる。リン酸カルシウムには組成および結晶形の異なる数種類のものが存在するが、骨においては大部分がハイドロキシアパタイトである。骨の無機質は破骨細胞により吸収され、骨芽細胞により産生される。
【0015】
本発明者らは、エステル硫酸基、またはエステルリン酸基を有する糖、または核酸がリン酸カルシウム層と結合するものの、破骨細胞の骨吸収活性により、リン酸カルシウム層から遊出することを利用し、エステル硫酸基、またはエステルリン酸基を有する糖または核酸を結合させたリン酸カルシウム層上(以下、基質と略す。)において破骨細胞を培養し、骨吸収作用により培地中に溶出した糖あるいは核酸、または基質中に残存した糖あるいは核酸を測定することによる、新規の骨吸収活性評価法を考案した。さらに、これらの糖あるいは核酸を予め標識することで測定がより簡便になる。
1.本発明定量方法
【0016】
本発明定量方法とは、あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化することを特徴とするリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの標識物質が、下記群の物質であるリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【0017】
本発明定量方法は、培養基板上に固相化した「標識物質で標識されたリン酸カルシウム」が培養対象物によって分解されて培地中に遊離した際に、その標識物質を測定することにより培養対象物のリン酸カルシウム分解能を定量化する方法である。
【0018】
本発明におけるエステル硫酸基またはエステルリン酸基を有する糖は、天然に存在するこれらエステル基を有する酸性糖あるいは、酸性糖または中性糖に人工的にエステル硫酸基またはエステルリン酸基を導入した糖である。天然に存在するエステル硫酸基を有する糖として、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸、フコイダン、アガロースなどが知られている。この他、グルコース、マンノース、ガラクトースのような単糖、シュクロース、フルクトース、マルトースのような二糖、ヒアルロン酸、アルギン酸、デキストラン、セルロース、グリコーゲン、キチン、キトサン、グルカン、ペクチン、カラゲナンのような多糖やこれらの修飾体などに人工的にエステル硫酸基またはエステルリン酸基を導入したものあるいは、天然のエステル硫酸基またはエステルリン酸基を有する糖にさらに人工的にエステル硫酸基またはエステルリン酸基を導入したものでも構わない。
【0019】
天然のエステル硫酸基を有する多糖のうち、コンドロイチン硫酸(CS)には、N-アセチルガラクトサミンの4位に硫酸基が結合したコンドロイチン硫酸A(CS-A)あるいはコンドロイチン硫酸B(CS-B、別名:デルマタン硫酸)、N-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸C(CS-C)の単硫酸化CSに加え、グルクロン酸の2位およびN-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸D(CS-D)や、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸E(CS-E)、イズロン酸とN-アセチルガラクトサミンの二糖構造において、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸H(CS-H)などの、繰り返し二糖単位に硫酸基を2個以上有する構造を含む多硫酸化コンドロイチン硫酸が存在する。また、CS以外に、多硫酸化多糖としてヘパリン、ヘパラン硫酸が知られている。本発明に使用する天然のエステル硫酸基を有する多糖としては、リン酸カルシウムとの親和性が高い多硫酸化体の方が単硫酸化体に比較して、より適している。また、人工的にエステル硫酸基を導入した多糖として、合成多硫酸化コンドロイチン硫酸(CPS)やデキストラン硫酸があり、これらは医薬品と市販されて、比較的細胞毒性も低いと考えられるため、これらあるいはこれらの標識体を使用しても構わない。また、本発明に使用する糖は、直鎖のものに限定されず、分枝していても良い。
【0020】
本発明におけるエステル硫酸基またはエステルリン酸基を有する核酸とは、天然に存在するデオキシリボ核酸(DNA)、リボ核酸(RNA)あるいはこれらの修飾体のことである。RNAは不安定であるため、DNAを用いることが望ましい。DNAの由来としてはウシ胸腺やサケ精子のものが市販され入手も簡便であるが、これらに限定されるものではない。
【0021】
糖を基質に使用した場合、その検出法としては特に限定されるものではなく、カルバゾール硫酸法やジメチルメチレンブルー、アルシアンブルー、トルイジンブルーなどの一般的な比色法により評価が可能である。核酸を用いた場合も、Hoechst33258やピコグリンなどの一般的な蛍光色素を用いた定量法により評価が可能である。基質中に残存した糖あるいは核酸は、エチレンジアミン四酢酸(EDTA)などのキレートや酸でリン酸カルシウムを溶解後、上記の測定法により評価することができる。また、培地中に遊離したものは直接、上記の測定法により評価することができる。
【0022】
糖あるいは核酸を標識することでより簡便に評価が可能となる。標識に使用する物質については、ペルオキシダーゼやアルカリホスファターゼなどの酵素、ビオチン、ラジオアイソトープ、可視あるいは蛍光色素等が挙げられるが、これらに限定されるものではない。安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。硫酸化多糖への標識法については、一例として、Ogamoらの方法(Ogamo A., Carbohydr Res. 105(1):69-85, 1982)を挙げることができる。核酸の標識法としては、核酸に特異的に結合する色素、例えばHoechst33258、Hoechst33342、Propidium iodide、Ethidium bromide、DAPI、アクリジンオレンジなどが簡便に利用できるが、これらに限定されるものではなく、安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。
【0023】
エステル硫酸基またはエステルリン酸基を導入した糖、または核酸の重量平均分子量は、特に限定されないが、リン酸カルシウム層に安定して結合する5000Da以上が好ましく、6000Da以上がさらに好ましい。糖や核酸の平均分子量は、同一試料でも測定法、測定条件等によって多少異なることが一般的に知られており、本発明においても上記平均分子量の範囲に厳密に限定されるべきものではない。
【0024】
本発明に使用するリン酸カルシウムは、ハイドロキシアパタイト、α−リン酸三カルシウム、リン酸四カルシウム、第二リン酸カルシウム二水塩、フッ素アパタイト、炭酸含有アパタイト、第二リン酸カルシウム無水塩、β−リン酸三カルシウム、リン酸八カルシウム、非結晶リン酸カルシウム、第一リン酸カルシウム無水塩、第一リン酸カルシウム一水塩などが挙げられ、破骨細胞の培養が可能な形状であれば問題はない。これらの焼結体でも構わないが、水和相を多く有する未焼結体の方が好ましい。また、象牙、骨、歯等の生体由来硬組織およびこれらのスライスあるいは粉体を用いても構わない。本発明評価法における基質の形状に関しては、破骨細胞の培養が可能なものであれば特に限定されないが、凹凸の少ない平坦な基質であることが好ましい。
【0025】
リン酸カルシウムへの糖または核酸の結合法に関しては特に限定されず、糖または核酸とリン酸カルシウムを水溶液中で結合させ、その後、リン酸塩緩衝化生理食塩液(PBS)、生理食塩液、培地等で洗浄すれば構わない。
【0026】
骨吸収活性を有する細胞とは主として破骨細胞のことであるが、骨髄細胞やマクロファージ由来の弱い骨吸収活性を有する前破骨細胞も含まれる。破骨細胞の培養法としては、特に限定されないが、骨髄細胞、単球、マクロファージあるいはこれらの株化細胞に、RANKL(Receptor activator of NF-κB ligand)やM-CSF(Macrophage-Colony Stimulating Factor)あるいはTNF-α(Tumor Necrosis Factor-α)やプロスタグランジンなどの既知の破骨細胞分化因子などを作用させ、成熟破骨細胞に分化を誘導する。その他の分化誘導因子を用いても構わない。あるいは、骨芽細胞などとの共存培養系により、破骨細胞を誘導させる方法でも構わない。
【0027】
破骨細胞による骨吸収作用を阻害する薬剤の種類については、特に限定されるものではなく、破骨細胞の骨吸収活性の抑制作用を有する薬剤が対象となる。あるいは、破骨細胞との共存培養においては、共存する細胞に作用する薬剤でも構わない。例えば、種々のビスフォスフォネート製剤、ビタミンK、エストロゲンおよびその誘導体、カルシトニン、副甲状腺ホルモン、RANK-RANKLの結合阻害剤などが挙げられる。ビスフォスフォネート製剤は、カルシウムと親和性を有し、破骨細胞の骨吸収作用の際に、同時に細胞内に取り込まれて作用を発揮するため、本発明の基質に結合させて、その作用を評価することも可能である。
【0028】
また、本発明による本発明定量方法によれば、ミュータンス菌などの細菌が産生する酸によるリン酸カルシウム分解活性を測定することも可能である。さらに本発明による方法を用いて、虫歯予防薬剤のスクリーニング系を構築することも可能である。
2.本発明プレート
【0029】
本発明プレートは、下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレートである。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【0030】
本発明プレートは、上述の本発明定量方法に用いることができる培養プレートである。本発明プレートにおける「リン酸カルシウム」は、ハイドロキシアパタイト、α−リン酸三カルシウム、リン酸四カルシウム、第二リン酸カルシウム二水塩、フッ素アパタイト、炭酸含有アパタイト、第二リン酸カルシウム無水塩、β−リン酸三カルシウム、リン酸八カルシウム、非結晶リン酸カルシウム、第一リン酸カルシウム無水塩、第一リン酸カルシウム一水塩などが挙げられる。これらの焼結体でも構わないが、水和相を多く有する未焼結体の方が、生体内の状況の再現性が著しく高いため好ましい。また、象牙、骨、歯等の生体由来硬組織およびこれらのスライスあるいは粉体を用いても構わない。
【0031】
本発明プレートにおける培養プレートとしては、市販の培養用のプレート等が利用可能であり、一般的に用いられるポリエチレンやポリスチレンなどの樹脂製プレートであっても、ガラス製プレートであってもいずれも使用可能である。またその形状は、シャーレのような形状であっても、マルチプレートであっても使用可能である。
【0032】
かかるプレートへのリン酸カルシウムの固相化方法は、物理的な吸着方法であっても化学的な吸着方法であっても、或いはプレートの製造時における材料へのリン酸カルシウム混合による方法であっても、いずれでも良い。
【0033】
本発明プレートにおけるエステル硫酸基またはエステルリン酸基を有する糖は、天然に存在するこれらエステル基を有する酸性糖あるいは、酸性糖または中性糖に人工的にエステル硫酸基またはエステルリン酸基を導入した糖である。天然に存在するエステル硫酸基を有する糖として、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸、フコイダン、アガロースなどが知られている。この他、グルコース、マンノース、ガラクトースのような単糖、シュクロース、フルクトース、マルトースのような二糖、ヒアルロン酸、アルギン酸、デキストラン、セルロース、グリコーゲン、キチン、キトサン、グルカン、ペクチン、カラゲナンのような多糖やこれらの修飾体などに人工的にエステル硫酸基またはエステルリン酸基を導入したものあるいは、天然のエステル硫酸基またはエステルリン酸基を有する糖にさらに人工的にエステル硫酸基またはエステルリン酸基を導入したものでも構わない。
【0034】
天然のエステル硫酸基を有する多糖のうち、コンドロイチン硫酸(CS)には、N-アセチルガラクトサミンの4位に硫酸基が結合したコンドロイチン硫酸A(CS-A)あるいはコンドロイチン硫酸B(CS-B、別名:デルマタン硫酸)、N-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸C(CS-C)の単硫酸化CSに加え、グルクロン酸の2位およびN-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸D(CS-D)や、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸E(CS-E)、イズロン酸とN-アセチルガラクトサミンの二糖構造において、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸H(CS-H)などの、繰り返し二糖単位に硫酸基を2個以上有する構造を含む多硫酸化コンドロイチン硫酸が存在する。また、CS以外に、多硫酸化多糖としてヘパリン、ヘパラン硫酸が知られている。本発明に使用する天然のエステル硫酸基を有する多糖としては、リン酸カルシウムとの親和性が高い多硫酸化体の方が単硫酸化体に比較して、より適している。また、人工的にエステル硫酸基を導入した多糖として、合成多硫酸化コンドロイチン硫酸(CPS)やデキストラン硫酸があり、これらは医薬品と市販されて、比較的細胞毒性も低いと考えられるため、これらあるいはこれらの標識体を使用しても構わない。また、本発明プレートに使用する糖は、直鎖のものに限定されず、分枝していても良い。
【0035】
本発明プレートにおけるエステル硫酸基またはエステルリン酸基を有する核酸とは、天然に存在するデオキシリボ核酸(DNA)、リボ核酸(RNA)あるいはこれらの修飾体のことである。RNAは不安定であるため、DNAを用いることが望ましい。DNAの由来としてはウシ胸腺やサケ精子のものが市販され入手も簡便であるが、これらに限定されるものではない。
【0036】
さらに、糖あるいは核酸を標識することで、プレートの使用時に、より簡便に評価が可能となる。標識に使用する物質については、ペルオキシダーゼやアルカリホスファターゼなどの酵素、ビオチン、ラジオアイソトープ、可視あるいは蛍光色素等が挙げられるが、これらに限定されるものではない。安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。硫酸化多糖への標識法については、一例として、Ogamoらの方法(Ogamo A., Carbohydr Res. 105(1):69-85, 1982)を挙げることができる。核酸の標識法としては、核酸に特異的に結合する色素、例えばHoechst33258、Hoechst33342、Propidium iodide、Ethidium bromide、DAPI、アクリジンオレンジなどが簡便に利用できるが、これらに限定されるものではなく、安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。
【0037】
エステル硫酸基またはエステルリン酸基を導入した糖、または核酸の重量平均分子量は、特に限定されないが、リン酸カルシウム層に安定して結合する5000Da以上が好ましく、6000Da以上がさらに好ましい。糖や核酸の平均分子量は、同一試料でも測定法、測定条件等によって多少異なることが一般的に知られており、本発明においても上記平均分子量の範囲に厳密に限定されるべきものではない。
【0038】
このような本発明プレートは、上述の本発明定量方法に用いることができる。特に、本発明プレートの他に、必要な試薬などもセットとした定量キットとすることで、たとえば、骨分解能を亢進又は抑制する化合物・薬剤のスクリーニングや、齲歯抑制剤のスクリーニングなど、幅広く使用することが可能となる。
【実施例1】
【0039】
予め37℃の5%CO2インキュベータ内に5時間以上放置し、炭酸ガスを含ませた0.2M CaCl2溶液(50mM Tris HCl pH7.4)と等量の120mM Na2HPO4溶液を混合し、CO2インキュベータ内で5分間インキュベートしてアパタイトを作製した。蒸留水で洗浄した後、アパタイト懸濁液を24wellプレートに添加し、37℃で一晩乾燥した。次に、80℃で3時間殺菌することでアパタイト固相化プレートを作製した。
【0040】
アパタイト固相化24wellプレートに、100μg/mLのフルオレセインアミン標識多硫酸化コンドロイチン硫酸(FACPS、PGリサーチ)を含むPBSを0.5mL/wellで添加し、37℃で2時間インキュベートした。PBSおよび培地で洗浄し、FACPS基質固相化プレートを作製した。
【0041】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellでFACPS基質固相化24wellプレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)を添加し、37℃、5%CO2条件下で培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。
【0042】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、FACPS基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定を用いた。
【0043】
RANKLの濃度に依存して、培養上清中の蛍光強度およびpitの面積は増大した(図1A、1B)。
【実施例2】
【0044】
実施例1と同様の条件にて、FACPS基質固相化プレートを作製し、RAW264細胞を播種した。同時に100ng/mLのRANKLおよび、破骨細胞の骨吸収抑制作用を有するPamidronate(ノバルティスファーマ、30、100μM)あるいはβ-estradiol(和光純薬、10、100nM)を添加し培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、FACPS基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0045】
RANKL添加により培養上清の蛍光強度が上昇したが、Pamidronate添加群ではその上昇が強く抑制された(図2A)。β-estradiol添加群では弱い抑制作用であった。また、pitの面積においても同様の作用が認められた(図2B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図2C)。
【実施例3】
【0046】
実施例1と同様の条件にて、アパタイト固相化プレート(24well)を作製した。アパタイト固相化プレートにDNA溶液(ウシ胸腺由来、Worthington社製、100μg/mL)を0.5mLずつ添加し、37℃で2時間インキュベートした。PBSおよび培地で洗浄することで、DNA基質固相化プレートを作製した。
【0047】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellでDNA基質固相化プレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)を添加し、37℃、5%CO2条件下で6日間培養した。培養上清を回収し、Hoechst33258溶液と混合した後、蛍光強度(励起波長355nm、蛍光波長460nm)をプレートリーダーで測定した。標準DNA溶液の値を基に、培養上清中のDNA量を算出した。
【0048】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、DNA基質固相化プレートに付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0049】
RANKLの濃度に依存して、培養上清中のDNA量およびpitの面積は増大した(図3A、3B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図3C)。
【実施例4】
【0050】
実施例1と同様の条件にて、アパタイト固相化プレート(24well)を作製した。アパタイト固相化プレートにDNA溶液(ウシ胸腺由来、Worthington社製、100μg/mL)を0.5mLずつ添加し、37℃で2時間インキュベートした。PBSで3回洗浄した後、Hoechst33258溶液(10μg/mL)を0.5mLずつ添加し、さらに1時間インキュベートした。PBSおよび培地で洗浄することで、標識DNA基質固相化プレートを作製した。
【0051】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellで標識DNA基質固相化プレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)あるいは、RANKL(100ng/mL)およびPamidronate(ノバルティスファーマ、1、10、100μM)を添加し、37℃、5%CO2条件下で6日間培養した。培養上清を回収し、蛍光強度(励起波長355nm、蛍光波長460nm)をプレートリーダーで測定した。
【0052】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、標識DNA基質固相化プレートに付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0053】
RANKLの濃度に依存して、培養上清中の蛍光強度およびpitの面積は増大した(図4A、4B)。また、RANKL添加により上昇した蛍光強度およびpitの面積は、Pamidronate添加群において強く抑制された(図5A、図5B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図5C)。
【実施例5】
【0054】
実施例1と同様の条件にて作製したアパタイト固相化プレートに、100μg/mLのカルセイン溶液(和光純薬)を添加し、同じ手法によりカルセイン基質固相化プレートを作製した。このプレートにRAW264細胞を播種し、同時にRANKLを添加して、37℃、5%CO2条件下で培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。
【0055】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、それぞれの基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定を用いた。
【0056】
カルシウムと親和性の高い蛍光物質であるカルセインを用いた基質固相化プレートにおいては、pitの面積はRANKLの濃度依存的に増大したものの、蛍光強度の濃度依存的上昇は認められなかった(図6A、6B)。
【産業上の利用可能性】
【0057】
本発明は、新規リン酸カルシウム分解活性定量方法およびその方法に使用する培養プレートに関するものであり、医薬品開発等で利用することができる。
【技術分野】
【0001】
本発明は、簡便なリン酸カルシウム分解活性定量方法に関する。
【背景技術】
【0002】
骨組織は、骨を形成する骨芽細胞と、骨を吸収する破骨細胞により恒常性が維持されている。骨芽細胞と破骨細胞は互いに影響することが知られており、両者のバランスが崩れることで骨疾患が誘発されることも明らかになっている。例えば、主要な骨疾患である骨粗鬆症においては、破骨細胞による骨吸収が骨芽細胞による骨形成を上回ることが一因と考えられている。骨粗鬆症に対する医薬品としては、骨芽細胞に作用する薬剤より、破骨細胞に作用する薬剤が現在、多く使用されている。例えば、一連のビスフォスフォネート製剤は、破骨細胞に直接作用し、骨吸収を抑制することが作用機序の一つと考えられている(非特許文献1)。
【0003】
このような、骨代謝のメカニズム、疾患の発症機序および薬剤の効果は、実験動物を用いた薬剤の投与試験や遺伝子ノックアウトの手法により明らかになってきている。しかしながら、これらの手法は、多額の費用と時間を要し、動物倫理の面からの問題点も存在する。さらに、薬効の比較や作用機序の解明には、一定の細胞集団を用いたin vitroの細胞培養系の方が適している場合が多く、分化段階の異なる細胞種を選択することで、薬剤の評価や分子の機能解析を詳細に研究することが可能となる。
【0004】
破骨細胞は、単球・マクロファージ由来の細胞が分化し、融合することで形成された多核細胞である。破骨細胞の分化に関しては、酒石酸耐性酸フォスファターゼ染色やアクチンリングの形成、カテプシンやコラゲナーゼに代表されるマトリックス分解酵素の発現など破骨細胞分化マーカーを用いた評価が可能である。しかしながら、これらの方法は、骨吸収を直接、評価する方法ではなく、また、操作が煩雑あるいは定量性に乏しく、薬剤スクリーニングなどの多サンプルの活性評価系には不向きである。一方、破骨細胞の機能による評価として、ピットアッセイによる骨吸収活性の測定が一般に行われている(非特許文献2、特許文献1)。ピットアッセイとは、象牙などの生体由来硬組織あるいはリン酸カルシウムが固相化されたプレート上で破骨細胞を培養し、リン酸カルシウムの吸収窩(ピット)を評価する方法である。このピットアッセイも、画像解析ソフト等を用いて吸収された面積あるいは数を測定するために、解析に多くの時間を要する。
【0005】
カルシウムと結合する蛍光物質であるカルセイン(分子量622.53)を用いて、破骨細胞が形成したピットを観察した例は存在するが(非特許文献3)、ピットの面積あるいは数を反映するマーカーとしてカルセインを用いた報告はない。さらに、他の定量的な骨吸収法に関する試みも報告されているが、培養条件等が制約されており、一般的な簡便法には至っていない(非特許文献4)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2005-192447号公報
【非特許文献】
【0007】
【非特許文献1】Rogers MJ., et al, J Bone Miner Res. 11(10):1482-91, 1996
【非特許文献2】Breuil V., J Bone Miner Res. 13(11):1721-9, 1998
【非特許文献3】Coxon FP., Bone. 42(5):848-60, 2008
【非特許文献4】Sugawara K., Anal Biochem. Jan 15;255(2):204-10, 1998
【発明の概要】
【発明が解決しようとする課題】
【0008】
通常、ピットアッセイは、次亜塩素酸や界面活性剤などを用いて、破骨細胞培養後のプレートから付着している細胞を除き、洗浄した後、そのまま、あるいは色素でリン酸カルシウム層を染色し、光学顕微鏡または電子顕微鏡を用いて、吸収された領域(ピット)の面積を画像解析により測定する方法が一般的である。ピットアッセイは実際の骨吸収活性を評価できる優れた方法であるが、ピットの面積を、画像解析装置を用いて測定するため、評価に時間を要する。また、測定誤差や変動が大きい欠点を有する。このような手間と時間を要し、測定誤差や変動が大きいピットアッセイに代わり、多検体の薬剤スクリーニングや機能解析を短時間に実施可能な骨吸収活性評価法が望まれていた。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決すべく鋭意検討を重ねた結果、エステル硫酸基、またはエステルリン酸基を有する糖、または核酸がリン酸カルシウム層と結合し、かつ、破骨細胞による骨吸収作用により、これらがリン酸カルシウム層から遊出することを発見した。当該現象に基づき、糖または核酸を利用した簡便なリン酸カルシウム分解活性測定方法を発明した。
【0010】
すなわち、本発明は以下の通りである。
1.あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が、下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
2.前記細胞が骨吸収活性を有する細胞またはその前駆細胞であることを特徴とする1記載のリン酸カルシウム分解活性定量方法。
3.前記糖または前記核酸の分子量が5,000以上である1又は2記載のリン酸カルシウム分解活性定量方法。
4.前記糖がグリコサミノグリカンである1乃至3に記載のリン酸カルシウム分解活性定量方法。
5.前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である4記載のリン酸カルシウム分解活性定量方法。
6.前記糖又は前記核酸が、色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上によりさらに標識されている1乃至5いずれか一項記載のリン酸カルシウム分解活性定量方法。
7.前記リン酸カルシウムが、天然由来もしくは合成のリン酸カルシウム結晶または象牙、骨もしくは歯由来硬組織のいずれかより選択される1乃至6いずれか一項記載のリン酸カルシウム分解活性定量方法。
8.下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレート。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
9.前記糖または前記核酸の分子量が5,000以上である8記載の培養プレート。
10.前記糖がグリコサミノグリカンである8又は9記載の培養プレート。
11.前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である10記載の培養プレート。
12.前記糖又は前記核酸が、さらに色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている8乃至11いずれか記載の培養プレート。
【発明の効果】
【0011】
本発明により、簡便で迅速なリン酸カルシウム分解活性定量方法が提供される。
【図面の簡単な説明】
【0012】
【図1】FACPS基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清の蛍光強度(図1A)と形成されたpitの面積(図1B)で測定した結果である。
【図2】FACPS基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収に対するβ-EstradiolあるいはPamidronateの作用を検討した結果である。図2Aは培養上清中に遊出した蛍光強度を、図2Bは形成されたpitの面積を測定した図である。図2Cは上清中の蛍光強度とpit面積の相関のグラフである。
【図3】DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清中のDNA量(図3A)と形成されたpitの面積(図3B)で測定した結果である。
【図4】標識DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収作用を、遊出した培養上清の蛍光強度(図4A)と形成されたpitの面積(図4B)で測定した結果である。
【図5】標識DNA基質固相化プレートにてRAW264細胞を培養し、RANKL添加により誘導された骨吸収に対するPamidronateの作用を検討した結果である。図5Aは培養上清中に遊出した蛍光強度を、図5Bは形成されたpitの面積を測定した図である。図5Cは上清中の蛍光強度とpit面積の相関のグラフである。
【図6】カルセイン基質上にてRAW264細胞を培養し、RANKL添加により誘導された骨吸収を、遊出した培養上清の蛍光強度と形成されたpitの面積で測定した結果である。図6A:カルセイン基質を用いた場合の蛍光強度、図6B:カルセイン基質を用いた場合のpit面積。
【発明を実施するための形態】
【0013】
以下、発明を実施するための最良の形態により本発明を詳説する。
【0014】
骨の約70%は無機質(ミネラル)、約20%はたん白質である。たん白質の約90%はコラーゲンである。無機質はリン酸カルシウムの結晶からなる。リン酸カルシウムには組成および結晶形の異なる数種類のものが存在するが、骨においては大部分がハイドロキシアパタイトである。骨の無機質は破骨細胞により吸収され、骨芽細胞により産生される。
【0015】
本発明者らは、エステル硫酸基、またはエステルリン酸基を有する糖、または核酸がリン酸カルシウム層と結合するものの、破骨細胞の骨吸収活性により、リン酸カルシウム層から遊出することを利用し、エステル硫酸基、またはエステルリン酸基を有する糖または核酸を結合させたリン酸カルシウム層上(以下、基質と略す。)において破骨細胞を培養し、骨吸収作用により培地中に溶出した糖あるいは核酸、または基質中に残存した糖あるいは核酸を測定することによる、新規の骨吸収活性評価法を考案した。さらに、これらの糖あるいは核酸を予め標識することで測定がより簡便になる。
1.本発明定量方法
【0016】
本発明定量方法とは、あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化することを特徴とするリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの標識物質が、下記群の物質であるリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【0017】
本発明定量方法は、培養基板上に固相化した「標識物質で標識されたリン酸カルシウム」が培養対象物によって分解されて培地中に遊離した際に、その標識物質を測定することにより培養対象物のリン酸カルシウム分解能を定量化する方法である。
【0018】
本発明におけるエステル硫酸基またはエステルリン酸基を有する糖は、天然に存在するこれらエステル基を有する酸性糖あるいは、酸性糖または中性糖に人工的にエステル硫酸基またはエステルリン酸基を導入した糖である。天然に存在するエステル硫酸基を有する糖として、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸、フコイダン、アガロースなどが知られている。この他、グルコース、マンノース、ガラクトースのような単糖、シュクロース、フルクトース、マルトースのような二糖、ヒアルロン酸、アルギン酸、デキストラン、セルロース、グリコーゲン、キチン、キトサン、グルカン、ペクチン、カラゲナンのような多糖やこれらの修飾体などに人工的にエステル硫酸基またはエステルリン酸基を導入したものあるいは、天然のエステル硫酸基またはエステルリン酸基を有する糖にさらに人工的にエステル硫酸基またはエステルリン酸基を導入したものでも構わない。
【0019】
天然のエステル硫酸基を有する多糖のうち、コンドロイチン硫酸(CS)には、N-アセチルガラクトサミンの4位に硫酸基が結合したコンドロイチン硫酸A(CS-A)あるいはコンドロイチン硫酸B(CS-B、別名:デルマタン硫酸)、N-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸C(CS-C)の単硫酸化CSに加え、グルクロン酸の2位およびN-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸D(CS-D)や、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸E(CS-E)、イズロン酸とN-アセチルガラクトサミンの二糖構造において、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸H(CS-H)などの、繰り返し二糖単位に硫酸基を2個以上有する構造を含む多硫酸化コンドロイチン硫酸が存在する。また、CS以外に、多硫酸化多糖としてヘパリン、ヘパラン硫酸が知られている。本発明に使用する天然のエステル硫酸基を有する多糖としては、リン酸カルシウムとの親和性が高い多硫酸化体の方が単硫酸化体に比較して、より適している。また、人工的にエステル硫酸基を導入した多糖として、合成多硫酸化コンドロイチン硫酸(CPS)やデキストラン硫酸があり、これらは医薬品と市販されて、比較的細胞毒性も低いと考えられるため、これらあるいはこれらの標識体を使用しても構わない。また、本発明に使用する糖は、直鎖のものに限定されず、分枝していても良い。
【0020】
本発明におけるエステル硫酸基またはエステルリン酸基を有する核酸とは、天然に存在するデオキシリボ核酸(DNA)、リボ核酸(RNA)あるいはこれらの修飾体のことである。RNAは不安定であるため、DNAを用いることが望ましい。DNAの由来としてはウシ胸腺やサケ精子のものが市販され入手も簡便であるが、これらに限定されるものではない。
【0021】
糖を基質に使用した場合、その検出法としては特に限定されるものではなく、カルバゾール硫酸法やジメチルメチレンブルー、アルシアンブルー、トルイジンブルーなどの一般的な比色法により評価が可能である。核酸を用いた場合も、Hoechst33258やピコグリンなどの一般的な蛍光色素を用いた定量法により評価が可能である。基質中に残存した糖あるいは核酸は、エチレンジアミン四酢酸(EDTA)などのキレートや酸でリン酸カルシウムを溶解後、上記の測定法により評価することができる。また、培地中に遊離したものは直接、上記の測定法により評価することができる。
【0022】
糖あるいは核酸を標識することでより簡便に評価が可能となる。標識に使用する物質については、ペルオキシダーゼやアルカリホスファターゼなどの酵素、ビオチン、ラジオアイソトープ、可視あるいは蛍光色素等が挙げられるが、これらに限定されるものではない。安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。硫酸化多糖への標識法については、一例として、Ogamoらの方法(Ogamo A., Carbohydr Res. 105(1):69-85, 1982)を挙げることができる。核酸の標識法としては、核酸に特異的に結合する色素、例えばHoechst33258、Hoechst33342、Propidium iodide、Ethidium bromide、DAPI、アクリジンオレンジなどが簡便に利用できるが、これらに限定されるものではなく、安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。
【0023】
エステル硫酸基またはエステルリン酸基を導入した糖、または核酸の重量平均分子量は、特に限定されないが、リン酸カルシウム層に安定して結合する5000Da以上が好ましく、6000Da以上がさらに好ましい。糖や核酸の平均分子量は、同一試料でも測定法、測定条件等によって多少異なることが一般的に知られており、本発明においても上記平均分子量の範囲に厳密に限定されるべきものではない。
【0024】
本発明に使用するリン酸カルシウムは、ハイドロキシアパタイト、α−リン酸三カルシウム、リン酸四カルシウム、第二リン酸カルシウム二水塩、フッ素アパタイト、炭酸含有アパタイト、第二リン酸カルシウム無水塩、β−リン酸三カルシウム、リン酸八カルシウム、非結晶リン酸カルシウム、第一リン酸カルシウム無水塩、第一リン酸カルシウム一水塩などが挙げられ、破骨細胞の培養が可能な形状であれば問題はない。これらの焼結体でも構わないが、水和相を多く有する未焼結体の方が好ましい。また、象牙、骨、歯等の生体由来硬組織およびこれらのスライスあるいは粉体を用いても構わない。本発明評価法における基質の形状に関しては、破骨細胞の培養が可能なものであれば特に限定されないが、凹凸の少ない平坦な基質であることが好ましい。
【0025】
リン酸カルシウムへの糖または核酸の結合法に関しては特に限定されず、糖または核酸とリン酸カルシウムを水溶液中で結合させ、その後、リン酸塩緩衝化生理食塩液(PBS)、生理食塩液、培地等で洗浄すれば構わない。
【0026】
骨吸収活性を有する細胞とは主として破骨細胞のことであるが、骨髄細胞やマクロファージ由来の弱い骨吸収活性を有する前破骨細胞も含まれる。破骨細胞の培養法としては、特に限定されないが、骨髄細胞、単球、マクロファージあるいはこれらの株化細胞に、RANKL(Receptor activator of NF-κB ligand)やM-CSF(Macrophage-Colony Stimulating Factor)あるいはTNF-α(Tumor Necrosis Factor-α)やプロスタグランジンなどの既知の破骨細胞分化因子などを作用させ、成熟破骨細胞に分化を誘導する。その他の分化誘導因子を用いても構わない。あるいは、骨芽細胞などとの共存培養系により、破骨細胞を誘導させる方法でも構わない。
【0027】
破骨細胞による骨吸収作用を阻害する薬剤の種類については、特に限定されるものではなく、破骨細胞の骨吸収活性の抑制作用を有する薬剤が対象となる。あるいは、破骨細胞との共存培養においては、共存する細胞に作用する薬剤でも構わない。例えば、種々のビスフォスフォネート製剤、ビタミンK、エストロゲンおよびその誘導体、カルシトニン、副甲状腺ホルモン、RANK-RANKLの結合阻害剤などが挙げられる。ビスフォスフォネート製剤は、カルシウムと親和性を有し、破骨細胞の骨吸収作用の際に、同時に細胞内に取り込まれて作用を発揮するため、本発明の基質に結合させて、その作用を評価することも可能である。
【0028】
また、本発明による本発明定量方法によれば、ミュータンス菌などの細菌が産生する酸によるリン酸カルシウム分解活性を測定することも可能である。さらに本発明による方法を用いて、虫歯予防薬剤のスクリーニング系を構築することも可能である。
2.本発明プレート
【0029】
本発明プレートは、下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレートである。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【0030】
本発明プレートは、上述の本発明定量方法に用いることができる培養プレートである。本発明プレートにおける「リン酸カルシウム」は、ハイドロキシアパタイト、α−リン酸三カルシウム、リン酸四カルシウム、第二リン酸カルシウム二水塩、フッ素アパタイト、炭酸含有アパタイト、第二リン酸カルシウム無水塩、β−リン酸三カルシウム、リン酸八カルシウム、非結晶リン酸カルシウム、第一リン酸カルシウム無水塩、第一リン酸カルシウム一水塩などが挙げられる。これらの焼結体でも構わないが、水和相を多く有する未焼結体の方が、生体内の状況の再現性が著しく高いため好ましい。また、象牙、骨、歯等の生体由来硬組織およびこれらのスライスあるいは粉体を用いても構わない。
【0031】
本発明プレートにおける培養プレートとしては、市販の培養用のプレート等が利用可能であり、一般的に用いられるポリエチレンやポリスチレンなどの樹脂製プレートであっても、ガラス製プレートであってもいずれも使用可能である。またその形状は、シャーレのような形状であっても、マルチプレートであっても使用可能である。
【0032】
かかるプレートへのリン酸カルシウムの固相化方法は、物理的な吸着方法であっても化学的な吸着方法であっても、或いはプレートの製造時における材料へのリン酸カルシウム混合による方法であっても、いずれでも良い。
【0033】
本発明プレートにおけるエステル硫酸基またはエステルリン酸基を有する糖は、天然に存在するこれらエステル基を有する酸性糖あるいは、酸性糖または中性糖に人工的にエステル硫酸基またはエステルリン酸基を導入した糖である。天然に存在するエステル硫酸基を有する糖として、コンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸、フコイダン、アガロースなどが知られている。この他、グルコース、マンノース、ガラクトースのような単糖、シュクロース、フルクトース、マルトースのような二糖、ヒアルロン酸、アルギン酸、デキストラン、セルロース、グリコーゲン、キチン、キトサン、グルカン、ペクチン、カラゲナンのような多糖やこれらの修飾体などに人工的にエステル硫酸基またはエステルリン酸基を導入したものあるいは、天然のエステル硫酸基またはエステルリン酸基を有する糖にさらに人工的にエステル硫酸基またはエステルリン酸基を導入したものでも構わない。
【0034】
天然のエステル硫酸基を有する多糖のうち、コンドロイチン硫酸(CS)には、N-アセチルガラクトサミンの4位に硫酸基が結合したコンドロイチン硫酸A(CS-A)あるいはコンドロイチン硫酸B(CS-B、別名:デルマタン硫酸)、N-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸C(CS-C)の単硫酸化CSに加え、グルクロン酸の2位およびN-アセチルガラクトサミンの6位に硫酸基が結合したコンドロイチン硫酸D(CS-D)や、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸E(CS-E)、イズロン酸とN-アセチルガラクトサミンの二糖構造において、N-アセチルガラクトサミンの4位および6位に硫酸基が結合したコンドロイチン硫酸H(CS-H)などの、繰り返し二糖単位に硫酸基を2個以上有する構造を含む多硫酸化コンドロイチン硫酸が存在する。また、CS以外に、多硫酸化多糖としてヘパリン、ヘパラン硫酸が知られている。本発明に使用する天然のエステル硫酸基を有する多糖としては、リン酸カルシウムとの親和性が高い多硫酸化体の方が単硫酸化体に比較して、より適している。また、人工的にエステル硫酸基を導入した多糖として、合成多硫酸化コンドロイチン硫酸(CPS)やデキストラン硫酸があり、これらは医薬品と市販されて、比較的細胞毒性も低いと考えられるため、これらあるいはこれらの標識体を使用しても構わない。また、本発明プレートに使用する糖は、直鎖のものに限定されず、分枝していても良い。
【0035】
本発明プレートにおけるエステル硫酸基またはエステルリン酸基を有する核酸とは、天然に存在するデオキシリボ核酸(DNA)、リボ核酸(RNA)あるいはこれらの修飾体のことである。RNAは不安定であるため、DNAを用いることが望ましい。DNAの由来としてはウシ胸腺やサケ精子のものが市販され入手も簡便であるが、これらに限定されるものではない。
【0036】
さらに、糖あるいは核酸を標識することで、プレートの使用時に、より簡便に評価が可能となる。標識に使用する物質については、ペルオキシダーゼやアルカリホスファターゼなどの酵素、ビオチン、ラジオアイソトープ、可視あるいは蛍光色素等が挙げられるが、これらに限定されるものではない。安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。硫酸化多糖への標識法については、一例として、Ogamoらの方法(Ogamo A., Carbohydr Res. 105(1):69-85, 1982)を挙げることができる。核酸の標識法としては、核酸に特異的に結合する色素、例えばHoechst33258、Hoechst33342、Propidium iodide、Ethidium bromide、DAPI、アクリジンオレンジなどが簡便に利用できるが、これらに限定されるものではなく、安全性が高く、簡便で、定量性および感度が高い蛍光色素などを用いることが望ましい。
【0037】
エステル硫酸基またはエステルリン酸基を導入した糖、または核酸の重量平均分子量は、特に限定されないが、リン酸カルシウム層に安定して結合する5000Da以上が好ましく、6000Da以上がさらに好ましい。糖や核酸の平均分子量は、同一試料でも測定法、測定条件等によって多少異なることが一般的に知られており、本発明においても上記平均分子量の範囲に厳密に限定されるべきものではない。
【0038】
このような本発明プレートは、上述の本発明定量方法に用いることができる。特に、本発明プレートの他に、必要な試薬などもセットとした定量キットとすることで、たとえば、骨分解能を亢進又は抑制する化合物・薬剤のスクリーニングや、齲歯抑制剤のスクリーニングなど、幅広く使用することが可能となる。
【実施例1】
【0039】
予め37℃の5%CO2インキュベータ内に5時間以上放置し、炭酸ガスを含ませた0.2M CaCl2溶液(50mM Tris HCl pH7.4)と等量の120mM Na2HPO4溶液を混合し、CO2インキュベータ内で5分間インキュベートしてアパタイトを作製した。蒸留水で洗浄した後、アパタイト懸濁液を24wellプレートに添加し、37℃で一晩乾燥した。次に、80℃で3時間殺菌することでアパタイト固相化プレートを作製した。
【0040】
アパタイト固相化24wellプレートに、100μg/mLのフルオレセインアミン標識多硫酸化コンドロイチン硫酸(FACPS、PGリサーチ)を含むPBSを0.5mL/wellで添加し、37℃で2時間インキュベートした。PBSおよび培地で洗浄し、FACPS基質固相化プレートを作製した。
【0041】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellでFACPS基質固相化24wellプレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)を添加し、37℃、5%CO2条件下で培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。
【0042】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、FACPS基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定を用いた。
【0043】
RANKLの濃度に依存して、培養上清中の蛍光強度およびpitの面積は増大した(図1A、1B)。
【実施例2】
【0044】
実施例1と同様の条件にて、FACPS基質固相化プレートを作製し、RAW264細胞を播種した。同時に100ng/mLのRANKLおよび、破骨細胞の骨吸収抑制作用を有するPamidronate(ノバルティスファーマ、30、100μM)あるいはβ-estradiol(和光純薬、10、100nM)を添加し培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、FACPS基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0045】
RANKL添加により培養上清の蛍光強度が上昇したが、Pamidronate添加群ではその上昇が強く抑制された(図2A)。β-estradiol添加群では弱い抑制作用であった。また、pitの面積においても同様の作用が認められた(図2B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図2C)。
【実施例3】
【0046】
実施例1と同様の条件にて、アパタイト固相化プレート(24well)を作製した。アパタイト固相化プレートにDNA溶液(ウシ胸腺由来、Worthington社製、100μg/mL)を0.5mLずつ添加し、37℃で2時間インキュベートした。PBSおよび培地で洗浄することで、DNA基質固相化プレートを作製した。
【0047】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellでDNA基質固相化プレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)を添加し、37℃、5%CO2条件下で6日間培養した。培養上清を回収し、Hoechst33258溶液と混合した後、蛍光強度(励起波長355nm、蛍光波長460nm)をプレートリーダーで測定した。標準DNA溶液の値を基に、培養上清中のDNA量を算出した。
【0048】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、DNA基質固相化プレートに付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0049】
RANKLの濃度に依存して、培養上清中のDNA量およびpitの面積は増大した(図3A、3B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図3C)。
【実施例4】
【0050】
実施例1と同様の条件にて、アパタイト固相化プレート(24well)を作製した。アパタイト固相化プレートにDNA溶液(ウシ胸腺由来、Worthington社製、100μg/mL)を0.5mLずつ添加し、37℃で2時間インキュベートした。PBSで3回洗浄した後、Hoechst33258溶液(10μg/mL)を0.5mLずつ添加し、さらに1時間インキュベートした。PBSおよび培地で洗浄することで、標識DNA基質固相化プレートを作製した。
【0051】
マウスマクロファージ由来RAW264細胞を、10%FBSを含むDMEM/F-12培地(フェノールレッド不含)に浮遊させ、1x104cells/wellで標識DNA基質固相化プレートに播種した。同時にRANKL(ヒトリコンビナント、オリエンタル酵母、10、30、100ng/mL)あるいは、RANKL(100ng/mL)およびPamidronate(ノバルティスファーマ、1、10、100μM)を添加し、37℃、5%CO2条件下で6日間培養した。培養上清を回収し、蛍光強度(励起波長355nm、蛍光波長460nm)をプレートリーダーで測定した。
【0052】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、標識DNA基質固相化プレートに付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定あるいはSpearmanの順位相関係数を用いた。
【0053】
RANKLの濃度に依存して、培養上清中の蛍光強度およびpitの面積は増大した(図4A、4B)。また、RANKL添加により上昇した蛍光強度およびpitの面積は、Pamidronate添加群において強く抑制された(図5A、図5B)。蛍光強度とpitの面積の間に、有意な正の相関が認められた(図5C)。
【実施例5】
【0054】
実施例1と同様の条件にて作製したアパタイト固相化プレートに、100μg/mLのカルセイン溶液(和光純薬)を添加し、同じ手法によりカルセイン基質固相化プレートを作製した。このプレートにRAW264細胞を播種し、同時にRANKLを添加して、37℃、5%CO2条件下で培養した。培養3日目に培地交換し、さらに3日間培養した後、培養上清を回収した。培養上清100μLあたり0.1N NaOHを50μL添加した後、蛍光強度(励起波長485nm、蛍光波長535nm)をプレートリーダーで測定した。
【0055】
また、培養後のプレートをPBSで洗浄した後、5%次亜塩素酸ナトリウム溶液で5分間処理し、それぞれの基質に付着した細胞を除いた。純水で洗浄した後、pitを顕微鏡にて観察し、写真撮影した。得られた画像を用い、画像解析ソフトによりpitの面積を測定した。統計学的処理はDunnettの多重比較検定を用いた。
【0056】
カルシウムと親和性の高い蛍光物質であるカルセインを用いた基質固相化プレートにおいては、pitの面積はRANKLの濃度依存的に増大したものの、蛍光強度の濃度依存的上昇は認められなかった(図6A、6B)。
【産業上の利用可能性】
【0057】
本発明は、新規リン酸カルシウム分解活性定量方法およびその方法に使用する培養プレートに関するものであり、医薬品開発等で利用することができる。
【特許請求の範囲】
【請求項1】
あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【請求項2】
前記細胞が骨吸収活性を有する細胞またはその前駆細胞であることを特徴とする請求項1記載のリン酸カルシウム分解活性定量方法。
【請求項3】
前記糖または前記核酸の分子量が5,000以上である請求項1又は2記載のリン酸カルシウム分解活性定量方法。
【請求項4】
前記糖がグリコサミノグリカンである請求項1乃至3いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項5】
前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である請求項4記載のリン酸カルシウム分解活性定量方法。
【請求項6】
前記糖又は前記核酸が、色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている請求項1乃至5いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項7】
前記リン酸カルシウムが、天然由来もしくは合成のリン酸カルシウム結晶または象牙、骨もしくは歯由来硬組織のいずれかより選択される請求項1乃至6いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項8】
下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレート。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【請求項9】
前記糖または前記核酸の分子量が5,000以上である請求項8記載の培養プレート。
【請求項10】
前記糖がグリコサミノグリカンである請求項8又は9記載のリン酸カルシウム分解活性定量方法。
【請求項11】
前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である請求項10記載の培養プレート。
【請求項12】
前記糖又は前記核酸が、さらに色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている請求項8乃至11いずれか一項記載の培養プレート。
【請求項1】
あらかじめ標識物質により標識したリン酸カルシウムを固相化した基板上で細胞を培養し、培地中に遊離した標識物質の量を定量化するリン酸カルシウム分解能の定量方法であって、リン酸カルシウムの前記標識が下記の群から選択される少なくとも一つの物質であることを特徴とするリン酸カルシウム分解活性定量方法。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【請求項2】
前記細胞が骨吸収活性を有する細胞またはその前駆細胞であることを特徴とする請求項1記載のリン酸カルシウム分解活性定量方法。
【請求項3】
前記糖または前記核酸の分子量が5,000以上である請求項1又は2記載のリン酸カルシウム分解活性定量方法。
【請求項4】
前記糖がグリコサミノグリカンである請求項1乃至3いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項5】
前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である請求項4記載のリン酸カルシウム分解活性定量方法。
【請求項6】
前記糖又は前記核酸が、色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている請求項1乃至5いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項7】
前記リン酸カルシウムが、天然由来もしくは合成のリン酸カルシウム結晶または象牙、骨もしくは歯由来硬組織のいずれかより選択される請求項1乃至6いずれか一項記載のリン酸カルシウム分解活性定量方法。
【請求項8】
下記の群から選択される少なくとも一つの標識物質と結合したリン酸カルシウムを固相化した培養プレート。
(a)エステル硫酸基を有する糖
(b)エステルリン酸基を有する糖
(c)エステル硫酸基を有する核酸
(d)エステルリン酸基を有する核酸
【請求項9】
前記糖または前記核酸の分子量が5,000以上である請求項8記載の培養プレート。
【請求項10】
前記糖がグリコサミノグリカンである請求項8又は9記載のリン酸カルシウム分解活性定量方法。
【請求項11】
前記グリコサミノグリカンがコンドロイチン硫酸、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ケラタン硫酸もしくはこれらの多硫酸化体または硫酸化ヒアルロン酸である請求項10記載の培養プレート。
【請求項12】
前記糖又は前記核酸が、さらに色素、蛍光色素、酵素、ビオチン、ラジオアイソトープのいずれか一つ以上により標識されている請求項8乃至11いずれか一項記載の培養プレート。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−172489(P2011−172489A)
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願番号】特願2010−36808(P2010−36808)
【出願日】平成22年2月23日(2010.2.23)
【出願人】(505291941)株式会社PGリサーチ (4)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願日】平成22年2月23日(2010.2.23)
【出願人】(505291941)株式会社PGリサーチ (4)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

