リン酸化ポリペプチド検出方法及び検出装置
【課題】 ポリペプチドのリン酸化の有無あるいは程度を容易に検出することのできる技術を提供する。
【解決手段】 リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出するリン酸化ポリペプチド検出方法である。
【解決手段】 リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出するリン酸化ポリペプチド検出方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ポリペプチドのリン酸化の有無あるいは程度を検出する技術に関する。
【背景技術】
【0002】
細胞シグナル伝達は、細胞が外的環境に応答するために必要な機構であり、細胞の増殖や分化を制御している。そのため、細胞シグナル伝達経路の研究は、細胞のがん化メカニズムや万能細胞(ES細胞やiPS細胞など)の分化過程の研究にとって重要なプロセスである。
【0003】
細胞内のシグナル伝達の主な伝達経路は、タンパク質のリン酸化カスケードである。すなわち、伝達経路上流のタンパク質が、下流のタンパク質をリン酸化もしくは脱リン酸化することによって、下流のタンパク質(複数であることも多い)を活性化する。活性化したタンパク質は、より下流のタンパク質を同様に活性化していく。シグナル伝達経路は、最終的には転写活性化因子を活性化してシグナル経路に応じたタンパク質を産生する。このようにして産生されたタンパク質が、再びシグナル経路に関与することにより、複雑なシグナル伝達ネットワークが作り上げられている。
【0004】
細胞シグナル伝達経路を研究する上では、経路上のタンパク質のリン酸化の度合いを明らかにする必要がある。
タンパク質もしくはその一部分であるペプチドのリン酸化を検出する従来の技術としては、γ位に放射性同位体32Pを含むATPによって放射性リン酸化された試料をオートラジオグラフィーによって検出するという方法が知られている。この方法では、生きた細胞内、試験管内いずれの環境下でも試料のリン酸化過程を調べることができ、リン酸化酵素とリン酸化される基質の組み合わせを選ばず汎用性があるという利点がある反面、放射性同位体を取り扱う必要があるという大きな欠点があった。
【0005】
また、タンパク質のリン酸化を検出する別の方法としては、電気泳動によってタンパク質を分離し、リン酸化部位特異的抗体、例えばリン酸化チロシン抗体等を用いて免疫化学的に検出する方法もある。この方法では、特定のアミノ酸配列を持つリン酸化部位を特異的に認識できるという利点がある。しかし、このことは逆に個々のリン酸化部位に対する抗体を用意しなければならないことを意味する。また、免疫化学的検出は、検出までの手順が煩雑であった。例えば標準的なウェスタンブロッティングでは、電気泳動、メンブレンへの転写、ブロッキング、一次抗体標識、複数回の洗浄、二次抗体標識、再度複数回の洗浄を行い、最後に発光基質などを用いた検出反応を行うため、試料を調整してから検出までに数時間以上の時間が必要であった。
【0006】
このように従来の手法では、タンパク質のリン酸化の度合いを簡便かつ正確に測定することができなかった。そのため、これらの欠点を克服するためのさまざまな新規の測定方法が考案・開発されてきた。
基質側を改良した技術として、基質であるペプチドもしくはタンパク質を特定の有機蛍光色素で修飾し、基質がリン酸化されることによって蛍光色素の蛍光強度や蛍光寿命の変化することを利用した検出方法がある(特許文献1)。この方法は、基質のリン酸化の度合いを簡便かつ定量性を持って測定することができる。しかし、基質を有機蛍光色素で修飾することが必要であることから細胞内のリン酸化・脱リン酸化反応の検出のためというよりは、キナーゼやホスファターゼの活性をハイスループットで測定し、それらの酵素の阻害薬剤のスクリーニングに用いるための検出方法である。
【0007】
検出側を改良した技術としては、検出試薬の開発と検出装置の開発が報告されている。
開発された検出試薬としては、二価のリン酸モノエステルアニオンに特異的に結合する有機金属錯体分子が報告されている(非特許文献1、特許文献2、特許文献3)。この分子は、アルカリホスファターゼの活性部位の構造から発想を得たもので、マンガンもしくは亜鉛の二価金属イオンを介してリン酸に配位する。この分子を抗体に代わる汎用的なリン酸化ペプチド検出試薬として用いる方法や、アクリルアミド電気泳動のゲル中に加えることによって、リン酸化されたタンパク質の泳動速度が遅くなることを利用したリン酸化タンパク質の識別・分離方法が知られている。
【0008】
この有機金属錯体分子は、商品名Phos−tagとして市販されており、単体のみならず、ビオチンに付与したもの、アガロースビーズに付与したもの、アクリルアミドに付与したものなどが入手可能である。これらの方法は、リン酸化ペプチドやリン酸化タンパク質をリン酸化特異的かつリン酸化部位によらず汎用的に標識する方法としては優れている。しかし、識別・検出する方法は従来の手法を用いる必要があった。
【0009】
また、タンパク質のリン酸化の度合いを検出する装置としては、Caliper社のマイクロ流路系を用いた測定装置が知られている(LabChip Ez Reader)。この手法では、蛍光標識された基質ペプチドを電圧の掛かったマイクロ流路系に流し、リン酸化による基質ペプチドの電荷の違いをマイクロ流路中の流速の違いとして検出する。この手法も、前述の有機蛍光色素による方法と同じくキナーゼやホスファターゼの活性をハイスループットで測定することを主眼としており、様々な夾雑物が混在している細胞抽出液での測定には適用することが困難である。
【0010】
タンパク質のリン酸化の度合いを検出する装置の別の例としては、蛍光相関分光法(FCS)を利用したものが挙げられる。FCSには、広義のFCSと呼ばれる手法と、狭義のFCSと呼ばれる手法とが知られている。広義のFCSは、蛍光測定データの空間・時間に関する相関関数を計算し、その相関関数から分子の運動、特にブラウン運動に関する情報を得る測定方法である。狭義のFCSと呼ばれる手法は、共焦点顕微鏡の光学系を用いて微小な焦点領域からの蛍光強度を経時的に測定し、その蛍光強度の揺らぎの相関関数を解析することによって分子の運動についての情報を導出する手法である。詳細は後述するが、このFCSを用いることで、分子の拡散時間τD、分子質量Mを求めることができる。
【0011】
FCSが分子質量を測定できることから、FCSは分子の相互作用を検出する方法に用いられてきた(特許文献4)。すなわち、分子Aと蛍光修飾された分子Bがあったとき、単体の分子Bと分子Aと結合した分子A−Bの質量の違いを拡散時間τDの違いとして区別する方法である。
【0012】
この方法の応用として、抗体と抗原の結合を検出する方法が公開されている(特許文献5、特許文献6)。また、この手法に抗リン酸化ペプチドに特異的に結合する抗体を用いて、リン酸化を検出する手法が公開されている(特許文献7)。この手法は、免疫化学的な検出についての項に書いたとおり、個々のリン酸化部位に対する抗体を用意する必要がある。
【0013】
また、FCSにおいて抗体に結合している分子と結合していない分子が混合した試料を測定する場合のように、二成分の分子を区別するためには、それぞれの拡散時間τDに1.6倍以上の差が必要であるとの報告がある(非特許文献2)。拡散時間τDが1.6倍とは分子量で4倍に相当する。抗体のFab領域はおよそ55kDaであり、IgGはおよそ170kDaであることから、より大きな分子量のIgG抗体を用いた場合でも最大で40kDaの基質までしか測定することができない。
【0014】
また、細胞から抽出したサンプルの場合などは、標的である蛍光リン酸化ポリペプチド以外にも、多くのリン酸化したタンパク質が存在する。それらの標的外の分子種が、使用する抗リン酸化ペプチド抗体のエピトープを持つ場合、標的分子と競合が発生する。そのため、抗リン酸化ペプチド抗体は標的であるリン酸化ポリペプチドに対して過剰に加えなくてはならない。抗体などの分子量の大きい分子を高濃度で用いることは、凝集が発生するなどの問題が発生するため、測定に際しての取り扱いや測定までの間の保管が困難となる。
【0015】
以上のように、リン酸化ポリペプチドをFCSで検出する場合、リン酸化部位に結合する分子の分子質量が大きいほど、測定可能なリン酸化ポリペプチドの分子量範囲が広くなるが、溶液中のリン酸化部位結合分子の濃度が高くなってしまい、測定が困難になるという二律背反する問題を解決しなければならない。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特許第4615867号公報
【特許文献2】米国特許第4615867号明細書
【特許文献3】米国特許出願公開第2010/0099120号明細書
【特許文献4】特開2008−298743号公報
【特許文献5】特開2010−256010号公報
【特許文献6】国際公開2007/032266号パンフレット
【特許文献7】特表2001−526380号公報
【非特許文献】
【0017】
【非特許文献1】Recognition of phosphate monoester dianion by an alkoxide-bridged dinuclear zinc(II) complex, E. Kinoshita et al. (2004), Dalton Trans., 1189-93.
【非特許文献2】Resolution of fluorescence correlation measurements, U. Meseth et al. (1999), Biophys. J. 76, 1619-31.
【発明の概要】
【発明が解決しようとする課題】
【0018】
ポリペプチドのリン酸化の度合いを測定する手法はさまざまな生物・医学的な研究や診断に重要である。しかし、上述のように、従来の手法では、リン酸化している部位に依存し、操作が煩雑で検出までに時間がかかり、ペプチドのように比較的低分子の試料しか扱えない、細胞内からの抽出試料では測定できないなどの制約があった。また、FCSを用いた測定は有望な候補であるが、リン酸化部位に結合する分子の種類や、その分子の分子量・濃度を測定試料によって使い分けなくてはならないという問題があった。
【0019】
本発明はかかる事情に鑑みてなされたものであって、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することのできる技術を提供することを目的とする。
【課題を解決するための手段】
【0020】
上記課題を解決するための本発明は、リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出するリン酸化ポリペプチド検出方法である。
【発明の効果】
【0021】
この発明によれば、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することができる。
【図面の簡単な説明】
【0022】
【図1】第1の実施の形態の検出方法を説明するための図。
【図2】SDS−PAGEによる電気泳動の測定結果を示す図。
【図3】第1の実施の形態の脱リン酸化したATTO−OVA(dephos−OVA)についてのFCS測定結果を示す図。
【図4】第1の実施の形態の脱リン酸化処理していないATTO−OVA(pOVA)についてのFCS測定結果を示す図。
【図5】第1の実施の形態のdephos−OVAとpOVAを1:1で混合した試料についてのFCS測定結果を示す図。
【図6】第1の実施の形態の測定結果をまとめて示す図。
【図7】Phos−tagポリマー中のヒドロキシメチルアクリルアミドの割合を変化させて測定した試料の拡散時間を示す図。
【図8】Phos−tagポリマー中のdephos−OVAとpOVAについてのRICS測定の結果を示す図。
【図9】第1の実施の形態の検出方法が適用されるレーザ顕微鏡システムの構成を示す図。
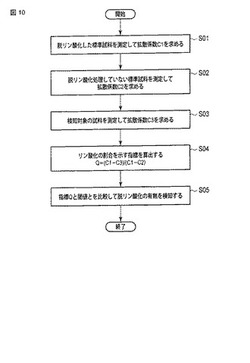
【図10】レーザ顕微鏡システムの動作手順を示すフローチャート。
【発明を実施するための形態】
【0023】
〔第1の実施の形態〕
図1は、第1の実施の形態の検出方法を説明するための図である。第1の実施の形態では、従来用いられた抗体に替えて、リン酸化部位と結合する分子複合体を用いる。この分子複合体は、ペプチドのリン酸化部位に結合する部分は比較的低分子でありながら拡散係数が大きいという物理的性質を備えている。そして、その分子複合体溶液と試料とを混合し、試料中のリン酸化した蛍光ポリペプチドを分子複合体と結合させ、リン酸化したポリペプチドとリン酸化していないポリペプチドの拡散係数の違いを計測する。計測した拡散係数の違いによってリン酸化の有無または程度を判断する。
【0024】
ペプチドのリン酸化部位と結合する分子複合体を実現する第一の実施の形態では、ポリマーを用いる。すなわち、リン酸基と結合する官能基を有するモノマーとの共重合ポリマーを用いる。そのようなリン酸基と結合する官能基を有し、かつ重合能を有するモノマーとしては、二価金属イオン錯体を付与されたアクリルアミド等が想定される。このモノマーとアクリルアミドの共重合ポリマーを作製することにより、上記性質の分子複合体を実現することができる。二価金属イオン錯体を付与されたアクリルアミドとしては、例えばPhos−tagアクリルアミドが市販されている(和光純薬)。
【0025】
即ち、第一の方法では、リン酸基と結合する官能基が二価金属イオン錯体である。より詳細には、二価金属イオン錯体が下記構造を備えている。
【0026】
【化1】

式中、Xは重合能を持つモノマー分子部分を示し、M2+は二価金属イオンである
また、上記共重合ポリマーを重合して作製する際に、ポリマー分子間を架橋するモノマーを適量加えることにより、重合したポリマー分子の溶液中の柔軟性を変えることができる。このような分子架橋剤としては、N,N’−メチレンビスアクリルアミドが良く知られている。この方法で作製したアクリルアミドポリマーは、アクリルアミドゲル電気泳動で用いられるようなゲルとなる。しかし、共重合ポリマーがゲル状になってしまうと、試料と均一に混合することが困難となり、操作が煩雑になると同時に、ポリマー分子複合体と結合できないリン酸化ポリペプチドが残ってしまい、測定精度が悪化する可能性が高い。
【0027】
そのため、共有結合による完全な網目構造を作るのではなく、一時的な結合を作る方法を検討した。そのような一時的な結合としては水素結合がある。アクリルアミドのアミド基も弱い水素結合を形成するが、より強い水素結合を導入するために、例えばヒドロキシル基を持つモノマーを共重合させることができる。そのようなモノマーとしてはN−(ヒドロキシアルキル)アクリルアミドが考えられ、その一例としてN−(ヒドロキシメチル)アクリルアミドがある。
【0028】
即ち、第一の方法では、リン酸化したペプチドとの結合部位を有する高分子(分子複合体)として、リン酸基と結合する官能基を有するモノマーとの共重合ポリマーを用いる。より詳細には、リン酸基と結合する官能基を有するモノマーと、アクリルアミド、およびN−(ヒドロキシアルキル)アクリルアミド類:CH2=CH(CO)NH(CH2)nOH, n = 1, 2…、との共重合ポリマーを用いる。
【0029】
ペプチドのリン酸化部位と結合する分子複合体を実現する第二の方法では、細胞骨格タンパク質を用いる。すなわち、リン酸化ペプチドと結合する機能ドメインと細胞骨格タンパク質ドメインとのキメラタンパク質の繊維状複合体を用いる。繊維状複合体内に野生型の細胞骨格タンパク質が入っていても良く、複合体内の割合は、キメラタンパク質の細胞内での発現量で調整することができる。
【0030】
リン酸化ペプチドと結合する機能ドメインとしては、リン酸化チロシンに結合するSH2ドメインがある。SH2ドメインは、約100アミノ酸残基からなるタンパク質ドメインである。細胞骨格タンパク質としては、アクチンフィラメントを形成するアクチンや、微小管を形成するチューブリンなどがある。これらの細胞骨格タンパク質とリン酸化ペプチド結合ドメインとのキメラタンパク質をコードする遺伝子配列を持つベクターは、既知の方法により容易に作製することができる。このベクターを培養細胞内に取り込ませることにより、一時的にキメラタンパク質を細胞内で発現させることができる。培養細胞内にベクターを導入する方法は、市販の遺伝子導入試薬を用いることにより、容易に実現できる。また、細胞内での遺伝子組換え反応により、キメラタンパク質遺伝子を細胞内のゲノムに取り込ませることにより、細胞内でキメラタンパク質を恒常的に発現する細胞株を作ることができる。
【0031】
リン酸化状態を測定したい基質ペプチドについても、その遺伝子配列を持つベクターを細胞内に導入することにより、細胞内で発現させることができる。その際に、蛍光タンパク質と融合した基質ペプチドの配列を用いることにより、細胞内で基質配列を持つ蛍光ポリペプチドを産生させることができる。基質ペプチドの配列としては、例えばFynキナーゼに対しては例えばGlu−Phe−Gly−Thr−Tyr−Gly−Thr−Leu−Serが基質となることが知られている(Modified phage peptide libraries as a tool to study specificity of phosphorylation and recognition of tyrosine containing peptides, L. Dente et al. (1997), J. Mol. Biol. 269, 694-703.)。蛍光タンパク質としては、オワンクラゲ由来の緑色蛍光タンパク質(GFP)が知られている。
【0032】
この基質蛍光ポリペプチドは、ペプチド配列に応じたキナーゼによるリン酸化とホスファターゼによる脱リン酸化反応の基質となり、そのリン酸化/非リン酸化状態の割合は細胞の状態を反映する。例えば、基質蛍光ポリペプチドを発現する培養中の細胞に、各種薬剤などによって外部から刺激を与えることにより、基質蛍光ポリペプチドのリン酸化状態が刺激に応答して変化する。この細胞をリン酸化・脱リン酸化酵素の阻害剤の存在下で破砕して抽出液を取り出し、本発明で提供する方法によって測定することにより、基質である蛍光ポリペプチドのリン酸化状態を知ることができる。
【0033】
また、ペプチドのリン酸化部位と結合する繊維状分子複合体を細胞内で発現している細胞に、上記の基質蛍光ポリペプチドを発現させることにより、細胞質溶液内で直接測定することができる。すなわち、リン酸化した基質蛍光ポリペプチドが細胞骨格上のリン酸化ペプチド結合ドメインと結合することによって、リン酸化していない基質蛍光ポリペプチドとは異なる拡散係数値を示すことを、蛍光相関分光法によって測定することができる。この場合、細胞質を抽出する必要が無いため、細胞を培養中に任意の時期に測定することが可能である。この方法を用いれば、単一の細胞について薬剤投与前と薬剤投与後の基質のリン酸化を調べることができる。
【0034】
蛍光ポリペプチドの拡散係数の測定方法としては、蛍光相関分光法(FCS)がある。FCSの測定は、市販の1分子蛍光分析システム、共焦点蛍光顕微鏡によって測定することが出来る。
以上説明したように、リン酸化部位と結合する分子複合体と、リン酸化の基質である蛍光ポリペプチドの拡散係数の測定方法とを組み合わせることにより、課題を解決することができる。
【0035】
以下に、上述の検討結果に基づいて構成したリン酸化ポリペプチド検出方法について説明する。
リン酸化ペプチドと結合する官能基が付与されたポリマー溶液を用いる。ポリマーは脱水状態もしくは高濃度溶液状態で提供され、使用者が測定試料に合わせて希釈して使用してもよい。
【0036】
測定したい試料とポリマー溶液を良く混合し、混合した溶液の液滴を底面がガラスの試料台に乗せる。液滴の代わりに底面がガラスのシャーレやマイクロプレートに深さが数ミリ以上になるまで試料液を満たしても良い。共焦点光学系の焦点が試料液中に結ぶように試料台の位置を調整し、測定を行う。
【0037】
試料は、生化学的アッセイによるものであってよい。例えば蛍光基質ポリペプチドとキナーゼの混合溶液、もしくはリン酸化している蛍光基質ポリペプチドとホスファターゼの混合溶液でもよい。
ポリマー溶液の組成を試料溶液中の基質ペプチドのリン酸化もしくは脱リン酸化反応を阻害しないように調製することにより、酵素反応を進めながら測定してもよい。もしくは、一定時間酵素反応を進めた後に、反応停止液を加えてから測定してもよい。酵素反応バッファの組成が測定条件に適さない場合は、マイクロスピンカラムなどを用いて酵素反応後の試料液のバッファを交換してから測定を行ってもよい。
【0038】
測定は、FCS測定器を用いることができる。解析は、測定機器に付属のソフトウェアを用いて行うことができる。
リン酸化の検出は、試料の拡散時間もしくは拡散係数の測定値を二つのコントロール試料との測定値と比較することによって行う。コントロール試料のうちの第一のものは、使用者の用いる測定試料と同じ蛍光基質ポリペプチドであってリン酸化されていない試料を用いることが望ましいが、分子量が近い蛍光ポリペプチドであってもよい。
【0039】
コントロール試料のうちの第二のものは、ポリマーのリン酸化ペプチド結合基と結合する蛍光分子である。例えば、測定に用いる蛍光基質ポリペプチドを完全にリン酸化したものであってもよい。リン酸化は使用者が酵素反応で行ってもよく、ペプチドを合成する際にあらかじめリン酸化しているアミノ酸を用いて合成したものであってもよい。酵素反応や合成で完全にリン酸化することが難しい場合は、市販のリン酸化タンパク質精製キットを用いて、リン酸化された蛍光基質ポリペプチドを精製してもよい。また、このコントロール試料はポリマーの拡散係数を測定するためのものであるので、測定試料の分子量と大きく異なっていてもよいので、測定試料とはまったく関係の無い蛍光リン酸化分子であってもよい。例えば、生体内でリン酸化されているタンパク質、例えばオブアルブミン(卵白アルブミン)を蛍光色素で修飾したものであってもよい。
【0040】
使用者は、試験を行いたい細胞内に蛍光基質ポリペプチドを導入する。導入する一つの方法は、標的とするキナーゼの基質となるペプチドを融合したキメラタンパク質をコードする遺伝子配列を持つベクターを、試験を行いたい細胞内に取り込ませ、細胞内で蛍光基質キメラタンパク質を発現させる方法である。キメラタンパク質のベクターは、既知の方法によって使用者自身で作製してもよく、細胞内リン酸化測定キットとして提供されてもよい。細胞内にベクターを導入する方法は、市販されている導入試薬を用いてもよい。導入試薬としては、インビトロジェン社のリポフェクチンなどがある。
【0041】
使用者は、遺伝子導入されて一時的にキメラタンパク質を発現している細胞をリン酸化検出実験に用いてもよい。もしくは、選択マーカーを用いてキメラタンパク質遺伝子がゲノムに取り込まれた細胞を選び出し、恒常的に発現する細胞を実験に用いてもよい。
【0042】
細胞内に蛍光基質ポリペプチドを導入する別の方法として、蛍光基質ポリペプチドを細胞内に直接導入してもよい。細胞内に蛍光基質ポリペプチドを直接導入する方法は、市販のマイクロインジェクション装置を用いてもよく、リポフェクチンなどの導入試薬を用いてもよい。
【0043】
使用者は、上記のようにして蛍光基質ポリペプチドが細胞内に導入された細胞を用いて、以下のようにリン酸化検出実験を行う。
細胞試料のリン酸化検出の第一の方法は、細胞抽出液を用いて細胞外で測定する方法である。細胞から細胞抽出液を得るには、超音波破砕や凍結融解法もしくは市販の細胞タンパク質抽出試薬を用いることができる。市販の細胞タンパク質抽出試薬としては、サーモフィッシャーサイエンティフィック社のM−PERなどがある。細胞から抽出した試料は、先に述べた細胞外実験に記述した方法により測定することができる。
【0044】
細胞試料のリン酸化検出の第二の方法は、細胞内での測定である。細胞内で測定するためには、蛍光基質ポリペプチドとともに、先に述べたリン酸化ペプチド結合ドメインと細胞骨格タンパク質ドメインとのキメラタンパク質を細胞に導入する必要がある。リン酸化ペプチド結合キメラタンパク質の細胞導入は、蛍光基質ポリペプチドの細胞導入の箇所で述べた方法を用いることができる。
【0045】
細胞内での蛍光基質ポリペプチドの拡散係数の測定は、蛍光相関分光法(FCS)による測定機能を備えた共焦点顕微鏡を用いて行うことができる。共焦点顕微鏡によって蛍光基質ポリペプチドとリン酸化ペプチド結合キメラタンパク質の両方を発現した細胞を選別し、いずれかの蛍光相関分光法による測定と解析を行うことによって、基質ポリペプチドの拡散係数を測定する。解析は顕微鏡に付属するソフトウェアを用いることができる。
【0046】
リン酸化の検出は、試験群の細胞内の蛍光基質ポリペプチドの拡散係数の測定値を、コントロール群の細胞内の蛍光ポリペプチドの測定値と比較することによって行う。コントロール群の細胞内には、蛍光基質ポリペプチドの基質ペプチド部分に、細胞内ではリン酸化されない変異が導入された、コントロール用蛍光ポリペプチドが導入されている。基質ペプチドのリン酸化されない変異とは、基質ペプチド配列から既知のあるいは推定されるリン酸化部位にあるアミノ酸残基を、リン酸化されることの無いアミノ酸とする変異である。例えば、セリンをホスホセリンとするキナーゼを対象としている場合、ペプチド配列中の該当するセリンをリン酸化され得ない他のアミノ酸、例えばアラニンに置換することで、細胞内でのリン酸化を防ぐことができる。
【0047】
続いて、上述の検出方法を適用したリン酸化ポリペプチドの測定例について説明する。
(第1の測定例)
測定に用いた試料は、ニワトリ由来オブアルブミン(OVA)である。OVAは、卵白の主要なタンパク質であり、385残基、43kDaのタンパク質である。卵白中では69位のセリンと345位のセリンがリン酸化されていることが知られている(データベースエントリーP01012参照)。
【0048】
凍結乾燥されたOVA(シグマアルドリッチ社、A7641−50MG)を100mMの炭酸水素ナトリウム溶液に溶かした。吸光光度計を用いて、消光係数ε=0.7(1cm,0.1%,280nm)として、5mg/mLとなるように濃度を調整した。
【0049】
OVAを蛍光修飾するために、ATTO488−NHS−Ester(ATTO−TEC社)を脱水したDMSOに溶かし、10mM溶液を調製した。そのうち、10μLを5mg/mLのOVA溶液600μLと混合し、遮光して常温で一時間、ゆっくりと転倒撹拌した。
【0050】
OVAと未反応の蛍光色素を分離するために、15,000rpmで10分間の遠心を行った後に、上清を10mM Tris−HCl pH7.5,150mM NaClバッファで平衡化されたカラムボリューム15mLのG−25 Superfine(GEヘルスケア社)カラムによって分離した。排除体積(void)画分を回収し、アミコンウルトラ限外濾過フィルタユニット(ミリポア社)によって8mg/mLまで濃縮した。濃縮した蛍光修飾OVA溶液の501nmにおける吸光度と280nmにおける吸光度から導出された、蛍光修飾OVA1分子あたりの結合した蛍光色素分子数は1.2個であった。
【0051】
ATTO488蛍光修飾OVA(ATTO−OVA)の脱リン酸化は、Antarcticホスファターゼ(New England Biolabs)を用いて以下のように行った。8mg/mLのATTO−OVAを4μL、10×Antarcticホスファターゼバッファ1μL、超純水4μL、Antarcticホスファターゼ1μL(5U)と混合し、遮光した25℃の環境で18時間静置した。その後、Antarcticホスファターゼを失活させるために、65℃で5分間の加熱処理を行った。比較のための、リン酸化されたままのATTO−OVA試料は、Antarcticホスファターゼの代わりに1μLの超純水を加え、同様の処理をして作製した。ATTO−OVAが脱リン酸化されていることは、25μMのPhos−tagアクリルアミド(和光純薬)と50μMの硫酸マンガンが添加された10%ゲルSDS−PAGEによって確認した。
【0052】
図2は、SDS−PAGEによる電気泳動の測定結果を示す図である。図の左にはリン酸化されたままのATTO−OVA試料の測定結果を示し、図の右には脱リン酸化処理後のATTO−OVA試料の測定結果を示している。
ATTO−OVA試料は電気泳動によって移動するが、今回の測定では、Phos−tagアクリルアミドを添加しているため、リン酸化されたATTO−OVA試料はこのPhos−tagアクリルアミドにトラップされることで泳動速度が遅くなる。一方、脱リン酸化処理後のATTO−OVAでは、Phos−tagアクリルアミドによる泳動速度の低下は少ない。
【0053】
図2では、脱リン酸化処理後のATTO−OVA試料の泳動距離は、リン酸化されたままのATTO−OVA試料の泳動距離よりも長い。従って、脱リン酸化処理が有効に行なわれていることが確認された。
Phos−tag添加アクリルアミドポリマー溶液の作製は、次のように行った。電気泳動用アクリルアミドHG(和光純薬)の2M水溶液を作製し、0.44μmフィルターで微粒子を除去した。500μLのポリマー溶液の作製には、2M アクリルアミド溶液を125μL(終濃度0.5M)、5mM Phos−tagアクリルアミド溶液を100μL(終濃度1mM)、10×TBSバッファ(500mM Tris pH7.5,1500mM NaCl)を50μL、超純水を213μL、100mM硫酸亜鉛水溶液を10μL、20%過硫酸アンモニウム水溶液5μL、テトラメチルエチレンジアミン1μLを良く混合し、使用までに12時間以上室温で静置した。
【0054】
20μLのポリマー溶液に対してタンパク質溶液を1μL加え、ピペッティングによって良く混合した。タンパク質溶液は、EGFPタンパク質については終濃度が10μg/mL、脱リン酸化処理済および未処理のATTO−OVAについては40μg/mLとなるように調製した。タンパク質を加えたポリマー溶液から10μLを96穴ガラスボトムディッシュの中心部に載せ、FCS測定を行った。
【0055】
FCS測定は、市販のFCS測定器を基に光学系を改良した試作機を用いて行った。試料溶液の液滴10μLをガラスボトムディッシュ上に作り、共焦点光学系が液滴下のガラス表面から200μm上部の液滴中に焦点を結ぶようにステージ位置を調節した。アルゴンレーザーの波長488nmを励起光源として用い、出力を3〜5%とした。対物レンズはオリンパス製UAPO 40X W3/340、二色フィルターにはDM488/543/633を用いた。4秒間の測定について自己相関関数を計算し、連続8回の測定を行って自己相関関数の平均値を解析した。
【0056】
測定対象が溶液中に拡散している一種類の蛍光分子の場合、蛍光強度の自己相関関数G(τ)は遅延時間τに対して、式(1)で表される。
【0057】
【数1】

ただし、sは焦点領域の断面と光軸方向の長さの比である。τDは拡散時間であり、焦点領域を蛍光分子が通過する典型的な時間の長さであり、分子の拡散係数Dに反比例する量である。G(0)は蛍光強度の揺らぎの大きさであり、焦点領域内の分子数に反比例する量である。
【0058】
測定値から計算された相関関数に対して、(式1)を非線形最小二乗法などによって当てはめることにより、蛍光分子の拡散時間τDが得られる。蛍光分子の拡散係数Dは、同一の光学系において測定された拡散係数が既知の標準試料の拡散時間τDと拡散係数Dの関係から導出される。
【0059】
また分子質量Mは、拡散係数Dとの間の関係から導くことができる。分子が球体であると仮定した場合、拡散係数Dは温度に比例し、球体の半径rと溶液の粘性係数ηの積に反比例する(アインシュタイン−ストークスの関係式)。分子の密度が一定であると仮定すれば、同じ粘性の溶液で測定した場合、分子質量Mは拡散係数Dの三乗に反比例し、拡散時間τDに対しては三乗に比例する。
【0060】
上述の解析方法を適用して、式1で表される自己相関関数に対して、G(0)およびτDをフリーパラメータとして非線形最小二乗法によって当てはめ、拡散時間τDを導出した。比較検討のために拡散係数Dを算出する際には、ローダミン6GについてのτDの測定値と拡散係数の文献値(414μm2/s;Precise measurement of diffusion by multi-color dual-focus fluorescence correlation spectroscopy, C. B. Muller et al. (2008), EPL 83, 46001.)を用いた。また、分子質量の推定には、各ポリマー条件におけるEGFPについてのτDの測定値と分子質量の計算値(27kDa)を用いた。
【0061】
[第1の実施例]
図3は、第1の実施の形態の脱リン酸化したATTO−OVA(dephos−OVA)についてのFCS測定結果を示す図である。図3の横軸は遅延時間τを表し、縦軸は自己相関値を表している。
測定した蛍光強度から計算した自己相関関数を実線で示している。その自己相関関数を式1でフィッティングした結果を破線で示している。このフィッティングによって導出された拡散時間τDは0.35msであった。
【0062】
図4は、第1の実施の形態の脱リン酸化処理していないATTO−OVA(pOVA)についてのFCS測定結果を示す図である。測定した蛍光強度から計算した自己相関関数を実線で、その自己相関関数を式1でフィッティングした結果を破線で示した。導出された拡散時間τDは1.17msであった。
【0063】
図5は、第1の実施の形態のdephos−OVAとpOVAを1:1で混合した試料についてのFCS測定結果を示す図である。測定した蛍光強度から計算した自己相関関数を実線で、その自己相関関数を式1でフィッティングした結果を破線で示した。導出された拡散時間τDは0.64msであった。
【0064】
図6は、第1の実施の形態の測定結果をまとめて示す図である。測定は、5つの試料(ローダミン6G、EGFP、脱リン酸化処理していないpOVA、脱リン酸化処理をしたdephos−OVA、及びpOVAとdephos−OVAとの混合)を対象とした。またEGFP、pOVA、dephos−OVAについては、媒質をTBSとPhos−tag共重合アクリルアミドポリマーとの2水準で測定した。ここで、ローダミン6G、EGFPは、標準試料である。
【0065】
これらそれぞれの水準において、FCSを用いて拡散時間を測定した。ローダミン6Gの拡散係数(=414μm2/s)は文献値(Precise measurement of diffusion by multi-color dual-focus fluorescence correlation spectroscopy, C. B. Muller et al. (2008), EPL 83, 46001.)である。その他の試料の拡散係数は、ローダミン6Gの拡散係数と測定したローダミン6Gの拡散時間とを用いて計算して求めた。EGFPの分子質量(=27kDa)は、アミノ酸配列からの計算値である。
【0066】
拡散係数の計算方法について説明する。上述のように拡散時間τDは、焦点領域を蛍光分子が通過する典型的な時間の長さであり、分子の拡散係数Dに反比例する量である。従って、他の試料の拡散係数CD、他の試料の拡散時間TD、ローダミン6Gの拡散係数CDR、ローダミン6Gの拡散時間TDRとすると、式(2)の関係が成立する。
CD=CDR ×(TDR/TD) ・・・式(2)
例えば、媒質TBS中のpOVAの拡散係数=414×25/133≒78、媒質Phos−tag中のpOVAの拡散係数=414×25/1092≒9と求められる。
【0067】
分子質量の計算方法について説明する。上述のように、同じ粘性の溶液で測定した場合、分子質量Mは拡散係数Dの三乗に反比例し、拡散時間τDに対しては三乗に比例する。他の試料の分子質量WM、他の試料の拡散時間TD、EGFPの分子質量WME、EGFPの拡散時間TDEとすると、式(3)の関係が成立する。
WM=WME ×(TD/TDE)3 ・・・式(3)
例えば、媒質TBS中のpOVAの分子質量=27×(133/100)3≒64、媒質Phos−tag中のpOVAの分子質量=27×(1092/369)3≒700と求められる。
【0068】
続いて、本実施の形態の測定方法を用いた図6に示す測定結果について説明する。
pOVAとdephos−OVAのTBSバッファ中での拡散係数は、78及び80とほとんど違いが無く、計算された分子質量も64及び59とOVAの分子量と近い値を示した。このことから、実験に用いたOVAには蛍光修飾や脱リン酸化処理によって変性や凝集が起きていないことが確認された。
【0069】
Phos−tag共重合アクリルアミドポリマーと混合した試料では、溶液の粘性が増加したため、コントロールとして用いたEGFPの拡散係数も28とTBSバッファ中の拡散係数104に比べて小さくなった。dephos−OVAのPhos−tagポリマー中での拡散係数は31とEGFPの拡散係数28と近い値を示し、脱リン酸化されていることにより、Phos−tagに結合していないことが示された。
【0070】
pOVAのPhos−tagポリマー中での拡散係数は9と大きく低下しており、dephos−OVAのPhos−tagポリマー中での拡散係数31との比較で3.4倍の違いを示した。この差は分子質量に換算すると40倍(=(3.4)3)であり、Phos−tagポリマーに結合したpOVAの見かけの分子質量は700kDaであった。
【0071】
以上説明した、本実施の形態の測定方法を用いた測定結果によれば、媒質としてPhos−tagポリマーを用いることによってOVAのリン酸化状態が明確に識別された。
そこで、dephos−OVAとpOVAを1:1で混合した試料について、Phos−tagポリマー中での拡散時間、拡散係数、分子質量を求めた。その結果は、図6のサンプルNo.5に記載している。
【0072】
dephos−OVAとpOVAを1:1で混合した試料の拡散係数は、それぞれ単独での拡散係数の平均値(20μm2/s)に近い値(16μm2/s)を示した。また、拡散時間もそれぞれ単独での拡散時間の平均値(714μs)に近い値(630μs)を示した。
【0073】
このことから、脱リン酸化の程度が未知のOVA試料について、拡散係数もしくは拡散時間を測定し、その測定結果をdephos−OVAとpOVAとのそれぞれの拡散係数もしくは拡散時間と比較することにより、脱リン酸化の程度を測定することが可能であることが示された。
【0074】
試料のリン酸化されている割合Psampは、式4で計算することができる。
【0075】
【数2】

τsampはポリマー溶液中の試料についての拡散時間の測定値、τdephosとτphospはそれぞれ脱リン酸化されたコントロール試料とリン酸化されたコントロール試料についての拡散時間の測定値である。
同様に試料のリン酸化されている割合Qsampは、式5で計算することができる。
【0076】
【数3】

Csampはポリマー溶液中の試料についての拡散係数、CdephosとCphospはそれぞれ脱リン酸化されたコントロール試料とリン酸化されたコントロール試料についての拡散係数である。
[第2の実施例]
第2の実施例では、Phos−tagポリマー水溶液を更に改善する方法について説明する。
【0077】
N−(ヒドロキシメチル)アクリルアミド(東京化成)の2M水溶液を調製した。2Mのアクリルアミド溶液と2Mのヒドロキシメチルアクリルアミドが合計25μLとなるように混合した。その混合溶液にPhos−tagポリマープレミックス[超純水260μL、Phos−tagアクリルアミド溶液60μL、10×TBSバッファ60μL、100mM硫酸亜鉛6μL、テトラメチルエチレンジアミン1.2μL]を64.5μL加え良く混合し、20%過硫酸アンモニウム水溶液0.5μLを加えて再度良く混合した。混合液は使用までに12時間以上室温で静置した。
【0078】
20μLのアクリルアミド/ヒドロキシメチルアクリルアミドポリマー溶液に対して脱リン酸化処理済または未処理のATTO−OVAタンパク質溶液を1μL加え、実施例1と同様にFCS測定を行った。
図7は、Phos−tagポリマー中のヒドロキシメチルアクリルアミドの割合を変化させて測定した試料の拡散時間を示す図である。
【0079】
図7の横軸は、Phos−tagポリマー溶液中のヒドロキシメチルアクリルアミドの割合を示している。左軸は、FCSで測定した拡散時間を示している。図中の(太)実線は、脱リン酸化未処理pOVAの測定値であり、点線は、脱リン酸化処理済dephos−OVAの測定値である。また、図7の右軸は、拡散時間の比(=脱リン酸化未処理pOVAの測定値/脱リン酸化処理済dephos−OVAの測定値)を表している。図中の(細)実線が、拡散時間の比である。
【0080】
ヒドロキシメチルアクリルアミドの割合が増えるにつれて、ポリマーの粘性が増加するため、拡散時間測定値はヒドロキシメチルアクリルアミドの割合の増加とともに大きくなる。脱リン酸化処理済dephos−OVAについては、ヒドロキシメチルアクリルアミドの割合に応じて単調に増加する傾向を示した。これに対し、脱リン酸化未処理pOVAについてはヒドロキシメチルアクリルアミドが加わることによって、ある割合までは拡散時間値が大きく増加し、その後は小さな増加率であった。そのため、dephos−OVAとpOVAの拡散時間の比は、ヒドロキシメチルアクリルアミドの割合が所定の値のときに最大となる。このことから、Phos−tagポリマーにポリマー繊維間に水素結合を導入するヒドロキシメチルアクリルアミドを添加することにより、試料のリン酸化の度合いを計測する精度が上昇することが示された。
【0081】
[第3の実施例]
第3の実施例では、走査画像相関分光法(RICS)を用いて測定する方法について説明する。
共焦点顕微鏡画像から分子の拡散係数を測定する方法としては、走査画像相関分光法(RICS)がある。RICSは共焦点顕微鏡の撮影方法の特徴を活かして相関関数を計算する測定手法である(Measuring fast dynamics in solutions and cells with a laser scanning microscope, M. A. Digman et al. (2005), Biophys. J. 89, 1317-27.)。
【0082】
共焦点顕微鏡は、視野の平面上で焦点位置を走査することによって画像を取得する。つまり、一枚の画像であっても各画素が取得される時間には差がある。一本の走査線上の隣り合うピクセル間の時間差は小さいが、隣り合う走査線上に乗っているピクセル間の時間差は大きくなる。また、撮影中に分子が視野平面上を移動すると、一度ある焦点位置で検出された蛍光分子が、焦点位置の走査の過程で別の位置で再度検出されることがある。これら二つの現象を加味して解析を行うことにより、蛍光分子の拡散係数を導出することができる。RICSによる解析手法を備えた共焦点顕微鏡はすでに開発されており(例えば、特開2011−85485号公報)、市販されている。
【0083】
RICSの特徴は、同一の走査線の隣り合う画素間の時間間隔(マイクロ秒)と走査線間の時間間隔(ミリ秒)という二つの時間スケールを持っていることにより、広い範囲の拡散係数を測定することができるという点である。例えば、拡散係数が100μm2/s程度の比較的小さなタンパク質一分子の拡散係数から、0.1μm2/s程度の巨大複合体の拡散係数まで計測することが可能である。そのため、基質である蛍光ポリペプチドのリン酸化の度合いを測定で求めるのに有利である。
【0084】
走査画像相関分光法(RICS)では、共焦点蛍光顕微鏡によって測定し、細胞拡散パッケージオプションを追加したソフトウェアを用いて解析を行った。
20μLの0.5Mアクリルアミドポリマー溶液に対して脱リン酸化処理済または未処理のATTO−OVAタンパク質溶液(0.4mg/mL)を1μL加えて混合したのち、10μLを96穴ガラスボトムディッシュの中心部に載せ、共焦点光学系が液滴中のガラス表面から200μm上部に焦点を結ぶようにステージ位置を調節した。アルゴンレーザーの波長488nmを励起光源として用い、出力を15%とした。対物レンズはUAPO 40X W3/340、二色フィルターにはDM488/543/633を用いた。
【0085】
試料溶液中の一辺12.8μmの正方形の範囲を一辺256ピクセルの解像度で測定した(0.05μm/ピクセル)。走査方向に隣り合うピクセル間の時間間隔は4μs、走査線間の時間間隔は2.12msであった。強度が1/e2となるビーム径w0は0.25μmとして解析を行った。連続して撮影した100枚の画像からバックグラウンドを計算して各画像から減算したのちに、各画像について自己相関画像を計算した。100枚の自己相関画像を平均化した画像に対して、扁平ガウシアンのフィッティングを行い、拡散係数Dを導出した。
【0086】
図8は、Phos−tagポリマー中のdephos−OVAとpOVAについてのRICS測定の結果を示す図である。各列の左側の画像は、共焦点顕微鏡で取得したラスター画像である。右側の画像は、その自己相関関数を表す画像である。この自己相関画像から自己相関関数を解析して得た拡散係数を画像の右側に示した。RICS測定では、拡散係数を直接導くことができる。この結果では、dephos−OVAの拡散係数は29μm2/sであり、pOVAの拡散係数である4.8μm2/sとの間には6倍という大きな違いがある。従って、Phos−tagポリマーとRICSによる測定によってOVAのリン酸化状態を明確に識別できることが示された。
【0087】
なお、第3の実施例では、走査画像相関分光法(RICS)を用いたが、蛍光相関分光法を顕微鏡画像に適用した画像相関分光法(ICS)を用いることができる。
即ち、蛍光ポリペプチドの拡散係数の測定方法には、蛍光相関分光法を顕微鏡画像に適用した画像相関分光法(ICS)という測定方法もある。ICSは、開発された当初は一枚の画像中で画素間の蛍光強度の相関関数を計算し、細胞内の会合体粒子の数と会合数を評価する手法であった(空間的ICS;Quantitation of membrane receptor distributions by image correlation spectroscopy: Concept and application, N. O. Petersen et al. (1993), Biophys. J. 65, 1135-46.)。その後、同一の視野に対して、一定時間間隔で撮影した複数の画像について、その画像の一つ一つのピクセルについて、その蛍光強度の時間に対する相関関数を計算して解析する手法が開発された(時間的ICS;Two-photon image correlation spectroscopy and image cross-correlation spectroscopy, P. W. Wiseman et al. (2000), J. Microscopy 200, 14-25.)。通常、一つのピクセルからの相関関数はノイズが多くパラメータを導出するのに不十分であるため、一定の領域内の複数のピクセルからの相関関数についての平均値を用いて解析を行う。
【0088】
ICSは、通常の顕微鏡では画像の撮影間隔が数十msより大きくなるため、高速で運動する分子の解析には適さないが、細胞骨格などのような細胞内の大きな構造の運動を捉えることができる。そのため、リン酸化部位と結合する分子複合体が細胞骨格である場合の解析に適している。また、画像を確認して解析範囲を決定することができるので、特定の細胞の細胞質中で、細胞骨格が存在している画像範囲内で相関関数の平均値を計算するということが可能である。そのため、視野内の複数の細胞それぞれについて基質蛍光ポリペプチドのリン酸化を測定することができる。
【0089】
なお、上述の検出方法は、人手(マニュアル)で実施するのみならず、FCS、ICS、RICSなどの解析処理を搭載した光測定装置によって自動で実施することができる。以下、自動で実施する態様について説明する。
図9は、第1の実施の形態の検出方法が適用されるレーザ顕微鏡システムの構成を示す図である。
レーザ顕微鏡システムは、顕微鏡本体1、レーザコンバイナー2、スキャンユニット3、ディテクタユニット4、コントロールユニット5、表示装置6及び記憶装置7を備えている。
【0090】
レーザコンバイナー2に設けられた1つのレーザ光源から出射したレーザ光は、ダイクロイックミラー(不図示)で反射された後スキャンユニット3に入射する。このスキャンユニット3によって、光軸はX軸、Y軸方向に偏向走査され、顕微鏡本体1の対物レンズ(不図示)に入る。これによって視野内の焦点面上にある蛍光標識されたサンプル試料の任意の位置に、測定領域(焦点領域)を位置することができる。
【0091】
焦点領域内の蛍光分子から発した蛍光は同じ対物レンズで補足され、逆の光路を通りダイクロイックミラーに導かれる。ダイクロイックミラーでは、励起光と比べ波長の長い蛍光を透過するように設計されており、蛍光はディテクタユニット4に到達する。ディテクタユニット4としては光電子増倍管が好適である。
【0092】
ディテクタユニット4で光電変換された蛍光の強度信号は、コントロールユニット5に入力される。コントロールユニット5では、解析ソフトウェアによってRICS解析が行われる。コントロールユニット5は、ディテクタユニット4からの蛍光強度信号と、スキャンユニット3からの走査位置情報とを対応づけてRICS解析を行う。RICS解析した結果は、適宜、表示装置6に表示され、また記憶装置7に記憶される。
【0093】
図9の右側には、本レーザ顕微鏡システムで得られる情報を模式的に示している。
サンプル8aにレーザ光を繰り返して走査照射して複数枚の蛍光画像8bを得る。このそれぞれの蛍光画像8bに基づいて蛍光強度に関するデータ8cを求めて、解析ソフトウェアに入力する。解析ソフトウェアは、それぞれのデータ8cに基づいてRICS解析を実行する。即ち、空間相関計算を行って空間相関関数図8dを求め、その結果と基準となる空間相関関数図との間でフィッティング解析を行う。
【0094】
図10は、レーザ顕微鏡システムの動作手順を示すフローチャートである。
図10のステップS01において、コントロールユニット5は、脱リン酸化した標準試料を測定してRICS解析により拡散係数C1を求める。ステップS02において、コントロールユニット5は、脱リン酸化していない標準試料を測定してRICS解析により拡散係数C2を求める。
【0095】
ステップS03において、コントロールユニット5は、検知対象の試料を測定してRICS解析により拡散係数C3を求める。ステップS04において、コントロールユニット5は、リン酸化の割合を示す指標Qを算出する。指標Qは、下記式(6)で表される。
Q= (C1−C3)/(C1−C2) 式(6)
ステップS05において、コントロールユニット5は、指標Qを予め定めた閾値と比較し、所望のリン酸化が行われたかどうかを判断する。
【0096】
なお、この指標Qと判断結果とはユーザに提示されるが、提示の態様については種々のバリエーションが可能である。例えば、所定の領域内について複数の測定を行いリン酸化の度合いを分布図に表して提示しても良く、また細胞ごとにリン酸化の度合いを色分けして表しても良い。
【0097】
なお、上述の自動処理は、拡散係数の他に拡散時間を用いても良い。また上述の自動処理は、RICSに限られず、FCS、ICSにおいても適用することができる。
[第2の実施の形態]
なお、上述の第1の実施の形態では、実施例として混合溶液中での測定方法を説明したが、この測定方法は、細胞内において発現した物質に対しても適用することができる。
【0098】
従って第2の実施の形態では、リン酸化したペプチドとの結合部位を有する高分子が、細胞内で発現したタンパク質である。あるいは、蛍光を発するポリペプチド分子が、細胞内で発現した蛍光タンパク質との融合タンパク質である。
また第2の実施の形態では、測定対象が生きた細胞であり、リン酸化したペプチドとの結合部位を有する高分子と蛍光を発するポリペプチド分子の一方もしくは両方が当該細胞内で発現したタンパク質であり、蛍光相関分光法を備えた顕微鏡によって測定される。
【0099】
なお、上述の各実施の形態で説明した機能は、ハードウェアを用いて構成するに留まらず、ソフトウェアを用いて各機能を記載したプログラムをコンピュータに読み込ませて実現することもできる。また、各機能は、適宜ソフトウェア、ハードウェアのいずれかを選択して構成するものであっても良い。
【0100】
尚、本発明は、上記実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化できる。
上記実施形態に開示されている複数の構成要素の適宜な組み合せにより種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。更に、異なる実施形態に亘る構成要素を適宜組み合せてもよい。
【産業上の利用可能性】
【0101】
この発明は、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することができる装置を製造する産業で利用することができる。
【符号の説明】
【0102】
1…顕微鏡本体、2…レーザコンバイナー、3…スキャンユニット、4…ディテクタユニット、5…コントロールユニット、6…表示装置、7…記憶装置。
【技術分野】
【0001】
本発明は、ポリペプチドのリン酸化の有無あるいは程度を検出する技術に関する。
【背景技術】
【0002】
細胞シグナル伝達は、細胞が外的環境に応答するために必要な機構であり、細胞の増殖や分化を制御している。そのため、細胞シグナル伝達経路の研究は、細胞のがん化メカニズムや万能細胞(ES細胞やiPS細胞など)の分化過程の研究にとって重要なプロセスである。
【0003】
細胞内のシグナル伝達の主な伝達経路は、タンパク質のリン酸化カスケードである。すなわち、伝達経路上流のタンパク質が、下流のタンパク質をリン酸化もしくは脱リン酸化することによって、下流のタンパク質(複数であることも多い)を活性化する。活性化したタンパク質は、より下流のタンパク質を同様に活性化していく。シグナル伝達経路は、最終的には転写活性化因子を活性化してシグナル経路に応じたタンパク質を産生する。このようにして産生されたタンパク質が、再びシグナル経路に関与することにより、複雑なシグナル伝達ネットワークが作り上げられている。
【0004】
細胞シグナル伝達経路を研究する上では、経路上のタンパク質のリン酸化の度合いを明らかにする必要がある。
タンパク質もしくはその一部分であるペプチドのリン酸化を検出する従来の技術としては、γ位に放射性同位体32Pを含むATPによって放射性リン酸化された試料をオートラジオグラフィーによって検出するという方法が知られている。この方法では、生きた細胞内、試験管内いずれの環境下でも試料のリン酸化過程を調べることができ、リン酸化酵素とリン酸化される基質の組み合わせを選ばず汎用性があるという利点がある反面、放射性同位体を取り扱う必要があるという大きな欠点があった。
【0005】
また、タンパク質のリン酸化を検出する別の方法としては、電気泳動によってタンパク質を分離し、リン酸化部位特異的抗体、例えばリン酸化チロシン抗体等を用いて免疫化学的に検出する方法もある。この方法では、特定のアミノ酸配列を持つリン酸化部位を特異的に認識できるという利点がある。しかし、このことは逆に個々のリン酸化部位に対する抗体を用意しなければならないことを意味する。また、免疫化学的検出は、検出までの手順が煩雑であった。例えば標準的なウェスタンブロッティングでは、電気泳動、メンブレンへの転写、ブロッキング、一次抗体標識、複数回の洗浄、二次抗体標識、再度複数回の洗浄を行い、最後に発光基質などを用いた検出反応を行うため、試料を調整してから検出までに数時間以上の時間が必要であった。
【0006】
このように従来の手法では、タンパク質のリン酸化の度合いを簡便かつ正確に測定することができなかった。そのため、これらの欠点を克服するためのさまざまな新規の測定方法が考案・開発されてきた。
基質側を改良した技術として、基質であるペプチドもしくはタンパク質を特定の有機蛍光色素で修飾し、基質がリン酸化されることによって蛍光色素の蛍光強度や蛍光寿命の変化することを利用した検出方法がある(特許文献1)。この方法は、基質のリン酸化の度合いを簡便かつ定量性を持って測定することができる。しかし、基質を有機蛍光色素で修飾することが必要であることから細胞内のリン酸化・脱リン酸化反応の検出のためというよりは、キナーゼやホスファターゼの活性をハイスループットで測定し、それらの酵素の阻害薬剤のスクリーニングに用いるための検出方法である。
【0007】
検出側を改良した技術としては、検出試薬の開発と検出装置の開発が報告されている。
開発された検出試薬としては、二価のリン酸モノエステルアニオンに特異的に結合する有機金属錯体分子が報告されている(非特許文献1、特許文献2、特許文献3)。この分子は、アルカリホスファターゼの活性部位の構造から発想を得たもので、マンガンもしくは亜鉛の二価金属イオンを介してリン酸に配位する。この分子を抗体に代わる汎用的なリン酸化ペプチド検出試薬として用いる方法や、アクリルアミド電気泳動のゲル中に加えることによって、リン酸化されたタンパク質の泳動速度が遅くなることを利用したリン酸化タンパク質の識別・分離方法が知られている。
【0008】
この有機金属錯体分子は、商品名Phos−tagとして市販されており、単体のみならず、ビオチンに付与したもの、アガロースビーズに付与したもの、アクリルアミドに付与したものなどが入手可能である。これらの方法は、リン酸化ペプチドやリン酸化タンパク質をリン酸化特異的かつリン酸化部位によらず汎用的に標識する方法としては優れている。しかし、識別・検出する方法は従来の手法を用いる必要があった。
【0009】
また、タンパク質のリン酸化の度合いを検出する装置としては、Caliper社のマイクロ流路系を用いた測定装置が知られている(LabChip Ez Reader)。この手法では、蛍光標識された基質ペプチドを電圧の掛かったマイクロ流路系に流し、リン酸化による基質ペプチドの電荷の違いをマイクロ流路中の流速の違いとして検出する。この手法も、前述の有機蛍光色素による方法と同じくキナーゼやホスファターゼの活性をハイスループットで測定することを主眼としており、様々な夾雑物が混在している細胞抽出液での測定には適用することが困難である。
【0010】
タンパク質のリン酸化の度合いを検出する装置の別の例としては、蛍光相関分光法(FCS)を利用したものが挙げられる。FCSには、広義のFCSと呼ばれる手法と、狭義のFCSと呼ばれる手法とが知られている。広義のFCSは、蛍光測定データの空間・時間に関する相関関数を計算し、その相関関数から分子の運動、特にブラウン運動に関する情報を得る測定方法である。狭義のFCSと呼ばれる手法は、共焦点顕微鏡の光学系を用いて微小な焦点領域からの蛍光強度を経時的に測定し、その蛍光強度の揺らぎの相関関数を解析することによって分子の運動についての情報を導出する手法である。詳細は後述するが、このFCSを用いることで、分子の拡散時間τD、分子質量Mを求めることができる。
【0011】
FCSが分子質量を測定できることから、FCSは分子の相互作用を検出する方法に用いられてきた(特許文献4)。すなわち、分子Aと蛍光修飾された分子Bがあったとき、単体の分子Bと分子Aと結合した分子A−Bの質量の違いを拡散時間τDの違いとして区別する方法である。
【0012】
この方法の応用として、抗体と抗原の結合を検出する方法が公開されている(特許文献5、特許文献6)。また、この手法に抗リン酸化ペプチドに特異的に結合する抗体を用いて、リン酸化を検出する手法が公開されている(特許文献7)。この手法は、免疫化学的な検出についての項に書いたとおり、個々のリン酸化部位に対する抗体を用意する必要がある。
【0013】
また、FCSにおいて抗体に結合している分子と結合していない分子が混合した試料を測定する場合のように、二成分の分子を区別するためには、それぞれの拡散時間τDに1.6倍以上の差が必要であるとの報告がある(非特許文献2)。拡散時間τDが1.6倍とは分子量で4倍に相当する。抗体のFab領域はおよそ55kDaであり、IgGはおよそ170kDaであることから、より大きな分子量のIgG抗体を用いた場合でも最大で40kDaの基質までしか測定することができない。
【0014】
また、細胞から抽出したサンプルの場合などは、標的である蛍光リン酸化ポリペプチド以外にも、多くのリン酸化したタンパク質が存在する。それらの標的外の分子種が、使用する抗リン酸化ペプチド抗体のエピトープを持つ場合、標的分子と競合が発生する。そのため、抗リン酸化ペプチド抗体は標的であるリン酸化ポリペプチドに対して過剰に加えなくてはならない。抗体などの分子量の大きい分子を高濃度で用いることは、凝集が発生するなどの問題が発生するため、測定に際しての取り扱いや測定までの間の保管が困難となる。
【0015】
以上のように、リン酸化ポリペプチドをFCSで検出する場合、リン酸化部位に結合する分子の分子質量が大きいほど、測定可能なリン酸化ポリペプチドの分子量範囲が広くなるが、溶液中のリン酸化部位結合分子の濃度が高くなってしまい、測定が困難になるという二律背反する問題を解決しなければならない。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特許第4615867号公報
【特許文献2】米国特許第4615867号明細書
【特許文献3】米国特許出願公開第2010/0099120号明細書
【特許文献4】特開2008−298743号公報
【特許文献5】特開2010−256010号公報
【特許文献6】国際公開2007/032266号パンフレット
【特許文献7】特表2001−526380号公報
【非特許文献】
【0017】
【非特許文献1】Recognition of phosphate monoester dianion by an alkoxide-bridged dinuclear zinc(II) complex, E. Kinoshita et al. (2004), Dalton Trans., 1189-93.
【非特許文献2】Resolution of fluorescence correlation measurements, U. Meseth et al. (1999), Biophys. J. 76, 1619-31.
【発明の概要】
【発明が解決しようとする課題】
【0018】
ポリペプチドのリン酸化の度合いを測定する手法はさまざまな生物・医学的な研究や診断に重要である。しかし、上述のように、従来の手法では、リン酸化している部位に依存し、操作が煩雑で検出までに時間がかかり、ペプチドのように比較的低分子の試料しか扱えない、細胞内からの抽出試料では測定できないなどの制約があった。また、FCSを用いた測定は有望な候補であるが、リン酸化部位に結合する分子の種類や、その分子の分子量・濃度を測定試料によって使い分けなくてはならないという問題があった。
【0019】
本発明はかかる事情に鑑みてなされたものであって、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することのできる技術を提供することを目的とする。
【課題を解決するための手段】
【0020】
上記課題を解決するための本発明は、リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出するリン酸化ポリペプチド検出方法である。
【発明の効果】
【0021】
この発明によれば、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することができる。
【図面の簡単な説明】
【0022】
【図1】第1の実施の形態の検出方法を説明するための図。
【図2】SDS−PAGEによる電気泳動の測定結果を示す図。
【図3】第1の実施の形態の脱リン酸化したATTO−OVA(dephos−OVA)についてのFCS測定結果を示す図。
【図4】第1の実施の形態の脱リン酸化処理していないATTO−OVA(pOVA)についてのFCS測定結果を示す図。
【図5】第1の実施の形態のdephos−OVAとpOVAを1:1で混合した試料についてのFCS測定結果を示す図。
【図6】第1の実施の形態の測定結果をまとめて示す図。
【図7】Phos−tagポリマー中のヒドロキシメチルアクリルアミドの割合を変化させて測定した試料の拡散時間を示す図。
【図8】Phos−tagポリマー中のdephos−OVAとpOVAについてのRICS測定の結果を示す図。
【図9】第1の実施の形態の検出方法が適用されるレーザ顕微鏡システムの構成を示す図。
【図10】レーザ顕微鏡システムの動作手順を示すフローチャート。
【発明を実施するための形態】
【0023】
〔第1の実施の形態〕
図1は、第1の実施の形態の検出方法を説明するための図である。第1の実施の形態では、従来用いられた抗体に替えて、リン酸化部位と結合する分子複合体を用いる。この分子複合体は、ペプチドのリン酸化部位に結合する部分は比較的低分子でありながら拡散係数が大きいという物理的性質を備えている。そして、その分子複合体溶液と試料とを混合し、試料中のリン酸化した蛍光ポリペプチドを分子複合体と結合させ、リン酸化したポリペプチドとリン酸化していないポリペプチドの拡散係数の違いを計測する。計測した拡散係数の違いによってリン酸化の有無または程度を判断する。
【0024】
ペプチドのリン酸化部位と結合する分子複合体を実現する第一の実施の形態では、ポリマーを用いる。すなわち、リン酸基と結合する官能基を有するモノマーとの共重合ポリマーを用いる。そのようなリン酸基と結合する官能基を有し、かつ重合能を有するモノマーとしては、二価金属イオン錯体を付与されたアクリルアミド等が想定される。このモノマーとアクリルアミドの共重合ポリマーを作製することにより、上記性質の分子複合体を実現することができる。二価金属イオン錯体を付与されたアクリルアミドとしては、例えばPhos−tagアクリルアミドが市販されている(和光純薬)。
【0025】
即ち、第一の方法では、リン酸基と結合する官能基が二価金属イオン錯体である。より詳細には、二価金属イオン錯体が下記構造を備えている。
【0026】
【化1】

式中、Xは重合能を持つモノマー分子部分を示し、M2+は二価金属イオンである
また、上記共重合ポリマーを重合して作製する際に、ポリマー分子間を架橋するモノマーを適量加えることにより、重合したポリマー分子の溶液中の柔軟性を変えることができる。このような分子架橋剤としては、N,N’−メチレンビスアクリルアミドが良く知られている。この方法で作製したアクリルアミドポリマーは、アクリルアミドゲル電気泳動で用いられるようなゲルとなる。しかし、共重合ポリマーがゲル状になってしまうと、試料と均一に混合することが困難となり、操作が煩雑になると同時に、ポリマー分子複合体と結合できないリン酸化ポリペプチドが残ってしまい、測定精度が悪化する可能性が高い。
【0027】
そのため、共有結合による完全な網目構造を作るのではなく、一時的な結合を作る方法を検討した。そのような一時的な結合としては水素結合がある。アクリルアミドのアミド基も弱い水素結合を形成するが、より強い水素結合を導入するために、例えばヒドロキシル基を持つモノマーを共重合させることができる。そのようなモノマーとしてはN−(ヒドロキシアルキル)アクリルアミドが考えられ、その一例としてN−(ヒドロキシメチル)アクリルアミドがある。
【0028】
即ち、第一の方法では、リン酸化したペプチドとの結合部位を有する高分子(分子複合体)として、リン酸基と結合する官能基を有するモノマーとの共重合ポリマーを用いる。より詳細には、リン酸基と結合する官能基を有するモノマーと、アクリルアミド、およびN−(ヒドロキシアルキル)アクリルアミド類:CH2=CH(CO)NH(CH2)nOH, n = 1, 2…、との共重合ポリマーを用いる。
【0029】
ペプチドのリン酸化部位と結合する分子複合体を実現する第二の方法では、細胞骨格タンパク質を用いる。すなわち、リン酸化ペプチドと結合する機能ドメインと細胞骨格タンパク質ドメインとのキメラタンパク質の繊維状複合体を用いる。繊維状複合体内に野生型の細胞骨格タンパク質が入っていても良く、複合体内の割合は、キメラタンパク質の細胞内での発現量で調整することができる。
【0030】
リン酸化ペプチドと結合する機能ドメインとしては、リン酸化チロシンに結合するSH2ドメインがある。SH2ドメインは、約100アミノ酸残基からなるタンパク質ドメインである。細胞骨格タンパク質としては、アクチンフィラメントを形成するアクチンや、微小管を形成するチューブリンなどがある。これらの細胞骨格タンパク質とリン酸化ペプチド結合ドメインとのキメラタンパク質をコードする遺伝子配列を持つベクターは、既知の方法により容易に作製することができる。このベクターを培養細胞内に取り込ませることにより、一時的にキメラタンパク質を細胞内で発現させることができる。培養細胞内にベクターを導入する方法は、市販の遺伝子導入試薬を用いることにより、容易に実現できる。また、細胞内での遺伝子組換え反応により、キメラタンパク質遺伝子を細胞内のゲノムに取り込ませることにより、細胞内でキメラタンパク質を恒常的に発現する細胞株を作ることができる。
【0031】
リン酸化状態を測定したい基質ペプチドについても、その遺伝子配列を持つベクターを細胞内に導入することにより、細胞内で発現させることができる。その際に、蛍光タンパク質と融合した基質ペプチドの配列を用いることにより、細胞内で基質配列を持つ蛍光ポリペプチドを産生させることができる。基質ペプチドの配列としては、例えばFynキナーゼに対しては例えばGlu−Phe−Gly−Thr−Tyr−Gly−Thr−Leu−Serが基質となることが知られている(Modified phage peptide libraries as a tool to study specificity of phosphorylation and recognition of tyrosine containing peptides, L. Dente et al. (1997), J. Mol. Biol. 269, 694-703.)。蛍光タンパク質としては、オワンクラゲ由来の緑色蛍光タンパク質(GFP)が知られている。
【0032】
この基質蛍光ポリペプチドは、ペプチド配列に応じたキナーゼによるリン酸化とホスファターゼによる脱リン酸化反応の基質となり、そのリン酸化/非リン酸化状態の割合は細胞の状態を反映する。例えば、基質蛍光ポリペプチドを発現する培養中の細胞に、各種薬剤などによって外部から刺激を与えることにより、基質蛍光ポリペプチドのリン酸化状態が刺激に応答して変化する。この細胞をリン酸化・脱リン酸化酵素の阻害剤の存在下で破砕して抽出液を取り出し、本発明で提供する方法によって測定することにより、基質である蛍光ポリペプチドのリン酸化状態を知ることができる。
【0033】
また、ペプチドのリン酸化部位と結合する繊維状分子複合体を細胞内で発現している細胞に、上記の基質蛍光ポリペプチドを発現させることにより、細胞質溶液内で直接測定することができる。すなわち、リン酸化した基質蛍光ポリペプチドが細胞骨格上のリン酸化ペプチド結合ドメインと結合することによって、リン酸化していない基質蛍光ポリペプチドとは異なる拡散係数値を示すことを、蛍光相関分光法によって測定することができる。この場合、細胞質を抽出する必要が無いため、細胞を培養中に任意の時期に測定することが可能である。この方法を用いれば、単一の細胞について薬剤投与前と薬剤投与後の基質のリン酸化を調べることができる。
【0034】
蛍光ポリペプチドの拡散係数の測定方法としては、蛍光相関分光法(FCS)がある。FCSの測定は、市販の1分子蛍光分析システム、共焦点蛍光顕微鏡によって測定することが出来る。
以上説明したように、リン酸化部位と結合する分子複合体と、リン酸化の基質である蛍光ポリペプチドの拡散係数の測定方法とを組み合わせることにより、課題を解決することができる。
【0035】
以下に、上述の検討結果に基づいて構成したリン酸化ポリペプチド検出方法について説明する。
リン酸化ペプチドと結合する官能基が付与されたポリマー溶液を用いる。ポリマーは脱水状態もしくは高濃度溶液状態で提供され、使用者が測定試料に合わせて希釈して使用してもよい。
【0036】
測定したい試料とポリマー溶液を良く混合し、混合した溶液の液滴を底面がガラスの試料台に乗せる。液滴の代わりに底面がガラスのシャーレやマイクロプレートに深さが数ミリ以上になるまで試料液を満たしても良い。共焦点光学系の焦点が試料液中に結ぶように試料台の位置を調整し、測定を行う。
【0037】
試料は、生化学的アッセイによるものであってよい。例えば蛍光基質ポリペプチドとキナーゼの混合溶液、もしくはリン酸化している蛍光基質ポリペプチドとホスファターゼの混合溶液でもよい。
ポリマー溶液の組成を試料溶液中の基質ペプチドのリン酸化もしくは脱リン酸化反応を阻害しないように調製することにより、酵素反応を進めながら測定してもよい。もしくは、一定時間酵素反応を進めた後に、反応停止液を加えてから測定してもよい。酵素反応バッファの組成が測定条件に適さない場合は、マイクロスピンカラムなどを用いて酵素反応後の試料液のバッファを交換してから測定を行ってもよい。
【0038】
測定は、FCS測定器を用いることができる。解析は、測定機器に付属のソフトウェアを用いて行うことができる。
リン酸化の検出は、試料の拡散時間もしくは拡散係数の測定値を二つのコントロール試料との測定値と比較することによって行う。コントロール試料のうちの第一のものは、使用者の用いる測定試料と同じ蛍光基質ポリペプチドであってリン酸化されていない試料を用いることが望ましいが、分子量が近い蛍光ポリペプチドであってもよい。
【0039】
コントロール試料のうちの第二のものは、ポリマーのリン酸化ペプチド結合基と結合する蛍光分子である。例えば、測定に用いる蛍光基質ポリペプチドを完全にリン酸化したものであってもよい。リン酸化は使用者が酵素反応で行ってもよく、ペプチドを合成する際にあらかじめリン酸化しているアミノ酸を用いて合成したものであってもよい。酵素反応や合成で完全にリン酸化することが難しい場合は、市販のリン酸化タンパク質精製キットを用いて、リン酸化された蛍光基質ポリペプチドを精製してもよい。また、このコントロール試料はポリマーの拡散係数を測定するためのものであるので、測定試料の分子量と大きく異なっていてもよいので、測定試料とはまったく関係の無い蛍光リン酸化分子であってもよい。例えば、生体内でリン酸化されているタンパク質、例えばオブアルブミン(卵白アルブミン)を蛍光色素で修飾したものであってもよい。
【0040】
使用者は、試験を行いたい細胞内に蛍光基質ポリペプチドを導入する。導入する一つの方法は、標的とするキナーゼの基質となるペプチドを融合したキメラタンパク質をコードする遺伝子配列を持つベクターを、試験を行いたい細胞内に取り込ませ、細胞内で蛍光基質キメラタンパク質を発現させる方法である。キメラタンパク質のベクターは、既知の方法によって使用者自身で作製してもよく、細胞内リン酸化測定キットとして提供されてもよい。細胞内にベクターを導入する方法は、市販されている導入試薬を用いてもよい。導入試薬としては、インビトロジェン社のリポフェクチンなどがある。
【0041】
使用者は、遺伝子導入されて一時的にキメラタンパク質を発現している細胞をリン酸化検出実験に用いてもよい。もしくは、選択マーカーを用いてキメラタンパク質遺伝子がゲノムに取り込まれた細胞を選び出し、恒常的に発現する細胞を実験に用いてもよい。
【0042】
細胞内に蛍光基質ポリペプチドを導入する別の方法として、蛍光基質ポリペプチドを細胞内に直接導入してもよい。細胞内に蛍光基質ポリペプチドを直接導入する方法は、市販のマイクロインジェクション装置を用いてもよく、リポフェクチンなどの導入試薬を用いてもよい。
【0043】
使用者は、上記のようにして蛍光基質ポリペプチドが細胞内に導入された細胞を用いて、以下のようにリン酸化検出実験を行う。
細胞試料のリン酸化検出の第一の方法は、細胞抽出液を用いて細胞外で測定する方法である。細胞から細胞抽出液を得るには、超音波破砕や凍結融解法もしくは市販の細胞タンパク質抽出試薬を用いることができる。市販の細胞タンパク質抽出試薬としては、サーモフィッシャーサイエンティフィック社のM−PERなどがある。細胞から抽出した試料は、先に述べた細胞外実験に記述した方法により測定することができる。
【0044】
細胞試料のリン酸化検出の第二の方法は、細胞内での測定である。細胞内で測定するためには、蛍光基質ポリペプチドとともに、先に述べたリン酸化ペプチド結合ドメインと細胞骨格タンパク質ドメインとのキメラタンパク質を細胞に導入する必要がある。リン酸化ペプチド結合キメラタンパク質の細胞導入は、蛍光基質ポリペプチドの細胞導入の箇所で述べた方法を用いることができる。
【0045】
細胞内での蛍光基質ポリペプチドの拡散係数の測定は、蛍光相関分光法(FCS)による測定機能を備えた共焦点顕微鏡を用いて行うことができる。共焦点顕微鏡によって蛍光基質ポリペプチドとリン酸化ペプチド結合キメラタンパク質の両方を発現した細胞を選別し、いずれかの蛍光相関分光法による測定と解析を行うことによって、基質ポリペプチドの拡散係数を測定する。解析は顕微鏡に付属するソフトウェアを用いることができる。
【0046】
リン酸化の検出は、試験群の細胞内の蛍光基質ポリペプチドの拡散係数の測定値を、コントロール群の細胞内の蛍光ポリペプチドの測定値と比較することによって行う。コントロール群の細胞内には、蛍光基質ポリペプチドの基質ペプチド部分に、細胞内ではリン酸化されない変異が導入された、コントロール用蛍光ポリペプチドが導入されている。基質ペプチドのリン酸化されない変異とは、基質ペプチド配列から既知のあるいは推定されるリン酸化部位にあるアミノ酸残基を、リン酸化されることの無いアミノ酸とする変異である。例えば、セリンをホスホセリンとするキナーゼを対象としている場合、ペプチド配列中の該当するセリンをリン酸化され得ない他のアミノ酸、例えばアラニンに置換することで、細胞内でのリン酸化を防ぐことができる。
【0047】
続いて、上述の検出方法を適用したリン酸化ポリペプチドの測定例について説明する。
(第1の測定例)
測定に用いた試料は、ニワトリ由来オブアルブミン(OVA)である。OVAは、卵白の主要なタンパク質であり、385残基、43kDaのタンパク質である。卵白中では69位のセリンと345位のセリンがリン酸化されていることが知られている(データベースエントリーP01012参照)。
【0048】
凍結乾燥されたOVA(シグマアルドリッチ社、A7641−50MG)を100mMの炭酸水素ナトリウム溶液に溶かした。吸光光度計を用いて、消光係数ε=0.7(1cm,0.1%,280nm)として、5mg/mLとなるように濃度を調整した。
【0049】
OVAを蛍光修飾するために、ATTO488−NHS−Ester(ATTO−TEC社)を脱水したDMSOに溶かし、10mM溶液を調製した。そのうち、10μLを5mg/mLのOVA溶液600μLと混合し、遮光して常温で一時間、ゆっくりと転倒撹拌した。
【0050】
OVAと未反応の蛍光色素を分離するために、15,000rpmで10分間の遠心を行った後に、上清を10mM Tris−HCl pH7.5,150mM NaClバッファで平衡化されたカラムボリューム15mLのG−25 Superfine(GEヘルスケア社)カラムによって分離した。排除体積(void)画分を回収し、アミコンウルトラ限外濾過フィルタユニット(ミリポア社)によって8mg/mLまで濃縮した。濃縮した蛍光修飾OVA溶液の501nmにおける吸光度と280nmにおける吸光度から導出された、蛍光修飾OVA1分子あたりの結合した蛍光色素分子数は1.2個であった。
【0051】
ATTO488蛍光修飾OVA(ATTO−OVA)の脱リン酸化は、Antarcticホスファターゼ(New England Biolabs)を用いて以下のように行った。8mg/mLのATTO−OVAを4μL、10×Antarcticホスファターゼバッファ1μL、超純水4μL、Antarcticホスファターゼ1μL(5U)と混合し、遮光した25℃の環境で18時間静置した。その後、Antarcticホスファターゼを失活させるために、65℃で5分間の加熱処理を行った。比較のための、リン酸化されたままのATTO−OVA試料は、Antarcticホスファターゼの代わりに1μLの超純水を加え、同様の処理をして作製した。ATTO−OVAが脱リン酸化されていることは、25μMのPhos−tagアクリルアミド(和光純薬)と50μMの硫酸マンガンが添加された10%ゲルSDS−PAGEによって確認した。
【0052】
図2は、SDS−PAGEによる電気泳動の測定結果を示す図である。図の左にはリン酸化されたままのATTO−OVA試料の測定結果を示し、図の右には脱リン酸化処理後のATTO−OVA試料の測定結果を示している。
ATTO−OVA試料は電気泳動によって移動するが、今回の測定では、Phos−tagアクリルアミドを添加しているため、リン酸化されたATTO−OVA試料はこのPhos−tagアクリルアミドにトラップされることで泳動速度が遅くなる。一方、脱リン酸化処理後のATTO−OVAでは、Phos−tagアクリルアミドによる泳動速度の低下は少ない。
【0053】
図2では、脱リン酸化処理後のATTO−OVA試料の泳動距離は、リン酸化されたままのATTO−OVA試料の泳動距離よりも長い。従って、脱リン酸化処理が有効に行なわれていることが確認された。
Phos−tag添加アクリルアミドポリマー溶液の作製は、次のように行った。電気泳動用アクリルアミドHG(和光純薬)の2M水溶液を作製し、0.44μmフィルターで微粒子を除去した。500μLのポリマー溶液の作製には、2M アクリルアミド溶液を125μL(終濃度0.5M)、5mM Phos−tagアクリルアミド溶液を100μL(終濃度1mM)、10×TBSバッファ(500mM Tris pH7.5,1500mM NaCl)を50μL、超純水を213μL、100mM硫酸亜鉛水溶液を10μL、20%過硫酸アンモニウム水溶液5μL、テトラメチルエチレンジアミン1μLを良く混合し、使用までに12時間以上室温で静置した。
【0054】
20μLのポリマー溶液に対してタンパク質溶液を1μL加え、ピペッティングによって良く混合した。タンパク質溶液は、EGFPタンパク質については終濃度が10μg/mL、脱リン酸化処理済および未処理のATTO−OVAについては40μg/mLとなるように調製した。タンパク質を加えたポリマー溶液から10μLを96穴ガラスボトムディッシュの中心部に載せ、FCS測定を行った。
【0055】
FCS測定は、市販のFCS測定器を基に光学系を改良した試作機を用いて行った。試料溶液の液滴10μLをガラスボトムディッシュ上に作り、共焦点光学系が液滴下のガラス表面から200μm上部の液滴中に焦点を結ぶようにステージ位置を調節した。アルゴンレーザーの波長488nmを励起光源として用い、出力を3〜5%とした。対物レンズはオリンパス製UAPO 40X W3/340、二色フィルターにはDM488/543/633を用いた。4秒間の測定について自己相関関数を計算し、連続8回の測定を行って自己相関関数の平均値を解析した。
【0056】
測定対象が溶液中に拡散している一種類の蛍光分子の場合、蛍光強度の自己相関関数G(τ)は遅延時間τに対して、式(1)で表される。
【0057】
【数1】

ただし、sは焦点領域の断面と光軸方向の長さの比である。τDは拡散時間であり、焦点領域を蛍光分子が通過する典型的な時間の長さであり、分子の拡散係数Dに反比例する量である。G(0)は蛍光強度の揺らぎの大きさであり、焦点領域内の分子数に反比例する量である。
【0058】
測定値から計算された相関関数に対して、(式1)を非線形最小二乗法などによって当てはめることにより、蛍光分子の拡散時間τDが得られる。蛍光分子の拡散係数Dは、同一の光学系において測定された拡散係数が既知の標準試料の拡散時間τDと拡散係数Dの関係から導出される。
【0059】
また分子質量Mは、拡散係数Dとの間の関係から導くことができる。分子が球体であると仮定した場合、拡散係数Dは温度に比例し、球体の半径rと溶液の粘性係数ηの積に反比例する(アインシュタイン−ストークスの関係式)。分子の密度が一定であると仮定すれば、同じ粘性の溶液で測定した場合、分子質量Mは拡散係数Dの三乗に反比例し、拡散時間τDに対しては三乗に比例する。
【0060】
上述の解析方法を適用して、式1で表される自己相関関数に対して、G(0)およびτDをフリーパラメータとして非線形最小二乗法によって当てはめ、拡散時間τDを導出した。比較検討のために拡散係数Dを算出する際には、ローダミン6GについてのτDの測定値と拡散係数の文献値(414μm2/s;Precise measurement of diffusion by multi-color dual-focus fluorescence correlation spectroscopy, C. B. Muller et al. (2008), EPL 83, 46001.)を用いた。また、分子質量の推定には、各ポリマー条件におけるEGFPについてのτDの測定値と分子質量の計算値(27kDa)を用いた。
【0061】
[第1の実施例]
図3は、第1の実施の形態の脱リン酸化したATTO−OVA(dephos−OVA)についてのFCS測定結果を示す図である。図3の横軸は遅延時間τを表し、縦軸は自己相関値を表している。
測定した蛍光強度から計算した自己相関関数を実線で示している。その自己相関関数を式1でフィッティングした結果を破線で示している。このフィッティングによって導出された拡散時間τDは0.35msであった。
【0062】
図4は、第1の実施の形態の脱リン酸化処理していないATTO−OVA(pOVA)についてのFCS測定結果を示す図である。測定した蛍光強度から計算した自己相関関数を実線で、その自己相関関数を式1でフィッティングした結果を破線で示した。導出された拡散時間τDは1.17msであった。
【0063】
図5は、第1の実施の形態のdephos−OVAとpOVAを1:1で混合した試料についてのFCS測定結果を示す図である。測定した蛍光強度から計算した自己相関関数を実線で、その自己相関関数を式1でフィッティングした結果を破線で示した。導出された拡散時間τDは0.64msであった。
【0064】
図6は、第1の実施の形態の測定結果をまとめて示す図である。測定は、5つの試料(ローダミン6G、EGFP、脱リン酸化処理していないpOVA、脱リン酸化処理をしたdephos−OVA、及びpOVAとdephos−OVAとの混合)を対象とした。またEGFP、pOVA、dephos−OVAについては、媒質をTBSとPhos−tag共重合アクリルアミドポリマーとの2水準で測定した。ここで、ローダミン6G、EGFPは、標準試料である。
【0065】
これらそれぞれの水準において、FCSを用いて拡散時間を測定した。ローダミン6Gの拡散係数(=414μm2/s)は文献値(Precise measurement of diffusion by multi-color dual-focus fluorescence correlation spectroscopy, C. B. Muller et al. (2008), EPL 83, 46001.)である。その他の試料の拡散係数は、ローダミン6Gの拡散係数と測定したローダミン6Gの拡散時間とを用いて計算して求めた。EGFPの分子質量(=27kDa)は、アミノ酸配列からの計算値である。
【0066】
拡散係数の計算方法について説明する。上述のように拡散時間τDは、焦点領域を蛍光分子が通過する典型的な時間の長さであり、分子の拡散係数Dに反比例する量である。従って、他の試料の拡散係数CD、他の試料の拡散時間TD、ローダミン6Gの拡散係数CDR、ローダミン6Gの拡散時間TDRとすると、式(2)の関係が成立する。
CD=CDR ×(TDR/TD) ・・・式(2)
例えば、媒質TBS中のpOVAの拡散係数=414×25/133≒78、媒質Phos−tag中のpOVAの拡散係数=414×25/1092≒9と求められる。
【0067】
分子質量の計算方法について説明する。上述のように、同じ粘性の溶液で測定した場合、分子質量Mは拡散係数Dの三乗に反比例し、拡散時間τDに対しては三乗に比例する。他の試料の分子質量WM、他の試料の拡散時間TD、EGFPの分子質量WME、EGFPの拡散時間TDEとすると、式(3)の関係が成立する。
WM=WME ×(TD/TDE)3 ・・・式(3)
例えば、媒質TBS中のpOVAの分子質量=27×(133/100)3≒64、媒質Phos−tag中のpOVAの分子質量=27×(1092/369)3≒700と求められる。
【0068】
続いて、本実施の形態の測定方法を用いた図6に示す測定結果について説明する。
pOVAとdephos−OVAのTBSバッファ中での拡散係数は、78及び80とほとんど違いが無く、計算された分子質量も64及び59とOVAの分子量と近い値を示した。このことから、実験に用いたOVAには蛍光修飾や脱リン酸化処理によって変性や凝集が起きていないことが確認された。
【0069】
Phos−tag共重合アクリルアミドポリマーと混合した試料では、溶液の粘性が増加したため、コントロールとして用いたEGFPの拡散係数も28とTBSバッファ中の拡散係数104に比べて小さくなった。dephos−OVAのPhos−tagポリマー中での拡散係数は31とEGFPの拡散係数28と近い値を示し、脱リン酸化されていることにより、Phos−tagに結合していないことが示された。
【0070】
pOVAのPhos−tagポリマー中での拡散係数は9と大きく低下しており、dephos−OVAのPhos−tagポリマー中での拡散係数31との比較で3.4倍の違いを示した。この差は分子質量に換算すると40倍(=(3.4)3)であり、Phos−tagポリマーに結合したpOVAの見かけの分子質量は700kDaであった。
【0071】
以上説明した、本実施の形態の測定方法を用いた測定結果によれば、媒質としてPhos−tagポリマーを用いることによってOVAのリン酸化状態が明確に識別された。
そこで、dephos−OVAとpOVAを1:1で混合した試料について、Phos−tagポリマー中での拡散時間、拡散係数、分子質量を求めた。その結果は、図6のサンプルNo.5に記載している。
【0072】
dephos−OVAとpOVAを1:1で混合した試料の拡散係数は、それぞれ単独での拡散係数の平均値(20μm2/s)に近い値(16μm2/s)を示した。また、拡散時間もそれぞれ単独での拡散時間の平均値(714μs)に近い値(630μs)を示した。
【0073】
このことから、脱リン酸化の程度が未知のOVA試料について、拡散係数もしくは拡散時間を測定し、その測定結果をdephos−OVAとpOVAとのそれぞれの拡散係数もしくは拡散時間と比較することにより、脱リン酸化の程度を測定することが可能であることが示された。
【0074】
試料のリン酸化されている割合Psampは、式4で計算することができる。
【0075】
【数2】

τsampはポリマー溶液中の試料についての拡散時間の測定値、τdephosとτphospはそれぞれ脱リン酸化されたコントロール試料とリン酸化されたコントロール試料についての拡散時間の測定値である。
同様に試料のリン酸化されている割合Qsampは、式5で計算することができる。
【0076】
【数3】

Csampはポリマー溶液中の試料についての拡散係数、CdephosとCphospはそれぞれ脱リン酸化されたコントロール試料とリン酸化されたコントロール試料についての拡散係数である。
[第2の実施例]
第2の実施例では、Phos−tagポリマー水溶液を更に改善する方法について説明する。
【0077】
N−(ヒドロキシメチル)アクリルアミド(東京化成)の2M水溶液を調製した。2Mのアクリルアミド溶液と2Mのヒドロキシメチルアクリルアミドが合計25μLとなるように混合した。その混合溶液にPhos−tagポリマープレミックス[超純水260μL、Phos−tagアクリルアミド溶液60μL、10×TBSバッファ60μL、100mM硫酸亜鉛6μL、テトラメチルエチレンジアミン1.2μL]を64.5μL加え良く混合し、20%過硫酸アンモニウム水溶液0.5μLを加えて再度良く混合した。混合液は使用までに12時間以上室温で静置した。
【0078】
20μLのアクリルアミド/ヒドロキシメチルアクリルアミドポリマー溶液に対して脱リン酸化処理済または未処理のATTO−OVAタンパク質溶液を1μL加え、実施例1と同様にFCS測定を行った。
図7は、Phos−tagポリマー中のヒドロキシメチルアクリルアミドの割合を変化させて測定した試料の拡散時間を示す図である。
【0079】
図7の横軸は、Phos−tagポリマー溶液中のヒドロキシメチルアクリルアミドの割合を示している。左軸は、FCSで測定した拡散時間を示している。図中の(太)実線は、脱リン酸化未処理pOVAの測定値であり、点線は、脱リン酸化処理済dephos−OVAの測定値である。また、図7の右軸は、拡散時間の比(=脱リン酸化未処理pOVAの測定値/脱リン酸化処理済dephos−OVAの測定値)を表している。図中の(細)実線が、拡散時間の比である。
【0080】
ヒドロキシメチルアクリルアミドの割合が増えるにつれて、ポリマーの粘性が増加するため、拡散時間測定値はヒドロキシメチルアクリルアミドの割合の増加とともに大きくなる。脱リン酸化処理済dephos−OVAについては、ヒドロキシメチルアクリルアミドの割合に応じて単調に増加する傾向を示した。これに対し、脱リン酸化未処理pOVAについてはヒドロキシメチルアクリルアミドが加わることによって、ある割合までは拡散時間値が大きく増加し、その後は小さな増加率であった。そのため、dephos−OVAとpOVAの拡散時間の比は、ヒドロキシメチルアクリルアミドの割合が所定の値のときに最大となる。このことから、Phos−tagポリマーにポリマー繊維間に水素結合を導入するヒドロキシメチルアクリルアミドを添加することにより、試料のリン酸化の度合いを計測する精度が上昇することが示された。
【0081】
[第3の実施例]
第3の実施例では、走査画像相関分光法(RICS)を用いて測定する方法について説明する。
共焦点顕微鏡画像から分子の拡散係数を測定する方法としては、走査画像相関分光法(RICS)がある。RICSは共焦点顕微鏡の撮影方法の特徴を活かして相関関数を計算する測定手法である(Measuring fast dynamics in solutions and cells with a laser scanning microscope, M. A. Digman et al. (2005), Biophys. J. 89, 1317-27.)。
【0082】
共焦点顕微鏡は、視野の平面上で焦点位置を走査することによって画像を取得する。つまり、一枚の画像であっても各画素が取得される時間には差がある。一本の走査線上の隣り合うピクセル間の時間差は小さいが、隣り合う走査線上に乗っているピクセル間の時間差は大きくなる。また、撮影中に分子が視野平面上を移動すると、一度ある焦点位置で検出された蛍光分子が、焦点位置の走査の過程で別の位置で再度検出されることがある。これら二つの現象を加味して解析を行うことにより、蛍光分子の拡散係数を導出することができる。RICSによる解析手法を備えた共焦点顕微鏡はすでに開発されており(例えば、特開2011−85485号公報)、市販されている。
【0083】
RICSの特徴は、同一の走査線の隣り合う画素間の時間間隔(マイクロ秒)と走査線間の時間間隔(ミリ秒)という二つの時間スケールを持っていることにより、広い範囲の拡散係数を測定することができるという点である。例えば、拡散係数が100μm2/s程度の比較的小さなタンパク質一分子の拡散係数から、0.1μm2/s程度の巨大複合体の拡散係数まで計測することが可能である。そのため、基質である蛍光ポリペプチドのリン酸化の度合いを測定で求めるのに有利である。
【0084】
走査画像相関分光法(RICS)では、共焦点蛍光顕微鏡によって測定し、細胞拡散パッケージオプションを追加したソフトウェアを用いて解析を行った。
20μLの0.5Mアクリルアミドポリマー溶液に対して脱リン酸化処理済または未処理のATTO−OVAタンパク質溶液(0.4mg/mL)を1μL加えて混合したのち、10μLを96穴ガラスボトムディッシュの中心部に載せ、共焦点光学系が液滴中のガラス表面から200μm上部に焦点を結ぶようにステージ位置を調節した。アルゴンレーザーの波長488nmを励起光源として用い、出力を15%とした。対物レンズはUAPO 40X W3/340、二色フィルターにはDM488/543/633を用いた。
【0085】
試料溶液中の一辺12.8μmの正方形の範囲を一辺256ピクセルの解像度で測定した(0.05μm/ピクセル)。走査方向に隣り合うピクセル間の時間間隔は4μs、走査線間の時間間隔は2.12msであった。強度が1/e2となるビーム径w0は0.25μmとして解析を行った。連続して撮影した100枚の画像からバックグラウンドを計算して各画像から減算したのちに、各画像について自己相関画像を計算した。100枚の自己相関画像を平均化した画像に対して、扁平ガウシアンのフィッティングを行い、拡散係数Dを導出した。
【0086】
図8は、Phos−tagポリマー中のdephos−OVAとpOVAについてのRICS測定の結果を示す図である。各列の左側の画像は、共焦点顕微鏡で取得したラスター画像である。右側の画像は、その自己相関関数を表す画像である。この自己相関画像から自己相関関数を解析して得た拡散係数を画像の右側に示した。RICS測定では、拡散係数を直接導くことができる。この結果では、dephos−OVAの拡散係数は29μm2/sであり、pOVAの拡散係数である4.8μm2/sとの間には6倍という大きな違いがある。従って、Phos−tagポリマーとRICSによる測定によってOVAのリン酸化状態を明確に識別できることが示された。
【0087】
なお、第3の実施例では、走査画像相関分光法(RICS)を用いたが、蛍光相関分光法を顕微鏡画像に適用した画像相関分光法(ICS)を用いることができる。
即ち、蛍光ポリペプチドの拡散係数の測定方法には、蛍光相関分光法を顕微鏡画像に適用した画像相関分光法(ICS)という測定方法もある。ICSは、開発された当初は一枚の画像中で画素間の蛍光強度の相関関数を計算し、細胞内の会合体粒子の数と会合数を評価する手法であった(空間的ICS;Quantitation of membrane receptor distributions by image correlation spectroscopy: Concept and application, N. O. Petersen et al. (1993), Biophys. J. 65, 1135-46.)。その後、同一の視野に対して、一定時間間隔で撮影した複数の画像について、その画像の一つ一つのピクセルについて、その蛍光強度の時間に対する相関関数を計算して解析する手法が開発された(時間的ICS;Two-photon image correlation spectroscopy and image cross-correlation spectroscopy, P. W. Wiseman et al. (2000), J. Microscopy 200, 14-25.)。通常、一つのピクセルからの相関関数はノイズが多くパラメータを導出するのに不十分であるため、一定の領域内の複数のピクセルからの相関関数についての平均値を用いて解析を行う。
【0088】
ICSは、通常の顕微鏡では画像の撮影間隔が数十msより大きくなるため、高速で運動する分子の解析には適さないが、細胞骨格などのような細胞内の大きな構造の運動を捉えることができる。そのため、リン酸化部位と結合する分子複合体が細胞骨格である場合の解析に適している。また、画像を確認して解析範囲を決定することができるので、特定の細胞の細胞質中で、細胞骨格が存在している画像範囲内で相関関数の平均値を計算するということが可能である。そのため、視野内の複数の細胞それぞれについて基質蛍光ポリペプチドのリン酸化を測定することができる。
【0089】
なお、上述の検出方法は、人手(マニュアル)で実施するのみならず、FCS、ICS、RICSなどの解析処理を搭載した光測定装置によって自動で実施することができる。以下、自動で実施する態様について説明する。
図9は、第1の実施の形態の検出方法が適用されるレーザ顕微鏡システムの構成を示す図である。
レーザ顕微鏡システムは、顕微鏡本体1、レーザコンバイナー2、スキャンユニット3、ディテクタユニット4、コントロールユニット5、表示装置6及び記憶装置7を備えている。
【0090】
レーザコンバイナー2に設けられた1つのレーザ光源から出射したレーザ光は、ダイクロイックミラー(不図示)で反射された後スキャンユニット3に入射する。このスキャンユニット3によって、光軸はX軸、Y軸方向に偏向走査され、顕微鏡本体1の対物レンズ(不図示)に入る。これによって視野内の焦点面上にある蛍光標識されたサンプル試料の任意の位置に、測定領域(焦点領域)を位置することができる。
【0091】
焦点領域内の蛍光分子から発した蛍光は同じ対物レンズで補足され、逆の光路を通りダイクロイックミラーに導かれる。ダイクロイックミラーでは、励起光と比べ波長の長い蛍光を透過するように設計されており、蛍光はディテクタユニット4に到達する。ディテクタユニット4としては光電子増倍管が好適である。
【0092】
ディテクタユニット4で光電変換された蛍光の強度信号は、コントロールユニット5に入力される。コントロールユニット5では、解析ソフトウェアによってRICS解析が行われる。コントロールユニット5は、ディテクタユニット4からの蛍光強度信号と、スキャンユニット3からの走査位置情報とを対応づけてRICS解析を行う。RICS解析した結果は、適宜、表示装置6に表示され、また記憶装置7に記憶される。
【0093】
図9の右側には、本レーザ顕微鏡システムで得られる情報を模式的に示している。
サンプル8aにレーザ光を繰り返して走査照射して複数枚の蛍光画像8bを得る。このそれぞれの蛍光画像8bに基づいて蛍光強度に関するデータ8cを求めて、解析ソフトウェアに入力する。解析ソフトウェアは、それぞれのデータ8cに基づいてRICS解析を実行する。即ち、空間相関計算を行って空間相関関数図8dを求め、その結果と基準となる空間相関関数図との間でフィッティング解析を行う。
【0094】
図10は、レーザ顕微鏡システムの動作手順を示すフローチャートである。
図10のステップS01において、コントロールユニット5は、脱リン酸化した標準試料を測定してRICS解析により拡散係数C1を求める。ステップS02において、コントロールユニット5は、脱リン酸化していない標準試料を測定してRICS解析により拡散係数C2を求める。
【0095】
ステップS03において、コントロールユニット5は、検知対象の試料を測定してRICS解析により拡散係数C3を求める。ステップS04において、コントロールユニット5は、リン酸化の割合を示す指標Qを算出する。指標Qは、下記式(6)で表される。
Q= (C1−C3)/(C1−C2) 式(6)
ステップS05において、コントロールユニット5は、指標Qを予め定めた閾値と比較し、所望のリン酸化が行われたかどうかを判断する。
【0096】
なお、この指標Qと判断結果とはユーザに提示されるが、提示の態様については種々のバリエーションが可能である。例えば、所定の領域内について複数の測定を行いリン酸化の度合いを分布図に表して提示しても良く、また細胞ごとにリン酸化の度合いを色分けして表しても良い。
【0097】
なお、上述の自動処理は、拡散係数の他に拡散時間を用いても良い。また上述の自動処理は、RICSに限られず、FCS、ICSにおいても適用することができる。
[第2の実施の形態]
なお、上述の第1の実施の形態では、実施例として混合溶液中での測定方法を説明したが、この測定方法は、細胞内において発現した物質に対しても適用することができる。
【0098】
従って第2の実施の形態では、リン酸化したペプチドとの結合部位を有する高分子が、細胞内で発現したタンパク質である。あるいは、蛍光を発するポリペプチド分子が、細胞内で発現した蛍光タンパク質との融合タンパク質である。
また第2の実施の形態では、測定対象が生きた細胞であり、リン酸化したペプチドとの結合部位を有する高分子と蛍光を発するポリペプチド分子の一方もしくは両方が当該細胞内で発現したタンパク質であり、蛍光相関分光法を備えた顕微鏡によって測定される。
【0099】
なお、上述の各実施の形態で説明した機能は、ハードウェアを用いて構成するに留まらず、ソフトウェアを用いて各機能を記載したプログラムをコンピュータに読み込ませて実現することもできる。また、各機能は、適宜ソフトウェア、ハードウェアのいずれかを選択して構成するものであっても良い。
【0100】
尚、本発明は、上記実施形態そのままに限定されるものではなく、実施段階ではその要旨を逸脱しない範囲で構成要素を変形して具体化できる。
上記実施形態に開示されている複数の構成要素の適宜な組み合せにより種々の発明を形成できる。例えば、実施形態に示される全構成要素から幾つかの構成要素を削除してもよい。更に、異なる実施形態に亘る構成要素を適宜組み合せてもよい。
【産業上の利用可能性】
【0101】
この発明は、ポリペプチドのリン酸化の有無あるいは程度を容易に検出することができる装置を製造する産業で利用することができる。
【符号の説明】
【0102】
1…顕微鏡本体、2…レーザコンバイナー、3…スキャンユニット、4…ディテクタユニット、5…コントロールユニット、6…表示装置、7…記憶装置。
【特許請求の範囲】
【請求項1】
リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、
測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出すること
を特徴とするリン酸化ポリペプチド検出方法。
【請求項2】
前記高分子がリン酸基と結合する官能基を有するモノマーとの共重合ポリマーであることを特徴とする請求項1記載のリン酸化ポリペプチド検出方法。
【請求項3】
前記高分子がリン酸基と結合する官能基を有するモノマーと、アクリルアミド、および下記式で表されるN−(ヒドロキシアルキル)アクリルアミド類との共重合ポリマーであることを特徴とする請求項1または2記載のリン酸化ポリペプチド検出方法。
CH2=CH(CO)NH(CH2)nOH, n=1,2…
【請求項4】
前記高分子のリン酸基と結合する官能基が二価金属イオン錯体であることを特徴とする請求項2または3記載のリン酸化ポリペプチド検出方法。
【請求項5】
前記高分子のリン酸基と結合する二価金属イオン錯体が下記構造を有することを特徴とする請求項4に記載のリン酸化ポリペプチド検出方法。
【化2】

式中、Xは重合能を持つモノマー分子部分を示し、M2+は二価金属イオンである
【請求項6】
前記高分子が、細胞内で発現したタンパク質であることを特徴とする請求項1記載のリン酸化ポリペプチド検出方法。
【請求項7】
蛍光を発するポリペプチド分子が、細胞内で発現した蛍光タンパク質との融合タンパク質であることを特徴とする請求項1乃至6の内いずれか1項に記載のリン酸化ポリペプチド検出方法。
【請求項8】
測定対象が生きた細胞であり、リン酸化したペプチドとの結合部位を有する高分子と蛍光を発するポリペプチド分子の少なくとも一つが当該細胞内で発現したタンパク質であり、蛍光相関分光法を備えた顕微鏡によって測定されることを特徴とする請求項6または7記載のリン酸化ポリペプチド検出方法。
【請求項9】
試料のリン酸化されている割合を表す下記指標Psampを用いて前記リン酸化の検出を行うことを特徴とする請求項1に記載のリン酸化ポリペプチド検出方法。
Psamp=(τsamp−τdephos)/(τphosp−τdephos)
ここで、τsampは前記高分子と検知対象のポリペプチド分子との混合溶液試料についての測定値、τdephosは前記高分子と脱リン酸化処理したポリペプチド分子との混合溶液試料についての測定値、τphospは前記高分子とリン酸化されたポリペプチド分子との混合溶液試料についての測定値。
【請求項10】
蛍光相関分光法が画像相関分光法(ICS)であることを特徴とする請求項1乃至9のうちいずれか1項に記載のリン酸化ポリペプチド検出方法。
【請求項11】
画像相関分光法が走査画像相関分光法(RICS)であることを特徴とする請求項10記載のリン酸化ポリペプチド検出方法。
【請求項12】
高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数を取得するリン酸化ポリペプチド検出装置であって、
前記高分子と検知対象のポリペプチド分子との混合溶液試料についての測定値τsampを取得する第1の測定部と、
前記高分子と脱リン酸化処理したポリペプチド分子との混合溶液試料についての測定値τdephosを取得する第2の測定部と、
前記高分子とリン酸化されたポリペプチド分子との混合溶液試料についての測定値τphospを取得する第3の測定部と、
試料のリン酸化されている割合を表す下記指標Psampを用いて前記リン酸化の検出を行う検出部とを有し、
前記高分子は、リン酸化したペプチドとの結合部位を有することを特徴とするリン酸化ポリペプチド検出装置。
Psamp=(τsamp−τdephos)/(τphosp−τdephos)
【請求項1】
リン酸化したペプチドとの結合部位を有する高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、
測定値である拡散時間または拡散係数に基づいて前記ポリペプチド分子のリン酸化を検出すること
を特徴とするリン酸化ポリペプチド検出方法。
【請求項2】
前記高分子がリン酸基と結合する官能基を有するモノマーとの共重合ポリマーであることを特徴とする請求項1記載のリン酸化ポリペプチド検出方法。
【請求項3】
前記高分子がリン酸基と結合する官能基を有するモノマーと、アクリルアミド、および下記式で表されるN−(ヒドロキシアルキル)アクリルアミド類との共重合ポリマーであることを特徴とする請求項1または2記載のリン酸化ポリペプチド検出方法。
CH2=CH(CO)NH(CH2)nOH, n=1,2…
【請求項4】
前記高分子のリン酸基と結合する官能基が二価金属イオン錯体であることを特徴とする請求項2または3記載のリン酸化ポリペプチド検出方法。
【請求項5】
前記高分子のリン酸基と結合する二価金属イオン錯体が下記構造を有することを特徴とする請求項4に記載のリン酸化ポリペプチド検出方法。
【化2】

式中、Xは重合能を持つモノマー分子部分を示し、M2+は二価金属イオンである
【請求項6】
前記高分子が、細胞内で発現したタンパク質であることを特徴とする請求項1記載のリン酸化ポリペプチド検出方法。
【請求項7】
蛍光を発するポリペプチド分子が、細胞内で発現した蛍光タンパク質との融合タンパク質であることを特徴とする請求項1乃至6の内いずれか1項に記載のリン酸化ポリペプチド検出方法。
【請求項8】
測定対象が生きた細胞であり、リン酸化したペプチドとの結合部位を有する高分子と蛍光を発するポリペプチド分子の少なくとも一つが当該細胞内で発現したタンパク質であり、蛍光相関分光法を備えた顕微鏡によって測定されることを特徴とする請求項6または7記載のリン酸化ポリペプチド検出方法。
【請求項9】
試料のリン酸化されている割合を表す下記指標Psampを用いて前記リン酸化の検出を行うことを特徴とする請求項1に記載のリン酸化ポリペプチド検出方法。
Psamp=(τsamp−τdephos)/(τphosp−τdephos)
ここで、τsampは前記高分子と検知対象のポリペプチド分子との混合溶液試料についての測定値、τdephosは前記高分子と脱リン酸化処理したポリペプチド分子との混合溶液試料についての測定値、τphospは前記高分子とリン酸化されたポリペプチド分子との混合溶液試料についての測定値。
【請求項10】
蛍光相関分光法が画像相関分光法(ICS)であることを特徴とする請求項1乃至9のうちいずれか1項に記載のリン酸化ポリペプチド検出方法。
【請求項11】
画像相関分光法が走査画像相関分光法(RICS)であることを特徴とする請求項10記載のリン酸化ポリペプチド検出方法。
【請求項12】
高分子と、リン酸化反応の基質となるペプチド配列を含み識別マーカが付与されたポリペプチド分子との混合溶液試料を、蛍光相関分光法(FCS)によって測定し、測定値である拡散時間または拡散係数を取得するリン酸化ポリペプチド検出装置であって、
前記高分子と検知対象のポリペプチド分子との混合溶液試料についての測定値τsampを取得する第1の測定部と、
前記高分子と脱リン酸化処理したポリペプチド分子との混合溶液試料についての測定値τdephosを取得する第2の測定部と、
前記高分子とリン酸化されたポリペプチド分子との混合溶液試料についての測定値τphospを取得する第3の測定部と、
試料のリン酸化されている割合を表す下記指標Psampを用いて前記リン酸化の検出を行う検出部とを有し、
前記高分子は、リン酸化したペプチドとの結合部位を有することを特徴とするリン酸化ポリペプチド検出装置。
Psamp=(τsamp−τdephos)/(τphosp−τdephos)
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−64652(P2013−64652A)
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2011−203711(P2011−203711)
【出願日】平成23年9月16日(2011.9.16)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成23年9月16日(2011.9.16)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

